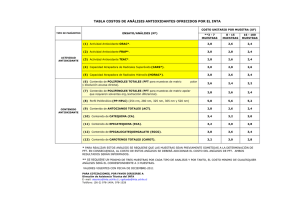
modificación del contenido de glutatión y su efecto en la expresión y
Anuncio

Profesor Patrocinante Dra. Ilona I. Concha Instituto de Bioquímica Facultad de Ciencias Profesor Co-Patrocinante Dra. Maite A. Castro Instituto de Bioquímica Facultad de Ciencias MODIFICACIÓN DEL CONTENIDO DE GLUTATIÓN Y SU EFECTO EN LA EXPRESIÓN Y FUNCIÓN DE LOS TRANSPORTADORES DE VITAMINA C EN CÉLULAS DE SERTOLI Tesis de Grado presentada como parte de los requisitos para optar al grado de Licenciado en Bioquímica y Título Profesional de Bioquímico HÉCTOR ENRIQUE MANCILLA CHÁVEZ VALDIVIA – CHILE 2010 Dedicado a mis padres y Hermanas Patty y Andrea AGRADECIMIENTOS Quiero agradecer a la Dra. Ilona Concha por darme la oportunidad de entrar a su laboratorio, por la confianza que depositó en mí y por guiarme durante todo este proceso educativo. Muchas gracias por el apoyo, la increíble paciencia y su buena voluntad. También quisiera agradecer a la Dra. Maite Castro y a la Dra. Constanza Angulo por su ayuda y consejos los cuales fueron de gran utilidad en mi formación profesional. A mis compañeros de laboratorio, por compartir sus conocimientos; la buena disposición y compañerismo han sido fundamentales en este aprendizaje. Rodrigo, Eduardo, Alex, Franz, Silvana, Felipe, Aníbal, Cristian, María Paz, Magda. Quisiera agradecer al Dr. Juan Carlos Vera y a la Dra. Coralia Rivas por permitirme ir a aprender metodologías relacionadas con mi tesis en su laboratorio del Departamento de Fisiopatología de la Facultad de Ciencias Biológicas de la Universidad de Concepción, después del incendio del 3 de Diciembre del 2007. Así mismo quisiera agradecer al Dr. Juan Carlos Slebe por la disposición de su laboratorio para realizar ciertos experimentos y al Dr. Joel Asenjo por su disposición y buena voluntad. Y por último a todos los integrantes del Instituto de Bioquímica que de algún modo participaron en mi formación académica. Quiero agradecer especialmente a mi familia, a mis padres quienes siempre me han brindado su confianza. Muchas gracias por apoyarme en todas la decisiones que he tomado en mi vida y su inmensa paciencia. También agradecer a mis hermanas Patty y Andrea, quienes han estado presentes en cada momento, gracias por estar siempre presentes. A mi querida Tamara, gracias por tu amor, increíble paciencia y compañía, te quiero mucho. Esta tesis fue desarrollada en el laboratorio de Metabolismo Molecular, perteneciente al Instituto de Bioquímica de la Facultad de Ciencias de la Universidad Austral de Chile y fue financiada por FONDECYT 1060135, proyecto de responsabilidad del Dra. Ilona Concha. I ÍNDICE DE CONTENIDOS Páginas 1. RESUMEN 1 1.1. SUMMARY 2 2. INTRODUCCIÓN 3 2.1. Glutatión 3 2.1.1. Generalidades del glutatión 3 2.1.2. Metabolismo del glutatión 8 2.1.3. Modificación del glutatión intracelular 11 2.2. Vitamina C 12 2.2.1. Generalidades vitamina C 12 2.2.2. Sistemas involucrados en el trasporte de la vitamina C 16 2.3. Relación funcional entre el glutatión y la vitamina C 19 II 2.4. Células de Sertoli y su papel en la espermatogénesis 25 2.5. Glutatión, vitamina C y espermatogénesis 31 3. MATERIALES Y MÉTODOS 37 3.1. Materiales 37 3.1.1. Reactivos químicos 37 3.1.2. Materiales biológicos 39 3.1.3. Instrumentos 39 3.2. Métodos 40 3.2.1. Cultivo de células de Sertoli 42GPA9 40 3.2.2. Ensayo de viabilidad mediante azul de tripán 40 3.2.3. Extracción de RNA 40 3.2.4. Reacción en cadena de la polimerasa acoplada a transcripción 41 reversa (RT-PCR) III 3.2.5. Inmunohistoquímica 44 3.2.5.1. Cromógena 44 3.2.5.2. Inmunofluorescencia 45 3.2.6. Inmunocitoquímica 47 3.2.7. Extracción y cuantificación de proteínas totales 3.2.8. Separación electroforética de proteínas 49 3.2.9. Transferencia de proteínas a membranas de PVDF 49 3.2.10. Análisis de Western blot 50 3.2.11. Ensayos de transporte 51 3.2.12. Modificación del contenido de glutatión 52 3.2.13. Determinación de glutatión total 52 3.2.14. Ensayo de TUNEL 53 3.2.15. Análisis estadístico 54 48 IV 4. RESULTADOS 55 4.1. Trasportadores de ácido ascórbico en el epitelio seminífero 55 4.2. Expresión y función de SVCT1 y SVCT2 en células de Sertoli 65 4.3. Efecto del BSO sobre el epitelio seminífero 70 4.4. Determinación del contenido de glutatión intracelular en células 88 de Sertoli 42GPA9 4.5. Efecto de la ausencia de glutatión sobre la expresión y función 95 de los transportadores de AA en células de Sertoli 4.6. Efecto del peróxido de hidrógeno sobre la viabilidad de las 100 células de Sertoli 42GPA9 depletadas de glutatión 5. DISCUSIÓN 5.1. Transportadores 103 de ácido ascórbico se expresan diferencialmente en el túbulo seminífero durante el desarrollo de la línea germinal masculina 104 V 5.2. Las células de Sertoli como modelo para estudiar la relación 107 entre los transportadores de AA y el glutatión 5.3. El efecto del BSO asociado a una disminución del contenido de 109 glutatión afecta la expresión y función de SVCT1 5.3.1. Estudios in vivo 109 5.3.2. Estudios in vitro 112 5.4. Sensibilidad de las células de Sertoli 42GPA9 depletadas de 116 glutatión al peróxido de hidrógeno 6. BIBLIOGRAFÍA 120 VI INDICE DE FIGURAS Páginas Figura 1. Estructura del glutatión 5 Figura 2. Ciclo redox del glutatión 6 Figura 3. Ciclo γ-glutamil 9 Figura 4. Oxidación de ácido ascórbico 13 Figura 5. Biosíntesis de ácido ascórbico en mamíferos 15 Figura 6. Reciclaje de la vitamina C 23 Figura 7. Epitelio seminífero 29 Figura 8. Localización de SVCT1 y del marcador de células de Sertoli, 57 WT1, durante el desarrollo del epitelio seminífero de rata Figura 9. Localización de SVCT2 y del marcador de células de Sertoli, 59 WT1, durante el desarrollo del epitelio seminífero de rata Figura 10. Inmunolocalización de SVCT1 y SVCT2 lo largo de todo el túbulo seminífero de rata 63 VII Figura 11. Funcionalidad de los transportadores de ácido ascórbico en 68 células de Sertoli Figura 12. Alteración del contenido de glutatión y su efecto en la 72 viabilidad celular en el epitelio seminífero de rata Figura 13. Expresión de SVCT1 en el epitelio seminífero de rata 75 depletado de glutatión Figura 14. Expresión de SVCT2 en el epitelio seminífero de rata 77 depletado de glutatión Figura 15. Expresión de GLUT3 en el epitelio seminífero de rata 80 depletado de glutatión Figura 16. Expresión de glicógeno sintasa en el epitelio seminífero de 83 rata depletado de glutatión Figura 17. Expresión de PTG en el epitelio seminífero de rata depletado 86 de glutatión Figura 18. Determinación del contenido de glutatión en células Sertoli 42GPA9 90 VIII Figura 19. Modificación del contenido de glutatión en células de Sertoli 94 42GPA9 Figura 20. Expresión de los transportadores de ácido ascórbico en 98 células de Sertoli 42GPA9 depletadas de glutatión Figura 21. Efecto del peróxido de hidrógeno en células de Sertoli 101 Transportadores de vitamina C y el contenido de glutatión en 118 42GPA9 tratadas con BSO Figura 22. el epitelio seminífero de rata IX INDICE DE TABLAS Páginas Tabla I. Expresión de los transportadores de ácido deshidroascórbico 32 (GLUTs) en testículo Tabla II. Expresión de los transportadores de ácido ascórbico (SVCTs) en 33 testículo Tabla III Contenido de glutatión y actividad de enzimas antioxidantes dependientes de glutatión en testículo 33 X LISTA DE ABREVIATURAS 3α-HSD : 3α-hidroxiesteroide deshidrogenasa AA : Ácido ascórbico ASC : Transportador de alanina-serina-cisteína BHT : Barrera hemato-testicular BSA : Albúmina de suero de bovino BSO : L-butionina-S,R-sulfoxamida Cit B : Citocalasina B Cit E : Citocalasina E DEM : Dietil maleato DHA : Ácido deshidroascórbico DHT : Dihidrotestosterona DMEN : Medio Dulbelcco`s Eagle modificado enriquecido con F-12 XI dNTP : Desoxinucleótido fosfato DOG : 2-desoxi-D-glucosa DTNB : 5,5’-ditio-bis-(ácido 2 nitrobenzoico) DTT : 1,4-ditiotreitol EDTA : Ácido etilendiaminotetracético EROs : Especies reactivas del oxígeno G6PD : Glucosa 6-P deshidrogenasa GLO : L-gulono-γ-lactona oxidasa GLUT : Transportador facilitativo de hexosas GPx : Glutatión peroxidasa GR : Glutatión reductasa GRx : Glutarredoxina GSH : Glutatión reducido XII GSSG : Glutatión oxidado GST : Glutatión S-transferasa GSTO : Glutatión S-transferasa omega HRP : Peroxidasa de rábano picante Km : Constante de Michaelis-Menten MGS : Glicógeno sintasa muscular NADPH : Dinucleótido de nicotinamida y adenina fosfato reducido NADP+ : Dinucleótido de nicotinamida y adenina fosfato OMG : 3- o-metilglucosa PBS :Tampón fosfato salino PDI : Proteína disulfuro isomerasa PHL : Floridzina PKC : Proteína quinasa C XIII PKA : Proteína quinasa dependiente de AMPc PP1 : Proteína fosfatasa 1 PVDF : Polivinilideno fluoruro RT-PCR : Transcriptasa reversa acoplada a la reacción de polimerasa en cadena SDS : Dodecil sulfato de sodio SVCT : Co-transportador de sodio/ascorbato TEMED : N,N,N´N´-tetrametilendiamina TNB : Ácido tio-nitrobenzoico TUNEL : TdT- mediated dUTP nick end labelling Vmax : Velocidad máxima WT1 : Factor de transcripción del tumor de Wilms γ-GT : γ-glutamil transpeptidasa 1 1. RESUMEN Las células somáticas de Sertoli tienen un rol clave en la maduración y supervivencia de las células germinales en el túbulo seminífero. Vitamina C y glutatión son los antioxidantes solubles más importantes en la fisiología celular y son fundamentales en el desarrollo de la línea germinal masculina y en la defensa contra agentes químicos y radiaciones. En este trabajo se estudió el comportamiento molecular y funcional de los trasportadores de vitamina C frente a niveles disminuidos de glutatión intracelular. Se utilizaron cortes de testículo de rata y la línea celular de Sertoli 42GPA9. Análisis de RT-PCR, inmucitoquímica y Western blot revelaron que las células de Sertoli expresan ambas isoformas de transportadores de vitamina C (SVCT 1 y 2). La función de estos transportadores se determinó mediante ensayos de transporte de ácido ascórbico. En experimentos in vivo con ratas tratadas con L-butionina-sulfoximina (BSO), inhibidor de la γ-glutamilcisteína sintetasa, observamos diferencias en los niveles y localización de SVCT1 en cortes de testículos. Se obtuvieron resultados similares cuando se trataron cultivos de células de Sertoli con este inhibidor. Sin embargo, cuando se realizaron ensayos funcionales en células de Sertoli depletadas de glutatión, observamos un aumento en la captación de ácido ascórbico. Estos datos sugieren que existe una estrecha relación entre los niveles intracelulares de glutatión y la expresión de SVCTs. 2 1.1. SUMMARY The somatic Sertoli cells within the seminiferous tubules perform a key role in supporting maturation and survival of germ cells. Vitamin C and glutathione are watersoluble antioxidants fundamental for cell physiology and are crucial in the development of male germ cell line as well as against chemical agents and radiation. In this work, we studied the molecular and functional behavior of vitamin C transporters under conditions of decreased levels of intracellular glutathione. We used rat testis slices and 42GPA9 Sertoli cell line. RT-PCR, immunocytochemical and Western blot analysis revealed that Sertoli cells express both isoforms of vitamin C transporters (SVCT 1 and 2). The function of these transporters was assessed by ascorbic acid uptake assays. In in vivo experiments with rats treated with L-buthionine-sulfoximine (BSO), an inhibitor of the γ-glutamylcystein synthetase, we observed differences in the levels and localization of SVCT1 in testicular slices. Similar results were obtained when Sertoli cell cultures were treated with this inhibitor. However, when functional assays were performed on glutathione depleted Sertoli cells, we observed an increase in ascorbic acid uptake. These data suggest a close relationship between intracellular glutathione levels and SVCT expression and localization. 3 2. INTRODUCCIÓN Existen dos tipos de antioxidantes: los antioxidantes enzimáticos y los antioxidantes no enzimáticos. Los primeros se encuentran dentro del organismo e impiden la formación de radicales libres a partir de otras moléculas. Si los radicales libres ya existen, estos antioxidantes se encargan de convertirlos en moléculas menos dañinas para el organismo. Ejemplos de estos antioxidantes son: la catalasa de los peroxisomas, la superóxido dismutasa y la glutatión peroxidasa. Los antioxidantes no enzimáticos son aquellos compuestos que donan sus electrones a los radicales libres, neutralizándolos y evitando reacciones en cadena. Sin embargo, los antioxidantes no enzimáticos como el glutatión, la vitamina C, la vitamina E y el β-caroteno no se convierten en radicales libres debido a la gran movilidad de sus otros electrones o simplemente son radicales libres no reactivos. 2.1. Glutatión 2.1.1. Generalidades del glutatión Dentro de la defensas no enzimáticas, tienen un papel importante los tioles no proteicos, de los cuales el glutatión (L-γ-glutamil-L-cisteinilglicina) es el más abundante presentando concentraciones entre 0,5-10 mM dentro de todas las células mamíferas, debido a que todas ellas poseen la maquinaria necesaria para su síntesis (Cotgreave y Gerdes 1998; Meister, 1983; Sies, 1996). El glutatión es un tripéptido derivado de la glicina, el glutamato y la cisteína, el cual es un antioxidante crítico debido a su relativa abundancia y capacidad para ciclar 4 rápidamente entre su forma reducida (GSH) y oxidada (GSSG) (Figura 1). Más del 90% del glutatión total (GSH+GSSG) se encuentra como GSH. En situaciones de estrés oxidativo, el GSH puede reaccionar directamente con los radicales libres o bien puede reducir los peróxidos por medio de la glutatión peroxidasa (GPx) formando GSSG por unión de dos moléculas de GSH mediante un puente disulfuro entre las cisteínas, el cual es inmediatamente reducido a GSH por medio de la enzima glutatión reductasa (GR), utilizando NADPH como cofactor (Figura 2). 5 Figura 1. Estructura del glutatión. El glutatión es un tripéptido derivado del glutamato, cisteína y glicina. Existe en dos formas: la forma reducida (GSH), y la forma oxidada, un compuesto formado por 2 moléculas de GSH unidas por un enlaces disulfuro, conocido como glutatión oxidado (GSSG). 6 Figura 2. Ciclo redox del glutatión. La eliminación de peróxidos en las células es realizado por la enzima glutatión peroxidasa (GPx). En esta reacción el glutatión reducido (GSH) es convertido en su forma oxidada (GSSG), pero luego es revertido nuevamente a GSH por acción de la glutatión reductasa (GR). Esta enzima utiliza el NADPH como cofactor. La glucosa-6-fosfato deshidrogenasa (G6PD) cataliza la primera reacción en la vía de la pentosa fosfato, la ruta metabólica que suple a las células de NADPH y de pentosas para la síntesis de ácidos nucleicos. La reacción catalizada por la G6PD es la reducción del NADP+ a expensas de la deshidrogenación de la glucosa6-fosfato en 6-fosfogluconato. 7 El GSH desempeña numerosas e importantes funciones metabólicas, una de ellas es la protección de las células contra la oxidación, debido a que posee un grupo sulfidrilo, el cual es un fuerte nucleofilo y confiere protección contra en daño causado por oxidantes, neutrófilos, radicales libres y compuestos tóxicos, así como proteger frente al efecto nocivo de las radiaciones (Sies,1991). Estos mecanismos de defensa incluyen la detoxificación de xenobióticos con la participación de enzimas conjugantes del tipo de la glutatión S-transferasa. Entre sus múltiples funciones destaca su participación en el correcto plegamiento de las proteínas recién sintetizadas, manteniendo los grupos sulfidrilo de las proteínas en su forma reducida y posee un papel importante en la reparación del DNA (Meister y Andereson, 1983; Meister, 1994). El glutatión también interviene en la síntesis de DNA (Estrela et al., 2006), en este proceso se requiere la reducción de ribonucleótidos para la formación de desoxirribonucleótidos, una reacción catalizada por la ribonucleótido reductasa. En esta reacción debe intervenir un donante de hidrógeno que puede ser la tiorredoxina o la glutarredoxina (Fernandes y Holmgren, 2004). Muchas de estas funciones se deben a su estructura química, el GSH posee dos características estructurales: un grupo sulfidrilo (-SH) de la cisteína, el cual interviene en las reacciones redox y un enlace γ- glutamilo entre la glutamina y la cisteína, el cual le da resistencia a la degradación por peptidasas celulares. Este enlace sólo es hidrolizable por la enzima γ-glutamil transpeptidasa (γ-GT) localizada en la membrana celular. 8 2.1.2. Metabolismo del glutatión El ciclo del γ-glutamil, es un conjunto de reacciones enzimáticas que participan tanto en la síntesis como en la degradación del glutatión, (Meister y Tate, 1976; Meister, 1983) (Figura 3). Estudios de Bloch y sus colaboradores demostraron que la síntesis de glutatión es catalizada en 2 pasos (Snoke y Bloch, 1945), siendo ambos dependiente de ATP. El primero paso consiste en una condensación del grupo γ-carboxilo del glutamato con el α-amino de la cisteína. El grupo carboxilo es activado inicialmente por el ATP para dar lugar a un intermediario de reacción del tipo fosfato de acilo, el cual es atacado por el grupo amino de la cisteína, dando lugar a la γ-glutamilcisteína. Este primer paso es realizado por la enzima γ-glutamilcisteína sintetasa. En condiciones fisiológicas, el paso limitante para la síntesis de glutatión es la disponibilidad de cisteína. La síntesis de glutatión está regulada por una retroalimentación negativa, ya que el glutatión inhibe la γ-glutamil-cisteín sintetasa (Richman y Mesiter, 1975). El segundo paso de la reacción es parecido, siendo activado el grupo α-carboxilo de la γ-glutamilcisteina a una forma fosfato acilo que permite la condensación con la glicina. Este último paso de la síntesis del glutatión es realizado por la enzima glutatión sintetasa. 9 Figura 3. Ciclo γ-glutamil. Es un conjunto de las reacciones enzimáticas que participan en la síntesis y degradación del GSH. Las enzimas y etapas involucradas están numeradas de la siguiente manera. 1, γ-glutamilcisteína sintetasa. 2, glutatión sintetasa. 3, salida de GSH. 4, γ-glutamil transpeptidasa. 5, γ-glutamil ciclotransferasa. 6, oxoprolinasa. 7, dipeptidasa. 8, sistema de transporte alanina-serina-cisteína (ASC). 9, acetilación. 10, glutatión S-transferasa. 10 El glutatión es degradado extracelularmente en un proceso de 2 etapas, la primera etapa es catalizada por la γ-glutamil transpeptidasa (γ-GT), catalizando 2 tipos de reacciones: • Reacción de transpeptidación: el grupo γ- glutamilo se transfiere a un aceptor adecuado. • Hidrólisis del enlace γ-glutamilo. La γ-GT se localiza en la membrana plasmática de las células (Meister y Anderson, 1983) y su sitio activo se orienta hacia la cara externa de la membrana. Cuando el GSH interacciona con la membrana, la γ-GT forma un γ-glutamil aminoácido, que entra al interior de la célula. La enzima γ-glutamil ciclotransferasa cataliza la liberación del aminoácido y formación de 5-oxoprolina. La oxoprolinasa cataliza la hidrólisis dependiente de ATP de la 5-oxoprolina, lo cual libera glutamato para la síntesis de GSH. También son sustrato de la γ-GT los GSH-conjugados producidos por la reacción catalizada por la glutatión S-transferasa. Dicha enzima cataliza las reacciones entre GSH y una amplia variedad de compuestos electrofílicos de origen exógeno. La segunda etapa es catalizada por la cistenil-glicina dipeptidasa, la cual hidroliza la cisteinilglicina formada por la γ-GT, liberando glicina y cisteína (Meister y Anderson, 1983). El sistema de transporte de alanina-serina-cisteína (ASC), mediante un transporte dependiente sodio, introduce cisteína al interior de la celular y es reutilizada en la síntesis de GSH (Chirstensen et al., 1967). Aunque no se conocen todas las funciones del ciclo γ-glutamil, se ha sugerido que también estaría participando 11 el metabolismo y transporte de aminoácidos, especialmente la cisteína (Meister y Larsson, 1995). 2.1.3. Modificación del glutatión intracelular El L-butionina-S,R-sulfoxamida (BSO) es un inhibidor específico de la γglutamilcisteína sintetasa (Griffith y Meister, 1979), enzima que cataliza la formación del enlace amido entre el ácido glutámico y la cisteína. La reacción corresponde a la etapa limitante de la síntesis de glutatión. El BSO se ha usado ampliamente para disminuir las concentraciones de glutatión en macrófagos, eritrocitos, células de Sertoli y células espermatogénicas de hámster (Rouzer et al, 1981; Griffith, 1981; den Boer et al, 1989). Por otro lado el dietil maleato (DEM) produce una rápida caída del GSH intracelular por conjugación, en una reacción mediada por la enzima glutatión Stransferasa. El producto de esta reacción es degradado y no entra al ciclo de reducción de glutatión por acción de la enzima glutatión reductasa, por lo que se produce una rápida depleción del GSH celular (Guaquil et al., 1997). 12 2.2. Vitamina C 2.2.1. Generalidades vitamina C La vitamina C (L-ácido ascórbico) es un micronutriente esencial para el organismo debido a que posee múltiples funciones fisiológicas. Esta vitamina es necesaria en la síntesis de colágeno y carnitina como co-factor enzimático, para mantener los iones metálicos en su forma reducida y en la neutralización de radicales libres generados a partir de numerosos procesos fisiológicos y patológicos (Carr y Frei, 1999; padayaty et al., 2003). Esta vitamina es una cetolactona de seis carbonos y dos grupos ácidos ionizables (pKa 4,04 y 11,34) que se encuentra parcialmente ionizada a pH fisiológico. La vitamina C puede existir en 2 formas biológicamente activas, la forma oxidada, el ácido deshidroascórbico (DHA) y la forma reducida, el ácido ascórbico (AA) (Carr y Frei, 1999). En los organismos la vitamina C se encuentra principalmente en su forma reducida como AA (Schorah et al., 1996), sin embargo se oxida en forma reversible a DHA. La oxidación es dependiente del pH, de la temperatura y de la concentración de algunos metales en transición, tales como hierro y cobre (Grünewald et al., 1993). Debido al carácter reversible de esta oxidación es que la biodisponibilidad de la vitamina C es igual a la suma de su forma oxidada y reducida (Figura 4). 13 Figura 4. Oxidación de ácido ascórbico. El ácido ascórbico (AA) es un agente reductor que perdiendo un electrón se transforma en el radical libre semideshidroascorbato (SDA). La pérdida de un segundo electrón da origen al ácido deshidroascórbico (DHA), que es la forma oxidada de la vitamina C. Tanto el ácido ascórbico como el ácido deshidroascórbico son biológicamente activos en procesos de óxido-reducción (Linster y Van Schaftingen, 2007). 14 La vitamina C es una vitamina hidrosoluble que es sintetizada en forma de AA por una variedad de organismos del reino animal y vegetal. En la mayoría de los mamíferos dicha síntesis ocurre en el hígado. Sin embargo, durante el transcurso de la evolución organismos como humanos, primates, conejillos de india, salmón coho y algunas aves han perdido la capacidad de sintetizarla y deben obtenerla de la dieta. Esto se debe a que carecen de L-gulono-γ-lactona oxidasa (GLO), la última enzima en la vía de síntesis de vitamina C partir de D-glucosa y D-galactosa. La GLO cataliza la oxidación de L-gulono-γ-lactona a ácido L-ascórbico con la formación de peróxido de hidrógeno (Figura 5) (Kiuchi et al, 1982; Padh, 1990; Naidu, 2003). Estas especies son capaces de sobrevivir gracias a que poseen un sistema de transporte que permite que AA proveniente de la dieta sea absorbida a nivel del intestino delgado. (Siliprandi et al, 1979). La vitamina C una vez ingerida de la dieta, es incorporada al plasma sanguíneo a través de su absorción intestinal. En el plasma la vitamina C está presente en su forma reducida a concentraciones que varían entre 20 y 50 µM (Capellmann et al., 1994). Diversas células y tejidos acumulan elevadas concentraciones de vitamina C, las cuales pueden llegar a valores 100 veces más altos que los encontrados en el plasma (Rose, 1988). La acumulación de vitamina C en determinados tejidos depende de un sistema de trasporte especializado que permita la incorporación de AA en determinados tipos celulares. 15 Figura 5. Biosíntesis de ácido ascórbico en mamíferos. El ácido ascórbico es sintetizado a partir de D-glucosa o D-galactosa. La enzima L-gulono-γ-lactona oxidasa no se expresa en humanos y primates, entre otras especies. 16 2.2.2. Sistemas involucrados en el trasporte de la vitamina C La vitamina C, debido a su tamaño y carga a pH fisiológico, no es capaz de difundir libremente a través de las membranas celulares, la entrada y la salida de esta vitamina en las células depende de dos mecanismos de trasporte: un primer sistema que transporta DHA y un segundo sistema que transporta AA (Bigley y Stankova,1974; Okamura, 1979; Schorah, 1992; Welch et al., 1995; Ngkeekwong y Ng, 1997). El ácido deshidroascórbico es transportado por un mecanismo facilitado de baja afinidad y de alta capacidad de transporte, a través de los transportadores facilitativos de hexosas (GLUTs), con 14 isoformas descritas (GLUT1-GLUT14), de las cuales GLUT1, GLUT2, GLUT3 y GLUT4 transportan DHA in vitro (Vera et al., 1993; Rumsey et al., 1997; Vera et al., 1995; Angulo et al., 1998). Estos transportadores presentan 12 dominios transmembrana, con sus extremos amino y carboxilo terminal intracelulares (Mueckler et al., 1994). El DHA presenta un mecanismo de transporte bi-direccional de baja afinidad (Km 1-4 mM) que es inhibido por glucosa y citocalasina B (Vera et al., 1993; Vera et al., 1995; Rumsey et al., 1997; Angulo et al., 1998; Nualart et al., 2003) Los distintos GLUTs difieren en sus propiedades funcionales, ya sea en las respectivas afinidades por sus sustratos. Además de lo anterior, muestran una distribución tisular y celular diferencial, observándose también que distintas células expresan normalmente más de una isoforma simultáneamente. GLUT1 es el transportador más ampliamente distribuido y se expresa en elevados niveles en células de las barreras sangre-tejido que se establecen por la formación de uniones ocluyentes entre células endoteliales (barrera hemato-encefálica) o entre células epiteliales (barrera intestinal). GLUT2 se expresa en hepatocitos, células β del páncreas, riñón y placenta. GLUT3 está presente 17 en forma abundante en el cerebro, riñón y placenta. GLUT4 está restringido al tejido adiposo y muscular los cuales comparten la propiedad de ser sensibles a la acción de la insulina (Mueckler et al., 1985; Flier et al., 1987; Thorens et al., 1988; Bashan et al., 1992; Lisinski et al., 2001; Reagan et al., 2001; Fueger et al., 2004; Korgun et al., 2005; Park et al., 2005). El ácido ascórbico es transportado por un mecanismo activo de alta afinidad y de baja capacidad de transporte, a través de los co-transportadores de Na+/ascorbato (SVCTs), con dos isoformas descritas hasta el momento, SVCT1 y SVCT2 (Tsukaguchi et al., 1999; Daruwala et al., 1999; Rajan et al., 1999; Wang et al., 1999; Wang et al., 2000). Tsukaguchi et al., (1998) clonaron dos transportadores de AA dependientes de sodio a partir de tejidos de rata, y los denominaron SVCT1 y SVCT2 (Sodium dependent Vitamin C Transporter). SVCT1 se clonó a partir de bibliotecas de cDNA de riñón de rata y humano (Daruwala et al., 1999; Faaland et al., 1998; Tsukaguchi et al., 1999), y se determinó que posee 604 aminoácidos; SVCT2 se clonó a partir de cerebro de rata y determinó que posee 592 aminoácidos. Ambas proteínas presentan 12 dominios de transmembrana y sus extremos amino y carboxilo terminal se encuentran orientados intracelularmente. Ambas proteínas poseen un 65 % de identidad aminoacídica, y los mayores porcentajes de identidad se encuentran en las regiones de transmembrana, en tanto que la mayor divergencia aminoacídica se encuentra en los extremos amino y carboxilo terminal (Tsukaguchi et al., 1998). En estudios cinéticos y funcionales realizados en ovocitos de Xenopus laevis y células transfectadas, se demostró que los trasportadores SVCTs son activados por sodio, saturables, electrogénicos y altamente específicos para L-ascorbato.(Faaland et al., 1998; 18 Daruwala et al., 1999; Rajan et al., 1999; Wang et al., 1999; Wang et al., 2000). Para SVCT1 se han descrito una Km aparente entre el rango de 65-237 µM y para SVCT2 una Km de 8-62 µM (Wang et al., 2000; Savini et al., 2007). SVCT2 requiere calcio y magnesio para su funcionamiento (Godoy et al., 2007). Estudios tendientes a demostrar la distribución del producto de expresión de los genes que codifican para SVCT1 y SVCT2 (hibridación in situ y Northern blot) sugieren que ambas isoformas poseen un patrón de expresión tejido específico. SVCT1 se expresa en tejidos epiteliales de absorción como intestino delgado, colón, riñón, ovario, páncreas, próstata, timo e hígado. Por su parte, SVCT2 se expresa en células metabólicamente activas y tejidos especializados, como tejido cerebral (principalmente en neuronas y algunos tipos de células gliales), tejido ocular, bazo, próstata, testículo, ovario, placenta, leucocitos y sistema endocrino, mostrando una expresión más general que SVCT1 (Faaland et al., 1998; Tsukaguchi et al., 1999; Wang et al., 1999; Wang et al., 2000; Castro et al., 2001, Mun et al., 2006). Sin embargo, estudios más detallados sugieren que la mayoría de los tejidos expresan ambas isoformas pero con diferentes niveles de expresión (Wilson, 2005). El eflujo de AA ha sido pobremente estudiado. Los transportadores de glucosa son capaces de transportar vitamina C hacia el exterior de las células sólo en su forma oxidada, y los transportadores activos de AA sólo funcionan facilitando el ingreso de esta vitamina al espacio intracelular. Dentro de las posibles formas de salida de ácido ascórbico desde las células, se ha descrito la participación de canales de aniones orgánicos sensibles a estiramiento (Filiberto et al., 1987; Siushansian et al., 1996; Wilson et al., 2000), la exocitosis a través de vesículas secretoras (von Zastrow et al., 19 1986), la participación de intercambiadores glutamato/ascorbato (Cammack et al., 1991) y de hemicanales formados por conexinas (Ahmad y Evans, 2002). Estos últimos podrían estar involucrados tanto en la entrada como en la salida de AA desde las células (Wilson, 2005). 2.3. Relación funcional entre el glutatión y la vitamina C La vitamina C y el glutatión son los antioxidantes solubles más importantes de la fisiología celular (Meister., 1994). El glutatión se ha visto involucrado en la acumulación celular de vitamina C y en mantenimiento de ésta en su forma reducida (Meister, 1994; Linster y Van Schaftingen, 2007), debido a que el DHA es incorporado rápidamente por las células y reducido a AA con la subsecuente acumulación de éste (Rumsey et al, 1997). Este proceso de regeneración de AA a partir de DHA, no es un proceso espontáneo, pues ocurre mediante mecanismos enzimáticos dependientes de glutatión (Himmerlreich et al, 1998; Ishikawa et al, 1998) e independiente de éste (Guaiquil et al, 1997). Sin embargo, el glutatión por sí solo es capaz de reducir el DHA a AA, pero es un proceso muy lento en condiciones fisiológicas (Linster y Van Schaftingen, 2007). La mantención de niveles constantes de vitamina C en una célula es un proceso dinámico en el que la vitamina C está bajo un constante reciclaje entre sus formas oxidada y reducida (Figura 6). En este contexto, los niveles de ácido ascórbico intracelulares no dependen solamente de la vitamina C recién transportada, sino que existen al menos dos procesos adicionales que pueden influenciar los niveles intracelulares de ácido ascórbico: la oxidación del ácido ascórbico intracelular por especies oxidantes generadas como producto del metabolismo oxidativo normal de una célula, y la 20 oxidación del ácido ascórbico intracelular durante la respuesta de la célula a eventos de estrés oxidativo. Los mecanismos enzimáticos involucrados en la reducción de DHA dependientes de glutatión corresponden a glutarredoxina (GRx), proteína disulfuro isomerasa (PDI) y glutatión S-transferasa omega (GTSO). Las dos primeras son oxidorreductasas y la última corresponde a una tioltransferasa, las cuales poseen en su sitio activo uno o más residuos de cisteína. Las glutarredoxinas son enzimas citosólicas pequeñas de 12 kDa, las cuales catalizan la reducción de los puentes disulfuro formados entre los grupos tiol de una proteína o los formados entre las proteínas y el GSH (Wells et al., 1990; Yang y Wells, 1991; Bushweller et al., 1992). Dependiendo de la presencia de una o dos cisteínas en su centro activo, se clasifican en monotiólicas y ditiólicas (Luikenhuis et al., 1998; Fernandes y Holmgren, 2004). Adicionalmente, las Grx en mamíferos tienen una lista creciente de funciones dentro de las cuales están la reducción del ácido deshidroascórbico, proliferación celular y la regulación de la actividad de factores de trascripción (Bandyopadhyay et al., 1998; Nakamura et al., 1999; Fernandes y Holmgren, 2004). Con respecto a la actividad DHA reductasa de esta proteína, análisis cinéticos han demostrado que presenta una Km aparente entre el rango de 0,2-2,2 mM y 1,6-8,7 mM para DHA y GSH, respectivamente. Basándose en la ubicación subcelular de la glutarredoxina, se sugiere que estaría contribuyendo en el reciclaje de la vitamina C en el citosol (Wells y Xu, 1994; Bánhegyi et al., 2003). PDI es una proteína de 57 kDa unida a la membrana del retículo endoplásmico, que sirve para crear y reorganizar los puentes disulfuro durante la síntesis proteica, 21 presentando una eficiencia catalítica para la actividad DHA reductasa de 250 veces menor que la glutarredoxina (Xu et al., 1996). Considerando la actividad reductasa en el retículo endoplásmico, se propuso que el DHA podría estar implicado como oxidante en la formación de puentes disulfuros en las proteínas catalizados por la PDI (Wells y Xu, 1994; Bánhegyi et al., 2003). Maellaro et al., (1994) purificó de hígado de rata una proteína con actividad DHA reductasa, con un peso molecular de 31 kDa y una Km aparente de 0,25 y 2,8 mM para DHA y GSH, respectivamente. Esta DHA reductasa no tiene homología con glutarredoxina y PDI, sino que pertenece a la nueva clase Omega de la super familia de glutatión S-transferasa (GSTs). Se han descrito y caracterizado dos genes que se transcriben activamente en humanos y se les ha denominado hGSTO1 (Board et al., 2000) y hGSTO2 (Wang et al., 2005). Se han descrito ortólogos en cerdo (Rouimi et al., 2001), ratón (Ishikawa et al., 1998), y rata (Ishikawa et al., 1998). Un aspecto importante en la secuencia de las subunidades de esta clase es la presencia en su sitio activo de una cisteína (Cys32) en vez de una tirosina o una serina (Board et al., 2000). Esta cisteína interactúa con el GSH formando un disulfuro mixto en su sitio activo. Esta característica puede relacionarse con la actividad tiol transferasa de la molécula, en la que se eliminan aductos S-tiolados formados entre las cisteínas de las proteínas y el GSH en respuesta a estrés oxidativo (Listowsky, 2005). Todo esto pone en evidencia la importancia que tiene este residuo cisteína y la formación del enlace disulfuro en la actividad catalítica de las GST de clase Omega (Board et al., 2000). En cuanto a la reducción de DHA, hGSTO2 resultó ser 70-100 veces más activa que hGSTO1 (Schmuck et al., 2005). Por último, el papel de la actividad DHA reductasa 22 dependiente de GSH en el reciclaje de la vitamina C fue demostrado cuando en células CHO que sobreexpresaban DHA reductasa de hígado de rata acumularon más AA que las células no transfectadas cuando se incubaron en presencia de DHA (Ishikawa et al., 1998). La reducción dependiente de glutatión es muy importante pero, aparentemente ésta no sería la única vía para la mantención del ácido ascórbico y es muy posible que existan múltiples mecanismos enzimáticos. Se ha observado que en células mieloides humanas la ausencia total de glutatión intracelular no afecta la capacidad de éstas para acumular intracelularmente grandes cantidades de ácido ascórbico (Guaiquil et al., 1997). En colon de rata se describió una actividad de reductasa de ácido deshidroascórbico que requiere de la participación de NADPH como dador de electrones y que posteriormente fue purificada de hígado de rata (Del Bello et al., 1994) e identificada como la enzima 3α-hidroxiesteroide deshidrogenasa (3α-HSD) (Del Bello et al., 1994; Pawlowski et al., 1991; Penning et al., 1984; Penning y Sharp, 1987). Estudios posteriores realizados en hepatocitos de rata y eritrocitos humanos, muestran que la enzima tiorredoxina reductasa, una selenoproteína que en conjunto con tiorredoxina forma un sistema de reducción de disulfuros proteicos (Gladyshev et al., 1996; Holmgren y Bjornstedt, 1995) y que en la ausencia de tiorredoxina puede reducir otros sustratos como ácido lipoico, vitamina K3 y aloxano, tiene la capacidad de reducir al ácido deshidroascórbico en presencia de NADPH, contribuyendo así a la mantención del contenido de ascorbato en hígado y eritrocitos (May et al., 1997; Mendiratta et al., 1998). 23 Figura 6. Reciclaje de la vitamina C. La vitamina C es incorporada al interior de la célula por dos mecanismos distintos, un trasporte activo que incorpora ácido ascórbico (AA) y un trasporte facilitativo que incorpora ácido deshidroascórbico (DHA). (azul). La utilización del AA como antioxidante conduce a la formación del radical libre semi-deshidroascorbato (SDA) en el citosol. Varios sistemas enzimáticos representados en verde convierten el SDA a AA. Por otro lado el DHA proveniente de fuentes externas, puede ser reducido a AA mediante mecanismos enzimáticos dependientes e independientes de glutatión (naranjo). GSTO, glutatión S-transferasa omega; 3αhidroxiesteroide DH, 3α-hidroxiesteroide deshidrogenasa; PDI, proteína disulfuro isomerasa. RH, molécula reducida. R+, molécula oxidada. 24 El primer indicio acerca de que existía una interacción funcional entre el glutatión y vitamina C, surgió de experimentos in vivo utilizando ratas recién nacidas, a las cuales se les indujo una deficiencia de glutatión al administrarles BSO. La disminución en el contenido de glutatión en los órganos de estas ratas produjo una disminución del contenido de ácido ascórbico intracelular de al menos un 50% en la mayoría de los órganos (Martensson y Meister, 1991). Por otro lado, la administración de vitamina C en la dieta incrementó notablemente los niveles de glutatión intracelular, no sólo en las ratas controles sino que también en las tratadas con BSO, previniendo los efectos letales producidos por la deficiencia de glutatión de una manera dependiente de la dosis (Martensson y Meister, 1991). Los mismos efectos fueron visualizados cuando a conejillos de india adultos se les indujo una deficiencia de glutatión (Griffith, et al., 1991). Investigaciones posteriores demostraron que la deficiencia de glutatión inducía muerte sólo en ratas recién nacidas, que al parecer no pueden sintetizar ácido ascórbico, y en animales incapaces de sintetizar ascorbato de manera endógena, como son los conejillos de india (Martensson et al., 1993). En ratones adultos que sí pueden sintetizar vitamina C, pero en los que la síntesis de glutatión fue inhibida con BSO, no se observó letalidad producida por la deficiencia de glutatión, pero si un aumento en la síntesis de ácido ascórbico por el hígado y en menor grado por el riñón (Martensson y Meister, 1992). En conejillos de india a los cuales se les administró una dieta libre de vitamina C, la administración de ésteres de glutatión disminuyó la pérdida de ácido ascórbico intracelular y retrasó la aparición de los síntomas de escorbuto (Martensson et al., 1993). Aunque no se conoce el mecanismo por el cual la vitamina C incrementa 25 los niveles de glutatión, este efecto parece ser específico ya que otros antioxidantes celulares son incapaces de generar un incremento en los niveles de glutatión intracelular (Skaper et al., 1997). Se ha sugerido que la vitamina C produciría una estimulación de las enzimas de la vía de las pentosas como la glucosa-6-fosfato deshidrogenasa y transaldolasa (Puskas et al., 2000). Lo que es interesante, es que esta interacción funcional vitamina C-glutatión también se observa en humanos, ya que en individuos con una deficiencia en los niveles de glutatión, éstos se ven aumentados luego de suplementación con vitamina C. Más aún, un estudio realizado con células endoteliales de vena umbilical humana demostró la presencia de radicales oxidantes en células conteniendo elevadas concentraciones de glutatión, los que fueron neutralizados rápidamente cuando las células fueron suplementadas con bajas concentraciones de vitamina C. 2.4. Células de Sertoli y su papel en la espermatogénesis El epitelio del túbulo seminífero está constituido principalmente por dos clases de células. Por una parte, la célula nutriente o nodriza, las células de Sertoli y, por otra, las células que constituyen la línea espermatogénica o seminal. Estas últimas se disponen en 4 a 8 capas que ocupan el espacio entre la membrana basal y la luz del túbulo (Stevens y Lowe, 1988). Estas células se dividen varias veces, se diferencian y terminan por producir espermatozoide, proceso conocido como espermatogénesis. Esta proliferación y diferenciación celular tiene lugar en varios microambientes que son el resultado de interacciones celulares que ocurren en el túbulo seminífero dentro del testículo (De Kretser et al., 1988). Por último, en el espacio intersticial entre los túbulos 26 se encuentran las células de Leydig que tienen función endocrina (Weinbauer y Wessels, 1999). La organización anatómica del túbulo seminífero proporciona las bases para el establecimiento de interacciones auto y paracrinas, y de contacto celular que forman una red de señalización celular que determinará el control del proceso espermatogénico (Grootegoed et al., 1989; Skinner et al., 1989; Jegou, 1993 Weinbauer y Wessels, 1999). Cuando colorantes vitales y otras sustancias son introducidas en el torrente circulatorio, abandonan rápidamente los vasos y pasan a los espacios extracelulares de la mayoría de los tejidos y órganos. En el testículo se ha descrito una estructura que controla el paso de sustancias a la región luminal del túbulo seminífero, la barrera hemato-testicular (BHT). Esta barrera no reside en las paredes de los vasos sanguíneos, como es el caso de la barrera hemato-encefálica, se debe, en cambio, a la presencia de complejos de unión especiales entre las células de Sertoli vecinas. De este modo, dividen al epitelio en un compartimento basal que contiene las espermatogonias y los espermatocitos preleptoténicos y un compartimento adluminal, que contiene las fases más avanzadas de diferenciación de las células germinales y que está limitado por las membranas de células de Sertoli adyacentes (Figura 5, A). Las moléculas de los espacios extracelulares del intersticio tienen acceso al compartimento basal, pero se les impide penetrar más profundamente en el epitelio, gracias a la barrera formada por las uniones entre las células de Sertoli. Está barrera cercana a la base del epitelio permite que las células de Sertoli mantengan en el compartimento adluminal un microambiente particularmente favorable para la diferenciación de las células germinales. El proceso de desarrollo espermatogénico consiste en la 27 proliferación de células madre y espermatogonias en contacto con la membrana basal (compartimento basal), seguido por la entrada de las células espermatogénicas en meiosis (espermatocitos preleptotenos) simultáneamente con la migración de éstos a través de las uniones estrechas entre las células de Sertoli sin perturbar la funcionalidad de la BHT (Ghabriel et al., 2002). El resto del proceso meiótico y postmeiótico hasta la etapa de espermátidas elongadas ocurre en el compartimento adluminal (Russell, 1980). La proliferación y diferenciación de los espermatocitos primarios (diploides), secundarios (haploide) y espermátidas (haploides) en el compartimento adluminal ocurre entonces bajo la influencia y control directo de las células de Sertoli (Figura 5, B) (Jegou, 1993; Skinner et al., 1991; Griswold, 1998). La principal función de las células de Sertoli es separar el túbulo seminífero en dos compartimentos fisiológicamente diferentes, formando la barrera hemato-testicular (BHT) (Holash et al., 1993), además de proporcionar nutrientes y factores de crecimiento necesarios para la espermatogénesis son proporcionados por estas células. Se sabe que en determinadas condiciones las células de Sertoli tienen actividad fagocitaria, digiriendo los fragmentos citoplasmáticos (cuerpos residuales) que se desprenden de las espermátidas durante su diferenciación, proceso conocido como espermatogénesis (Clermont et al., 1987), Las células de Sertoli presentan características morfológicas claras, estas células son alargadas y columnares, de forma piramidal, y se apoyan sobre la lámina basal del túbulo (Sertoli, 1865). Su membrana celular es irregular y presentan un citoplasma claro, eosinofílico y con formaciones granulares, contiene numerosas mitocondrias, poco visible que constantemente cambia para permitir el movimiento progresivo de las células germinales hacia el lumen de 28 túbulo (Pineau et al., 1999). El núcleo es de morfología irregular ovalada, se localiza cerca de la lámina basal en la base del túbulo seminífero y se caracteriza por su forma alargada con cromatina poco visible, el nucleoplasma es vesicular, con un nucléolo grande, prominente y denso. Presentan un citoesqueleto bien desarrollado y son capaces de anclarse a la lámina basal a través de uniones del tipo hemidesmosomas (Brehm y Steger, 2005). 29 A B 30 Figura 7. Epitelio seminífero. A. Esquema representativo de la arquitectura del epitelio seminífero en mamífero. Barrera hemato-testicular formada por las células de Sertoli. Las células de Sertoli vecinas se unen lateralmente por uniones ocluyentes que dividen el túbulo seminífero en dos compartimentos e impiden el libre paso de sustancias entre ambos. El compartimento basal comprende el espacio intersticial y los espacios ocupados por las espermatogonias (A). El segundo compartimento, denominado adluminal, incluye la luz del túbulo y el espacio que se extiende entre células vecinas desde la luz hasta las uniones estrechas (B). Este compartimento contiene espermatocitos, espermátidas y espermatozoides. B. Esquema representativo de la espermatogénesis en el epitelio seminífero. Comienza con la proliferación de las espermatogonias que están en contacto la membrana basal, la ultima división da lugar a los espermatocitos I, posteriormente estas células entran en meiosis para dar lugar a las espermátidas, la cuales se diferencian para alcanzar la maduración completa de los espermatozoides. 31 2.5. Glutatión, vitamina C y espermatogénesis En testículo de mamíferos, las células de Sertoli controlan la proliferación y diferenciación de las células germinales a través de comunicación célula-célula y conforman la barrera hemato-testicular. Estas células juegan un papel fundamental en la regulación de la diferenciación y el metabolismo de las células germinales, incluyendo la capacidad para regular los sistemas antioxidantes y responder a estrés oxidativo. Antioxidantes como la vitamina C y el glutatión son fundamentales para la fisiología del sistema reproductor masculino. La vitamina C es esencial en el desarrollo normal de la línea germinal masculina, encontrándose altamente concentrado en el lumen del túbulo seminífero gracias a la expresión de los transportadores de vitamina C (Tabla I y II). La carencia de vitamina C produce en conejillos de indias degeneración masiva del epitelio germinal con descamación hacia el lumen de los túbulos seminíferos y un efecto similar al de la privación androgénica en tejidos blanco tales como testículo, epidídimo, conducto deferente y glándulas accesorias, sumado a un efecto secundario de esterilidad, que se manifiesta como pérdida de la capacidad fecundante (Chinoy et al., 1986). Concentraciones bajas de vitamina C en el líquido seminal están estrechamente vinculadas con una calidad espermática disminuida e infertilidad 32 Tabla I. Expresión de los transportadores de ácido deshidroascórbico (GLUTs) en testículo. Transportador Expresión en tejido/tipo celular Función Referencia GLUT1 Testículo, células de Sertoli, espermatocitos, espermátidas, espermatozoides. Transporte de glucosa y ácido deshidroascórbico en células de Sertoli y espermatozoides, transporte de glucosa en espermatocitos paquiténicos y espermátidas redondas. Angulo et al., 1998; Kokk et al., 2004,; Carosa et al., 2005; Rauch et al., 2006; Angulo et al., 2008; Galardo et al., 2008 GLUT2 Testículos, células de Sertoli, espermatocitos, espermátidas, espermatozoides. Transporte de glucosa y ácido deshidroascórbico en espermatozoides Angulo et al., 1998; Kokk et al., 2004,; Angulo et al., 2008 GLUT3 Testículos, células de Sertoli, espermatocitos, espermátidas, espermatozoides. Transporte de glucosa y ácido dehidroascórbico en células de Sertoli y espermatozoides, transporte de glucosa en espermatocitos paquiténicos y espermátidas redondas Burant y Davidson 1994; Angulo et al., 1998; Kokk et al., 2004; Rauch et al., 2006; Angulo et al., 2008; Galardo et al., 2008 GLUT4 Testículos, células de Sertoli No descrito Angulo et al., 1998; Angulo et al., 2008 Adaptado de Angulo et al. (2010) 33 Tabla II. Expresión de los transportadores de ácido ascórbico (SVCTs) en testículo. Transportador Expresión en tejido/tipo celular Función Referencia SVCT1 Testículo, células de Transporte de Sertoli, espermatocitos, ácido ascórbico en células de Sertoli espermátidas, espermatozoide Angulo et al., 2008 SVCT2 Testículo, células de Transporte de Sertoli, espermatocitos, ácido ascórbico en células de Sertoli espermátidas, espermatozoide Tsukaguchi et al., 1999; Wang et al., 2000; Angulo et al., 2008 Adaptado de Angulo et al. (2010) Tabla III. Contenido de glutatión y actividad de enzimas antioxidantes dependientes de glutatión en testículo Glutatión Célula de Sertoli 27 Espermatocito paquitenico 54 Espermátida redonda 55 Espermatozoide 50 10 19 17 21 10 12 10 1400 200 200 50 No detectado (nmol/mg de proteína) Actividad GPx (nmol producto/min/mg proteína) Actividad GR (nmol producto/min/mg proteína) Actividad GST (nmol producto/min/mg proteína) (Bauche at al., 1994) 34 El líquido seminal de individuos normales contiene un nivel de vitamina C (727± 90 µM) que es varias veces mayor al normalmente encontrado en el suero (Berg et al., 1941; Paz et al., 1977). La vitamina C es concentrada y secretada por las vesículas seminales durante la eyaculación y es considerada como uno de los principales agentes antioxidantes del semen. En el hombre, la disminución de la vitamina C del semen está estrechamente relacionada con una calidad espermática reducida, expresada en términos de disminución de la motilidad, menor número de espermatozoides, alteración en la morfología y abundante aglutinación entre las células (Dawson et al., 1987; Lewis et al., 1997; Sönmez et al., 2005) El papel de la vitamina C en la espermatogénesis se podría relacionar con la elevada capacidad de los espermatozoides de mamíferos para generar especies de oxígeno reactivas. La vitamina C, junto con otros compuestos en el líquido seminal, juega un papel central en la protección del espermatozoide contra especies de oxígeno reactivas como H2O2 y O2, que se generan a nivel de las membranas de los propios espermatozoides (Aitken y Fischer, 1994; Aitken y Krausz, 2001). Por otro lado, se ha sugerido que el glutatión jugaría un importante papel durante la espermatogénesis debido a que mediciones en testículos de rata y ratón han revelado un elevado contenido de glutatión y actividad de enzimas antioxidantes dependientes de glutatión (Tabla III) (Li, 1975; Bauche at al., 1994; Castellón, 1994; Tramer et al., 1998; Rao y Shaha, 2000; Castellon et al., 2005). De hecho, también se ha propuesto una relación entre infertilidad y un contenido disminuido de glutatión (Teaf et al., 1987; Irvine, 1996; Kumar et al., 2000). Grosshans y Calvin (1985) observaron un incremento del contenido de glutatión en testículo de rata entre días los 8 y 28 post- 35 natal, manteniéndose los niveles de glutatión elevados durante todo el desarrollo testicular. Este evento coincide con el inicio de la espermatogénesis, sugiriendo que el GSH sería un factor importante en dicho proceso. Numerosos estudios han demostrado que la concentración de glutatión en células espermatogénicas es mucho mayor que las reportadas en las células de Sertoli, sin embargo, estudios con células aisladas y en cultivos mixtos de células germinales y células de Sertoli, han revelado que aparentemente las células germinales no poseerían la maquinaria o los precursores necesarios para sintetizar glutatión, sugiriendo una nueva función para la célula de Sertoli en la síntesis de glutatión por parte de las células germinales o las células del epidídimo, relacionada con la biodisponibilidad de aminoácidos precursores (Bauche et al., 1994; Li et al., 1989; den Boer et al., 1989; Castellon, 1999; Kaneko et al., 2002; Castellon et al., 2003; Castellon et al., 2005). Es ampliamente sabido que el ácido ascórbico funciona como un antioxidante esencial en casos de severa deficiencia de glutatión, y que fisiológicamente glutatión y ácido ascórbico actúan en conjunto como un sistema antioxidante celular que muestran propiedades antioxidantes posiblemente complementarias. A pesar de que el papel del glutatión y del ácido ascórbico en la defensa contra el estrés oxidativo ha sido ampliamente documentada en distintos tipos celulares (Macho et al., 1997; Sato et al., 1995; Schulz et al., 2000; Guaiquil et al., 2001), no existe evidencia si los transportadores de ácido ascórbico están involucrados en este sistema. Además, se sabe que el desarrollo y la supervivencia de las células germinales dependen del contacto con las células de Sertoli en el epitelio seminífero de rata. Glutatión y vitamina 36 C son fundamentales en el desarrollo de la línea germinal masculina y en la defensa contra agentes químicos y radiaciones. En todo este contexto las células de Sertoli son un modelo válido para estudiar en comportamiento molecular y funcional de los trasportadores de AA frente a los niveles intracelulares de glutatión, debido a que estas células son las encargadas de formar la barrera hemato-testicular a través de la cual se lleva a cabo el desarrollo de la línea germinal masculina, además de proveer de nutrientes y factores de crecimiento, a si como de vitamina C a las células germinales. Tomando en consideración lo anterior se planteó siguiente hipótesis: La ausencia de glutatión afecta la expresión y función de los transportadores de acido ascórbico en células de Sertoli. Por lo tanto, los objetivos específicos de esta tesis son: 1. Evaluar la localización de los trasportadores de vitamina C en cortes de testículo de rata de distintas edades y en testículos adultos depletados de glutatión. 2. Determinar la viabilidad celular de las células de Sertoli 42GPA9 depletadas de glutatión. 3. Evaluar la expresión y función de los transportadores de vitamina C en células de Sertoli 42GPA9 depletadas de glutatión. 37 3. MATERIALES Y MÉTODOS. 3.1. Materiales. 3.1.1. Reactivos químicos. De Sigma Chemical Co. (USA) se obtuvieron los siguientes reactivos: azul de Coomassie G-250, Histochoice (fijador de tejido), ioduro de propidio (IP), citocalasina B (cito B), citocalasina E (cito E), ouabaína, 2-desoxiglucosa (DOG), o-metilglucosa (OMG), L-ácido ascórbico (AA), Tritón X-100, rojo fenol, starter-RT (oligo-dT), azul de tripán, solución de colágeno tipo I de cola de rata, ácido sulfosalicílico, glutatión reductasa, 5,5'-ditiobis (2-ácido nitrobenzoico), glutatión reducido, nicotinamida adenín dinucleótido fosfato (NADPH), L-butionina-S,R-sulfoxamida (BSO) y dietil maleato (DEM). De Merck & Co, Inc. (Alemania) se obtuvieron los siguientes reactivos: cloruro de mercurio II, ácido clorhídrico, cloruro de potasio, alcohol metílico, alcohol etílico, fosfato diácido de sodio, fosfato dihidrógeno de potasio, arcrilamida, bisacrilamida, alcohol isopropílico, cloroformo, hidróxido de sodio. De Winkler Ltda. (Chile) se adquirió albúmina de suero de bovino (BSA), glicina, Tris, carbonato de sodio, dodecilsulfato de sodio (SDS), persulfato de amonio, cloruro de sodio, cloruro de calcio, cloruro de magnesio, reactivo de Bradford, agua ultra pura libre de nucleasas, tampón de carga de proteínas 2X. De Gibco-BRL Laboratorios Life Technologies, Inc. (USA) se adquirió: tripsinaEDTA, penicilina/estreptomicina/fungizona. 38 De Hyclone (USA), se obtuvo medio de cultivo Dulbelco´s Eagle modificado enriquecido con F-12 (DMEM-F12) y suero fetal bovino (FBS). De Santa Cruz Biotechnology (USA), se obtuvo anti GLUT3 (sc-7582), anti βactina (sc-81178), anti SVCT1 (sc-9921), anti SVCT2 (sc-9927), anti WT1 (sc-192). De INVITROGEN Corporation (USA), se obtuvo TOPRO-3, anticuerpo anti-IgG de cabra y conejo conjugado a Alexa Fluor 488, anticuerpo anti-igG de cabra conjugado a Alexa Fluor 568 y medio de montaje para fluorescencia. De Pierce Biotechnology, Inc. (USA) se adquirieron los anticuerpos secundarios conjugados a peroxidasa, anti-IgG de ratón, anti-IgG de cabra y anti-IgG de conejo, reactivo ECL para quimioluminescencia y cocktail de inhibidores de proteasas 100X. De Promega Co. (USA), se adquirió la enzima transcriptasa reversa M-MLV, los dNTP`s, la enzima GoTaq polimerasa, estándar de DNA 100bp. De Lonza Group Ltda, (Suiza), se obtuvo Agarosa Seakem. De OMEGA Bio-Tek Inc, (USA), se obtuvo RNASolv. De MBI Fermentas (USA), fue obtenido el estándar de peso molecular preteñido para geles de poliacrilamida-SDS.De bioWORLD (USA), se adquirió TEMED. De Calbiochem, EMD Chemicals Inc (USA), se adquirió Tween 20 y β-mercaptoetanol. Los análogos radioactivos [1,2-3H]-desoxi-D-glucosa (3H-DOG) y D-3-O-[metil-3H]glucosa (3H-OMG) fueron adquiridos en American Radiolabeled Chemicals, Inc. (USA) y el 1-14C-L-ácido ascórbico (14C-AA) en Perkin Elmer Inc, (USA). 39 3.1.2 Material biológico. Para los cortes histológicos se utilizaron ratas adultas Sprague-Dawley, obtenidas del bioterio de la Universidad Austral de Chile, donde son mantenidos según las normas vigentes. Estos animales de experimentación son anestesiados con cloroformo y sacrificados por decapitación, según las medidas de bioseguridad del “Manual de Normas de Bioseguridad” de CONICYT de 2008. Los restos animales son cremados en el incinerador del Fundo Teja Norte de la Universidad Austral de Chile, donde se descartan los desechos biológicos de acuerdo al Manual de Procedimiento para el Manejo de Residuos de la UACh. 3.1.3 Instrumentos. Los equipos utilizados fueron los siguientes: pHmetro Radiometer Copenhagen PHM 83 Autocal, balanza Precisa 180ª, cámara de Neubauer VWR, centrífuga Eppendorf 5417-R, centrífuga Beckman Coulter Allegra 6, centrífuga Microv Fisher Scientific, incubador para cultivo NuaireTMDH Autoflow, gabinete de seguridad biológica NuaireTM Class II UN-425-600-E, microscopio confocal OLYMPUS Fluoview FV 1000, microscopio de epifluorescencia OLYMPUS BX 50 con cámara OLYMPUS U-TV0 5XC-3, microscopio invertido OLYMPUS CKX41, fuente de poder EPS 250 de Scientific Company, agitador magnético IKAMAGR RCT, sonicador Ultrasonic Homogenizer 4710 Cole Parmer Instruments Co. espectrofotómetro Aligent 8453, sistema de electroforesis y transferencia Mini ProteanR Tri-Carb 1600 TR, agitador orbital Lab-Line, baño termorregulado Haake 40 D8, freezer a -70ºC Foma Scientific Bio-freezer 8425, freezer a -20ºC Consul, refrigerador Fensa y Whirlpool. 3.2. Métodos. 3.2.1 Cultivo de células de Sertoli 42GPA9. Las células de Sertoli 42GPA9 se cultivaron en medio DMEM-F12 suplementado con FBS (suero bovino fetal) al 10%, L-glutamina 2 mM, penicilina 50 U/mL, estreptomicina 50 mg/mL y fungizona 50 ng/mL a 37ºC y CO2 al 5 % (Bourdon et al., 1998; Lablack et al., 1998; Bourdon et al., 1999; Xing y Sairam, 2001). 3.2.2 Ensayo de viabilidad mediante azul de tripán El colorante azul de tripán no puede penetrar células vivas, por consiguiente, si este coloide logra entrar a las células éstas se consideran como células muertas (color azul). Para el conteo se utilizó tripsina 0.25% por 10 minutos para obtener una suspensión celular la cual fue tratada con azul de tripán (1:1) procediéndose posteriormente a contar en cámara de Neubauer. 3.2.3 Extracción de RNA Se obtuvo RNA total de células en cultivo mediante un método equivalente al de Trizol, utilizando RNA-Solv. Se homogeneizaron 5-10 x 106 células en 1mL de reactivo y se transfirieron a un tubo nuevo, se agregó 0,2 mL de cloroformo y se agitó 41 vigorosamente por 15 segundos en vórtex, inmediatamente se incubó en hielo por 10 minutos. Se centrifugó la muestra a 12000 x g por 15 minutos a 4ºC obteniéndose tres fases. Posteriormente el 80% de fase acuosa se transfirió a un tubo nuevo y se precipitó el RNA con 0,5 mL de isopropanol dejando reposar 20 minutos, luego el RNA fue centrifugado a 12000 x g por 10 minutos a 4ºC y se lavó con 1 mL de etanol 80% en vortex, posteriormente se centrifugó a 7500 x g por 5 minutos y se retiró el etanol, se dejó secar por 5 minutos y se resuspendió en 30µL de agua ultra pura libre de nucleasas. Se determinó la concentración del RNA midiendo absorbancia a 260 nm usando la relación de una unidad de absorbancia corresponde a 40µg/mL de RNA. A las muestras obtenidas se les determinó la relación de absorbancia 260 nm/280 nm, encontrándose todas dentro del rango de 1,9-2,0. 3.2.4 Reacción en cadena de la polimerasa acoplada a trancripción reversa (RTPCR) Para la trascripción reversa se preparó una mezcla consistente en 4 µg de RNA, 1 µl de starter-RT 5 µM (oligo-dT) y agua libre de nucleasas para completar 35,5 µL, la que se incubó a 70ºC por 5 minutos para finalmente dejarla en hielo. Paralelamente se preparó una segunda mezcla que contenía 10 µL de tampón RT 5X (Tris-HCl 250 mM, KCl 375 mM, MgCl2 15 mM, DTT 50 mM, pH 8,3), 4 µL de dNTP´s 10 mM, 0,7 µL de enzima transcriptasa reversa M-MLV (200 U/µL), se juntaron ambas mezclas y se incubaron a 42ºC por 1 hora. Adicionalmente, se realizó el mismo procedimiento en ausencia de la enzima transcriptasa reversa para descartar la presencia de contaminación con DNA genómico. 42 Para la reacción de amplificación, se utilizaron partidores diseñados para amplificar segmentos internos de mSVCT1, mSVCT2. Para controlar la integridad de los cDNAs, se llevaron a cabo reacciones de amplificación utilizando partidores diseñados para amplificar el gen que codifica para β-actina. En todos los casos, se preparó la mezcla de reacción conteniendo en todos los casos: 2,5 µL de tampón green 5X, 1,25 µL de MgCl2 25 mM (tampón y MgCl2, suministrado con la enzima), 0,25 µL de dNTP´s 10 mM, 5,3 µL de agua libre de nucleasas, 1,3 µL de cada partidor 10 µM, 1 µL de templado y finalmente 0,1 µL de enzima GoTaq (5 U/µL), generando un volumen final de 13 µL. Se utilizaron 2 pares juegos de partidores para cada isoforma de los SVCTs. SVCT1 y SVCT2, diseñados para rata/ratón y SVCT1.1 y SVCT2.1 diseñados exclusivamente para ratón. Los partidores usados fueron: SVCT1 Sentido: 5’ act ctc ctc cgc atc cag at3’ Antisentido: 5’ cca ggc ggg cag agg cgt ag 3’ Tamaño del amplicón: 304 pb SVCT1.1 Sentido: 5’ ctt gag agg tgg aag tgt c 3’ Antisentido: 5’ cag tag ccc agc gat aat gc 3’ Tamaño del amplicón: 651 pb SVCT2 Sentido: 5’ ttg acc att aca ccc acg gt 3’ Antisentido: 5’ cat aga agc cat act ttg tg 3’ Tamaño del amplicón: 307 pb 43 SVCT2.1 Sentido: 5’ tgg acc ctt gac cat cac ac 3’ Antisentido: 5’ agg cgt agt agt cac cga tg 3’ Tamaño del amplicón; 475 pb β-actina: Sentido: 5` gca ccc tgt gct cac cga gg 3` Antisentido: 5` caa tgc cac tgg tac gac cag ag 3` Tamaño del amplicón: 350 pb Para cada reacción de amplificación se siguieron los siguientes protocolos: SVCT1: Se realizaron 35 ciclos incubando a 94°C durante 45 segundos, a 52°C durante 45 segundos y 72 °C durante 30 segundos. SVCT1.1: Se realizaron 35 ciclos incubando a 94°C durante 45 segundos, a 54°C durante 45 segundos y 72 °C durante 30 segundos. SVCT2: Se realizaron 35 ciclos incubando a 94°C durante 50 segundos, a 55°C durante 50 segundos y 72ºC durante 30 segundos. SVCT2.2: Se realizaron 35 ciclos incubando a 94°C durante 50 segundos, a 59°C durante 50 segundos y 72ºC durante 30 segundos. β-actina: Se realizaron 30 ciclos incubando a 94ºC durante 30 segundos, a 64ºC durante 30 segundos y 72ºC durante 30 segundos. Por último, los productos de amplificación obtenidos se resolvieron en geles de agarosa al 1,5% que contenían bromuro de etidio 0,2 mg/mL. La electroforesis se realizó a 60 V y se visualizaron las bandas obtenidas en un transiluminador UV. 44 3.2.5 Inmunohistoquímica 3.2.5.1 Cromógena Los testículos de rata se fijaron con Bouin acuoso (75 mL ácido pícrico saturado en agua, 25 mL formamida 40%, 5 mL ácido acético glacial) por 48 horas. Posteriormente, las muestras fueron incluidas en parafina. Los testículos fijados e incluidos se seccionaron con un micrótomo, obteniéndose cortes seriados de 5 µm de grosor y fueron montados en portaobjetos de vidrio gelatinizados. Los cortes incluidos en parafina fueron pasadas por xilol y una batería descendente de etanol (100% I, 100% II, 95% I, 95% II, 70%, (v/v)) por 5 minutos cada uno para desparafinar e hidratar, luego se lavaron tres veces con agua destilada por 3 minutos. Posteriormente, los cortes fueron sometidos a un tratamiento para mejorar la exposición de los antígenos que consistió en incubar la muestra con citrato de sodio 10 mM (pH 6,0) en un horno microondas, 1 minuto a 100% de potencia, 10 minutos a 10% de potencia y 15 minutos a temperatura ambiente. Para eliminar el exceso de citrato se lavó con agua destilada dos veces por 5 minutos. Para eliminar la actividad de la peroxidasa endógena, los cortes se trataron con 3% peróxido de hidrógeno en metanol durante 15 minutos. Seguido de tres lavados con tampón fosfato 0,1 M (PBS, pH 7,4; 320 mOsm), por 5 minutos. Se bloqueó y permeabilizó con solución de bloqueo (5% BSA, 0.3% Tritón X-100, en PBS 0,1 M) por 2 horas en cámara húmeda a temperatura ambiente. Para la incubación con los anticuerpos primarios (anti-SVCT 1, anti-SVCT2, anti-GLUT3, anti-MGS y anti-PTG) se utilizaron diluciones de 1:100 en solución de bloqueo modificada (1% BSA, 0,3% tritón X-100 en PBS 0,1 M). Se incubaron con el 45 anticuerpo primario por toda la noche a 4°C en cámara húmeda. Posteriormente se lavaron los cortes tres veces con PBS 0,1 M Tritón 0,3% por 10 minutos. Como anticuerpo secundario se utilizó anti-igG de cabra, anti-igG de rata y anti-igG de conejo conjugados con peroxidasa de rábano (HRP), según fuera el caso, en una dilución 1:200 en solución de bloqueo modificada, se incubó por 2 horas en cámara húmeda a temperatura ambiente. Se lavó tres veces con PBS 1x-Tritón X-100 0,3 % una vez con PBS 0,1 M por 10 minutos cada uno. Para el revelado se incubó con una solución de 3,3´-diaminobenzidina (DAB) 0,7 mg/mL y 0,03% de peróxido de hidrógeno por 10 minutos en oscuridad seguido de tres lavados con agua destilada por 3 minutos. Los núcleos fueron teñidos con hematoxilina durante 10 segundos y el viraje de color se realizó inmediatamente en borato de sodio por 2 segundos. Finalmente, los cortes fueron deshidratados en una batería ascendente de etanol (70%, 95% II, 95% I, 100% II y 100% I (v/v)) y xilol por 5 minutos cada uno, para luego ser montados utilizando bálsamo de Canadá. Los cortes fueron observados en un microscopio de epifluorescencia OLYMPUS BX 50 agrupado con una cámara OLYMPUS U-TV0 5XC-3. 3.2.5.2 Inmunofluorescencia Los testículos de rata se fijaron con p-formaldehido al 4% en tampón fosfato 0.1M, pH 7,4 por 48 horas. Posteriormente, las muestras fueron incluidas en parafina. Los testículos fijados e incluidos se seccionaron con un micrótomo, obteniéndose cortes seriados de 5 µm de grosor y fueron montados en portaobjetos de vidrio gelatinizados. 46 Los cortes incluidos en parafina fueron pasados por xilol y una batería descendente de etanol (100% I, 100% II, 95% I, 95% II, 70%, (v/v)) por 5 minutos cada uno para desparafinar e hidratar, luego se lavaron tres veces con agua destilada por 3 minutos. Posteriormente, los cortes fueron sometidos a un tratamiento para mejorar la exposición de los antígenos que consistió en incubar la muestra con citrato de sodio 10 mM (pH 6,0) en un horno microondas, 1 minuto a 100% de potencia, 10 minutos a 10% de potencia y 15 minutos a temperatura ambiente. Para eliminar el exceso de citrato se lavó con agua destilada dos veces por 5 minutos Después de dos lavados con PBS 0,1 M por 10 minutos, se bloqueó y permeabilizó con solución de bloqueo (5% BSA, 0,3% Tritón X-100, en PBS 0,1 M) por 2 horas en cámara húmeda a temperatura ambiente. Para la incubación con los anticuerpos primarios (anti-SVCT 1, anti-SVCT2, anti-WT1) se utilizó una dilución de 1:100 en solución de bloqueo modificada (1% BSA, 0,3% Tritón X-100 en PBS 0,1 M). Se incubaron con el anticuerpo primario por toda la noche a 4°C en cámara húmeda. Posteriormente, se lavaron los cortes tres veces con PBS 0.1 M Tritón 0,3% por 10 minutos. Como anticuerpo secundario se utilizó anti-igG de cabra conjugado a Alexa fluor 596 y anti-igG de conejo conjugado a Alexa fluor 488 en una dilución 1:200 en solución de bloqueo modificada y se incubó durante 2 horas en cámara húmeda a temperatura ambiente. Se lavó tres veces con PBS 0,1 M-Tritón X100 0,3 % y una vez con PBS 0,1 M por 10 minutos cada uno. Los núcleos fueron teñidos utilizando TOPRO-3 1:5000 junto a la incubación del anticuerpo secundario. Las muestras fueron montadas con medio de montaje para fluorescencia DAKO y visualizadas utilizando un microscopio confocal invertido. 47 3.2.6 Inmunocitoquimica Las células de Sertoli 42GPA9 fueron cultivadas sobre cubreobjetos redondos de vidrio (12mm), previamente tratados con colágeno, las preparaciones fueron fijadas con Histochoice : etanol (4:1),). Después de dos lavados con PBS 0,1 M ( pH7,4) por 10 minutos, se bloqueó y permeabilizó con solución de bloqueo (5% BSA, 0,3% Tritón X100, en PBS 0,1 M) por 2 horas en cámara húmeda a temperatura ambiente. Para la incubación con los anticuerpos primarios (anti-SVCT 1, anti-SVCT2 y anti-βactina) se utilizo diluciones de 1:50 y 1:200 en solución de bloqueo modificada (1% BSA, 0,3% Tritón X-100 en PBS 0,1 M). Se incubaron con el anticuerpo primario por toda la noche a 4°C en cámara húmeda. Posteriormente se lavaron los cortes tres veces con PBS 0,1 M-Tritón X-100 0,3% por 10 minutos. Como anticuerpo secundario se utilizó anti-igG de cabra conjugado a Alexa fluor 488 y anti-igG de ratón conjugado a Alexa fluor 568, en una dilución 1:200 en solución de bloqueo modificada, se incubó durante 2 horas en cámara húmeda a temperatura ambiente. Se lavó tres veces con PBS 0,1 M-Tritón X100 0,3 % y una vez con PBS 0,1 M por 10 minutos cada uno. Los núcleos fueron teñidos con ioduro de propidio 1,7ug/mL o TOPRO 3, según el caso, ambos incubados junto al anticuerpo secundario. Las muestras fueron montadas con medio de montaje para fluorescencia DAKO y visualizadas utilizando un microscopio confocal invertido. 48 3.2.7 Extracción y cuantificación de proteínas totales Las células en cultivo previamente lavadas con PBS 0,1M (pH 7,4) fueron despegadas de las placas de cultivo utilizando tripsina-EDTA 0,25% (p/v). El sedimento celular fue resuspendido en tampón A (sacarosa 300 mM, DTT 3 mM, PMSF 100 µg/mL, aprotinina 2 µg/mL, pestatina A 1 µg/mL, leucopeptina 2 µg/mL y EDTA 1 mM, pH 7,4) y sonicado 3-5 veces durante 15 segundos a 4ºC hasta disgregar completamente. Los homogeneizados fueron centrifugados a 14,000 x g durante 15 minutos a 4ºC. El sobrenadante fue rescatado y cuantificado mediante el método de Bradford. Estos extractos proteicos fueron utilizados para realizar ensayos de Western blot. Las proteínas se cuantificaron utilizando el método de Bradford (Bradford et al. 1976). Se construyó una curva de calibración entre 0 y 40 µg de proteína en un volumen final de 100 µL. Se utilizó como estándar BSA (2 ug/µL) diluido en agua deionizada. Para todas las lecturas se utilizó un blanco de agua desionizada, la misma usada para las diluciones. Se adicionó a cada tubo de la curva 1 mL del reactivo de Bradford 1x (0.01% azul de Coomasie G, 4.75% etanol, 8.5% ácido fosfórico) y se incubó por 3 minutos a temperatura ambiente. Finalmente, se realizó la lectura de absorbancia en un espectrofotómetro a una longitud de onda de 595 nm. Para la cuantificación de las muestras se tomó una alícuota de 5 µL de cada una y se diluyó hasta completar un volumen final de 100 µL. En seguida se adicionó 1 mL de reactivo de Bradford 1x. 49 3.2.8 Separación electroforética de proteínas Las muestras de proteínas fueron separadas electroforéticamente en geles de poliacrilamida al 10%. El gel separador y el espaciador se prepararon a partir de una solución de acrilamida:bisacrilamida 30:0,8%. El gel separador se preparó con una concentración final de poliacrilamida de 10% conteniendo Tris (pH 8,8) 375 mM; SDS 0,1%, persulfato de amonio 0,04% y TEMED 0,03%. Mientras que el gel espaciador se preparó con una concentración final de poliacrilamida de 3,8% incluyendo Tris 125 mM (pH 6,8), 0,1% SDS, 0,01% persulfato de amonio y 0,04% TEMED. Se tomaron muestras de proteínas de 40 µg a 80 µg y se les agregó tampón carga 2X Winkler (Tris 100 mM, 2-mercaptoetanol 2%, SDS 4%, glicerol 20%, azul bromofenol 0,2%, pH 6,8) a cada una y se calentaron a 95ºC por 5 minutos. Las muestras fueron cargadas en el gel realizándose la electroforesis a 30mA por 1 hora en tampón de corrida (Tris 25 mM, glicina 190 mM, SDS 0,1%, pH 8,3). Las proteínas separadas fueron transferidas a membranas de PVDF. 3.2.9 Transferencia de proteínas a membranas de PVDF Finalizada la electroforesis, las muestras se electrotransfirieron a membranas de PVDF (difluoruro de polivinildeno; 0,45 micrones de poro, 100-145 µm de espesor). Sobre una esponja embebida en tampón de transferencia (Tris 25 mM, glicina 190 mM, SDS 0,1%, metanol 20%, pH 8,3) se depositó secuencialmente: un trozo de papel de filtro (Whatman n° 1), la membrana de PVDF (previa activación de la membrana en metanol por 15 segundos), el gel a transferir, otro papel de filtro y luego otra esponja 50 embebida en el misma tampón. Esto se colocó en una cámara de electrotransferencia conteniendo el tampón mencionado y se aplicó una intensidad de corriente de 400 mA por 1 horas. Una vez cumplido el tiempo la membrana se dejó secar a temperatura ambiente. Para verificar el buen resultado de la transferencia, el gel fue teñido con solución de azul de Coomassie (30% metanol y 10% ácido acético) durante tres horas, y luego desteñido en una solución que contenía 30% de metanol y 10% de ácido acético. 3.2.10 Análisis de Western blot Para los experimentos de Western blot las membranas se incubaron con 10 ml de solución de bloqueo (BSA 5%, Tween-20 0,1%) durante 2 horas con agitación constante a temperatura ambiente. Luego, se expuso las membranas a los anticuerpos primarios de interés, diluidos 1:5000 – 1:1000 en solución de bloqueo modificada (BSA 1%, Tween-20 0,1%) durante toda la noche con agitación constante a temperatura ambiente. Finalizado este periodo, las membranas se lavaron tres veces por 20 minutos en PBS 0,1 M-Tween-20 0,1% y se incubaron con anti-IgG de cabra o ratón conjugado a peroxidasa de rábano (HRP) 1:5000 en solución de bloqueo modificada durante 2 horas a temperatura ambiente. Finalmente, las membranas se lavaron 2 veces con en PBS 0,1 M-Tween-20 0,1% y una vez con PBS 0,1 M. El revelado del conjugado se realizó utilizando un método de quimioluminiscencia, el cual se basa en la emisión de luz no radiactiva detectando antígenos inmovilizados unidos directa o indirectamente con anticuerpos conjugados con HRP. Se vertió sobre las membranas una solución que contenía peróxido de hidrógeno y luminol. Luego de 1 minuto, se expuso durante 10-30 51 minutos un film fotográfico con la membrana tratada con luminol. La reacción fue revelada con reactivo D72 y fijada con reactivo U3. 3.2.11 Ensayos de transporte Para los ensayos de transporte los cultivos de células de Sertoli 42GPA9 fueron crecidas en placas de 12 pocillos. Previo a cada experimento, se analizaron cuidadosamente los cultivos celulares bajo el microscopio, de modo de asegurar que sólo aquellos pocillos con densidad celular uniforme fueran usados. Además, se despegaron las células de tres pocillos de estas placas, las cuales fueron cuantificadas utilizando una cámara de Neubauer con el fin de estimar el número promedio de células totales por pocillo. Los ensayos de incorporación con radioisótopos se realizaron según lo descrito por Angulo y colaboradores (2008). Las células fueron lavadas con tampón de incubación (Hepes 15 mM, NaCl 135 mM, KCl 5 mM, CaCl2 1,8 mM, MgCl2 0,8 mM, pH 7,4, 320 mOsm) e incubadas en esta misma solución durante 30 minutos, a 32ºC en el caso de Sertoli 42GPA9, para permitir el equilibrio entre los espacios extra e intracelular. Luego de este periodo, se realizaron los ensayos de captación en 400 µl de tampón de incubación que contenía 0,1-0,4 µCi de 14 C-L-ácido ascórbico (14C-AA) o 1- 1,2 µCi de D-3-O-[metil-3H] glucosa (3H-OMG). La reacción fue detenida con tampón de incubación frío que contenía HgCl2 0,2 mM, seguido de 3 lavados con la misma solución. Luego, las células fueron tratadas con 200 µl de tampón de lisis (Tris-HCl 10 mM pH 8,0, SDS 0,2%) y la radiactividad incorporada fue medida por centelleo líquido. Los ensayos de transporte de ácido ascórbico se realizaron en presencia de DTT 1-5 52 mM. Con respecto a los ensayos de inhibición, las células fueron pre-incubadas a 32ºC durante 30 minutos (citocalasina B, citocalasina E) o 1 hora (ouabaína, floridzina). Todos los ensayos utilizando radioisótopos fueron realizados de acuerdo a las medidas de bioseguridad del “Manual de Normas de Bioseguridad” de CONICYT de 2008. Los residuos contaminados fueron almacenados en bodegas especiales destinadas para ello en las instalaciones del PAAC (Proyecto de Administración Ambiental Corporativo), de acuerdo al Manual de Procedimiento para el Manejo de Residuos de la UACh. 3.2.12 Modificación del contenido de glutatión En cultivo de células de Sertoli 42GPA9, el glutatión intracelular fue depletado por tratamiento con L-butionina-(S,R) sulfoximida (BSO) (0,25 a 2 mM) por 24 horas, seguido por una incubación de 60 minutos con dietilmaleato (1 mM) (Guaiquil et al., 1997). En animales, el glutatión celular fue depletado in vivo inyectando BSO intraperitonealmente a una concentración de 4 mmol/Kg de peso dos veces al día (9 AM y 9 PM) (Martensson et al., 1991; Martensson y Meister, 1992). 3.2.13 Determinación de glutatión total Para medir glutatión total (Guaiquil et al., 1997), las células se lisaron con Tritón X-100 al 0,4% en PBS 0,1 M (pH 7,4) y el homogeneizado se ajustó a 2,5% ácido sulfosalicílico y se centrifugó a 10.000 x g por 10 min. Un volumen del sobrenadante se agregó a pocillos de placas de micro titulación conteniendo Na2HPO4 70 mM pH 7,5 EDTA 3,5 mM, 5,5’-ditio-bis-(ácido 2 nitrobenzoico) (DTNB) 0,6 mM, Tritón X-100 0,2%, 53 ácido sulfosalicílico 2,5% y 1000 unidades de glutatión reductasa (tipo III). La reacción comienzó luego de agregar NADPH y se midió el cambio de absorbancia a 412 nm. La lectura se realizó durante 1 minuto. 3.2.14 Ensayo de TUNEL El ensayo fue realizado con TACS TDT Kit, Las células fueron crecidas en cubreobjetos redondos de 12 mm, luego se fijaron con p-formaldehido al 4% en tampón fosfato 0.1 M (pH 7,4) por 15 minutos y se permeabilizaron con una solución 1:100 de proteinasa K 1 mg/ml. Luego se procedió a lavar con una solución de PBS 0,1 M libre de nucleasas 3 veces por 5 minutos. El control positivo de la técnica de TUNEL se incubó con una solución de nucleasas a 37ºC por 30 minutos, mientras las otras muestras permanecían en PBS 0,1 M. Las nucleasas fueron inactivadas con 2 lavados de PBS 0,1 M por 5 minutos. Las muestras fueron pre incubadas durante 5 minuto con tampón TDT 1X (0,1 M tampón TACS SAFE-TDT; 0,05 mg/ml BSA y 0,06 mM 2mercaptoetanol ácido sulfónico), se secaron del exceso del tampón y se incubaron por una hora a 37ºC con la mezcla reactiva (0,005 mM dNTP biotinilados, cobalto, y enzima Desoxinucleotidil Transferasa Terminal). La reacción se detuvo incubando con tampón STOP 1X (0,01 M EDTA, pH 8,0) durante 5 minutos a temperatura ambiente, luego de lavar 2 veces con PBS 0,1 M durante 2 minutos. Posteriormente, se incubó con una solución de estreptovidina conjugadas con peroxidasa de rábano (HRP) 1:200 durante 25 minutos. Finalmente, las muestras se lavaron 3 veces con PBS 0,1 M y se procedió a revelar. Para el revelado se incubó con una solución de 3,3´-diaminobenzidina (DAB) 0,7 mg/mL y 0,03% de peróxido de hidrógeno por 10 minutos en oscuridad seguido de 54 tres lavados con agua destilada por 3 minutos. Se realizó una tinción nuclear con hematoxilina durante 10 segundos y puestos inmediatamente en borato de sodio por 2 segundos. Finalmente los cortes fueron deshidratados en una batería ascendente de etanol (70%, 95% II, 95% I, 100% II y 100% I (v/v)) y xilol por 5 minutos cada uno, para luego ser montados utilizando bálsamo de Canadá. Los cortes fueron observados en un microscopio de epifluorescencia OLYMPUS BX 50 con cámara OLYMPUS U-TV0 5XC-3. Cuando se utilizaron cortes histológicos de testículo de rata, los cortes incluidos en parafina fueron pasadas por xilol y una batería descendente de etanol (100% I, 100% II, 95% I, 95% II, 70%, (v/v)) por 5 minutos cada uno para desparafinar e hidratar, luego se lavaron tres veces con agua destilada por 3 minutos. Se lavaron 2 veces con PBS 0,1 M y se continuaron permeabilizando igual que el ensayo descrito anteriormente en células de Sertoli. 3.2.15 Análisis estadístico La significancia de las diferencias entre tratamientos, para datos que cumplieron con los supuestos de pruebas paramétricas, fue obtenida con análisis de varianza (ANOVA), de una y dos vías, seguidas por la prueba a posteriori de Bonferroni`s, la que permite evaluar las diferencias entre todos los grupos. Para estas pruebas, diferencias con valores p<0.05 fueron interpretadas como significativas. Todos los análisis fueron realizados utilizando el software estadístico GraphPad Prism 5.0. 55 4. RESULTADOS 4.1 Trasportadores de ácido ascórbico en el epitelio seminífero El desarrollo del epitelio seminífero y la espermatogénesis de mamíferos, son procesos muy complejos que involucran eventos de migración celular, proliferación, diferenciación, e interacción célula a célula. Múltiples estudios han demostrado que agentes tóxicos como los pesticidas, producen un aumento significativo del estrés oxidativo en el testículo, conduciendo a un daño en las células germinales, causado alteraciones durante la espermatogénesis. (Samanta y Chainy, 1997). Dentro de las barreras de defensa frente a los daños producidos por estrés oxidativo, la vitamina C juega un rol fundamental en distintos tipos celulares. Tomando en consideración lo anterior, la presencia de transportadores de AA se vuelve primordial para la adquisición de esta protección durante el desarrollo del sistema reproductor masculino. Se analizó la expresión y localización de los co-transportadores de Na+/ascorbato (SVCTs) en cortes de testículo de rata de distintas edades. Para poder ver la presencia de los transportadores de AA en células de Sertoli en los cortes se utilizó un marcador específico de estas células, la proteína WT1, factor de transcripción de la familia de factores activadores dedos de zinc, siendo abundante en el tumor de Wilms (WT) (Matsunaga, 1981), el cual es un tumor embrionario que se expresa específicamente en las células de Sertoli y no en las células germinales (Merhi et al., 2001). La presencia de la proteína SVCT1 y SVCT2 en el epitelio seminífero fue demostrada mediante inmunofluorescencia y Western blot, utilizando anticuerpos purificados por afinidad, dirigidos contra un péptido ubicado en la porción N-terminal de estos transportadores. 56 Se realizaron co-inmunofluorescencia indirecta para WT1 y SVCT1 (figura 8) y WT1 y SVCT2 (figura 9) en cortes de testículo de rata de 1, 5, 15 ,35 y 60 días de edad. En la figura 1 se observó la inmunorreacción positiva para WT1 en todas las edades, con mayor intensidad en la base del túbulo a partir de los 15 días de desarrollo, el resto de la marca podría corresponder a las prolongaciones de las células de Sertoli que van desde la región basal a la región adluminal del túbulo seminífero. Esto también se observó en la figura 9, presentando el mismo patrón durante las distintas edades. Con respecto a los transportadores de AA, se observó una inmunorreacción positiva para SVCT1 en las distintas edades, sin embargo, hay diferencias en el patrón de expresión y localización durante el desarrollo del epitelio seminífero (Figura 8). En el primer día se observó un intensa inmunorreacción en la base del túbulo seminífero de carácter puntiforme. A los 5 días se observó una marca punteada de menor intensidad localizada a lo largo de todo el túbulo seminífero, esta se mantiene a los 15 y 35 días de desarrollo. Por último, a los 60 días la marca para SVCT1 se vuelve más difusa, pero siempre con una leve tendencia puntiforme. La co-localización de SVCT1 y WT1 se observó muy débil en todas las edades. La presencia de SVCT1 en el epitelio seminífero fue confirmada mediante ensayo de Western blot, utilizando extracto de proteínas totales de testículo de 60 días. Se detectó una banda correspondiente al tamaño de 49 kDa para SVCT1 (Figura 8, B, carril 1). Se utilizó anticuerpo contra βactina como control de carga, detectándose una banda de 43kDa (Figura 8, B, carril 2). En ensayos descritos en la literatura SVCT1 presentó una banda de 55-65 kDa aproximadamente en tejido de rata y ratón (Jin et al., 2005; Mun et al., 2006; Lee et al., 2006). 57 A B 58 Figura 8. Localización de SVCT1 y del marcador de células de Sertoli, WT1, durante el desarrollo del epitelio seminífero de rata. A. Análisis inmunohistoquímico para WT1 (verde) y SVCT1 (rojo) en cortes de testículo de rata de 1, 5, 15, 35 y 60 días. Se muestra la superposición de imágenes de SVCT1 y WT1 (Merge) y una ampliación de ésta (Zoom) en cada caso. La co-localización de ambas proteínas se observa en amarillo. La barra de magnificación corresponde a 20 µm. B. Western blot para SVCT1 utilizando proteínas totales de testículo (1), como control de carga se utilizó β-actina (2). 59 Para SVCT2 se observó la aparición de inmunorreacción en la base del túbulo seminífero a partir de los 15 días, sin embargo, en los primeros días de desarrollo la marca es muy débil a lo largo del todo el túbulo seminífero. La co-localización de SVCT2 y WT1 es muy marcada a los 15, 35 y 60 días (Figura 9, A), observándose sólo a partir de los 15 días. La presencia de SVCT2 en el epitelio seminífero fue confirmada mediante ensayo de Western blot, utilizando extracto de proteínas totales de testículo de rata de 60 días. Se detectaron dos bandas correspondientes a los tamaños de 53 y 75 kDa (Figura 9, A, carril 1). Se usó anticuerpo contra β-actina como control de carga, detectándose una banda de 43kDa. (Figura 9, B, carril 2). Se ha descrito que SVCT2 presenta una banda intensa de 66 kDa aproximadamente en tejidos de rata y ratón (Wu et al., 2003; García et al., 2005; Jin et al., 2005; Mun et al., 2006; Lee et al., 2006). 60 A B 61 Figura 9. Localización de SVCT2 y del marcador de células de Sertoli, WT1, durante el desarrollo del epitelio seminífero de rata. A. Análisis inmunohistoquímico para WT1 (verde) y SVCT2 (rojo) en cortes de testículo de rata de 1, 5, 15, 35 y 60 días. Se muestra la superposición de imágenes de SVCT2 y WT1 (Merge) y una ampliación de ésta (Zoom) en cada caso. La co-localización de ambas proteínas se observa en amarillo. La barra de magnificación corresponde a 20 µm. B. Western blot para SVCT2 utilizando proteínas totales de testículo (1), como control de carga se utilizó β-actina (2). 62 Con el fin de comparar la distribución de los SVCTs a lo largo del epitelio seminífero se estudió la localización de SVCT1 y SVCT2 en cortes de testículo de rata adulta. Para determinar si estas proteínas se encuentran en las células de Sertoli en el epitelio seminífero, se utilizó el marcador específico WT1 en ensayos de doble inmunofluorescencia indirecta. Los núcleos fueron teñidos con TOPRO-3, una sonda nuclear que facilita el reconocimiento de las células presentes en el túbulo seminífero, mediante morfología nuclear. Al analizar la localización de SVCT1 en el tejido se observó una inmunorreacción difusa y puntiforme a lo largo del epitelio, además se observó una marca intensa para SVCT1 en la cola de los espermatozoides (Figura 10, A). Al realizar la superposición de ambas imágenes (WT1 y SVCT1) se observó que existen zonas de co-localización discretas las cuales sugieren que SVCT1 se localiza en células que son positivas para el marcador de células de Sertoli WT1 (Figura 10, A). Al utilizar el mismo tipo de análisis usando anticuerpos específicos contra SVCT2, se observó una reacción intensa en la región basal del túbulo, además, al igual que SVCT1, SVCT2 se encuentra en las colas de los espermatozoides (Figura 10, B). Al observar la superposición de ambas imágenes se vió una co-localización muy abundante en la zona basal del túbulo seminífero indicando que SVCT2 estaría presente en células de Sertoli (Figura 10, B). En conclusión, estos resultados sugieren que los transportadores de AA se expresan diferencialmente durante el desarrollo del epitelio seminífero de rata y que ambas isoformas están presentes con distinto patrón de localización en el túbulo seminífero en ratas reproductivamente maduras. 63 A B 64 Figura 10. Inmunolocalización de SVCT1 y SVCT2 lo largo de todo el túbulo seminífero de rata. Análisis inmunohistoquímico para WT1 (A, B), SVCT1 (A) y SVCT2 (B), en cortes de testículo de rata adulta. Los núcleos fueron marcados con TOPRO 3. Se muestra la superposición de imágenes de SVCT1/2 y WT1 (Merge) y una ampliación de cada imagen (Zoom). La co-localización de ambas proteínas se observa en amarillo. La barra de magnificación corresponde a 20 µm. 65 4.2 Expresión y función de SVCT1 y SVCT2 en células de Sertoli La vitamina C puede ser adquirida por las células en su forma oxidada, ácido deshidroascórbico, o en su forma reducida, ácido ascórbico. Es importante destacar que prácticamente toda la vitamina C en el organismo se encuentra como AA (Schorah et al., 1996). Por otro lado, las células de Sertoli son las encargadas de formar la BHT, impidiendo eficazmente la entrada de sustancias al compartimento adluminal, Por lo tanto, se procedió a identificar la expresión de los transportadores SVCTs mediante RTPCR, inmunofluorescencia y Western blot en células de Sertoli 42GPA9 con el objeto de averiguar si AA puede ser transportado al compartimento adluminal. Según análisis de RT-PCR realizados a partir de preparaciones de RNA total obtenidas de los cultivos, utilizando partidores específicos para el mRNA de SVCT1 y SVCT2 fue posible amplificar un fragmento de 304 pb para SVCT1 (Figura 11, A, carril 1) y 307 pb para SVCT2 (Figura 11 A, carril 3), los cuales corresponden al tamaño esperado. El mismo fragmento fue amplificado en muestras provenientes de cDNA de células Caco-2, las cuales expresan ambas isoformas de SVCTs (Figura 11, A, carril 2 y 4). No se observó banda en el control negativo. La presencia de las proteínas SVCT1 y SVCT2 en células de Sertoli fue demostrada por análisis de Western blot e inmunofluorescencia. Utilizando extracto de proteínas totales de células de Sertoli 42GPA9, se detectó una banda correspondiente al tamaño de 50 kDa para SVCT1 tanto en las células de Sertoli (Figura 11, B, carril 1), como en proteínas totales de células Caco-2 usadas como control positivo (Figura 11, B, carril 2), y una banda de 62 kDa aproximadamente para SVCT2, tanto en los extractos de células de Sertoli (Figura 11, B, carril 3), como en extractos de neuronas 66 corticales en cultivo usados como control positivo (Figura 11, B, carril 4). Usando los mismos anticuerpos se realizó la técnica de inmunofluorescencia para SVCT1 y SVCT2 en células de Sertoli 42GPA9 y en células de cultivo primario. Se observó una marcada fluorescencia usando anti-SVCT1 a nivel del citoplasma principalmente y en menor grado en la membrana celular de las células de Sertoli 42GPA9, en cambio en los cultivos primarios la fluorescencia detectada es más débil a nivel de citoplasma y membrana celular (Figura 11, C). Por otro lado, utilizando anticuerpos contra SVCT2, se observó marca en el citoplasma y la membrana de las células de Sertoli 42GPA9, en cambio en los cultivos primarios se observó una intensa fluorescencia en el citoplasma y la membrana celular (Figura 11, C). Todos estos resultados demuestran que las proteínas son expresadas y sintetizadas por las células de Sertoli, pero no nos dan evidencia si estos trasportadores son funcionales en este sistema celular. Para averiguar si los transportadores SVCT1 y SVCT2 son funcionales, se realizaron ensayos de transporte de AA en células de Sertoli 42GPA9. Los ensayos de incorporación se realizaron durante 5 minutos a 32º C frente a concentraciones crecientes de AA. La incorporación resultó ser saturable, lo cual es una característica clásica de este transportador. (Figura 11, D). Análisis de Eadie-Hofstee demostró que la incorporación de AA es mediada por 2 componentes. Un componente de gran afinidad con una Km aparente de 10-12 µM y una Vmax de 100-121 pmoles/106celxmin, y un componente de menor afinidad con una Km aparente entre 38 mM y una Vmax de 70-90 pmoles/106celxmin (Figura 4, E). Los estudios de inhibición en los ensayos de transporte son importantes para determinar la función de los mismos. Se utilizan sustancias conocidas en cuanto a su 67 poder bloqueador de ciertas actividades y/o etapas. Citocalasina B y E son muy utilizadas, pues la primera es un inhibidor específico de los transportadores facilitativos de hexosas, mientras que la segunda no causa efecto en la función de estos transportadores (Basketter y Widas, 1978; Deves y Krupka, 1978). Floridzina (PHL) es un inhibidor de los transportadores de glucosa dependientes de sodio (SGLTs) (Toggenburger et al., 1982), mientras que ouabaína inhibe la bomba sodio-potasio ATPasa. Se llevaron a cabo estudios de inhibición y competencia los cuales revelaron que tanto floridzina como ouabaína disminuyen significativamente el transporte de AA 100 µM en aproximadamente 70% (Figura 11, F). Lo que indica que el transporte de AA es mediado por los co-transportadores de sodio/ascorbato, pues los datos se correlacionan con los ya descritos para este transporte (Padh y Aleo, 1987). Además, se analizó el efecto del inhibidor específico, citocalasina B, de los transportadores facilitativos de hexosas que son capaces de transportar DHA pero no AA. Se observó, que citocalasina B y citocalasina E no inhiben el transporte de AA en células de Sertoli y que usando los análogos de glucosa DOG y OMG, que son transportados por los transportadores facilitativos de hexosas, no se observa una diferencia estadísticamente significativa. En conclusión, estos resultados confirman que las células de Sertoli 42GPA9 son capaces de expresar el mensajero de ambas isoformas de los co-transportadores de sodio/ascorbato, sintetizar las proteínas (SVCT1 y SVCT2), e incorpora AA a través de transportadores funcionales. 68 A C B 69 Figura 11. Funcionalidad de los transportadores de ácido ascórbico en células de Sertoli. A. Análisis de RT-PCR para SVCT1 y SVCT2. Carril 1: RNA total aislado de línea celular de Sertoli 42GPA9, carril 2: RNA de células Caco-2. B. Análisis de Western blot para SVCT1 y SVCT2, carril 1: proteínas aisladas de la línea celular de Sertoli 42GPA9; carril 2: proteínas de células Caco-2 (SVCT1) y proteínas de neuronas corticales (SVCT2) ambas usadas como controles positivos, respectivamente. C. Inmunofluorescencia para SVCT1 (verde) y SVCT2 (verde) en las células de Sertoli 42GPA9 y cultivo primario de células de Sertoli. Los núcleos fueron teñidos con ioduro de propidio, PI, (rojo). La barra de magnificación corresponde a 20 µm. D. Curva de saturación para la incorporación de 14 C-ácido ascórbico (AA) (5 min, 32ºC). E. Gráfico de Eadie-Hofstee para los datos obtenidos en D. F. En la gráfica se observa el efecto de distintos inhibidores (floridzina, ouabaína, citocalasina E y B) y sustratos (2-desoxi-Dglucosa, DOG, y 3-O-metilglucosa, OMG) en el transporte de AA 100 µM a 32ºC por 5 min. Los datos corresponden a la media de 3 experimentos independientes ± DS. *** p<0,001. Extraído de Angulo et al., (2008). 70 4.3 Efecto del BSO sobre el epitelio seminífero El glutatión es un antioxidante que desempeña un papel clave en el control de la infertilidad masculina (Luberda, 2005). El L-butionina-S,R-sulfoxamida (BSO) bloquea la síntesis de GSH mediante la inhibición específica de la primera enzima de su síntesis, la y-glutamilcisteína sintetasa (Griffith y Meister, 1979), por lo que se ha usado ampliamente para disminuir el glutatión celular en gran variedad de tejidos, tanto in vivo como in vitro. En estudios de depleción de glutatión realizados en testículo de rata utilizando BSO demostraron que los niveles de glutatión disminuyen en un 20% a las 24 horas, sin embargo se recupera lentamente a las 72 horas, llegan a valores muy similares a los normales (Teaf et al., 1987; Hirano et al., 1997). Hasta la fecha no se ha demostrado el efecto del BSO en la viabilidad de las células espermatogénicas, ni se ha relacionado con la expresión y localización de los co-transportadores de sodio/ascorbato. Para visualizar el efecto del BSO sobre la viabilidad de las células espermatogénicas, se trataron ratas con 4 mmol/kg de BSO durante 24 y 48 horas. Se obtuvieron cortes histológicos de los testículos y se realizaron ensayos semicuantitativos mediante la técnica de TUNEL (TdT-mediated dUTP Nick end labeling), la que se fundamenta en la detección de quiebres de DNA internucleosomal, que tienen lugar durante la apoptosis. En la figura 12, A se observan las imágenes representativas del ensayo en todos los tratamientos. Con flechas blancas se indican las células TUNEL positivas. Además, se muestra un gráfico representativo de las células TUNEL positivas en cada 10 túbulos seminíferos versus los distintos tratamientos con BSO (figura 12, B), indicando que no hay diferencias significativas en la viabilidad celular de los 71 testículos de rata tratados con BSO y los controles. En todos los casos se obtuvieron aproximadamente 2 células TUNEL positiva/10 túbulos seminíferos, siendo muy similares a los encontrados en condiciones fisiológicas en testículos de rata de 60 días. Los resultados expuestos anteriormente, demuestran que los tratamientos con BSO no afectan en la viabilidad de las células espermatogénicas en testículos de rata adulta. 72 A B 73 Figura 12. Alteración del contenido de glutatión y su efecto en la viabilidad celular en el epitelio seminífero de rata. Se inyectó BSO intraperitonealmente a una concentración de 4 mmol/Kg de peso. Los cortes fueron obtenidos luego de un tratamiento de 24 y 48 horas con BSO. Análisis semi-cuantitativo mediante la técnica de TUNEL en cortes de testículo de rata adulta depletadas de glutatión. En flecha blanca se observa una célula TUNEL positiva. A. se muestran imágenes representativas y el control positivos de la técnica de TUNEL. Los núcleos fueron teñidos con hematoxilina (azul). B se muestra el gráfico representativo. 74 Teniendo en cuenta la relación funcional que existe entre el glutatión y la vitamina C y el efecto producido por deficiencia de glutatión sobre esta vitamina, sumado a que en los sistemas biológicos la vitamina C se encuentra en su forma reducida, se podría pensar que glutatión podría ejercer algún efecto sobre la expresión de los transportadores de AA (SVCTs). Para esto se realizaron ensayos de inmunohistoquímica con el fin de ver la presencia y localización de SVCT1 Y SVCT2 en cortes de testículo de rata tratados con BSO durante 24 y 48 horas. En la inmunodetección de SVCT1, se observó la típica marca puntiforme que va desde la región basal a la región adluminal del túbulo seminífero en las ratas controles, sin embargo en los cortes tratados por 24 horas con BSO hay una notable disminución en la marca para SVCT1. Este efecto se vió revertido a las 48 horas con una intensa y marcada inmunorreacción en células que se encuentran en la base del túbulo seminífero, sugiriendo una redistribución de SVCT1 comparado con el control (Figura 13). Del mismo modo, se inmunodetectó SVCT2 en los cortes de testículo depletados de glutatión sin encontrar ningún cambio en las distintas condiciones, observándose un intensa inmunorreacción en la base del túbulo seminífero, característica de esta isoforma (Figura 14). 75 76 Figura 13. Expresión de SVCT1 en el epitelio seminífero de rata depletado de glutatión. Se realizó inmunohistoquímica en cortes de testículo de ratas depletadas de glutatión, inyectando intraperitonealmente BSO a una concentración de 4 mmol/Kg de peso. Los cortes fueron obtenidos luego de un tratamiento de 24 y 48 horas con BSO. Se muestra la inmunorreacción de SVCT1 (café). En cada caso se muestra una ampliación de la imagen (Zoom). Los núcleos fueron teñidos con hematoxilina (azul). La barra de magnificación corresponde a 20 µm. 77 78 Figura 14. Expresión de SVCT2 en el epitelio seminífero de rata depletado de glutatión. Se realizó inmunohistoquímica en cortes de testículos de ratas depletadas de glutatión, inyectando BSO intraperitonealmente a una concentración de 4 mmol/Kg de peso. Los cortes fueron obtenidos luego de un tratamiento de 24 y 48 horas con BSO. Se muestra la inmunorreacción de SVCT2 (café). Los núcleos fueron teñidos con hematoxilina (azul). En cada caso se muestra una ampliación de la imagen (Zoom). La barra de magnificación corresponde a 20 µm. 79 Estudios previos demostraron que el BSO es capaz de disminuir en un 20% el contenido de glutatión en testículo de rata, Nosotros demostramos que este efecto no produce alteración en la viabilidad de las células espermatogénicas. Con respecto a la relación de glutatión con la vitamina C, encontramos que una de las isoformas de los transportadores de sodio/ascorbato, SVCT1 se ve alterada a nivel de expresión y localización celular en el epitelio seminífero de rata. Se analizaron otras proteínas mediante inmunohistoquímica en los mismos cortes de testículo de rata tratados con BSO, con el fin de demostrar que el efecto del BSO era específico para SVCT1 y no un efecto sistémico. Para esto se inmunodetectó GLUT3, un transportador facilitativo de hexosas que está involucrado en el metabolismo de la vitamina C. GLUT3 tiene una alta afinidad por 2 desoxi-D-glucosa (2-DOG), sin embargo, es capaz de trasportar galactosa, manosa, xilosa y ácido deshidroascórbico. Se ha demostrado su expresión en testículo, células de Sertoli y en células germinales masculinas (Rauch et al., 2004; Angulo et al., 2008; Kokk et al., 2007). Los análisis de inmunohistoquímica fueron positivos para GLUT3, tanto en testículo tratados con BSO como el control (Figura 15), se observó un intensa marca en la membrana plasmática en células ubicadas en la zona adluminal del epitelio seminífero y en la cola de los espermatozoides. 80 81 Figura 15. Expresión de GLUT3 en el epitelio seminífero de rata depletado de glutatión. Se realizó inmunohistoquímica en cortes de testículo de ratas depletadas de glutatión celular, inyectando BSO intraperitonealmente a una concentración de 4 mmol/Kg de peso. Los cortes fueron obtenidos luego de un tratamiento de 24 y 48 horas con BSO. Se muestra la inmunorreacción con GLUT 3 (café). Los núcleos fueron teñidos con hematoxilina (azul). En cada caso se muestra una ampliación de la imagen (Zoom). La barra de magnificación corresponde a 20 µm. 82 Asimismo, se analizaron proteínas que no tienen relación con el metabolismo de la vitamina C, sino con el metabolismo del glicógeno. El glicógeno es una forma importante de almacenamiento energético en mamíferos. La glucógeno sintasa (GS) y glucógeno fosforilasa (GP) son las encargadas de la síntesis y degradación del glicógeno respectivamente, las cuales están sujetas a múltiples niveles de regulación tanto hormonal como alostérico. La glicógeno sintasa es activada por desfosforilación, mientras que ocurre lo contrario con la glucógeno fosforilasa (Lawrence y Roach, 1997). En mamífero se han descrito 2 isoformas de glucógeno sintasa, una isoforma hepática (LGS), la cual es tejido específica, y una forma muscular (MGS), la cual no sólo se expresa en tejido muscular, sino que también en tejido adiposo, riñón, bazo y sistema nervioso (Nuttall y Gannon, 1993; Shulman, et al., 1995). En trabajos anteriores se ha demostrado actividad de la glucógeno sintasa en testículo como fluctuaciones cíclicas del contenido de glucógeno en las células del epitelio seminífero (Fouquet y Guha, 1969), sin embargo, no se ha descrito a qué isoforma se atribuye esta actividad. En nuestro laboratorio se ha demostrado que en testículo de rata se encuentra presente la isoforma muscular de la glicógeno sintasa (Villarroel et al., datos no publicados). Utilizando anticuerpos específicos contra MGS se realizó inmunohistoquímica en cortes de testículo de rata tratados con BSO (Figura 16). Los resultados muestran que sólo se logró inmunodetectar la proteína en los cortes controles, observando una marca contínua a lo largo de todo el epitelio seminífero siendo más intensa en la base. También hubo inmunorreacción positiva en la cola de los espermatozoides y en las células de Leydig. 83 84 Figura 16. Expresión de glicógeno sintasa en el epitelio seminífero de rata depletado de glutatión. Se realizó inmunohistoquímica en cortes de testículos de ratas depletadas de glutatión celular, inyectando BSO intraperitonealmente a una concentración de 4 mmol/Kg de peso. Los cortes fueron obtenidos luego de un tratamiento de 24 y 48 horas con BSO. Se muestra la inmunorreacción de glicógeno sintasa muscular, MGS, (café). En cada caso se muestra una ampliación de la imagen (Zoom). Los núcleos fueron teñidos con hematoxilina (azul). La barra de magnificación corresponde a 20 µm. 85 Por otro lado, la proteína fosfatasa 1 (PP1) es la responsable de la desfosforilacion de GS y GP, para ser activada requiere estar unida a moléculas de glucógeno. Esto se logra por la presencia de subunidades-G de unión especifica a moléculas de glucógeno, las cuales son responsable de dirigir la PP1 a las moléculas de glucógeno (Hubbard y Cohen, 1991). Hasta la fecha se han descrito 4 diferentes subunidades-G, entre la que destaca PTG, expresada principalmente en músculo, hígado y tejido adiposo (Aggen et al., 2000; Brady, et al., 1997), sin embargo, en nuestro laboratorio se ha demostrado la expresión del mRNA de esta proteína de andamio en testículo de rata (Villarroel et al, datos no publicados). Asimismo, se ha demostrado que PTG, además de su capacidad por dirigir a la PP1 hacia el glucógeno, es capaz de unir diferentes enzimas involucradas en el metabolismo del glucógeno, como GS y GP (Brady et al., 1997; Printen et al., 1997). Utilizando anticuerpos específicos contra PTG, se realizaron ensayos de inmunohistoquímica en los cortes de testículo de rata tratados con BSO (Figura 17). La inmunodetección fue positiva en todos los casos, observándose una marca intensa en las células de Leydig del epitelio seminífero. Los tratamientos con BSO produjeron un aumento en la inmunorreacción para PTG a las 24 y 48 horas. Los resultados anteriormente expuesto, nos sugieren que niveles bajos de glutatión en testículo de rata podrían modular la expresión y localización de SVCT!, y no de SVCT2 y GLUT3. Sin embargo, deficiencia de glutatión produce alteraciones en proteínas que no tienen relación con el metabolismo de la vitamina C. 86 87 Figura 17. Expresión de PTG en el epitelio seminífero de rata depletado de glutatión. Se realizó inmunohistoquímica en cortes de testículos de ratas depletadas de glutatión celular, inyectando BSO intraperitonealmente a una concentración de 4 mmol/Kg de peso. Los cortes fueron obtenidos luego de un tratamiento de 24 y 48 horas con BSO. Se muestra la inmunorreacción con PTG (café). Los núcleos fueron teñidos con hematoxilina (azul). En cada caso se muestra una ampliación de la imagen (Zoom). La barra de magnificación corresponde a 20 µm. 88 4.4 Determinación del contenido de glutatión intracelular en células de Sertoli 42GPA9 Se han determinado concentraciones elevadas de glutatión en testículo de rata y ratón (Calvin y Turner; 1982). En espermatocitos y espermátidas aislados de hámster se ha observado una disminución gradual del contenido de glutatión durante incubaciones prolongadas, pero sin una pérdida en la viabilidad celular, ya que el contenido de ATP en las células se mantiene (den Boer et al, 1989). Esto sugiere que las células germinales no poseen la maquinaria o los precursores necesarios para la síntesis de glutatión, proponiendo una nueva función para la célula de Sertoli en la síntesis de glutatión por parte de las células germinales. Además, las células de Sertoli serían las encargadas de acumular el ácido ascórbico en el lumen del túbulo seminífero. Por estas razones se procedió a estudiar el efecto de la depleción de glutatión sobre la expresión y localización de los co-trasportadores de sodio/ascorbato en estas células. Primeramente, utilizando células de Sertoli 42GPA9 se determinó el contenido normal de glutatión intracelular. Para ello se midió el volumen de intercambio celular, con el fin de poder determinar con exactitud la concentración de glutatión de cada célula. Para esto se realizaron ensayos de trasporte con 3-O-metilglucosa (OMG), un análogo de glucosa no metabolizable. Este sustrato es específico para los transportadores facilitativos de hexosas, y es transportado a favor de un gradiente de concentración hasta alcanzar un equilibrio en el cual la cantidad de análogo que entra se iguala a la que sale, de esta forma se podrá determinar el volumen de intercambio celular. 89 En experimentos de incorporación de este sustrato usando 0,5 mM de OMG se observó un aumento lineal de la incorporación en estas células durante el primer minuto de incubación, con una velocidad inicial de 1076 ± 150 pmoles/106célulaxminuto (Figura 18, A). Se determinó un volumen de intercambio celular de 3,2µL/106 células. Los análisis de dosis respuesta del transporte de OMG indican que el transporte aumenta a medida que aumentó la concentración de sustrato (Figura 18, B). A continuación, se determinó la concentración de glutatión intracelular total (GSH +GSSG) en cultivos de células de Sertoli 42GPA9. El principio de la cuantificación se basa en la velocidad de formación del cromóforo TNB tras la reducción de DTNB, ya que esto es proporcional a la suma de GSH y GSSG. Las células fueron crecidas en placas de 12 pocillos y luego se midió el contenido glutatión cada 24 horas de cultivo. Se observó una variabilidad en el contenido de glutatión en las células de Sertoli durante 72 horas de cultivo, obteniendo concentraciones promedios entre 1,5-4,7mM (Figura 17, C). Este fenómeno ya ha sido reportado anteriormente (Guaiquil et al., 1997). 90 A B C 91 Figura 18. Determinación del contenido de glutatión en células Sertoli 42GPA9. A y B. Ensayos funcionales utilizando 3H-OMG en células de la línea 42GPA9 mantenidas durante 7 días en cultivo. A. Cinética de incorporación de OMG 0,5 mM a 20 ºC durante 600 segundos. La línea en los gráficos corresponde al ajuste a una exponencial (R = 0,9860). Determinando un volumen de intercambio de 3,2µL/106 células. B. Curva de saturación para la incorporación de OMG (30 segundos, 20 ºC). La línea corresponde al ajuste a una hipérbola rectangular (R = 0,9914) de la cual se obtuvieron los parámetros: Km= 4 ± 0,2 mM y Vmax= 1042 ± 211 pmoles/106celxmin. C. Gráfico representativo de la concentración de glutatión intracelular en cultivo de células de Sertoli. La concentración de glutatión total fue determinada mediante una cuantificación espectrofotométrica. 92 Por último, se modificó el contenido de glutatión usando tratamientos con BSO, DEM y BSO/DEM. El dietil maleato (DEM) es un sustrato para la GST, siendo utilizado para disminuir los niveles de glutatión mediante una reacción de conjugación catalizada por esta enzima (Allameh et al, 1987). Este compuesto ha sido ampliamente utilizado para depletar de glutatión cultivos celulares, incluyendo células de ovario de hámster chino (Mitchell et al., 1983; Rice et al., 1986), células de carcinoma de pulmón humano (Brodie y Reed, 1985), espermátidas redondas de ratas (den Boer et al., 1989). Los tratamientos con 0,25; 0,5; 1 y 2 mM de BSO durante 24 horas produjeron una fuerte caída de glutatión de 5,8 mM en las células no tratadas a 560 µM con 0,25 mM de BSO, con 0,5; 1 y 2 mM BSO se obtuvieron concentraciones muy similares entre 70 y 50 µM. (Figura 19, A). El DEM tiene un efecto agudo sobre la concentración de glutatión intracelular, 1 mM de DEM produce una disminución del 55% del glutatión intracelular en sólo 60 minutos. (Figura 19, B). Al tratar las células con ambas moléculas, BSO/DEM, la condición con 0,25 mM BSO por 24 horas seguido de 1 mM DEM durante 1 hora se obtuvo una concentración de 650 µM, siendo muy similar al valor obtenido cuando las células fueron tratadas sólo con 0,25 mM BSO. Por el contrario, en las células tratadas con 0,5; 1 y 2 mM BSO seguido del tratamiento con DEM no se detectó glutatión (Figura 19, B), debido a la sensibilidad del método. Los cultivos de Sertoli 42GPA9 tratados con BSO, DEM y BSO/DEM no mostraron toxicidad celular bajo las condiciones experimentales en estudio, se realizaron ensayos de viabilidad celular por exclusión con azul de tripán, la cual fue siempre mayor al 95% (Figura 18, C y D). 93 De estos resultados, se concluye que la modificación del contenido de glutatión en las células de Sertoli 42GPA9 utilizando BSO y DEM, no afecta la viabilidad, logrando así obtener cultivos celulares libres de este tiol. 94 A B *** C *** *** ** *** *** *** *** D FIGURA 19: Modificación del contenido de glutatión en células de Sertoli 42GPA9. A y B. Se realizaron ensayos de depleción del contenido intracelular de glutatión en células de Sertoli 42GPA9. Se utilizaron células no tratadas (control), incubadas por 24 horas con 0,25; 0,5; 1 y 2 mM BSO (A), o incubadas con 0,25; 0,5; 1 y 2 mM BSO seguida de un tratamiento de una hora con 1 mM dietil maleato, DEM, (B). C y D. Análisis de viabilidad en células de Sertoli 42GPA9 depletadas de glutatión, mediante exclusión con azul de tripán. Los datos corresponden a la media de 3 experimentos independientes ± DS. *** p<0,001; ** p<0,01. 95 4.5 Efecto de la ausencia de glutatión sobre la expresión y función de los transportadores de AA en células de Sertoli Para tener una mejor aproximación del efecto producido por la alteración del metabolismo del glutatión sobre los transportadores de AA, se analizó la expresión y función de los co-trasportadores de sodio/ascorbato en células de Sertoli 42GPA9 depletadas de glutatión. Los siguientes experimentos las células de Sertoli 42GPA9 fueron incubadas con 1 mM BSO durante 24 horas o 48 horas, seguido de 1mM DEM por 1 hora, respectivamente. El tratamiento BSO/DEM produjo una fuerte caída del glutatión total de aproximadamente 6 mM en las células controles a concentraciones no detectables por el método en las células tratadas. Cuando estas células depletadas de glutatión se cultivaron en un medio libre de BSO, los niveles de glutatión comenzaron a incrementar a las 48horas alcanzando concentraciones alrededor de los 150 µM (datos no mostrados). A continuación, se procedió a identificar la expresión de los SVCTs mediante RTPCR, inmunofluorescencia y Western blot en células de Sertoli 42GPA9. Según análisis de RT-PCR realizados a partir de preparaciones de RNA total obtenidas de los cultivos sin tratamiento (control) y depletadas de glutatión, utilizando partidores específicos para el mRNA de SVCT1 y SVCT2, fue posible amplificar un fragmento de 651 pb para SVCT1 (Figura 20, A, carril 4) y 475 pb para SVCT2 (Figura 20, A, carril 7), los cuales corresponden al tamaño esperado. En las células tratadas con 1 mM BSO por 24 horas seguido de 1 mM DEM por 1 hora no fue posible encontrar el mRNA de SVCT1 (Figura 20, A, carril 5), no obstante, fue posible amplificar el mRNA de SVCT2 (Figura 20,A, 96 carril 8), obteniendo el tamaño esperado. Por último, en células tratadas con 1 mM BSO por 48 horas seguido de 1 mM DEM por 1 hora, se amplificaron ambos transcritos con los tamaños esperados (Figura 20, A, carril 6 y 9). Como control de carga se usaron partidores específicos para el mRNA de β-actina (Figura 20, A, carril 1, 2 y 3). La presencia de las proteínas SVCT1 y SVCT2 en células de Sertoli depletadas de glutatión fue demostrada por análisis de Western blot e inmunofluorescencia. Utilizando extracto de proteínas totales de células de Sertoli sin tratar (control) y depletadas de glutatión, se detectó una banda correspondiente al tamaño de 62 kDa para SVCT1 tanto en las células controles como en las tratadas por 24 horas, sin embargo las células tratadas por 48 horas se detectó una disminución de alrededor del 50% en la banda correspondiente a SVCT1 (Figura 20, B). Para SVCT2 se detectó una banda de 69 kDa y no se observó diferencia entre los tratamientos (Figura 20, B). Usando los mismos anticuerpos se realizó la técnica de inmunofluorescencia para SVCT1 y SVCT2 en células de Sertoli 42GPA9 (Figura 20, C). Se observó una marcada fluorescencia usando anti-SVCT1 a nivel del citoplasma principalmente y en menor grado en la membrana celular de las células 42GPA9, tanto en el control como en las células depletadas de glutatión, sin embargo hay una leve disminución de la inmunofluorescencia en las células tratas por 48 horas con BSO/DEM. En cambio utilizando anti-SVCT2, se observó fluorescencia a nivel del citoplasma y en menor grado en la membrana plasmática, sin diferencias entre las células controles y las tratadas con BSO/DEM. Estos resultados sugieren que la ausencia de glutatión en las células de Sertoli 42GPA9 produce una efecto sobre la expresión del mRNA y de una disminución a nivel 97 proteico de SVCT1, pero no de SVCT2. A continuación se realizaron ensayos de incorporación de 100 µM de AA a 37ºC por 2 minutos con el objeto de evaluar si el transporte de AA estaba alterado (Figura 20. D). Las células de Sertoli depletadas de glutatión a las 24 y 48 horas aumentaron la incorporación de AA en aproximadamente un 50% en comparación a las células controles. En resumen, estos resultados indican que la modificación del contenido de glutatión en las células de Sertoli 42GPA9 utilizando BSO y DEM, produce sólo una disminución tanto a nivel del mensajero como de la proteína de SVCT1. Sin embargo, análisis funcionales de estos transportadores revelan un aumento en la captación de AA en estas células. 98 A B C D ** ** 99 Figura 20. Expresión de los transportadores de ácido ascórbico en células de Sertoli 42GPA9 depletadas de glutatión. Las células de Sertoli fueron tratadas con 1mM BSO por 24 horas, seguidas de 1mM DEM por 1 hora. A. Análisis de RT-PCR para SVCT1 y SVCT2 en células de Sertoli 42GPA9 depletadas de glutatión. B Análisis de Western blot para SVCT1 y SVCT2 en células de Sertoli 42GPA9 depletadas de glutatión. C. Análisis de inmunocitoquímica para SVCT1 (verde) y SVCT2 (verde) en células de Sertoli 42GPA9 depletadas de glutatión. Los núcleos fueron teñidos con ioduro de propidio (PI). La barra de magnificación corresponde a 20µm. D. Se realizaron ensayos de funcionales utilizando 14 C-AA en células depletadas de glutatión, la gráfica muestra la incorporación 100 µM de ácido ascórbico (AA) a 37ºC por 2 minutos. Los datos corresponden a la media de 3 experimentos independientes ± DS. ** p<0,01. 100 4.6 Efecto del peróxido de hidrógeno sobre la viabilidad de las células de Sertoli 42GPA9 depletadas de glutatión Sabiendo de antemano, por trabajos en nuestro laboratorio, que las células de Sertoli son altamente resistentes al estrés oxidativo (Pulgar, 2009), evaluamos la resistencia de estas células depletadas de glutatión frente al peróxido de hidrógeno (H2O2). Las células de Sertoli 42GPA9 tratadas con 0,25; 0,5; 1 y 2 mM de BSO durante 24 horas se expusieron por 3 horas con 1 mM H2O2. Se evaluó la viabilidad celular por exclusión con azul de tripán (Figura 21, A), sin encontrar diferencias significativas entre las células no tratadas, las células expuestas sólo con H2O2 y las células depletadas con las distintas concentraciones de BSO y luego expuestas a H2O2. Sin embargo, cuando se realizó el mismo experimento, evaluando la viabilidad mediante la técnica de TUNEL (Figura 21, B), observamos un incremento de las células TUNEL positivas de manera dosis dependiente a las concentraciones de BSO cuando las células fueron tratadas con 1 mM H2O2 por 3 horas. En la figura 21 B, se muestra en el inserto una imagen representativa del ensayo utilizando 0,25 mM de BSO, seguido de 1 mM H2O2 por 3 horas, en el cual se observan las células TUNEL positivas con los núcleos marcados de color café. Estos resultados sugieren que el glutatión sería un antioxidante fundamental para suplir las demandas frente a condiciones de estrés oxidativo en las células de Sertoli. 101 A B *** *** *** 102 Figura 21. Efecto del peróxido de hidrógeno en células de Sertoli 42GPA9 tratadas con BSO. A. Análisis de viabilidad celular mediante exclusión con azul de tripán en células de Sertoli 42GPA9 depletadas de glutatión. Las células fueron tratadas con 0,25; 0,5; 1 y 2 mM BSO por 24 horas, luego fueron expuestas por 3 horas con 1 mM H2O2. B. Análisis semi-cuantitativo de la técnica de TUNEL en células de Sertoli depletadas de glutatión. En inserto se muestran imágenes representativas de las células de Sertoli 42GPA9 control y TUNEL positiva. Los datos corresponden a la media de 3 experimentos independientes ± DS. *** p<0,001. 103 5. DISCUSIÓN Estudios han demostrado que la infertilidad masculina representa el 40% del problema de infertilidad total, afectando a un hombre de cada 20 en la toda la población (Arabi, 2004). Las principales causas de ésta son la exposición a sustancias o fármacos tóxicos, radiación, nicotina y especies de oxígeno reactivas (EROs). Se ha demostrado que EROs puede desencadenar una infertilidad masculina por dos tipos de mecanismos, el primer mecanismo consiste en un daño a nivel de la membrana plasmática del espermatozoide afectando la movilidad y la capacidad para fusionarse con el ovocito y el segundo corresponde a una daño en el DNA de las células espermatogénicas afectando la contribución genómica paterna en el embrión. Los antioxidantes como vitamina C y glutatión, por sus altas concentraciones reportadas en el túbulo seminífero, estarían previniendo el daño oxidativo de las células espermatogénicas. El hallazgo principal de esta tesis es la modulación del co-trasportador de sodio/ascorbato, SVCT1, frente a bajos niveles de glutatión en células de Sertoli 42GPA9. Para un mejor entendimiento del aporte de este estudio al conocimiento científico de los transportadores de AA en el túbulo seminífero, la discusión se presentará en cuatro capítulos. 104 5.1 Transportadores de ácido ascórbico se expresan diferencialmente en el túbulo seminífero durante el desarrollo de la línea germinal masculina En Ratus norvegicus la espermatogénesis comienza a partir del cuarto día postnacimiento con la migración de los gonocitos desde el centro del túbulo seminífero hacia la membrana basal. Esta migración está probablemente facilitada por moléculas de adhesión como la cadherina P presentes en las células de Sertoli de los testículos inmaduros (Lin y Dephilip, 1996), seguido de su transformación a espermatogonias tipo A o células madre. Los gonocitos son células de gran tamaño, núcleo es esférico y voluminoso y poseen un gran nucléolo (Müller y Skakkebaek ,1984). Las células de Sertoli son inmaduras y muy numerosas (26 por sección tubular transversal) y adoptan un patrón pseudoestratificado. Luego comienza una onda de proliferación en el epitelio seminífero, que se manifiesta por un aumento de las espermatogonias tipo A, la aparición de las espermatogonias tipo B y los primeros espermatocitos I (Nistal y Paniagua, 1984). A los 15 días post-nacimiento, la primera generación de espermatocitos I entra en meiosis, al mismo tiempo una segunda generación de células madre comienza una nueva ronda de proliferación y diferenciación. Por último, a los 4550 días post-nacimiento son producidos los primeros espermatozoides. Vitamina C se ha visto ampliamente involucrada en infertilidad masculina. la disminución de esta vitamina en el plasma seminal está estrechamente relacionada con una calidad espermática reducida, expresada en términos de disminución de la motilidad, menor número de espermatozoides, alteración en la morfología y abundante aglutinación entre las células (Dawson et al., 1987; Jacob et al., 1992; Lewis et al., 1997; Sönmez et al., 2005). Angulo et al, (2008) demostró la presencia de los co- 105 trasportadores de sodio/ascorbato (SVCT1 y SVCT2) en testículos de rata. En dicho estudio se demostró que estos trasportadores son funcionales y que están involucrados en el transporte de AA hacia el lumen del túbulo seminífero, siendo parcialmente responsables de las altas concentraciones de AA reportadas en el plasma seminal (Berg et al., 1941; Paz et al., 1977; Sönmez et al., 2005). Sin embargo, no hay evidencia hasta la fecha del patrón de expresión y localización de estos transportadores durante el desarrollo testicular. Se decidió usar el marcador de células de Sertoli WT1, debido a que es un factor de transcripción expresado en células de Sertoli temprano en la vida fetal y continúa siendo expresado en estas células durante la madurez. Se localiza principalmente en el núcleo y menos intensamente en el citoplasma, en todas las fases del desarrollo de estas células. Por lo tanto, es un marcador estable de células de Sertoli (Sharpe et al., 2003). Al analizar la presencia de SVCT1 y SVCT2 mediante inmunohistoquímica en los cortes de testículo de rata de distintas edades, se observó un patrón de distribución diferencial de estos transportadores durante el desarrollo del epitelio seminífero. SVCT1 muestra una mayor expresión en los primeros días de desarrollo atribuible a la inmunodetección tanto de las células de Sertoli inmadura como en los gonocitos. En el primer día post-nacimiento se observa la presencia del trasportador en la base del túbulo seminífero, sin haber co-localización con WT1, sugiriendo que un mayor porcentaje de esta proteína está presente en los gonocitos. Sin embargo, a los 5 días post-nacimiento hay un cambio en la distribución de SVCT1 ubicándose en todo el epitelio seminífero y co-localizando fuertemente en el centro con WT1. Este cambio tan 106 radical en la ubicación de SVCT1 podría ser resultado de la migración y transformación de los gonocitos a espermatogonias tipo A, además las células de soporte dejan de dividirse y se diferencian a células de Sertoli. La localización de SVCT1 en los estados más desarrollados del testículo muestra una distribución de carácter punteado a lo largo de todo el epitelio seminífero, con variaciones entre las edades. Esta diferencia en las edades de 15, 35 y 60 días pareciera que no tener relación con el proceso espermatogénico, esto sugiere que SVCT1 estaría localizado en los distintos tipos de células espermatogénicas que están presentes en las distintas etapas del desarrollo, cumpliendo la función de incorporar AA en estas células. Por otro lado, SVCT2 no fue detectado en los primeros días de desarrollo, en cambio a los 15 días post-nacimiento, cuando comienza la primera meiosis de los espermatocitos I, se detectó una marcada fluorescencia a lo largo de todo el epitelio seminífero, siendo más intensa en la base del túbulo y manteniéndose hasta la madurez del órgano. Esto sugiere que SVCT2 no sólo podría estar cumpliendo el rol de incorporar ácido ascórbico en las células de la línea germinal masculina durante el proceso diferenciación y proliferación de estas células con la subsecuente formación de los espermatozoides, sino que podría estar asi mismo involucrado en la regulación de algún proceso involucrado en la diferenciación o proliferación de estas células, ya que SVCT2 se ha visto involucrado en diferenciación de osteoclastos y macrófagos (Wu et al., 2004; Qiao y May, 2009). Wu et al., (2008) demostró que SVCT2 estaría cumpliendo un papel dual en la placenta: estimula la esteroidogénesis, de este modo ayudando a mantener el embarazo, y acumulado AA en el feto. Estos hallazgos podrían sugerir que SVCT2 en el 107 túbulo seminífero controlando la podría estar cumpliendo también una función dual, ya sea expresión o síntesis de de algún factor regulatorio de la espermatogénesis, o bien produciendo un cambio en las células de Sertoli que aumente su sensibilidad a testosterona. Esto último se podría correlacionar ya que en los tejidos donde actúa la testosterona, ésta se reduce de inmediato gracias a la enzima 5 α−hidroxilasa, a dihidrotestosterona (DHT) que es un andrógeno mucho más potente, además en estudios realizados en conejillos de india se ha visto que la hidroxilación de la prolina en el cartílago articular era especialmente resistente a deficiencias de ascorbato, produciendo una disminución en la síntesis de colágeno (Spanheimer, et al., 1986). Es interesante destacar que en las células de Leydig, encargadas de sintetizar y secretar testosterona, sólo se logró inmunolocalizar SVCT2 (datos no mostrados), pudiendo estar relacionado con la síntesis de testosterona. En conclusión, sólo se puede afirmar que existe una expresión y localización diferenciada de los transportadores de ácido ascórbico (SVCTs) a lo largo del desarrollo del epitelio seminífero, y que este patrón podría estar relacionado de algún modo con la espermatogénesis. 5.2 Las células de Sertoli como modelo para estudiar la relación entre los transportadores de AA y el glutatión Se determinó la expresión de transportadores de AA, SVCT1 y SVCT2 en células de Sertoli 42GPA9 en cultivo, mediante análisis de RT-PCR, inmunofluorescencia y 108 Western blot y también se analizó la función de estos transportadores mediante ensayos funcionales utilizando radioisótopos. Los resultados obtenidos por RT-PCR, inmunofluorescencia y Western blot confirman la expresión de los transportadores SVCT1 y SVCT2 en estas células, sin embargo, hubo pequeñas diferencias observadas en los resultados de Western blot para las proteínas de células de Sertoli y las descritos previamente para SVCT1 y SVCT2; esto podrían deberse a los distintos estados de glicosilación que pueden sufrir estas proteínas (Tsukaguchi et al., 1999). Los ensayos funcionales revelaron que el trasporte de AA en estas células está mediado por 2 componentes, el primero con una Km aparente cercana a 38 µM que probablemente corresponda a la actividad de SVCT1 y el otro con una Km aparente de 12 µM, que podría corresponder a la isoforma SVCT2. Esta última Km es muy cercana a lo descrito para SVCT2 en célula CaCo-2 y para el transportador SVCT2 humano clonado y expresado en ovocitos de Xenopus laevis (Maulén et al., 2003). La Km para SVCT1 ha sido descrita en un rango de valores muy amplio desde 75 a 200 µM aproximadamente (Wang et al., 1999). En resumen, las células de Sertoli 42GPA9 expresan SVCT1 y SVCT2, siendo ambas isoformas funcionales. Se ha demostrado que las células de Sertoli tienen toda la maquinaria necesaria para la síntesis de glutatión, así como las enzimas relacionadas con el metabolismo y la función de este antioxidante (Lu y Steinberger, 1977; den Boer et al., 1989; Bauche at al., 1994). Las células de Sertoli 42GPA9 constituyen así un modelo válido para estudiar la relación entre la expresión y localización de los co-transportadores de sodio/ascorbato y los niveles intracelulares de glutatión. 109 5.3 El efecto del BSO, asociado a una disminución del contenido de glutatión afecta la expresión y función de SVCT1 El glutatión y la vitamina C muestran una fuerte interdependencia funcional. La interrupción del metabolismo del glutatión en ratas y conejillos de indias, utilizando tratamiento con butionina-(SR)-sulfoximina (BSO), un potente y específico inhibidor de la síntesis del glutatión, reveló una disfunción y mortalidad asociada con la deficiencia de glutatión, la cual fue revertida cuando se administró vitamina C en la dieta (Martensson, et al., 1991). Estudios previos sobre la expresión y función de los transportadores de ácido ascórbico en respuesta de diferentes estímulos, han demostrado que en células COS-1 que sobre expresan SVCT1 y SVCT2, tratadas con activadores de proteína quinasa C, muestran una disminución en la incorporación de AA, debido a una redistribución de SVCT1 en las membranas intracelulares sin afectar a SVCT2. Estos resultados indicarían que SVCT1 y SVCT2 son regulados independientemente (Liang et al., 2002). 5.3.1 Estudios in vivo Se realizaron ensayos de inmunohistoquímica en cortes de testículo tratados con BSO durante 24 y 48 horas. Estudios previos demostraron que utilizando una sola inyección con BSO se logró disminuir el contenido de glutatión sólo entre 10-20%, después de 32 horas, en cambio utilizando 2 inyecciones era más eficaz, resultando en una reducción en un 20-25% en 32-48 horas después de la inyección final (Slott, et al.,1989). Se utilizaron dos inyecciones para depletar de glutatión los testículos de rata 110 adulta, para lograr una mayor disminución de este tiol. Los resultados obtenidos por Stoll, et al. (1989) demostraron que el recambio de glutatión en el testículo es relativamente lento, debido a la modesta y retardada disminución de glutatión por los tratamientos con BSO. Es interesante destacar que los tratamientos con BSO no resultaron tener efecto nocivo en las células germinales del epitelio seminífero, ya que no fue posible encontrar células apoptóticas mediante la técnica de TUNEL. Glutatión cumple un rol importante en la proliferación y diferenciación de las células germinales, principalmente en la protección de las células germinales frente a la acción de radicales libres, evitando mutaciones hereditarias (Teaf et al., 1985). Daños producidos en el DNA pueden ser detectados mediante la técnica de TUNEL, debido a la fragmentación del DNA. Sin embargo, con una disminución del 30 % del glutatión testicular, no hubo efecto sobre las células espermatogénicas, dándole importancia a otros antioxidantes como la vitamina C, la cual se encuentra a altas concentraciones en testículos de mamíferos y protege frente al estrés oxidativo producido por el desbalance de las especies prooxidante y antioxidante en los testículos tratados con BSO. En los ensayos de TUNEL se muestra que en todas las condiciones hay aproximadamente 2 células apoptóticas en cada 10 túbulos analizados, esto se debe a un evento de apoptosis fisiológica que ocurre durante el desarrollo del sistema reproductor en mamíferos. Esta apoptosis controla la superproducción de gametos masculinos y restringe los niveles normales de proliferación, para que no sobrepasen la capacidad de apoyo de las células de Sertoli (Kocak et al., 2002). La apoptosis de 111 células germinales ocurre en los testículos durante la espermatogénesis, esto ocurre predominantemente en las espermatogonias. Con respecto a los transportadores de vitamina C, hemos demostrado que los tratamientos con BSO asociados con una disminución del glutatión testicular, producen una alteración sólo en la expresión y localización de SVCT1. SVCT2 y GLUT3 no son afectados por estos tratamientos. Mardones et al. (2008), utilizando cultivos de células de hepatoma de rata tratados con BSO observaron una disminución en la incorporación de AA, así como en la expresión de SVCT 1 y 2. En cambio cuando utilizaron cultivos de hepatocitos de rata observaron una disminución en la incorporación de AA, la cual fue atribuible a un internalización de SVCT1. En ambos casos no observaron variaciones en los transportadores facilitativos de hexosas (Mardones et al., 2008). Estos hallazgos concuerdan en cierto modo con los resultados obtenidos en el epitelio seminífero, y la respuesta observada por la deficiencia de glutatión es al parecer tejido especifica. Además, esta alteración sería observable solamente en relación a los transportadores de AA y no a los transportadores de DHA. Cuando analizamos las proteínas relacionadas con el metabolismo del glicógeno observamos que glicógeno sintasa muscular (MGS) y PTG se ven alteradas de distinta manera en los cortes de testículo de rata tratadas con BSO. Por un lado observamos que los tratamientos con BSO producen una disminución significativamente de MGS a lo largo de todo el epitelio, y por el otro lado hay un aumento de PTG en las células de Leydig. Esto sugiere que la disminución de glutatión en las células de Sertoli produce alteración en la expresión de estas proteínas. 112 En conclusión podemos afirmar que en ratas tratadas in vivo con BSO, se observaron diferencias en la expresión y localización del transportador SVCT1 a nivel del epitelio seminífero. 5.3.2 Estudios in vitro Los estudios realizados en células de Sertoli 42GPA9, demostraron que estas células, al ser tratadas con BSO/DEM, se logra una drástica caída del glutatión intracelular, sin producir toxicidad en estas células. Las concentraciones utilizadas de BSO/DEM fueron escogidas debido a las variaciones observadas en el contenido de glutatión en las células en cultivo, de este modo asegurando una depleción completa en cualquier placa de células tratadas con estas moléculas. La capacidad de las células de Sertoli para regular la expresión de los transportadores de AA en respuesta a la una alteración del metabolismo de glutatión, resultó en la disminución de la expresión de SVCT1, sin embargo hay un aumento significativo en la incorporación de AA en estas células. Esta disminución en la expresión de SVCT1 concuerda con los resultados obtenidos por Mardones et al. (2008), además con los resultados obtenidos in vivo, ya que en ratas adultas tratadas con BSO por 24 horas se observó una disminución en la inmunorreacción de SVCT1 en el epitelio seminífero. El aumento en la incorporación de AA es un evento contradictorio, pues los tratamientos con BSO/DEM producen una disminución en la expresión de una de las isoformas de estos transportadores. Una de las explicaciones más probables de este 113 aumento puede relacionarse a variaciones de las propiedades cinéticas de uno o ambos transportadores, o algún cambio en la localización subcelular de estos transportadores. La homeostasis celular es controlada por un balance entre señales de supervivencia y de muerte celular, las cuales son mediadas por modificaciones posttraduccionales de proteínas. La fosforilaciones de los grupos hidroxilo de las serina, treonina y tirosina en las proteínas son probablemente una de las modificaciones más conocidas, sin embargo nuevas observaciones han dejado en evidencia que las modificaciones post-traduccionales en los grupos sulfidrilo de las cadenas laterales de las proteínas, pueden participar también en eventos de señalización celular. En particular las S-glutationilaciones, en la cual se forma un enlace disulfuro entre la cisteína de la cadena lateral de la proteína y el glutatión, al igual que las fosforilaciones es un mecanismo reversible en la regulación de proteínas. La S-glutationilación altera sustancialmente la funcionalidad y localización de enzimas, receptores, proteínas estructurales, factores de transcripción y proteínas de transporte. Estos cambios, naturalmente, tienen profundas implicaciones para la fisiología celular. Esta oxidación del grupo sulfidrilo de la cisteína por S-glutationilación se ha visto involucrada en distintas proteínas que tienen que ver con el citoesqueleto (actina y tubulina), el metabolismo energético (Gliceraldehído-3-fosfato deshidrogenasa y piruvato quinasa), señalización celular (proteína tirosina fosfatasa 1B y PKC), homeostasis de calcio (receptor de rianodina I y II), muerte celular (caspasa 3) plegamiento de proteínas (PDI y proteosoma 20S) y por último en el estado redox de las células (glutatión S-transferasa y tiorredoxina 1) (Mohr et al., 1999; Sykes MC et al., 114 2007; Wang et al., 2001; Landino et al., 2004; Cotgreave et al., 2002; Fratelli et al., 2002; Klatt et al., 2000; Ward et al., 2000; Haendeler J, 2006). Las modificaciones de proteínas por S-Glutationilación ocurren tanto en células sometidas a estrés oxidativo como en condiciones fisiológicas. Estudios han demostrado que el factor regulador del interferon 3 se encuentra S-glutationilado en condiciones normales o inactivo, y durante una infección viral su estado de Sglutationilación se ve disminuido, gracias a la actividad de la glutarredoxina-1 (GRX-1), la cual es una enzima citoplasmática que cataliza la reducción reversible del grupo sulfidrilo de la proteína S-glutationiladas (Gravina y Mieyal, 1993; Prinarakis et al., 2008). Gilge et al (2008) analizaron la relación entre la cantidad de proteínas S- glutationiladas y la concentración de glutatión intracelular en células HEK 293. Cuando estas células fueron sometidas a tratamientos con BSO observaron una disminución de las proteínas S-glutationiladas con respecto a las células no tratadas. Esto permite especular que cuando se produce una caída drástica en el contenido de glutatión en las células de Sertoli, muchas de estas modificaciones post-traduccionales que se encuentran en condiciones fisiológicas se ven alteradas, sugiriendo que este aumento en la incorporación de AA se pueda deber a alteraciones de sitios de S-glutationilación de alguno de estos transportadores produciendo cambios en sus propiedades cinéticas o bien cambios en su localización que explique de algún modo el aumento en la incorporación. Por otro lado los trasportadores de AA tienen múltiples sitios de fosforilación dependientes de PKC. La fosforilación de SVCT1 inhibe la traslocación del citoplasma a 115 la membrana plasmática, en cambio la fosforilación de SVCT2 altera la actividad de transportador por cambios conformacionales. Es bien sabido que la proteína quinasa C es inactivada por S-glutationilación en condiciones de estrés, de este modo aumentaría la traslocación de SVCT1 desde el citoplasma a la membrana plasmática, aumentando la incorporación de AA bajo condiciones de estrés oxidativo. Sin embargo, en este estudio las células tratadas con BSO experimentarían una disminución de las proteínas S-glutationilisadas totales, produciendo una activación de PKC, lo que desencadenaría una inhibición de la traslocación de SVCT1 a la membrana plasmática. Esto no explica el aumento de la incorporación de AA en las células tratadas con BSO, pero se correlaciona muy bien con los resultados obtenidos con SVCT1 tanto in vivo a las 48 horas de tratamiento, que sugieren una redistribución de SVCT1 a lo largo del epitelio seminífero y una posible internalización de éstos. La proteína quinasa dependiente de AMPc (PKA) también resulta ser regulada por S-glutationilación, debido a un realce en la desfosforilación de la subunidad catalítica de PKA (Kenneth et al., 2004). Wu et al., (2007) demostraron que SVCT2 interacciona físicamente con PKA y que esta quinasa es capaz de fosforilar SVCT2 in vitro y en células intactas en los sitios Ser402 y Ser639. Esta fosforilación produce la traslocación de SVCT2 a la membrana plasmática, aumentando el trasporte de AA al interior de las células. Estos antecedentes sugieren que SVCT2 podría ser el responsable en el aumento de la captación de AA por las células de Sertoli 42GPA9 tratadas con BSO, debido a la disminución total de las proteínas S-glutationiladas provocando a su vez una activación de PKA, seguido de la fosforilación de SVCT2 por 116 PKA y de la traslocación de éste a la membrana plasmática con la subsecuente incorporación de AA. En conclusión, sólo se puede afirmar que al modificar el contenido de glutatión en células de Sertoli 42GPA9, se observa una disminución en la expresión de SVCT1, sin embargo los ensayos funcionales demuestran un aumento en la incorporación de AA. 5.4 Sensibilidad de las células de Sertoli 42GPA9 depletadas de glutatión al peróxido de hidrógeno A realizar ensayos de viabilidad celular en células tratadas con distintas concentraciones de BSO y posteriormente expuestas a peróxido de hidrógeno, se observó mediante la técnica de TUNEL un incremento de las células TUNEL positivas de manera dosis dependiente a las concentraciones de BSO. Cuando las células fueron sólo expuestas a peróxido de hidrógeno no se observó un cambio significativo en el número de células TUNEL positivas, sin embargo, cuando fueron tratadas con BSO previamente, se observaron cambios significativos en todas las condiciones, sugiriendo que el glutatión sería importante en el reciclaje de la vitamina C y que la actividad de las enzimas con actividad DHA reductasa no dependientes de glutatión no lograrían suplir las demandas de reciclaje de esta vitamina, aumentado las especies prooxidantes y produciendo la muerte celular, posiblemente mediante apoptosis. 117 Como conclusión se puede afirmar que la disminución del contenido de glutatión en células de Sertoli 42GPA9 produce un aumento en la sensibilidad frente al peróxido de hidrógeno. Por último, es interesante destacar que teóricamente las células con niveles bajos de glutatión en su microambiente, debieran presentar concentraciones inferiores de AA, en comparación a las células en condiciones fisiológicas, En estas condiciones SVCT2 tendría un rol primordial, por sus propiedades cinéticas (mayor afinidad por AA que SVCT1), en la captación de ácido ascórbico por las células. Los resultados obtenidos en esta tesis demuestran una disminución de SVCT1 en el epitelio seminífero, corroborándose con la disminución en la expresión de SVCT1 en células de Sertoli 42GPA9. Sin embargo, el aumento de la incorporación de AA no fue explicado experimentalmente, proponiendo un aumento en la capacidad de trasporte (Vmax) de SVCT2, ya sea por la traslocación de éste hacia la membrana plasmática, o por alguna modificación que cambie su propiedades cinéticas favoreciendo el transporte de AA. En la Figura 22, se muestra un esquema que muestra el efecto de la deficiencia de glutatión sobre los transportadores de vitamina C en el epitelio seminífero de rata. 118 Figura 22. Transportadores de vitamina C y el contenido de glutatión en el epitelio seminífero de rata. Transportadores de AA (SVCT) y transportadores de ácido dehidroascórbico (DHA) (GLUT). El AA entra en las células de Sertoli a través de los transportadores SVCT. La vitamina C puede entrar también a las células de Sertoli como DHA por los transportadores GLUT, y ser reducida rápidamente a AA mediante las enzimas DHA reductasas dependiente de glutatión. Contenido de glutatión intracelular en la célula de Sertoli, (GSH) [3,1 mM], espermatocitos (GSH) y espermátidas (GSH) [5,6 y 6,1 mM, Bauchè et al. (1994)]. La disminución del contenido de GSH en las células de Sertoli afecta la expresión del Transportador SVCT1 y no SVCT2, ni GLUT3, sin embargo hay un aumento en la incorporación AA, mediante un mecanismo desconocido. 119 En este estudio nos preguntamos si los cambios en la expresión del transportador de ácido ascórbico se relacionan con la capacidad antioxidante de las células, o la disponibilidad celular de otros antioxidantes que no sean la vitamina C. El tratamiento con un inhibidor. L-butionina-S,R-sulfoxamida (BSO), de la γ- glutamilcisteína sintetasa conduce a la disminución de los niveles celulares de GSH, y su aplicación puede proporcionar un modelo experimental útil de la deficiencia de GSH. Los niveles celulares de GSH pueden aumentarse mediante el suministro de sustratos para la síntesis de éste, como análogos de oxiprolina usados para aumentar los niveles de glutatión en linfocitos (Williamson et al., 1982; Fidelus et al., 1987) y la Nacetilcisteína, la cual es capaz de entrar en una amplia variedad de células, siendo más soluble y menos oxidable que la cisteína, y capaz de aumentar también los niveles de glutatión (Cotgreave et al., 1991; Bonanomi y Gazzaniga,1980). Por otro lado hay compuestos de entrega de GSH, como ésteres de glutatión. Finalmente, el aumento de GSH celular puede ser de utilidad terapéutica, además de ser una herramienta futura para estudiar el comportamiento de los transportadores de vitamina C frente a concentraciones elevadas de glutatión y poder dilucidar con mayor detalle el efecto de este tiol no proteico sobre estos transportadores. 120 6. BIBLIOGRAFÍA Aggen J.B., Nairn A.C. and Chamberlin R. (2000). Regulation of protein phosphatase-1. Chem. Biol., 7(1), R13-23. Review. Ahmad, S. and Evans, W.H. (2002). Post-translational integration and oligomerization of connexin 26 in plasma membranes and evidence of formation of membrane pores: implications for the assembly of gap junctions. Biochem. J., 1, 365(Pt 3):693-699. Aitken, J. and Fisher, H. (1994). Reactive oxygen species generation and human spermatozoa: the balance of benefit and risk. Bioessays 16, 259-267. Aitken R.J. and Krausz C. (2001). Oxidative stress, DNA damage and the Y chromosome. Reproduction,122(4), 497-506. Aliameli, Saxena, M., Mehta L.N. and Raj H.G. (1987). Comparison of pulmonary and hepatic glutathione depletion by diethyl maléate. Med. Sci. Res., 15, 957-958. Angulo, C., Rauch, C., Droppelmann, A., Reyes, A.M., Slebe, J.C., Delgado-Lopéz, F., Guaquil, V.H., Vera, J.C. y Concha, I.I. (1998). Hexose transporter expresión and function in mammalian spermatozoa: cellular localization and transport of hexosas and vitamin C. J. Cell. Biochem., 71, 189-203. 121 Angulo C., Castro M.A., Rivas C.I., Segretain D., Maldonado R., Yañez A.J., Slebe J.C, Vera J.C and Concha I.I. (2008). Molecular identification and functional characterization of the vitamin C transporters expressed by Sertoli cells. J. Cell Physiol., 217(3), 708-16. Ângulo C., Maldonado R., Pulgar E., Mancilla H., Cordova A., Villarroel F., Castro M.A., and Concha I.I. (2010) Vitamin C and oxidative stress in the seminiferous epithelium. Biol Res (in press) Bánhegyi G., Csala M., Nagy G., Sorrentino V., Fulceri R. and Benedetti A. (2003). Evidence for the transport of glutathione through ryanodine receptor channel type 1. Biochem. J., 376(Pt 3), 807-12. Bashan, N., Burdett, E., Hundal, H.S. y Klip, A. (1992). Regulation of glucose transport and GLUT1 glucose transporter expression by O2 in muscle cells in culture. American Physiol. Society, 61, C682-C690. Basketter, D. A. and Widas, W. F. (1978). Asymetry of the hexose transfer system in human erythrocytes. Comparison of the effects of cytochalasin B, phloretin and maltose. J. Physiol. 278, 389-401. Bauché F., Fouchard M.H. and Jégou B. (1994). Antioxidant system in rat testicular cells. FEBS Lett., 349(3), 392-6. 122 Berg, O. C., Huggins, C. and Hodges, C. V. (1941). Concentration of ascorbic acid and the phosphatases in secretions of the male genital tract. American J. Physiology 133, 82-87. Bigley, R.H. and Stankova, L. (1974). Uptake and reduction of oxidized and reduced ascorbate by human leukocytes. J. Exp. Med., 139, 1084-1092. Brehm, R. and Steger, K. (2005). Regulation of Sertoli cells and germ cell differentiation. Advances in anatomy embryology and cell biology, 181, 7-34. Springer. Board P.G, Coggan M., Chelvanayagam G., Easteal S., Jermiin L.S., Schulte G.K., Danley D.E., Hoth L.R., Griffor M.C., Kamath A.V., Rosner M.H., Chrunyk B.A., Perregaux D.E., Gabel C.A., Geoghegan K.F. and Pandit J. (2000). Identification, characterization, and crystal structure of the Omega class glutathione transferases. J. Biol. Chem., 275(32), 24798-806. Bonanomi L. and Gazzaniga A. (1980). Toxicological, pharmacokinetic and metabolic studies on acetylcysteine. Eur. J. Respir. Dis. Suppl., 111, 45-51. Bourdon, V., Lablack, A., Abbe, P., Segretain, D. and Pointis, G. (1998). Characterization of a clonal Sertoli cell line using adult PyLT transgenic mice. Biol. Reprod., 58(2), 591-599. 123 Bourdon, V., Defamie, N., Fenichel, P. and Pointis, G. (1999). Regulation of tissue type plasminogen activator and its inhibitor (PAI-1) by lipopolyaccharide-induced phagocytosis in a Sertoli cell line. Exp. Cell Res., 247(2), 367-372. Brady M.J., Printen J.A., Mastick C.C. and Saltiel A.R. (1997). Role of protein targeting to glycogen (PTG) in the regulation of protein phosphatase-1 activity. J. Biol. Chem., 272(32), 20198-204. Brodie A.E. and Reed D.J. (1985). Buthionine sulfoximine of cystine uptake and glutathione biosynthesis in humanlung carcinoma cells. Toxicol.appl. Pharmacol., 77,381-387. Burant C.F. and Davidson N.O. GLUT3 glucose transporter isoform in rat testis: localization, effect of diabetes mellitus, and comparison to human testis. Am. J. Physiol., 267(6 Pt 2), R1488-95. Bushweller J.H., Aslund F., Wüthrich K. and Holmgren A. (1992). Structural and functional characterization of the mutant Escherichia coli glutaredoxin (C14----S) and its mixed disulfide with glutathione. Biochemistry., 31(38), 9288-93. Castellón EA. (1994). Glutathione and gamma-glutamyl cycle enzymes in rat testis during sexual maturation. Arch. Androl., 33(3), 179-85. 124 Castellón EA. (1999). Influence of age, hormones and germ cells on glutathione Stransferase activity in cultured Sertoli cells. Int. J. Androl., 22(1), 49-55. Castellón E., Rioseco H., Rojas J., Royer M., Salas E., Contreras H. and Huidobro C. (2005). Glutathione peroxidase activity in cell cultures from different regions of human epididymis. Asian J. Androl., 7(1), 33-7. Cammack, J., Ghasemzadeh, B. and Adams, R.N. (1991). The pharmacological profile of glutamate-evoked ascorbic acid efflux measured by in vivo electrochemistry. Brain Res., 565(1), 17-22. Capellmann, M., Becka, M. and Bolt, H. M. (1994). A note on distribution of human plasma levels of ascorbic and dehydroascorbic acid. J. Physiol Pharmacol., 45, 183-187. Carosa E., Radico C., Giansante N., Rossi S., D'Adamo F., Di Stasi S.M., Lenzi A. and Jannini E.A. (2005). Ontogenetic profile and thyroid hormone regulation of type-1 and type-8 glucose transporters in rat Sertoli cells. Int. J. Androl., 28(2), 99-106. Carr, A. And Frei, B. (1999). Does vitamin C act as a pro-oxidant under physiological conditions?. Faseb. J., 13, 1007-1024. 125 Castro, M., Caprile, T., Astuya, A., Millán, C., Reinicke, K., Vera, J.C., Vásquez, O., Aguayo, L.G. and Nualart, F. (2001). High-affinity sodium-vitamin C co-transporters (SVCT) expresión in embryonic mouse neurons. J. Neurochem., 78(4), 815-823. Chinoy, N. J., Mehta, R. R., Seethalakshmi, L., Sharma, J. D. and Chinoy, M. R. (1986). Effects of vitamin C deficiency on physiology of male reproductive organs of guinea pigs. International J. of Fertility, 31, 232-239. Christensen, H. N., Liang, M. and Archer, E.G. (1967). A distinct Na+-requiring transport system for alanine, serine, cysteine, and similar amino acids. J. Biol. Chem., 242(22), 5237-5246. Cotgreave, I.A., Moldiéus, P. and Schuppe, I. (1991). The metabolism of Nacetylcysteine by human endothelial cells. Biochem. Pharmacol., 42(1), 13-6. Cotgreave, I.A. and Gerdes, R.G. (1998). Recent trends in glutathione biochemistryglutathione-protein interactions: a molecular link between oxidative stress and cell proliferation?. Biochem. Biophys. Res. Commun., 242, 1-9. Cotgreave, I.A., Gerdes, R., Schuppe-Koistinen, I. and Lind, C. (2002). Sglutathionylation of glyceraldehyde-3-phosphate dehydrogenase: role of thiol oxidation and catalysis by glutaredoxin. Methods. Enzymol., 348,175–182. 126 Clermont, Y., Morales, C. and Hermo, L. (1987). Endocytic activities of Sertoli cells in the rat. Cell biology of the testis and epididymis. Ann. N. Y. Acad. Sci., 513, 1-15. Daruwala, R., Song, J., Koh, W.S., Rumsey, S.C. and Levine, M. (1999). Cloning and functional characterization of the human sodium-dependent vitamin C transporter hSVCT1 and hSVCT2. FEBS Letters, 460, 480-484. Dawson, E. B., Harris, W. A., Rankin, W. E., Charpentier, L. A. and McGanity, W. J. (1987). Effect of ascorbic acid on male fertility. Ann. N. Y. Acad. Sci., 498, 312-323. Del Bello B., Maellaro E., Sugherini L., Santucci A., Comporti M. and Casini A.F. (1994). Purification of NADPH-dependent dehydroascorbate reductase from rat liver and its identification with 3 alpha-hydroxysteroid dehydrogenase. Biochem. J.,304( Pt 2), 38590. Den Boer P.J., Mackenbach P. and Grootegoed JA. (1989). Glutathione metabolism in cultured Sertoli cells and spermatogenic cells from hamsters J. Reprod. Fertil., 87(1), 391-400. De Kretser, D.M. and Kerr, J.B. (1988). The cytology of the testis. In: E. Knobil, J. Neil, I.L. Ewing, G.S. Greenwald, C.L. Markert and D.W. pfaff (eds). Physiol. Reprod., 1(1), 837-932. New York: Raven Press. 127 Deves, R. and Krupka, R. M. (1978). Cytochalasin B and the kinetics of inhibition of biological transport: a case of asymmetric binding to the glucose carrier. Biochim. Biophys. Acta, 510, 186-200. Estrela, J.M., Ortega, A. and Obrador, E. (2006). Glutathione in cancer biology and therapy. Crit. Rev. Clin. Lab. Sci., 43(2), 143-181. Faaland, C.A., Race, J.E., Ricken, G., Warner, F.J., Williams, W.J. and Holtzman, E.J. (1998). Molecular characterization of two novel transporters from human and mouse kidney and from LLC-PK1 cells reveals a novel conserved family that is homologous to bacterial and Aspercillus nucleobase transporters. Biochimica et Biophysica Acta, 1442, 353-360. Fernandes, A.P. and Holmgren, A. (2004). Glutaredoxins: glutathione-dependent redox enzymes with functions far beyond a simple thioredoxin backup system. Antioxid. Redox. Signal., 6, 63-74. Fidelus R.K. and Tsan M.F. (1987). Glutathione and lymphocyte activation: a function of ageing and auto-immune disease. Immunology, 61(4), 503-8. Filiberto, M., Moss R. and Sege, P. (1987). Patient perspectivas. Integrative Cancer Therapies, 4(1), 75-76. 128 Fueger, P.T., Hess, H.S., Bracy, D.P., Pencek, R.R., Posey, K.A., Charron, M.J. and Wasserman, D.H. (2004). Regulation of insulin-stimulated muscle glucose uptake in the conscious mouse: role of glucose transport is dependent on glucose phosphorylation capacity. Endocrinology, 145(11), 4912-4916. Flier, J.S., Mueckler, M.M., McCall, A.L. and Lodish, H.F. (1987). Distribution of glucose transporter messenger RNA transcripts in tissues of rat and man. J. Clin. Invest., 79(2), 657-661. Fratelli, M., Demol, H., Puype, M., Casagrande, S., Eberini, I., Salmona, M., Bonetto, V., Mengozzi, M., Duffieux, F., Miclet, E., Bachi, A., Vandekerckhove, J., Gianazza, E. and Ghezzi, P. (2002). Identification by redox proteomics of glutathionylated proteins in oxidatively stressed human T lymphocytes. Proc. Natl. Acad. Sci. USA., 99, 3505–3510. Galardo M.N., Riera M.F., Pellizzari E.H., Chemes H.E., Venara M.C., Cigorraga S.B. and Meroni S.B. (2008). Regulation of expression of Sertoli cell glucose transporters 1 and 3 by FSH, IL1 beta, and bFGF at two different time-points in pubertal development. Cell Tissue Res., 334(2), 295-304. García, M.A., Salazar, K., Millán, C., Rodríguez, F., Montecinos, H., Caprile, T., Silva, C., Cortes, C., Reinicke, K., Vera, J.C., Aguayo, L.G., Olate, J., Molina, B. and Nualart, F. (2005). Sodium vitamin C cotransporter SVCT2 is expressed in hypotalamic glial cells. Glia., 50, 32-47. 129 Ghabriel, M.N., Lu, J.J., Hermanis, G., Zhu, C. and Setchell, B.P. (2002). Expression of a blood-brain barrier-specific antigen in the reproductive tract of the male rat. Reproduction, 123, 389-397. Chen H., Pechenino A.S., Liu J., Beattie M.C., Brown T.R. and Zirkin B.R. (2008). Effect of glutathione depletion on Leydig cell steroidogenesis in young and old brown Norway rats. Endocrinology., 9(5), 2612-9. Gladyshev V.N., Jeang K.T. and Stadtman T.C. ( 1996). Selenocysteine, identified as the penultimate C-terminal residue in human T-cell thioredoxin reductase, corresponds to TGA in the human placental gene. Proc. Natl. Acad. Sci. U S A, 93(12), 6146-51. Gilge J.L., Fisher M. and Chai Y.C. (2008). The effect of oxidant and the non-oxidant alteration of cellular thiol concentration on the formation of protein mixed-disulfides in HEK 293 cells. PLoS One, 3(12), e4015. Godoy, A., Ormazabal, V., Moraga-Cid, G., Zuñiga, F.A., Sotomayor, P., Barra, V., Vasquéz, O., Montecinos, V., Mardones, L., Guzmán, C., Villagran, M., Aguayo, L.G., Oñate, S.A., Reyes, A.M., Cárcamo, J.G., Rivas, C.I. and Vera, J.C. (2007). Mechanistic insights and functional determinants of the transport cycle of the ascorbic acid transporter SVCT2. Activation by sodium and absolute dependence on bivalent cations. J. Biol. Chem., 282(1), 615-624. 130 Gravina S.A and Mieyal J.J. (1993). Thioltransferase is a specific glutathionyl mixed disulfide oxidoreductase. Biochemistry, 32(13), 3368-76. Griffith O.W. (1981). The role of glutathione turnover in the apparent renal secretion of cystine. J. Biol. Chem., 256(23),12263-8. Griffith, O.W. and Meister, A. (1979). Glutathione: interorgan translocation, turnover, and metabolism. Proc. Natl. Acad. Sci. U S A., 76(11), 5606-5610. Griswold, M.D. (1998). The central role of Sertoli cells in spermatogenesis. Cell Develop. Biol., 9, 411-416. Grootegoed, J.A., Den Boer, P.J. and Mackenbach, P. (1989). Sertoli cell-germ cell communication. Ann. N. Y. Acad Sci., 564, 232-242. Grunewald, R. W., Weber, I. I., Kinne-Saffran, E. and Kinne, R. K. (1993). Control of sorbitol metabolism in renalk inner medulla of diabetic rats: regulation by substrate, cosubstrate and products of the aldose reductase reaction. Biochim. Biophys. Acta, 1225(1), 39-47. Guaiquil, V. H., Farber, C. M., Golde, D. W. and Vera, J. C. (1997). Efficient transport and accumulation of vitamin C in HL-60 cells depleted of glutathione. J. Biol. Chem., 272(15), 9915-9921. 131 Guaiquil, V. H., Vera, J. C. and Golde, D. W. (2001). Mechanism of vitamin C inhibition of cell death induced by oxidative stress in glutathione-depleted HL-60 cells. J. Biol. Chem., 276(44), 40955-40961. Haendeler, J. (2006). Thioredoxin-1 and posttranslational modifications. Antioxid. Redox Signal., 8, 1723–1728. Himmelreich, U., Drew, K.N., Serianni, A.S. y Kuhel, P.W. (1998). 13C NMR studies of vitamin C transport and its redox cycling in human erythrocytes. Biochemistry 37(20), 7578-88. Hirano T., Yamaguchi Y. and Kasai H. (1997). Inhibition of 8-hydroxyguanine repair in testes after administration of cadmium chloride to GSH-depleted rats. Toxicol. Appl. Pharmacol., 147(1), 9-14. Holash, J.A., Harik, S.I., Perry, G. Stewart, P. A. (1993). Barrier properties of testis microvessels. Proc. Natl. Acad. Sci., USA 90, 11069-11073. Holmgren A. and Björnstedt M. (1995). Thioredoxin and thioredoxin reductase. Methods Enzymol., 252, 199-208. Hubbard M.J. and Cohen P. (1991). Targeting subunits for protein phosphatases. Methods Enzymol., 201,414-27. 132 Ishikawa, T., Casini, A.F. and Nishikimi, M. (1998). Molecular cloning and functional expression of rat liver glutathione-dependent dehydroascorbate reductase. J. Biol. Chem., 273(44), 28708-28712. Jegou, (1993). The Sertoli-germ cell communication network in mammals. Int. Rev. Cytol., 147, 25-96. Jin, X., Guangshu, H., Tianna, H., Houbin, H. and Bin, C. (2005). The multifocal ERG in early detection of diabetic retinopathy. Med. Biol. Soc., 7, 7762-5. Kaneko T., Iuchi Y., Kobayashi T., Fujii T., Saito H., Kurachi H. and Fujii J. (2002). The expression of glutathione reductase in the male reproductive system of rats supports the enzymatic basis of glutathione function in spermatogenesis. Eur. J. Biochem., 269(5), 1570-8. Kiuchi, K., Nishikimi, M. and Yagi, K. (1982). Purification and characterization of Lgulonolactone oxidase from chicken kidney microsomas. Biochemistry., 21(20), 50765082. Kocak I., Dundar M., Hekimgil M. and Okyay P. (2002). Assessment of germ cell apoptosis in cryptorchid rats. Asian J. Androl., 4(3), 183-6. 133 Kokk, K., Veräjänkorva, E., Wu, X. K., Tapfer, H., Poldoja, E. and Pöllänen, P. (2004). Immunohistochemical detection of glucose transporters class I subfamily in the mouse, rat and human testis. Medicina, 40(2), 156-160. Kokk K., Veräjänkorva E., Wu X.K., Tapfer H., Põldoja E., Simovart H.E. and Pöllänen P. (2007). Expression of insulin signaling transmitters and glucose transporters at the protein level in the rat testis. Ann. N. Y. Acad. Sci., 1095, 262-73. Klatt, P., Pineda Molena, E., Perez-Sala, D. and Lamas, S. (2000). Novel application of S-nitrosoglutathione-Sepharose to identify proteins that are potential targets for Snitrosoglutathione-induced mixed-disulphide formation. Biochem J., 349, 567–578. Korgun E.T., Celik-Ozeni, C., Seval, Y., Desoye, G. and Demir, R. (2005). Do glucose transporters have other roles in addition to placental glucose transport during early pregnancy?. Histochem. Cell Biol., 123, 621-629. Lablack, A., Bourdon, V., Defamie, N., Batias, C., Mesnil, M., Fenichel, P., Pointis, G. and Segretain, D. (1998). Ultraestructural and biochemical evidence for gap junction and connexin 43 expression in a clonal Sertoli cell line: a potencial model in the study of junctional complex formation. Cell Tissue Research, 294(2), 279-287. 134 Landino, L.M., Moynihan, K.L., Todd, J.V. and Kennett, K.L. (2004). Modulation of the redox state of tubulin by the glutathione/glutaredoxin reductase system. Biochem. Biophys. Res. Commun., 314, 555–560. Lee, H.M., Oh, B.C., Yang, J.H., Cho, J., Lee, D.S., Hwang, W.S. and Lee, J.R. (2006). Age-dependent expression of immune-privilige and proliferation-related molecules on porcine Sertoli cells. Xenotransplantation, 13(1), 69-74. Lewis S.E., Sterling E.S., Young I.S. and Thompson W. (1997). Comparison of individual antioxidants of sperm and seminal plasma in fertile and infertile men. Fertil. Steril., 67(1),142-7. Liang, W. J., Johnson, D., Ma, L. S. y Jarvis, S. M. (2002). Regulation of the human vitamin C transporters expressed in COS-1 cells by protein kinase C. Am. J. Physiol. Cell Physiol., 283, C1696-C1704. Li T.K. (1975).The glutathione and thiol content of mammalian spermatozoa and seminal plasma. Biol. Reprod., 12(5), 641-6. Li L.Y., Seddon A.P., Meister A. and Risley M.S. (1989). Spermatogenic cell-somatic cell interactions are required for maintenance of spermatogenic cell glutathione. Biol. Reprod., 40(2), 317-31. 135 Lin L.H. and DePhilip R.M. (1996). Differential expression of placental (P)-cadherin in sertoli cells and peritubular myoid cells during postnatal development of the mouse testis. Anat. Rec., 244(2), 155-64. Linster, C.L. and Van Schaftingen, E. (2007). Biosynthesis, recycling and degradation in mammals. FEBS. J., 274(1), 1-22. Listowsky I. (2005). Proposed intracellular regulatory functions of glutathione transferases by recognition and binding to S-glutathiolated proteins. J. Pept. Res., 65(1), 42-6. Lisinski, I., Schürmann, A., Joost, H.G., Cushman, S.W. y Al-Hasani, S.W. (2001). Targeting of GLUT6 (formerly GLUT9) and GLUT8 in rat adipose cells. Biochem. J., 358, 517-522. Lu C. and Steinberger A. (1977). Gamma-glutamyl transpeptidase activity in the developing rat testis. Enzyme localization in isolated cell types. l. Reprod.,17(1), 84-8. Luikenhuis S., Perrone G., Dawes I.W. and Grant C.M. (1998). The yeast Saccharomyces cerevisiae contains two glutaredoxin genes that are required for protection against reactive oxygen species. Mol. Biol. Cell., 9(5):1081-91. 136 Macho A., Hirsch T., Marzo I., Marchetti P., Dallaporta B., Susin S.A., Zamzami N. and Kroemer G. (1997). Glutathione depletion is an early and calcium elevation is a late event of thymocyte apoptosis. J. Immunol., 158(10), 4612-9. Martensson J., Han J., Griffith O.W. and Meister A. (1993). Glutathione ester delays the onset of scurvy in ascorbate-deficient guinea pigs. Proc. Natl. Acad. Sci. U S A., 90(1), 317-21. Martensson J. and Meister A. (1991). Glutathione deficiency decreases tissue ascorbate levels in newborn rats: ascorbate spares glutathione and protects. Proc. Natl. Acad. Sci. U S A., 88(11), 4656-60. Martensson J. and Meister A. (1992). Glutathione deficiency increases hepatic ascorbic acid synthesis in adult mice. Proc. Natl. Acad. Sci. U S A., 89(23), 11566-8. Matsunaga, E. 1981. Genetics of Wilm´s tumor. Hum. Genet. 57, 231-246. May J.M., Mendiratta S., Hill K.E.and Burk R.F. (1997). Reduction of dehydroascorbate to ascorbate by the selenoenzyme thioredoxin reductase. J. Biol. Chem., 272(36), 22607-10. 137 Maulén, N. P., Henríquez, E. A., Kempe, S., Cárcamo, J.G., Schmid-Kotsas, A., Bachem, M., Grünert, A., Bustamante, M.E., Nualart, F. and Vera, J.C. (2003). Upregulation and polarized expression of the sodium-ascorbic acid transporter SVCT1 in post-confluent differentiated CaCo-2 cells. J. Biol. Chem., 278(11), 9035- 9041. Meister, A. (1983). Selective modification of glutathione metabolism. Science., 220, 472477. Meister, A. (1994). Glutathione-Ascorbic Acid Antioxidant System in Animals. J. Biol. Chem., 269, 9397-400. Meister, A. and Anderson, M.E. (1983). Glutathione. Annu. Rev. Biochem., 52, 711-760. Meister, A., and Larsson, A. (1995) in The Metabolic and Molecular Basis of Inherited Disease (Scriver, C. R., Beaudet, A. L., Sly, W. S., and Valle, D., eds) 7th Ed., pp. 1461–1477, McGraw-Hill, Inc., New York. Meister, A. and Tate, S.S. (1976). Glutathione and related gamma-glutamyl compounds: biosynthesis and utilization. Annu. Rev. Biochem., 1976(45), 559–604. Merhi, R.A., Guillaud, L., Delouis, C. and Cotinot, C. (2001). Establishment and characterization of immortalized ovine cell lines. In Vitro Cell. And Develop. Biol., 37(9), 581-588. 138 Mendiratta S., Qu Z.C. and May J.M. Enzyme-dependent ascorbate recycling in human erythrocytes: role of thioredoxin reductase. Free Radic. Biol. Med., 25(2), 221-8. Mitchell, J.B., Russo, Biaglow, J.E. and McPherson, S. (1983). Cellular glutathione depletion by diethyl maléate or buthionine sulfoximine: no effect of glutathione depletion on the oxygen enhancement ratio. Radiation Res. 96, 422-428. Mohr S., Hallak H., de Boitte A., Lapetina E.G. and Brüne B. (1999). Nitric oxide-induced S-glutathionylation and inactivation of glyceraldehyde-3-phosphate dehydrogenase. J. Biol. Chem., 274(14), 9427-30. Montiel E.E., Huidobro C.C. and Castellon E.A. (2003). Glutathione-related enzymes in cell cultures from different regions of human epididymis. Arch. Androl., 49(2), 95-105. Mueckler, M., Caruso, C., Baldwin, S.A., Panico, M., Blench, I., Morris, H.R., Allard, W.J., Lienhard, G.E. and Lodish, H.F. (1985). Sequence and structure of a human glucose transporter. Science, 229(4717), 941-5. Mueckler, M., Kruse, M., Strube, M., Riggs, A.C., Chiu, K.C. and Permutt, M.A. (1994). A mutation in the GLUT2 glucose transporter gene of a diabetic patient abolishes transport activity. J. Biol. Chem., 269(27), 17765-77. 139 Müller J. and Skakkebaek N.E. (1984). Fluctuations in the number of germ cells during the late foetal and early postnatal periods in boys. Acta Endocrinol. (Copenh)., 105(2), 271-4. Mun, H.G., Kim, M.J., Lee, J.H., Kim, H.J., Cheng, Y.H., Chung, Y.B., Kang, J.S., Hwang, Y., Oh, S.H., Kim, J., Hwnag, D.H., Shin, D.H. and Lee, W. J. (2006). Immunohistochemical study of the distribution of sodium-dependent vitamin C transporters in adult rat brain. J. Neuroscience Research, 83, 919-928. Naidu K.A. (2003). Vitamin V in human health and disease is still a mystery? An overview. Nutr. J., 21, 2:7. Ngkeekwong, F.C. and Ng, L.L. (1997). Two distinct uptake mechanisms for ascorbate and dehydroascorbate in human lymphoblasts and their interaction with glucose. Biochem. J., 324, 225-230. Nistal M. and Paniagua R. (1984). Occurrence of primary spermatocytes in the infant and child testis. Andrologia., 16(6), 532-6. Nualart, F.J., Rivas, C.I., Montecinos, V.P., Godoy, A.S., Guaquil, V.H., Golde, D.W., Vera, J.C. (2003). Recycling of vitamin C by a bystander effect. J. Biol. Chem., 278, 10128-10133. 140 Nuttall F.Q. and Gannon M.C. (1993). Allosteric regulation of glycogen synthase in liver. A physiological dilemma. J. Biol. Chem., 268(18), 13286-90. Okamura, M. (1979). Uptake of L-ascorbic acid and L-dehydroascorbic acid by human erythrocytes and HeLa cells. J. of Nutritional Sci. and Vitaminology., 25, 269-279. Padh, H. and Aleo, J. J. (1987). Characterization of the ascorbic acid transport by 3T6 fibroblasts. Biochim. Biophys. Acta, 901, 283-290. Padh, H. (1990). Cellular functions of ascorbic acid. Biochem. Cell. Biol., 68, 1166-1173. Padayatty, S.J., Katz, A., Wang, Y., Eck, P., Kwon, O., Lee, J.H., Chen, S., Corpe, C., Dutta, A., Dutta, S.K. and Levine, M. (2003). Vitamin C as an Antioxidant: Evaluation of Its Role in Disease Prevention. J. Am. Coll. Nutr., 22(1), 18-35. Park, J.L., Loberg, R.D., Duquaine, D., Zhang, H., Deo, B.K., Ardanaz, N., Coyle, J., Atkins, K.B., Schin, M., Charron, M.J., Kumagai, A.K., Pagano, P.J. and Brosius III, F.C. (2005). GLUT4 facilitative glucosa transporter specifically and differencially contributed to agonist induced vascular reactivity in Morse aorta. Arterioscler. Thromb. Vasc. Biol., 25(8), 1596-1602. Pawlowski J.E, Huizinga M. and Penning T.M. (1991). Cloning and sequencing of the cDNA for rat liver 3 alpha-hydroxysteroid/dihydrodiol dehydrogenase. J. Biol. Chem., 266(14), 8820-5. 141 Penning T.M. and Sharp R.B. ( 1987). Prostaglandin dehydrogenase activity of purified rat liver 3 alpha-hydroxysteroid dehydrogenase. Biochem. Biophys. Res. Commun., 148(2), 646-52. Paz, G., Soter, A., Hommonai, Z. T. and Kraicer, P. F. (1977). Human semen analysis: seminal plasma and prostatic fluid compositions and their interlations with sperm quality. Int. J. of Fertil., 22, 140-147. Penning T.M., Mukharji I., Barrows S. and Talalay P. (1994). Purification and properties of a 3 alpha-hydroxysteroid dehydrogenase of rat liver cytosol and its inhibition by antiinflammatory drugs. Biochem. J., 222(3), 601-11. Pineau, C., Dupaix, A. and Jégou, B. (1999). The co-culture of Sertoli cells and germ cells: applications in toxicology. Toxicol. In Vitro, 13, 513-520. Puskas F., Gergely P. Jr, Banki K. and Perl A. (2000). Stimulation of the pentose phosphate pathway and glutathione levels by dehydroascorbate, the oxidized form of vitamin C. FASEB J., 14(10), 1352-61. Prinarakis E., Chantzoura E., Thanos D. and Spyrou G. (2008). S-glutathionylation of IRF3 regulates IRF3-CBP interaction and activation of the IFN beta pathway. EMBO J., 27(6), 865-75. 142 Printen J.A., Brady M.J. and Saltiel A.R. PTG, a protein phosphatase 1-binding protein with a role in glycogen metabolism. Science., 275(5305),1475-8. Qiao H. and May J.M. (2009). Macrophage differentiation increases expression of the ascorbate transporter (SVCT2). Free. Radic. Biol. Med., 46(8), 1221-32. Rajan, D.P., Huang, W., Dutta, B., Devoe, L.D., Leibach, F.H., Ganapathy, V. and Prasad, P. D. (1999). Human placental sodium-dependent vitamin C transporter (SVCT2): molecular cloning and transport function. Biochem. Biophys. Res. Commun., 262, 762-768. Rao A.V. and Shaha C. (2000). Role of glutathione S-transferases in oxidative stressinduced male germ cell apoptosis. Free Radic. Biol. Med., 29(10), 1015-27. Rauch, M. C., Ocampo, M. E., Bohle, J., Amthauer, R., Yañez, A. J., Rodriguez-Gil, J. E., Slebe, J. C., Reyes, J. G. and Concha, I. I. (2006). Hexose transporters GLUT1 and GLUT3 are colocalized with hexokinase I in caveolae microdomains of rat spermatogenic cells. J. Cell Physiol., 207(2), 397-406. Reagan, L.P., Gorovits, N., Hoskin, E.K., Alves, S.E., Katz, E.B., Grillo, C.A., Piroli, G. G., McEwen, B.S. y Charron, M.J. (2001). Localization and regulation of GLUTx1 glucose transporter in the hippocampus of streptozotocin diabetic rats. Proc. Natl. Acad. Sci., 98(5), 2820-2825. 143 Rice G.C, Bump E.A., Shrieve D.C, Lee, W. and Kovacs, M. (1986). Quantitative analysis of cellular glutathione by flow cytometry utilizing monochlorobimane: some applications to radiation and drug resistance in vitro and in vivo. Cancer Res., 46, 61056110. Richman, P.G. and Meister, A. (1975). Regulation of gamma-glutamyl-cysteine synthetase by nonallosteric feedback inhibition by glutathione. J. Biol. Chem., 250(4), 1422-1426. . Rose, R.C. (1988). Transport of ascorbic acid and other water-soluble vitamins. Biochim. Biophys. Acta., 947, 335-366. Rouimi P., Anglade P., Benzekri A., Costet P., Debrauwer L., Pineau T. and Tulliez J. (2001). Purification and characterization of a glutathione S-transferase Omega in pig: evidence for two distinct organ-specific transcripts. Biochem. J., 358(Pt 1), 257-62. Rouzer C.A., Scott W.A., Griffith O.W., Hamill A.L. and Cohn Z.A. (1981). Depletion of glutathione selectively inhibits synthesis of leukotriene C by macrophages. Proc. Natl. Acad. Sci., 78(4), 2532-2536. Rumsey, S.C., Kwon, O., Xu, G.W., Burant, C.F., Simpson, I. and Levine, M. (1997). Glucose transporters isoforms GLUT1 and GLUT3 transport dehydroascorbic acid. J. Biol. Chem., 272, 18982-18989. 144 Russell, L. D. (1980). Sertoli-germ cell interrelations: a review. Gamete Research, 3, 179-202. Sato N., Iwata S., Nakamura K., Hori T., Mori K. and Yodoi J. (1995). Thiol-mediated redox regulation of apoptosis. Possible roles of cellular thiols other than glutathione in T cell apoptosis. J. Immunol., 154(7), 3194-203. Savini, I., Duflot, S. and Avigliano, L. (2000). Dehydroascorbic acid uptake in a human keratinocyte cell line (HaCaT) is glutathione-independent. Biochem. J., 345(Pt 3), 665672. Schmuck E.M., Board P.G., Whitbread A.K., Tetlow N, Cavanaugh J.A., Blackburn A.C. and Masoumi A. (2005). Characterization of the monomethylarsonate reductase and dehydroascorbate reductase activities of Omega class glutathione transferase variants: implications for arsenic metabolism and the age-at-onset of Alzheimer's and Parkinson's diseases. Pharmacogenet Genomics, 15(7), 493-501. Schorah, C.J. (1992). The transport of vitamin C and effects of disease. Proc.Nutr. Society, 51, 189-198. Schorah, C.J., Downing, C., Piripitsi, A., Gallivan, L. Al-Hazaa, A.H., Sanderson, M.J. and Bodenham, A. (1996). Total vitamin C, ascorbic acid, and dehydroascorbic acid concentrations in plasma of critically ill patients. Am. Clin. Nutr., 63, 760-765. 145 Schulz J.B., Lindenau J., Seyfried J. and Dichgans J. (2000). Glutathione, oxidative stress and neurodegeneration. Eur. J. Biochem., 267(16), 4904-11. Sertoli, E. (1865). Dell´esistenza di particolari cellule ramificate nei canalicoli seminiferi del testicolo umano. Morgagni, 7, 31-40 Sharpe, R. M., McKinnell, C., Kivlin, C. and Fisher, J. S. (2003). Proliferation and functional maturation of Sertoli cells, and their relevance to disorders of testis function in adulthood. Reproduction 125, 769-784. Shulman R.G., Bloch G. and Rothman D.L. (1995). In vivo regulation of muscle glycogen synthase and the control of glycogen synthesis. Proc. Natl. Acad. Sci. U S A., 92(19), 8535-42. Review Sies, H. (1991). Role of Reactive Oxygen Species in Biological Processes. Klin. Wochenschr., 69, 965-968. Sies, H. (1999). Glutathione and its role in cellular functions. Free. Rad. Bio. Med., 27, 916-92. Siliprandi, L., Vanni, P., Kessler, M. and Semenza, G. (1979). Na+-dependent, electroneutral L-ascorbate transport across brush border membrana vesicles from guinea pig small intestine. Biochim. Biophys. Acta 552, 129-142. 146 Siushansian, R., Dixon, S.J. and Wilson, J.X. (1996). Osmotic swelling stimulates ascorbate efflux from cerebral astrocytes. J. Neurochem., 66, 1227-1233. Skaper S.D., Fabris M., Ferrari V., Dalle Carbonare M. and Leon A. (1997). Quercetin protects cutaneous tissue-associated cell types including sensory neurons from oxidative stress induced by glutathione depletion: cooperative effects of ascorbic acid. Free Radic. Biol. Med., 22(4), 669-78. Skinner, M.K., McLachan, R.I. y Bremner, W.J. (1989). Stimulation of Sertoli cell inhibin secretion by testicular paracrine factor PmodS. Mol. Cell Endocrinol., 66(2), 239-249. Skinner, M.K., Norton, J.N., Mullaney, B.P., Roselli, P.D., Whaley, P.D. and Anthony, C.T. (1991). Cell-cell interactions and the regulation of testis function. Ann. N. Y. Acad. Sci., 637, 354-363. Slott V.L., Linder R.E., Strader L.F. and Perreault S. (1989). Unilateral depletion of testicular glutathione levels in the rat following intratesticular injections of diethylmaleate and buthionine sulfoximine. Toxicol. App.l Pharmacol., 98(2),369-73. Snoke, J.E. and Bloch, K. (1955). Studies on the mechanism of action of glutathione synthetase. J. Biol. Chem., 213(2), 825-835. 147 Sönmez, M., Türk, G. and Yüce, A. (2005). The effect of ascorbic acid supplementation on sperm quality, lipid peroxidation and testosterone levels of male Wistar rats. Theriogenology, 63, 2063-2072. Spanheimer R.G., Bird T.A. and Peterkofsky B. (1986). Regulation of collagen synthesis and mRNA levels in articular cartilage of scorbutic guinea pigs. Arch. Biochem. Biophys., 246(1), 33-41. Stevens, A. and Lowe, J.S. (1988). Male reproductive system. Histology, 304-321. Gower Medical Publishing, New York. Sykes M.C., Mowbray A.L. and Jo H. (2007). Reversible glutathiolation of caspase-3 by glutaredoxin as a novel redox signaling mechanism in tumor necrosis factor-alphainduced cell death. Circ. Res., 100(2), 152-4. Teaf C.M., Harbison R.D. and Bishop J.B. (1985). Germ-cell mutagenesis and GSH depression in reproductive tissue of the F-344 rat induced by ethyl methanesulfonate. Mutat. Res., 144(2), 93-8. Teaf C.M., Bishop J.B. and Harbison R.D. (1987). Depression of glutathione in male reproductive tissues and potentiation of EMS-induced germ cell mutagenesis by Lbuthionine sulfoximine. Teratog. Carcinog. Mutagen., 7(6), 497-513. 148 Thorens, B., Sarkar, H.K., Kaback, H.R. and Lodish, H.F. (1988). Cloning and functional expression in bacteria of a novel glucose transporter present in liver, instestine, kidney, and beta-pancreatic islet cells. Cell, 55, 281-290. Toggenburger, G., Kessler, M. and Semenza, G. (1982). Phlorizin as a probe of the small-intestinal Na+, D-glucose cotransporter. A model. Biochim. Biophys. Acta, 688, 557-571. Tramer F., Rocco F., Micali F., Sandri G. and Panfili E. (1998). Antioxidant systems in rat epididymal spermatozoa. Bio.l Reprod., 59(4), 753-8. Tsukaguchi, H., Tokui, T., Mackenzie, B., Berger, U.V., Chen, X.Z., Wang, Y., Brubaker, R. F. and Hediger, M. A. (1999). A family of mammalian Na+ dependent L-ascorbic acid transporters. Nature, 399, 70-75. Vera, J.C., Rivas, C.I., Velásquez, F.V., Zhang, R.H., Concha, I.I. and Golde, D.W. (1995). Resolution of the facilitated transport of dehydroascorbic acid from its intracellular accumulation as ascorbic acid. J. Biol. Chem. 270, 23706-23712. Vera, J.C., Rivas, C.I., Fischbarg, J. y Golde, D.W. (1993). Mammalian facilitative hexose transporters mediate the transport of dehydroascorbic acid. Nature, 364, 79-82. 149 Von Zastrow, M., Tritton, T.R. and Castle, J.D. (1986). Exocrine secretion granules contain peptide amidation activity. Proc. Natl. Acad. Sci., USA 83, 3297-3301. Wang, H., Dutta, B., Huang, W., Devoe, L.D., Leibach, F.H., Ganapathy, V. and Prasad, P.D. (1999). Human Na+ dependent vitamin C transporter 1 (hSVCT1): primary structure, functional characteristic and evidence for a non-functional splice variant. Biochim. Biophys. Acta., 1461, 1-9. Wang, Y., Mackenzie, B., Tsukaguchi, H., Weremowicz, S., Morton, C.C. and Hediger, M.A. (2000). Human vitamina C (L-ascorbic acid) transporter SVCT1. Biochem. Biophys. Res. Commun., 267, 488-494. Wang, J., Boja, E.S., Tan, W., Tekle, E., Fales, H.M., English, S., Mieyal, J.J. and Chock, P.B. (2001). Reversible glutathionylation regulates actin polymerization in A431 cells. J. Biol. Chem., 276, 47763–47766. Wang L., Xu J., Ji C., Gu S., Lv Y., Li S., Xu Y., Xie Y. and Mao Y. (2005). Cloning, expression and characterization of human glutathione S-transferase Omega 2.Int. J .Mol. Med., 16(1), 19-27. 150 Ward, N.E., Stewart, J.R., Ioannides, C.G. and O’Brian, C.A. (2000). Oxidant induced Sglutathiolation inactivates protein kinase C-alpha (PKC-alpha): a potential mechanism of PKC isozyme regulation. Biochemistry, 39, 10319–10329. Weinbauer, G.F. and Wessels,J. (1999). Paracrine control of spermatogenesis. Andrologia, 31, 249-262. Welch, R.W., Wang, Y., Crossman, A.J., Park, J.B., Kirk, K.L. and Levine, M. (1995). Accumulation of Vitamin C (Ascorbate) and Its Oxidized Metabolite Dehydroascorbic Acid Occurs by Separate Mechanisms. J. Biol. Chem., 270, 12584-12592. Wells W.W. and Xu D.P. (1994). Dehydroascorbate reduction. J. Bioenerg. Biomembr., 4, 369-377. Wells W.W., Xu D.P., Yang Y.F. and Rocque P.A. (1990) Mammalian thioltransferase (glutaredoxin) and protein disulfide isomerase have dehydroascorbate reductase activity. J. Biol. Chem., 15;265(26),15361-4. Williamson J.M., Boettcher B. and Meister A. (1982). Intracellular cysteine delivery system that protects against toxicity by promoting glutathione synthesis. Proc. Natl. Acad. Sci. U S A, 79(20), 6246-9. 151 Wilson, J.X., Peters, C.E., Sitar, S.M. Daoust, P. and Gelb, A.W. (2000). Glutamate stimulates ascorbate transport by astrocytes. Brain Res., 858, 61-66. Wilson, J.X. (2005). Regulation of vitamin C transport. Annu. Rev. Nutr., 25, 6.1-6.21. Wu, X., Itho, N., Taniguchi, T., Nakanishi, T., Tatsu, Y., Yumoto, N. and Tanaka, K. (2003). Zinc-induced sodium-dependent vitamin C transporter 2 expression: potent roles in osteoblast differentiation. Arch. Biochem. Biophys., 420, 114-120. Wu X., Itoh N., Taniguchi T., Hirano J., Nakanishi T. and Tanaka K. (2004). Stimulation of differentiation in sodium-dependent vitamin C transporter 2 overexpressing MC3T3E1 osteoblasts. Biochem. Biophys. Res. Commun., 317(4), 1159-64. Wu X., Zeng L.H., Taniguchi T. and Xie Q.M. (2007). Activation of PKA and phosphorylation of sodium-dependent vitamin C transporter 2 by prostaglandin E2 promote osteoblast-like differentiation in MC3T3-E1 cells. Cell Death Differ., 14(10), 1792-801. Xing, W. and Sairam, M. (2001). Characterization of regulatory elements of ovine folliclestimulating hormone (FSH) receptor gene: the role of E-box in the regulation of ovine FSHreceptor expression. Biology of Reproduction, 64, 579-589. 152 Xu D.P., Washburn M.P., Sun G.P. and Wells W.W. (1996). Purification and characterization of a glutathione dependent dehydroascorbate reductase from human erythrocytes. Biochem. Biophys. Res. Commun., 221(1), 117-21. Yang Y.F. and Wells W.W. (1991). Catalytic mechanism of thioltransferase J. Biol. Chem., 266(19),12766-71.