La tomografía por emisión de positrones (PET)
Anuncio

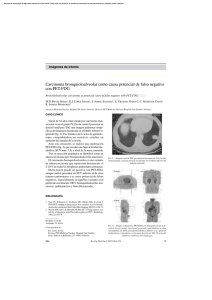
2 La tomografía por emisión de positrones (PET) en oncología ginecológica JOSÉ LUIS CARRERAS DELGADO*, ANTONIO MALDONADO SUÁREZ**, CARLOS TRAMPAL PULIDO*** * Catedrático de Medicina Nuclear. Universidad Complutense. Centro PET Complutense. Madrid. ** Especialista en Medicina Nuclear. Centro PET Complutense. Madrid. *** Residente Medicina Nuclear. Centro PET Complutense. Madrid. INTRODUCCIÓN. BASES DE LA TÉCNICA La Tomografía por Emisión de Positrones (PET) es una técnica de Medicina Nuclear con características claramente diferenciadas respecto a otros métodos de Diagnóstico por la Imagen (1). Utiliza moléculas marcadas con isótopos radiactivos emisores de positrones que, administradas a pacientes in vivo para su posterior detección externa, representa en imágenes la distribución corporal de las mismas. Muestra en imagen un proceso metabólico, muchas veces más precoz que los anatómicos visualizados tanto por la Tomografía Axial Computarizada (TAC) como por la Resonancia Nuclear Magnética (RMN) y Ecografía (US). Hablamos por tanto de Medicina Molecular que, en el campo de la Oncología, está suponiendo hoy en día una auténtica revolución. La información que proporciona la PET es un perfecto complemento a la aportada por otras técnicas de imagen tanto funcionales (SPECT) como morfoanatómicas (RMN, TAC, US, Rx convencional, etc.). Los estudios de PET permiten obtener una visión molecular de la enfermedad, complementaria de la anatomoclínica actual, así como diagnosticar y valorar procesos con escasa o nula repercusión anatomo-estructural. 24 Los isótopos utilizados en PET tienen una serie de peculiaridades ya que son emisores de positrones. Estos, tras un breve recorrido en la materia, se aniquilan al combinarse con un electrón negativo de la misma. La pequeña masa de ambos se convierte en energía electromagnética en forma de un par de fotones emitidos en la misma dirección y sentido contrario que son recogidos por el sistema de detección externo o Cámara de Positrones. Los isótopos más importantes son los siguientes: 15O, 13 N, 11C y 18F. Al poseer una vida media tan corta (2, 10, 20 y 110 minutos respectivamente), ofrecen ventajas desde el punto de vista de protección radiológica, ya que los pacientes son sometidos a dosis de radiación más bajas que con otras técnicas radiológicas. Con estos isótopos, que forman parte de la mayoría de las moléculas predominantes en los medios biológicos, se pueden marcar una multitud de moléculas de interés en investigación y/o diagnóstico clínico sin modificar su comportamiento. Al poder incorporar trazadores a cualquier sustrato biológico, permite estudiar y cuantificar regionalmente fenómenos biológicos, fisiológicos, bioquímicos y farmacológicos de forma inocua. Sin embargo, las moléculas que han demostrado tener un interés clínico constituyen por ahora un número muy reducido, siendo la más importante la Flúor-2-deoxi-D-glucosa marcada con 18 F ( FDG), realizándose el 85% de los estudios clínicos de PET con ella en la actualidad, siendo por tanto el trazador PET más utilizado en la práctica clínica habitual. Se trata de un análogo de la glucosa que, tras ser administrado al paciente por vía intravenosa, es transportada al interior de las células de la mayoría de los tejidos por difusión facilitada de modo similar a la glucosa. En el interior de las células la FDG es fosforilada por acción de la enzima hexoquinasa y la glucoquinasa, pasando a FDG-6-Fosfato. La reacción es reversible por efecto de la enzima glucosa-6-fosfatasa. La acción de la hexoquinasa es potenciada por la hipoxia, frecuente en los tejidos tumorales, estimulando el transporte de FDG a través de la membrana y su fosforilización, en un intento de potenciar el metabolismo glicolítico, en especial el anaeróbico, en detrimento de otros sustratos más consumidores de oxígeno. La FDG-6-Fosfato ya no sigue a partir de aquí las vías metabólicas de la glucosa, quedando atrapada en el interior de las células. En el momento de realizar la exploración, 45-60 minutos tras la inyección, la mayor parte de la radiación detectada proviene de los tejidos con bajas concentraciones de glucosa-6-fosfatasa como son el cerebro y el miocardio. Otros tejidos como el músculo, hígado, riñón, piel e intestino, con más altas concentraciones de esta enzima, en el momento de la obtención de las imágenes PET acumulan pequeñas cantidades de FDG produciendo en la imagen un bajo nivel de actividad de fondo. Recientemente (2) se ha encontrado una estrecha correlación entre la expresión del transportador de glucosa en la membrana celular GLUT-1, medida por métodos inmunohistoquímicos, y la captación de 3H-FDG, medida por autorradiografía en un modelo de tumor mamario murino. Zincke et al (3) realizaron un estudio para comparar los hallazgos histológicos en el cáncer de mama con el grado de captación de FDG, mediante la realización de un estudio PET-FDG. Se practicó estudio histológico sobre 60 lesiones mamarias malignas en 40 mujeres, analizando diferentes parámetros: porcentaje de células tumorales, densidad de vascularización, presencia de linfocitos, fibrosis, necrosis o áreas quísticas, grado de proliferación celular, tasa mitótica, presencia de receptores estrogénicos y de progesterona, y el inhibidor del plasminógeno activado (PAI-1). La expresión de la proteína transportadora de glucosa (Glut-1) fue valorada por inmunohistoquímica. Existió una correlación significativa entre el grado de captación de FDG y el grado de proliferación celular, tasa mitótica y niveles de PAI-1. Sin embargo, no existió correlación con la expresión de Glut-1 o el porcentaje de células tumorales. Concluyeron los autores que la captación de FDG en el cáncer de mama podría proporcionar información pronóstica. La presencia de fibrosis, necrosis, leucocitos o áreas quísticas en el seno tumoral no repre- 25 Figura 1. Nódulo de mama derecha en 1/4 súperoexterno, de alto grado de malignidad (SUV 11.5; 1.5 cm diámetro) en estudio PET-FDG. Imágenes sospechosas en mamografía y ecografía. Confirmación histológica, sin evidencia de afectación axilar. 26 Figura 2. Tumor de mama derecha que en PET-FDG aparece como maligno de bajo grado (SUV 2.3; 1.5 cm). Estudio mamográfico sospechoso y ecografía normal. Se confirman los hallazgos PETFDG mediante anatomía patológica. 27 sentó efecto significativo en la captación de FDG. La determinación de la expresión de la proteína transportadora de glucosa Glut-1 tampoco se correlacionó con la intensidad de captación de la FDG. Uno de los escasos defectos que se le puede achacar a la técnica PET es la poca especificidad que posee la valoración únicamente visual de las imágenes. Esto es fácilmente subsanable en la actualidad, ya que al estudio meramente cualitativo se le añade en todos los casos un índice semicuantitativo que mide el metabolismo de la glucosa en las lesiones tumorales. Recibe el nombre de SUV (Standardized Uptake Value ) que en español significa Valor de Captación Estándar, y está calculado en base a la captación de FDG por parte del tumor en relación con el peso del paciente y la dosis de radiofármaco administrada. El umbral más utilizado de SUV para diferenciar entre lesión benigna y maligna se sitúa entre 2.5-3, según la mayoría de los autores. UTILIDAD DE LA PET-FDG EN EL CÁNCER DE MAMA Detección de lesiones primarias (Fig. 1-4) Recientemente Bassa y cols (4), en un estudio en el que incluyeron 16 pacientes, detectaron la totalidad de las lesiones primarias aunque se trataba de casos de carcinoma de mama localmente avanzado. Esta sensibilidad del 100%, desciende al 75% cuando se trata de detectar la existencia de tumor residual. Otros autores (5) como Avril y cols, en 51 pacientes con lesiones mamarias sospechosas, encuentran sensibilidades comprendidas entre 68-94% y especificidad entre 84-97% para el análisis visual y en dependencia del criterio utilizado en la interpretación de la imagen. El análisis cuantitativo usando el SUV y curvas ROC mostraron que el punto óptimo se situaba en una sensibilidad del 75% y una especificidad del 100% para un umbral de SUV de 2.5. Cuando al SUV se añade otro método que permite obtener una cuantificación más precisa como es la corrección del efecto de volumen parcial (CEVP), la sensibilidad ascendió al 92% y la especificidad al 97%. Varios grupos han analizado también estos aspectos metodológicos. Así, en un estudio prospectivo (6) sobre 84 pacientes, el grupo de Avril evalúa la eficacia diagnóstica de la PET-FDG en la detección de tumores malignos de mama. A todos los pacientes se les practicó estudio PET-FDG, confirmándose histopatológicamente 111 tumores de mama. Observaron en las curvas ROC que para un SUV de 2.1 la sensibilidad era de 62% por una especificidad del 91%. Tras aplicar la CEVP, la sensibilidad aumentó a un 78% con una especificidad del 90%. Vieron que la sensibilidad de la PET se veía influenciada por el tamaño del tumor, ya que eran difícil de detectar aquellos inferiores a 1 cm. Concluyeron que la PET - FDG puede ser de gran utilidad ante estudios diagnósticos convencionales dudosos en el estadiaje de tumores de mama > 1 cm con una alta eficacia diagnóstica. Este mismo grupo (7) evaluó varios criterios cuantitativos en la valoración de las imágenes PET-FDG. El estudio que llevaron a cabo fue de carácter prospectivo sobre 73 pacientes con mamografía sospechosa o nódulos mamarios palpables analizados mediante biopsia. Se observaron un total de 97 tumores de mama mediante histología, 46 benignos y 51 malignos. Con el fin de diferenciar entre lesiones benignas de malignas utilizaron curvas ROC para el SUV. Tuvieron en cuenta circunstancias tales como la glucemia o el efecto parcial de volumen. Encontraron de una eficacia diagnóstica estos métodos cuantitativos para diferenciar entre lesión benigna de maligna en la mama. Recomiendan unir esta información al análisis visual para de esa forma disminuir la variabilidad inter-observador de la prueba. 28 Un resumen de los resultados de los diferentes grupos de trabajo puede observarse en la Tabla I. TABLA I Utilidad de la PET-FDG en la detección de lesiones primarias en cáncer de mama. Resultados de los diferentes grupos Autor Año Pacientes Bassa 1996 16 100 100 Avril 1996 51 92 97 Avril 1997 84 78 90 Utech 1996 124 100 100 Total 275 Sensibilidad 92,5 Especificidad 96,7 Valoración de la afectación axilar (Tabla II) Crippa y cols (8,9) estudiaron 72 pacientes con cáncer de mama. La PET-FDG realizó un correcto estadiaje en 64 pacientes, existiendo 4 falsos positivos y 4 falsos negativos. La sensibilidad, especificidad y precisión para detectar metástasis axilares fue del 85, 91 y 89% respectivamente. En los diferentes estadios (clasificación TNM) se obtuvieron los siguientes resultados: N0 = sensibilidad del 70%, especificidad 92%, precisión 86%, N1a= sensibilidad 85.5%, especificidad 100%, precisión 95%; N1b-2 = sensibilidad 100%, especificidad 67%, precisión 87%. Por tanto la PET-FDG presentó una precisión diagnóstica en la detección de metástasis axilares del 89%, siendo muy alta (95%) en el caso de pacientes con un estadio N1a, lo cual resulta de especial interés. Apuntan datos interesantes con respecto al SUV. Observaron que la media en aquellos tumores con afectación axilar era superior al SUV de los prima- TABLA II Utilidad de la PET-FDG en la detección de afectación ganglionar axilar en el carcinoma de mama. Resultados de los diferentes grupos de estudio Autor Año Pacientes Crippa 1997 72 85 100 Adler 1997 50 95 97 Utech 1996 124 100 90 Romer 1997 65 79 100 Avril 1996 51 79 96,7 Avril 1997 75 81 90,5 Crippa 1997 66 84 85 85,2 90,3 Total 503 Sensibilidad Especificidad CONTINUAR