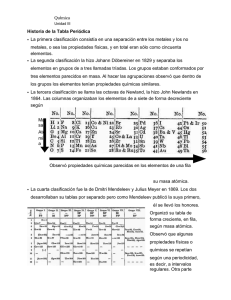
sistema periodico - Practicas de quimica
Anuncio

SISTEMA PERIODICO Teoría y práctica 6 Ju. Daniel De la cruz Villanueva QUÍMICA PREUNIVERSITARIA 2014 QUÍMICA – NIVEL INTERMEDIO PREINGENIERIA Introducción En los inicios del siglo XIX, cuando habían sido descubiertos 55 elementos, los químicos comenzaron a observar e interesarse en las similitudes que existían en el comportamiento de algunos de ellos y a mediados de siglo tuvieron lugar los primeros intentos por clasificarlos. La clasificación de los elementos que hoy conocemos se originó en los trabajos del científico alemán Lothar Meyer y fundamentalmente del ruso Dimitri I. Mendeleev, quienes de manera independiente, propusieron en 1869 las primeras versiones de la tabla periódica. Mendeleev tuvo además la genialidad de dejar espacios en su tabla para elementos que aún no habían sido descubiertos y de predecir sus propiedades. Llegó incluso a plantear que las propiedades de los elementos y de los compuestos que estos forman se repiten periódicamente con el incremento de sus masas atómicas, lo que fue el basamento para la formulación, a principios del siglo XX, de la ley periódica. A la luz de nuestro conocimiento actual acerca de la estructura atómica la ley periódica se plantea como: las propiedades de los elementos son funciones periódicas de sus números atómicos debido a la repetición, cada cierto número de elementos, de estructuras electrónicas semejantes. La tabla periódica no es más que la representación gráfica de la ley periódica. En la tabla periódica (TP) los elementos químicos los ordenamos en orden creciente en numero atómico (numero de protones), y vamos colocando los elementos que tienen las mismas propiedades químicas unos debajo de otros obtendremos la Tabla Periódica, esto que parece tan sencillo no lo ha sido, y para llegar a la forma actual de la Tabla Periódica, han trabajado muchos científicos y durante mucho tiempo. Elemento químico es una sustancia que está formada por átomos con el mismo numero atómico (numero de protones), por ejemplo todos los átomos de Oxigeno tienen 8 protones aunque hay distintos isótopos que se diferencian en el numero de neutrones. La TP esta formada por 114 elementos, de estos solo 92 son naturales, los otros han sido fabricados en laboratorio. En la TP podemos hacer una clasificación de los elementos: metales, no metales y metaloides. Los no metales son: H, B, C, N, O, F, P, S, Cl, Se, Br, I, At, y los gases nobles He, Ne, Ar, Kr, Xe, y Rn. MCQ - 1 QUÍMICA – NIVEL INTERMEDIO PREINGENIERIA Los elementos metálicos son el resto y los metaloides (o semimetales) son los que están en el límite de los dos grupos y a veces tienen propiedades metálicas y otras de los no metales desde su comportamiento FÍSICO, y son: Si, Ge, As, Sb, Te. Los elementos los podemos organizar en grupos, en los cuales los elementos tienen las mismas propiedades químicas, aproximadamente. Así tenemos el grupo de los alcalinos: Li, Na, K, Rb, Cs, y Fr (para recordarlos podemos emplear la nemotecnia: LiNa – Kasi – Roba – Casa – Francesa), o el de los halógenos: F, Cl, Br, I, y At (nemotecnia: Fuiste Clara Bronceada I Atractiva). ESTRUCTURA ELECTRONICA DE LA ÚLTIMA CAPA, UTILIZANDO LA TP Todos los elementos que están en la misma columna tienen la misma configuración en la última capa. Por lo que bajo un punto de vista electrónico los elementos de la Tabla Periódica los podemos dividir en 4 bloques mediante el empleo de la mecánica cuántica: • Los elementos s, son los elementos que sus últimos electrones se alojan en un orbital s. Y son la columna del H (s1, tiene un solo electrón en la ultima capa) y los de la columna del Be (s2, tienen 2 electrones en la ultima capa) • Los elementos p, son los elementos en que los últimos electrones se alojan en los orbitales p, y son: 1. los de la columna del B (s2 p1, tienen entonces 2+1, tres electrones en la ultima capa) 2. Los de la columna del C (s2 p2, tienen entonces 2+2, cuatro electrones en la ultima capa) 3. Los de la columna del N (s2 p3, tienen 2+3, cinco electrones en la ultima capa) 4. Los de la columna del O (s2 p4, tienen 2+4, seis electrones en la ultima capa) 5. Los de la columna del F (s2 p5, tienen 2+5, siete electrones en la ultima capa) 6. Los de la columna del Ne (s2 p6, tienen 2+6, ocho electrones en la ultima capa) • Los elementos d que van del Sc (d1) al Zn (d10) • Y los elementos f que están fuera de la TP que son los Lantanidos y los Actinidos. IONES ESTABLES. ANIONES Y CATIONES. Un ión es un átomo o un grupo de átomos cargado eléctricamente, por lo que habrá iones negativos, que llamaremos aniones e iones positivos, cationes. Los elementos de los grupos s y p, tienen la tendencia natural a adquirir la estructura electrónica de un gas noble, en su ultima capa, a perder electrones (los metales) o a ganar electrones (los no MCQ - 2 QUÍMICA – NIVEL INTERMEDIO PREINGENIERIA metales) para conseguir tener en su ultima capa 8 electrones. Y cuando alcanzan estos 8 electrones tienen mayor estabilidad. Esta regla se llama la regla del octeto. Los metales del grupo IA (Li, Na, K, Rb, Cs, Fr, todos ellos s1) perderán 1 electrón y como en la capa anterior tienen 8 electrones se estabilizaran, al perder un electrón pierden una carga negativa y como inicialmente son neutros (igual carga positiva que negativa) quedaran cargados con una carga positiva. Ej. Na0 1e- + Na+. Los metales del grupo IIA (todos ellos s2) perderán 2 electrones y quedaran cargados con 2 cargas positivas. Ej. 2 e- + Mg2+. Mg0 Los no metales del grupo VIIA (F, Cl, Br, I todos ellos s2 p5) ganarán 1 electrón para estabilizarse y por tanto quedaran con una carga negativa. Ej. Cl0 + 1e - Cl-. Los no metales del grupo VIA (todos ellos s2 p4) ganarán 2 electrones para estabilizarse y quedaran con dos cargas negativas. Ej. S0 + 2e- S2-. Los elementos de los grupos VA, IVA y IIIA deberían ganar 3, 4 y 5 electrones, respectivamente, pero esto es muy difícil, por consideraciones que no se pueden tratarse en este curso, y estos elementos no formaran, generalmente, ni aniones estables ni cationes estables. Los gases nobles tienen ya una configuración s2 p6, por lo que tienen 8 electrones en su ultima capa, y no forman aniones ni cationes a condiciones ordinarias. Son estables. El Helio es de todos ellos el que tiene por configuración 1s2. EJERCICIOS: 1º Completa la tabla: Elemento p+ e– A 20 22 no B 60 40 C D 18 E 36 Z Masa atómica (MA) 35 85 Grupo Periodo Familia 54 44 2º Utilizando la Tabla Periódica calcula la configuración electrónica de la ultima capa de los siguientes elementos: a) K, b) Cl, c) Se d) Mg, e) B, e) Ne, f) C, g) P 3º Calcula los iones estables de los siguientes elementos químicos: Mg, Br, S, Li, Ca, F, P, y Ne MCQ - 3 QUÍMICA – NIVEL INTERMEDIO PREINGENIERIA Los Elementos químicos Existe más de un centenar de diferentes elementos químicos. Estos elementos tienen en común el estar constituidos por una mínima unidad: el átomo. Sin embargo, los átomos de un elemento se diferencian de los átomos de otro elemento en el número de protones que poseen, por lo cual: Habrá tantos tipos de elementos químicos como átomos existan. Por lo tanto, podemos definir de manera más completo un elemento químico. ELEMENTO QUÍMICO es aquella sustancia formada por átomos que poseen la misma cantidad de protones y que no puede ser descompuesta en otras sustancias más simples. Símbolos químicos y tabla periódica Cada uno de los más de cien elementos químicos identificados recibe un nombre, al que se le asigno un símbolo. El símbolo de un elemento químico corresponde a uno abreviatura latina del nombre del elemento, que puede constar de una o dos letras. Por ejemplo, el oxigeno, gas que permite la vida de la mayoría de los seres vivos, tiene como símbolo la letra O, mientras que uno de los metales más valiosos, el oro, se identificó por las letras Au. MCQ - 4 QUÍMICA – NIVEL INTERMEDIO PREINGENIERIA Uno de los elementos químicos que forma parte de la materia presente en todos los seres vivos es el carbono y se representa por la letra C. Los químicos han analizado las características de los diferentes elementos y han observado que cada uno presenta propiedades específicas. Es así como, la mayoría de ellos se encuentra en estado sólido, 11 en estado gaseoso y sólo 2 en estado líquido a 25oC. Basándose en las propiedades químicas comunes, los elementos químicos han sido ordenados en una tabla, con filas y columnas, que recibe el nombre como sabemos de tabla periódica de los elementos. La existencia de esta tabla se debe o los aportes realizados por el químico ruso Dimitrí Ivánovich Mendeléíev, quien a mediados del siglo pasado, fue el primero en clasificar los elementos conocidos de acuerdo a su masa y los ordenó en forma progresiva. Ciertamente la tabla que usamos hoy es más completa que la de Mendeléíev, sin embargo, su aporte facilitó la tarea de organizar y clasificar los diferentes elementos que componen la materia. Elementos importantes Varios elementos químicos tienen gran importancia para los seres vivos. Por ejemplo: - el oxigeno (O) posibilita la vida en nuestro planeta - el calcio (Ca) da solidez y resistencia a nuestros huesos - el carbono (C) está presente en todas nuestras células - el sodio (Na),el potasio (K) y el cloro (Cl)son indispensables para el funcionamiento de las células nerviosas. La mayoría de los elementos químicos que son de importancia para los seres vivos, se requieren en cantidades pequeñísimas, sin embargo, su ausencia puede generar enfermedades que alteran el funcionamiento de todo el organismo. Esto ocurre con el yodo (I). Cuando el organismo no logra obtener los niveles de yodo necesarios, se produce un crecimiento anormal de la glándula "tiroides", que se manifiesta por un abultamiento en el cuello. Así pues vemos que algo tan simple como un elemento, puede determinar la alteración de algo tan complejo como un ser vivo. MCQ - 5 QUÍMICA – NIVEL INTERMEDIO PREINGENIERIA Desarrollo de la tabla periódica moderna Características de la Clasificación Periódica Moderna de los Elementos Se han hechos diversas modificaciones a la tabla periódica desde los tiempos de Mendeleiev. Entre las más importantes debe de mencionarse la ordenación de los elementos de acuerdo con el incremento del número atómico, en lugar del peso atómico y la estructuración de conjuntos de elementos (bloques) relacionados con las configuraciones electrónicas y en el modelo cuántico del átomo. Por lo general, la tabla periódica cuántica incluye: símbolo del elemento, número atómico, masa atómica, valores de los números cuánticos (n, l. m y s), clase, período, familia, número de electrones en los subniveles y los orbitales que contienen uno o dos electrones. Estructura En la tabla cuántica los elementos se clasifican en orden creciente de sus números atómicos y en función de sus configuraciones electrónicas. Los elementos se encuentran agrupados en cuatro clases según la posición de su electrón diferencial: el bloque s, el p, el d y el f, que contienen elementos con electrón diferencial localizado en orbital s, p, d o f, respectivamente. La clase se indica en la parte inferior de los conjuntos. Los elementos se encuentran también en tres tipos que se indican en la parte inferior de las clases: 1. Elementos representativos (A). Aquéllos con electrón diferencial en orbital de subnivel s o p. 2. Elementos de transición (B) con electrón diferencial en orbital de subnivel d. 3. Elementos tierras raras o lantánidos o actínidos con electrón diferencial en f; pero que se encuentran incluidos en la zona d (transición interna, Grupo IIIB, según IUPAC, grupo 3) La tabla periódica cuántica está integrada por ocho períodos, cuyo valor se indica en la columna de la extrema izquierda de la tabla. Período Número de elementos 1o 2 2o 8 3o 8 4o 18 MCQ - 6 QUÍMICA – NIVEL INTERMEDIO PREINGENIERIA 5o 18 6 o 32 7 o Está incompleto pero cuando se llena tendrá 32 Período es un conjunto de elementos que tienen el mismo valor de la suma n + 1 (ene + ele = contenido de energía), para su último electrón (electrón diferencial). Por ejemplo, el período 4o está integrado por los elementos Al, Si, P, S, Cl, Ar, K y Ca, todos ellos tienen el mismo valor de la suma n + 1 para su electrón diferencial, que en este caso es igual a cuatro. Elemento Al Si P S Cl Ar K Ca Electrón diferencial 3p 3p 3p 3p 3p 3p 4s 4s En n + 1 3+1 3+1 3+1 3+1 3+1 3+1 4+0 4+0 Suma 4 4 4 4 4 4 4 4 La clasificación periódica cuántica consta de 32 familias cuyo valor aparece en la parte inferior de las columnas. Existen 32 familias debido a que hay dos electrones en s, seis en p, diez en d y catorce en f. Familia es un conjunto de elementos que tienen el mismo número de electrones en el nivel donde se encuentra colocado en electrón diferencial. Clasificación periódica de los elementos Después de conocer diferentes clasificaciones que existen sobre las distintas sustancias, resulta de gran interés y de singular importancia para una buena NOMENCLATURA de los compuestos, el conocer ciertas características de los elementos de acuerdo al acomodo que guardan en la TABLA PERIODICA. El ordenamiento de los elementos en la tabla periódica no fue hecho al azar, sino más bien es el fruto de un gran número de intentos por agruparlos en función de sus propiedades y el orden seguido es en base a un NUMERO ATOMICO que viene siendo la cantidad de protones existentes en el NUCLEO del átomo. Tal vez la tabla periódica que resulte más común , en esta podemos apreciar 7 renglones horizontales llamados PERIODOS, además de 18 columnas verticales llamadas GRUPOS. MCQ - 7 QUÍMICA – NIVEL INTERMEDIO PREINGENIERIA El nombre de TABLA PERIODICA la recibe precisamente porque cada cierto número de elementos las propiedades químicas se repiten; quedando colocados uno bajo el otro, todos aquellos elementos, que presentan propiedades con similitud para formarse así un GRUPO. Los PERIODOS están formados por un conjunto de elementos que teniendo propiedades químicas diferentes, mantienen en común el presentar igual número de niveles con electrones en su envoltura, correspondiendo el número de PERIODO al total de niveles. Las propiedades químicas de los elementos dependen de la distribución electrónica en los diferentes niveles, por ello; todos aquellos que tienen igual número de electrones en su último nivel presentan propiedades químicas similares, correspondiendo el número de período en que se encuentra ubicado, al del último nivel con electrones y el número de grupo guarda relación con la cantidad de electrones en la última capa. La tabla periódica puede dividirse en diversas formas según las propiedades que se deseen estudiar, de tal suerte que se agrupan conjuntos de elementos con características comunes. METALES, NO METALES Y METALOIDES Aún antes de establecerse la tabla periódica; ya el creador de la SIMBOLOGIA de los elementos J. J. BERZELIUS publicó en 1814 una clasificación sistemática en donde agrupaba dos tipos: los METALES y los NO METALES. Las características de los elementos METALICOS son: • Conducen con facilidad el calor y la electricidad. • Presentan brillo metálico • Generalmente pueden ser laminados o estirados formando alambres, propiedades que se conocen como MALEABILIDAD y DUCTILIDAD. • Por lo regular a temperatura ambiente son sólidos excepto Hg, Ga, Cs y Fr. • Al combinarse con NO METALES ceden electrones por lo que adquieren cargas positivas (CATIONES). MCQ - 8 QUÍMICA – NIVEL INTERMEDIO PREINGENIERIA Los NO METALES presentan las siguientes características: • Son malos conductores del calor y la electricidad. • No son maleables ni dúctiles. • Reciben electrones al combinarse con los METALES adquiriendo así cargas NEGATIVAS (ANIONES). Algunos elementos suelen comportarse según las condiciones como metales o como no metales; a estos se les conoce como METALOIDES. En la clasificación periódica de DIECIOCHO columnas (según IUPAC) podemos apreciar a estos grupos de elementos claramente delimitados, lo cual nos parece razonable si pensamos que las características de ellos dependen de la distribución electrónica, entre más próximos estén los elementos, mayor semejanza tendrán en sus propiedades y esto se debe a que la distribución electrónica presenta también una gran semejanza. Si admitimos que las propiedades químicas de los elementos dependen de la ubicación de los electrones en su envoltura, tenemos una CLASIFICACION DE ELEMENTOS EN FUNCION DE SU DISTRIBUCION ELECTRONICA. En esta clasificación los elementos se agruparon en cuatro bloques según el tipo de orbital atómico en que se ubique su electrón diferencial. Otra clasificación que resulta importante conocer y es de gran utilidad en la NOMENCLATURA es la que nos brinda información sobre la capacidad de combinación de los elementos o sea su VALENCIA así como su ESTADO o NUMERO DE OXIDACION (EO). Existe una clasificación TRADICIONAL que ubica a los elementos representativos en ocho grupos identificados como A y a los de transición en B. Los elementos representativos son conocidos así porque el número de grupos representa la cantidad de electrones en su CAPA DE VALENCIA o sea el ULTIMO NIVEL y la cantidad de electrones en esa capa nos indica la valencia máxima que el elemento puede presentar. La VALENCIA de un elemento se refiere a la capacidad de combinación que presenta; en el caso de los NO METALES se relaciona con el número de átomos de hidrógeno con que se puede enlazar y en los METALES con cuántos átomos de cloro se une. MCQ - 9 QUÍMICA – NIVEL INTERMEDIO PREINGENIERIA Ejemplos: El Calcio se puede unir a dos átomos de Cloro por lo que su valencia es dos. CaCl2 El Oxígeno forma agua uniéndose a dos hidrógenos, su valencia también será dos. H2O El Nitrógeno se une a tres Hidrógenos en la formación de Amoníaco, su valencia es tres. NH3 Propiedades atómicas y variaciones periódicas: carga nuclear efectiva, radio atómico, radio iónico, energía de ionización, afinidad electrónica, electronegatividad. La carga nuclear efectiva, es la fuerza con la cual el núcleo positivo atrae a los electrones de la capa de valencia. Está en función inversa a la distancia de los electrones y en razón directa al número de protones. Por lo tanto, a mayor radio atómico menor carga nuclear, y a menor radio atómico mayor atracción: Variación de la carga nuclear en grupos y periodos de la tabla. Para los elementos de un grupo de la tabla, la carga nuclear disminuye de arriba hacia abajo y aumenta a largo de un período de izquierda a derecha. Tamaño Atómico. Con frecuencia pensamos que los átomos son objetos esféricos con límites bien definidos. Sin embargo, una conclusión que podemos obtener de la mecánica cuántica, es que el átomo no tiene límites claramente definidos que determinen su tamaño. La forma en el que un átomo reacciona químicamente depende de muchos factores, entre los que podemos mencionar la carga nuclear, el tamaño efectivo del átomo, la configuración electrónica, etc. La carga nuclear de un átomo aumenta al aumentar el número atómico, debido a que el número de protones se incrementa; sin embargo, los electrones de valencia se encuentran protegidos de la acción del núcleo por los electrones de los niveles interiores que se encuentran más cerca de este. La carga nuclear efectiva que siente un electrón exterior (electrón de valencia) es la parte de la carga del núcleo que influye sobre él. La carga nuclear efectiva no es igual a la carga núcleo, porque los electrones de los niveles interiores contrarrestan (efecto pantalla) o protegen parte de la carga del núcleo. MCQ - 10 QUÍMICA – NIVEL INTERMEDIO PREINGENIERIA En 1870, Lothar Meyer fue el primero en observar la variación periódica del tamaño de los átomos y calculó el volumen atómico de los elementos dividiendo el peso atómico entre la densidad. El volumen atómico calculado de esta manera es únicamente una indicación cualitativa del tamaño del átomo, porque la densidad de un elemento depende de su temperatura y su estructura cristalina. Aquellos elementos que presentan diferentes formas cristalinas alotrópicas tendrán, evidentemente, más de un volumen atómico. Sin embargo, el tamaño atómico es un concepto muy útil que nos puede ayudar a comprender el comportamiento químico de los elementos RADIO ATÓMICO (RA) Se puede definir como la mitad de la distancia entre los núcleos de dos átomos iguales que están unidos entre sí. Dentro de un grupo los radios aumentan al aumentar el número atómico, porque los electrones se colocan en niveles cada vez más alejados del núcleo y porque la carga negativa de los otros electrones los repele. Dentro de un periodo los radios disminuyen al aumentar el número atómico. El nuevo electrón que diferencia a un átomo del anterior se sitúa en el mismo nivel o en uno más próximo al núcleo, pero la carga positiva del núcleo va aumentando, produciéndose más atracción sobre los electrones y haciendo que el volumen disminuya. Los menores valores del radio aparecen en los elementos de transición porque el electrón diferenciador se va metiendo en un orbital más interno (d o f). RADIO IÓNICO (RI) Es el radio de un átomo que ha ganado o perdido electrones respecto a los que temía si fuera neutro. Estos radios siguen las mismas variaciones que los radios atómicos: pero no tienen los mismos valores. Los iones positivos tienen un radio menor que el átomo neutro, porque al perderse electrones, los que quedan podrán disminuir sus distancias al existir menos repulsiones. Esto es más notable con los metales alcalinos si pierden un electrón o con los alcalinotérreos si pierden dos, porque ello implica que pierden un nivel de energía con respecto al átomo neutro. MCQ - 11 QUÍMICA – NIVEL INTERMEDIO PREINGENIERIA Los iones negativos son más grandes que los átomos neutros correspondientes porque los electrones capturados están sometidos a repulsiones por parte de los electrones que va estaban en el último nivel. Cuando varias especies (iónicas o neutras) tienen los mismos electrones, para comparar su tamaño hay que mirar la carga nuclear. Cuanto mayor sea ésta, mayor será la fuerza electrostática y menor será el radio. Energía de Ionización (EI= PI) La energía de ionización, también llamada potencial de ionización, es la energía que requiere un átomo gaseoso en estado basal para perder totalmente un electrón. La energía de ionización aumenta para los elementos de un período de izquierda a derecha y disminuye para los elementos de un grupo de arriba hacia abajo. Lo anterior se origina por interrelación entre el efecto pantalla, el tamaño del átomo y la carga del núcleo: SOBRE LA ENERGÍA DE IONIZACIÓN Es la energía necesaria para arrancar un electrón de un átomo en estado gaseoso. Se arrancará primero el electrón menos atraído por el núcleo. Si se pueden arrancar más de uno, se habla de primera.. segunda, tercera ?,. . energía de ionización (a medida que se saca mas electrones la EI aumenta). Dentro de un grupo la energía de ionización disminuye al aumentar el número atómico porque el último electrón se coloca en orbitales cada vez más alejados del núcleo y la atracción electrostática disminuye con el cuadrado de la distancia. En un periodo aumenta con el número atómico, debido a que al aumentar la carga nuclear, sin aumentar los niveles, la atracción sobre los electrones es mayor. MCQ - 12 QUÍMICA – NIVEL INTERMEDIO PREINGENIERIA Los elementos con menor energía de ionización dentro de cada periodo son los metales alcalinos. La energía de ionización es máxima para los gases nobles ya que estos elementos poseen una estructura estable y no tienen tendencia a ceder electrones. Existen algunas irregularidades correspondientes a átomos con subniveles llenos o semillenos: La segunda energía de ionización es siempre mayor que la primera porque el catión formado ha disminuido Afinidad Electrónica (AE = EA) La afinidad electrónica es la cantidad de energía que se desprende o absorbe por la adición de un electrón al átomo neutro gaseoso de un elemento, para producir un ión negativo. En general, la afinidad electrónica es mayor para los no-metales que para los metales. Esta medida de la facilidad con que los elementos captan electrones, es consecuencia de la configuración electrónica, siendo mucho mayor para los elementos situados cerca de los gases nobles. SOBRE LA AFINIDAD ELECTRÓNICA Es la energía que se desprende cuando un átomo en estado gaseoso capta un electrón. Los valores de la afinidad electrónica tienen, en general, signo negativo, indicando que es una energía desprendida. Si el signo es positivo es que el elemento no tiene ninguna tendencia a captar un electrón, ya que captar un electrón resulta energéticamente desfavorable. Es una magnitud difícil de calcular, no se conocen el valor de la afinidad electrónica de todos los elementos y no tiene una variación tan regular como la energía de ionización. MCQ - 13 QUÍMICA – NIVEL INTERMEDIO PREINGENIERIA En general, presenta variaciones similares a la energía de ionización: si un átomo tiene una energía de ionización baja es que cede fácilmente electrones y no tendrá tendencia a ganarlos, por lo que la afinidad electrónica (en valor absoluto) será baja; sin embargo, si un átomo tiene una energía de ionización elevada es que no tiene tendencia a perder electrones y si la tendrá a ganarlos, por lo que poseerá una afinidad electrónica elevada (en valor absoluto). Por lo tanto, en valor absoluto, la afinidad electrónica dentro de un grupo disminuye a medida que aumenta el número atómico, ya que aumenta el tamaño y el electrón que se mete está menos atraído por el núcleo. En un periodo aumenta con el número atómico. Vuelven a ser los metales alcalinos los elementos con menor afinidad electrónica. Y son los halógenos en los que se desprende mayor energía al introducir un electrón, porque poseen siete electrones en su nivel energético más externo. Elementos de mayor afinidad electrónica en la tabla periódica. Número de Oxidación (EO = NO) Número de oxidación o estado de oxidación, es el número de electrones que gana o pierde un elemento cuando se combina para adquirir la configuración de un gas noble inmediato. Debido a la gran inactividad química de los gases nobles, se considera que su configuración electrónica es estable y tiende a ser adoptada por los demás elementos cuando entra en reacción. Los gases nobles poseen ocho electrones de valencia acomodados en ns2np6, con excepción del helio que sólo tiene dos colocados en 1s. Cuando un átomo neutro se combina puede perder electrones y adquiere un número de oxidación positivo, tantas veces positivos como electrones haya perdido, o puede ganar electrones adquiriendo un número de oxidación negativo cuyo valor es igual al número de electrones ganados. Los elementos de los grupos I A, II A y III A, que tienen 1, 2 y 3 electrones de valencia respectivamente, cuando se combinan tienden a perderlos para adquirir la configuración MCQ - 14 QUÍMICA – NIVEL INTERMEDIO PREINGENIERIA electrónica del gas noble inmediato. Los miembros de la familia I A presentan número de oxidación 1+, los de la II A el de 2+ y el grupo III A el estado de oxidación 3+. Los elementos del grupo IV A pueden perder o ganar electrones; sin embargo, generalmente comparten electrones con otros átomos. Los números de oxidación característicos son 4+ ó 4-. En los grupos V A, VI A y VII A existe una tendencia general a ganar electrones para adquirir la configuración electrónica del gas noble inmediato. Estos elementos muestran número de oxidación de 3- la quinta familia, 2- la sexta y 1- la séptima. Estos elementos, excepto el flúor y el oxígeno, por ser los más electronegativos, pueden perder electrones y tener números de oxidación positivos. La tendencia a perder electrones y tener números de oxidación positivos. Los metales exhiben siempre números de oxidación positivos y los no metales al unirse a metales tienen números de oxidación negativos, pero cuando se unen a no metales más electronegativos como el flúor o el oxígeno, actúan con estados de oxidación positivos. Todos los elementos en estado negativo o molecular (Cl2 , H2 , O2, Fe, P4, Na) tienen número de oxidación de cero. Los gases nobles por tener una configuración estable, presentan número de oxidación de cero. El elemento flúor por ser el más electronegativo tiene estados de oxidación de 1- y cero. El oxígeno por seguir en electronegatividad tiene 2-, cero y 1- en los peróxidos. El hidrógeno presenta número de oxidación de 1+, cero y 1-. Electronegatividad (EN) La electronegatividad, es una medida relativa del poder de atracción de electrones que tiene un átomo cuando forma parte de un enlace químico. Su unidad es el pauling ya que fue Linus C. Pauling quien estableció esta escala. En un grupo la electronegatividad disminuye de arriba hacia abajo y en un período aumenta de izquierda a derecha. Así, el elemento más electronegativo es el flúor (4.0), le sigue el oxígeno (3.5), luego el cloro (3.0), etcétera. MCQ - 15 QUÍMICA – NIVEL INTERMEDIO PREINGENIERIA Variación de Electronegatividades en Grupos y Período de la tabla periódica. Con base en lo anterior, debemos considerar que los elementos (no metales) localizados en la esquina derecha superior de la tabla periódica (VIIA) son los que tienden a ganar electrones con mayor facilidad; por lo tanto, no son buenos conductores de la electricidad, se reducen fácilmente y se usan comúnmente como oxidantes. SOBRE LA ELECTRONEGATIVIDAD (EN) Se define la electronegatividad de un elemento como la tendencia de un átomo de dicho elemento, que forma parte de una molécula, a atraer los electrones con los que están enlazados. Existen diferentes escalas de electronegatividades, aunque la más utilizada es la de Pauling. Esta escala va de 0 a 4, aunque ningún elemento tiene valor cero. El menor es el Fr (0,7) y el mayor el F (4,0) Es una propiedad periódica ligada con la energía de ionización y la afinidad electrónica de manera que un elemento que posea una afinidad electrónica y una energía de ionización elevada será muy electronegativo y viceversa. En general, cuanto menor es el átomo más tendencia tendrá a atraer a los electrones por lo que la electronegatividad será mayor. Por lo tanto, en un grupo disminuye al aumentar el número atómico y en un periodo aumenta con el número atómico CARÁCTER METÁLICO La electronegatividad es una propiedad que sirve para clasificar a los elementos en metales y no metales. Los metales se caracterizan porque la fuerza de atracción que ejercen sus átomos sobre los electrones externos es pequeña, lo que trae consigo valores bajos de la energía de ionización, de la afinidad electrónica y de la electronegatividad; tienen gran tendencia a formar cationes y se comportan como agentes reductores. MCQ - 16 QUÍMICA – NIVEL INTERMEDIO PREINGENIERIA Los átomos de los no metales atraen fuertemente a los electrones y poseen valores elevados de energía de ionización, afinidad electrónica y electronegatividad: forma fácilmente aniones y son agentes oxidantes. La clasificación actual de los elementos en Metales, No Metales y Semimetales, en la Tabla Periódica: A la izquierda de los semimetales están los metales y a su derecha los no metales. B Si Ge As Sb Te Po At El carácter metálico varía: En un grupo aumenta al aumentar el número atómico y en un periodo disminuye al aumentar el número atómico Elementos de importancia económica, industrial y ambiental en la región o en el país. Comúnmente se agrupan los elementos en Metales y No Metales. Los metales son elementos que tienen generalmente brillo metálico, son maleables, dúctiles, buenos conductores del calor y de la electricidad; la propiedad fundamental que justifica la clasificación, es que sus óxidos al combinarse con el agua forman hidróxidos. Los no metales son elementos químicos que con el oxígeno forman óxidos, que se combinan con el agua para constituir ácidos; estos óxidos se conocen con el nombre de anhídridos. La tabla periódica nos muestra que los elementos están agrupados de modo tal que parece indicar su distribución en la naturaleza. En la parte superior están los gases que constituyen la atmósfera como en nitrógeno y el oxígeno. En el centro están las sales y el agua, si se toma en cuenta que los extremos de la tabla se cierran y se unen los metales alcalinos con los halógenos. MCQ - 17 QUÍMICA – NIVEL INTERMEDIO PREINGENIERIA En la parte inferior están los metales que en forma de minerales se encuentran en el interior de la tierra. Algunos Elementos Importantes: Aluminio (Al) El aluminio es un metal de un brillo semejante al de la plata, y se deja pulir fácilmente. Generalmente la superficie está cubierta de una capa opaca que está formada de óxido. Es el metal má ligero de los comunes, y transporta fácilmente la electricidad. Es un agente reductor muy poderoso, por lo que se usa para obtener el cromo y el manganeso. Usos: El aluminio no es atacado por los alimentos comunes, por esta razón y por ser un conductor del calor, se está usando actualmente en la fabricación de utensilios de cocina. El polvo de aluminio tiene una gran aplicación en la fabricación de pinturas, principalmente para cubrir los objetos de fierro que están en la intemperie. También se inicia el uso del aluminio como conductor de la corriente eléctrica, porque su conductibilidad es muy cercana a la del cobre, con la gran ventaja de su densidad baja. En forma de aleaciones se emplea en la construcción de los aeroplanos; entre la aleaciones que tiene mayor aplicación está el duraluminio, aleación formada con aluminio, cobre y manganeso tan duro como el acero y cuya densidad es la mitad del mismo; el magnalium, el cual conserva la ligereza del aluminio y se deja elaborar con facilidad. En la actualidad el papel aluminio o lámina delgada está sustituyendo al estaño, pues se emplea en la envoltura, de muchos artículos. Azufre (S) El azufre es elemento no metal, sólido de color amarillo, más familiar y fue uno de los primeros que llamó la atención del hombre, por encontrarse junto con las rocas volcánicas en la superficie de la tierra. El azufre se encuentra nativo y combinado en la tierra; en forma combinada se halla en los sulfuros y en los sulfatos. En México existe al estado nativo en el cráter del Popocatépetl de donde se explotó en una época en gran escala. Uso: El azufre se usa en la fabricación del papel a partir de la madera; en la industria del petróleo para la refinación de la gasolina; en la vulcanización del caucho y en gran variedad de productos químicos entre los que debemos mencionar en primer lugar el ácido sulfúrico, producto básico de MCQ - 18 QUÍMICA – NIVEL INTERMEDIO PREINGENIERIA grandes industrias, el dióxido de azufre en la industria del blanqueo, de los sulfitos, sulfatos y poli sulfatos. Cobalto (Co) Metal de color blanco que se emplea en la elaboración de aceros especiales debido a su alta resistencia al calor, corrosión y fricción. Se han encontrado minerales oxidados y sulfuros en Sonora, Jalisco, Michoacán, Puebla y Oaxaca. Uso: Se emplea en herramientas mecánicas de alta velocidad, imanes y motores. En forma de polvo se emplea como pigmento azul para vidrio. Es catalizador. Su isótopo radiactivo se emplea en el I.N.I.N. México, porque produce radiaciones gamma. Hierro (Fe) El hierro es un metal de color blanco-grisáceo muy dúctil y maleable. Cuando se le coloca en un campo magnético adquiere la propiedad de atraer los cuerpos magnéticos. El oxígeno del aire en presencia húmeda se combina con él, produciendo el hidrato férrico llamado herrumbre. Cuando se le cubre con una capa de zinc se le conoce como fierro galvanizado y cubierto con el estaño forma la hojalata. En sus combinaciones con los demás elementos se le encuentra unido con dos valencias positivas y con tres; en el primer caso las sales llevan el nombre de ferrosas y en el segundo el de férricas. Uso: Se le emplea en la industria, arte y medicina. Para fabricar acero, cemento, fundiciones de metales no ferrosos; la sangre lo contiene en la hemoglobina. Flúor (F) El flúor es el elemento electronegativo más activo de todos los conocidos; debido a su actividad química intensa no se encuentra libre en la naturaleza, sino en forma de compuestos naturales o minerales, entre los que debemos recordar la fluorita (CaF2) y la criolita (NaAlF6); Ambos minerales son muy usados, el primero para la preparación del ácido fluorhídrico y el segundo para la obtención del aluminio. MCQ - 19 QUÍMICA – NIVEL INTERMEDIO PREINGENIERIA Uso: Con el flúor se obtienen ciertos compuestos orgánicos halogenados como el teflón, nombre comercial del politetrafluoretileno, este compuesto es un plástico muy resistente a las temperaturas elevadas, a los ácidos y a la acción de los disolventes, se emplea para recubrir: sartenes, tuberías, aviones, etc. Fósforo (P) El fósforo (palabra de origen griego que significa "llevo luz"), elemento no metálico, que por su gran actividad química no se encuentra libre en la naturaleza, sino que abunda en forma de minerales. Los huesos y los dientes encierran alrededor de 50% de fosfato de calcio. Muchos terrenos contienen pequeñas cantidades de fosfatos solubles que son necesarias para el desarrollo de las plantas. Uso: Es la materia prima en la fabricación de las cerillas, bajo la forma de fósforo rojo o en la de bisulfuro de fósforo (P4S3). Tiene aplicaciones para la elaboración de detergentes, plásticos, lacas, explosivos, refinación de azúcar, industria textil, fotografía, fertilizantes, cerámicas, pinturas, alimentos para ganados y aves. Mercurio (Hg) Se encuentra nativo en la naturaleza, metal líquido a temperatura ambiente de color blanco brillante, resistente a la corrosión y buen conductor eléctrico. Uso: Se le emplea en la fabricación de instrumentos de precisión, baterías, termómetros, barómetros, amalgamas dentales, armas para preparar cloro, sosa cáustica, medicamentos insecticidas, fungicidas y bactericidas. Plata (Ag) La plata es un metal blanco, no es duro. Se encuentra en forma nativa, generalmente en las rocas cuarzosas, pero en pequeñas cantidades. Es el mejor conductor del calor y de la electricidad. Uso: Su uso tradicional ha sido en la acuñación de monedas y manufactura de vajillas y joyas. Se emplea en fotografías, aparatos eléctricos, aleaciones, soldadura. La producción de plata en México se obtiene como subproducto del beneficio de sulfuros de plomo, cobre y zinc que la contienen. Recientemente se ha substituido su uso en monedas por la aleación cobre – níquel. MCQ - 20 QUÍMICA – NIVEL INTERMEDIO PREINGENIERIA Plomo (Pb) El plomo es un metal blando y muy pesado, de bajo punto de fusión, bajo límite elástico, resistente a la corrosión, se le obtiene del sulfuro llamado galena PbS. Uso: El plomo se usa en la manufactura de acumuladores; en la fabricación de metales para chumaceras; en la copelación de la plata, en la fabricación de tubos y de soldaduras, en la elaboración de tipos de imprenta, en la fabricación del litargirio y del minio. Oro (Au) Es seguramente este metal el más antiguamente conocido por el hombre. El oro es un metal amarillo, relativamente blando que funde a más de 1000 oC, es el metal más maleable y dúctil de los conocidos. Al estado puro es blando, para su uso de joyería y en monedas, se hace una aleación con el cobre. Las monedas de oro de todas las naciones tienen la misma ley: 90 de oro en 100 de aleación. Las aleaciones de oro se expresan en quilates, el oro puro es de 24 quilates. Usos: El oro se emplea en gran escala para la acuñación de monedas y para la fabricación de joyas. En odontología se usa porque es un metal inalterable, es atacado únicamente por el agua regia. Las sales de oro se emplean para el dorado electrolítico y para el virado fotográfico Uranio (U) Utilizado como combustible nuclear, éste es un elemento raro en la naturaleza y nunca se presenta en estado libre. Existen 150 minerales que lo contienen. El torio se encuentra asociado al uranio. En México este mineral está regido por la ley promulgada en 1949, que declara como reservas mineras nacionales los yacimientos de uranio y torio y demás substancias de las cuales se obtengan isótopos que pueden producir energía nuclear. Cadmio (Cd). Metal tóxico que se origina en la refinación del zinc; también proviene de operaciones de eelctrodeposición y por tanto contamina agua y aire. Contenido en algunos fertilizantes y contamina el suelo. MCQ - 21 QUÍMICA – NIVEL INTERMEDIO PREINGENIERIA Cromo (Cr) El cromo y sus compuestos son perjudiciales al organismo, pues destruyen todas las células. Se le emplea en síntesis orgánicas y en la industria del acero. Un cromato soluble contamina el agua. Elementos de importancia económica y contaminantes. Antimonio (Sb) El antimonio se emplea en aleaciones, metal de imprenta, baterías, cerámica y textiles. El envenenamiento se produce por ingestión, inhalación de vapores y principalmente por un gas llamado estibina. Arsénico (As) Se emplea en venenos para hormigas, insecticidas, pinturas, medicamentos y vidrio. Es uno de los elementos más venenosos que hay, así como sus compuestos, todos sin excepción. Azufre (S) Principalmente sus óxidos SO2 Y SO3 contaminan el aire y con agua producen la lluvia ácida. Substancias tales como derivados clorados de azufre, sulfatos, ácidos, son corrosivos. El gas H2S es sumamente tóxico y contaminan el aire. El azufre es empleado en algunos medicamentos para la piel. Bromo (Br) Sus vapores contaminan el aire, además sus compuestos derivados son lacrimógenos y venenosos. Cloro (Cl) Sus vapores contaminan el aire y son corrosivos. Se le emplea en forma de cloratos para blanquear la ropa, para lavados bucales, para cerillos. Los cloratos son solubles en agua y la contaminan además de formar mezclas explosivas con compuestos orgánicos. Fósforo (P) MCQ - 22 QUÍMICA – NIVEL INTERMEDIO PREINGENIERIA El fósforo blanco o amarillo es muy venenoso. El fósforo rojo no lo es, pero se encuentra contaminado por el blanco. Se emplea fósforo en síntesis, pinturas, fertilizantes, plaguicidas, ocasionando contaminación de aire, suelo y agua. El gas PH3 es muy venenoso y los vapores de compuestos orgánicos fosforados contaminan el aire. Manganeso (Mn) Se emplea en la manufactura del acero y de pilas secas. La inhalación de polvos y humos conteniendo manganeso causa envenenamiento. También contamina el agua y atrofia el cerebro. Mercurio (Hg) Metal de gran utilidad por ser líquido, pero contamina el agua, aire y causa envenenamiento. Las algas lo absorben, luego los peces y finalmente el hombre. Los granos lo retienen y finalmente el hombre los come. Plomo (Pb) El plomo se acumula en el cuerpo conforme se inhala del aire o se ingiere con los alimentos y el agua. La mayor parte del plomo que contamina el aire proviene de las gasolinas para automóviles, pues se requiere para proporcionarle propiedades antidetonantes. También se le emplea en pinturas, como metal de imprenta, soldaduras y acumuladores. Por su uso el organismo se ve afectado de saturnismo. Sus sales son venenosas como el acetato. EJERCICIOS 1. ¿Qué tienen en común?: • los isótopos de un mismo elemento • los elementos de un grupo de la tabla periódica • los elementos de un mismo periodo • los elementos de transición. MCQ - 23 QUÍMICA – NIVEL INTERMEDIO 2. PREINGENIERIA Escribir la configuración electrónica del elemento de Z = 21 y explicar si se trata de un metal alcalino. 3. Indicar las principales diferencias entre los elementos de la familia de los alcalinos y la de los halógenos. 4. Definir los conceptos: afinidad electrónica y electronegatividad. Indicar cuáles son los elementos de mas alta afinidad electrónica y los de más baja electronegatividad. 5. Definir en relación con su estructura electrónica externa: a) los elementos de transición; b) los lantánidos; c) los actinidos. 6. Cuatro elementos distintos A. B, C y D tienen de número atómico 6, 9, 13 y 19, respectivamente. Determinar: a) El número de electrones de valencia de cada uno de ellos. b) Su clasificación en metales y no metales. c) El número de electrones desapareados en su estado fundamental. d) Grupo y periodo al que pertenecen. 7. ¿Un elemento cuyo electrón diferenciador tiene los siguientes números cuánticos n=3, l=2. m=0 y s=1I2 es un elemento representativo? Indicar su periodo y su grupo. 8. Con respecto a los elementos de números atómicos 11, 15, 36. 38 Y 42 se pide: a) periodo y grupo al que pertenecen b) indicar si son metales o no metales. 9. Indicar la posición en el sistema periódico, así como si son elementos representativos de transición o de transición interna, los siguientes elementos: A) 1s2 2s2 2p6 3s2 3p6 4s23d10 B) 1s2 2s2 2p6 3s2 3p6 4s1 C) 1s2 2s2 2p6 3s2 3p3 D) 1s2 2s2 2p6 3s2 3p6 4s23d7 E) 1s2 2s2 2p6 3s2 3p6 4s23d104p6 F) 1s2 2s2 2p6 3s2 3p6 4s23d104p65s24d105p66s2 10. Explica si es correcta la afirmación: la configuración electrónica de todos los elementos de transición es n s2 (n-l) dx. 11. ¿Cuál de las siguientes afirmaciones con relación al elemento de número atómico 16 es incorrecta? a) se encuentra en el tercer periodo b) tiene propiedades químicas similares a las del elemento de Z=34 c) es un metal d) forma un anión divalente 12. Ordena el sodio, potasio y rubidio en cuanto a su: ionización; c) poder reductor, razonar las respuestas. MCQ - 24 a) volumen atómico; b) potencial de QUÍMICA – NIVEL INTERMEDIO PREINGENIERIA 13. Tenemos dos elementos del mismo periodo: X y Z, siendo X más electronegativo que Z. Señalar las respuestas verdaderas: a) X tiene menor energía de ionización b) Z tiene menor afinidad electrónica c) Z tiene mayor radio atómico d) el par de electrones del enlace X-Z se encuentra desplazado hacia X. 14. Razonar la veracidad o falsedad de las siguientes respuestas en cuanto al átomo de argón (Z=18) y el ion sulfuro S2- (Z=16): a) ambos poseen. el mismo número de electrones b) por tanto el número de protones será igual c) el volumen del ion será superior al del átomo de argón 15. K+, Ca2+, Cl-, S2- y Ar tienen el mismo número de electrones. Ordénalos según su radio de mayor a menor. 16. Sean los siguientes iones isoelectrónicos: I- , Ba2+, La3+, Te2- , Cs+ Ordénalos en orden creciente a su radio iónico. 17. Ordena. en cuanto al radio y a la energía de ionización. las siguientes especies isoelectrónicas: H- , He, Li+ 18. ¿La primera energía de ionización de un átomo es mayor, menor o igual que su segunda energía? 19. Dado un elemento cualquiera del sistema periódico compara su radio atómico y su energía de ionización: a) con el elemento de la casilla de la derecha b) con el de la casilla de abajo. 20. El primer y segundo potencial de ionización para el átomo de litio (Z=3) son respectivamente: 520 y 7300 kJ/mol. Razona: a) la gran diferencia que existe entre ambos valores de energía; b) ¿ qué elemento presenta la misma configuración electrónica que la primera especie iónica?; c) ¿cómo varia el potencial de ionización de los elementos del mismo grupo? 21. Un átomo neutro de un elemento X tiene 15 electrones. a)¿Cuál es su número atómico? b )¿Cuál es el número total de electrones s ? c) ¿Es el elemento un metal o no metal? Razona las respuestas. 22. Especie química: Li Na Na+ Mg Mg+ Be Be+ O N P.I. (eV) : 5,39 5,14 47,3 7,64 15,0 9,32 18,2 13,6 14,5 23. Explica la causa de que el potencial de ionización del: a) litio sea mayor que el del sodio, pero inferior al del berilio b) oxígeno sea inferior al del Nitrógeno, que tiene una electronegatividad inferior a la del oxígeno c) Mg+ sea mayor que la del magnesio, pero inferior a la del Na+. 24. Las energías de ionización del boro son EI= 191; E2= 578; E3= 872 y E4= 5962 kcal/mol. Basándose en su configuración electrónica (Z=5), explicar estos valores. ¿A qué grupo pertenece el boro? MCQ - 25 QUÍMICA – NIVEL INTERMEDIO PREINGENIERIA 25. En contra de la variación general, la afinidad electrónica del silicio (Z=14) es mayor que la del fósforo (Z = 15). ¿Por qué? 26. Ordena, en orden de electronegatividad creciente, los elementos de números atómicos 12, 17 y 35. 27. El potencial de ionización del sodio es 5,12 eV. Si se tienen 25 g de este metal. ¿qué cantidad de energía es necesaria para ionizar todos los átomos? So1: 536 457 J. 28. La afinidad electrónica del fluor es -3.45 eV. Átomo-1. Calcular la energía desprendida al obtener 3.6 g de iones fluoruro a partir de átomos de flúor en estado gaseoso y fundamental. SoI: 6,3.104 J. 29. En el sistema periódico se encuentran en la misma columna los elementos cloro, bromo y yodo colocados en orden creciente de su número atómico. Si el número atómico del cloro es 17: a) Escriba la configuración electrónica de los tres elementos. b) Defina el primer potencial de ionización de un elemento químico y asigne a cada uno de los tres elementos el potencial de ionización que pueda corresponderle de entre los siguientes: 10,4; 11,8 y 13,1 eV. c) Defina que es afinidad electrónica. 30. Dados los tres elementos del sistema periódico: A, B, C cuyos números atómicos respectivos son 8, 16 y 19. a) Escriba las configuraciones electrónicas de cada uno e indique cuál de ellos presentará el valor mayor del primer potencial de ionización. 31. Considere el elemento de número atómico Z=36 a) ¿Cuál es su configuración electrónica? b) ¿Cuál es su posición en e el sistema periódico de los elementos? c) ¿Cómo será su potencial de ionización en comparación con el del potasio? 32. Dadas las siguientes configuraciones electrónicas de dos elementos: A: 1s2 2s2 2p2 B: 1s2 2s2 2p1 3s1 Indique de modo razonado si son ciertas o falsas las afirmaciones: a) ¿Es posible la configuración dada a B? b) Las dos configuraciones corresponden al mismo elemento c) Para separar un electrón de B se necesita más energía que para separarlo del A MCQ - 26 QUÍMICA – NIVEL INTERMEDIO PREINGENIERIA Preguntas resueltas 1. Indique cuál de las siguientes proposiciones enfoca con mayor precisión la ley periódica moderna: A) Las propiedades periódicas son función de las masas atómicas. B) La tabla periódica moderna se fundamenta en la ley periódica moderna. C) Las propiedades de los elementos son una función periódica de sus números atómicos. D) Las propiedades de los elementos son directamente proporcional a sus números atómicos. E) La actual ley periódica es una modificación de la planteada por Mendeleiev. RESOLUCIÓN La Ley periódica moderna de Moseley, dice: “Las propiedades de los elementos varían en función periódica de sus números atómicos (Z)” CLAVE: C 2. Sobre la ley periódica moderna, señale la proposición incorrecta. A) Se basa en el número atómico de los elementos. B) Tiene como sustento el trabajo de Moseley. C) Tuvo como antecedentes los trabajos de Meyer y Mendeleiev. D) Explica coherentemente la variación de las propiedades periódicas de los elementos. E) Las propiedades de los elementos son una función periódica de sus pesos atómicos. RESOLUCIÓN “Las propiedades de los elementos varían en función periódica de sus pesos atómicos” Corresponde a la ley anterior de Mendeleiev (1869) que ya no tiene validez CLAVE: E 3. Determine que propiedades de la tabla periódica son correctas. I. En la actualidad la tabla periódica ya tiene ocho períodos pues el último elemento tiene un número atómico de 120. II. La tabla periódica está dividida en elementos representativos y de transición formando un total de 18 grupos o familias. III. Los elementos de transición interna se caracterizan por tener electrones en sus subniveles f en su configuración electrónica. RESOLUCIÓN I (F) Hay 112 elementos plenamente identificados. II. (V) 8 grupos A y 10 grupos B III. (V) elementos de transición interna terminan en: ns2 (n − 2 ) f1......14 RSPTA: F, V, V 4. Indique la verdad (V) o falsedad (F) de cada una de las siguientes proposiciones sobre la tabla periódica moderna: I. En cada grupo se encuentran los elementos que tiene propiedades físicas y químicas similares. II. El número atómico aumenta de derecha a izquierda en un período. III. En un período se ubican los elementos que presentan la misma cantidad de niveles en su distribución electrónica. MCQ - 27 QUÍMICA – NIVEL INTERMEDIO PREINGENIERIA RESOLUCIÓN I. (V) En un grupo, las propiedades son semejantes II. (F) Aumenta Z Aumenta Z III. (V) Por ejemplo: todos los elementos del periodo 3, tienen 3 niveles de energía. RSPTA: V, F, V 5. Indique que proposiciones son correctas: I. En la tabla periódica moderna, los elementos químicos están ordenados en 18 grupos. II. El elemento con la configuración de valencia 5s2 4d10 pertenece al período 5 y grupo IIB. III. La tabla moderna presenta 7 períodos. RESOLUCIÓN I. (V) II. (V) completando su configuración es: kr 5 s2 4 d10 Periodo 5 Grupo II B III. (V) RSPTA: V, V, V 6. No es grupo notable de elementos: A) Li,Na,K,Rb, Cs,Fr. B) He,Ne, Ar,Kr, Xe,Rn. C) Hg,H, Cu, fe, Co,U. D) F, Cl,Br, I, At. E) Be, Mg, Ca, Sr, Ba, Ra. RESOLUCIÓN Grupo Hg → II B H → IA Cu → IB Hay elementos de grupos diferentes. CLAVE: C 7. Identifique, cuál relación elemento-grupo notable es incorrecta: A) Na: metal alcalino. B) Cl: halógeno C) Ca: alcalinotérreo D) S: halógeno E) Rn: gas noble. RESOLUCIÓN S → Es anfígeno u calcógeno (VIA) CLAVE: D MCQ - 28 QUÍMICA – NIVEL INTERMEDIO 8. PREINGENIERIA Se tiene 2 elementos, con sus respectivas configuraciones electrónicas. A: Ne 3s1 B: 1s2 2s2 2p6 3s2 Señale verdadero (V) o falso (F) según corresponda. I. Ambos elementos son representativos. II. Ambos elementos pertenecen a un mismo grupo. III. El segundo elemento es un gas noble. RESOLUCIÓN Grupo Periodo 1 Ne 3S A: IA 3 B: Ne3S2 I. II. III. IIA 3 (V) son de grupos “A” (F) (F) es un metal alcalino-terreo RSPTA: V, F, F 9. Indique si la proposición es verdadera (V) o falsa (F). - Los elementos representativos son aquellos en los cuales se encuentra una buena correspondencia en las variaciones de las propiedades. - Son elementos representativos: Ca, K, N, Br. Elemento N K Ca Br Z 7 19 20 35 - Los elementos representativos terminan su configuración electrónica en nsx npy , donde x + y = número de grupo. RESOLUCIÓN I. (V) los elementos de grupos A muestran una variación regular de sus propiedades. II. (V) Grupo Ca 2 20 :Ar 4 S II A 19k :Ar 4 S1 7 IA N : He2 s2 2p3 35 VA Br : Ar 4 s2 3p10 4p5 VII A Los 4 son de grupos “A” III. (V) Nº Romano = Nº electrones de grupo de valencia RSPTA: V, V, V 10. X y Z son dos elementos que tienen las siguientes propiedades: Elemento X Z Configuración gas noble ns1 # e− de valencia 1 2 5 g a s n o b l e n s n p 7 MCQ - 29 QUÍMICA – NIVEL INTERMEDIO PREINGENIERIA Indique la proposición correcta: A) Elemento X está en el grupo IA y Z en IB. B) El elemento X es un alcalino y Z alcalinotérreo. C) Los elementos X e Z son metales. D) El elemento X es representativo y Z es de transición. E) El elemento X está en el grupo IA y Z en el grupo VIIA. RESOLUCIÓN Grupo 1 x : G.Nns IA y : G.Nns2 np5 VIIA CLAVE: E 11. Indique que proposición (es) es (son) correcta(s), respecto a los elementos de transición. I. Sus electrones de valencia se ubican en orbitales s y d. II. Hay configuraciones de valencia que debiendo terminar d4 y d9 , terminan en d5 y d10 , es el caso del 24 Cr y 29 Cu , respectivamente. III. Todos los elementos de transición son metales. RESOLUCIÓN I. (V) metal de transición termina en nsx (n − 1) dy II. (V) 24 Cr : Ar 4s1 3d5 distribuciones 29 Cu : Ar 4s1 3d10 mas estables III. (V) RSPTA: V, V, V 12. Dados los siguientes grupos de elementos: X: Li, Ba, S, F. Y: Ag, V, Co, W. Elemento Li S F Ba V Ag Co W Z 3 16 9 56 23 47 27 74 ¿Cuál(es) de las siguientes proposiciones es incorrecta? I. El grupo X está conformado sólo por elementos representativos. II. El grupo Y está formado por elementos formadores de ácidos. III. El grupo de elementos Y utiliza orbitales d en el nivel de valencia, mientras que del grupo X no lo hace. MCQ - 30 QUÍMICA – NIVEL INTERMEDIO PREINGENIERIA RESOLUCIÓN I. Grupo IA 1 (V) 3Li: He2 s Ba: xe 6 s2 IIA S : Ne3s2 3p4 VIA F : He2 s2 2p5 VIIA 56 16 9 II. (F) porque son metales de transición III. (V) 10 47 A g : kr 5 s1 4d RSPTA: V, F, V 13. Al estudiar las propiedades de tres elementos químicos se obtuvieron resultados. Propiedades Nº Atómico Conductividad eléctrica A 100º C A 20 alta B 24 alta C 26 Alta líquido sólido sólido los siguientes Sobre la base de los datos anteriores, indique la(s) proposiciones(es) correcta(S). I. A es un metal representativo mientras que B y C son de transición. II. C tiene un radio mayor que A. III. Las temperaturas de fusión y durezas de B y C son mayores que los de A. RESOLUCIÓN I. (V) el punto de fusión de A es menor de 100 oC, típico de un metal alcalino –terreo. 20 II. III. A : Ar 4 s2 (F) 24 B : Ar 4 s1 3d5 26 C : Ar 4 s2 3d6 Los 3 son del periodo 4, pero el radio aumenta hacia la izquierda. A>B>C (V) porque A es alcalino - terreo RSPTA: V, F, V 40 Ca : dicho elemento tiene como 14. Un elemento tiene igual número de neutrones que el 20 número de masa una unidad menos que la masa del calcio. Determine a que grupo pertenece dicho elemento. RESOLUCIÓN Según datos: Nº de neutrones = 40 - 20 = 20 Nº de masa = 40 – 1 = 39 → Z = 39- 20 = 19 MCQ - 31 QUÍMICA – NIVEL INTERMEDIO PREINGENIERIA Ar 4 s1 → IA RSPTA: IIA 15. ¿Cuál de los siguientes elementos no está acompañada del período y grupo al cual pertenecen realmente? A) 11Na : 3,I A B) 17 Cl : 3, VII A Se :4, VI A D) 29 Cu :4,IIB C) 34 E) 27 Co :4, VIIIB RESOLUCIÓN 29 Cu : Ar 4 s1 3 d10 Periodo 4 Grupo IB CLAVE: D 16. Identifique la proposición incorrecta(s) respecto a los metales. I. Son ejemplos de metales alcalinos, H, Na, K, Cs. II. Para un grupo a medida que aumenta el número atómico, los elementos aumentan su carácter metálico. III. Aproximadamente las ¾ partes de los elementos químicos son metales. RESOLUCIÓN I. (F) H no es metal II. (V) Aumenta Z Aumenta carácter metálico III. (V) RSPTA: F, V, V 17. ¿Cuál de los siguientes elementos es un semimetal? A) He B) K C) Ge RESOLUCIÓN D) Cl E) Pb Son semimetales B, Si Ge, As, Sb, Te, Po y At. CLAVE: C MCQ - 32 QUÍMICA – NIVEL INTERMEDIO PREINGENIERIA 18. Marque verdadero (V) o falso (F) según corresponda: - Todos los metales son buenos conductores de calor y la electricidad. - En general, los no metales no conducen el calor ni la electricidad. - Los metales son dúctiles y maleables. RESOLUCIÓN I. (V) Debido a sus eléctrones deslocalizados II. (V) a excepcion de grafito, los demas no conducen la electricidad. III. (V) se pueden hacer de ellos hilos y laminas RSPTA: F, V, V 19. Tomando en cuenta la posición que ocupan en la tabla periódica, los elementos: 11 Na, 13 Al, K, 37 Cl, 35 19 17 Rb, Mg, 12 Br, 9F. Señale la veracidad (V) o falsedad (F) de las siguientes proposiciones. - Respecto a su radio tienen orden creciente 11 Na < 19K <37 Rb. - El aluminio tiene mayor electronegatividad que el magnesio, pero menor que el cloro. - El F, Cl y Br, en este orden, mantienen electronegatividad decreciente. RESOLUCIÓN Ubicando los elementos en la tabla. Periodo 1 3 11 Na : Ne3 s 19 k : Ar 4 s1 1 37 Rb : kr 5 s 2 Mg : Ne3s Grupo IA 4 IA 5 IA 3 II A 1 13 Aℓ : Ne3s 3p 3 III A 17 Cℓ : Ne3s2 3p5 3 VII A Br : Ar4s2 3d10 4p5 4 VII A 2 VII A 12 2 35 2 9 5 F : He2 s 2p Aℓ Cℓ Br I. (V) Mayor radio MCQ - 33 QUÍMICA – NIVEL INTERMEDIO II. PREINGENIERIA (V) Mayor E.N. III. (V) Menor E.N. RSPTA: V, V, V 20. Analizando la variación de las propiedades periódicas, marque la alternativa correcta: A) El radio atómico aumenta en un período a medida que aumenta el número atómico y en un grupo a medida que disminuye el número atómico. B) La energía de ionización disminuye tanto en un período como en un grupo con el aumento del número atómico. C) Las energías de ionización de los elementos de un grupo, se pueden correlacionar con los radios de sus respectivos átomos. Ambas magnitudes son inversamente proporcionales. D) El carácter metálico aumenta en un período con el aumento del número atómico. E) La electronegatividad de los elementos del grupo VIIA, aumenta con el aumento del número atómico. RESOLUCIÓN En un grupo Aumenta E.I. Aumenta R.A. CLAVE: C 21. Indique cuál de las siguientes proposiciones es incorrecta: A) En un período el radio atómico es inversamente proporcional al número atómico. B) La electronegatividad es directamente proporcional al número atómico en un grupo. C) En un grupo el radio atómico de los elementos aumenta, al aumentar el número atómico. D) Los halógenos son los elementos más electronegativos de cada período. E) Los elementos del séptimo período son los menos electronegativos de cada grupo. RESOLUCIÓN En un grupo Aumenta E.I. Aumenta Z son inversamente Proporcionales CLAVE: B MCQ - 34 QUÍMICA – NIVEL INTERMEDIO PREINGENIERIA 22. ¿Qué diagrama muestra la variación general, en la tabla periódica moderna, como el aumento de la electronegatividad? A) B) C) D) E) Ninguna es correcta RESOLUCIÓN Aumenta E.N. Aumenta E.N. CLAVE: D 23. Se tiene dos elementos, con sus respectivas configuraciones electrónicas: A) Ne 3 s2 3p4 B) Ar 4 s2 I. II. El primer elemento es más electronegativo que el segundo. Con respecto a sus iones divalentes positivos, el segundo tiene mayor radio iónico que el primero. III. El segundo tiene mayor radio atómico que el primero. MCQ - 35 QUÍMICA – NIVEL INTERMEDIO PREINGENIERIA RESOLUCIÓN 2 A : Ne3 s 3p 4 A : Ar 4 s2 Periodo 3 Grupo VI A 4 II A I. (V) porque A es no – metal y B es metal II. (V) r B 2+ >r A 2+ Porque B 2+ esta a la izquierda III. (V) rB > rA RSPTA: V, V, V 24. Determine las(s) proposición(es) incorrecta(s), respecto a la energía de ionización. I. Se define como la cantidad mínima de energía para retirar un electrón de un átomo en estado sólido. II. La energía de ionización crece al arrancar los electrones más internos de un átomo gaseoso. El1 < El2 < El3 . III. La afinidad electrónica es el fenómeno opuesto a la energía de ionización. RESOLUCIÓN Aumenta E.I. Aumenta E.I. I. (F) se mide cuando el elemento se encuentra en estado gaseoso. II. (V) si en un mismo átomo se desea arrancar más e− , la E.I. aumenta cada vez más. III. (F) porque la afinidad electrónica es una energía liberada en muchas especies, pero es absorbida en otras especies. RSPTA: F, V, F MCQ - 36 QUÍMICA – NIVEL INTERMEDIO PREINGENIERIA Preguntas tomadas en la Universidad de Ingeniería 1. ¿Cuál es la alternativa incorrecta, respecto al cuarto período de la Tabla Periódica Moderna? (Ex – UNI 1991) A) En este período se completa el llenado de orbitales 3d. B) Todos los elementos de transición tienen sus orbitales 4s semillenos. C) Este período contiene solo 18 elementos. D) Sus elementos carecen de electrones en orbitales 4f. E) Este período se inicia con el K y termina con el Kr. 2. Con respecto a la clasificación periódica de los elementos, indique cuál de las siguientes expresiones es falsa: (Ex – UNI 1991) A) Döbereiner establece un ordena-miento de los elementos, basándose fundamental-mente en los pesos atómicos crecientes. B) Los elementos que se hallan ordenados entre los grupos IIIA y VIIA de la Tabla periódica, tienen naturaleza ácida. C) Newlands establece un ordenamiento en grupos de 8 elementos cada uno, sin involucrar en ellos a los elementos de transición. D) El sexto período de la tabla periódica larga contiene un total de 32 elementos. E) En la tabla periódica larga, los elementos están ordenados según sus números atómicos crecientes. 3. Indicar la proposición verdadera con respecto a la clasificación periódica de los elementos químicos: (Ex – UNI 1992) A) Las tríadas fueron propuestos por Newland. B) Las octavas fueron propuestas por Döbereriner. C) Los elementos en orden de sus pesos atómicos en una curva helicoidal fue propuesto por Meyer. D) Las deficiencias que presentaba la clasificación de Mendeleiev, fueron solucionados por Moseley. E) Los gases raros fueron descubiertos por Chancourtois. 4. De los elementos con número atómico 11, 12, 36, 38, 52 y 56 diga cuáles pertenecen al mismo grupo de la tabla periódica. (Ex – UNI 1993 I) A) 11, 36 y 52 B) 12, 38 y 56 C) 11, 38 y 56 D) 12, 36 y 52 E) 11, 36 y 56 5. Indicar al elemento ubicado en el IV grupo de la tabla periódica que se usa en la fabricación de dispositivos electrónicos en el estado puro, mientras que algunos de sus compuestos se emplea como material principal en la industria de la construcción. (Ex – UNI 1993 II) A) Si B) Ti C) Hf D) Ge E) Zr MCQ - 37 QUÍMICA – NIVEL INTERMEDIO PREINGENIERIA 6. Un átomo del elemento E, en su estado basal, puede representarse como: • •• E• • Si presenta 4 niveles energéticos, ¿cuáles de las siguientes proposiciones son correctas respecto al elemento E? I. Se ubica en el grupo 15 de la Tabla Periódica Moderna. II. Su capa de valencia tiene la configuración: 4s23d104p5 III. Su número atómico es 33. (Ex – UNI 2010 I) A) Solo I B) Solo III C) I y III D) II y III E) I; II y III 7. La Tabla Periódica Moderna se construye de acuerdo a la configuración electrónica externa de sus elementos, formando los bloques s, p, d y f. Indique la secuencia correcta, después de determinar si cada proposición es verdadera (V) o falsa (F): I. El elemento con Z = 25 pertenece al bloque d. II. El elemento con Z = 49 pertenece al bloque p. III. El elemento con Z = 80 pertenece al bloque f. (Ex – UNI 2011 I) A) VVV B) FVV C) FFF E) VVF D) VFV 8. Dadas las siguientes proposiciones respecto al elemento con Z = 25, indique la secuencia correcta después de determinar si la proposición es verdadera (V) o falsa (F): I. Pertenece al cuarto período. II. Pertenece al grupo VIB. III. Es un no metal. (Ex – UNI 2011 II) A) VVV B) VVF C) VFF D) FVF E) FFV Propiedades periódicas 1. Con respecto a los radios atómicos de los elementos de una familia o grupo en la tabla periódica, podemos afirmar que: (Ex – UNI 1982) A) Disminuyen a medida que aumenta el número atómico. B) Aumentan a medida que aumenta el número atómico. C) No se observa ninguna secuencia apreciable. D) Todos tienen el mismo radio atómico. E) No se han podido determinar aún estos. 2. Con respecto a los radios atómicos de los elementos de un período en la tabla periódica podemos afirmar que: (Ex – UNI 1984 I) A) Disminuye a medida que aumenta el número atómico. B) Aumenta a medida que aumenta el número atómico. C) No se observa ninguna secuencia apreciable. MCQ - 38 QUÍMICA – NIVEL INTERMEDIO PREINGENIERIA D) Todos tienen el mismo radio atómico. E) No se han podido determinar todavía estos. 3. Teniendo en cuenta la tabla periódica de los elementos, ¿cuál de las siguientes proposi-ciones es correcta con respecto a la variación de los radios atómicos?: (Ex – UNI 1989) A) En un mismo período se mantienen constantes. B) En un mismo grupo aumentan de abajo hacía arriba. C) En un mismo período decrecen de izquierda a derecha. D) En un mismo período aumentan con el número atómico. E) En un mismo grupo decrecen con el incremento del número de protones. 4. Referente a las propiedades periódicas de los elementos, indicar cuál de las siguientes proposiciones es falsa: (Ex – UNI 1997 I) A) Los seis miembros del grupo de los gases nobles se caracterizan por su inactividad química. B) Los cuatro primeros miembros de la familia de los halógenos son los no metales más activos químicamente. C) El grupo de los metales alcalinos es el más activo entre todos los metales. D) Los elementos electropositivos están a la derecha de la Tabla Periódica y los electronegativos a la izquierda. E) La valencia principal de los elementos alcalinotérreos es +2. 5. ¿Cuáles son los tamaños relativos entre los pares de especies siguientes? Cl–; Cl y K; K+ (Ex – UNI 1999 I) A) B) C) D) E) Cl – = Cl – > Cl – < Cl – > Cl – > Cl Cl Cl Cl Cl y y y y y K < K+ K = K+ K < K+ K > K+ K < K+ 6. ¿En qué orden varía el tamaño (volumen atómico) de los elementos alcalinos? (Ex – UNI 2000 II) A) B) C) D) E) K > Cs > Rb > Na > Li Na > Rb > K > Cs > Li Li > Na > K > Rb > Cs Cs > Rb > K > Na > Li K > Cs > Rb > Li > Na 7. Determinar que proposiciones son verdaderas (V) o falsas (F) según corresponda, en el orden que se presentan: I. Los compuestos formados entre elementos del grupo VIIA y grupo IA son compuestos iónicos. II. El radio iónico monopositivo en un período decrece a medida que aumenta el número atómico. III. En los elementos llamados de transición interna se comienza a llenar con electrones el subnivel d. MCQ - 39 QUÍMICA – NIVEL INTERMEDIO PREINGENIERIA (Ex – UNI 2002 I) A) VFV D) FFV C) VVF B) FVF E) VVV 9. Entre las parejas de iones: Li+ y Be2+; N3– y F–; indicar la alternativa que contiene las proposiciones correctas respecto de sus radios. Números atómicos: Li (3); Be (4); N (7); F (9). I. rLi + ⟨ rBe 2 + ; r F - ⟨ r N 3 II. rBe 2+ ⟨ rLi + ; rN 3 - ⟨ rF - III. rBe 2 + ⟨ rLi + ; rF - ⟨ rN 3(Ex – UNI 2002 II) A) I D) I y II B) II E) II y III C) III 10. Respecto a los siguientes elementos: 11X; 19Y; 34Z ¿Cuáles de las siguientes proposiciones son verdaderas? I. X tiene menor radio atómico que Y. II. Z tiene mayor radio atómico que Y. III. La energía de ionización de Y es menor que la de Z. (Ex – UNI 2003 I) A) I D) I; II y III B) I y III E) II C) II y III 11. En relación a los elementos del grupo IA, marque la proposición correcta: (Ex – UNI 2005 I) A) B) C) D) E) Unos son metales alcalinos y otros metaloides. El radio atómico de los elementos crece de arriba hacia abajo. El número de capas electrónicas aumenta de abajo hacia arriba. El número de electrones de la capa más externa varía entre 1 y 8. Forman aniones simples y complejos. 12. Respecto a los elementos químicos de la tabla periódica, señale las proposiciones correctas: I. En un período, la tendencia a formar cationes aumenta de derecha a izquierda. II. En los halógenos, la fuerza del carácter oxidante varía en forma directa a su número atómico. III. Los elementos están ordenados en forma creciente a sus masas atómicas y distribuidas en 18grupos y 7períodos. (Ex – UNI 2005 II) A) Solo I B) Solo II C) Solo III D) I y II E) I y III 13. Dadas las siguientes proposiciones referidas a los elementos representativos de la tabla periódica: I. La electronegatividad en un grupo aumenta de arriba hacia abajo. II. El número de electrones de valencia para el átomo neutro es igual al número asignado al grupo. MCQ - 40 QUÍMICA – NIVEL INTERMEDIO PREINGENIERIA III. Los elementos del grupo IA forman, generalmente, enlace iónico con los elementos del grupo VIIA. Son correctas: (Ex – UNI 2006 I) A) Solo I B) Solo II C) Solo III D) I y III E) II y III 14. Comparando los elementos cesio (Cs) y estroncio (Sr) y considerando las siguientes proposiciones en relación a sus propiedades periódicas: I. El radio atómico del Cs es mayor que el del Sr. II. La electronegatividad del Sr es menor que el del Cs. III. La energía de ionización del Cs es mayor que el del Sr. (Datos: N° atómico del Cs = 55, Sr = 38) Señale la alternativa que presenta la secuencia correcta después de determinar si la proposición es verdadera (V) o falsa (F). (Ex – UNI 2007 II) A) VVF B) VVV C) VFV D) VFF E) FFV 15. Con respecto a las variaciones periódicas de las propiedades de los elementos, señale la alternativa correcta: (Ex – UNI 2008 I) A) Los radios de los cationes de los elementos alcalinos disminuyen con el aumento del número atómico. B) Los radios de los cationes son mayores que los radios atómicos respectivos. C) Los metales de transición tienen los valores más altos de energía de ionización. D) Los elementos de un grupo tienen, entre sí, propiedades químicas diferentes. E) En la configuración electrónica de los elementos del grupo IIA, se tiene 2 electrones en la capa externa. 16. Comparando los elementos químicos Mg, K y Ca, señale la alternativa que presenta la secuencia correcta, después de determinar si las proposiciones siguientes son verdaderas (V) o falsas (F). I. El orden decreciente de la primera energía de ionización (EI) es: EICa > EIK > EIMg II. El orden decreciente del radio atómico (r) es: rMg > rK > rCa III. El magnesio, Mg, tiene la mayor electronegatividad. Números atómicos: Ca, calcio = 20 K, potasio = 19, Mg, magnesio = 12 (Ex – UNI 2012 I) A) VVF B) FVF C) VVV D) VFF E) FFV MCQ - 41 QUÍMICA – NIVEL INTERMEDIO PREINGENIERIA Preguntas propuestas 01. Indique el valor de verdad de las proposiciones siguientes: I. Mendeleiev agrupó los elementos en función de sus propiedades químicas y “pesos atómicos”. II. Para ordenar los elementos de Meyer utilizó la valencia o capacidad de combinación de los elementos químicos. III. Si la ley Periódica de Mendeleiev fuese exacta el Teluro debería estar ubicado con los halógenos y el yodo con los anfígenos. A) VVV B) VFV C) VFF D) FFV E) FVF 02. El ordenamiento periódico de los elementos que realizó L. Meyer está basado en A) La variación de las valencias con respecto al número atómico. B) La variación de las densidades con los “pesos atómicos”. C) La variación de los volúmenes atómicos con los “pesos atómicos”. D) La variación de radios atómicos con los números atómicos. E) La variación de las valencias con los “pesos atómicos”. 03. Respecto a los elementos A, D y F, se sabe que A y D son del mismo grupo, y D y F son del mismo periodo, por lo tanto se puede concluir correctamente que: I. A y D deben tener propiedades similares. II. D y F tienen una configuración electrónica con igual número de niveles de energía. III. A y D deben terminar en similar configuración electrónica. A) Solo I B) Solo II C) Solo III D) I y II E) I, II y III 04. Respecto a los grupos de la tabla periódica moderna y su configuración electrónica terminal, marque lo incorrecto. A) Metales alcalino-térreos ns2 B) Halógenos ns2np5 C) Metales alcalinos ns1 D) Calcógenos ns2np3 E) Anfígenos ns2np4 05. Indique el valor de verdad (V) de las proposiciones siguientes: I. Un elemento que tiene 4 electrones en su cuarto nivel de energía es un elemento representativo. II. Un metal puede ser elemento representativo o elemento de transición. III. Los no metales son elementos representativos. A) VVV B) VVF C) FVV D) FFF E) FVF 06. Respecto a los elementos de la TPM, señale las proposiciones verdaderas (V) o falsas (F): I. La gran mayoría de los elementos son metales. II. Los no metales pueden ser sólidos, líquidos o gases. III. El silicio es un semimetal. Es por ello que es un semiconductor. MCQ - 42 QUÍMICA – NIVEL INTERMEDIO A) VVV D) VVF 07. B) VFV E) FFF PREINGENIERIA C) FVV Indique el valor de verdad de las proposiciones siguientes: I. Un elemento cuyo anión dinegativo es isoelectrónico con II. III. A) D) 20 Ca 2+ es un semimetal. Un elemento que tiene 11 electrones en su tercer nivel de energía es un metal. Los elementos representativos pueden ser metales, no metales o semimetales. VVV B) VFV C) FVV FVF E) FFF 08. Diga que proposiciones son correctas: I. Se denominan elementos representativos a los elementos de los grupos IA al VIIA, o según la IUPAC son los correspondientes a los grupos 1, 2, 13, 14, 15, 16, 17. II. Los elementos que presentan configuración de valencia con subniveles s o s-p (los de mayor número cuántico principal) corresponden a los denominados elementos representativos y a los gases nobles, y todos ellos abarcan los tres estados de agregación (sólido, líquido y gaseoso). III. Son elementos representativos: 35Cs, 31Ga, 50Sn, 83Bi, 34Se. A) VVV B) VVF C) VFV D) FVV E) FVF 09. En relación a la tabla periódica, identifique la alternativa incorrecta: X W Y Z A) B) C) D) E) 10. El bloque Z, corresponde a los metales de transición interna. El bloque X, Y, Z, corresponden a elementos metálicos. El bloque W contiene metales, no metales y semimetales. El bloque Y corresponde a metales de transición. El bloque Y corresponde a elementos típicamente dúctiles, maleables y malos conductores eléctricos. Escriba la notación de Lewis para un elemento (E), en cuya configuración se observa que _ existen 17 e en sus subniveles ℓ = 1. A) D) 11. ii iE i i ii iE i ii i B) E E) C) iE i ii iE i i ii Indique el valor de verdad de las proposiciones siguientes: MCQ - 43 QUÍMICA – NIVEL INTERMEDIO PREINGENIERIA ii I. Un elemento, cuyo anión trinegativo tiene la representación de Lewis ii E ii ii 3− , pertenece al grupo VIA. II. Un ion que tiene tantos electrones como el 23 V 2 + : [ Ar ] 3d3 , se origina de un elemento que pertenece al grupo VB y 4º periodo. III. Los elementos ferromagnéticos pertenecen al grupo VIIIB. A) VVV B) VVF C) VFF D) FFV E) FFF 12. Indique las proposiciones correctas, teniendo en cuenta la siguiente información. Elemento Z Na 11 Aℓ 13 S 16 I. El radio atómico del aluminio es mayor que el radio atómico del sodio. II. El radio del S 2 _ es menor que el radio del A ℓ + III. El radio del Na es mayor que el radio del A ℓ A) Solo I B) Solo II C) Solo III D) I y II E) I, II y III 13. 3+ . 3+ Diga que proposiciones son correctas (V) y cuáles son incorrectas (F): + _ I. Los radios de un átomo E y sus iones E y E radio del átomo es 91,4 pm. 3+ son 15 pm; 91,4 pm y 260 pm; entonces el 2+ II. El radio del Fe es mayor que el radio del Fe . III. Los elementos alcalinotérreos tienen radios atómicos e iónicos mayores que los radios de los átomos e iones del grupo 1, respectivamente. A) VVV B) VVF C) VFF D) FVF E) FFV 14. Indique la veracidad (V) o falsedad (F) de las proposiciones siguientes: I. La energía de ionización es la mínima energía necesaria para arrancar un electrón de un átomo en estado gaseoso. II. Es un ejemplo de un proceso de ionización. + _ Ca(g) → Ca(g) + 1e ; E1 = +590 kJ/mol III. La afinidad electrónica es la energía desprendida cuando un átomo en estado gaseoso acepta un electrón. A) VVV B) FFV C) VVF D) FVV E) VFV 15. Indique verdadero (V) o falso (F) según corresponda: I. Para un elemento dado, la segunda energía de ionización siempre es menor que la primera energía de ionización. II. La afinidad electrónica del potasio 19K es menor que la del bromo 35Br. MCQ - 44 QUÍMICA – NIVEL INTERMEDIO PREINGENIERIA III. Los elementos con afinidad electrónica positiva, ganan electrones con gran facilidad cuando forman iones negativos. A) VVV D) FFV 16. B) VFV E) FFF C) FVF Determine las proposiciones verdaderas (V) o falsas (F): I. El proceso + 2+ _ Na(g) + energía → Na(g) + e corresponde a la segunda ionización del sodio. II. III. A) D) 17. Respecto a los metales alcalinos, el cesio tiene mayor energía de ionización que el litio. Los no metales tienen afinidades electrónicas negativas. VVV B) FVF C) VFV FVV E) FFF Identifique la especie química de menor radio y mayor energía de ionización: A) 8 O(g) B) 9 F(g) D) 11Na(g) E) 12 Mg(g) C) 5 B(g) 18. Indique la alternativa incorrecta: A) En la escala de Pauling los elementos de más alta electronegatividad son: F, O, N, Cℓ B) En un grupo de la Tabla Periódica Moderna, el elemento de menor número atómico posee mayor electronegatividad. C) En un periodo de la Tabla Periódica Moderna, la electronegatividad aumenta con el número atómico. D) El 12 Mg es más electronegativo que el 13 Aℓ . E) La electronegatividad es la tendencia de un átomo a atraer electrones hacia su núcleo cuando forma un enlace químico. 19. Indique las proposiciones correctas: I. Para elementos de la Tabla Periódica Moderna que se encuentren en un mismo grupo la electronegatividad aumenta con la disminución de la carga nuclear. II. En la Tabla Periódica Moderna a mayor número atómico (Z) mayor electronegatividad. III. En general los metales son más electronegativos que los no metales. A) VVV B) VFF C) VFV D) FFV E) FFF 20. Respecto al elemento químico con Z = 33 , indique lo correcto. I. Tiene estado de oxidación máximo +7. II. Tiene estado de oxidación mínimo – 3 . III. Es un elemento del grupo VA. A) I y II B) Solo II C) II y III D) Solo III E) I y III MCQ - 45 QUÍMICA – NIVEL INTERMEDIO PREINGENIERIA Bibliografía Cepreuni, Material de Química, preuniversitario, Lima, Peru 2013. Banco de preguntas de la UNI desde 1980 hasta el 2014. Desarrollado por micienciaquimica, material en constante cambio. GARRITZ – CHAMIZO. Estructura Atómica, un enfoque Químico. Fondo Educativo Interamericano, S.A. México. 1986. ROMO DE VIVAR; Alfonso. Química Universo Tierra y Vida. Quinta reimpresión. UNAM, México. 1996. CHANG; Raymond. Química. Editorial McGraw – Hill Interamericana editores. Séptima edición. Colombia. 2002. Netgrafía • http://renovacionciencias.wordpress.com/grado-decimo/estructura-atomica/ • http://www.nature.com/ncomms/journal/v3/n7/full/ncomms1944.html • http://www.lavozdegalicia.es • http://www.micienciaquimica.blogspot.com MCQ - 46