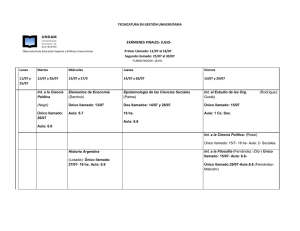
Curso sobre Avances y Actualización en Bio-Radioterapia
Anuncio

3/5/07 09:49 Página 1 Curso sobre Avances y Actualización en Bio-Radioterapia CURSOS_ESO_BioRadio_2007_CUB_v7 Curso sobre Avances y Actualización en Bio-Radioterapia Curso de la ESO 10-11 mayo 2007 Coordinadores: Dr. Felipe A. Calvo, ES Dr. Manuel de las Heras, ES European School of Oncology Milan, Italy tel: +39 02 8546 451 fax:+39 02 8546 4545 e-mail: eso@esoncology.org website: www.cancerworld.org Centro Nacional de Investigaciones Oncológicas (CNIO) Melchor Fernández Almagro, 3 28029 Madrid www.cnio.es CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:52 Página 1 CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:52 Página 2 CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 3 Curso sobre Avances y Actualización en Bio-Radioterapia Curso de la ESO 10-11 mayo 2007 Coordinadores: Dr. Felipe A. Calvo, ES Dr. Manuel de las Heras, ES Centro Nacional de Investigaciones Oncológicas (CNIO) Melchor Fernández Almagro, 3 28029 Madrid www.cnio.es La reproducción del material de este libro está condicionada a la obtención previa del permiso correspondiente de los ponentes. CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 4 ÍNDICE Introducción . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 7 Programa del curso . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 9 Lista de ponentes . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 12 Sesión 1 . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 15 Técnicas especiales: índice terapeútico e impacto en los resultados clínicos . . . . . . . . . . . . Dr. Ignacio Petschen 17 Radiocirugía craneal. La radioterapia estereoatáxica actual en tumores cerebrales. El neurinoma del acústico como modelo . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Dr. Salvador Villá 4 23 Radioterapia intraoperatoria . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Dra. Carmen González San Segundo 27 Radioterapia de intensidad modulada . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Dr. José López Torrecilla 33 La braquiterapia: Tendencias actuales y futuras . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Dr. Ferrán Guedea 37 Sesión 2 . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 43 Radioterapia 3D . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Dr. Alfredo Ramos 45 El desarrollo de la radioterapia 4D . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Dra. Pino Alcántara 49 Disponibilidad y oportunidades del PET-TAC . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Dr. Juan Antonio Díaz-González 53 Fusión de imagen y planificación dosimétrica . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Dr. Alfredo Serna 59 Sesión 3 . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 63 Radioquimioterapia en tumores de cabeza y cuello . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Dr. Alejandro de la Torre 65 Radioterapia modulada por nuevas dianas biológicas en carcinoma de cabeza y cuello . . . Dr. Jordi Giralt 69 Descenso de estadificación patológica en cáncer de recto . . . . . . . . . . . . . . . . . . . . . . . . . . Dr. Francisco Javier Serrano 75 Perfil molecular y neoadyuvancia en cáncer de recto . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Dra. Laura Cerezo 81 Curso sobre avances y actualización en Bio-Radioterapia CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 5 Sesión 4 . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 87 Supresión androgénica asociada a radioterapia en el tratamiento del cáncer de próstata . . . Dra. Almudena Zapatero 89 Cáncer de pulmón . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Dr. Ismael Herruzo 95 Cáncer de mama . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Dr. Enrique Alonso 109 Radiobiología y Radioterapia basada en la evidencia modelos clínicos: Cáncer esófago-gástrico . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Dr. Luis Alberto Pérez Romasanta Índice 113 Metástasis óseas: Radioterapia basada en la evidencia modelos clínicos . . . . . . . . . . . . . . . . Dra. Amalia Palacios 117 Metástasis cerebrales . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Dr. Victor Muñoz 125 Re-irradiación . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Dr. Ignacio Azinovic 133 Conclusiones . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 139 Fundamentos de la Investigación Translacional aplicada en el campo de la Radioterapia . . . . Dr. Manuel de las Heras 141 5 CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 6 CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 7 Introducción a radioterapia es una actividad asistencial integrada en la medicina especializada de los países desarrollados y en el fundamento de la especialidad oncológica más antigua reconocida en la Unión Europea. La radioterapia oncológica progresa por la fusión del conocimiento generado por el avance tecnológico de aplicación médica y los adelantos en la biología humana. El uso de radiaciones ionizantes en el tratamiento del cáncer define la práctica médica de los especialistas en Oncología Radioterápica. La investigación clínica y translacional (aplicada), es un componente de actividad imprescindible en cualquier faceta del cáncer humano. Sus fundamentos incluyen un amplio espectro de actividad científica: física de radiaciones, biología tumoral y de tejidos normales, imagen biomédica, patología médico-quirúrgica y soporte clínico-farmacológico de síntomas. Este curso revisa, en un nivel divulgativo y actualizado, las implicaciones biológicas de la práctica clínica radioterápica con especial énfasis en modelos de desarrollo tecnológico por subtipos tumorales. Es de interés para oncólogos, biólogos, radiofísicos, diplomados universitarios de enfermería y técnicos, así como para cualquier médico con interés en los conceptos prácticos y doctrinales del cáncer. L Introducción 7 CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 8 CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 9 PROGRAMA Jueves 10 de mayo PRESENTACIÓN Y BIENVENIDA 08:55 Dr. Miguel Angel Piris Centro Nacional de Investigaciones Oncológicas, Madrid Sesión I . RADIOBIOLOGÍA DE LA RADIOTERAPIA PRECISA 09:00 Técnicas especiales: índice terapeútico e impacto en los resultados clínicos Dr. Ignacio Petschen. Hospital Universitario La Fé, Valencia 09:20 Radiocirugía craneal. La radioterapia estereoatáxica actual en tumores cerebrales. El neurinoma del acústico como modelo Dr. Salvador Villá. Instituto Catalán de Oncología, Hospitalet, Barcelona 09:40 Radioterapia intraoperatoria Dra. Carmen González San Segundo, Hospital Universitario Gregorio Marañón, Madrid 10:00 Radioterapia de intensidad modulada Dr. José López Torrecilla. Hospital General Universitario, Valencia 10:20 La braquiterapia: Tendencias actuales y futuras Dr. Ferrán Guedea. Instituto Catalán de Oncología, Hospitalet, Barcelona 10:40 Discusión 11:00 Descanso Programa 9 CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 10 Sesión 2 . RADIOTERAPIA GUIADA POR LA IMAGEN 11:30 Radioterapia 3D Dr. Alfredo Ramos. Hospital Universitario Ramón y Cajal, Madrid 11:50 El desarrollo de la radioterapia 4D Dra. Pino Alcántara. Hospital Clínico San Carlos, Madrid 12:10 Disponibilidad y oportunidades del PET-TAC Dr. Juan Antonio Díaz-González. Clínica Universitaria de Navarra, Pamplona 12:30 Fusión de imagen y planificación dosimétrica Dr. Alfredo Serna. Hospital Universitario Virgen de la Arrixaca, Murcia 12:50 Discusión 13:10 Descanso / Almuerzo Sesión 3 . RADIOBIOLOGÍA DE LA RESPUESTA TUMORAL: MODELOS CLÍNICOS 15:40 Radioquimioterapia en tumores de cabeza y cuello Dr. Alejandro de la Torre. Hospital Universitario Puerta de Hierro, Madrid 16:00 Radioterapia modulada por nuevas dianas biológicas en carcinoma de cabeza y cuello Dr. Jordi Giralt. Hospital Universitari Vall d’Hebron, Barcelona 16:20 Descenso de estadificación patológica en cáncer de recto Dr. Francisco Javier Serrano. Hospital General Universitario Gregorio Marañón, Madrid 16:40 Perfil molecular y neoadyuvancia en cáncer de recto Dra. Laura Cerezo. Hospital Universitario La Princesa, Madrid 17.00 Discusión 10 Curso sobre avances y actualización en Bio-Radioterapia CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 11 Viernes 11 de mayo Sesión 4 . RADIOBIOLOGÍA Y RADIOTERAPIA BASADA EN LA EVIDENCIA MODELOS CLÍNICOS 09:00 Supresión androgénica asociada a radioterapia en el tratamiento del cáncer de próstata Dra. Almudena Zapatero. Hospital Universitario La Princesa, Madrid 09:20 Cáncer de pulmón Dr. Ismael Herruzo. Hospital Universitario Carlos Haya, Málaga 09:40 Cáncer de mama Dr. Enrique Alonso. Hospital Universitario Puerta del Mar, Cádiz 10:00 Radiobiología y Radioterapia basada en la evidencia modelos clínicos: Cáncer esófago-gástrico Dr. Luis Alberto Pérez Romasanta. Hospital Nuestra Sra de Alarcos, Ciudad Real 10:20 Discusión 10:40 Descanso 11:10 Metástasis óseas: Radioterapia basada en la evidencia modelos clínicos Dra. Amalia Palacios. Hospital Universitario Provincial Reina Sofía, Córdoba 11:30 Metástasis cerebrales Dr. Victor Muñoz. Hospital Meixoeiro, Vigo. Pontevedra 11:50 Re-irradiación Dr. Ignacio Azinovic. Hospital San Jaime, Torrevieja 12:10 Discusión RADIOBIOLOGÍA CLÍNICA ACTUALIZADA: CONCLUSIONES 12:30 Fundamentos de la Investigación Translacional aplicada en el campo de la Radioterapia Dr. Manuel de las Heras. Hospital clínico San Carlos, Madrid 12:50 Fundamentos de la Investigación Clínica Dr. Felipe A. Calvo. Hospital Universitario Gregorio Marañón, Madrid Programa 11 CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 12 PONENTES Alcántara, Pino pinoac@yahoo.es Médico Especialista de Área. Hospital Universitario Clínico San Carlos (Madrid) Alonso, Enrique ejalon@infonegocio.com Hospital Universitario Puerta del Mar (Cádiz) Azinovic, Ignacio azinovic@hsanjaime.com USP Hospital San Jaime (Torrevieja) Calvo, Felipe A. fcalvo.hgugm@salud.madrid.org Jefe del Departamento de Oncología. Hospital Universitario Gregorio Marañón (Madrid) Cerezo, Laura lcerezo.hlpr@salud.madrid.org Jefe de Sección y Responsable de la Unidad. Servicio de Oncología Radioterápica, Hospital Universitario La Princesa (Madrid) Díaz González, Juan Antonio jadiaz@unav.es Clínica Universitaria Universidad de Navarra (Pamplona) Giralt, Jordi jgiralt@vhebron.net Jefe de Sección y Responsable de la Unidad. Hospital Universitari Vall d`Hebron (Barcelona) González San Segundo, Carmen cgss@saludalia.com Hospital Universitario Gregorio Marañón (Madrid) Guedea, Ferrán guedea@iconcologia.net Jefe del Servicio Oncología ICO. Institut Català d'Oncologia (ICO), Hospital Duran y Reynals (Barcelona) H de las eras, Manuel mherasonco@yahoo.es Jefe de Servicio de Oncología Radioterápica. Hospital Clínico San Carlos (Madrid) Herruzo, Ismael ismael.herruzo.sspa@juntadeandalucia.es Jefe de Servicio de Oncología Radioterápica. Hospital Universitario Carlos Haya (Málaga) Lanzós, Eduardo elanzos.hdoc@salud.madrid.org Hospital Universitario 12 Octubre (Madrid) López Torrecilla, José jltorrecilla@eresa.com Jefe de Servicio. Hospital General Universitario (Valencia) Mañas, Ana amanas.hulp@salud.madrid.org Presidenta de la Sociedad Española de Oncología Radioterápica SEOR Jefe del Servicio de Oncología Radioterápica. Hospital Universitario La Paz (Madrid) 12 Curso sobre avances y actualización en Bio-Radioterapia CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 13 Muñoz, Victor M. victor.munoz.garzon@sergas.es Responsable de la Unidad. Hospital Do Meixoeiro. Instituto Galego de Medicina Técnica (Vigo) Palacios, Amalia amalia.palacios@telefonica.net Jefe de Servicio. Hospital Universitario Provincial Reina Sofía (Córdoba) Pedraza, Vicente vpedraza@ugr.es Catedrático de Radiología y Medicina Física. Universidad de Granada. Presidente de la Comisión de la Especialidad. Hospital Clínico San Cecilio (Granada) Pérez Romasanta, Luís Alberto luisp@sescam.jccm.es Jefe de Servicio Oncología Radioterápica Hospital General de Ciudad Real (Ciudad Real) Petchen, Ignacio petschen_ign@gva.es Jefe de Servicio. Hospital Universitario La Fe (Valencia) Ramos, Alfredo aramosa.hrc@salud.madrid.org Hospital Universitario Ramón y Cajal (Madrid) Serna, Alfredo alfredo.serna@carm.es Servicio Oncología Radioterápica, Servicio de Radiofísica. Hospital Universitario Virgen de la Arrixaca (Murcia) Serrano, Francisco Javier javierserrano@clinicalaluz.es Hospital General Universitario Gregorio Marañón (Madrid) T orre, Alejandro Atorre.hpth@salud.madrid,org de la Hospital Universitario Puerta de Hierro (Madrid) Villá, Salvador svilla@ico.scs.es Médico Especialista de Área. Hospital Universitàri Germans Trias i Pujol. ICO (Badalona) Zapatero, Almudena azapatero.hlpr@salud.madrid.org Médico Especialista de Área. Hospital Universitario La Princesa (Madrid) Ponentes 13 CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 14 CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 15 Sesión 1 RADIOBIOLOGÍA DE LA RADIOTERAPIA PRECISA CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 16 CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 17 TÉCNICAS ESPECIALES: ÍNDICE TERAPEÚTICO E IMPACTO EN LOS RESULTADOS CLÍNICOS Dr. Ignacio Petschen Jefe del Servicio de Oncología Radioterápica Hospital Universitario La Fé, Valencia CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 18 CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 19 Radiobiología de la radioterapia precisa: Técnicas especiales. Índice terapéutico y su impacto Dr. Ignacio Petschen Verdaguer Servicio de Oncología Radioterápica, Hospital Universitario de La Fé, Valencia a radioterapia (RT) de alta precisión determina distribuciones de dosis y fraccionamientos que se apartan de los modelos de la RT convencional. La alta precisión implica una elevada conformación de la dosis, por lo que las altas dosis se ajustan al volumen tumoral, con una brusca caída de las mismas hacia los tejidos sanos peritumorales. Ello permite: L – Intensificación de la dosis tumor – Dosis en los órganos críticos (OR), aunque más bajas, de distribución heterogénea. – Hipofraccionamiento – Fracción única Dichas características modifican sin duda los parámetros estándares con repercusión radiobiológica, y deben tomarse en consideración para el cálculo de las TCP y NTCP. No digamos ya si se trata de radiaciones corpusculares con mayor eficacia biológica relativa (RBE). Distinguiremos como técnicas de RT externa de alta precisión (no abordaremos la braquiterapia): – RT de intensidad modulada (IMRT) – RT estereotáxica – Radiocirugía – Radioterapia intraoperatoria (RTIO) – Hadronterapia La primera comporta frecuentemente una falta de uniformidad o una heterogeneidad en la distribución de dosis en los órganos sanos próximos al tumor, lo que modifica sin duda alguna la estimación del riesgo. Hasta ahora la estimación de las complicaciones se basaba en el modelo de Lyman, Kutcher, Burman obtenido de datos clínicos recogidos por Emami. Las dosis recibidas por todo o parte del OR en cuestión indica la probabilidad de complicación. Las actuales técnicas que implican una gran heterogeneidad de dosis en los OR, medida en los histogramas dosis/volumen (HDV), hacen necesaria la construcción de nuevos modelos matemáticos. Una reciente publicación (1) propone un nuevo estándar para referir los resultados de los protocolos de RT : el atlas de incidencias de complicaciones basado en los HDV, del que se obtendrán modelos más adecuados . Especial interés tiene el riesgo de carcinogénesis en los pacientes tratados con estas técnicas, pues al implicar estas modernas tecnologías mayor volumen de tejidos sanos expuesto a dosis bajas, este riesgo se incrementa. Para ello el modelo de competición de riesgo entre inducción de mutaciones del ADN y la muerte celular parece el más apropiado, considerando al mismo tiempo la distribución completa de la dosis (2). Estimaciones teóricas, aunque obtenidas de estudios de pacientes irradiados por cáncer, incrementan este riesgo si se utiliza la IMRT (factor de 1.75 a 2) al aumentar la dosis integral por mayor número de incidencias y más unidades monitor (3). Ello tiene especialísimo interés en la RT de los tumores infantiles, pues su corta edad predispone a la cacinogénesis de los niños que sobreviven. El hipofraccionamiento no reporta beneficio en la inmensa mayoría de los tumores, puesto que el cociente alfa/beta del tumor es superior al del de los efectos tardíos en los tejidos sanos, lo que reduce el índice terapéutico, excepción hecha de algunos tumores como el melanoma y el carcinoma Sesión 1 19 CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 20 de próstata (4). Aunque en apoyo del hipofraccionamiento debe considerarse también, especialmente en la intensificación de dosis, la repoblación acelerada tumoral que, sobre todo en tumores de corto Tpot, exige reducir el tiempo total de tratamiento, por tanto, aumentar la dosis por fracción en vez de aumentar el número de fracciones (5). Otra circunstancia a tener en cuenta es que la precisa determinación de la forma y volumen tumorales con las modernas técnicas diagnósticas y la capacidad de concentrar las altas dosis en dichos volúmenes, junto a la mayor complejidad de cada sesión de RT, hacen muy recomendable el hipofraccionamiento, llegando a no superarse las 5 sesiones en el caso de la RT estereotáxica o, incluso, a la sesión única en el caso de la radiocirugía. En ella los fenómenos biológicos inducidos difieren de los de la RT fraccionada, pues parte de su efecto se basa en una necrosis localizada debida, en las lesiones cerebrales, a alteraciones vasculares que provocan una endarteritis obliterante, y a una alteración glial. La ya larga experiencia y buenos resultados de esta tecnología en tumores y determinada patología cerebral, avalan su práctica. Su extensión a tumores de tronco mediante el “stereotactic body frame” se encuentra en fase de evaluación, debiendo realizarse ensayos bien diseñados que demuestren su eficacia. La RTIO sólo puede realizarse evidentemente en sesión única, basándose su indicación en la visión directa del tumor y el alejamiento mecánico de los OR. Alternativas a ella son la BTIO (braquiterapia intraoperatoria) y sobreimpresiones con equipos punteros como la tomoterapia helicoidal o el “ciberknife”. Localizaciones tumorales abdominales de comprometida resecabilidad total, en las que el control local es determinante del pronóstico, como es el cáncer de recto loco-regional avanzado o recidivante, o los sarcomas retroperitoneales, son las indicaciones más definidas (6). No debe olvidarse la RTIO como técnica de irradiación mamaria parcial en cáncer de mama precoz. Pese a contar con numerosos trabajos que ponen de manifiesto muy elevadas tasas de control local, se echan en falta ensayos comparativos que establezcan su definitivo valor. En lo que a los hadrones se refiere contamos con la ventaja de una distribución de dosis excelente a causa del “pico de Bragg”, haciendo que las dosis que reciben los tejidos sanos sean mínimas; ello conduce a que la indicación preferente sea la de tumores perfectamente delimitables, adyacentes a OR, sobre todo si en ellos se demuestra efectiva la escalada de dosis. Se han obtenido excelentes resultados en cordomas y condrosarcomas de base de cráneo y cervicales, así como en melanomas oculares (7,8). Un campo de aplicación que se impone por su lógica es el de los tumores de la infancia, especialmente del SNC, habida cuenta de la morbilidad que pueden causar bajas dosis en tejidos sanos en desarrollo, así como su potencial carcinogenético. Análisis que calculan este riesgo, basados en el modelo de la publicación nº 60 de la ICRP, obtienen una reducción del mismo que oscila entre un factor de 2 ,para un rabdomiosarcoma, y un factor de entre 8 y 15, para un meduloblastoma (9). Por último determinados tumores sólidos del adulto, como carcinomas de próstata, de cabeza y cuello, de pulmón no microcítico, hepatocelular..., pueden también beneficiarse de los protones, bien a título exclusivo, bien en combinación con fotones (7,8). Junto a las ventajas puramente físicas de distribución de dosis descritas para los hadrones, existen otras de carácter biológico por tratarse de radiaciones corpusculares de mayor transferencia lineal de energía (LET). Escasamente superior en el caso de los protones, pues su aumento sólo se produce en el pico de Bragg, por lo que la componente del “plateau” al extender los haces de protones por el PTV hace que la media de la RBE sea de 1,1 (entre 0,9 y 1,4). Se tendrá pues en cuenta cuando los órganos de riesgo se encuentren inmediatamente detrás del pico de Bragg, y pudieran ser alcanzados por éste. Recientes estudios apuntan hacia una elevada inducción de apoptosis cuando determinadas líneas celulares se irradian con protones (10). Cuando se utilizan iones de peso elevado –el carbono 20 Curso sobre avances y actualización en Bio-Radioterapia CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 21 es el más utilizado en la actualidad- la RBE alcanza valores de entre 2 y 3. Ello añade, a la característica ya mencionada de una excelente distribución de dosis física, la de una menor dependencia del oxígeno, de las fases del ciclo celular, y una menor capacidad de reparación del daño subletal. Por ello su indicación será preferente en tumores bien diferenciados de crecimiento lento, radio-resistentes por hipoxia, con lenta redistribución celular y con alta reparación intracelular. Tumores de glándulas salivares, de senos paranasales, sarcomas de partes blandas y óseos localmente avanzados, de bajo grado especialmente, son neoplasias candidatas a esta modalidad terapéutica (6). De todos modos parece razonable que, tanto para los protones como para los iones, se demuestre su beneficio en ensayos prospectivos aleatorizados, antes de extender profusamente las instalaciones de hadronterapia (11,12). Bibliografía 1. Jackson A, Yorke ED and Rosenzweig KE. The atlas of complication incidence: A proposal for a new standard for reporting the results of radiotherapy protocolos. Semin Radiat Oncol 16: 260-268, 2006. 2. Dasu A., Toma-Dasu I, Olofsson J and Karlsson M. The use of risk estimation models for induction of secondary cancers following radiotherapy. Acta Oncologica 44: 339-347, 2005. 3. Hall EJ and Wuu CH-S. Radiation induced second cancers: The impact of ·D-CRT and IMRT. Int J Radiat Oncol Biol Phys 56: 83-88, 2003. 4. Brenner DJ, Martinez AA, Edmundson GK et al. Direct evidence that prostata tumors show high sensitivity to fractionation (low alfa/beta ratio), similar to late-responding normal tissue. Int J Radiat Oncol Biol Phys 52: 6-13, 2002. 5. Jones L, Metcalfe P and Hoban P. Accounting for treatment delays when treating highly proliferative tumors. Phys Med Biol 44: 223-234, 1999. 6. Willet CG, Czito BG and Tyler DS. Intraoperative Radiation Therapy. J Clin Oncol 25: 971-977, 2007. 7. Schulz-Ertner, Jäkel O and Schlegel W. Radiation therapy with charged particles. Semin Radiat Oncol 16: 249-259, 2006. 8. Spiro IJ et al. Proton Beam Radiation Therapy. Chapter 65 of Principles and Practice of Oncology. De Vita VT et al. 6th Edition (ISBN:0-7817-2229-2), pg. 3229-34. 9. Miralbell R, Lomax A, Cella L and Schneider U. Potential reduction of the incidence of radiationinduced second cancers by using proton beams in the treatment of pediatric tumors. Int J Radiat Oncol Biol Phys 54: 824-829, 2002. 10. Di Pietro C, Piro S, Ragusa M et al. Cellular and molecular effects of protons: Apoptosis induction and potential implications for cancer therapy. Apoptosis 11: 57-66, 2006. 11. Brada M, Pijls-Johannesma M and De Ruysscher D. Proton therapy in clinical practice: Current clinical evidence. J Clin Oncol 25: 965-970, 2007. 12. Pijls-Johannesma M, De Ruysscher D, Dekker A and Lambin PH. Protonen en ionen in de behandeling van kanker; systematisch literatuuroverzicht. Ned tijdschr geneeskd, 150: 2435-41, 2006. Sesión 1 21 CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 22 CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 23 RADIOCIRUGÍA CRANEAL LA RADIOTERAPIA ESTEREOATÁXICA ACTUAL EN TUMORES CEREBRALES. EL NEURINOMA DEL ACÚSTICO COMO MODELO Dr. Salvador Villà Médico Especialista de Área, Oncologia Radioteràpica Hospital Universitàri Germans Trias i Pujol ICO Badalona CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 24 CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 25 Radiocirugía craneal La radioterapia estereoatáxica actual en tumores cerebrales. El neurinoma del acústico como modelo Dr. Salvador Villà, Oncologia Radioteràpica, H. Universitàri Germans Trias i Pujol ICO, Badalona a Radiocirugía (RC) fue descrita por L. Lekesell a principios de los años 1950 en el Instituto Karolinska de Estocolmo. El término RC se aplica a la administración de una sola dosis alta de radiación en un volumen intracraneal de volumen reducido. El término Radioterapia Estereoatáxica Fraccionada (RTEF) se fundamenta en los mismos criterios físicos y mecánicos que la RC pero con un fraccionamiento de la dosis. Clásicamente el I. Karolinska se basó en dosis única para lesiones o tumores cerebrales, más como criterio quirúrgico que oncológico. L La Radioterapia estereoatáxica (RTE) craneal, que sería el término más correcto en la actualidad, se define, pues, como el tratamiento con irradiación ionizante de lesiones intracraneales u oculares usando haces directos y convergentes de manera estereoatáxica en dosis única (RC) o en dosis fraccionada (RTEF). Desde hace muchos años los tratamientos con RT se han propuesto que sean con fracciones de irradiación separadas para llegar a una dosis total determinada en relación al control tumoral, paliación de síntomas y un cociente de efectividad terapéutica y efectos secundarios lo más favorable posible para la primera. En los últimos 25 años, se han ido modificando, primero las dosis totales en RC y, posteriormente, el número de fracciones para llegar en la actualidad a un verdadera dualidad en muchas patologías tumorales. Es decir, muchos tumores cerebrales que son admitidos para RT estereoatáxica pueden ser tratados tanto con dosis única como con algún esquema de fraccionamiento, sin una evidencia clara en la literatura de cual es la mejor opción; y con una interpretación difícil en cuanto a resultados de respuesta tumoral y efectos secundarios (ES). Uno de los tumores que han sufrido esta evolución terapéutica es el achwanoma o neurinoma del acústico (NA), lesión localizada en el ángulo pontocerebeloso y en íntimo contacto con el nervio facial, el nervio trigémino y el tronco cerebral, e, indirectamente, con el IV ventrículo. El NA es un tumor relativamente raro con una incidencia de 1 caso nuevo por 100.000. Aproximadamente entre un 2 y un 4% de pacientes con NA tienen NF2, cuya incidencia es de 1 por 50.000 de la población general. Los pacientes con NA tienen diversas opciones terapéuticas. La simple observación en determinados casos, la microcirugía, la RC o la RTEF son opciones igualmente válidas y los controles del tumor a cinco años son similares en las 3 opciones terapéuticas En el NA tratado con RTE buscamos la reducción o desaparición del tumor y una incidencia mínima o nula de ES. Las dosis altas administradas en volúmenes pequeños con RC están fuera del rango de dosis que se usa en radioterapia convencional, de manera fraccionada y en volumen grande. La relación dosis-fracción-tiempo-volumen es fundamental para entender las complicaciones. Es necesario, además, prestar atención a las diferentes áreas cerebrales irradiadas. Se considera que la RC puede ser Sesión 1 25 CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 26 más tóxica que la RTEF. Las causas podrían estar relacionadas con la inhomogeneidad de la dosis en el volumen blanco, la dosis total, el tamaño del tumor y el sistema de fijación que puede modificar la precisión y cambiar las dosificación en zonas de órganos de riesgo próximas. Por lo tanto, la RTEF se ha convertido en una opción válida para sustituir a la radiocirugía y los resultados en control tumoral son excelentes. El siguiente objetivo es conseguir que la toxicidad sea menor o nula y que la calidad de vida del paciente mejore. La evaluación y prevención de la toxicidad es de las preocupaciones mayores en este tipo de pacientes que tienen un pronóstico bueno a largo plazo. Un seguimiento regular y ordenado con test de neurofisiología (blink reflex, estimulación magnética transcraneal), audiometrías y neuroimagen con RMs craneales es fundamental para dicha evaluación. 26 Curso sobre avances y actualización en Bio-Radioterapia CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 27 RADIOTERAPIA INTRAOPERATORIA Dra. Carmen González San Segundo Hospital Universitario Gregorio Marañón, Madrid CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 28 CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 29 Radioterapia intraoperatoria Dra. Carmen González San Segundo Hospital Universitario Gregorio Marañón, Madrid INTRODUCCIÓN La Radioterapia Intraoperatoria (IORT) es una modalidad terapéutica que permite incorporar al tratamiento del cáncer, una dosis única de radiación durante el tiempo quirúrgico, como sobreimpresión o como tratamiento único, en un tumor no resecado o en el lecho quirúrgico, permitiendo el desplazamiento y la protección de los tejidos normales. Los pacientes subsidiarios de IORT son aquellos a los que se les va a someter a una resección quirúrgica y que tienen un alto riesgo de recidiva local, con limitación de la dosis de irradiación externa por la intolerancia a altas dosis de los órganos críticos. MODALIDADES Existen dos formas de IORT: – la IORT externa (IOERT) con electrones (figura 1). Puede realizarse con un acelerador lineal convencional o con un acelerador móvil, desplazable al quirófano. Sus ventajas frente a la IORT con braquiterapia son el menor tiempo de tratamiento, la posibilidad de emplear diferentes energías con diferentes rendimientos en profundidad y que no requiere habitaciones especiales blindadas. La dosis se prescribe en la isodosis del 90% – la braquiterapia con alta tasa de dosis (HDR-IORT) (figura 2) aplicada con dispositivos especiales como el aplicador de Harrison-Anderson-Mick (HAM), cargados con iridio 192. Sus ventajas frente a la IOERT son la mejor adaptación a superficies curvas y a cavidades estrechas inaccesibles a los conos de IOERT, la irradiación de volúmenes muy limitados y la posibilidad de irradiar la piel y el tejido subcutáneo. La dosis se prescribe habitualmente a un centímetro del plano de los catéteres o a 0’5 cm de la superficie del aplicador. En ambos casos, se suele asociar un componente de Radioterapia (RT) externa que permita aumentar los márgenes de seguridad y limitar el riesgo de recidivas marginales, ya que los márgenes aplicados con IORT son menores. PRINCIPIOS RADIOBIOLÓGICOS El objetivo básico de la IORT es mejorar el índice terapéutico al incrementar la relación dosis tumoral/dosis en tejidos normales. Al administrarse de forma única, maximiza el efecto biológico de la dosis, con una bioequivalencia entre 2 y 3 veces mayor que la dosis administrada con fraccionamiento convencional. Considerando el modelo lineal-cuadrático y asumiendo un α/β de 3 para los tejidos normales de respuesta lenta y un α/β de 10 para los tejidos tumorales, las bioequivalencias establecidas son: – 12 Gy: 25-30 Gy en fraccionamiento convencional – 15 Gy: 30-37’5 Gy – 20 Gy: 40-50 Gy Sesión 1 29 CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 30 Siguiendo los principios de radiobiología, la IORT aporta la ventaja de disminuir el riesgo de repoblación tumoral que se puede producir, incluso de forma acelerada, tras el tratamiento quirúrgico. La probabilidad de control tumoral disminuye con el incremento del número de células malignas iniciales. Al disminuir la repoblación en el intervalo entre la cirugía y la RT y entre las fracciones de RT externa convencional, el beneficio radiobiológico es evidente. La posibilidad de actuar sobre tejidos bien vascularizados con un óptimo metabolismo aerobio, también favorece el efecto beneficioso de la IORT (vasodilatación con aumento del flujo vascular inducido por la anestesia, ventilación con oxígeno puro durante la cirugía…). Sin embargo, el efecto beneficioso de la reoxigenación entre fracciones se pierde, sin despreciar tampoco el menor efecto sobre las células hipóxicas con los regímenes de hipofraccionamiento. La IORT, sin embargo, elimina las ventajas potenciales del fraccionamiento en lo que se refiere a la redistribución. Además, su principal desventaja deriva de la mala tolerancia a largo plazo de los tejidos normales cuando se utilizan dosis altas y únicas. La aparición de efectos secundarios tardíos, a partir de dosis de 15-17 Gy, hacen recomendable no sobrepasar dosis de prescripción de 20 Gy para evitar que la neurotoxicidad y las alteraciones vasculares se disparen. TOXICIDAD La mayor parte de los efectos secundarios tardíos se conocen a partir de estudios experimentales en animales, fundamentalmente en perros, llevados a cabo en la década de los 80. En general, aunque de gran interés científico, los resultados en animales no son completamente extrapolables a los resultados en humanos, ante la imposibilidad de reproducir en ellos el efecto de otros tratamientos como la quimioterapia o la influencia de la exéresis amplia de los tejidos. Además de la información facilitada por estos estudios, la experiencia acumulada por grupos de trabajo en IORT ha permitido conocer mejor la toxicidad tardía esperada con esta técnica. Los efectos secundarios además de ser dosis dependiente, se relacionan con otros parámetros como los tratamientos oncológicos aplicados, el volumen de irradiación, la longitud de las estructuras tubulares irradiadas o la posibilidad de desplazar o proteger los órganos sanos. El principal órgano limitante de dosis es el nervio periférico, con un riesgo de toxicidad tardía grave del 35% a los 5 años, si se sobrepasa su dosis de tolerancia. Con dosis de 10-15 Gy, se objetiva destrucción axonal y aumento del tejido conectivo endo, epi y perineural, A partir de 20 Gy, el riesgo de hialinización de los capilares con riesgo de trombosis y hemorragia se multiplica. Por ello, se recomienda no sobrepasar una dosis de 16 Gy cuando el volumen de tratamiento incluya una longitud importante de un nervio periférico. Otro órgano limitante es el uréter. Su afectación es más frecuente si se ha producido una disección de la túnica vascular. La ventaja respecto al nervio periférico es que su desplazamiento fuera del campo de tratamiento es más factible. Dosis superiores de 12’5 Gy pueden producir hasta dos tercios de complicaciones estenóticas. Aunque se concretará más en la ponencia sobre la tolerancia de otros órganos, finalizamos describiendo los daños a nivel vascular. Se traducen en isquemia progresiva por proliferación de la íntima de la microvasculatura, que puede condicionar obliteración de la misma a partir de los 20 Gy. Con dosis de 40 Gy, se produce una fibrosis de la íntima con necrosis hialina de la capa media. A diferencia de lo que ocurre en los modelos animales, el aumento del riesgo de tumores radioinducidos no se ha objetivado en pacientes tratados con IORT. 30 Curso sobre avances y actualización en Bio-Radioterapia CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 31 INDICACIONES Su descripción detallada sobrepasa el objetivo de este resumen. En la actualidad, junto a las indicaciones clásicas de IORT en tumores digestivos (páncreas, recto…), sarcomas y tumores de la esfera ORL, su indicación como técnica de sobreimpresión o tratamiento radioterápico completo en cáncer de mama y en tumores infantiles, es objeto de múltiples estudios y publicaciones en los últimos 5 años. Las ventajas cosméticas, la posibilidad de acortar el tiempo total de tratamiento y de realizar escalada de dosis, unidas a unas cifras muy prometedoras de control local, convierten a la IORT en un excelente tratamiento adyuvante en estas localizaciones tumorales. FUTURO Además de las mejoras técnicas, instrumentales y de coordinación multidisciplinar que se están implementando, la posibilidad de realizar investigación translacional con estudios inmunohistoquímicos y citogenéticos de las biopsias obtenidas durante la cirugía, tanto en los tejidos normales fuera y dentro del campo de irradiación, como de las células tumorales sometidas o no a la irradiación, es una realidad emergente en varios grupos de trabajo. La incorporación de pruebas funcionales como el PET que permitan monitorizar la actividad fisiológica de los tejidos normales y predecir su respuesta a la IORT es otra perspectiva de futuro que ya está en marcha. Bibliografía 1. Calvo FA, Meiriño RM, Orecchia R. Intraoperative radiation therapy. First part: Rationale and techniques. Critical Rev Oncol/Hematol 2006; 59:106-15. 2. Azinovic I, Calvo FA, Puebla F, Aristu J, Martínez-Monge R. Long-term normal tissue effects of intraoperative electrón radiation therapy (IOERT): late sequelae, tumor recurrence, and second malignancies. Int J Radiat Oncol Biol Phys 2001; 49:597-64. 3. Sindelar WF, Johnstone PAS, Hoekstra HJ, et al. Normal tissue tolerance to intraoperative irradiation: The National Cancer Institute experimental studies. In: Gunderson LL, Willett CG, Harrison LB, Calvo FA, editors. Intraoperative irradiation: Techniques and results. Totowa; NJ. Human Press; 1999:131-46. 4. Willet CG, Czito BG, Tyler DS. Intraoperative radiation therapy. J Clin Oncol 2007;25:971-7. 5. Beddar AS, Biggs PJ, Chang S, et al. Intraoperative radiation therapy using mobile electron lineal accelerators: repor t of AAPM Radiation Therapy Committee Task Group No. 72. Med Phys 2006;33:1476-89. 6. Beddar AS, Krishnan S, Briere TM, et al. The optimization of dose delivery for intraoperative highdose-rate radiation therapy using curved HAM applicators. Radiother Oncol 2006;78:207-12. 7. Cividalli A, Creton G, Ceciarelli F, Strigari L, Danesi D, Benassi M. Influence of time interval between surgery and radiotherapy on tumor regrowth. J Exp Clin Cancer Res 2005;24:109-16. 8. Oreccia R, Veronesi U. Intraoperative electrons. Semen Radiat Oncol 2005;15:76-83. 9. Radioterapia Intraoperatoria. Informe AETS, 1999. 10. Merrick HW, Gunderson LL, Calvo FA. Future directions in intraoperative radiation therapy. Surg Oncol Clin N Am 2003;12:1099-105. Sesión 1 31 CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 32 11. Hu KS, Enker WE, Harrison LB. High-dose-rate intraoperative irradiation: current status and future directions. Semin Radiat Oncol 2002;12:62-80. 12. Dubois JB. Late effects of intraoperative radiotherapy. Cancer Radiother 1997;1:817-22. 13. Sindelar WF, Tepper JE, Kinsella TJ, et al. Late effects of intraoperative radiation therapy on retroperitoneal tissues, intestine, and bile duct in a large animal model. Int J Radiat Oncol Biol Phys 1994;29:781-8. 14. Kinsella TJ, Sindelar WF, DeLuca AM, et al. Yolerance of peripheral nerve to intraoperative radiotherapy (IORT): clinical and experimental studies. Int J Radiat Oncol Biol Phys 1985;11:1579-85. Figura 1: IOERT Figura 2: HDR-IORT 32 Curso sobre avances y actualización en Bio-Radioterapia CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 33 RADIOTERAPIA DE INTENSIDAD MODULADA Dr. José López Torrecilla Jefe del Servicio de Oncología Radioterápica-ERESA Hospital General Universitario, Valencia CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 34 CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 35 Radioterapia de intensidad modulada Dr. José López Torrecilla. Servicio Oncología Radioterápica-ERESA Hospital General Universitario, Valencia a necesidad de conformar la irradiación al volumen tumoral, protegiendo al máximo las estructuras sanas vecinas al tumor, ha impulsado la evolución de la radioterapia desde sus comienzos. La mejora de las técnicas de imagen (TAC, Resonancia magnética, CT-PET) ha permitido al oncólogo radioterápico la posibilidad de definir con mayor precisión el volumen tumoral, obligando a mejorar los sistemas de planificación y administración de tratamiento. L La aparición de los multiláminas en los año 90, en principio con láminas de un centímetro en el isocentro y que posteriormente han sido reducidas a 0,5 cm., han permitido configurar campos de tratamiento cada vez mas ajustados al volumen que se desea tratar. Además el uso de secuenciadores, para administrar de una forma rápida y seguida una secuencia de segmentos o bien un movimiento continuo de las láminas, han dado lugar a distribuciones de dosis cada vez mas ajustada a lo que el oncólogo radioterápico diseña como volumen de tratamiento. El desarrollo de los planificadores que permiten a los radiofísicos diseñar tratamientos con una alta conformación de las curvas de isodosis al volumen tumoral y aceleradores lineales fiables en la liberación de la dosis planificada, ha permitido la aparición de la llamada modulación de intensidad (IMRT), que no es mas que una evolución de la radioterapia conformada en la el haz de radiación tiene una fluencia o intensidad no uniforme, de tal manera que la fluencia varía según el espesor del volumen a irradiar, teniendo también en cuenta la presencia de órganos de riesgo. La última mejora incorporada en la cadena de preparación y tratamiento del paciente, ha venido a reforzar uno de los eslabones más débiles hasta ahora, la reproducción diaria del tratamiento. La verificación del volumen de tratamiento antes de cada sesión mediante la radioterapia guiada por la imagen (IGRT) permite administra con una gran precisión todo el trabajo previamente planificado por el oncólogo radioterápico y el radiofísico. Bibliografía 1. Intensity Modulated Radiotherapy: Current status and issues of interest. Intensity Modulated Radiation Therapy Collaborative Working Group. Int J Radiat Oncol Biol Phys 2001;51 (4): 880–914. 2. Galvin JM, Ezzell G, Eisbrauch A, et al. Implementing IMRT in clinical practice: a joint document of the American Society for Therapeutic Radiology and Oncology and the American Association of Physicists in Medicine. Int J Radiat Oncol Biol Phys 2004;58 (5): 1616-1634. 3. Nutting C, Dearnaley DP, Webb S. Intensity modulated radiation therapy: A clinical review. Br J Radiol 2000;73:459–469. 4. Eisbruch A, Kim HM, Terrell JE, et al. Xerostomia and its predictors following parotid-sparing irradiation of head-and neck cancer. Int J Radiat Oncol Biol Phys 2001;50:695–704. 5. de Arruda FF, Zhung J, Narayana A, et al. Intensity-modulated radiation therapy (IMRT) for the treatment of oropharyngeal carcinoma: The MSKCC experience. Int J Radiat Oncol Biol Phys 2006;64:363–373. 6. Zelefsky MJ, Fuks Z, Happersett L, et al. Clinical experience with intensity modulated radiation therapy (IMRT) in prostate cancer. Radiother Oncol 2000;55:241–249. 7. Chao KS, Ozyigit G, Blanco AI, et al. Intensity-modulated radiation therapy for oropharyngeal carcinoma: Impact of tumor volume. Int J Radiat Oncol Biol Phys 2004;59:43–50. Sesión 1 35 CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 36 CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 37 LA BRAQUITERAPIA: TENDENCIAS ACTUALES Y FUTURAS Dr. Ferrán Guedea Jefe de Servicio de Oncología Radioterápica Institut Català d’Oncologia (ICO) Hospital Duran y Reynals, Barcelona CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 38 CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 39 La braquiterapia: Tendencias actuales y futuras Dr. Ferrán Guedea, J. Pera, A. Polo, M. Ventura Servicio de Oncología Radioterápica Institut Català d’Oncologia (ICO), Hospital Duran y Reynals, Barcelona. INTRODUCCIÓN. Los avances que se están desarrollando en la braquiterapia son numerosos e importantes (1— 7), y prueba de ello son las recientes publicaciones (8, 9) y varios estudios realizados últimamente. Así, un estudio Europeo conocido como “Patterns of Care for Brachytherapy in Europe (PCBE)”, que fue puesto en marcha el año 2001, permitió tener una clara visión de la actualidad y de las líneas de futuro de la braquiterapia. El estudio PCBE es un ambicioso y extenso proyecto cuyo objetivo esencial ha sido crear un grupo de trabajo para obtener información detallada de la Braquiterapia en el Área Europea, con el soporte del la Sociedad Europea de Oncología Radioterápica (ESTRO) y la sociedad Europea de braquiterapia (GEC-ESTRO). Se realizó un cuestionario sobre las infraestructuras y las características de la braquiterapia en el Área Europea, accesible mediante una página web. Para ello se nombró un Coordinador Nacional en cada país para tomar las responsabilidades propias del PCBE. Asimismo el coordinador general de todos los países junto con la ESTRO y con el “National Cancer Services Analysis” del Reino Unido compilaron toda la información administrada por cada país para recoger datos globales de toda el Área Europea en cuanto a infraestructuras, recursos humanos, proyectos de investigación, tendencias de las diferentes tipos de tratamientos en braquiterapia, etc. Se analizaron aquellos países que incluyeron los datos de como mínimo el 50% de sus centros (36 países). Los países con menos del 50% de los datos fueron excluidos del análisis. Asimismo se reagruparon los países de Europa en 3 grandes grupos: 15 países inicialmente miembros de la Unión Europea más 4 países con similar situación socioeconómica (Islandia, Mónaco, Noruega y Suiza) (EC+4); 10 países nuevos miembros de la Unión Europea (NEC) y otros 14 países posibles candidatos futuros para entrar en la Unión (OEC). La media de los pacientes tratados con braquiterapia en cada centro se determinó en cada grupo: 107 pacientes por centro en EC+4, 237 en NEC y 243 en OEC en el año 2002. El mayor número de pacientes tratados con braquiterapia fue debido a los tumores ginecológicos, sobretodo en NEC y en OEC. El número de unidades de carga diferida en los diferentes países de la Unión Europea, el número de tratamientos con braquiterapia en tumores ginecológicos, de mama o de próstata, y el número de pacientes tratados según el tipo de braquiterapia (HDR, MDR, LDR, PDR, manual) fueron estudiados en cada país y en su conjunto. Finalmente se comparó el número de tratamientos con braquiterapia durante los años 1997 y 2002, y se observó un incremento de más de un 10% en la media del número de tratamientos de realizados en cada centro comparando los datos obtenidos en 1997 y en 2002, (10—14). Estos resultados sugieren claramente la necesidad de continuar el estudio PCBE cada 5 años para demostrar los desarrollos en este campo, y las líneas de futuro de la braquiterapia que se pueden resumir en la utilización de la HDR y la PDR, la irradiación parcial de la mama (APBI), la braquiterapia prostática con Yodo-125 o HDR, y finalmente la IGBT. AVANCES DE LA BRAQUITERAPIA. Así, basándose en nuestra propia experiencia, las publicaciones recientes y el estudio PCBE podríamos resumir los avances en braquiterapia en los siguientes puntos: Sesión 1 39 CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 40 1. La Consolidación y desarrollo de la HDR y de la PDR. La utilización de ambas técnicas ha permitido la optimización de la dosimetria en los tratamientos de braquiterapia, y en el caso de la HDR la realización de dichos tratamientos ambulatorios. Si estudiamos la frecuencia de los tratamientos con HDR en Europa vemos que representan más del 50% de los tratamientos (sobretodo en ginecología), mientras que la PDR aún solo representa un 5% aproximadamente. 2. La Irradiación parcial de la mama (APBI). Las recidivas locales de las pacientes tratadas mediante tratamiento conservador en tumores iniciales de mama se localizan en el 86% de los casos aproximadamente en el mismo cuadrante donde estaba el tumor inicial. Si a este hecho añadimos que existen menos recidivas locales en las pacientes de más de 55 años se podría suponer que existe un grupo de pacientes seleccionadas con cáncer mama inicial de buen pronóstico en las cuales la irradiación exclusiva del cuadrante dónde se localiza el tumor inicial ofrecería iguales resultados que la irradiación de toda la mama. Ensayos fase II realizados en todo el mundo sugieren que esta consideración es valida, y actualmente existen 3 ensayos fase III (2 en Europa y uno en EEUU) que están abiertos para responder definitivamente a esta cuestión (15). 3. La braquiterapia en el cáncer de próstata con Yodo-125 o bien con HDR ha sido muy importante durante esta última década y ha permitido que dicho tratamiento asociado o no a la radioterapia externa obtenga excelentes tasas de control bioquímico de la enfermedad con mínima morbilidad. Nuevos desarrollos como la braquiterapia de próstata en tiempo real, etc. siguen demostrando la enorme vitalidad en este ámbito de la braquiterapia. A pesar de todo ello, la braquiterapia de próstata solamente representa un 8.1% del total de tratamientos de braquiterapia en Europa. 4. La IGBT (La Braquiterapia Guiada por la Imagen) es un concepto reciente que se basa en la utilización de las imágenes de TAC y/o Ecografia y/o RMN, etc. para el mejor conocimiento de la distribución de las dosis y de la prescripción del tratamiento de braquiterapia. 5. También hay que considerar como avances todos aquellos estudios clínicos que reagrupan pacientes tratados similarmente y que intentan extraer conclusiones al tener una mayor casuística. Ejemplos de esto son los estudios de Guedea y colaboradores a nivel europeo (16) y de Zelesfsky y colaboradores a nivel de Estados Unidos (17). Estos estudios agrupan 1050 pacientes con cáncer de próstata inicial tratados con Braquiterapia con Yodo-125 en la primera publicación y 2693 pacientes en la segunda publicación. Bibliografía 1. Slotman B.J., Leer J.W.H. Infrastructure of radiotherapy in the Netherlands: evaluation of prognoses and introduction of a new model for determining the needs. Radioth. Oncol. 2003. 66: 345-349. 2. Tatsuzaki H., Levin C.V. Quantitative status of resources for radiation therapy in Asia and Pacific Region. Radiother. Oncol. 2002. 63:147-150. 3. Zubizarreta E.H., Poitevin A., Levin C.V. Overview of radiotherapy resources in Latin America: a survey by the International Atomic Energy Agency (IAEA). Radiother. Oncol. 2004. 73:97-100. 4. Esco R., Palacios A., Pardo J., Biete A., Carceller J.A., Veiras C., Vazquez G. Infrastructure of radiotherapy in Spain: a minimal standard of radiotherapy resources. Int. J. Radiat. Oncol. Biol. Phys. 2003. 56:319-327. 5. Lopez Torrecilla J., Bataller E. Situación de la braquiterapia en España. Análisis de complejidad y tiempos de preparación y tratamiento. Rev. Oncología 2001. 3:91-99. 40 Curso sobre avances y actualización en Bio-Radioterapia CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 41 6. Zelefsky M.J., Moughan J., Owen J., et al. Changing trends in National Practice for external beam radiotherapy for clinically localized prostate cancer: 1999 Patterns of Care Survey for prostate cancer. Int. J. Radiat. Oncol. Biol. Phys. 2004. 59:1053-1061. 7. Bernier J., Horiot J.C., Bartelink H. Profile of radiotherapy departments contributing to the Cooperative Group of Radiotherapy of EORTC. Int. J. Radiat. Oncol. Biol. Phys. 1996. 34: 953-960. 8. Cumberlin R.L., Coleman C.N. New directions in Brachytherapy. Int. J. Radiat. Oncol. Biol. Phys. 53, 611. 2002. 9. Mazeron J.J. Editorial: Brachytherapy: a new era. Radiother. Oncol. 74, 223-226. 2005. 10. F. Guedea, T. Ellison, G. Heeren, M. Ventura, G. François, J.J. Mazeron, B. Cottier, J.L. Torrecilla, P. Bilbao, M. Taillet, JM Borràs. Preliminary analysis of the resources in Brachytherapy in Europe and its variability of use. Clin. Transl. Oncol. 2006;8(7):491-9. 11. F. Guedea, T. Ellison, J. Venselaar, J.M. Borràs, P. Hoskin, R. Poetter, G. Heeren, R. Nisin, G. François, J.J. Mazeron, E.V. Limbergen, M. Ventura, M. Taillet, B. Cottier. Overview of Brachytherapy resources in Europe: a survey of Patterns of Cares study for Brachytherapy in Europe (PCBE). Radiother. Oncol. 82 (1), 50-4. 2007. 12. F. Guedea, M. Ventura, A. Polo, J. Skowronek, J. Malicki, W. Bulski, G. Zwierzchowski, J. López Torrecilla, P Bilbao, J.M. Borràs. Patterns of Care for Brachytherapy in Europe (PCBE) in Spain and Poland: comparative results. Aceptado para publicación en Reports of Practical Oncology and Radiotherapy. 13. D. Peiffert, J.J. Mazeron, F. Guedea, R. Nisin. La curiethérapie en France en 2002: Résutats de l’enquête PCBE de l’ESTRO. Aceptado para publicación en Cancer/Radiothérapie. 14. F. Guedea, M. Ventura, A. Polo. Patterns of care for breast brachytherapy in Europe. Partial Breast Irradiation using Multicatheter Brachytherapy, 1ª edición, pp 3-6. Ed. Zuckschwerdt, Munich, 2006. 15. J.L. Guinot, L. Arribas, F. Guedea, A. Polo, C. Gutiérrez, J. Pera. Irradiación parcial de la mama con braquiterapia: un nuevo enfoque terapéutico. Rev. Sen. Patol. Mam. 19(3), 82-87. 2006. 16. F. Guedea, F. Aguilo, A. Polo, S. Langley, R. Laing, A. Henderson, S. Aaltomaa, V. Kataja, J.-E. Palmgren, F. Bladou, N. Salem, G. Serment, L. Nava. Early biochemical outcomes following permanent interstitial brachytherapy as monotherapy in 1050 patients with clinical T1–T2 prostate cancer. Radiother. Oncol. 80.57-61. 2006. 17. M.J. Zelefsky, D.A. Kuban, L.B. Levy, L. Potters, D. C. Beyer, J.C. Blasko, B.J. Moran, J.P. Ciezki, A.L. Zietman, T.M. Pisansky, M. Elshaikh, E. M. Horwitz. Multi-institutional analysis of long-term outcome for stages T1–T2 prostate cancer treated with permanent seed implantation. Int. J. Radiat. Oncol. Biol. Phys. 2007 Feb 1; 67(2):327-333. Sesión 1 41 CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 42 CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 43 Sesión 2 RADIOTERAPIA GUIADA POR LA IMAGEN CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 44 CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 45 RADIOTERAPIA 3D Dr. Alfredo Ramos Aguerri Servicio de Oncología Radioterápica Hospital Ramón y Cajal, Madrid CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 46 CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 47 Radioterapia 3D Dr. Alfredo Ramos Aguerri Servicio de Oncología Radioterápica Hospital Ramón y Cajal, Madrid a radioterapia forma parte del arsenal terapéutico para la lucha contra la enfermedad cancerosa junto a otras terapéuticas como son la cirugía, quimioterapia, terapias biológicas, etc. Es un arma terapéutica de las más eficaces, ya que consigue por sí sola el control de más del 12 % de los tumores y en combinación con otras armas terapéuticas más de un 14% de los mismos. Es de vital importancia en el tratamiento de los tumores localizados, ya que su control puede alcanzar en algunas localizaciones el 90%. Lo que hay que tener claro es que en la enfermedad oncológica si no hay control tumoral local, no hay posibilidades de curación. Como bien sabemos la radioterapia actúa fundamentalmente en las fases G2 y M del ciclo celular y éstas son las más radiosensibles. La radioterapia, produce dos efectos fundamentales a nivel de la materia. Por medio del mecanismo de acción directa, provoca lesiones a nivel del DNA, molécula blanco principal, dentro de la célula tumoral, y que puede provocar la muerte de la misma, o bien por la acción indirecta provocando ionización e hidrólisis del agua, radicales libres y dando lugar asimismo a lesiones radioinducidas. Estos daños se pueden clasificar en función de su gravedad, en daño subletal, aquel que la célula puede reparar, en daños potencialmente letales en que el acúmulo de daños subletales da lugar a la imposibilidad de que la célula sea incapaz de su reparación y dá lugar a la muerte celular, o daño letal, aquel que realmente desde el inicio puede provocar la muerte celular. L Desde el punto de vista clínico estos daños se traducen en unos daños agudos, aquellos que son inmediatos y que suceden durante el curso del tratamiento radioterápico o en su inmediata proximidad, y daños crónicos que son aquellos daños que permanecen a largo plazo. El objetivo principal del tratamiento radioterápico, como bien sabemos, es la obtención del máximo control tumoral provocando los mínimos efectos secundarios en los tejidos sanos. En el tratamiento radioterápico, nos movemos en lo que llamamos ventana terapéutica o índice terapéutico, que es la relación existente entre el control tumoral y los efectos secundarios derivados de la acción de la irradiación sobre los tejidos sanos. La secuencia del proceso terapéutico se inicia con la Hª clínica del paciente, clasificación tumoral y su indicación terapéutica, seguidamente se realiza la simulación para la delimitación de volúmenes a irradiar, la planificación y elección del tratamiento, la puesta en marcha del mismo, el inicio del tratamiento y el seguimiento de los pacientes. En la época de la simulación 2D, ésta se realizaba por medio de dos radiografías ortogonales, donde para poder irradiar de forma adecuada el volumen tumoral se realizaban grandes puertas de entrada, y por tanto con inclusión de grandes volúmenes de tejidos sanos, y así mismo existía dificultad para delimitar órganos de riesgo y por tanto un desconocimiento de las dosis tóxicas en éstos órganos. En los últimos 15 años, se han llevado a cabo avances importantísimos a todos los niveles y desde el punto de vista didáctico he clasificado estos avances en dos grupos: los avances tecnológicos y mejora del índice terapéutico. Esta última por medio de fraccionamientos alterados, la utilización de radiosensibilizadores, hipertermia, combinaciones con quimioterapia, el uso de fototerapia, terapias biológicas, partículas pesadas y tratamientos de soporte que hacen o que contribuyen a que la radioterapia pueda mejorar el control de la enfermedad. Sesión 2 47 CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 48 En cuanto a los avances tecnológicos han mejorado de forma eficaz los sistemas de inmovilización, la posibilidad de control por medio de la imagen portal, la simulación virtual, la planificación 3D, radioterapia conformada 3D y modulación de intensidad de dosis, también la utilización de radioterapia intraoperatoria, que de alguna manera podíamos incluirla dentro de los avances anteriores, el uso de la braquiterapia moderna, la radioterapia por giada por imagen, y el uso de la radiocirugía y de la radioterapia estereotáxica fraccionada. Es evidente que los desarrollos tecnológicos, nos han facilitado poder disponer de un conocimiento tridimensional de la anatomía y, ha permitido a los oncólogos radioterápicos identificar mejor los volúmenes tumorales así como los órganos de riesgo. En cuanto a estos desarrollos llevados a cabo en los últimos 10 – 15 años están la tomografía axial computarizada, la resonancia magnética, la tomografía por emisión de positrones, la utilización de PET –TAC, combinación de dos anteriores, sistemas de fusión de imágenes, también el desarrollo de multiláminas y micromultiláminas en los aceleradores modernos que permite la conformación de los volúmenes y el desarrollo de nuevos sistemas de planificación tridimensional, han contribuido claramente a una mejora del del tratamiento radioterápico para el control tumoral. Estos desarrollos tecnológicos que proporcionan imágenes tridimensionales, han permitido la utilización de técnicas con haces externos de irradiación, administrando dosis más altas y que pueden ser conformadas mucho más cerca del volumen a irradiar y por tanto reducir el volumen de tejido sano circundante. A esta forma de irradiación externa, es lo que denominamos radioterapia conformada 3D. Los haces utilizados en esta técnica, tienne una intensidad homogénea en toda la sección del haz o pequeñas modificaciones en la fluencia provocadas por cuñas o filtros compesadores y podemos llamarla radioterapia conformada 3D clásica o tradicional, frente a la Radioterapia con Intensidad Modulada (IMRT), que es la forma más avanzada de conformación como resultado de una optimización de la fluencia de los haces de irradiación. También es necesario definir los distintos volúmenes como son GTV, CTV, PTV, OR; volumen tratado, volumen irradiado, volumen de planificación y órganos de riesgo y en el último desarrollo del ICRU 62, también perfecciona lo que es el PTV con lo que denominamos margen interno y margen de colocación. Los nuevos planificadores disponen de herramientas que también nos permiten tener un conocimiento de las posibilidades de control tumoral así como de los efectos secundarios derivados de esta irradiación basándose en el conocimiento de la biológía de los tejidos, es lo que definimos como TCP y NTCP, que nos pueden ayudar a tomar una decisión terapéutica. Es evidente que, el desarrollo de estas nuevas tecnologías con el conocimiento volumétrico tanto de los tumores como de los órganos de riesgo y los nuevos sistemas de planificación, así como del desarrollo de los nuevos aceleradores, ha dado lugar de forma indudable a un avance claro en la calidad de los tratamientos radioterápicos que han contribuido y están contribuyendo de forma clara al control de la enfermedad con menos efectos secundarios. Esta posibilidad de determinar los volúmenes tumorales, así como de los órganos de riesgo, la posibilidad de adecuar las curvas de isodosis a estos volúmenes, por medio de técnicas adecuadas de irradiación que permiten alcanzar una optima distribución de dosis sobre dichos volúmenes, así como los nuevos desarrollos actualmente en curso como 4 D, Radioterapia por Imagen Guiada y lo que hoy denominamos Radioterapia Adaptativa, van a permitir sin ninguna duda, alcanzar cotas de control tumoral hasta ahora mismo insospechadas, con menores efectos secundarios y por tanto con mejor calidad de vida. 48 Curso sobre avances y actualización en Bio-Radioterapia CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 49 EL DESARROLLO DE LA RADIOTERAPIA - 4D Dra. Pino Alcántara Carrió Médico Especialista de Área Hospital Clínico San Carlos, Madrid CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 50 CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 51 EL DESARROLLO DE LA RADIOTERAPIA - 4D Dra. Pino Alcántara Carrió Hospital Clínico San Carlos, Madrid n general, la habilidad de administrar de forma precisa y conformada la dosis de irradiación a un blanco determinado se asocia a una evolución más favorable de la enfermedad y a una menor morbilidad. Durante los últimos años hemos asistido a una vertiginosa mejora de la capacidad para conformar la dosis para un blanco inmóvil con nuevos sistemas de adquisición de imágenes, planificación y administración del tratamiento. Las últimas innovaciones técnicas pretenden lograr la máxima conformación de dosis también para órganos con movimiento no sólo inter sino también intra-fracción. De esta manera, pretendemos lograr una escalada de las dosis a administrar en busca de un mayor control tumoral sin aumentar e incluso disminuyendo la morbilidad del tratamiento. E Las estrategias que se pueden utilizar para minimizar el movimiento intrafracción de algunos órganos causado por la respiración (fundamentalmente hablamos del pulmón, hígado y páncreas, aunque también se utiliza para próstata, mama, etc) son múltiples. Podemos por ejemplo controlar o modificar el movimiento tumoral alterando el patrón respiratorio con diferentes maniobras (por ejemplo con compresión abdominal), o tratando en determinadas pausas respiratorias voluntarias o inducidas por nosotros (por ejemplo con “Deep Inspiration Breath Holding” o con “Active Breath Control”). También podemos tratar permitiendo el movimiento tumoral libre, pero manteniendo constante la posición del haz de irradiación frente al volumen a tratar. Esto último lo podemos lograr bien con “Beam tracking”, como con “Couch motion” o con el “gating respiratorio”. Decimos que estamos haciendo “GATING RESPIRATORIO” cuando logramos sincronizar el tratamiento radioterápico con el movimiento respiratorio, disparando el haz de irradiación en determinada fase del ciclo respiratorio. Para ello es básico contar con una buena adquisición de imágenes, y con una fiel correlación de estas imágenes con cada fase consecutiva del ciclo respiratorio. Más importante si cabe es esta correlación de la anatomía con la respiración cuando queremos hacer “BEAM TRACKING”, es decir, administrar de manera continua nuestro tratamiento radioterápico adaptándonos en cada momento a la posición del tumor y a la deformación de la anatomía debida a la respiración. Todas estas técnicas precisan ser guiadas con máxima fidelidad por la imagen formando parte de la RT guiada por la imagen o IGRT. Al hablar de técnicas de imagen, no sólo son fundamentales los nuevos sistemas de adquisición de imágenes de verificación con alta calidad, sino también la incorporación de escáneres 4D para la adquisición de imágenes de planificación, que son capaces de mostrarnos la anatomía del paciente en relación con cada momento respiratorio. Con la incorporación de estos escáneres 4D se minimizan los errores de adquisición que pueden existir con los escáneres helicoidales 3D. Podríamos decir que la Radioterapia – 4D (RT-4D) no es más (ni menos) que la conformación del tratamiento radioterápico no sólo en los 3 ejes del espacio (RT-3D) sino también adaptada a la variabilidad en el tiempo que dura la fracción del tratamiento radioterápico. Para ello es preciso la adquisición de imágenes durante cada fase consecutiva del ciclo respiratorio, y nace por tanto el “ESCÁNER 4-D” (4D-CT) que nos indica cuál es la localización del tumor y de los órganos de riesgo en cada momento de la respiración. Una vez registradas todas estas imágenes anatómicas y su relación con la respiración, surge la necesidad de hacer una planificación adaptada a todos estos datos, lo que llamamos “4D-TREATMENT PLANNING”. Si además logramos administrar el tratamiento de una forma continua durante la respiración del paciente, adaptándonos a las imágenes recogidas en nuestro 4DSesión 2 51 CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 52 CT y realizando el tratamiento planificado para cada momento de la respiración (4D - treatment planning), estaremos administrando un tratamiento con RT-4D (4D-TREATMENT DELIVERY). Se abre por tanto un amplio campo donde investigar continuas mejoras técnicas que permitan la administración de tratamientos con RT-4D de forma precisa, y estudios clínicos que demuestren que la administración del tratamiento radioterápico con esta nueva tecnología consigue realmente mayor control tumoral y menor morbilidad. Referencias: 1. Goitein M: Organ and Tumor Motion: An Overview. Seminars in Radiation Oncology, Vol 14, No 1 (January), 2004: pp 2-9 2. George T. Y. et al: Artifacts in Computed Tomography Scanning of Moving Objects. Seminars in Radiation Oncology, Vol 14, No 1 (January), 2004: pp 19-26 3. Mageras G. S. et al: Deep Inspiration Breath Hold and Respiratory Gating Strategies for Reducing Organ Motion in Radiation Treatment. Seminars in Radiation Oncology, Vol 14, No 1 (January), 2004: pp 65-75 4. Dawson L. A. et al: Interventions to Reduce Organ Motion Effects in Radiation Delivery. Seminars in Radiation Oncology, Vol 14, No 1 (January), 2004: pp 76-80 5. Keall P: 4-Dimensional Computed Tomography Imaging and Treatment Planning. Seminars in Radiation Oncology, Vol 14, No 1 (January), 2004: pp 81-90 6. Dawson L. and Jaffray D: Advances in Image-Guided Radiation Therapy J Clin Oncol.2007; 25: 938946 7. H Alasti et al: A novel four-dimensional radiotherapy method for lung cancer: imaging, treatment planning and delivery. Phys. Med. Biol 2006; 51: 3251-3267 8. Keall PJ et al: Four-dimensional radiotherapy planning for DMLC-based respiratory motion tracking. Med Phys. 2005 Apr;32(4):942-51 9. Rietzel E, Pan T, Chen GT: Four-dimensional computed tomography: image formation and clinical protocol. Med Phys. 2005 Apr;32(4):874-89 10. Guckenberger M et al: Is a Single Respiratory Correlated 4D-CT Study Sufficient for Evaluation of Breathing Motion? Int J Radiat Oncol Biol Phys. 2007 Apr 1;67(5):1352-9 11. Tewatia D, Zhang T, Tome W, Paliwal B, Metha M.: Clinical implementation of target tracking by breathing synchronized delivery. Med Phys. 2006 Nov;33(11):4330-6. 52 Curso sobre avances y actualización en Bio-Radioterapia CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 53 DISPONIBILIDAD Y OPORTUNIDADES DEL PET-TAC Dr. Juan A. Díaz González Departamento de Oncología Clínica Universitaria. Universidad de Navarra, Pamplona CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 54 CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 55 Disponibilidad y oportunidades del PET-TAC Dr. Juan A. Díaz González Departamento de Oncología Clínica Universitaria. Universidad de Navarra, Pamplona l progreso en Oncología en el momento actual se mueve en dos grandes ejes: la caracterización molecular con finalidad diagnóstica/pronóstica y el diseño de nuevas estrategias terapéuticas. E Por una parte, muchos de los esfuerzos de la investigación básica y traslacional en cáncer se centran en conocer mejor los procesos genéticos y moleculares que originan y desarrollan el cáncer. Esto nos ayudará a realizar un mejor diagnóstico: conocer mejor la localización y extensión de los tumores, identificar las áreas diferenciales intratumorales con comportamientos biológicos específicos y definir los factores pronósticos de respuesta y evolución de cada tumor. Para esta aproximación diagnóstica está siendo de gran utilidad la integración de las nuevas técnicas de imagen con los descubrimientos moleculares y genéticos. En este sentido, ha emergido el concepto de imagen funcional o imagen molecular, que empieza a incorporar las características biológicas de las distintas áreas tumorales a las características anatómicas o morfológicas proporcionadas por las técnicas de imagen convencionales. En definitiva el objetivo es poder visualizar los procesos biológicos intratumorales. El otro gran campo de desarrollo es el terapéutico. La incorporación de nuevos agentes quimioterápicos, su combinación con las nuevas formas de radioterapia y la integración de nuevas moléculas terapéuticas desarrolladas a partir del conocimiento de las modificaciones moleculares de los tumores, está consiguiendo una mayor selectividad e intensidad terapéutica. Esta línea de investigación busca un mayor índice terapéutico y se apoya necesariamente en la línea de investigación diagnóstica previamente mencionada. La Oncología Radioterápica es un área de la Oncología Clínica que interviene en el tratamiento locorregional de la enfermedad tumoral. La mayoría de los tumores son sensibles a este tipo de tratamiento y se utiliza en algún momento del proceso terapéutico en casi todas las neoplasias. El desarrollo técnico de la radioterapia —conformación tridimensional, técnicas estereotácticas, modulación de la intensidad del haz de irradiación (IMRT), braquiterapia, radioterapia intraoperatoria— ha conseguido una mayor selectividad en el tratamiento sobre las áreas afectas y reducir la toxicidad sobre los tejidos limitantes de dosis, al conseguir una mayor conformación anatómica del haz de irradiación. Sin embargo, la eficacia terapéutica en algunas localizaciones tumorales aún no ha alcanzado el nivel deseable y es preciso un enfoque de tratamiento que, apoyándose en las características moleculares de los tumores, consiga una mayor especificidad sobre las células tumorales respetando las células sanas. Existe un gran desarrollo experimental en esta dirección. En Oncología Radioterápica una línea de investigación prioritaria es la conexión de las técnicas de imagen con las bases moleculares del cáncer, de manera que se puedan optimizar los tratamientos, realizando un abordaje terapéutico diferencial en función del comportamiento biológico del tumor. Marcadores genéticos, moleculares y metabólicos, en conjunción con las técnicas de imagen morfológica, podrían delimitar de una forma más precisa, no sólo la localización anatómica de la enfermedad tumoral, sino también el comportamiento diferencial de un mismo tumor en función de sus características biológicas. Este planteamiento llevaría a modificar los modelos actuales utilizados en la definición de volúmenes de tratamiento radioterápico de gross tumor volume (GTV) y clinical tumor volume (CTV), hacia un nuevo concepto que podría denominarse biological target volume (BTV). Esto supondría un enfoque más acorde con el comportamiento tumoral ya que podría permitir una mejor caracterización topográfica y funcional Sesión 2 55 CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 56 del tumor, una mayor selectividad en los tratamientos (al permitir un tratamiento diferencial dentro del propio tumor con terapias biodirigidas) y una evaluación de respuesta a los tratamientos más específica. Las modernas técnicas de radioterapia conformada tridimensional (3D-CRT), braquiterapia y de radioterapia con modulación de la intensidad del haz (IMRT) consiguen una mayor precisión anatómica; la incorporación de la biología tumoral conseguiría una mayor eficacia y especificidad terapéutica. Si conseguimos visualizar la actividad biológica intratumoral (imagen biológica) podremos realizar una sobreimpresión terapéutica selectiva con una aproximación biológica sobre áreas diferenciales (biologically conformal boost), incrementando de este modo el índice terapéutico. En este contexto, es prioritario la correlación y validación de la imagen metabólica con las características biológicas de los tumores. El estudio y comparación vis-a-vis de las imágenes de la PET con los hallazgos inmunohistoquímicos proporcionará la correcta validación de las imágenes PET para planificación terapéutica. La PET ha demostrado un mayor rendimiento diagnóstico que las pruebas de imagen convencional en un buen número de situaciones oncológicas. Dando un paso adelante, existen datos cada vez más consistentes en la literatura científica que muestran una ganancia en la precisión diagnóstica con PETTAC respecto a cada una de estas técnicas por separado en tumores de cabeza y cuello, cáncer de pulmón, tumores gastrointestinales, mama, linfoma, melanoma. Una correcta estadificación tumoral es la base sobre la que se sustenta una adecuada planificación dosimétrica en Oncología Radioterápica. Una mayor sensibilidad y especificidad en la identificación de la extensión tumoral se traducirá en un mayor índice terapéutico. El PET-TAC tendrá una mayor influencia en la planificación dosimétrica en función de su sensibilidad y especificidad para un tipo tumoral concreto en relación con el objetivo del tratamiento. Una sensibilidad adecuada evitará la exclusión de enfermedad neoplásica de los volúmenes de irradiación. Mientras, una mayor especificidad reducirá los volúmenes de dosis altas de irradiación mejorando la tolerancia de los órganos a riesgo y eventualmente permitirá escalar dosis aumentando la probabilidad de control tumoral. Hay datos preliminares disponibles sobre la influencia del PET-TAC en planificación dosimétrica, especialmente en tumores de cabeza y cuello, cáncer de pulmón y tumores gastrointestinales. Quedan, sin embargo, muchas e importantes preguntas abiertas que se convierten en líneas de investigación necesarias. Está pendiente de definir si la planificación con PET-TAC debe incorporarse a la planificación dosimétrica en cualquier localización tumoral o si debe ser reservada para situaciones específicas. No existen apenas estudios que demuestren la correlación espacial entre la imagen metabólica y la histología tumoral. Estudios prospectivos con metodología precisa y objetivos bien definidos deben explorar si puede existir un impacto en el control local y la supervivencia, o al menos una reducción significativa en la toxicidad, con la incorporación de esta herramienta en la planificación de radioterapia. Por último, un campo de investigación emergente, es establecer cuál es el valor de los cambios de imagen metabólica con los tratamientos. Se abre la posibilidad de establecer factores pronósticos de respuesta y de control de la enfermedad, y la oportunidad de evaluar de una manera biológicamente más específica el efecto de las nuevas formas de tratamiento molecularmente dirigido. Bibliografía recomendada Ling CC, Humm J, Larson S, et al. Towards multidimensional radiotherapy (MD-CRT): biological imaging and biological conformality. Int J Radiat Oncol Biol Phys. 2000 Jun 1;47(3):551-60. Chapman JD, Bradley JD, Eary JF, et al. Molecular (functional) imaging for radiotherapy applications: an RTOG symposium. Int J Radiat Oncol Biol Phys. 2003 Feb 1;55(2):294-301. Coleman CN. Linking radiation oncology and imaging through molecular biology. Radiology. 2003 Jul;228(1):29-35. 56 Curso sobre avances y actualización en Bio-Radioterapia CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 57 Weber WA. Positron emission tomography as an imaging biomarker. J Clin Oncol. 2006 Jul 10;24(20): 3282-92. van Baardwijk A, Baumert BG, Bosmans G, et al. The current status of FDG-PET in tumour volume definition in radiotherapy treatment planning. Cancer Treat Rev. 2006 Jun;32(4):245-60 Gregoire V, Haustermans K, Geets X, et al. PET-based treatment planning in radiotherapy: a new standard? J Nucl Med. 2007 Jan;48 Suppl 1:68S-77S. Weber WA, Figlin R. Monitoring cancer treatment with PET/CT: does it make a difference? J Nucl Med. 2007 Jan;48 Suppl 1:36S-44S. Belkacémi Y, et al., Metabolic functional imaging for tumor radiosensitivity monitoring, Crit. Rev. Oncol./Hematol. (2007) In Press. Sesión 2 57 CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 58 CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 59 FUSIÓN DE IMAGEN Y PLANIFICACIÓN DOSIMÉTRICA Dr. Alfredo Serna Berná Servicio de Oncología Radioterápica Servicio de Radiofísica Hospital Virgen de la Arrixaca, Murcia CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 60 CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 61 Fusión de imagen y planificación dosimétrica Dr. Alfredo Serna Berná Servicio de Radiofísica. Hospital Virgen de la Arrixaca. Murcia a oncología radioterápica está en un periodo de rápido desarrollo científico y tecnológico. La radioterapia tridimensional (3D-CRT) y la radioterapia con intensidad modulada (IMRT) con capacidad para obtener imágenes de alta calidad durante el tratamiento, permite la administración de la dosis de radiación con un grado de precisión que no había sido conseguido jamás con anterioridad. La motivación de estos avances tecnológicos es que una mayor precisión en la administración del tratamiento a conducirá a un menor daño al tejido normal permitiendo al mismo tiempo una mayor y más precisa administración de dosis de radiación al tejido tumoral. Para aprovechar completamente los avances tecnológicos que nos permiten mayor precisión es necesario que en el proceso de planificación se tenga una información precisa sobre la localización espacial y extensión del volumen diana. L Los planes de tratamiento en radioterapia se han desarrollado usando imágenes de RX e imágenes de TAC. Estas proporcionan datos relativos a las características de atenuación del paciente permitiendo así mismo la identificación de estructuras y órganos para la especificación y delineación de volúmenes de tratamiento. El uso de otras modalides de imagen como la resonancia magnética nuclear y los ultrasonidos permiten una mejora en la precisa delimitación de los volúmenes de tratamiento. Sin embargo, no fue hasta la introducción del PET donde se pudo precisar no solo a los tejidos que presentaban una anomalía puramente anatómica a través de TAC sino aquellos que presentaban una función anómala. Actualmente los sistemas que combinan un detector PET con un escáner TAC pueden proporcionar información anatómica (que es la base para la planificación de tratamiento) e información funcional a nivel molecular. Es bien conocido que existe una alta variabilidad interobservador en la delimitación de volúmenes de tratamiento basándose exclusivamente en imágenes TAC. La incorporación de otras modalidades como RM y PET ayudan a disminuir esta fuente de incertidumbre. En localizaciones como próstata, cáncer de pulmón, cabeza y cuello y esófago ha sido demostrada su utilidad. Puesto que la planificación de tratamiento se realiza sobre imágenes de TAC es necesario que cualquier modalidad de imagen puede ser alineada con la imagen de TAC de referencia. Para ello se emplean distintos procedimientos de fusión de imágenes debido a que el paciente no se dispone de la misma manera durante la adquisición de datos, existe un lapso de tiempo importante entre distintas modalidades, variaciones anatómicas importantes (pre vs postquirúrgico), etc. Uno de los algoritmos más preciso y general para el registro de imágenes intermodalidad (CT-RM, CT-PET) es el basado en el intercambio de información mutua. Este algoritmo es muy útil cuando se tiene una gran falta de alineamiento o una de las modalidades de imagen tiene limitada información anatómica (PET). El siguiente aspecto fundamental en la planificación de los tratamientos radioterápicos consiste en la precisa determinación de la distribución de dosis de radiación en el paciente. Los algoritmos de cálculo de dosis deben ser flexibles (adaptables a cualquier situación clínica), precisos y rápidos (interactividad durante la planificación). La mayoría de sistemas de planificación son muy similares en las prestaciones sobre manejo de imágenes y visualización en pantalla. Sin embargo, el algoritmo de cálculo de dosis es la parte del software más crítica, compleja y que diferencia los distintos sistemas. La importancia del algoritmo de cálculo de dosis con precisión radica en que muchas decisiones clínicas son tomadas basándose en las distribuciones de dosis y los histogramas dosis volumen. Es por tanto de vital importancia tener un conocimiento detallado no solo del algoritmo de cálculo y sus limitaciones, sino también de la implementación en el sistema de planificación que frecuentemente conlleva simplificaciones para Sesión 2 61 CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 62 agilizar el cálculo. Existen básicamente dos aproximaciones al cálculo de dosis : a) los métodos basados en correcciones que modifican la distribución de dosis de referencia (medidas en maniquí de agua) para tener en cuenta modificadores de haz, contorno del paciente y heterogeneidades tisulares, y b) los métodos basados en modelos, tal como los procedimientos de convolución/superposición y de Monte Carlo que pretende calcular la dosis a partir de principios físicos fundamentales y usar las medidas de referencia sólo para ajustar los parámetros del modelo. Todos los algoritmos de cálculo se basan en los datos medidos experimentalmente y en modelos de transporte de energía en cierta medida. Los modelos basados en correcciones requieren gran cantidad de medidas experimentales y son inherentemente precisos en condiciones próximas en las que se tomaron los datos. Sin embargo, muchas situaciones clínicas son totalmente diferentes a las condiciones de geometría y haz que fueron medidas y por tanto las correcciones pueden ser significativamente diferentes de la unidad. Por otro lado los algoritmos basados en modelos necesitan menos medidas experimentales para ajustar el modelo, de modo que no puede reproducir tan precisamente los datos de referencia, pero son mucho más precisos en la mayoría de las situaciones clínicas. El método basado en modelo considerado como más preciso es el de Monte Carlo, aunque debido a su complejidad y todavía lentitud en el cálculo se reserva para situaciones dosimétricas especiales. Los algoritmos de convolución/superposición se han convertido en los algoritmos predominantes en los sistemas de planificación pues son capaces de dar resultados absolutamente comparables con el método de Monte Carlo en la mayoría de aplicaciones clínicas 3D. 62 Curso sobre avances y actualización en Bio-Radioterapia CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 63 Sesión 3 RADIOBIOLOGÍA DE LA RESPUESTA TUMORAL: MODELOS CLÍNICOS CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 64 CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 65 RADIOQUIMIOTERAPIA EN TUMORES DE CABEZA Y CUELLO Dr. Alejandro de la Torre Tomás. Servicio de Oncología Radioterápica Hospital Universitario Puerta de Hierro, Madrid CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 66 CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 67 Radioquimioterapia en tumores de cabeza y cuello Dr. Alejandro de la Torre Tomás Servicio de Oncología Radioterápica, Hospital Universitario Puerta de Hierro, Madrid l tratamiento de los tumores del área de cabeza y cuello ha cambiado de forma trascendental en los últimos años, desde todos los aspectos en que pueda contemplarse su aplicación. E En primer lugar ha cambiado la metodología de imagen para el diagnóstico de extensión, a través de la utilización de la PET (Tomografía por Emisión de Positrones), que añade niveles trascendentales de precisión al TAC y a la RMN, con repercusiones evidentes, aplicables en la planificación de la irradiación. (1)(2) En segundo lugar ha cambiado la tecnología de la irradiación, pasando de las técnicas de dosimetría en dos dimensiones (2D), a la planificación tridimensional (3D) en los años 80-90, y que se sirve de la TAC para reconstruir los volúmenes tumorales y de los órganos en riesgo de ser dañados por la irradiación. Mas recientemente estamos asistiendo a una nueva revolución que implica cambios de concepto (volumen a irradiar, volumen a proteger, homogeneidad de la dosis), cambios en las unidades de alta energía, cambios en los planificadores, cambios incluso en la forma de trabajar, todo ello encaminado a desarrollar tratamientos mas ajustados al tumor y que a la vez limite al máximo la irradiación de los tejidos sanos. Nos referimos a los tratamientos con Modulación de Intensidad (IMRT) que lentamente se están introduciendo en nuestro medio por la evidencia de las mejoras que están introduciendo en los pacientes oncológicos y especialmente en los del área de cabeza y cuello. (3) (4) Tercero: está cambiando, o se pretende que cambie, el estándar en tumores avanzados, que es la Radioquimioterapia, es decir la utilización simultánea en el tiempo de Radioterapia y Quimioterapia. Se trabaja en el desarrollo de la utilización de quimioterapia neoadyuvante, previa al tratamiento radical, ya que la inclusión de Taxanos al esquema clásico, Platino-5FU, podría mejorar el control y la supervivencia de los pacientes. (5). La utilización de Radioquimioterapia se ha mostrado además como tratamiento estándar en situación postoperatoria en todos aquellos pacientes con situaciones de alto riesgo de recidiva loco-regional.(6)(7) Cuarto: ha cambiado, o esta cambiando el concepto de Cirugía-Tratamiento radical, ya que se ha podido comprobar de forma evidente y definitiva que en determinadas situaciones existen tratamientos alternativos capaces de conservar la función faringo-laríngea evitando así mutilaciones definitivas. Todo ello sin pérdida de la probabilidad de supervivencia.(8) Quinto: ha cambiado la expectativa de limitarse a una probabilidad de controlar la enfermedad en aquellos pacientes no susceptibles de quimioterapia por la presencia de comorbilidades o edad que impidan su utilización. La llegada de drogas biológicas de diseño con probada actividad en estos tumores y sin una toxicidad cruzada con la Quimioterapia o la Radioterapia (9), ha venido a cubrir un hueco importante en una población de pacientes con un estado general frecuentemente deteriorado. Se amplía además la posibilidad de la investigación clínica en estos tumores (Radioterapia+ Quimioterapia+Fármacos biológicos) abriendo nuevos horizontes para mejorar las posibilidades de curación en uno de los tumores más frecuentes (5º-7º) de las sociedades industrializadas. Por último hay que nombrar un último cambio en un mayor interés, actualizado y necesario, por disminuir los efectos nocivos mas frecuentes de la irradiación; Mucositis y Xerostomia. Se cuenta para ello con tratamientos de soporte capaces de limitar los síntomas indeseables mas frecuentes (dolor, Sesión 3 67 CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 68 disfágia, perdida de peso, xerostomía) que hacen el tratamiento penoso para el paciente. Además la investigación clínica nos ha facilitado drogas útiles para la prevención y tratamiento de la xerostomía, no solo desde el punto de vista sintomático, y una nueva generación de fármacos biológicos esta a punto de irrumpir para disminuir los efectos de la irradiación sobre los tejidos sanos.(10)(11)(12) En resumen, un hoy prometedor y un futuro cargado de esperanza para hacer de estos tratamientos, potentes vehículos de curación, con una toxicidad aceptable y el menor sufrimiento para el enfermo afecto de tumores del área de cabeza y cuello. Bibliografía 1. Wong RJ, Lin DT, Schoder H, et al. Diagnostic and prognostic value of [(18)F] fluorodeoxyglucose positron emission tomography for recurrent head and neck squamous cell carcinoma. J Clin Oncol 2002;20:4199–4208. 2. Tucker R, Coel M, Ko J, et al. Impact of fluorine-18 fluorodeoxyglucose positron emission tomography on patient management: First year’s experience in a clinical center. J Clin Oncol 2001;19:2504–2508. 3. Mendenhal WMl,. Amdur RJ, and Palta JR. Intensity-Modulated Radiotherapy in the Standard. Management of Head and Neck Cancer: Promises and Pitfalls. J Clin Oncol 2006; 24:2618-2623. 4. Galvin JM and De Neve W. Intensity Modulating and Other Radiation Therapy Devices for Dose Painting. J Clin Oncol 2007; 25:924-930. 5. Hitt R, Grau J, Lopez-Pousa A et al.Randomized phase II/III clinical trial of induction chemotherapy (ICT) with either cisplatin/5-fluorouracil (PF) or docetaxel/cisplatin/5-fluorouracil (TPF) followed by chemoradiotherapy (CRT) vs. crt alone for patients (pts) with unresectable locally advanced head and neck cancer (LAHNC) J Clin Oncol; 2006 ASCO Annual Meeting Proceedings (Post-Meeting Edition).24: ABS 5515. 6. Bernier J, Domenge C, Ozsahin M, et al. Postoperative irradiation with or without concomitant chemotherapy for locally advanced head and neck cancer. N Engl J Med 2004;350:1945-52. 7. Cooper JS, Pajak TF, Forastiere AA, et al. Postoperative concurrent radiotherapy and chemotherapy in high-risk squamous-cell carcinoma of the head and neck. N Engl J Med 2004;350:1937-44. 8. Forastiere AA, Goepfert H, Maor M, et al. Concurrent Chemotherapy and Radiotherapy for Organ Preservation in Advanced Laryngeal Cancer. N Engl J Med 2003; 349:2091-2098. 9. Bonner JA, Harari PM, Giralt J, et al. Radiotherapy plus Cetuximab for SquamousCell Carcinoma of the Head and Neck. N Engl J Med 2006;354:567-78. 10. Brizel DM, Wasserman TH, Henke M et al. Phase III Randomized trial of amifostine as a radioprotector in head and neck cancer. J Clin Oncol. 2000; 18:339-345. 11. Horiot JC, Lipinski F, Schraub S y cols. Post-radiation severe xerostomia relieved by pilocarpine: a prospective French cooperative study. Radiother Oncol;2000.55:233-239. 12. Spielberger R, Stiff P, Bensinger W, y cols. Palifermin for oral mucositis after intensive therapy for hematologic cancers. N Engl J Med 2004; 351:2590-2598. 68 Curso sobre avances y actualización en Bio-Radioterapia CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 69 RADIOTERAPIA MODULADA POR NUEVAS DIANAS BIOLÓGICAS EN CARCINOMA DE CABEZA Y CUELLO Dr. Jordi Giralt Jefe de Sección y Responsable de la Unidad Servicio de Oncología Radioterápica Hospital Universitario Vall d’Hebron, Barcelona CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 70 CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 71 Radioterapia modulada por nuevas dianas biológicas en carcinoma de cabeza y cuello Dr. Jordi Giralt Servicio de Oncología Radioterápica Hospital Universitario Vall d’Hebron, Barcelona INTRODUCCIÓN La utilización de fármacos biológicos para potenciar el efecto de la radioterápia en el tratamiento del cáncer es una de las líneas de investigación mas prometedoras en el campo de la oncología radioterápica. Los fármacos biológicos implican la administración de un compuesto que administrado por vía sistémica interacciona y potencia el efecto de las radiaciones ionizantes bloqueando un proceso metabólico celular. En los últimos años ha habido una explosión en el conocimiento de los mecanismos celulares y moleculares que regulan e interaccionan con los efectos producidos por las radiaciones en las células eucariotas. Muchos de los genes que codifican proteinas relacionadas con la reparación del daño por radiaciones, se han identificado y clonado. Estos genes o sus proteinas son dianas potenciales para modificar la respuesta a la radiación de los tejidos sanos o neoplasicos. A pesar de que nuestro conocimiento en los mecanismos de regulación celular es bastante limitado, podemos empezar a explorar la eficacia terapeútica de modificar o bloquear alguno de estos procesos. Sin embargo, hay que realizar mucho trabajo para superar todas las dificultades. Las intervenciones farmacológicas han de ser específicas. Para ello hay que explotar las diferencias moleculares entre las células sanas y las neoplásicas. El proceso de muerte celular es multifactorial y habrá que ver si bloqueando un solo mecanismo se modifica la respuesta a las radiaciones. La toxicidad de estos fármacos biológicos no es despreciable. Hay que estudiar como integramos estos nuevos fármacos con los tratamientos de radioterapia y quimioterapia. En la actualidad la investigación translacional es uno de los campos más prometedores de la investigación en oncología y estos fármacos biológicos podrán integrarse en la misma. Revisaremos datos clínicos de los más importantes. RECEPTOR DEL FACTOR DE CRECIMIENTO EPIDÉRMICO El receptor del factor de crecimiento (EGFR) es una glicoproteina de transmembrana de 170 kilodalton y pertenece a la familia de los receptores de la tyrosin kinasa tipo 1. Esta compuesta por una porción extracelular que se une al receptor, un segmento de transmenbrana y un dominio intracelular con actividad tyrosin kinasa. Para acoplarse al factor de crecimiento se necesitan 2 receptores y se produce un dímero, activándose la actividad proteinkinasa. Esta actividad produce la estimulación de la vía de las kinasas, estimulando la reproducción celular, su diferenciación y el crecimiento. Dentro de los ligandos que pueden dimerizar EGFR están el factor de crecimiento epidérmico (EGF), el factor de transformación de crecimiento a, las amfiregulinas y el factor de crecimiento plaquetario. Todas las células epiteliales expresan EGFR y muchas de las mesenquimales. La expresión de EGFR se ha relacionado con tumores más agresivos, siendo un factor de mal pronóstico en muchos tumores. Hay dos formas de bloquear EGFR, a nivel de la porción extracelular mediante anticuerpos monoclonales específicos o a nivel intracelular utilizando inhibidores de la tirosinkinasa. C225 o cetuximab es un anticuerpo monoclonal quimérico dirigido contra la porción extracelular de EGFR. Estudios in vitro han demostrado que cetuximab inhibe el crecimiento celular, aumenta la radiosensibilidad y promueve la apoptosis radioinducida. La combinación de cetuximab y radioterapia Sesión 3 71 CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 72 en el tratamiento de carcinomas escamosos en ratones atímicos confirma el efecto radiosensibilizador de cetuximab. Estos buenos resultados son la base para la utilización de cetuximab en ensayos clínicos, principalmente en tumores colorectales, de cabeza y cuello y de páncreas. Cetuximab combinado con radioterapia ha sido evaluado en un ensayo clínico fase I-II, en tumores de cabeza y cuello. Bonner trata 16 pacientes con radioterapia estándar o hiperfraccionada con una infusión una semana antes de iniciar la irradiación (dosis de carga) y semanalmente durante la radioterapia. El perfil de toxicidad fue moderado y obtuvo una tasa de respuestas completas del 80%. Las dosis de cetuximab recomendadas para el estudio fase III fueron de 400 mg/m2 para la dosis de carga y de 250 mg/m2 durante la radioterapia. En pacientes con tumores da cabeza y cuello localmente avanzados, se ha realizado el estudio fase III comparando el tratamiento de radioterapia con o sin cetuximab. Se podía emplear un régimen de radioterapia convencional, hiperfraccionada o de sobreimpresión concomitante. Se incluyeron 424 pacientes, 213 en el grupo control y 211 en el grupo experimental (radioterapia + cetuximab). Con una mediana de seguimiento de 38 meses y un seguimiento mínimo de 24 meses se obtuvieron los siguientes resultados: los pacientes tratados con cetuximab y radioterapia presentaron un incremento significativo de la toxicidad cutánea a expensas de la foliculitis y de las reacciones alérgicas por el anticuerpo. Pero lo que es más importante es que no presentaron diferencias en la toxicidad en mucosas, ni como estomatitis ni como esofagitis. Estos resultados se corroboran al analizar la calidad de vida. Los pacientes tratados con cetuximab y radioterapia no presentaron diferencias ni en el índice global, ni en los trastornos de la deglución, ni en la tasa de sondas nasogástricas, ni en el uso de analgesia. El análisis de la supervivencia muestra que los pacientes tratados con cetuximab y radioterapia presentan un incremento estadísticamente significativo del control local (19 frente a 36 meses; p= 0,02) y de la supervivencia global (28 frente a 54 meses; p= 0,02). Estos resultados demuestran que la asociación de cetuximab y radioterapia en el tratamiento de los pacientes con TCC localmente avanzados mejora la supervivencia en comparación con los tratamientos con radioterapia exclusiva. La otra forma de bloquear el EGFR es utilizando fármacos inhibidores de la tyrosin kinasa. En evaluación clínica hay 2 fármacos el OSI774 o tarceva y el o lapatinib. Son quinazolonas que inhiben los ligandos por inhibición del ATP. Su vía de administración es oral. Estudios preclínicos demuestran que iressa administrado con radioterapia tiene un efecto potenciador. La modulación del EGFR ofrece una nueva herramienta en el tratamiento del cáncer. Esta se puede realizar con diversos fármacos. Los estudios clínicos en curso nos enseñaran cual es la manera de combinarlos con quimioterapia y radioterapia. INHIBIDORES DE LA ANGIOGÉNESIS La angiogénesis es un proceso fundamental en la embriogénesis, en el desarrollo de un órgano y en los procesos de cicatrización. También ocurre en condiciones patológicas como la artritis reumatoidea, la degeneración macular, las retinopatias proliferativas o el crecimiento de tumores. La angiogénesis es un proceso complejo regulado por factores de crecimiento pro- y anti-angiogénicos. Algunos de estos factores son específicos del endotelio (factor de crecimiento endotelio-vascilar VEGF) mientras que otros no son tan específicos como las metaloproteasas de matriz (MMP). Los factores de crecimiento angiogénicos se liberan en respuesta a hipoxia, estrés mecánico (presión por proliferación celular) y por alteraciones genéticas. VEGF aumenta la permeabilidad capilar, estimula la migración de células endoteliales, estimula la síntesis de proteasas y la maduración de vasos. Los receptores de VEGF tienen actividad tirosin kinasa y parece que su expresión restringida a células endoteliales. Hay 3 miembros: VEGFR-1, VEGFR-2 , VEGFR-3, siendo VEGFR-2 el mas relevante en angiogenesis y permeabilidad. Las células endoteliales activadas producen MMP, que rompen la matriz extracelular del vaso y permiten a las 72 Curso sobre avances y actualización en Bio-Radioterapia CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 73 células endoteliales penetrar por la matriz generando un nuevo vasos. Otras partículas que intervienen son las integrinas que median en la migración de las nuevas células endoteliales hacia los tejidos vecinos, creandose nuevos vasos. Los tumores requieren de procesos de angiogénesis para crecer. El VEGF juega un papel fundamental en la angiogénesis, se expresa en la mayoría de tumores y es un factor de mal pronóstico. VEGF se estimula por hipoxia, por oncogenes con Ras y por citoquinas. Se han desarrollado diferentes estrategias para bloquear a VEGF como son los anticuerpos monoclonales, peptidos que interfieran la union de VEGF con su receptory agentes que bloquean su señal. Por el momento los estudios con farmacos contra VEGF estan en fase preclínica o en fase I. Datos preliminares sugieren que en combinación con las radiaciones se obtiene un efecto radiopotenciador. Bibliografia 1. Brown JM. Therapeutic targets in radiotherapy. Int J Radiat Oncol Biol Phys 2001, 49: 319-326 2. Mason KA, Komaki R, Cox J, et al. Biology-based combined-modality radiotherapy: workshop report. Int J Radiat Oncol Biol Phys 2001, 50:1079-1089 3. Grandis JR, Melhem MF, Gooding WE, et al. Levels of TGF-alpha and EGFR protein in head and neck squamous cell carcinoma and patient survival. J Natl. Cancer Inst. 1998; 90: 824-832. 4. Raymond E, Faivre S, Armand JP. Epidermal growth factor receptor tyrosine kinase as a target for anticancer therapy. Drugs. 2000;60 Suppl 1:15-23. 5. Harari PM, Huang SM. Head and neck cancer as a clinical model for molecular targeting of therapy: combining EGFR blockade with radiation. Int J Radiat Oncol Biol Phys. 2001;49:427-33 6. Bonner JA, Raisch KP, Trummell HQ et al. Enhanced apoptosis with combination C225/radiation treatment serves as the impetus for clinical investigation in head and neck cancers. J Clin Oncol. 2000 Nov 1;18(21 Suppl):47S-53S 7. Huang SM, Harari PM. Modulation of radiation response after epidermal growth factor receptor blocks in squamous cell carcinomas: inhibition of damage repair, cell cycle kinetics a tumor angiogenesis. Clin Cancer Res. 2000;6:2166-74. 8. Bonner, J.A., Harari, P.M, Giralt, J.. y cols. Radiotherapy plus cetuximab for squamous-cell carcinoma of the head and neck. N Engl J Med. 2006 Feb 9;354(6):567-78 9. Cherrington JM, Strawn LM, Shawver LK. New paradigms for the treatment of cancer: the role of anti-angiogenesis agents. Adv Cancer Res . 2000;79:1-38. 10. Smith BD, Smith GL, Carter D, et al. Prognostic significance of vascular endothelial growth factor protein levels in oral and oropharyngeal squamous cell carcinoma. J Clin Oncol. 2000;18:2046-52. 11. Brekken RA, Overholser JP, Stastny VA, et al. Selective inhibition of vascular endothelial growth factor (VEGF) receptor 2 (KDR/Flk-1) activity by a monoclonal anti-VEGF antibody blocks tumor growth in mice. Cancer Res 2000;60:5117-5124. 12. Gorski DH, Beckett MA, Jaskowiak NT, et al. Blockage of the vascular endothelial growth factor stress response increases the antitumor effects of ionizing radiation. Cancer Res. 1999;59:3374-8 Sesión 3 73 CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 74 CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 75 DESCENSO DE ESTADIFICACIÓN PATOLÓGICA EN CÁNCER DE RECTO Dr. Javier Serrano Hospital General Universitario Gregorio Marañón, Madrid CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 76 CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 77 Descenso de estadificación patológica en cáncer de recto. Dr. Javier Serrano Hospital General Universitario Gregorio Marañón, Madrid l estudio de la respuesta patológica en la pieza quirúrgica y el grado de descenso de estadificación en el cáncer de recto localmente avanzado tratado mediante los nuevos esquemas de quimioterapia y radioterapia preoperatoria ha despertado últimamente un enorme interés entre la comunidad científica. El número de estudios clínicos publicados en revistas biomédicas dentro y fuera del ámbito de la oncología, que han explorado esta cuestión ha crecido exponencialmente durante la última década. E Para conseguir una valoración precisa y objetiva del grado de respuesta histopatológica en el espécimen quirúrgico y del descenso o no de estadio tumoral, es imprescindible llevar a cabo una correcta estadificación clínica del tumor antes del inicio de tratamiento neoadyuvante. En este sentido, los métodos diagnósticos habitualmente utilizados, al margen de la rectoscopia con biopsia, han sido la tomografía computerizada (TC) y la ecografía endorrectal (EER). Sin embargo, en los últimos años, la resonancia magnética con sonda endorrectal (RM) y la tomografía por emisión de positrones (PET) han irrumpido con fuerza como nuevas herramientas para obtener una información más precisa sobre el grado de afectación tumoral. No obstante, queda por determinar el papel exacto que debe jugar cada una de estas técnicas diagnósticas dentro del protocolo de estadificación del cáncer de recto, aunque la EER parece mantenerse con el método diagnóstico más eficiente, según un reciente metaanálisis (1). Desde la publicación en 1997 del Swedish Rectal Cancer Trial (2), en el que se demostró que el tratamiento con radioterapia externa preoperatoria (esquema hipofraccionado 25 Gy / 5 fracciones) conseguía un incremento del control local y de la supervivencia global con respecto al tratamiento quirúrgico exclusivo, se han diseñado innumerables estudios clínicos que han intentado profundizar en la misma dirección con el fin de determinar cual sería el esquema más adecuado para el tratamiento preoperatorio del cáncer de recto localmente avanzado. A la luz de los meta-análisis y ensayos clínicos randomizados que se han publicado al respecto (3,4,5,6,7,8), parece razonable pensar que el esquema preoperatorio con un mayor nivel de evidencia consistiría en un tratamiento combinado de radioterapia externa (45-50.4 Gy / 25-28 fracciones) junto con quimioterapia concomitante basada en fluoropirimidinas (5-FU, infusión continua), el cual ha demostrado un aumento en la tasa de control de local, aunque sin impacto en la supervivencia global. El índice de respuestas patológicas completas utilizando este tipo de quimio-irradiación oscila entre el 6-15%, significativamente superior con respecto a la radioterapia preoperatoria exclusiva (3-5%). Según un reciente meta-análisis (9), los únicos factores que parecen actuar de forma independiente sobre el grado de respuesta patológica son: la utilización del 5-FU en infusión continua, una dosis total de radioterapia al menos de 45 Gy, y la inclusión de un segundo agente citostático simultáneamente con el 5-FU. Además, se han publicado diversos estudios que apuntan que un intervalo de 6-8 semanas desde la finalización del tratamiento neoadyuvante hasta la cirugía es decisivo para obtener una mayor respuesta patológica en la pieza quirúrgica. En los últimos años, han aparecido numerosas publicaciones en las que se analizan nuevos esquemas de quimioirradiación concomitante, explorando vías de administración alternativas (fluoropirimidinas orales: Capecitabina, Tegafur, UFT), evaluando fraccionamientos alterados de radioterapia Sesión 3 77 CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 78 (hiperfraccionamientos: 55-60 Gy / 31-34 fracciones), o añadiendo al 5-FU un segundo agente citostático que se haya mostrado eficaz en el cáncer colorrectal (Oxaliplatino, Irinotecan). Por lo general, se trata de ensayos fase I-II o de series prospectivas institucionales que en su mayoría, tienen como objetivo principal la tasa de respuestas patológicas completas, la cual se sitúa alrededor del 12-39%, dependiendo de los estudios (10,11,12,13,14,15). Recientemente, la aparición de nuevos fármacos con actividad específica sobre ciertas dianas biológicas presentes en las células tumorales (EGFR, VEGF), ha propiciado la inclusión de estos agentes anti-tumorales en los protocolos de tratamiento neoadyuvante para el cáncer de recto. Los resultados preliminares de distintos ensayos fase I y II comunicados hasta ahora son prometedores, presentando tasas de respuesta de hasta un 70%, con porcentajes de esterilización tumoral o de mínimo residuo microscópico próximos al 50%. La respuesta patológica completa se define como la ausencia total de células tumorales viables en el especimen quirúrgico tras un análisis histopatológico minucioso. Se trata de un índice de eficacia del tratamiento relativamente rápido de obtener y sencillo de calcular. Sin embargo, está sujeto a múltiples factores de confusión, como son la variabilidad en el rigor a la hora de realizar el examen histopatológico, las pruebas diagnósticas empleadas para la estadificación o el intervalo entre la radioterapia y la cirugía, lo que hace muy difícil la comparación de los resultados entre los distintos estudios. Una forma de minimizar este problema, sería el establecimiento de una escala histológica común que sirviera para medir el grado objetivo de respuesta tumoral en la pieza quirúrgica, como ya se ha empezado a observar en trabajos recientemente publicados (grado de respuesta tumoral o tumor regression grading – TRG). Según estos estudios, un alto grado de respuesta patológica podría estar en relación con un incremento en la supervivencia libre de enfermedad (16). Sin embargo, no existe evidencia científica suficiente todavía para afirmar que la tasa de respuestas patológicas completas se comporte como un factor pronóstico en términos de supervivencia y control de la enfermedad. Un aspecto de especial relevancia de cara a futuras investigaciones en este campo, sería la posibilidad de definir marcadores clínicos, patológicos y/o moleculares que fueran capaces de predecir el grado de respuesta tumoral al tratamiento neoadyuvante. Esto permitiría categorizar a priori a los pacientes en respondedores o no respondedores, y así, ofrecer el enfoque terapéutico más adecuado en función de su perfil. En este sentido, ya se han publicado algunos trabajos que apuntan la posibilidad de llevar a cabo una cirugía más conservadora en los casos que presentan una gran respuesta patológica, atendiendo al bajo riesgo de diseminación microscópica intramural o ganglionar mesorrectal (17,18). Finalmente, varios estudios señalan que la sobre-expresión del EGFR (Epidermal Growth Factor Receptor) en las células tumorales es un indicador de una pobre respuesta al tratamiento neoadyuvante, lo que según algunas series, podría ir en detrimento de la supervivencia libre de enfermedad (19,20). Bibliografía: 1. Rectal cancer: local staging and assessment of lymph node involvement with endoluminal US, CT, and MR imaging—a meta-analysis. Bipat S, Glas AS, Slors FJ, Zwinderman AH, Bossuyt PM, Stoker J. Radiology. 2004; 232(3): 773-83. 2. Improved survival with preoperative radiotherapy in resectable rectal cancer. Swedish Rectal Cancer Trial. N Engl J Med. 1997; 336(14): 980-987. 3. Preoperative radiotherapy for resectable rectal cancer: A meta-analysis. Camma C, Giunta M, Fiorica F, Pagliaro L, Craxi A, Cottone M. JAMA. 2000; 284 (8): 1008-1015. 78 Curso sobre avances y actualización en Bio-Radioterapia CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 79 4. Adjuvant radiotherapy for rectal cancer: a systematic overview of 8,507 patients from 22 randomised trials. Colorectal Cancer Collaborative Group. Lancet. 2001; 358:1291-1304. 5. Preoperative radiotherapy combined with total mesorectal excision for resectable rectal cancer. Dutch Colorectal Cancer Group. Kapiteijn E, Marijnen CA, Nagtegaal ID, Putter H, Steup WH, Wiggers T, Rutten HJ, Pahlman L, Glimelius B, van Krieken JH, Leer JW, van de Velde CJ; N Engl J Med. 2001; 345(9): 638-646. 6. Preoperative versus postoperative chemoradiotherapy for rectal cancer. Sauer R, Becker H, Hohenberger W, Rodel C, Wittekind C, Fietkau R, Martus P, Tschmelitsch J, Hager E, Hess CF, Karstens JH, Liersch T, Schmidberger H, Raab R; German Rectal Cancer Study Group. N Engl J Med. 2004; 351(17): 1731-1740. 7. Chemotherapy with preoperative radiotherapy in rectal cancer. Bosset JF, Collette L, Calais G, Mineur L, Maingon P, Radosevic-Jelic L, Daban A, Bardet E, Beny A, Ollier JC; EORTC Radiotherapy Group Trial 22921. N Engl J Med. 2006; 355(11): 1114-23. 8. Preoperative radiotherapy with or without concurrent fluorouracil and leucovorin in T3-4 rectal cancers: results of FFCD 9203. Gerard JP, Conroy T, Bonnetain F, Bouche O, Chapet O, ClosonDejardin MT, Untereiner M, Leduc B, Francois E, Maurel J, Seitz JF, Buecher B, Mackiewicz R, Ducreux M, Bedenne L. J Clin Oncol. 2006; 24(28): 4620-4625. 9. Pathological complete response following pre-operative chemoradiotherapy in rectal cancer: analysis of phase II/III trials. Hartley A, Ho KF, McConkey C, Geh JI. Br J Radiol. 2005; 78: 934-938. 10. Randomized phase II study of neoadjuvant combined-modality chemoradiation for distal rectal cancer: Radiation Therapy Oncology Group Trial 0012. Mohiuddin M, Winter K, Mitchell E, Hanna N, Yuen A, Nichols C, Shane R, Hayostek C, Willett C; Radiation Therapy Oncology Group Trial 0012. J Clin Oncol. 2006; 24(4): 650-655. 11. Cancer and Leukemia Group B 89901; Ryan DP, Niedzwiecki D, Hollis D, Mediema BE, Wadler S, Tepper JE, Goldberg RM, Mayer RJ. Phase I/II study of preoperative oxaliplatin, fluorouracil, and external-beam radiation therapy in patients with locally advanced rectal cancer: Cancer and Leukemia Group B 89901. J Clin Oncol. 2006; 24(16): 2557-2562. 12. Multicenter phase II trial of chemoradiation with oxaliplatin for rectal cancer. Rodel C, Liersch T, Hermann RM, Arnold D, Reese T, Hipp M, Furst A, Schwella N, Bieker M, Hellmich G, Ewald H, Haier J, Lordick F, Flentje M, Sulberg H, Hohenberger W, Sauer R. J Clin Oncol. 2007; 25(1): 110-117. 13. Improved incidence of pT0 downstaged surgical specimens in locally advanced rectal cancer (LARC) treated with induction oxaliplatin plus 5-fluorouracil and preoperative chemoradiation. Calvo FA, Serrano FJ, Diaz-Gonzalez JA, Gomez-Espi M, Lozano E, Garcia R, de la Mata D, Arranz JA, GarciaAlfonso P, Perez-Manga G, Alvarez E. Ann Oncol. 2006; 17(7): 1103-1110. 14. Neoadjuvant capecitabine and oxaliplatin followed by synchronous chemoradiation and total mesorectal excision in magnetic resonance imaging-defined poor-risk rectal cancer. Chau I, Brown G, Cunningham D, Tait D, Wotherspoon A, Norman AR, Tebbutt N, Hill M, Ross PJ, Massey A, Oates J. J Clin Oncol. 2006; 24(4): 668-674. 15. Phase II study of capecitabine (Xeloda) and concomitant boost radiotherapy in patients with locally advanced rectal cancer. Krishnan S, Janjan NA, Skibber JM, Rodriguez-Bigas MA, Wolff RA, Das P, Delclos ME, Chang GJ, Hoff PM, Eng C, Brown TD, Crane CH, Feig BW, Morris J, Vadhan-Raj S, Hamilton SR, Lin EH. Int J Radiat Oncol Biol Phys. 2006; 66(3): 762-771. Sesión 3 79 CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 80 16. Prognostic significance of tumor regression after preoperative chemoradiotherapy for rectal cancer. Rodel C, Martus P, Papadoupolos T, Fuzesi L, Klimpfinger M, Fietkau R, Liersch T, Hohenberger W, Raab R, Sauer R, Wittekind C. J Clin Oncol. 2005; 23(34): 8688-8696. 17. Distal intramural spread of rectal cancer after preoperative radiotherapy: the results of a multicenter randomized clinical study. Chmielik E, Bujko K, Nasierowska-Guttmejer A, Nowacki MP, Kepka L, Sopylo R, Wojnar A, Majewski P, Sygut J, Karmolinski A, Huzarski T, Wandzel P. Int J Radiat Oncol Biol Phys. 2006; 65(1): 182-188. 18. Prediction of mesorectal nodal metastases after chemoradiation for rectal cancer : results of a randomised trial: implication for subsequent local excision. Bujko K, Nowacki MP, Nasierowska-Guttmejer A, Kepca L, Winkler-Spytkowska B, Suwinski R, Oledzki J, Stryczynska G, Weiczorak A, Serkies K, Rogowska D, Tokar P; Polish Colorectal Study Group. Radiother Oncol. 2005; 76(3): 234-240. 19. The expression of epidermal growth factor receptor results in a worse prognosis for patients with rectal cancer treated with preoperative radiotherapy: a multicenter, retrospective analysis. Giralt J, de las Heras M, Cerezo L, Eraso A, Hermosilla E, Velez D, Lujan J, Espin E, Rosello J, Majo J, Benavente S, Armengol M, de Torres I; Grupo Español de Investigacion Clinica en Oncologia Radioterapica (GICOR). Radiother Oncol. 2005; 74(2): 101-108. 20. Epidermal growth factor receptor as a predictor of tumor downstaging in locally advanced rectal cancer patients treated with preoperative chemoradiotherapy. Kim JS, Kim JM, Li S, Yoon WH, Song KS, Kim KH, Yeo SG, Nam JS, Cho MJ. Int J Radiat Oncol Biol Phys. 2006; 66(1): 195-200. 80 Curso sobre avances y actualización en Bio-Radioterapia CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 81 PERFIL MOLECULAR Y NEOADYUVANCIA EN CÁNCER DE RECTO Dra. Laura Cerezo Jefe de Sección y Responsable de la Unidad Servicio de Oncología Radioterapeútica Hospital Universitario de la Princesa, Madrid CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 82 CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 83 Perfil molecular y neoadyuvancia en cáncer de recto Dra. Laura Cerezo Servicio de Oncología Radioterapeútica Hospital Universitario de la Princesa, Madrid ESTADO ACTUAL DEL TRATAMIENTO NEOADYUVANTE El tratamiento recomendado para los pacientes con estadios II y III de cáncer de recto es la combinación de cirugía, radioterapia y quimioterapia. La estrategia neoadyuvante, es decir, la radioterapia o radioquimioterapia seguida de cirugía presenta una serie de ventajas radiobiológicas y clínicas bien conocidas como son la mayor radiosensibilidad de las células tumorales, la reducción del tamaño tumoral con mayor probabilidad de resecabilidad y de conservación del esfínter anal, y la menor morbilidad sobre las asas de intestino delgado. Diferentes estudios randomizados han demostrado el beneficio de la RT preoperatoria frente a la cirugía exclusiva, incluso cuando se realiza resección total del mesorrecto 1,2, la superioridad de la radioterapia preoperatoria frente a la postoperatoria 3 y de la radioquimioterapia frente a la radioterapia sola 4. Falta por determinar la dosis total de irradiación y el esquema de fraccionamiento, ya que el único estudio publicado no ha encontrado diferencias significativas entre el curso largo (50 Gy en 25 fx) y el curso corto (25 Gy en 5 fx) en el porcentaje de conservación del esfínter 5. Aunque la recidiva local ha pasado a ser un problema menor, las metástasis a distancia constituyen la forma más común de fallo del tratamiento con los regímenes de quimioterapia estándar 3,4, lo cual subraya la necesidad de tratamientos sistémicos más efectivos. FACTORES PRONÓSTICOS CLÍNICOS Y MOLECULARES El tamaño del tumor, el intervalo entre la radioterapia y la cirugía y la tasa de respuesta patológica completa son factores pronósticos con influencia en el control local y en la conservación del esfínter 6,7,8 . Recientemente están siendo identificados factores pronósticos moleculares que ayudarán no sólo a seleccionar pacientes de riesgo, sino además a desarrollar nuevas estrategias terapéuticas. Aunque el cáncer colorectal (CCR) esporádico constituye la mayoría de los casos, el 5% de CRC hereditario ha permitido conocer algunas vías de señalización como son la inestabilidad cromosómica, responsable del 85% de los CCR y la inestabilidad de los microsatélites (MSI), responsable del 15% restante. Los genes frecuentemente relacionados con inestabilidad cromosómica son APC (Adenomatous Polyposis Coli), DCC (Deleted in Colorectal Cancer), P53, y K-ras, mientras que los relacionados con MSI son los genes reparadores MLH1 y MSH2. La delección o inactivación de estos genes, en un determinado orden cronológico, conduce a la progresión maligna 9. Se puede encontrar MSI en el 1015% de CCR esporádico y en el 95% de cáncer de colon hereditario no polipósico. A nivel molecular, la sobreexpresión del receptor del factor de crecimiento epidérmico (EGFR) y del factor de crecimiento del endotelio vascular (VEGF) se suelen asociar a fenotipos más agresivos de CCR y a peor pronóstico, con resistencia al tratamiento neoadyuvante y con el desarrollo de metástasis a distancia 10,11. Sesión 3 83 CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 84 AVANCES EN EL TRATAMIENTO NEOADYUVANTE DEL CÁNCER DE RECTO Además de la disponibilidad de nuevas drogas citotóxicas como el oxaliplatino y el irinotecan, la investigación básica ha llevado a la identificación de nuevas dianas moleculares. Los agentes más prometedores en el tratamiento del CCR son el anticuerpo Cetuximab que bloquea el dominio extracelular del EGFR, y el anticuerpo humanizado Bevacizumab, que se une al VEGF libre, inhibiendo la angiogénesis y el crecimiento tumoral. Ambos agentes han demostrado superioridad en combinación con quimioterapia en CCR metastático 12,13, sentado las bases para su utilización en el contexto del tratamiento neoadyuvante. Cetuximab es un potente radiosensibilizante que actúa disminuyendo la repoblación celular, promoviendo la apoptosis y aumentando la reoxigención. El estudio fase I llevado a cabo por Hofheinz et al14, combinando cetuximab con irinotecan y capecitabina más radioterapia en cáncer de recto (T3-T4 o N+) ha demostrado buena tolerancia y un alto porcentaje de respuestas patológicas completas (11 de 19 casos). Son necesarios estudios prospectivos para confirmar estos resultados preliminares y para asegurar que no aumentan las complicaciones perioperatorias. El mayor conocimiento del significado de los diferentes factores moleculares y la mayor comprensión de las vías de señalización celular permitirá en un futuro adecuar los tratamientos oncológicos específicos al perfil genético y molecular de cada paciente. Bibliografía 1. Swedish Rectal Cancer Trial. Improved survival with preoperative radiotherapy in respectable rectal cancer. N Engl J Med 1997; 336:980-7. 2. Kapiteijn E, Marijnen CAM, Nagtegaal ID, et al. Preoperative radiotherapy combined with total mesorectal excision for respectable rectal cancer. New Engl J Med 2001; 345:638-646. 3. Sauer R, Becker H, Hohenberger W, Rodel C, et al. Preoperative versus postoperative chemoradiotherapy for rectal cancer. N Engl J Med 2004; 351:1731-40. 4. Bosset JF, Collette L, Calais G, et al. Chemotherapy with preoperative radiotherapy in rectal cancer. N Engl J Med 2006; 355:1114-23. 5. Bujko K, Nowacki MP, Nasierowska-Guttmejer A, et al. sphincter preservation following preoperative radiotherapy for rectal cancer: report of a randomised trial comparing short –term radiotherapy vs. conventionally fractionated radiochemotherapy. Radiother Oncol 2004; 72:15-24. 6. Rödel C, Martus P, Papadoupolos T, et al. Prognostic significance of tumor regression after preoperative chemoradiotherapy for rectal cancer. J Clin Oncol 2005; 23:8688-8696. 7. Francois Y, Nemoz Cj, Baulieux J, et al. Influence of the interval between preoperative radiation therapy and surgery on downstaging and on the rate of sphincter-sparing surgery for rectal cancer: The Lyon R90-01 randomized trial. J Clin Oncol 1999; 17:2396-402. 8. Janjan NA, Crane C, Feig BW, et al. Improved overall survival among responders to preoperative chemoradiation for locally advance rectal cancer. Am J Clin Oncol 2001; 24:107-12. 9. Kitisin K, Mishra L. Molecular biology of colorectal cancer: New targets. Semin Oncol 2006; 33(Suppl 11):14-23. 10. Giralt J, de las Heras M, Cerezo L, et al. The expression of epidermal growth factor receptor results in a worse prognosis for patients with rectal cancer treated with preoperative radiotherapy: A multicenter, retrospective analysis. Radiother Oncol 2005; 74:101-108. 84 Curso sobre avances y actualización en Bio-Radioterapia CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 85 11. Navalpotro B, Giralt J, Cerezo L, et al. Prognostic significance of cyclooxigenase-2 (COX-2) and vascular endothelial growth factor (VEGF) in patients with rectal cancer treated with preoperative radiotherapy. Radiother Oncol 2004; 73(Suppl 1):pag 168. 12. Cunningham D, Humblet Y, Siena S, et al. Cetuximab nonotherapy and cetuximab plus irinotecan in irinotecan-refractory metastatic colorectal cancer. N Engl J Med 2004; 351:337-345. 13. Hurwitz HI, Fehernbacher L, Hainsworth JD, et al. Bevacizumab in combination with fluorouracil and leucovorin: an active regimen for first-line metastatic colorectal cancer. J Clin Oncol 2005; 23:3502-8. 14. Hofheinz RD, Horisberger K, Woernle C, et al. Phase I trial of cetuximab in combination with capecitabine, weekly irinotecan, and radiotherapy as neoadjuvant therapy for rectal cancer. Int J Radiat Oncol Biol Phys 2006; 66(5): 1384-1390. Sesión 3 85 CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 86 CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 87 Sesión 4 RADIOBIOLOGÍA Y RADIOTERAPIA BASADA EN LA EVIDENCIA MODELOS CLÍNICOS CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 88 CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 89 SUPRESIÓN ANDROGÉNICA ASOCIADA A RADIOTERAPIA EN EL TRATAMIENTO DEL CÁNCER DE PRÓSTATA Dra. Almudena Zapatero. Médico Especialista de Área Servicio de Oncología Radioterápica Hospital Universitario de la Princesa, Madrid CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 90 CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 91 Supresión androgénica asociada a radioterapia en el tratamiento del cáncer de próstata Dra. Almudena Zapatero Servicio de Oncología Radioterápica Hospital Universitario de la Princesa, Madrid COMBINACIÓN DE ABLACIÓN ANDROGÉNICA Y RADIOTERAPIA: JUSTIFICACIÓN La justificación para combinar la supresión androgénica con la radioterapia radical procede de datos experimentales y de la práctica clínica. Sabemos desde hace muchos años que la RT produce muerte celular por lesión directa en el DNA. En la última década se ha demostrado que la RT también actúa sobre la membrana plasmática dando lugar a una cascada de respuestas biológicas que desembocan en la apoptosis (hidrólisis de esfingomielina mediante la esfingomielinasa, lo que genera ceramida que es un potente inductor de la apoptosis). Sabemos también que la RT induce la liberación de citokinas envueltas en la proliferación de fibroblastos, lesión endotelial y regulación de la apoptosis. Por otro lado, es bien conocido que la ablación androgénica produce disminución del volumen tumoral (citoreducción). Esta reducción resultaría en una disminución de la hipoxia tumoral, aumentando por lo tanto la radiosensibilidad. Asociado, esta descrito un enlentecimiento del ciclo celular mediado por el bloqueo androgénico que implicaría una disminución de la repoblación celular durante la irradiación. Estudios recientes indican que la deprivación androgénica puede producir muerte celular por apoptosis. Finalmente, la hormonoterapia administrada de forma adyuvante a radioterapia actuaría esterilizando las micrometástasis ocultas, mientras que la irradiación mataría las células tumorales independientemente de su hormonosensibilidad en un fenómeno de cooperación espacial similar al que ocurre con la radioquimioterapia. La evidencia experimental de estas hipótesis procede de dos grupos de trabajo con amplia experiencia publicada. Los datos derivados de experimentos animales llevados a cabo por Zietman et al del Massachussets General Hospital y de forma paralela, Pollack et al del MDACC, han demostrado la posible existencia de una respuesta apoptótica supra-aditiva entre radiación y supresión androgénica. La siguiente cuestión es si existe realmente un beneficio clínico para los pacientes con la asociación de hormonoterapia y radioterapia. En la actualidad disponemos ya de los resultados maduros de múltiples estudios aleatorizados mono y multi-institucionales, con más de 4000 pacientes reclutados, que han estudiado el papel de la combinación de hormono-radioterapia en el cáncer de próstata localizado COMBINACIÓN DE SUPRESIÓN ANDROGÉNICA Y RADIOTERAPIA FRENTE A RADIOTERAPIA EXCLUSIVA: IMPACTO EN SUPERVIVENCIA Existen más de 10 ensayos prospectivos aleatorizados y una revisión sistemática Cohrane que han investigado el beneficio potencial de la asociación de deprivación androgénica (mayoritariamente con goserelina) bien neoadyuvante y de corta duración (habitualmente menos de 6 meses), bien adyuvante y generalmente prolongada (entre dos años e indefinida) con radioterapia externa radical en pacientes con cáncer de próstata localizado. Sesión 4 91 CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 92 Las potenciales conclusiones derivadas de estos ensayos de deprivación androgénica en combinación con radioterapia convencional parecen confirmar un beneficio en supervivencia global para aquéllos pacientes con enfermedad localmente avanzada de alto riesgo (T3-4, Gleason 7-10) cuando se utilizan esquemas de hormonoterapia prolongada (≥2 años), y posiblemente para pacientes con T3 y Gleason £ 6 con hormonoterapia corta neoadyuvante. ¿CUÁL ES EL PAPEL DE LA DEPRIVACIÓN ANDROGÉNICA EN COMBINACIÓN CON RADIOTERAPIA 3D EN INTENSIFICACIÓN DE DOSIS? Debido a que los ensayos aleatorizados fase III que han demostrado beneficio con el empleo de DA han empleado de forma exclusiva dosis de radiación convencionales entre 65.0 Gy y 70.0 Gy, la cuestión que se deriva a continuación, es si el empleo de DA podría conducir a un beneficio adicional en pacientes tratados con RTC-3D a dosis altas. Aunque diversos autores han presentado resultados de estudios prospectivos y retrospectivos mono-institucionales tratando de contestar esta controversia 24-27 con datos contradictorios, no disponemos aún de los resultados de los ensayos aleatorizado en marcha. Entre los estudios no aleatorizados publicados cabe destacar la experiencia nacional del grupo GICOR. Se trata de un estudio prospectivo multicéntrico de 416 pacientes, asignados según factores pronóstico a uno de 3 grupos de riesgo y tratamiento que combinaba RT dosis altas con o sin hormonoterapia. Los resultados preliminares de este estudio confirman un beneficio significativo de la dosis elevada (> 72 Gy) de radiación con independencia del grupo de riesgo y específicamente en pacientes de alto riesgo en asociación con hormonoterapia prolongada. Está en marcha un ensayo clínico fase III (DART01/05) del mismo grupo de investigación que investiga la duración óptima del tratamiento hormonal en combinación con RTC3D a dosis altas. PRESENTE – FUTURO: MARCADORES MOLECULARES DE RADIOSENSIBILIDAD, NUEVAS MOLÉCULAS. Con el creciente conocimiento de la biología molecular del cáncer de próstata y la tecnología del microarray ha sido posible identificar genes de importancia potencial en el desarrollo del cáncer de próstata, agresividad y diseminación metastática. Más relevante aún es la creciente evidencia de la implicación de dichos marcadores moleculares en la resistencia a tratamientos (radioterapia, hormonoterapia, quimioterapia) y en la identificación de nuevas dianas de intervención terapéutica. La radioresistencia envuelve procesos en la vía de señal antiapoptótica. La sobre-expresión de la proteína antiapoptótica Bcl-2 es observada entre el 30%-60% de pacientes con cáncer de próstata al diagnóstico y en cerca del 100% de los cánceres de próstata hormono-refractarios. La proteína Bcl-2 está significativamente sobre-expresada en las recidivas tras radioterapia del cáncer de próstata localizado, sugiriendo que alteraciones en la vía apoptótica pueden ser importantes en el desarrollo de recidivas locales. También se ha encontrado una sobre-expresión de Bcl-xL en el 80%-100% de cánceres hormonorefractarios y una correlación con supervivencias más cortas. Finalmente, la sobreexpresión de ambas proteínas antiapoptóticas Bcl-2/Bcl-xL disminuye la respuesta pro-apoptótica de la radiación, hormono y quimioterapia. 92 Curso sobre avances y actualización en Bio-Radioterapia CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 93 Con estos antecedentes el grupo Uro-Oncológico del HUP en colaboración con el CNIO ha puesto en marcha un proyecto de investigación en pacientes con cáncer de próstata tratados con radiohormonoterapia, cuyo objetivo primario es estudiar las diferencias de patrones existentes en marcadores biológicos-moleculares (Ki-67, Bcl-2/Bax, p53, p21, factores de crecimiento….) determinados en biopsias prostáticas pre y post tratamiento de pacientes tratados con radioterapia a altas dosis (con y sin supresión androgénica asociada) y determinar un perfil de radioresistencia, así como identificar patrones diferenciales en pacientes tratados con radioterapia versus radio-hormonoterapia. Referencias bibliográficas 1. Pollack A, Zagars GK, Starkschall G, Antolak JA, Lee JJ, Huang E, von Eschenbach AC, Kuban DA, Rosen I. Prostate cancer radiation dose response: results of the M. D. Anderson phase III randomized trial. Int J Radiat Oncol Biol Phys 2002;53(5):1097-105. 2. Zelefsky MJ, Fuks Z, Hunt M, Lee HJ, Lombardi D, Ling CC, Reuter VE, Venkatraman ES, Leibel SA. High dose radiation delivered by intensity modulated conformal radiotherapy improves the outcome of localized prostate cancer. J Urol 2001;166(3):876-81. 3. Fiveash JB, Hanks G, Roach M, Wang S, Vigneault E, McLaughlin PW, Sandler HM. 3D conformal radiation therapy (3DCRT) for high grade prostate cancer: a multi-institutional review. Int J Radiat Oncol Biol Phys 2000;47(2):335-42. 4. Hanks GE, Hanlon AL, Epstein B, Horwitz EM. Dose response in prostate cancer with 8-12 years’ follow-up. Int J Radiat Oncol Biol Phys 2002;54(2):427-35. 5. Joon DL, Hasegawa M, Sikes C, et al Supraadditive apoptotic response of R3327-G rat prostate tumors to androgen ablation and radiation. Int J Radiat Oncol Biol Phys. 1997 Jul 15;38(5):1071-7. 6. Pollack A, Ashoori F, Sikes C, et al. The early supra-additive apoptotic response of R3327-G prostate tumors to androgen ablation and radiation is not sustained with multiple fractions. Int J Radiat Oncol Biol Phys. 2000 Jan 1;46(1):153-8. 7. Bolla M, Collette L, Blank L, et al. Long-term results with immediate androgen suppression and external irradiation in patients with locally advanced prostate cancer (an EORTC study): a phase III randomized trial. Lancet. 2002;360(9327):103-6. 8. Pilepich MV, Winter K, John MJ, et al. Phase III radiation therapy oncology group (RTOG) trial 8610 of androgen deprivation adjuvant to definitive radiotherapy in locally advanced carcinoma of the prostate. Int J Radiat Oncol Biol Phys. 2001;50(5):1243-52. 8. Hanks GE, Pajak TF, Porter A, et al. Radiation Therapy Oncology Group. Phase III trial of long-term adjuvant androgen deprivation after neoadjuvant hormonal cytoreduction and radiotherapy in locally advanced carcinoma of the prostate: the Radiation Therapy Oncology Group Protocol 92-02. J Clin Oncol 2003; 21:3972-3978. 10. Roach M, Lu JD, Lawton C, et al. A phase III trial comparing whole pelvic (WP) to prostate only (PO) radiotherapy and neoadjuvant to adjuvant total androgen suppression (TAS): preliminary analysis of RTOG 94-13 (abstract). Int J Radiat Oncol Biol Phys 2001; 51:3. 11. D’Amico AV, Manola J, Loffredo M, et al. 6-month androgen suppression plus radiation therapy vs radiation therapy alone for patients with clinically localized prostate cancer: a randomized controlled trial. JAMA 2004;292:821-7 Sesión 4 93 CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 94 12. Pilepich MV, Winter K, Lawton CA et al. Androgen suppression adjuvant to definitive radiotherapy in prostate carcinoma. Long-term results of phase III RTOG 8531. Int J Radiat Oncol Biol Phys, 2005;61:1285-1290. 13. Jani AB, Basu A, Abdalla I, Connell PP, Krauz L, Vijayakumar S. Impact of hormone therapy when combined with external beam radiotherapy for early-stage, intermediate-, or high-risk prostate cancer. Am J Clin Oncol. 2003; 26(4): 382-5. 14. Symon Z, Griffith KA, McLaughlin PW, Sullivan M, Sandler HM. Dose escalation for localized prostate cancer: substantial benefit observed with 3D conformal therapy. Int J Radiat Oncol Biol Phys. 2003; 57(2): 384-90. 15. Nguyen KH, Horwitz EM, Hanlon AL, Uzzo R, Polack A. Does short-term androgen deprivation substitute for radiation dose in the treatment of high risk prostate cancer. Int J Radiat Oncol Biol Phys 2002 54:2: 133-135. 16. Almudena Zapatero, Francisco Valcárcel, Felipe A. Calvo, Rosa Algás, Amelia Béjar, Javier Maldonado, Salvador Villá. Risk-adapted androgen deprivation and escalated 3d-conformal radiotherapy for prostate cancer: does radiation dose influence outcome of patients treated with adjuvant androgen deprivation? Report of a multicenter trial GICOR 05/99. J Clin Oncol 2005;23:6561-6568. 17. Almudena Zapatero, Mario A. López, Ricardo Minués, Feliciano García-Vicente. Dose-escalation with three-dimensional conformal radiotherapy for prostate cancer. Is more dose really better in highrisk patients treated with androgen deprivation? Clin Oncol 2006.18:600-607. 18. Almudena Zapatero. Indicaciones y Resultados de Radioterapia Externa Asociada a Hormonoterapia. En: Cáncer de Próstata (capítulo 28, pp 319-328). Eds. Javier Angulo, Oscar Leiva. 2007. 19. Rile Li, Kateri Heydon, M. Elizabeth Hammond, et al. Ki-67 Staining Index Predicts Distant Metastasis and Survival in Locally Advanced Prostate Cancer Treated With Radiotherapy: An Analysis of Patients in Radiation Therapy Oncology Group Protocol 86-10. Clinical Cancer research, 2004;10, 4118–4124. 20. Mark A. Ritter, Kennedy W. Gilchrist, Marta Voytovich, Et Al. The Role Of P53 In Radiation Therapy Outcomes For Favorable-To-Intermediate–Risk Prostate Cancer Int. J. Radiat Oncol Biol. Phys., 53,. 574–580, 2002. 21. Li-Yan Khor, Michelle Desilvio, Rile Li, Et Al. Bcl-2 And Bax Expression And Prostate Cancer Outcome In Men Treated With Radiotherapy In Radiation Therapy Oncology Group Protocol 86-10.Int J Radiat Oncol Biol Phys 2006;66:25–30. 94 Curso sobre avances y actualización en Bio-Radioterapia CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 95 CÁNCER DE PULMÓN Dr. Ismael Herruzo Cabrera Jefe de Servicio de Oncología Radioterápica Hospital Carlos Haya, Málaga CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 96 CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 97 Cáncer de pulmón Dr. Ismael Herruzo Cabrera. Servicio de Oncología Radioterápica. Hospital Carlos Haya de Málaga. e aportan un resumen de ponencia, recogiendo las recomendaciones del proceso del cáncer de pulmón, elaborado por la Consejería de Salud, que pienso es un buena propuesta, así como las recomendaciones para los diagnósticos cuidados en enfermería para estos tumores recogidos en dicha guía. S Intercalaremos los principales comentarios de la ponencia. El cáncer de pulmón supone la mayor causa de muerte por cáncer en el mundo occidental. En España se presentan 18.500 casos nuevos al año, que producen 17.308 muertes, en el año 2000. Por sexos, la razón varón:mujer es de 4,5 en Europa y de 11 en España, reflejando el la tendencia del hábito en nuestro país, con menor riesgo laboral en las mujeres españolas. En cuanto a la prevalencia parcial, la incidencia de los últimos 5 años ha ocasionado la existencia de 24.000 casos prevalentes en España, que refleja la alta mortalidad de este tumor escasa diferencia entre casos prevalentes e incidentes). A pesar de los avances diagnósticos y terapéuticos, el cáncer de pulmón sigue siendo altamente letal: menos del 15% de los pacientes logran sobrevivir cinco años tras el diagnóstico. La marcada variabilidad geográfica y temporal del cáncer de pulmón refleja la distribución de sus factores de riesgo, principalmente el consumo de tabaco, que constituye el agente etiológico más importante. En el conjunto de países europeos, en los hombres, España ocupaba uno de los últimos lugares en cuanto a la frecuencia de este tumor en los años 70, mientras que los países del norte y centro de Europa partían de tasas más elevadas. La eficacia de la lucha antitabáquica en estos países se ha traducido en una disminución de la incidencia y la mortalidad. Aunque la frecuencia del cáncer de pulmón es mucho menor en mujeres, la disminución de tasas o la estabilización de las mismas se observa en muy pocos países. La variabilidad geográfica aumentado, siendo la incidencia en Dinamarca y Reino Unido unas cinco o seis veces mayor que España. Sin embargo el consumo de tabaco de las mujeres españolas empieza a mostrar su efecto la tendencia observada en los últimos años (López-Abente 2002). las ha en en Sesión 4 97 CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 98 Dentro de nuestro país, la mortalidad muestra una mayor heterogeneidad en hombres que en mujeres. Las tasas más altas en los hombres se concentran en el suroeste (Cádiz y Sevilla) y en algunas provincias del norte (Asturias y Vizcaya) mientras que llama la atención la alta mortalidad en las mujeres de Gran Canaria. Un análisis pormenorizado de la evolución de la mortalidad por cáncer de pulmón en España muestra que el ritmo de incremento se ralentiza a partir de 1988, y en 1994 comienza a descender un 0,35% anual. En mujeres, la mortalidad aumenta en España a un ritmo del 2,4% anual desde 1990. Se ha estimado que el tabaco contribuye a la aparición del 80-90% de los casos de cáncer de pulmón en hombres y del 55%-80% de los casos en las mujeres. Además, la exposición ocupacional a diferentes sustancias - como el arsénico, el asbesto, los hidrocarburos aromáticos policíclicos, etc.-, explicaría el 18% de los casos en hombres y menos del 1% en las mujeres. Otros factores de riesgo reconocidos son las radiaciones ionizantes, la contaminación atmosférica y la menor ingesta de vegetales y frutas frescas, probablemente reflejando el efecto de los agentes antioxidantes contenidos en estos alimentos. (LA SITUACIÓN DEL CÁNCER EN ESPAÑA. Área de Epidemiología Ambiental y Cáncer. Centro Nacional de Epidemiología. Instituto de Salud Carlos III © MINISTERIO DE SANIDAD Y CONSUMO. CENTRO DE PUBLICACIONES. ISBN: 84-7670-673-1- 2005) Actualmente no se recomienda el scrinig con TAC, aunque puede disminuir la mortalidad, al diagnosticarlos en EI, en población seleccionada de alto riesgo. TÉCNICAS EN EL CA. BRONCOGÉNICO 2º ESCALÓN DIAGNÓSTICA ESTADIFICACIÓN Citología de esputo Tomografía axial computarizada Endoscopia respiratoria Punción-aspiración transtorácica control de TAC TAC craneal Toracocentesis y biopsia pleural ciega Resonancia Magnética Videotoracoscopia Gammagrafía ósea Biopsia de metástasis extratorácicas PET Mediastinoscopia/ Mediastinotomía 98 Curso sobre avances y actualización en Bio-Radioterapia CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 99 Respecto al diagnostico anatomopatologico, se reproduce la clasificación más aceptada, de la OMS, teniendo en cuenta que hoy día los marcadores inmunohistoquímicos y genéticos han supuesto un cambio radical al permitir en el adenocarcinoma diferenciar tumor primario de metastásico, en el cáncer bronquiloalveolar predecir el pronóstico y en el adenocarcinoma predecir la respuesta a QT. En tumores avanzados y metastáticos estos factores predictivos genéticos nos orientaran a la hora de decidor asociar a la QT convencional las nuevas dianas terapéuticas (bevacizumab y erlotinib). Sigue siendo útil la distinción entre cáncer microcítico y no microcítico por el diferente manejo terapéutico y pronóstico. Sesión 4 99 CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 100 CLASIFICACIÓN TNM CATEGORÍA T (TUMOR PRIMARIO) Tx No se puede valorar el tumor primario, o hay tumor demostrado por la presencia de células malignas en el esputo o lavados bronquiales, pero no visualizado por técnicas de imagen o broncoscopia. T0 No hay evidencia de tumor primario Tis Carcinoma in situ T1 Tumor de 3 cm o menos en su diámetro mayor, rodeado de pulmón o pleura visceral, y sin evidencia broncoscópica de invasión más proximal que el bronquio lobar1 T2 Tumor con cualquiera de las siguientes características de tamaño o extensión: – Más de 3 cm en su diámetro mayor – Afecta al bronquio principal a 2 cm o más de la carina principal – Invade la pleura visceral Asociado con atelectasia o neumonitis obstructiva que se extiende a la región hiliar, pero no afecta al pulmón entero T3 Tumor de cualquier tamaño que invade directamente cualquiera de lo siguiente: pared torácica (incluyendo tumores del surco superior), diafragma, la pleura mediastínica o pericardio parietal; o tumor en el bronquio principal a menos de 2 cm de la carina principal pero sin afectación de la misma; o atelectasia o neumonitis obstructiva asociada del pulmón entero T4 Tumor de cualquier tamaño que invade cualquiera de lo siguiente: mediastino, corazón, grandes vasos, tráquea, esófago, cuerpo vertebral, carina; o tumor con un derrame pleural maligno2 CATEGORÍA N (GANGLIOS LINFÁTICOS REGIONALES) Nx No se pueden valorar los ganglios regionales N0 Sin metástasis ganglionares regionales N1 Metástasis en los ganglios peribronquiales y/o hiliares ipsilaterales, incluyendo extensión directa N2 Metástasis en los ganglios mediastínicos ipsilaterales y/o subcarínicos N3 Metástasis en los ganglios mediastínicos contralaterales, hiliares contralaterales, escalénicos o supraclaviculares (ipsi o contralaterales) CATEGORÍA M (METÁSTASIS A DISTANCIA) Mx No se puede valorar la presencia de metástasis a distancia M0 Sin metástasis a distancia M1 Metástasis a distancia presentes3 1 También se clasifica como T1 al infrecuente tumor superficial, de cualquier tamaño, con el componente invasivo limitado a la pared bronquial, que se puede extender próximamente al bronquio principal. 2 La mayoría de los derrames pleurales asociados con el carcinoma broncogénico se deben al tumor. Sin embargo, hay algunos pacientes en quienes múltiples estudios histopatológicos del líquido pleural son negativos para tumor, el líquido no es hemático y no es un exudado. Cuando estos elementos y el juicio clínico indican que el derrame no se relaciona con el tumor se debería de excluir el derrame como un elemento de clasificación, y el paciente debería de ser estadificado como T1, T2 o T3. 3 Nódulos metastásicos separados del tumor primario en el pulmón ipsilateral pero en distinto lóbulo al tumor primario, son clasificados como M1 100 Curso sobre avances y actualización en Bio-Radioterapia CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 101 CLASIFICACIÓN DE SITUACIONES ESPECIALES Invasión del nervio frénico T3 Parálisis de la cuerda vocal (resultante de la invasión de la rama recurrente del nervio vago), obstrucción de la vena cava superior o compresión de la tráquea o del esófago en tumores centrales T4 Parálisis de la cuerda vocal (resultante de invasión de la rama recurrente del nervio vago), obstrucción de la vena cava superior o compresión de la tráquea o del esófago en tumores periféricos con evidente afectación mediastínica N2 Afectación de grandes vasos, definidos como aorta, vena cava superior, vena cava inferior, tronco de la ar teria pulmonar, porción intrapericárdica de las ar terias pulmonares derecha e izquierda y porción intrapericárdica de las venas pulmonares derechas e izquierdas superiores e inferiores T4 Extensión directa al pericardio parietal T3 Extensión directa al pericardio visceral T4 Focos tumorales separados de la invasión pleural directa del tumor primario T4 Lesiones separadas por fuera de la pleura, en la pared torácica o el diafragma M1 Tumor del sulcus superior con afectación de costilla, músculo intercostal, cadena simpática, ganglio estrellado o a la parte más baja del plexo braquial Tumor de Pancoast con afectación de cuerpo ver tebral o extensión hacia los forámenes neuronales Tumores simultáneos en el mismo pulmón: se utiliza la T más alta y se indica entre paréntesis la multiplicidad (m) o el número de tumores (nº) Carcinoma bronquioloalveolar en forma de infiltrado difuso sin evidencia de obstrucción endobronquial T3 T4 T(m) o T(nº) Tx Carcinoma bronquioloalveolar difuso bilateral M1 Carcinoma bronquioloalveolar en forma de varios nódulos en el mismo lóbulo T4 Carcinoma bronquioloalveolar en forma de varios nódulos en diferentes lóbulos, ipsi o contralaterales M1 Los tumores simultáneos en ambos pulmones se clasifican por separado El derrame pericárdico sigue las mismas reglas que el derrame pleural PROTOCOLO DE TRATAMIENTO QUIRÚRGICO DE CP DE CÉLULAS NO PEQUEÑAS Pruebas de operabilidad para resección pulmonar Espirometría; gasometría arterial; difusión; gammagrafía de perfusión pulmonar cuantitativa y diferencial; prueba de marcha; consumo de oxígeno. • Los pacientes con FEV1≥≥2 L, DLCO≥≥60%, sin disnea, ni signos radiológicos de neumopatía intersticial, no requieren otros estudios funcionales respiratorios. • Si FEV1 postbroncodilatador < 2 L, DLCO< 60%, presencia de disnea de 3 o menos pisos, se efectuará cálculo del FEV1 postoperatorio predicho (FEV1Pp) y del DLCO postoperatorio predicho (DLCOPp), con independencia de la resección pulmonar propuesta. Se requerirá una gammagrafía de perfusión pulmonar cuantificada y diferencial. Sesión 4 101 CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 102 • Se consideran operables con riesgo aceptable los pacientes con FEV1Pp y DLCOPp mayores del 40% del teórico. Estos pacientes no precisan otros estudios funcionales respiratorios. • Se consideran de alto riesgo los pacientes con FEV1Pp y DLCOPp menores del 40% del teórico. Exploración quirúrgica Exploración quirúrgica del mediastino: mediastinoscopia (cervical estándar o extendida), mediastinotomía, o toracoscopia: • Por mediastinoscopia cervical estándar pueden explorarse y biopsiarse las adenopatías paratraqueales derechas e izquierdas, altas y bajas, así como las subcarinales anteriores. • La mediastinoscopia cervical extendida permite la exploración y biopsia de las adenopatías prevasculares y de la ventana aorto-pulmonar. • La mediastinotomía paraesternal también permite la exploración y biopsia de las adenopatías prevasculares y de la ventana aorto-pulmonar. • Con la toracoscopia pueden explorarse y biopsiarse las adenopatías paraesofágicas y del ligamento pulmonar. Estadio TNM IA T1N0M0 IB T2N0M0 IIA T1N1M0 IIB IIIA IIIB IV T2N1M0 T3N0M0 T3N1M0 T1-3N2M0 T4N0-3M0 T1-4N3M0 T1-4N1-3M1 Tratamiento (Supervivencia 5 a.) Cirugía (67% SG) Cirugía (+ tratam adyuvante1) IB (57% SG) IIA (55% SG) IIB (39% SG). Tr. Neoadyuvante + cirugía (selección) QT+RT en N2 irresecables (23-25% SG) QT + RT (cirugía excepcionalmente) IIIB (3-7% SG) IV (1% SG) 1.- Los últimos estudios realizados de quimioterapia adyuvante ofrecen un significativo impacto en la supervivencia desde el estadio IB hasta IIIA con N2 mínima, lo que hace que deba ser considerada como un tratamiento de elección. Pacientes estadiados quirúrgicamente: 10% son estadío I, 20% E II, 15% E IIIA, 15% IIIB y 40% IV. Cirugía de resección pulmonar La cirugía de resección se realizará en función de las características del tumor. Se tendrán en cuenta los siguientes criterios: • El tumor y las adenopatías deben resecarse completamente, siempre que sea posible, generalmente por resección anatómica (lobectomía o neumonectomía). • Tratar de no transgredir el tumor, para evitar la diseminación de células tumorales. • La resección de las estructuras adyacentes infiltradas se efectuará “en bloque” con el tumor, siempre que sea posible. • Si existen dudas sobre la infiltración de los bordes de resección se efectuará examen anatomopatológico intraoperatorio y re-excisión si están infiltrados y es técnicamente factible. • Todas las estaciones ganglionares mediastínicas deben ser biopsiadas o, preferiblemente, resecadas. 102 Curso sobre avances y actualización en Bio-Radioterapia CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 103 TRATAMIENTO MULTIMODAL: A) Estadios I, II y IIIA (T3 N1) 1) La cirugía es el tratamiento de elección. 2) Tratamientos adyuvantes en función de los hallazgos anatomopatológicos: a) Radioterapia en pN2 y/o resección “incompleta” (R1, R2). Dosis alrededor de 50-65 Gy en función de la carga tumoral residual, sobre las zonas de riesgo: borde de resección afecto (clips quirúrgicos si los hubiera), mediastino en pN2. No está indicada en estadios I y II completamente resecados (PORT meta-análisis). Se suele indicar tras resecciones incompletas o en estadios IIIA (N2). Aunque no existen ensayos aleatorizados, otro tipo de estudios indican que disminuye la recidiva local, sin demostrarse impacto en la supervivencia. Existe alguna evidencia de mejoría en la supervivencia con hiperfraccionamiento, a costa de mayor toxicidad aguda, coste y problemas logísticos (Meta-análisis de Stuchke de 1997 con 3 ensayos aleatorizados, ensayo aleatorizado del CHART (Saunders, 1999). No hay evidencia científica de la utilidad de una irradiación nodal electiva (Senan, 2002; Emami, 2003). b) Quimioterapia en estadios Ib y II y IIIA completamente resecados: 4 ciclos con cisplatino/ vinorelbina o paclitaxel/carboplatino. 3) La radioterapia radical es la alternativa terapéutica a la cirugía en caso de contraindicación o negativa del paciente, si cumple estos criterios: a) Ausencia de pérdida ponderal superior al 10% no achacable a otras causas. b) Ausencia de infección pulmonar incontrolada. c) Buen estado general: escala funcional de Karnofsky > 70%. d) Adecuada reserva funcional respiratoria, en relación a los volúmenes de irradiación. e) Dosis por encima de 60 Gy en fraccionamiento convencional o sus equivalentes radiobiológicos, sobre el tumor y las adenopatías afectas (diámetro corto superior a 10 mm en TC y/o PET +). 4) La quimioterapia no está indicada fuera de su uso como terapia adyuvante. En otras situaciones debe considerarse experimental y reservarse para ensayos clínicos. 5) La radioterapia preoperatoria no está indicada. 6) Tratamientos paliativos si se precisan: en caso de contraindicación o negativa del paciente a lo anterior Sesión 4 103 CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 104 B) Estadio IIIA (N2) potencialmente resecable No existe en el momento actual una recomendación clara basada en pruebas científicas para estos casos, debe individualizarse la decisión en función de las condiciones médicas y preferencias del paciente, teniendo las siguientes alternativas terapéuticas: 1) Quimioterapia neoadyuvante (3 ciclos con un esquema basado en platino) seguida de tratamiento quirúrgico y posterior valoración de posibles tratamientos adyuvantes según los criterios previamente descritos. Siempre previa confirmación histológica (mediastinoscopia) de la afectación ganglionar. En los dos únicos estudios que la avalan (Rosell 1994-1999, Roth 1994-1998) se realizaron mediastinoscopias sistemáticas con ganglios mediastínicos mayores a 1 cm en la TC y todos los N2 estaban confirmados histológicamente. 2) Cirugía de inicio. Además, en los N2 resecables descubiertos en el curso de la intervención (IIIA2) se debe continuar con la cirugía de intención radical si es técnicamente posible. 3) Quimioterapia y radioterapia radical si se cumplen los criterios antes citados. 4) Tratamientos paliativos. 104 Curso sobre avances y actualización en Bio-Radioterapia CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 105 C) Estadio IIIA irresecable (IIIA4) y IIIB 1) Quimioterapia y radioterapia radical , si se cumplen los criterios previos y en ausencia de derrame pleuro-pericárdico maligno o afectación supraclavicular, excepto si es en contigüidad a un tumor del sulcus superior, en cuyo caso no se contraindica una radioterapia radical. a) En pacientes con buen estado general, aceptables pruebas funcionales respiratorias y pérdida de peso < 5%, el tratamiento de elección será quimioterapia/radioterapia concomitante, con esquemas de quimioterapia basados en platino. b) En el resto de los pacientes se valorará tratamiento de quimioterapia (3 ciclos), seguido de radioterapia de forma secuencial. c) En pacientes no candidatos a tratamiento con quimioterapia, se valorará radioterapia radical como tratamiento único. 2) Tratamientos paliativos en caso contrario. 3) Excepcionalmente, en algunos estadios IIIB (T4 N0-1 M0) se podría valorar cirugía. D) Estadio IV 1) Quimioterapia: a) El tratamiento de elección consistirá en 4 a 6 ciclos y posterior re-evaluación. La quimioterapia en pacientes con buen estado general consistirá en una combinación de 2 agentes citostáticos. La quimioterapia de primera línea en pacientes con CPNM avanzado debe ser un régimen de combinación de dos fármacos basado en platino. Los regímenes de quimioterapia sin platino podrían usarse como alternativa a los regímenes basados en platino. b) Si hay progresión radiológica, se valorará tratamiento de segunda línea. 2) Se valorará cirugía de una metástasis única y accesible, siempre que el tumor primario esté controlado o pueda efectuarse un tratamiento quirúrgico (T1-3 N0-1) y la metástasis sea cerebral, suprarrenal o pulmonar. 3) Tratamientos paliativos. E) Radioterapia paliativa Si el paciente no es tributario de un tratamiento radical, tiene síntomas paliables y una esperanza de vida superior a 6 semanas. 1) Fraccionamientos cortos (10 Gy/1 fracción, 16-17 Gy/2 fracciones/7 días) se han demostrado tan eficaces, incluso más rápidos en la respuesta sintomática, que otros más prolongados. En pacientes con mejor situación funcional, dosis mayores parecen aportar un modesto incremento de la supervivencia, si bien a costa de una mayor toxicidad. Los volúmenes de irradiación deben acomodarse al crecimiento tumoral responsable del síntoma a paliar. 2) La braquiterapia, sola o en combinación con radioterapia externa u otras terapias endoscópicas (láser, crioterapia, electrocoagulación, terapia fotodinámica, etc.), puede jugar un papel importante para paliar síntomas derivados directamente del crecimiento tumoral endobronquial (hemoptisis, obstrucción). Sesión 4 105 CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 106 F) Situaciones especiales Síndrome de Compresión de Vena Cava Superior 1) Nada más conocerse el diagnóstico se debe remitir al paciente a radioterapia con carácter de urgencia, para poder iniciar el tratamiento antes de las siguientes 24 h. Desde el momento del diagnóstico clínico deben indicarse corticoides a dosis altas. 2) No existe un nivel de dosis de irradiación recomendado. Se suelen emplear fraccionamientos del tipo de 30 Gy/10 fracciones/12 días, 20 Gy/5 fracciones/5 días. 3) Con posterioridad, dependiendo de la evolución y extensión de la enfermedad, se valorarán otros tratamientos: quimioterapia, stent venoso, fibrinolíticos, etc. Metástasis cerebral de CP de inicio clínico 1) Valoración por neurocirujano para su resección, si la lesión es única (por RM), no hay otras metástasis, tiene un buen estado funcional (Karnofsky > 70%) y el primario es potencialmente resecable (T13 N0-1) y operable. 2) Si no es posible o conlleva un alto riesgo, remitir a Radioterapia para tratamiento con radioterapia externa o, dependiendo del tamaño, radiocirugía. 3) Posteriormente se valorarán otros tratamientos (radioterapia holocraneal, cirugía del primario, quimioterapia, radioterapia torácica, etc.) PROTOCOLO DE TRATAMIENTO CA. MICROCITICO Definición de enfermedad Limitada (EL) y Extendida (EE) (Criterios NCI): 1) Enfermedad limitada es todo tumor confinado a un hemitórax, ganglios linfáticos regionales (hiliares y mediastínicos) que puede ser incluido razonablemente en un campo de radioterapia: se incluye ganglios mediastínicos contralaterales y la ganglionar supraclavicular. Si existe derrame pleural, la citología debe de ser negativa. (Equivalente a I – IIIb). 2) Enfermedad extendida es toda aquella no comprendida en estos límites. (Estadio IV) Existe una subdivisión a efectos prácticos en 3 estadios de diferente pronóstico Estadio EL Estadio TNM LDH Edad (PS ³ 70 %) Supervivencia a 5 años A I – IIIA (N0) Normal < 70 años 49 % B IIIA (N+) - IIIB Normal < 70 años 20 % C IIIA - B Elevada > 70 años 1% Definición: Estadio A: Baja carga tumoral Estadio B: Localmente avanzado Estadio C: Factores de mal pronóstico 106 Curso sobre avances y actualización en Bio-Radioterapia CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 107 A) Enfermedad limitada al tórax del VALG12 1) Cirugía en algún caso muy seleccionado (T1-2 N0 M0) y siempre tras un minucioso estudio de extensión y con criterios de operabilidad y buen estado funcional (Karnofsky > 70%). 2) Quimioterapia: cisplatino y etopósido (4 ciclos). 3) Radioterapia torácica: concurrente, o bien secuencial tras una buena respuesta a la quimioterapia. Dosis habitualmente recomendadas de 45-50 Gy en fraccionamiento convencional sobre el tumor clínico (primario + adenopatías) aunque la tendencia actual es hacia dosis radiobiológicamente equivalentes más elevadas. 4) La tendencia, a la luz de los ensayos clínicos disponibles13, es a iniciar de forma simultánea un tratamiento quimio y radioterápico hiperfraccionado. 5) Radioterapia craneal profiláctica si se obtiene una remisión clínica completa en tórax por estudios de imagen. Dosis en torno a 30 Gy (24-36 Gy) con fracciones de 2-3 Gy (5 días a la semana) sobre el contenido neuro-meníngeo central completo (conformación individualizada “en casco”). 6) Tratamientos paliativos. B) Enfermedad extendida 1) Quimioterapia: esquema cisplatino/carboplatino y etopósido (cada 3 semanas). Valorar la duración del tratamiento en función de la respuesta al mismo, cada 3 ciclos de tratamiento. 2) Tratamientos paliativos. C) Situaciones especiales Síndrome de Compresión de Vena Cava Superior 1) El paciente debe remitirse a Oncología Médica de forma inmediata para poder iniciar un tratamiento sistémico antes de las siguientes 24-48 h. Desde el diagnóstico clínico se deben indicar dosis altas de corticoides. 2) En los casos en que no sea posible una quimioterapia, el paciente rechace dicho tratamiento, o bien no haya respuesta clínica, debe remitirse a Radioterapia con carácter de urgencia. 3) Si se objetiva una buena respuesta a la quimioterapia y existe indicación para ello, debe considerarse una radioterapia torácica programada. Metástasis cerebral de CP de inicio clínico – Valoración por Oncología Médica para tratamiento con quimioterapia, como cualquier enfermedad extendida. – Si no hay respuesta neurológica sintomática a la quimioterapia, se debe valorar una radioterapia craneal paliativa. Sesión 4 107 CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 108 Bibliografía: 1 LA SITUACIÓN DEL CÁNCER EN ESPAÑA. Área de Epidemiología Ambiental y Cáncer. Centro Nacional de Epidemiología. Instituto de Salud Carlos III © MINISTERIO DE SANIDAD Y CONSUMO. CENTRO DE PUBLICACIONES. ISBN: 84-7670-673-1- 2005 2 Erick Hansen. Mark RoachIII. Handbook of evidence-based radiation oncology. Cap. 13 y 14 pag 153173. Springer. 2007. 3 Macbeth F, Abratt R Cho K et al. Lung cancer management in limited resource settings: guidelines for appropriate good care. RadiaT Oncol . 82 : 123-131. 2007. 4 Proceso asistencial integrado cáncer de pulmón. Consejería de Salud. Junta de Andalucía. 2007. 5 Protocolo cáncer de pulmón del H. C Haya. Resto de referencias en texto o en las diapositivas. 108 Curso sobre avances y actualización en Bio-Radioterapia CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 109 CÁNCER DE MAMA: Dr. Enrique Alonso Hospital Universitario Puerta del Mar, Cadiz CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 110 CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 111 CÁNCER DE MAMA: Dr. Enrique Alonso Hospital Universitario Puerta del Mar, Cadiz l cáncer de mama es el tumor más frecuente en las mujeres occidentales, estimándose que en los países de la Unión Europea, la probabilidad de desarrollar un cáncer de mama antes de los 75 años es del 8%. En España, la tasa de incidencia ajustada por edad en 1998 era de 67 por 100.000, la menor de la UE y, al igual que en otros países occidentales, ha sufrido un considerable aumento, más marcado entre las décadas del 70 al 90. Sin embargo la mortalidad por cáncer de mama en España comienza a descender en el año 1992, a un ritmo del 2% anual, lo que ha provocado un aumento de la supervivencia que se sitúa por encima del 75% a los cinco años del diagnóstico. E Se acepta que esta disminución es debida a la interrelación de los programas de cribado poblacional y a las mejoras obtenidas en el tratamiento. Pero, debido a que el periodo temporal en el que se describe la disminución de la mortalidad coincide en el tiempo con el desarrollo de ambos factores, es difícil definir que proporción le corresponde a cada uno de ellos, aunque un estudio del Nacional Cancer Institute atribuye a los programas de cribado poblacional un porcentaje en la mejora que oscila entre el 28 y 65% (con una media del 46%), siendo el resto responsabilidad de las mejoras obtenidas en el tratamiento. En lo que al tratamiento con radioterapia se refiere la documentación clínica nos ofrece: – Pruebas concluyentes de una importante reducción en las recidivas loco-regionales cuando tras la mastectomía radical modificada se administra radioterapia en pared costal y cadenas ganglionares. – Pruebas concluyentes de que la radioterapia tras mastectomía radical modificada aumenta la supervivencia libre de enfermedad. – Pruebas contradictorias sobre el efecto de la radioterapia tras mastectomía radical modificada en la supervivencia global. – Pruebas concluyentes de que la supervivencia cáncer específica aumenta con la administración de radioterapia tras la mastectomía radical modificada. – Pruebas concluyentes de que la supervivencia cáncer no específica disminuye con la administración de radioterapia tras la mastectomía radical modificada. – Alguna prueba de que la supervivencia global aumenta tras la administración de un tratamiento radioterápico técnicamente correcto. – Pruebas concluyentes de que en pacientes con ganglios positivos, la radioterapia, con la cirugía y el tratamiento sistémico, disminuye la recidiva local y aumenta la supervivencia. – Pruebas contradictorias de que el tratamiento conservador mas radioterapia es comparable a la mastectomía radical modificada en términos de recidiva local. – Pruebas concluyentes de que el tratamiento conservador mas radioterapia es comparable a la mastectomía radical modificada, en términos de supervivencia libre de enfermedad y supervivencia global – Pruebas concluyentes de que el tratamiento radioterápico tras cirugía conservadora produce una reducción en las recidivas homolaterales y por tanto en la realización de mastectomías de rescate. Sesión 4 111 CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 112 – Pruebas concluyentes de que la no realización de radioterapia tras la cirugía conservadora no tiene influencia en la supervivencia global. – Pruebas concluyentes de que la radioterapia aumenta la mortalidad por toxicidad tardía, sobre todo cardiaca y pulmonar. – Pruebas insuficientes para definir la cronología mas adecuada en la integración del tratamiento sistémico y la radioterapia postoperatoria A pesar de las pruebas concluyentes comentadas sobre la eficacia de la cirugía conservadora seguida de radioterapia, con el valor añadido sobre la mastectomía de evitar los trastornos psicológicos asociados a la amputación de la mama, persiste una amplia variabilidad en la practica clínica que consigue que, en nuestro medio, el porcentaje de cirugía conservadora realizada a las pacientes diagnosticadas de cáncer de mama, oscile entre el 24 y 98 %. Aunque generalmente se aducen motivos como la comorbilidad o el deseo de la paciente, las pruebas nos muestran que los factores que predicen el uso de la cirugía conservdora son tanto sociales (localización, tamaño y tipo de financiación del Hospital donde se interviene la paciente), como clínicos (edad menor de 70 años, T1 y ausencia de componente intraductal extenso). Teniendo en cuenta por un lado, que la mayoría de los motivos descritos no coinciden con las conclusiones de los consensos, y por otro, que no existe publicado en la literatura en lengua castellana ninguna herramienta para la ayuda en la toma de decisiones que permita ayudar a las pacientes en la toma de decisiones sobre su propio tratamiento, resulta evidente que aún tenemos mucho que mejorar en el tratamiento de las mujeres con cáncer de mama. Bibliografía 1. La situación del cáncer en España. Centro Nacional de Epidemiología Instituto de Salud Carlos III. Ministerio de Sanidad y Consumo. 2005. 2. Effect of Screening and Adjuvant Therapy on Mortality from Breast Cancer. Donald A Berry et al. The New England Journal of Medicine; 353, (17): pg. 1784. 2005. 3. Factors Predicting the Use of Breast-Conserving Therapy in Stage I and II Breast Carcinoma. Monica Morrow and cols: J Clin Oncol; 19:2254-2262. 2001. 4. Randomized Trials of Breast-Conserving Therapy Versus Mastectomy for Primary Breast Cancer. A Pooled Analysis of Updated Results. Ismail Jato et al. American Journal of Clinical Oncology; 28 (3): 289. 2005. 5. Recurrence rates after treatment of breast cancer with standard radiotherapy with or without additional radiation. Harry Bartelink el al. The New England Journal of Medicine; 345 (19): 1378. 2001. 6. A Systematic Overview of Radiation Therapy Effects in Breast Cancer. Lars Erik Rutqvistet al. Acta Oncologica; 42(5/6): 532-545. 2003. 8. Effects of radiotherapy and of differences in the extent of surgery for early breast cancer on local recurrence and 15-year survival: an overview of the randomised trials. Early Breast Cancer Trialists’ Collaborative Group (EBCTCG). Lancet; 366: 2087–2106. 2005. 9. Study of Failure Pattern Among High-Risk Breast Cancer Patients With or Without Postmastectomy Radiotherapy in Addition to Adjuvant Systemic Therapy: Long-Term Results From the Danish Breast Cancer Cooperative Group DBCG 82 b and c Randomized Studies. Hanne M. Nielsen el al. J Clin Oncol; 24:2268-2275. 2006. 112 Curso sobre avances y actualización en Bio-Radioterapia CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 113 RADIOBIOLOGÍA Y RADIOTERAPIA BASADA EN LA EVIDENCIA MODELOS CLÍNICOS: CÁNCER ESÓFAGO-GÁSTRICO Dr. Luis A. Pérez Romasanta Jefe de Servicio de Oncología Radioterápica Hospital General de Ciudad Real, Ciudad Real CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 114 CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 115 Radiobiología y Radioterapia basada en la evidencia Modelos clínicos: Cáncer esófago-gástrico Dr. Luis A. Pérez Romasanta Dra. Marta Marcos Oset, Dr. Miguel Sanz Martín Oncología Radioterápica Hospital General de Ciudad Real, Ciudad Real or incidencia y mortalidad, el cáncer gástrico ocupa el cuarto lugar en el ranking de nuestro país. El cáncer de esófago ocupa el decimocuarto puesto en incidencia. La mortalidad por ambos tumores es elevada, con supervivencias a cinco años entre el 10-30%. Los resultados de los tratamientos actuales son por tanto subóptimos. P Una de las estrategias de tratamiento en el cáncer de esófago es la asociación concomitante de quimio-radioterapia. El estudio más ilustrativo de este tipo lo consitutuyó el protocolo RTOG 85-01 que comparó la radioterapia a dosis altas (64 Gy) frente a RT con dosis moderadas (50 Gy) y quimioterapia concomitante y adyuvante. Se observó un beneficio estadísticamente significativo en la supervivencia media y actuarial a 5 años y en el control local a favor de los pacientes asignados al grupo experimental. Este estudio demostró la eficacia de la opción terapéutica de tratamiento combinado no-quirúrgico alcanzando los mismos niveles de supervivencia que el tratamiento quirúrgico. Sin embargo, el estudio también puso de manifiesto que la recurrencia local continuaba siendo el principal problema de los pacientes con cáncer de esófago no-metastásico. Disponemos de los medios técnicos para realizar escalada de dosis de radiación sobre el tumor primario, pero la relación entre la dosis de radiación y el control tumoral no ha sido demostrada en subsiguientes estudios clínicos de tratamiento combinado (INT 0123). Revisaremos los resultados de estos estudios y sus limitaciones para evaluar la relación dosis-respuesta. En la estrategia de tratamiento del cáncer de estómago se explota la cooperación espacial entre las diversas modalidades terapéuticas. La adecuación espacial de la radioterapia condiciona por tanto los resultados del tratamiento, tanto en términos de control tumoral como de toxicidad. Revisaremos los criterios de definición de volúmenes de tratamiento tradicionales adaptándolos a las técnicas tridimensionales vigentes actualmente. Asimismo, presentaremos datos preliminares de los procedimientos de radioterapia 4D implantados en nuestro centro para la planificación de radioterapia en pacientes con tumores asentados en la porción superior del abdomen. Bibliografía 1. Estrategia en cáncer del sistema nacional de Salud. Ministerio de Sanidad y Consumo 2006. 2. Cooper JS, Guo MD, Herskovic A, et al. Chemoradiotherapy of locally advanced esophageal cancer: long-term follow-up of a prospective randomized trial (RTOG 85-01). Radiation Therapy Oncology Group. JAMA. 1999;281:1623-7. 3. Minsky B, Pajak T, Ginsberg R, et al.: INT 0123 (RTOG 94-05) Phase III trial of combined-modality therapy for esophageal cancer : High-dose versus standard-dose radiation therapy. J Clin Oncol 2002;20:1167-1174. 4. Gastric Surgical Adjuvant Radiotherapy Consensus Report. Rational and clinical implementation. Int J Radiat Oncol Biol Phys 2002; 52:283-293. 5. Keall P. 4-Dimensional Computed Tomography Imaging and Treatment Planning. Sem Radiat Oncology 2004;14:81-90. Sesión 4 115 CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 116 CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 117 METÁSTASIS OSEAS: RADIOTERAPIA BASADA EN LA EVIDENCIA MODELOS CLÍNICOS Amalia Palacios Jefe del Servicio de Oncología Radioterápica Hospital Reina Sofía, Córdoba CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 118 CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 119 Metástasis oseas: radioterapia basada en la evidencia modelos clínicos Dra. Amalia Palacios Servicio de Oncología Radioterápica Hospital Reina Sofía, Córdoba a radioterapia es una modalidad terapéutica efectiva en el tratamiento paliativo del dolor secundario a metástasis óseas [1]. Las metástasis óseas son una aparición frecuente en la progresión de múltiples procesos oncológicos, especialmente del cáncer de pulmón, mama y próstata. La evolución de los tratamientos sistémicos y la mejora en los cuidados de soporte ha aumentado la expectativa de vida de estos pacientes, que pueden vivir largos periodos de tiempo con metástasis óseas. Esta evolución oncológica puede comprometer la movilidad y el estado funcional de los pacientes que la sufren. L El esquema optimo de irradiación continua siendo un tema de debate. En los últimos años varios han sido los estudios comparando esquemas de fracción única (habitualmente 8 Gy) con regimenes multifraccionados (5 – 10 fracciones) Tabla 1 [2-7]. Estos estudios generaron la realización de 3 metaanálisis [1, 8-10], que en su conjunto corresponden a 20 ensayos randomizados e incluyen 5500 pacientes valorables, realizados entre 1982 – 2002. Y cuyas conclusiones, muy coincidentes entre ellos, podemos resumirlas como: – La Radioterapia es claramente efectiva en la reducción del dolor por metástasis óseas. – No existen diferencias en la eficacia analgésica entre los regimenes de fracción única (FU) y los esquemas multifraccionados (MF). – Las tasas de re-tratamiento efectuadas y las de fracturas patológicas son superiores tras esquemas de fracción única. – No se ha detectado relación dosis – respuesta. – Se requieren datos adicionales para evaluar el papel de las reirradiaciones y el impacto de la radioterapia en la calidad de vida. La magnitud de la eficacia analgésica de la radioterapia queda reflejada en el análisis comparativo de los 2 metanalisis publicados en 2003 [11] (tabla 2). Es evidente la efectividad de la radioterapia externa en la reducción del dolor: aproximadamente el 60% de los pacientes responden a la radioterapia y un tercio consigue respuesta completa independientemente de si ha sido tratado con una FU o un esquema MF en análisis por intención de tratar [9, 10]. Estas tasas se incrementan alrededor de un 10% si el análisis estadístico se limita exclusivamente a los pacientes evaluables [10]. No hay una firme evidencia de que los esquemas fraccionados prevengan la aparición de fracturas patológicas dado que ningún estudio ha valorado este riesgo previo al tratamiento. Aunque la tasa de fracturas patológicas es significativamente superior tras FU, la diferencia absoluta es baja, del orden del 2% [6]. Han sido múltiples las críticas metodologicas sobre estos ensayos randomizados, fundamentalmente por la ausencia de criterios estándar a la hora de cuantificar el dolor y su cronología, las indicación y evaluación de las reirradiaciones, y la metodología estadística del análisis. Ello conllevó la realización de un consenso internacional para establecer la metodología a seguir en los futuros ensayos sobre metástasis óseas [12]. Dos grandes ensayos han sido publicados tras los metanalisis de 2003, y ambos efectúan un estudio comparativo entre los esquemas de 8 Gy en FU y 30 Gy administrados en 10 fracciones: el RTOG 97-14 [13] y un estudio multicéntrico noruego – sueco [14]. Los resultados obtenidos son muy Sesión 4 119 CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 120 similares entre ellos, y reproducen las conclusiones de ensayos previos, aportando como nuevo la evidencia de que la respuesta analgésica es mantenida como mínimo 28 semanas (fin del seguimiento), el similar consumo de analgésicos opioides y no opioides en ambos brazos y un consumo constante de estos en el periodo de observación. Entre sus conclusiones destaca el considerar estándar la administración de 8 Gy en FU como tratamiento analgésico ante metástasis óseas no complicadas [14]. En abril de 2007 se ha publicado una nueva revisión sistemática con meta-análisis asociado que ha actualizado los datos de análisis previos sobre los ensayos randomizados que comparan FU versus esquemas MF [15, 16], (tabla 3), y de nuevo no aparecen diferencias significativas sobre la eficacia analgésica de ambos brazos tanto para el total de respuestas obtenidas como para respuestas completas, y tanto en análisis con intención de tratar como sobre pacientes valorables. Igualmente se repite el hallazgo de una significativa y alta tasa de retratamientos en el grupo de fracción única (p=0.002). Existe por lo tanto una evidencia abrumante sobre que 8 Gy es un esquema adecuado y optimo para el tratamiento del dolor por metástasis óseas no complicadas. A pesar de esta evidencia, el análisis de la practica diaria refleja que el esquema mas utilizado en EEUU es el de 30 Gy/10 fracciones, 20 Gy/5 en Canadá y 8Gy/1 en Gran Bretaña y ciertos países europeos [17-20]. Hay una cierta resistencia para adoptar 8Gy como practica estándar aún a pesar de su eficacia demostrada [9, 10, 15], conveniencia del paciente [21] y coste efectividad [22]. Las renuencias de los clínicos a implantar esquemas de sesión clínica pueden estar asociadas a las tasas de retratamiento detectadas (2,45 veces superior con FU) y cierta evidencia de que ciertos subgrupos de pacientes, pueden beneficiarse de esquemas fraccionados [15]. Disponemos de un ensayo randomizado comparando 8 Gy en FU con 20 Gy en 5 fracciones en pacientes con un componente de dolor neuropatico secundario a metástasis óseas [23]. Se aprecia con el esquema de 30 Gy una mayor probabilidad de respuesta (61% vs 53% p=0.18), y mayor mediana de tiempo hasta el fracaso del tratamiento (3,7 vs 2,4 meses), aunque en ningún caso con significancia estadística. Los autores concluyen que 8 Gy no ha demostrado ser tan efectivo como 20 Gy en 5 fracciones, pero no es significativamente peor. Recomiendan el esquema fraccionado salvo en aquellos pacientes con mal estado general, bajo performance status y centros con lista de espera relevante [23]. La remineralizacion ósea tras la irradiación de metástasis osteoliticas puede ser cuantificada con tomografía axial computarizada. La mediana del porcentaje de cambio en la densidad ósea antes y a los 3 meses de la irradiación paliativa con los esquemas de 8Gy, 20Gy/5, 30Gy/10 fueron: 128 (98255), 141 (79-342), y 145 (65-235), respectivamente en un subgrupo de pacientes con cáncer de mama [24], y deben contemplarse los esquemas fraccionados cuando el objetivo sea la remineralizacion y estabilización ósea y no exclusivamente la analgesia [25]. Estos objetivos suelen plantearse ante pacientes con buen pronóstico y expectativas de larga supervivencia. Ante situaciones con importantes masas de tejidos blandos alrededor de las lesiones óseas, el objetivo paliativo, además de la analgesia puede ser la reducción de la masa tumoral, y los clínicos tienen tendencia a utilizar dosis fraccionadas. No hay datos para hacer recomendaciones clínicas basadas en la evidencia en estas situaciones [26]. Recomendaciones terapéuticas basadas en la evidencia [26]: Ante metástasis óseas no complicadas (fractura patológica, compresión medular), y cuando la intención del tratamiento es antiálgica se recomienda una fracción única de 8 Gy. No disponemos de suficiente evidencia en la actualidad para efectuar recomendaciones de esquemas multifraccionados ante otros objetivos paliativos que no sean la exclusiva analgesia: 120 Curso sobre avances y actualización en Bio-Radioterapia CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 121 – Pacientes con metástasis únicas y larga expectativa de vida. – Prevención y tratamiento de la compresión medular. – Prevención y tratamiento de fracturas patológicas. – Tratamiento de las masas de partes blandas asociadas a las lesiones óseas. Tabla 1. Estudios comparativos de dosis únicas y esquemas fraccionados. 10 Gy / 1 22,5 Gy / 5 Gaze 1997 8 Gy / 1 20 Gy / 4 Nielsen 1998 8 Gy / 1 20 Gy / 5 30 Gy / 10 Bone Pain Trial Working Party 1999 8 Gy / 1 24 Gy / 6 Dutch Bone Metastasis Study 1999 8 Gy / 1 30 Gy / 10 Hartsell 2005 8 Gy / 1 30 Gy / 10 Kaasa 2006 Tabla 2. Análisis comparativo de los meta-análisis publicados en 2003 Comparación Meta - Analisis Wu et al Sze et al Multi-fracción 58.7% 59% Fracción Unica 62.1% (p=0.04) 60% (p=0.7) Multi-fracción 32.3% 32% Fracción. Unica 33.4%(p=0.05) 34% (p=0.2) Tasa de respuesta (IT) Tasa de R. C. (IT) Tasa de respuesta (evaluables) Multi-fracción 72.5% Fracción Unica 72.7% (p=0.09) NS Tasa de R. C. (evaluables) Multi-fracción 40% Fraccion Unica 39.2% (p=0.06) NS Tabla 3 - fracción única versus esquemas multifracción: Meta-análisis 2007 [15, 16] FU MF OR p Tasa total de respuestas 57% 57% 1.00 0.93 Respuestas Completas 23% 24% 0.98 0.98 Fracturas patologicas Riesgo incrementado 0.75 Compresion medular Riesgo incrementado 0.15 Probabilidad de retratamiento 2.45 veces superior 0.00001 Sesión 4 121 CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 122 Bibliografia 1. McQuay, H.J., et al., Radiotherapy for the palliation of painful bone metastases. Cochrane Database Syst Rev, 2000(2): p. CD001793. 2. Price, P., et al., Prospective randomised trial of single and multifraction radiotherapy schedules in the treatment of painful bony metastases. Radiother Oncol, 1986. 6(4): p. 247-55. 3. Hoskin, P.J., et al., A prospective randomised trial of 4 Gy or 8 Gy single doses in the treatment of metastatic bone pain. Radiother Oncol, 1992. 23(2): p. 74-8. 4. Gaze, M.N., et al., Pain relief and quality of life following radiotherapy for bone metastases: a randomised trial of two fractionation schedules. Radiother Oncol, 1997. 45(2): p. 109-16. 5. Nielsen, O.S., et al., Randomized trial of single dose versus fractionated palliative radiotherapy of bone metastases. Radiother Oncol, 1998. 47(3): p. 233-40. 6. Steenland, E., et al., The effect of a single fraction compared to multiple fractions on painful bone metastases: a global analysis of the Dutch Bone Metastasis Study. Radiother Oncol, 1999. 52(2): p. 101-9. 7. 8 Gy single fraction radiotherapy for the treatment of metastatic skeletal pain: randomised comparison with a multifraction schedule over 12 months of patient follow-up. Bone Pain Trial Working Party. Radiother Oncol, 1999. 52(2): p. 111-21. 8. McQuay, H.J., D. Carroll, and R.A. Moore, Radiotherapy for painful bone metastases: a systematic review. Clin Oncol (R Coll Radiol), 1997. 9(3): p. 150-4. 9. Sze, W.M., et al., Palliation of metastatic bone pain: single fraction versus multifraction radiotherapy—a systematic review of randomised trials. Clin Oncol (R Coll Radiol), 2003. 15(6): p. 345-52. 10. Wu, J.S., et al., Meta-analysis of dose-fractionation radiotherapy trials for the palliation of painful bone metastases. Int J Radiat Oncol Biol Phys, 2003. 55(3): p. 594-605. 11. Roos, D.E. and R.J. Fisher, Radiotherapy for painful bone metastases: an overview of the overviews. Clin Oncol (R Coll Radiol), 2003. 15(6): p. 342-4. 12. Chow, E., et al., International consensus on palliative radiotherapy endpoints for future clinical trials in bone metastases. Radiother Oncol, 2002. 64(3): p. 275-80. 13. Hartsell, W.F., et al., Randomized trial of short- versus long-course radiotherapy for palliation of painful bone metastases. J Natl Cancer Inst, 2005. 97(11): p. 798-804. 14. Kaasa, S., et al., Prospective randomised multicenter trial on single fraction radiotherapy (8 Gy x 1) versus multiple fractions (3 Gy x 10) in the treatment of painful bone metastases. Radiother Oncol, 2006. 79(3): p. 278-84. 15. Chow, E., et al., Palliative radiotherapy trials for bone metastases: a systematic review. J Clin Oncol, 2007. 25(11): p. 1423-36. 16. Chow, E., et al., Meta-analysis of Palliative Radiotherapy Trials for Bone Metastases. Clin Oncol (R Coll Radiol), 2007. 19(3): p. S26. 17. Chow, E., et al., Palliation of bone metastases: a survey of patterns of practice among Canadian radiation oncologists. Radiother Oncol, 2000. 56(3): p. 305-14. 18. Lievens, Y., et al., Differences in palliative radiotherapy for bone metastases within Western European countries. Radiother Oncol, 2000. 56(3): p. 297-303. 122 Curso sobre avances y actualización en Bio-Radioterapia CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 123 19. Roos, D.E., Continuing reluctance to use single fractions of radiotherapy for metastatic bone pain: an Australian and New Zealand practice survey and literature review. Radiother Oncol, 2000. 56(3): p. 315-22. 20. Gupta, T. and R. Sarin, Palliative radiation therapy for painful vertebral metastases: a practice survey. Cancer, 2004. 101(12): p. 2892-6. 21. Szumacher, E., et al., Treatment of bone metastases with palliative radiotherapy: patients’ treatment preferences. Int J Radiat Oncol Biol Phys, 2005. 61(5): p. 1473-81. 22. Agarawal, J.P., et al., The role of external beam radiotherapy in the management of bone metastases. Clin Oncol (R Coll Radiol), 2006. 18(10): p. 747-60. 23. Roos, D.E., et al., Randomized trial of 8 Gy in 1 versus 20 Gy in 5 fractions of radiotherapy for neuropathic pain due to bone metastases (Trans-Tasman Radiation Oncology Group, TROG 96.05). Radiother Oncol, 2005. 75(1): p. 54-63. 24. Chow, E., et al., Computed tomography (CT) evaluation of breast cancer patients with osteolytic bone metastases undergoing palliative radiotherapy–a feasibility study. Radiother Oncol, 2004. 70(3): p. 291-4. 25. Koswig, S. and V. Budach, [Remineralization and pain relief in bone metastases after after different radiotherapy fractions (10 times 3 Gy vs. 1 time 8 Gy). A prospective study]. Strahlenther Onkol, 1999. 175(10): p. 500-8. 26. Wu, J.S., et al., Radiotherapy fractionation for the palliation of uncomplicated painful bone metastases an evidence-based practice guideline. BMC Cancer, 2004. 4: p. 71. Sesión 4 123 CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 124 CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 125 METASTASIS CEREBRALES Dr. Victor M. Muñoz Garzón Responsable de la Unidad de Oncología Radioterápica Instituto Galego de Medicina Técnica Hospital do Meixoeiro, Vigo CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 126 CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 127 Metastasis cerebrales Dr. Victor M. Muñoz Garzón Unidad de Oncología Radioterápica Instituto Galego de Medicina Técnica Hospital do Meixoeiro, Vigo IMPACTO Las metástasis cerebrales son una causa mayor en la morbi- mortalidad del cáncer. 20-40% de los pacientes con cáncer desarrollarán metástasis al SNC. Las presentarán en pulmón (50-60%) , Mama (15%) , Melanoma (5-10%) y gastrointestinal (4-6%).(1-2).La sintomatología comprende uno o varios entre cefalea, mareo con o sin vértigo , nauseas , vómitos, visión borrosa o doble, y dificultad para caminar o manejar objetos. Los cambios de humor o de carácter también se pueden observar. Las crisis comiciales son menos frecuentes. En cualquier caso los síntomas están en relación con la localización (4). los factores pronósticos son: estado general, estado funcional, edad, otras metástasis, histología. ausencia de neoplasia primaria o una estabilización de larga evolución condicionan una mejor evolución. la neuroimagen puede ser un indicador indirecto de mejor evolución cuando se compara la respuesta a la radioterapia (13). La supervivencia sin tratamiento es unas cuantas semanas , con tratamiento 6 meses de media y con factores favorables y combinación de tratamientos mayor de 8 meses (5-12). BIOLOGÍA El proceso de las metástasis hematógenas al cerebro es dificultoso pero lo puede favorecer: sistema neovascular inmaduro, alta presión intersticial, proximidad de las células los vasos sanguíneos son factores que favorecen intravasación de la célula . Una vez en la circulación, las células están sujetas a fuerzas tales como turbulencias que puede destruirlas intravascular o durante la extravasación.(1)El cerebro es un órgano especial : ausencia de drenaje linfático, barrera hematoencefálica e intersticio con un ambiente rico en cloruros. Ello hace que ciertos clones sean más “afines” que otros por un efecto autodirigido por ejemplo con células oat cell de pulmón o de melanoma.El proceso de extravasación y anidamiento de las células tumorales viene determinado por múltiples procesos enzimáticos por ejemplo las metaloproteasas y las neurotrofinas capaces de degradar la matriz extracelular y la barrera hematoencefalica. (1-3) La biología molecular de las metástasis cerebrales ayuda a comprender los diferentes comportamientos. Así el pronóstico de metástasis histológicamente diferentes o al contrario dentro de una misma histología: diferente comportamiento. Este es el caso de la baja expresión del gen Nm23 en melanoma sugiere un alto potencial de metástasis cerebrales. Muchos otros genes están implicados en la capacidad y desarrollo de las metástasis cerebrales KAI1, PTEN/MMAC1,CD44 etc(1). RADIOBIOLOGÍA La radiobiologia clásica y dentro de ella el modelo lineal cuadrático es el único elemento que podemos usar para buscar la equivalencia entre los fraccionamientos sin embargo los resultados de los modelos radiobiológicos no se correlacionan adecuadamente con los resultados clínicos (7). Así pues varios factores deberemos analizar: Localización: áreas elocuentes son más sensibles a complicaciones graves y no se debe sobrepasar una dosis de 8-10Gy en 1 fracción (tronco cerebral etc.) y 56Gy en fraccionamiento habitual. Sesión 4 127 CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 128 OAR cercanos: La tolerancia de los pares craneales a la radiación ronda los 8 Gy –12 Gy sensibles vs resistentes en 1 sola fracción(9).A menos de 5-10 mm del nervio óptico deben tratarse con Radioterapia convencional fraccionada o bien RT estereotactica fraccionada(REF). Comportamiento a la irradiación: Se establecieron en las lesiones cerebrales en 4 categorías (Larson y col.1993) (6) siendo las metástasis categoría 4: Blanco de respuesta-precoz rodeado de tejido normal de respuesta tardía, como metástasis cerebrales o glioblastomas.Buena respuesta a radiocirugía monodosis aunque Parte del tratamiento debe ser fraccionado. Relación dosis-volumen: líneas de isoefecto de Kjellberg, línea de isoriesgo de Flickinger etc. Otras sobre los efectos dosis-volumen y riesgo de complicaciones, relacionados con la dosis-control tumoral ( Flickinger 1997). En los llevados a cabo por la RTOG en metástasis cerebrales previamente irradiadas (8). De aqui se deriva que dosis menores para mayor volumen para evitar complicaciones. Reirradiación: Precaución à aumenta hasta 50% radionecosis. No obstante RTOG 90-05 en pacientes con metástasis y tumores cerebrales malignos previamente irradiados que recibieron RDC, no encontraron relación entre toxicidad à dosis de RTH previas (8). TRATAMIENTO Sin tratamiento la supervivencia mediana de los pacientes sintomáticos con metástasis cerebrales es de unas cuantas semanas, mejora ligeramente con el tratamiento corticoideo llegando hasta 2 meses y con RTH la supervivencia mediana se sitúa entre los 3 y 6 meses.La RTOG estratifica en 3 clases pronósticas (15): clase i: lesión única, kf > 70%, edad < 65 años, tumor primario controlado y sin más metástasis sistémicas. clase ii: sin algún criterio de la clase i ;clase iii: paciente con karnofsky < 70 % .La estratificación dará la oportunidad de decidir entre los tratamientos disponibles o incluso no tratar. El tratamiento de las metástasis cerebrales incluye: Cirugía para diagnóstico o para una rápida resolución de los problemas clínicos derivados de la compresión o efecto de masa aunque el riesgo de recidiva es de hasta un 85%. La combinación de cirugía con RTH , mejor si joven con metástasis única y clase I. La RTH sola proporciona una mejoría neurológica en >50% de pacientes. La supervivencia mediana es de 3-6 meses. Con varios esquemas equivalentes 30 Gy en 10 fracciones , 40 Gy en 15-20 fracciones, 20 Gy en 5 fracciones.El fraccionamiento es preferible más bajo en pacientes de clase I y II .La RT Holocraneal además disminuye algo el riesgo de aparición de nuevas lesiones comparado con cirugía o Radiocirugía solas (ver en Evidencia). La RDC consigue un control local de hasta un 80-90%. Debe acompañarse de RT Holocraneal. Añadir RDC ó REF a la RTH aumenta el control local y la supervivencia (14). Entre las localizaciones peor para localización infratentorial. La supervivencia de ambas técnicas combinadas oscila de 8 a 12 meses y mayores en determinados casos seleccionados. La selección de pacientes debe incluir pacientes de pocas metástasis cerebrales (<4) de tamaños pequeños (<4cm). Recientemente se están introduciendo fármacos asociados a la irradiación holocraneal. 128 Curso sobre avances y actualización en Bio-Radioterapia CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 129 Con Temozolamida se ha publicado un ensayo Fase II español multicentrico que muestra su eficacia y tolerancia con supervivencia 54% a 3 meses con RT holocraneal sola y 72% asociada a TMZ (16). La biología molecular está dando sus frutos así por ejemplo se ha encontrado que el Efaproxiral asociado a la RT holocraneal mejora control y supervivencia especialmente en subgrupos de Ca de mama. (17) EVIDENCIA Metástasis solitaria(como único hallazgo tras meses de enfermedad neoplásica controlada) – Resección: sí para buen estado general, ninguna enfermedad extracraneal(ó mínima) , y una sola metástasis cerebral accesible de áreas no elocuentes. La RTH posterior reduce el riesgo de recaida (10 y 12). – Una revisión Cochrane (12) analiza la diferencia entre cirugía y radiocirugía con o sin RT holocraneal en NSCLC , no encontraron diferencias. Metástasis única (cuando hay más enfermedad neoplásica pero solo 1 MTS cerebral) – Una revisión sistemática identificó tres ensayos clínicos aleatorizados, 195 pacientes en total. Comparando resección quirúrgica más RT holocraneal con RT holocraneal sóla.No observan diferencias significativas en la supervivencia p = 0,35, aunque hubo un alto grado de heterogeneidad entre los ensayos. Un ensayo muestra que la cirugía y la RT holocraneal incrementan la duración de la supervivencia funcionalmente independiente (18). – Hay una ventaja en añadir radiocirugía a RT holocraneal vs Rt Holocraneal sola en estos pacientes encontrada en el metanalisis de May (2005) (20) (MTS única y en MTS solitaria) De las metastasis múltiples – De 1 a 4 MTS : Un ensayo randomizado multicéntrico comparando Radiocirugía sola o combinaga con RTH. 132 pacientes . No hubo diferencias significativas en cuanto a supervivencia rondando los 8 meses pero sí las hubo en cuanto a recaida cerebral 46,8% vs 76,4% RT+RDC vs RDC a 12 meses (p<0,01) , esto apoya el hecho de combinar ambas terapias para 1-4 MTS con < 3 cm. (19) – Múltiples : No hay diferencias en cuanto a supervivencia o control tumoral en los diferentes fraccionamientos de RTH (20). Tampoco el añadir RDC (20) – No hay suficientes evidencias en cuanto a Qt o radiosensibilizadores (20). – Otra revisión Cochrane 2007 sobre RTH en MTS múltiples encuentra:No beneficia la modificación de fraccionamiento de dosis en comparación con el fraccionamiento control (3 000 cGy en diez fracciones) de la RTH en la supervivencia a seis meses. Tampoco diferencias en el control de síntomas ni en mejoría neurológica entre los diferentes grupos de fraccionamiento. Tampoco se encontró beneficio al añadir radiosensibizadores a la RTH en la supervivencia general o en las tasas de respuesta. El radiosensibilizador motexafin gadolinio no mejoró la calidad de vida ni el tiempo de progresión neurológica general. Con el misonidazol tampoco hubo mejorías en los resultados.(21) Sesión 4 129 CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 130 “Profilaxis craneal en Ca de Pulmón” – SCLC (oat cell) – Revisión cochrane 2000: La RTH profiláctica en pacientes con RC aumenta la supervivencia 5,3% a 3 años(22). – Ensayo clínico (Cao 2005): la enfermedad cerebral apareció en 3,8% de los pacientes con profilaxis craneal vs 32% sin , en pacientes con Respuesta Completa y enfermedad limitada de manera significativa. También mejoró la supervivencia a 1,3 y 5 años en 12, 10 y 10% respectivamente aunque sin significación estadística (23) – NSCLC (no de células pequeñas): – Revisión cochrane 2005 : no hay pruebas suficientes “ofreced un ensayo clínico” para profilaxis craneal en pacientes en respuesta completa de NSCLC (24). Bibliografía 1. N Nathoo, A Chahlavi, G H Barnett and S A Toms ;Pathobiology of brain metastases . Journal of Clinical Pathology 2005;58:237-242 2. Fidler I.J.; Schackert G.; Zhang R-d.; Radinsky R.; Fujimaki T.; The Biology of Melanoma Brain Metastasis; Cancer and Metastasis Reviews, Volume 18, Number 3, September 1999, pp. 387-400(14) 3. MacDonald NJ, Steeg PS. Molecular basis of tumour metastasis. Cancer Surv 1993;16:175–99. 4. Levin VA, Leibel SA, Gutin PH: Neoplasms of the central nervous system. In: DeVita VT Jr, Hellman S, Rosenberg SA, eds.: Cancer: Principles and Practice of Oncology. 6th ed. Philadelphia, Pa: Lippincott Williams & Wilkins, 2001, pp 2100-60. 5. Rees,J Neurological oncology MEDICINE 32:10 2004 The Medicine Publishing Company 6. Larson DA, Flickinger JC, Loeffler JS: The radiobiology of radiosurgery. Int. J. Radiat Oncol Biol Phys 25: 557-561, 1993. 7. Kirkpatrick J P. Marks L B. M.D. Modeling killing and repopulation kinetics of subclinical cancer: direct calculations from clinical data ; International Journal of Radiation Oncology*Biology*Physics ;Volume 58, Issue 2, 1 February 2004, Pages 641-654 8. Shaw E, Scott C, Souhami L, et al: Single dose radiosurgical treatment of recurrent previously irradiated primary brain tumors and brain metastases: final report of RTOG protocol 90-05. Int. J. Radiation Oncology Biol. Phys. 47: 291-298, 2000. 9. Tishler RB, Loeffler JS, Lunsford LD et al: Tolerance of cranial nerves of the cavernous sinus to radiosurgery. Int. J. Radiat. Oncol. Biol. Phys. 30: 215-221, 1993. 10. D. Bafaloukosa,*, H. GogasThe treatment of brain metastases in melanoma patients ; CANCER TREATMENT REVIEWS (2004) 30, 515–520 11. Nazila Assasi, Melissa Brouwers, Manya Charette ,Nadia Coakley, Laurie Cocking, y cols . Management of brain metastases: role of radiotherapy alone or in combination with other treatment modalities.2004; http://www.guideline.gov/summary/summary.aspx?doc_ id=4983&nbr=003529&string=brain+AND+metastases 130 Curso sobre avances y actualización en Bio-Radioterapia CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 131 12. Bonfill X, Exposito J. Cirugía versus radiocirugía para pacientes con metástasis cerebral solitaria del cáncer de pulmón de células no-pequeñas (Revisión Cochrane traducida). En: La Biblioteca CochranePlus, 2007 Número 1. Oxford: Update Software Ltd. Disponible en: http://www.updatesoftware.com. (Traducida de The Cochrane Library, 2007 Issue 1. Chichester, UK: John Wiley & Sons, Ltd.) 13. Ericson K, Kihlstrom L, Mogard J, et al: Positron emission tomography using 18F-fluorodeoxyglucose in patients with stereotactically irradiated brain metastases. Stereotactic and Functional Neurosurgery 1996, S1:214-224. 14. Kondziolka D, Patel A, Lundsford LD, et al: Stereotactic radiotherapy plus whole brain radiotherapy vs radiotherapy alone for patients with multiple brain metastases. Int J Radiat Oncol Biol Phys 1999, 45:427-434. 15. Gaspar L, Scott C, Rotman M, et al: Recursive partitioning analysis of pronostic factors in three Radiation Therapy Oncology Group brain metastases trials. Int J Radiat Oncol Biol Phys 1997, 37:745751. 16. Eug`Enia Verger, M.D.,* Miguel Gil, M.D.,† Ricardo Yaya, M.D.,‡ N´Uria Vi ˜Nolas, M.D.,*Salvador Vill`A, M.D.,† Teresa Pujol, M.D.,* Llorenc¸ Quint´O, B.Sc.,* And Francesc Graus, M.D.*” Temozolomide And Concomitant Whole Brain Radiotherapy In Patients With Brain Metastases: A Phase Ii Randomized Trial” Int. J. Radiation Oncology Biol. Phys., Vol. 61, No. 1, pp. 185–191, 2005 17. Suh JH, Stea B, Nabid A, Kresl JJ, Fortin A, Mercier JP, Senzer N, Chang EL, Boyd AP, Cagnoni PJ, Shaw E Phase III study of efaproxiral as an adjunct to whole-brain radiation therapy for brain metastases J Clin Oncol. 2006 Jan 1;24(1):13-5. PMID: 16314614. 18. Hart MG, Grant R, Walker M, Dickinson H. Resección quirúrgica y radioterapia total del cerebro versus radioterapia total del cerebro solamente para las metástasis cerebrales (Revisión Cochrane traducida). En: La Biblioteca Cochrane Plus, 2007 Número 1. Oxford: Update Software Ltd. Disponible en: http://www.update-software.com. 19. Aoyama H, Shirato H, Tago M, Nakagawa K, Toyoda T, Hatano K, Kenjyo M, Oya N, Hirota S, Shioura H, Kunieda E, Inomata T, Hayakawa K, Katoh N, Kobashi ;Stereotactic radiosurgery plus whole-brain radiation therapy vs stereotactic radiosurgery alone for treatment of brain metastases: a randomized controlled trial. JAMA. 2006 Jun 7;295(21):2535-6 20. May N. Tsao a,b, Nancy S. Lloyd c,*, Rebecca K.S. Wong b,d,Eileen Rakovitch a, Edward Chow a, Normand Laperriere d,;the Supportive Care Guidelines Group of Cancer Care Ontario’s Program in Evidence-based Care; Radiotherapeutic management of brain metastases: A systematic review and meta-analysis; Cancer Treatment Reviews (2005) 31, 256–273 21. Tsao MN, Lloyd N, Wong R, Chow E, Rakovitch E, Laperriere N. Radioterapia total del cerebro para el tratamiento de las metástasis cerebrales múltiples (Revisión Cochrane traducida). En: La Biblioteca Cochrane Plus, 2007 Número 1. Oxford: Update Software Ltd. Disponible en: http://www.update-software.com. 22. The Prophylactic Cranial Irradiation Overview Collaborative Group. Irradiación craneal por prevenir metastases del cerebro de célula pequeña cáncer pulmonar en pacientes en remisión completa (Revisión Cochrane traducida). En: La Biblioteca Cochrane Plus, 2007 Número 1. Oxford: Update Software Ltd. Disponible en: http://www.update-software.com. (Traducida de The Cochrane Library, 2007 Issue 1. Chichester, UK: John Wiley & Sons, Ltd.). Sesión 4 131 CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 132 23. Cao KJ, Huang HY, Tu MC, Pan GY ; Long-term results of prophylactic cranial irradiation for limitedstage small-cell lung cancer in complete remission.; Chinese medical journal vol 118, I 15 ,2005 Aug pp1258-62 24. Lester JF, Coles B, Macbeth FR. Irradiación craneal profiláctica para la prevención de las metástasis cerebrales en pacientes que reciben tratamiento radical para el cáncer del pulmón de células no pequeñas (Revisión Cochrane traducida). En: La Biblioteca Cochrane Plus, 2007 Número 1. Oxford: Update Software Ltd. Disponible en: http://www.update-software.com. (Traducida de The Cochrane Library, 2007 Issue 1. Chichester, UK: John Wiley & Sons, Ltd.). 132 Curso sobre avances y actualización en Bio-Radioterapia CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 133 CURSO DE AVANCES Y ACTUALIZACIONES EN BIO-TERAPIA RE-IRRADIACIÓN Dr. Ignacio Azinovic Unidad de Radioterapia Plataforma de Oncología USP Hospital San Jaime, Torrevieja - Alicante CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 134 CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 135 Curso de Avances y Actualizaciones en Bio-terapia Re-irradiación Dr. Ignacio Azinovic Unidad de Radioterapia Plataforma de Oncología. USP Hospital San Jaime, Torrevieja - Alicante INTRODUCCIÓN. La reirradiación supone un proceso profundamente individualizado que gracias a avances recientes tanto de técnicas quirúrgicas como de radioterapia hacen más planteable como abordaje en situaciones de recidivas locoregionales. La primera opción ante la recidiva de un tumor tratado con radioterapia es la cirugía. Debido a la escasez de márgenes quirúrgicos en la mayoría de estas localizaciones, la escasa repuesta a agentes quimioterápicos convencionales, hacen que la re-irradiación forme parte ocasionalmente de un componente de abordaje de tratamiento multidisciplinar. En aquellas situaciones en la que la cirugía no es posible, el retratamiento está limitado por la dosis de irradiación previa, tiempo de intervalo entre tratamientos y cómo ésta afectará a los tejidos sanos circundantes (1). El conocimiento de la tolerancia de los tejidos normales a la radioterapia y la aparición de los histogramas dosis volumen permiten afinar en este tipo de abordajes (2). Se han descrito trabajos de re-irradiación sobre todo en tumores de la esfera orl, cerebrales (primarios como metastásicos), y tumores de localización pélvica. Tanto la braquiterapia como la radioterapia tridimensional conformada convencional como las técnicas de IMRT (radioterapia de intensidad modulada) permiten realizar re-tratamientos sobre volúmenes confinados. La braquiterapia (intracavitaria como intersticial) es una técnica preferible en este tipo de situaciones para poder limitar el volumen de tejido sano que reciba radioterapia. La integración de la radioterapia guiada por la imagen a su vez permite realizar estos tratamientos con una mayor probabilidad de éxito. Todas estas técnicas permiten una delimitación más precisa de nuestro volumen diana ahorrando tejido normal circundante que en la mayoría de los casos está previamente irradiado. Complementariamente a los avances técnicos de la radioterapia como son la cirugía con/sin injertos vascularizados, las técnicas de radioterapia intaoperatoria han permitidos ciertos rescates en tumores de la esfera orl y pélvicos. PATOLOGÍAS MÁS COMÚNMENTE TRATADAS. Tumores cerebrales. Las técnicas de irradiación en condiciones estereotáxicas han sido primordiales para la reirradiación en tejido cerebral, primero en dosis únicas y posteriormente empleando fraccionamientos. Poco se sabe sobre la capacidad de regeneración del tejido nervioso a un primer curso de radioterapia. Se establece que la tolerancia del sistema nervioso central (SNC) es de unos 50-60 Gy en fracciones de 2 Gy. Las modalidades más comúnmente empleadas en SNC: braquiterapia, radiocirugía, radioterapia estereotáxica fraccionada producen medianas de supervivencias entre 8 -25 meses administrando dosis suplementarias que oscilan entre 10 y 70 Gy según la técnica empleada (3). Otras estrategias para mejorar el índice terapéutico se realizan empleando braquiterapia infusional (Gliasite) mediante 125 I administrado intracavitariamente o directamente empleando técnicas de radioinmunoterapia o radioterapia intraoperatoria (4). Sesión 4 135 CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 136 Esfera ORL. La radioterapia externa junto con quimioterapia es la conducta más comúnmente empleada. Dosis acumulativas superiores a los 100 Gy producen importante morbilidad aunque hay autores que sitúan dicho límite en los 130 Gy . La tasa de supervivencia a 2 años oscila entre 15-37% después de administrar dosis de 40-75 Gy. En alguna de estas series la cirugía entra como parte del tratamiento inicial o como un posible rescate (1). Otras alternativas empleadas en este intraoperatoria. Las tasas de supervivencia un grupo más seleccionado de pacientes. relacionadas con el tratamiento como por tipo de situaciones incluyen la braquiterapia y la radioterapia son ligeramente superiores 20-55% a 2 años pero supone En todos ellos la toxicidad es sustancial tanto por causas otras causas (5). Tumores pélvicos. La reirradiación como tratamiento exclusivo produce una paliación de síntomas en más del 50% de los pacientes con una mediana de duración alrededor de los 7-17 meses con dosis cercanas a los 40-50 Gy (6-8). Los resultados mejoran sensiblemente cuando se combinan con un rescate quirúrgico con/sin radioterapia intraoperatoria donde se describen un 20 % de largos supervivientes y un 40 % de control local (6). Nuevas estrategias. La incorporación de la IMRT con/sin imagen guiada (IG-IMRT) puede mejorar los resultados obtenidos por su capacidad de excluir o reducir dosis a órganos dosis limitantes. Se ha demostrado que la IMRT puede reducir la dosis tanto de la vejiga como del intestino delgado en más de un 40 % (9). Esta técnica se puede perfilar como óptima en reirradiaciones pélvicas. Así mismo la IMRT ha supuesto un auge en el tratamiento de ciertas metástasis óseas describiendo resultados esperanzadores de paliación con escasos efectos adversos (10). Otros enfoques deberían ir orientados no sólo a mejorar la distribución de la dosis sino a delimitar mejor la zona de tratamiento. Con esta finalidad se emplea la fusión con PET/TAC, resonancia o Spect (11, 12). A pesar de todos estos avances y ante la imposibilidad de administrar dosis radicales en la gran mayoría de las situaciones hace obligado la combinación con agentes clásicos o nuevas dianas para poder administrar dosis biológicamente curativas (13). Conclusión. La reirradiación debe considerarse un planteamiento profundamente multidisciplinar. En la mayoría de los casos es un planteamiento paliativo y en aquellas ocasiones en que las dosis acumulativas son superiores a los 100 Gy los efectos secundarios pueden ser importantes. La asociación de nuevas técnicas de irradiación y/o dianas terapéuticas es crítica para un resultado más satisfactorio. La incorporación de nuevas tecnologías en los departamentos de radioterapia como la IMRT, IG-IMRT, fusión con PET, resonancia (con/sin espectroscopia) incrementará la experiencia en este tipo de circunstancias. Debido al incremento de trabajo que estas situaciones producen y la carga de trabajo en que las unidades de radioterapia están sometidas, el número de pacientes tratados con reirradiación no es muy numeroso y es importante que se generen grupos de trabajo o centros de referencia para tratar este tipo de situaciones tan complicadas. 136 Curso sobre avances y actualización en Bio-Radioterapia CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 137 Referencias 1. Kao J, Garofalo MC, Milano MT, Chmura SJ, Citron JR, Haraf DJ. Reirradiation of recurrent and second primary head and neck malignancies: a comprehensive review. Cancer Treat Rev 2003;29(1):21-30. 2. Nieder C, Milas L, Ang KK. Tissue tolerance to reirradiation. Semin Radiat Oncol 2000;10(3):200-9. 3. Veninga T, Langendijk HA, Slotman BJ, Rutten EH, van der Kogel AJ, Prick MJ, et al. Reirradiation of primary brain tumours: survival, clinical response and prognostic factors. Radiother Oncol 2001;59(2):127-37. 4. Gabayan AJ, Green SB, Sanan A, Jenrette J, Schultz C, Papagikos M, et al. GliaSite brachytherapy for treatment of recurrent malignant gliomas: a retrospective multi-institutional analysis. Neurosurgery 2006;58(4):701-9; discussion 701-9. 5. Martinez-Monge R, Alcalde J, Concejo C, Cambeiro M, Garran C. Perioperative high-dose-rate brachytherapy (PHDRB) in previously irradiated head and neck cancer: Initial results of a Phase I/II reirradiation study. Brachytherapy 2006;5(1):32-40. 6. Valentini V, Morganti AG, Gambacorta MA, Mohiuddin M, Doglietto GB, Coco C, et al. Preoperative hyperfractionated chemoradiation for locally recurrent rectal cancer in patients previously irradiated to the pelvis: A multicentric phase II study. Int J Radiat Oncol Biol Phys 2006;64(4):1129-39. 7. Mohiuddin M, Marks G, Marks J. Long-term results of reirradiation for patients with recurrent rectal carcinoma. Cancer 2002;95(5):1144-50. 8. Mohiuddin M, Marks GM, Lingareddy V, Marks J. Curative surgical resection following reirradiation for recurrent rectal cancer. Int J Radiat Oncol Biol Phys 1997;39(3):643-9. 9. Nutting CM, Convery DJ, Cosgrove VP, Rowbottom C, Padhani AR, Webb S, et al. Reduction of small and large bowel irradiation using an optimized intensity-modulated pelvic radiotherapy technique in patients with prostate cancer. Int J Radiat Oncol Biol Phys 2000;48(3):649-56. 10. Wright JL, Lovelock DM, Bilsky MH, Toner S, Zatcky J, Yamada Y. Clinical outcomes after reirradiation of paraspinal tumors. Am J Clin Oncol 2006;29(5):495-502. 11. Heron DE, Smith RP, Andrade RS. Advances in image-guided radiation therapy—the role of PETCT. Med Dosim 2006;31(1):3-11. 12. Dawson LA, Jaffray DA. Advances in image-guided radiation therapy. J Clin Oncol 2007;25(8):93846. 13. Bonner JA, Harari PM, Giralt J, Azarnia N, Shin DM, Cohen RB, et al. Radiotherapy plus cetuximab for squamous-cell carcinoma of the head and neck. N Engl J Med 2006;354(6):567-78. Sesión 4 137 CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 138 CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 139 Conclusiones RADIOBIOLOGÍA CLÍNICA ACTUALIZADA CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 140 CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 141 FUNDAMENTOS DE LA INVESTIGACIÓN TRANSLACIONAL APLICADA EN EL CAMPO DE LA RADIOTERAPIA Dr. Manuel de las Heras Jefe del Servicio de Oncología Radioterápica Hospital Clínico San Carlos, Madrid CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 142 CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 143 Fundamentos de la Investigación Translacional aplicada en el campo de la Radioterapia Dr. Manuel de las Heras Hospital Clínico San Carlos, Madrid l objetivo de los tratamientos en Oncología es eliminar el mayor número de células tumorales con una mínima toxicidad en las células sanas. Los tratamientos clásicos del cáncer como son: la cirugía, radioterapia y quimioterapia, son relativamente eficaces en el control de algunos tumores sólidos, pero al ser poco específicos actúan también contra las células benignas, produciendo efectos no deseables en los tejidos sanos. Estos efectos secundarios significan toxicidades a veces importantes en órganos y sistemas que van a limitar las dosis que podemos aplicar a los tumores, sino somos capaces de seleccionar mejor los pacientes y tumores a los que se aplican los tratamientos. La radioterapia tiene un papel fundamental en el tratamiento de los tumores malignos. Su efecto se debe al daño celular que desarrolla tanto en el ADN como en los tejidos mesenquimales y vasculares de alrededor. Clásicamente es conocido que este daño está mediado por la ionización del agua dentro de las células al producirse radicales libres (Se estima que 1 Gy produce 105 ionizaciones causando 200 roturas simples de banda y 40 roturas dobles o potencialmente letales y aunque la mayoría de este daño en el ADN es reparado, la muerte celular guarda una relación directa con el número de roturas dobles). Hasta hace poco tiempo, apenas nada se conocía sobre los mecanismos íntimos del daño celular producido por las radiaciones ionizantes. En los últimos años se han ido conociendo nuevos genes que son inducidos como promotores de productos citotóxicos o enzimas causantes del daño final de la radioterapia. La posibilidad de respuesta tumoral a las radiaciones ionizantes está determinada por la dosis total de radiación, el número de fracciones y la dosis por fracción, y por supuesto del tipo de tumor (90% de control con una dosis de 4 Gy en algunos linfomas y no existe respuesta clínica efectiva con muy altas dosis en los glioblastomas multiforme). También acontecen factores individuales (generalmente epigenéticos), que determina una respuesta diferente del mismo tumor al mismo tratamiento. Llamamos cambios epigenéticos a los que ocurren en la expresión de los genes sin cambios en la secuencia del ADN. Existe una relación entre cambios epigenéticos en los tumores y progresión tumoral, al menos por 2 vías conocidas: metilación del ADN y remodelación de la cromatina. E La metilación del ADN es la adición de un grupo metilo a la base citosina y esto actúa como un universal “Switch off” de la expresión genética durante el desarrollo. La metilación silencia los oncosupresores como el p16, receptores de estrógenos, Rb, VHL y otros. Las células que sufren metilación se inmortalizan. La metilación también juega un papel fundamental en los genes de reparación del “mismacth”, que tanta importancia tienen en la respuesta a los agentes citotóxicos, como los derivados del platino y la propia radioterapia. También es capaz de bloquear factores de transcripción dirigidos al ADN. Existen numerosas proteinas llamadas histonas componentes de la cromatina. La HAT (histona acetiltransferasa) y la HDAC (histona deacetilasa) son genes activadores y supresores y empieza a emerger la relación entre histonas y metilación del ADN. Al metilarse el ADN se remodela la cromatina y modifican las histonas por deacetilación impidiendo la transcripción al ADN, generando una gran alteración en el sistema regulatorio celular. Los polimorfismos de un único nucleótido (en la terminología anglosajona los “SNIPs- Single Nucleotide Polymorphyms”) es una variación en la secuencia de ADN que ocurre cuando un único nucleótido (A,T,C o G) difiere entre miembros de la especie. Los SNPs pueden estar en secuencias que codifican genes o en regiones intergenética, pudiendo producirse diferentes respuestas a enfermedades, Conclusiones 143 CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 144 drogas y radioterapia. Los SNPs están siendo cada día más estudiados en su relación con las radiaciones ionizantes. La reparación a nivel molecular de las lesiones causadas en el ADN por la radioterapia, es otra vía de gran investigación aplicada en el campo de los agentes físicos o químicos, para así evitar la transmisión de alteraciones génicas en las divisiones celulares y cuando la reparación no sea posible, se activan los mecanismos de apoptosis celular. Hasta la fecha se han descrito cuatro mecanismos básicos de reparación del DNA : Base Excision-repair (BER), Nucelotide Excision-repair (NER), Mismatch-Repair y Non-Homologous End-Joining (NHEJ) Las lesiones dobles (DSBs), las más letales producidas por las radiaciones ionizantes, son reparadas principalmente por el sistema NHEJ que reconoce las zonas terminales del ADN fraccionado. La proteína XRCC4 y la ligasa IV, intervienen en la fase final de polimerización y ligación del DNA reparado. Proteínas del sistema BER, como XRCC1, también participan e la reparación del DNA lesionado por radiaciones ionizantes. Obviamente variaciones (mutaciones o polimorfismos) en estas proteínas pueden condicionar la respuesta frente a la radioterapia y otros agentes citotóxicos. Estudios epidemiológicos demuestran una estrecha relación con polimorfismos de XRCC1 y susceptibilidad a padecer tumores de cabeza y cuello y respuestas a la radioterapia junto con otros genes de reparación (XRCC4, XPC etc.) El mayor conocimiento de los mecanismos íntimos de la transformación maligna y en la manera de conseguir diseñar tratamientos más racionales basados en dianas específicas que complementen a los tratamientos clásicos, es hoy una de las vías de investigación más excitantes en el tratamiento del cáncer. Estos nuevos tratamientos llamados genéricamente, tratamientos basados en dianas terapeúticas (“Target-Based Therapy”), tienen el propósito de mejorar la eficacia terapéutica al ser tratamientos más selectivos y menos tóxicos. De esta forma pueden mejorar el “índice terapeútico”, es decir la relación entre muerte tumoral y toxicidades en los tejidos de sanos, que en los tumores sólidos de los adultos es muy estrecha. El impresionante incremento en el conocimiento de los procesos moleculares que intervienen en la transformación celular, está desembocando en nuevos tratamientos biológicos. Estas nuevas terapias pueden afectar a multitud de dianas específicas que van desde, la transducción de señales mitógenas al núcleo, la regulación de la transcripción nuclear, el control del ciclo celular, la apoptosis, las mejoras de la oxigenación tumoral y de la hipoxia, los nuevos agentes contra la angiogénesis, los inhibidores de las metaloproreasas de la matriz, sin olvidarnos de los estudios preliminares de los inhibidores de la telomerasa, enzima disregulada en casi el 80% de los tumores malignos humanos. Esta “terapia conformacional a nivel celular” o lo que algunos llaman “terapia radiogénica” nace de la combinación de la mejor radioterapia a nivel tecnológico con la mejor selección (conformación) a nivel biológico. Esta será con toda seguridad la forma en que trataremos muchos tumores avanzados en los próximos años, en muchas patologías en que la supervivencia apenas ha mejorado en los últimos veinte años y en los que las supervivencias a largo plazo sin selección previa entre los enfermos, apenas llegan al 30% de todos los pacientes1,2. La investigación translacional o aplicada, no es más que acercar a los investigadores cerca de la clínica, para que conozcan los problemas que preocupan más a los clínicos, trabajar así de un forma más coordinada, y acortar el tiempo en que los nuevos tratamientos llegan a los pacientes. Es lo que está ocurriendo en la actualidad, y es la razón por la que la oncología, más que ninguna otra ciencia biomédica haya tenido unos avances tan espectaculares en los últimos años. Debemos disponer de factores pronósticos más selectivos antes de indicar los tratamientos, y también debemos tener factores predictivos más robustos cuando se aplica el tratamiento combinado, como es la radioquimioterapia. 144 Curso sobre avances y actualización en Bio-Radioterapia CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 145 CONCLUSIONES.En los próximos años vamos a disponer de una verdadera avalancha de tratamientos contra “dianas” específicas de los tumores, que además van a poder ser combinados con radioterapia y quimioterapia. Todos los tratamientos tienen un perfil de toxicidad aceptable y actúan de numerosas formas a nivel de los mecanismos de progresión tumoral. Algunos detienen o bloquean señales mitógenas de transducción3,4 o inhiben factores estimuladores, otros lo hacen como moduladores del ciclo celular, otros actúan bloqueando la telomerasa, o inhibiendo las metaloproteasas de la matriz extracelular y la angiogénesis5. Muchos de ellos ya están evaluándose ya en estudios fase III, en tumores avanzados de cabeza y cuello, pulmón, mama o colorectal y otros están en periodo de evaluación preclínica. Los tumores malignos serán tratados en los próximos años con una alta intensidad terapeútica: radioterapia de alto nivel tecnológico (IMRT), IGRT, fusión con PET con nuevos trazadores, aceleradores de protones e iones de carbono, junto con nuevos esquemas de quimioterapia y dianas terapeúticas específicas. Todo esto hará que el cáncer se convierta un una enfermedad más crónica y se adapte una terapia personalizada para cada paciente. De todas formas queda mucho camino por recorrer y a pesar del enorme esfuerzo realizado, muchos problemas permanecen sin resolver, porque la investigación científica es sobre todo una lección de humildad6. De todas formas el tratamiento del cáncer debe ser integral, sistémico y local, porque si falta alguno de los dos no existe posibilidad de curación. La frase de Theodore S. Lawrence7: “Pensar Globalmente, pero actuar Localmente”( Tkink Globally, Act Locally”), creo que debería cambiarse por: “Pensar y actuar globalmente” 1. Defining a future role for radiogenic therapy. Kamisnki JM, Kaminski A, Dicker AP at al. Cancer Treat Reviews 2001; 27, 289-294. 2. Radiotherapy and cellular signalling. Lewanski C and Gullick W. The Lancet Oncol 2001; vol 2: 366370. 3. Rusch V, Mendelsohn J, Dmitrovsky E. The epidermal growth factor receptor and its ligands as therapeutic targets in human tumors. Cytokine Growth Factor Rev 1996; 7: 133-141. 4. Mendelsohn J. Targeting the Epidermal Growth Factor Receptor for cancer therapy. David A. Karnofsky award lecture. J Clin Oncol 2002; vol 20, 18 (Sep 15 Suppl): 1-13. 5. Harrison LB, Chadha M, Hill RJ et al. Impact of tumor hypoxia and anemia on radiation therapy outcoms. The Oncologist 2001: 7: 492-508. 6. J. Bernier, J. Overgaard. Bridings gaps in translational radiation oncology. Radiother Oncol 2006; 80: 109-111. 7. Lawrence T, Petrelli N, Li B et al. Think Globally, Act Locally. J Clin Oncol 2007 ; vol 25: 6: 921-927. Conclusiones 145 CURSOS_ESO_BioRadio_2007_INT_v7 30/5/07 13:53 Página 146