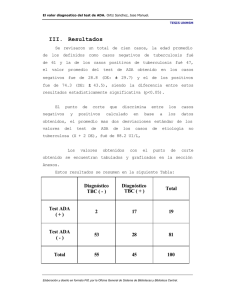
Informe Final Proyecto FODECYT No_ 064-2006
Anuncio

CONSEJO NACIONAL DE CIENCIA Y TECNOLOGÍA –CONCYT SECRETARIA NACIONAL DE CIENCIA Y TECNOLOGÍA -SENACYTFONDO NACIONAL DE CIENCIA Y TECNOLOGÍA -FONACYTUNIVERSIDAD MARIANO CALVEZ INFORME FINAL DETERMINACION DE LOS NIVELES DE ADENOSIN DEAMINASA (ADA) PARA DIAGNOSTICO DE TUBERCULOSIS, EN PACIENTES CON DERRAME PLEURAL, QUE ACUDEN A LOS HOSPITALES DE REFERENCIA NACIONAL EN LA CUDAD DE GUATEMALA, DURANTE LOS AÑOS 2006 AL 2007. PROYECTO FODECYT No. 064- 2006 LICDA.EYDA MENDIA DE CAMPOLLO. Investigadora Principal GUATEMALA, AGOSTO DEL 2009. MINISTERIO DE SALUD UNIVERSIDAD MARIANO GALVEZ FUNDACION DAMIAN AGRADECIMIENTO: La realización de este trabajo, ha sido posible gracias al apoyo financiero dentro del Fondo Nacional de Ciencia y Tecnología, - FODECYT-, otorgado por la Secretaria nacional de Ciencia y Tecnología, - SENACYT – y el Consejo Nacional de Ciencia y Tecnología – CONCYT. OTROS AGRADECIMIENTOS. Mis más sinceros agradecimientos a las altas autoridades de la Universidad Mariano Gálvez de Guatemala, al señor Rector Dr. Álvaro Rolando Torres Moss, a los Honorable miembros del Consejo Directivo y al dr. Ricardo San José Director del Instituto de Investigaciones de esta casa de estudios superiores, por toda la confianza y apoyo brindados para el desarrollo de las diferentes etapas en el proyecto de investigación. Y un especial agradecimiento a todos lo miembros integrantes del equipo de investigación en el presente proyecto: Dr. Carlos Ovando Melchor, Dr. Luís Sánchez Bustamante, Dr. Ricardo Mena, Licda. Ana Esther Barrientos, Sra. María Milagro de Enríquez y Sra. Lorena Zea. i INDICE CONTENIDO Página RESUMEN SUMARY viii ix PARTE I I.1 I.2 INTRODUCCIÓN PLANTEAMIENTO DEL PROBLEMA I.2.1 Antecedentes…………………………………………………………………….. I.2.2 Justificación………………………………………………………………………. I.3 OBJETIVOS 1.3.1 Objetivo General…………………………………………………………………. 1.3.2 Objetivos Específicos……………………………………………………………. I.4 METODOLOGÍA I.4.1 Localización………………………………………………………………………... I.4.1.1 Georeferenciación…………………………………………………….. I.4.1.2 Condiciones Climáticas de la ciudad de Guatemala………………. I.4.1.3 Capacidad Instalada y Medidas de Bioseguridad………………….. I.4.2 Variables I.4.2.1 Variables Dependientes………………………………………………. I.4.2.2 Variables Independientes…………………………………………….. I.4.3 Indicadores. I.4.3.1 Sensibilidad…………………………………………………………….. I.4.3.2 Especificidad…………………………………………………………… I.4.3.3 Prevalencia…………………………………………………………….. I.4.3.4 Valor Predictivo Positivo……………………………………………… I.4.3.5 Valor Predictivo Negativo…………………………………………….. I.4.3.6 Certeza…………………………………………………………………. I.4.3.7 Razón de Probabilidad………………………………………………... I.4.3.8 Probabilidad Post Test………………………………………………... I.4.3.9 Cáncer de Pulmón…………………………………………………….. I.4.3.10 Neumonía o Pulmonía. ………………………………………………. I.4.3.11 Derrame Pleural……………………………………………………….. I.4.3.12 Enfermedad Pulmonar Obstructiva Crónica………………………... I.4.3.13 Problema Cardíaco (IC)………………………………………………. I.4.3.14 Género Masculino……………………………………………………... I.4.3.15 Género Femenino……………………………………………………… I.4.3.16 VIH………………………………………………………………………. I.4.3.17 Mycobacterium tuberculosis………………………………………….. I.4.3.18 Bacteria Alcohol Ácido Resistente…………………………………… I.4.3.19 Lowenstein-Jensen Medio de Cultivo……………………………….. I.4.4 Estrategia Metodológica. I.4.4.1 Población……………………………………………………………….. I.4.4.2 Muestra…………………………………………………………………. I.4.4.3 Criterios de Inclusión para el Paciente……………………………….. ii 1 3 3 5 6 6 6 7 7 7 12 12 14 14 15 16 16 16 17 17 17 18 18 18 18 19 19 20 20 21 21 21 22 22 22 23 23 23 23 I.4.4.4 Recursos……………………………………………………………….. Método. I.4.5.1 Cotización y compra de: Equipos, Materiales e Insumos…………. I.4.5.2 Papelería……………………………………………………………….. I.4.5.3 Preparación de Reactivos y Medios de Cultivo…………………….. I.4.5.4 Calibración de equipos………………………………………………... I.4.5.5 Diseño de Base de Datos…………………………………………….. I.4.5.6 Coordinación e Inducción al Personal de Salud…………………… I.4.5.7 Visitas de Supervisión………………………………………………… I.4.5.8 Aspectos Éticos de la Investigación…………………………………. I.4.5.9 Llenado de Instrumentos de Recolección de Datos……………….. I.4.5.10 Toma, Transporte y Conservación de muestra…………………….. I.4.5.11 Procesamiento de Muestra…………………………………………… Técnica Estadística Instrumentos Utilizados 23 24 24 24 24 25 25 25 25 26 26 26 27 30 30 II.1. MARCO TEÓRICO II.1.1. Tuberculosis pulmonar............................................................................... II.1.2. Aspectos Epidemiológicos......................................................................... II.1.3. Patogenia...................................................................................................... II.1.4. Primo Infección Tuberculosa..................................................................... II.1.5. Hipersensibilidad e Inmunidad................................................................... II.1.6. Tuberculosis Extra Pulmonar..................................................................... II.1.7. Pleuritis Tuberculosa.................................................................................. II.1.8. Derrame Pleural Tuberculoso..................................................................... II.1.9. Diagnóstico Bacteriológico de Tuberculosis............................................ II.1.10. Marcadores Bioquímicos............................................................................ II.1.11. Marcadores Inmunológicos........................................................................ II.1.12. Marcadores Tumorales............................................................................... 31 31 31 32 34 36 37 37 38 40 48 52 53 I.4.5 I.4.6 I.4.7 PARTE II PARTE III III.1 III.2 RESULTADOS DISCUCIÓN DE RESULTADOS 54 91 PARTE IV IV.1 IV.2 IV.3 IV.4 CONCLUSIONES RECOMENDACIONES REFERENCIAS BIBLIOGRÁFICAS ANEXOS 96 97 98 103 PARTE V V.1 INFORME FINANCIERO V.2 CRONOGRAMA DE ACTIVIDADES V.3 EQUIPO DE INVESTIGACIÓN 123 124 125 iii INDICE CUADROS CUADROS I.4.1.2 I.4.2.1 I.4.2.2 Cuadro # 1 Cuadro # 2 Cuadro # 3 III.1.1 Cuadro # 4 III.1.2 III.1.3 III.1.4 Cuadro # 5 Cuadro # 6 Cuadro # 7 Cuadro # 8 III.1.5 Cuadro # 9 III.1.6 Cuadro # 10 III.1.7 Cuadro # 11 III.1.8 Cuadro # 12 III.1.10 Cuadro # 13 III.1.11 Cuadro # 14 III.1.12 Cuadro # 15 III.1.13 Cuadro # 16 Cuadro # 17 III.1.14 Cuadro # 18 III.1.15 Cuadro # 19 III.1.16 Cuadro # 20 III.1.21 Cuadro # 21 Cuadro # 22 III.1.26 Cuadro # 23 Cuadro # 24 Página Condiciones climáticas de la Ciudad de Guatemala…………….. Variables Dependientes…………………………………………….. Variables Independientes…………………………………………… Procedencia de la Muestra, según tipo de Género de Paciente………………………………………………………………. Aspecto de los Líquidos Pleurales………………………………… Color de los Líquidos Pleurales……………………………………. Resultado de Cultivo de los Líquidos Pleurales………………….. Resultado de la Identificación de Cepas de Mycobacterium aisladas………………………………………………………………. Resultado de los Frotis (BK) en pacientes con Derrame Pleural……………………………………………………………….. Diagnósticos principales de los Pacientes con derrame Pleural………………………………………………………………… Resultado de la Prueba VIH – SIDA de pacientes con Derrame Pleural……………………………………………............................. Criterios de LIGHT, para Clasificación de Líquidos Pleurales como Exudados……………………………………………………… Procedencia de Líquido Pleural, como exudado Según Género del Paciente…………………………………………………………... Aspecto del Líquido Pleural, como Exudado……………………... Color del Líquido Pleural, como Exudado……………….............. Resultado de cultivo, de Líquido Pleural, como Exudado………. Resultado de Identificación de cepas de Mycobacterium aislada……………………………………………………….............. Resultados de Frotis (BK) de Líquido Pleurales, como Exudados……………………………………………………............. Diagnósticos Agrupados, para pacientes con Líquidos Pleurales, como Exudados…………………………………………. Resultados de VIH-SIDA de pacientes con Líquido Pleural, como Exudado……………………………………........................... Resultados de ADA en Líquidos Pleurales y su relación con Tipo de Prueba para confirmar de diagnóstico Positivo a Tuberculosis, en pacientes de Género Femenino……………………………………………………............. Resultados de ADA en Líquidos Pleurales y su relación con Tipo de Prueba para confirmación de diagnóstico Positivo a Tuberculosis, en pacientes de Género Masculino……………………………………………………............. Resultados de ADA en Líquidos Pleurales, como Exudados y su relación con Tipo de Prueba para confirmación de diagnóstico Positivo a Tuberculosis, en pacientes de Género Femenino……………………………………………………………... Resultados de ADA en Líquidos Pleurales, como Exudados y su relación con Tipo de Prueba para confirmación de diagnóstico Positivo a Tuberculosis, en pacientes de Género Masculino……………………………………………………………... iv 12 14 15 54 54 55 55 56 56 57 57 58 59 60 60 61 61 61 62 62 69 69 76 76 INDICE GRÁFICAS Página GRÁFICAS III.1.9 Gráfica # 1 III.1.26 Gráfica # 2 III.1.27 Gráfica # 3 III.1.28 Gráfica # 4 III.1.29 ROC 1 III.1.30 ROC 2 Síntomas que presentaron los pacientes que ingresaron al estudio……………………………………… Resultados de ADA en Líquidos Pleurales, como Exudados y su relación con Tipo de Prueba para confirmación de diagnóstico Positivo a Tuberculosis, en pacientes de Ambos Géneros...…………………………… Valores de ADA, para pacientes VIH-SIDA Positivos, que presentaron Derrame Pleural, para ambos géneros.. Valores reportados en función de leucocitos, para los 106 pacientes analizados con Derrame Pleural, como Exudados……………………………………………………... Para Análisis de datos, para Adenosin Deaminasa en pacientes con Derrame Pleural…………………………….. Para Análisis de datos para Adenosin Deaminasa en pacientes con Derrame Pleural…………………………….. v 59 77 77 78 79 86 INDICE TABLAS TABLAS III.1.18 Tabla # 1 Tabla # 3 Tabla # 5 Tabla # 7 Tabla # 9 Tabla # 11 Tabla # 13 III.1.19 Tabla # 15 III.1.20 Tabla # 16 III.1.23 Tabla # 2 Tabla # 4 Tabla # 6 Tabla # 8 Tabla # 10 Tabla # 12 Tabla # 14 III.1.24 Tabla # 17 III.1.25 Tabla # 18 Página Casos diagnosticados como Neumonía………………… Casos diagnosticados como Cáncer……………………… Casos diagnosticados como Insuficiencia Respiratoria Crónica………………………………………………………... Casos diagnosticados como Insuficiencia Cardiaca…….. Casos diagnosticados como derrame…………………….. Casos diagnosticados como Proceso Inflamatorio………. Casos diagnosticados como Herida de Armas de Fuego. Teorema de Bayes: Relación Estándar de Oro Versus Resultado determinación de ADA…………………………. Teorema de Bayes: Relación Cultivo versus Resultado y Determinación de ADA……………………………………… Casos diagnosticados como Neumonías, en Derrames Pleurales, como Exudados…………………………………. Casos diagnosticados como Cáncer, en Derrames Pleurales, como Exudados…………………………………. Casos diagnosticados como Insuficiencia Respiratoria Crónica, como Exudados…………………………………… Casos diagnosticados como Insuficiencia Cardiaca, como Exudados……………………………………………… Casos diagnosticados como Derrame, como Exudados... Casos diagnosticados como Proceso Inflamatorio, como Exudados……………………………………………………... Casos diagnosticados como Herida de Arma de Fuego, como Exudado……………………………………………….. Teorema de Bayes: Relación Estándar de Oro Versus Resultado Determinación de ADA (Exudado)……………. Teorema de Bayes: Relación Cultivo resultado determinación de ADA (Exudado)…………………………. vi 64 64 65 65 65 66 66 67 68 71 71 72 72 73 73 73 74 75 INDICE ANEXOS CONTENIDO IV.4.1. IV.4.2. IV.4.3. IV.4.4. Boleta No.1 Boleta No.2 Boleta No.3 Tablas de Ref. Página Instrumento de Recolección de Datos Carta de Consentimiento Informado Formato de Informe de Resultados Derrame Pleural 104 106 108 109 INDICE FOTOS ANEXOS FOTOS Foto Foto Foto Foto Foto Foto Foto Foto Foto Foto Foto Foto Foto Foto Foto Foto Foto Foto Foto Foto Foto Foto Foto Foto No. No. No. No. No. No. No. No. No. No. No. No. No. No. No. No. No. No. No. No. No. No. No. No. 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 Foto No. 25 Foto No. 26 Página Área Norte de Nivel de seguridad III Área Sur de Nivel de seguridad III Área Sur de Nivel de seguridad III Área de Esterilización, Lavado y Reparación de Material. Recepción de Muestras Preparación de Muestras Cultivo de Muestras Cultivo de Muestras Centrifugación de Muestras Centrifugación de Muestras Incubación de Muestras Incubación de Muestras Lectura de Cultivos Lectura de Cultivos Determinación de Enzima Adenosin Deaminasa Determinación de Enzima Adenosin Deaminasa Alimentación de Base de Datos Manejo de Información Referencia de Muestras Identificación de BAAR en los Frotis Prueba de Nitratos Prueba de Niacina Concentración de Estándares Valor en el rango Positivo para la determinación de Adenosin deaminasa Valor Alto en la Determinación de Adenosin Deaminasa Valor Bajo en la Determinación de Adenosin Deaminasa vii 110 110 111 111 112 112 113 113 114 114 115 115 116 116 117 117 118 118 119 119 120 120 121 121 123 123 RESUMEN. El presente estudio de investigación es de tipo descriptivo prospectivo, sobre la Determinación de los niveles de Adenosin Deaminasa (ADA) para diagnóstico de Tuberculosis en pacientes con Derrame Pleural, que acudieron a los Hospitales de Referencia a Nivel Nacional, Hospital San Juan de Dios, Hospital Roosevelt y Sanatorio San Vicente, durante el 2006 al 2007, los cuales están ubicados en la capital de Guatemala, siendo de acceso para toda la población del país. Considerando que la incidencia de Tuberculosis Pulmonar en Guatemala, es de 17.9 %, (Memoria de labores, PNTB 2004), que la manifestación extra pulmonar más importante es la Tuberculosis Pleural (TBP) que es relativamente frecuente presentando un problema general de Salud Pública, que está ligada a la prevalencia de Tuberculosis de cada región, , además de transformándose en una rara sintomatología clínica en los países desarrollados y que el diagnóstico de este tipo de afección, permanece siendo un desafío, por los métodos convencionales, debido al escaso número de microorganismos presentes, se investigo el aporte de Adenosin Deaminasa, en comparación con el cultivo y el Diagnóstico Médico. Se analizaron en los laboratorios del Instituto de Investigaciones Químicas, Biológicas, Biomédicas y Biofísicas (I2QB3), un total de 215 líquidos de Derrame Pleural, de pacientes que acudieron a los tres Hospitales de Referencia Nacional, antes mencionados, tomadas por el personal hospitalario, y transportadas en mismo día, desde los Hospitales a las instalaciones del I2QB3, por personal propio del proyecto. El objetivo principal del proyecto era Validar el uso de la Determinación de ADA, en Líquidos Pleurales para el diagnóstico de la TBP El método utilizado para la Determinación de ADA fue la técnica colorimétrica modificada de Gitiseppe Giusti y Bruno Galanti y la técnica de cuantificación de Berthelot Los resultados obtenidos en 215 líquidos pleurales, de pacientes que acudieron a los Hospitales de Referencia Nacional, nos llevaron a establecer un Valor de Corte de 34 U/L , de los cuales 106 líquidos fueron verdaderos Exudados Pleurales, de ellos 36 presentaron un valor de Adenosin Deaminasa superior a 34.0 U/L (valores considerados, para el estudio, como POSITIVOS a Tuberculosis Pleural) y 70 con un rango menor de 34 U/L (Valores considerados, para el estudio, como NEGATIVOS a Tuberculosis Pleural), con una sensibilidad del 73.33 %, especificidad del 78.02%, VPP de 35.48 % y VPN de 94.67%. También se obtuvieron valores elevados de Adenosin Deaminasa, para otras enfermedades en el Derrame Pleural, que deben considerarse en la interpretación de los resultados, pero que pueden ser confirmadas con otro tipo de análisis. En conclusión La Determinación de Adenosin Deaminasa es una técnica sensible y específica, para el diagnóstico de TBP, destacándose su alto Valor Predictivo Negativo, reduciendo la necesidad de biopsias, y acortando el tiempo de diagnóstico, además de su fácil ejecución y bajo costo. viii SUMARY The present research study is descriptive and prospective, about the determination of the levels of Adenosin Deaminasa (ADA) in the diagnosis of tuberculosis in patients with pleural stroke, assisted at: Hospital National San Juan de Dios, Hospital Roosevelt y Sanatorium San Vicente, in 2006 and 2007 in Guatemala City. Considering that the incidence of pulmonary tuberculosis in Guatemala is 17.9% (work memory PNTB 2004) and that the most important extra pulmonary manifestation of tuberculosis is pleural tuberculosis (TBP) which is relatively frequent, making it a huge problem in a public health management, linked to the prevalence of tuberculosis in each region. In developed countries, is a rare group of clinic symptoms, transform the diagnosis in a challenge to the conventional methods, because the rare number of presents microorganisms. The researches compare the contribution of Adenosin Deaminasa with the culture and the medical diagnosis. The analysis was made in the IIQBB laboratories, in a total of 215 pleural stroke fluids, in patients that went to the Nationals Hospitals in mention. The fluid was been taken by the personal of each hospital and transported the same day to the laboratory by the personal of the project. The principal objective of the study was the validation of the use of the determination of ADA in pleural fluids to the diagnostic of TBP The used method for the determination of ADA was the modified colorimetric technique of Giuseppe Giusti, Bruno Galanti and the quantification technique of Berthelot. The obtain results in 215 pleural fluids, shows a cut value of 34 U/L, obtain 106 fluids like true pleural fluids, of which 36 fluids, have a value of ADA superior than 34.0 U/L (this study, these value is considerate POSITIVE for pleural tuberculosis) and 70 samples shows a lower range of these value. (This study, that values is considerate NEGATIVE for pleural tuberculosis), with a sensibility about 73.33% specific about 78.02%, PPV of 35.48% y NPV of 94.67%. Others deceases can increscent the rates of ADA in pleural fluids, that have to take in count to emit the diagnosis. In conclusion the determination of Adenosin Deaminasa (ADA) is a sensitive and specific technique to the diagnosis of TBP. Their high NPV, reduce the need of biopsy and make a fast diagnosis. The execution of this technique is simple and low cost. ix PARTE I I.1. INTRODUCCION. La tuberculosis (abreviada TBC o TB) es una enfermedad infecciosa, causada por diversas especies del género Mycobacterium, todas ellas pertenecientes al Complejo Mycobacterium tuberculosis. La especie más importante y representativa, causante de tuberculosis es el Mycobacterium tuberculosis o bacilo de Koch. La TBC es posiblemente la enfermedad infecciosa más prevalente en el mundo. Otras micobacterias como Mycobacterium bovis, Mycobacterium africanum, Mycobacterium canetti, y Mycobacterium microti pueden causar también la tuberculosis, pero estas especies no lo suelen hacer en el individuo sano. Aunque la tuberculosis es una enfermedad predominantemente de los pulmones, puede también verse afectando el sistema nervioso central, el sistema linfático, circulatorio, genitourinario, gastrointestinal, el hueso, articulaciones y aún la piel. Según estimaciones de la Organización Mundial de la Salud (OMS 2006) la Región más afectada es Asia Sudoriental quien registró el mayor número de nuevos casos de tuberculosis, correspondiéndole el 34% de la incidencia mundial. Sin embargo, la tasa de incidencia estimada en el África subsahariana es casi el doble que en la Región de Asia Sudoriental, con cerca de 350 casos por 100 000 habitantes. En el informe OMS de 20063 Se calcula que 1,7 millones de personas murieron por tuberculosis en 2005. La tendencia epidemiológica de la incidencia de TBC sigue aumentando en el mundo, pero la tasa de mortalidad y prevalencia están disminuyendo, No obstante, esa lenta disminución está contrarrestada por el crecimiento de la población. Como consecuencia, sigue aumentando el número de nuevos casos por año a escala mundial y en las regiones de la OMS de África, el Mediterráneo Oriental y Asia Sudoriental. La tuberculosis pleural (TBP) es relativamente frecuente, presentando un problema general de salud pública, estando ligada a la prevalencia de tuberculosis de cada región, mientras se observa con frecuencia en los países más pobres y se transforma en una rara sintomatología clínica en los países desarrollados. En Guatemala la incidencia de Tuberculosis Pulmonar es de 17.9 %, (Memoria de labores PNTB 2004), ante esta situación la presencia de un derrame pleural, debe diferenciarse si se trata de un exudado o trasudado, lo cual se realiza a través de pruebas bioquímicas, como proteínas Totales, Láctico deshidrogenasa, siguiendo los criterios de Light. (Light. RW 1972) 1 Las principales causas de exudado pleural son: procesos malignos, efusiones para neumónicas, tuberculosis y artritis reumatoidea. (Mastel NH 2003 y Cohen M et al 2001) La manifestación extra pulmonar más importante es la Tuberculosis Pleural, aún si el paciente no recibiera tratamiento, el derrame pleural suele resolverse espontáneamente, pero con alta probabilidad de desarrollar durante los próximos 5 años Tuberculosis Pulmonar y Extra Pulmonar. Por esta razón es muy importante llegar al diagnóstico definitivo en la evaluación del derramen pleural y definir si se trata de un exudado o trasudados. Los cultivos de líquidos pleurales son positivos en menos del 25 % de los casos y la coloración Ziehl Neelsen sólo en casos esporádicos es positiva. (Wal W Yeung et al 2003 y de Wit et al 1992) La biopsia pleural para cultivo y estudio histológico, es el método comúnmente usado, el mismo puede conducir hasta un 80% de los casos (Wall W Yeung et al 1991 y Barbas C et al 1991). Todos los métodos usados combinados incluyendo cultivo, contribuirán a la confirmación microbiológica, por esta razón se está considerando el de la técnica indirecta “Determinación de ADA” En conclusión la bacteriología del Líquido Pleural (LP) para el diagnóstico de la Tuberculosis Pleural (TBP) es lenta y poco sensible, la Biopsia da mejora rendimiento, pero es invasiva y costosa. A pesar que la determinación de la Adenosin De Aminasa (ADA) en el LP se describe como un recurso valioso para el diagnóstico de la TBP, no existe hasta el momento una experiencia en nuestro medio. ADA es un glicoproteína que actúa como hidrolasa catalizando la deaminación hidrolítica de la Adenosina y deoxiadenosina en Inosina y Deoxinosina respectivamente, de tal manera, regula la concentración intracelular de metabolitos tóxicos como deoxiadenosina trisulfato, cuya acumulación puede causar la lisis de linfocitos. Se ha demostrado también el aumento de ADA en empiemas pleurales, derrames por artritis reumatoidea, o linfomas, etiologías que por parámetros bioquímicos y clínicos se diferencian de tuberculosis. (Sahn SA 1988) El objetivo de este trabajo fue analizar los valores de ADA en pacientes con derrame pleural, investigando el aporte que realiza la técnica indirecta, como es la actividad de ADA y el aporte definitivo lo métodos convencionales (cultivo y clínica), ya que en la literatura se describe la “Determinación de ADA “como un recurso valioso para este tipo de afección, convirtiéndose en la primera experiencia nacional de este tipo. 2 I.2. PLANTEAMIENTO DEL PROBLEMA I.2.1. Antecedentes La tuberculosis pulmonar representa un importante problema de salud a nivel mundial, la OMS indica que un tercio de esta población, está infectada por el bacilo tuberculoso, que de 8 - 10 millones de esas personas desarrollan la enfermedad y 3 millones mueren anualmente. Es la responsable de tener una morbilidad y mortalidad mayor que cualquier patología y es la causa de un cuarto de todas las muertes prevenibles a nivel mundial. (Farga V 1989, Camin2003). Un rápido y definitivo diagnóstico es uno de los principales retos para el control de la Tuberculosis (TB) y constituye un problema frecuente en la práctica médica, especialmente para la tuberculosis extra pulmonar, incluyendo a la pleuresía tuberculosa. (D.Orphanidum et al 2000, E. Torzkoparan et al 2005). Guatemala ocupa el tercer lugar de Latinoamérica con mayor incidencia de casos de Tuberculosis de todas las formas. Se esperan aproximadamente 5,000 casos nuevos de TB pulmonar( TBP) y sólo se detectan menos del 50%, de los esperados, esto en parte se debe a la baja pesquisa, falta de información de la población, diagnóstico no oportuno, a pesar de que este problema es considerado prioritario para el sistema nacional de salud .(Salazar Lezna et al 1997, Ozakidetzal 2001) En base a las estadísticas de los Hospitales de Referencia Nacional conocemos que en los 2 últimos años, cursaron con Derrame Pleural aproximadamente 250 pacientes, de los cuales solo el 3 % fue diagnosticado como Tuberculosis Pulmonar a través de los métodos tradicionales. Entre el 97% restante, se encuentran incluidas otras patologías como neoplasias, empiemas, quilotorax, hemotórax, incluyendo casos probables de tuberculosis no diagnosticados, los cuales podrían estar considerados dentro del grupo de los idiopáticos. Existen numerosas enfermedades que se puede asociar con Derrame Pleural, y el análisis del líquido pleural mediante la toracocentesis permite establecer un diagnóstico definitivo en más de dos terceras partes de los pacientes, el resto puede requerir un período de espera, para la resolución espontánea o el empleo de otros métodos diagnósticos (Porcel-Pérez JM 2000). La mayoría de pacientes pueden someterse a una toracocentesis y permitir una variedad de diagnósticos, pero obliga a diferenciar entre exudado y trasudado y realizar estudios bioquímicos (recuento de células, glucosa, LDH, proteína total, entre otros) y análisis microbiológicos (gram, ZN, cultivos), aunque existen razones que deben prevalecer entre coste-efectividad para defender el protocolo de actuación. 3 La Toracocentesis diagnóstica está indicada en los Derrames Pleurales para neumónicos, con el fin de identificar el agente etiológico y distinguir los derrames no complicados de los complicados, ya que ni la clínica ni el estudio radiológico nos lo permiten, llas contraindicaciones son escasas, debiéndose valorar si existe diátesis hemorrágica (corregir previamente las anomalías de la coagulación), enfermedad cutánea en el punto de entrada o ventilación mecánica con presiones muy elevadas. No hay una información clara sobre cuánto líquido puede extraerse en la punción pleural. En segundo lugar se puede utilizar la Broncoscopia, después la Biopsia (con un 54 % de rentabilidad) luego la Toracotomía y por último la Toracoscopía la cual se realiza bajo anestesia local y sedación con una rentabilidad diagnóstica del 90 % (Porcel-Pérez JM 2000). La Toracoscopía es de menor invasividad y el menor dolor postoperatorio en cambio, no es útil en la fase organizativa, y sólo es posible en pacientes que toleren la ventilación selectiva de un pulmón. Su eficacia en las diferentes series pediátricas varía entre un 30% y un 100%, dependiendo de la precocidad de su realización. Si fracasa, hay que recurrir a la Toracotomía. Todos estos procedimientos requieren, personal capacitado, equipo y condiciones de infraestructura para su realización, aumentando los costos y la dificultad en su realización. En la actualidad el diagnóstico de Pleuresía Tuberculosa (TBP) continúa siendo todo un reto. Por lo que se precisa de una estrategia de diagnóstico rentable, de fácil manejo e implementación, mínimamente invasiva, de exactitud elevada y que proporcione resultados rápidamente. (A. Bengoa MP et al 2001, Morrys Casagrande et al 2004) Una de las estrategias que está cobrando auge es la determinación de los niveles de Adenosina De Aminasa (ADA) que ha aumentado su popularidad en áreas de alta incidencia de TBP, principalmente por el costo-beneficio que significa para los países en vías de desarrollo. (A. Bengoa MP et al 2001, Morrys Casagrande et al 2004, Heiz F 1984, Ortiz Sánchez 2002) 4 I.2.2. Justificación. El diagnóstico de Tuberculosis Pleural (TBP) es un problema clínico común, algunas veces difícil y de mayor importancia en los países en vías de desarrollo, debido a la mayor prevalencia de la Tuberculosis como enfermedad. El diagnóstico se resuelve a través de la punción y la biopsia pleural para el cultivo microbiológico y el estudio histológico, asegurando el diagnóstico en el 86 % de los ensayos (Ortiz Sánchez et al. 2002) se ha reportado que estos procedimientos, combinados con cultivos del líquido pleural y de esputo, proporcionan la confirmación microbiológica del Mycobacterium tuberculosis en el 90% de los casos. A pesar de esto, estas pruebas no son prácticas en el sentido clínico, ya que el resultado del cultivo demora demasiado tiempo, de 1 a 2 meses en promedio, aún con la mejor tecnología, por lo que ayuda a tomar una adecuada y oportuna decisión terapéutica, siendo necesaria la realización de una prueba que pueda hacer el diagnóstico con la misma certeza, pero en un tiempo menor, por lo menos antes que el paciente sea dado de alta del establecimiento de salud. La bacteriología del Líquido Pleural (LP) para el diagnóstico de la Tuberculosis Pleural (TBP) es lenta y poco sensible, la Biopsia da mejora rendimiento, pero es invasiva y costosa. A pesar que la determinación de la Adenosin De Aminasa (ADA) en el LP se describe como un recurso valioso para el diagnóstico de la TBP, no existe hasta el momento una experiencia en nuestro medio. En este contexto, se pensó en utilizar una prueba diagnóstica mucho más rápida, como la “Determinación de ADA” una prueba colorimétrica simple, y poco costosa a la cual se le ha dado, en otros países, un uso muy amplio y se le ha atribuido un gran valor diagnóstico. Sin embargo debe establecerse la evidencia de la sensibilidad y especificidad adecuada, para ser utilizada como prueba diagnóstica. Se necesita además establecer otros parámetros tales como Valor Predictivo Positivo, que indica la probabilidad de que el resultado Positivo sea correcto, así como determinar el Valor Predictivo Negativo, que determina la probabilidad de que el resultado Negativo sea igualmente acertado. Para nuestro medio hay que establecer la prueba y definir cuál es el Valor Diagnóstico, así como la especificidad y sensibilidad, dependiendo el Punto de Corte elegido y las características del paciente. (Ortiz Sánchez et al. 2002) 5 I.3 OBJETIVOS. I.3.1 OBJETIVO GENERAL: • Determinar los niveles de Adenosin Deaminasa (ADA) para diagnóstico de Tuberculosis en pacientes con Derrame Pleural, que acuden a los Hospitales de Referencia Nacional, en la ciudad de Guatemala durante los años 2006 al 2007. I.3.2. OBJETIVOS ESPECÍFICOS: • Demostrar que la determinación de los niveles de Adenosin Deaminasa (ADA) puede ser considerada como un método alternativo para el diagnóstico de Tuberculosis con Derrame Pleural. • Determinar la sensibilidad y especificidad de los niveles de Adenosin Deaminasa (ADA) en muestras de exudado para el diagnóstico de Tuberculosis en pacientes con Derrame Pleural. • Determinar el Valor Predictivo Positivo y Negativo de los niveles de Adenosìn Deaminasa (ADA) en muestras de exudado para el diagnóstico de Tuberculosis en pacientes con Derrame Pleural. 6 I. 4. METODOLOGÍA. I.4.1. Localización: Para la realización del proyecto, la metodología básicamente se dividió en dos partes, una consistió en la toma de muestras e las instalaciones de los Hospitales de Referencia Nacional, Roosevelt, San Juan de Dios y Sanatorio San Vicente y la otra, parte práctica, se Instituto de Investigaciones Químicas, Biológicas, Biomédicas y Biofísicas de la Universidad mariano Gálvez I.4.1.1. Georeferenciación de los lugares, donde se encuentran las instituciones participantes en la investigación. 1.4.1.1.1. Mapa y Localización de Guatemala. Guatemala se encuentra en la región Centroamérica y limita al norte con México, al oeste con Belice y al sur con Honduras y El Salvador, bordeando el Golfo de Honduras. 7 El relieve se caracteriza por ser montañoso y con mesetas de caliza. Su territorio, de 108.430 km²,[1] es un poco más pequeño que el de Tennessee, EE. UU. Coordenadas: 15°30′N 90°15′O I.1.4.1.1.2. Mapa y Localización del Instituto de Investigaciones Químicas, Biológicas, Biomédicas y Biofísicas. I2QB3 14°39'22.62"N 90°30'50.51"O 8 I.1.4.1.1.3. Mapa y Localización del Hospital Roosevelt. Hospital Roosevelt Coordenadas: 14°36'46.40"N; 90°32'33.90"O 9 I.1.4.1.1.4. Mapa y Localización del Hospital San Juan de Dios. San Juan de Dios, Coordenadas: 14°38'22.32"N; 90°31'14.80"O 10 I.1.4.1.1.5. Mapa y Localización del Sanatorio San Vicente. Sanatorio San Vicente, Coordenadas: 14°37'48.07"N; 90°32'22.35"O 11 I.4.1.2. Condiciones climatológicas de la Cuidad de Guatemala. En la ciudad de Guatemala se encuentran ubicadas las cuatro instituciones que participaron en la ejecución del proyecto de investigaciones, y por ende estuvieron sometidas a las mismas condiciones climatológicas, las cuales aparecen en el cuadro siguiente: Cuadro 1. Condiciones Climatológicas de la Cuidad de Guatemala. Localidad Elevación (Msnm). temperaturas Cº Absolutas Precipitación Humedad Brillo Solar Vel. Viento Evaporación Km/hrs. en Milímetros Relativa Max - Min Max - Min Milímetros Total/Hrs/ Promedio en % Mes. Departamento de Guatemala : Guatemala, INSIVUMEH 1502 24.5 - 14.0 33.4 - 4.2 1196.8 203.6 78 17.7 120.2 I.4.1.3. Capacidad Instalada y Medidas de Bioseguridad del Instituto de Investigaciones Químicas, Biológicas, Biomédicas y Biofísicas de la Universidad Mariano Gálvez. El instituto de Investigaciones Químicas, Biológicas, Biomédicas y Biofísicas, tiene sus orígenes en la Facultad de Medicina y Ciencias de la Salud, especialmente creado para enriquecer la formación profesional altamente competitiva con procesos de investigación tecnológica de punta, y que redunde no sólo en avanzar en la investigación sino en proporcional a la comunidad guatemalteca servicios tecnológicos de calidad, reconocida. Este Instituto inició sus actividades en Guatemala a partir del año 2005 en el área de docencia, para las facultades de Medicina y Ciencias de la Salud, Odontología, y la Escuela de Fisioterapia. Y con miras a futuro para otras facultades y colegios adscritos a la universidad Las oficinas y los laboratorios del I2QB3 están localizados en el campus central de la Universidad Mariano Gálvez con un mantenimiento netamente institucional. La capacidad instalada de los laboratorios del Instituto es con un equipo único no sólo para Guatemala, sino para toda el área Centroamérica, contando además con una infraestructura diseñada para fines de investigación , lo cual constituye un importante apoyo para la labor científica e investigativa en el país. 12 Para fines de este proyecto las áreas de los laboratorios que van a utilizarse son las siguientes: 1.4.1.3.1.Área de Nivel de Seguridad III: En la cual se procesarán todas las muestras, procedentes de los pacientes con derrame pleural, altamente sospechosos para el Mycobacterium tuberculosis, el cual constituye un peligro probado para el personal de laboratorio, así como para otras personas que puedan estar expuestas a aerosoles infecciosos en el laboratorio. Cumpliendo con lo recomendado para el procesamiento de este tipo de muestras, donde las prácticas de laboratorio deben realizarse con equipo de contención (gabinetes de contención, entre otros) y en instalaciones que protejan al personal, medio ambiente y a la comunidad. I.4.1.3.2. Área de Esterilización, Lavado y Preparación de Material: Esta área tiene como propósito asegurar de forma eficiente en la desinfección de todo el material utilizado durante el proyecto, contando con el equipo adecuado para el efecto y reduciendo los accidentes y riesgos laborales. I.4.1.3.3.Área de Abastecimiento de Agua: Aprovisionamiento de agua potable en cantidad, presión y puntos de agua adecuados a la necesidad para las áreas de trabajo. I.4.1.3.4.Área de Aguas Servidas: Aguas servidas de laboratorio y Aguas servidas Sépticas / Infecciosas: llevaran un tratamiento previo, para su descontaminación antes de ser vertidas al drenaje público. I.4.1.3.5.Área de Almacenamiento Temporal de Desechos Bioinfecciosos: Tanto los desechos sólidos como los líquidos (derrames pleurales) llevarán un proceso de autoclaveado, previo a su almacenamiento temporal, en la bodega destinada para el efecto, utilizando bolsas rojas y los contenedores proporcionados por la empresa ECOTERMO, quien se encarga del proceso final del desecho bioinfeccioso. 13 I.4.2. Las Variables I.4.2.1.Variables Dependientes. Son características del objeto de estudio que son determinadas y que dependen del valor que asuman otros fenómenos o variables independientes. Cuadro 2. Variables Dependientes e Indicadores estudiados en el proyecto. Nombre Enzima Adenosin Deaminasa Variable Dependiente Presencia de la enzima Amonio libre Concentración de amonio libre Test diagnóstico de Bayes y Curva ROC Enzima Adenosin Deaminasa Fuente: FODECYT 064-2006 14 Indicador Valor < de 34 U/L m. Valor > de 34U/L m. Valor < de 90 U/L m Valor > de 90 U/L m. Dato de absorbancia, leída con un filtro de 630 nm Sensibilidad Especificidad Valor Predictivo Positivo Valor Predictivo Negativo Certeza Diagnóstica I.4.2.2. Variables Independientes. Son todos aquellos atributos que se presentan en los valores de este tipo y determinan los cambios en los valores de otra. Cuadro 3. Variables Independientes e Indicadores estudiados en el proyecto. Nombre Paciente con un diagnóstico final. Paciente de diferente género Tipo de análisis efectuado al líquido pleural, para cada paciente Variable Independiente Cáncer Neumonía Derrame Pleural. Problema Cardiaco Infección Respiratoria Crónica. Proceso Inflamatorio Masculino Femenino Proteína total Glucosa LDH VIH Tinción de Ziehl Neelsen Cultivo en medio Lowenstein Jensen Líquido Pleural Pruebas Bioquímicas a M. tuberculosis: Niacina Nitrato Color Aspecto Fuente: FODECYT 064-2006 15 Indicador. Definición (listado adjunto) “ “ “ “ “ “ “ >de 3 gr / dl < de 60 mgr / dl >de 200 U/L Positivo o Negativo Presencia o Ausencia de BAAR( Bacilos Alcohol Acido Resistentes) Aislamiento Positivo o Negativo para M. tuberculosis. Niacina: Producción o no Nitrato: Reducción o no Amarillo, Amarillo pálido, Rojizo, Ámbar, Café, Incoloro, Blanquecino, Grisáceo, Marrón, verde, Rosado. Muy turbio, Turbio, Ligeramente Turbio, Límpido, Hemorrágico, Con Fibrina. I.4.3. Indicadores: Los indicadores tienen gran utilidad en la etapa de formulación y evaluación del proyecto y además contribuyen a la valoración de las decisiones y sus definiciones son las siguientes: I.4.3.1. Sensibilidad Se define como la razón de los Verdaderos Positivos (test positivo en enfermedad) o proporción de individuos con la enfermedad que presentan un resultado Positivo. Indica qué tan buena es una prueba para identificar a las personas enfermas. La sensibilidad en epidemiología es la probabilidad de clasificar correctamente a un individuo enfermo, es decir, la probabilidad de que para un sujeto enfermo se obtenga en una prueba diagnóstica un resultado Positivo. La sensibilidad es, por lo tanto, la capacidad de la prueba complementaria para detectar la enfermedad. La sensibilidad se puede calcular a partir de la siguiente relación: Donde VP es Verdaderos Positivos y FN Falsos Negativos. Por eso a la sensibilidad también se la conoce como la Fracción de Verdaderos Positivos (FVP). (Salech Felipe, 2005) I.4.3.2. Especificidad Definida como la razón de Verdaderos Negativos (test negativos en los sin enfermedad) Es decir, la proporción de individuos sin la enfermedad que presentan un resultado Negativo. Indica cuán buena es la prueba para identificar a los individuos que NO tienen la enfermedad. La especificidad en epidemiología, es la probabilidad de definir de forma correcta a un individuo sano, es decir, la probabilidad de que un sujeto verdaderamente sano obtenga un resultado negativo en una prueba complementaria. 16 Otra forma de definir la especificidad es la capacidad para detectar a los individuos sanos. Y se puede calcular a partir de la siguiente relación: Donde VN, serían los Verdaderos Negativos; y FP, los Falsos Positivos. Por eso a la especificidad también se le denomina Fracción de Verdaderos Negativos (FVN). (Salech Felipe, 2005) I.4.3.3. Prevalencia Frecuencia con la que se presenta una determinada enfermedad en una población, puede ser estimada por los clínicos de diferentes maneras: por experiencia personal, por estadísticas de salud. En otras palabras, la frecuencia (expresada en porcentaje) en la cual se encuentra una condición determinada en el total de la población y pretende responder a la pregunta: ¿Cuán frecuente es esta condición en mi población? Corresponde a la Probabilidad Pre Test. (Salech Felipe, 2005) I.4.3.4. Valor Predictivo Positivo Si existe una persona con un test positivo, cuál es la probabilidad de que él o ella tengan la condición en estudio. (Salech Felipe, 2005) I.4.3.5. Valor Predictivo Negativo Indica cuál es probabilidad de que una persona con un examen negativo no tenga la condición en estudio. (Salech Felipe, 2005) 17 I.4.3.6. Certeza Corresponde a los Positivos Verdaderos y Negativos Verdaderos como una proporción de todos los resultados. Responde a la pregunta: ¿Qué proporción de todos los test han dado el resultado correcto? (Salech Felipe, 2005) I.4.3.7. Razón de Probabilidad Razón de Probabilidad o LR: es la propiedad más importante de un test, pues nos permite movernos de una probabilidad pre-test a una probabilidad post-test. Se define como la razón entre la probabilidad de tener un resultado del test en la población con la condición versus tener el mismo resultado en la población sin la condición. (Salech Felipe, 2005) I.4.3.8. Probabilidad Post Test Éste es el marcador más importante para nuestro paciente ya que si aplicamos una combinación entre la prevalencia de la enfermedad, la probabilidad pre-test del paciente y el LR + del test obtendremos la probabilidad de que tenga la enfermedad o condición luego de aplicado el test. (Salech Felipe, 2005) I.4.3.9. Cáncer de Pulmón: Es un crecimiento anormal de células en el tejido de uno o ambos pulmones. Dicho crecimiento es generalmente maligno proveniente de células epiteliales y puede causar metástasis e infiltración a otros tejidos del cuerpo. Otros nombres: Carcinoma broncopulmonar El cáncer de pulmón es uno de los cánceres más comunes en el mundo. Es la principal causa de muerte por cáncer entre los hombres y las mujeres en los Estados Unidos. El fumar cigarrillos causa la mayoría de los cánceres de pulmón. A mayor cantidad de cigarrillos diarios que fume al día y cuanto más joven se comienza a fumar, mayor será el riesgo de desarrollar un cáncer de pulmón. La exposición a altos niveles de contaminación, radiación y asbesto también puede aumentar el riesgo. 18 Los síntomas comunes del cáncer de pulmón incluyen: • • • • • • • • Una tos que no desaparece y empeora con el tiempo Dolor constante en el pecho Tos con expectoración con sangre Falta de aire, silbidos al respirar o ronquera Problemas repetidos por neumonía o bronquitis Inflamación del cuello y la cara Pérdida del apetito o pérdida de peso Fatiga Existen muchos tipos de cáncer de pulmón. Cada uno de ellos crece y se disemina de un modo distinto y se trata de una forma diferente. El tratamiento también depende del estadio o de qué tan avanzado se encuentre. El tratamiento puede incluir quimioterapia, radiación y cirugía. (Biblioteca Nacional de EEUU) I.4.3.10. Neumonía o Pulmonía: El término neumonía y su sinónimo neumonitis se refieren a los procesos inflamatorios del parénquima pulmonar. Estos trastornos difieren bastante en función del agente causal, de los elementos precipitantes, del curso de la enfermedad, de la patología y del pronóstico. Las neumonías pueden tener su origen en una variedad de agentes infecciosos y no infecciosos que incluyen toxinas inhaladas, bacterias, virus, rickettsias, micoplasmas y hongos. Como las causas más frecuentes de neumonía son las bacterias y los virus se concretará en esta guía lo correspondiente a ellos, con excepción de las Mycobacterias y los gérmenes que alteran al paciente inmunocomprometido. (Sánchez Carlos David, 1994) I.4.3.11. Derrame Pleural: Es el acúmulo anormal de un exceso de líquido en la cavidad torácica que resulta del desequilibrio entre la formación del líquido pleural y su remoción. Se presenta más frecuentemente por enfermedades de la pleura o los pulmones, pero puede ser causado por alteraciones extra pulmonares, como cardíacas (ICC), renales (síndrome nefrótico), hepáticas (cirrosis con ascitis), pancreáticas (pancreatitis); pueden también presentarse por enfermedades sistémicas (LES, artritis reumatoidea), o por reacción a drogas (nitrofurantoina); finalmente, puede ser de carácter neoplásico. (Páez Sylvia 1994) 19 I.4.3.12. Enfermedad Pulmonar Obstructiva Crónica: Se caracteriza por la presencia de una obstrucción crónica y poco reversible al flujo aéreo, causada, fundamentalmente, por una respuesta inflamatoria anómala al humo del tabaco. La enfermedad pulmonar obstructiva crónica (EPOC) es un término que se emplea para agrupar dos trastornos: el enfisema y la bronquitis crónica. La bronquitis crónica se caracteriza por la inflamación prolongada del interior de los bronquios. El enfisema, por el daño irreversible en los alvéolos pulmonares. La mayoría de los pacientes con EPOC presenta una combinación de ambas, aunque por lo general predomina uno de los dos trastornos. La mayoría de los pacientes con EPOC, que tienen por definición una obstrucción al flujo aéreo, comparten características de bronquitis crónica y enfisema. Se considera que los pacientes cuya asma se caracteriza por una reversibilidad incompleta de la obstrucción aérea tienen una forma de EPOC (denominada bronquitis asmática o EPOC asmática en Estados Unidos), porque con frecuencia no se pueden distinguir de los que tienen una bronquitis crónica con hiperreactividad de la vía aérea. Los pacientes con obstrucción completamente reversible de la vía aérea sin características de bronquitis crónica ni enfisema tienen asma, pero no EPOC. (Directorio Médico Interactivo) I.4.3.13. Problema Cardiaco: La insuficiencia Cardíaca (IC): La Insuficiencia Cardiaca (IC) es el estado fisiopatológico en el cual el corazón es incapaz de mantener una circulación adecuada para las necesidades metabólicas del organismo. La Insuficiencia Cardiaca Congestiva (ICC) es uno de los dos mayores signos de la presencia de enfermedad cardiaca importante. Se ha estimado que la Insuficiencia Cardiaca Congestiva inicia antes de un año de edad en aproximadamente 90% de los lactantes y niños que desarrollaran el desorden en la edad pediátrica; y la mayoría de estos pacientes están por abajo de los 6 meses de edad, hacemos hincapié en las diversas causas etiológicas de a cuerdo a las edades pediátricas, así como sus manifestaciones clínicas, diagnóstico y tratamiento por la importancia de su incidencia. (Directorio Médico Interactivo) 20 I.4.3.14. Género Masculino: Es un término de gramática. En los nombres y en algunos pronombres, es el rasgo inherente de las voces que designan personas del sexo masculino, animales macho y, convencionalmente, determinados objetos o cosas. En algunos adjetivos, determinantes y otras clases de palabras, es el rasgo gramatical de concordancia con los sustantivos de género masculino. (Enciclopedia Wikipedia) I.4.3.15. Género Femenino: Es un término de gramática. En los nombres y en algunos pronombres, es el rasgo inherente de las voces que designan personas del sexo femenino, animales hembra y, convencionalmente, determinados objetos o cosas. En algunos adjetivos, determinantes y otras clases de palabras, es el rasgo gramatical de concordancia con los sustantivos de género femenino. . (Enciclopedia Wikipedia) I.4.3.16. VIH (Acrónimo de virus de inmunodeficiencia humana): Es el agente infeccioso determinante del síndrome de inmunodeficiencia adquirida (SIDA). Según el Comité Internacional de Taxonomía de Virus (ICTV) el VIH se incluye en el género Lentivirus, encuadrado en la subfamilia Orthoretrovirinae de la familia Retroviridae. Puede ser detectado por la prueba de VIH. Otros nombres: Síndrome de inmunodeficiencia adquirida, VIH SIDA es la sigla del Síndrome de Inmunodeficiencia Adquirida. Es el estadio más avanzado de infección por el virus de inmunodeficiencia humana (VIH). El VIH es un virus que mata o daña las células del sistema inmunológico del organismo. El VIH suele contagiarse a través de las relaciones sexuales sin protección con una persona infectada. El SIDA también puede contagiarse por compartir agujas con drogas o mediante el contacto con la sangre de una persona infectada. Las mujeres pueden transmitírselo a sus bebés durante el embarazo o el parto. Los primeros signos de infección con VIH pueden ser inflamación de los ganglios y síntomas gripales. Los mismos pueden presentarse y desaparecer un mes o dos después de la infección. Los síntomas graves pueden no aparecer hasta pasados meses o años. . (Biblioteca Nacional de EEUU) 21 I.4.3.17. Mycobacterium tuberculosis: Es una bacteria responsable de la mayor cantidad de casos de Tuberculosis en el mundo. Fue descrito por primera vez el 24 de marzo de 1882 por Robert Koch, de ahí su sobrenombre de "Bacilo de Koch", quien posteriormente recibiría el premio Nobel de Fisiología o Medicina en 1905. Su genoma está secuenciado, lo que permitirá aclarar su relación con las otras especies del complejo Mycobacterium tuberculosis. (Caminero JA, 2003) I.4.3.18. Bacteria Alcohol-Acido-Resistente: Bacteria que frecuentemente incolora, aeróbica estricta. Su crecimiento está subordinado a la presencia de oxígeno y al valor del pH circundante. Es muy resistente al frío, la congelación y la desecación y por el contrario muy sensible al calor, la luz solar y la luz ultravioleta. Su multiplicación es muy lenta (se divide cada 16 a 20 horas) y ante circunstancias adversas puede entrar en estado latente, pudiendo retrasar su multiplicación desde algunos días hasta varios años. El reservorio natural del M. tuberculosis es el hombre, tanto el sano infectado como el enfermo. . (Caminero JA, 2003) I.4.3.19. Lowenstein-Jensen Medio Base. Es esta una base para la preparación de varios medios destinados al aislamiento, cultivo y diferenciación de Mycobacterias. . (Caminero JA, 2003) 22 I.4.4. ESTRATEGICA METODOLÓGICA. I.4.4.1. Población: Todos los pacientes que consultaron a los Hospitales de Referencia Roosevelt, San Juan de Dios y Sanatorio San Vicente, con derrame pleural, durante los meses establecidos para el estudio. I.4.4.2. Muestra: Todos los pacientes con derrame pleural que ingresaron a los Hospitales, que cumpliendo con los criterios de inclusión. (Método de muestreo no probabilístico) Nota: Para los pacientes que participaron en el proyecto, ya NO fue necesario llenar al final la boleta de Consentimiento Informado, ni que la firmaran, debido a que automáticamente cuando los pacientes llegaban a los Hospitales de Referencia, se les efectúa la Toracentesis como procedimiento de rutina a nivel diagnóstico, lo cual quedaba registrado y documentado en hoja de ingreso del expediente clínico. I.4.4.3.Criterios de Inclusión para el Paciente: - Mayor de 15 años sin distinción de género. - Que haya ingresado a los Hospitales arriba mencionados con derrame pleural, no Traumático y sin diagnóstico específico durante el período establecido para el Estudio. - Y que no sea paciente VIH/SIDA Positivo. Nota: En caso de pacientes con VIH, se les aceptaron por ser un número menor en el estudio, además de haber sido un requerimiento específico de los médicos que laboran en los Hospitales de Referencia. I.4.4.4. Recursos: I.4.4.4.1. Humanos: • • • • • Profesionales Investigadores. Personal de laboratorio Personal médico y paramédico de los Hospitales incluidos en el estudio. Personal de apoyo. Pacientes que ingresen al estudio. 23 I.4.4.4.2 Materiales: • • • Papelería Equipo, Materiales, reactivos e Insumos de laboratorio Combustible. I.4.5. METODO. El presente estudio de investigación es de tipo descriptivo prospectivo sobre la Determinación de los niveles de ADA, para el diagnóstico de Tuberculosis, en pacientes con Derrame Pleural llevado a cabo en 215 muestras de Líquidos Plurales, de pacientes que acudieron a los hospitales de referencia nacional, durante el 2006 al 2007. a través de la metodología de Determinación de ADA por la técnica colorimétrica modificada de Gitiseppe Giusti y Bruno Galanti, y la técnica de cuantificación de Berthelot , Para su desarrollo se ejecutaron las siguientes actividades: I.4.5.1 Cotización y Compra de Equipos, Materiales e Insumos: Actividad que se realizó desde el inicio del proyecto, menores fueron efectuadas en el transcurso del mismo. algunas otras compras I.4.5.2. Papelería. Se diseñaron y elaboraron los siguientes Instrumentos: Instrumento de Recolección de Datos (Anexo, Boleta No 1) Hoja de Consentimiento Informado, (Anexo, Boleta No 2) Documento con Lineamientos del Estudio (Anexo, Documento No. 3) Boleta de Informe de Laboratorio (Anexo, Documento No 4) I.4.5.3.Preparación de Reactivos y Medios de Cultivo. Se prepararon todos los reactivos para ser utilizados, en el procesamiento de muestras: Colorantes para la Tinción de Ziehl Neelsen Reactivos para la Decontaminación de las muestras. Reactivos para la realización del Cultivo en el medio de Lowenstein Jensen. Reactivos para la Determinación de presencia de Niacina y reducción de Nitratos. Reactivos para la preparación de la muestra, y determinación de amonio libre. Soluciones desinfectantes. 24 I.4.5.4. Calibración de Equipos Se calibraron los siguientes equipos: Balanza con sensibilidad de 0.0001 gramos. Pipetas automáticas, de 1- 10 ul, 10- 100 ul, y de 100- 1000 ul. Pipetas repetidoras. Incubadora. Espectrofotómetro. Refrigerador. Campana de flujo laminar, y control de la lámpara de luz ultravioleta. I.4.5.5. Diseño de Base de Datos. Se trabajó en el diseño de la una Base de Datos, con ayuda de los siguientes programas: Excel, Epi-Info, BioMates, los cuales sirvieron para consolidar, la información general tanto del paciente como de la muestra. I.4.5.6. Coordinación e Inducción al Personal de Salud. Se trabajó inicialmente con los directores de los Hospitales, para establecer horarios y responsables, para cada una de de las diferentes actividades. Se realizaron capacitaciones para el personal médico y paramédico con entregas parciales de insumos. Las capacitaciones, se enfocaron en brindar información completa acerca de la metodología, objetivos y logística del proyecto de investigación y la importancia de la participación de cada una de las personas involucradas en el estudio. Se les hizo entrega de los siguientes documentos: - Hoja de Consentimiento Informado, (Anexo, Boleta No 2) - Documento con Lineamientos del Estudio (Anexo, Documento No. 3) I.4.5.7. Visitas de Supervisión. Se efectuaron visitas mensuales a cada uno de las instituciones involucradas en el proyecto de investigación, como parte del seguimiento, monitoreo, supervisión, reabastecimiento de insumos e información de avances obtenidos dentro del proyecto de investigación. 25 I.4.5.8. Aspectos Éticos de la Investigación. Para dar cumplimiento a los aspectos éticos de toda investigación, se trabajo con toda discrecionalidad con respecto a los resultados encontrados. Y por rutina administrativa los líquidos analizados ya contaban con autorización de los pacientes, para su análisis dentro de la institución, siendo la muestra del estudio, una alícuota de la muestra general, con la cual, el personal del laboratorio de cada Hospital, realiza sus análisis de rutina. I.4.5.9. Llenado del Instrumento de Recolección de Datos. La boleta de Recolección de datos (Boleta No. 1) fue completada por el personal de salud ya sea del laboratorio, médicos o paramédicos y /o personal integrante del equipo de trabajo del mismo proyecto. I.4.5.10. Toma, Transporte y Conservación de la muestra. I.4.5.10.1. Toma de Muestra. La muestra fue tomada a los pacientes sujetos de estudio en los servicios de emergencia o de encamamiento a criterio del médico especialista; con la técnica de Toracocentesis, necesitando para el estudio, un mínimo de 10 ml del líquido de Derrame Pleural, el que fue depositado en un tubo vacutainer sin anticoagulante, cumpliendo con todas las medidas de esterilidad. (Este volumen, No incluye el volumen requerido para los análisis de rutina en el área bioquímica o microbiológica en cada uno de los Hospitales). I.4.5.10.2. Transporte de Muestra. Después de ser tomada la muestra, fue transportada de inmediatamente al laboratorio del Hospital, para su conservación en cadena de frío (+ 4°C a + 8°C). Posteriormente, de una coordinación con el mensajero contratado para el efecto dentro del proyecto, la muestra fue transportada, en un termo en cadena de frío, al laboratorio del Instituto de Investigaciones Químicas, Biológicas, Biomédicas y Biofísicas (I2QB3) de la Universidad Mariano Gálvez de Guatemala, donde se realizaron: Los frotis, el cultivo, la identificación de las Micobacterias y la determinación de las concentraciones de la enzima Adenosin De Aminasa. I.4.5.10.3. Conservación de Muestra. Si por alguna razón, la muestra no pudo ser transportada de inmediatamente al IIQBBB, fue refrigerada por un tiempo no mayor de 24 horas. (NO CONGELADA) en las instalaciones de los laboratorios de cada uno de los Hospitales de Referencia. 26 I.4.5.11. Procesamiento de Muestra. A toda muestra extraída y referida al laboratorio del I2QB3, se le efectuó el siguiente procedimiento: I.4.5.11.1. Identificación de Muestra: Se le asignó un número único de código, el cual estaba formado de la siguiente manera: La primera letra, correspondía a la palabra “Hospital” asignándole una letra mayúscula, seguida de la primera letra correspondiente al Nombre del Hospital (las dos letras en mayúscula). Seguidamente el número correlativo que correspondía a la boleta, y que estaba ubicado en el extremo superior derecho de la misma, correspondía igualmente a la identificando del paciente y por ende igualmente a la muestra. Los siguientes dos dígitos, en el código, correspondían al mes y al año en el cual fue tomada la muestra. Los últimos dos dígitos correspondían al año en que fue tomada la muestra. Ejemplo: HR-001- 05 / 06 Esto correspondía a: Muestra tomada en el Hospital Roosevelt, con la Boleta 001, igualmente al número del paciente, en el mes de mayo, del año 2006. I.4.5.11.2. Realización y Coloración del Frotis, Los frotis o (BK) de cada una de las muestras, fue tenido con la tinción de ZiehlNeelsen, utilizada para la determinación de la presencia o ausencia de Bacilos Alcohol Acido Resistentes (BAAR) La metodología fue estandarizada, previa realización a las muestras del estudio. Posterior a esto se realizó el Frotis a cada una de las muestras, identificando cuantificando los bacilos, y reportadas de la siguiente forma: Positiva (+) menos de un Bacilo Alcohol Acido Resistente (BAAR) por campo, en 100 campos observados. Positiva (++) de uno a 10 BAAR por campo, en50 campos observados. Positiva (+++) más de 10 BAAR por campo, en 20 campos observados. Negativa, en el caso de no encontrar ningún BAAR en toda la preparación de la muestra. Se utilizaron muestras positivas con BAAR, como control de la técnica de la Coloración. 27 y Las lecturas de las muestras fueron en duplicado, por dos personas diferentes, como control de lectura. I.4.5.11.3. Cultivo de la Muestra Las muestras fueron procesadas según la metodología modificada de Petroff e inoculadas en duplicado en el medio de cultivo Lowenstein Jensen, para demostrar la viabilidad de las Mycobacterias, trabajando una inoculación en directo y la otra neutralizada. La metodología fue estandarizada, previa realización a las muestras del estudio. Se efectuaron lecturas a lo largo de dos meses y reportadas de la siguiente forma: Cultivo Positivo: # de colonias aisladas de Mycobacterias sp. Cultivo Positivo: > de 20 colonias aisladas de Mycobacterias sp. Cultivo Positivo: Incontables colonias, aisladas de Mycobacterias sp. Cultivo Negativo: No se aislaron colonias de Mycobacterias sp. Cultivo Contaminado: En el caso de presentar crecimiento de otras bacterias, dentro del tubo de medio de Lowenstein Jensen. Se utilizó la cepa de ATTC de Mycobacterium tuberculosis H37 Rv. como control Positivo como parte des sistema de calidad, tanto del proceso, como para la verificación de la calidad del medio de cultivo. I.4.5.11.4. Identificación de las Cepas Aisladas. A todo Cultivo Positivo para cepas de Mycobacterias sp, se les realizaron dos diferentes pruebas bioquímicas, y estas fueron: I.4.5.11.4.1.Test de Niacina. Reacción en tubo, para determinar la Producción o Ausencia de Niacina. Resultado e interpretación. Positiva. Cambio de color en la solución del tubo, se transforma en amarillo, indica producción de niacina. Negativa. No hay cambio de color en el solución del tubo, indica Ausencia de Niacina. 28 Se utilizó la cepa ATTC de Mycobacterium tuberculosis H37 Rv. Como control Positivo como parte des sistema de calidad, tanto del proceso, como para la verificación de la calidad del Test. I.4.5.11.4.2. Test de Reducción de Nitratos. Reacción en tubo, para determinar la Reducción o NO de Nitratos Resultado e interpretación. Positiva. Cambio de color en la solución del tubo, se transforma en roja, indica reducción de Nitratos. Negativa. No hay cambio de color en el solución del tubo, indica NO reducción de Nitratos. Se utilizó la cepa ATTC de Mycobacterium tuberculosis H37 Rv. Como control Positivo como parte des sistema de calidad, tanto del proceso, como para la verificación de la calidad del Test. I.4.5.11.5. Almacenamiento de las Cepas Aisladas: Para toda cepa aislada, se preparó una suspensión de la misma en agua destilada y se congeló a (-85°C) para futuros estudios. I.4.5.11.6. Control de Calidad. Se había considerado enviar al Laboratorio de Salud Pública de Chile, una tercera parte de las muestras ya procesadas cada siete meses, como Control de Calidad Externa, pero como únicamente se obtuvieron 6 aislamientos Positivos, ya no se enviaron. I.4.5.11.7. Determinación de Actividad Enzimática de Adenosina De Aminasa. La metodología utilizada, fue la del método colorimétrico de Gitiseppe Giusti y Bruno Galanti modificado, basado en la cuantificación de Amonio liberado según Berthelot. La enzima reacciona con Adenosina para producir Inosina + amoniaco. ADA Adenosina + H20 Inosina + NH3 29 Los iones amonio que se forman se valoran por el método de Berthelot, donde el amoniaco en presencia de una base reacciona con el fenol e hipoclorito de sodio, formando Azul de Indofenol. Se realizaron las lecturas de absorbancia a 630 nm, tomando al agua destilada como valor 0. Se obtuvo una lectura como: DO: valor de la Densidad Óptica. Para la correlación entre amonio y enzima se utilizó la siguiente definición: Una unidad de ADA es definida como la cantidad de enzima requerida para la liberación de 1 mmol de amonio por minuto en condiciones estándar del ensayo, y el resultado es expresado en U/L m. (Unidades por Litro por minuto) Aquí se utilizó apoyo del programa Excel y Teorema de Bayes, para los cálculos correspondientes según normas de estadística aplicada. I.4.5.11.8. Mantenimiento y Reparación de Equipo. Dentro de la metodología de trabajo, se le dio mantenimiento al espectrofotómetro, garantizando de esta forma la calidad de las determinaciones o lecturas de densidad óptica. I.4.6. Técnica Estadística. Para el análisis de los datos se utilizaron los siguientes programas: Excel versión 2007. Epi Info 3.4 versión 2007 Bio Mates para el Teorema de Bayes y para la Curva ROC La estadística aplicada a la información recabada fue descriptiva y analítica con un análisis univariado y bivariado, obteniendo frecuencia, porcentajes, desviaciones, coeficientes de variación, media, y puntos de corte. I.4.7. Instrumentos Utilizados Instrumento de Recolección de Datos (Anexo, Boleta No 1) Hoja de Consentimiento Informado, (Anexo, Boleta No 2) Documento con lineamientos del estudio (Anexo, Documento No. 3) Boleta de informe de laboratorio (Anexo, Documento No 4) 30 PARTE II II.1. MARCO TEORICO II.1.1.Tuberculosis Pulmonar. La tuberculosis (TB) es una infección crónica producida por Mycobacterium tuberculosis (M. tuberculosis). Se contagia por inhalación y desde el pulmón se disemina por vía linfática y hemática a través de todo el organismo. La TB es una enfermedad que puede prevenirse, de fácil curación y de excelente relación costo-beneficio con acertadas medidas de control. Algunos países desarrollados han considerado a esta enfermedad como superada y han dejado de invertir en programas de control. Sin embargo, en la actualidad las migraciones masivas de población, la facilidad para viajar y la epidemia de infección por el virus de la inmunodeficiencia humana (VIH) han complicado el problema mundial del control de la TB. (Sánchez Hernández I.M. 1998) II.1.2. Aspectos Epidemiológicos La TB es una enfermedad infecciosa crónica con una elevada morbilidad y mortalidad mundial, en especial en los países en vías de desarrollo y en las áreas urbanas más pobres de los países desarrollados. Según cifras de la Organización Mundial de la Salud (OMS) se producirán en esta década 90 millones de nuevos casos y más de 30 millones de muertes por TB. Para su correcto manejo requiere el cumplimiento de un tratamiento adecuado por parte del paciente, y además un control comunitario con estudio de sus contactos para diagnosticar y tratar precozmente los posibles focos de infección y/o posibles infectados. Existirán, por tanto, indicadores epidemiológicos de infección, de enfermedad y de mortalidad. (Sánchez Hernández I.M. 1998) 31 II.1.3. Patogenia. El bacilo tuberculoso puede penetrar en el sujeto no inmune por diversas vías: pulmonar (la única importante en la práctica), digestiva (M. bovis) y cutánea (inoculación accidental en el laboratorio). Los núcleos goticulares (doplet nuclei) portadores del bacilo alcanzan los alvéolos por inhalación, en especial los alvéolos de los lóbulos inferiores de ambos pulmones que son los mejor ventilados. M. tuberculosis inicia su infección en los macrófagos alveolares. Los macrófagos humanos son extremadamente susceptibles a los bacilos tuberculosos, que se multiplican libremente en su interior produciendo la lisis celular y la infección de nuevas células monocíticas atraídas al lugar de la infección por la respuesta inflamatoria inicial inespecífica. (Sánchez Hernández I.M. 1998) A nivel celular, la micobacteria infectante se sitúa en los fagosomas de los macrófagos; su destrucción depende de la fusión de los fagosomas con los lisosomas que contiene enzimas proteolíticas. La multiplicación del bacilo origina un foco inicial circunscrito llamado lesión primaria o chancro de inoculación de Ghon. Dado que el bacilo tuberculoso no produce toxinas y el organismo no ha tenido tiempo de iniciar la respuesta inmunológica, el germen se multiplica libremente y difunde hasta los ganglios hiliares y la corriente sanguínea pudiendo llegar a todos los órganos de la economía. La respuesta inmunitaria es doble: humoral y celular. La humoral produce abundantes anticuerpos cuya importancia en la lucha contra la infección tuberculosa parece nula, ignorándose actualmente cuál puede ser su función. La inmunidad de tipo celular (hipersensibilidad retardada mediada por linfocitos T) desempeña un papel fundamental en la curación, tarda de dos a ocho semanas en establecerse, manifestándose por el viraje tuberculínico. Si es lo suficientemente eficaz, impide la multiplicación de los gérmenes en la lesión primaria produciendo granulomas que limitan la progresión de la enfermedad y originan la curación clínica. En caso contrario, se produce una progresión local o general. Durante la curación clínica de la enfermedad, algunos gérmenes permanecen vivos en el interior de los macrófagos, por lo que algunos autores la denominan fase de infección latente. En la mayoría de los casos, los macrófagos y los linfocitos T consiguen detener la multiplicación de los bacilos, pero en un 5% de los casos esta inmunidad será insuficiente para impedir el desarrollo de la tuberculosis primaria. No obstante, aun cuando se consiga detener la infección inicial, algunos bacilos son capaces de persistir intracelularmente y en otro pequeño porcentaje de los infectados, si los mecanismos inmunológicos se deprimen, el bacilo tuberculoso puede multiplicarse y producirse la TB postprimaria. . (Sánchez Hernández I.M. 1998) La reinfección exógena es excepcional pero posible, como se ha demostrado por recientes brotes en pacientes infectados por el VIH, al hallar bacilos con fagotipo distinto al que originó la primo infección. . (Sánchez Hernández I.M. 1998) 32 Lo habitual es que todo comience cuando una persona virgen de infección tuberculosa entra en contacto con un tuberculoso bacilífero. Al hablar, toser o estornudar éste libera partículas que contienen bacilos tuberculosos, las que pueden ser inhaladas por el primero. Las partículas más pequeñas, capaces de llegar al alvéolo pulmonar, son fagocitadas por los macrófagos de su pared. Lo que posteriormente suceda depende del volumen del inóculo, de la virulencia del germen y de la capacidad microbicida del macrófago. Si el bacilo logra sobrevivir, se multiplica libremente dentro del macrófago. Ello conduce a la destrucción de esta célula y a la liberación de numerosos bacilos, que van a ser fagocitados por otros macrófagos y eventualmente por monocitos y polimorfo nucleares (PMN). Localmente y como mecanismo de defensa, se constituye un foco inflamatorio, que al inicio es inespecífico. Desde este sitio, los bacilos libres o fagocitados por los macrófagos son transportados hacia los ganglios linfáticos regionales (hiliares y mediastinales); a veces supraclaviculares o retroperitoneales. Siguiendo el conducto torácico son vertidos en el torrente sanguíneo, con la consecuente siembra bacilar de los pulmones y de todo el resto del organismo. Algunos tejidos favorecen la retención y la multiplicación bacilar: ganglios, riñón, epífisis de huesos largos, cuerpos vertebrales, áreas meníngeas yuxta ependimarias adyacentes a los espacios subaracnoideos; pero fundamentalmente los segmentos ápicoposteriores de los pulmones. La consecuencia más importante de esta diseminación linfohemática es la siembra de dichos segmentos pulmonares, donde la enfermedad puede progresar sin interrupción o después de un período latente de meses o años. (Enciclopedia Médica) En los últimos años se ha observado un cambio en los patrones epidemiológicos y clínicos de la enfermedad tuberculosa. Al descender la prevalencia de la tuberculosis disminuyó el riesgo de exposición al bacilo tuberculoso y el riesgo de infección tuberculosa anual (RITA). Como consecuencia la tuberculosis se desplazó a edades más avanzadas, la primoinfección suele ser más tardía y las formas de reactivación se observan especialmente en adultos mayores (que son los infectados hace 50 años cuando el RITA era mayor y donde se ubica gran parte de la población de inmunodeprimidos por diversas causas). Otra consecuencia de la menor exposición al bacilo es el debilitamiento de las reacciones de hipersensibilidad y de resistencia (hecho observado en los adultos mayores). Esto se atribuye a la falta del reiterado estímulo antigénico dado por repetidos reencuentros con el germen, lo que resulta necesario para que ambas se mantengan. Al perder la inmunidad esta población se hace susceptible a la reinfección exógena lo que explicaría las formas atípicas de tuberculosis en el viejo, similares a la tuberculosis primaria del niño. 33 En lo que respecta a la presentación clínica de la enfermedad, en edades avanzadas de la vida la tuberculosis suele manifestarse bajo formas diferentes y más sutiles o enmascarada. (Jiménez María del Carmen 2001) II.1.4. Primo Infección Tuberculosa Constituye el resultado del primer contacto del organismo con el bacilo de Koch. Los bacilos que han llegado por vía aerógena anidarán en los alvéolos periféricos, muchas veces subpleurales, produciendo el denominado complejo primario de Ghon O imagen bipolar, constituido por un foco de alveolitis e hipertrofia ganglionar por afectación linfática. De dos a ocho semanas después del primer contacto el paciente desarrolla una hipersensibilidad de tipo celular que origina la reacción tuberculínica y una acción sobre el foco de alveolitis con reabsorción o caseosis y cavitación. El hecho de que la alveolitis inicial anide con frecuencia en los alvéolos subpleurales explica la pleuritis con derrame pleural que puede acompañar en algunos casos a la primo infección tuberculosa. Las manifestaciones clínicas son muy variadas, pueden pasar inadvertidas y traducirse solamente por el viraje de la reacción tuberculínica. En general se caracteriza por un cuadro tóxico febricular, tos seca o escasamente productiva. Respecto a las manifestaciones radiológicas, en la infancia suele predominar el componente ganglionar sobre el parenquimatoso, pudiendo producir incluso atelectasia por compresión (síndrome del lóbulo medio). En las personas jóvenes y los adultos suele predominar el componente parenquimatoso sobre el ganglionar. Se observan infiltrados, con o sin cavitación, de predominio en lóbulos inferiores. La evolución es en general benigna y un 20% de los casos curan espontáneamente. (Martínez L. de G. Fernando 2007) Antes de la introducción de la quimioterapia efectiva, la TB miliar era más frecuente en niños y se presentaba tras la primo infección. En la actualidad y en los países desarrollados ocurre con mayor frecuencia en adultos, fundamentalmente en inmunodeprimidos. Su clínica se caracteriza por un cuadro inespecífico e insidioso de afectación del estado general de dos a cuatro semanas de duración con fiebre irregular, sudores nocturnos, cefalea, astenia, anorexia y pérdida de peso. Posteriormente aparece sintomatología local por afectación pulmonar (75% de los casos), meníngea y menos frecuentemente: médula ósea, hígado, peritoneo, etc. Cuando afecta al pulmón puede ser un hallazgo subclínico que resulta de la exploración radiológica de un paciente afecto de síntomas generales, o bien manifestarse con disnea, tos seca y dolores torácicos vagos. La auscultación pulmonar suele ser normal. La radiología de tórax es muy sugestiva con una siembra difusa y simétrica de nódulos uniformes de 1-2 mm de diámetro. (Sánchez Hernández I.M. 1998) El curso que adopte la infección primaria depende de la magnitud del inóculo, del estado inmunitario del huésped y de factores locales. 34 Noventa y cinco por ciento de los infectados aparentemente curan, aunque suelen permanecer bacilos viables latentes. La curación se produce por involución, fibrosis, capsulación y calcificación. El 5% restantes (grandes inóculos, niños pequeños, inmunodeprimidos) desarrollan enfermedad tuberculosa siguiendo a una primo infección que no pudo ser controlada por el sistema inmunitario celular. El período de incubación es de 2 a 10 semanas. En la mayoría de los casos la primo infección cursa asintomática y el resultado positivo de la prueba tuberculínica es el único testigo de haberla padecido. Cuando la primo infección es patente (tuberculosis primaria) va acompañada de manifestaciones clínicas y radiológicas. Los síntomas son inespecíficos (tos, fiebre, malestar). Es frecuente que en el niño las adenopatías regionales adquieran gran tamaño, mayor que el foco pulmonar, mientras que habitualmente están radiológicamente ausentes en el adulto. Esas adenomegalias pueden comprimir la luz bronquial y ocasionar atelectasia del sector pulmonar correspondiente. El más afectado es el bronquio del lóbulo medio, por ser de menor calibre (síndrome del lóbulo medio). Durante esta etapa y asociado al comienzo de la hipersensibilidad tuberculínica, puede observarse el eritema nodoso o la queratoconjuntivitis flictenular; los que no se presentan en otros períodos de la enfermedad. El derrame pleural siguiendo a la tuberculosis primaria no es frecuente en niños. La evolución generalmente es benigna y un 20% curan espontáneamente. En raros casos (preferentemente niños, inmunodeprimidos o ancianos) el foco primario evoluciona a la constitución de un área neumónica con o sin cavitación. El diagnóstico de tuberculosis primaria es difícil porque las manifestaciones clínicas no son específicas, la prueba cutánea con PPD puede ser negativa, la imagen radiológica no es fácil de interpretar y es difícil encontrar el bacilo. En menos de la mitad de los casos se obtiene un cultivo positivo. El diagnóstico está especialmente orientado por la noción epidemiológica familiar. (Martínez, Fernando, 1968) Las secuelas son poco importantes si el tratamiento se inicia precozmente. Cuando el tratamiento se comienza estando la enfermedad más evolucionada, las secuelas son más frecuentes y severas: enfisema, fibrosis, bronquiectasias, cavidades residuales, las que pueden sobre infectarse. (Casal Román 1990, Diacon AH et al 2004, Salazar Lezama et al 1997, Ozakidetzal 2001, D. Ophanidum G et al 2000, Hirschom R 1980) 35 II.1.5. Hipersensibilidad e Inmunidad. Ante la presencia del bacilo la persona infectada instala progresivamente, en forma simultánea y en el curso de pocas semanas, las reacciones de hipersensibilidad de tipo retardado y de inmunidad de tipo celular. Ambos fenómenos están estrechamente relacionados, son el resultado de la activación específica de células T y modifican la reacción del huésped a la ulterior exposición al antígeno. Pero tienen consecuencias diferentes. La Hipersensibilidad de tipo retardado se mide por la prueba cutánea tuberculínica. Para realizarla se emplea el PPD (derivado proteico purificado) que se prepara con el filtrado de un cultivo de M. tuberculosis. En la cara anterior del antebrazo, se inyecta por vía intradérmica 0,1 ml de PPD, que equivalen a 5 UT (unidades de tuberculina). La lectura de la reacción se hace a las 48 - 72 horas de realizada, midiéndose la induración producida. Se considera positiva si su diámetro es de 10 mm o más, dudosa entre 5 y 10 mm (puede ser consecuencia de la vacunación con BCG o de la infección por otra Mycobacterias) y negativa si es menor. La reactividad aparece 3 a 6 semanas después de la infección e indirectamente marca el desarrollo de la inmunidad celular. La interpretación del resultado suele ser difícil y debe realizarse en el contexto de cada caso. La hipersensibilidad retardada no participa en el control de la infección y causa efectos nocivos como son la caseificación y consecuente cavitación. (Piedrula Gil 2000) El individuo virgen de infección tuberculosa carece de inmunidad natural frente al bacilo tuberculoso. La RESISTENCIA A LA INFECCIÓN se desarrolla por la presencia del bacilo y está condicionada por el cambio en el modo de reaccionar los macrófagos. La capacidad que adquirieran para controlar el crecimiento bacteriano determina la posterior evolución de la infección. Noventa por ciento de las personas infectadas, con inmunidad normal, controlan la infección tuberculosa gracias al desarrollo de la INMUNIDAD CELULAR, aunque algunos bacilos queden viables en los granulomas. Sólo un 10% desarrollarán enfermedad, la mitad en los 2 primeros años que siguen a la primoinfección y el otro 5%, años después. Cuando esto sucede hay que buscar alguna de las causa que deterioran el sistema inmune celular (infección VIH, diabetes, alcoholismo, mala alimentación, enfermedad debilitante, linfoma, neoplasia, administración de corticoides o drogas inmunosupresoras). La reacción inflamatoria tisular, que al comienzo era inespecífica, ahora se hace específica y se constituye el granuloma. Ésta es una reacción de mediación celular, cuya finalidad es “tabicar” al bacilo y evitar que la infección progrese. El granuloma está constituido por una corona de macrófagos, células epitelioides, células gigantes multinucleadas y linfocitos, rodeando la caseosis que no siempre está presente. El caseum es un medio no apropiado para el desarrollo del bacilo por la falta de oxígeno, su pH ácido y la existencia de ácidos grasos que inhiben el crecimiento bacteriano.( Piedrula Gil Gonzalo 2000 ) 36 II.1.6.Tuberculosis Extra Pulmonar. En la práctica totalidad de los casos de TB extra pulmonar existe un foco primario en el pulmón, que puede ser visible o no en la radiografía de tórax. Se admite que desde este foco primario pulmonar se puede producir una diseminación, bien por contigüidad, bien por vía linfática o por vía hematógena, siendo esta última vía la causante de la mayoría de las TB extra pulmonares a excepción de la pleural y la linfática. La casi totalidad de las TB extra pulmonares tienen baciloscopia negativa, por lo que su capacidad de contagio es, prácticamente nula. La afectación pleural por la TB es relativamente frecuente y, dado que sus aspectos clínicos y radiológicos se exponen en otro capítulo de este monográfico y que su tratamiento es similar al de la TB pulmonar, este trabajo se va a centrar en el resto de formas extrapulmonares de la tuberculosis.( P. Fanlo1, G. Tiberio, 2007) Cualquier órgano puede ser asiento de enfermedad tuberculosa. La localización extra pulmonar observada con mayor frecuencia es la ganglionar. Otras son: pleural, peritoneal, meníngea, pericárdica, ósea, renal, etc. (Salazar Lezama et al 1997, Ozakidetzal 2001) II.1.7. Pleuritis Tuberculosa. Muchas veces es la primera manifestación clínica de la enfermedad suele aparecer 3 a 12 meses después de la primoinfección. El mecanismo más frecuente es la invasión de la pleura visceral por microorganismos procedentes de un foco subpleural o un ganglio. En el niño es el foco subpleural de la primoinfección y en el adulto la reactivación de un foco latente. En menos de la tercera parte de los pacientes se observa radiológicamente el infiltrado subpleural. La reacción de hipersensibilidad explica la abundancia del derrame. El primer paso para identificar la enfermedad responsable del derrame pleural consiste en determinar si es un exudado o un trasudado (De Alonso, Miguel et al 1996) Una vez establecido el síndrome clínico de interposición líquida y corroborada por estudios imagenológicos sigue siendo la toracocentesis una técnica sencilla y útil que puede conducirnos al diagnóstico de, al menos, el 75 % de los pacientes con Derrame Pleural. La diferenciación entre ambos se realiza siguiendo los criterios de Light. (Ligth RW et al 1972) 37 El Líquido Exudado, es definido por el nivel de proteínas mayor al 50% de la sérica y el nivel de LDH mayor de 60%. El consumo de glucosa no es definitorio pues el nivel de la misma también está descendido en otras infecciones bacterianas, neoplasias y artritis reumatoide. La Adenosina De aminasa en el líquido está elevada en la tuberculosis, pero también lo está en otras condiciones. La biopsia pleural pone en evidencia la presencia de granulomas en 84% de pleuresía tuberculosas de pacientes VIH negativos, pero sólo en 44% de los coinfectados por VIH. La baciloscopía del esputo y del líquido pleural es poco rentable, por la escasez de bacilos en el parénquima y la pleura. La frecuente negatividad de la baciloscopía del esputo indica el bajo nivel de contagiosidad. El paciente sin evidencia de lesión parenquimatosa radiológica y sin tos se considera no infeccioso. (Martínez Ocaña I, et al 1983) II.1.8. Derrame Pleural Tuberculoso. El derrame pleural se define como la acumulación anormal de líquido en el espacio pleural. No se trata de una entidad patológica sino del resultado de un desequilibrio entre la formación del líquido pleural y su reabsorción. La mayoría de las veces es secundario a enfermedad pleural o pulmonar, pero puede ser causado por enfermedades extra pulmonares (cardiacas, hepáticas, renales, pancreáticas), sistémicas (LES, artritis reumatoidea) y neoplásicas (primarias, metastásicas). (Camacho Durán, Fidel, 2002) En niños y adultos jóvenes suele ser manifestación de la primo infección tuberculosa. El foco primario periférico subpleural se abre a la pleura produciendo una reacción inflamatoria exudativa con muy escasos gérmenes. En los pacientes seniles es casi siempre consecuencia de la reactivación de un foco subpleural antiguo, en fase de infección latente, o de la consecuente diseminación hematógena. La clínica se caracteriza por dos presentaciones típicas; una infrecuente con clínica aguda sugestiva de neumonía con fiebre y dolor en punta de costado; otra más frecuente y bifásica, con pródromos inespecíficos (en relación con la primo infección): astenia, anorexia y pérdida de peso, y dolor en punta de costado (agudo en la pleuritis seca y sordo con el derrame) con fiebre de 38 a 39 °C y disnea, si el derrame es copioso. La exploración física evidencia semiología de derrame pleural con matidez, disminución de las vibraciones vocales, hipofonesis y soplo pleural espirativo. Una vez establecido el síndrome clínico de interposición líquida y corroborada por estudios imagenológicos sigue siendo la toracocentesis una técnica sencilla y útil que puede conducirnos al diagnóstico de, al menos, el 75 % de los pacientes con derrame pleural. (Sahn SA 1988) El primer paso para identificar la enfermedad responsable del derrame pleural consiste en determinar si es un exudado o un trasudado. 38 II.1.8.1. Los Derrames Pleurales se dividen en Trasudados y Exudados. II.1.8.1.1. Trasudados son filtrados del plasma que resultan del aumento de la presión hidrostática, disminución de la presión oncótica y, en ocasiones, alteración de la permeabilidad capilar. Las causas más frecuentes de Trasudados, en su orden, son: • Insuficiencia cardiaca congestiva; • Síndrome nefrótico; • Cirrosis; • Sobrecarga de líquidos. II.1.8.1.2. Exudados son líquidos ricos en proteínas, resultado de la inflamación de la pleura, se producen por alteraciones de la permeabilidad capilar. Otra causa es la obstrucción del drenaje linfático. Las causas más frecuentes de Exudados son: • Infecciones; • Enfermedad maligna; Existen varios criterios para la diferenciación entre trasudados y exudados. Los más utilizados son los criterios de Light (con uno solo se hace el diagnóstico): 1. Relación proteínas Líquido Pleural / sérica >0,5. 2. Relación de deshidrogenasa láctica (LDH) pleural / sérica >0,6. 3. LDH pleural >2/3 límite superior de LDH normal en suero. Otros criterios útiles para el diagnóstico de exudado son: • Concentración de glucosa en líquido pleural <60 mg/dl, sugestivo de empiema; • Neoplasia; • Tuberculosis (TBC); • Lupus eritematoso sistémico (LES). Un valor de pH en el Líquido Pleural <7,3, se encuentra en las mismas condiciones patológicas que cursan con glucosa baja y en la ruptura esofágica. Se asocia, además, con una menor tasa de supervivencia en el caso de patología maligna y menor respuesta a la pleurodesis química. En cuanto al recuento y la diferenciación celulares, recuentos de leucocitos >10.000/mL se ven en exudados y >50.000/mL en el empiema. La linfocitosis es indicativa de TBC, enfermedad maligna, sarcoidosis y colagenosis. (Camacho Durán, Fidel, 2002) La neutrofilia predomina en neumonía, embolia y pancreatitis. La medición de triglicéridos es de utilidad siempre que se sospeche o se quiera descartar quilotórax, entidad en la cual se encuentran valores >110 mg/dL. 39 Cuando el valor de Adenosin deaminasa (ADA) sea >45 UI, el diagnóstico se inclina hacia TBC. Son criterios diagnósticos de por si solos, la presencia de material purulento o cultivo positivo para determinar empiema, y la citología positiva para determinar malignidad. Recuentos de eritrocitos >100.000 indican cáncer, trombo embolismo pulmonar o trauma. En presencia de valores elevados de amilasa se debe sospechar pancreatitis o perforación esofágica). (Camacho Durán, Fidel et al 2002) En cuanto a la relación colesterol pleural / colesterol sérico, el punto de corte se estableció en 0,3, con una sensibilidad del 97 % y una especificidad del 100 %. Otros autores han confirmado estos resultados. En pacientes con insuficiencia cardiaca de larga evolución, tratada con diuréticos, se pueden obtener valores de proteínas en el rango de exudado, por lo que en estos casos se recomienda determinar el gradiente de albúmina (albúmina en suero-albúmina en líquido pleural) 1,2 g/L para indicar exudado y mayor para indicar trasudado. Recientemente se confirmó la utilidad de este parámetro en pacientes con derrame pleural transudativo crónico. Una vez caracterizado el derrame pleural, el segundo paso consiste en precisar su causa. Para el diagnóstico etiológico debemos auxiliarnos de los métodos bioquímico, microbiológico y citológico, así como de otras técnicas diagnósticas: Biopsia pleural percutánea y la Toracoscopía. En el presente trabajo pretendemos revisar los marcadores bioquímicos de mayor utilidad en el momento actual para poder aproximarnos a un diagnóstico definitivo en estos pacientes. (Camacho Durán, Fidel et al 2002) II.1.9. Diagnóstico Bacteriológico de la Tuberculosis Para atacar el problema del diagnóstico de laboratorio de la tuberculosis u otras enfermedades micobacterianas se han utilizado dos enfoques: El enfoque directo involucra: 1. La detección de la micobacteria por microscopía o cultivo. 2. Técnicas Químicas de Diagnóstico: Detección de ácidos micólicos, de ácido tuberculoesteárico, de Adenosin Deaminasa (ADA) 3. Detección e identificación de antígenos micobacterianos. 4. Técnicas de biología molecular: sondas de ácidos nucleico marcadas con métodos radioactivos y no reactivos, reacción en cadena de la polimerasa. 40 El enfoque indirecto incluye la medida de la inmunidad del huésped contra la bacteria por: 1. Inmunidad humoral, a través de la detección de anticuerpos contra la bacteria. 2. Inmunidad celular, a través de pruebas cutáneas. II.1.9.1.Bacteriología: La bacteriología de la expectoración (BK) incluyendo las baciloscopías y los cultivos, puede ser positiva en alrededor del 90% de todas las formas de tuberculosis pulmonar que eliminan bacilos por el esputo. Con dos muestras de esputo pueden diagnosticarse, sólo con la baciloscopía, por lo menos en los países en desarrollo, más de 70% de los casos bacilíferos. Basta el agregado de un cultivo para aumentar el rendimiento por encina del 90%. Esto, que puede ser muy satisfactorio desde el punto de vista de los programas de localización de casos, resulta insuficiente en las tuberculosis menos avanzadas, que tienen lesiones cerradas y no eliminan bacilos tuberculosos por la expectoración o lo hacen en forma intermitente (Farga, V.1992). Casi todos los enfermos pueden producir alguna cantidad de expectoración para el examen bacteriológico. Es necesario instruir a los pacientes para obtener buenas muestras. Para evitar secreciones nasofaríngeas o saliva, hay que indicarles que hagan tres respiraciones profundas, seguidas de una fuerte inspiración y una tos profunda con inmediata expectoración en el recipiente toma-muestra (Schlossberg, D. 2000). Cuando no se consigue expectoración con estas maniobras, se puede recurrir otros procedimientos para obtener muestras de las secreciones bronquiales. El más antiguo y el más empleado en niños es el estudio del contenido gástrico, que debe ser hecho en ayunas y procesado de inmediato, razón por la cual tiene su mejor aplicación en el paciente hospitalizado, idealmente al lado de la cama del enfermo (deben extraerse unos 50 ml de jugo gástrico y cuando se prevea que habrá alguna demora en el manejo bacteriológico de la muestra, su pH se debe neutralizar de inmediato) ( Fishman, A.1998, Fraser, R. 1992, Schlossberg, D. 2009). En algunos medios se recurre al hisopado laríngeo o a la inducción de esputo mediante la nebulización de suero salino hipertónico. En este último caso, hay que advertir al laboratorio, ya que la expectoración inducida es bastante acuosa y no debe ser confundida con saliva (Schlossberg, D. 2000). 41 En esta era de medicina más agresiva, se está recurriendo cada vez con mayor frecuencia en casos especiales, a la fibrobroncoscopia, que permite obtener muestras de secreción bronquial por aspiración o a través de lavados bronquiales o bronco alveolares y, eventualmente, a biopsias de la mucosa bronquial o transbronquiales, para confirmar el diagnóstico La expectoración o cualquier otra muestra que se obtenga, debe recogerse en un frasco limpio y seco, provisto de una tapa a prueba de pérdidas y de una etiqueta para anotar la fecha y el nombre del enfermo. En el acto de tomar las muestras se producen aerosoles infectantes, de modo que es esencial tomar las medidas estándar para la protección del personal de salud. (Fishman, A.1998) II.1.9.2.Microscopía: La microscopía de la expectoración, empleando la tinción de Ziehl -Neelsen, permite observar los bacilos como bastoncillos ligeramente curvados, de color rojo sobre un fondo azul. Cuando deben leerse muchos exámenes resulta más conveniente la microscopia fluorescente. En este caso se utiliza auramina fenolada como colorante, con la cual los bacilos se tornan fluorescentes cuando se los expone a la luz ultravioleta, haciéndose fácilmente visibles. Se pueden emplear así objetivos que amplían considerablemente cada campo microscópico, lo que permite examinar un número de campos 15 veces mayor que con la tinción de Fiel-Neelsen. Desafortunadamente, estos microscopios son costosos y sólo se justifican en grandes laboratorios, cuando deben procesarse más de 50 muestras diarias (Schlossberg, D. 2000, Fishman, A.1998) La forma como se informa la baciloscopía varía en diferentes países. Se sabes que el número de bacilos no sólo se relaciona con la gravedad de la tuberculosis, sino con el grado de contagiosidad. Actualmente tendemos a seguir las recomendaciones de la Organización Panamericana de la Salud, que informa las baciloscopías en cruces en función del número de bacilos ácido alcohol resistente (BAAR): Negativa (-): No se encuentran BAAR en 100 campos observados Positiva (+): Menos de un BAAR por campo, en promedio, en 100 campos observados Positiva (++): Entre uno a diez BAAR por campo, en promedio. en 50 campos observados Positiva (+++): Más de 10 BAAR por campo, en 20 campos observados 42 En las baciloscopías que no son obviamente positivas, deben examinarse por lo menos 100 campos, siguiendo la metodología detallada en los manuales de bacteriología. En caso de duda, debe ampliarse la lectura a 200 campos o más, o hacer nuevos frotis de la misma muestra. Cuando en una lamina se observan sólo 1 a 3 BAAR por 100 campos, la muestra debe ser informada como negativa, en tanto no se confirme su positividad con nuevos extendidos, con nuevas muestras o con el cultivo (Schlossberg, D. 2000, Farga, V.1992). La microscopía, utilizando la técnica de coloración de Fiel–Neelsen, es rápida, económica y sencilla. La sensibilidad es baja, varía dependiendo del tipo de muestra y la micobacteria involucrada, ya que como regla deben existir entre cinco mil a diez mil bacilos por ml de expectoración para que tengan un 50% de posibilidades de ser detectados al microscopio; sólo cuando el número de bacilos alcanza a más de 100.000 por ml de expectoración, podemos esperar que las baciloscopías sean consistentemente Positivas. Utilizando la tinción fluorescente, este número puede ser tan bajo como 1.000 bacilos por ml (Schlossberg, D. 2000, Farga, V.1992). Los mejores resultados se obtienen con muestras respiratorias cargadas de M. tuberculosis. El rango de sensibilidad oscila entre 50-80% y la especificidad es virtualmente del 100%. Aunque la especificidad de la baciloscopía es vecina al 100%, se debe recordar el teorema de Bayes que dice que a medida que la prevalencia de una enfermedad disminuye, aumenta la proporción de exámenes falsos positivos asociados a ella. Una práctica común en los laboratorios bien equipados es la de concentrar las muestras clínicas por centrifugación, mejorando considerablemente la sensibilidad de la microscopía (Mioner H., Gebre N., Karlsson, 1994) La microscopía no identifica las especies micobacterianas. Por lo que se recomienda que el resultado de la microscopía sea confirmada por cultivo e identificación, cuando existe la posibilidad que la infección sea debida a otra micobacteria diferente al M. tuberculosis o cuando se requieren pruebas de sensibilidad hacia las drogas. II.1.9.3.Cultivo: El cultivo es una técnica que tiene mayor sensibilidad (70–90%), ya que basta que existan más de 10 bacilos/ ml, en muestras digeridas y concentradas, para que sea positivo. Recordemos que la baciloscopía sólo utiliza 0,001 ml de la muestra, efectuando un extendido de unos 10.000 campos microscópicos, de los cuales en el mejor de los casos, sólo se leen 100 a 200 campos; en cambio, los cultivos procesan 0,1 ml de expectoración (Farga, V.1992) 43 Es por esto que los cultivos son el método de elección para el diagnóstico de la tuberculosis en los países desarrollados; aun en los países en desarrollo, su implementación puede aumentar el rendimiento del diagnóstico bacteriológico hasta en un 20% o más (Farga, V. 1992, Rossman, Milton ,1996) En los medios de cultivo sólidos, como el de Löwenstein-Jensen, que es uno de los más usados en clínica, las colonias aparecen como rugosas, no pigmentadas, formando cordones. Es característico que los bacilos tuberculosos variedad humana tengan actividad catalasa débil, que desaparece al calentarlos a 68 grados C, y pruebas de niacina y de reducción de nitrato positivos. Esto permite diferenciarlos de las micobacterias atípicas o no tuberculosas. Por otra parte, los bacilos resistentes a la isoniacida generalmente son catalasa negativos (Farga, V. 1992) Los cultivos pueden ser persistentemente negativos en alrededor del 10% de los casos de tuberculosis pulmonar, aunque ésta sea tan severa como una diseminación miliar. Hay que tener presente que al procesar el esputo, los métodos de decontaminación, unos más que otros, son capaces de destruir gran cantidad de bacilos. Por otra parte, las lesiones con escasas poblaciones bacterianas no eliminan gérmenes todos los días ni en todas las expectoraciones. Así, para la confirmación del diagnóstico, en los casos sospechosos de tuberculosis, frecuentemente es necesario repetir los estudios bacteriológicos en días sucesivos. La incubación del inóculo en una atmósfera de 5 a 10% de anhídrido carbónico aumenta la positividad del examen (Rossman, Milton, 1996) Algunos autores informan como negativos los cultivos con menos de 5 colonias, por la mayor probabilidad de que representen contaminaciones u otros errores de laboratorio; pero la verdad es que no hay consenso sobre su verdadera significación. Parece razonable aceptar que un cultivo positivo aislado, con un numero bajo de colonias, en ausencia de otros elementos que hagan pensar en tuberculosis, no es suficiente para indicar un tratamiento potencialmente tóxico. Sólo la positividad de nuevas muestras, asociada a una cuidadosa evaluación clínica, podrán hacernos cambiar de criterio (Farga V, 1992. Fraser, R.1992) II.1.9.4.Medios de Cultivo: La práctica recomendada es cultivar tanto en medios sólidos y líquidos Medios sólidos incluyen medios basados en huevo tales como Löwenstein-Jensen, Coletsos, Ogawa Kudoh, medios basados en agar tales como Middlebrook 7H10. Medios líquidos incluyen caldo de Kirchner y caldo de Middlebrook 7H9. Sin embargo, aproximadamente el 70% de los laboratorios utilizan sólo los medios sólidos para el cultivo de micobacterias (Woods G.L., Witebsky F.G.1993) 44 El medio de Ogawa modificado por Kudoh, es más fácil de preparar que el Löwenstein-Jensen y es más económico ya que no contiene 1-asparagina, la cual es costosa y no está disponible en muchos países. El procedimiento de inoculación es simple, no requiere equipo especial y produce menos contaminación de los cultivos bajo condiciones desfavorables. Además la capacidad de amortiguación del medio hace posible inocular la muestra sin ajustar el pH (Kudoh S., Kudoh T. A 1974). El aislamiento de las Mycobacterias por cultivo es entorpecido por su lento crecimiento. Un promedio de incubación de 4 semanas en medios convencionales se requiere antes que pueda ser detectado crecimiento. Los métodos de identificación convencionales después del cultivo incluyen determinación de la velocidad de crecimiento, crecimiento a diferentes temperaturas, morfología de la colonia producción de pigmentos y susceptibilidad a los agentes. Utilizando los métodos convencionales, la identificación de las especies puede requerir 2 a 4 semanas adicionales (. Restrepo, Jorge. ,1998; Rossman, Milton. 1996). Se han hecho muchos intentos para mejorar los métodos de cultivo del bacilo tuberculoso, de modo que se pueda disponer de sus resultados en plazos más breves. Las técnicas más útiles a este respecto parecen ser las radiométricas, que permiten hacer el diagnóstico de muchas infecciones bacterianas en pocas horas y de la tuberculosis en pocos días. Además, tienen una mayor sensibilidad que los métodos bacteriológicos tradicionales (Farga, V, 1992). Existen otros métodos más rápidos: • El método radiométrico BACTEC, es un sistema automatizado que detecta CO2 (marcado con carbono 14) el cual es liberado por la micobacteria durante el metabolismo y descarboxilación del sustrato marcado con carbono 14 (1). Para el diagnóstico de la tuberculosis se emplean unos frascos pequeños que contienen medio de cultivo de Middlebrook enriquecido, rico en ácido palmítico marcado con carbono 14 (C14). El C14 es un isótopo radioactivo natural, que emite radiaciones beta, es decir electrones de muy baja frecuencia, inofensivos para el personal de laboratorio (Farga, V, 1992). En estos frascos se siembran las muestras a estudiar y si en ellos hay micobacterias vivas, al metabolizar éstas los ácidos grasos con C14, liberan el isótopo en forma de CO2, marcado con C14 al medio ambiente, desde donde es aspirado y llevado a una cámara de ionización y transformado en una corriente eléctrica proporcional a la cantidad de bacilos en crecimiento que haya en la muestra. Esta señal eléctrica se inscribe y se expresa como un “índice de crecimiento” (Farga, V, 1992. Rossman, Milton 1996). Se trata de un método automatizado, de alta sensibilidad y especificidad, que en forma simple permite hacer el diagnóstico de tuberculosis en menos de una semana ene. 95% de los casos (Schlossberg,D.2000) 45 Este mismo procedimiento sirve para conocer en pocos días la sensibilidad de las cepas en estudio. Las mismas botellitas se expenden con determinadas concentraciones de cada medicamento antituberculoso, de modo que la emisión de radioactividad desde un cultivo que contenga determinada droga, significa que el bacilo se está multiplicando en ese medio y, por lo tanto, que es resistente a ella (Schlossberg,D,2000) Esta técnica es tan versátil que permite hacer el diagnóstico diferencial entre las distintas especies micobacterianas. Así, las muestras pueden sembrarse en frascos que contienen aditivos que favorecen o impiden la multiplicación de las diferentes micobacterias facilitando su correcta tipificación. (Rossman, Milton 1996) Estos métodos diagnósticos han experimentado un renovado interés en esta época de SIDA porque facilitan la rápida diferenciación entre micobacterias tuberculosas y las micobacterias del complejo avium-intracellulare, de tan diferente significación pronóstica y terapéutica. (Rossman, Milton, 1996) Las Mycobacterias en las muestras clínicas pueden ser detectadas en la mitad del tiempo requerido por los métodos de cultivo convencionales en medios sólidos. Con este sistema, el número de cultivos positivos puede ser mayor que los cultivos convencionales en medios sólidos. El sistema BACTEC requiere gasto importante disponibilidad de desperdicios radioactivos, lo cual evita su uso en muchos laboratorios. El sistema Septi- Chek AFB, consiste en un caldo de Middlebrook 7H9 en fase líquida más tres medios sólidos, agar Middlebrook 7H11, medio de huevo modificado y agar chocolate. Aunque el sistema bifásico requiere más tiempo (aproximadamente 3 semanas) que el sistema BACTEC (aproximadamente 2 semanas), es comparable en términos de recuperación global (Sewell D.L., Rashad A.L., 1993). Este método es más económico que el BACTEC pero más costoso que el método convencional de cultivo. • La detección de micro colonias en medios sólidos es un nuevo enfoque para el aislamiento de micobacterias de muestras clínicas (Welch D.F., Guruswamy AP, Sides SJ, Shaw CH, Gilchrist MJR. 1993) • Se inoculan placas de agar y se vierten ligeramente en caldo de Middlebrook, posteriormente se examinan microscópicamente. La detección de micobacterias utilizando el método de micro colonias requiere alrededor de la mitad del tiempo necesitados por los métodos de cultivo convencional en medios sólidos, pero la recuperación de las micobacterias es menos eficiente que con los medios convencionales. Este método es más económico pero más laborioso. 46 • El sistema ESP Myco consiste en un frasco que contiene una modificación del caldo Middlebrook 7H9 y ácido oleico, albúmina, dextrosa y catalasas. Los frascos contienen el medio y una esponja de celulosa para incrementar la superficie de crecimiento. La tasa de aislamiento para M. tuberculosis es equivalente a la del sistema BACTEC. El sistema ESP es automático y mide cambios en la concentración de oxígeno (Schlossberg, D. 2000) • El sistema MB/Bac T Alert utiliza frascos con un medio modificado Middlebrook 7H9 mediante la adición de factores de crecimiento. Un sensor en la base de cada frasco permite detectar la producción de CO2 mediante colorimetría. Actualmente no hay estudios de comparación con otros sistemas. Los resultados indican que es comparable al BACTEC (Schlossberg, D. 2000) • El sistema de tubo MGIT, contiene un medio de base 7H9 enriquecido con antibióticos y con un indicador fluorescente en el fondo de cada tubo sensible al oxígeno. Al crecer la micobacteria y utilizar el oxígeno, el indicador es excitado tornándose fluorescente, lo cual puede visualizarse con el uso de luz ultravioleta. El tiempo de aislamiento es similar al BACTEC. Una ventaja en relación al BACTEC es la posibilidad de llevar a cabo la detección del organismo mediante sondas de ácidos nucleicos de manera directa. Hay riesgos de obtener resultados falsos positivos por errores en la lectura de los tubos, ya que depende de la experiencia del observador (Schlossberg, D. 2000) El diagnóstico bacteriológico de la tuberculosis, a través del cultivo, es altamente sensible y específico, pero requiere de varias semanas para su lectura y en casos en los que se requiera una toma de decisiones rápidas para instaurar una terapéutica efectiva (por ejemplo meningitis tuberculosa), su valor es muy limitado. Por lo tanto, el cultivo aumenta la sensibilidad diagnóstica a expensas de un mayor costo y de una demora de varias semanas en su informe. (Farga, V. 1992. Fishman, A 1998. Rossman, Milton 1996). Durante el último decenio la medicina y los organismos internacionales han tomado conciencia que para lograr la erradicación de la tuberculosis, es más importante mejorar los métodos diagnósticos que seguir haciendo énfasis en la búsqueda de nuevos medicamentos para perfeccionar el tratamiento de la enfermedad. Así, la introducción de una prueba diagnóstica simple, que permitiera la detección precoz de la tuberculosis, probablemente tendría un impacto fulminante en la lucha contra esta enfermedad mucho mayor que el descubrimiento de nuevas drogas (Farga, V. 1992). 47 De allí, que recientemente se hayan desarrollado pruebas diagnósticas muy sofisticadas y novedosas que permiten el diagnóstico de la enfermedad a nivel molecular (sondas de ácidos nucleicos, reacción en cadena de la polimerasa) con una gran sensibilidad, especificidad y en un corto tiempo. Desafortunadamente tales pruebas son costosas en su inicio, requieren de personal altamente calificado y su sensibilidad y especificidad son muy variables de uno a otro laboratorio. Por lo tanto no están disponibles en todos los países en vías de desarrollo. (Farga, V. 1992, Fishman, A 1998. Parsons, P. 1998. . Restrepo, Jorg 1998. Rossman, Milton 1996) II.1.10. Marcadores Bioquímicos. En los últimos años han aumentado los parámetros bioquímicos y marcadores biológicos que pueden determinarse en el líquido pleural, pero su utilidad diagnóstica es limitada. Por lo tanto, debe evitarse la solicitud indiscriminada de muchos parámetros para evitar gastos innecesarios y sobrecarga de trabajo al laboratorio. (Paiz Isidoro 1998) II.1.10.1. Proteínas. La determinación de la cifra de proteínas en líquido pleural es únicamente de utilidad para clasificar los derrames en exudados y trasudados, y no para el diagnóstico diferencial, pues varios procesos patológicos alteran su valor. (Camacho Duran 2002) II.1.10.2. Adenosìn De Aminasa (ADA) La Adenosin Deaminasa (ADA), es una enzima del catabolismo de las purinas que cataliza la Deaminación irreversible de adenosina y 2-deoxiadenosina a inosina y deoxiinosina respectivamente, liberando amonio en el proceso. La función fisiológica principal de la ADA, está relacionada con la proliferación y diferenciación linfocítica. Como marcador de inmunidad celular, su actividad se encuentra aumentada en aquellas enfermedades en las cuales la respuesta inmune esta mediada por células (Zavialov AV, et al 2005) (Kashyap RS, et al 2006). La ADA tiene dos isoenzimas ADA 1 y ADA 2: La ADA 1 se encuentra ampliamente distribuida, tiene un PH óptimo entre 7 y 7.5, actúa por igual sobre los sustratos adenosina y deoxiadenosina, regulando la inmunidad celular. La ADA 2 es menos ubicuo, coexiste con la ADA 1 únicamente en monocitos y macrófagos, tiene un PH óptimo de 6.5 y tiene una afinidad débil por la 2- deoxiadenosina. 48 Cuando los monocitos y macrófagos son infectados por micro organismos intracelulares, se incrementan los niveles de la ADA 2 y 2-deoxiadenosina, dirigidos contra estos microorganismos jugando un papel preponderante en la inmunidad celular. (Valdés San José 1996, Gakis C.1996) Se ha encontrado un aumento de la actividad de la ADA sérica en diferentes entidades: enfermedades hepáticas, tuberculosis (TB), fiebre tifoidea, mononucleosis infecciosa y ciertas neoplasias, especialmente de origen hematológico. Los mecanismos exactos de dicho aumento en suero no se conocen con exactitud (4). En pacientes con infección por VIH se han encontrado altos niveles de la ADA sérica, a expensas principalmente de la isoenzima ADA 2 (Tsubel I, Sagawa K, Shichijo S, 1995) Es una enzima derivada del metabolismo de las purinas que cataliza la desimanación de Adenosina a Inosina, predomina en el tejido linfoide, sobre todo en los linfocitos T. Se observa un incremento de los niveles de ADA en todos los procesos en los que la inmunidad celular está estimulada, por lo que se ha confirmado su utilidad en pleuresías tuberculosas. Niveles de ADA en líquido pleural entre 33 y 50 U/L tienen una sensibilidad del 100 % y una especificidad hasta del 97 %. Siempre deben tenerse presente otros procesos inmunológicos, linfo-proliferativos o neoplásicos, que pueden elevar los niveles de ADA (Camacho Duran 2002) Algunos autores consideran al ADA como un marcador de la inmunidad mediada por células, y aunque su actividad puede estar aumentada en empiemas y derrames causados por otras causas como linfomas, enfermedades autoinmunes, y lupus eritematoso sistémico, su indicación principal es en el diagnóstico de derrames tuberculosos. Hasta el momento la determinación de ADA no se realiza en nuestro medio, y por lo tanto no existe experiencia sobre su utilidad para acelerar y mejorar el diagnóstico de la tuberculosis extra pulmonar (Rojas Betha, YI Augusto, ACCINELLI Roberto 1993). Un papel de ADA es su rol en la diferenciación de las células linfoides y en la maduración de los macrófagos. La presencia de ADA en fluidos pleurales refleja una respuesta celular inmune y en particular la activación de linfocitos T. (Stiehm ER et al 1997, D Ophanidum et al 2000) El ADA cuenta con dos formas moleculares, las cuales tienen sus propias y particulares propiedades y han sido identificadas en los humanos. ADA1 y ADA2, cada isoforma está codificada por un diferente lugar en el mismo gen. ADA1 tiene su mayor actividad en linfocitos y ovocitos, mientras que ADA2 aparece originándose desde los monolitos. (Hirschom R et al 1980) 49 Se observa un incremento de los niveles de ADA en todos los procesos en los que la inmunidad celular está estimulada, por lo que se ha confirmado su utilidad en pleuresías tuberculosas. (Ocaña I et al 1983). Por otra parte, con una cifra inferior a 20 U/dl prácticamente se puede descartar una tuberculosis. Es importante recordar que mientras más sugerente de tuberculosis sea el cuadro clínico o menores sean las posibilidades de neoplasia, menor será el nivel de ADA que podremos considerar como un apoyo suficiente como para iniciar tratamiento, sin tener que recurrir a otros exámenes. (Garrido Villena et al 2004, García et al 2004, Isidoro A et al 1998) En algunos países se utiliza para establecer la actividad de la tuberculosis pulmonar y se le ha determinado como marcador evolutivo de la respuesta al tratamiento convencional de TB pulmonar. La infección TB aumenta la producción del ADA sérico y cuando la infección es tratada disminuye el valor sérico de la enzima", aunque no se sabe con seguridad cual es el mecanismo íntimo de esta reacción. (Abel mejía Varela et al 1998, Martínez Carlos et al 1998, D.Orphanidum et al 2000) I.1.10.3. Isozima (Muramidasa) Esta enzima sintetizada por los neutrófilos y las células del sistema mononuclear fagocítico, también se encuentra muy elevada en las pleuritis tuberculosas, es muy sugestiva de esta entidad una relación lisozima pleural/sérica > 1,2. También se han encontrado valores altos de lisozima en enfermos con empiema y artritis reumatoidea. Los últimos años se han caracterizado por la introducción en la práctica clínica de un considerable número de parámetros bioquímicos, algunos de los cuales han probado su utilidad en enfermedades o situaciones específicas, otros son poco sensibles o poco específicos y un grupo de ellos aun han de demostrar su utilidad. Los avances que se vienen produciendo en el campo de la biología molecular constituirán en un futuro no lejano un pilar importante en el diagnóstico y la atención clínica de los derrames pleurales. (Ocaña I et al 1983) II.1.10.4. Amilasa. La elevación de la amilasa en líquido pleural, por encima de valores séricos normales o un cociente líquido/plasma > 1,0 sugiere pancreatitis aguda, seudoquiste pancreático, ruptura esofágica, malignidad o ruptura de embarazo ectópico. La amilasa pleural en la ruptura esofágica es de origen salival. Un 10 % de las pleuresías malignas se asocian con niveles altos de amilasa y generalmente el sitio del tumor primario es pulmón y ovario, más que páncreas. Recientemente, se ha descrito elevación de la amilasa en los derrames pleurales de los heroinómanos. (Suñe Natalia 2000, Alfageme Michavila 2007) 50 II.1.10.5. Deshidrogenada Láctica. Su importancia radica en la separación de exudados y trasudados. No obstante, niveles muy altos se han asociado a derrames para neumónicos complicados, pleuresía reumática y paragonimiasis pleural. En cuanto al valor diagnóstico de la determinación de las isoenzimas de LDH, los estudios son contradictorios, aunque la LDH-5 parece ser más específica de pleuresía maligna. (Suñe Natalia 2000, Alfageme Michavila 2007) II.1.10.6. Glucosa. Su concentración en líquido pleural es similar a la plasmática, con un valor habitualmente mayor de 60 mg/dL, y generalmente en correlación con el nivel del pH del líquido pleural. Se observa disminución de los niveles de glucosa en líquido pleural en varios procesos como artritis reumatoide, empiema, derrame maligno, pleuresía tuberculosa, pleuritis lúpica y ruptura esofágica. Los valores más bajos, en ocasiones no detectables, se relacionan con la artritis reumatoide y los empiemas. (Suñe Natalia 2000, Alfageme Michavila 2007) II.1.10.7. pH La determinación del valor de pH en líquido pleural es muy útil en la evaluación de los derrames pleurales. En ausencia de acidosis sanguínea, el descenso del pH pleural se correlaciona, bien con la disminución de la glucosa o con el incremento de LDH. Tiene así una gran utilidad en el diagnóstico diferencial de los exudados, además permite estimar la evolución y el pronóstico del proceso subyacente.7 La acidosis del líquido pleural (pH<7,3) se ha encontrado en la ruptura esofágica (incidencia del 100 % después de 24 h, pH=6,00), empiema (pH=5,5-7,29), pleuresía reumática (pH=7,00) y con un pH entre 7,00 y 7,29 las pleuresías malignas, tuberculosas y lúpicas. Un pH pleural bajo tiene implicaciones diagnósticas, pronosticas y terapéuticas en los derrames para neumónicos y neoplásicos. En los primeros, un pH<7,10 asociado a glucosa menor de 40 mg/dL y LDH mayor de 1 000 U/L, es indicación de drenaje para su adecuada resolución.20, 27 En los segundos, un pH<7,3 predice una supervivencia corta, elevada rentabilidad de la biopsia pleural y la citología, y respuesta pobre a la pleurodesis química. (Suñe Natalia 2000, Alfageme Michavila 2007) 51 II.1.10.8. Triglicéridos. Los niveles de triglicéridos se han mostrado útiles en el diagnóstico de quilotórax. Actualmente se considera que una cifra de triglicéridos superior a 110 mg/dL es diagnóstica de quilotorax. Valores inferiores a 50 mg/dL lo descartan y cuando oscila entre 50-110 mg/dL es preciso recurrir a la demostración de quilo micrones mediante estudio electroforético, ya que su presencia es sinónimo de quilotórax. (Suñe Natalia 2000, Alfageme Michavila 2007) II.1.10.9. Creatinina. La elevación de creatinina en líquido pleural puede ser útil en el diagnóstico de urinotórax (acumulación de orina en el espacio pleural asociada a uropatía obstructiva). El diagnóstico se confirma cuando el cociente de creatinina de líquido pleural/suero. (Ligth RW 1972). II.1.10.10. Ácido Hialurónico. Su elevación en líquido pleural por encima de 100 mg/L es muy sugestiva de mesotelioma, aunque algunos derrames benignos han mostrado niveles altos del mismo. El hecho de que se haya comprobado que todos los líquidos pleurales con ácido hialurónico elevado son viscosos, ha relegado un tanto su determinación, por demás compleja y poco sensible. (Suñe Natalia 2000, Alfageme Michavila 2007) II.1.11. Marcadores Inmulógicos. II.1.11.1. Factor Reumatoideo. Su indicación debe responder a la sospecha clínica de pleuritis secundaria a artritis reumatoidea, entonces debemos obtener títulos iguales o mayores al nivel del suero, en un rango > 1:320. Títulos inferiores pueden corresponder a derrames para neumónicos o malignos. (Suñe Natalia 2000, Alfageme Michavila 2007) 52 II.1.11.2. Anticuerpos Antinucleares. Los títulos > 1:160 (o una relación entre líquido pleural y suero superior a 1), son sugestivos de derrames pleurales reumatoideos y lúpicos, respectivamente. (Suñe Natalia 2000, Alfageme Michavila 2007) II.1.12. Marcadores Tumorales. Constituyen uno de los parámetros más estudiados en los últimos años, pero los resultados contradictorios en su aplicación, han limitado su utilidad en la práctica clínica, por lo que no han podido desplazar a la citología y/o la histología. Uno de los más estudiados ha sido el antígeno carcinoembrionario (CEA), de particular valor en el diagnóstico de los adenocarcinomas, sobre todo de pulmón, mama y tracto gastrointestinal si el nivel de CEA es > 12 ng/mL. Otros marcadores como orosomucoide, antígeno hístico polipeptídico, fosfohexosaisomerasa, alfafetoproteína, enolasa neuroespecífica, factor de crecimiento derivado de las plaquetas, mucina, anticuerpos monoclonales y muchos otros no han demostrado aún un valor significativo en el diagnóstico de derrames tumorales. (Suñe Natalia 2000, Alfageme Michavila 2007) 53 PARTE III III.1. Resultados. De las 215 muestras procesadas en las Instalaciones de los laboratorios de IIQBB de la UMG, tomadas en los Hospitales san Juan de Dios, Roosevelt y Sana torio San Vicente, provenientes de pacientes que acudieron con Derrame Plural, se obtuvieron los siguientes resultados: III.1.1.De las 215 muestras 111 pertenecieron al sexo femenino y 104 al sexo masculino. (Cuadro # 4) Cuadro # 4. Procedencia de la Muestra, según tipo de Género de Paciente. Tipo de Género del Paciente Femeninas Masculinos Gran Total Total de Muestras 111 104 215 Fuente: FODECYT 064-2006 III.1.2.Con respecto al aspecto de los Líquidos Pleurales, los de mayor porcentaje fueron los Turbios, con un 55.80 %, y los Ligeramente Turbios con un 23.30 %.y en menor porcentaje (0.5 %) los Muy turbio. (Cuadro # 5) Cuadro # 5. Aspecto de los Líquidos Pleurales. Aspecto Turbio Ligeramente Turbio Otros Límpido Hemorrágico Con fibrina Muy turbio Total No. 120 50 21 16 6 1 1 215 Fuente: FODECYT 064-2006 54 % 55.80% 23.30% 9.80% 7.40% 2.80% 0.50% 0.50% 100.00% III.1.3. Con respecto al Color de los Líquidos Pleurales, el de mayor porcentaje fue el Amarillo, con un porcentaje de 52.60 %, en segundo lugar con un 29.80% los Rojizos. (Cuadro # 6). Cuadro # 6. Color de los Líquidos Pleurales. Color No. % Amarillo Rojizo Otros Ámbar Café Incoloro Verde 113 64 20 5 3 3 3 52.60% 29.80% 9.30% 2.30% 1.40% 1.40% 1.40% Blanquecino Grisáceo Marrón Rosado Total 1 1 1 1 215 0.50% 0.50% 0.50% 0.50% 100.00% Fuente: FODECYT 064-2006 III.1.4. Del total de muestras 215, se obtuvieron 6 Cultivos Positivos y estos mismos fueron Positivos a la identificación para M. tuberculosis (Cuadro # 7 y 8). Cuadro # 7. Resultado de Cultivo de los Líquidos Pleurales. Cultivo No. Positivo 6 % 2.79% Negativo 209 97.21% Total 215 100.0% Fuente: FODECYT 064-2006 55 Cuadro # 8. Resultado de la Identificación de Cepas de Mycobacterium aisladas. No. de Cepas aisladas por Cultivo Resultado Test de producción de Niacina Resultado Test de Reducción de Nitratos 6 Positivas Positivas Cepa confirmada de M. tuberculosis M. tuberculosis Fuente: FODECYT 064-2006 III.1.5. Todas las muestras dieron resultado negativo para BAAR con la tinción de Ziehl Neelsen. (Cuadro # 9) Cuadro # 9. Resultado de los Frotis (BK) en pacientes con Derrame Pleural BK Negativo Total No. % % acumulado 215 100.0% 100.0% 215 100.0% 100.0% Fuente: FODECYT 064-2006 56 III.1.6. De las 17 etiologías más frecuentes de los derrame Pleural, para los pacientes que acudieron a los Hospitales fueron, entre ellas: Neumonía con un 14.00 %, Neoplasias con un 11.20 %, Tuberculosis 8.80% y Tuberculosis y Cáncer 0.50%. (Cuadro # 10) Cuadro # 10. Diagnósticos principales de los Pacientes con derrame Pleural. % DX. / GRUPO Sin acceso a información Neumonía Neoplasia TB Derrame Problema cardiaco VIH-SIDA Insuficiencia Renal Crónica Herida / Arma de fuego Paquipleuritis Proceso Inflamatorio Absceso EPOC. Hipocalemia Lupus Eritematoso Pseudo linfoma TB y Cáncer Trauma hepático Total No. 95 30 24 19 15 6 6 5 4 2 2 1 1 1 1 1 1 1 215 44.20% 14.00% 11.20% 8.80% 7.00% 2.80% 2.80% 2.30% 1.90% 0.90% 0.90% 0.50% 0.50% 0.50% 0.50% 0.50% 0.50% 0.50% 100.00% Fuente: FODECYT 064-2006 III.1.7. Según reporte de los Hospitales, únicamente a 39 pacientes se les efectuó la prueba de VIH, siendo 14 de ellos Positivos, 25 negativos y 176 que no reportaron el resultado. (Cuadro #11) Cuadro # 11. Resultado de la Prueba VIH – SIDA de pacientes con Derrame Pleural VIH-SIDA No. Positivo 14 % 6.5% % acumulado 6.5% Negativo 25 11.6% 18.1% No reporta 176 81.9% 100.0% Total 215 100.0% 100.0% Fuente: FODECYT 064-2006 57 III.1.8. Tomando como base los Criterios de Light, para la clasificación de Líquidos Pleurales como Exudados, se obtuvieron únicamente 22 muestras, Verdaderamente como Exudados. Así mismo tomando en cuenta los Criterios de Light Modificados de Porcel JN, 2006, se obtuvieron: 106 muestras, (Cuadro # 12) Cuadro # 12. Criterios de LIGTH, para Clasificación de Líquidos Pleurales como Exudados CRITERIOS Criterio de Light Criterio de Light Modificado Criterio de Light Modificado Criterio de Light Modificado Criterio de Light Modificado Criterio de Light Modificado Glucosa < 60 mgr/dl Positiva para este valor Negativa para este valor Negativa para este valor Positiva para este valor Negativa para este valor Positiva para este valor Proteína Total > 3 gr/dl Positiva para este valor LDH >200 U/L Positiva para este valor Positiva para este valor Negativa para este valor 106 Muestras Negativa para este valor Positiva para este valor 106 Muestras Negativa para este valor Negativa para este valor 69 Muestras Positiva para este valor Positiva para este valor 66 Muestras Positiva para este valor Negativa para este valor Fuente: FODECYT 064-2006 58 TOTAL 22 Muestras 34 Muestras III.1.9. De los Síntomas que aducía el paciente y se registraron, fueron los siguientes: 1er. Lugar: Disnea ,2do.Lugar: Expectoración ,3er.Lugar: Dolor Toráxico y 4to Lugar: Tos (Gráfica # 1) Gràfica # 1. Síntomas que presentaron los pacientes que ingresaron al estudio Fuente: FODECYT 064-2006 III.1.10. De las 106 muestras consideradas como Exudados (en base al criterio de Light Modificado de Porcel JN, 2006) 52 pertenecieron al Sexo Femenino y 54 al Sexo Masculino. (Cuadro # 13) Cuadro # 13. Procedencia de Líquido Pleural, como Exudado Según Género del Paciente. Tipo de Género del Paciente Total de Muestras Femeninas 52 Masculinos 54 Gran Total 106 Fuente: FODECYT 064-2006 59 III.1.11. Con respecto al aspecto de los Exudados, los de mayor porcentaje fueron los Turbios, con un 63.20 %, y los Ligeramente Turbios con un 25.47%.y en menor Porcentaje 2.83 % los Hemorrágico (Cuadro # 14) Cuadro # 14. Aspecto del Líquido Pleural, como Exudado. Aspecto Turbio Ligeramente Turbio Límpido No. 67 27 9 % 63.20% 25.47% 8.50% Hemorrágico Total 3 106 2.83% 100.00% Fuente: FODECYT 064-2006 III.1.12. El color de los Líquidos Pleurales, de mayor porcentaje fue el Amarillo, con un porcentaje de 54.71 %, en segundo lugar con un 33.01 % los Rojizos y en menor porcentaje 0.94 % los Verdes. (Cuadro # 15). Cuadro # 15. Color del Líquido Pleural, como Exudado. Color Amarillo Rojizo Ámbar Café Incoloro Amarillo Pálido Grisáceo Marrón Rosado Verde Total No. 58 35 3 3 2 1 1 1 1 1 106 Fuente: FODECYT 064-2006 60 % 54.71% 33.01% 2.83% 2.83% 1.88% 0.94% 0.94% 0.94% 0.94% 0.94% 100.00% III.1.13. Del total de muestras 106 como Exudados, se obtuvieron 4 Cultivo Positivo y éstos mismos dieron identificación positiva a M. tuberculosis (Cuadro # 16 y 17). Cuadro # 16. Resultado de cultivo, de Líquido Pleural, como Exudado. Cultivo Positivo Negativo Total No. 4 102 106 % 3.77 % 96.23 % 100.00% Fuente: FODECYT 064-2006 Cuadro # 17. Resultado de Identificación de cepas de Mycobacterium aislada No. de Cepas aisladas por Cultivo 4 Resultado Test de producción de Niacina Resultado Test de Reducción de Nitratos Positivas Positivas Cepa confirmada de M. tuberculosis M. tuberculosis Fuente: FODECYT 064-2006 III.1.14. Todas las muestras de Exudado, dieron resultado negativo para BAAR con la Tinción de Ziehl Neelsen. (Cuadro # 18) Cuadro # 18. Resultados de Frotis (BK) de Líquidos Pleurales, como Exudados. BK Negativo Total No. % % acumulado 106 100.0% 100.0% 106 100.0% 100.0% Fuente: FODECYT 064-2006 61 III.1.15. De las 11 etiologías más frecuentes de los Exudados, para los pacientes que acudieron a los Hospitales fueron, entre ellas: Neoplasias con un 14.15 %, Neumonía con un 13.20 %, Tuberculosis 13.20 % y Tuberculosis y Cáncer 0.94 % (Cuadro # 19). Cuadro # 19. Diagnósticos Agrupados, para pacientes con Líquidos Pleurales, como Exudados. DX agrupado Sin diagnóstico final Neoplasias Neumonía TB(Tuberculosis) Derrame Problema cardiaco Insuficiencia Renal Crónica No. 43 15 14 14 9 4 % 40.56% 14.15% 13.20% 13.20% 8.49% 3.77% 2 1.88% 1 0.94% 1 1 1 1 106 0.94% 0.94% 0.94% 0.94% 100.00% Absceso Paquipleuritis Proceso Inflamatorio TB y Cáncer VIH-SIDA Total Fuente: FODECYT 064-2006 III.1.16. Según reporte de los Hospitales, para los Exudados, únicamente a 19 pacientes se les efectuó la prueba de VIH, siendo 6 de ellos Positivos, 13 negativos y 87 que no reportaron el resultado. (Cuadro # 20) Cuadro # 20. Resultado de VIH-SIDA de pacientes con Líquido Pleural, como Exudado. VIH-SIDA Positivo Negativo Sin reporte Total No. 6 13 87 106 Fuente: FODECYT 064-2006 62 % 5.66% 12.26% 82.07% 100.00% III.1.17. Al tener analizar las 215 muestras como Líquidos Pleurales, con respecto a los valores de ADA obtenidos, se encontró: a) 156 Paciente con el valor de ADA <34 U/L b) 47 Pacientes entre el valor del rango para ADA de >34 U/L a 90 U/L c) 12 Pacientes con el valor de ADA >90 U/L. (Diagrama “A”) DIAGRAMA "A" PARA 215 PACIENTES Valores de ADA Pacientes < 34 U/L m RANGO (>de 34U/Lm a 90U/L m ) 156 Pacientes Casos Pacientes Casos TB + = 6 C+ = 1 47 TB - = 150 C-=5 C+ = 1 12 Casos TB + = 12 C+ = 1 > 90 U/L m TB - = 35 C - = 11 C - = 149 C+ = 0 C+ = 3 63 TB + = 2 C - = 32 TB - = 10 C-=2 C+ = 0 C - = 10 III.1.18. De los 215 pacientes que presentaron Derrame Pleural, y que su valor de ADA se encuentra fuera del rango positivo (>34 U/L a 90 U/L,) se pudieron identificar varios de los diagnósticos que no son Tuberculosis, como por ejemplo: Neumonías, Neoplasias, Infección Renal Crónica, Insuficiencia Cardiaca, Derrame General y Herida de Arma de Fuego (Tablas # 1, 3, 5, 7, 9,11 y 13) Tabla # 1. Casos diagnosticados como Neumonía CASOS 215 Pacientes Neumonía = 30 Casos < 34 U/L >90 U/L RANGO (>de 34 U/L a 90 U/L ) TOTAL 18 4 8 30 Porcentaje 60.00% 13.30% 26.70% 100.00% Fuente: FODECYT 064-2006 Tabla # 3. Casos diagnosticados como Cáncer CASOS 215 Pacientes Cáncer= 24 Casos < 34 U/L >90 U/L RANGO (>de 34 U/L a 90 U/L ) TOTAL Fuente: FODECYT 064-2006 64 21 3 0 24 Porcentaje 87.50% 12.50% 0.00% 100.00% Tabla # 5. Casos diagnosticados como Insuficiencia Respiratoria Crónica CASOS 215 Pacientes Insuficiencia Respiratoria Crónica= 5 Casos Porcentaje < 34 U/L 4 80.00% >90 U/L 1 20.00% 0 0.00% RANGO (>de 34 U/L a 90 U/L ) TOTAL 5 100.00% Fuente: FODECYT 064-2006 Tabla # 7. Casos diagnosticados como Insuficiencia Cardiaca. CASOS 215 Pacientes Insuficiencia Cardiaca= 4 Casos < 34 U/L >90 U/L RANGO (>de 34 U/L a 90 U/L ) TOTAL 4 0 0 4 Porcentaje 100.00% 0.00% 0.00% 100.00% Fuente: FODECYT 064-2006 Tabla # 9 Casos diagnosticados como derrame. CASOS 215 Pacientes Derrame= 15 Casos < 34 U/L >90 U/L RANGO (>de 34 U/L a 90U/L ) TOTAL Fuente: FODECYT 064-2006 65 11 2 2 15 Porcentaje 73.40% 13.30% 13.30% 100.00% Tabla # 11 Casos diagnosticados como Proceso Inflamatorio. CASOS 215 Pacientes Proceso Inflamatorio = 2 Casos < 34 U/L >90 U/L RANGO (>de 34 U/L a 90 U/L ) TOTAL 1 0 1 2 Porcentaje 50.00% 0.00% 50.00% 100.00% Fuente: FODECYT 064-2006 Tabla # 13. Casos diagnosticados como Herida de Arma de Fuego. CASOS 215 Pacientes Herida con Arma de Fuego= 4 Casos < 34 U/L >90 U/L RANGO (>de 34 U/L a 90 U/L ) TOTAL Fuente: FODECYT 064-2006 66 4 0 0 4 Porcentaje 100.00% 0.00% 0.00% 100.00% III.1.19. De los 215 pacientes que presentaron Derrame Pleural, se relaciono la información según el Teorema de Bayes, el estándar de Oro (Caso TB según diagnóstico médico) versus resultado Positivo de ADA, se obtuvieron los siguientes resultados. a) Sensibilidad del 60 % b) Especificidad del 82.05 % c) Valor predictivo Positivo del 25.53 % d) Valor Predictivo Negativo del 94.24 % e) Certeza del 80.00 % (Tablas # 15) TABLA # 15 T eorema de Bayes: R elaciòn E standar de O ro Versus R esultado Determinacion de ADA. CARACTERISTICAS DE PACIENTES No. de P acientes que participaron. ( Dx T B. versus ADA) No. 215 ADA + 47 ADA+T B+ 12 ADA + TB 35 ADA 168 E standar de Oro Dx T B. C línico 1 ADA P ositivo P ositivo 12 Negativo 8 Total 20 S ensibilidad 0,60 E specificidad 0,82 P revalencia 0,06 VP P 0,26 VPN 0,95 C erteza 0,80 R azon de P de Test +-0,22 R azon de p de T est - 0,49 Negativo 35 160 195 60,00 82,05 5,89 25,53 95,24 80,00 -22,05 48,75 67 Total 47 168 215 ADA - TB + ADA - T B - Dx de T B + 8 160 20 Dx T B 195 III.1.20. De los 215 pacientes que presentaron Derrame Pleural, y relacionando la información según el Teorema de Bayes, el estándar de Oro (Caso Cultivo Positivo) versus resultado de ADA Positivo, se obtuvieron los siguientes resultados: a) Sensibilidad del 66.67 b) b) Especificidad del 79.43 % c) Valor Predictivo Positivo del 8.51 % d) Valor Predictivo Negativo del 98.81 % e) Certeza del 77.67 % (Tablas # 16) TAB L A # 16 Teorema de B ayes: R elación C ultivo versus r R s ultado y Determinación de ADA. CARACTERISTICAS DE PACIENTES 2 No. de P acientes con C ultivo.( Dx de C ultivo vers us AD A) No. 215 ADA + 47 ADA+C lt+ 4 ADA+C ult43 ADA 168 E standar de O ro C ultivo 2 ADA P ositivo Negativo Total P ositivo 4 43 47 Negativo 2 166 168 Total 6 209 215 S ens ibilidad 0,67 66,67 E specificidad 0,79 79,43 P revalencia 0,02 1,89 VP P 0,09 8,51 VP N 0,99 98,81 C erteza 0,79 79,07 R azon de P de T es t + -0,13 -12,76 R azon de p de T es t - 0,42 41,97 5 de 9 tienen s angre 485 68 ADA-C ult+ 2 ADA-C ult166 Dx. C ult+ 6 Dx C ult 209 III.1.21. Con respecto a los resultados obtenidos para ADA, en los Líquidos Pleurales de 215 pacientes, se obtuvo mayor número de casos positivos a Tuberculosis, con relación a los otros dos tipos prueba empleados, y no mostró diferencia significativa entre pacientes por Género. (Cuadro 21 y 22) Cuadro # 21. Resultados de ADA en Líquidos Pleurales y su relación con Tipo de Prueba para confirmación de diagnóstico Positivo a Tuberculosis, en pacientes de Género Femenino. Tipo de Valor ADA Valor ADA Valor ADA TOTAL Prueba < de 34 U/L > de 34 U/L a >de 90 U/L Diagnóstica (Negativo para 90 U/L ( Negativo Para el TB) (Positivo para para TB) paciente TB) Clínica 5 3 1 9 positiva a Tuberculosis Cultivo positivo para Tuberculosis 1 3 0 4 Determinación de ADA 81 23 7 111 Fuente: FODECYT 064-2006 Cuadro # 22. Resultados de ADA en Líquidos Pleurales y su relación con Tipo de Prueba para confirmación de diagnóstico Positivo a Tuberculosis, en pacientes de Género Masculino. Valor ADA TOTAL Tipo de Valor ADA Valor ADA >de 90 U/L Prueba < de 34 U/L > de 34 U/L a ( Negativo Diagnóstica (Negativo para 90 U/L Para el TB) (Positivo para para TB) paciente TB) Clínica 1 9 1 11 positiva a Tuberculosis Cultivo positivo para Tuberculosis 1 1 0 2 Determinación de ADA 75 24 5 104 Fuente: FODECYT 064-2006 69 III.1.22. De los 106 pacientes que presentaron Líquido Pleural como Exudados, con respecto a los valores de ADA obtenidos, se encontró: a) 70 Paciente con el valor de ADA <34 U/L b) 31 Pacientes entre el valor del rango para ADA de >34 U/L a 90 U/L c) 5 Pacientes con el valor de ADA >90 U/L. (Diagrama “B” ) DIAGRAMA "B" PARA 106 PACIENTES Valores de ADA Pacientes < 34 U/L m RANGO (>de 34U/Lm a 90U/L m ) Pacientes 70 Casos C+ = 1 Pacientes 31 Casos TB + = 3 TB - = 67 C-=2 C+ = 1 C - = 66 5 Casos TB + = 11 C+ = 2 > 90 U/L m TB - = 20 C-=9 TB + = 1 C+ = 0 C+ = 0 70 C - = 20 TB - = 4 C-=1 C+ = 0 C-=4 III.1.23. De los 106 pacientes que presentaron Líquido Pleural como Exudado, y con el valor de ADA fuera del rango positivo (>34U/L a 90U/L), se pudieron identificar varios de los diagnósticos que no son Tuberculosis, como por ejemplo: Neumonías, Neoplasias, Infección Renal Crónica, Insuficiencia Cardiaca, Derrame General y Herida de Arma de Fuego. (Tablas # 2, 4, 6, 8, 10,12 y 14) Tabla # 2. Casos diagnosticados como Neumonías, en Derrames Pleurales, como Exudados. CASOS 106 Pacientes Neumonía = 14 Casos < 34 U/L >90 U/L RANGO (>de 34 U/L a 90 U/L ) TOTAL 8 1 5 14 Porcentaje 57.00% 7.00% 36.00% 100.00% Fuente: FODECYT 064-2006 Tabla # 4. Casos diagnosticados como Cáncer, en Derrames Pleurales, como Exudados. CASOS 106 Pacientes Cáncer= 15 Casos < 34 U/L >90 U/L RANGO (>de 34 U/L a 90 U/L ) TOTAL Fuente: FODECYT 064-2006 71 13 0 2 15 Porcentaje 86.70% 0.00% 13.30% 100.00% Tabla # 6. Casos diagnosticados como Insuficiencia Respiratoria Crónica, como Exudados. CASOS 106 Pacientes Insuficiencia Respiratoria Crónica= 2 Casos Porcentaje < 34 U/L 2 100.00% >90 U/L 0 0.00% 0 0.00% RANGO (>de 34 U/L a 90 U/L ) TOTAL 2 100.00% Fuente: FODECYT 064-2006 Tabla # 8. Casos diagnosticados como Insuficiencia Cardiaca, como Exudados. CASOS 106 Pacientes Insuficiencia Cardiaca= 6 Casos < 34 U/L >90 U/L RANGO (>de 34 U/L a 90 U/L ) TOTAL Fuente: FODECYT 064-2006 72 6 0 0 6 Porcentaje 100.00% 0.00% 0.00% 100.00% Tabla # 10. Casos diagnosticados como Derrame, como Exudados. CASOS 106 Pacientes Derrame = 9 Casos < 34 U/L >90 U/L RANGO (>de 34 U/L a 90 U/L ) TOTAL 6 1 2 9 Porcentaje 66.70% 11.10% 22.20% 100.00% Fuente: FODECYT 064-2006 Tabla # 12. Casos diagnosticados como Proceso Inflamatorio, como Exudados. CASOS 106 Pacientes Proceso Inflamatorio = 1 Caso < 34 U/L >90 U/L RANGO (>de 34 U/L a 90U/L ) TOTAL 1 0 0 1 Porcentaje 100.00% 0.00% 0.00% 100.00% Fuente: FODECYT 064-2006 Tabla # 14. Casos diagnosticados como Herida de Arma de Fuego, como exudado. CASOS 106Pacientes Herida con Arma de Fuego= 0 Casos < 34 U/L >90 U/L RANGO (>de 34 U/L a 90 U/L ) TOTAL Fuente: FODECYT 064-2006 73 0 0 0 0 Porcentaje 0.00% 0.00% 0.00% 0.00% III.1.24. De los 106 pacientes que presentaron Líquido Pleural como Exudado, y relacionando la información según el Teorema de Bayes, el estándar de Oro (Caso TB según diagnóstico médico) versus resultado Positivo de ADA, se obtuvieron los siguientes resultados. a) Sensibilidad del 73.33 b) Especificidad del 78.02 % c) Valor predictivo Positivo del 35.48 % d) Valor Predictivo Negativo del 94.67 % e) Certeza del 77.36 % (Tablas # 17) Tabla 17. TAB L A # 17 C AR AC T E R IS T IC AS DE P AC IE NT E S 4 No.de P acientes requisitos de E xudado sólo P roteína.( Dx T B . versus ADA) Teorema de Bayes: Relación Estándar de Oro Versus Resultado Determinación de ADA (Exudado) No. 106 ADA + 31 ADA+T B + 11 ADA + T B 20 ADA 75 E stándar de oro Dx T B. C línico 4 ADA P ositivo P ositivo 11 Negativo 4 T otal 15 S ensibilidad 0,73 E specificidad 0,78 P revalencia 0,12 VP P 0,35 VP N 0,95 C erteza 0,77 R azón de P de T est +-0,05 R azón de p de T est - 0,34 74 Negativo 20 71 91 73,33 78,02 11,53 35,48 94,67 77,36 -4,69 34,18 T otal 31 75 106 ADA - T B + ADA - T B - Dx de T B + 4 71 15 Dx T B 91 III.1.25. De los 106 pacientes que presentaron Líquido Pleural como Exudado, y relacionando la información según el teorema de Bayes, el estándar de Oro (Caso Cultivo Positivo) versus resultado de ADA Positivo, se obtuvieron los siguientes resultados: a) Sensibilidad del 50.00 % b) Especificidad del 71.57 % c) Valor Predictivo Positivo del 6.45 % d) Valor Predictivo Negativo del 97.33 % e) Certeza del 68.87 % (Tablas # 18) TA B L A # 18 Teorema de Bayes: Relación Cultivo resultado determinación de ADA.(Exudado) C AR AC T E R IS T IC AS DE P AC IE NT E S No. 5 No.de P acientes requis itos 106 de E xudado s ólo P roteína.( Dx T b. vers us C ultivo) ADA + 31 ADA+ C lt+ 2 ADA+C ult29 ADA 75 E s tándar de oro C ultivo 5 ADA P os itivo P os itivo 2 Negativo 2 T otal 4 S ens ibilidad 0,50 E s pecificidad 0,72 P revalencia 0,02 VP P 0,06 VPN 0,97 C erteza 0,71 R azón de P de T es t +-0,22 R azón de p de T es t - 0,70 Negativo 29 73 102 50,00 71,57 1,90 6,45 97,33 70,75 -21,57 69,86 75 T otal 31 75 106 ADA-C ult+ 2 ADA-C ult73 Dx. C ult+ 4 Dx C ult 102 III.1.26. Con respecto a los resultados obtenidos para ADA, en los Líquidos Pleurales, como Exudados de 106 pacientes, se obtuvo mayor número de casos Positivos a Tuberculosis, con relación a los otros dos tipos prueba empleados, y no mostró diferencia significativa entre pacientes por Género. (Cuadro # 21 22 y Gráfica # 2) Cuadro # 23. Resultados de ADA en Líquidos Pleurales, como Exudados y su relación con Tipo de Prueba para confirmación de diagnóstico Positivo a Tuberculosis, en pacientes de Género Femenino. Tipo de Prueba Diagnóstica Para el paciente Clínica positiva a Tuberculosis Valor ADA < de 34 U/L (Negativo para TB) Valor ADA >de 90 U/L ( Negativo para TB) TOTAL 2 Valor ADA > de 34 U/L a 90 U/L (Positivo para TB) 2 1 5 Cultivo positivo para Tuberculosis 1 1 0 2 Determinación de ADA 35 13 4 52 Fuente: FODECYT 064-2006 Cuadro # 24. Resultados de ADA en Líquidos Pleurales, como Exudados y su relación con Tipo de Prueba para confirmación de diagnóstico Positivo a Tuberculosis, en pacientes de Género Masculino. Tipo de Prueba Diagnóstica Para el paciente Clínica positiva a Tuberculosis Valor ADA < de 34 U/L (Negativo para TB) Valor ADA >de 90 U/L ( Negativo para TB) TOTAL 1 Valor ADA > de 34 U/L a 90 U/L (Positivo para TB) 9 0 10 Cultivo positivo para Tuberculosis 1 1 0 2 Determinación de ADA 35 18 1 54 Fuente: FODECYT 064-2006 76 Gráfica # 2. Resultados de ADA en Líquidos Pleurales, como Exudados y su relación con Tipo de Prueba para confirmación de diagnóstico Positivo a Tuberculosis, en pacientes de Ambos Géneros. Fuente: FODECYT 064-2006 III.1.27. En el caso de los 14 pacientes positivos a VIH-SIDA, 8 de ellos estuvieron dentro del rango de ADA positivo (>34 U/L a 90 U/L), y se comporto igualmente para ambos sexos. (Gráfica # 3) . Gráfica # 3 Valores de ADA, para pacientes VIH-SIDA Positivos, que presentaron Derrame Pleural, para ambos géneros. Fuente: FODECYT 064-2006 77 III.1.28. Para los 106 casos, que presentaron recuentos de Glóbulos blancos (Leucocitos / mm3), tenemos: Recuento >de 1,000 leucocitos /mm3: 24 casos Recuento >de 10,000 leucocitos / mm3: 4 Casos Sin Información: 78 Casos. (Gráfica # 4) Gràfica # 4 Valores reportados en función de leucocitos, para los 106 pacientes analizados con Derrame Pleural, como exudados. Fuente: FODECYT 064-2006 III.1.29. Para las 215 muestras procesadas y analizadas según la Curva ROC, se obtuvieron los siguientes resultados: a. Los datos fueron analizados con un intervalo de confianza de 95 %. b. El valor bajo el área fue de 0.781 c. El estándar de error fue de 0.052 d. El valor para la significancia asintótica fue de 0.000 e. El valor de corte fue de 34.07 para una sensibilidad del 70.0%. (Curva ROC # 1) 78 ROC Curve 1 Para Análisis de datos para Adenosin Deaminasa en pacientes con Derrame Pleural. Notes Output Created Comments Input Missing Value Handling 21-JUL-2008 18:20:20 Filter Weight Split File N of Rows in Working Data File Definition of Missing Cases Used Syntax Resources <none> <none> <none> 215 User-defined missing values are treated as missing. Statistics are based on all cases with valid data for all variables in the analysis. ROC ADA1 BY Diag1N (1) /PLOT = CURVE(REFERENCE) /PRINT = SE COORDINATES /CRITERIA = CUTOFF(INCLUDE) TESTPOS(LARGE) DISTRIBUTION(FREE) CI(95) /MISSING = EXCLUDE . Elapsed Time 0:00:00.28 Fuente: FODECYT 064-2006 Case Processing Summary Valid N Diag1N (listwise) Positive(a) 20 Negative 195 Larger values of the test result variable(s) indicate stronger evidence for a positive actual state.a The positive actual state is 1. Fuente: FODECYT 064-2006 79 ROC Curve 1.0 Sensitivity 0.8 0.6 0.4 0.2 0.0 0.0 0.2 0.4 0.6 0.8 1 - Specificity Std. Asymptotic Área Error(a) Sig.(b) .781 .052 .000 a Under the nonparametric assumption b Null hypothesis: true area = 0. Asymptotic 95% Confidence Interval Lower Bound .678 Fuente: FODECYT 064-2006 80 Upper Bound .883 1.0 Coordinates of the Curve Test Result Variable(s): ADA 1 Positive if Greater Than or Equal To(a) -.8800 .1700 .3250 .4450 .5800 .7250 .8050 .8700 .9450 1.0900 1.2200 1.3000 1.3400 1.3650 1.4500 1.5800 1.7200 1.8250 1.8800 1.9350 2.0400 2.1350 2.1600 2.2200 2.3000 2.3550 2.4850 2.6150 2.6950 2.7650 2.8150 2.8800 2.9350 3.2250 3.5150 3.6700 3.8250 3.8800 4.0650 4.3000 4.5400 Sensitivity 1 - Specificity 1.000 1.000 1.000 .985 1.000 .979 1.000 .974 1.000 .964 1.000 .959 1.000 .954 1.000 .949 1.000 .944 1.000 .938 1.000 .928 1.000 .923 1.000 .913 1.000 .908 1.000 .892 1.000 .887 1.000 .882 1.000 .877 1.000 .872 1.000 .862 1.000 .856 1.000 .846 1.000 .841 1.000 .836 1.000 .826 1.000 .821 1.000 .815 1.000 .810 1.000 .805 1.000 .800 1.000 .790 1.000 .785 1.000 .779 .950 .779 .950 .769 .950 .764 .950 .759 .950 .754 .950 .749 .950 .744 .950 .738 81 4.7500 5.0400 5.4350 5.6150 5.6700 5.8550 6.1200 6.3300 6.4850 6.6200 6.8850 7.1150 7.1850 7.3100 7.5000 7.7500 7.9600 8.0650 8.1700 8.2500 8.3750 8.5850 8.7250 9.0150 9.3300 9.4600 9.6200 9.8050 9.9600 10.0650 10.1450 10.3550 10.7250 11.1200 11.3750 11.4800 11.6200 11.8300 12.0650 12.2750 12.4600 12.5650 12.6200 12.6650 12.9800 13.4900 13.7550 .950 .950 .950 .950 .950 .950 .950 .950 .950 .950 .950 .950 .950 .950 .950 .950 .950 .900 .900 .900 .900 .900 .850 .850 .850 .850 .850 .850 .850 .850 .850 .850 .850 .850 .850 .850 .850 .850 .850 .850 .850 .850 .850 .850 .850 .850 .850 .733 .728 .723 .718 .713 .708 .703 .697 .692 .682 .677 .672 .667 .662 .656 .651 .646 .646 .641 .636 .631 .626 .626 .621 .615 .610 .600 .590 .585 .579 .574 .569 .564 .559 .554 .549 .544 .538 .533 .528 .523 .513 .508 .503 .497 .492 .482 82 13.9400 14.1500 14.3050 14.4150 14.7050 14.9800 15.2450 15.5150 15.7000 15.9900 16.1750 16.2850 16.6150 16.9800 17.2000 17.3600 17.4150 17.6800 18.1250 18.4900 18.9150 19.6000 20.3350 20.6550 20.7100 20.9950 21.3100 21.5650 21.7500 21.9500 22.4200 23.1650 23.6400 24.0600 24.4950 25.3250 26.2050 27.0200 27.8400 28.0250 28.2350 28.7850 29.4850 29.7950 30.8850 32.4200 33.0150 .850 .850 .850 .850 .850 .850 .800 .800 .800 .800 .800 .800 .800 .800 .800 .800 .800 .800 .800 .800 .800 .800 .800 .800 .800 .800 .800 .800 .800 .800 .800 .800 .800 .800 .800 .800 .800 .750 .750 .750 .750 .700 .700 .700 .700 .700 .700 .477 .472 .467 .462 .456 .451 .451 .446 .441 .436 .426 .415 .410 .405 .400 .395 .390 .385 .379 .374 .364 .359 .349 .344 .338 .328 .323 .318 .313 .308 .303 .297 .287 .282 .277 .272 .267 .267 .262 .256 .251 .251 .246 .241 .236 .231 .226 83 33.1800 33.5300 34.0750 34.3550 34.4600 34.9200 35.5700 36.6750 39.4100 41.5150 41.9350 42.2500 43.4100 46.0950 47.9750 48.3600 49.7800 52.3200 53.6650 54.3300 55.0650 55.9250 57.1400 58.1300 58.9050 59.5400 59.8950 61.7450 63.7200 64.2750 65.8550 67.5700 68.1550 68.2800 68.3900 68.6550 69.0400 69.2250 69.6300 72.0000 76.2250 78.5150 79.6750 81.5700 83.5700 88.6250 94.2600 .700 .700 .700 .700 .700 .650 .600 .600 .600 .600 .600 .600 .600 .600 .600 .600 .550 .550 .550 .550 .550 .550 .550 .550 .550 .550 .550 .500 .450 .400 .400 .400 .400 .350 .300 .300 .300 .250 .250 .250 .200 .200 .200 .150 .150 .100 .050 .221 .215 .210 .205 .200 .200 .200 .195 .190 .185 .179 .174 .169 .164 .159 .154 .154 .149 .144 .138 .133 .128 .123 .118 .113 .108 .103 .103 .103 .103 .097 .092 .087 .087 .087 .082 .077 .077 .072 .067 .067 .062 .056 .056 .051 .051 .051 84 105.8150 122.6150 136.5450 149.2650 166.4450 207.2850 260.8000 340.4300 440.6800 558.8350 633.3400 .050 .050 .050 .050 .000 .000 .000 .000 .000 .000 .000 .046 .041 .036 .031 .031 .026 .021 .015 .010 .005 .000 a The smallest cutoff value is the minimum observed test value minus 1, and the largest cutoff value is the maximum observed test value plus 1. All the other cutoff values are the averages of two consecutive ordered observed test values. Fuente: FODECYT 064-2006 III.1. 30. Para las 106 muestras procesadas como exudados, y analizadas según la Curva ROC, se obtuvieron los siguientes resultados: a. Los datos fueron analizados con un intervalo de confianza de 95 %. b. El valor bajo el área fue de 0.801 c. El estándar de error fue de 0.064 d. El valor para la significancia asintótica fue de 0.000 e. El valor de corte fue de 34.07 para una sensibilidad del 73.33% (Curva ROC # 2). 85 ROC Curve 2 Para Análisis de datos para Adenosin Deaminasa en pacientes con Derrame Pleura (Exudado) Notes Output Created Comments Input Missing Value Handling 21-JUL-2008 18:08:03 Filter Weight Split File N of Rows in Working Data File Definition of Missing Cases Used Syntax Resources <none> <none> <none> 106 User-defined missing values are treated as missing. Statistics are based on all cases with valid data for all variables in the analysis. ROC ADA1 BY Diag1N (1) /PLOT = CURVE(REFERENCE) /PRINT = SE COORDINATES /CRITERIA = CUTOFF(INCLUDE) TESTPOS(LARGE) DISTRIBUTION(FREE) CI(95) /MISSING = EXCLUDE . Elapsed Time 0:00:00.30 Fuente: FODECYT 064-2006 Case Processing Summary Valid N (listwise) 15 91 Larger values of the test result variable(s) indicate stronger evidence for a positive actual state. a The positive actual state is 1. Diag1N Positive(a) Negative Fuente: FODECYT 064-2006 86 ROC Curve 1.0 Sensitivity 0.8 0.6 0.4 0.2 0.0 0.0 0.2 0.4 0.6 1 - Specificity Area Under the Curve Std. Asymptotic Area Error(a) Sig.(b) .801 .064 .000 a Under the nonparametric assumption b Null hypothesis: true area = 0.5 Coordinates of the Curve Test Result Variable(s): ADA 1 Asymptotic 95% Confidence Interval Lower Bound .676 Fuente: FODECYT 064-2006 87 Upper Bound .927 0.8 1.0 Coordinates of the Curve Test Result Variable(s): ADA 2 Positive if Greater Than or Equal To(a) -.8800 .2750 .5900 .8050 1.0150 1.2750 1.5900 2.0350 2.4550 2.7750 3.2000 3.6450 4.0100 4.3000 4.5900 5.1950 5.6450 5.9650 6.7200 7.3100 7.5000 7.7500 7.9600 8.3550 8.7250 9.0150 9.4900 9.8550 10.0650 10.1450 10.3550 10.7250 11.1200 11.3750 11.4800 11.8550 12.2750 12.4600 12.5650 Sensitivity 1 - Specificity 1.000 1.000 1.000 .989 1.000 .978 1.000 .967 1.000 .956 1.000 .945 1.000 .934 1.000 .923 1.000 .901 1.000 .890 1.000 .879 1.000 .868 1.000 .857 1.000 .846 1.000 .835 1.000 .824 1.000 .813 1.000 .802 1.000 .791 1.000 .780 1.000 .769 1.000 .758 1.000 .747 .933 .747 .867 .747 .867 .736 .867 .725 .867 .714 .867 .703 .867 .692 .867 .681 .867 .670 .867 .659 .867 .648 .867 .637 .867 .626 .867 .615 .867 .604 .867 .593 88 12.6200 12.9650 13.4900 13.8850 14.1500 14.3050 14.4150 14.9700 15.6750 16.0450 16.2850 16.7050 17.2000 17.3600 17.4150 18.0450 19.6550 20.7100 20.9950 21.4950 21.9500 22.4200 23.1650 23.6400 24.0850 26.1400 27.9450 28.2350 28.7850 29.4850 31.3300 33.0150 33.4600 34.0900 34.4600 34.9200 35.5700 36.6750 39.4100 41.8300 45.2900 48.3600 51.0200 53.6650 54.3300 55.0650 55.9250 .867 .867 .867 .867 .867 .867 .867 .867 .867 .867 .867 .867 .867 .867 .867 .867 .867 .867 .867 .867 .867 .867 .867 .867 .867 .867 .867 .867 .800 .800 .800 .800 .800 .800 .800 .733 .667 .667 .667 .667 .667 .667 .600 .600 .600 .600 .600 .582 .571 .560 .549 .538 .527 .516 .505 .495 .484 .473 .462 .451 .440 .429 .418 .407 .396 .385 .374 .363 .352 .341 .330 .319 .308 .297 .286 .286 .275 .264 .253 .242 .231 .220 .220 .220 .209 .198 .187 .176 .165 .165 .154 .143 .132 .121 89 60.0850 .600 .110 63.7200 .533 .110 64.2750 .467 .110 65.8550 .467 .099 67.5700 .467 .088 68.1550 .467 .077 68.2800 .400 .077 68.6150 .333 .077 69.0400 .333 .066 69.6050 .267 .066 75.3950 .267 .055 81.5700 .200 .055 83.5700 .200 .044 88.6250 .133 .044 94.2600 .067 .044 105.8150 .067 .033 129.5100 .067 .022 149.2650 .067 .011 320.2100 .000 .011 486.3300 .000 .000 a The smallest cutoff value is the minimum observed test value minus 1, and the largest cutoff value is the maximum observed test value plus 1. All the other cutoff values are the averages of two consecutive ordered observed test values. Fuente: FODECYT 064-2006 90 III.2. DISCUSISON DE RESULTADOS. Indudablemente en Guatemala la incidencia de Tuberculosis para todas las formas es del 24.5 % y de este porcentaje el 17.9 % corresponde a Tuberculosis Pulmonar, presentando Derrame Pleural en un buen número de pacientes aproximadamente 250 según estadísticas de los dos últimos años, de los Hospitales de Referencia Nacional (Memoria de Labores Programa Nacional de Tuberculosis 2004) Existen muchas causas como responsables del Derrame Pleural, por lo cual cuando se encuentra un paciente con acumulación de este líquido, debe establecerse como primer punto la causa y, determinar si se trata de un Exudado o Transmudado, ya que la Pleuritis Tuberculosa está considerada como un Exudado(de la Cruz 2001). En base a esta información y para fines del estudio por ser este el primer trabajo en el tema, en Guatemala y por estar el valor diagnóstico de ADA sujeto a consideración, se procesaron una totalidad de 215 muestras de Derrame Pleural, y se analizaron los datos como dos poblaciones diferentes, considerando cada una de ellas, como dos escenarios distintos, para establecer cual nos proporciona la mejor información con fines de Sensibilidad, Especificidad, Valor Predictivo Positivo, Valor Predictivo Negativo, Punto de Corte y Certeza Diagnóstica, para concluir con la Utilidad de la Determinación del ADA, en el diagnóstico de Pleuritis Tuberculosa a partir del análisis de los Líquidos o derrames Pleurales, como parte complementaria a los otros análisis que se le efectúan al paciente. La primera población de muestras analizadas correspondió a una totalidad de 215 muestras recibidas y procesadas sin hacer ninguna diferenciación entre Exudado y Transudado. Para la segunda población se partió del criterio de Light modificado, tomando como base las proteínas totales en el líquido de derrame pleural, con un valor de > de 3gr/dl (de la Cruz 2001) con la debida observación que no pudimos documentar toda la información requerida, para la totalidad de muestras por situaciones administrativas de los mismos Hospitales. Desde que Giusti en 1,974 estableció y dio a conocer el método de análisis enzimático, para la medición de la actividad enzimática de Adenosin Deaminasa, se han realizado múltiples estudios al respecto, mostrando la utilidad de la determinación de esta enzima, se le ha dado un uso muy amplio y se le ha atribuido un alto valor diagnóstico en muchas partes del mundo como por ejemplo en España, según estudios efectuados por el Dr. Oscar Asencio de la Cruz, Dr. Antonio Moreno Galdo, en Uruguay por los Dres. Cecilia Coitinho*, Rosario San Martín, o en Chile por el Dr. John E. Heffener, entre otros, quienes han apoyado de esta forma los informes iníciales, por lo que nosotros en este 91 proyecto, nos hemos valido al igual que ellos, del Teorema de Bayes para establecer la Especificidad, Sensibilidad, Certeza Diagnóstica, Valor Predictivo Positivo y Valor Predictivo Negativo, y con apoyo de la Curva ROC, para establecer la Utilidad Diagnóstica con el Punto de Corte y con ello mostrar la mejor relación entre Especificidad y Sensibilidad. Con ayuda del análisis de datos en la Curva ROC (1 y 2), pudimos establecer en nuestro estudio un valor de ADA en el punto de corte para Derrames Pleurales tuberculosos de 34 U/L, con un rango de Positividad para Tuberculosis de > 34 U/L a 90 U/L, valores similares fueron establecidos en otros estudios como por ejemplo el de Strankinga 1,987, Cecilia Coitinho en el 2007, donde el Punto de Corte fue de un valor de 40 U/L, y un rango de positividad de > 40 U/L a 146 U/L. Apoyados con el Teorema de Bayes,(Tablas 15 y 17 ) pudimos establecer una Especificidad de 82.05 % en la población de 215 muestras de Derrame Pleural y una Especificidad de 78.02 % en la población de 106 muestras consideradas como Exudados, logrando porcentajes muy similares a los de Maritz 1,982 y García 1,995; Cecilia Coitinho 2007, lo que demuestra que con una Especificidad del 82.5 % ò del 78.02 % la prueba es capaz de identificar a los individuos que NO tienen la enfermedad. La Sensibilidad obtenida para el test de ADA, resulto de 60.0 % para la población de 215 muestras de Derrame Pleural y de 73.33 % para la población de 106 muestras considerados como Exudados. Datos muy similares fueron obtenidos por Quiroa William Arciniegas en Colombia, donde obtuvo una Especificidad de 85.7 % y una Sensibilidad de 88.0% en un estudio donde la muestra fueron 254 pacientes con Derrame Pleural. Esta Sensibilidad coincide cuando se analizan los mismos datos con la Curva ROC, confirmándonos la calidad de los datos, también cuando nuestros valores son comparados con valores de ADA de otros investigadores. Un factor importante que contribuyo a la obtención de un valor bajo en la Sensibilidad del test de ADA puede deberse a que el 33.01% de los líquidos eran rojizos (Cuadro No.15), y no se puedo establecer si se debía a un proceso traumático a la hora de la toma de muestra, o a un proceso infeccioso, lo cual está demostrado por otros investigadores (Coitinho Cecilia, Rosario San Martín Uruguay 2007 ) quienes afirman que la presencia de estas células ( eritrocitos ) en los Líquidos Pleurales, reducen la Sensibilidad de la Determinación de ADA. Según el Dr. Rodrigo Moreno ( 1997) afirma que un valor inferior a 20 U/L, hace improbable una tuberculosis pleural y esto se ve reflejado en nuestro estudio, en el cual únicamente 3 casos clínicos de tuberculosis pleural ( Diagrama B ) estaban incluidos entre los 70 pacientes considerados como Exudado, que tenían valores por debajo de 34 U/L , o sea valor ADA Negativo, pero lo interesante del caso es que de los tres pacientes antes mencionados, dos de ellos presentaban un color rojizo en su muestra de líquido, lo que sugiere un margen de error, para la Determinación del ADA, por contener el líquido gran cantidad de eritrocitos. 92 Hay que considerar un dato de importancia, el cual es partir de una confirmación sobre el tipo de Derrame Pleural, ( Exudado o Transudado ) en base a los criterios de Light,( Cuadro No. 12) un ejemplo de ello son las publicaciones del Dr. Villena Garrido, español, en el 2003 donde afirma que utilizando los criterios de Light para los Líquidos Pleurales se obtiene una Sensibilidad cercana al 100%, y una Especificidad inferior (7283%) que garantizan que el líquido es un verdadero Exudado. Y de esta forma se mejorará tanto en Sensibilidad como en Especificidad diagnóstica al someter el exudado al análisis correspondiente de ADA. Por otro lado, el Valor Predictivo Negativo (Tablas 16 y 18) obtenido en ambas poblaciones : La primera con 215 muestras de Derrame Pleural siendo de 95.24 % y para la segunda población de 106 muestras como verdaderos Exudados , siendo de : 94.67 %, podemos determinar que la prueba es capaz de de indicar con esa probabilidad, que una persona con un valor de ADA < de 34 U/L como punto de corte, NO tiene la condición en estudio, como lo demostraron otros investigadores como por ejemplo Coitinho Cecilia, Rosario San Martín Uruguay 2007,F. Salech, Chile 2005 y Sebastián Valderrama, Chile 2005, quienes afirman que con esta información se reduce la necesidad de biopsias y acorta el tiempo diagnóstico. Al analizar la información que nos proporciona la Curva ROC 2, encontramos que el Punto de Corte, está en “34.46 U/L “indicando para ese valor, la mejor Sensibilidad y la mejor Especificidad, lo que nos confirma los datos obtenidos con el Teorema de Bayes, al igual que lo demostraron F. Salech, Chile 2005 y Sebastián Valderrama, Chile 2005. Al analizar la Curva ROC 2, podemos ver que los otros valores que nos proporciona, están dentro de un Intervalo de Confianza del 95 % , que el margen de error es menor de 0.65 , con un Valor Asintótico de 0.00, y un Valor de Área bajo la curva de 0.801, por lo cual son muy validos los datos obtenidos, a su vez los valores considerados como Positivos (rango de 34 U/L a 90 U/L ) también son válidos como lo demostró Hanley en su estudio en 1988, F. Salech, Chile 2005 y Sebastián Valderrama, Chile 200, por lo que podemos afirmar que la Determinación de ADA es un aporte útil en forma complementaria, para el Diagnóstico de Tuberculosis Pleural, con presencia de Derrame. (Bongiovanmi Ma. Eugenia, et al 2004, Cecilia Coitinho 2007) Nuestros resultados muestran que la determinación de ADA, resulto ser mejor que la Bacteriología, ya que los BAAR son poco vistos en las tinciones de Zeihl Neelsen (Cuadros 9 y 18 ) en extendidos de líquidos pleurales, como también lo demostró Quiroa William Arciniegas en Colombia en el 2005, donde afirmó que la baciloscopía en un Líquido Pleural poco aporta al diagnóstico de Tuberculosis Pleural, ya que en uno sus estudios únicamente 2 casos de 47 estudiados dieron resultado Positivo. También afirmó que el cultivo de BK del Líquido Pleural es de poca Sensibilidad 25% y en un solo caso fue el único método definitivo de diagnostico, situación similar obtenida en nuestro estudio (Cuadros 7, 8, 16, y 17) en el cual se obtuvo para el cultivo una Sensibilidad entren 50 % a 60 % como también lo evidenciaron otros investigadores como Berger HW 1993, y Scharer L. 1,978. 93 Los Derrames Pleurales son bastante frecuentes en la enfermedad tuberculosa y su diagnóstico diferencial es un reto clínico (Álvarez, 1989) la literatura describe hasta un 19 % de derrames sin diagnóstico definitivo, en virtud de estas afirmaciones el diagnóstico se hace en un 14% a 20 %. sobre bases clínicas. Sin embargo la biopsia pleural percutánea es una técnica segura y según Quiroa William Arciniegas en Colombia en el 2005, en su estudio concluyó que fue el método de diagnóstico más sensible para confirmar casos de tuberculosis pleural en el 93.18% de los casos, al igual que ZakariyaYousef Breval F, en su estudio en el 2008 por lo que la citología es considerada el estándar de oro Pero en el caso de nuestro estudio, por no contar con este dato, del resultado de biopsia para todos los casos, se cambio el Estándar de Oro, dejando al Diagnóstico clínico como “ Positivo para Pleuritis Tuberculosa” y como Verdadero Negativo los casos de pacientes “Heridos por Arma de Fuego”. El 100% de las heridas por arma de fuego, presentaron un valor negativo para el ADA, (Tabla 13 y 14) lo cual confirma que en esos procesos, no estaban elevados los glóbulos blancos, ya que la enzima Adenosina Deaminasa se eleva en presencia de los mismos, sobre todo en linfocitos T y que es un producto de los Linfocitos activados, asimismo su aumento esta en relación a una respuesta de tipo celular frente al antígeno de Mycobacterium, información que coincide con Zakariya Yousef Breval F en su estudio del 2008 donde afirma que en pacientes, ante un valor de ADA elevado y un cociente linfocitos/neutrófilos en LP > 0,75, se podría establecer el diagnóstico de alta probabilidad de Tuberculosis Pleural. La literatura también nos indica que en procesos Neoplásicos (Tablas 3 y 4) el valor de ADA es elevado (Isidoro A. Páez 1998), pero según nuestro estudio, los datos obtenidos para ADA en este tipo de proceso, se mantuvieron en un 87.5% con un valor de < 34 U/L y un 12.5 % > de 90 U/L lo cual nos ayuda significativamente para una adecuada discriminación de este tipo de casos. En la mayoría de los casos, los trasudados se deben a Insuficiencia Cardiaca (J. M. Porcel 2,004), y cursan como de tipo exudativo (Mejía S. Gilmar 2,003) y nuestros resultados demuestran que el 100% de estos casos (Tabla # 7 y # 8) presentando un valor para ADA > de 34 U/L m ó sea Negativo para diagnóstico a Tuberculosis pleural. Según el Dr. Eduardo Cruz y colaboradores (1987), los valores de ADA, se encuentran elevados en los procesos Para neumónicos, y en nuestro estudio, como se puede apreciar en las Tablas #1 y # 2, únicamente un 26.7 % y 36 % dieron positivo para los rangos de ADA Positivos a Tuberculosis Pleural, lo cual demuestra que para estas afecciones en las que coincide un valor de ADA, puede diferenciarse con el resultado de cultivo bacteriano, como bien lo afirma el Dr. Ernesto Prieto, miembro de la Asociación Argentina de Medicina respiratoria, en sus algoritmos diagnósticos del Derrame Pleural. 94 La combinación de ADA con el recuento de leucocitario diferencial de Líquido Pleural, aumenta la especificidad para el diagnóstico de Pleuresía Tuberculosa.(Diacon A.H 2004) no obstante en el presente estudio, no todos los casos tenían este parámetro realizado, como se puede apreciar en la Gráfica # 4, lo que hizo perder una valiosa información, ya que al contar con de la determinación de ADA y con el recuento de glóbulos blancos y la relación de leucocitos y neutrófilos, se acercaría a la prueba diagnóstica ideal para Pleuresía Tuberculosa (Porcel, J M 2004). El estudio histológico de la biopsia pleural, es el recurso diagnóstico muy importante con una Sensibilidad arriba del 98.3 % según Quiroa William Arciniegas en Colombia en el 2005, pero lamentablemente este dato no se pudo constatar en la mayoría de los casos analizados, y es más nos quedamos con un 40.0 % a 44.0% de casos donde no se pudo recabar la información completa para los casos ( Cuadros 10 y 19 ), este aspecto también incidió en los datos obtenidos de sensibilidad y especificidad, los cuales se hubieran mejorado de haber completado todo la información diagnóstica básica, la cual es parte del trabajo rutinario en los Hospitales de Referencia. Al comparar los datos obtenidos con respecto al Estándar de oro “Diagnóstico Clínico” el Resultado del “Cultivo para Micobacterias” y el Resultado de la “Determinación de ADA”, (Cuadros 21, 22,23 y 24) podemos apreciar que la recuperación de Casos como Tuberculosis Pleural es evidente, como bien lo afirma Zakariya-Yousef Breval F, en su estudio en el 2008 diciendo que la elevación de ADA en líquido pleural puede ser utilizada para obtener una rápida orientación diagnóstica. La interacción entre estas dos enfermedades (Tuberculosis y VIH / SIDA) suele hacer que el diagnóstico para TB, sea muy dificultoso (Cabrera Susana G. 2007), sin embargo en nuestro estudio, no se pudo llegar a un valor de ADA definitivo ya que no se aprecia un dato significativo entre los positivos y negativos, (Gráfica 4), punto muy importante que también comenta J.Bras en su estudio brasileño del 2004, también porque fue un valor muy pequeño de pacientes, esto debido a que dentro de los criterios de inclusión no estaban considerados este tipo de pacientes, y los pocos que ingresaron no nos dan idea completa para el análisis, además de las 14 muestras, pertenecientes a este tipo de pacientes 11 de ellas eran totalmente amarillo, y 3 rojas, quizá el parámetro de Bilirrubina y Hemoglobina pudo intervenir en el valor del ADA, como lo establece A. Bengoa M.P en su publicación del 2001. 95 PARTE IV IV.1. CONCLUSIONES. 1. Se pudo Determinar los Niveles de ADA para establecer un diagnóstico de Tuberculosis en pacientes con Derrame Pleural que acudieron a los Hospitales de Referencia Nacional en la Ciudad de Guatemala, en base a los siguientes valores: < de 34 U/L Negativo para el diagnóstico de TB Pleural; >de 90 U/L Negativo para el diagnóstico de TB Pleural. Y Valores entre el Rango de >34 U/L a 90 U/L POSITIVOS para el diagnóstico de Tuberculosis Pleural. 2. Se demostró que la Determinación de los Niveles de Adenosina Deaminasa es un método alternativo, auxiliar, complementario, eficaz, de bajo costo y gran rapidez para confirmar la sospecha de Tuberculosis Pleural, acortando el tiempo de diagnóstico y evitando que el paciente sea sometido a un proceso mucho más invasivo como es la biopsia, para completarle el diagnóstico, 3. Los valores de más de 34 U/L de ADA en Líquido Pleural resultaron estadísticamente significativos para los Derrames Pleurales de etiología tuberculosa (p<0,12), con una sensibilidad de 73.33%, especificidad de 78.02%, Y con un Valor Predictivo Negativo de 94.67%. Por lo que el presente estudio, de la Determinación de ADA en Líquidos Pleurales, confirmo su utilidad para el diagnóstico etiológico de los Derrames Pleurales Exudativos, coincidiendo con estudios similares al referido por la literatura. 4. Los Criterios de Positividad y de Negatividad de la Curva ROC, coincidieron con los valores obtenidos con el Teorema de Bayes, y ambos fueron estadísticamente significativo para los Derrames Pleurales de etiología tuberculosa, especialmente haciendo énfasis en el valor Predictivo Negativo del Test. 96 IV. 2. RECOMENDACIONES. 1. Para mejorar la sensibilidad y especificidad proporcionada en la Determinación de Adenosin Deaminasa, realizársele al paciente estudios complementarios como son: - Recuento de linfocitos / neutrófilos, para mejorar la Especificidad. - Cultivo bacteriológico / mejorar el valor predictivo negativo. - Determinación de pruebas bioquímicas, para cumplir con los criterios de Light, para establecer un verdadero Exudado. - Determinación de Colesterol, ya que con este parámetro puede llegarse al 100% de Sensibilidad 2. Como prácticamente ningún examen es 100 % sensible ni especifico, se recomienda el combinar como mínimo, los parámetros antes mencionados, con los Niveles de la Determinación de Adenosin Deaminasa, por ser esta un método complementario, para conseguir una mejor precisión diagnóstica. 3. Proponer este algoritmo de estudios complementarios, a los médicos de los Hospitales de Referencia, y unificar criterios para mejorar el diagnóstico, de todos aquellos pacientes con derrame pleural, que se quedan como idiopáticos y mejorar el Estándar de oro. 4. Realizar otras investigaciones similares, ya que siendo este el primero a Nivel de País, no se pudo completar la información en todos los casos y no se tomo en cuenta la realización de las determinaciones de bilirrubina y hemoglobina. 5. Realizar otros estudios en otros líquidos corporales, como por ejemplo: Líquido Cefalorraquídeo, Líquido Pericárdico, y/o Líquido ascítico entre otros, ya que sería de mucha ayuda y beneficio no sólo para el paciente, sino para la institución porque disminuiría los costos hospitalarios. 97 IV. 3. REFERENCIAS BIBLIOGRAFICAS. 1. Alfageme Michavila et al. (2007) Principios de Urgencias, Emergencia y Cuidados Críticos. Capítulo 2.6 Patología Pleural. Versión en línea. 2. Alvarez S. et al (1989).Extra pulmonary tuberculosis revisited a review of experience at Boston City and other hospitals Boston. Rev Revisit Medical, Chile.Vol. 63 Pages. 25-55. 3. Bongiovanmi, Ma.Eugenia, Vera Oscar et al (2004) Aporte de Adenosin Deaminasa como método indirecto para el diagnóstico de Pleuresía Tuberculosa. Revista Experiencia Médica. Córdoba, Argentina. Volumen, 22, No. 1 Pág. 12 -16 4. Bengoa. A, Sanz M. P., Rus A., Borque L. (2001). Nuevo procedimiento colorimétrico para la determinación de adenosina desaminasa en líquidos biológicos. Revista de Diagnóstico Biológico. Madrid 50 (2), 1-12. 5. Cabrera Susana G, Medina Julio C et al. (2007) Dificultad en el diagnóstico de Tuberculosis en pacientes infectados por el virus de inmunodeficiencia humana (VIH) y variables que determinan el inicio de un tratamiento empírico antituberculoso. Rev. Médica Uruguaya. Uruguay. Volumen. 23 Pág.: 164-172. 6. Caminero, J.A. (2003). Guía de la tuberculosis para Médicos especialistas. (pp. 3, 6, 17, 29, 32, 77,125). Francia, Paris. Brochage. 7. Casagrande Kaisemann, M; Lineu Kritski, A; Pereira, Ma. De Fátima; Trajman, A. (2004). Dosagwem da atividade da adenosina deaminase no Líquido Pleural para o diagnóstico da tuberculose pleural. 30 (6), 1-14. Brasil. Disponible en http://www.scielo.com 8. Casal Roman, M. (1990). Microbiología clínica de las enfermedades por Micobacterias. Facultad de Medicina Universidad de Córdoba España. (pp. 1925). 9. Centralab. Vademécum de análisis. Adenosin Deaminasa en sangre. 19982003. Disponible en http://www.centralab.com. 10. Coitinho Cecilia, San Martín Rosario, et al, (2007) Utilidad de la dosificación de Adenosin Deaminasa en el diagnóstico de tuberculosis pleural. Revista Médica de Uruguay. Vol. 23 No. 1. Pág: 19-24. 98 11. Cruz Mena Edgardo. Quiroga teresa. (1997) Líquido Pleural: Optimización de su aporte diagnóstico. Boletín de la escuela de medicina Pontificia Universidad Católica de Chile. Chile. No. 26 pág. 75-80w 12. Diacon, AH; Van de Wal, Bx; Wyser, C; Sedema, JP; Besuidenhout, J; Bolliger, CT y Walzl, G. (2004). Del laboratorio a la clínica oncología. Herramientas de diagnóstico en pleuresía tuberculosa: estudio comparativo directo. Europea Respiratory Journal. España. 5 (2), 1-5. 13. Ena, J; Vals, V; Pérez de Oteyza, C y Enríquez de Salamanca R. (1990). Utilidad y limitaciones de la Adenosin desaminasa en el diagnóstico de la pleuresía tuberculosa. Estudio metanalítico. Med Clin 95, 333-335. 14. Farga.V. (1989). Tuberculosis. Santiago Chile Mediterraneo. (pp. 11, 43.52, 59, 69, 74, 145) 15. García Pachón, E; Padilla Navas, Shum. (2005). Mesotelioma, de Adenosin Desaminasa y proteína C reactiva Arch Bronconeumol. 41, 175 – 175. 16. Goto, M; Nogushi, Y; Koyama, H; Hira, K; Shimbo, T y Fujui, T; (2003). Diagnostic value of adenosine deaminase in tuberculous pleural effusion; a Meta-analysis. Ann Clin 17. Heinz, F; (1984). Adenosie Deamiase: UC-ethod. Bergmeyer HU, Ed, Methods in Enzymatic Analysis. Vol 4, 3rd ed. Weinheim: Verlag Chemise, l984. Page 308-315. 18. Hirschorn, R; Ratech, H. (1980). Isozymes of Adenosine Deaminasa Curr Top Biol Med Res. 4: 131-157. 19. Isidoro, A; Páez, P; Dr. Pedro, P; Pino, A; Dr. Rodríguez Vázquez, Juan C y Dr. Gassiot Nuño, Carlos (1998) “Derrame pleural: marcadores bioquímicos en el enfoque diagnóstico" Revista Cubana Médica. 37 (2), pág.: 93-99 20. Kaplan NO. Specific Adenosine Deaminase from intestine. Methods Enzimol 1955; 2: 473-475. 21. Kashyap, Rajpal S. Deshpande Poonam S et al (2007). Adenosine Deaminase activity in the supernatant of monocytes infected with M. tuberculosis. Revisit International Journal Integrative Biology. Nagar Nagpur, India. Vol 1. No. 2 Page 61 – 64. 22. Light RW. E; Mc Gregor, M.I; Luchsinger, P.C; y Ball WC. (1972) Pleural effusions: the diagnostic separation of transudates and exudates. Ann Intern Med. 77, Page 507-13. 99 23. Maritz FJ, et al (1982) ADA estimation in the differentiation of pleural effusions África Medical J. Chile Vol. 62. Pages: 556-558. 24. Martínez, C.E; Rubio, R; Morón, F.E; Bazurto, M.A. (1998). Relación entre los niveles de adenosina deaminasa y desarrollo de engrosamiento pleural residual en tuberculosis pleural. Acta Médica Colombiana, Colombia. vol.23. 25. Mejía Varela, A; Pajares, V; Fernández, Alicia. (1998). Adenosina deaminasa sérica como marcador de la respuesta terapéutica en TB pulmonar. 37 (6), 1-7. 26. Memoria de labores Programa Nacional de Tuberculosis. (2004). Estadísticas del Programa Nacional de Tuberculosis. 27. Miguel J de; Alonso, E; Izquierdo, J.L y Serrano, J.A. (1996). Utilidad de los marcadores biológicos en el derrame pleural. Revista Clínica Española. 196 (2), 107-12. 28. Ocaña, I; Martínez-Vázquez, JM; y Segura, RM. (1983). Adenosine Deaminasa in pleural fluids. Test for diagnosis of tuberculous pleural effusion. Chest; 84: (pp. 51-3). 29. Organización Panamericana de la Salud (OPS) / Organización Mundial de la Salud (OMS). (1986). Bacteriología de la tuberculosis. Argentina. Centro Panamericano de Zoonosis. Notas Técnicas (pp. 26, 27,28). 30. Orphanidum, D; Stratakos, G; Risidakis, A; y Toumbis, M. (2000). Adenosin de Aminase activity and lysozyme levels in bronchoalveolar lavage fluid in Patient’s whit pulmonary tuberculosis. The International Journal of Tuberculosis and Lung Disease, 2 (2), 147. 31. Ortiz Sánchez, José M. (2002). El valor Diagnóstico del Test de ADA, Universidad del Perú, Facultad de Medicina. Perú. (pp. 1-5). 32. Ozakidetza/ Servicio Vasco de Salud. (2001). Programa de Prevención y Control de la Tuberculosis “Administración de la Comunidad Autónoma del país Vasco. España 1ª Edición. Documento de Consenso pp. 18. 33. Páez Sylvia Jairolt Roa. (1994) Derrame Pleural. Manual de Urgencias en Medicina Interna. Asociación Colombiana. 34. Porcel, J.M (2000) Manejo práctico de derrame pleural. Revista Anales de la Medicina Interna. Madrid.Vol. 19. No. 4 pág.: 1- 10 100 35. Quiroa William et al (2005) Tuberculosis Pleural. Vis. Salud Capítulo 37. Pág 127- 132. 36. Shan S.A. (1988). The pleura: state of the art. Am Rev Respired Dis 138, Pág 184- 234. 37. Sánchez Carlos David. (1994) Neumología en el adulto, Guías de actuación en urgencias y Emergencias. 38. .Salech Felipe, Valderrama SSebastián, et al (2005) Evaluación de Test Diagnóstico. Utilidad de Adenosin Deaminasa (ADA) en el diagnóstico de peritonitis tuberculosa. Revista: Gástrica Latinoamericana. Chile. Vol. 16. No. 3 Pág.: 262 - 268 39. Salazar-Lezama M, Quiroz-Rosales H, Báñales-Méndez JL, SánchezGuzmán M, Villareal-Velarde H, Báez-Saldaña R, et al. (1997). Métodos diagnósticos de derrame pleural de tuberculosis primaria en una región con alta prevalencia de tuberculosis Estudio en población mexicana Revista de Investigación Clínica. 49 (6), 453-456. 40. Sociedad Española de bioquímica Clínica y Patología Molecular. (1996). ISO enzimas y formas múltiples de las enzimas en Bioquímica Clínica. Monografía del Comité de Publicaciones de la SEQC. 11, 13-15. 41. Salojin VK, Zhang JJ, Delovitch TL. (1998)T cell anergy and altered T cell receptor signaling: effects on autoimmune disease. Immunology Today 19:468-73. 42. Stiehm ER, Ammann AJ. (1997). Combined antibody (B-Cell) & cellular (TCell) iunodeficiency disorders. In: Stites DP, Terr AI, Parslow TG EDS. Medical Immunology, 9 th Ed., Appleton & Lange, Stamford, Duct; (Pp.369-361). 43. Strankinga WF, et al (1987) Adenosine Deaminase activity in tuberculoses pleural effusions a diagnostic test tubercle. Vol. 68. Pág: 137- 140. 44. Tricopoulos A, Fahy O, Tonnell AB.(199) Delayed type hypersensitivity reaction to nominal proteins antigens and to environs. Eur J Dermatol 9:26-8. 45. Torzkoparan, E; Déniz, O; Cakir, E; et. Al, (2005). The diagnostic values of serum, pleural fluid and urine neopterin measurements in tuberculous leurisy. The international Journal of Tuberculosis and Lung Disease. South Africa. 9 (9), 1040. 101 46. Villena Garrido, V; López Encuentra, A; Echave-Sustaeta, J; Álvarez Martínez, C; Rey Terrón, L; Sotelo, MT; et al. (2004). Mesotelioma pleural: experiencia durante 9 años y descripción de 62 casos. Arch Bronconeumol. 40, 203-8. Disponible en http://www.medlineplus.com 102 IV.4. ANEXOS. 103 IV.4. ANEXOS. IV.4.1. Anexo No.1. Instrumento de recolección de datos. DETERMINACIÓN DE LA ACTIVIDAD DE ADENOSIN DEAMINASA (ADA) PARA EL DIAGNÓSTICO DE LA TUBERCULOSIS. Introducción: La Adenosin Deaminasa (ADA) es una enzima derivada del metabolismo de las purinas, cuya cantidad se encuentra elevada en los exudados provenientes de pleuresías, peritonitis y meningitis tuberculosa e incluso en suero de enfermos con tuberculosis activa. La aplicación más útil de esta técnica es en el diagnóstico de la meningitis tuberculosa y en el diagnóstico diferencial entre pleuresías tuberculosas y neoplásicas. Muestra: Todos los pacientes con derrame pleural, que ingresen al hospital y que cumplan con los criterios de inclusión y que acepten ingresar al estudio. Criterios de Inclusión. Paciente. - Mayor de 15 años sin distinción de género. - Que ingrese al Hospital presentando un derrame pleural, no traumático y sin diagnóstico específico, durante el peritado establecido para el proyecto (enero a diciembre 2007.) - Que firme la hoja de consentimiento informado. - Y que no sea paciente VIH / SIDA positivo Obtención de la muestra clínica: - Las muestras para el estudio de ADA se obtienen a través de procedimientos especiales (Toracocentesis), en forma aséptica, condición que debe mantenerse hasta su procesamiento. Se recomienda no trabajar una muestra cuando ésta tiene indicios de hemólisis, la presencia de hemoglobina altera los resultados de la determinación. 104 Alícuota de muestra para el envío: - La alícuota debe ser entre un volumen de 5 a 10 ml. del líquido de derrame Pleural, el que deberá ser depositado en un tubo vacutainer sin anticoagulante, cumpliendo con todas las medidas de esterilidad. (No se incluye el volumen requerido para los diagnósticos de rutina). Identificación de muestra clínica: Se efectuará con un código, el cual estará formado de la siguiente manera: Se anotará la primera letra de la palabra “Hospital” (Con letra mayúscula) seguida de la primera letra del Nombre del Hospital (Con mayúscula). Seguidamente el número correlativo de la boleta, el cual estará ubicado en el extremo superior derecho de la misma. Identificando al paciente e igualmente a la muestra. Los siguientes dos dígitos corresponderán al mes del año en el cual fue tomada la muestra. Los últimos dos dígitos identifican el año en que fue tomada la muestra. Ejemplo: HR-001- 05 / 06 Muestra tomada en el Hospital Roosevelt, que corresponde a la boleta 001 (Igual número para el paciente) durante el mes de mayo, del año 2006. Conservación de la muestra clínica: - Se recomienda conservar la muestra a bajas temperaturas (sin congelar) mientras llegan al laboratorio. Transporte de la muestra clínica: - Después de ser tomada, deberá ser transportada inmediatamente (en el mismo día) al laboratorio del Hospital, para ser alicuotada y conservación en cadena de frío (+ 4°C a + 8°C). -Posteriormente, de una coordinación con el mensajero contratado para el efecto, la muestra deberá ser transportada al laboratorio del Instituto de Investigaciones Químicas, Biológicas, Biomédicas y Biofísicas (IIQBBB) de la Universidad Mariano Gálvez de Guatemala, en un termo en cadena de frío, adicionando una unidad refrigerante y con las medidas de bioseguridad y evitar durante el traslado cualquier contaminación potencial. 105 IV.4.2. Anexo No.2. CARTA DE CONSENTIMIENTO INFORMADO Determinación de los niveles de ADA para Dx. de Tuberculosis en pacientes con derrame pleural Identificación: Este estudio está siendo conducido por la Licda. Eyda de Campollo (IIQBBB, de la UMG de Guatemala) y por el Dr. Carlos Alberto Ovando (Área de Salud Guatemala Central del MSP y AS) La siguiente información describe el estudio y su papel como participante en el mismo. Por favor, escuche cuidadosamente y no dude en preguntar al entrevistador cualquier duda que tenga acerca del estudio o sobre esta carta de consentimiento. Invitación y Propósito del Estudio: Usted está invitado para participar como voluntario dentro de un estudio sobre la Determinación de los niveles de ADA, para Dx. de tuberculosis , en pacientes con derrame pleural, que está siendo conducido por El Instituto de Investigaciones Químicas , Biológicas, Biomédicas y Biofísicas de la UMG y por el Ministerio de Salud Pública . Procedimientos: En los Hospitales de Referencia Nacional que son centro de toma de muestras del exudado de todos los pacientes con derrame pleural, quienes ingresan a dichos centros como sospechosos de padecer tuberculosis pulmonar. Las muestras podrán ser tomadas por el médico especialista del servicio de Urgencias y de Piso cuando se considere necesario. Si usted acepta participar voluntariamente en este estudio, los resultados de laboratorio de su muestra, serán incluidos en el mismo. Además, usted será entrevistado por el personal médico o paramédico, quienes le harán preguntas personales y relacionadas con su enfermedad. Riesgos: No existen riesgos específicos relacionados con la participación en este estudio que difieran de los riesgos mínimos asociados con la toma de muestra que se realiza a todos los pacientes de los servicios. Esos riesgos serán minimizados si las muestras son tomadas por personal experimentado del hospital. Beneficios: Si usted decide participar en este estudio, recibirá un diagnóstico precoz sobre si usted tiene o no tuberculosis. Usted también recibirá información sobre la enfermedad, su tratamiento y como prevenir la infección. Su participación ayudará a adquirir un mejor entendimiento de la enfermedad con el propósito de mejorar su control y prevención. Confidencialidad: Su información será mantenida confidencialmente de acuerdo con la práctica médica estándar. Su nombre no será utilizado en ningún reporte o publicación resultante de este estudio. La información del estudio será codificada y guardada en archivos bajo llave. Sólo el personal del estudio tendrá acceso a los archivos cuando sea necesario. Pág. 1 de 2. 106 Consideraciones Financieras: Su participación en el estudio no implicará algún gasto para usted. Los exámenes de laboratorio, incluyendo la baciloscopía, cultivo y la determinación de la actividad enzimática de la muestra, serán realizados para cada participante sin ningún costo, No se les dará compensación directa por participación en el estudio. Preguntas: Si usted tiene alguna pregunta o problema relacionado con este estudio, por favor no dude en contactar a la Licda. Eyda de Campollo (Tel. 24111800, Extensión 1176) o al Dr. Carlos Ovando (Tel. 24720298). Participación voluntaria: Su participación en este estudio es voluntaria. Usted puede decidir no ser parte del estudio o salir de él en cualquier momento y sin ningún perjuicio en su tratamiento médico. Consentimiento: 1. Yo reconozco que mi participación en el estudio es voluntaria. Tengo la libertad para participar o salir del estudio en cualquier momento. 2. Yo doy permiso a los investigadores de este estudio, para usar la información recolectada en el cuestionario y concedo el acceso a mi archivo médico del hospital. Nombre del Paciente_______________________________________________ Firma del paciente o familiar: ________________________________________ Fecha: _____________________________________________________________ pág. 2 de 2. 107 IV.4.3. Anexo No.3 Informe de Resultado. 108 IV.4.4. Tablas de Referencia. 109 110 FOTOS CAPACIDAD INSTALADA EN LOS LABORATORIOS DEL I2QB3, UNIVERSIDAD MARIANO GÁLVEZ. Foto No. 1 Área Norte de Nivel de Seguridad III Foto No. 2 Área Sur de Nivel de Seguridad III 110 Foto No. 3 Área Sur de Nivel de Seguridad III Foto No. 4 Área de Esterilización, Lavado y Preparación de Material 111 Foto No. 5 Recepción de Muestras Foto No. 6 Preparación de Muestras 112 Foto No. 7 Cultivo de Muestras Foto No. 8 Cultivo de Muestras 113 Foto No. 9 Centrifugación de Muestras Foto No. 10 Centrifugación de Muestras 114 Foto No. 11 Incubación de Muestras Foto No. 12 Incubación de Muestras 115 Foto No. 13 Lectura de Cultivos Foto No. 14 Lectura de Cultivos 116 Foto No. 15 Determinación de Enzima Adenosín Deaminasa Foto No. 16 Determinación de Enzima Adenosín Deaminasa 117 Foto No. 17 Alimentación de Base de Datos Foto No. 18 Manejo de Información 118 Foto No. 19 Referencia de Muestras Foto No. 20 Identificación de BAAR en Los Frotis 119 Foto No. 21 Prueba de Nitratos Foto No. 22 Prueba de Niacina 120 Foto No. 23 Concentraciones de Estándares Foto No. 24 Valor en el Rango Positivo para la determinación de Adenosín Deaminasa 121 Foto No. 25 Valor Alto en la Determinación de Adenosín Deaminasa Foto No. 26 Valor Bajo en la Determinación de Adenosín Deaminasa 122 AD-R-0013 DÉCIMA CONV OCATORIA LINEA FODECYT Nombre del Proyecto: Determinación de los niveles de ADA para diagnóstico de tuberculosis en pacientes con derrame pleural que acuden a los hospitales de referencia nacional en la ciudad de Guatemala, durante los años 64-2006 Licda. Eyda de Campollo Q346.146,01 18 MESES 01/09/2006 al 29/02/2008 PRÓRROGA AL 30/06/2008 En Ejecuciòn TRANSFERENCIA Asignacion Menos (-) Pendiente de Mas (+) Ejecutado Presupuestaria Numero del Proyecto: Investigador Principal: Monto Autorizado: Fecha de Inicio y Finalización: Grupo Renglon Nombre del Gasto Ejecutar 1 181 122 142 123 163 185 196 2 241 243 261 267 268 269 272 291 295 3 323 Servicios no personales Estudios, investigaciones factibilidad y proyectos de Impresión, encuadernación y reproducción Fletes Mantenimiento y reparación de equipo médico, sanitario y de laboratorio Servicios de capacitación Servicios de atención y protocolo MATERIALES Y SUMINISTROS Papel de escritorio Productos de papel o cartón Elementos y compuestos químicos Tintes, pinturas y colorantes Productos plásticos, nylon, vinil y pvc Otros productos químicos y conexos Productos de Vidrio Útiles de oficina Útiles menores, médico-quirúrgicos y de laboratorio PROPIEDAD, PLANTA, EQUIPO E INTANGIBLES Equipo médico, sanitario y de laboratorio GASTOS DE ADMÓN. (10%) MONTO AUTORIZADO (-) EJECUTADO SUBTOTAL (-) CAJA CHICA TOTAL POR EJECUTAR Q Q Q 183.882,00 4.838,00 10.500,00 Q 7.100,00 Q 6.300,00 Q 2.900,00 Q 162.036,00 Q 868,75 Q Q Q 21.846,00 3.969,25 3.400,00 Q Q Q 2.167,07 430,00 539,00 Q Q Q 1.232,93 2.348,10 Q Q Q Q Q 161,21 1.130,46 24.601,28 974,50 6.449,95 359,15 Q Q 10.109,50 298,05 Q Q Q Q Q Q Q Q 50,20 148,72 128,50 158,05 1.050,00 20,50 61,10 Q 7.831,88 Q 6.696,54 Q 3.522,34 Q Q 59.965,72 31.467,82 Q Q 314,47 - Q 307.895,85 Q 38.250,16 Disponibilidad Q 38.250,16 Q Q Q Q Q Q Q 5.250,00 Q 2.362,90 Q 161,21 Q 1.180,66 Q 4.100,00 20.650,00 1.103,00 6.608,00 1.050,00 10.130,00 Q Q 4.087,00 Q Q 60.280,19 31.467,82 Q 346.146,01 Q Q Q 346.146,01 307.895,85 38.250,16 Q 38.250,16 430,00 Q 1.700,00 Q 14.062,90 Q 13.632,90 V.2 CRONOGRAMA TRIMESTRAL DE ACTIVIDADES No ACTIVIDAD 1 Septiembre 2006 a mayo del 2008 3er Tri 4to Tri, 5to Tri 1er Tri. 2do Tri. 6to Tri. Solicitud de Fondos al Concyt X X X X X X 2 Compra de Equipo, Materiales y Suministros X X X X X X 3 Preparación de Papelería. X X X X X AMPLIACIÓN X 4 5 Elaboración de Medios de Cultivo , Reactivos y Calibración de Equipos. X Elaboración de Base de Datos X X X 6 Coordinación e Inducción al Personal de Salud X X 7 Coordinación /Toma de Muestras 8 Conservación de Muestras 9 Transporte y Referencia de Muestras 10 Procesamiento de Muestras X X X X X X X X X X X X X X X X X X X X X X X X Alimentación de Base de 11 Datos X X X X X 12 Visita de Supervisión X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X Elaboración de Informes 13 Preliminares Control de Calidad ( otros 14 gastos) X Mantenimiento y Reparación 15 de Equipo. X 16 Elaboración de Informe Final X X X X X X X X X X 17 Impresión de Informe Final. Licda. Eyda de Campollo Dr. Ricardo Mena Licda. Ana Barrientos UMG HGSJDD UMG Téc. Milagro de Enríquez Sra. Lorena Zea 124 X UMG UMG EQUIPO DE INVESTIGACIÓN Licda. Eyda Lissette Mendía de Campollo Directora del Área de Biotecnología Instituto de Investigaciones Químicas, Biológicas, Biomédicas y Biofísicas Universidad Mariano Gálvez Dr. Carlos Alberto Ovando Melchor Epidemiólogo del equipo área de salud Guatemala Ministerio de Salud Pública y Asistencia Social Dr. Luis Vicente Sánchez Bustamante Representante de Fundación Damián Dr. Ricardo Mena Epidemiólogo del Hospital General San Juan de Dios Ministerio de Salud Pública y Asistencia Social Licda. Ana Esther Barrientos Medrano Asistente Profesional de Servicios Instituto de Investigaciones Químicas, Biológicas, Biomédicas y Biofísicas Universidad Mariano Gálvez Sra. Milagro Gómez de Enriquez Técnica de Laboratorio Instituto de Investigaciones Químicas, Biológicas, Biomédicas y Biofísicas Universidad Mariano Gálvez Sra. Lorena Zea Técnica de Laboratorio Instituto de Investigaciones Químicas, Biológicas, Biomédicas y Biofísicas Universidad Mariano Gálvez 125