Aspectos biomédicos de las inmunocalinas en la especie humana*
Anuncio

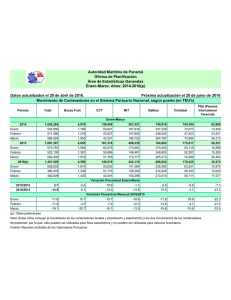
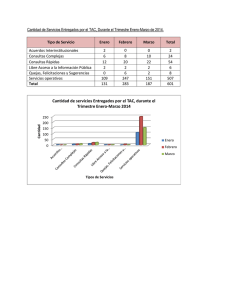
77 Aspectos biomédicos de las inmunocalinas en la especie humana* GRÉGORY ALFONSO GARCÍA MORÁN1 ANANÍAS GARCÍA CARDONA2 Resumen La familia de las lipocalinas está compuesta de varios miembros proteicos que son definidos, en general, por la actividad de unión de ligandos lipofílicos. Un subgrupo de lipocalinas, notablemente la glicoproteína ácida alfa 1, la-microglobulina alfa 1, la glicodelina, la lipocalina asociada a la gelatinasa del neutrófilo, la subunidad gamma del factor C8 del complemento, la prealbúmina lacrimal y la sintetasa de la prostaglandina D, ejercen significativas funciones inmunológicas, porque pueden tener actividad antiinflamatoria o antimicrobiana. Asimismo, muchos de los principales alergenos en los mamíferos son lipocalinas, lo que puede reflejar su conexión con el sistema inmune. Esta revisión resume estos hallazgos científicos y sus implicaciones en la salud humana. Palabras clave: Alergia, inflamación, inmunidad, inmunocalinas, lipocalina, prostaglandinas D2. * Este artículo es producto del grupo de Investigación Formativa en Ciencias Básicas del Instituto de Investigación, de la Facultad de Medicina, de la Fundación Universitaria Sánitas. 1 Docente facilitador, y docente experto Genética, y Biología Celular y Molecular. Facultad de Medicina, Unidad de Educación e Instituto de Investigación, Fundación Universitaria Unisánitas; Docente posgrado, Laboratorio de Inmunología Clínica, Facultad de Ciencias, Pontificia Universidad Javeriana, Bogotá, D.C. 2 Docente, coordinador, Unidad de Morfología, Facultad de Medicina y Facultad de Rehabilitación, Terapia y Desarrollo Humano, Instituto de Ciencias Básicas, Universidad del Rosario, Bogotá, D.C. Recibido: 24/04/2007 Revisado: 30/05/2007 Aceptado: 15/06/2007 Univ. Méd. Bogotá (Colombia), 49 (1): 77-96, enero-marzo de 2008 78 Tittle Introducción Biomedical aspects of the immunocalins in human species La familia de las lipocalinas está compuesta por varios miembros proteicos que comparten una estructura común, en general, definida por la unión y el transporte de ligandos lipofílicos. Abstract The lipocalin family is composed of various proteic members that are defined in general by the lipophylic ligand binding. A subset of the lipocalins, notably alpha(1)-acid glycoprotein, alpha(1)microglobulin, glycodelin, neutrophil gelatinaseassociated lipocalin, complement factor gamma-subunit, tear prealbumin, and prostaglandin D synthase, exert significant immunology functions, because may have anti-inflammatory and/ or antimicrobial activity. Most major mammalian allergens are lipocalins and may reflect the connection between lipocalins and the immune system. This review summarizes these findings and their implications in human heath. Key words: Allergy, inflammation, immunity, immunocalin, lipocalina, prostaglandin D2 (PGD2). Las lipocalinas están implicadas en: • Transporte de lípidos. • Fisiología hematoinmune como antiinflamatorios y antimicrobianos. • Neurofisiología, en especial del sueño. • Fisiología de la reproducción y la fertilidad. • Génesis de la inflamación alérgica, puesto que se comportan como alergenos. Figura 1. Fisiología general de las LCN García G.A., García A., Aspectos biomédicos de las inmunocalinas en la especie humana 79 • Embriogénesis renal y transporte del hierro (figura 1). Las lipocalinas desempeñan un rol en la fisiopatología y la bioclínica de diversas entidades patológicas, según sus variaciones en la concentración plasmática y en diversos líquidos biológicos. En la electroforesis proteica sanguínea, las lipocalinas equivalen y se sitúan en la banda alfa (2µ)microglobulina. El nombre de lipocalina fue propuesto en 1987 por Pervai y Brew, para un grupo de más de 150 proteínas hasta ahora identificadas, de expresión predominantemente extracelular, de masa molecular promedio de 18 a 20 kDa, con una longitud promedio de 200 aminoácidos; están presentes filogenéticamente en las eubacterias, relacionadas estructuralmente, compartiendo una identidad menor del 20% en promedio, las cuales tienen capacidad de acarrear sobre sí pequeñas moléculas lipofílicas. Las lipocalinas, junto con los miembros de la familia de las proteínas unidoras de ácidos grasos (fatty acid binding proteins, FABP), los miembros de la familia de la avidina (proteínas presentes en la clara del huevo, que secuestran la vitamina llamada biotina), los miembros de la familia de las triabinas y ciertos inhibidores de metaloproteinasas, constituyen la superfamilia de las calicinas[1, 2]. El objetivo de este artículo es revisar la información aportada por la investigación biomédica del papel de las lipocalinas en biología, fisiopatología y bioclínica hematoinmune, de tal manera que predomina un estilo de revisión descriptiva. Metodología Esta revisión es de tipo narrativo y descriptivo. Nuestra búsqueda se sustentó en dos campos: los bancos de genética, genómica, proteómica y enzimología, y los bancos de bibliografía científica. En el primer caso se consultó el Banco de Genética y Genómica Humana MIM (Mendelian Inheritance McKusick)[3] y el HUGO (Human Genome Organization)[4]. La nomenclatura y codificación para genes, proteínas y trastornos relacionados, que se utiliza es la asignada por MIM y HUGO. Para la búsqueda de bibliografía y literatura científica médica humana, se consultaron los dos principales bancos electrónicos: el banco norteamericano PubMedline (National Library of Medicine database)[5] y el banco europeo EMBASE (The bibliographic database for biomedical and pharmacological information)[6]. La matriz de búsqueda que se aplicó para PubMed y EMBASE fue “human Univ. Méd. Bogotá (Colombia), 49 (1): 77-96, enero-marzo de 2008 80 lipocalin review” con los campos “immunology, hematology, biology, immunobiology, pathobiology, pathology”, con los conectores “or, and, or/ and”, y los límites de fecha “2000corriente”. Decidimos aplicar límites anuales desde 2000, dada la poca información existente. Características generales de las lipocalinas: estructura y función A pesar de la poca similitud en la secuencia de los distintos miembros (20%), los estudios de la estructura tridimensional (3D) sugieren una estructura unidora de ligandos, dependiente de secuencias muy conservadas de aminoácidos, que exhiben la formación de un número variable de láminas plegadas beta (usualmente 8) con las que se conforma una estructu- ra similar a una canasta de baloncesto, denominada barril beta, que le permite unir ligandos lipofílicos. La actividad molecular y bioquímica de las lipocalinas se sustenta en seis eventos: • Unión y transporte de moléculas lipofílicas, como componentes del complejo vitamínico A (por ejemplo, ácido retinoico todo trans, ácido 9-cis-retinoico, retinal todo trans, 13-cis-retinal, retinol todo trans), incluso retinoides y precursores carotenoides, hormonas esteroideas y tiroideas, ácidos grasos (en especial de cadena larga), ácidos biliares, agentes inmunógenos lipofílicos, fármacostóxicos y moléculas odorantes, olfatorias y gustativas. El término Figura 2. Lípidos ligandos para las LCN García G.A., García A., Aspectos biomédicos de las inmunocalinas en la especie humana 81 apolipocalinas hace referencia a la proteína libre que no está uniendo y transportando ligandos lipófilos (figura 2). ganeso, la cual disminuye en presencia de sales de sodio. Esta actividad podría ser fundamental como microbicida (figura 3). • Unión y transporte de hierro. • Actividad unidora de receptores de membrana. • Actividad formadora de complejos macromoleculares, como con ciertas proteasas o mediadores de la comunicación celular, como la interleucina 8 (IL8). • En forma variable, algunos miembros tienen la capacidad de biosintetizar eicosanoides del tipo prostaglandinas de la serie D2 (PGD2). • Actividad como endonucleasas, dependiente de magnesio o man- Estas actividades bioquímicas sustentan diversos fenómenos celulares y tisulares, como la proliferación, la división y la supervivencia celulares, y la apoptosis. La gran variedad de funciones biológicas de las lipocalinas es mediada por la conjunción de las seis capacidades mencionadas, cada una de ellas ejercida en una menor o mayor proporción, entre los distintos miembros. Así, por ejemplo, la actividad unidora y transportadora de moléculas odorantes (feromonas), olfatorias y Figura 3. Actividad molecular de las LCN Univ. Méd. Bogotá (Colombia), 49 (1): 77-96, enero-marzo de 2008 82 gustativas, les confiere un papel fundamental en la fisiología del sentido compuesto sensitivo y sensorial del gusto y el olfato. La unión y el transporte de moléculas antigénicas lipofílicas las relaciona con funciones inmunes. La actividad unidora de metales como el hierro, depende de la presencia variable de grupos prostéticos. El transporte y la unión son clave en la fisiología para la captación de tipo nutricional, la depuración o aclaramiento (clearance) y la reabsorción de compuestos endógenos y exógenos en el epitelio (por ejemplo, el sistema tubular renal). También son esenciales en el transporte citosólico de moléculas lipofílicas que ejercen control sobre la transcripción a través de receptores nucleares, es decir, complejo vitamínico A, ácidos grasos, ácidos biliares y metabolitos intermedios de los esteroles (por ejemplo, farnesoides). Algunas de ellas tienen actividad barredora de lípidos modificados, que pueden desencadenar situaciones patológicas[1, 2, 7, 8]. • Receptor de membrana que interactúa con la lipocalina 1 (lipocalin-interacting-membranereceptor, LIMR), y • Megalina. El LIMR (MIM610007) es una proteína decodificada a partir de un gen de 17 exones, con 487 aminoácidos, una masa molecular de 55 kDa, 9 regiones transmembrana y una región amino-terminal orientada hacia el espacio extracelular. El LIMR se expresa en testículos, glándula pituitaria, glándula suprarrenal, placenta, timo, cerebelo, estómago, glándula mamaria y médula espinal de adultos, y en riñon y pulmón fetales; hay baja expresión en colon, páncreas y próstata. Por su parte, la megalina, también denominada LRP2 (lipoprotein receptor related 2, LRP2), es un receptor epitelial que forma parte de un complejo captador de membrana denominado megaCUBAM. El megaCUBAM, según el tipo celular variable, está constituido por proteínas como: • Megalina. Receptores de superficie para las lipocalinas Al parecer hay muchos receptores para las lipocalinas, pero se han definido parcialmente sólo dos: • El receptor para la alfa-2-macroglobulina, también denominado CD91 o LRP1 (lipoprotein receptor related 1). • Cubilina. • AMN (amnionless). García G.A., García A., Aspectos biomédicos de las inmunocalinas en la especie humana 83 • RAP (receptor associated protein). • Uromodulina, también denominada como proteína de TammHorsfall. Este complejo puede unir lipocalinas solas o unidas a sus ligandos lipofílicos, captarlos con fines nutricionales celulares o para su reabsorción tubular renal o para su degradación lisosómica. También puede generar cascadas de segundo mensajeros tras la unión de las lipocalinas y así regular la expresión génica (figura 4) (9-11). Lipocalinas como enzimas involucradas en la biosíntesis de prostaglandinas de la serie D2 La biosíntesis de la serie D2 de las prostaglandinas es efectuada por dos tipos de enzimas: • Sintetasa de lipocalina, denominada L-PGDS (lipocalina-prostaglandina D2-sintetasa). • Sintetasa no lipocalina, denominada H-PGDS, de alta expresión en células y tejidos hematoinmunes (figura 5). Figura 4. Complejo receptor de membrana para LCN Univ. Méd. Bogotá (Colombia), 49 (1): 77-96, enero-marzo de 2008 84 De acuerdo con la clasificación enzimática de la International Union of Biochemistry and Molecular Biology (IUBMB), se clasifica tal actividad como EC 5.3.99.2. y el nombre sistémico bioquímico corresponde a (5,13)-(15S)-9a, 11a-epidioxi-15hidroxiprosta-5, 13-dienoato Disomerasa. Ambas enzimas utilizan cofactores sulfhidrilos; es así que la actividad de la sintetasa de lipocalina, L-PGDS, depende de la presencia de compuestos sulfhidrilos distintos al glutatión. Por el contrario, la sintetasa no lipocalina, H-PGDS, sí es dependiente de glutatión y se clasifica como una transferasa de glutatión, miembro de la subfamilia sigma[12, 13]. Inmunocalinas (inmunolipocalinas): lipocalinas de acción hematoinmune Algunas lipocalinas participan en la inmunidad innata, de tipo antiinflamatorio, antimicrobiano o ambos, como: • • • • • • Alfa-1-microglobulina. Glicoproteína ácida alfa 1. Glicodelina. Lipocalina1. Lipocalina 2. Fracción C8G del complemento y L-PDGS (figura 6). Figura 5. Biosíntesis de la PGD2 García G.A., García A., Aspectos biomédicos de las inmunocalinas en la especie humana 85 Figura 6. Las inmunoLCN Muchas de estas inmunocalinas son proteínas de fase aguda de la inflamación producidas en el hígado. Su actividad se relaciona variablemente con su carácter de lipocalinas unidoras y transportadoras de moléculas lipofílicas, tanto del huésped como del microorganismo patógeno; otro aspecto principal de su participación en la inmunofisiología se deriva de la unión, el secuestro y el transporte del hierro, como también de su actividad en la biosíntesis de prostaglandinas. Otras poseen actividad antimicrobiana directa por sus propiedades catiónicas que unen paredes celulares microbianas negativamente cargadas, como sucede en particular con la lipocalina 2. Esta última secuestra hierro creando un ambiente ferropénico para el pató- geno invasor[14]. Hasta el presente, en la especie humana se encuentran 20 miembros bien definidos. En la tabla 1 se consignan los datos genómicos, proteómicos y bioquímicos de las siete principales inmunocalinas. Lipocalina 1: una lipocalina glandular exocrina La lipocalina 1 se decodifica de un gen a partir del cual se producen cuatro isoformas por corte y empalme alternativo. La variedad de 176 aminoácidos, que es la más estudiada, une los lípidos de la capa lipídica del fluido lacrimal de la córnea; al unir estos lípidos producidos por las glándulas de Meibomio, se estabiliza la capa lipídica de interfase y disminuye la tensión superficial. Univ. Méd. Bogotá (Colombia), 49 (1): 77-96, enero-marzo de 2008 86 La lipocalina 1 es producida, también, por las glándulas sudoríparas ecrinas, las glándulas salivares, la glándula prostática, las células mucosas nasales, las glándulas traqueobronquiales y las células corticotropas de la adenohipófisis. La lipocalina 1 participa activamente en la captación de sabores. La lipocalina 1 es inducida por inflamación, infección o hierro. La lipocalina 1, la lactoferrina, la cistatina S y la lisozima son proteínas antibacterianas que se encuentran en el fluido lacrimal, de las cuales las tres primeras son miembros de la familia de las cistininas (inhibidores de la proteinasa cistinina), que ofrecen un mecanismo más de control negativo para la inflamación desaforada. La producción de estas cuatro proteínas varía en diversas enfermedades autoinmunes que afectan las glándulas lacrimales, como la enfermedad de Sjögren, la enfermedad Adamantiades-Behçet o la enfermedad de Vogt-Koyanagi-Harada; incluso, la lipocalina 1 es un autoantígeno en la enfermedad de Sjögren[15-18]. Lipocalina 2 como inhibidora y estabilizadora de la metaloproteasa de matriz tipo 9 La lipocalina 2 es una glicoproteína que se decodifica a partir de un gen que contiene 7 exones y genera cinco versiones por corte y empalme alter- nativo, que explican los diversos reportes de masa molecular variable (19,2, 22,6 ó 25 kDa); la versión más estudiada es la de 198 aminoácidos. Originalmente, se aisló de los gránulos de los neutrófilos polimorfonucleares. Puede ser monomérica y homodimérica o heterodimérica; en este último caso forma un complejo con la metaloproteinasa MMP9, también conocida como la gelatinasa del neutrófilo polimorfonuclear. La lipocalina 2 estabiliza y aumenta la vida media de la MMP9. La lipocalina 2 también puede formar macrocomplejos con la IL8, conocida citocina promotora de migración y activación del polimorfonuclear. El secuestro de la MMP9 y la IL8 explican en gran parte su actividad antiinflamatoria. La lipocalina 2 también es producida por muchos tejidos que son expuestos a microorganismos, en especial, los tejidos epiteliales durante la inflamación. Se ha sugerido que podría tener actividad en la biosíntesis de las prostaglandinas como algunas de sus familiares. A diferencia de las otras lipocalinas, posee gran una mayor cantidad de aminoácidos polares cargados positivamente, por lo cual, por mucho tiempo, se sugirió que la lipocalina 2 reconoce los formilpéptidos microbianos, pero su estructura no sustenta esta hipótesis; es más García G.A., García A., Aspectos biomédicos de las inmunocalinas en la especie humana 87 Tabla 1 Genética y genómica de las inmunocalinas Miembro Nomenclatura alterna MIM Localización cromosómica LCN1 (lipocalina 1) VEGP (proteína similar a la proteína producida por la glándula salival menor sublingual posterior de von Ebner de los mamíferos), prealbúmina lacrimal 151675 9q34 LCN2 (lipocalina 2) NGAL (lipocalina asociada a la gelatinasa del neutrófilo), OBCN 24P3 (lipocalina oncogénica 24P3), uterocalina, siderocalina 600181 9q34 120930 9q34 C8G (subunidad gamma del componente 8 de la cascada del complemento) PTGDS (sintetasa de prostaglandina D2) Beta-TRACE, cerebrina-28 176803 9q34 ITI (inhibidor de la interalfa-tripsina) cadena liviana AMBP (microglobulina alfa 1), bikunina 176870 9q34 ORM1 (oroso-mucoide 1) AGP1 (glicoproteína ácida alfa 1) tipo 1 138600 9q34 Glicodelina Beta-lactoglobulina, PP14, PAEP (proteína endometrial asociada a progestágenos) 173310 9q34 probable su interacción con la porción lipídica de los lipopolisacáridos. La lipocalina 2 se puede detectar en médula ósea, útero, próstata, glándulas salivales, glándulas lacrimales, estómago, apéndice cecal, colon, tráquea, pulmones, glándula mamaria y, en el feto, en el bazo y el pulmón. La lipocalina 2 es un factor regulador negativo de la hematopoyesis de tipo pro- Univ. Méd. Bogotá (Colombia), 49 (1): 77-96, enero-marzo de 2008 88 apoptótico, cuya expresión es suprimida por la interleucina 3 (IL3). Estudios adicionales a este respecto han mostrado que el fármaco MK886, que es un inductor de apoptosis por la inhibición que hace de la 5 lipooxigenasa al interactuar específicamente con su proteína activadora (FLAP), también induce apoptosis directamente y, posiblemente, a través de la inducción de lipocalina 2. Hoy hay más tendencia, por las evidencias existentes, a pensar que la lipocalina 2 se produce en células que están en estrés y que es una defensa en contra de los tóxicos (por ejemplo, lípidos oxidados o sobrecarga de hierro) o que facilita la supervivencia de las células, más que sea o desempeñe un rol pro-apoptótico. Este efecto proapoptótico, aún no definido, también se ha encontrado en la glándula mamaria y el endometrio no neoplásicos en regresión hormonal. La lipocalina 2 es expresada junto con la MMP9 en altas concentraciones por células neoplásicas y esto se correlaciona con el pronóstico y el potencial metastásico en algunos estudios; en otros estudios muestra que la expresión de lipocalina 2 sola promueve la diferenciación y es de buen pronóstico. Todo esto nos hace concluir que aún se espera mayor investigación para elucidar las verdaderas actividades biológicas y fisiopatológicas de la lipocalina 2 en el cáncer[19-22]. Lipocalina 2 y el metabolismo del hierro La lipocalina 2 une sideróforos bacterianos de la clase catecolato tipo férrico, como la enteroquelina, a través de una interacción permutada cíclicamente entre el híbrido electrostático y el catión pi. Esto explica su potente acción bacteriostática, ya que atrapa hierro y limita su disponibilidad. Incluso atrapa los sideróforos de las micobacterias, denominados carboximicobactinas. El gen que codifica la lipocalina 2 es activado en la inflamación secundaria a infección, entre otros estímulos, por la cascada de señalamiento dependiente de los receptores TLR (toll-like receptor 2). La lipocalina 2 participa en el metabolismo del hierro, ya que normalmente une y transporta este metal; incluso, hay evidencias de la filtración glomerular del complejo y su consecuente recaptación por la megalina en el túbulo proximal, con la reabsorción secundaria del hierro. La lipocalina 2 forma parte de lo que se llama pool de hierro no unido a transferrina (nontransferrin-bound iron, NTBI), el cual es una ruta de transporte importante durante el desarrollo en el útero y en estados de sobrecarga férrica (por ejemplo, hemocromatosis). La lipocalina 2 García G.A., García A., Aspectos biomédicos de las inmunocalinas en la especie humana 89 dentro del NTBI une y transporta ferro-ascorbato, ferro-citrato y ferronitrilotriacetato. La lipocalina 2 participa en la activación y represión de genes regulados por el hierro, pues une y libera hierro en el citoplasma para tal efecto. La lipocalina 2 sufre ciclos de captación y liberación a partir de los endosomas, pero su sensibilidad al pH y su localización subcelular difieren totalmente a partir de la transferrina. Esto parece ser fundamental tanto en la respuesta innata como en la embriogénesis epitelial, en especial, la renal[23]. Lipocalina 2 y la promoción de la embriogénesis renal La lipocalina 2 es un factor nefrogénico que participa en algunos pasos de la embriogénesis. Es producida por las gemas de los uréteres y actúa sobre el mesénquima metanéfrico derivado del mesodermo intermedio, regulando la diferenciación de éste hacia la formación de los glomérulos y los túbulos de la nefrona[24]. La inmunocalina C8ã La subunidad de masa molecular de 22 kDa conocida como C8gamma del complemento es una lipocalina, codificada a partir de un gen polimórfico en la especie humana. C8 es uno de los cinco componentes del complejo citolítico de ataque a membrana, junto con C5b, C6, C7 y C9. El C8 es un complejo triheteromérico formado por una subunidad alfa, una beta y una gamma. Las subunidades C8 alfa y C8 gamma están ligadas covalentemente por un puente disulfuro y se asocian no covalentemente con la subunidad C8 beta (25). La inmunocalina alfa-1microglobulina La alfa-1-microglobulina, también denominada proteína HC, se libera por escisión proteolítica a partir del precursor de la bikunina. Su masa molecular es de 31 kDa y fue originalmente aislada a partir de la orina de pacientes con envenenamiento crónico con cadmio. Puede encontrarse libre o en un complejo con la inmunoglobulina A (IgA) en la sangre, el líquido cefalorraquídeo y la orina, en bajas concentraciones, y está presente en altas concentraciones en el síndrome nefrótico y en la proteinuria tubular, al igual que en la sangre y la orina de pacientes en diálisis renal. La alfa-1-microglobulina se encuentra en el plasma sanguíneo y en los tejidos conectivos estromales de diversos órganos. Es más abundante o concentrada en la interfase entre las células y su inmediato espacio extracelular, en par- Univ. Méd. Bogotá (Colombia), 49 (1): 77-96, enero-marzo de 2008 90 ticular, en los pulmones, intestinos, riñones y placenta. Filogenéticamente es antigua y se correlaciona con la coloración críptica en varias especies de vertebrados, como las ranas y los peces, dado que une cromóforos amarillo-café de pequeña talla generados por grupos prostéticos unidos a los residuos aminoacídicos de ella. Se ha relacionado recientemente con el catabolismo del grupo hem por medio de un mecanismo desconocido que conlleva a la formación concomitante de cromóforos derivados de la quinurenina, los cuales están muy estrechamente unidos a los residuos aminoacídicos del bolsillo hidrofóbico de esta lipocalina[26]. La inmunocalina glicoproteína ácida alfa 1 Esta lipocalina es una proteína altamente glicosilada, en especial con ácido siálico, lo cual le da una importante carga negativa. Es una proteína de fase aguda hepática, aunque puede ser sintetizada por otros tipos celulares. Su glicosilación varía por diversos factores, lo cual, como se ha encontrado, redundaría en su actividad. Su efecto es inhibitorio sobre la actividad del neutrófilo, la plaqueta y la activación y consecuente degranulación plaquetaria. Es llamativo que su efecto sobre el linaje monocitomacrófago-célula dendrítica es activador, con la inducción de citocinas proinflamatorias, lo cual hace pensar que esto es fundamental para su posible inducción hepática[27]. La inmunocalina L-PGD2S Esta enzima cataliza la conversión de la prostaglandina de serie H2 hacia la serie D2. L-PGDS representa, aproximadamente, el 3% de las proteínas del líquido cefalorraquídeo humano y es la segunda proteína cuantitativamente más importante después de la albúmina. Es expresada por oligodendrocitos, leptomeninges y epitelio de los plexos coroideos. Su expresión también es importante en el humor acuoso y el fluido amniótico. Su actividad se ha relacionado con inducción del sueño, termorregulación, modulación del dolor, inhibición de la agregación plaquetaria, relajación de músculos lisos, e incluyen como resultados la vasodilatación, la respuesta inflamatoria en especial alérgica, la reproducción, la fertilidad y la liberación hormonal. Al parecer, gran parte de las actividades mencionadas para la L-PGDS depende de su generación de PGD2. La actividad de la L-PGDS está más acoplada tempo- García G.A., García A., Aspectos biomédicos de las inmunocalinas en la especie humana 91 roespacialmente con las ciclooxigenasas constitutivas (nCOX y eCOX). PGD2 actúa por medio de receptores serpentina asociados a sistemas de tranducción de señales del tipo proteínas G triméricos; se reconocen dos tipos de éstos: DP1 y DP2 (también denominados CRTH2 ó GPR44). La PGD2 ejerce otros efectos indirectamente puesto que es a partir de ella que se biosintetizan las prostaglandinas de la serie J2 (PGJ2, delta12-PGJ2 y 15-desoxi-delta(12,14)-PGJ2). Las PGJ2 se sintetizan espontáneamente y anaenzimáticamente por deshidratación a partir de la PGD2. Las PGJ2 son ligandos para los receptores nucleares y factores de transcripción denominados isotipos gamma del receptor activador de la proliferación peroxisomal (PPARG), en especial, la 15-desoxi-delta(12,14)-PGJ2(15DDPGJ2). Para la activación de PPARG se necesita de su heterodimerización con los receptores nucleares para el ácido 9-cisretinoico (también denominado rexinoide), en especial, los isorreceptores RXRB y RXRG La activación de PPAARG por 15DDPGJ2 puede estimular o reprimir la expresión génica y ello depende del tipo de cofactores de transcripción que se recluten y de los tipos de elementos de respuesta presentes en los promotores génicos. Los PPARG también son activados por diversos ácidos grasos poliinsaturados (AGEPI), algunos antiinflamatorios no esteroideos (AINE) y los fármacos antidiabéticos de la clase tiazolidinedionas, como la ciglitazona. Los PPARG han sido involucrados ampliamente con adipogénesis, metabolismo lipídico, sensibilidad a la insulina, apoptosis, e inmunorregulación (tanto antiinflamatoria como inmunosupresora) [28]. La inmunocalina glicodelina (beta-lactoglobulina) La beta-lactoglobulina es la proteína más abundante en la leche de las especies rumiantes equinas, ovinas y bovinas, y también está presente en la leche de muchas otras especies, pero no todas, dado que está ausente en roedores, lagomorfos y humanos. Por ejemplo, la vaca doméstica produce 2 a 3 g/L de esta lipocalina. Une varios ligandos lipofílicos como retinol, ácidos grasos, colesterol y vitamina D2. Fuera de esto, su exagerada expresión en la glándula mamaria de muchas especies sugiere que es importante principalmente como fuente de aminoácidos. En los humanos es una proteína de 172 aminoácidos y de masa molecular de 18,787 kDa, sintetizada por el endometrio secretor y la decidua, y secretada abundantemente por el endometrio bajo la influencia de la progesterona. No se expresa en el endometrio posmenopáusico, la Univ. Méd. Bogotá (Colombia), 49 (1): 77-96, enero-marzo de 2008 92 placenta, el hígado, el riñón ni las suprarrenales. Existen dos isoformas denominadas glicodelina A (GdA) y glicodelina S (GdS). La glicodelina A se encuentra en el líquido amniótico a partir del tercer trimestre de la gestación; tiene funciones contraceptivas, ya que inhibe la unión del espermatozoide a la zona pelúcida del huevo. La glicodelina S se encuentra en el plasma seminal y es secretada por las vesículas seminales. La expresión de glicodelina A se regula negativamente en la fase periovulatoria. Las glicodelinas también se detectan en las trompas de Falopio, ovarios, mamas, vesículas seminales, médula ósea, plaquetas y glándulas sudoríparas ecrinas (también denominadas merocrinas). Tanto la glicodelina A como la S son inmunosupresoras, pues deprimen la respuesta de múltiples células efectoras inmunes. Las glicodelinas son angiogénicas mediante la inducción del eje factor de crecimiento vascular endotelial A y su receptor (VEGFA/VEGFR). Se detectan niveles elevados de glicodelinas en forma circulante, en personas con neoplasias malignas genitourinarias o ginecológicas, al igual que en el tejido in situ. Esto se correlaciona con inmunosupresión y proangiogénesis paraneoplásica. Sin embargo, en algunos estudios de cáncer de ovario y de mama, se demues- tra que la expresión de las glicodelinas se correlaciona con un mejor pronóstico, lo que sugiere que favorece más la diferenciación que la inmunosupresión y la angiogénesis. Se necesitan más estudios en la relación con las glicodelinas y el cáncer. Una proteína de la misma familia de la proteína plasmática macroglobulina alfa 2 es la PZP (pregnancy zone protein), que se une de manera no covalente y forma un complejo con la lipocalina glicodelina. Tanto la PZP como la glicodelina son proteínas que se expresan en niveles elevados durante la gestación; tienen acción inmunomoduladora y producen inmunosupresión fisiológica en la gestación. La PZP también se encuentra en las plaquetas. La PZP y la macroglobulina alfa 2 son reconocidas por el receptor LRP1[29]. Lipocalinas y la génesis de la inflamación alérgica La interrelación de las lipocalinas con los trastornos inflamatorios alérgicos se hace a dos niveles: 1) Como ya habíamos mencionado, la PGD2 actúa por medio de receptores serpentina asociados a sistemas de tranducción de señales del tipo proteínas G triméricos: DP y CRTH2. La PGD2 es sintetizada, principalmente, por el linaje García G.A., García A., Aspectos biomédicos de las inmunocalinas en la especie humana 93 basófilo-mastocito; actúa sobre receptores presentes en el linaje linfoide T, por lo cual genera una diferenciación funcional Th2, que va a encargarse de desarrollar los estigmas patognomónicos, como la eosinofilia y la presencia de inmunoglobulinas relacionadas como IgE, gracias al cambio y la promoción de isotipo de anticuerpo. 2) Varias lipocalinas de diversos organismos son alergenos para la especie humana. Entre las lipocalinas que actúan como aeroalergenos se destacan: Mus m1 (ratón), Rat n1 (rata), Can f1 y Can f2 (perros), Equ c1 y Equ c2 (caballos), Bos d2 (vaca), Bos d5 (beta-lactoglobulina de la leche de vaca), Bla g4 (cucaracha) y las kernel presentes en las semillas leguminosas. En general, lo que se denomina alergenos respiratorios mayores provenientes de perros, ratones, ratas, caballos y vacas, son lipocalinas. Son fácilmente accesibles para nosotros, pues se sintetizan y expresan ampliamente en los tejidos y órganos de estos animales, al igual en la especie humana. Curiosamente, algunas lipocalinas aeroalergénicas puede poseer actividad sobre la endonucleasa. El reconocimiento por la inmunoglobulina E (IgE) varía; por ejemplo, en el alergeno Bos d5, los epítopos se encuentran a todo lo largo de la molécula, mientras que en Bos d2 se ubican en el extremo carboxiterminal. Algunas de estas lipocalinas poseen epítopos para el reconocimiento por linfocitos T, como sucede con Bos d5; estos sitios pueden variar en número, ya que en pacientes alérgicos se han detectado 5 epítopos distintos para Bos d2. El reconocimiento de estos epítopos varía en diversas poblaciones humanas alérgicas. Como es de esperarse, la respuesta frente a estos alergenos es de perfil celular y citocínico por linfocitos T ayudadores 2 (Th2). En la actualidad se está trabajando, con genética e inmunogenética estructural dirigida, en la modificación de estas lipocalinas aeroalergénicas para generar vacunas y para reorientar la respuesta hacia un perfil linfoide Th1, que es contra-alergénico[30-33]. Conclusión Es probable que filogenéticamente y evolutivamente las inmunocalinas surgieran como una parte integral de los sistemas de defensa de los organismos y, al parecer, constituyen una red citocínica accesoria y ampliamente extendida. Gran parte de la funcionalidad de las inmunocalinas se enfoca hacia la protección frente al daño de los tejidos. Este conocimiento abre una nueva frontera en la tera- Univ. Méd. Bogotá (Colombia), 49 (1): 77-96, enero-marzo de 2008 94 péutica farmacológica humana en inmunomodulación, dado su potencial uso como captadores antigénicos como opsoninas, o como antídotos o como antagonistas. Otras lipocalinas muestran también un potencial uso como marcadores en patología clínica y de laboratorio[34-37]; por ejemplo, recientemente se encontró que la lipocalina 2 urinaria es un potencial marcador de nefritis lúpica[38]. Bibliografía 1. García GA, Clavijo DA, Mejía OR, et al. Aspectos biomédicos de la familia de las lipocalinas (LCN) en la especie humana. Univérsitas Médica, 2007; 48 (2). 2. Grzyb J, Latowski D, Strzalka K. Lipocalins - a family portrait. J Plant Physiol. 2006; 163: 895-915. 3. 4. OMIM [base de datos]. Baltimore: Johns Hopkins University; 1966- [fecha de acceso: 27 de abril de 2007]. Disponible en: http://www.ncbi.nlm.nih.gov/ entrez/dispomim. HUGO [base de datos]. Bethesda: National Library of Medicine and others (exp.: Celera Genomics and the Sanger Center); 1989- [fecha de acceso: 27 de abril de 2007]. Disponible en: http://www.hugo-international.org/ index.html. 5. PubMed [base de datos]. Bethesda: National Library of Medicine; 1966[fecha de acceso: 27 de abril de 2007]. Disponible en: http://www.ncbi. nlm.nih.gov/PubMed/. 6. EMBASE [base de datos]. Amsterdam: Elsevier B.V.; 1974- [fecha de acceso: 5 de junio de 2007]. Disponible en: h t t p : / / w w w. i n f o . e m b a s e . c o m / embase_com/ 7. Flower DR, North AC, Sansom CE. The lipocalin protein family: structural and sequence overview. Biochim Biophys Acta. 2000; 1482: 9-24. 8. Yusifov TN, Abduragimov AR, Gasymov OK, et al. Endonuclease activity in lipocalins. Biochem J. 2000; 347: 815-9. 9. Flower DR. Beyond the superfamily: the lipocalin receptors. Biochim Biophys Acta. 2000; 1482: 327-36. 10. Faber K, Hvidberg V, Moestrup SK, et al. Megalin is a receptor for apolipoprotein M, and kidney-specific megalin-deficiency confers urinary excretion of apolipoprotein M. Mol Endocrinol. 2006; 20: 212-8. 11. García GA, Hernández S, Mejía OR, et al., Biología y patobiología humanas del complejo de absorción y transporte epitelial MegaCUBAM. Rev Med. 2007; 15:94-104. 12. Urade Y, Hayaishi O. Prostaglandin D synthase: structure and function. Vitam Horm. 2000; 58: 89-120. 13. Urade Y, Eguchi N. Lipocalin-type and hematopoietic prostaglandin D synthases as a novel example of functional convergence. Prostaglandins Other Lipid Mediat. 2002; 68-69:375-82. 14. Logdberg L, Wester L. Immunocalins: a lipocalin subfamily that modulates immune and inflammatory responses. Biochim Biophys Acta. 2000; 1482: 284-97. 15. Wojnar P, Dirnhofer S, Ladurner P, et al. Human lipocalin-1, a physiological scavenger of lipophilic compounds, is García G.A., García A., Aspectos biomédicos de las inmunocalinas en la especie humana 95 produced by corticotrophs of the pituitary gland. J Histochem Cytochem. 2002; 50: 433-5. 16. Katunuma N, Shiota H, Le QT. Medical significance of cysteine protease inhibitors in mammalian secretory fluids. J Med Invest. 2003; 50: 154-61. 17. Bron AJ, Tiffany JM, Gouveia SM, et al. Functional aspects of the tear film lipid layer. Exp Eye Res. 2004; 78: 347-60. 18. Navone R, Lunardi C, Gerli R, et al. Identification of tear lipocalin as a novel autoantigen target in Sjogren’s syndrome. J Autoimmun. 2005; 25: 229-34. 19. Neutrophil gelatinase-associated lipocalin as a survival factor. Biochem J. 2005; 391: 441-8. 20. Fernández CA, Yan L, Louis G, et al. The matrix metalloproteinase-9/ neutrophil gelatinase-associated lipocalin complex plays a role in breast tumor growth and is present in the urine of breast cancer patients. Clin Cancer Res. 2005; 11: 5390-5. 21. lausen P, Niemann CU, Cowland JB, et al. On mouse and man: neutrophil gelatinase associated lipocalin is not involved in apoptosis or acute response. Eur J Haematol. 2005; 75: 332-40. 22. Levy O. Antimicrobial proteins and peptides: anti-infective molecules of mammalian leukocytes. J Leukoc Biol. 2004; 76:909-25. 23. Flo TH, Smith KD, Sato S, et al. Lipocalin 2 mediates an innate immune response to bacterial infection by sequestrating iron. Nature. 2004; 432: 917-21. 24. Schmidt-Ott KM, Mori K, Li JY, et al. Dual action of neutrophil gelatinaseassociated lipocalin. J Am Soc Nephrol. 2007; 18: 407-13. 25. Schreck SF, Parker C, Plumb ME, et al. Human complement protein C8 gamma. Biochim Biophys Acta. 2000; 1482: 199-208. 26. García GA, Hernández S, Mejía OR, et al. Biología y patobiología humana del ácido hialurónico en la estabilización de la matriz extracelular y la inflamación. Rev Med UMNG. 2006; 14:80-7. 27. Hochepied T, Berger FG, Baumann H, et al. Alpha(1)-acid glycoprotein: an acute phase protein with inflammatory and immunomodulating properties. Cytokine Growth Factor Rev. 2003; 14: 25-34. 28. Herlong JL, Scott TR. Positioning prostanoids of the D and J series in the immunopathogenic scheme. Immunol Lett. 2006; 102:121-31. 29. Seppala M, Taylor RN, Koistinen H, et al. Glycodelin: a major lipocalin protein of the reproductive axis with diverse actions in cell recognition and differentiation. Endocr Rev. 2002; 23: 401-30. 30. Aalberse RC. Structural biology of allergens. J Allergy Clin Immunol. 2000; 106: 228-38. 31. Mantyjarvi R, Rautiainen J, Virtanen T. Lipocalins as allergens. Biochim Biophys Acta. 2000; 1482: 308-17. 32. Virtanen T. Lipocalin allergens. Allergy. 2001; 56 (Suppl 67): 48-51. 33. Ferreira F, Hawranek T, Gruber P, et al. Allergic cross-reactiviry: from gene to the clinic. Allergy. 2004; 59:243-67. Univ. Méd. Bogotá (Colombia), 49 (1): 77-96, enero-marzo de 2008 96 34. Xu S, Venge P. Lipocalins as biochemical markers of disease. Biochim Biophys Acta. 2000; 1482: 298-307. 37. Schlehuber S, Skerra A. Anticalins as an alternative to antibody technology. Expert Opin Biol Ther. 2005; 5:1453-62. 35. Skerra A. ‘Anticalins’: a new class of engineered ligand-binding proteins with antibody-like properties. J Biotechnol. 2001; 74:257-75. 38. Pitashny M, Schwartz N, Qing X, et al. Urinary lipocalin-2 is associated with renal disease activity in human lupus nephritis. Arthritis Rheum. 2007; 56: 1894-903. 36. Schlehuber S, Skerra A. Anticalins in drug development. BioDrugs. 2005; 19: 279-88. García G.A., García A., Aspectos biomédicos de las inmunocalinas en la especie humana