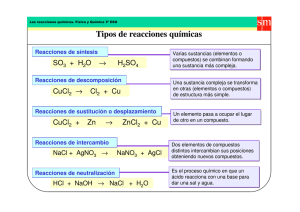
carreras tecnico quimico: profesorado en quimica licenciado en
Anuncio

UNIVERSIDAD NACIONAL DE CATAMARCA FACULTAD DE CIENCIAS EXACTAS Y NATURALES CARRERAS TECNICO QUIMICO: PROFESORADO EN QUIMICA LICENCIADO EN QUIMICA LICENCIADO EN CIENCIAS AMBIENTALES CURSO DE INGRESO 2012 A TEÓRICO –PRÁCTICA QUÍMICA-TÉCNICAS DE ESTUDIO Docenes Coordinadores: Lic. Susana Fiad y Msc. Dora Galarza Docentes a Cargo del Dictado: Prof. Elvira Lema Prof. Anabella Quevedo Prof. Laura Favore Ayte. Alumno: Maria Rosa Rodríguez CURSO DE INGRESO MODULO: QUÍMICA Y TECNICAS DE ESTUDIO OBJETIVOS: Diagnosticar los conocimientos de Química Básica que el alumno ingresante posee. Nivelar y afianzar los conocimientos de Química General e Inorgánica adquiridos en el Nivel Polimodal. Resolver situaciones problemáticas que permitan desarrollar los contenidos de la Química propios de la escuela media con otros previstos en ingresos universitarios. Preparar al alumno para que se inicie en el estudio avanzado de la Química. Favorecer la Inserción del alumno en la vida Universitaria. Estimular al alumno a emplear técnicas de estudio que faciliten la articulación en lo que respecta al aprendizaje de la Química, entre el Nivel Polimodal y el Universitario. Nivelar los conocimientos sobre las fórmulas y nomenclatura de la Química Inorgánica adquiridos en el Nivel Polimodal e incorporar fórmulas y nomenclaturas de compuestos inorgánicos que no se desarrollan habitualmente el Nivel Polimodal y que son requeridos por los contenidos previstos en el Programa de la asignatura, Química General. Desarrollar los procesos mentales que propendan a la construcción del conocimiento. Desarrollar experiencias en el laboratorio. METODOLOGÍA: se desarrollará mediante clases teórico-prácticas, clases prácticas de aula y de laboratorio, clases de consulta, Taller, Experiencias de laboratorio y se contará con la Guía de Actividades como material impreso DOCENTES RESPONSABLES: Lic. Susana Fiad, Msc.Dora Galarza, AUXILIARES DOCENTES: JTP. Prof. Elvira Leonor Lema; Prof. Anabella Quevedo AYUDANTES ALUMNOS: María Rosa Rodríguez-Laura Favore CONTENIDOS: Módulo I: Conceptos Básicos de Química Química: objeto .Método Científico. Materia. Propiedades físicas y químicas Propiedades extensivas e intensivas. Estados de la materia. Sistemas. Materiales. Métodos de separación de fases y Métodos de fraccionamiento. Sustancias simples y compuestas. El agua: importancia biológica. Propiedades del agua. Alotropía. Elementos químicos. Módulo II: Fórmulas y Nomenclatura de la Química Inorgánica. Fórmulas químicas y compuesto. Valencia. Fórmulas estructurales. Normas de nomenclatura: aspectos generales, normas prácticas elementales. Empleo de prefijos numéricos. Esquemas generales de nomenclatura inorgánica Reacción química. Ecuación química. Combinaciones binarias oxigenadas: óxidos básicos, ácidos, superiores, inferiores, anfóteros, mixtos y neutros. Otras combinaciones binarias. 1 Combinaciones ternarias y de orden superior: oxácidos, hidróxidos, sales: neutras, básicas, ácidas, dobles y mixtas. Módulo III: Técnicas de Estudio aplicadas a la Química. Las Técnicas de estudio. Cómo, donde y cuando estudiar. El horario personal y la organización del material de estudio. Las gráficas, cuadros, tablas y dibujos explicativos. Cómo tomar apuntes. Cómo preparar un examen. La memoria y las reglas nemotécnicas. Organigramas de aprendizaje: Mapas Conceptuales. Registro de los resultados. Redacción de Informes. La resolución de problemas en Química. BIBLIOGRAFIA: Fiad,S, (2009)“Guía Teórico Práctica: Química y Técnicas de Estudio” Fiad,S, (2006)“Guía Teórico Práctica. Química General” Coronel de Arias, M. ; Galarza de Moreno D. (1997), “Guía de Trabajos Prácticos de la Cátedra de Laboratorio I”. Facultad de Ciencias Exactas y Naturales. UNCa. -Brown.(1993) Química-La Ciencia Central. 5ta. Edición. Editorial Prentice-Hall Hispanoamericana. Brady-Humiston. (1993)Química Básica.Principios y Estructura. 2da. Edición. Chang.( 1996) Química. 4ta. Edición. Editorial McGraw Hill. Whitten-Gailey. (1992) Química General. Editorial McGraw Hill. 3era. Edición. Angelini-Baumgartener y otros. (1995) Temas de Química General. Editorial Eudeba. Long G- Henttz,F. (1991) Química General. Problemas y Ejercicios. 3era. Edición. Editorial Addison-Wesley Iberoamericana. Teijón-García – Jiménez - Guerrero. (2000) La Química en problemas. 2da. Edición. Editorial alfaomega. Quiñoa,E- Riguera,R. (1996). Nomenclatura y Formulación de los compuestos Inorgánicos. Una guía de estudio y autoevaluación. Editorial Mc Graw Hill Chemical Education Material Study.(1996) Manual de laboratorio para Química, Una ciencia Experimental. Editorial Reverté. -Ceretti,H-Zalts,A. (2000) Experimentos en Contexto. Química. Manual de Laboratorio. 1ª. Edición. Editorial Pearson Educación. Mills,J- Hampton,M.(1991) Microscale and macroscale experiments for General Chemistry. Editorial McGraw-Hill, Inc. Hill;Kolb. (1999) Química para el nuevo milenio.8va. Edición. Ed.Prentice-Hall. ANDER-EGG, EZEQUIEL (1991), El taller una alternativa para la renovación pedagógica, Editorial Magisterio del Río de la Plata. ASTOLFI, P. (1988) El aprendizaje de conceptos científicos: aspectos epistemológicos, cognitivos y lingüisticos; Revista Enseñanza de las Ciencias, Vol. 6/N° 2, pág. 147 – 155 BELTRÁN, J. (1993), “Procesos estrategias y técnicas de aprendizaje”. Editorial Síntesis. Madrid. BRADY, H. (1992); “Química General”, Editorial Limusa. CERETTI , H., ZALTS, A. (2000). “Experimentos en el Contexto. Química. Manual de Laboratorio”. Pearson Educación. DEL ROSAL, Oscar C. (1981). “La comunicación docente-disidente”. Editorial Plus Ultra. FERRERES, V; IMBERNON, F. (1999). “Formación y actualización para la función pedagógica”. Síntesis Educación. 2 GARCIA HOURCADE y RODRIGUEZ de AVILA (1988) Ideas previas, esquemas alternativos, cambio conceptual y el trabajo en el aula. Revista Enseñanza de las Ciencias. Vol.6/N° 2 pág. 161 – 166. MEDAURA, Olga. (1991). “Una didáctica para un profesor diferente”. Editorial Humanitas. NOVAK Y GONIN, (1988). “Aprendiendo a Aprender”. Editorial Martinez Roca. REGLAMENTO DEL CURSO INTRODUCTORIO DE QUIMICA: 1) El alumno deberá cumplimentar con un 80% (ochenta por ciento) de asistencia a las clases teórico-prácticas y prácticas del curso. 2) Aprobar con el 60% (setenta por ciento) cada uno de los trabajos prácticos desarrollados. 3) Presentar en tiempo y forma los Informes oportunamente solicitados. 4) Aprobar el examen final del curso con el 60% (setenta por ciento). Este examen será escrito y versará sobre los contenidos programados para el curso. Se tomará el último día previsto para el dictado del curso. 5) Las instancias recuperatorias serán de acuerdo a lo estipulado en el Reglamento del Ingreso a las carreras de grado de la Facultad de ciencias Exactas y Naturales. Resol C.D.F.C.E.yN.Nº Msc. Dora Galarza Lic. Susana Fiad A LOS ALUMNOS INGRESANTES A LAS CARRERAS DE QUIMICA Y DE CIENCIAS AMBIENTALES Estimados alumnos: Escribimos estas líneas a los efectos de darles la Bienvenida, presentarles la materia y ponerles a disposición el material para el desarrollo del Curso de Ingreso. La Química permite obtener un entendimiento importante de nuestro mundo y su funcionamiento. Se trata de una ciencia eminentemente práctica que tiene una enorme influencia en nuestra vida diaria. De hecho la Química está en el centro de muchas cuestiones 3 que preocupan a casi todo el mundo: el mejoramiento de la atención médica, la conservación de los recursos naturales, la protección del ambiente , la satisfacción de nuestras necesidades diarias en cuanto a alimento, vestido y albergue, etc. La Química también afecta todas las facetas de nuestra vida de manera muy directa, por ejemplo nuestra apariencia personal depende de procesos químicos, sustancias químicas llamadas hormonas ayudan a determinar nuestra estatura, peso, figura. Nuestro estado de buena salud depende de las sustancias químicas que conservan los alimentos que ingerimos y nos protegen de enfermedades suministrando al cuerpo los nutrientes necesarios para que funcione en forma apropiada. Toda nuestra vida es química, y por ello sobran las razones para llamarla la Ciencia Central. Al estudiar Química, aprenderemos a usar el potente lenguaje y las ideas que han evolucionado para describir y entender la materia. Además, el entendimiento del comportamiento de los átomos y las moléculas nos permite comprender mejor otras áreas de la ciencia, la tecnología y la ingeniería moderna. La cátedra Química General es, como su nombre lo indica, la parte de la química que debe sentar las bases para estudios más avanzados de esta ciencia. Por ello la cátedra ha preparado el presente material con la finalidad de orientar al alumno en el estudio de la materia durante esta etapa del Curso de Ingreso y favorecer la adquisición del ritmo de estudio necesario. En la Guía se encuentran desarrollados los temas teóricos, explicaciones detalladas para la resolución de problemas, ejemplos y actividades propuestas de los contenidos que corresponden al Curso Introductorio y que constituyen la base que debe tener el estudiante para cursar exitosamente la primera materia especifica de la carrera: Química General I, para los químicos y Química I para los de Ciencias Ambientales. ¡¡¡¡ BUENA SUERTE !!!! y no olviden que el estudio universitario requiere de esfuerzo y dedicación La Cátedra La Ciencia Química istemas Materiales Química es la ciencia que estudia la composición, estructura y propiedades de las sustancias, así como las transformaciones de la materia. La química es una ciencia fáctica y como tal posee un objetivo y un método. Objetivo: estudia la materia Método de estudio: método científico 4 A los fines prácticos se divide en química inorgánica y química orgánica. Química Inorgánica Química Orgánica Intervienen los elementos químicos El carbono es el principal elemento. pero el carbono es poco frecuente Al combinarse con hidrógeno, oxígeno (sólo en Dióxido Monóxido de Carbónico, de Carbono, y nitrógeno, es capaz de formar gran Carbono, Acido cantidad de compuestos distintos. Carbonatos y Bicarbonatos). Predominan los los compuestos compuestos complejos. sencillos. Predominan Los compuestos son solubles en Los compuestos son solubles en solventes apolares (éter, cloroformo, solventes polares (agua). benceno). Los compuestos son termoestables. Los compuestos son termolábiles. Los Los compuestos, en general, no compuestos, en general, conducen corriente eléctrica. conducen corriente eléctrica. Los compuestos son estables y no Los compuestos son inestables e inflamables. inflamables. La velocidad de reacción es rápida. La velocidad de reacción es lenta. Podemos definir Materia como: Todo aquello que puede ser percibido por los sentidos o bien, todo aquello que constituye el mundo físico que nos rodea, susceptible de adquirir distintas formas. Las principales características de la materia son: Es ponderable (posee masa) Es extensa (ocupa un lugar en el espacio) Es impenetrable Es indestructible Es divisible Propiedades de la materia 5 Las propiedades de la materia son aquellas cualidades de la misma que pueden ser apreciadas por los sentidos (color, brillo, textura). Puede ser sólida, líquida o gaseosa. Se clasifican en: Propiedades Intensivas: Son aquellas que no varían con la cantidad de materia (masa) considerada. Dependen del tipo de materia considerada, es decir de la sustancia. Son las constantes físicas. Ejemplos: peso específico, densidad, punto de fusión, punto de ebullición, coeficiente de solubilidad, índice de refracción, conductividad térmica, etc. Propiedades Extensivas: Son aquellas que varían con la cantidad de materia considerada. Ejemplos: peso, volumen, forma, superficie, etc. Un ejemplo de propiedades intensivas: 1 kg. o 1 mg. o cualquier otra cantidad de agua, hierve a 100 °C a una presión de 1.013,25 hPa (presión atmosférica a nivel del mar. Esta cantidad expresada como hectopascales en el SI, solía expresarse en otros sistemas de unidades que van cayendo en desuso, como 760 mm. Hg ó 1 Atmósfera de presión). Estados de agregación de la materia Los estados físicos o de agregación de las sustancias, conocidos hasta hoy, son: sólido, líquido, gaseoso, plasma y cubo de hielo cuántico. Los estados de la materia que se encuentran en la naturaleza son sólidos, líquidos y gaseosos, y en laboratorios de cierta complejidad se generaron dos nuevos estados: el plasma y el cubo de hielo cuántico. Cada uno de estos estados surge de la acción e intensidad de dos fuerzas intermoleculares: las de atracción o cohesión (llamadas también fuerzas de Van der Waals que tienden a unir las moléculas ocupando el menor espacio posible) y las de repulsión (que tienden a separar las moléculas, de tal forma que ocupen el mayor espacio posible). Estas fuerzas actúan en sentidos opuestos y simultáneamente sobre las moléculas, en continuo movimiento, de un cuerpo. En la naturaleza a la materia la encontramos en los siguientes estados: Estado Sólido: Poseen forma y volumen propio. Predominan las fuerzas de atracción entre sus moléculas. No se pueden comprimir. Son rígidos y no fluyen. Se caracterizan por tener un agrupamiento ordenando de partículas que no se mueven de sus posiciones fijas, vibran alrededor de ellas. Los sólidos se pueden dividir en dos categorías: cristalinos y amorfos. Los cristalinos como el hielo, por ejemplo, poseen un ordenamiento estricto y de gran alcance, es decir sus átomos, iones o moléculas ocupan posiciones específicas, en este caso las fuerzas de 6 atracción son máximas. En los amorfos como el vidrio, por ejemplo, carecen de ordenamiento bien definido y de un orden molecular de largo alcance. En el tema 9 del programa retomaremos los sólidos y los estudiaremos con mayor profundidad. Estado Líquido: Fluyen con facilidad (la capacidad de fluir está en relación inversa a la viscosidad del líquido). Según las características del líquido se encuentran líquidos “movibles” como el agua y “viscosos” como el aceite Poseen volumen propio y adquieren la forma del recipiente que los contiene. Están igualadas en sus moléculas las fuerzas de atracción y repulsión molecular. No se pueden comprimir. Las propiedades del estado líquido son diversas y varían en forma notable en los distintos líquidos. Las variaciones dependen de la naturaleza y las fuerzas de atracción entre las partículas que los constituyen. Las fuerzas de atracción de las moléculas del líquido que tienden a mantenerlas unidas dentro de un recipiente, adoptando la forma de éste, se denominan fuerzas cohesivas. Las fuerzas que existen entre las moléculas del líquido y las del recipiente se llaman fuerzas adhesivas que determinan la forma del menisco. En este estado existe cierta tendencia a la ordenación de las moléculas, que es contrarrestada por el movimiento caótico de sus moléculas. En el tema 9 del programa retomaremos los líquidos y los estudiaremos con mayor profundidad. Estado Gaseoso: Fluyen con facilidad. No poseen forma propia (adoptan la forma del recipiente que los contiene) ni volumen propio (tienden a ocupar el volumen disponible) porque las fuerzas de repulsión entre sus moléculas predominan sobre las de atracción o cohesión. Son compresibles. Todos los gases que no reaccionan entre sí se mezclan en todas proporciones formando sistemas homogéneos o inhomogénenos. Sus moléculas están muy separadas y se mueven al zar. En un gas el número de partículas por unidad de volumen es también muy pequeño. Las partículas se mueven de forma desordenada, con choques entre ellas y con las paredes del recipiente que los contiene. Esto explica las propiedades de expansibilidad y compresibilidad que presentan los gases: sus partículas se mueven libremente, de modo que ocupan todo el espacio disponible. La compresibilidad tiene un límite, si se reduce mucho el volumen en que se encuentra confinado un gas éste pasará a estado líquido. El comportamiento físico de un gas es independiente de su composición química y se define por medio de las variables: volumen, presión, temperatura y el número de moles de la sustancia. Debido a los avances de la ciencia, hoy en día, y en laboratorios específicos se pueden obtener otros dos nuevos estados de de la materia Plasma: Gas que se obtiene calentando una sustancia en estado gaseoso hasta una temperatura tan elevada que sus átomos se convierten en iones, siendo la concentración de partículas 7 negativas y positivas casi idénticas, motivo por el cual es prácticamente neutro y buen conductor de la corriente eléctrica. Cubo de hielo Cuántico o Condensado de Bose-Einstein: gas que se ha enfriado a una temperatura próxima al 0K originando átomos ultracongelados que pierden energía y movilidad, uniéndose en un superátomo que constituye este quinto estado de la materia, actualmente en experimentación. Cambio de estado: Es el pasaje, de una porción de materia, de un estado de agregación a otro por variación de la temperatura y/o de la presión (los cambios de estado se verifican siguiendo leyes físicas características). Volatilización Fusión Sólido Vaporización Líquido Solidificación Gaseoso o Vapor Licuación o condensación Sublimación Vapor y Gas Se entiende por vapor de una sustancia al gas que se obtiene de un líquido (por evaporación) o de un sólido (por volatilización), estando o no en contacto con ellos. Se entiende por gas al estado de agregación de una sustancia en esas condiciones de presión y temperatura. Ej hablamos del gas oxígeno y del vapor de agua Cambios de Fase Generalmente las transiciones de fase sólido-líquido-gas se representan en una curva de calentamiento, mientras que los cambios de estado gas-líquido-sólido se representan en una curva de enfriamiento. Analicemos la siguiente curva de calentamiento: Cuando se agrega calor a un sólido (A), su temperatura comienza a elevarse hasta alcanzar el punto de fusión (B); a partir de este punto, todo el calor agregado ES utilizado para fundir el sólido, permaneciendo constante la temperatura durante el cambio de estado sólidolíquido(B-C). Cuando todo el sólido se ha fundido y transformado en líquido(C) comienza a elevarse la temperatura de este último hasta alcanzar el punto de ebullición (D). A continuación ocurre la 8 transición de fase líquido-gas, fenómeno que también ocurre a temperatura constante (D-E). Finalmente cuando todo el líquido se ha convertido en gas (E) el calor adicionado sólo eleva la temperatura del gas. Gráfico: Curva típica de calentamiento para un mol de una sustancia Sistemas Materiales La materia no varía en función de su forma o tamaño, sino en relación con su composición. Por eso, desde el punto de vista químico, interesa la constitución de la materia. Para estudiar experimentalmente la composición o cualquier propiedad de la materia, es necesario tomar y aislar una porción limitada de la misma a partir del medio que nos rodea. Esa porción de materia se denomina Sistema Material. Entre las propiedades que caracterizan a los Sistemas Materiales citaremos la Extensión (capacidad para ocupar una parte del espacio) y la Inercia (incapacidad de los cuerpos para salir del estado de reposo, para cambiar las condiciones de su movimiento o para cesar en él, sin la aplicación o intervención de alguna fuerza). Los Sistemas Materiales poseen una determinada cantidad de materia, y a eso lo denominamos Masa. Una manera de medir la cantidad de masa de un sistema material es midiendo (determinando) su Peso. El Peso es la fuerza con la que in cuerpo es atraído por el centro de gravedad de la Tierra. 9 Como la distancia que existe entre los distintos puntos de la superficie terrestre y el centro de gravedad no siempre es igual, los valores de la fuerza de atracción hacia la tierra varían ligeramente de un sitio a otro. De todo esto se deduce que: Masa es una magnitud constante, mientras que Peso es variable. La unidad de masa en el Sistema Internacional de Pesas y Medidas (SI) es el kilogramo (Kg.) Existen distintas clases de materia que se distinguen por las cualidades que nuestros sentidos perciben (en forma directa o indirecta). Tales cualidades o propiedades físicas, características de cada sustancia, que no dependen del tamaño ni de la forma, se denominan propiedades Intrínsecas o Específicas. Citaremos entre estas propiedades: color, olor, conductividad, dureza, ductibilidad, sabor, brillo, transparencia, punto de fusión, punto de ebullición, densidad, etc. Entre ellas, las que se pueden medir son más útiles que las que no se pueden cuantificar. Clasificación de los Sistemas Materiales Sobre la base de sus propiedades intensivas, los sistemas pueden clasificarse: Sistemas homogéneos Sistemas heterogéneos Sistemas Inhomogéneos Sistemas Homogéneos Poseen idénticas propiedades intensivas en todos los puntos del sistema (monofásicos). Ejemplo: agua destilada, agua salada, aire seco, mercurio. Se clasifica en: Sustancias Puras: No pueden ser fraccionadas por métodos físicos o mecánicos (son sistemas homogéneos no fraccionables)Ejemplos: Hielo, hierro, sodio, cloro, mercurio, agua. Pueden ser: Sustancias puras simples: están formadas por átomos y por lo tanto no pueden descomponerse. Ejemplos: hidrógeno (H2), oxígeno (O2), sodio (Na), cloro (Cl2). Sustancias puras compuestas: están formadas por átomos distintos y pueden descomponerse. Ejemplos: agua (H2O), cloruro de sodio (NaCl), alcohol. Soluciones: Pueden ser fraccionadas por métodos físicos o mecánicos obtenidos en dos o más sustancias puras. Ejemplos: el fraccionamiento del agua salada origina agua dulce y sal (cloruro de sodio). 10 Sistemas Heterogéneos Poseen distintas propiedades intensivas en todos los puntos del mismo y presentan superficie de separación o interfase entre las fases que lo forman. Ejemplo: arena y agua, aceite y agua. Fase: Es cada uno de los sistemas homogéneos que constituyen el sistema heterogéneo. Ejemplo: en el sistema arena - agua, la arena es una fase y el agua otra. Componente: Es cada una de las sustancias que componen un sistema. Ejemplo: en el sistema agua salada – arena, la arena y el agua salada son distintas fases, pero en este sistema hay tres componentes, la arena, el agua y la sal. Sistemas Inhomogéneos No presentan superficie de discontinuidad, pero sus propiedades varían en forma gradual y continua. Ejemplo: la atmósfera terrestre. En resumen, los sistemas se clasifican: Clasificación Sistemas Sustancias Puras Homogéneos Ejemplos Simples Na, Cl2, H2, O2, S Compuestas NaCl, H2O, H2SO4 Soluciones NaCl en H2O H2SO4 en H2O Sistemas Cloruro de Sodio en Heterogéneos agua con arena. Acido sulfúrico en agua con hielo. Veamos como ejemplo, la sangre, que parece un sistema homogéneo a simple vista, pero observado al microscopio revela su heterogeneidad. Las porciones homogéneas que constituyen el sistema heterogéneo se denomina Fases. Los sistemas heterogéneos presentan dos o más fases, mientras que los homogéneos son monofásicos. Veamos algunos ejemplos. Son sistemas heterogéneos: − Sangre (varios componentes). − Aceite y agua (dos componentes). − Benceno y agua (dos componentes). Son sistemas homogéneos: − Sacarosa o azúcar común (un componente). − Cloruro de sodio o sal de cocina disuelta en agua (dos componentes). − Bicarbonato de sodio (un componente). 11 Son sistemas inhomogéneos: el aire En la naturaleza lo más frecuente es encontrar sistemas de varios componentes (algunos como sistemas homogéneos y otros heterogéneos). Para analizar (esto lo hace la Química Analítica) un componente del sistema, es necesario separarlo y purificarlo para luego identificarlo. Para la separación de las fases de un sistema heterogéneo se aplican métodos físicos, tales como: Sedimentación, Centrifugación, Filtración. También Métodos eléctricos, Métodos magnéticos, etc. Para la separación de los componentes de un sistema homogéneo se utilizan métodos como: Cristalización, Destilación simple o fraccionada, Adsorción fraccionada (cromatografía). Si aplicamos algunos de estos métodos a un sistema homogéneo como, por ejemplo, sal disuelta en agua, se obtienen fracciones con propiedades intensivas distintas entre sí y respecto del sistema inicial: cloruro de sodio, sólido de color blanco y agua. El sistema homogéneo inicial, en este caso es una Solución. Si con los mismos procedimientos intentamos fraccionar otro sistema homogéneo como, por ejemplo, naftaleno (llamada comúnmente naftalina) obtenemos fracciones con propiedades intensivas iguales y a su vez idénticas a las del sistema original. En este caso, existe inicialmente una Sustancia Pura. Podemos decir entonces, que: Solución: es un sistema homogéneo fraccionable, y Sustancia Pura: es un sistema homogéneo "no" fraccionable. A las sustancias puras se las considera Especies Químicas, destacando así la especificidad de sus propiedades. Cuerpo Cuerpo u objeto es la porción limitada en materia con forma y uso definido (una mesa, un árbol, una bacteria, etc.) .Por ser parte integrante de la materia se caracterizan porque ocupan un lugar en el espacio (que no puede ser ocupado por otro cuerpo en el mismo tiempo) y poseen masa. La masa de un cuerpo se relaciona con el peso. Peso = Masa x Aceleración de la Gravedad Es decir, el peso es la fuerza (atracción) que ejerce la tierra sobre los cuerpos. Su expresión matemática es P = m.g Sustancia Sustancia es la calidad de materia que constituye un cuerpo Propiedades de las sustancias: 12 Las sustancias se caracterizan por sus propiedades individuales y a veces únicas, es decir toda sustancia pura tiene una serie de propiedades características que la distinguen de las demás. Propiedades organolépticas: son aquellas que se aprecian con los sentidos. Por ejemplo: color, olor, sabor, impresión al tacto,etc.. Propiedades físicas: son aquellas que pueden medirse y observarse sin modificar la composición o identidad de la sustancia. Estas propiedades sirven para identificar una sustancia y es común encontrarlas en tablas que figuran en los libros de química. Por ejemplo: densidad, solubilidad, punto de fusión, punto de ebullición, etc. Propiedades químicas: son aquellas que se observan cuando una sustancia participa en una reacción a partir de la cual se transforma en una o más sustancias diferentes. Revelan el comportamiento de una sustancia frente a otra. Por ejemplo la capacidad de combinación y/o de descomposición. Clasificación de las sustancias: Según su Origen Naturales: existen en la naturaleza (aceites, azúcares, hidrocarburos) Artificiales: se obtienen por síntesis del laboratorio (aspirina). Según su naturaleza química: Inorgánicas: están formadas por todos los elementos (ácido sulfúrico, cloruro de sodio). El carbono es poco abundante y sólo se encuentra en algunos compuestos como ácido carbónico, carbonato y bicarbonato. Orgánicas: están formados por carbono como elemento fundamental excepto ácido carbónico, carbonato y bicarbonato (alcohol, glucosa, aceites) Según su composición química: Simples: están formadas por átomos de igual naturaleza (hidrógeno, nitrógeno, carbono). Compuestas: están formadas por átomos de distinta naturaleza (cloro de sodio, bicarbonato de sodio). Las sustancias puras se clasifican a su vez, en simples y compuestas. El criterio de clasificación utilizado en este caso es el de la Descomposición. Cuando por variación de ciertas condiciones, como presión, temperatura, etc., un sistema cambia sus propiedades intensivas en forma permanente, decimos que ha sufrido una nueva transformación. La descomposición es una transformación química ya que las sustancias intervinientes o reactivos, se convierten en productos. 13 Por ejemplo: el calentamiento de clorato de potasio originan dos productos, cloruro de potasio (sólido blanco) y oxígeno (gas). Otro ejemplo: si se hace pasar una corriente eléctrica continúa a través de una solución acuosa conductora, el agua de la misma se convierte en dos gases, hidrógeno y oxígeno. Producida la descomposición, ninguna de las sustancias puras formadas será, separadamente, transformable en la sustancia compuesto original. El hidrógeno, al igual que el oxígeno, no será convertible, por separado, en la sustancia compuesta agua. Sustancia pura compuesta: Es aquella que puede descomponerse en dos o más sustancias puras simples. Ejemplo: almidón, agua, amoníaco. Sustancia pura simple: Es la que no puede descomponerse en otras por ninguno de los métodos químicos corrientes. Ej.: hierro, aluminio, oxígeno. No hay un método exclusivo capaz de descomponer cualquier compuesto, razón por la cual la tarea de clasificar todas las sustancias conocidas fuera ardua y lenta. Aún a principios del siglo XIX, algunas sustancias simples eran consideradas compuestas y viceversa. Actualmente se han identificado alrededor de 3 millones de sustancias, en su casi totalidad, compuestas. Sólo hay un poco más de un centenar de sustancias simples o sustancias elementales (la mayoría naturales y algunas artificiales). El resultado final del análisis de un sistema material, utilizando métodos físicos y químicos, es la sustancia elemental que, por el momento podremos llamar Elemento. El camino inverso, el de la síntesis química, nos permite llegar a obtener sistemas materiales compuestos a partir de elementos. Cuando dos elementos se combinan químicamente dan un compuesto, en el cual ambos componentes ya no son identificables por sus propiedades, ni separables por métodos físicos. Esto es lo que se denomina Combinación Química. Ejemplo, si hacemos arder un trozo de carbón en presencia de abundante oxígeno, ambas sustancias simples se combinan formando un compuesto llamado anhídrido carbónico o dióxido de carbono. Sí, por otro lado, quemamos hidrógeno en presencia de oxígeno, se obtiene la sustancia compuesta agua. Si ahora se hace burbujear anhídrido carbónico en el agua, parte del gas se dispersa en el agua formando una solución (una parte se combina con el agua para dar ácido carbónico) pero una parte queda como dióxido de carbono gaseoso, el cual forma con la fase liquida un sistema heterogéneo gas - líquido. Los sistemas materiales heterogéneos y las soluciones dentro de los sistemas homogéneos reciben el nombre de mezclas. Las mezclas poseen propiedades diferentes de las que presentan 14 las combinaciones. Sus componentes no pierden las propiedades específicas y son separables por métodos físicos. Energía Se ha dicho que el mundo físico está construido por la materia, pero es necesario además considerar la existencia de la energía, la cual se define como la capacidad para realizar trabajo. Por trabajo se entiende toda producción de un cambio en el estado de un sistema, venciendo la resistencia que se opone a dicho cambio. Por ejemplo, cuando elevamos un objeto desde su posición a nivel del suelo hasta cierta altura, se realiza un trabajo, ya que se cambia la posición del cuerpo y para ello debe vencerse la resistencia representada por la fuerza de gravedad. El trabajo realizado queda entonces almacenado en el objeto bajo la forma de energía potencial, que se hará evidente en forma de energía cinética (movimiento) si se deja caer el cuerpo a su nivel original. La energía potencial es, pues, la energía almacenada en un cuerpo y depende de su posición o relación con respecto a otros, y matemáticamente se la puede calcular a través de: Ep = P. h, donde P es peso y h altura.. Como P = m.g , entonces la energía potencial es también: Ep = m.g.h La energía cinética es la energía propia de un cuerpo en movimiento, y matemáticamente se la puede calcular a través de: Ec = m.v2/2 donde m es la masa y v la velocidad con que se mueve. La unidad de energía en el sistema M.K.S es el Joule, que es el trabajo realizado por una fuerza de un Newton aplicada a lo largo de un metro. La unidad de energía en el sistema c.g.s es el ergio, que es el trabajo realizado por una fuerza de una dyna aplicada a lo largo de un centímetro. Una dina es la fuerza que actuando durante un segundo sobre una masa de un gramo produce en ella un movimiento de una velocidad de 1 cm. por seg. El ergio es muy pequeño, razón por la cual en la práctica se utiliza el joule o julio (107 ergios). La energía puede presentarse bajo diferentes modalidades, ya sea como energía mecánica, química, térmica, lumínica, eléctrica, etc. en ciertas condiciones, una forma de energía puede ser convertida en otra. Los cambios químicos (cambios en la composición de la materia) casi siempre se acompañan de cambios de energía (almacenamiento o liberación de energía). Toda sustancia posee energía, que se denomina energía química y depende de su constitución. Por ejemplo, si la sustancia oxígeno reacciona con la sustancia hidrógeno para formar la sustancia agua, se produce liberación de energía en forma de calor. Estas reacciones que 15 transcurren con liberación de energía calórica se denominan reacciones exotérmicas e indica que la o las sustancias reaccionantes poseen mayor energía química potencial que el o los productos de la reacción. Esta diferencia energética se exterioriza durante la reacción por la liberación de calor. Hay otras reacciones en las cuales la sustancia formada posee más energía química potencial que la o las sustancias iniciales, por cuya razón es necesario suministrar energía para que el cambio químico se produzca (reacción endotérmica). Durante muchos años se consideró que materia y energía eran dos entidades diferentes. La materia se caracterizaba por poseer masa, la energía, no. A principios de este siglo, Einstein propuso que materia y energía son sólo manifestaciones distintas de una misma realidad y formuló la relación existente entre la masa (m) y la energía (E) en su famosa ecuación: E = m x c2 Donde c es la velocidad de la luz, cuyo valor es 2,9979 x 10 10 c/seg. (Prácticamente 300.000 km./seg.) La ecuación de Einstein indica que es muy grande la cantidad de energía que puede obtenerse por conversión de una pequeña cantidad de materia. La confirmación experimentada de ello fue obtenida casi cuatro décadas después, en ocasión de las primeras experiencias de Enrico Fermi sobre reacciones nucleares. Otra manera de Clasificar los Sistemas Materiales es la siguiente. Los sistemas están formados por uno o varios cuerpos rodeados por un medio o entorno con el cual pueden interaccionar intercambiando materia y/o energía. Según esto, los sistemas pueden ser: Sistemas abiertos: Intercambian con el medio materia y energía en forma de calor: El agua se evapora y el calor se disipa hacia el medio Agua a 100 ºC Agua a 30 ºC Sistemas cerrados: Intercambian con el medio energía en forma de calor. No intercambian materia. Hay pérdida evaporación. de calor. No hay 16 Agua a 100 ºC Agua a 30 ºC Sistemas aislados: No intercambian ni materia ni energía con el medio Recipiente No se pierde calor ni temperatura. Aislante Agua a 100 ºC Agua a 100 ºC Sistemas Dispersos Sistema disperso o mezcla es todo sistema material formado por más de una sustancia, en proporciones no definidas. Este sistema está constituido por una fase dispersa (formadas por sustancias disueltas en la dispersión) y por una fase dispersante (fase que disuelve a la dispersa). Clasificación: se realiza según el grado de división de las partículas dispersas en: I-Dispersión macroscópica o grosera: sistema heterogéneo al ojo humano. Las partículas dispersas se ven a simple vista. Ejemplo: Arena, Agua. II-Dispersión fina: sistema homogéneo al ojo humano y heterogéneo al microscopio. Toma distinto nombre según el estado físico de la fase dispersa y de la fase dispersante. Si ambas fases son líquidas, se denomina: Emulsión; por ejemplo, la leche: dispersión de partículas de materia grasa en medio líquido, observadas al microscopio. Si la fase dispersa es sólida, la dispersión se llama: Suspensión; por ejemplo, la tinta china: dispersión de partículas de carbón disueltas en un líquido. III-Dispersión coloidal o sol: sistema homogéneo al microscopio y heterogéneo al ultra microscopio. Ejemplos: gelatina, mayonesa. Según una clasificación se la llama emulsión coloidal, a aquella cuya fase dispersa y fase dispersante son líquidas. A las partículas de la fase dispersa se las denominan micelas A las dispersiones coloidales se las suele llamar soles. Si el medio dispersante es agua se las llama hidrosoles, si es alcohol, se las llama alcohosoles. Si los soles pierden algo del medio dispersante, las dispersiones coloidales se espesan, quedando masas gelatinosas, denominadas geles, que se clasifican según el medio de dispersión. Por ejemplo: Hidrogeles, Alcohogeles. 17 A las dispersiones coloidales se las suele clasificar considerando la afinidad relativa entre las fases: 1- Si la afinidad es pequeña, se dice que la fase dispersa es liófoba, por ejemplo: hidrófoba, alcohófoba. Estos se llaman “coloides irreversibles” porque precipitan fácilmente y una vez secos no pueden dispersarse nuevamente. Por ejemplo: Haluros de Ag, sulfuro arsenioso. 2-Si la afinidad es grande se dice que la fase dispersa es liófila, por ejemplo: hidrófila o benzófila. Estos se llaman “coloides reversibles” porque una vez separada la fase dispersante y obtenida la suspensión seca, puede nuevamente prepararse la misma, al agregarle la fase dispersante, por ejemplo: dispersiones de almidón, jabón. Esta clasificación no es estricta, puesto que existen ejemplos que poseen características de ambos grupos, tales como los óxidos hidratados. Esta distinta afinidad determina propiedades características para ambos soles, de importante aplicación. Por ejemplo: En los soles liófobos, su tensión superficial y viscosidad son análogas a la del medio de dispersión, y en los soles liófilos, su tensión superficial es menor que la del medio de dispersión, mientras que la viscosidad es mucho mas elevada. En 1907, Carl Ostwald clasificó las dispersiones coloidales según el estado físico de las fases dispersas y dispersante, en los siguientes tipos: Medio de Fase dispersa Ejemplos Gas Líquido Nubes. Nieblas Gas Sólido Humo. Polvo volcánico Líquido Gas Espuma Líquido líquido Mayonesa. Manteca Líquido Sólido Pinturas Sólido Gas Pelo cano. Piedra dispersión pómez Sólido Líquido Jalea. Queso Sólido Sólido Piedras preciosas Este tipo de dispersiones presentan las siguientes propiedades características: a-Sedimentación: mediante la utilización de ultracentrífuga o con el aditamento de sustancias, se origina la precipitación de las fases dispersas. Es un método que se utiliza para separar proteínas, utilizando el precipitante indicado. 18 b-Propiedad óptica: Efecto Tyndall: se denomina así al fenómeno que se origina al realizar la siguiente experiencia: si en una habitación a oscuras se hace incidir un haz de luz, especialmente en dirección perpendicular al movimiento de las partículas dispersas, se observan puntos luminosos en la disolución coloidal, debido a la dispersión de la luz que originan las partículas coloidales. c-Movimiento Browniano: es el movimiento caótico, incesante, irregular en forma de zigzag, que se observa al ultramicroscopio. Se debe a los choques entre las moléculas del medio de dispersión y la fase dispersante. d-Propiedad eléctrica: Electroforesis: se denomina así al fenómeno que se obtiene cuando se somete a una dispersión coloidal a una diferencia de potencial elevado, observándose que esta se desplaza como un conjunto hacia uno de los electrodos. Por ejemplo: Goma arábiga, sulfuros, colorantes ácidos en estado coloidal están cargado negativamente y por consiguiente, se dirigen al ánodo y los óxidos, hidróxidos y colorantes básicos están cargados positivamente y por consiguiente se dirigen al cátodo. e-Floculación: la adición de electrolitos a las dispersiones coloidales de soles liófobos produce la agrupación de partículas y su separación del líquido, al “precipitar” la fase dispersa. Esta precipitación se conoce como Coagulación y Floculación. Un ejemplo de dispersión coloidal son los suelos, que están constituidos por coloides inorgánicos como las arcillas (constituidos por óxidos e hidróxidos de hierro y aluminio) y sílice; y coloides orgánicos como la parte nutritiva del suelo Dispersiones: son(formado sistemasmediante heterogéneos llamado humus la acción de distintos microorganismos con procesos físicos químicos)homogéneos Soluciones: son ysistemas Comparación entre las propiedades de los coloides y las soluciones a. Propiedades mecánicas Difusión: Fenómeno por el cual una sustancia, por el movimiento de sus moléculas, tiende a ocupar todo el volumen posible. Los coloides difunden lentamente, las soluciones lo hacen rápidamente. Diálisis: Es la difusión de una sustancia a través de una membrana (celofán, pergamino). Los coloides no dializan a través de ellas; las soluciones si. Filtración: Permite separar partículas suspendidas en los líquidos que las contienen mediante la utilización de filtros. Los coloides y las soluciones filtran; las dispersiones groseras y finas no lo hacen. Ultrafiltración: Consiste en usar filtros cuyo tamaño de poros es muy pequeño. Los coloides no ultrafiltran y las soluciones sí. 19 b. Propiedades ópticas Visibilidad al ultramicroscopio: la observación de los coloides al ultramicroscopio permite visualizar las micelas y no a las moléculas de las soluciones. Efecto Tyndall: Si un sistema coloidal es iluminado lateralmente puede observarse la marcha del rayo luminoso dentro del mismo por la difracción que éste sufre al chocar con las micelas, este fenómeno se denomina efecto Tyndall. Los coloides presentan Efecto Tyndall; las soluciones no (son ópticamente vacías). Movimiento Browniano: Al observar las micelas al ultramicroscopio se las ve animadas por un movimiento rectilíneo y frecuentes cambios de dirección. Este fenómeno se denomina movimiento Browniano.y no es observado en las soluciones. c. Propiedades eléctricas Electroforesis: Sometidas a la acción de un campo eléctrico, las micelas se dirigen hacia uno u otro electrodo (polo).Se denomina cataforesis al movimiento de las micelas hacia el cátodo (electrodo negativo), anaforesis es el movimiento de las micelas hacia el ánodo (electrodo positivo). Resumen de las propiedades de los coloides Mecánicas Ópticas Eléctricas Difusión + Diálisis - Filtración + Ultrafiltración - Ultramicroscopio + Efecto Tyndall + Movimiento Browniano + Electroforesis + En el siguiente cuadro vemos ejemplos de dispersiones según quien sea el dispersante y la fase dispersa: Dispersión Fase Dispersante Fase Dispersa Tinta china agua negro de humo Niebla aire Agua Arcilla en agua agua Arcilla IV- Dispersión verdadera o molecular: sistema homogéneo aún al ultramicroscopio. Corresponde al sistema material homogéneo denominado solución. Ejemplo: agua salada. 20 Resumiendo, podemos clasificar a los sistemas dispersos como: Sistemas dispersos Dispersiones Groseras Soluciones verdaderas Finas Emulsiones Coloidales Suspensione s En el siguiente cuadro se clasifican según el tamaño de las partículas: Tamaño de Visibilidad Diálisis Filtración Ultrafiltrac. Ejemplos partícula (micrones - - ) Dispersión p > 50 Ojo _ 50 > p > 0,1 Microscopio _ _ _ Agua y arena _ Emulsiones: grosera Dispersión fina +o_ leche, crema. Suspensiones: Tinta china Dispersión 0,1 > p > 0,001 coloidal Solución Ultramicrosco _ + _ pio p < 0,001 Gelatina Agar + + verdadera + Agua y azúcar Agua y sal Nota: recuerde que 1 micrón es 1x10-6 metros o 1x10-4 centímetros Mezclas Cuando se unen una o más sustancias (la unión puede ser real o aparente) se forma una mezcla. Las mezclas son homogéneas o heterogéneas y sus componentes se pueden separar por métodos mecánicos o físicos. Métodos de Separación Para separar los componentes de un sistema homogéneo se utilizan Métodos de Fraccionamiento. Para separar las fases de un sistema heterogéneo se utilizan Métodos de Separación de Fases. a) Métodos de Fraccionamiento de Sistemas Homogéneos: 21 Permiten separar los componentes de una solución pero no los de una sustancia pura. Los más importantes son: Destilación: Permite separar líquidos de sólidos o líquidos entre sí. En una primera etapa se produce la separación por evaporación y luego una condensación por enfriamiento. Existen distintos tipos: Destilación simple: permite separar el líquido del sólido de una solución. Ejemplo: destilación del agua natural. Se utiliza un aparato como se ve en la figura. Destilación fraccionada: permite separar dos o más líquidos mezclados siempre que posean próximos pero diferentes puntos de ebullición (P.E.). Ejemplo: agua y alcohol (P.E. 100 ºC y 78 ºC respectivamente). Se utiliza un aparato como se ve en la figura que requiere de un dispositivo adicional llamado corrientemente columna de fraccionamiento: 22 Cristalización: Se usa para separar sólidos con distintas solubilidades a diferentes temperaturas. La máxima cantidad de gramos de una sustancia que se disuelve en 100gramos de agua es lo que llamamos corrientemente solubilidad. Este método consiste en disolver el sistema en el solvente hirviendo y luego, dejar enfriar. De esta forma el componente menos soluble cristaliza y sus cristales se separan por filtración. Ej. Una mezcla de sal en agua se coloca en un recipiente y se somete a evaporación. El agua se evapora y queda un residuo cristalino. Cromatografía: La palabra Cromatografía significa “Escribir en Colores” ya que cuando fue desarrollada los componentes separados eran colorantes. Los componentes de una mezcla pueden presentar una diferente tendencia a permanecer en cualquiera de las fases involucradas. Mientras más veces los componentes viajen de una fase a la otra (partición) se obtendrá una mejor separación. Las técnicas cromatográficas se basan en la aplicación de la mezcla en un punto (Punto de Inyección o Aplicación) seguido de la influencia de la fase móvil. Se utiliza para separar componentes de soluciones cuando se dispone de pequeñas cantidades o cuando la cantidad de sustancias disueltas es elevada. La separación se produce al competir por las sustancias disueltas una fase fija o estacionaria y una fase móvil que se desplaza a través de la primera. Algunos ejemplos son: separación de pigmentos vegetales, separación de aminoácidos de una proteína, separación de cationes de distintos metales. b) Métodos de separación de fases: 23 Permiten separar las distintas fases que forman parte de un sistema heterogéneo. Algunos ejemplos son: Tría: Consiste en tomar con pinzas o con la mano las fases sólidas dispersas en otro sólido o líquido. Por ej. Al sacar un lápiz de la cartuchera, al sacar trozos de hielo de un vaso de gaseosa. Decantación: Separa líquidos de sólidos o líquidos no miscibles por acción de la gravedad. La fase de mayor peso específico se deposita en el fondo del recipiente y la otra sobrenada, facilitando la separación Ejemplo: eristrosedimentación (sedimentación y separación de los componentes de la sangre, al separar el agua del aceite, la clara de la yema, etc.. Centrifugación: consiste en colocar el sistema material formado por un líquido y un sólido en un recipiente que se hace girar a gran velocidad, (centrífuga), acelerando la decantación por acción de la fuerza centrífuga. Ejemplo: separación de plasma y glóbulos rojos de la sangre (Hematocrito). Filtración: Separa líquidos de sólidos dejando pasar al líquido por un poro cuyo tamaño no permite el pasaje sólido. Ejemplo: filtración de arena y agua. Tamización: el sistema formado por dos sólidos de diferente tamaño de partículas se coloca sobre una mall de metal tamiz, dejando pasar las de menor tamaño y reteniendo las de mayor tamaño. Averigua en que consisten los métodos de flotación, imantación y disolución Composición Centesimal Se denomina composición centesimal al porcentaje de cada una de las fases que forman parte de un sistema heterogéneo, o de los componentes de una solución, o de los elementos de una sustancia pura. Así como los métodos de separación permiten hacer un análisis cualitativo de las mezclas, la composición centesimal permite hacer un análisis cuantitativo de las mismas: Ejemplo 1: Para un sistema formado por: 10 g de talco, 40 g de arena y 20 g de azufre a. Calcular la masa total del sistema 10 g de talco + 40 g de arena + 20 g de azufre = 70 g masa total b. Calcular qué porcentaje de la masa total representa cada componente. Talco Arena Azufre 24 70 g ------ 100% 70 g ------- 100% 70 g ------- 100% 10 g ------ x = 14,28 % 40 g ------ x = 57,14% 20 g ------ x = 28,57% también se pueden resolver calculando la cantidad de cada componente en 100 g del sistema: Talco Arena 70 g ------ 10 g de talco 70 g ------- 40 g de aren 10 g ------ x = 14,28 g% 100 g ------ x = 57,14 g% Azufre 70 g ------- g de azufre 20 g ------ x = 28,57 g% c. Verificación 14,28% de talco + 57,14% de arena + 28,57% de azufre = 100 % del sistema Ejemplo 2: Una sustancia pura contiene 4 g. de azufre y 7 g. de hierro. a. Calcular la masa total de la sustancia 4 g de azufre + 7 g de hierro = 11 g de sustancia b. Calcular qué porcentaje de la masa total representa cada elemento. Azufre Hierro 11 g ------- 100% 11 g ------- 100% 4 g ------- x = 36,36 % 7 g ------- x = 63,64 % También Azufre Hierro 11 g ------- 4 g de azufre 11 g ------- 7 g de hierro 100 g ------- x = 36,36 g% 7 g ------- x = 63,64 g% c. Verificación 36,36 % de azufre + 63,64% de hierro = 100 % de sustancia. UNIDADES DE MEDICIÓN En el año 1960 la Conferencia General de Pesos y Medidas, la autoridad internacional en lo que respecta a unidades, propuso una revisión y modernización del sistema métrico llamada Sistema Internacional de Unidades (SI). En el siguiente cuadro se muestran las siete unidades básicas del SI, las demás se pueden derivar de estas básicas. Cantidad Básica Nombre de la Unidad Símbolo Longitud metro m Masa kilogramo k Tiempo tiempo s 25 Corriente eléctrica ampere A Temperatura kelvin K Cantidad de sustancia mol mol Intensidad luminosa candela cd Al igual que las unidades métricas, las unidades del SI cambian en múltiplos de 10 mediante una serie de prefijos como los que se muestran en la siguiente tabla, y que son utilizados frecuentemente en química. Prefijo Símbolo Significado Ejemplo Tera T 1000000000000 ó 1.1012 1terametro (Tm)= 1.1012m Giga G 1000000000 ó 1.109 1gigametro(Gm)= 1.109m Mega M 1000000 ó 1.106 1megametro(Mm)= 1.106m Kilo k 1000 ó 1.103 1kilometro(Km)= 1.103m Deci d 1/10 ó 1.10-1 1decimetro(dm)=0,1 ó 1.10-1 m Centi c 1/100 ó 1.10-2 1centimetro(cm)=0,01 ó 1.10-2 m Mili m 1/1000 ó 1.10-3 1centimetro(mm)=0,001 ó 1.10-3 m Micro µ 1/1000000 ó 1.10-6 1micrometro(µm)= 1.10-6 m Nano n 1/1000000000 ó 1.10-9 1nanometro(nm)= 1.10-9m Pico P 1/1000000000000 ó 1.10-12 1picometro (pm)= 1.10-12m Trabajo Práctico Nº 1 1-Clasificar las siguientes propiedades como químicas o físicas: a) Los objetos hechos de plata se manchan; b) el color rojo de los rubíes se debe a la presencia de iones de cromo; c) el punto de ebullición del etanol es 78ºC. 2-Identifique todas las propiedades físicas y las transformaciones en el siguiente enunciado: “La temperatura del terreno es un factor importante para la maduración de las naranjas, porque ella afecta la evaporación del agua y la humedad del aire circundante”. 3-Identifique si las siguientes propiedades son extensivas o intensivas: a. La temperatura a la cual se derrite el hielo; b. El color del cloruro de níquel c. la energía producida cuando se quema la gasolina; d. el costo de la gasolina; la dureza del hormigón 4-Identificar cada uno de los siguientes cambios como físico o químico: 26 a- Un leño que arde b- La sal que se disuelve en el agua c- La fusión de la nieve d- Ebullición del agua e- La leche que se corta f- Empañar un espejo g- La fractura de un pedazo de hormigón h- Combustión del carbón 5- Dos trozos de materia de 5 y 10 g, respectivamente, tienen la misma densidad ¿Se trata de la misma sustancia?¿Por qué? 6-Lea atentamente el siguiente listado de caracteres de los estados de la materia y coloque en el paréntesis la letra que le corresponde: A: estado sólido B: estado líquido C: estado gaseoso ( ) Predominio de las fuerzas de cohesión ( ) Volumen constante y forma variable ( ) Partículas (moléculas, átomos o iones) distribuidos ordenadamente ( ) Volumen y forma variada ( ) Predominio de las fuerzas de repulsión intermoleculares ( ) Movimiento vibratorio de las moléculas en un sitio fijo ( ) Moléculas dotadas de gran cantidad de energía cinética ( ) Forma y volumen constante. 7-Durante siglos, los aborígenes australianos han usado las hojas de los árboles de eucalipto para aliviar los dolores de garganta y otros dolores. El principal componente activo se ha identificado y se denomina eucaliptol. El análisis de una muestra de eucaliptol con una masa total de 3,16 g dio su composición como 2,46 g de carbono, 0,373 g de hidrógeno y o,329 g de oxígeno. Determine los porcentajes de las masas de C, H y O del eucaliptol. 8- Lee con atención los siguientes sistemas materiales y coloca en el paréntesis la letra de la derecha que corresponde al ítem de la izquierda. - Salmuera con cristales de sal - Agua con trozos de hielo - Agua con nafta en reposo - Agua - Un litro de salmuera liquida - Granito ( ( ( ( ( ( ) ) ) ) ) ) A) Sistemas Homogéneos B) Sistemas Heterogéneos 9-Dibuja un esquema del sistema material formado por trozos de hielo, agua salada y alfileres. a- En dicho esquema escribe el nombre de las distintas fases. b- Justifica la ubicación relativa de las fases. c-Clasifica el sistema material. 10- Completa el siguiente cuadro: Sistema Material Clasificación Pequeñas gotas de aceite en agua Partículas de hollín en el aire Agua condensada en la atmósfera Dispersión de talco enagua Fase dispersa Fase dispersante 27 11-Observa las dos listas detalladas a continuación, una de sistemas heterogéneos y otra de métodos de separación. Coloca en los paréntesis de abajo él número del sistema de la izquierda, acompañado de la correspondiente letra de la derecha: Sistemas Heterogéneos Métodos de separación 1) Azufre en polvo y limaduras de hierro a) Flotación 2) Arena y corcho molido b) Disolución 3) Arena y Kerosén c) Tamización 4) Harina y salvado d) Imantación 5) Azufre en polvo y sal fina e) Filtración ( ) ( ) ( ) ( ) ( ) 12-Un sistema material esta formada por agua, hielo y talco. Indica que tipo de sistema es, cuales son las fases y como procederías para separarlas. 13-Indica que métodos utilizarías para separar los siguientes sistemas heterogéneos. Ejemplifica. a) Dos fases sólidas de distintos tamaños b) Dos líquidos miscibles entre sí y de punto de ebullición diferente c) Una fase sólida dispersa en un liquido d) Dos fases liquidas no miscibles y de diferente punto de ebullición 14- Indica sistemas homogéneos formados por: e) Dos componentes líquidos f) Tres componentes gaseosos g) Un componente sólido h) Dos componentes sólidos 15- El vino es una solución formada por agua, alcohol y otros solutos sólidos de menor proporción. Sabiendo que el punto de ebullición del agua es de 100 °C y la del alcohol es 78 °C que método utilizaría para separar dicho compuesto. Fórmulas y Nomenclatura de la Química Inorgánica Introducción Teórica: Para comprender los fenómenos químicos que es necesario saber interpretar los, al igual que cuando uno le una novela o una película; y Química esto se logra a través de las ecuaciones químicas que, no son otra cosa que la interpretación simbólica de las reacciones químicas. Toda ecuación química consta de dos partes: 28 1. Sustancias iniciales o reaccionantes 2. Sustancias finales o productos de la reacción Por ejemplo: A BC D Sustancias Iniciales Pr oductos Además debemos recordar que en Química también nos interesa cuantificar las reacciones y por lo tanto es oportuno recordar la famosa Ley de Conservación de la masa o la Ley de Lavoisier que dice: "En toda reacción química las masas de las sustancias iniciales es igual a las masas de las sustancias finales". En símbolos y para el ejemplo anterior: mA + mB = mC + mD Por lo tanto debemos tener presente que toda ecuación química debe estar correctamente igualada, lo que significa que el número de átomos de cada elemento debe ser el mismo en ambos lados de la ecuación. Ahora vamos a considerar la parte más dificultosa para los alumnos del Nivel Medio, a los que la química no les apasiona, (que por supuesto no es el caso de Uds.), son las muy conocidas Sales. Pero para llegar a ellas debemos realizar primero una revisión de otros conceptos fundamentales. Comenzaremos recordando lo que es un Elemento Químico Elemento Químico: Es una sustancia básica que puede combinarse con otros elementos para formar compuestos y que no pueden desdoblarse en sustancias más simples. Los elementos se clasifican, en general, en dos grupos: A. Metales: Son todos sólidos excepto el mercurio que es líquido (conocido porque está presente en los termómetros de uso frecuente). Conducen la corriente eléctrica y el calor, y además son dúctiles y maleables. B. No Metales: Se presentan al estado sólido como el carbono, al líquido como el bromo y al gaseoso como el oxigeno, hidrógeno, nitrógeno, etc. En general los elementos se representan a través de un símbolo que consta de una letra inicial del nombre en mayúscula, y para obviar la situación presentada por varios elementos cuyos nombres comienzan con la misma letra, se convino en agregar una segunda letra en minúscula, tomadas las dos de los nombres en latín o griego. 29 Por ejemplo: Ag (Argentum) Plata Au (Aurum) Oro Los elementos de la vida Todos los seres vivos están constituidos, cualitativa y cuantitativamente por los mismos elementos químicos. De todos los elementos que se hallan en la corteza terrestre, sólo unos 25 son componentes de los seres vivos Esto confirma la idea de que la vida se ha desarrollado sobre unos elementos concretos que poseen unas propiedades físico-químicas idóneas acordes con los procesos químicos que se desarrollan en los seres vivos. Se denominan elementos biogénicos o bioelementos a aquellos elementos químicos que forman parte de los seres vivos. Atendiendo a su abundancia (no importancia) se pueden agrupar en tres categorías: Según su abundancia se pueden clasificar en tres grupos. 1. Bioelementos primarios: H, O, C, N, Son los más abundantes en los seres vivos, representan un 99.3 % del total de los átomos del cuerpo humano, de estos cuatro los más abundantes son el hidrogeno y el oxigeno porque hacen parte de la biomolécula agua. 2. Bioelementos secundarios: Ca. P. K. S. Na. Cl. Mg. Fe. Todos ellos minerales, constituyen 0.7 % del total de los átomos del cuerpo humano. 3. Oligoelementos: Mn. I. Cu. Co. Zn. F. Mo. Se. y otros. Se presentan solo en trazas o en cantidades realmente muy pequeña, pero a pesar de la mínima cantidad su presencia es esencial para el correcto funcionamiento del organismo. La ausencia de estos oligoelementos determina enfermedades carenciales. Otro criterio de clasificación es la función que desempeñan en el organismo y se pueden agrupar de acuerdo con las funciones en: 1. Plástica o estructural: H. O. C. N. P. S. Hacen porte de la estructura del organismo. Músculos piel etc. 2. Esquelética: Ca. Mg. P. F. Si. Encargados de dar rigidez; hacen parte del armazón del organismo (huesos, dientes, cartílagos) 30 3. Energética: C. H. O. P. Son parte fundamental de moléculas con alto contenido de energía ATP, AcetilCoA, Creatina fosfato, fosfoenol pirúvico etc. 4. Catalítica: Fe. Co. Cu. I. Se. Mg. Mn, Mo; participan en las reacciones bioquímicas activando o haciendo parte del sitio activo de las enzimas para aumentar la velocidad de las reacciones. 5. Osmótica: Na, Cl, K, mantienen y regulan la distribución adecuada del agua en los diferentes compartimentos intra y extracelulares. Valencia de un elemento: entendemos a la valencia de un elemento como la capacidad de combinación de los mismos. A continuación se verá un cuadro en el que los elementos se hallan agrupados por carácter y por valencia (se encuentran los más utilizados en la escritura de las fórmulas de compuestos de química inorgánica). Para poder rápidamente escribir fórmulas ya que es el lenguaje de la asignatura es necesario recordar de memoria el listado de los elementos que figuran en ellas. Esto les facilitará la escritura de las fórmulas. METALES Símbolos Nombre Valencia Li Litio 1 Na Sodio K Potasio Ag Plata Hg Mercurio Cu Cobre Ca Calcio Sr Estroncio Ba Bario Be Berilio Mg Magnesio Zn Zinc Cd Cadmio Au Oro 1, 3 Al Aluminio 3 1,2 2 31 Fe Hierro 2, 3 Co Cobalto Ni Níquel Sn Estaño Pt Platino Pb Plomo Cr Cromo 2, 3, 6 Mn Manganeso 2,3,4,6,7 2, 4 NO METALES Símbolos Nombre Valencia H Hidrógeno 1 F Flúor O Oxígeno 2 B Boro 3 C Carbono 4 Si Silicio S Azufre 2, 4, 6 N Nitrógeno 3, 5 P Fósforo As Arsénico Sb Antimonio Cl Cloro Br Bromo I Iodo 1, 3, 5, 7 En algunos textos puede encontrarse el bromo sólo con valencia 1, 3 y 5 lo cual se discutirá oportunamente. A continuación veremos un cuadro que sintetiza la secuencia a seguir para recordar cómo se escribían y nombraban las sales: 32 No metálicos propiamente dichos Dobles Hidruros +H2 No Metal Hidrácidos Oxido ácido o Anhídrido +O2 +H2O Básicas Ácidos Neutras Sal Mixtas Elementos Ácidas Metal +H2 +H2O Oxido Básico +O2 Hidróxidos Hidruros metálicos Óxidos Básicos: Son compuestos que resultan de la combinación de un metal con el oxigeno y para escribir la fórmula del mismo se debe intercambiar valencias, es decir el metal le pasa su valencia al oxigeno como un subíndice, e igualmente el oxigeno le pasa su valencia al metal también como subíndice. En los casos que estos subíndices sean divisibles por un mismo número se los debe simplificar, por ejemplo para un caso general: M1O2 Donde M representa a un metal O representa al oxígeno 1 valencia del oxígeno 2 valencia del metal Tomaremos ahora algunos ejemplos y escribiremos la ecuación de obtención del óxido: 4 Na + O2 2 Na 2 O 33 Para nombrar estos compuestos y los que siguen utilizaremos las distintas Nomenclaturas. En la Antigua (NA), se escribe la palabra óxido seguida de la preposición de y del nombre del metal, siempre que el metal tenga una sola valencia. Si en cambio tiene dos y se prevé el uso de terminaciones oso para la menor valencia e ico para la mayor suprimiendo la preposición de. En la nomenclatura moderna (NM) se tiene en cuenta la atomicidad del compuesto (subíndices) utilizando prefijos como mono, di, tri, etc. En la nomenclatura Numeral Stock (NS) se escribe la palabra óxido seguido de la preposición de y del nombre del metal acompañado de la valencia del mismo en números romanos y entre paréntesis. Por ejemplo: El caso de un metal con una sola valencia: 4Na + O2 2 Na 2O NA: Oxido de sodio NM: Monóxido de disodio NS: Oxido de sodio (I) En el caso de un metal con dos valencias: 4 Au + O2 2 Au2O NA: Oxido auroso NM: Monóxido de dioro NS: Oxido de oro (I) 4 Au + O2 2 Au2O3 NA: Oxido Aúrico NM: Trióxido de dioro NS: Oxido de oro (III) En los primeros párrafos de este apunte dijimos que toda ecuación química debe ser igualada. En las ecuaciones anteriores se observa la igualación con números enteros que figuran adelante de las fórmulas, a los cuales llamaremos coeficientes. Por ahora, se usará el método del tanteo que consiste en “jugar” con los coeficientes hasta igualar la ecuación. A manera de ayudita se les puede decir que la forma más fácil es colocando adelante del símbolo un número de tal 34 manera de convertir en par los subíndices impares. Continuando por la misma rama del cuadro llegamos a los hidróxidos. Hidróxidos: Son compuestos que resultan de la combinación del óxido básico con el agua y responden a la siguiente fórmula general: M (OH)v Donde M= metal (OH)= grupo oxhidrilo v= valencia del metal Una ecuación de obtención sería por ejemplo: Na2O + H2O 2Na(OH) NA: Hidróxido de sodio NM: Monohidróxido de sodio NS: Hidróxido de sodio (I) Para nombrarlos solo se cambia la palabra óxido por hidróxido. Al anterior se lo llama Hidróxido de Sodio. Otros ejemplos serán: Au2O + H2O 2Au(OH) NA: Hidróxido Auroso NM: Monohidróxido de oro NS: Hidróxido de oro (I) Au2O3 + 3H2O 2 Au(OH)3 NA: Hidróxido Aúrico NM: Trihidróxido de oro NS: Hidróxido de oro (III) Comenzaremos ahora a recorrer la otra rama del cuadro y hablaremos sobre los anhídridos. Anhídridos: 35 Son compuestos que resultan de la combinación de los no metales con el oxigeno, y para escribir su fórmula también se debe intercambiar valencias como en el caso de los óxidos básicos y debe usarse el mismo criterio con respecto a la simplificación de los subíndices. Por ejemplo: C2 O4 C + O2 1 2 NA: Anhídrido carbónico NM: Dióxido de carbono NS: Oxido de Carbono (IV) Para nombrarlos según la nomenclatura antigua (NA) se emplea la palabra anhídrido seguida del nombre del no metal terminado en ico si tiene una sola valencia, y se usará oso e ico si tuviera dos valencias. Para el ejemplo anterior sería anhídrido carbónico. En la nomenclatura moderna y en la numeral Stock se siguen las mismas reglas que para los óxidos básicos. Otro ejemplo sería el caso del azufre. El azufre posee las valencias 2,4 y 6; pero solo forma anhídrido con 4 y 6: S + O2 S2O4 1 2 NA: Anhídrido sulfuroso NM: Dióxido de azufre NS: Oxido de azufre (III) 2 S + 3 O2 S2O6 : 2 SO3 1 3 NA: Anhídrido sulfúrico NM: Trióxido de azufre NS: Oxido de azufre (VI) Otro caso es cuando el no metal tiene 4 valencias, como por ejemplo el cloro. En donde además de las terminaciones oso e ico, se usan los prefijos hipo para la menor y per para la mayor a saber: 36 2 Cl2 + O2 2 Cl2O NA: Anhídrido hipocloroso NM: Monóxido de dicloro NS: Oxido de cloro (I) 2 Cl2 + 3 O2 2 Cl2O3 2 Cl2 + 5 O2 2 Cl2O5 2 Cl2 + 7 O2 2 Cl2O7 NA: Anhídrido cloroso NM: Trióxido de dicloro NS: Oxido de cloro (III) NA: Anhídrido clórico NM: Pentóxido de dicloro NS: Oxido de cloro (V) NA: Anhídrido perclórico NM: Heptóxido de dicloro NS: Oxido de cloro (VII) Continuamos con el cuadro y llegamos a los ácidos Ácidos: Son compuestos que resultan de la combinación del anhídrido con el agua y se escribe la fórmula de la siguiente manera: primero el símbolo del hidrógeno, luego el del no metal en cuestión y por último el del oxigeno. Luego se colocan los subíndices en cada uno de los elementos que lo forman y que resultan de la suma de los mismos que figuran en el primer miembro de la ecuación, adoptando el mismo criterio para que los otros compuestos con respecto a la simplificación de los subíndices. Para nombrarlos se cambia la palabra anhídrido por la palabra ácido en la nomenclatura antigua. En la nomenclatura moderna se usan prefijos para indicar los subíndices presentes en el oxígeno seguido del nombre del no metal terminado en ato y recién “de hidrógeno” si tiene uno, y “de hidrógeno o trihidrógeno si tienen 2 o 3 hidrógenos respectivamente”. 37 En la Numeral Stock se escribe el nombre del no metal terminado en ato, seguido de un paréntesis con la valencia del mismo en números romanos y de la expresión “de hidrógeno”. Por ejemplo: CO2 + H2O H2CO3 NA: Ácido carbónico NM: Trioxocarbonato de dihidrógeno NS: Carbonato (IV) de hidrógeno N2O3 + H2O H2N2O4: 1 N2O5 + H2O 1 H2N2O6: 1 Cl2O + H2O 1 ácido nitroso 2 HNO3 ácido nítrico 2 HClO ácido hipocloroso 3 H2Cl2O2: 1 2 HNO2 2 1 1 A continuación vamos a recordar los llamados casos especiales de ácidos. Debemos considerar acá al fósforo, arsénico y antimonio. Estos elementos que poseen valencias 3 y 5 forman dos anhídridos, pero cada uno de estos anhídridos puede formar ácidos según se combinen con 1,2 o 3 moléculas de agua. Para nombrarlos se utilizan prefijos meta, piro y orto, respectivamente. Por ejemplo: P2O3 + H2O H2P2O4: 1 1 2 HPO2 P2O3 + 2 H2O H4P2O5: P2O3 + 3 H2O H6P2O6: 3 1 Ácido pirofosforoso H3PO3 Ácido ortofosforoso ó Fosforoso 2 HPO3 Ácido metafosfórico 3 P2O5 + H2O H2P2O6: 1 1 Ácido metafosforoso 2 3 P2O5 + 2 H2O H4P2O7: P2O5 + 3 H2O H6P2O8: Ácido pirofosfórico 2H3PO4 Ácido ortofosfórico ó Fosfórico 38 3 1 4 También se deben contemplar el caso de Silicio y Boro. El Silicio se combina con 1 y 2 moléculas de H2O y se usan los prefijos meta y orto respectivamente. El Boro se combina con 1 y 3 moléculas H2O y se usan los prefijos meta y orto respectivamente. Están invitados a realizarlo. A veces es conveniente saber hacer la fórmula de ácido directamente (sin realizar la ecuación). Esto es posible para todos los ácidos excepto para los casos especiales y se lo realiza de la siguiente forma: Ejemplo 1: Si se pide la fórmula del ácido Sulfúrico: 1. Escribo los símbolos de los elementos que lo forman: HSO 2. Pienso en la valencia con que el azufre actúa en este caso 6 (la mayor); e inmediatamente me pregunto si es un número par; si la respuesta es afirmativa como en este caso coloco un subíndice 2 en el H: H2SO. 3. Sumo mentalmente la valencia 6 del azufre con el número de hidrógeno o sea 2; 6 +2 = 8 y a este resultado lo divido en 2 y obtengo así el subíndice del oxigeno en la H2SO4 fórmula del ácido: Ejemplo 2: Si se pide la fórmula del ácido Perbrómico: 1. Procedo igual que en el ejemplo 1 escribiendo los símbolos: HBrO 2. Pienso en la valencia, en este caso 7, y como es impar el subíndice del H en el ácido debe ser 1: HBrO 3. Sumo mentalmente la valencia del Bromo, 7, con el número 7 del ácido, o sea: 7 + 1 =8 lo divido en 2 para obtener el subíndice del oxigeno: HBrO4 Caso del Cromo: 39 Cromo: Cr, valencias: 2, 3 y 6 Este elemento forma compuestos de carácter básico con las valencias 2 y 3; mientras que con 6 forma los de carácter ácido: 2 Cr + O2 2 Cr2O2 CrO Óxido cromoso; monóxido de cromo; óxido de cromo (II) 4 Cr + 3 O2 2 Cr2O3 Óxido crómico; trióxido de cromo; óxido de cromo (III) CrO + H2O Cr(OH)2 Hidróxido cromoso; dihidróxido de cromo; hidróxido de cromo (II) Cr2O3 + 3 H2O 2 Cr(OH)3 Hidróxido crómico; trihidróxido de cromo; hidróxido de cromo (III) Con valencia 6: Cr2O6 = CrO3 anhídrido crómico CrO3 + H2O ------------- H2 CrO4 ácido crómico 2 moléculas de ácido crómico por acción del calor se deshidratan y forman el ácido dicrómico: 2 H 2 CrO4 ------------- H2 Cr2 O7 + H2O Caso del Manganeso: Con valencias 2 y 3 forman compuestos de carácter básico, con valencia 4 carácter neutro y con valencia 6 y 7 carácter ácido. MnO óxido manganoso – monóxido de manganeso – óxido de manganeso (II) Mn(OH)2 hidróxido manganoso – dihidróxido de manganeso – hidróxido de Mn (II) Mn2O3 óxido mangánico – trióxido de dimanganeso – hidróxido de manganeso (III) Mn(OH)3 dióxido de manganeso – óxido de manganeso (III) MnO2 dióxido de manganeso – óxido de manganeso (IV) MnO3 anhídrido manganoso – trióxido de manganeso – óxido de manganeso (VI) H2MnO4 ácido mangánico Mn2O7 anhídrido permangánico HMnO4 ácido permangánico 40 Caso del Nitrógeno: Nitrógeno: N. Valencias 1, 2, 3, 4 y 5. Con valencia 1,2 y 4 forma óxidos neutros, con 3 y 5 óxidos ácidos. N2O óxido nitroso, monóxido de dinitrógeno u óxido de nitrógeno I NO óxido nítrico, monóxido de nitrógeno u óxido de nitrógeno II N2O3 anhídrido nitroso, trióxido de dinitrógeno u óxido de nitrógeno III N2O4 tetróxido de dinitrógeno u óxido de nitrógeno IV N2O5 anhídrido nítrico, pentóxido de dinitrógeno u óxido de nitrógeno V Hidruros: Son compuestos formados por hidrógeno y otro elemento. Se clasifican en: a) Hidruros metálicos: formados por un metal, generalmente del grupo I o 11 de la tabla periódica y el H. Ejemplo: NaH hidruro de sodio CaH2 hidruro de calcio b) Hidruros no metálicos: se incluyen los hidrácidos y todo compuesto formado por hidrógeno y un no metal. Ejemplo: NH3 hidruro de nitrógeno o amoníaco PH3 hidruro de fósforo o fosfina CH4 hidruro de carbono o metano Hidrácidos: Son ácidos que no tienen oxigeno y están formados por hidrógeno y un no metal generalmente de los grupos VII y VI A de la tabla, actuando con la menor de sus valencias. Para nombrarlos se usa la palabra ácido seguido del nombre del elemento terminado en “hídríco”. Ej.: H2 + Cl2 --------- 2HCl ácido clorhídrico H2 + S --------- H2S ácido sulfhídrico Radicales de ácidos: se llama así al grupo de átomos que quedan cuando un ácido pierde hidrógeno. Se carga negativamente con tantas cargas como hidrógenos haya perdido A continuación se dan algunos ejemplos y queda como tarea completar todo el cuadro: 41 ACIDO FORMULA H2SO4 HNO3 HCl H4P2O7 NOMBRE Sulfúrico RADICAL FORMULA HSO4- Sulfato ácido SO4 2- Sulfato NO3- Nitrato Cl- Cloruro Nítrico Clorhídrio Pirofosfórico NOMBRE H3P2O7- Pirofosfato triácido H2S H2CO3 SALES Sales Neutras: Son compuestos que resultan de la reacción de neutralización entre los ácidos y los hidróxidos (llamados bases). Se originan por el desplazamiento de los hidrógenos de los ácidos por metales. Las sales se clasifican teniendo en cuenta si la sustitución de los hidrógenos por metales se hace total o parcialmente: serán neutras cuando la sustitución es total, y ácidas si es parcial. Por ahora nos limitaremos a las neutras. Para nombrarlas se toma el nombre del ácido del cual procede la sal y se agregan las terminaciones según lo siguiente: a) Los ácidos terminados en hídrico originan sales terminadas en uro. b) Los ácidos terminados en oso originan sales terminadas en ito. c) Los ácidos terminados en ico originan sales terminadas en ato. En la siguiente tabla se muestran en resumen las pautas Nombre del ácido Hipo ---------- oso Nombre de la sal Hipo ---------- ito 42 Per ------------ ico Per ------------ ato ----------------- oso ----------------- ito ----------------- ico ----------------- ato ----------------- hídrico ----------------- uro Piro------------ ico Piro------------ ato Orto------------ oso Orto------------ ito Ahora a través de un ejemplo concreto se explicarán los pasos a seguir para escribir la fórmula de una sal. Supongamos que se nos solicitara escribir la ecuación del Sulfato Férrico: a. Se analiza el nombre de la sal para saber de qué ácido proviene, en este caso es el ácido sulfúrico y se escribe la fórmula según se explicó anteriormente. SO3 + H2O H2 SO4 b. Se escribe la fórmula del hidróxido, en este caso: Fe(OH) 3, que es el hidróxido férrico. c. Se escribe la ecuación de formación de la sal sumando el ácido con el hidróxido: H2SO4 + Fe (OH)3 d. En el segundo miembro de la ecuación, se debe escribir la fórmula de la sal de la siguiente manera: primero el símbolo del metal, al lado y entre paréntesis lo que queda del ácido al quitarle los hidrógenos (a este grupo se lo llama radical del ácido). Luego se debe intercambiar valencias: la del metal pasa como subíndice al radical del ácido, y la del radical (que está dada por el número de hidrógenos sustituidos) pasa como subíndice al metal. Con respecto a la simplificación de estos subíndices se debe adoptar igual criterio que en los otros compuestos. e. Por último y como toda ecuación hay que igualarla. En el ejemplo se verán los mecanismos para averiguar los coeficientes del ácido y del hidróxido, y luego, por tanteo, se determinará el coeficiente del agua. Por ejemplo: Sulfato Férrico ácido sulfúrico Hidróxido férrico 3 H2SO4 + 2 Fe(OH)3 Fe2 (SO4)3 + 6 H2O 43 Sales ácidas: Son aquellas que en su nombre se lee la palabra ácido y en su fórmula se encuentra presente el Hidrógeno. Se originan a partir de ácidos con 2 o más Hidrógenos en su fórmula Ejemplo: Sulfato ácido Plúmbico. Para los puntos a., b. y c. Se procede igual que para sales neutras. H2SO4 + Pb (OH)4 d. En el segundo miembro se debe escribir la fórmula de la sal de la siguiente manera: el símbolo del metal, al lado del radical del ácido con un número de hidrógenos igual al prefijo que lleva la palabra ácido en el nombre de la sal, si es ácido 1, si dice diácido 2 y si dice triácido 3. Luego se intercambian valencias entre el metal y el radical y de ahí se procede de la misma forma que para sales neutras: 4 H2SO4 + Pb (OH)4 Pb1 (H SO4)4 + 4 H2O Sales Básicas: Son aquellas que en su nombre se lee la palabra “básico”, y en su fórmula aparece el grupo (OH). Se originan de hidróxidos con 2 ó más grupos oxhidrilos en su fórmula. Ejemplo: Yodato dibásico de aluminio. Para los puntos a., b y c. se procede como en sales neutras HlO3 + Al (OH)3 d. En el 2º miembro se debe escribir la fórmula de la siguiente manera: el símbolo del metal seguido de tantos grupos oxhidrilos como lo indique el prefijo de la palabra básico en el nombre de la sal. Se encierra todo esto entre paréntesis y a continuación se escribe el radical del ácido como en las sales neutras. De allí en adelante se sigue como en lo explicado anteriormente. HlO3 + Al(OH)3 Al (OH)21 (IO3)1 + H2O Nota: El subíndice uno no es necesario escribirlo, acá se lo pone con fines aclaratorios solamente. 44 Sales Dobles: Son aquellas que presentan en su fórmula 2 metales y se las nombra con el nombre del radical seguido del nombre de un metal, la conjunción “y” y el nombre del segundo metal o con la palabra “doble”. Ejemplo: K1Na1SO4 Sulfato de Sodio y Potasio NaCaCl1+2 Cloruro doble de Sodio y Calcio Sales Mixtas: Son aquellas que presentan en su fórmula 2 radicales ácidos Ejemplo: Na2 (BrO2) (Cl)1 Cloruro Bromito de Sodio Mg2 (PO4) (Br)1 Bromo Fosfato de Magnesio Otros compuestos Peróxidos Este es el nombre genérico de las combinaciones de oxigeno y metal, en las que el primero presenta la agrupación atómica (-O-O-) Su fórmula es referible a: M2 (O2)a Y se nombran con la palabra peróxido seguida del nombre del metal (en general alcalino o alcalino térreo) en genitivo o adjetivado. Ejemplos: Peróxido de bario BaO2 Peróxido de calcio CaO2 Peróxido de cúprico CuO2 Peróxido de litio Li2O2 Peróxido niqueloso NiO2 Agua Oxigenada H2O2 Oxilita Na2O2 Otros nombres Oxidos mixtos o salinos 45 Se trata de un tipo de combinación oxigenada de los metales que responden a la fórmula: M3O4 Aunque debemos señalar que no se trata de una combinación química propiamente dicha, sino que es una forma de referirnos a la asociación de los dos óxidos de los metales que pueden actuar con más de una valencia. Se nombran con la palabra óxido y el nombre del metal terminado en –oso e –ico, sucesivamente. Ejemplos: 2 PbO + PbO2 Pb3O4 Oxido plumboso plúmbico MnO + Mn2O3 Mn3O4 Oxido manganoso mangánico FeO + Fe2O3 Fe3O4 Oxido ferroso férrico Trabajo Práctico Nº 2 1 - Dados los siguientes compuestos químicos: MgS; LiBrO3; Pb(CO3)2; KHSO4 La secuencia correcta que relaciona los nombres con las fórmulas es: a. sulfato de magnesio- bromato de litio- carbonato plumboso- sulfato de potasio b. sulfuro de magnesio- bromato de litio- carbonato plúmbico- sulfito ácido de potasio c. sulfito de magnesio- bromito de litio- carbonato plumboso- sulfito ácido de potasio d. sulfuro de magnesio- bromato de litio- carbonato plúmbico- sulfato ácido de potasio 2- Dadas las siguientes fórmulas y nombres de compuestos químicos: I) AlIO3 trioxoiodato de aluminio II) Cu(HS)2 sulfuro de cobre(II) III) Ag3N nitruro de plata IV) HBrO ácido brómico V) H3PO4 ácido fosfórico Indicar la opción que contiene el conjunto de pares correctos: a- I, II y III b- II, III y V c- II y IV d- I, III y V 3- El cloro tiene diferentes valencias y forma así diferentes compuestos, algunos de los cuales se presentan a continuación: I) HCl II) Cl2O III) KClO3 IV) Mg(ClO4)2 Sus respectivos nombres son: I)cloruro de sodio II) hipoclorito de oxígeno III) perclorato de potasio IV) clorito de magnesio I)cloruro de hidrógeno II) monóxido de di cloro III) perclorato de potasio IV) clorato de magnesio I)cloruro de hidrógeno II) monóxido de di cloro III) clorato de potasio IV) perclorato de magnesio I)cloruro de hidrógeno II) dióxido de cloro III) clorato de potasio IV) perclorato de magnesio 46 4-Dadas los siguientes nombres: tetraoxosulfato de dihidrógeno, hidróxido de estroncio, clorato (I) de calcio, fluoruro de litio, nitrato(V) de aluminio, trioxocarbonato de di potasio, tetraoxosilicato de diberilio, sulfato(IV) de magnesio, monoxoclorato de hidrógeno, sulfuro de sodio, óxido de fósforo (III). Escribir las correspondientes fórmulas. 5-Nombrar y clasificar los siguientes compuestos: K2O, MgO, PbO2, P2O5, HgO, NO, SiO2, Co2O3, Cl2O7, CO, SnO, MnO2, I2O, CrO, N2O, MnO3. 6-Formular los siguientes compuestos: óxido de mercurio(I), anhídrido hipobromoso, Dióxido de platino, óxido de niquel(II), anhídrido nítrico, óxido manganoso, monóxido de bario, trióxido de di cromo, óxido de bromo(V), anhídrido sulfúrico, óxido de yodo(VII) 7-Complete las ecuaciones de disociación iónica de los siguientes compuestos, dando el nombre del anión: a. H2SO4 (.........) _ _ _ _ _ _ _ _ + _ _ _ _ _ _ _ _ b. _ _ _ _ _ _ _ _ (H2O) + H+ + NO-3 (................................) (................................) c. _ _ _ _ _ _ _ _ (H2O) Ca2+ + _ _ _ _ _ _ _ _ (oxhidrilo) d. Na(OH) (.........) _ _ _ _ _ _ _ _ + _ _ _ _ _ _ _ _ (...............................) e. _ _ _ _ _ _ _ _(.........) _ _ _ _ _ _ _ _ + _ _ _ _ _ _ _ _ f._ _ _ _ _ _ _ _ (.........) Fe3+ + 3OH- (sulfito) (...............................) 8-Complete las siguientes reacciones indicando en cada caso el nombre de las sales que se forman: a. ácido nitroso + hidróxido de potasio agua + ............................. b. ácido clorhídrico + hidróxido de bario agua + ............................ 9-Efectue la disociación de los siguientes ácidos y coloque e nombre a todos los radicales formados: a. acido clórico b. acido sulfuroso 47 c. acido sulfhídrico d. acido pirofosfórico e. acido metasiliciso 10. Complete las siguientes ecuaciones de neutralización, dando el nombre de la oxosal. a. H2SO4 +_ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ + K2SO4 b. _ _ _ _ _ _ _ _ + Cu (OH) c. HNO3 + Ca (OH)2 ............................. _ _ _ _ _ _ _ _ + CuClO2 ............................ ________ +________ ........................... d. H2S + _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ + FeS .......................... e. _ _ _ _ _ _ _ _ + _ _ _ _ _ _ _ _ H2O + HgSO3 .......................... f. _ _ _ _ _ _ _ _ + _ _ _ _ _ _ _ _ H2O + CaCl2 ......................... 11-Dé el nombre de las siguientes sales: a BaSO3:.................................. b. . .... d. c Ca(NO2)2:............................. f. . .... h. e KNO3:................................... j. . ... FeCl3: ......................... NaClO:................................. CuSO4:................................. Li2CO3:................................ g Al(NO3)2:........................... 48 TRABAJOS PRACTICOS DE LABORATORIO 49 TRABAJO PRACTICO Nº 1 RECONOCIMIENTO DEL MATERIAL DE LABORATORIO Y DE PICTOGRAMAS 1) Dibuje el material de laboratorio que encontrará en la mesada. 2) Busque en la Biblioteca de la Facultad, en libros de textos o en Internet información de los mismos de tal manera que construya una ficha de cada uno (esta información debe responder a las siguientes preguntas: de que están fabricados, el nombre, para que se usa, etc.). El informe deberá presentarse por grupo y bajo las pautas de redacción de informes establecidas en el módulo Técnicas de Estudio. 3) Para la correcta manipulación de los productos peligrosos es imprescindible que el usuario sepa identificar los distintos riesgos, intrínsecos a la naturaleza de los diversos reactivos químicos, a través de la señalización con los símbolos de peligrosidad respectivos. Los símbolos de riesgo o peligrosidad son pictogramas o representaciones impresas en fondo anaranjado, utilizados en rótulos o informaciones de productos químicos. Éstos sirven para advertir sobre la peligrosidad o riesgo de un producto. Busque información y complete el siguiente cuadro referente a algunos pictógramas y sus significado que puede encontrar en el laboratorio. Pictograma Significado Clasificación y precaución . 50 51 TRABAJO PRÁCTICO N° 2 DENSIDAD DE SÓLIDOS Y LÍQUIDOS 1) Densidad de sólidos: A) Densidad de la masilla: a) Modele tres esferas de diferentes valores de radio con la masilla que se encuentra en la mesada. b) Determine la masa de cada una, primero con la balanza granataria y luego con la balanza analítica. Registre todos los valores en el cuadro. c) Coloque agua en una probeta hasta cierta cantidad. Lea el volumen. Introduzca una de las esferas y lea nuevamente el volumen. Determine, por diferencia, el volumen de la misma. Regísterlo en el cuadro. d) Repita el procedimiento para las otras dos esferas. e) Calcule la densidad utilizando los valores de la masa obtenida con las dos balanzas y registrelo en el cuadro. Muestra de Masa (gramos) Masilla Granataria Analítica 1 Volumen Densidad (cm³) S/ Granataria S/Analítica 2 3 B) Densidad de Metales: a) Dados los siguientes matales: Fe, Cu, Co y Zn, determine la masa y el volumen de cada uno siguiendo las instrucciones del punto 1 A. Anote los valores en el cuadro. b) Calcule la densidad y registre los valores en el cuadro. Metales Masa (gr) Volumen (cm³) Densidad (g / cm³) 2) Densidad del agua: 52 a) Determine la masa de un vaso de precipitado de 50 cm³ de capacidad. b) Agregue agua hasta la cuarta parte de su capacidad y determine nuevamente su masa. Regístrelo en el cuadro. c) Calcule, por diferencia, la masa del agua. Regístrelo en el cuadro. d) Trasvase el agua a una probeta graduada y lea su volumen. Regístrelo en el cuadro. e) Calcule la densidad y anótelo en el cuadro. B) Densidad de un líquido desconocido: a) Solicite la muestra al profesor. b) Proceda como en el punto 2 A. Líquidos Masa (gr.) Volumen (cm³) Densidad (g / cm³) Agua Sustancia x C) Densidad de líquidos usando densímetros: a) Opere según instrucciones del profesor para determinar nuevamente la densidad del agua y del líquido desconocido. b) Anote los resultados en el cuadro. c) Compare los resultados con los obtenidos en 2 A y en 2 B. Líquidos Densidad (g / cm³) Agua Sustancia x 3) Para responder: a) ¿Con cuál de las dos balanzas obtuvo constancia de masa? ¿Por qué? b) Calcule el error porcentual con los datos obtenidos (para la experiencia de la masilla) en los valores obtenidos de la densidad. Explique. c) Informe con la ayuda de la tabla de densidades el nombre del líquido desconocido. 53 TRABAJO PRÁCTICO Nº 3 SISTEMAS MATERIALES 1- Coloque en un vaso de precipitado unos ml de agua destilada,, disuelva en el agua con la ayuda de una cuchara unos gramos de cloruro de sodio (sal), luego agregue unos gramos de arena y de limaduras de hierro, y por último un corcho cortado en 6 trozos. 2-Observe el sistema en estudio, dibújelo e indique: a-Tipo de sistema. b-¿Cuántas y cuáles son las fases que lo forman?. c-¿Cuáles son las sustancias que lo forman (componentes)?. 3-Con la ayuda de una pinza, extraer los trozos de corcho que hay en el sistema. Indique como se llama este procedimiento. 4-Deje reposar el sistema hasta que estén bien separadas las fases. Vierta con cuidado el agua que sobrenada a otro recipiente. ¿Cómo se denomina esta acción?. ¿Cuándo es posible efectuarla?. 5-Coloque el residuo de arena y las limaduras de hierro en una cápsula de porcelana y sométalas a un secado con la ayuda de un mechero, sosteniendo la cápsula con una pinza de madera. ¿En qué consiste un secado?. 6-Al residuo seco acérquele un imán y separe las limaduras de hierro. ¿Cómo se llama este método?. ¿Cuándo es posible realizar una separación magnética?. 7-Prepare un filtro según le indica el profesor y luego vierta lentamente la suspensión de agua salada y arena. Espere a que pase a través del papel.¿ Cómo se llama este procedimiento?. ¿Por qué la solución pasa por el filtro y no lo hacen las partículas de arena?. 8-Observe la solución que le quedó en la probeta, ¿Qué clase de sistema tiene, cuántas fases y cuántos componentes presenta el mismo?. 9-Coloque la solución en una cápsula de porcelana y caliente con la ayuda de un mechero hasta la evaporación total del líquido. ¿Cómo se denomina este procedimiento?. .Describa el producto obtenido luego que se evapora el agua. 10- a. Marque con un lápiz (no use bolígrafo, marcador ni lapicera) la línea de salida a 3 – 4 cm del borde de una tira de papel de filtro de 4x8 cm de ancho. Con la punta de un aguja grande coloque una gota pequeña de tinta líquida de color rojo y otra de tinta líquida de color verde sobre la tira de papel (no utilizar la misma aguja). Las gotas deben quedar separadas entre 1,5 cm. Luego, dejar secar las manchas. 54 b. Preparar una mezcla con 2 ml de alcohol etílico y 2 ml de agua. Colocarla en un vaso de pp. Introduzca la tira de papel en el vaso, de tal manera que la orilla donde están las gotas quede hacia abajo, y que la mezcla no toque las manchas dejadas por las gotas. Tapar el vaso con un vidrio de reloj para que no se evapore el alcohol. c. Dejar que la mezcla líquida ascienda hasta la orilla superior del papel y observar. d. El alcohol asciende por el papel de filtro (se absorbe por capilaridad) y, al llegar a las manchas de tinta ¿Qué sucede? Tinta roja:.................................................................................................................................. Tinta verde:............................................................................................................................... I)Indicar los componentes y colores de cada tinta que observó.. II)¿Podemos afirmar que la tinta roja y la verde son mezclas? ¿Cómo se denomina a este método de separación?. CONCLUSIONES: 1) ¿Cuáles son los métodos para la separación de las fases de un sistema heterogéneo que ha empleado en este trabajo práctico?. 2) ¿Qué método utilizó para separar un sistema homogéneo?. 3) Mencione otros métodos de separación que conozca. 4) ¿Por qué se denominan métodos separativos?. 55 TRABAJO PRÁCTICO Nº 4 COLOIDES 1) Solicite al JTP y/o Ayudante de Trabajos Prácticos los 100 ml de solución de gelatina al 6% preparada en agua caliente, dejar enfriar un poco y colocar con una probeta 10 ml en 10 tubos de ensayo diferentes y numerados, de la siguiente manera: a. tubo 1: 5 ml de azul de metileno b. tubo 2: 5 ml de sulfato de cobre c. tubo 3: 5 ml de colorante rojo d. tubo 4: 5 ml colorante azul e. tubo 5: 5 ml de dicromato de potasio f. tubo 6: 5 ml cloruro cobáltico g. tubo 7: 5 ml de nitrato férrico h. tubo 8: 5 ml cloruro férrico i. tubo 9: 5 ml ferrocianuro de potasio j. tubo 10: 5 ml permanganato de potasio 2- En el momento de la adición del gel de gelatina a cada una de las sustancias anotar la hora. Medir la distancia recorrida como función de tiempo, cada vez que el avance de cualquiera de las soluciones sea apreciable NOTA: la difusión, en forma general, para estos sistemas es muy lenta, por lo que no se extrañe que cuando alcanza el equilibrio se haya tardado 2 o 3 días en difundir. 3- Anote todas sus observaciones durante una semana. B- PREPARACIÓN DE SISTEMAS COLOIDALES 1. Preparación del Sol de yoduro de plata: En un tubo de ensayo de 5 ml colocar 0,2 ml de KI 0,1 N y diluir con agua destilada a 1,1 ml de volumen final. En otro tubo colocar 0,1 ml de nitrato de plata 0,1n y diluir tambien a 1,1 ml. Poco a poco y agitando se vierte la solución de AgNO3 2. Preparación del Sol de hierro (III): en 1 ml de agua destilada hirviendo colocar con una pipeta 0,05 ml de solución de FeCl3 al 32 %. Observe el momento de unión entre los líquidos. Reserve el producto para experiencia C 3. Preparación de coloides de gelatina: Disuelva o,2 g de gelatina en 80 ml de agua destilada hirviendo, coloque luego el sistema en un baño de agua fría. Anote sus 56 observaciones. Realice lo mismo pero ahora disolviendo 0,75 g de gelatina en 25 ml de agua. Verifique efecto Tyndall 4. Preparación de coloide de benceno: En dos tubos de ensayo colocar 2 ml de agua destilada y 1 ml de benceno. En un de ellos agregar 2 gotas de solución jabonosa. Agitar los 2 tubos fuertemente. Anote sus observaciones. C- PURIFICACIÓN DEL SOL DE HIERRO (III) POR DIÁLISIS 1. Haga una bolsa de papel celofán e introduzca el sol de hierro en ella. Medir pH. 2. Selle la parte superior de la bolsa con una liga o cinta, asegurándose que el sol no salga por el cuello. 3. Introduzca la bolsa sellada en un vaso de pp de 100 ml que contenga 50 ml de agua destilada. Después de una semana medir pH.¿Verifica que se produjo diálisis? D- De acuerdo a las experiencias realizadas señale que propiedades de los coloides pudo observa y verificar. TRABAJO PRÁCTICO Nº 5. LABORATORIO VIRTUAL En esta instancia se trabajará en la sala de computación con un software educativo “Laboratorio virtual de química” 57 TECNICAS DE ESTUDIO 58 PLANES DE ESTUDIO Que es un Plan de Estudios? Es el diseño curricular concreto respecto de unas determinadas enseñanzas realizado por una universidad, sujeto a las directrices generales comunes y a las correspondientes directrices generales propias, cuya superación da derecho a la obtención de un título universitario de grado de carácter oficial y validez en todo el territorio nacional. Características: El plan de estudios ha de estar diseñado de tal forma que contemple la formación, preparación y entrenamiento de futuros profesionales mediante la aplicación de un método investigativo general y de los métodos y normas particulares de las diferentes disciplinas, con responsabilidad y conciencia de su incidencia en la sociedad. Los planes de estudios se elaboran y aprueban por las universidades, en la forma que determinan sus estatutos o normas de organización y funcionamiento, previa autorización de su implantación por el órgano competente de la respectiva comunidad autónoma. Deben ajustarse a las directrices generales comunes y a las directrices generales propias que el gobierno nacional establezca para cada título y se homologan de acuerdo con la normativa vigente al respecto. Categorías/clasificaciones: - Estudios de Grado: comprenden las enseñanzas universitarias de primer ciclo y tienen como objetivo lograr la capacitación de los estudiantes para integrarse en el ámbito laboral con una cualificación profesional apropiada. - Estudios de Posgrado: comprenden las Especializaciones, Maestrías, Doctorados, Posdoctorados. Constituyen una formación avanzada dirigida a una especialización académica o profesional o bien a promover la iniciación en tareas investigadoras. Representan el nivel más elevado de la Educación Superior. A continuación te presento los Planes de Estudio del Departamento Química de la Facultad de Ciencias Exactas y Naturales, desde ahora, “tu facultad”. En este contexto te informo que en la FACEN existen tres Carreras relacionadas directamente con la Química, ellas son: Licenciatura en Química, Profesorado en Química y Técnico Químico Universitario. La propuesta es analizarlos y despejar las dudas que tengas al respecto. Esto es muy importante, por lo que te sugiero que prestes mucha atención para que puedas participar con preguntas e inquietudes. Nº PLAN DE ESTUDIOS LICENCIATURA EN QUIMICA , PLAN 2011 Crédito Crédito Horario Horario Anual Semanal 59 Asignatura Cuat. PRIMER AÑO 01 02 QUÍMICA GENERAL I MATEMÁTICA I 2 asignaturas semanales 03 QUÍMICA GENERAL II 04 MATEMÁTICA II 05 FÍSICA I 3 asignaturas semanales Total anual SEGUNDO AÑO 06 07 08 QUÍMICA INORGÁNICA QUÍMICA ORGÁNICA I FÍSICA II 3 asignaturas semanales 09 QUÍMICA ORGÁNICA II 10 QUÍMICA ANALÍTICA I 11 MATEMÁTICA III 3 asignaturas semanales Total anual TERCER AÑO 12 BIOLOGÍA GENERAL 13 14 15 QUÍMICA FÍSICA I QUÍMICA ANALÍTICA II 3 asignaturas semanales QUÍMICA ORGÁNICA III 16 QUIMIOMETRIA 1° 2° 1° 2° 1° 2° 17 18 QUÍMICA FÍSICA II QUÍMICA BIOLÓGICA 4 asignaturas semanales Total anual (*) CUARTO AÑO 19 20 21 22 23 24 25 26 27 28 QUÍMICA FÍSICA III MICROBIOLOGIA GENERAL QUÍMICA AMBIENTAL BROMATOLOGIA I OPTATIVA I (**) 5 asignaturas semanales QUÍMICA ANALÍTICA III TOXICOLOGÍA HIGIENE Y SEGURIDAD LABORAL TECNOLOGÍA QUÍMICA QUIMICA BIOINORGANICA 5 asignaturas semanales 1° 2° 10 08 18 07 06 08 21 150 120 270 105 90 120 315 585 10 10 08 28 10 10 06 26 150 150 120 420 150 150 90 390 810 04 60 10 10 24 07 150 150 360 105 05 75 10 04 26 150 60 390 750 07 04 04 04 09 28 07 04 04 04 10 29 105 60 60 60 135 420 105 60 60 60 150 435 60 Total anual 855 QUINTO AÑO 29 30 31 32 33 34 OPTATIVA II (**) TECNOLOGÍA DE LOS ALIMENTOS ANALISIS DE MINERALES 3 asignaturas semanales BROMATOLOGÍA II QUIMICA ANALITICA AMBIENTAL 2 asignaturas semanales TRABAJO FINAL Total anual 09 10 10 29 10 10 20 1° 2º 135 150 150 435 150 150 300 200 935 anual (*) Para cursar el cuarto año de la carrera de Licenciatura en Química el alumno deberá aprobar un exam suficiencia de Inglés Técnico o cursar la asignatura extracurricular Inglés Técnico que ofrece la U Académica. En este último caso, la condición requerida es tener aprobado el 2do. Año de la c Licenciatura en Química. (**) Las 2 asignaturas optativas se elegirán de la siguiente nómina de asignaturas Departamento de Química. ofrecidas Plan de Estudios: Profesorado en Química Nº Asignatura Curs. Hor. Correlatividad Regular Aprobada Primer Año 01 Matemática I 1º C 8 ------ ------ 02 Química General I 1º C 6 ------ ------ 03 Laboratorio I 1º C 8 ------ ------ 04 Biología General 2º C 6 2 ------ 05 Física I 2º C 8 1 ------ 06 Química General II 2º C 6 2-3 ------ Segundo Año 07 Química Inorgánica 1º C 8 3-5 2 08 Física II 1º C 6 5 1 09 Química Orgánica I 1º C 8 6 2-3 10 Matemática II 2º C 6 ------ 1 11 Química Orgánica II 2º C 8 7-9 6 12 Química Analítica I 2º C 8 9 6-7 13 Problemática de la Educación I 2º C 8 ------ ------ 3 ------ Tercer Año 14 Problemática de la Educación II 1º C 10 61 15 Psicología Evolutiva y del Aprendizaje 1º C 8 13 ------ 16 Química Analítica II 1º C 6 12 7-9 17 Química Industrial 2º C 6 ------ 11-12 18 Didáctica Especial 2º C 8 14 13 19 Elementos de Geoquímica 2º C 6 ------ 7-9 20 Química Física I 2º C 8 ------ 7-8-10 8 20 ------ 1º C 10 18 11-14-16 Cuarto Año 21 Química Física II 22 1º C Practica de la Enseñanza de la Química I 23 Química Biológica 1º C 6 ------ 4-11 24 Historia y Epistemología de la Química 1º C 6 ------ 9-11 25 Química Ambiental 2º C 6 17 16 26 Bromatología 2º C 6 23 11-16 ------ 22 27 Practica de la Enseñanza de la Química II 2º C 12 Plan de Estudios: Técnico Químico Universitario Nº Asignatura Curs. Hor. Correlatividad Regular Aprobada Primer Año 01 Matemática 1º C 8 ------ ------ 02 Química General I 1º C 6 ------ ------ 03 Laboratorio I 1º C 8 ------ ------ 04 Biología General 2º C 6 2 ------ 05 Física I 2º C 8 1 ------ 06 Química General II 2º C 6 2-3 ------ Segundo Año 07 Química Inorgánica 1º C 8 3-5 2 08 Física II 1º C 6 5 1 09 Química Orgánica I 1º C 8 6 2-3 10 Laboratorio II 2º C 8 7-8 3-5-6 11 Química Orgánica II 2º C 8 7-9 6 12 Química Analítica 2º C 8 9 6-7 Tercer Año 62 13 Microbiología General 1º C 6 11 4-10 14 Toxicología 1º C 6 11-12 9-10 15 Practica Profesional I 1º C 10 11-12 7-9-10 16 Química Industrial 2º C 6 ------ 11-12 17 Optativa 2º C 6 ------ ------ 18 Practica Profesional II 2º C 10 13-14 15 Plan de Estudios: Licenciatura en Ciencias Ambientales , PLAN 2010 Nro. Asignatura Horas Año 0 COMPUTACION - 2010 - 1 0 0 0 INGLES TECNICO - 2010 - 1 0 0 0 BIOLOGIA GENERAL - 2010 - 1 7 1 0 QUIMICA I - 2010 - 1 4 1 0 ESTUDIO DEL AMBIENTE - 2010 - 1 7 1 0 FUNDAMENTOS DE MATEMATICA - 2010 - 1 3 1 0 ZOOLOGIA - 2010 - 1 4 2 0 QUIMICA II - 2010 - 1 4 2 0 BOTANICA SISTEMATICA - 2010 - 1 4 2 0 FISICA AMBIENTAL - 2010 - 1 6 2 0 RECURSOS NATURALES - 2010 - 1 4 2 0 GESTION AMBIENTAL - 2010 - 1 3 3 0 OPTATIVA - 2010 - 1 3 3 0 MICROBIOLOGIA AMBIENTAL - 2010 - 1 6 3 0 QUIMICA AMBIENTAL - 2010 - 1 6 3 0 ADMNISTRACION Y LEGISLACION AMBIENTAL - 2010 - 1 3 3 0 ECOLOGIA - 2010 - 1 7 3 0 GEOLOGIA Y GEOMORFOLOGIA - 2010 - 1 6 4 0 EDUCACION AMBIENTAL - 2010 - 1 3 4 0 DESARROLLO SOSTENIBLE - 2010 - 1 6 4 0 ALIMENTACION AMBIENTE Y SOCIEDAD - 2010 - 1 6 4 0 ORDENAMIENTO TERRITORIAL - 2010 - 1 6 4 0 TRABAJO FINAL - 2010 - 1 8 5 0 EVALUACION DE IMPACTO AMBIENTAL - 2010 - 1 4 5 0 PATRIMONIO CULTURAL Y CIENTIFICO - 2010 - 1 6 5 SISTEMA DE INFORMACION GEOGRAFICA APLICADA AL 0 6 5 AMBIENTE - 2010 - 1 0 METODOLOGIA DE LA INVESTIGACION EN CIENCIAS 6 5 63 0 3 AMBIENTALES - 2010 - 1 ESTADISTICA - 2010 - 1 FISICA - 2010 - 1 6 6 5 1 1. LAS TÉCNICAS DE ESTUDIO Las técnicas de estudio se han convertido en uno de los temas no solamente actuales sino también importantes, interesantes e imprescindibles para los estudiantes de todos los niveles educativos. Luego de comprobar a través de los diferentes sistemas de evaluación, el fracaso escolar que se produce en las instituciones o centros educativos, los estudiantes especialmente tendrían que asumir ésta realidad y tratar de mejorar su rendimiento con normas, trucos, técnicas o recetas de estudio que puedan revertir sus rendimientos. Pero ante todo es fundamental la toma de conciencia, por parte de los mismos acerca de la necesidad, para el logro de sus objetivos tanto personales como académicos de "tener que estudiar". Para ello es fundamental que los estudiantes se comprometan responsablemente a dar prioridad al estudio, sobre las demás actividades, con la finalidad de lograr sus expectativas, en cuánto a su formación profesional, desechando toda aptitud negativa o de rechazo, ante las exigencias propias del estudio, dado que es evidente que la sociedad cada día demanda de los profesionales, más calidad y excelencia en el desempeño de sus funciones, para insertarse con éxito en el mercado laboral. Nosotros los docentes les proponemos actualizar sus conocimientos con respecto a las técnicas de estudio, para utilizarlas como herramientas para optimizar sus capacidades intelectuales y aprendizajes. Las técnicas de estudio son un conjunto de herramientas, fundamentalmente lógicas, que ayudan a mejorar el rendimiento y facilitan el proceso de memorización y estudio. La organización a la hora de comenzar un año escolar es fundamental. A partir del horario de las clases presénciales, se debe organizar el resto del tiempo, de tal manera que les permita el repaso, la consulta, ampliación de los contenidos que se imparten en las diferentes asignaturas. Por lo tanto demás está decirlo el estudio debe ser diario o continuo, hasta convertirse en un hábito, lo que no significa que basta con estar sentado delante de los libros dos o tres horas todos los días; Sino que debe ser un hábito conciente que les s ayude a detectar necesidades, dificultades, que les permita analizar en que campos o temas se tiene más problemas, organizar y planificar prioridades inmediatas (exámenes parciales o finales, y trabajos prácticos, monografías, etc.), y a partir de ahí confeccionar un horario de "trabajo" diario. Sí, decimos bien, "trabajo" ya que ustedes deben tomar conciencia que el estudio, hasta finalizar sus formaciones académicas y convertirse en profesionales activos socialmente, es mientras tanto su “trabajo”, y que el éxito de sus futuros laborales depende en gran medida de la preparación científica, idoneidad, dedicación y vocación que logren y manifiesten durante su tiempo como estudiantes Es preciso tener claro o mentalizarse al elegir la carrera o profesión a lograr que estudian para forjar sus propios porvenires o futuros y no lo de sus padres, para evitar futuros abandonos o frustraciones que les coarten sus vidas. 64 2. CÓMO, DONDE Y CUANDO ESTUDIAR. EL HORARIO PERSONAL Y LA ORGANIZACIÓN DEL MATERIAL DE ESTUDIO. "Un buen plan de trabajo debe ser personal, realista, flexible y con tiempo para el estudio y tiempo para el descanso"(Brunet) El primer paso que debemos dar en el campo de las técnicas de estudio, es el de tener bien en claro que estudiar es necesario y fundamental, pero que para realizar correctamente esta tarea es conveniente que confluyan ciertas condiciones básicas para rendir bien y obtener provecho. Es fundamental que tengan bien claro ciertas condiciones que benefician el estudio: Donde estudiar En una habitación que dispongan para ello, si puede ser de su uso exclusivo, sin malos olores, bien aireada y ventilada, ni con mucho calor ni con frío, sin molestias de ruidos, ni otro tipo de distracciones (televisión, juegos de los hermanos, radio, etc.). Que tengan una mesa de trabajo amplia, en la que puedan tener encima todo el material que van a necesitar, sin otros objetos de distracción como revistas, juegos, adornos móviles, etc. La luz que sea preferiblemente natural y si no es así que sea blanca o azul y que proceda del lado contrario a la mano con la que escriben (a un zurdo la luz tendrá que provenirle de la derecha). Tanto la mesa como la silla deberán estar en consonancia con su altura, ser cómodas pero no en exceso. La silla tiene que tener respaldo y ser dura. La excesiva comodidad les llevará a rendir menos e incluso a dejar de estudiar, pero con la incomodidad ocurrirá lo mismo. Como y cuando estudiar Debe cuidarse mucho la postura. Con el tronco estirado y la espalda apoyada en el respaldo de la silla. A una distancia alrededor de 30 cm. del libro o apuntes y si es posible que estén inclinados sobre un atril u otro objeto, esto hace que la vista y los ojos no se cansen tan pronto. Es muy importante estar decidido a la hora de ponerse a estudiar, no titubear e intentar mentalizarlos de que ese es el trabajo que tienen que hacer y es mejor hacerlo con alegría y distensión que enfadados y sin ganas. Es muy importante que antes de ponerse a estudiar hagan una reflexión sobre todo lo que van a necesitar y lo coloquen o en la mesa o al alcance de la mano (diccionarios, libros de consulta, bolígrafos, reglas, enciclopedias, etc). También es muy importante que sepan que es lo que van a hacer cada día y tenerlo todo planificado (pero con flexibilidad). Por eso es muy conveniente que hagan un horario de estudio diario pero que tiene que ser realista, teniendo en cuenta sus capacidades, realizable y factible y también flexible y preparado para los imprevistos, donde no solo esté reflejado el tiempo de estudio sino también el tiempo de ocio y descanso. 65 A la hora de hacer su horario que piensen cual es el mejor momento para estudiar, según sus condiciones, y siempre que empiecen por las asignaturas más fáciles para pasar posteriormente a las más difíciles y terminar con otras también fáciles. - Las horas de ocio también son importantes, que no se olviden de ellas. Deben dormir una media de 8 a 10 horas, es fundamental para luego rendir bien. En los horarios o programas que construyamos debemos reflejar el tiempo que nos llevaría leer con detenimiento y entendiendo los contenidos que nos han dado ese día. A este tiempo de lectura también le sumamos, mas o menos, lo que nos lleva hacer los ejercicios que debemos resolver para cada día. Tenemos que reflexionar sobre cual es el tiempo real que esta tarea nos llevaría, sin pensar en hacerlo con gran velocidad para terminar pronto. Esta tarea tan simple nos ayudara a saber por donde andamos en cada asignatura y a irnos haciendo una idea de los temas que se van viendo en clase. Esto nos facilitara su posterior estudio. Colocar una postal bajo la línea que lee, tratando de ir aumentando progresivamente la rapidez de la lectura y leyendo cada línea con sólo tres o cuatro fijaciones, según sea su longitud. Como se puede ver, la velocidad va junto con la comprensión, que podemos trabajar con los conocidos análisis de textos pero no solo por escrito sino también oralmente. 3. LOS ESQUEMAS Y LOS CUADROS SINÓPTICOS. El esquema es una técnica que realmente tenemos muy olvidada pero que da mucho juego. No es una técnica sencilla ya que depende directamente de como se haya realizado el subrayado y la lectura. Un esquema debe presentar las ideas centrales del texto, destacadas con claridad. Presenta de forma sencilla y lógica la estructura del texto. Debe tener una presentación limpia y clara. En el esquema se destacan los puntos principales del texto y los subtemas que se consideren de interés. Se utilizan signos para destacar ideas, subrayado, las mayúsculas y minúsculas, colores y distintos tipos de letras. Estará escrito en términos concisos y cortos. Para trabajar el esquema partimos de la lectura analítica de un texto y de su posterior subrayado. Vamos separando cada contenido por puntos, rayas y subrayados. Vemos si lo que hemos escrito expresa la idea completa del texto sin dejarnos datos fundamentales. Podemos utilizar las mayúsculas para señalar los apartados fundamentales y las minúsculas para los elementos de importancia que hay en ellos. El esquema se escribe todo seguido y debe intentarse que ocupe el menos espacio posible. No existen nexos de unión de ideas sino, en ocasiones, flechas. No se deben escribir palabras sin contenido propio del texto que analizamos. El esquema es como un resumen pero más esquematizado, sencillo y claro. Con un solo golpe de visto podemos percatarnos de la información que contiene el texto estudiado. En síntesis: 66 Localizamos las ideas centrales del texto. Subrayamos las palabras o frases que destaquen esas ideas. Subrayar sobre todo las palabras clave. Anotar al margen la idea central del texto y de los distintos párrafos. Por otra parte el cuadro sinóptico es una variante del esquema que sobre todo se utilizará cuando existan datos muy concretos como fechas, nombres, cantidades y cuando un texto habla de los mismos elementos pero en distintas contextualizaciones. Su técnica es igual a la del esquema pero para su concreción se confecciona un cuadro con las entradas que sean necesarias. 4. CÓMO TOMAR APUNTES. Esta técnica es necesaria en la Universidad. Es evidente que para una buena toma de apuntes debemos estar atentos a la clase y con actitudes positivas tanto hacia el profesor como hacia lo que se expone. Para facilitar la toma de apuntes es conveniente que anteriormente se sepa el tema de clase. También es muy beneficioso el haber leído el tema dictado en la clase anterior. Posteriormente estos apuntes se pueden completar con los datos de otros compañeros y con el uso del libro de texto u otros. 5. CÓMO PREPARAR UN EXAMEN. Para preparar un examen correctamente es necesario conocer con claridad los contenidos que tienen que estudiar. A partir de aquí nos podemos ir haciéndonos una idea de como vamos a tener que estudiar: con gran memorización, con conexión de ideas, con todos los datos hasta los de menos importancia, etc. A partir de ahí es simplemente la puesta en práctica de todas las técnicas vistas hasta ahora: Una primera lectura rápida de lo que hay que estudiar. Segunda lectura lenta, analítica, con subrayado y notas a los márgenes. Confección de un resumen. Confección de un esquema o cuadro sinóptico. Repaso con lectura general por encima, lectura de lo subrayado, lectura del resumen y repaso final a las ideas del esquema. Si realmente conseguimos seguir este orden en todas sus fases, los resultados serán realmente buenos y las notas, sin duda alguna, también. 6. CÓMO HACER UN EXAMEN. Lo primero que tenemos que hacer por nuestra parte, es quitarle importancia y trascendencia al examen como algo imposible de lograr, o lo difícil que será. A partir de ahí es la hora de demostrar que todo nuestro trabajo ha servido de algo. Primero hay que tener en claro el tiempo que tenemos para el examen. 67 Hacer una primera lectura general de todas las preguntas. Leer detenidamente cada pregunta y tener en claro lo que se está preguntando. Comenzar contestando aquellas que saben sin extenderse demasiado, con la información que claramente se les pide. Después si les queda tiempo se las completan. Después seguir con las preguntas que creen que no saben, no dominen o desconozcan. Repasar las respuestas que han contestado antes de entregar el examen. 7. LA MEMORIA Y LAS REGLAS NEMOTÉCNICAS. Uno de los temas que más interés tiene en las Técnicas de Estudio, es La Memoria. Es evidente que en todo proceso de estudio la memoria es uno de los elementos fundamentales. Pero lo importante es entender a la memoria correctamente. "La memoria funciona como un gran archivo. Ubicar la información en el lugar correspondiente implica agilizar el proceso de selección y recuperación del material" Empezaremos diciendo que la memoria y el proceso memorístico está formado por lo que podríamos denominar tres fases: Registrar. Retener. Rememorar Nuestra memoria es como un gran armario o archivo en el que es evidente que encontraremos mejor las cosas si las tenemos ordenadas de una forma lógica. También está demostrado que recordaremos más y mejor aquello que comprendamos (por eso no es conveniente "estudiar" sin saber lo que "estudiamos"). Registrar: En esta fase adquirimos el contacto con los elementos que posteriormente memorizaremos. Sería la primera lectura. Para tener más claros estos conceptos que leemos usamos el subrayado, los esquemas, los resúmenes o fichas. Pero es fundamental que lo que leamos y escribamos lo hagamos de una forma ordenada, lógica y comprendiendo lo que se lee. No te pongas a estudiar un tema de matemáticas que se fundamenta en uno anterior que no lo conoces o no lo entiendes. Retener: Cuanta más atención prestemos a lo que intentemos memorizar, más fácil nos será retenerlo. Esta es una premisa básica dentro del proceso de la memorización: La Atención. Por esta razón el interés y la motivación ante lo que estamos leyendo y pretendemos memorizar es algo básico. Es fundamental la 68 concentración: aislaros de ruidos, olores, gente que pasa por la habitación, de la televisión e incluso en ciertas ocasiones de la música No es recomendable estudiar con música cuya letra conocemos, esto nos distraerá. Tampoco es bueno estudiar con la radio y por supuesto la televisión es nefasta. Si queres estudiar con música podes hacerlo pero con clásica o instrumental. Tampoco que sea Rock o Heavy, más bien Jazz, Blues, Regae, New Age, Folk, etc. Para retener las cosas, releer los textos solo con lo subrayado, releer las fichas o anotaciones y, por supuesto, releer los temas. Rememorar: Este es, para nosotros, el proceso más importante y el que a todos más les interesa. El recordar aquello que hemos memorizado. Para ello, la manera de haberlo retenido (ordenado, con lógica, con notas, subrayados, esquemas) va a ser fundamental y también el interés que hayamos puesto en ello. A veces intentamos recordar algo que sabemos claramente que lo hemos estudiado, pero como no lo hicimos de la manera correcta y con la lógica necesaria no es imposible rememorarlo. Como ven, la lógica, el orden, la intención es la base. Pero es que realmente son las piezas claves de la memoria. Dentro del tema de la memoria, tenemos la memoria a corto plazo y la memoria a largo plazo (esta segunda es la que a todos más nos interesa). En un principio cuando empezamos a estudiar, la información pasa a la memoria a corto plazo, pero lo que tenemos que pretender es "enviarla" a la memoria a largo plazo, que es la que subsiste y la que necesitamos a la hora de los exámenes o pruebas. Para que la información pase a la memoria a largo plazo es necesario la repetición, la concentración, el orden y la lógica y sobre todo el interés por esos contenidos que queremos memorizar. Lo que sí es evidente es que se recuerda mejor lo que previamente hemos escrito o que previamente hemos clasificado. Por esto insistimos tanto en lo del subrayado, los resúmenes, los esquemas y las fichas. Un tema de 30 páginas de historia se puede resumir en una ficha señalando en ella solo los apartados o puntos clave del tema y luego al mirar simplemente esa ficha, si ya lo hemos estudiado, la mente irá soltando todos los contenidos de esos apartados ella sola. Por esta razón, cuando en un examen nos pregunten sobre el reinado de Felipe II podremos recordar lo estudiado ya que nuestra mente ya tiene esa información procesada y memorizada y solo necesita el epígrafe de ese material para soltar toda la información. 7.1. LAS REGLAS NEMOTÉCNICAS O TRUCOS PARA RECORDAR: Las reglas nemotécnicas son un conjunto de trucos, casi siempre lingüísticos, para facilitar la memorización. Posiblemente habrán oído hablar de ellos. Se basan es que recordamos mejor aquello que conocemos o aquello que nosotros mismos hemos creado. Esto lo veremos mucho mejor con un ejemplo. La primera línea de la tabla periódica de los elementos químicos: Litio-Berilio-Boro-Carbono-Nitrógeno-Oxígeno-Fluor-Neón Si tenemos que memorizar esta serie, un buen método sería confeccionar una frase con la primera o primeras letras de cada uno de estos elementos: "La BBC no funciona". Esta podría ser una de las posibilidades para acordarnos de estos ocho elementos. Fijaros que he utilizado la L de Litio (La), la B de Berilio y Boro, la 69 C de Carbono (BBC), la N de Nitrógeno y la O de Oxígeno (no), la F de Fluor y la N de Neón (funciona). Esta es una posibilidad para este ejemplo concreto, pero seguro que podrán encontrar otros muchos no solo para esta serie sino para esas cosas que tienen que estudiar y no hay manera de memorizarlas y recordarlas. 8. ORGANIGRAMAS DE APRENDIZAJE CUADRO SINÓPTICO Un cuadro sinóptico es una forma de organizar gráficos ampliamente utilizados como recursos instruccionales y se definen como representaciones visuales que comunican la estructura lógica del material educativo.(Ambruster, 1994; Trowbride y Wandersee, 1998; West, Farmery Wolf, 1991). Son estrategias para organizar la información nueva a aprender, son de mucha utilidad cuando se trata de resumir en forma esquemática un gran contenido de conocimientos. El cuadro sinóptico proporciona una estructura global coherente de una temática y sus múltiples relaciones. Pueden utilizarse como estrategias de enseñanza tanto en la clase magistral como en los textos. Esta herramienta indica cómo se ordena un texto y sus elementos principales, permite visualizar una representación esquemática de la información, lo cual aclara su comprensión y facilita la percepción y el recuerdo de las relaciones entre las ideas. Los cuadros sinópticos pueden presentarse por medio de llaves y tomar forma de diagramas o pueden estar compuestos por filas y columnas a manera de tablas. Sugerencias para elaborar un cuadro sinóptico Antes de elaborar un mapa necesitan INFORMACIÓN No se deben incluir ideas propias, solamente los puntos principales en forma breve y concisa. Deben indicarse los conceptos centrales de manera ordenada y sistemática. Representar en forma esquemática las relaciones entre los conceptos centrales. Identificar los puntos principales del texto. Identificar los conceptos centrales del texto. Relacionar los conceptos centrales de manera que puedan ser organizados. Elaborar un esquema que contenga los conceptos centrales y sus relaciones. Ampliar las ideas principales con las ideas subordinadas a estos. Mapas Conceptuales ¿Qué es un mapa conceptual? Un mapa conceptual es un recurso esquemático para presentar un conjunto de significados conceptuales incluidos en una estructura de proposiciones. Los mapas conceptuales proporcionan un resumen esquemático de lo aprendido y ordenado de una manera jerárquica. El conocimiento está organizado y representado en todos los 70 niveles de abstracción, situando los más generales e inclusivos en la parte superior y los más específicos y menos inclusivos en la parte inferior. ¿Cuáles son los elementos fundamentales que lo componen? De acuerdo con la definición de Novak, el mapa conceptual contiene tres elementos fundamentales: Concepto: se entiende por concepto una regularidad en los acontecimientos o en los objetos que se designan mediante algún término. Los conceptos hacen referencia a acontecimientos que son cualquier cosa que sucede o puede provocarse y a objetos que son cualquier cosa que existe y se puede observar. Los conceptos son, según Novak, las imágenes mentales que provocan en nosotros las palabras o signos con los que expresamos regularidades. Proposición: consta de dos o más términos conceptuales (conceptos) unidos por palabras (palabras enlace) para formar una unidad semántica. Es la unidad semántica más pequeña que tiene valor de verdad, puesto que se afirma o niega algo de un concepto; va más allá de su denominación. Palabras enlace: Son las palabras que sirven para unir los conceptos y señalar el tipo de relación existente entre ambos. Por ejemplo, “es”; “de una”; “se distingue”; “por orden de”; “integrada por”; “son”; “de”; “en”; “se expresan con”, etc. ¿Cuáles son las características que deben reunir? Señalaremos tres características o condiciones propias de los mapas que los diferencian de otros recursos gráficos y de otras estrategias: Jerarquización: En los mapas conceptuales los conceptos están dispuestos por orden de importancia o de inclusividad. Los conceptos más inclusivos ocupan los lugares superiores de la estructura gráfica. Los ejemplos se sitúan en último lugar y no se enmarcan. En un mapa conceptual sólo aparece una vez el mismo concepto. En ocasiones, es conveniente terminar las líneas de enlace con una flecha para indicar el concepto derivado, cuando ambos están situados a la misma altura o en el caso de relaciones cruzadas. Selección: Los mapas constituyen una síntesis o resumen que contiene lo más importante o significativo de un mensaje, tema o texto. Previamente a la construcción del mapa hay que elegir los términos que hagan referencia a los conceptos en los que conviene centrar la atención. Como es obvio, si queremos recoger en un mapa un mensaje o texto muy extenso, quedarán excluidos muchos conceptos que podrían recogerse si nos centráramos en una parte de ese mensaje. Existen unas limitaciones de tipo material con las que hay que contar, además del destino o la utilidad que asignemos al mapa. Cuidaremos más la claridad si lo vamos a utilizar como recurso de apoyo en una exposición oral que cuando lo destinamos a nuestro uso particular. De cualquier forma es preferible realizar mapas con diversos niveles de generalidad. Uno presenta la panorámica global de una materia o tema y otros se centran en partes o subtemas más concretos. Impacto visual: Esta característica se apoya en la anterior. Se aconseja no dar por definitivo el primer mapa que hayamos trazado, sino tomarlo como borrador y repetirlo para mejorar su presentación. Algunas sugerencias para mejorar el impacto visual: se destacan más los términos conceptuales cuando los escribimos con letras mayúsculas y los enmarcamos con elipses. Esta figura es preferible al rectángulo para aumentar el contraste entre las letras y el fondo. 71 9. REGISTRO DE LOS RESULTADOS La forma de anotarlos resultados depende de la naturaleza de la investigación y de la imaginación del investigador. Aquí, sólo hay necesidad de señalar que todo detalle significante debe escribirse inmediatamente que se ha observado, con todas las características relevantes. El cuaderno de laboratorio ideal, ha de ser inteligible a otros que pudieran tener que continuar el trabajo sin terminar, y, además, inteligible a su autor 10 años después. Los diseños de un aparato han de recoger diversas fases de su construcción, así como su acabado, y cualquier serie de observaciones que muestren una relación funcional entre magnitudes que se han de representar gráficamente inmediatamente que se han hecho las medidas. Siguiendo esta regla, los hechos inesperados pueden confirmarse y hacer lecturas repetidas significantes. Cuando llega el momento de describir el trabajo completo, bien sea en forma de una tesis, de un informe o de un artículo para su publicación, el trabajo a realizar será el menor si de vez en cuando, durante el curso de la investigación, el investigador hubiese redactado anticipadamente párrafos o secciones. Suponiendo que se tiene práctica, posiblemente se necesita mucha, tales redacciones previas tienden a captar un aspecto reciente y próximo que vale la pena reservar para la presentación final. Muchos no tienen el don de escribir bien, pero la mayoría pueden mejorarse mediante imitación cuidadosa, prestando mucha atención en la lectura del vocabulario, la puntuación y la distribución. No despreciar la gramática, y usar regularmente un diccionario-para los significados no para el deletreo-. Un buen lenguaje no sólo para este fin, sino en toda ocasión, consiste en un lenguaje que sea claro y breve, deje al lector fuera de dudas en cuanto al significado y que sea sufucientemente variado en la forma para evitar aburrirlo o irritarlo. Volviendo a la presentación, lo primero que se viene a la cabeza es el gran número de los que comienzan a redactar el trabajo sin haber examinado previamente otro análogo al que están intentando hacer. Existen tres cosas que un lector desea casi siempre conocer: por qué y cómo se hizo el trabajo y, si se obtuvieron, cuáles fueron los resultados y qué conclusiones se sacaron de ellos. El estudio de cualquiera que sea la cuestión a describir ha de hacerse en tres secciones. El que la “introducción” y “conclusión” se pongan al principio o la última cierre el trabajo, es cuestión indiferente; pero cualquier camino que se adopte, el autor debe llevar al lector a un conocimiento de lo que ha descubierto. El “supense” está fuera de lugar en una comunicación científica. Se han de reseñar brevemente todas las condiciones importantes de los experimentos; no sólo aquellas de inmediata relación con el trabajo, sino otras que puedan servir, posiblemente, para ramificaciones posteriores de dicho trabajo. Así, no es necesario para el fin que tratamos registrar una temperatura particular o el volumen de una vasija que aparece constante a través de una serie de experimentos, pero la experiencia ha demostrado que la omisión de sólo estos dos factores particulares ha restado utilidad a ciertos trabajos que hubieran sido muy útiles de haberlos incluido. 9.1. REDACCIÓN DE INFORMES 72 Es habitual que se solicite a los alumnos la elaboración de informes que reflejan lo sucedido durante un trabajo experimental. La redacción de informes en Química puede comprometer: a)Sólo el completamiento de espacios en blanco, cuadros, tablas, gráficos, etc. En este caso, la secuencia de desarrollo del informe está pautada por la Cátedra quien determina la forma y el orden en que se registrarán los resultados. En ámbitos distintos a los académicos suele utilizarse un informe impreso-estándar- que recibe el nombre de protocolo de análisis. b)La elaboración misma del informe con su desarrollo incluido. En este caso, es el alumno quien propone y decide en qué orden informará acerca de los resultados y cuáles de ellos en cantidad y calidad serán considerados. La Cátedra orienta a fin de lograr que sean tenidos en cuenta aquellos que sean relevantes. ¿En qué consisten los informes? El informe consiste en una redacción, escrita en tercera persona (“se desarrolla”, “se considera”, etc.) en lenguaje informativo, que comunica algo ocurrido con la mayor objetividad y con los detalles considerados significativos pero sintéticamente expresados. En Química el informe puede estar referido a la verificación del cumplimiento de leyes, a la producción de reacciones químicas en general, a la manifestación de fenómenos físicos diversos, al reconocimiento de propiedades, etc. Por lo general, y según la función que cumplen, los informes pueden ordenarse en dos grandes grupos: a) Informe descriptivo: es aquel que se limita a describir hechos o narrar sucesos o procesos. En esta clase de informes hay que abstenerse de hacer comentarios, interpretaciones o juicios de valor: contienen solamente hechos. En realidad este tipo de informe, tal cual está planteado, no es demasiado útil para registrar sucesos químicos, ya que la mera descripción de la medida no alcanza para entender el significado de las experiencias. b) Informe interpretativo: es aquel que, además de exponer los hechos o las situaciones, contiene una explicación hipotética de los mismos, una interpretación o una valoración de lo ocurrido. En estos informes es fundamental la claridad con que se distinguen los hechos de las interpretaciones. Ejemplos: a) Supongamos que se desea averiguar de qué manera influye la temperatura sobre la solubilidad de una sal. 1- Si el informe sólo registra los procedimientos de la experiencia (“se realizó...”, “se calentó...”, “se midió...”, etc.) y lo sucedido al cabo de los mismos, estamos frente a una descripción de lo ocurrido en la experiencia. 73 2- Si el informe además considera, el análisis de los datos obtenidos llegándose hasta la elaboración de conclusiones que permiten contrastar las hipótesis previamente supuestas: “al comparar los datos obtenidos e interpretar la relación entre los parámetros considerados se puede inferir que la solubilidad de la sal considerada aumenta con el aumento de temperatura...”, estamos frente a un informe interpretativo. El lenguaje de un informe debe ser: Simple Objetivo Directo Preciso Gramaticalmente correcto. ¿Qué factores tener en cuenta al planear y preparar un informe? Presentación: trabajo realizado de manera pulcra y legible. Organización: coherencia general de la composición, que se refleja en una presentación lógica y efectiva del material. Originalidad: expresión, que se refleja en la eficaz exposición de las ideas propias y en la seguridad del planteamiento. Variedad: amplitud de contenido, que se releja en el apoyo de fuentes bibliográficas de referencia. Mecánica: uso correcto del idioma, que se refleja en la ausencia de errores de gramática (ortografía, puntuación y uso de mayúsculas). Formato: adoptar una forma correcta de organizar y presentar el trabajo, que se refleja en los esquemas adoptados para estructurar el contenido del informe. ¿Cuál es la estructura formal del informe? El escrito final debe tener una unidad de conjunto, es decir un principio, un medio, un fin, en otras palabras debe componerse de: a) Introducción: Planteo claro y simple del problema y las razones que motivaron el estudio del mismo. Ej. “El objetivo de este trabajo fue averiguar como influyen los cambios de concentración en la velocidad de una reacción química” En esta primera parte también se deben considerar las limitaciones que se presentaron, la definición de términos importantes y la metodología utilizada en el desarrollo de la experiencia. b) Desarrollo: En este apartado se describen las evidencias desde los procedimientos utilizados. Es la parte principal del trabajo y por consiguiente debe hacerse de manera lógica. Es la sustancia del argumento y la preparación para la formulación de hipótesis. En este momento puede apelarse al uso de tablas, cuadros, gráficos, preguntas, etc. que ayuden a ver mejor el despliegue de los sucesos relacionados con el problema que se aborda. 74 El desarrollo incluye dentro de sí distintos momentos que para los informes en Química son esenciales: -Un momento destinado a conjugar “lo que sucede u observa” -Un momento destinado a recoger esos datos, producto fundamentalmente de la observación y experimentación, y agruparlos de manera sistemática. -Un momento destinado a representar los datos obtenidos con alternativas que permitan visualizar mejor las relaciones entre ellos. Según la experiencia que deba realizarse serán los momentos a los que se apele. No todos implican necesariamente usar todas las etapas antes mencionadas. c)Final: Es la etapa que requiere establecer relación entre los datos, hechos y observaciones realizadas de manera tal de arribar a una o más generalizaciones. Es el momento que permite pasar de un informe descriptivo a un informe de tipo interpretativo. 10. ACTIVIDADES ACTIVIDAD Nº 1: ORGANIGRAMAS DE APRENDIZAJE 1- Realiza, con tu grupo de trabajo, un cuadro sinóptico para cada lectura. 2- Uno de los cuadros sinópticos deberá ser realizado, también, en un papel afiche, para exponerlo al finalizar la clase. 3- Realiza, con tu grupo de trabajo, un mapa conceptual para cada lectura analizada. 4- Uno de los mapas conceptuales deberá ser realizado, también, en un papel afiche, para exponerlo al finalizar la clase. El Amplio Mundo de la Química. CIENCIA FÁCIL Serie de artículos de divulgación sobre temas básicos de la ciencia – “La Química es una Ciencia Exacta que estudia aquellos fenómenos que modifican la naturaleza íntima de la materia. Cuando estos fenómenos ocurren, la sustancia deja de ser lo que era antes de que tuviesen lugar, por lo que decimos que se transformó”. (6/12/06 - Agencia CyTA-Instituto Leloir. Por María Cristina Chaler) El científico en general, y en especial el químico, tiene una mirada muy distinta a la del hombre común, ya que observa con su interés puesto en el micro mundo de la materia. Cuando estudia un sistema material, enfoca el proceder de las moléculas, por lo tanto, lo ve muy distinto de como se presenta, se cuestiona sus propiedades y busca las explicaciones de su comportamiento. 75 El brillo, para el químico, es movimiento de electrones; el color es la devolución por parte de las moléculas de una energía perteneciente a la luz que no absorben; la fragilidad tiene que ver con el rechazo de cargas eléctricas en la estructura de la sustancia; los estados son producto de las fuerzas intermoleculares; y la materia no es más que electricidad condensada y abundante espacio vació, de modo que se presenta ante nuestros ojos con una apariencia contundente, que no es tal. La realidad, para un químico, se muestra de otra manera que para el hombre común. El químico necesita profundos conocimientos, que le aportan las Matemáticas y la Física, pues el mundo es físico-químico, y las teorías en que se apoyan los descubrimientos se rigen por leyes matemáticas. Luego de estudiar y observar profundamente lo que lo rodea, el químico se anima a modificarlo, para lo que desarrolla metodologías a fin de sintetizar sustancias que le serán útiles al hombre y le proveerán confort y progreso. La petroquímica, por ejemplo, fue una de las ramas de la química que hacen gozar a la humanidad de beneficios y confort sin los cuales ya no podría vivir. Si observamos lo que nos rodea, donde coloquemos la vista encontraremos el trabajo de un químico: las pinturas, los revestimientos, los plásticos, el papel, las tinturas, los vidrios, los cristales, el cuero sintético, la fotografía, la tecnología de alimentos, los medicamentos, las investigaciones criminológicas, la descontaminación del medio ambiente, los análisis clínicos, los fertilizantes para el agro, las investigaciones arqueológicas, el genoma… y podríamos nombrar muchísimas aplicaciones más en donde interviene el campo de la química. Las Ciencias Químicas se dividen en dos grandes ramas: Química Inorgánica y Química Orgánica. La primera estudia todo lo referente al reino mineral, mientras que la segunda es la química de la materia viva y sus productos derivados, por ejemplo, el petróleo. Dentro de ambos grupos tenemos las ramas de las Químicas Analíticas, que se dedican a investigar sistemas y descubrir qué tipos de sustancias los componen y en qué cantidad. La investigación de los fenómenos esta a cargo de la Físico Química, que estudia los por qué de todo lo que ocurre químicamente en la materia e incluso las distintas teorías atómicas, la mecánica cuántica, la velocidad de las reacciones y cómo influyen determinadas sustancias como aceleradores o retardadores de algunas de ellas. Explica todo ello con engorrosos cálculos matemáticos que confirman los resultados experimentales. Aquí encontramos el punto de contacto entre la Física y la Química. La tecnología y el análisis de los alimentos son estudiados por una rama de la química llamada Bromatología. Lo referente a la industria lo estudia la Química Industrial, que se ocupa de profundizar fenómenos que ocurren en los procesos industriales, como la destilación, evaporaciones, formación de cristales, transmisiones de calor, mezclas y resistencia 76 química de los materiales. En el nivel de la Medicina, la Química se transforma en Bioquímica o Química Biológica, que estudia las complejas reacciones de los organismos vivos. Los avances de los últimos años confirmaron que las enfermedades comienzan en las biomoléculas y tienen una íntima relación con la Química Biológica. La célula es un pequeño pero complejísimo laboratorio que tiene que funcionar muy bien para que gocemos del estado de salud. Conociendo profundamente la Química Biológica, podemos diagnosticar en forma más precisa muchas enfermedades y también llegar rápidamente a su cura. Todos estos estudios ampliados y profundizados con conocimientos de Física y Matemáticas hacen del científico químico un especialista con gran capacidad para encarar la solución de problemas que necesitan de una profunda investigación. La ciencia pura investiga, y la tecnología debe encontrar aplicación a los descubrimientos que ésta realiza, con el único fin de promover el bien y el confort de la humanidad. Todo esto despierta un gran debate ético, en el que no vamos a profundizar, ya que la Ciencia y la Tecnología poseen en sí una finalidad extremadamente positiva, que sólo el hombre corrupto desvirtúa y pervierte. El hombre es un ser conflictivo, que no siempre se encamina por los senderos correctos. ¿Cuáles son los caminos correctos? • Aquellos que nos benefician manteniendo nuestra integridad como personas y no superponiéndose a los derechos de otros. • Son los que responden a valores universales, para vivir en armonía con uno mismo, con quienes nos rodean y sobre todo con el Universo. • Son los que no alteran el sutil equilibrio de la naturaleza. • Son los que respetan al ser y sobretodo a la naturaleza. • Son los que nos permiten vivir y dejar vivir. El estudio de las Ciencias Puras tiene por objetivo la apropiación del saber enfocado hacia los fenómenos de la Naturaleza y del Universo. En algún punto las Ciencias se encuentran con la Filosofía 77 AGENCIA DE NOTICIAS CIENTÍFICAS Y TECNOLÓGICAS CYTA - INSTITUTO LELOIR SISTEMAS MATERIALES La observación de nuestro mundo circundante nos muestra una realidad compleja e intrincada. Pensemos solamente en lo que se encuentra en nuestra aula: personas, aire, pizarrón, tizas, bancos, sillas, escritorio, paredes, ventanas, vidrios, puerta, etcétera. Y si ampliamos nuestra consideración fuera del edificio escolar, veremos plantas, más personas, automóviles, edificios, animales, etc., etc., o sea, que la complejidad se incrementa rápidamente. Es evidente que resulta imposible estudiar en forma simultánea todo lo que nos rodea. Necesitamos aislar de modo real o imaginario un conjunto de objetos, o uno de ellos o una fracción para su estudio detenido y minucioso. Así, analizamos el agua de un vaso, un lápiz, un borrador, un cubito de hielo, la sal de mesa, el aceite, el aire, el alcohol, un trozo de granito, una porción de arena, un pedazo de madera... Cada una de estas porciones del Universo presenta una organización más o menos intrincada, pero siempre compleja, y constituyen diferentes sistemas. Por otra parte, ya sea que se encuentren en estado sólido, líquido o gaseoso, dichas fracciones se caracterizan por ocupar un lugar en el espacio y por estar dotadas de masa, es decir, por estar compuestas de materia. Esto determina que las porciones mencionadas, cuando son sometidas a un estudio experimental, reciban la denominación de sistemas materiales. Entonces, podemos definir: Sistema Material: es toda porción del Universo dotada de masa que se aísla en forma real o imaginaria para su estudio experimental. El estudio de los sistemas materiales es fundamental en Química. ¿Cuáles son las sustancias y los elementos químicos que constituyen dichos sistemas materiales, cómo interactúan entre sí, cuáles son sus propiedades, qué transformaciones e intercambios de masa y energía se producen en ellos?, son cuestionamientos esenciales en Química. El químico, para encontrar respuestas a los diversos interrogantes que se le plantean, realiza experimentos, descubre leyes, elabora teorías, propone modelos..., que lo llevan a crear un lenguaje propio. En consecuencia, podemos establecer que: Química es la disciplina científica que se ocupa de investigar la composición de los sistemas materiales y los cambios que se producen en ellos. ¿Cómo se clasifican los sistemas materiales? Las propiedades de las sustancias se pueden clasificar en propiedades extensivas e intensivas. Estas últimas son aquellas que no dependen de la masa de que se dispone, como por ejemplo el punto de fusión, el punto de ebullición, la densidad, etcétera. 78 Sistemas homogéneos Entre los sistemas materiales podemos observar en muchos de ellos que las propiedades intensivas son iguales en todas sus partes, como es el caso del agua destilada. Cualquier fracción de ella que se considere tiene el mismo punto de fusión, densidad, índice de refracción, etcétera. Estos sistemas se denominan sistemas homogéneos y se caracterizan por estar constituidos por una sola fase. Además del agua destilada, podemos señalar como ejemplos al azúcar, aceite, sal de mesa, agua de mar filtrada, nafta, agua azucarada, etcétera, es decir, las distintas soluciones y sustancias puras que existen en la Naturaleza. Fase: Es toda porción homogénea de un sistema material. Sistema heterogéneo Por el contrario, hay otros sistemas como agua con aceite, granito (roca formada por cuarzo, mica y feldespato), en que las propiedades intensivas son diferentes según la porción que se examine. Estos sistemas se llaman heterogéneos y están formados por lo menos por dos fases. La superficie de separación entre las fases (interfase) es evidente y bien definida. Los sistemas heterogéneos están constituidos por sistemas homogéneos agrupados, pues cada fase, si es separada de las demás, forma un sistema homogéneo. Sistemas inhomogéneos Además, hay otra clase de sistemas materiales, menos frecuentes, en los cuales las interfases son imprecisas y no están bien determinadas. Así, si colocamos en el fondo de una probeta llena de agua un trozo de remolacha o cristales de sulfato de cobre y lo dejamos en reposo varias horas, veremos la formación de zonas de diferente intensidad de color sin interfases definidas. Estos sistemas se denominan inhomogéneos. Un ejemplo típico es la atmósfera terrestre, cuya concentración disminuye gradualmente a medida que se asciende en ella (a 10km de altura queda menos del 5% de aire). Por lo tanto, las propiedades intensivas, como la densidad, varían continuamente según la altitud a la cual se determine. Separación de las fases de un sistema heterogéneos Las fases que forman un sistema heterogéneo se pueden separar unas de otras utilizando procedimientos adecuados a cada caso: • Cuando el sistema está formado por una fase líquida y otra sólida, como agua y arena, se lo deja cierto tiempo en reposo para que sedimente la arena y luego se separa el agua, trasvasándola con cuidado a otro recipiente o succionándola con pipeta o sifón. En el caso de que se trate de dos líquidos no miscibles o inmiscibles, como agua y aceite, se utiliza una ampolla de decantación. Se coloca el sistema dentro de la ampolla y se lo deja en reposo hasta que se separen los líquidos (el agua ocupa la parte inferior, por ser más densa). Luego, al abrirla llave se deja salir el agua, debiendo cerrarse el paso cuando está por pasar el aceite. Esta operación que permite separar sistemas sólido-líquido o líquido-líquido de diferente densidad, se denomina decantación. 79 • Algunos sistemas están formados por una fase líquida en cuyo interior hay partículas sólidas en suspensión, como por ejemplo el agua turbia de un charco. En este caso se puede proceder de dos modos distintos: a) Se hace pasar el sistema líquido-sólido a través de una superficie porosa, llamada filtro, generalmente colocada dentro de un embudo. Las partículas sólidas son retenidas por el filtro porque tienen un diámetro mayor que los poros. Como filtro es muy utilizado un papel poroso, denominado papel de filtro, aunque también se utilizan arena, algodón, polvo de carbón, telas especiales, lana de vidrio, porcelana, amianto, etcétera. Este procedimiento se llama filtración. b) En otras ocasiones, primero se precipitan las partículas sólidas y luego se hace una decantación. Para acelerar la sedimentación de dichas partículas se las somete a la acción de la fuerza centrífuga: el sistema se coloca en tubos cónicos que giran a gran velocidad dentro de aparatos llamados centrífugas, lo cual determina que las partículas, por ser más densas, precipiten, ocupando el fondo de dichos recipientes. Este procedimiento recibe el nombre de centrifugación. Una vez lograda la separación de las fases, se realiza la decantación del líquido. • En el caso de sistemas cuyas fases son sólidas, se opera de diferentes modos, según las características que presenten: a) Cuando una de las fases se encuentra dividida en trozos de tamaños diferentes, éstos se pueden separar tomándolos con una pinza. Es el caso de extraer trozos de mármol mezclados en arena. Este método es denominado tría. b) Si las partículas que forman cada fase sólida tienen diferente tamaño, se coloca el sistema material sobre una malla de metal o plástico (tamiz), se sacude y entonces las partículas de menor diámetro atraviesan la malla, mientras que las de mayor tamaño quedan retenidas. El procedimiento se llama tamización y como ejemplo se puede señalar la separación del canto rodado, de la arena. c) Cuando los sólidos tienen diferente densidad, tal como una mezcla de arena y corcho, se agrega un líquido que tenga una densidad intermedia con respecto a ellos, como el agua. El corcho flota y la arena se deposita en el fondo. Este método se denomina flotación. d) En el caso de que una de las fases sea soluble en un determinado solvente y la otra no, como ocurre en la mezcla de arena y sal, se agrega agua, se agita para asegurarla disolución de la sal, y se procede a filtrar, separando la arena del agua salada. Este procedimiento se denomina disolución. Luego, por evaporación se separa la sal del agua. e) Si los sólidos tienen diferente densidad, como la arena y el oro, se hace circular una corriente de agua que arrastra la mezcla a través de canales; entonces, las pepitas metálicas (más densas) sedimentan, mientras que la arena se mantiene en suspensión. Esta forma de 80 separación de fases recibe el nombre de levigación. f) Cuando uno de los sólidos está compuesto por hierro, se puede separar de la mezcla acercándole un imán. Este método se llama separación magnética. Así, en el proceso de fabricación de la harina, una de las operaciones previas consiste en apartar de los granos de trigo pequeños trozos metálicos (clavos, alambres, etc.), haciéndolos pasar por un campo magnético. Además de estos procedimientos para la separación de las fases de un sistema heterogéneo, existen muchos otros que no describiremos por razones de tiempo. En un sistema heterogéneo, cada una de las fases que lo integran, después de ser separadas constituyen sistemas homogéneos. Fraccionamiento de un sistema homogéneo Entre los sistemas homogéneos debemos diferenciar aquellos que están constituidos por una sustancia pura (agua destilada, cloruro de sodio), de otros que están formados por dos o más sustancias (agua salada) y que se denominan soluciones. En éstas últimas es posible separar las sustancias que las componen, es decir, proceder al fraccionamiento del sistema homogéneo. Para fraccionar una solución es necesario escoger el método más apropiado para cada caso: a) Cuando el sistema está formado por una sustancia sólida disuelta en otra líquida, como el agua salada, para separar el agua de la sal, se realiza una destilación simple. Para ello se usa un aparato constituido por un balón con tubo de desprendimiento, un termómetro, un refrigerante y un recipiente colector. En el balón se coloca el agua salada y luego se calienta hasta la ebullición. Los vapores de agua que se forman ascienden y salen por el tubo de desprendimiento. Al chocar con la superficie fría del refrigerante se condensan, cayendo gota a gota como agua líquida en el recipiente colector. Como la sal no se vaporiza queda retenida en el balón, y de ese modo se separa el agua de la sal. b) En ciertas ocasiones, como para separar los pigmentos de una solución coloreada, se utiliza la técnica denominada cromatografía. Este método admite diferentes variantes, siendo una de las más usadas la cromatografía de partición sobre papel. Consiste en una tira de papel de filtro suspendida en un recipiente, cuya extremidad inferior está sumergida en un solvente orgánico (éter de petróleo, butanol, etanol, etc.) La muestra a analizar se deposita sobre el papel próxima al solvente. Este asciende por capilaridad y arrastra las sustancias que forman la muestra, las cuales van alcanzando distintas alturas de acuerdo con su masa molecular, afinidad con el solvente, etcétera. De ese modo se logra la separación de los diferentes componentes de una solución. c) En el caso de que los componentes de un sistema sean solubles en un mismo solvente a la 81 temperatura de ebullición, pero uno de ellos es insoluble o poco soluble en frío, se procede a realizar una cristalización fraccionada, la cual consiste en disolver el sistema en el solvente hirviendo y luego, se deja enfriar. De esta forma el componente menos soluble se cristaliza y sus cristales se separan por filtración. Las técnicas que permiten separar los componentes de una solución, como la destilación, la cromatografía y la cristalización fraccionada, reciben la denominación de métodos de fraccionamiento. Soluciones y sustancias puras De acuerdo con lo que se ha expresado, si se aplica un método de fraccionamiento adecuado a una solución, se obtienen porciones o fracciones que tienen propiedades intensivas distintas entre sí y con relación a dicha solución. Cada una de esas fracciones corresponde a una sustancia diferente. Entonces se puede afirmar que: Soluciones es todo sistema homogéneo fraccionable. En cambio, si se trata de fraccionar una sustancia pura, no hay posibilidades de hacerlo. Todas las porciones que se obtienen presentan las mismas propiedades intensivas. Por lo tanto: Sustancia pura es todo sistema homogéneo no fraccionable. Cuando en un recipiente se encuentra una sustancia pura, todas las moléculas tienen la misma composición. Así, una muestra de agua es pura si todas las moléculas que la forman están constituidas por dos átomos de hidrógeno y uno de oxígeno. Por el contrario, si además de moléculas de agua hay otras compuestas por un átomo de cloro y otro de sodio (cloruro de sodio) el agua no es pura, pues contiene sal y entonces es agua salada. Por lo tanto: Una sustancia es pura cuando todas las moléculas que la constituyen son iguales. En el caso de tener varias sustancias diferentes mezcladas entre sí, hay tantas clases de moléculas como sustancias constituyen la mezcla. En razón de que las moléculas no son visibles, se plantea un problema: ¿Cómo se puede comprobar si una sustancia es pura o no? Experimentalmente se ha comprobado que ciertas propiedades intensivas, como el punto de ebullición, el punto de fusión, la densidad, etcétera, tienen valores constantes para cada sustancia pura. Así, en el caso del agua su punto de fusión es de O º C y el de ebullición de 100 °C (a la presión normal), la densidad es de 1 g/ml a los 4 °C de temperatura; mientras que el alcohol etílico (etanol) tiene un P.F. de -114 º C, P.E. de 78,4 º C y una densidad de 0,79 g/ml a 82 20 º C de temperatura. Sobre la base de estos datos se deduce que determinando esas propiedades, también llamadas constantes físicas, se puede verificar si la sustancia es pura o no. Clasificación de las sustancias puras Al examinar las sustancias puras podemos distinguir dos clases: a) aquellas que se pueden descomponer en otras más simples, como el agua que origina hidrógeno y oxígeno, o el dióxido de carbono que se descompone en carbono y oxígeno. Estas sustancias reciben la denominación de sustancias compuestas. b) Otras, como el oxígeno, el hidrógeno, el hierro, no se pueden descomponer y se las llama sustancias simples. El análisis de la composición de las moléculas de las sustancias compuestas muestra que están formadas por átomos de dos o más especies. Molécula de agua compuesta por un átomo de oxígeno y dos de hidrógeno. H 2O Molécula de dióxido de carbono constituida por un átomo de carbono y dos de oxígeno. CO2 En cambio, el examen de las moléculas que forman a las sustancias simples revela que están constituidas por átomos de la misma especie. Veamos a modo de ejemplo: Molécula de hidrógeno formada por dos átomos de hidrógeno: H-H Molécula de oxígeno constituida por dos átomos de oxígeno: O=O Molécula de helio compuesta por un solo átomo de helio: He ACTIVIDAD Nº 2: DE FIJACIÓN 1- La propuesta ahora es realizar una revisión de la técnica de mapa conceptual. Para ello te entrego un resumen, para aliviar el camino, con el que deberás realizar, con tu grupo de trabajo, un mapa conceptual. El trabajo deberá realizarse también en un papel afiche para su posterior exposición. 83 Coloides Los coloides son mezclas intermedias entre las soluciones y las suspensiones. Las partículas en los coloides son más grandes que las moléculas que forman las soluciones. Para clasificar una sustancia como coloidal, las dimensiones de las partículas del soluto están comprendidas entre 10 y 100 nm (1 nanómetro = 1x10-9 m) mientras que las moléculas en solución están entre 0.1 y 10 nm. Diferencias entre soluciones, coloides y suspensiones Solución Tamaño de las partículas:0.1 nm Coloide Tamaño de las partículas Una fase presente l0 y lOO nm Dos fases presentes Homogénea No se separa al reposar En el límite No se separa al reposar Transparente Intermedia Suspensión Mayores de 100 nm Dos fases presentes Heterogénea Se separa al reposar No transparente Partes de un coloide Los coloides están compuestos de dos partes: 1. La fase dispersa o partículas dispersas: esta fase corresponde al soluto en las soluciones, y está constituida por moléculas sencillas o moléculas gigantes como el almidón. Pueden actuar como partículas independientes o agruparse para formar estructuras mayores y bien organizadas. 2. La fase de la dispersión o medio dispersante: es la sustancia en la cual las partículas coloidales están distribuidas. Esta fase corresponde al solvente en las soluciones. La leche es un coloide: la grasa constituye las partículas dispersas y el agua es el medio dispersante. Tipos de coloides Según el estado físico en que se encuentren la tase dispersa y el medio dispersante, los coloides toman diferentes nombres: Clases de Coloides Medio Dispersante Sustancia Dispersa Ejemplo 84 Soles, geles Emulsiones líquido líquido sólido líquido Espumas líquido gas Aerosoles líquidos Aerosoles sólidos Espumas sólidas Emulsiones sólidas Sol sólido gas gas sólido sólido sólido líquido sólido gas líquido sólido pintura, gelatina leche, mayonesa, cremas. espuma de jabón, crema batida. neblina, nubes humo. caucho queso, mantequilla algunas aleaciones. Los coloides según la afinidad entre la fase dispersa y la dispersante Los coloides se clasifican según la afinidad al medio dispersante en: a) Liofóbicos o liófobos: si las partículas dispersas tienen poca afinidad por el medio dispersante. Estos coloides son poco estables y muy difíciles de reconstituir Ejemplo: el aceite suspendido en el agua. Este tipo de coloides corresponden a una dispersión de una fase en otra de distinto tipo químico. b) Liofílicos: si las partículas tienen fuerte afinidad al medio de suspensión. Estos coloides son fáciles de reconstituir si el sistema coloidal es roto. Ejemplo: el jabón disperso en agua, gelatina en agua, caucho en benceno. Formación de partículas coloidales Para la formación de coloides se emplean los siguientes métodos: 1. Dispersión: consiste en reducir de tamaño pedazos grandes de materia el batido y la agitación se emplean para formar emulsiones y espumas como la mayonesa y la nata batida. El almidón, la cola, la gelatina, se disgregan espontáneamente en partículas coloidales cuando se colocan en el agua. Calentando y agitando se acelera el proceso. 2. Condensación: la formación de la niebla y las nubes son los mejores ejemplos de condensación. También, la formación de sustancias insolubles a partir de soluciones, la formación del negro de humo que es la forma coloidal del carbón y se emplea para fabricar la tinta de imprenta y la tinta china. Importancia de los coloides 1. Todos los tejidos vivos son coloidales. 2. El suelo en parte está constituido de una materia coloidal. 3. Muchos de los alimentos que ingerimos son coloides: el queso, la mantequilla, las sopas claras, las jaleas, la mayonesa, la nata batida, la leche. 85 En la industria, los cauchos, los plásticos, las pinturas, las lacas y los barnices son coloides. En la fabricación de las cerámicas, los plásticos, los textiles, el papel, las películas fotográficas, las tintas, los cementos, las gomas, los cueros, lubricantes, jabones, insecticidas agrícolas, detergentes y en proceso como blanqueo, purificación y flotación de minerales, dependen de la absorción en la superficie de materia coloidal. ACTIVIDAD N° 3: REDACCION DE INFORMES. Realiza un informe descriptivo de las experiencias, un informe para cada experiencia, realizadas en el Módulo de Química. 86