Quimica General I: Teoria y Laboratorio
Anuncio

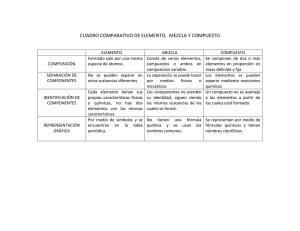
PONTIFICIA UNIVERSIDAD CATÓLICA DEL ECUADOR ESCUELA DE CIENCIAS QUIMICAS 1. DATOS INFORMATIVOS MATERIA CÓDIGO CARRERA NIVEL No. CREDITOS: CRÉDITOS TEORÍA SEMESTRE/ AÑO ACADÉMICO: CRÉDITOS DE PRÁCTICA PROFESOR Química General I 12793 Ciencias Químicas, Mención Química Analítica I 5 3 Primero 2009-2010 2 Gladys Acurio R., Pregrado: Lcda. Ciencias de la Educación Especialización Química. Posgrado: Magister en Docencia Universitaria e Investigación Área de Docencia: Bioquímica; Análisis orgánico, Química Orgánica, Química General. Horario de atención: Viernes de 10h00-12 h00 Oficina: 303 de Ed. Ciencias Químicas Teléfono: 2291700 Ext. 1278 e-mail: gacurio@puce.edu 2.DESCRIPCION DE LA MATRIA Este curso está dirigido a estudiantes del primer nivel de la Carrera de Química Analítica y pretende proporcionar las bases de Química General que ayude a entender y comprender los fundamentos de Química General .Los tópicos a desarrollarse son: Estructuras atómica y molecular de la materia.- Sistema de unidades.-Distribución electrónica.Propiedades de la tabla periódica.-Enlaces Químicos.- Representación de moléculas según Lewis.-Fórmulas.- Nomenclatura.- Ecuaciones Químicas.- Tipos de Ecuaciones.-Resolución de problemas 3. OBJETIVO GENERAL Proporcionar a los estudiantes los fundamentos de Química General tanto teóricos como prácticos 4. OBJETIVOS ESPECÍFICOS 4.1. Aprender los principios y conceptos fundamentales de la Química General. 4.2. Comprender las transformaciones químicas que se produce en la sustancias Inorgánicas presentes en el organismo vivo 4.3. Aplicar las propiedades de la tabla periódica en el estudio de elementos químicos por grupos . 4.4. Realizar la distribución electrónica por niveles, subniveles y orbitales atómicos 4.5. Relacionar la distribución electrónica con la ubicación de los elementos de la tabla periódica 4.6. Describir los modelos del enlace químico y asociarlos con las características y propiedades de los compuestos inorgánicos 4.7. Aprender a representar la estructura de moléculas y compuestos inorgánicas, según la estructura de Lewis 4.8. Aprender la utilización adecuada del lenguaje químico como: símbolos, fórmulas y Ecuaciones químicas. 4.9. Representar las diferentes reacciones químicas mediante ecuaciones y reconocer los Diferentes sistemas de igualación 4.10 Afirmar los conocimientos teóricos con experimentos seleccionados para este nivel 5.-CONTENIDOS Capítulo 1: Materia y energía - Propiedades de la materia - Clasificación de la materia - Energía - Propiedades de las sustancias - Separación de mezclas. Capítulo 2: Medidas químicas - Sistema internacional de unidades - Unidades de medidas importantes - Unidades de conversión - Ejercicios de aplicación Capítulo 3: Elementos, átomos, iones - Estructura de los átomos - Masas relativas de los átomos - Isótopos - Mol - Número de Avogadro - Estructura de ión Capítulo 4: Moléculas y moles - Tipos de fórmulas - Peso atómico y molecular - Calculo de la composición porcentual a partir de fórmulas - Determinación de la fórmula empírica - Determinación de la fórmula molecular Capítulo 5: El sistema periódico y propiedades - Desarrollo de la tabla periódica - Energía de ionización - Afinad electrónica - Bases para el ordenamiento periódico - Relaciones periódicas - Propiedades por familias o grupos - Utilidad del tabla periódica Capítulo 6 :Estructura electrónica de los átomos - Teoría cuántica - El espectro atómico de hidrógeno y el modelo de Bohr - El átomo mecánico cuántico - Números cuánticos - Niveles de energía-orbitales - Distribución de electrones en los átomo Capítulo 7: Enlaces Químicos - Enlace iónico o electrovalente - Enlace covalente - Polaridad de enlace y electronegatividad - Símbolos de Lewis y la regla del octeto - Estructuras de resonancia - Fuerzas de los enlaces covalente - Números de oxidación Capítulo 8: Nomenclatura y formulación Química - Compuestos binarios - Compuestos ternarios - Aniones y cationes - Sales - Complejos Capítulo 9: Escritura y balanceo de Ecuaciones Químicas - Cómo Escribir las ecuaciones? - Tipos de ecuaciones - Métodos para balancear ecuaciones - Ejercicios de aplicación - Contenido de Laboratorio - Experimento1 Entrega y limpieza de material Experimento 2 Uso del Mechero: Aplicaciones Experimento 3 Uso de Balanza: Aplicaciones Experimento 4 Material Volumétrico: manejo y calibración Experimento 5 Separación y purificación por métodos físicos Experimento 6 Agua destilada y Aguas Duras Experimento 7 Determinación de la fórmula Empírica Experimento 8 Obtención de oxígeno: propiedades Experimento 9 Obtención de Cloro, CO, CO2 Experimento 10 Obtención de Nitrógeno y amoníaco Experimento 11 Aguas de cristalización, eflorescencia y delicuescencia Experimento 12 Reacciones Químicas: Tipos y manifestaciones Experimento 13 Espectros de elementos ala llama Experimento 14 Preparación de pigmentos con sales inorgánicas Programa de Teoría y Laboratorio por semanas Contenido de Teoría Contenido de Laboratorio Agosto Unidad 1 Práctica 1 17-21 Materia y energía Entrega y limpieza de material Indicaciones Generales Agosto Unidad 2 Práctica 2 24-28- Medidas químicas Uso del Mechero: Trabajo en Sistema internacional de unidades vidrio .Elementos al calor y compuestos la calor Agosto- Unidad 3 Práctica 3 Septiembre Elementos, átomos, iones Uso 31-4 Estructura de los átomos Determinación de densidad de Balanza: de sólidos , líquidos y gases Septiembre Unidad 4 Práctica 4 7-11 Moléculas y moles Material Volumétrico: Tipos de fórmulas calibración y uso Septiembre Unidad 5 Práctica 5 14-18 El sistema periódico y propiedades Separación y purificación por Primera parte métodos físicos Septiembre Unidad 6 Práctica 6 21-25 El sistema periódico y propiedades Agua destilada y Aguas Duras evaluación Segunda parte Septiembre 28-2 Evaluación Unidad 1-6 y prácticas 1-6 escrita de teoría y laboratorio Octubre Unidad 7 Práctica 7 5-9 Estructura Electrónica de los Determinación de la Fórmula átomos parte 1 Empírica Unidad 8 Práctica 8 Octubre 12-16 Octubre 19-23 Estructura Electrónica,parte dos Unidad 9 Obtención de oxígeno propiedades Práctica 9 Enlaces Químicos ,parte 1 Obtención de cloro, monóxido de carbono, y dióxido de carbono Octubre Unidad 10 Práctica 10 26-30 Enlaces Químicos, parte 2 Obtención de nitrógeno y amoniaco: propiedades Noviembre Unidad 11 2-6 Nomenclatura Práctica 11 y formulación Aguas de cristalización, química ,parte 1 eflorescencia y delicuescencia Noviembre 9-13 Segunda Unidades 7-11 y prácticas de 7-11 evaluación escrita de teoría y laboratorio Noviembre 16-20 Unidad 12 Nomenclatura Práctica 12 y formulación química, parte dos Noviembre 23-27 Noviembre- Unidad 13 Escritura y Balanceo de ecuaciones , primera parte Reacciones químicas: tipos y manifestaciones Práctica 13 Espectros de los elementos a la llama Unidades 12-13 y prácticas 12-13 Tercera Diciembre Preparación de e pigmentos Evaluación 30-4 con sales inorgánicas. escrita de teoría y laboratorio Diciembre 7-11 Escritura y balanceo ecuaciones ,segunda parte de Entrega de canceles Examen final de laboratorio Diciembre 14-18 Examen final de teoría Examen final acumulativo de teoría 6.- METODOLOGIA El aprendizaje de la materia de Química General se circunscribe a exposición, trabajo grupal , ejercicios de cálculo apoyado por deberes, lecciones y consultas e investigación Entre los recursos didácticos que se usarán tenemos: a. Texto apoyo “Química de MASTERTON b. Tabla periódica c. Diagramas, esquemas, talleres. d. Recortes de lectura seleccionados Asignatura: QUÍMICA GENERAL I TEORÍA Y LABORATORIO ORGANIZACIÓN DOCENTE SEMANAL ACTIVIDADES DE INTERACCIÓN DOCENTE - ESTUDIANTES TRABAJO AUTÓNOMO DEL ESTUDIANTE (HORAS PRESENCIALES) (HORAS NO PRESENCIALES) SEMANA (1 - 17) N° de horas de clases teóricas N° de horas de clases prácticas, N° de horas de laboratorios, tutorías talleres especializadas EVALUACIONES ACTIVIDADES (Descripción) N° de horas TEMAS A TRATAR (N° del tema, unidad, o capítulo descritos en Contenidos) T. Materia y energía L. instrucciones generales y limpieza de material 1° semana 3 4 2 2° semana 3 4 2 Deber, consulta, elaboración de informe Resolución de problemas. elaboración de informe 2 2 T. Sistema internacional de unidades L. Uso del mechero.-aplicaciones 3° semana 3 4 2 Lectura de artículo, elaboración de informe 4° semana 3 4 2 Manejo de la T. Periódica y .- consulta ,elaboración de informe 2 5° semana 3 4 2 Escribir las propiedades de los elementos y elaboración de informe 2 T. Estructura atómica.- átomos y iones . L. Uso de la Balanza : determinación de densidades T. Moléculas. Moles, tipos de fórmula L. Calibración y uso de material volumétrico T. Sistema periódica y propiedades .parte uno L. Separación de mezclas 2 Primera prueba de teoría y laboratorio. Unidades 1.2.3.4,5 6° semana 3 4 8° semana 3 4 2 Deberes, glosario, e informe 2 Revisión y corrección pruebas T. Distribución electrónica de elementos de principales L. determinación de la fórmula empírica 9° semana 3 4 2 Dibujar moléculas con estructura de Lewis. Elaboración de informe 2 T. Enlace iónico L. Obtención de Oxígeno y propiedades 2 Dibujar moléculas con estructura de Lewis. Elaboración de informe 2 T. Enlace covalente L. Obtención de Cloro , monóxido de carbono y dióxido de carbono 2 Ejercicios de nomenclatura y elaboración de informe 2 T. Nomenclatura y Formulación compuestos binarios L. Obtención de nitrógeno y amoníaco 2 T. Nomenclatura y formulación de compuestos terciarios. L.T tipos de reaccione s químicas sus manifestaciones. 10° semana 11° semana 12° semana 13° semana 14° 3 3 4 4 3 4 3 4 3 4 2 Ejercicios de nomenclatura y elaboración de informe 2 2 Consulta deberes e informe 2 Segunda prueba de teoría y laboratorio Revisión y corrección de la prueba semana 15° semana 16° semana 17º semana 3 4 3 4 3 EXÁMENES 4 Tercera prueba de teoría y laboratorio 2 2 Investigación de temas Cuestionario, 2 2 Examen final de laboratorio T, Escritura y balanceo de ecuaciones parte uno L. Preparación de pigmentos con sales inorgánicas Revisión y corrección de las pruebas Espectros a la llama Presentación de temas de investigación Resolución de cuestionario y entrega de canceles 7.- EVALUACION 7.1 Cronograma de Evaluaciones Primera: Septiembre 28-2 Segunda: Noviembre: 9-13 Tercera: Diciembre1-4 Examen final Laboratorio: Diciembre 7-11. Examen final de teoría: Diciembre 14-18 7.2 Sistema de Calificaciones Nota parcial de Teoría /6 1. Evaluaciones escritas por unidades 4 puntos 2. Actividades de clase, deberes, cuestionarios 1 punto 3. Exposiciones y resolución de problemas 1 punto Examen final 12 18+12 = 30 Nota parcial de Laboratorio/4 1. Informes 1 punto 2.-Evaluaciones escritas y prácticas 2 puntos 3.- Trabajo de laboratorio 1 punto Examen final 8 puntos 12+8=20 7.3 Fecha de Entrega en secretaría Nota 1 La semana 5-9 de octubre Nota 2 La semana 16-20 Noviembre Nota 3 La semana 7-11 Diciembre 8.-BIBLIOGRAFÍA Textos de referencia 1. Brown, T., Lemay, H. y Bursten, B., Química: la Ciencia Central, Prentice hall, México, 1998 2. Chang, R., Química, Editorial Mc Graw-Hill, cuarta edición, México, 1992. 3. Hein, Morrins., Química, Iberoamericana, 1992 4. Mastertorn, Slowinsky, Química General Superior, Interamericana, México, 1985 5. Zumdahl, Stern, S., Fundamentos de Química, McGraw0Hill, México, 1993 6. Whitten, Gailey y Davis. Fundamentos de Química, Editorial Mc Graw Hill. Quinta edición, México. 1998. Textos recomendados MORTIMER, Química Grupo Editorial Iberoamericana PETRUCCI, R. y HARWOOD, W. "Química General. Principios y Aplicaciones Modernas”. Editorial Prentice Hall. Madrid, 1999. Elaborado por: Lcda. Gladys Acurio e-mail: gacurio@puce.edu.ec Atención a estudiantes Viernes 10h00—12h00. Quito a 23 de Abril del 2009