O H+ + OH
Anuncio

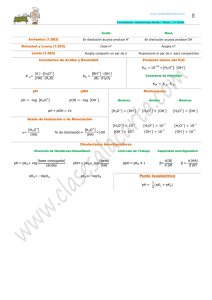
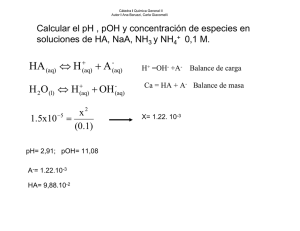
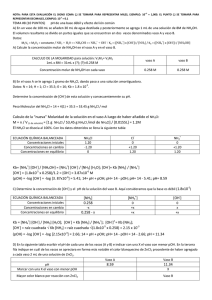
EQUILIBRIO QUÍMICO ÁCIDO - BASE TEMARIO 1) Química Analítica. Análisis Químico Cualitativo y Análisis Químico Cuantitativo 2) Importancia de la Química Analítica en la carrera de Agronomía 3) Equilibrio Químico: Equilibrio Ácido - Base 4) Ionización del agua 5) Función “p” Sorensen. Escala de pH. 6) Ionización de ácidos y bases fuertes y débiles 7) Acidez total, actual y potencial ¿QUE ES LA QUÍMICA ANALÍTICA? ¿Y EL ANÁLISIS QUÍMICO? SEMEJANZAS Y DIFERENCIAS A.Q.CUALITATIVO Y CUANTITATIVO A. Q. CUALITATIVO A. Q. CUANTITATIVO a) Hacen uso de las mismas propiedades físicas o químicas SEMEJANZAS b) Requieren de las mismas operaciones preliminares a) Naturaleza de la muestra b) Resultados se expresan DIFERENCIAS en palabras o símbolos c) Tolera pérdidas parciales a) Cantidad en la muestra b) Resultados se expresan en cifras y unidades c) No tolera pérdidas ¿CUÁL ES SU IMPORTANCIA EN LA CARRERA DE AGRONOMÍA? Mercados Producto Fresco Exportación Productos humanos Suelo Cultivos Deficiencias Contaminación Agua Industria C. Química Nutricional Toxicología Estabilidad Producto Animal Insumos Desechos Plaguicidas Fertilizantes Aire Agua Suelo Desarrollo Rural Granjas Dietas Cosechas Animales Domésticos EQUILIBRIO QUÍMICO: EQUILIBRIO ÁCIDO-BASE Equilibrio Ácido-Base Química Analítica Reacciones químicas reversibles Equilibrio Químico V1 = V2 a A + b B V1 V2 c C + d D Equilibrio Ácido-Base Ley de Acción de las Masas V1 = K1 [A]a [B]b V2 = K2 [C]c [D]d ; si V1 = V2 , entonces: K1 [A]a [B]b = K2 [C]c [D]d K1 K2 = [C]c [D]d [A]a [B]b ; si K1 / K2 Keq = [C]c [D]d [A]a [B]b Ley del Equilibrio Químico Equilibrio Ácido-Base ¿QUÉ ES UN ELECTROLITO? Equilibrio Ácido-Base Fuertes HCl H+ + Cl- NaOH ELECTROLITOS KCl Na+ + OHK+ + Cl- Débiles CH3COOH NH4OH CH3COO- + H+ NH4+ + OH- Equilibrio Ácido-Base CONCEPTO ÁCIDO – BASE BRONSTED Y LOWRY Ácido Donador de protones Ácido Base Base conjugada + H+ Aceptor de protones Base + H+ Ácido conjugado Concepto Par Ácido-Base Conjugado Reacción de Neutralización Ácido + Base Base conj. + Ácido conj. Equilibrio Ácido-Base Ej: HNO2 + ácido NH3 base + H 2O NO2- base base conj. H2O ácido NH4+ ácido conj. + + H 3O ácido conj. + OHbase conj. Sustancias que se comportan como ácidos o bases Sustancias anfipróticas IONIZACIÓN DEL AGUA Ionización del agua H 2O + H 2O Keq = + H 2O H+ H 3O + [H2O] Keq [H2O] = [H+][OH-] 1 x 10-14 = [H+][OH-] OH- OH- [H+][OH-] Kw = [H+][OH-] + Keq (25ºC) = 1,8 x 10-16 [H2O] (25ºC)= 55,5 M Ionización del agua H 2O + H 2O Keq = + H 2O H+ H 3O + [H2O] Keq [H2O] = [H+][OH-] 1 x 10-14 = [H+][OH-] OH- OH- [H+][OH-] Kw = [H+][OH-] + Keq (25ºC) = 1,8 x 10-16 [H2O] (25ºC)= 55,5 M Determinar [H+] y [OH-] Ionización del agua Kw = [H+][OH-] Kw = x Kw = x2 . x = √ Kw x = √ 1 x 10-14 x = [H+] = [OH-] = = 1 x 10-7 M 1 x 10-7 M Sol. neutras [H+] > [OH-]; [H+] > 1 x 10-7 M Sol. ácidas [H+] < [OH-]; [H+] < 1 x 10-7 M Sol. básicas DETERMINACIÓN DEL pH DE ÁCIDOS Y BASES FUERTES Y DÉBILES Cálculo de pH Función “p” de Sorensen función p = - log [iones] pH = - log [H+] pOH = - log [OH-] Si Kw = [H+] [OH-], al aplicar log log 1x 10-14 = log [H+] + log [OH-] -14 = log [H+] + log [OH-] (-1) 14 = - log [H+] - log [OH-] 14 = pH + pOH Escala de pH Cálculo de pH Escala de pH [H+] [OH-] pH pOH 1x100 1x10-14 0 14 1x10-1 1x10-13 1 13 1x10-2 1x10-12 2 12 1x10-7 1x10-7 7 . . . 7 . . . 1x10-13 1x10-1 13 1 1x10-14 1x100 14 0 . . . . . . . . . . . . . . . Sol. ácidas . . . Sol. neutras Sol. básicas Cálculo de pH Ácidos y Bases Fuertes Ca Ej: HCl H+ Ca + ClCa pH = -log [H+] pH = -log Ca Cb Ej: NaOH Na+ + OHCb pOH = -log [OH-] pOH = -log Cb pH = 14 - pOH Cb Cálculo de pH Ácidos y Bases Débiles Ca Ej: CH3COOH CH3COO- Ca - x Ka = x [CH3COO-] [H+] [CH3COOH] x2 = Ka . Ca pH = -log [H+] + = x.x Ca - x H+ x = x 2 Ca x = [H+] = √ Ka . Ca Cálculo de pH Ácidos y Bases Débiles Cb Ej: Kb = NH4OH NH4+ Cb - x x [NH4+] [OH-] [NH4OH] x2 = Kb . Cb pOH = -log [OH-] pH = 14 - pOH = + OHx x.x Cb - x = x 2 Cb x = [OH-] = √ Kb . Cb ACIDEZ TOTAL, ACTUAL Y POTENCIAL Acidez total, actual y potencial Acidez Total ó Titulable: Concentración de iones H+ que puede originar el ácido Acidez Actual ó Activa: Concentración de iones H+ presentes en solución (ionizados) Acidez Potencial: Concentración de iones H+ unidos covalentemente al ácido, una vez ocurrida la ionización Acidez total, actual y potencial Ej: HNO3 0,1 M Ca HNO3 ACIDO HNO3 H++NO3 Ca ACIDEZ TOTAL AT=Ca AT=0,1M C6H5COOH AT=Ca AT=0,1M Ca C6H5COOH 0,1 M; Ka = 6,3 x 10-5 Ca C6H5COOH C6H5COO- + H+ Ca-x x x ACIDEZ ACTUAL ACIDEZ POTENCIAL AA =[H+] AA=x=0,1M AP=AT-AA AP=0M AA=[H+]=x x=√ Ka.Ca x=√ 6,28x10-5 x 0,1 x=√ 6,28x10-6 x=2,5x10-3 M AP=AT – AA AP=0,1–2,5x10-3 AP=0,0975~0,1M ¿QUÉ SON SOLUCIONES REGULADORAS? Soluciones reguladoras COMPOSICIÓN a) Acido débil + Sal proveniente del ácido base conjugada Ej.: C6H5COOH + C6H5COONa Par ácido-base conjugado b) Base débil + Sal proveniente de la base ácido conjugado Ión común Ej.: NH4OH + NH4Cl Soluciones reguladoras PREPARACIÓN a) Mezcla directa de los componentes Una base débil y la sal de la misma base Un ácido débil y la sal del mismo ácido b) Neutralización parcial del electrolito débil BD + AF → Sal + H2O Ej.: NH4OH + HCL → NH4Cl + H2O Siempre que el reactivo en exceso sea la base débil AD + BF → Sal + H2O Ej.: CH3COOH + KOH → CH3COOK + H2O Siempre que el reactivo en exceso sea el ácido débil Soluciones reguladoras CÁLCULO DEL pH a) Acido débil + Sal Ej: HClO / NaOCl Ca HClO H+ + ClO- Ca - x x Cs NaOCl 0 x Na+ + ClOCs Ka = [H+] [ClO-] [HClO] x = [H+] = Ka . Ca Cs [H+] = x [ClO-] = Cs + x [HClO] = Ca - x Cs Ka = x . (Cs + x) = x . Cs (Ca – x) Ca pH = -log [H+] Soluciones reguladoras CÁLCULO DEL pH b) Base débil + Sal Ej: NH4OH / NH4Cl Cb NH4OH NH4+ + OH- Cb - x Cs NH4Cl 0 x x NH4+ + ClCs [NH4+] = Cs + x [OH-] = x [NH4OH] = Cb - x Cs Kb = [NH4+] [OH-] [NH4OH] Kb = (Cs + x) . x = Cs . x (Cb – x) Cb x = [OH-] = Kb . Cb Cs pOH = -log [OH-] pH = 14 - pOH Soluciones reguladoras ACCIÓN REGULADORA Se presenta cuando el sistema regulador trata de mantener el pH, cuando es sometido a variaciones como: • Adición de un ácido fuerte • Adición de una base fuerte • Dilución: en general el pH no cambia con la dilución. Soluciones reguladoras ACCIÓN REGULADORA a) Adición de un ácido fuerte HCl Cb NH4OH Cb - x Cs NH4Cl 0 NH4OH + HCl < NH4+ + OHx x NH4+ + Cl- [NH4+] = Cs [OH-] = x [NH4OH] = Cb Cs Cs NH4Cl + H2O > x = [OH-] = Kb . (Cb – a) (Cs + a) > pOH = -log [OH-] < pH = 14 - pOH Soluciones reguladoras ACCIÓN REGULADORA a) Adición de una base fuerte KOH Cb NH4OH Cb - x Cs NH4Cl 0 NH4Cl + KOH < NH4+ + OHx x NH4+ + Cl- [NH4+] = Cs [OH-] = x [NH4OH] = Cb Cs Cs NH4OH + KCl > x = [OH-] = Kb . (Cb + b) (Cs - b) < pOH = -log [OH-] > pH = 14 - pOH Soluciones reguladoras CAPACIDAD REGULADORA La máxima capacidad reguladora se logra cuando: Ca = Cs Ca = 1 Cs [H+] = Ka . Ca ; Cs [OH-] = Kb . Cb ; Cs ó Cb = 1 Cs [H+] = Ka ; pH = pKa [OH-] = Kb ; pOH = pKb Soluciones reguladoras CAPACIDAD REGULADORA pH = pKa – log Ca Cs Ecuación HendersonHasselbach La Capacidad Reguladora depende de: • Características del ácido y la base débil • Concentraciones de los componentes • Relación entre concentraciones del ácido y su sal, o de la base y su sal ¿CUÁL ES LA IMPORTANCIA DE ESTAS SOLUCIONES EN EL SISTEMA PRODUCTIVO AGRÍCOLA??