1 TEMA 7 REACCIONES REDOX Hay una familia muy amplia de
Anuncio

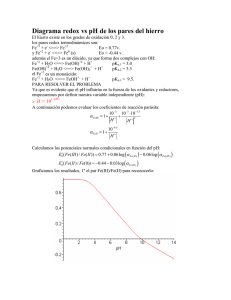
1 TEMA 7 REACCIONES REDOX Hay una familia muy amplia de reacciones que se producen con la pérdida formal de electrones y su ganancia por otro átomo. Como la ganancia de electrones recibe el nombre de reducción y la perdida de electrones es una oxidación, el proceso global se denomina reacción redox. 1.- Reglas del número de oxidación El número de oxidación también es llamado estado de oxidación. Los números de oxidación son valores teóricos utilizados para simplificar la asignación de electrones. Se utilizan estos valores para los elementos comunes sobre la base de un conjunto de reglas: 1. El número de oxidación, Nox, de un átomo como un elemento es cero 2. El número de oxidación de un ión monoatómico es el mismo que la carga de su ión. 3. La suma algebraica de los números de oxidación en un compuesto poliatómico neutro es cero; en un ión poliatómico, es igual a su carga. 4. En combinación de elementos, el elemento más electronegativo tiene su característico número de oxidación negativo (por ejemplo, -3 para el nitrógeno, -2 para el oxígeno, -1 para el cloruro) y el elemento más electropositivo tiene un número de oxidación positivo. 5. El hidrógeno tiene habitualmente el número de oxidación +1 (excepto con elementos más electropositivos, donde es –1). Por ejemplo, para calcular el número de oxidación del S en al ácido sulfúrico, H2SO4, se utiliza la regla 3: 2[Nox(H)] + [Nox(S)] + 4[Nox(O)] = 0 Dado que habitualmente el oxígeno tiene el número de oxidación –2 (regla 4) y el hidrógeno +1 (regla 5), tenemos: 2(+1) + [Nox(S)] + 4(-2) = 0 por tanto, [Nox(S)]= +6 Deduzcamos el número de oxidación del yodo en el ICl4-. Para ello utilizamos la regla 3: [Nox(I)] + 4[Nox(Cl)] = -1 2 El cloro es más electronegativo que el iodo, por tanto el cloro tendrá un número de oxidación de –1 (regla 4). Asi: [Nox(I)] + 4(-1) = -1 por tanto, [Nox(I)] = +3 2.- Potenciales de reducción 2.1.- Semirreacciones redox Es conveniente considerar que una reacción redox es la suma de dos semirreacciones. En una semirrrreaccion de reducción una sustancia gana electrones, como sucede en: 2H+(aq) + 2 e H2(g) En una semirreacción de oxidación una sustancia pierde electrones como en: Zn(s) Zn2+(aq) + 2 e La separación de las semireacciones no corresponde a una separación física real de los dos procesos. La especie oxidada y reducida de una reacción redox forman un par redox. El par se escribe colacando primero la especie oxidada y a continuación la reducida, como en H+/H2 y Zn2+/Zn, y es corriente no mostrar las fases. 2.2.- Potenciales normales estándar de reducción y serie electroquímica Para calcular los E0 se construyen pilas con dos pares redox uno de los cuales es el H+/H2, al que arbitrariamente se le asigna el valor E0(H+/H2)= 0. Se trata entonces de calcular el E0 del par Zn2+/Zn. Para ello se escriben las semirreacciones redox y se tiene en cuenta que ∆G= -nFE: 3 1 Zn2+ + 2e Zn E0(Zn2+/Zn)= ? ∆G0(Zn2+/Zn)= -nFE0 E0(H+/H2)= 0 ∆G0(H+/H2)= 0 2 H2 - 2e 2H+ _________________________________________________________ 1+2 Zn2+ + H2 Zn + 2 H+ ∆G0r= ∆G0(Zn2+/Zn) + ∆G0(H+/H2) = ∆G0(Zn2+/Zn)= + 142 KJ/mol Se trata de una reacción no espontanea ya que ∆G0 > 0 , para la cual E0(Zn2+/Zn) = ∆G0/nF. Por tanto, el criterio de espontaneidad de una reacción redox es E0 > 0, lo cual determina que ∆G0 < 0. Construyendo pilas en las que: - Un par redox es el H+/H2 con E0= 0 - Otro par redox cualquiera con E0 ≠ 0. Se pueden calcular los E0 de otros pares redox y formar así la serie electroquímica. En la serie electroquímica los pares redox se ordenan según E0 decreciente. De tal manera que cada par oxida al siguiente situado por debajo de él. 2.3.- Ecuación de Nernst Esta ecuación permite calcular los potenciales redox cuando las concentraciones de las sustancias son distintas de 1 M. Teniendo en cuenta la siguiente reacción general: 4 a OxA - bRedB a’ RedA + b’ OxB Se define el cociente de acción de masas Q como: Q= (|Red A|a’ |OxB|b’)/(|OxA|a |RedB|b) Teniendo en cuenta que la variación de la energía libre de Gibss en condiciones no estandar es: ∆G= ∆G0 + RT Ln Q y que ∆G= -nFE , se tiene que: -nFE= -nFE0 + RT LnQ y por tanto E= E0 - (RT/nF) Ln Q que escrita en logaritmos decimales queda: E = E0 -(0.059/n) log Q En el equilibrio E= 0 y por tanto E0= (RT/nF) Ln Keq 2.4.- Factores cinéticos de las reacciones redox: sobrepotencial Para que una reacción redox sea posible desde el punto de vista termodinámico tiene que cumplirse que E> 0. Sin embargo, esta condición no es suficiente para que la reacción transcurra a velocidad apreciable, y por tanto, se produzca desde un punto de vista práctico. Para que esto ocurra es necesario comunicar un potencial adicional de ≈ 0.6 volt., y asi la reacción transcurra a velocidad apreciable. 2.5.- Efecto de la formación de complejos o de la precipitación en los potenciales de reducción Mn+/M En condiciones estándar, los iones Ag+ se reducen a Ag pero si la concentración de Ag+ baja, la aplicación de la ecuación de Nernst muestra que el potencial de reducción se hace menos positivo (es decir, ∆G es menos negativa). Como consecuencia, la reducción de Ag+ a Ag se hace menos fácil. En otras palabras, Ag+ se ha estabilizado con respecto a la reducción. En la práctica, una concentración de iones Ag+ más baja puede lograse diluyendo la disolución acuosa, pero también se puede ocasionar eliminando iones Ag+ de la disolución mediante la formación de un complejo estable o por precipitación de una sal moderadamente soluble. Ag+ (aq) + e Ag(s) AgCl(s) + e Ag(s) + Cl- E0= 0.80 V E0= 0.22 V o bien, para el catión Co3+, Co3+(aq) + e Co2+(aq) [Co(NH3)6]3+(aq) + e [Co(NH3)6]2+ (aq) E0= 1.92 V E0= 0.11 V 5 3.- Extracción de los elementos 3.1.- Elementos que se extraen por reducción: diagrama de Ellingham aplicado a la reducción de óxidos metálicos. En los diagramas de Ellingham se representa la ∆G para una reacción de reducción de oxidos metálicos en función de la temperatura a la que se realiza la reacción. Sea la reacción general: MO(s) + C(s) M(s ó l) + CO(g) Esta reacción completa contiene a otras dos: 1 M(s) + 1/2O2(g) MO(s) ∆S0(M/MO)? ∆S<0 porque se pasa de tener ½ mol gaseoso a no tener ninguno. Por tanto, teniendo en cuenta que ∆G= ∆H- T∆S se tendra en una representación de ∆G frente a T una linea recta de pendiente positiva. 2 C(s) + ½ O2(g) CO(g) ∆S0(C/CO)? ∆S > 0 porque se pasa de tener ½ mol gaseoso a tener 1 mol gaseoso. Por tanto la representación de ∆G frente a T será una línea recta de pendiente negativa. La reacción global que se obtiene sumando –1 y 2 es la siguiente: MO(s) + C(s) M(s) + CO(g) Para esta reacción ∆G0r= ∆G0(C/CO) – ∆G0(M/MO) 6 De la representación gráfica de ∆G frente a T se tiene que a temperaturas para las que la línea ∆G(C/CO) se encuentre por debajo de la línea del óxido metálico, ∆G(M/MO), es decir a la derecha del punto de corte de las dos líneas rectas, la reducción del óxido por el carbono es espontánea porque se cumple que ∆G0r= ∆G0 (C/CO) – ∆G0(M/MO) < 0. 3.2.- Elementos que se extraen por oxidación Los halogenos son elementos que se extraen por oxidación. La energía libre de Gibbs para la reacción de oxidación de iones Cl- en agua es de ∆G0= 422 KJ/mol. 2 Cl- (aq) + 2 H2O (l) 2 OH- (aq) + H2 (g) + Cl2 (g) como ∆G0 es muy positiva debe emplearse la electrolisis, lográndose ésta con un potencial de unos 2.2 voltios. El F2 se prepara por electrolisis de una mezcla anhidra de fluoruro de potasio y fluoruro de hidrógeno que funde por encima de 72 °C. Los halógenos mas fácilmente oxidables, Br2 y I2, se obtienen por oxidación química de los haluros acuosos con cloro. 4.-Estabilidad redox en agua 4.1.- Reacciones con el agua El agua puede actuar como agente oxidante, cuando actúa de esta forma, se reduce a H2. Puede actuar también como agente reductor, oxidándose entonces a O2. Las sustancias que pueden subsistir en agua tienen potenciales de reducción que se encuentran entre los dos límites definidos por estos dos procesos. 4.1.1.- Oxidación por el agua La reacción de los metales con el agua o con los ácidos acuosos es, realmente, la oxidación del metal por el agua o los iones hidrógeno, porque la reacción global es uno de los procesos siguientes M(s) + H2O(l) M+(aq) + ½ H2(g) + OH- (aq) M(s) + H+(aq) M+(aq) + ½ H2(g) Estas reacciones son termodinámicamente favorables cuando M es un metal del bloque “s” distinto del berilio o un metal de la primera serie “d”, desde el grupo 4 hasta al menos el grupo 7 (Ti, V, Cr, Mn). Aunque las reacciones del magnesio y el aluminio con el aire húmedo son espontáneas, los dos metales pueden utilizarse durante años en presencia de agua y oxígeno. No son atacados por ellos porque se pasivan, es decir, quedan protegidos frente a la reacción por una película impermeable de óxido. Los óxidos de magnesio y aluminio forman una capa protectora que recubre la superficie de sus metales 7 respectivos. Este fenómeno de pasivado se presenta también en el hierro, cobre y cinc. 4.1.2.- Reducción por el agua El agua puede actuar como reductora mediante la semirreacción 2H2O(l) 4H+(aq) + O2(g) + 4e Esta semirreacción de oxidación es la contraria de la de reducción O2(g) + 4H+(aq) + 4e 2H2O(l) E0= +1.23 V Este potencial de reducción muy positivo muestra que el agua acidificada es un agente reductor débil, excepto frente a agentes oxidantes enérgicos. Un ejemplo de este último caso es el Co3+(aq), para el que E0(Co3+/Co2+)= +1.82 V. Es reducido por el agua con desprendimiento de O2 4Co3+(aq) + 2H2O(l) 4Co2+(aq) + O2(g) + 4H+(aq) E0= +0.59 V Este valor de E0 es muy próximo al sobrepotencial necesario para que la velocidad de reacción sea significativa. Como se forman iones H+ en la reacción, el cambio de las condiciones ácidas a neutras o básicas favorece la oxidación, puesto que una disminución de la concentración de iones H+ favorece la formación de los productos. Sólo unos pocos agentes oxidantes (Ag2+es un ejemplo de ello) pueden oxidar al agua con suficiente rapidez para que sea apreciable la velocidad de desprendimiento de O2. Hay potenciales mayores que +1.23 V para varios pares redox de los utilizados normalmente en disolución acuosa, como Ce4+/Ce3+ (+1.72 V), el par Cr2O72-/Cr3+ en medio ácido (+1.38 V) y el par MnO4-/Mn2+ en medio ácido (+1.51 V). La dificultad de la reacción reside en el hecho de tener que tranferir cuatro electrones para formar un enlace doble O=O. Dado que las velocidades de las reacciones redox suelen estar controladas por la lentitud a la que se puede formar un enlace doble O=O, es un reto para el químico imorgánico encontrar buenos catalizadores para el desprendimiento de O2. Se han realizado ciertos progresos mediante la utilización de complejos de rutenio. 4.1.3.- Campo de estabilidad del agua Un agente reductor que pueda reducir el agua a H2 rápidamente, o un agente oxidante que la pueda oxidar a O2 rápidamente, no puede sobrevivir en disolución acuosa. El campo de estabilidad del agua es el intervalo de valores del potencial de reducción y del pH para el que el agua es termodinámicamente estable a la oxidación y reducción. 8 Los límites superior e inferior del campo de estabilidad se identifican hallando la dependencia de E con el pH para las semirreacciones específicas de oxidación y reducción. La semirreacción de oxidación para el par O2, H+/H2O es O2(g) + 4H+(aq) + 4e 2H2O(aq) ; n=4 ; Q= 1/pO2[H+]4 Donde pO2 es la presión parcial de oxígeno. Se deduce que E= E0 - (RT/nF)Ln(pO2[H+]4) Para una presión de oxígeno de 1 bar, a 25 °C E= 1.23 – 0.059 x pH en voltios Esta expresión define el límite superior del campo de estabilidad. Así, cualquier especie con un potencial de reducción más alto que este valor puede ser reducida por el agua, con liberación de O2. La reducción de H+(aq) a H2 se produce mediante la semirreacción: 2H+(aq) + 2e H2(g) ; n= 2 ; Q= pH2/[H+]2 por lo que E= E0 – (RT/nF)Ln(pH2/[H+]2) 9 Si la presión parcial de hidrógeno es, aproximadamente, 1 bar y la temperatura 25 °C entonces: E= -0.059 x pH en voltios Esta expresión define el límite inferior del campo de estabilidad. Así, cualquier especie con un potencial de reducción más bajo que este valor puede reducir H+(aq) a H2. Los pares que son termodinámicamente estables en agua se encuentran entre los límites definidos por las líneas inclinadas. Un par que esté fuera del campo es inestable. El campo de estabilidad del agua “natural” se completa mediante dos línea verticales adicionales a pH= 4 y pH= 9, que marcan los límites de pH que se encuentran comúnmente en los lagos y corrientes acuosas. 4.2.- Desproporción Como E0(Cu+/Cu)= +0.52 V y E0(Cu2+/Cu+)= +0.16 V, y ambos potenciales se encuentran dentro del campo de estabilidad del agua, los iones Cu+ no oxidarán ni reducirán al agua. A pesar de ello, el Cu(I) no es estable en disolución acuosa, porque puede sufrir desproporción, o sea, una reacción en la que el número de oxidación del elemento aumenta y disminuye simultáneamente. Dicho con otras palabras, el elemento que sufre desproporción sirve de oxidante y reductor de él mismo 2Cu+(aq) Cu2+(aq) + Cu(s) Esta reacción es espontánea porque E0= 0.52 V – 0.16 V= +0.36 V. Se puede obtener una idea más cuantitativa de la posición de equilibrio utilizando la relación E0= (RT/nF)LnK en la forma: 0.36 V= (0.059 V/n) logK Como en la reacción se transfiere un electrón, K= 1.3x106. 5.- Diagramas de potenciales Indican la estabilidad termodinámica relativa de un conjunto de especies en las que un elemento se presenta en diferentes estados de oxidación. 5.1.- Diagrama de Latimer Los diagramas de Latimer de un elemento químico varían según las condiciones ácidas o básicas del medio de reacción. 10 - Diagrama de Latimer del cloro a pH ácido ClO4+7 +1.20 ClO3+5 +1.18 +1.65 +1.63 +1.36 ClO2- HClO Cl2 Cl+3 +1 0 -1 para una etapa concreta se tiene: ClO4- + 2 H+ + 2 e ClO3- + H2O - E0= 1.20 Diagrama de Latimer del cloro a pH básico - ClO4 +7 +0.37 ClO3+5 +0.20 ClO2+3 +0.68 +0.42 +1.35 ClO Cl2 Cl+1 0 -1 para una etapa concreta se tiene: 2 ClO- + 2H2O + 2e Cl2 + 4 OH- E0= 0.42 El diagrama de Latimer permite calcular los E0 de pares no contiguos. E02 E01 A B C n1 n2 __________________________ nt = n1 + n2 Para la variación total de energía libre se tiene: ∆G0total= ∆G01 + ∆G02 -ntFEot = –n1FE01 - n2FE02 Eot= (n1E01 + n2E02) / (n1 + n2) El diagrama de Latimer permite deducir a partir de los valores de E0, la especie que tiene tendencia a la desproporción, es decir, a pasar desde un estado de oxidación dado a otro superior y a otro inferior. Según el diagrama de Latimer la desproporción ocurre cuando una especie dada tiene a su izquierda una de inferior E0 y a su derecha otra de superior E0. Por ejemplo, en el diagrama de Latimer de H2O2 en medio ácido se tiene: O2 0 0.70 H2O2 -1 La reacción de desproporción que ocurre es: 1.76 H2O -2 11 H2O2 -2e O2 1 + 2 H+ E0= 0.70 Oxidación en el ánodo 2 H2O2 + 2 H+ + 2e 2 H2O E0= 1.76 Reduccion en el cátodo __________________________________________________ 1+2 2 H2O2 O2 + 2 H2O E0(pila)= E0 (cátodo) – E0 (ánodo)= 1.76 – 0.70= 1.06 volt. 5.2.- Diagramast de Frost Un diagrama de Frost para un elemento X es la representación de nE0 para el par X(N)/X(0) frente al número de oxidación, N, del elemento. Como nE0 es proporcional a la energía libre normal de la reacción de conversión de la especie X(N) en el elemento, se puede considerar también el diagrama de Frost como una representación de la energía libre normal de formación frente al número de oxidación. Por tanto, el estado de oxidación más estable del elemento corresponde a la especie situada mas abajo en el diagrama de Frost. Sea el diagrama de Frost del oxígeno en disolución ácida. Su elaboración se realiza de la siguiente manera: 0.70 1.76 O2 H2O2 H2O 0 -1 -2 ___________ 1.23 __________ Para la transformación de O2 a H2O2 se tiene que N oxidación del oxígeno en O2= 0 y N oxidación del oxígeno en H2O2= -1, por lo que ∆Nox x E0= -1x0.70= -0.70 Voltios. 12 Para la transformación de H2O2 a H2O se tiene que N oxidación del oxígeno en O2= 0 y N oxidación del oxígeno en H2O= -2, por lo que ∆Nox x E0= -2x1.23= -2.46 Voltios. Explicación del diagrama de Frost del manganeso en disolución ácida: 1. Las especies más estables termodinámicamente serán encontradas en la zona inferior del diagrama. De esta manera, Mn(II) es la más estable (desde una perspectiva redox) de todas las especies de manganeso. 2. Una especie con una curva convexa [tal como el ión manganato (MnO4)2- y el ión Mn(III)] tendrán tendencia a desproporcionar. 3. Una especie con una curva cóncava [tal como el óxido de manganeso(IV), MnO2] no se desproporciona 4. Una especie que está arriba y a la izquierda en el dibujo [tal como el ión permanganato, (MnO4)-] será fuertemente oxidante. 5. Una especie que está alta y a la derecha en el dibujo será fuertemente reductora. De esta manera, el metal manganeso es moderadamente reductor. 5.3.- Diagramas de Pourbaix Un diagrama de Pourbaix es un gráfico que muestra, no solamente cómo varía el potencial de un par con el pH sino también las especies reales que existen a cada pH y los posibles pares redox en los que participan. Las regiones en el diagrama indican las condiciones de pH y potencial bajo las cuales una especie en particular es estable. Veremos brevemente cómo construir un diagrama de Pourbaix sencillo, para lo cual hemos elegido una solución acuosa de Fe. 13 Comencemos con Fe(III); la siguiente semirreacción de reducción: Fe3+(aq) + e Fe2+(aq) E0= 0.77 V No involucra iones H+, por lo que su potencial es independiente del pH del medio, y en consecuencia tendremos una línea horizontal en el diagrama de Pourbaix. Si en el sistema existe una especie con un potencial de reducción mayor que el que determina esta línea, la especie oxidada, Fe3+, será estable. Vemos entonces que esta línea horizontal es una especie de frontera que separa las regiones en las que Fe3+y Fe2+ son estables. Consideremos ahora la siguiente reacción: 2Fe3+(aq) + 3H2O(l) Fe2O3(s) + 6H+(aq) Esta no es una reacción redox y las regiones de estabilidad del Fe3+ y del Fe2O3 son independientes de cualquier par redox que también esté presente. Sin embargo, estas regiones de estabilidad sí dependen del pH, el ión Fe3+(aq) es estable a pH bajos, mientras que el Fe2O3 lo es a pH altos. Estas regiones las separaremos mediante una línea vertical que dependerá de las características ácido-base del par considerado y de la solubilidad del óxido. Consideremos la siguiente reacción: Fe2O3(s) + 6H+ (aq) + 2e 2Fe2+(aq) + 3H2O(l) 14 Esta sí es una reacción redox, en la cual intervienen protones. Por lo tanto, el potencial del par Fe2O3/Fe2+ es función del pH de la solución. Podemos calcular esta dependencia utilizando la ecuación de Nernst: E= E0 – (0.059/2) log ([Fe2+]2 / [H+]6) En condiciones estándar excepto para [H+], y reordenando obtenemos: E= E0 –0.177 pH Vemos entonces que el potencial disminuye linealmente a medida que el pH aumenta. La región de potencial y pH que queda por debajo de esta recta corresponde a las condiciones en las cuales la especie reducida es estable. Observemos que para oxidar el Fe2+ en soluciones ácidas se necesita un agente oxidante más poderoso que para hacerlo en soluciones básicas. La línea vertical a pH 9 divide las regiones en las cuales productos o reactivos de la siguiente reacción son estables: Fe2+(aq) + H2O(l) FeO(s) + 2H+(aq) Nuevamente esta no es una reacción redox, y la línea vertical muestra que el FeO(s) es favorecido cuando el pH es mayor que 9 (este pH puede calcularse a partir del valor del KPS y el Kw). Otra línea separa las regiones en las cuales FeO(s) y Fe2O3(s) son estables: Fe2O3(s) + 2H+(aq) + 2e 2FeO(s) + H2O(l) El potencial de esta reacción depende del pH: E= E0 –0.059 pH Finalmente, y ya que estamos trabajando en disolución acuosa podemos agregar al diagrama las dos líneas que representan las fronteras de la zona de estabilidad del agua. Como vimos con anterioridad, cualquier especie que tenga un potencial mayor que el límite superior de la zona de estabilidad del agua, se reducirá oxidando el agua a oxígeno, mientras que si su potencial es menor que el límite inferior de la zona de estabilidad del agua, será oxidada por ésta.