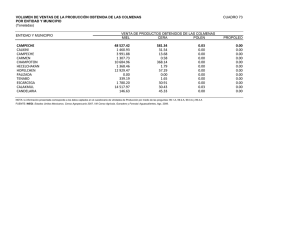
análisis de la calidad y actividad antiinflamatoria tópica in vivo
Anuncio

Universidad de Chile Facultad de Ciencias Químicas y Farmacéuticas Departamento de Química Farmacológica Toxicológica Laboratorio de Productos Naturales ANÁLISIS DE LA CALIDAD Y ACTIVIDAD ANTIINFLAMATORIA TÓPICA IN VIVO DE PROPÓLEOS DE LA REGIÓN METROPOLITANA Memoria para optar al título de Química Farmacéutica CATALINA PAZ FIGUEROA BENAVIDES DIRECTORES DE TESIS: POFESOR PATROCINANTE Dra. Carla Delporte Vergara1 Dra. Ximena Silva A2 Dra. Carla Delporte Vergara1 (1) Depto. de Química Farmacológica y Toxicológica. (2) Unidad de pruebas biológicas, ISP. Circulación restringida 2012-2014 Santiago, Chile 2012 Dedicada a mis padres, María Alejandra Benavides y Enrique Figueroa, quienes me han ayudado enormemente a llegar hasta esta instancia y a Fabrizio Cavada, mi gran amor, por estar siempre a mi lado. “El mundo está en manos de aquellos que tienen el coraje de soñar y de correr el riesgo de vivir sus sueños” ii AGRADECIMIENTOS Primero que todo agradezco a mi familia por ayudarme durante estos largos años, especialmente a mis padres, a mi hermana y a mi abuela, quienes me han enseñado, acompañado y entregado todo su amor desde que nací. Le doy gracias a Fabrizio, por estar siempre junto a mí, por apoyarme durante los momentos más difíciles y por haberme motivado cuando más lo necesité. Agradezco a todos mis amigos, quienes logran que las pruebas sean más fáciles y las metas más alcanzables, principalmente a Camila, Javiera y Diego, que han estado a mi lado desde muy pequeños y han sido muchas las experiencias compartidas; y a mis compañeras de carrera, Carolina, Vanessa, Alexandra y Jasmín, quienes superaron junto a mí todas las etapas de la Universidad y gracias a ellas el ánimo y la alegría siempre estuvieron presentes. Además debo expresar mi gran gratitud y respeto hacia la profesora Carla Delporte por su gran hospitalidad, amabilidad, cariño, apoyo y paciencia. Es una excelente profesora y un gran ejemplo a seguir. También quiero agradecer especialmente a Gabriela y a Consuelo por el gran apoyo que me brindaron desde que ingresé al laboratorio, por la ayuda incondicional en todos los momentos y por el lindo vínculo formado. Finalmente le doy gracias a todos mis compañeros del Laboratorio de Productos Naturales por todos los lindos momentos compartidos. A David por su gran disposición y buen humor, a Romina, Cristian, Daniela, Jorge, y Paola por la gran alegría, acogida, compañerismo y ayuda brindada. SINCERAMENTE, MUCHÍSIMAS GRACIAS A TODOS USTEDES. iii TABLA DE CONTENIDOS ABREVIATURAS…………………………………………………………………………….ix RESUMEN……………………………………………………………………………………..xii ABSTRACT……………………………………………………………………………………xiii I. INTRODUCCIÓN………………………………………………………………………1 II. HIPÓTESIS……………………………………………………………………………..7 III. OBJETIVOS…………………………………………………………………………….8 1. Objetivos Generales……………………………………………………………..8 2. Objetivos Específicos……………………………………………………………8 IV. MATERIALES Y MÉTODOS 1. Recolección de las muestras……………………………………………………..9 2. Preparación de extractos globales y seriados…………………………………..10 2.1.- Descerado con ciclos de temperatura……………………………………..10 2.2.- Extracción con solventes de polaridad creciente…………………………12 3. Control de calidad fisicoquímica……………………………………………….13 3.1.- Características sensoriales…….……………….………...………….…….13 3.2.- Determinación de la pérdida por calentamiento…...……………………...13 3.3.- Determinación del índice de oxidación…………………………………...14 3.4.- Determinación de sustancias extraíbles en n-hexano……………………. 14 3.5.- Determinación de resinas……………………………………………...… 15 3.6.- Determinación de impurezas Mecánicas………………………………… 16 3.7.- Determinación de flavonoides………..…………………….………….… 17 3.8.- Determinación de compuestos fenólicos totales…...……………………. 18 3.9.- Determinación de cenizas…………………………………………….….. 19 iv 4. Determinación de los perfiles cromatográficos por c.c.f....…….......………… 20 5. Determinación de la actividad antiinflamatoria tópica in vivo…….......…….... 21 V. RESULTADOS Y DISCUSIONES……………………………………………..…… 24 i. Preparación de extractos globales y seriados.…………………………….…… 24 ii. Control de calidad fisicoquímica….………………………………………...… 25 1. Características sensoriales ……….………………………………...… 25 2. Determinación de la pérdida por calentamiento…………...….……… 26 3. Determinación del índice de Oxidación……………………………... 27 4. Determinación de sustancias extraíbles en n-hexano………………… 28 5. Determinación de resinas……………………………………………... 29 6. Determinación de Impurezas mecánicas………………………...…… 30 7. Determinación de flavonoides……….……………………………..… 32 8. Determinación de compuestos fenólicos totales.……………………... 34 9. Determinación de cenizas ………………………………………….… 35 iii. Determinación de los perfiles cromatográficos por c.c.f. …….…………….… 36 1. Reactivo Liebermann…………………………………………….…… 37 2. Reactivo NP y UV-365 nm…………………………………............… 39 3. Reactivo ρ-anisaldehído sulfúrico………………………………….… 41 iv. Determinación de la actividad antiinflamatoria in vivo………………………. 44 VI. CONCLUSIÓN……………………………………………………………………..… 47 VII. REFERENCIAS……………………………………………………………………… 48 1. Referencias Bibliográficas……………………………………………………. 48 2. Anexos………………………………………………………………………… 51 v ÍNDICE DE FIGURAS Figura 1: Propóleos en bruto con distintas consistencias y coloraciones…….………...…. 1 Figura 2: Apis mellifera L…………………………………………………….………….. 2 Figura 3: Propóleo en cápsulas……………………………………………………………. 3 Figura 4: Zonas de recolección del propóleo………………………………………….….. 9 Figura 5: Propóleo en bruto…………………………………..…………………….….… 11 Figura 6: Solución etanólica de propóleo…………………………………………..……. 11 Figura 7: Baño Termorregulador a 70°C……………………………………..…………. 11 Figura 8: Refrigerador a -20°C………………………………………………………….. 11 Figura 9: Propóleo filtrado en frío………………………………………………………..11 Figura 10: Ratón identificado y con la muestra de propóleo aplicada……………………. 23 Figura 11: Sacabocados y discos de orejas de 6 mm……………………………….…….. 23 Figura 12: Propóleo Cajón de Maipo……………………………………………………... 25 Figura 13: Propóleo Caleu………………………………………………………………… 25 Figura 14: Propóleo Curacaví…………………………………………………………….. 25 Figura 15: Propóleo Buin…………………………………………………………………. 26 Figura 16: Propóleo Pirque………………………………………………………..……… 26 Figura 17: Curva calibración de quercetina…………………………………………...….. 32 Figura 18: Estructura base de los flavonoides…………………………………………..… 33 Figura 19: Curva calibración de ácido gálico……………………………………………... 34 Figura 20: c.c.f.reveladas con Liebermann-Burchard……..…………………….……...… 37 Figura 21: c.c.f. reveladas con Natural products……......………...………………………. 39 Figura 22: c.c.f. reveladas con ρ-anisaldehído sulfúrico………………………………….. 41 vi ÍNDICE DE CUADROS Tabla 1: Rendimientos de los extractos preparados……...……...…………………....… 24 Tabla 2: Pérdida por calentamiento de los propóleos en bruto….....….……..….……… 26 Tabla 3: Índice oxidación de los propóleos en bruto…..……………………………..… 27 Tabla 4: Sustancias extraíbles en n-hexano de los propóleos…..…...….....……….….... 28 Tabla 5: Porcentajes de resinas de los propóleos…..…………………...….…...…….… 30 Tabla 6: Impurezas mecánicas de los propóleos………………………………………... 31 Tabla 7: Concentraciones de flavonoides de los propóleos..………………………….... 32 Tabla 8: Concentraciones de compuestos fenólicos totales….………………….……… 34 Tabla 9: Porcentajes de cenizas de los propóleos………………………………………..35 Tabla 10: Posible perfil químico de los propóleos según c.c.f………...…………...….… 43 Tabla 11: Actividad Antiinflamatoria de los EEG…………………………….……….… 44 vii ÍNDICE DE ANEXOS Anexo 1: Test de Mann-Whitney para TPA de propóleo de Caleu Anexo 2: Test de Mann-Whitney para TPA de propóleo de Cajón del Maipo Anexo 3: Test de Mann-Whitney para TPA de propóleo de Curacaví Anexo 4: Test de Mann-Whitney para TPA de propóleo de Buin Anexo 5: Test de Mann-Whitney para TPA de propóleo de Pirque Anexo 6: Test de Kruskal-Wallis ANOVA para TPA de todos los propóleos Anexo 7: Test de Mann-Whitney para AA de propóleo de Caleu Anexo 8: Test de Mann-Whitney para AA de propóleo de Cajón del Maipo Anexo 9: Test de Mann-Whitney para AA de propóleo de Curacaví Anexo 10: Test de Mann-Whitney para AA de propóleo de Buin Anexo 11: Test de Mann-Whitney para AA de propóleo de Pirque Anexo 12: Test de Kruskal-Wallis ANOVA para AA de todos los propóleos Anexo 13: Test de Mann-Whitney para los EAI entre dos tipos de propóleos Anexo 14: Test de Mann-Whitney para los EAI entre dos tipos de propóleos Anexo 15: Test de Mann-Whitney para los EAI entre dos tipos de propóleos Anexo 16: Test de Mann-Whitney para los EAI entre dos tipos de propóleos viii ABREVIATURAS A : Absorbancia AA : Ácido araquidónico B : Buin C : Cenizas CA : Caleu CAPE : Feniletil éster del ácido cafeico c.c.f. : Cromatografías en capa fina CM : Cajón del Maipo Conc. : Concentración COX : Ciclooxigenasa CV : Curacaví DNA : Ácido desoxirribonucleico d.s. : Desviación estándar EAI : Efecto antiinflamatorio EEG : Extracto etanólico global EROs : Especies reactivas del oxígeno ESD : Extracto seriado de diclorometano ESE : Extracto seriado de etanol ESH : Extracto seriado de hexano Ext. : Extracto FeCl3 : Tricloruro de hierro (III) Fenol. : Fenoles fig. : Figura FLA2 : Fosfolipasa A2 ix Flav. : Flavonoides graf. : Gráfico H : Perdida por calentamiento ILs : Interleuquinas IM : Impurezas mecánicas iNOS : Óxido nítrico sintasa inducible I. Oxidación : Índice de oxidación ISP : Instituto de Salud Pública LOX : Lipoxigenasa LTs : Leucotrienos NF-κβ : Factor nuclear kappa B nm. : Nanómetros NO : Óxido nítrico NP : Natural Products n.v. : Nombre vulgar ORAC : Oxygen radical absorbance capacity P : Pirque PIs : Prostaciclinas PGs : Prostaglandinas PKC : Proteína quinasa C PL : Fosfolípidos R : Resinas Rd : Rendimiento SE : Sustancias extraíbles en n-hexano RNA : Ácido ribonucleico x SEM : Error estándar de la media TLRs : Receptores de tipo Toll TNF-α : Factor de necrosis tumoral alfa TPA : 13-acetato de 12-tetradecanoilforbol Tpo. : Tiempo TXs : Tromboxanos v.s. : Versus xi RESUMEN El propóleo es una sustancia de naturaleza compleja, altamente adhesiva, recolectada y usada por las abejas. Está constituido por sustancias resinosas, gomosas y balsámicas; ceras, aceites esenciales y polen. La obtención del propóleo se lleva a cabo cuando las abejas extraen sustancias de las yemas vegetales, hojas y grietas de las cortezas de los árboles, para mezclarlas posteriormente con secreciones de sus glándulas mandibulares (cera y enzimas). Al propóleo se le han atribuido diversas propiedades farmacológicas tales como: antibacteriana, antifúngica, antiviral, antiinflamatoria, antiulcerosa, hepatoprotectora y antitumoral, entre otras. El siguiente trabajo tuvo como objetivo evaluar la calidad fisicoquímica de cinco propóleos de la Región Metropolitana de Santiago de Chile (Caleu, Cajón del Maipo, Curacaví, Buin y Pirque), utilizando como referencia la Norma IRAM-INTA 15935-1, del Instituto Argentino de Normalización, y evaluar el efecto antiinflamatorio tópico (EAI) en ratones, utilizando al ácido araquidónico (AA) y al 13-acetato de 12-tetradecanoilforbol (TPA) como agentes inflamatorios. Los propóleos evaluados, cumplieron con los parámetros exigidos por la norma Argentina IRAM-INTA 15935-1 (2008), demostrando que los propóleos chilenos son similares o incluso mejores, respecto a la calidad, que los propóleos colombianos, argentinos y brasileros. Todos los extractos etanólicos globales de los propóleos estudiados presentaron actividad antiinflamatoria significativa al utilizar TPA como agente inflamatorio, donde el resultado mayor fue para el propóleo de Curacaví (62,6 %± 3,7), el menor fue para el de Caleu (49,5 %± 3,2) y ninguno superó el efecto alcanzado por el fármaco de referencia indometacina (92,9 % ± 3,2). En cambio para la inflamación causada por AA cuatro de los cinco propóleos mostraron actividad antiinflamatoria significativa, donde el valor más alto fue para el propóleo de Buin (58,7 % ± 6,5) y lo sigue de forma muy cercana el de Curacaví (57,8 % ± 3,9); ambos muestran un efecto muy superior al fármaco de referencia nimesulida (48,8 % ± 4,0). Finalmente, la magnitud de los EAI estuvo directamente relacionada con la concentración de compuestos fenólicos totales de este producto apícola. xii ABSTRACT QUALITY ANALYSIS AND IN VIVO TOPICAL ANTIINFLAMMATORY ACTIVITY OF PROPOLIS FROM METROPOLITAN REGION Propolis is a complex, highly adhesive substance, collected and used by bees. It consists of resinous, rubbery and balsamic substances; waxes, essential oils and pollen. The obtaining of propolis is performed when substances extracted by bees from plant buds, leaves and crevices in the bark of trees, are later mixed with secretions from their mandibular glands. Several pharmacological properties have been ascribed for propolis such as antibacterial, antifungal, antiviral, anti-inflammatory, antiulcer, hepatoprotective and anti-tumor, among others. The objective of this study was to evaluate the physicochemical quality of five propolis from the Región Metropolitana de Santiago de Chile (Caleu, Cajon del Maipo, Curacaví, Buin and Pirque), using the IRAM-INTA 15935-1 standard, by the Instituto Argentino de Normalización as reference and evaluate the topical anti-inflammatory effect (EAI, in Spanish) in mice, using the arachidonic acid (AA) and 13-tetradecanoylphorbol 12-acetate (TPA) as inflammatory agents. The evaluated propolis, succeeded with the parameters required by the argentinian standard IRAM-INTA 15935-1 (2008), showing that the chilean propolis were similar or even better than its colombian, argentinian and brazilian counterparts, in quality terms. All of the studied global ethanol extracts of propolis showed significant antiinflammatory activity using TPA as inflammatory agent, where the higher result was for propolis from Curacaví (62,6 % ± 3,7), the lowest was for propolis from Caleu (49,5 % ± 3,2) and none exceeded the effect achieved by the reference drug indomethacin (92,9 % ± 3,2). On the other hand, for the AA induced inflammation, four out of five propolis showed significant antiinflammatory activity, where the highest value was for propolis from Buin (58,7 % ± 6,5) followed very closely by propolis from Curacaví (57,8 % ± 3,9). Both showed a far superior xiii effect to the reference drug nimesulide (48,8 % ± 4,0). Finally, the results for EAI are closely related to the concentration of total phenolic compounds of propolis. xiv INTRODUCCIÓN I. INTRODUCCIÓN La palabra propóleo deriva del griego pro (en defensa de) y polis (ciudad); con ella se designa a la sustancia que recubre la colmena o polis de las abejas, desempeñando funciones defensivas (Palomino et al., 2009). El propóleo es una sustancia de naturaleza compleja, altamente adhesiva, recolectada y usada por las Apis mellifera L. (n.v. abejas) (Peña, 2008). Está constituido por sustancias resinosas, gomosas y balsámicas; ceras, aceites esenciales y polen (Woisky & Salatino, 1998; Tosi et al., 2006). Como se aprecia en la figura 1, la consistencia es muy variada y presentan distintas tonalidades de color castaño, marrón, pardo, rojizo y verde, según sea el origen botánico y geográfico (Salamanca et al., 2007). El aroma puede ser suave, intenso, dulce o desagradable, según el lugar de recolección (Tosi et al., 2006). A B Figura 1: Propóleos en bruto con distintas consistencias y coloraciones, A. Propóleo de Buin; B. Propóleo de Curacaví La obtención del propóleo se lleva a cabo cuando las abejas propolizadoras (figura 2) extraen, mediante sus mandíbulas, exudados de las yemas vegetales, de las hojas y de las grietas de las cortezas de los árboles, para posteriormente mezclarlos con secreciones de sus glándulas mandibulares (ácido 10-hidroxidecenoico) permitiendo su ablandamiento para triturarlo, y produciendo una hidrólisis enzimática a algunos de sus componentes (Salamanca et al., 2007; Kalogeropoulos et al., 2009). 1 INTRODUCCIÓN Las abejas utilizan el propóleo para barnizar el interior de la colmena con fines desinfectantes, para cerrar grietas y consolidar los componentes estructurales. También lo utilizan para recubrir los cadáveres de los enemigos que se hayan introducido en la colmena (escarabajos, lagartijas, entre otras), los que quedan embalsamados evitando así su descomposición (Palomino et al., 2009). La composición química del propóleo es compleja y depende de la flora presente en el área de recolección, sin embargo, se han identificado como principales componentes: alcoholes, aldehídos, aminoácidos, ácidos y ésteres aromáticos, flavonoides, ácidos grasos, lignanos, triterpenos y esteroides (Woisky & Salatino, 1998; Russo et al., 2004). En el hemisferio norte (Europa, América del Norte, del Sur y Asia occidental), las especies vegetales, que las abejas comúnmente visitan para la elaboración del propóleo, son las siguientes: Populus spp. (n.v. Álamos), Betula spp. (n.v. Abedules), Ulmus spp. (n.v. Olmos), Quercus spp. (n.v. Robles), Salix spp. (n.v. Sauces), Aesculus hippocastanum L. (n.v. Castaño de Indias) y Figura 2: Apis mellifera L. Picea spp. (n.v. Coníferas) (Kosalec et al., 2003). Este producto de la colmena ha sido utilizado desde tiempos antiguos por las propiedades farmacéuticas que se le han atribuido, tales como: antibacteriana, antifúngica, antiviral, antiinflamatoria, antiulcerosa, hepatoprotectora, antitumoral, entre otras. Cabe destacar que algunos de estos efectos han sido relacionados con el contenido de compuestos fenólicos, especialmente de flavonoides (Peña, 2008; Alencar et al., 2007). Los flavonoides, junto con los ácidos fenólicos y sus ésteres, genéricamente incluidos en los denominados “compuestos fenólicos”, son actualmente considerados los principales componentes bioactivos del propóleo. Estos compuestos tienen importantes propiedades farmacológicas, destacándose la actividad antioxidante que permite disminuir la peroxidación lipídica y el efecto de los radicales libres, particularmente frente a radicales alcoxi y superóxido (Salamanca et al., 2007). 2 INTRODUCCIÓN Dentro de los flavonoides descritos comúnmente en el propóleo se han encontrado: apigenina, crisina, quercetina, canferol, galangina, pinocembrina, hesperidina, acacetina, medicarpina y canferido, entre otros (Bedascarrasbure et al., 2004; Alencar et al., 2007; Russo et al., 2004). El propóleo es ampliamente utilizado en la medicina folclórica, en apiterapia, como constituyente de productos cosméticos y como comida saludable, entre otros (Kalogeropoulos et al., 2009). A pesar de que se han reportado reacciones alérgicas debido a la presencia de las ceras (Peña, 2008), el propóleo es relativamente seguro, observándose que, a una dosis de 2000 mg/Kg administrada en ratones, no presentó efectos tóxicos agudos (Mohammadzadeh et al., 2007b). Finalmente, la amplia diversidad en la composición química de este producto apícola y su empleo generalizado en la industria, han traído como consecuencia la necesidad del control de calidad y la estandarización de sus componentes activos. Con este fin, se han desarrollado diversas normas internacionales, como por ejemplo, la norma Ramal Rusa RST 317-1977, la norma Ramal del Ministerio de Agricultura de Cuba-1994, el reglamento técnico para la fijación de identidad y calidad de propóleos del Ministerio de Agricultura de Brasil-1999 y la norma IRAM, del Instituto Argentino de Normalización – Subcomité de Productos Agroalimentarios del NOA-2008 (Palomino et al., 2009), esta última fue utilizada para realizar el análisis de la calidad fisicoquímica de los propóleos evaluados (características sensoriales, perdida por calentamiento, índice de oxidación, sustancias extraíbles en n-hexano, determinación de resinas, determinación de impurezas mecánicas, determinación de flavonoides, determinación de compuestos fenólicos totales y determinación de cenizas), debido a que es una versión actualizada de las primeras normas realizadas, permitiéndonos comparar nuestros resultados, con otros estudios internacionales. Es evidente que la introducción efectiva del propóleo en la terapéutica depende de las condiciones estandarizadas de recolección y de los procedimientos sistemáticos de control de sus parámetros físicoquímicos, químicos y microbiológicos (Woisky & Salatino, 1998). Actualmente en Chile todavía no se ha creado ningún protocolo o norma Figura 3: Propóleo en cápsulas 3 INTRODUCCIÓN para evaluar a los propóleos nacionales. A pesar de ello, se comercializan en la farmacia una serie de preparados con fines terapéuticos, como son los spray de uso local, jarabes y cápsulas (figura 3), entre otros. Muchos países han estudiado los efectos farmacológicos de sus propóleos, como por ejemplo, se ha evaluado la actividad antioxidante de propóleos de Irán (Mohammadzadeh et al., 2007a), la actividad antimicrobiana de propóleos de Brasil (Alencar et al., 2007), la actividad antitumoral de propóleos de Croacia (Orsolic & Basic, 2004) y el efecto antiinflamatorio de propóleos de Corea (Seon Song et al., 2002). Por el contrario, en Chile son bastante limitados estos estudios, encontrando sólo el efecto antifúngico sobre Candida spp. (Herrera et al., 2010) y la capacidad de modular el metabolismo de la glucosa en ratones diabéticos. (Pacheco et al., 2011). Sin embargo, existe una mayor diversidad de estudios chilenos relacionados con la determinación de la composición química de nuestros propóleos (Peña, 2008). Por todo lo mencionado anteriormente, es de suma importancia la realización de nuevos estudios científicos en este tema, ya que nos permitirán identificar y clasificar las diversas propiedades farmacológicas de los propóleos de distintos lugares de nuestro país y avanzar hacia la estandarización de este producto apícola. En esta memoria se determinó la actividad antiinflamatoria tópica, de propóleos de distintos lugares de la Región Metropolitana de Santiago. Para este estudio se utilizaron dos agentes inflamatorios, 13-acetato de 12-tetradecanoilforbol (TPA) y ácido araquidónico (AA), debido a que generan distintos mediadores proinflamatorios permitiéndonos estimar el posible mecanismo de acción de los propóleos. La inflamación es la respuesta, del sistema inmunológico de un organismo, al daño causado a sus células y tejidos vascularizados, por patógenos o por cualquier otro agresor de naturaleza biológica, química, física o mecánica. Aunque es dolorosa, normalmente es una respuesta reparadora, que contempla entre otras cosas, la eliminación de agentes patógenos y de células infectadas, la creación de barreras y la reparación del tejido lesionado por la agresión o por la respuesta del huésped (García, 2008). 4 INTRODUCCIÓN La respuesta tisular a la agresión contempla cuatro componentes, a modo de una cascada inflamatoria, estas son: Inductores inflamatorios, los sensores que los detectan, los mediadores inflamatorios inducidos por los sensores y los tejidos diana que serán afectados por los mediadores. Así, el tipo de vía inducida, dependerá de la naturaleza de la activación inflamatoria. De esta forma, las bacterias serán detectadas por los receptores de tipo Toll (TLRs) propios de los macrófagos, produciendo citoquinas inflamatorias (factor de necrosis tumoral-α, interleuquinas), prostaglandinas (PGs) y quimioquinas. Estos mediadores actúan en diversos tejidos, incluyendo vasos sanguíneos, provocando vasodilatación y extravasación de neutrófilos. Los neutrófilos juntos a los macrófagos y los mastocitos destruyen a los patógenos. A su vez, las infecciones virales inducen a la síntesis de Interferones de tipo I y la activación de linfocitos citotóxicos, mientras que las infecciones por parásitos producen interleuquina-5 (IL-5) e histamina por mastocitos y basófilos (Medzhitov, 2010). El reconocimiento de estos patógenos conduce a la síntesis de mediadores lipídicos de la inflamación conocidos bajo el nombre colectivo de eicosanoides. Los eicosanoides derivan del ácido araquidónico (AA), un ácido graso ω-6 poliinsaturado que los mamíferos pueden incorporar directamente a través la dieta o sintetizar a partir de ácido linoleico (Astudillo et al., 2009). Dentro de este grupo de mediadores lipídicos encontramos a las prostaglandinas (PGs), que son pequeñas moléculas que regulan numerosos procesos orgánicos. La producción de PGs comienza con la liberación de AA desde los fosfolípidos (PL) de las membranas celulares, por acción de la fosfolipasa A2 (FLA2) en respuesta a estímulos inflamatorios. El AA es convertido a PGH2 por las enzimas ciclooxigenasas 1 y 2 (COX-1 y COX-2). COX-1 se expresa constitutivamente en la mayoría de los tejidos y participa en procesos homeostáticos (ej. protección del epitelio gástrico); COX-2, por el contrario, es una enzima inducible y se encuentra involucrada principalmente en la regulación de la inflamación. La vía COX da lugar a PGs, tromboxanos (TXs) y prostaciclinas (PIs). Las PIs son eficaces antiinflamatorios, mientras que las PGs clásicas (PGE2 y PGF2α) y TXs son proinflamatorias. El AA puede ser metabolizado a través de otras dos vías enzimáticas: lipoxigenasas (LOXs), que dan lugar a los hidroperóxidos, leucotrienos (LTs) y lipoxinas; y el citocromo P450 que forma derivados epóxidos. Mientras que los LTs son potentes proinflamatorios, las lipoxinas frenan el proceso inflamatorio. De esta 5 INTRODUCCIÓN forma, cuando la concentración local de PGE2 incrementa, consigue un efecto inhibidor de la COX2 y de la LOX-5 (generadora de LTB4), a la vez que induce la expresión de LOX-15 (generadora de lipoxinas que frenan el influjo de neutrófilos). Tales efectos detienen el proceso de inflamación (García, 2008). Por otra parte, el incremento de la concentración local de mediadores proinflamatorios provocan los signos clínicos de la inflamación: calor, rubor, tumor y dolor; definidos previamente por el doctor romano Cornelius Celso (García, 2008). Posteriormente Rudolph Virchow en 1858 agregó un quinto signo, el trastorno de la función (functio laesa) (Medzhitov, 2010). Estos síntomas microscópicamente se entienden como producto de la vasodilatación, acumulación de leucocitos, infiltración del líquido intersticial y la estimulación nerviosa (Cone, 2001). En las diferentes investigaciones, es bastante común observar que se utilice AA y TPA como agentes inflamatorios tópicos en animales. Este último se obtiene del aceite de crotón (Croton tiglium L.) y posee propiedades irritantes, pro-inflamatorias y promotora de tumores. Su mecanismo de acción no está dilucidado totalmente, pero se sabe que es mediado por la activación de la proteína quinasa C (PKC), y de la FLA2, como también por la inducción de las COXs y la translocación/activación de las LOXs (Franco et al., 2007; Murakawa et al., 2006). A nivel bioquímico aumenta la producción de eicosanoides, principalmente de PGE2 y LTB4; y de citoquinas proinflamatorias como el factor de necrosis tumoral α (TNF-α) (Murakawa et al., 2006; Puignero et al., 1998). La inflamación por TPA consta de dos etapas, una temprana (3 h después de la aplicación) donde el engrosamiento de la dermis es evidente, pero con poca cantidad de infiltrado; y una tardía (6 h, en este momento se observa el edema máximo ocurrido) donde hay una gran cantidad de infiltrados (Murakawa et al., 2006). También hay producción del ácido ribonucleico (RNA) y del ácido desoxirribonucleico (DNA) entre las 12 h y 48 h con el fin de sintetizar nuevas proteínas en el desarrollo del edema, ya que se producen cambios en la agrupación epidérmica de estas (Gómez et al., 2011; Inoue et al., 1989). A diferencia del TPA, el AA induce una respuesta inflamatoria de corta duración (6 h), paralela a la generación de PGs, TXs y de LTs (Puignero et al., 1998), presentando un edema máximo transcurrido 1 h tras la aplicación del agente inflamatorio. 6 HIPÓTESIS II. HIPÓTESIS Los propóleos de la Región Metropolitana de Santiago de Chile cumplen con el criterio de calidad fisicoquímica, exigido por la norma IRAM, del Instituto Argentino de Normalización – Subcomité de Productos Agroalimentarios del NOA-2008. Los propóleos presentan actividad antiinflamatoria tópica in vivo y la magnitud de ésta depende directamente de la concentración de flavonoides y del total de los compuestos fenólicos presentes en las muestras. 7 OBJETIVOS III. OBJETIVOS 1. Objetivos generales Contribuir al conocimiento farmacológico de distintas muestras de propóleos de la Región Metropolitana de Santiago (Caleu, Cajón del Maipo, Buin, Curacaví y Pirque), determinando su actividad antiinflamatoria tópica. Además de contribuir con la determinación de las propiedades fisicoquímicas de los propóleos, mediante un análisis del control de calidad de éstos. 2. Objetivos específicos - Recolectar las muestras de propóleos y preparar los distintos extractos. - Analizar la calidad fisicoquímica de los propóleos Chilenos según la norma Argentina IRAM-INTA 15935-1 (2008), que incluye la concentración de flavonoides y compuestos fenólicos totales. - Analizar cualitativamente, en forma comparativa, la composición química de los propóleos mediante cromatografías en capa fina (c.c.f.). - Evaluar in vivo la actividad antiinflamatoria tópica de los diferentes extractos globales. 8 MATERIALES Y MÉTODOS IV. MATERIALES Y MÉTODOS 1. Recolección de las muestras Se recolectaron muestras de propóleo, durante el periodo de primavera-verano del año 2011, de colmenas situadas en las siguientes localidades de la Región Metropolitana de Santiago (fig. 4): Cajón del Maipo Caleu Curacaví Buin Pirque Posteriormente las muestras fueron almacenadas a 8°C y protegidas de la luz. Figura 4: Zonas de recolección del propóleo 9 MATERIALES Y MÉTODOS 2. Preparación de extractos globales y seriados 2.1.- Descerado con ciclos de temperatura Para poder elaborar los distintos extractos, fue necesario realizar un proceso previo de descerado mixto (con ciclos de temperatura), según las metodologías propuestas por Alencar et al. (2007) y Kalogeropoulos et al. (2009). 2.1.1. Procedimiento Como se visualiza en el esquema 2.1.2, se masaron 300 g de propóleo en bruto y se adicionaron 500 mL de etanol. La mezcla etanólica se introdujo a un baño termoregulado a 70°C durante 30 min. Luego se dejó enfriar a temperatura ambiente y se refrigeró a -20°C, durante 12 h. Se filtró en frío con papel plegado múltiple y se conservó el sobrenadante para repetir el procedimiento un mínimo de tres veces, para lograr la eliminación completa de las ceras. 10 MATERIALES Y MÉTODOS 2.1.2. Esquema Disuelve Calienta Figura 5: Propóleo en bruto Figura 6: Solución etanólica de propóleo Enfría Figura 8: Refrigerador a -20°C Figura 7: Baño Termorregulador a 70°C Filtra Figura 9: Propóleo filtrado en frío 11 MATERIALES Y MÉTODOS 2.2.- Extracción con solventes de polaridad creciente para obtener los extractos seriados 2.2.1. Procedimiento Una vez descerado el propóleo, se concentró el extracto en un evaporador rotatorio hasta eliminar completamente el solvente (etanol), obteniendo así el extracto etanólico global (EEG). Se guardó una cantidad suficiente del EEG seco y el resto se utilizó para obtener los extractos seriados, los cuales se elaboraron mediante la extracción sucesiva con solventes de polaridad creciente: hexano, diclorometano y etanol, para luego ser concentradas en el evaporador rotatorio hasta eliminar el solvente. Obteniendo de esta forma los extractos: seriados de hexano (ESH), seriados de diclorometano (ESD) y los extractos seriados de etanol (ESE), respectivamente. Cada extracción se realizó mediante agitamiento constante y hasta lograr el total agotamiento de la muestra. 2.2.2. Cálculos - Se calculó el rendimiento (Rd) de los extractos mediante la siguiente fórmula: Dónde: Rd = Rendimiento (g/100g) Pf = Masa final del EEG o de los extractos seriados Pi = Masa muestra propóleo en bruto (en caso de EEG) y masa del EEG seco (en caso de extractos seriados) 12 MATERIALES Y MÉTODOS 3. Control de calidad fisicoquímica de acuerdo con la Norma Argentina IRAM-INTA (2008) 3.1.- Características sensoriales del propóleo en bruto La determinación se realizó mediante los sentidos, lo evaluaron cinco personas y se consideró el resultado mayoritario. Se determinó: olor (intenso, suave, dulce), color (amarillo, pardo, verdoso, marrón, rojizo o negro), sabor (suave, fuerte y picante), consistencia (maleable o rígido) y aspecto (homogéneo o heterogéneo) (según la Norma Argentina IRAM-INTA, 2008). 3.2.- Determinación de la pérdida por calentamiento del propóleo en bruto 3.2.1. Procedimiento La determinación se efectuó por triplicado. Se taró una cápsula de porcelana previamente secada en estufa a 100ºC y se masaron aproximadamente 4 g de propóleo en bruto, se calentó en una estufa regulada a 100°C ± 2°C durante 2 h. Posteriormente se retiró la cápsula, se colocó en un desecador hasta que llegó a temperatura ambiente y se masó. El resultado se expresó como el promedio de las mediciones ± la desviación estándar (d.s.) (según Norma Argentina IRAM-INTA., 2008). 3.2.2. Cálculos - Se calculó la pérdida por calentamiento (H) mediante la siguiente fórmula: [ ( ( ) ) ] 13 MATERIALES Y MÉTODOS Dónde: H = Pérdida por calentamiento (humedad) (g/ 100 g) CTS = Masa de la cápsula con la muestra seca (g) CTH = Masa de la cápsula con la muestra en bruto (g) M100 = Masa de la cápsula vacía (g) 3.3.- Determinación del índice de oxidación 3.3.1. Procedimiento La determinación se efectuó por triplicado. Se masaron 0,2 g de la muestra de propóleo en bruto y se colocó en un matraz de 125 mL. Se añadió 5 mL de etanol 96 % y se dejó en reposo durante 1 h. Luego se completó el volumen con agua destilada, se filtró a través de un papel filtro simple y se recogió el filtrado. Se colocaron 2 mL del filtrado en un tubo de ensayo, se añadió 1 mL de solución de ácido sulfúrico al 98% y se agitó durante 1 min. Posteriormente se agregó en el tubo 1 gota de solución de permanganato de potasio 0,1 N y se puso en marcha el cronómetro al entrar en contacto la gota con la solución. Se registró el tiempo en que la solución tardó en decolorarse, en segundos (s). El permanganato al reducirse cambia de un color rosado fuerte a incoloro. El resultado se expresó como el promedio de las determinaciones ± d.s. (según Norma Argentina IRAM-INTA, 2008). 3.4.- Determinación del porcentaje de sustancias extraíbles en n-hexano 3.4.1. Procedimiento La determinación se efectuó por triplicado. Se masaron aproximadamente 2 g de propóleo en bruto, se depositó en un cartucho de celulosa seco previamente tarado y posteriormente se colocó en el cuerpo de un extractor de Soxlhet. Se taró el balón del extractor de Soxlhet, y se colocó en él un volumen adecuado de n-hexano y se calentó durante 6 h, una vez que el solvente entró en ebullición. En el balón quedaron las ceras disueltas en n-hexano, por lo que fue necesario evaporar el solvente en un evaporador rotatorio; el remanente se trasladó a una cápsula de Petri, la cual se colocó en un desecador hasta temperatura ambiente, para 14 MATERIALES Y MÉTODOS finalmente masarla. Se masó hasta lograr constancia de masa (cuya diferencia no fuese más de 5 mg). El resultado se expresó como el promedio de las determinaciones ± d.s. (según Norma Argentina IRAM-INTA, 2008). 3.4.2. Cálculos - Se calculó el contenido de sustancias extraíbles (SE) mediante la fórmula siguiente: ( ) Dónde: SE = Contenido de sustancias extraíbles en n-hexano (g/100 g) BC1 = Masa de la cápsula de Petri con sustancias extraíbles (g) BC0 = Masa de la cápsula vacía (g) m = Masa del propóleo bruto (g) 3.5.- Determinación del porcentaje de resinas 3.5.1. Procedimiento La determinación se efectuó por triplicado. Se colocó el remanente de cada una de las muestras resultantes del procedimiento anterior (es decir el propóleo en bruto agotado con nhexano), en el cuerpo de un extractor Soxlhet y se colocó en el balón del extractor un volumen adecuado de etanol al 96% y se calentó hasta que el solvente entró en ebullición. Se mantuvo en esas condiciones durante 6 h como mínimo, hasta que el etanol en contacto con la muestra fuera incoloro. El punto final de la extracción se determinó agregando aproximadamente 0,1 mL de una solución de FeCl3 al 10%, a un 1 mL de dicho etanol y se observó el cambio de color de la solución; cuando no viró de amarillento a verdoso, se dio por finalizada la extracción. La aparición de un color verde indica la presencia de compuestos fenólicos (Silver et al., 1979). 15 MATERIALES Y MÉTODOS Posteriormente se depositó cuantitativamente la solución etanólica contenida en el balón a un matraz aforado de 100 mL y se aforó con etanol. A una muestra de 50 mL de esta solución se le eliminó el disolvente en un evaporador rotatorio y a continuación, se colocó en una estufa a 80 °C para evaporar los restos de etanol. Luego, se colocó en un desecador hasta temperatura ambiente y se masó. Se repitió el último procedimiento hasta lograr constancia de masa, (cuya diferencia no fuese más de 5 mg). Los 50 mL restantes se guardaron en frascos ámbar para la determinación de compuestos fenólicos y flavonoides. El resultado se expresó como el promedio de las determinaciones ± d.s. (según Norma Argentina IRAM-INTA, 2008). 3.5.2. Cálculos - Se calcularon los porcentajes de resinas (R) mediante la fórmula siguiente: ( ) Dónde: R = Contenido de resinas (g/100 g) BR1 = Masa del balón con resinas secas (g) BR0 = Masa del balón vacío seco (g) M = Masa del propóleo en bruto (g) 3.6.- Determinación del porcentaje de impurezas mecánicas 3.6.1. Procedimiento El ensayo se efectuó por triplicado. El propóleo en bruto proveniente de los puntos 3.4.1. y 3.5.1. (es decir, la muestra agotada con n-hexano y etanol) fue secada a 80 °C, luego fue depositada en un desecador hasta que alcanzó la temperatura ambiente y se masó hasta peso constante (cuya diferencia no fuese más de 5 mg). El resultado se expresó como el promedio de las determinaciones ± la d.s. (según Norma Argentina IRAM-INTA., 2008). 16 MATERIALES Y MÉTODOS 3.6.2. Cálculos - El contenido de impurezas mecánicas (IM) fue calculado mediante la fórmula siguiente: ( ) Dónde: IM = Contenido de impurezas mecánicas (g/100g) P1 = Masa del cartucho (o el papel) seco (g) P = Masa del cartucho (o el papel) vacío seco (g) m = Masa de la muestra (g) 3.7.- Determinación de flavonoides mediante la reacción colorimétrica con tricloruro de aluminio La determinación de los flavonoides de la solución etanólica de resinas (proveniente del ensayo 3.5.1) de cada uno de los propóleos en estudio, se realizó mediante un ensayo espectrofotométrico con tricloruro de aluminio. La sustancia patrón utilizada fue la quercetina. 3.7.1. Procedimiento para construir la curva de calibración de quercetina Se prepararon soluciones de 2, 4, 6, 8 y 10 µg/mL de quercetina en metanol. A distintos volúmenes de una solución madre de quercetina (concentración de 100 µg/mL), se le agregaron 0,5 mL de una solución de tricloruro de aluminio (5 % p/v) y se enrasó a 25 mL con metanol. Se dejaron 30 min en la oscuridad, para luego leer las absorbancias a 465 nm en un espectrofotómetro Unicam UV-VIS (según Norma Argentina IRAM-INTA., 2008). 17 MATERIALES Y MÉTODOS 3.7.2. Procedimiento para la determinación de flavonoides de las muestras La determinación se efectuó por triplicado. Se pipetearon 0,5 mL de la solución etanólica de resinas, se agregaron 0,5 mL de la solución de tricloruro de aluminio y luego se enrasaron con metanol a 25 mL. Se preparó un blanco con 0,5 mL de alcohol etílico y 0,5 mL de solución de tricloruro de aluminio y se enrasó con metanol. Las soluciones se dejaron en la oscuridad durante 30 min, se colocaron en una cubeta de cuarzo y se leyeron las absorbancias a 465 nm. Cuando se obtuvo una absorbancia (A) muy baja o muy alta, se aumentó o disminuyó la concentración de las soluciones etanólicas de resinas, respectivamente. Con los valores de A obtenidos, se interpoló en la curva de calibración, y se obtuvieron las concentraciones de flavonoides expresadas como equivalentes de quercetina. El resultado (g/100g) se enunció como el promedio de las determinaciones ± d.s. (según Norma Argentina IRAM-INTA, 2008). 3.8.- Determinación de compuestos fenólicos totales mediante el método de microfolin La determinación del contenido total de compuestos fenólicos de la solución etanólica de resinas (proveniente del ensayo 3.5.1) de cada uno de los propóleos en estudio, se realizó mediante un ensayo espectrofotométrico con el reactivo de Folin-Ciocalteu. La sustancia patrón utilizada fue el ácido gálico. 3.8.1. Procedimiento para realizar la curva calibración de ácido gálico Se prepararon soluciones acuosas con distintas concentraciones de ácido gálico (10, 20, 30, 40, 50, 60, 70, 80 y 90 % p/v) desde una solución madre de ácido gálico al 1 % p/v. El volumen final fue de 10 mL. Posteriormente se tomaron 100 µL de cada solución y se colocaron en tubos eppendorf, se agregaron 100 µL del reactivo de Folin-Ciocalteu, se agitó suavemente y se dejaron en reposo durante 2 min. Luego se añadieron 800 µL de una solución de carbonato de sodio y se calentó en un baño termorregulador a 40°C durante 20 min. Finalmente, se colocaron las soluciones en cubetas de cuarzo y se leyeron las absorbancias en un espectrofotómetro Unicam UV-VIS a 740 18 MATERIALES Y MÉTODOS nm, contra un blanco (100 µL agua destilada, 100 µL reactivo de Folin-Ciocalteu y 800 µL de la solución de carbonato de sodio, sometido a las mismas condiciones) (Cicco et al., 2009). 3.8.2. Procedimiento para la determinación de compuestos fenólicos totales de las muestras La determinación se efectuó por triplicado. Se tomó 5 ml de la solución etanólica de resinas (proveniente del ensayo 3.5.1) de cada propóleo y se completó a un volumen de 100 mL con agua destilada. Se realizaron las diluciones necesarias y se agregaron 100 µL de la solución a un tubo eppendorf, seguido de 100 µL del reactivo de Folin-Ciocalteu. Luego se agitaron suavemente y se dejaron en reposo durante 2 min. Se añadieron 800 µL de la solución de carbonato de sodio y se calentaron en un baño termorregulado a 50 °C durante 20 min. Finalmente se colocaron las soluciones en cubetas de cuarzo y se leyeron las A en un espectrofotómetro a 740 nm contra un blanco preparado en las mismas condiciones. Los valores de A obtenidos, se interpolaron en la curva de calibración, y se obtuvieron las concentraciones de compuestos fenólicos totales, expresadas como equivalentes de ácido gálico. El resultado (g/100) se enunció como el promedio de las determinaciones ± d.s. (Cicco et al., 2009). 3.9.- Determinación del porcentaje de cenizas en las muestra de propóleo en bruto Las muestras evaluadas provienen del ensayo 3.2.1, es decir son muestras de propóleos en bruto previamente sometidas a calentamiento a 100°C durante 2 h. 3.9.1. Procedimiento La determinación se efectuó por triplicado. A la muestra, se le agregó ácido sulfúrico al 98% y se quemó en un mechero bajo campana para eliminar elementos orgánicos, según farmacopea. Luego se llevó a un horno de mufla, y se incineró a 550 °C ± 25 °C, hasta obtener las cenizas. A continuación se dejó enfriar en un desecador hasta que alcanzó la temperatura ambiente, para luego masarlas hasta obtener masa constante (no difieren entre sí en más de 5 mg). El resultado se expresó como el promedio de las determinaciones ± d.s. (según Norma Argentina IRAM-INTA., 2008). 19 MATERIALES Y MÉTODOS 3.9.2. Cálculos - Se calculó el porcentaje de cenizas (C), mediante la fórmula siguiente: ( ) ( ) Dónde: C = Porcentaje cenizas (g/100 g) CZ = Masa de la cápsula con cenizas (g) CPh = Masa de la cápsula con la muestra húmeda (g) m = Masa de la cápsula (g) 4. Determinación de los perfiles cromatográficos de los diferentes extractos de propóleos, por cromatografía en capa fina (c.c.f.) Se realizó un análisis cualitativo mediante c.c.f. de los distintos extractos preparados (globales y seriados, provenientes del punto 2.2.1) de los cinco propóleos en estudio, con el objetivo de determinar la probable presencia de familias de compuestos frecuentemente descritos en los propóleos como fenoles, triterpenoides y esteroides, entre otros. Las cromatografías fueron desarrolladas en cromatofolios de aluminio con Sílica gel 60 F254, empleando como fase móvil una mezcla de hexano, acetato de etilo y ácido acético glacial (60:40:1). Los cromatofolios fueron visualizados a luz ultravioleta a las longitudes de onda 254 y 365 nm y reveladas con los siguientes reactivos (Wagner & Bladt, 1996): - Liebermann-Burchard (5 mL de anhídrido acético, 5 mL de ácido sulfúrico concentrado y 50 mL de etanol absoluto). Los cromatofolios rociados con este reactivo fueron 20 MATERIALES Y MÉTODOS calentados a 100°C por 2 min y observados al visible. Este revelador permitió detectar la posible presencia de triterpenos, monoterpenos, sesquiterpenos, diterpenos y esteroides. - Natural products (NP) (2-aminoetil difenilborinato al 1% en metanol). Los cromatofolios rociados con este reactivo fueron observados a luz UV a una longitud de onda de 365 nm. Este reactivo permitió detectar la posible presencia de flavonoides, otros ácidos fenólicos y cumarinas. - P-anisaldehído sulfúrico (0,5 mL de anisaldehído, 10 mL ácido de acético glacial, 85 mL de etanol y 5 mL de ácido sulfúrico concentrado). Los cromatofolios rociados con este reactivo fueron calentados a 100°C por 2 min y observados al visible. Este reactivo permitió detectar la posible presencia de triterpenoides, saponinas y aceites esenciales. 5. Determinación de la actividad antiinflamatoria tópica in vivo 5.1. Procedimiento Los ensayos fueron llevados a cabo empleando ocho ratones tratados con cada extracto a evaluar y dieciséis animales controles, ambos de la cepa CF1 (ratones albinos suizos) de 20-25 g. Se aplicaron 10 µL de la muestra en la parte interna de la oreja derecha del ratón y 10 µL en la parte externa, como se puede observar en la figura 10, mientras que en la oreja izquierda se aplicó sólo el vehículo de la muestra. Luego de 5 min se aplicó en la oreja derecha el agente inflamatorio, AA o TPA, a la dosis de 2 mg/oreja y 5 µg/oreja, respectivamente (Lloret y Moreno, 1955). Los fármacos de referencia que se utilizaron son nimesulida para el AA e indometacina para el TPA. Una hora después de aplicado el AA o 6 horas después de aplicado el TPA los animales se sacrificaron por dislocación cervical y a continuación se les extrajo a cada ratón un disco de 6 21 MATERIALES Y MÉTODOS mm de diámetro de ambas orejas como se aprecia en la figura 11. La magnitud del edema fue determinada mediante la diferencia del peso de la oreja derecha respecto de la izquierda. La actividad antiinflamatoria de las muestras fueron calculadas comparando la mediana de los pesos de los edemas producidos en los animales controles y en los tratados con la muestra. El manejo estadístico de los datos para determinar la significancia de los efectos antiinflamatorios (EAI) de las muestras, fue a través del método no paramétrico para datos independientes, Mann-Whitney y la significancia estadística de todos los grupos fue evaluada usando el test Kruskall-Wallis. Las diferencias serán consideradas significativas para un p ≤ 0,05. Este ensayo fue realizado en la Unidad de pruebas Biológicas del Instituto de Salud Pública (ISP), el cual cumple con las normas internacionales de mantención de animales de experimentación. En donde los modelos biológicos fueron mantenidos en instalaciones debidamente certificadas y los ensayos realizados se ajustaron a los principios éticos contenidos en las “Normas Internacionales en investigación Biomédicas que involucra el uso de animales”. De acuerdo a las normas internacionales de bioética animal, se debe utilizar el mínimo de animales necesarios para obtener resultados válidos, aplicando siempre el principio de las 3 Rs (Remplazar animales por otro sistema, Reducir número de animales y Refinar el trato del animal). Debido a esto, se calculó estadísticamente el número de animales necesitados para este ensayo, resultando que 8 es el número mínimo de ratones requeridos a intervenir, suficientes para obtener resultados estadísticamente significativos. 22 MATERIALES Y MÉTODOS 5.2. Imágenes Figura 10: Ratón identificado y con la muestra de propóleo aplicada Figura 11: Sacabocados y discos de orejas de 6 mm 23 RESULTADOS Y DISCUSIONES V. i. RESULTADOS Y DISCUSIONES Preparación de los extractos globales y seriados Los resultados de los rendimientos (Rd) de los extractos globales y seriados preparados, se expresan en la tabla 1 para los propóleos de Cajón del Maipo (CM), Caleu (CA), Curacaví (CV), Buin (B) y Pirque (P). Tabla 1: Rendimientos de los diferentes extractos de propóleos Propóleo Rd EEG Rd ESH Rd ESD Rd ESE CM 23,5 % 0,1 % 87,3 % 1,9 % CA 20,5 % 3,6 % 89,1 % 4,0 % CV 26,0 % 0,2 % 84,8 % 6,1 % B 33,0 % 0,3 % 62,0 % 19,6 % P 31,5 % 0,2 % 69,2 % 7,4 % Al observar los resultados, respecto a los extractos seriados, notamos que los rendimientos de los ESH son similares (a excepción del propóleo de Caleu) y muy bajos, esto último podría deberse a que hubo un proceso previo de descerado, el cual pudo arrastrar parte de los compuestos apolares. También podemos resaltar que dentro de los extractos seriados, el mejor rendimiento es para el ESD, luego le sigue el ESE y en último lugar el ESH. Finalmente se pudo apreciar que los Rd de los todos los EEG son relativamente similares entre ellos. 24 RESULTADOS Y DISCUSIONES ii. Control de calidad fisicoquímica de acuerdo con la Norma Argentina IRAM-INTA (2008) 1. Características sensoriales del propóleo en bruto Se expresan a continuación los resultados de las características sensoriales evaluadas para los propóleos, junto a las fotografías de los propóleos en bruto de CM, CA, CV, B y P (figuras 12, 13, 14,15 y 16, respectivamente). - Propóleo Cajón de Maipo Color: Anaranjado y distintas tonalidades de café Olor: Dulce suave Sabor: insípido Consistencia: Maleable, granulado y poco pegajoso Figura 12 Aspecto: homogéneo - Propóleo Caleu Color: café verdoso oscuro Olor: dulce suave y agradable Sabor: cera suave Consistencia: duro y rígido Figura 13 Aspecto: heterogéneo - Propóleo Curacaví Color: amarillo mostaza Olor: dulce muy intenso Sabor: cera suave Consistencia: duro, rígido y pegajoso Figura 14 Aspecto: heterogéneo 25 RESULTADOS Y DISCUSIONES - Propóleo Buin Color: café tierra Olor: dulce medianamente intenso Sabor: insípido Consistencia: maleable y pulverizado Figura 15 Aspecto: homogéneo - Propóleo Pirque Color: amarillo mostaza oscuro con zonas anaranjadas Olor: dulce suave y agradable Sabor: insípido Figura 16 Consistencia: rígido y pegajoso Aspecto: homogéneo 2. Determinación de la pérdida por calentamiento del propóleo en bruto Los resultados obtenidos en la determinación de humedad de las muestras de propóleos en bruto de CM, CA, CV, B y P se observan a continuación en la tabla 2. Tabla 2: Pérdida por calentamiento de los propóleos en bruto Propóleo H1 H2 H3 H CM 2,8 % p/p 2,9 % p/p 3,0 % p/p 2,9 % p/p ± 0,1 CA 2,3 % p/p 1,9 % p/p 2,1 % p/p 2,1 % p/p ± 0,2 CV 1,9 % p/p 2,0 % p/p 2,1 % p/p 2,0 % p/p ± 0,1 B 2,9 % p/p 3,5 % p/p 2,7 % p/p 3,0 % p/p ± 0,4 P 0,87 % p/p 0,92 % p/p 0,75 % p/p 0,85 % p/p ± 0,1 26 RESULTADOS Y DISCUSIONES Según los requisitos de calidad exigidos por la norma Argentina utilizada, IRAM-INTA 15935-1 (2008), la perdida por calentamiento tiene un máximo de 10% (10g/100g). Teniendo en cuenta el requisito de la norma, los cinco propóleos cumplen con este criterio, mostrando resultados bastante similares entre ellos, exceptuando al de Pirque que obtuvo un resultado mucho menor. Este análisis es importante debido a que si las muestras poseen una humedad excesiva, se favorece el desarrollo de mohos y levaduras, además de fermentaciones que generan productos no deseados y toxinas perjudiciales para el organismo (Palomino et al., 2010). Propóleos de Argentina sometidos al mismo procedimiento han obtenido resultados entre 1,4% y 6,2% (Tosi et al., 2006), siendo semejantes o incluso un poco más elevados, que los valores obtenidos por los propóleos evaluados en este trabajo. Lo mismo sucede si comparamos nuestros resultados con propóleos de Brasil, los cuales han obtenido porcentajes de humedad entre 3,4% y 5,4% (Días et al., 2012). 3. Determinación del índice de oxidación Los resultados de la determinación del índice de oxidación de las muestras de propóleos en bruto de CM, CA, CV, B y P, se enuncian en la tabla 3. Tabla 3: Índice de oxidación de los propóleos en bruto Propóleo Tpo. Decoloración 1 Tpo. Decoloración 2 Tpo. Decoloración 3 I. Oxidación CM 3,0 s 3,7 s 4,6 s 3,7 s ± 0,8 CA 11,6 s 13,3 s 18,6 s 14,5 s ± 3,7 CV 2,6 s 2,9 s 1,6 s 2,4 s ± 0,7 B 8,3 s 8,2 s 9,2 s 8,6 s ± 0,6 P 4,31 s 3,12 s 2,66 s 3,36 s ± 0,9 Según los requisitos de calidad exigidos, de acuerdo con la norma IRAM-INTA 15935-1 (2008), el tiempo máximo de decoloración de las muestras es de 22 s, por lo tanto, todas las 27 RESULTADOS Y DISCUSIONES muestras de propóleos evaluadas cumplen con esta exigencia, siendo el de Curacaví el más bajo y el de Caleu el más alto. Este tipo de análisis es utilizado para determinar la capacidad reductora de las muestras, permitiendo tener una estimación del efecto antioxidante de los propóleos (Salamanca et al., 2007) y por lo tanto, indicando la posible presencia de compuestos de naturaleza fenólica, o con grupos funcionales oxidables (hidroxilos, insaturaciones, entre otras). (Palomino et al., 2010). Sin embargo, este método es cualitativo y bastante subjetivo, dependiendo dentro de muchas cosas de la capacidad visual del analista. Tosi et al. (2006) evaluaron el índice de oxidación de propóleos argentinos y obtuvieron resultados entre 16 y 21 s, los cuales son bastante más elevados que los obtenidos por los propóleos evaluados en este trabajo; mientras que propóleos colombianos obtuvieron un rango de valores entre 2,1 s. y 19,2 s., siendo más cercanos a nuestros resultados (Salamanca et al., 2007). 4. Determinación del porcentaje de sustancias extraíbles en n-hexano A continuación se visualizan los resultados obtenidos en la determinación de sustancias extraíbles con n-hexano, para las muestras de CM, CA, CV, B y P, por medio de la tabla 4. Tabla 4: Sustancias extraíbles en n-hexano de los propóleos Propóleo SE 1 SE 2 SE 3 SE CM 27,7 % p/p 24,8 % p/p 29,7 % p/p 27,4 % p/p ± 2,5 CA 25,9 % p/p 26,4 % p/p 27,9 % p/p 26,7% p/p ± 1,0 CV 21,7 % p/p 19,3 % p/p 20,1 % p/p 20,4 % p/p ± 1,2 B 25,0 % p/p 25,6 % p/p 23,0 % p/p 24,5 % p/p ± 1,4 P 24,9 % p/p 22,9 % p/p 21,7 % p/p 23,2 % p/p ± 1,6 28 RESULTADOS Y DISCUSIONES Según la norma IRAM-INTA 15935-1 (2008), el máximo de sustancias extraíbles con nhexano es de un 35% y de acuerdo a los resultados presentados en las tablas, todas las muestras de propóleo estudiadas cumplen con este parámetro de calidad. El resultado menor es el de Curacaví y el mayor es el de Cajón del Maipo. Una gran cantidad de sustancias extraídas con solventes apolares como es el hexano, indica un gran contenido de ceras en el propóleo (Palomino et al., 2010). Teniendo presente que los componentes bioactivos de los propóleos no se encuentran en las ceras, desde el punto de vista terapéutico, sería ideal que éstos tengan un bajo contenido de ceras y un mayor contenido de resinas. Además es importante mencionar, que el contenido de ceras está determinado por la época del año en donde se extrajo el propóleo y el procedimiento de cosecha (Palomino et al., 2010; Woisky & Salatino, 1998). Al evaluar nuestros resultados, podemos determinar que las diferentes muestras de propóleos poseen una baja cantidad de cera y además, los resultados son muy parecidos entre sí, demostrando cierta similitud entre los distintos tipos de propóleos en este aspecto. Finalmente, investigaciones en propóleos argentinos obtuvieron valores entre 27,1% y 33,2% para este parámetro (Tosi et al., 2006), resultando ser levemente superiores a los propóleos chilenos evaluados en este trabajo. Mientras que el porcentaje de ceras extraídas con hexano, para un propóleo de Antioquia, Colombia (72,32%) (Palomino et al., 2010) fue considerablemente más alto. 5. Determinación del porcentaje de resinas Por medio de la tabla 5 se expresan los resultados de la determinación de resinas para los propóleos de CM, CA, CV, B y P. 29 RESULTADOS Y DISCUSIONES Tabla 5: Porcentajes de resinas de los propóleos Propóleo R1 R2 R3 R CM 55,8 % p/p 58,6 % p/p 55,8 % p/p 56,7 % p/p ± 1,6 CA 65,2 % p/p 65,9 % p/p 73,1 % p/p 68,1 % p/p ± 4,4 CV 82,3 % p/p 82,3 % p/p 82,3 % p/p 82,3 % p/p ± 0,0 B 72,8 % p/p 70,0 % p/p 73,2 % p/p 72,0 % p/p ± 1,7 P 75,2 % p/p 84,4 % p/p 76,6 % p/p 78,7 % p/p ± 5,0 Según los requisitos de calidad exigidos por la norma IRAM-INTA 15935-1 (2008), el contenido mínimo de resinas para los propóleos es de un 35% p/p y todas las muestras analizadas están por sobre ese valor, cumpliendo satisfactoriamente con este requisito. Es importante saber que cuanto mayor sea el valor de esta fracción, mejor será el propóleo en términos de rendimiento farmacológico y mejor será la calidad del producto final, puesto que es allí donde se encuentran los compuestos con actividad biológica, tal como se mencionó anteriormente (Palomino et al., 2010). En este parámetro notamos que existe una mayor variabilidad de los resultados, donde los valores más altos son para los propóleos de Curacaví y Pirque, que de acuerdo a lo mencionado anteriormente, serían las muestras con mejor rendimiento. Si comparamos nuestros resultados con los obtenidos en un estudio argentino (40,1% – 61,2%) (Tosi et al., 2006) y uno colombiano (14,08%) (Palomino et al., 2010), realizados de la misma forma, podemos apreciar que nuestros valores son considerablemente más elevados que el de los otros propóleos. 6. Determinación del porcentaje de impurezas mecánicas Los resultados de la determinación de impurezas mecánicas para los propóleos de CM, CA, CV, B y P, se expresan en la tabla 6. 30 RESULTADOS Y DISCUSIONES Tabla 6: Impurezas mecánicas de los propóleos Propóleo IM 1 IM 2 IM 3 IM CM 9,0 % p/p 9,4 % p/p 8,4 % p/p 8,9 % p/p ± 0,5 CA 14,7 % p/p 14,6 % p/p 14,7 % p/p 14,7 % p/p ± 0,1 CV 4,6 % p/p 4,6 % p/p 4,6 % p/p 4,6 % p/p ± 0,0 B 14,3 % p/p 15,2 % p/p 13,9 % p/p 14,5 % p/p ± 0,7 P 2,8 % p/p 2,5 % p/p 3,1 % p/p 2,8 % p/p ± 0,3 Según los requisitos de calidad exigidos por la norma IRAM-INTA 15935-1 (2008), el contenido máximo de impurezas mecánicas permitido es de 25 %. De acuerdo a esto, todas las muestras cumplen con esta exigencia. Al igual que las ceras, las impurezas mecánicas no contienen principios activos y su elevada presencia disminuyen la potencial eficacia terapéutica del propóleo (Palomino et al., 2010). Por otra parte, se ha relacionado este parámetro con el método de extracción por raspaje de los bastidores y otras partes de la colmena, donde las muestras de propóleo recolectadas se podrían contaminar con impurezas (Casanova, 2009). Los resultados más bajos son para los propóleos de Curacaví y Pirque, mientras que el resultado más alto es para el de Caleu, pero a pesar de eso no sobrepasa lo exigido como máximo según la norma utilizada. Finalmente, podemos concluir que los resultados obtenidos en este ensayo, muestran que los propóleos chilenos analizados presentan menos impurezas mecánicas que los propóleos argentinos (20,0% - 21,8%) (Tosi et al., 2006) y un porcentaje similar a un propóleo de Colombia (10,47%) (Palomino et al., 2010). 31 RESULTADOS Y DISCUSIONES 7. Determinación de flavonoides mediante la reacción colorimétrica con tricloruro de aluminio En la figura 17 se presenta la curva de calibración de quercetina, en la cual se interpolan las absorbancias obtenidas en el ensayo, de las distintas muestras de propóleos, con el fin de obtener la concentración de flavonoides expresados como equivalentes de quercetina. Absorbancia vs. Concentración (µg/mL) de Quercetina 0,8 0,7 y = 0,1087x - 0,002 R² = 0,9964 Absorbancia 0,6 0,5 A = 0,1087xC - 0,002 R2 = 0,9964 0,4 0,3 0,2 0,1 0 0 1 2 3 4 5 6 7 µg/mL Figura 17: Curva calibración de quercetina Los resultados de las concentraciones de flavonoides expresadas como equivalentes de quercetina, para los distintos propóleos, se detallan en la tabla 7. Tabla 7: Concentraciones de flavonoides de los propóleos Cajón del Maipo Caleu Curacaví Buin Pirque C1 (g/100g) 0,46 0,37 0,89 3,65 0,76 C2 (g/100g) 0,54 0,30 0,85 4,08 0,93 C3 (g/100g) 0,51 0,28 0,93 3,51 0,85 Concentraciones equivalentes de quercetina 0,50 % ± 0,04 0,32 % ± 0,05 0,89 % ± 0,04 3,75 % ± 0,30 0,85 % ± 0,09 Según los requisitos de calidad exigidos, de acuerdo con la norma IRAM-INTA 15935-1 (2008), la mínima cantidad de flavonoides presentes en las muestras debe ser un 1% y 32 RESULTADOS Y DISCUSIONES observamos que la mayoría de los propóleos evaluados están por debajo de lo requerido, a excepción de Buin, que alcanza un valor mucho más elevado. Se puede considerar que los flavonoides están conformados por una estructura básica derivada de la fenilcromona, que consiste en 2 anillos bencénicos en los extremos de la molécula, unidos por un anillo de 3 átomos de carbono, la cual puede contener varias moléculas de OH como sustituyentes (figura 18). Gracias a su estructura es que se le atribuyen sus distintas propiedades, principalmente el efecto antioxidante (Bedascarrasbure et al., 2004). Figura 18: Estructura base de los flavonoides Si comparamos nuestros resultados con los obtenidos por propóleos colombianos (0,52% - 3,25%), notamos que los valores de ambos trabajos son muy similares (Salamanca et al., 2007), al igual que los obtenidos por los propóleos de Brasil (0,77% - 2,69%) (Woisky & Salatino, 1998). Mientras que resultados de propóleos de Argentina son bastante superiores a todos los anteriores (3,61% - 12,28%) (Bedascarrasbure et al., 2004). Debemos resaltar que según la metodología establecida por la norma argentina, sólo se pueden determinar flavonas y flavonoles, ya que éstos desde el punto de vista reactivo, pueden formar complejos estables con el tricloruro de aluminio y así ser susceptibles de analizar mediante espectrofotometría ultravioleta-visible; pero no así las flavanonas, las cuales se deben determinar por otro método (2-4 dinitrofenilhidrazina) (Salamanca et al., 2007). También es importante destacar que al analizar los resultados de numerosos estudios, los propóleos en general, describen grandes diferencias con respecto a la cantidad de flavonoides presentes y esto se atribuye en parte, a que las muestras son de distintas zonas geográficas (distinta vegetación circundante a la colmena), lo que sustenta la necesidad de estandarizar los diferentes tipos de propóleos (Bedascarrasbure et al., 2004). 33 RESULTADOS Y DISCUSIONES 8. Determinación de compuestos fenólicos totales mediante el método de microfolin En la figura 19 se ilustra la curva de calibración de ácido gálico, en la cual se interpolan las absorbancias obtenidas en el ensayo, con el fin de obtener la concentración de compuestos fenólicos totales, expresados como equivalentes de ácido gálico. Absorbancia vs. Concentración de ácido gálico 0,8 Absorbancia 0,7 0,6 0,5 A = 0,1044xC + 0,0088 R2 = 0,9995 0,4 y = 0,1044x + 0,0088 R² = 0,9995 0,3 0,2 0,1 0,0 0 1 2 3 4 5 6 7 8 μg /mL Figura 19: Curva calibración de ácido gálico Los resultados de las concentraciones de compuestos fenólicos totales, expresadas como equivalentes de ácido gálico para los distintos propóleos se detallan en la tabla 8. Tabla 8: Concentraciones de compuestos fenólicos totales Cajón del Maipo Caleu Curacaví Buin Pirque C1 (g/100g) 14,45 14,64 22,24 20,15 19,10 C2 (g/100g) 14,50 14,79 23,23 23,54 19,18 C3 (g/100g) 16,80 12,82 24,49 21,73 21,41 Concentraciones equivalentes de ácido gálico 15,25 % ± 1,34 14,08 % ± 1,10 23,32 % ± 1,13 21,80 % ± 1,70 19,90% ± 1,31 Según la norma Argentina IRAM-INTA 15935-1 (2008), el contenido mínimo de compuestos fenólicos que deben contener las muestras es de 5 %, según esto podemos observar que todas las muestras superan con mucha diferencia esta exigencia, donde el valor más bajo es de un 14,1 % para el propóleo de Caleu y el más alto es de un 23,3 %, para el de Curacaví, no 34 RESULTADOS Y DISCUSIONES existiendo grandes diferencias entre todos las muestras. Cabe destacar que nuestros resultados son semejantes a los obtenidos por propóleos argentinos (13,7 - 21,3 %) (Bedascarrasbure et al., 2004) y un poco superiores a los de Brasil (8,8 - 13,7 %) (Woisky & Salatino, 1998). Dentro de los compuestos fenólicos más estudiados presentes comúnmente en el propóleo se encuentra el feniletil éster del ácido cafeico (CAPE), a este compuesto se le han atribuido diversas propiedades farmacológicas, destacándose: el efecto antiinflamatorio, al inhibir la actividad de la COX de manera dosis dependiente (Rossi et al., 2002); el efecto antitumoral al fomentar la apoptosis celular, detener el ciclo celular y reducir la angiogénesis (Jing Wu et al., 2011); y el efecto hipoglicemiante, al aumentar la recaptación de la glucosa, e incrementar la sensibilidad de las células por la insulina (Soo Lee et al., 2007). 9. Determinación del porcentaje de cenizas en las muestras de propóleo en bruto Los resultados obtenidos en la determinación de cenizas, para los propóleos de CM, CA, CV, B y P, se detallan a continuación, en la tabla 9. Tabla 9: Porcentajes de cenizas de los propóleos Propóleo C CM 1,5 % p/p 1,5 % p/p 1,5 % p/p 1,5 % p/p ± 0,0 CA 1,8 % p/p 1,9 % p/p 1,8 % p/p 1,8 % p/p ± 0,1 CV 1,3 % p/p 1,4 % p/p 1,6 % p/p 1,4 % p/p ± 0,2 B 3,2 % p/p 3,2 % p/p 3,2 % p/p 3,2 % p/p ± 0,0 P 1,08 % p/p 1,09 % p/p 1,05 % p/p 1,07 % p/p ± 0,02 1 C 2 C 3 C Según los requisitos de calidad exigidos, de acuerdo con la norma IRAM-INTA 15935-1 (2008), el contenido máximo de cenizas permitido es de 5 %. Al observar los resultados obtenidos, vemos que todas las muestras de propóleos analizadas cumplen con este requisito. 35 RESULTADOS Y DISCUSIONES También podemos observar que los resultados son bastante parecidos, exceptuando a Buin que es el que presenta la mayor cantidad de cenizas. Las cenizas son el residuo inorgánico del propóleo y su medición sirve para determinar, en parte, si las muestras de propóleo han sido adulteradas con algún material como es la arcilla, ya que, el porcentaje de cenizas se dispara a valores muy superiores (Woisky & Salatino, 1998). Finalmente, si comparamos nuestros resultados con los obtenidos por propóleos de Argentina (1,8% - 2,4%) (Tosi et al., 2006) y propóleos de Brasil (1,6% - 2,2%) (Días et al., 2012), podemos observar que los resultados son bastante similares entre ellos, a excepción del propóleo de Buin que obtuvo un valor levemente superior al resto. iii. Determinación de los perfiles cromatográficos de los diferentes extractos de propóleos, por cromatografía en capa fina (c.c.f.) En las Figuras 20, 21 y 22, podemos observar los cromatogramas de los distintos extractos de los propóleos en estudio, al ser revelados con distintos reactivos. Cada extracto presentó un perfil cromatográfico diferente lo que se evidenció en el número, color e intensidad de las manchas y las polaridades de los compuestos presentes (en la sílica gel los compuestos polares quedan retenidos en la fase estacionaria, por lo tanto sus Rf o factor de retención son menores). 36 RESULTADOS Y DISCUSIONES 1. c.c.f. reveladas con el reactivo Liebermann-Burchard y observadas al visible EEG ESH ESD EEG ESE A ESH ESD ESE EEG ESH B ESH D ESD ESE C EEG EEG ESD ESH ESD ESE ESE E Figura 20: c.c.f. reveladas con el reactivo Liebermann-Burchard y observadas al visible, A. Propóleo Caleu; B. Propóleo Cajón del Maipo; C. Propóleo Curacaví; D. Propóleo Buin; E. Propóleo Pirque EEG: Extracto etanólico global, ESH: Ext. Seriado de hexano, ESD: Ext. Seriado de diclorometano, ESE: Ext. Seriado de etanol 37 RESULTADOS Y DISCUSIONES Algunos compuestos como monoterpenos, sesquiterpenos, diterpenos, triterpenos y esteroides se colorean de café oscuro y gris claro con este revelador (Wagner & Bladt, 1996). En las c.c.f. realizadas los colores más observados son café, rojos y amarillos, pudiendo existir compuestos que son parte de alguna de las familias mencionadas. En la figura 20, los perfiles cromatográficos con mayores similitudes se observan entre los cromatogramas de los propóleos de Caleu (A) y Cajón del Maipo (B), ya sea al comparar los EEG o los extractos seriados. Por el contrario, los perfiles cromatográficos del resto de los propóleos: propóleo de Curacaví (C), propóleo de Buin (D) y propóleo de Pirque (E), son muy diferentes, tanto para los EEG, como para los extractos seriados. 38 RESULTADOS Y DISCUSIONES 2. c.c.f. reveladas con el reactivo Natural products y observadas a la luz UV-365 nm EEG ESH ESD ESE EEG ESH A ESD ESE EEG ESH B EEG ESH ESD D ESE ESD ESE C EEG ESH ESD ESE E Figura 21: c.c.f. reveladas con el reactivo NP y observadas a la luz UV-365 nm, A. Propóleo Caleu; B. Propóleo Cajón del Maipo; C. Propóleo Curacaví; D. Propóleo Buin; E. Propóleo Pirque EEG: Extracto etanólico global, ESH: Ext. Seriado de hexano, ESD: Ext. Seriado de diclorometano, ESE: Ext. Seriado de etanol 39 RESULTADOS Y DISCUSIONES En las CCF realizadas, encontramos marcadas fluorescencias verdes, azules y anaranjadas. Según la literatura (Wagner & Bladt, 1996), los siguientes compuestos presentan fluorescencias al UV- 365 tras la revelación con NP, pudiendo estar presentes en los extractos evaluados: Antronas y antranoles : Amarillos fluorescentes intensos Glicósidos flavónicos : Naranjo, verde y azules Cumarinas y ácido fenol carboxílico : Azules intensos, azules verdosos Ácidos fenólicos (ácido cafeico) : Azules Flavonoles (quercetina, miricetina, camferol) : Amarillo anaranjado, amarillo verdoso Flavonas (apigenina, luteolina) : Naranjo, amarillo verdoso En los cromatogramas de la figura 21, existe cierta similitud de los perfiles cromatográficos entre los EEG y los extractos seriados del propóleo de Curacaví (C) y el de Buin (D), por el contrario, hay grandes diferencias en los perfiles cromatográficos del resto de los propóleos: propóleo de Caleu (A), propóleo de Cajón del Maipo (B) y propóleos de Pirque (E), tanto para los EEG, como para los extractos seriados. 40 RESULTADOS Y DISCUSIONES 3. c.c.f. reveladas con el reactivo ρ-anisaldehído sulfúrico y observadas al visible EEG ESH ESD EEG ESE A ESH ESD EEG ESE B EEG ESH ESD D ESE ESH ESD ESE C EEG ESH ESD ESE E Figura 22: c.c.f. reveladas con el reactivo p-anisaldehído sulfúrico y observadas al visible, A. Propóleo Caleu; B. Propóleo Cajón del Maipo; C. Propóleo Curacaví; D. Propóleo Buin; E. Propóleo Pirque EEG: Extracto etanólico global, ESH: Ext. Seriado de hexano, ESD: Ext. Seriado de diclorometano, ESE: Ext. Seriado de etanol 41 RESULTADOS Y DISCUSIONES En los cromatogramas se destacan principalmente las coloraciones amarillas, naranjas, verdes y azules. Según la literatura (Wagner & Bladt, 1996) los siguientes compuestos presentan coloraciones tras la revelación con ρ-anisaldehído sulfúrico, pudiendo estar presentes en los extractos evaluados: Terpenos : Rojos violetas, café rojizo, azul verdoso, azul y grises Aceites esenciales : Azul intenso, verde, rojos y café. Saponinas : Azules, azules violetas, rojas, amarillos cafesoso. Triterpenos : Azul violeta, rojo violeta En las cromatografías de la figura 22, se observa con mayor claridad las diferencias de los perfiles cromatográficos de los EEG y los distintos extractos seriados, de los diferentes propóleos, en comparación con los cromatogramas revelados con los reveladores LiebermannBurchard y NP. 42 RESULTADOS Y DISCUSIONES A continuación, en la tabla 10, se identifican las familias de compuestos que posiblemente están presentes en los propóleos evaluados, tras la observación de los distintos cromatogramas obtenidos por c.c.f. Tabla 10: Posible perfil químico de los propóleos según c.c.f. Familia de compuestos vs. reveladores usados Terpenos con LB (café) y PS (rojo violeta) Glicósidos flavónicos con NP (naranjo, verde y azul) Flavonoles con NP (amarillo anaranjado) Flavonas con NP (naranjo) Ácidos fenólicos con NP (azules) Cumarinas con NP (azul intenso) Aceites esenciales con PS (azul intenso) Propóleo Caleu Propóleo Cajón del Maipo Propóleo Curacaví Propóleo Buin Propóleo Pirque + + + ++ ++ ++ + + ++ ++ + ++ + + +++ ++ +++ ++ + + + ++ LB: reactivo Liebermann-Burchard; NP: reactivo Natural products; PS: reactivo ρ-anisaldehído sulfúrico A modo general, las diferencias en los perfiles cromatográficos demuestran la diversidad en la composición química de cada uno de los propóleos, lo que puede ser explicado en gran parte, por las distintas vegetaciones circundantes a la colmena. Es importante mencionar que a pesar de que los propóleos analizados corresponden a un área geográfica relativamente pequeña, la composición química de los propóleos es diversa. Este hecho refleja la diversidad florística presente en las zonas de donde se recolectaron los propóleos. 43 RESULTADOS Y DISCUSIONES iv. Determinación de la actividad antiinflamatoria tópica in vivo En la tabla 11 se detallan los resultados del efecto antiinflamatorio (EAI) de los EEG de los distintos propóleos y se comparan con los resultados obtenidos en el ensayo in vitro de actividad antioxidante ORAC (Oxygen radical absorbance capacity), el cual se realizó en el marco de una tesis de doctorado en el mismo laboratorio (Actividad antioxidante, compuestos fenólicos y calidad de propóleos de la región metropolitana de Chile). Además se pretende relacionar ambos efectos terapéuticos con las concentraciones de flavonoides y compuestos fenólicos totales, obtenidas por las muestras. Tabla 11: Actividad antiinflamatoria de los EEG vs. el contenido de flavonoides, fenoles totales y actividad antioxidante AA TPA Dosis oreja Medio de dilución % EAI ± SEM % EAI ± SEM Conc. Flav. % p/p ± d.s. Conc. Fenol. % p/p ± d.s. Índice ORAC EEG Curacaví 3mg/oreja Etanol 57,8 ± 3,9 * 62,6 ± 3,7 * 0,89 ± 0,04 46,63 ± 2,26 2,7 ± 0,1 EEG Cajón Maipo 3mg/oreja Etanol 21,5 ± 11,1* 51,2 ± 4,3 * 0,50 ± 0,04 30,50 ± 2,69 2,4 ± 0,1 EEG Buin 3mg/oreja Etanol 58,7 ± 6,5 * 54,5 ± 4,5 * 3,75 ± 0,30 43,61 ± 3,40 3,3 ± 0,1 EEG Caleu 3mg/oreja Etanol 8,1 ± 7,9 49,5 ± 3,2 * 0,32 ± 0,05 28,16 ± 2,20 3,5 ± 0,1 Etanol 33,2 ± 8,7 * 53,1± 5,8 * 0,85 ± 0,09 39,79 ± 2,62 2,9 ± 0,1 Acetona 48,8 ± 4,0* EEG Pirque 3mg/oreja Nimesulida 1mg/oreja Indometacina 0,5 mg/oreja Acetona 92,9 ± 3,2* : Máximo efecto; * Resultado significativo con un p ≤ 0,05; AA: Ácido Araquidónico; TPA: 13-acetato de 12tetradecanoilforbol; EAI: Efecto antiinflamatorio; SEM: Error estándar de la media; % p/p: Porcentaje peso/peso; d.s.: Desviación estándar; ORAC: Oxygen radical absorbance capacity; EEG: Ext. etanólico global. 44 RESULTADOS Y DISCUSIONES Si observamos los resultados nos damos cuenta que todos los EEGs de los propóleos estudiados presentaron actividad antiinflamatoria significativa al utilizar TPA como agente inflamatorio, donde el resultado mayor fue para el propóleo de Curacaví (62,6 % ± 3,7), el menor fue para el propóleo de Caleu (49,5 % ± 3,2) y ninguno superó el efecto alcanzado por el fármaco de referencia indometacina. En cambio, para la inflamación causada por AA, cuatro de los cinco propóleos mostraron actividad antiinflamatoria significativa, donde el valor más alto fue para el propóleo de Buin (58,7 % ± 6,5) y lo sigue de forma muy cercana el propóleo de Curacaví (57,8 % ± 3,9); ambos mostraron un efecto muy superior al fármaco de referencia nimesulida. De acuerdo a lo anterior podemos concluir que los EEGs de todos los propóleos presentaron actividad antiinflamatoria tópica in vivo, ya sea por la vía del TPA o por la vía del AA o por ambas. La utilización de dos agentes inflamatorios distintos fue muy relevante, ya que nos permitió dilucidar el posible mecanismo de acción de las muestras. Así, para aquellos extractos que presentaron actividad frente al AA podemos suponer que actuaron a nivel tanto de las COXs como de las LOXs, reduciendo principalmente la concentración de PGs, TXs y LTs. Además, como se sabe que la formación del edema es menor que con TPA y de corta duración, podemos suponer que este mecanismo es a través de las enzimas que se expresan constitutivamente en el organismo, como son la COX-1 (formadora de PGs), la LOX-5 (formadora de LTs) y la LOX-15 (formadora de lipoxinas). En cambio, el edema formado por el TPA es mayor, de duración más prolongada, y se observa un aumento considerable del TNF-α, esto nos permitiría suponer que el mecanismo es a través de las enzimas inducibles del proceso inflamatorio como son COX-2 y la óxido nítrico sintasa inducible (iNOS). (Gómez et al., 2011; Inoue et al., 1989). También podemos observar que las muestras que presentaron mayor efecto antiinflamatorio, ya sea vía AA o TPA, son los EEGs de los propóleos de Buin y Curacaví, siendo éstos los que presentaron mayor concentración de compuestos fenólicos (43,61% y 46,63%; respectivamente) y además, el propóleo de Buin fue el único que presentó un mayor contenido de flavonoides (3,75 %). Esto es un resultado esperado, ya que como se dijo anteriormente, estos compuestos son parte importante de las sustancias bioactivas del propóleo. 45 RESULTADOS Y DISCUSIONES Se sabe que los flavonoides poseen una gran variedad de propiedades farmacológicas entre las que se destaca la actividad antiinflamatoria, donde se han reportado efectos sobre la actividad inhibitoria de TNF-α en macrófagos, de algunos compuestos como luteolina, quercetina y luteolina 7-glucósido (Gómez et al., 2011). Además, se ha visto que la quercetina posee propiedades antioxidantes e inhibe el metabolismo del AA, evitando el incremento de PGE2 y en menor medida el de LTB4. (Fernández & Torres). Compuestos fenólicos como el ácido cafeico, ácido cumárico y el ácido ferúlico, pueden reducir la formación de importantes mediadores de la inflamación como la COX-1 y COX-2, e inhibir a la LOX-5 y la formación de óxido nítrico (NO), observándose una reducción de los edemas inducidos por TPA (Fernández & Torres). Uno de los componentes más estudiados del propóleo es el feniletil éster del ácido cafeico (CAPE), un potente inhibidor de la activación del factor nuclear kappa β (NF-kβ) (Shvarzbeyn & Huleihel, 2011). Estudios anteriores han reportados efectos antiinflamatorios de EEGs de propóleos, a través de la inhibición del gen de transcripción de la iNOS, producto de la inhibición del NF-kβ (Song et al., 2002). Por otro lado, se sabe que la actividad antioxidante está estrechamente relacionada con la actividad antiinflamatoria, ya que los radicales libres son ampliamente producidos cuando hay daño tisular, además de ser liberados al espacio extracelular por los leucocitos tras la exposición a agentes quimiotácticos, o por estimulación fagocitaria. También se ha comprobado que el incremento de las especies reactivas del oxígeno (EROs) está relacionado con la activación del FN-kB, el cual es muy importante en la inflamación, ya que controla la transcripción de genes que codifican la expresión de IL-1, TNF-α, citoquinas, factores de crecimiento, y la expresión de COX–2, iNOS y de la FLA2 (Fernández & Torres). De esta forma, uno de los EEG con mayor actividad antioxidante (mayor índice ORAC) fue el propóleo de Buin (3,3), el cual también demostró una gran actividad antiinflamatoria significativa frente a TPA y AA. Sin embargo, no siempre hubo una relación directa entre los resultados del ensayo ORAC y el EAI. 46 CONCLUSIÓN VI. CONCLUSIÓN Los extractos seriados con mayor rendimiento fueron los ESD, mientras que los de menor rendimiento fueron los ESH. Observando sólo las características organolépticas de los propóleos, ya es posible distinguir la influencia de la zona de recolección y por lo tanto, de la flora circundante, en la consistencia, aspecto, color, entre otros, de las muestras estudiadas. Las diferencias en los perfiles cromatográficos demuestran la diversidad en la composición química de cada uno de los propóleos lo que puede ser explicado en gran parte por la flora circundante a la colmena. Todos los propóleos evaluados, cumplen de forma muy prometedora la mayoría de los parámetros exigidos por la norma Argentina IRAM-INTA 15935-1 (2008). Con respecto al EAI, se acepta la hipótesis planteada, ya que todos los propóleos evaluados obtuvieron efectos antiinflamatorios tópicos in vivo frente a TPA o frente a AA, de forma significativa. El EAI de los EEGs de los propóleos fue directamente proporcional a la concentración de compuestos fenólicos totales y en cierta medida, a la concentración de flavonoides. La calidad de los propóleos chilenos es similar o incluso mejor que la de los propóleos colombianos, argentinos y brasileros. Esto es de gran importancia, ya que Argentina y Brasil son países cuya exportación de este producto apícola es elevada y reconocida internacionalmente. Finalmente esta memoria contribuyó a demostrar las propiedades antiinflamatorias tópicas de propóleos de la Región Metropolitana de Santiago de Chile. 47 REFERENCIAS VII. REFERENCIAS 1. Referencias Bibliográficas ALENCAR S., OLDONI T., CASTRO M., CABRAL I., COSTA-NETO C., CURY J., ROSALEN P., IKEGAKID M. Chemical composition and biological activity of a new type of Brazilian propolis: Red propolis. Journal of Ethnopharmacology 113: 278–283. Brasil, Junio 2007. ASTUDILLO A., PÉREZ-CHACON G., BALBOA M., y BALSINDE J. Arachidonic acid mobilization by stimuli of the innate immune response. Inmunología Vol. 28 (4): 182-192. España, Diciembre 2009. BEDASCARRASBURE E., MALDONADO L., ÁLVAREZ A. y RODRÍGUEZ E. Contenido de Fenoles y Flavonoides del Propóleos Argentino. Acta Farm. Bonaerense 23 (3): 369-72. Argentina, Abril 2004. CASANOVA G. Fundación para la Innovación Agraria (FIA). Resultados y Lecciones en Desarrollo de Productos a Base de Propóleos. Proyecto de Innovación en la IX Región de La Araucanía. Fundación para la Innovación Agraria. [en línea]. Chile, 2009. González G. [consulta: 26 septiembre 2012] CICCO N., LANORTE M., PARAGGIO M., VIGGIANO M., LATTANZIO V. A reproducible, rapid and inexpensive Folin–Ciocalteu micro-method in determining phenolics of plant methanol extracts. Microchemical Journal 91: 107–110. Italia, 2009. CONE J. Inflammation. The American Journal of Surgery 182: 558–562. U.S.A. Septiembre 2011. DIAS L., PEREIRA A., ESTEVINHO L. Comparative study of different Portuguese samples of propolis: Pollinic, sensorial, physicochemical, microbiological characterization and antibacterial activity. Food and Chemical Toxicology 50: 4246–4253. Brasil, 2012. FERNÁNDEZ F. & TORRES M. [consulta: 13 agosto 2012] Inflamación y Plantas medicinales. [en línea], [s.a]. FRANCO L., OSPINA L., MATIZ G., GAITAN R. Utilización del modelo de edema auricular inducido por TPA en la evaluación farmacológica de los cálices de physalis peruviana l. Scientia et Technica Año XIII, No 33: 0122-1701. Marzo 2007. GARCÍA P. Inflamación. IX Programa de Promoción de la Cultura Científica y Tecnológica. Rev.R.Acad.Cienc.Exact.Fís.Nat. Vol. 102, (1): 91-159. España, 2008. 48 REFERENCIAS GÓMEZ H., GONZÁLEZ K. y MEDINA J. Actividad Antiinflamatoria de Productos Naturales. Boletín Latinoamericano y del Caribe de Plantas Medicinales y Aromáticas vol. 10 (3): 182-217. Chile, Mayo 2011. HERRERA C., ALVEAR M., BARRIENTOS L., MONTENEGRO G., y SALAZAR L. The antifungal effect of six commercial extracts of Chilean propolis on Candida spp. Cien. Inv. Agr. 37(1):75-84. Chile, 2010. INOUE H., MORI T., SHIBATA S. y KOSHIHARA Y. Modulation by glycyrrhetinic acid derivatives of TPA-induced mouse ear oedema. Br. J. Pharmacology. 96:204-210. Japón, 1989. KALOGEROPOULOS N., KONTELES S., TROULLIDOU E., MOURTZINOS I., KARATHANOS V. Chemical composition, antioxidant activity and antimicrobial properties of propolis extracts from Greece and Cyprus. Food Chemistry 116: 452 – 461. Grecia, Febrero 2009. KOSALEC I., BAKMAZ M., PEPELJNJAK S. Analysis of propolis from the continental and Adriatic regions of Croatia. Acta Pharm. 53: 275–285. Croacia, Octubre 2003. LEE E., UHM K., LEE Y., HAN M., LEE M., PARK J., SUH P., PARK S., KIM H. CAPE (caffeic acid phenethyl ester) stimulates glucose uptake through AMPK (AMP-activated protein kinase) activation in skeletal muscle cells. Biochemical and Biophysical Research Communications 361: 854–858. Korea, Julio 2007. LLORET S. &. MORENO J. Effect of an anti-inflamatory peptide (Antiflammin 2) on cell influx, eicosanoid biosynthesis and oedema formation by arachidonic acid and tetradecanoylphorbol dermal application. Biochemical Pharmacology, Vol. 50 (3): 347-353. España, Marzo, 1995. MEDZHITOV R. Inflammation 2010: New Adventures of an Old Flame. Leading Edge. [en línea]. [consulta: 8 Noviembre 2012] MOHAMMADZADEH S., SHARRIATPANAHI M., HAMEDI M., AMANZADEH Y, SADAT S., NASSER S. Antioxidant power of Iranian propolis extract. Food Chemistry 103: 729 – 733. Iran, 2007a. MOHAMMADZADEH S., SHARIATPANAHI M., HAMEDI M., AHMADKHANIHA R., SAMADI N., NASSER S. Chemical composition, oral toxicity and antimicrobial activity of Iranian propolis. Food Chemistry 103: 1097–1103. 2007b. MURAKAWA M., YAMAOKA K., TANAKA Y., FUKUDA Y. Involvement of tumor necrosis factor (TNF)-α in phorbol ester 12-O-tetradecanoylphorbol-13-acetate (TPA)-induced skin edema in mice. Biochemical pharmacology 71: 1331– 1336. Japón 2006. 49 REFERENCIAS Norma Argentina, IRAM-INTA 15935-1 [en línea], primera edición 2008-06-20. Productos del Noroeste Argentino, Propóleos. Parte 1, Propóleos en bruto. ORSOLIC N. & BASIC I. Water-soluble derivative of propolis and its polyphenolic compounds enhance tumoricidal activity of macrophages. Journal of Ethnopharmacology 102: 37–45. Croacia, Mayo 2005. PACHECO A., DALEPRANE J., FREITAS V., FERDERBAR S., HIRABARA S., CUEVAS A., SAAVEDRA N., CURI R., ABDALLA D. y SALAZAR L. Efecto del Propóleos Chileno sobre el Metabolismo de Glucosa en Ratones Diabéticos. Int. J. Morphol., 29(3):754-761. Chile, 2011. PALOMINO G., LADY R.; GARCÍA P., CARLOS M.; GIL G., JESÚS H.; ROJANO, BENJAMÍN A.; DURANGO R., DIEGO L. Determinación del contenido de fenoles y evaluación de la actividad antioxidante de propóleos recolectados en el departamento de Antioquia (Colombia). Vitae, Vol. 16 (3): 388-395. Colombia, 2009. PALOMINO R., MARTÍNEZ J., GARCÍA C., GIL J. y DURANGO D. Caracterización Fisicoquímica y Actividad Antimicrobiana del Propóleos en el Municipio de la Unión (Antioquia, Colombia). Revista Facultad Nacional de Agronomía – Medellín vol. 63 (1): 53735383. Colombia 2010. PEÑA R. Estandarización en propóleos: antecedentes químicos y biológicos. Cien. Inv. Agr. 35(1): 17-26. Chile 2008. PUIGNERO V., TURULL A., & QUERALT J. Arachidonic Acid (AA) and Tetradecanoylphorbol Acetate (TPA) exert systemic effects when applied topically in the mouse. Inflammation, Vol. 22 (3). España, 1998. ROSSI A., LONGOB R., RUSSOC A., BORRELLIA F., SAUTEBINA L. The role of the phenethyl ester of caffeic acid (CAPE) in the inhibition of rat lung cyclooxygenase activity by propolis. Fitoterapia 73 (1): 30–37. Italia, 2002. RUSSOA A., CARDILEB V., SANCHEZC F., TRONCOSOC N., VANELLAA A., GARBARINO J. Chilean propolis: antioxidant activity and antiproliferative action in human tumor cell lines. Life Sciences 76: 545–558. Julio, 2004. SALAMANCA G., CORREA I. y PRINCIPAL J. Perfil de flavonoides e índices de oxidación de algunos propóleos colombianos. Zootecnia Trop., 25(2): 95-102. Colombia, Marzo 2007. SHVARZBEYN J., HULEIHEL M. Effect of propolis and caffeic acid phenethyl ester (CAPE) on NF-KB activation by HTLV-1 Tax. Antiviral Research 90: 108–115, 2011. SONG Y., PARK E., HUR G., RYU Y., KIM Y., JIN C. Ethanol extract of propolis inhibits nitric oxide synthase gene expression and enzyme activity. Journal of Ethnopharmacology 80: 155 - /161. U.S.A. Enero, 2002. 50 REFERENCIAS TOSI E., CIAPPINI M., CAZZOLLI, A., TAPIZ, L. Physicochemical characteristics of propolis collected in Santa Fe (Argentine). Apiacta 41: 110-120. Argentina 2006. Wagner H. y Bladt S. PLANT DRUG ANALYSIS, A Thin Layer Chromatography Atlas. Segunda Edición. Springer, 1996. WOISKY R. & SALATINO A. Analysis of propolis: some parameters and procedures for chemical quality control. Journal of Apicultural Research 37(2): 99 – 105. Brasil, Marzo 1998. WU J., OMENE C., KARKOSZKA J., BOSLAND M., ECKARD J., KLEIN C., FRENKEL K. Caffeic acid phenethyl ester (CAPE), derived from a honeybee product propolis, exhibits a diversity of anti-tumor effects in pre-clinical models of human breast cancer. Cancer Letters 308:43–53. U.S.A., 2011. SILVER J., MORRISON I., REES L. A Mössbauer spectroscopic study of frozen solutions of FeCl3- phenols. Inorganic and Nuclear Chemistry Letters Vol. 15: 433-436. 1979. 2. Anexos 51 Anexo 1: Test de Mann-Whitney para datos no paramétricos e independientes Inflamación tópica inducida por TPA: PROPÓLEO CALEU extracto etanólico global en etanol Dosis: 3 mg/ 20 uL/ oreja Ratón 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 O.derecha 0,0155 0,0182 0,0161 0,0180 0,0190 0,0198 0,0184 0,0203 O izquierda 0,0082 0,0098 0,0070 0,0077 0,0080 0,0088 0,0067 0,0070 n 8 promedio 0,0182 mediana 0,0183 Desv. Std 0,0017 Error Std 0,0006 W % E con promedio % E CON MEDIANA mediana de controles mediana de muestra % E FINAL CON MEDIANA z= p= 8 0,0079 0,0079 0,0010 0,0004 MUESTRA (Od-Oi) 0,0073 0,0084 0,0091 0,0103 0,0110 0,0110 0,0117 0,0133 % EAI 65,4 60,2 56,9 51,2 47,9 47,9 44,5 37,0 8 0,0103 0,0107 0,0019 0,0007 8 51,4 49,5 9,1 3,2 Fecha: 27-04-2012 % INF 89,0 85,7 130,0 133,8 137,5 125,0 174,6 190,0 Ranking 1,0 2,0 3,0 4,0 5,5 5,5 7,0 8,0 O derecha 0,0276 0,0284 0,0290 0,0283 0,0278 0,0270 0,0301 0,0283 0,0312 0,0312 0,0300 0,0293 0,0299 0,0299 0,0318 0,0399 16 0,0300 0,0296 0,0030 0,0007 CONTROLES O izquierda (Od-Oi) 0,0101 0,0175 0,0102 0,0182 0,0104 0,0186 0,0092 0,0191 0,0079 0,0199 0,0071 0,0199 0,0098 0,0203 0,0075 0,0208 0,0098 0,0214 0,0098 0,0214 0,0084 0,0216 0,0073 0,0220 0,0074 0,0225 0,0070 0,0229 0,0080 0,0238 0,0102 0,0297 16 0,0088 0,0088 0,0013 0,0003 % Inflam. 173,3 178,4 178,8 207,6 251,9 280,3 207,1 277,3 218,4 218,4 257,1 301,4 304,1 327,1 297,5 291,2 16 0,0212 0,0211 0,0029 0,0007 36,0 51,6 49,5 0,0211 0,0107 49,5 Z = w-[n(m+n+1)/2]/RAIZ[m*n(m+n+1)/12] Hipótesis nula: mediana de las muestras es igual o superior a la mediana de los controles Hipótesis alternativa: mediana de las muestras es menor a la mediana de los controles A un nivel de 0.05 se rechaza la hipótesis nula -3,92 4,44247E-05 HAY DIFERENCIAS SIGNIFICATIVAS ENTRE LOS EDEMAS DE LAS MUESTRAS Y LOS EDEMAS DE LOS CONTROLES Ranking 9,0 10,0 11,0 12,0 13,5 13,5 15,0 16,0 17,5 17,5 19,0 20,0 21,0 22,0 23,0 24,0 Anexo 2: Test de Mann-Whitney para datos no paramétricos e independientes Inflamación tópica inducida por TPA: PROPÓLEO CAJÓN MAIPO extracto etanólico global en etanol Dosis: 3 mg/ 20 uL/ oreja Ratón 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 O.derecha 0,0146 0,0170 0,0188 0,0201 0,0206 0,0206 0,0221 0,0240 n 8 promedio 0,0197 mediana 0,0204 Desv. Std 0,0029 Error Std 0,0010 W % E con promedio % E CON MEDIANA mediana de controles mediana de muestra % E FINAL CON MEDIANA z= p= O izquierda 0,0088 0,0095 0,0099 0,0102 0,0099 0,0094 0,0109 0,0098 8 0,0098 0,0099 0,0006 0,0002 MUESTRA (Od-Oi) 0,0058 0,0075 0,0089 0,0099 0,0107 0,0112 0,0112 0,0142 % EAI 72,5 64,5 57,8 53,1 49,3 46,9 46,9 32,7 8 0,0099 0,0103 0,0026 0,0009 8 53,0 51,2 12,2 4,3 Fecha: 14-06-2012 % INF 65,9 78,9 89,9 97,1 108,1 119,1 102,8 144,9 Ranking 1,0 2,0 3,0 4,0 5,0 6,5 6,5 8,0 O derecha 0,0276 0,0284 0,0290 0,0283 0,0278 0,0270 0,0301 0,0283 0,0312 0,0312 0,0300 0,0293 0,0299 0,0299 0,0318 0,0399 16 0,0300 0,0296 0,0030 0,0007 CONTROLES O izquierda (Od-Oi) 0,0101 0,0175 0,0102 0,0182 0,0104 0,0186 0,0092 0,0191 0,0079 0,0199 0,0071 0,0199 0,0098 0,0203 0,0075 0,0208 0,0098 0,0214 0,0098 0,0214 0,0084 0,0216 0,0073 0,0220 0,0074 0,0225 0,0070 0,0229 0,0080 0,0238 0,0102 0,0297 16 0,0088 0,0088 0,0013 0,0003 % Inflam. 173,3 178,4 178,8 207,6 251,9 280,3 207,1 277,3 218,4 218,4 257,1 301,4 304,1 327,1 297,5 291,2 16 0,0212 0,0211 0,0029 0,0007 36,0 53,2 51,2 0,0211 0,0103 51,2 Z = w-[n(m+n+1)/2]/RAIZ[m*n(m+n+1)/12] Hipótesis nula: mediana de las muestras es igual o superior a la mediana de los controles Hipótesis alternativa: mediana de las muestras es menor a la mediana de los controles A un nivel de 0.05 se rechaza la hipótesis nula -3,92 4,442E-05 HAY DIFERENCIAS SIGNIFICATIVAS ENTRE LOS EDEMAS DE LAS MUESTRAS Y LOS EDEMAS DE LOS CONTROLES Ranking 9,0 10,0 11,0 12,0 13,5 13,5 15,0 16,0 17,5 17,5 19,0 20,0 21,0 22,0 23,0 24,0 Anexo 3: Test de Mann-Whitney para datos no paramétricos e independientes Inflamación tópica inducida por TPA: PROPÓLEO CURACAVÍ extracto etanólico global en etanol Dosis: 3 mg/ 20 uL/ oreja Ratón 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 O.derecha 0,0127 0,0167 0,0153 0,0176 0,0170 0,0180 0,0200 0,0199 n 8 promedio 0,0172 mediana 0,0173 Desv. Std 0,0024 Error Std 0,0008 W % E con promedio % E CON MEDIANA mediana de controles mediana de muestra % E FINAL CON MEDIANA z= p= O izquierda 0,0094 0,0099 0,0080 0,0098 0,0090 0,0083 0,0102 0,0099 8 0,0093 0,0096 0,0008 0,0003 MUESTRA (Od-Oi) % EAI 0,0033 84,4 0,0068 67,8 0,0073 65,4 0,0078 63,0 0,0080 62,1 0,0097 54,0 0,0098 53,6 0,0100 52,6 8 0,0078 0,0079 0,0022 0,0008 Fecha: 14-06-2012 % INF 35,1 68,7 91,3 79,6 88,9 116,9 96,1 101,0 Ranking 1,0 2,0 3,0 4,0 5,0 6,0 7,0 8,0 8 62,9 62,6 10,4 3,7 O derecha 0,0276 0,0284 0,0290 0,0283 0,0278 0,0270 0,0301 0,0283 0,0312 0,0312 0,0300 0,0293 0,0299 0,0299 0,0318 0,0399 O izquierda 0,0101 0,0102 0,0104 0,0092 0,0079 0,0071 0,0098 0,0075 0,0098 0,0098 0,0084 0,0073 0,0074 0,0070 0,0080 0,0102 16 0,0300 0,0296 0,0030 0,0007 16 0,0088 0,0088 0,0013 0,0003 CONTROLES (Od-Oi) 0,0175 0,0182 0,0186 0,0191 0,0199 0,0199 0,0203 0,0208 0,0214 0,0214 0,0216 0,0220 0,0225 0,0229 0,0238 0,0297 % Inflam. 173,3 178,4 178,8 207,6 251,9 280,3 207,1 277,3 218,4 218,4 257,1 301,4 304,1 327,1 297,5 291,2 16 0,0212 0,0211 0,0029 0,0007 36,0 63,1 62,6 0,0211 0,0079 62,6 Z = w-[n(m+n+1)/2]/RAIZ[m*n(m+n+1)/12] Hipótesis nula: mediana de las muestras es igual o superior a la mediana de los controles Hipótesis alternativa: mediana de las muestras es menor a la mediana de los controles A un nivel de 0.05 se rechaza la hipótesis nula -3,92 4,4425E-05 HAY DIFERENCIAS SIGNIFICATIVAS ENTRE LOS EDEMAS DE LAS MUESTRAS Y LOS EDEMAS DE LOS CONTROLES Ranking 9,0 10,0 11,0 12,0 13,5 13,5 15,0 16,0 17,5 17,5 19,0 20,0 21,0 22,0 23,0 24,0 Anexo 4: Test de Mann-Whitney para datos no paramétricos e independientes Inflamación tópica inducida por TPA: PROPÓLEO DE BUIN Dosis: 3 mg/ 20 uL/ oreja Ratón 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 O.derecha 0,0158 0,0172 0,0172 0,0180 0,0193 0,0203 0,0220 0,0220 n 8 promedio 0,0190 mediana 0,0187 Desv. Std 0,0023 Error Std 0,0008 W % E con promedio % E CON MEDIANA mediana de controles mediana de muestra % E FINAL CON MEDIANA z= p= O izquierda 0,0100 0,0110 0,0095 0,0090 0,0091 0,0090 0,0095 0,0094 8 0,0096 0,0095 0,0007 0,0002 MUESTRA (Od-Oi) 0,0058 0,0062 0,0077 0,0090 0,0102 0,0113 0,0125 0,0126 % EAI 72,5 70,6 63,5 57,3 51,7 46,4 40,8 40,3 8 0,0094 0,0096 0,0027 0,0009 8 55,4 54,5 12,7 4,5 Fecha: 08-11-2012 % INF 58,0 56,4 81,1 100,0 112,1 125,6 131,6 134,0 Ranking 1,0 2,0 3,0 4,0 5,0 6,0 7,0 8,0 O derecha 0,0276 0,0284 0,0290 0,0283 0,0278 0,0270 0,0301 0,0283 0,0312 0,0312 0,0300 0,0293 0,0299 0,0299 0,0318 0,0399 O izquierda 0,0101 0,0102 0,0104 0,0092 0,0079 0,0071 0,0098 0,0075 0,0098 0,0098 0,0084 0,0073 0,0074 0,0070 0,0080 0,0102 16 0,0300 0,0296 0,0030 0,0007 16 0,0088 0,0088 0,0013 0,0003 CONTROLES (Od-Oi) 0,0175 0,0182 0,0186 0,0191 0,0199 0,0199 0,0203 0,0208 0,0214 0,0214 0,0216 0,0220 0,0225 0,0229 0,0238 0,0297 % Inflam. 173,3 178,4 178,8 207,6 251,9 280,3 207,1 277,3 218,4 218,4 257,1 301,4 304,1 327,1 297,5 291,2 Ranking 9,0 10,0 11,0 12,0 13,5 13,5 15,0 16,0 17,5 17,5 19,0 20,0 21,0 22,0 23,0 24,0 16 0,0212 0,0211 0,0029 0,0007 36,0 55,7 54,5 0,0211 0,0096 54,5 Z = w-[n(m+n+1)/2]/RAIZ[m*n(m+n+1)/12] Hipótesis nula: mediana de las muestras es igual o superior a la mediana de los controles Hipótesis alternativa: mediana de las muestras es menor a la mediana de los controles A un nivel de 0.05 se rechaza la hipótesis nula -3,92 4,44247E-05 HAY DIFERENCIAS SIGNIFICATIVAS ENTRE LOS EDEMAS DE LAS MUESTRAS Y LOS EDEMAS DE LOS CONTROLES Anexo 5: Test de Mann-Whitney para datos no paramétricos e independientes Inflamación tópica inducida por TPA: PROPÓLEO PIRQUE extracto etanólico global en etanol Dosis: 3 mg/ 20 uL/ oreja Ratón 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 O.derecha 0,0147 0,0178 0,0203 0,0209 0,0194 0,0202 0,0203 0,0267 n 8 promedio 0,0200 mediana 0,0203 Desv. Std 0,0034 Error Std 0,0012 W % E con promedio % E CON MEDIANA mediana de controles mediana de muestra % E FINAL CON MEDIANA z= p= O izquierda 0,0108 0,0100 0,0122 0,0113 0,0092 0,0099 0,0095 0,0106 8 0,0104 0,0103 0,0010 0,0004 MUESTRA (Od-Oi) 0,0039 0,0078 0,0081 0,0096 0,0102 0,0103 0,0108 0,0161 % EAI 81,5 63,0 61,6 54,5 51,7 51,2 48,8 23,7 8 0,0096 0,0099 0,0034 0,0012 8 54,5 53,1 16,3 5,8 Fecha: 14-06-2012 % INF 36,1 78,0 66,4 85,0 110,9 104,0 113,7 151,9 Ranking 1,0 2,0 3,0 4,0 5,0 6,0 7,0 8,0 O derecha 0,0276 0,0284 0,0290 0,0283 0,0278 0,0270 0,0301 0,0283 0,0312 0,0312 0,0300 0,0293 0,0299 0,0299 0,0318 0,0399 O izquierda 0,0101 0,0102 0,0104 0,0092 0,0079 0,0071 0,0098 0,0075 0,0098 0,0098 0,0084 0,0073 0,0074 0,0070 0,0080 0,0102 16 0,0300 0,0296 0,0030 0,0007 16 0,0088 0,0088 0,0013 0,0003 CONTROLES (Od-Oi) % Inflam. 0,0175 173,3 0,0182 178,4 0,0186 178,8 0,0191 207,6 0,0199 251,9 0,0199 280,3 0,0203 207,1 0,0208 277,3 0,0214 218,4 0,0214 218,4 0,0216 257,1 0,0220 301,4 0,0225 304,1 0,0229 327,1 0,0238 297,5 0,0297 291,2 16 0,0212 0,0211 0,0029 0,0007 36,0 54,8 53,1 0,0211 0,0099 53,1 Z = w-[n(m+n+1)/2]/RAIZ[m*n(m+n+1)/12] Hipótesis nula: mediana de las muestras es igual o superior a la mediana de los controles Hipótesis alternativa: mediana de las muestras es menor a la mediana de los controles A un nivel de 0.05 se rechaza la hipótesis nula -3,92 4,44247E-05 HAY DIFERENCIAS SIGNIFICATIVAS ENTRE LOS EDEMAS DE LAS MUESTRAS Y LOS EDEMAS DE LOS CONTROLES Ranking 9,0 10,0 11,0 12,0 13,5 13,5 15,0 16,0 17,5 17,5 19,0 20,0 21,0 22,0 23,0 24,0 Anexo 6: Test de Kruskal-Wallis ANOVA para datos no paramétricos e independientes Comparación de los EAI de los EEG de los distintos propóleos utilizados en ensayo de TPA N TPA EEG CA TPA EEG CM TPA EEG CV TPA EEG B TPA EEG P Min 8 8 8 8 8 Q1 36,96682 32,70142 52,60664 40,28436 23,69668 N 45,37915 46,91943 53,67299 42,18009 49,40758 Median % EAI Q3 Max 49,52607 59,36019 65,40284 51,18483 62,79621 72,51185 62,55924 67,18009 84,36019 54,50237 68,83886 72,51185 53,08057 62,67773 81,51659 Mean Rank Sum Rank 15,875 127 18,1875 145,5 28,125 225 20,125 161 20,1875 161,5 TPA EEG CA TPA EEG CM TPA EEG CV TPA EEG B TPA EEG P 8 8 8 8 8 Chi-Square DF 4,98528 Prob>Chi-Square 4 0,28881 Hipótesis nula: Todas las muestras poseen EAI iguales Hipótesis Alternativa: Las muestras poseen EAI distintos A un nivel de 0.05 NO hay motivos para rechazar la hipótesis nula NO HAY DIFERENCIAS SIGNIFICATIVAS ENTRE LOS EAI DE LOS DISTINTOS PROPÓLEOS Anexo 7: Test de Mann-Whitney para datos no paramétricos e independientes Inflamación tópica inducida por AA: PROPÓLEO CALEU extracto etanólico global en etanol Dosis: 3 mg/ 20 uL/ oreja Ratón 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 O.derecha O izquierda 0,0188 0,0133 0,0163 0,0105 0,0169 0,0081 0,0196 0,0096 0,0212 0,0107 0,0203 0,0089 0,0214 0,0099 0,0207 0,009 n 8 promedio 0,0194 mediana 0,0200 Desv. Std 0,0019 Error Std 0,0007 W % E con promedio % E CON MEDIANA mediana de controles mediana de muestra % E FINAL CON MEDIANA z= p= 8 0,0100 0,0098 0,0016 0,0006 MUESTRA (Od-Oi) 0,0055 0,0058 0,0088 0,0100 0,0105 0,0114 0,0115 0,0117 % EAI 50,7 48,0 21,1 10,3 5,8 -2,2 -3,1 -4,9 8 0,0094 0,0103 0,0025 0,0009 8 15,7 8,1 22,4 7,9 Fecha: 27-04-2012 % INF 41,4 55,2 108,6 104,2 98,1 128,1 116,2 130,0 Ranking 1,0 2,0 3,0 8,0 10,5 15,0 16,0 18,0 CONTROLES O derecha O izquierda (Od-Oi) % Inflam. 0,0168 0,0076 0,0092 121,1 0,0093 161,4 0,0230 0,0088 0,0099 119,3 0,0182 0,0083 0,01 114,9 0,0187 0,0087 0,0100 114,9 0,0187 0,0087 0,0105 132,9 0,0184 0,0079 0,0111 148,0 0,0186 0,0075 0,0111 116,8 0,0206 0,0095 0,0112 131,8 0,0197 0,0085 0,0116 158,9 0,0189 0,0073 0,0120 120,0 0,0220 0,0100 0,0130 144,4 0,0220 0,0090 0,0132 165,0 0,0212 0,0080 0,0139 152,7 0,0230 0,0091 0,0139 182,9 0,0215 0,0076 0,0139 182,9 0,0215 0,0076 16 0,0202 0,0202 0,0019 0,0005 16 0,0084 0,0084 0,0008 0,0002 Ranking 4,0 5,0 6,0 8,0 8,0 10,5 12,5 12,5 14,0 17,0 19,0 20,0 21,0 23,0 23,0 23,0 16 0,0115 0,0112 0,0017 0,0004 73,5 18,2 8,1 0,0112 0,0103 8,1 Z = w-[n(m+n+1)/2]/RAIZ[m*n(m+n+1)/12] Hipótesis nula: mediana de las muestras es igual o superior a la mediana de los controles Hipótesis alternativa: mediana de las muestras es menor a la mediana de los controles A un nivel de 0.05 NO hay motivos para rechazar hipótesis nula -1,62 0,052317 NO HAY DIFERENCIAS SIGNIFICATIVAS ENTRE LOS EDEMAS DE LAS MUESTRAS Y LOS EDEMAS DE LOS CONTROLES Anexo 8: Test de Mann-Whitney para datos no paramétricos e independientes Inflamación tópica inducida por AA: PROPÓLEO CAJÓN DEL MAIPO extracto etanólico global en etanol Dosis: 3 mg/ 20 uL/ oreja Ratón 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 O.derecha O izquierda 0,0136 0,0085 0,0188 0,0111 0,019 0,0111 0,0174 0,0088 0,0175 0,0086 0,019 0,009 0,0238 0,0089 0,0243 0,0093 n 8 promedio 0,0192 mediana 0,0189 Desv. Std 0,0035 Error Std 0,0012 W % E con promedio % E CON MEDIANA mediana de controles mediana de muestra % E FINAL CON MEDIANA z= p= 8 0,0094 0,0090 0,0011 0,0004 MUESTRA (Od-Oi) % EAI 0,0051 54,3 0,0077 30,9 0,0079 29,1 0,0086 22,9 0,0089 20,2 0,0100 10,3 0,0149 -33,6 0,0150 -34,5 8 0,0098 0,0088 0,0035 0,0012 Fecha: 31-05-2012 % INF 60,0 69,4 71,2 97,7 103,5 111,1 167,4 161,3 Ranking 1,0 2,0 3,0 4,0 5,0 10,0 23,0 24,0 8 12,4 21,5 31,3 11,1 CONTROLES O derecha O izquierda (Od-Oi) 0,0168 0,0076 0,0092 0,0093 0,0230 0,0088 0,0099 0,0182 0,0083 0,0100 0,0187 0,0087 0,0100 0,0187 0,0087 0,0105 0,0184 0,0079 0,0111 0,0186 0,0075 0,0111 0,0206 0,0095 0,0112 0,0197 0,0085 0,0116 0,0189 0,0073 0,0120 0,0220 0,0100 0,0130 0,0220 0,0090 0,0132 0,0212 0,0080 0,0139 0,0230 0,0091 0,0139 0,0215 0,0076 0,0139 0,0215 0,0076 16 0,0202 0,0202 0,0019 0,0005 16 0,0084 0,0084 0,0008 0,0002 % Inflam. 121,1 161,4 119,3 114,9 114,9 132,9 148,0 116,8 131,8 158,9 120,0 144,4 165,0 152,7 182,9 182,9 16 0,0115 0,0112 0,0017 0,0004 72,0 15,0 21,5 0,0112 0,0088 21,5 Z = w-[n(m+n+1)/2]/RAIZ[m*n(m+n+1)/12] Hipótesis nula: mediana de las muestras es igual o superior a la mediana de los controles Hipótesis alternativa: mediana de las muestras es menor a la mediana de los controles A un nivel de 0.05 se rechaza la hipótesis nula -1,71 0,043205 HAY DIFERENCIAS SIGNIFICATIVAS ENTRE LOS EDEMAS DE LAS MUESTRAS Y LOS EDEMAS DE LOS CONTROLES Ranking 6,0 7,0 8,0 10,0 10,0 12,0 13,5 13,5 15,0 16,0 17,0 18,0 19,0 21,0 21,0 21,0 Anexo 9: Test de Mann-Whitney para datos no paramétricos e independientes Inflamación tópica inducida por AA: PROPÓLEO CURACAVÍ extracto etanólico global en etanol Dosis: 3 mg/ 20 uL/ oreja Ratón 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 O.derecha 0,013 0,0143 0,0157 0,0139 0,0145 0,0135 0,0167 0,0162 n 8 promedio 0,0147 mediana 0,0144 Desv. Std 0,0013 Error Std 0,0005 W % E con promedio % E CON MEDIANA mediana de controles mediana de muestra % E FINAL CON MEDIANA z= p= O izquierda 0,009 0,0102 0,0112 0,0093 0,0097 0,0086 0,0097 0,0091 8 0,0096 0,0095 0,0008 0,0003 MUESTRA (Od-Oi) 0,0040 0,0041 0,0045 0,0046 0,0048 0,0049 0,0070 0,0071 % EAI 64,1 63,2 59,6 58,7 57,0 56,1 37,2 36,3 8 0,0051 0,0047 0,0012 0,0004 8 54,0 57,8 11,0 3,9 Fecha: 31-05-2012 % INF 44,4 40,2 40,2 49,5 49,5 57,0 72,2 78,0 Ranking 1,0 2,0 3,0 4,0 5,0 6,0 7,0 8,0 CONTROLES O derecha O izquierda (Od-Oi) % Inflam. 0,0168 0,0076 0,0092 121,1 0,0093 161,4 0,0230 0,0088 0,0099 119,3 0,0182 0,0083 0,0100 114,9 0,0187 0,0087 0,0100 114,9 0,0187 0,0087 0,0105 132,9 0,0184 0,0079 0,0111 148,0 0,0186 0,0075 0,0111 116,8 0,0206 0,0095 0,0112 131,8 0,0197 0,0085 0,0116 158,9 0,0189 0,0073 0,0120 120,0 0,0220 0,0100 0,0130 144,4 0,0220 0,0090 0,0132 165,0 0,0212 0,0080 0,0139 152,7 0,0230 0,0091 0,0139 182,9 0,0215 0,0076 0,0139 182,9 0,0215 0,0076 16 0,0202 0,0202 0,0019 0,0005 16 0,0084 0,0084 0,0008 0,0002 Ranking 9,0 10,0 11,0 12,5 12,5 14,0 15,5 15,5 17,0 18,0 19,0 20,0 21,0 23,0 23,0 23,0 16 0,0115 0,0112 0,0017 0,0004 36,0 55,4 57,8 0,0112 0,0047 57,8 Z = w-[n(m+n+1)/2]/RAIZ[m*n(m+n+1)/12] Hipótesis nula: mediana de las muestras es igual o superior a la mediana de los controles Hipótesis alternativa: mediana de las muestras es menor a la mediana de los controles A un nivel de 0.05 se rechaza la hipótesis nula -3,92 4,442E-05 HAY DIFERENCIAS SIGNIFICATIVAS ENTRE LOS EDEMAS DE LAS MUESTRAS Y LOS EDEMAS DE LOS CONTROLES Anexo 10: Test de Mann-Whitney para datos no paramétricos e independientes Inflamación tópica inducida por AA: PROPÓLEO BUIN extracto etanólico global en etanol Dosis: 3 mg/ 20 uL/ oreja Ratón 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 O.derecha O izquierda 0,0112 0,0094 0,0118 0,0085 0,0139 0,01 0,0141 0,0096 0,0139 0,0092 0,0141 0,0083 0,0146 0,0084 0,0173 0,0087 n 8 promedio 0,0139 mediana 0,0140 Desv. Std 0,0018 Error Std 0,0007 W % E con promedio % E CON MEDIANA mediana de controles mediana de muestra % E FINAL CON MEDIANA z= p= 8 0,0090 0,0090 0,0006 0,0002 MUESTRA (Od-Oi) % EAI 0,0018 83,9 0,0033 70,4 0,0039 65,0 0,0045 59,6 0,0047 57,8 0,0058 48,0 0,0062 44,4 0,0086 22,9 8 0,0049 0,0046 0,0021 0,0007 Fecha: 31-05-2012 % INF 19,1 38,8 39,0 46,9 51,1 69,9 73,8 98,9 Ranking 1,0 2,0 3,0 4,0 5,0 6,0 7,0 8,0 8 56,5 58,7 18,4 6,5 CONTROLES O derecha O izquierda (Od-Oi) % Inflam. 0,0168 0,0076 0,0092 121,1 0,0093 161,4 0,0230 0,0088 0,0099 119,3 0,0182 0,0083 0,0100 114,9 0,0187 0,0087 0,0100 114,9 0,0187 0,0087 0,0105 132,9 0,0184 0,0079 0,0111 148,0 0,0186 0,0075 0,0111 116,8 0,0206 0,0095 0,0112 131,8 0,0197 0,0085 0,0116 158,9 0,0189 0,0073 0,0120 120,0 0,0220 0,0100 0,0130 144,4 0,0220 0,0090 0,0132 165,0 0,0212 0,0080 0,0139 152,7 0,0230 0,0091 0,0139 182,9 0,0215 0,0076 0,0139 182,9 0,0215 0,0076 16 0,0202 0,0202 0,0019 0,0005 16 0,0084 0,0084 0,0008 0,0002 Ranking 9,0 10,0 11,0 12,5 12,5 14,0 15,5 15,5 17,0 18,0 19,0 20,0 21,0 23,0 23,0 23,0 16 0,0115 0,0112 0,0017 0,0004 36,0 57,8 58,7 0,0112 0,0046 58,7 Z = w-[n(m+n+1)/2]/RAIZ[m*n(m+n+1)/12] Hipótesis nula: mediana de las muestras es igual o superior a la mediana de los controles Hipótesis alternativa: mediana de las muestras es menor a la mediana de los controles A un nivel de 0.05 se rechaza la hipótesis nula -3,92 4,442E-05 HAY DIFERENCIAS SIGNIFICATIVAS ENTRE LOS EDEMAS DE LAS MUESTRAS Y LOS EDEMAS DE LOS CONTROLES Anexo 11: Test de Mann-Whitney para datos no paramétricos e independientes Inflamación tópica inducida por AA: PROPÓLEO PIRQUE extracto etanólico global en etanol Dosis: 3 mg/ 20 uL/ oreja Ratón 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 O.derecha 0,0140 0,0148 0,0155 0,0166 0,0164 0,0171 0,0187 0,0219 n 8 promedio 0,0169 mediana 0,0165 Desv. Std 0,0025 Error Std 0,0009 W % E con promedio % E CON MEDIANA mediana de controles mediana de muestra % E FINAL CON MEDIANA z= p= O izquierda 0,0089 0,0090 0,0092 0,0096 0,0085 0,0090 0,0080 0,0086 8 0,0089 0,0090 0,0005 0,0002 MUESTRA (Od-Oi) 0,0051 0,0058 0,0063 0,0070 0,0079 0,0081 0,0107 0,0133 % EAI 54,3 48,0 43,5 37,2 29,1 27,4 4,0 -19,3 8 0,0080 0,0075 0,0027 0,0010 8 28,0 33,2 24,6 8,7 Fecha: 18-10-2012 % INF 57,3 64,4 68,5 72,9 92,9 90,0 133,8 154,7 Ranking 1,0 2,0 3,0 4,0 5,0 6,0 13,0 21,0 CONTROLES O derecha O izquierda (Od-Oi) % Inflam. 0,0168 0,0076 0,0092 121,1 0,0093 161,4 0,0230 0,0088 0,0099 119,3 0,0182 0,0083 0,0100 114,9 0,0187 0,0087 0,0100 114,9 0,0187 0,0087 0,0105 132,9 0,0184 0,0079 0,0111 148,0 0,0186 0,0075 0,0111 116,8 0,0206 0,0095 0,0112 131,8 0,0197 0,0085 0,0116 158,9 0,0189 0,0073 0,0120 120,0 0,0220 0,0100 0,0130 144,4 0,0220 0,0090 0,0132 165,0 0,0212 0,0080 0,0139 152,7 0,0230 0,0091 0,0139 182,9 0,0215 0,0076 0,0139 182,9 0,0215 0,0076 16 0,0202 0,0202 0,0019 0,0005 16 0,0084 0,0084 0,0008 0,0002 Ranking 7,0 8,0 9,0 10,5 10,5 12,0 14,5 14,5 16,0 17,0 18,0 19,0 20,0 23,0 23,0 23,0 16 0,0115 0,0112 0,0017 0,0004 55,0 30,1 33,2 0,0112 0,0075 33,2 Z = w-[n(m+n+1)/2]/RAIZ[m*n(m+n+1)/12] Hipótesis nula: mediana de las muestras es igual o superior a la mediana de los controles Hipótesis alternativa: mediana de las muestras es menor a la mediana de los controles A un nivel de 0.05 se rechaza la hipótesis nula -2,76 0,0029285 HAY DIFERENCIAS SIGNIFICATIVAS ENTRE LOS EDEMAS DE LAS MUESTRAS Y LOS EDEMAS DE LOS CONTROLES Anexo 12: Test de Kruskal-Wallis ANOVA para datos no paramétricos e independientes Comparación de los EAI de los EEG de los distintos propóleos utilizados en ensayo de AA N Min AA EEG CA AA EEG CM AA EEG CV AA EEG B AA EEG P 8 8 8 8 8 Q1 -4,93274 -34,52915 36,32287 22,86996 -19,28251 N -2,9148 -22,64574 41,92825 45,29148 9,86547 Median % EAI Q3 Max 8,07175 41,25561 50,67265 21,52466 30,49327 54,26009 57,84753 62,33184 64,12556 58,74439 69,0583 83,8565 33,18386 46,86099 54,26009 Mean Rank Sum Rank 12,125 97 12,5 100 30,125 241 30,6875 245,5 17,0625 136,5 AA EEG CA AA EEG CM AA EEG CV AA EEG B AA EEG P 8 8 8 8 8 Chi-Square DF 20,05509 Prob>Chi-Square 4 4,87E-04 Hipótesis nula: Todas las muestras poseen EAI iguales Hipótesis Alternativa: Las muestras poseen EAI distintos A un nivel de 0.05 se rechaza la hipótesis nula HAY DIFERENCIAS SIGNIFICATIVAS ENTRE LOS EAI DE LOS DISTINTOS PROPÓLEOS Anexo 13: Test de Mann Whitney para los EAI de dos grupos de propóleos BUIN V.S. CURACAVÍ N EAI B EAI CV Min 8 8 N EAI B EAI CV 8 8 U Q1 22,86996 36,32287 45,29148 41,92825 Mean Rank Sum Rank 9,1875 7,8125 Z 37,5 0,52549 Median Q3 Max 58,74439 69,0583 83,8565 57,84753 62,33184 64,12556 73,5 62,5 Exact Prob>|U| Asymp. Prob>|U| 0,59285 0,59924 Hipótesis Nula: EAI de Buin es igual al de Curacaví Hipótesis Nula: EAI de Buin es distinto al de Curacaví A un nivel de 0.05 no hay motivos para rechazar la hipótesis nula NO hay diferencia significativa entre el EAI de Buin y el de Curacaví BUIN V.S. PIRQUE N EAI B EAI P N EAI B EAI P Min 8 8 Q1 22,86996 -19,28251 Median Q3 Max 45,29148 58,74439 69,0583 83,8565 9,86547 33,18386 46,86099 54,26009 Mean Rank Sum Rank 8 11,375 8 5,625 U Z 55 91 45 Exact Prob>|U| Asymp. Prob>|U| 2,36297 0,01476 0,01813 Hipótesis Nula: EAI de Buin es igual al de Pirque Hipótesis Nula: EAI de Buin es distinto al de Pirque A un nivel de 0.05 se rechaza la hipótesis nula Hay diferencias significativas entre los EAI de Buin y Pirque BUIN V.S. CAJÓN MAIPO N Min Q1 EAI B 8 22,86996 EAI CM 8 -34,52915 N EAI B EAI CM 8 8 U Mean Rank Sum Rank 11,8125 5,1875 Z 58,5 45,29148 -22,64574 2,73256 Median Q3 Max 58,74439 69,0583 83,8565 21,52466 30,49327 54,26009 94,5 41,5 Exact Prob>|U| Asymp. Prob>|U| 0,00326 0,00628 Hipótesis Nula: EAI de Buin es igual al de Cajón del Maipo Hipótesis Nula: EAI de Buin es distinto al de Cajón del Maipo A un nivel de 0.05 se rechaza la hipótesis nula Hay diferencias significativas entre los EAI de Buin y Cajón del Maipo Anexo 14: Test de Mann Whitney para los EAI de dos grupos de propóleos BUIN V.S. CALEU N EAI B EAI CA Min 8 8 N EAI B EAI CA 8 8 U Q1 22,86996 -4,93274 Median 45,29148 -2,9148 Mean Rank Sum Rank 11,8125 5,1875 Z 58,5 2,73256 Q3 58,74439 8,07175 Max 69,0583 41,25561 83,8565 50,67265 94,5 41,5 Exact Prob>|U| Asymp. Prob>|U| 0,00326 0,00628 Hipótesis Nula: EAI de Buin es igual al de Caleu Hipótesis Nula: EAI de Buin es distinto al de Caleu A un nivel de 0.05 se rechaza la hipótesis nula Hay diferencias significativas entre los EAI de Buin y Caleu PIRQUE V.S. CURACAVI N Min Q1 EAI P 8 -19,28251 EAI CV 8 36,32287 N EAI P EAI CV Median 9,86547 41,92825 Mean Rank Sum Rank 8 5,4375 8 11,5625 U Z 7,5 Q3 33,18386 57,84753 Max 46,86099 54,26009 62,33184 64,12556 43,5 92,5 Exact Prob>|U| Asymp. Prob>|U| -2,52236 0,00761 0,01166 Hipótesis Nula: EAI de Pirque es igual al de Curacaví Hipótesis Nula: EAI de Pirque es distinto al de Curacaví A un nivel de 0.05 se rechaza la hipótesis nula Hay diferencias significativas entre los EAI de Pirque y Curacaví PIRQUE V.S. CAJÓN MAIPO N Min Q1 EAI P 8 -19,28251 EAI CM 8 -34,52915 N EAI P EAI CM 8 8 U Mean Rank Sum Rank 9,875 7,125 Z 43 Median 9,86547 -22,64574 1,10435 Q3 33,18386 21,52466 79 57 Exact Prob>|U| Asymp. Prob>|U| 0,26651 0,26944 Hipótesis Nula: EAI de Pirque es igual al de Cajón del Maipo Hipótesis Alternativa: EAI de Pirque es distinto al de Cajón Maipo A un nivel de 0.05 no hay motivos para rechazar la hipótesis nula NO hay diferencia significativa entre el EAI de Pirque y Cajón del Maipo 46,86099 30,49327 Max 54,26009 54,26009 Anexo 15: Test de Mann Whitney para los EAI de dos grupos de propóleos CURACAVI V.S. CAJON MAIPO N Min Q1 EAI CV 8 36,32287 EAI CM 8 -34,52915 N EAI CV EAI CM 8 8 U Median 41,92825 -22,64574 Mean Rank Sum Rank 12,25 4,75 Z 62 3,09812 Q3 57,84753 21,52466 62,33184 30,49327 Max 64,12556 54,26009 98 38 Exact Prob>|U| Asymp. Prob>|U| 6,22E-04 0,00195 Hipótesis Nula: EAI de Curacaví es igual al de Cajón del Maipo Hipótesis Nula: EAI de Curacaví es distinto al de Cajón del Maipo A un nivel de 0.05 se rechaza la hipótesis nula Hay diferencias significativas entre los EAI de Curacaví y Cajón del Maipo CURACAVI V.S. CALEU N Min Q1 EAI CV 8 36,32287 EAI CA 8 -4,93274 N EAI CV EAI CA Median 41,92825 -2,9148 Mean Rank Sum Rank 8 12 8 5 U Z 60 2,88808 Q3 57,84753 8,07175 Max 62,33184 64,12556 41,25561 50,67265 96 40 Exact Prob>|U| Asymp. Prob>|U| 0,00186 0,00388 Hipótesis Nula: EAI de Curacaví es igual al de Caleu Hipótesis Nula: EAI de Curacaví es distinto al de Caleu A un nivel de 0.05 se rechaza la hipótesis nula Hay diferencias significativas entre los EAI de Curacaví y Caleu CAJÓN MAIPO V.S. CALEU N Min Q1 EAI CM 8 -34,52915 EAI CA 8 -4,93274 N EAI CM EAI CA 8 8 U Q3 21,52466 8,07175 Mean Rank Sum Rank 8,9375 71,5 8,0625 64,5 Z 35,5 Median -22,64574 -2,9148 0,31529 Exact Prob>|U| Asymp. Prob>|U| 0,7411 0,75254 Hipótesis Nula: EAI de Cajón del Maipo es igual al de Caleu Hipótesis Nula: EAI de Cajón del Maipo es distinta al de Caleu A un nivel de 0.05 no hay motivos para rechazar la hipótesis nula NO hay diferencia significativa entre el EAI de Cajón del Maipo y Caleu 30,49327 41,25561 Max 54,26009 50,67265 Anexo 16: Test de Mann Whitney para los EAI de dos grupos de propóleos PIRQUE V.S. CALEU N EAI P EAI CA 8 8 Min Q1 -19,28251 -4,93274 8 8 Mean Rank Sum Rank 9,625 7,375 N EAI P EAI CA U Z 41 0,89268 Median 9,86547 -2,9148 Q3 33,18386 8,07175 77 59 Exact Prob>|U| Asymp. Prob>|U| 0,38228 0,37203 Hipótesis Nula: EAI de Pirque es igual al de Caleu Hipótesis Nula: EAI de Pirque es distinta al de Caleu A un nivel de 0.05 no hay motivos para rechazar la hipótesis nula NO hay diferencia significativa entre el EAI de Pirque y el de Caleu 46,86099 41,25561 Max 54,26009 50,67265