Nombre del Área
Anuncio
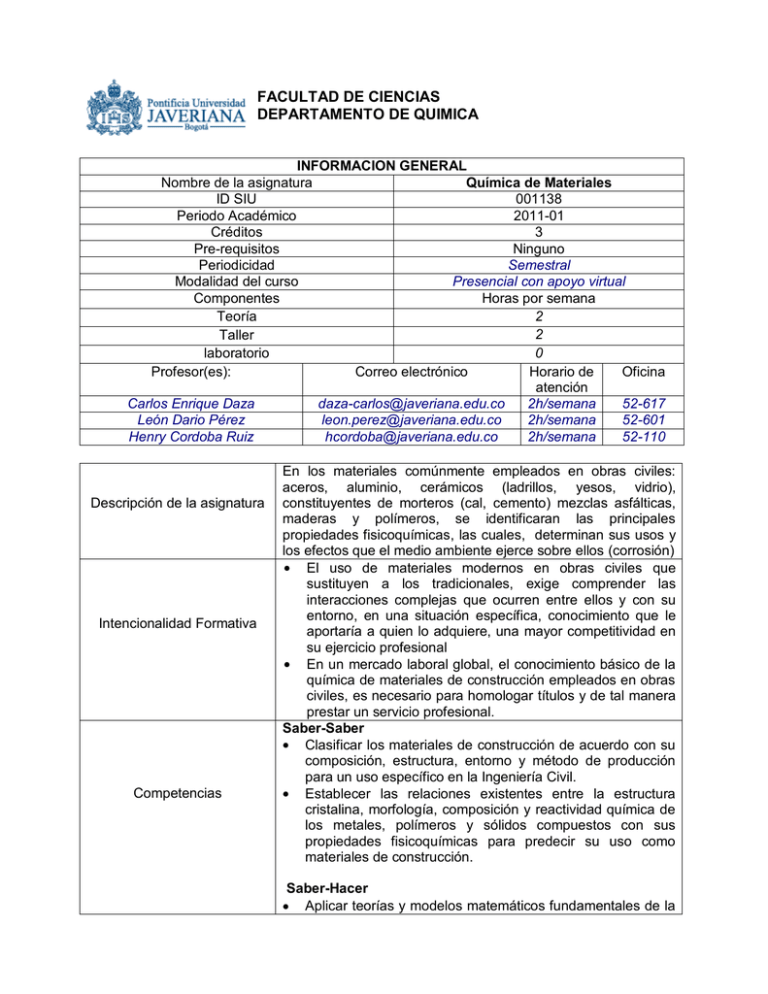
FACULTAD DE CIENCIAS DEPARTAMENTO DE QUIMICA INFORMACION GENERAL Química de Materiales Nombre de la asignatura ID SIU 001138 Periodo Académico 2011-01 Créditos 3 Pre-requisitos Ninguno Semestral Periodicidad Presencial con apoyo virtual Modalidad del curso Componentes Horas por semana 2 Teoría 2 Taller 0 laboratorio Profesor(es): Correo electrónico Horario de Oficina atención Carlos Enrique Daza daza-carlos@javeriana.edu.co 2h/semana 52-617 León Dario Pérez leon.perez@javeriana.edu.co 2h/semana 52-601 Henry Cordoba Ruiz hcordoba@javeriana.edu.co 2h/semana 52-110 Descripción de la asignatura Intencionalidad Formativa Competencias En los materiales comúnmente empleados en obras civiles: aceros, aluminio, cerámicos (ladrillos, yesos, vidrio), constituyentes de morteros (cal, cemento) mezclas asfálticas, maderas y polímeros, se identificaran las principales propiedades fisicoquímicas, las cuales, determinan sus usos y los efectos que el medio ambiente ejerce sobre ellos (corrosión) El uso de materiales modernos en obras civiles que sustituyen a los tradicionales, exige comprender las interacciones complejas que ocurren entre ellos y con su entorno, en una situación específica, conocimiento que le aportaría a quien lo adquiere, una mayor competitividad en su ejercicio profesional En un mercado laboral global, el conocimiento básico de la química de materiales de construcción empleados en obras civiles, es necesario para homologar títulos y de tal manera prestar un servicio profesional. Saber-Saber Clasificar los materiales de construcción de acuerdo con su composición, estructura, entorno y método de producción para un uso específico en la Ingeniería Civil. Establecer las relaciones existentes entre la estructura cristalina, morfología, composición y reactividad química de los metales, polímeros y sólidos compuestos con sus propiedades fisicoquímicas para predecir su uso como materiales de construcción. Saber-Hacer Aplicar teorías y modelos matemáticos fundamentales de la química en el cálculo de variables fisicoquímicas que predicen las características y/o el comportamiento ante el medio ambiente de un material. Realizar razonamientos matemáticos haciendo uso de la constante de equilibrio para determinar la solubilidad de sólidos iónicos y su efecto sobre la meteorización de rocas y suelos. Proponer métodos de prevención de la corrosión de metales conociendo los factores externos que la pueden favorecer para incrementar la vida útil de los materiales metálicos. Criterios de desempeño Contenidos temáticos Estrategias pedagógicas Objetivos de aprendizaje Saber-Ser Adquirir una actitud crítica y comprometida con el medio ambiente que prevenga el uso indiscriminado de materias primas para la obtención de materiales de construcción. Desarrollar una actitud adecuada para el trabajo en grupo que permita el desarrollo participativo y activo en actividades como la preparación de una exposición o el desarrollo de un taller. Aprobado con 60% de los logros establecidos Conceptos sobre el átomo, enlace, la estructura cristalina, el proceso de solidificación de metales, de solubilización acuosa y equilibrio químico de materiales cerámicos, potencial z para suspensiones coloidales y reacciones de oxi-reducción para explicar el deterioro de materiales metálicos. En cada tema se hace presentación de los conceptos por parte del profesor, para fundamentar la base de discusión en el taller, de los conceptos fundamentales y descriptivos. Los estudiantes aclaran y se apropian los conceptos a través de la discusión y desarrollo de ejercicios en clase. El proceso se complementa con ejercicios y lecturas durante el trabajo individual y la presentación de los conceptos desarrollados analizando las propiedades de materiales empleados en obras civiles. Diferenciar los tipos de enlaces químicos (primarios y/o secundarios) para establecer la dureza de un material. Calcular la densidad volumétrica de un metal a partir de modelos cristalinos. Identificar los tipos de defectos cristalinos para establecer su relación con las propiedades macroscópicas de un sólido. Realizar cálculos de concentración de una solución usando diferentes tipos de unidades. Determinar la concentración de especies en el equilibrio de un sistema acuoso para calcular el pH de una solución de ácidos o bases débiles. Calcular el valor del potencial de una celda galvánica compuesta por dos metales para establecer las condiciones que pueden conducir a la corrosión de un metal. Conocer el concepto de potencial zeta y su aplicación en la estabilización de suspensiones coloidales. Bibliografía, Textos guía Otra bibliografia Smith W. y Hashemi J. . Ciencia e ingeniería de materiales. McGraw. 2007. Chang, R. Química General. Mac GrawHill. 2000 1. Askeland, D.R., Ciencia e Ingeniería de los materiales, 3 Edición, Thomson Editores, 1998 2. Hernández, F. y A Martín. Introducción a la química de materiales. Editorial Rugarte. 1997 3. Baquero, R. El fascinante mundo del estado sólido: la superconductividad. UPTC. 2006 4. Brown, T. L., Lemay Jr., H. E. Química. La Ciencia Central. Ed. Pearson Education. 2002. 5. Chung, Yip-wah, Introduction to materials science and engineering. CRC Press, 2007 6. Sears, F. W., Zemansky, M. W., Física Universitaria. Ed. Pearson Education. 2001. 7. Morrison R.T y Boyd R.N., Química Orgánica, 5º ed., Addison-Wesley Iberoamericana, U.S.A, 1990. 8. Callister W.D., Jr. Introducción a la Ciencia e Ingeniería de los materiales. University of Utah, Salt Lake City, EE.UU. Tercera edición. 1996. 9. González-Viñas, Wenceslao y Manzini Hector. Ciencia de los materiales, Editorial Ariel 2005 e-BOOK 10. González F. Introducción a la geoquímica. Secretaría General de la OEA. Programa Regional de desarrollo Científico y tecnológico. Washington, D.C, 1982 11. Krauskopf KB. and Bird D:K. Introduction to geochemistry. McGraw-Hill,1995 CRONOGRAMA DE LA ASIGNATURA QUIMICA DE MATERIALES Estrategia Semana Fecha Tema a Tratar pedagógica 1 Semana del 23 Materiales clasificación, relación de las Discusión académica, de julio propiedades de los materiales con la desarrollo de taller y composición, estructura, entorno y examen corto método de producción. Manejo de unidades. 2 Semana del 30 El átomo. Peso molecular. Definición de Discusión académica, de julio mol y número de Avogadro. desarrollo de taller y Configuración electrónica. Tabla examen corto periódica. Composición de Mezclas. Orbítales atómicos, hibridación y orbitales moleculares. 3 Semana del 6 Tipos de enlaces químicos: iónico, Discusión académica, de agosto covalente y metálico y su relación con desarrollo de taller y la conductividad eléctrica y calórica examen corto 4 Semana del 13 Fuerzas secundarias (fuerzas de Van Discusión académica, de agosto der Walls, puentes de hidrógeno) y su desarrollo de taller y relación con las temperaturas de fusión examen corto 5 Semana del 20 de agosto 6 Semana del 27 de agosto Semana del 3 de septiembre 7 8 Semana del 10 de septiembre 9 Semana del 17 de septiembre Semana del 24 de septiembre 10 11 Semana del 1 de octubre Semana del 8 de octubre 12 Semana del 15 de octubre 13 Semana del 22 de octubre 14 Semana del 29 de octubre 15 Semana del 5 de noviembre 16 Semana del 12 de noviembre 17 Semana del 19 de noviembre Semana del 26 de noviembre 18 y ebullición. Tipos de sólidos Estructuras cristalinas y amorfas. Estudio de la estructura cristalina común en metales. Cálculo de la densidad a partir del modelo cristalino. Proceso de solidificación de metales Primer parcial Discusión académica, desarrollo de taller y examen corto Sesión de ejercicios y examen escrito Proceso de solidificación de metales y Discusión académica, su efecto sobre las redes cristalinas y desarrollo de taller y las propiedades mecánicas (ductilidad y examen corto fragilidad) de los metales: imperfecciones. Disoluciones acuosas. Unidades de Discusión académica, concentración. desarrollo de taller y examen corto SEMANA DE REFLEXIÓN Equilibrio químico. Chatelier. Principio de Le Discusión académica, desarrollo de taller y examen corto Ácidos y bases. Electrolitos. Definición Sesión de ejercicios y y cálculo del pH. Equilibrios en solución. examen escrito Ejercicios de refuerzo Discusión académica, Segundo Parcial desarrollo de taller y examen corto Oxidación y corrosión de metales, corrosión electroquímica. Ley de Nernst. Velocidad de corrosión. Tipos de Discusión académica, corrosión y métodos de inhibición de la desarrollo de taller y corrosión examen corto Soluciones coloidales. Definición de Discusión académica, Potencial Z desarrollo de taller y examen corto Exposiciones de Materiales de construcción empleados estudiantes en obras civiles con bajo impacto ambiental Exposiciones de Materiales de construcción empleados estudiantes en obras civiles con bajo impacto ambiental Ejercicios de refuerzo Sesión de ejercicios Tercer Parcial Examen escrito ASPECTOS POR EVALUAR Y FORMAS DE EVALUACIÓN Dos parciales (cada uno 20%) = 40%. Examen final = 20% Exámenes cortos = 20%. Exposición (poster y presentación) = 20%__ 100%








