Inmunología, inmunopatología y vacunación en
Anuncio
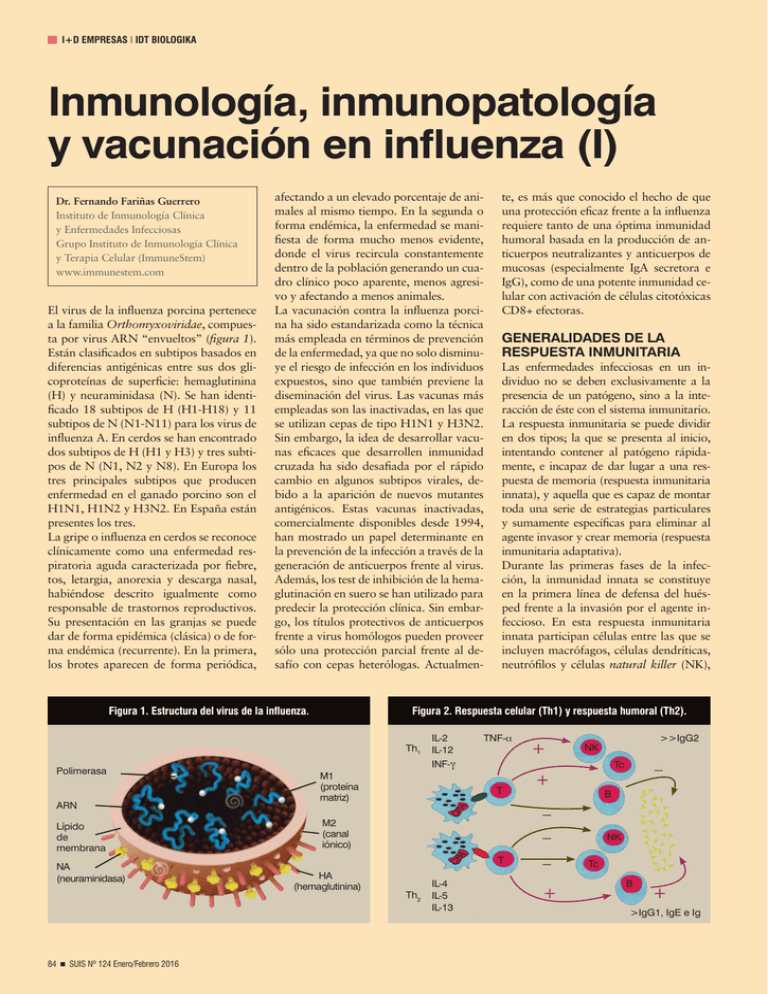
I+D EMPRESAS I IDT BIOLOGIKA Inmunología, inmunopatología y vacunación en influenza (I) Dr. Fernando Fariñas Guerrero Instituto de Inmunología Clínica y Enfermedades Infecciosas Grupo Instituto de Inmunología Clínica y Terapia Celular (ImmuneStem) www.immunestem.com El virus de la influenza porcina pertenece a la familia Orthomyxoviridae, compuesta por virus ARN “envueltos” (figura 1). Están clasificados en subtipos basados en diferencias antigénicas entre sus dos glicoproteínas de superficie: hemaglutinina (H) y neuraminidasa (N). Se han identificado 18 subtipos de H (H1-H18) y 11 subtipos de N (N1-N11) para los virus de influenza A. En cerdos se han encontrado dos subtipos de H (H1 y H3) y tres subtipos de N (N1, N2 y N8). En Europa los tres principales subtipos que producen enfermedad en el ganado porcino son el H1N1, H1N2 y H3N2. En España están presentes los tres. La gripe o influenza en cerdos se reconoce clínicamente como una enfermedad respiratoria aguda caracterizada por fiebre, tos, letargia, anorexia y descarga nasal, habiéndose descrito igualmente como responsable de trastornos reproductivos. Su presentación en las granjas se puede dar de forma epidémica (clásica) o de forma endémica (recurrente). En la primera, los brotes aparecen de forma periódica, afectando a un elevado porcentaje de animales al mismo tiempo. En la segunda o forma endémica, la enfermedad se manifiesta de forma mucho menos evidente, donde el virus recircula constantemente dentro de la población generando un cuadro clínico poco aparente, menos agresivo y afectando a menos animales. La vacunación contra la influenza porcina ha sido estandarizada como la técnica más empleada en términos de prevención de la enfermedad, ya que no solo disminuye el riesgo de infección en los individuos expuestos, sino que también previene la diseminación del virus. Las vacunas más empleadas son las inactivadas, en las que se utilizan cepas de tipo H1N1 y H3N2. Sin embargo, la idea de desarrollar vacunas eficaces que desarrollen inmunidad cruzada ha sido desafiada por el rápido cambio en algunos subtipos virales, debido a la aparición de nuevos mutantes antigénicos. Estas vacunas inactivadas, comercialmente disponibles desde 1994, han mostrado un papel determinante en la prevención de la infección a través de la generación de anticuerpos frente al virus. Además, los test de inhibición de la hemaglutinación en suero se han utilizado para predecir la protección clínica. Sin embargo, los títulos protectivos de anticuerpos frente a virus homólogos pueden proveer sólo una protección parcial frente al desafío con cepas heterólogas. Actualmen- Figura 1. Estructura del virus de la influenza. Lípido de membrana NA (neuraminidasa) 84 n SUIS Nº 124 Enero/Febrero 2016 M1 (proteína matriz) IL-2 IL-12 INF-γ Las enfermedades infecciosas en un individuo no se deben exclusivamente a la presencia de un patógeno, sino a la interacción de éste con el sistema inmunitario. La respuesta inmunitaria se puede dividir en dos tipos; la que se presenta al inicio, intentando contener al patógeno rápidamente, e incapaz de dar lugar a una respuesta de memoria (respuesta inmunitaria innata), y aquella que es capaz de montar toda una serie de estrategias particulares y sumamente específicas para eliminar al agente invasor y crear memoria (respuesta inmunitaria adaptativa). Durante las primeras fases de la infección, la inmunidad innata se constituye en la primera línea de defensa del huésped frente a la invasión por el agente infeccioso. En esta respuesta inmunitaria innata participan células entre las que se incluyen macrófagos, células dendríticas, neutrófilos y células natural killer (NK), Th2 IL-4 IL-5 IL-13 + T Tc + – + >>IgG2 NK – B – – CP A M2 (canal iónico) HA (hemaglutinina) TNF-α T CP A ARN GENERALIDADES DE LA RESPUESTA INMUNITARIA Figura 2. Respuesta celular (Th1) y respuesta humoral (Th2). Th1 Polimerasa te, es más que conocido el hecho de que una protección eficaz frente a la influenza requiere tanto de una óptima inmunidad humoral basada en la producción de anticuerpos neutralizantes y anticuerpos de mucosas (especialmente IgA secretora e IgG), como de una potente inmunidad celular con activación de células citotóxicas CD8+ efectoras. NK Tc B + >IgG1, IgE e Ig I+D EMPRESAS I IDT BIOLOGIKA que están equipadas con receptores para la detección de los patógenos. Todos los patógenos llevan consigo una seña de identidad, una serie de moléculas que son fácilmente reconocidas por las células del sistema inmunitario. A estas señales se les denominan PAMPs (patrones moleculares asociados a patógenos). Estas moléculas son reconocidas por las células inmunitarias a través de unos receptores llamados PRR (receptores de reconocimiento de patrones). Dentro de estos receptores los hay de diversos tipos. Los más conocidos son los llamados TLR (receptores tipo Toll), entre los que se encuentran aquellos que reconocen específicamente estructuras como los lipopolisacáridos bacterianos (TLR2 y TLR4), o la flagelina (proteína del flagelo) de bacterias y parásitos (TLR5), entre otros. Además de estos TLR, que se sitúan en la superficie de las células inmunitarias, también existen receptores de reconocimiento de patógenos dentro de las células (llamados NLR, y RLR, entre otros), que están especializados en reconocer moléculas pertenecientes a organismos intracelulares (virus, bacterias intracelulares, rickettsias, leishmania, toxoplasmas, hongos tipo histoplasma y criptococos, etc.). La estimulación de cualquiera de estos receptores por parte de un patógeno, va a conllevar la producción de una serie de mediadores inflamatorios (citoquinas). Entre estos mediadores o citoquinas se encuentran los interferones tipo I (IFN α y β), que se emplean para establecer mecanismos de defensa frente a la infección por agentes intracelulares (principalmente virus), y otros que modulan el paso a una segunda fase de respuesta más específica (inmunidad adaptativa), induciendo la proliferación de la células T de memoria, potenciando la secreción de IFN-γ, la diferenciación de las células B a células plasmáticas productoras de anticuerpos, o la activación de la células NK y linfocitos T8 citotóxicos. A diferencia de la inmunidad innata, la inmunidad adaptativa es específica frente a un determinado antígeno y crea memoria. La acción coordinada de los linfocitos CD4+ (T4 o helper), CD8+ (citotóxicos/ supresores) y B efectoras (células plasmáticas) darán lugar al desarrollo de esta segunda fase de respuesta específica frente a la infección. Dependiendo del tipo y moléculas que se formen durante la respuesta innata, el Figura 3. Respuestas frente al patógeno. Th2 GATA-3 STAT-6 IL-4 Parásitos extracelulares (helmintos) IL-4 Célula T-CD4+ no diferenciada Th1 INF- γ IL-12 TGF-β IL-6 T-bet STAT-4 INF-γ Parásitos intracelulares IL-17 Bacterias extracelulares Autoinmunidad Th17 STAT-3 Treg TGF-β Foxp3 balance final de citoquinas que se formen determinará el desarrollo posterior de una respuesta adaptativa basada fundamentalmente en una respuesta celular (Th1) con activación de linfocitos T8 citotóxicos y NK, una respuesta humoral (Th2) con producción de una alta cantidad y calidad de anticuerpos, una respuesta basada en la activación de polimorfonucleares neutrófilos (Th17) o una respuesta de carácter mixto (Th1+Th2) (figura 2). Las células Th1 y Th17 promueven principalmente la respuesta celular contra patógenos intracelulares entre los que se encuentran virus, algunas bacterias (micobacterias, salmonela, listeria, etc.), rickettsias, parásitos protozoarios (coccidios, toxoplasmas, etc.) y algunos hongos (histoplasmas, criptococos, etc.). En las infecciones por estos agentes intracelulares, las células Th1 secretan citoquinas (interleuquina 2, interleuquina 12, interferón-γ, etc.) que activan la proliferación de células T CD8+ citotóxicas principalmente y NK. De esta forma estas células T citotóxicas, una vez activadas, migran hacia el foco de infección, y una vez reconocidas las células infectadas, se unen a ellas estrechamente y las “perforan” valiéndose de una proteína llamada perforina y aprovechando ésta para inyectar en la célula infectada otra serie de proteínas (granzimas), que van a acabar con la célula infectada y el agente patógeno que esta esconde en su interior. Para la defensa frente a agentes extra- TGF-β IL-10 Inmunosupresión celulares, parásitos macroscópicos (helmintos) y toxinas, el sistema inmunitario dispone de la respuesta Th2. Los linfocitos Th2 producen una serie de citoquinas (IL-4, IL-5, IL-10 e IL-13), estimulando con ello una respuesta inmunitaria de tipo humoral, caracterizada por la producción de grandes cantidades de inmunoglobulinas por parte de los linfocitos B, principalmente IgM, IgA, IgE e IgG1, que será responsable de la defensa frente a estos agentes infecciosos extracelulares y sus toxinas. Recientemente se han descrito otras subpoblaciones de células T conocidas como células T reguladoras (Treg), cuya función principal es la de modular la respuesta inmunitaria como mecanismo de prevención del daño tisular. Estas células juegan un papel muy importante ya que una respuesta adaptativa apropiada se traduce en la eliminación del agente patógeno y la resolución de la enfermedad, pero un fallo en la regulación de esta respuesta se traduce en el desarrollo de cuadros inmunopatológicos (autoinmunidad, alergias, enfermedades por inmunocomplejos, etc.). Las células Treg son capaces de inhibir y modular los fenómenos inmunopatológicos controlando la respuesta exacerbada de los Th1, Th2, y Th17. Si este control falla, tendremos una patología inmunomediada asociada a la infección, cuyas consecuencias pueden ser peores que el daño que el propio patógeno pueda producir. Sin embargo, y SUIS Nº 124 Enero/Febrero 2016 n 85 I+D EMPRESAS I IDT BIOLOGIKA por otro lado, una sobreactivación de las Treg durante una respuesta inmunitaria puede hacer al huésped tolerante frente al patógeno, estableciendo un mecanismo de “no respuesta” frente al mismo, facilitando su implantación, multiplicación y diseminación (figura 3). RESPUESTA INMUNITARIA FRENTE AL VIRUS DE LA GRIPE El tracto respiratorio no es sólo el lugar de infección para los virus influenza, sino que también es el lugar donde se ejerce la defensa frente a la infección. Como ya se ha comentado en la introducción general, la infección de las células del tracto respiratorio origina la activación de la respuesta inmunitaria innata frente al virus. Si este es capaz de superar esta primera fase de respuesta, entonces se pone en marcha una segunda fase de inmunidad adaptativa, más específica, llevada a cabo por linfocitos T (T4 o helper y T8 o citotóxicos) y linfocitos B para la producción tanto de respuestas de tipo celular (Th1) como humoral (Th2) con producción de altos niveles de anticuerpos neutralizantes. En muchas ocasiones la patología inducida por un agente infeccioso no sólo se debe a la virulencia del mismo, sino también al desarrollo de respuestas inmunopatológicas por parte del sistema inmunitario que dañan al propio organismo. Estos fenómenos inmunopatológicos se han descrito en la infección por el virus influenza, cuya patogenicidad en algunas cepas ha sido correlacionada con una excesiva respuesta inmunitaria. La rápida acumulación de citoquinas proinflamatorias (tormenta de citoquinas) después de la infección juega un papel importante en la morbilidad y mortalidad de los individuos afectados. En ratones y humanos, niveles muy altos de citoquinas como TNF-α, RANTES (regulador de activación, secreción y expresión normal de células T), MIP 1α, y 1β (proteína inflamatoria de macrófagos) y MCP-1 (proteína-1 quimiotáctica de monocitos), fueron marcadamente altos en individuos infectados con virus H5N1, comparado con los infectados con H3N2 o H1N1. En cerdos, estas citoquinas y otras como la IL-12, IL-18 e IFN-γ juegan un papel importante en la patogénesis de influenza. La acción pleiotrópica o multifuncional de estas citoquinas, da lugar a una serie 86 n SUIS Nº 124 Enero/Febrero 2016 de signos asociados entre los que figuran el cuadro constitucional (fiebre, anorexia/ hiporexia, decaimiento), y la producción de proteínas de fase aguda (PFA) como la haptoglobina (HG), proteína de unión al lipopolisacárido (LBP) y la proteína C reactiva (PCR), fabricadas por el hígado en respuesta a la actividad de dichas citoquinas. Infecciones experimentales con virus influenza en voluntarios humanos, muestran un pico de PCR en suero tres días después de la infección. Este pico es significativamente más alto en la infección natural. En cerdos, dicho pico también se da de forma similar, encontrándose una mayor cantidad de estas proteínas de fase aguda a nivel de lavados broncoalveolares (LBA), comparados con muestras de suero. RESPUESTA INMUNITARIA INNATA Cuando el virus de la gripe infecta a las células del tracto respiratorio, la respuesta innata se pone en funcionamiento rápidamente y controla la replicación viral durante las primeras fases de la infección. Las células epiteliales pulmonares infectadas por el virus inician la respuesta inmunitaria mediante la liberación de una serie de proteínas (citoquinas y quimioquinas) que movilizan las células inmunitarias hacia el foco de infección. Los principales receptores TLR encargados de reconocer al virus de la gripe son TLR3, TLR7 y TLR8, RIG-1 y NALP-3, estos dos últimos son receptores intracelulares. La estimulación de estos TLR conlleva la producción de mediadores y citoquinas como el interferón tipo I (IFN α y β). Estos mediadores forman parte de la primera línea de defensa antiviral y modulan el paso a la inmunidad adaptativa. Estudios en animales y humanos han demostrado que la liberación temprana de altos niveles nasales y pulmonares de IFN tipo I, se correlacionan con una menor replicación del virus gripal. RESPUESTA INMUNITARIA ADAPTATIVA El reconocimiento del virus influenza por la interacción de las células del sistema inmunitario innato dará lugar a la activación de la inmunidad adaptativa, que reconocerá antígenos virales específicos para su eliminación. La respuesta inmunitaria adaptativa es específica frente a un determinado antígeno y crea memoria. La acción coordinada de las células T4 o helper, T8 citotóxicas y B efectoras (plasmáticas) serán las encargadas de eliminar la infección y de proteger contra la reinfección. Cuando los macrófagos y células dendríticas reconocen al virus en el sistema respiratorio, migran a los nódulos linfáticos regionales, donde presentarán los antígenos virales a los linfocitos T, y estos se diferenciaran a células T colaboradoras (Th o T helper) de tipo Th1, Th2 o Th17, que desarrollarán respuestas eminentemente de tipo celular, humoral (formación de anticuerpos) o mixtas. Los anticuerpos cumplen un papel relativamente pobre en las infecciones virales agudas; sin embargo son importantes en la prevención de reinfecciones. Estos anticuerpos pueden unirse a epítopos presentes en las proteínas de superficie de la partícula viral favoreciendo la neutralización del virus, que reduce su infectividad. La existencia de anticuerpos previos, puede frenar la infección más rápidamente. En la infección por virus influenza, los anticuerpos antihemaglutinina (anti-H) previenen la entrada del virus en la célula diana, mientras que los antineuraminidasa (anti-N), no son capaces de neutralizar el virus, pero limitan la liberación de partículas virales desde la superficie de la célula infectada. Como ya se ha comentado, las células T reguladoras juegan un papel muy importante en el control de mecanismos inmunopatológicos dañinos para el propio huésped. Una respuesta adaptativa apropiada se traduce en la eliminación del virus y la resolución de la enfermedad, pero un fallo en la regulación de esta respuesta por parte de estas células reguladoras se traduce en inmunopatología y daño pulmonar. Actualmente se ha demostrado que algunos virus, como el de la gripe o influenza, son capaces de sobreactivar a las células T reguladoras induciendo una respuesta de “tolerancia” a la infección, y por lo tanto, facilitando el proceso viral. Este es uno de los mecanismos de inmunoevasión empleado por el virus para su supervivencia. Otra estrategia de evasión empleada por este patógeno es a través de la proteína no estructural NS1 del virus, que es capaz de inhibir la respuesta inmunitaria del huésped bloqueando la producción de interferón tipo I (α y β).







