Descargar
Anuncio

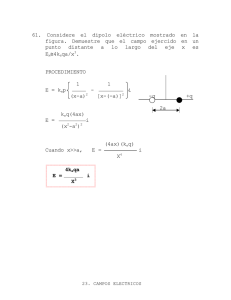
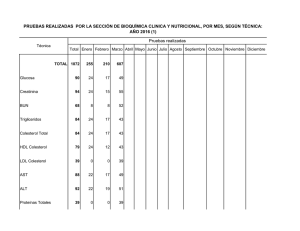
UNIVERSIDAD NACIONAL DEL CENTRO DEL PERU FACULTAD DE INGENIERÍA EN INDUSTRIAS ALIMENTARIAS DEPARTAMENTO ACADÉMICO DE CIENCIA E INGENIERÍA DE ALIMENTOS ASIGNATURA : BIOQUÍMICA GENERAL CÓDIGO : 035A DOCENTE Ing. M.Sc. EMILIO FREDY YÁBAR VILLANUEVA TEMA PRINCIPIOS DE BIOENERGÉTICA HUANCAYO-2016 OBJETIVOS 1. Explicar y analizar la aplicación de los principios de la termodinámica en la bioenergética 2. Explicar y analizar el carácter energético de la molécula del ATP y su hidrólisis. 3. Explicar los cálculos y el intercambio de energía en la célula 1 INTRODUCCION La bioenergética es una ciencia que se encarga de estudiar las transformaciones energéticas en los sistemas vivos. La energía es definida como la capacidad de realizar trabajo, el cual puede ser mecánico, eléctrico, osmótico o químico. La primera ley de la termodinámica establece el principio de conservación de la energía: La energía puede convertirse de una forma a otra, pero el total de energía del universo permanece constante. La segunda ley de la termodinámica establece la dirección de un proceso espontáneo. Un proceso espontáneo es el que resulta de un incremento neto en la entropía total, o desorden, del sistema más su medio ambiente. Una de las principales razones de estudiar bioquímica es comprender cómo los organismos vivos utilizan la energía química de su ambiente para llevar a cabo sus actividades bioquímicas. Esto requiere entender los principios más simples de fisicoquímica y termodinámica y cómo se aplican a los organismos vivos. Asimismo, se necesita conocer los llamados compuestos “ricos en energía” que permiten que el organismo vivo capture y posteriormente utilice la energía química contenida en los alimentos que consume. El sol es la fuente de energía para toda la vida existente en el planeta. Esta energía, la energía lumínica solar, es capturada por organismos fotosintéticos y utilizada para convertir el CO2 en el material celular del organismo compuesto principalmente de proteínas, carbohidratos y lípidos, pero también cantidades más pequeñas de ácidos nucleicos, vitaminas, coenzimas y otros compuestos. Algunos de estos productos de la fotosíntesis (carbohidratos y lípidos) son utilizados a su vez por organismos no fotosintéticos, principalmente animales, como fuente de energía para su crecimiento, desarrollo y reproducción. Otros compuestos esenciales que no pueden ser sintetizados por animales (ciertos aminoácidos, ácidos grasos y vitaminas) son suministrados también por los organismos fotosintéticos (principalmente plantas superiores) cuando son consumidos por los animales como alimento. Se resume en la figura 1. 2 Figura 1. Fuentes de energía y nutrientes 1. DEFINICION DE METABOLISMO Metabolismo, es la suma de transformaciones químicas que se producen en una célula u organismo (vías metabólicas). Sus principales características son: las reacciones enzimáticas están organizadas en las rutas metabólicas, un precursor se convierte en producto final a través de intermediarios, cada reacción ocasiona un pequeño cambio específico en la estructura química y las vías metabólicas son interdependientes y sus actividades están reguladas coordinadamente. En la célula intacta, se llevan a cabo simultáneamente procesos tanto sintéticos (anabólicos) como de degradación (catabólicos) y la energía liberada de algunos compuestos puede utilizarse para la síntesis de otros componentes celulares. La figura 2, muestra el ciclo del ATP-ADP y los procesos metabólicos en la célula. 3 Figura 2. Ciclo del ATP-ADP y procesos metabólicos en la célula 4 2. CONCEPTO DE ENERGIA LIBRE Energía libre (G) es la energía útil capaz de realizar trabajo. Si A se convierte en B en una reacción química. AB (1) Es posible hablar de un cambio de energía libre (ΔG). Si el contenido de energía libre del producto B (GB), es menor que el contenido de energía libre del reactivo A (G A), el ΔG será una cantidad negativa. Es decir, ΔG = GB - GA = Cantidad negativa cuando GA >GB El hecho de que ΔG sea negativo significa que la reacción ocurre con una disminución en la energía libre. Asimismo, si B se convierte de nuevo en A, la reacción implicará un incremento en la energía libre, es decir, ΔG será positivo. Las reacciones que tienen un ΔG negativo se denominan exergónicas, mientras que las que tienen un ΔG positivo se denominan endergónicas. El valor de ΔG negativo, no guarda relación alguna con la velocidad a la cual la reacción ocurre. Por ejemplo, la glucosa puede ser oxidada por el O2 en CO2 y H2O de acuerdo con la siguiente ecuación: (2) C6H12O6 + 6O2 6CO2 + 6H2O El ΔG de esta reacción es una cantidad negativa muy grande, aproximadamente -686 Kcal/mol de glucosa. Sin embargo, este -ΔG no tiene relación alguna con la velocidad de la reacción. La oxidación de la glucosa puede ocurrir en términos de pocos segundos en presencia de un catalizador en una bomba calorimétrica. La reacción 2, se efectúa también en la mayoría de los organismos vivos a velocidades que van de unos pocos minutos a varias horas. Sin embargo, la glucosa puede mantenerse almacenada en frasco por años en presencia de oxígeno sin que sufra oxidación. El factor que determina la velocidad a la cual se lleva a cabo una reacción es la energía de activación. La teoría química postula que la reacción, tendrá lugar por medio de un complejo activado o intermediario (por ejemplo, A*). La función de los catalizadores, entre ellos las enzimas, es disminuir la energía de activación y permitir que la reacción se lleve a cabo. El cambio de energía libre de una reacción puede relacionarse con otras propiedades termodinámicas de A y B mediante la expresión: ΔG = ΔH – TΔS En esta expresión, ΔH es el cambio en el contenido de calor que ocurre a medida que la reacción 1 se lleva a cabo a una presión constante; T es la temperatura 5 absoluta a la cual ocurre la reacción; y ΔS es el cambio de entropía, término que expresa el grado de aleatoriedad o desorden de un sistema. El ΔH de una reacción puede medirse en un calorímetro, un instrumento diseñado para medir cuantitativamente el calor producido a una presión constante. 3. DETERMINACIÓN DEL ΔG Para la reacción 1, puede derivarse la expresión: G = Gº+RTln (4) [B] [A] Donde ΔG° es el cambio de energía libre estándar, R, es la constante universal de los gases; T, la temperatura absoluta; y [B] y [A] las concentraciones de A y B en moles por litro. Si se considera el ΔG en el equilibrio, es posible calcular ΔG°. En el equilibrio, no existe conversión neta de A en B y, en consecuencia, el ΔG es 0. Asimismo la proporción de [B] y [A] en el equilibrio es la constante de equilibrio Keq. Sustituyendo estas cantidades en la ecuación 4 se tiene que: 0 = ΔG° + RTlnKeq (5) ΔG° = -RTlnKeq Cuando se da valor numérico de las constantes (R=1.987 cal/mol-grado; 25°C = 298°K y ln x = 2.303 log10x), la ecuación se convierte en (a 25°C): ΔG° = -(1.987) (298) (2.303) log10Keq (6) = -1363 log10Keq Esta ecuación que relaciona a ΔG° con Keq es una forma bastante útil de determinar el ΔG° de una reacción específica. En la tabla 1 se calcula ΔG° para una serie de Keq que va de 0.001 a 103. 6 TABLA 1. Relación entre Keq y ΔG° ΔG°=-1363) log10Keq(Cal) Keq Log10Keq 0.001 -3 4089 0.01 -2 2726 0.1 -1 1363 1.0 0 0 10 1 -1363 100 2 -2726 1000 3 -4089 Del mismo modo es posible evaluar ΔG° para una situación en la cual la concentración tanto de los reactivos como la de los productos sea igual a 1. Cuando [A] = [B] = 1M, la ecuación 4 se convierte en: G = Gº+RTln 1 1 = Gº De esta manera, ΔG°, puede definirse como el cambio de energía libre cuando reactivos y productos están presentes a una concentración igual a la unidad o, más ampliamente, en su “estado estándar”. El estado estándar de los solutos en solución corresponde a una molaridad de 1; para los gases, 1 atm; para los disolventes como el agua, una actividad de 1. El Cambio de energía libre estándar ΔG° a cualquier pH distinto de 0 se designa como ΔG; asimismo, debe indicarse el pH para un determinado ΔG. Por su supuesto, si no se forma ni utiliza un protón en la reacción, ΔG será independiente del pH y ΔG° será igual a ΔG. Un ejemplo demostrará el uso de estos términos. En presencia de la enzima fosfoglucomutasa, la glucosa-1-fosfato se convierte en glucosa-6-fosfato. Si se inicia con glucosa 1-fosfato 0.020 M a 25°C, se observa que la concentración de este compuesto disminuye hasta 0.001 M, mientras que la concentración de la glucosa-6fosfato aumenta hasta 0.019 M. La Keq de la reacción es 0.019 dividido entre 0.001, esto es 19. Por lo tanto: 7 ΔG° = -RTlnKeq = -1363log10Keq = -1363Log10 19 = (-1363) (1.28) = -1745 cal Las tablas 2 y 3 muestran los cambios de energía libre estándar de algunas reacciones químicas y la figura 3, muestra la hidrólisis del ATP. TABLA 2. Energía Libre Estándar Metabolitos Importantes de Hidrólisis de algunos ΔG’ a pH 7.0 (cal/mol) Fosfoenolpiruvato -14,800 AMP-cíclico -12,000 1,3-Difofoglicerato -11,800 Fosfocreatina -10,300 Acetil fosfato -10,100 S-adenosilmetionina -10,000 Pirofosfato -8,000 Acetil CoA -7500 ATP a ADP y Pi -7,300 ATP a AMP y pirofosfato -8,600 ADP a AMP y Pi -7,300 AMP a adenosina y Pi -2,200 UDP-glucosa a UDP y glucosa -8,000 Glucosa-1-fosfato -5,000 Fructuosa-6-fosfato -3,800 Glucosa-6-fosfato -3,300 sn-glicerol-3-fosfato -2,200 8 TABLA 3. Cambios de energía libre estándar de algunas reacciones químicas Figura 3. Hidrólisis del ATP 9 4. ACOPLAMIENTO DE REACCIONES En la célula, la energía disponible en una reacción exergónica suele utilizarse para promover una reacción endergónica relacionada y con ello se hace que efectúe un trabajo. Lo anterior se logra mediante el acoplamiento de reacciones que tienen intermediarios comunes. Un ejemplo específico puede ilustrar mejor este importante principio. 10 5. ΔG y OXIDORREDUCCION El ΔG de una reacción que implica un proceso de oxidorreducción puede relacionarse con la diferencia de los potenciales de oxidorreducción (ΔEO) de los reactivos. Un agente reductor puede definirse como una substancia que tiende a donar un electrón y oxidarse. 2+ 3+ Fe Fe 3+ De modo similar, el Fe +1 electrón es un agente oxidante debido a que es capaz de aceptar electrones y reducirse. Fe3+ + 1 electrón Fe2+ Las figuras 4 y 5, muestran las fórmulas moleculares de los principales transportadores de electrones. TABLA 3. Potenciales de Reducción de algunas Semirreacciones Oxidorreducción de importancia Biológica Semirreacción (Escrita como Reducción) E’O a pH 7.0 (V) ½ O2 + 2H+ + 2 e– Fe3+ + 1 e– H20 0.82 Fe2+ 0.77 Citocromo a-Fe3+ + 1e– Citocromo a-Fe2+ 0.29 Citocromo c-Fe3+ + 1e– Citocromo c-Fe2+ 0.25 Ubihidroquinona 0.10 Ubiquinona + 2H+ + 2e– – + Ácido deshidroascórbico +2H + 2e Glutatión oxidado+2H++2e– Fumarato + 2H+ + 2e– Ácido Ascórbico 0.06 2 Glutatión Reducido 0.04 Succinato Citocromo b-Fe3+ + 1 e– Citocromo b-Fe2+ – + Oxalacetato + 2H + 2e Malato – + Enzima Amarilla+2H +2e -0.04 -0.10 Enzima Amarilla Reducida -0.12 Acetaldehído + 2H+ + 2e– Piruvato + 2H+ + 2e– Etanol -0.16 Lactato – + 0.03 Riboflavina + 2H + 2e -0.19 Riboflavina-H2 + -0.20 – Acido 1,3-difosfoglicérico+2H + 2e -0.29 Gliceraldehído3-fosfato + Pi NAD+ + 2H+ + 2e– NADH + H+ Acetil CoA + 2H+ + 2e– H+ + 1e– -0.32 Acetaldehído + CoA-SH ½ H2 3+ Ferredoxina-Fe + -0.41 -0.42 – + 1e – Acetato + 2H + 2e 2+ -0.43 Acetaldehído + H20 -0.47 Ferrodoxina-Fe -0.43 11 de Figura 4. Fórmula molecular del NAD Figura 5. Fórmula molecular del FAD y FMN Otras substancias como el H+ o los compuestos orgánicos; por ejemplo: acetaldehído, pueden funcionar como agentes oxidantes y reducirse. Estas reacciones en las cuales se indica que los electrones son consumidos (o producidos), pero en las cuales no se ha indicado el donador (o aceptor), se denominan 12 semirreacciones. Sin duda, la tendencia o potencialidad de cada uno de estos agentes para aceptar o donar electrones se deberá a las propiedades específicas del compuesto y, por ende, es necesario contar con algún patrón para fines de comparación. Este estándar de comparación es del H2, al cual se ha dado arbitrariamente el potencial de reducción, EO de 0.000 V, a pH 0 para la semirreacción: H+ + 1 e– ½ H2 Puesto que la anterior reacción consume un protón, el potencial de esta semirreacción variará con el pH, y a pH 7.0, se estima que el potencial de reducción E’O de dicha reacción es -0.420 V. Utilizando este valor como estándar, puede determinarse el potencial de reducción de cualquier compuesto capaz de sufrir oxidorreducción con respecto al hidrógeno. La tabla 3, es una lista de dichos potenciales, e incluye varias coenzimas y substratos. Nótese que estos potenciales son para las reacciones escritas como reducciones. Cuando dos reacciones cualesquiera de esta tabla se acoplan, la que tenga el potencial de reducción más positivo procederá como se escribe (es decir, como una reducción), impulsando en sentido inverso la semirreacción con el potencial de reducción menos positivo (es decir, como una oxidación). Cualitativamente, es posible observar que los compuestos con los potenciales de reducción más positivos (por ejemplo: O 2 o Fe3+) son buenos agentes oxidantes, mientras que los que presentan los potenciales de reducción más negativos son agentes reductores (por ejemplo: H2 o NADH). Asimismo, es posible derivar la expresión ΔG’ = -n ΔE’O, donde: n es el número de electrones transferidos en una reacción de oxidorreducción;, la constante de Faraday (23063 cal/V equivalente) y ΔE’O la diferencia de potencial de reducción entre los agentes oxidante y reductor. Es decir, ΔE’O = [E’O de la semirreacción que contiene el agente oxidante] – [E’O de la semirreacción que contiene el agente reductor] Por ejemplo considérese la reacción total que resulta del acoplamiento de dos semirreacciones que incluyen acetaldehído y NAD+. Puesto que este valor es una cantidad negativa grande, la reacción es termodinámicamente factible. Con la información con que se cuenta, no es posible determinar si la reacción ocurrirá o no a una velocidad detectable. De manera similar, puede calcularse el ΔG’ de la oxidación del NADH por el O2 molecular, una reacción común en los tejidos vivos. 13 NADH + H+ + ½ O2 NAD+ + H20 En esta reacción, n = 2, ΔE’O = 0.82 – (-0.32) ó 1.14 V, y ΔG’ = -n ΔE’O = (-2) (23 063) (1.14) = -52 600 cal 6. BIBLIOGRAFIA 1. Boyer, R. 2000 Conceptos de Bioquímica. Edit. International Thomson Editores. México. 2. Campbell, M. y Farrell, S. 2004. Bioquímica. Edit. THOMSON. México. 3. Conn, E., Stumpf, P., Bruening, P. y Doi, R. 2001. Bioquímica Fundamental. Edit. LIMUSA México. 4. Horton, H. 2007. Principios de Bioquímica. Edit. Pearson Educación. MadridEspaña. 5. Macarulla, J., Marino, A. Macarulla, A. 2002. Bioquímica Cuantitativa. II Cuestiones sobre Metabolismo. Edit. REVERTE S.A. Barcelona España. Visitar las siguientes páginas 1. http://www.ufpel.edu.br/iqg/db/Apresenta%E7%F5es_PPT/ana_chaves.htm 2. http://www.uco.es/organiza/departamentos/bioquimica-biolmol/practicasgenerales.htm 14