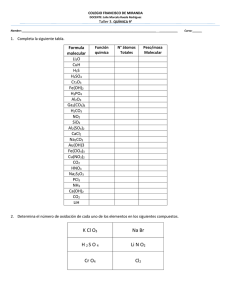
1. El tricloro de fósforo, PCl 3, es un compuesto
Anuncio

1. El tricloro de fósforo, PCl3, es un compuesto importante desde el punto de vista comercial y es utilizado en la fabricación de pesticidas, aditivos para la gasolina y otros muchos productos. El PCl3 se obtiene por combinación directa del fósforo y el cloro: P4(s) + Cl2(g) → PCl3(l) ¿qué masa de PCl3(l) se forma en la reacción de 125 g de P4 con 323 g de Cl2 y cuanto reactivo en exceso sobra? 2. Si en el ejercicio anterior, se hacen reaccionar 215 g P4 con 725 g de Cl2, ¿cuántos gramos de PCl3 se formarían y cuanto reactivo en exceso sobra? 3. Si se hace reaccionar 1kg de cada uno de los siguientes compuestos: PCl3, Cl2 y P4O10, ¿cuántos kilogramos de POCl3 se formarán y cuanto reactivo en exceso sobra? PCl3(l) + Cl2(g) + P4O10(s) → POCl3(l) 4. Si se hacen reaccionar 12.2 g de H2 y 154 g de O2, ¿qué gas es el reactivo limitante y que cantidad queda en exceso después de la reacción? ¿Cuánto producto se forma? H2(g) + O2(g) → H2O(l) 5. Una reacción secundaria en el proceso de fabricación del rayón a partir de pulpa de madera es: CS2 + NaOH → Na2CS3 + Na2CO3 + H2O ¿Cuántos gramos de Na2CS3 se producen en la reacción de 92.5 ml de CS2 líquido (d=1.26 g/ml) y 2.78 moles de NaOH? ¿Cuánto reactivo en exceso sobra? ¿Cuántos gr de Na2CO3 y H2O se generan?