Intoxicación accidental por alcohol metílico
Anuncio
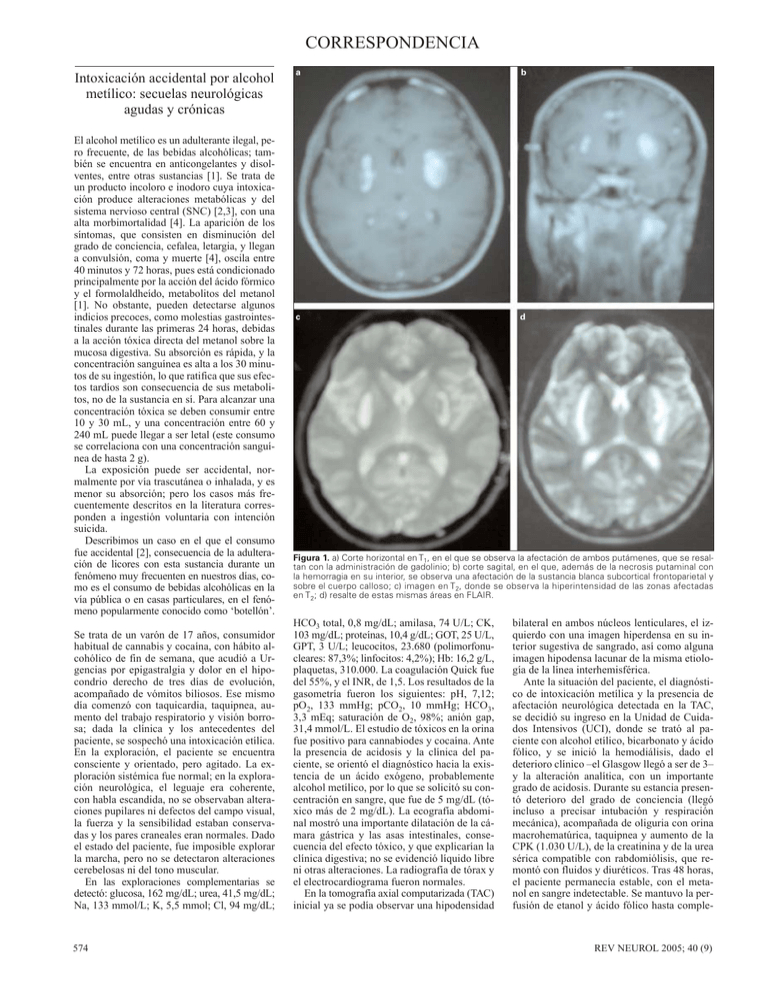
CORRESPONDENCIA Intoxicación accidental por alcohol metílico: secuelas neurológicas agudas y crónicas El alcohol metílico es un adulterante ilegal, pero frecuente, de las bebidas alcohólicas; también se encuentra en anticongelantes y disolventes, entre otras sustancias [1]. Se trata de un producto incoloro e inodoro cuya intoxicación produce alteraciones metabólicas y del sistema nervioso central (SNC) [2,3], con una alta morbimortalidad [4]. La aparición de los síntomas, que consisten en disminución del grado de conciencia, cefalea, letargia, y llegan a convulsión, coma y muerte [4], oscila entre 40 minutos y 72 horas, pues está condicionado principalmente por la acción del ácido fórmico y el formolaldheído, metabolitos del metanol [1]. No obstante, pueden detectarse algunos indicios precoces, como molestias gastrointestinales durante las primeras 24 horas, debidas a la acción tóxica directa del metanol sobre la mucosa digestiva. Su absorción es rápida, y la concentración sanguínea es alta a los 30 minutos de su ingestión, lo que ratifica que sus efectos tardíos son consecuencia de sus metabolitos, no de la sustancia en sí. Para alcanzar una concentración tóxica se deben consumir entre 10 y 30 mL, y una concentración entre 60 y 240 mL puede llegar a ser letal (este consumo se correlaciona con una concentración sanguínea de hasta 2 g). La exposición puede ser accidental, normalmente por vía trascutánea o inhalada, y es menor su absorción; pero los casos más frecuentemente descritos en la literatura corresponden a ingestión voluntaria con intención suicida. Describimos un caso en el que el consumo fue accidental [2], consecuencia de la adulteración de licores con esta sustancia durante un fenómeno muy frecuenten en nuestros días, como es el consumo de bebidas alcohólicas en la vía pública o en casas particulares, en el fenómeno popularmente conocido como ‘botellón’. Se trata de un varón de 17 años, consumidor habitual de cannabis y cocaína, con hábito alcohólico de fin de semana, que acudió a Urgencias por epigastralgia y dolor en el hipocondrio derecho de tres días de evolución, acompañado de vómitos biliosos. Ese mismo día comenzó con taquicardia, taquipnea, aumento del trabajo respiratorio y visión borrosa; dada la clínica y los antecedentes del paciente, se sospechó una intoxicación etílica. En la exploración, el paciente se encuentra consciente y orientado, pero agitado. La exploración sistémica fue normal; en la exploración neurológica, el leguaje era coherente, con habla escandida, no se observaban alteraciones pupilares ni defectos del campo visual, la fuerza y la sensibilidad estaban conservadas y los pares craneales eran normales. Dado el estado del paciente, fue imposible explorar la marcha, pero no se detectaron alteraciones cerebelosas ni del tono muscular. En las exploraciones complementarias se detectó: glucosa, 162 mg/dL; urea, 41,5 mg/dL; Na, 133 mmol/L; K, 5,5 mmol; Cl, 94 mg/dL; 574 a b c d Figura 1. a) Corte horizontal en T1, en el que se observa la afectación de ambos putámenes, que se resaltan con la administración de gadolinio; b) corte sagital, en el que, además de la necrosis putaminal con la hemorragia en su interior, se observa una afectación de la sustancia blanca subcortical frontoparietal y sobre el cuerpo calloso; c) imagen en T2, donde se observa la hiperintensidad de las zonas afectadas en T2; d) resalte de estas mismas áreas en FLAIR. HCO3 total, 0,8 mg/dL; amilasa, 74 U/L; CK, 103 mg/dL; proteínas, 10,4 g/dL; GOT, 25 U/L, GPT, 3 U/L; leucocitos, 23.680 (polimorfonucleares: 87,3%; linfocitos: 4,2%); Hb: 16,2 g/L, plaquetas, 310.000. La coagulación Quick fue del 55%, y el INR, de 1,5. Los resultados de la gasometría fueron los siguientes: pH, 7,12; pO2, 133 mmHg; pCO2, 10 mmHg; HCO3, 3,3 mEq; saturación de O2, 98%; anión gap, 31,4 mmol/L. El estudio de tóxicos en la orina fue positivo para cannabiodes y cocaína. Ante la presencia de acidosis y la clínica del paciente, se orientó el diagnóstico hacia la existencia de un ácido exógeno, probablemente alcohol metílico, por lo que se solicitó su concentración en sangre, que fue de 5 mg/dL (tóxico más de 2 mg/dL). La ecografía abdominal mostró una importante dilatación de la cámara gástrica y las asas intestinales, consecuencia del efecto tóxico, y que explicarían la clínica digestiva; no se evidenció líquido libre ni otras alteraciones. La radiografía de tórax y el electrocardiograma fueron normales. En la tomografía axial computarizada (TAC) inicial ya se podía observar una hipodensidad bilateral en ambos núcleos lenticulares, el izquierdo con una imagen hiperdensa en su interior sugestiva de sangrado, así como alguna imagen hipodensa lacunar de la misma etiología de la línea interhemisférica. Ante la situación del paciente, el diagnóstico de intoxicación metílica y la presencia de afectación neurológica detectada en la TAC, se decidió su ingreso en la Unidad de Cuidados Intensivos (UCI), donde se trató al paciente con alcohol etílico, bicarbonato y ácido fólico, y se inició la hemodiálisis, dado el deterioro clínico –el Glasgow llegó a ser de 3– y la alteración analítica, con un importante grado de acidosis. Durante su estancia presentó deterioro del grado de conciencia (llegó incluso a precisar intubación y respiración mecánica), acompañada de oliguria con orina macrohematúrica, taquipnea y aumento de la CPK (1.030 U/L), de la creatinina y de la urea sérica compatible con rabdomiólisis, que remontó con fluidos y diuréticos. Tras 48 horas, el paciente permanecía estable, con el metanol en sangre indetectable. Se mantuvo la perfusión de etanol y ácido fólico hasta comple- REV NEUROL 2005; 40 (9) CORRESPONDENCIA a b c Figura 2. Imagen en T1 (a) y T2 (b, c), donde se observan todavía las lesiones en los ganglios basales y en la sustancia blanca; observamos la variación de la señal respecto a la previa del área hemorrágica, así como un menor volumen del área afectada. tar 72 horas; durante este período sufrió una infección respiratoria, de la que mejoró satisfactoriamente con un tratamiento antibiótico adecuado. Dada la buena evolución, la posibilidad de desintubar al paciente y su estabilidad clínica –de hecho, el paciente sólo se quejaba de visión borrosa y disfonía, en un principio atribuida a la intubación–, se decidió su paso a planta, donde, además de la clínica referida, aparecieron movimientos muy llamativos coreoatetósicos, predominantes en los miembros superiores. En la exploración se encontraba consciente y orientado, con hipoestesia en el territorio L4, L5 y S1, con sensibilidad artrocinética y propioestésica abolida. El balance muscular en los miembros inferiores (MMII) era: psoas, 3/5 (derecho 3+), cuádriceps, 4/5. Presentaba reflejo cutaneoplantar bilateral extensor y ligeros edemas en los MMII. La hemoglobina es de 10 mg/dL; el VCM, 84 fl; la LDH, 586; el Fe, 40 μg/dL; la ferritina, 318 ng/mL; la transferrina 165 μg/dL; la saturación de Fe, 19,4%; el resto, normal. Se mantuvo la disfonía, en un primer momento atribuida a la intubación, pero que también se ha relacionado con la afectación neurológica; éste parece el origen más probable en este caso, dadas las características de la voz y la persistencia de la sintomatología. La exploración oftalmológica fue compatible con neuritis retrobulbar mayor en el ojo derecho; la agudeza visual era de 1, los movimientos oculares, normales, y el campo visual estaba preservado. En la oftalmoscopia se detectó un ligero borramiento del bordetemporal superior del ojo derecho, dudoso en el ojo izquierdo, y el resto era normal. En la RM (Fig. 1) de control realizada a los 10 días del ingreso se observa una alteración de la señal de diverso tamaño y morfología localizada en el tronco cerebral y ambos núcleos lenticulares, y de situación cortical y subcortical en los lóbulos parietales, manifestada por una hiperintensidad en la secuencia en FLAIR y T2 con captación, a excepción de las lesiones localizadas en el tronco; en el núcleo lenticular izquierdo se observó un área hiperintensa rodeada de un halo hipodenso en T2 e hiperintenso en T1, en REV NEUROL 2005; 40 (9) relación con un componente hemorrágico. En difusión, sólo existían alteraciones en el núcleo talámico izquierdo y en pequeñas regiones corticales parasagitales. Desde entonces, hasta el alta, el paciente permaneció estable con dolor neuropático, en remisión tras un tratamiento con triptizol. Al mes del diagnóstico, la disfonía había mejorado y los movimientos coreicos habían desaparecido. En la exploración se observaba una leve mejoría de la fuerza (4+/5 en el psoas, 4/5 en el tibial anterior, y el resto sin cambios), una hipoestesia en L4, L5 y S1, reflejo cutaneoplantar extensor, hiperreflexia en los MMII y distonía pasiva en los MMII, manifestada con un pie en equino varo. En la RM de control, a los tres meses (Fig. 2), persistía la lesión en ambos putámenes, aunque había disminuido de tamaño, así como en la región cortical de los lóbulos frontales por encima de la rodilla del cuerpo calloso; no se objetivaron lesiones del nervio óptico, si bien no se realizaron cortes específicos. Actualmente, persiste una disminución de la agudeza visual en el ojo izquierdo, con palidez papilar en la oftalmoscopia, la hiperreflexia en los MMII con posición en equino varo y reflejo cutaneoplantar extensor, con mejoría de la fuerza y remisión de la afonía. En la literatura existen casos similares al descrito [5-8], pero las características epidemiológicas hicieron difícil el diagnóstico, ya que el propio paciente desconocía la adulteración de la bebida ingerida con esta sustancia, mientras que la mayoría de los casos tienen intención suicida. Por otra parte, la latencia de los síntomas, en este caso, es algo mayor a la descrita –casi cuatro días, aunque retrospectivamente se pudo sospechar antes–; comenzó con sintomatología digestiva incluso antes de la consulta en Urgencias, para aparecer posteriormente la clínica neurológica. Este hecho corrobora la idea de que la toxicidad se debe a los metabolitos (fórmico y formolaldehído) de esta sustancia, más que al mismo agente tóxico, que resulta relativamente inocuo per se [9], aunque el mecanismo exacto de esta le- sión todavía se discute. Existe una tendencia a producir afectación simétrica en regiones específicas; la naturaleza de estas estructuras (tegmento pontino, putamen, caudado, nervio óptico) orientan a la isquemia, dado que corresponden a regiones hipoperfundidas o regiones vasculares limítrofes; de hecho, se ha demostrado estasis en la vena de Rosenthal y signos de hipoperfusión en las arterias lenticuloestriadas [5]; pero la atrofia óptica, fundamentalmente retroquiasmática, parece deberse a un efecto mieloclástico directo del ácido fórmico, sin afectación axonal [10]; de hecho, se ha detectado desmielinización en los estudios autópsicos [4,9], y se ha demostrado la acción del formolaldehído como inhibidor de la citocromo oxidasa. El mecanismo de la hemorragia también se debate, dado que la mayoría de los pacientes que llegan a tener esta alteración radiológica se hemodializan; se ha propuesto que ésta sea secundaria a la heparinización, pero no podemos descartar la transformación hemorrágica de una isquemia previa, especialmente si consideramos que esa es la naturaleza de las otras lesiones; de hecho, en nuestro caso el sangrado fue anterior a la hemodiálisis. A favor de la hipótesis toxicometabólica se encuentra el hecho de que estas mismas alteraciones se observan en otras patologías, como la intoxicación por CO, la atrofia óptica de Leber, la acidosis láctica congénita o síndrome de Leigh, el síndrome de Wilson o síndrome de Kearns-Sayre, patologías que se deben al acúmulo de sustancias tóxicas como consecuencia de un déficit en diversas rutas metabólicas y que indican la especial susceptibilidad de estas regiones, y el paralelismo con esta intoxicación no es sólo radiológico, sino también asintomático [5,9,10]. Esto se debería a la especial susceptibilidad de los ganglios basales al déficit energético; teóricamente, el déficit de ácido fólico, cofactor de la citocromo oxidasa [5,9] necesario para la formación de CO2, sería el responsable. Asimismo, se ha detectado hiperamoniemia en relación con los ganglios basales; incluso, se ha sugerido que se debe a una mayor acumulación de metanol en estas regiones [6]. 575 CORRESPONDENCIA Entre los hallazgos radiológicos destaca la necrosis simétrica de ambos putámenes [11], con cierto grado de hemorragia en algunos casos, como el previo; pero también se han descrito otros, como necrosis cerebelosa, edema cerebral, necrosis de la sustancia blanca (de etiología discutida, ya que según algunos autores se deberían a edema, mientras otros apoyan la teoría isquémica) [5,12,13], y hasta hemorragia subaracnoidea [14], asociándose con el pronóstico algunos de ellos, como la afectación subcortical del tegmento; la transformación hemorrágica [15] cursa con una importante afectación residual. Destaca el hecho de que, si bien durante las primeras 24 horas la TAC es normal, a partir de este período se pueden detectar alteraciones como la afectación putaminal, especialmente cuando existe hemorragia [15,16], y posteriormente incluso afectación subcortical y necrosis putaminal. Esto es importante porque, si bien el grado de acidosis es el que nos da el pronóstico vital –hasta el 75% muere en las primeras 48 h–, la afectación del SNC tiene importantes correlaciones con la evolución las secuelas, y dado que en la mayoría de los centros no existe acceso a una RM de urgencias, mientras la TAC de urgencias es accesible en la mayoría de ellos. Consideramos que las alteraciones en las pruebas de imagen tienen una importante validez pronóstica en cuanto a la persistencia de síntomas como rigidez, temblor, cara de máscara, discurso monótono, incluso movimientos anormales, como en el presente caso; a diferencia de lo que sucede en patologías congénitas, suelen remitir con el tiempo por mecanismos de adaptación y compensación de las neuronas remanentes, y, como otros casos de afectación extrapiramidal, mejoran con levodopa. Dada la trascendencia de esos fenómenos, se establece la necesidad de un tratamiento agresivo y precoz, basado en antagonizar la enzima implicada en la trasformación del metanol en sus metabolitos. En el tratamiento se ha empleado etanol en dosis variable según la gravedad, aunque, dada la posibilidad de producir depresión respiratoria, también se ha empleado fomepicilo [2]. En nuestro caso, se valoraron las dos opciones; pero, dado que en España sólo se autoriza el uso de la segunda para concentraciones superiores a 20 mg/dL [2,17] y, en ocasiones, si el pH es inferior a 7,3 o el bicarbonato menor de 20, se optó por el empleo de etanol. La gravedad de la acidosis hizo necesaria la hemodiálisis. Por otro lado, ciertas lesiones, como un importante edema [5], condicionan la necesidad de tratamiento específico con diuréticos, hiperventilación y concentraciones más altas de etanol –hasta 20%, en lugar del 5% empleado habitualmente–. Asimismo, la afectación radiológica ayuda a predecir el riesgo hemorrá- 576 gico, y algunos autores, como Phang et al, llegan a postular la conveniencia de realizar hemodiálisis sin heparinización [7]. La correlación clinicorradiológica es clara; las manifestaciones neurológicas subagudas se deben a la afectación de los ganglios basales y producen movimientos coreicos muy llamativos, comunes a otras enfermedades en las que éstos también se lesionan; posteriormente, desaparecen y persisten los signos de piramidalismo, probablemente secundario a un mecanismo compensatorio por neuronas remanentes, con una leve mejoría radiológica. Generalmente, son permanentes, aunque existe algún caso con tratamiento precoz en el que se ha observado una remisión de la sintomatología. Debemos tener presente, en consecuencia, el diagnóstico de intoxicación metílica en todo paciente joven asociado a consumo de alcohol, dado que, además, éste retrasa la aparición de los síntomas –la concentración sanguínea máxima se encuentra hasta 52 horas después [2]– y dificulta, en ocasiones, la sospecha; pero, provoca una importante lesión celular. Ante una disminución del grado de conciencia y acidosis metabólica, se deben realizar determinaciones séricas, ya que los métodos espirométricos no distinguen los distintos tipos de alcohol, y también una prueba de imagen, ya que se trata de un cuadro potencialmente tratable con importantes secuelas –alteraciones visuales, rigidez, temblor y otros síntomas extrapiramidales, con movimientos anormales en un primer momento y disminución de la fuerza y alteración del tono muscular residual, que puede condicionar posturas distónicas, como en el presente caso– [10]; afecta a centros importantes, como la cápsula interna, el putamen o el nervio óptico, cuya repercusión en la actividad diaria es importante, y condiciona déficit incluso en pacientes totalmente asintomático en un primer momento; el diagnóstico y el tratamiento precoz influyen en este pronóstico [7]. L. Turpín-Fenoll a, S. Martí-Martín a, C. Martín-Estefanía a, J.M. Seguí-Ripoll b Aceptado: 21.02.05. a Servicio de Neurología. b Servicio de Medicina Interna. Hospital General Universitario de Alicante. Alicante, España. Correspondencia: Dra. Laura Turpín Fenoll. Conde Roche, 4, 4.º A. E-30004 Murcia. E-mail: lturdoc@ hotmail.com BIBLIOGRAFÍA 1. Roldán J, Frauca C, Dueñas A. Intoxicación por alcoholes. An Sist Sanit Navar 2003; 26: 129-39. 2. Karen A, Lshine M, Carson R, Harris D. Methanol ingestion: prevention of toxic sequelae after massive ingestion. J Emerg Med 2003; 24: 433-6. 3. Cursiefen C, Bergua A. Acute bilateral blindness caused by accidental methanol intoxication during fire ‘eating’. Br J Ophthamol 2002; 86: 1064-5. 4. Mittal BV, Desai AP, Khade KR. Methyl alcohol poisoning: an autopsy study of 28 cases. J Postgrad Med 1991; 37: 9-13. 5. McLean DR, Jacobs H, Mielks BW. Methanol poisoning: a clinical and pathological study. Ann Neurol 1980; 8: 161-7. 6. Andreu P, Fonteno MD, Victoria S. Development of neurologic symptoms in a 26-yearold woman following recovery from methanol intoxication. Pulmonary and Critical Care Pearls 2002; 122: 1436-8. 7. Phnag PR, Passori L, Mielke B. Bilateral putaminal hemorrhage associated with methanol poisoning. Crit Care Med 1988; 16: 137-40. 8. Sutton TL, Foster RL, Liner SR. Acute methanol ingestion. Pediatr Emerg Care 2002; 18: 360-3. 9. Onder F, Ilker S, Kansu T, Kural G. Acute blindness and putaminal necrosis in methanol intoxication. Int Ophthalmol 1999; 22: 81-4. 10. Sharpe JA, Hostovsky M, Bilbao JM, Rewcastle NB. Methanol optic neuropathy: a histopathologic study. Neurology 1982; 32: 1093-100. 11. Raymond J, Roberge MD, Faem A. Putaminal infarct in methanol intoxication: case report and role of imaging studies. Vet Hum Toxicol 1999; 40: 94-8. 12. Suit PF, Estes ML. Methanol intoxication a clinical features and differential diagnosis. Cleve Clin J Med 1990; 57: 464-71. 13. Rubstein D, Escott E, James P. Methanol intoxication with putaminal and white matter necrosis: MR and CT findings. AJNR Am J Neuroradiol 1995; 16: 1492-4. 14. Del Carpio-O’Donovan R, Glay J. Subarachnoid hemorrhage resulting from methanol intoxication: demonstration by computed tomography. Can Assoc Radiol J 1992; 43: 299-301. 15. Kuteifan K, Oesterle H, Tajahmady T, Gutbub AM, Laplatte G. Necrosis and haemorrhage of putamen en methanol poisoning shown on MRI. Neuroradiology 1998; 40: 158-60. 16. Comoglu S, Ozen B, Ozbakir S. Methanol intoxication with bilateral basal ganglia infarct. Australas Radiol 2001; 45: 357-8. 17. Pamies RJ, Sugar D, Rives LA, Herold AH. Metanol intoxication: how to help patients who have been exposed to toxic solvents. Postgrad Med 1993; 93: 189-91. REV NEUROL 2005; 40 (9)