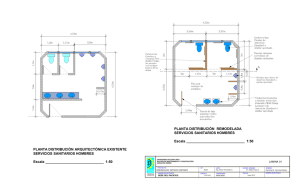
Informe de Novedades Farmacoterapéuticas
Anuncio

Dirección General de Farmacia y Productos Sanitarios Informe de Novedades Farmacoterapéuticas de la Comunidad de Madrid Enero 2007 0 Nuevos principios activos autorizados Ropinirol (Adartrel®) - Rotigona (Neupro®) - Sorafenib (Nexavar®) Sunitinib (Sutent®) - Vareniclina (Champix®) 2 Nuevas asociaciones de principios activos ya comercializados Glimepirida/Rosiglitazona (Avaglim®) 6 Nuevas indicaciones autorizadas Clopidogrel (Plavix®, Iscover®) 6 Nuevas formas farmacéuticas de interés Desmopresina (Minurin Flas®) 7 Primeros genéricos Bicalutamida - Iohexol - Perindopril 7 Nuevos principios activos que han obtenido dictamen positivo para su autorización Bupropion (Elontril®) - Sitagliptin (Januvia® /Xelevia®) 7 Nuevas indicaciones con opinión positiva para su autorización Vacuna neumocócica conjugada (Prevenar®) Dirección General de Farmacia y Productos Sanitarios 8 Dirección General de Farmacia y Productos Sanitarios. Consejería de Sanidad y Consumo. Enero 2007. Número 0 Objetivo Este informe constituye una herramienta de ayuda a los profesionales en la identificación de las novedades relevantes que afectan a los medicamentos incluidos en la prestación farmacéutica del Sistema Nacional de Salud, así como a otros medicamentos, autorizados o con dictamen positivo para su autorización. Además, se pretende proporcionar una información básica incluyendo referencias bibliográficas o direcciones de internet para facilitar a los profesionales la posibilidad de ampliar sus conocimientos sobre los medicamentos incluidos. Fuentes de consulta para la selección de novedades farmacoteraNota Informativa mensual de la Agencia Española de Medicamentos y Productos Sanitarios. Nomenclator del Ministerio de Sanidad y Consumo. Metodología Tras la revisión de las fuentes consultadas se realiza una selección de las novedades que se incluirán en el informe considerando: para su autorización procede de la Nota Informativa mensual de la Agencia Española de Medicamentos y Productos Sanitarios. • los nuevos principios activos autorizados y aquellos que han obtenido un dictamen positivo para su autorización Los datos relativos a los nuevos principios activos, nuevas formas farmacéuticas, nuevas dosificacines y nuevas asociaciones de principios activos autorizados incluidos en el informe corresponden a: nombre del o los principios activos; nombre comercial; grupo terapéutico; código ATC; presentaciones; laboratorio titular de la autorización; fecha de autorización; si procede, fecha de comercialización, precio y tipo de aportación; indicaciones; notas de interés y referencias bibliográficas o direcciones de internet. • las nuevas asociaciones de principios activos ya comercializados, autorizadas o con dictamen positivo para su autorización • las nuevas indicaciones de principios activos ya comercializados, autorizadas o con opinión positiva para su autorización. • las nuevas formas farmacéuticas o nuevas dosificaciones de principios activos ya comercializados que puedan presentar un interés especial para los clínicos. • los principios activos autorizados por primera vez como genéricos o con opinión positiva para su autorización. Se incluye información tanto de medicamentos ya comercializados, como de aquellos autorizados, pero aún no comercializados. La información sobre las novedades que han obtenido opinión positiva Nuevos principios activos autorizados1 En el caso de los nuevos principios activos o asociaciones que han obtenido opinión positiva para su autorización por parte de la Agencia Española de Medicamentos y Productos Sanitarios, se incluyen los siguientes datos: nombre del o los principios activos, nombre comercial, laboratorio solicitante de la autorización, indicaciones, notas de interés y referencias bibliográficas o direcciones de internet. Se trata de medicamentos que, tras haber sido evaluados, han obtenido una opinión favorable para ser autorizados. Por lo tanto, aún no están comercializados. ROPINIROL (Adartrel®) Grupo terapéutico: agonistas dopaminérgicos Código ATC: N04BC04 Presentaciones: ADARTREL 0,25 mg, ADARTREL 0,50 mg, ADARTREL 1 mg, ADARTREL 2 mg comprimidos recubiertos con película. Los formatos autorizados son: 28 y 84 comprimidos, salvo para la presentación de 0,25 mg. En este caso son: 2 y 12 comprimidos. En la Ficha Técnica se señala que es posible que se comercialicen sólo algunos tamaños de envases. Laboratorio: GlaxoSmithKline Fecha de autorización: 4-7-2006 Se incluyen medicamentos autorizados independientemente de si están comercializados o no. 1 Dirección General de Farmacia y Productos Sanitarios Dirección General de Farmacia y Productos Sanitarios. Consejería de Sanidad y Consumo. Informe de Novedades Farmacoterapéuticas. Nuevos principios activos autorizados Fecha de comercialización: enero de 2007. Las presentaciones actualmente comercializadas son: Adartrel 0,25 mg 12 comprimidos recubiertos con película, Adartrel 0,50 mg 84 comprimidos con película y Adartrel 2 mg 28 comprimidos con película. Precio (PVP-IVA): 1,62; 20,58 y 16,95 euros, respectivamente. Aportación: reducida. Indicaciones: tratamiento sintomático del síndrome de piernas inquietas idiopático de moderado a grave. Notas de interés: ropinirol está autorizado desde 1997, aunque sólo para el tratamiento del Parkinson. El titular de la autorización es también GlaxoSmithKline y el nombre comercial es Requip. Adartrel sólo se ha aprobado para el síndrome de piernas inquietas, no tiene la indicación de Parkinson. Por tanto, la compañía, comercializa ropinirol con dos nombres comerciales diferentes: Requip para Parkinson y Adartrel para síndrome de piernas inquietas. Por este motivo, la información sobre Adartrel se incluye en este apartado y no en el de nuevas indicaciones. Más información: - http://www.fda.gov/bbs/topics/ANSWERS/2005/ANS01356.html - http://www.fda.gov/cder/foi/label/2005/020658s013lbl.pdf - http://www.keele.ac.uk/schools/pharm/MTRAC/ProductInfo/verdicts/R/RopiniroleRLS.pdf. - http://www.attract.wales.nhs.uk/question_answers.cfm?question_id=2328 - http://www.tripdatabase.com/SearchResults.html?s=1&gk=ropinirole+cochrane+restless&itemId=249549 - http://www.uwo.ca/cns/ebn/CATs/move-rls-ropinirole.htm ROTIGONA (Neupro®) Grupo terapéutico: agonistas dopaminérgicos Código ATC: N04BC09 Presentaciones: NEUPRO 2 mg/24 h, 4 mg/24 h, 6 mg/24 h y 8 mg/24 h parches transdérmicos. Los formatos autorizados son: 7, 20, 28, 30, 56, 60, 84, 90 y 100. En la Ficha Técnica se señala que puede que solamente estén comercializados algunos tamaños de envases. NEUPRO 2 mg/24 h + 4 mg/24 h + 6 mg/24 h + 8 mg/24 h 7+7 parches transdérmicos (envase “de inicio”). Laboratorio: Schwarz Pharma Limited Fecha de autorización: 21-4-2006. Para Neupro 2mg/24h+4mg/24h+6mg/24h+8mg/24h 7+7 parches transdérmicos: 28-6-2006 Fecha de comercialización: enero de 2007. Los formatos comercializados, además del envase “de inicio”, son: los de 7 parches y los de 28 parches (con la excepción de Neupro 2 mg/24 horas que sólo está comercializado en formato de 7 parches). Precio (PVP-IVA): 40,21 euros (Neupro 2 mg/24 h). Resto: 105,19-158,81 euros. Aportación: reducida, salvo Neupro 2 mg/24 h 7 parches transdérmicos que está excluido de la financiación con cargo a fondos del Sistema Nacional de Salud. En la actualidad, el laboratorio está tramitando su inclusión en la financiación. Indicaciones: tratamiento de los signos y síntomas de la etapa inicial de la enfermedad de Parkinson idiopática como monoterapia (es decir, sin L-dopa) o en combinación con levodopa, es decir, a lo largo de la enfermedad, durante los estadíos finales, cuando se reduce el efecto de la levodopa o se vuelve incoherente y se producen fluctuaciones de su efecto terapéutico (fin de dosis o fluctaciones “on-off ”) Notas de interés: antiparkinsoniano disponible en forma de parches. En caso de dosis superiores a 8 mg/24 horas pueden aplicarse varios parches. Dosis máxima: 16 mg/24 h. Más información: • http://www.emea.europa.eu/humandocs/PDFs/EPAR/neupro/H-626-PI-es.pdf • http://www.nelm.nhs.uk/Record%20Viewing/viewRecord.aspx?id=568827 Dirección General de Farmacia y Productos Sanitarios Dirección General de Farmacia y Productos Sanitarios. Consejería de Sanidad y Consumo. Enero 2007. Número 0 Nuevos principios activos autorizados • http://www.scottishmedicines.org.uk/updocs/rotigotine%20(NEUPRO)%20(287-06).pdf • Babic T, Boothmann B, Polivka J, Rektor I, Boroojerdi B, Hack HJ et al. Rotigotine transdermal patch enables rapid titration to effective doses in advanced-stage idiopathic Parkinson disease: subanalysis of a parallel group, open-label, dose-escalation study. Clin Neuropharmacol. 2006;29:238-42. • Guldenpfennig WM, Poole KH, Sommerville KW, Boroojerdi B. Safety, tolerability, and efficacy of continuous transdermal dopaminergic stimulation with rotigotine patch in early-stage idiopathic Parkinson disease. Clin Neuropharmacol. 2005;28:106-10. • The Parkinson Study Group. A controlled trial of rotigotine monotherapy in early Parkinson’s disease. Arch Neurol 2003;60:1721-8. SORAFENIB (Nexavar®) Grupo terapéutico: inhibidores de la proteinquinasa Código ATC: L01XE05 Presentaciones: NEXAVAR 200 mg 112 comprimidos recubiertos con película. Laboratorio: Química Farmacéutica Bayer. Fecha de autorización: 15-1-2007. Fecha de comercialización: enero de 2007. Precio (PVP-IVA): 3.738,7 euros Aportación: reducida. Indicaciones: tratamiento de pacientes con carcinoma de células renales avanzado en los que ha fracasado la terapia previa con interferón-alfa o interleukina-2 o que se consideran inapropiados para dicha terapia. Notas de interés: es de Diagnóstico Hospitalario. La dosis recomendada es de 800 mg (4 comprimidos) al día, administrando 2 comprimidos cada 12 horas. Según la Ficha Técnica el empleo de Nexavar “debe ser supervisado por un médico experimentado en el uso de terapias anticáncer”. Más información: • http://www.emea.europa.eu/humandocs/PDFs/EPAR/nexavar/H-690-PI-es.pdf • http://www.fda.gov/cder/foi/nda/2005/021923_s000_NexavarTOC.htm • http://www.australianprescriber.com/upload/pdf/articles/849.pdf • http://www.scottishmedicines.org/updocs/sorafenib%20200mg%20tablets%20(Nexavar)%20(321-06).pdf • Kane RC, Farell AT, Saber H, Tang S, Williams G, Jee JM et al. Sorafenib for the treatment of advanced renal cell carcinoma. Clinical Cancer Research 2006;12:7271-8. SUNITINIB (Sutent®) Grupo terapéutico: inhibidores de la proteinquinasa. Código ATC: L01XE04 Presentaciones: SUTENT 12,5 mg 30 cápsulas duras, SUTENT 25 mg 30 cápsulas duras; SUTENT 50 mg 30 capsulas duras Laboratorio: Pfizer Fecha de autorización: 2-8-2006 Fecha de comercialización: enero de 2007. Precio (PVP-IVA): 1.275; 2.550; 5.100 euros, respectivamente. Aportación: reducida. Indicaciones:1) tratamiento de tumores malignos no resecables y/o metastásicos del estroma gastrointestinal (GIST) después del fracaso al tratamiento con mesilato de imatinib debido a la resistencia o intolerancia. 2) Tratamiento de Dirección General de Farmacia y Productos Sanitarios Dirección General de Farmacia y Productos Sanitarios. Consejería de Sanidad y Consumo. Informe de Novedades Farmacoterapéuticas. Nuevos principios activos autorizados cáncer de células renales avanzado y/o metastático (CCRM) después del fracaso al tratamiento con interferón alfa o interleukina-2. Notas de interés: es de Diagnóstico Hospitalario. La dosis recomendada es de 50 mg una vez al día durante un periodo de 4 semanas consecutivas, seguido por un periodo de 2 semanas de descanso para cumplimentar un ciclo completo de 6 semanas. Según la Ficha Técnica, “el tratamiento debe ser iniciado por un médico con experiencia en el tratamiento del cáncer de células renales o de GIST”. Más información: • http://www.emea.europa.eu/humandocs/Humans/EPAR/sutent/sutent.htm • http://www.accessdata.fda.gov/scripts/cder/drugsatfda/index.cfm?fuseaction=Search.Label_ApprovalHistory#apphist • Pavlakis N. Drug treatment of renal treatment. Aust Prescr 2006;29:151–3. • http://www.australianprescriber.com/upload/pdf/articles/849.pdf. • http://www.scottishmedicines.org.uk/updocs/sunitinib%20_Sutent_%20MRCC%20_343-07_.pdf • http://www.nelm.nhs.uk/Record%20Viewing/vR.aspx?id=566018 • Coppin C, Porzsolt F, Awa A, Kumpf J, Coldman A, Wilt T. Immunotherapy for advanced renal cell cancer. Cochrane Database Syst Rev 2005;1D001425-CD001425. • Motzer RJ, Hutson TE, Tomczak P, Michaelson D, Bukowski RM,Rixe O et al. Sunitinib versus interferon alfa in metastatic renal-cell carcinoma. N Engl J Med 2007;356:115-24. VARENICLINA (Champix®) Grupo terapéutico: principios activos utilizados en la dependencia por nicotina. Código ATC: N07BA03. Presentaciones: CHAMPIX Starter Pack (0,5 mg 11 comprimidos + 1 mg 14 comprimidos); CHAMPIX 0,5 mg 56 comprimidos; CHAMPIX 1 mg 28 comprimidos; CHAMPIX 1 mg 56 comprimidos. Laboratorio: Pfizer. Fecha de autorización: 25-10-2006. Fecha de comercialización: enero de 2007. Precio (PVP-IVA): 54,64; 122,39; 61,19 y 122,39 euros, respectivamente. Aportación: está excluido de la financiación. Indicaciones: está indicado en adultos para dejar de fumar. Notas de interés: precisa receta. Es un agonista parcial del receptor nicotínico α4β2. La pauta recomendada es: días 1-3: 0,5 mg/24 horas; días 4-7: 0,5 mg/12 horas; días 8-fin del tratamiento: 1 mg/12 horas. La administración debe iniciarse 1 ó 2 semanas antes de dejar de fumar. Los pacientes deben ser tratados durante 12 semanas. En aquellos que hayan dejado de fumar pasadas las 12 semanas, puede considerarse un tratamiento adicional de 12 semanas a una dosis de 1 mg/12 horas. Más información: • http://www.emea.eu.int/humandocs/PDFs/EPAR/champix/H-699-PI-es.pdf • http://www.attract.wales.nhs.uk/question_answers.cfm?question_id=2400 • http://www.mrw.interscience.wiley.com/cochrane/clsysrev/articles/CD006103/abstract.html • http://www.ash.org.uk/html/cessation/ASHVareniclineguidance.pdf • http://www.guideline.gov/summary/summary.aspx?ss=15&doc_id=9800&nbr=5247. Dirección General de Farmacia y Productos Sanitarios Dirección General de Farmacia y Productos Sanitarios. Consejería de Sanidad y Consumo. Enero 2007. Número 0 Nuevas asociaciones de principios activos ya comercializados GLIMEPIRIDA/ROSIGLITAZONA (Avaglim®) Grupo terapéutico: combinaciones de fármacos hipoglucemiantes orales. Código ATC: pendiente de asignación. Presentaciones: AVAGLIM 4 mg/4 mg 14, 28, 56 y 112 comprimidos recubiertos con película; AVAGLIM 8 mg/4 mg 14, 28, 56 y 112 comprimidos recubiertos con película. En la Ficha Técnica se advierte que posiblemente sólo se comercializarán algunos de los formatos autorizados. Laboratorio: GlaxoSmithKline. Fecha de autorización: 17-7-2006. Fecha de comercialización: febrero de 2007. Los formatos comercializados corresponden a 28 comprimidos Precio (PVP-IVA): 28,21 euros (Avaglim 4 mg/4 mg) y 40,21 euros (Avaglim 8 mg/4 mg). Aportación: reducida. Indicaciones: tratamiento de pacientes con diabetes mellitus tipo 2 que no alcanzan el control glucémico suficiente con la dosis óptima de sulfonilurea administrada en monoterapia y, para los que el tratamiento con metformina es inadecuado por existir contraindicación o intolerancia. Notas de interés: se administra una vez al día. Requiere visado (lleva Cupón Precinto Diferenciado). Más información: • http://www.emea.europa.eu/humandocs/PDFs/EPAR/avaglim/H-675-PI-es.pdf • http://www.accessdata.fda.gov/scripts/cder/drugsatfda/index.cfm?fuseaction=Search.DrugDetails • http://www.fda.gov/medwatch/safety/2006/jun06.htm#Avandaryl • Derosa G, Cicero AF, D’Angelo A, Gaddi A, Ciccarelli L, Piccinni MN et al. Effects of 1 year of treatment with pioglitazone or rosiglitazone added to imepiride on lipoprotein (a) and homocysteine concentrations in patients with type 2 diabetes mellitus and metabolic syndrome: a multicenter, randomized, double-blind, controlled clinical trial. Clin Ther 2006;28:679-88. • McCluskey D, Touger MS, Melis R, Schleusener DS, McCluskey D. Results of a randomized, double-blind, placebo-controlled study administering glimepiride to patients with type 2 diabetes mellitus inadequately controlled with rosiglitazone monotherapy. Clin Ther 2004;26:1783-90 Nuevas indicaciones autorizadas CLOPIDOGREL (Plavix®, Iscover®): pacientes que presentan síndrome coronario agudo: infarto de miocardio agudo con elevación del segmento ST, en combinación con AAS en pacientes tratados médicamente de elección para terapia trombolítica. Previamente estaba autorizado en la prevención de eventos aterotrombóticos en: • pacientes que han sufrido infarto de miocardio (desde los pocos días hasta un máximo de 35 días), infarto cerebral (desde los 7 días hasta un máximo de 6 meses) o arteriopatía periférica establecida. • pacientes que presentan síndrome coronario agudo sin elevación del segmento ST (angina inestable o infarto de miocardio sin onda Q), en combinación con ácido acetilsalicílico (AAS). Laboratorios: Sanofi Pharma Bristol-Myers Squibb SNC. Dirección General de Farmacia y Productos Sanitarios Dirección General de Farmacia y Productos Sanitarios. Consejería de Sanidad y Consumo. Informe de Novedades Farmacoterapéuticas. Nuevas formas farmacéuticas de interés DESMOPRESINA (Minurin Flas®) Grupo terapéutico: vasopresina y análogos. Código ATC: H01BA02. Presentaciones: MINURIN FLAS 60 microgramos liofilizado oral; MINURIN FLAS 120 microgramos liofilizado oral; MINURIN FLAS 240 microgramos liofilizado oral. Otras presentaciones: comprimidos, gotas nasales y ampollas. Laboratorio: Ferring Fecha de autorización: 15-12-2006. Fecha de comercialización: aún no comercializado. Precio (PVP-IVA): no disponible. Aportación: no disponible. Indicación: tratamiento de la diabetes insípida central y enuresis primaria nocturna en pacientes (mayores de 5 años) con capacidad normal de concentrar la orina. Notas de interés: es una nueva forma farmacéutica: liofilizado oral, que se administra por vía sublingual. Se coloca debajo de la lengua y se disuelve casi instantáneamente en la boca sin ingesta de líquidos. Se administra 3 veces al día (en diabetes insípida) y 1 vez al día (antes de acostarse) en enuresis nocturna. Más información: • https://sinaem4.agemed.es/consaem/especialidad.do?metodo=verFichaHtml&codigo=68268&fichaCompleta=S Primeros genéricos BICALUTAMIDA: (50 mg comprimidos recubiertos con película). Autorizado y comercializado. IOHEXOL: (240, 300 y 350 mg I/ml solución inyectable). Autorizado pero aún no comercializado. PERINDOPRIL2 : (2 mg, 4 mg y 8 mg comprimidos). Ha obtenido opinión positiva para su autorización. Aún no comercializado. Nuevos principios activos que han obtenido dictamen positivo para su autorización2 BUPROPION (Elontril®) Laboratorio: GlaxoSmithKline Indicación: tratamiento de episodios de depresión mayor. 2 Esta información procede de la Nota Informativa mensual de la Agencia Española de Medicamentos y Productos Sanitarios. Hace referencia a aquellas novedades farmacoterapéuticas que han obtenido opinión positiva para su autorización. Dirección General de Farmacia y Productos Sanitarios Dirección General de Farmacia y Productos Sanitarios. Consejería de Sanidad y Consumo. Enero 2007. Número 0 Nuevos principios activos que han obtenido dictamen positivo para su autorización Notas de interés: el principio activo, bupropion, ya está comercializado en España con los nombres de Zyntabac y Quomem para la deshabituación de la dependencia tabáquica, pero la autorización se solicita con un nombre comercial diferente y el trámite no se realiza como nueva indicación. Es importante evitar situaciones en que un mismo paciente pueda estar recibiendo dos medicamentos que contengan bupropion de forma simultánea, ya que aumenta el riesgo de aparición de convulsiones, que es una reacción adversa dosis dependiente. Más información: • http://www.accessdata.fda.gov/scripts/cder/drugsatfda/index.cfm?fuseaction=Search.Label_ApprovalHistory • Thase ME, Haight BR, Richard N, Rockett CB, Mitton M, Modell JG et al. Remission rates following antidepressant therapy with bupropion or selective serotonin reuptake inhibitors: a meta-analysis of original data from 7 randomized controlled trials. J Clin Psychiatry 2005; 66(8): 974-81 • Rush AJ, Trivedi MH, Wisniewski SR, Stewart JW, Nierenberg AA, Thase ME et al. Bupropion-SR, sertraline, or venlafaxine-XR after failure of SSRIs for depression. N Engl J Med 2006;354:1231-42. Comment: Evid Based Ment Health 2006; 9(4):100. • http://www.infopoems.com/infopointer/index.cfm?action=results&id=80605 SITAGLIPTIN (Januvia® /Xelevia®) Laboratorio: Merck Sharp & Dohme Indicación: tratamiento de la diabetes mellitus tipo 2 en combinación con metformina o, en determinados pacientes, con un agonista PPARg como tiazolidinodionas, para la mejora del control de la glucemia en aquellos casos en los que la dieta y el ejercicio junto con un fármaco en monoterapia no permitan un adecuado control de la glucemia. Más información: • http://www.emea.eu/htms/human/opinion/opinion.htm • http://www.accessdata.fda.gov/scripts/cder/drugsatfda/index.cfm?fuseaction=Search.DrugDetails • http://www.ganfyd.org/index.php?title=Sitagliptin • http://www.pcpoh.bham.ac.uk/publichealth/horizon/PDF_files/2005reports/Sitagliptin.pdf • Sitagliptin Study 021 Group. Effect of the dipeptidyl peptidase-4 inhibitor sitagliptin as monotherapy on glycemic control in patients with type 2 diabetes. Diabetes Care 2006;29:2632-7. Nuevas indicaciones con opinión positiva para su autorización2 VACUNA NEUMOCÓCICA CONJUGADA (Prevenar®): inmunización activa contra la otitis media causadas por los serotipos 4, 6B, 9V, 14, 18C, 19F y 23 de Streptococcus pneumoniae en niños desde 2 meses hasta 5 años de edad. Actualmente Prevenar se encuentra indicado para la inmunización activa contra la sepsis, meningitis, neumonía bacteriémica y bacteriemia causada por los mismos serotipos en niños desde 2 meses hasta 5 años de edad. Laboratorio: Wyeth Lederle Vaccines. Más información: • http://www.emea.europa.eu/pdfs/human/opinion/Prevenar_8239907en.pdf 2 Esta información procede de la Nota Informativa mensual de la Agencia Española de Medicamentos y Productos Sanitarios. Hace referencia a aquellas novedades farmacoterapéuticas que han obtenido opinión positiva para su autorización. Dirección: Javier Hernández Pascual Comité Editorial: M ónica Ausejo Segura, Javier Arias Hernández, Mª Ángeles Cruz Martos, Ángel Mataix Sanjuán, Inmaculada Fernández Esteban, Carmen Marina Meseguer Barros, Teresa Molina García. Correspondencia: Informe de Novedades Farmacoterapéuticas. Dirección General de Farmacia y Productos Sanitarios. Consejería de Sanidad y Consumo. C/ Recoletos, 1. 28001 Madrid. Tel. 91 426 90 17. Fax: 91 426 91 38. Correo electrónico: evaluacion.farmacia@salud.madrid.org. Edita: Consejería de Sanidad y Consumo. Dirección General de Farmacia y Productos Sanitarios. Tirada: 500 ejemplares. Imprime: Consejería de Sanidad y Consumo / S.G.T. Sº AA.GG. Centro Digital de Reprografía. Depósito legal: M-16341-2007. ISSN: 1887-6854. Cita sugerida: D irección General de Farmacia y Productos Sanitarios. Informe de Novedades Farmacoterapéuticas. Madrid: Comunidad de Madrid, Consejería de Sanidad. Enero 2007. Nº0. Dirección General de Farmacia y Productos Sanitarios Dirección General de Farmacia y Productos Sanitarios. Consejería de Sanidad y Consumo.