Ver PDF - Hospital de Niños de la Santísima Trinidad
Anuncio

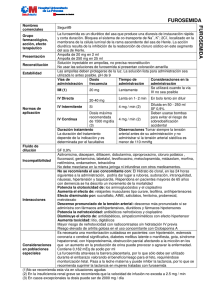
Gobierno de la Provincia de Córdoba Ministerio de Salud Hospital de Niños de la Santísima Trinidad Página 1 de 8 Informe Comité de Farmacoterapéutica Informe Nº: 4 Datos del Solicitante Solicitante: UTI Área: UTI Consulta N°: 4 Fecha: 09/09/2009 Tema de la consulta Estabilidad de Furosemida en bombas de infusión continua. Interacciones. Tolerancia Respuesta Estabilidad de Furosemida en bombas de infusión continua. Interacciones. Tolerancia Introducción Denominación química Acido 5-(aminosulfonil)-4-cloro-2-[(2-furanilmetil)amino]benzoico.(1, 2) Fórmula empírica C12H11ClN2O5S (1, 2) Peso molecular 330,74 (1, 2) Código ATC: C03CA01 CAS: 54-31-9 (1, 2) Clasificación Diurético de alta eficacia (3) o diurético del asa (1) o de alto techo derivado de la sulfonamida. (2) Mecanismo de acción y efectos farmacológicos Actúa en la rama ascendente del asa de Henle. Inhibe la reabsorción de iones sodio (Na +) y cloruro (Cl-) con pérdida de agua(4) Provoca diuresis al inhibir un sistema electroneutro de cotransporte de iones sodio/potasio/cloruro (Na+-K+-2Cl-) a nivel de la rama ascendente del asa de Henle, disminuyendo la reabsorción activa de sodio y aumentando su excreción (natriuresis). (2) También produce una cierta disminución de la resistencia vascular periférica lo que complementa la acción antihipertensora.(2) Aumenta el flujo sanguíneo renal sin incrementar el filtrado glomerular. Aumenta la excreción de iones potasio, calcio y magnesio. Incrementa la acidez titulable, y el amonio.(4) Aumenta la excreción renal de prostaglandina E2. Activa el sistema renina angiotensina. (4) Farmacocinética La furosemida se absorbe fácil y rapidamente por el tubo digestivo. (1, 2) La biodisponibilidad es del 60-70%, pero la absorción es variable y errática.(1) La semivida de eliminación es de aproximadamente de 2 horas, aunque se prolonga en recién nacidos y pacientes con insuficiencia Hospital de Niños de la Santísima Trinidad - Comité de Farmacoterapéutica TE: 0351-4586400 int. 606 - email: farmacoterapeutica@hospitaldeninos.com.ar Gobierno de la Provincia de Córdoba Ministerio de Salud Hospital de Niños de la Santísima Trinidad Página 2 de 8 Informe Comité de Farmacoterapéutica Informe Nº: 4 renal y hepática.(1) El tiempo de vida media en recién nacidos a término varía entre 4 a 29 horas y en pretérminos varía entre 8 a 44 horas.(4) El tiempo para que aparezca la acción es de 0.5-1 hora (vía oral), 5 minutos (vía endovenosa) y la duración de la misma es de 6 horas (vía oral), 2 horas (vía intravenosa).(2) El grado de unión a proteínas plasmáticas es del 98%, descendiendo en pacientes con insuficiencia renal, hepática o cardiaca.(2) Se produce un metabolito glucurónido de la furosemida en cantidades variables. Existe controversia sobre la existencia de otro potencial metabolito el ácido 4-cloro-5-sulfamoil antranilico (CSA). (1) Se excreta por orina por filtración glomerular y secreción tubular, (4) mayoritariamente en forma inalterada (50-70% de la dosis endovenosa). Su semivida de eliminación es de 0.5-1.5 horas (hasta 14 horas en insuficiencia renal).(2) En falla multiorgánica severa el tiempo de vida media pude variar entre 20 a 24 horas.(1) Existe también algo de excreción por vía biliar y la eliminación no renal aumenta considerablemente en caso de insuficiencia renal. La furosemida atraviesa la barrera placentaria y se distribuye en la leche materna. El aclaramiento de furosemida no aumenta con hemodiálisis, varía con la edad, el estado de las enfermedades subyacentes y la interacción con otros fármacos (se reduce por el probenecid y la indometacina).(1) Indicaciones Según el vademecum neonatal de la Sociedad Argentina de Pediatría(4) (SAP): sobrecarga hídrica, edema pulmonar, insuficiencia cardíaca congestiva, hipertensión arterial, oliguria no secundaria a hipovolemia, displasia broncopulmonar, hipercalcemia sintomática (suplementar iones sodio, potasio y cloruro). Vías de administración y dosis Vías: oral y parenteral.(4) Dosis: 2 mg/kg/dosis. Intervalo cada 24 horas en prematuros, cada 12 horas en término.Infusión contínua: 0,1 mg/kg/hora, máximo de 0,4 mg/kg/hora.(4) No sobrepasar la velocidad de 4 miligramos/minuto.(2, 5, 6) La administración muy rápida favorece la aparición de ototoxicidad.(5) En la publicación de medicamentos esenciales de la OMS(7) y en Martindale,(1)se detalla que la dosis para niños por vía parenteral para tratamiento de edema es de 0.5–1.5 mg/kg/día (máximo 20 miligramos diarios). Para la infusión continua, se recomienda emplear suero salino fisiológico o solución de Ringer, el pH de la infusión debe exceder de 5,5 y la velocidad no debe superar 4 miligramos/minuto los sueros glucosados no resultan idóneos.(8) No mezclar en la jeringa con otros medicamentos. En caso necesario diluir con suero salino isotónico. No emplear soluciones ácidas. No infundir mezclado con otros medicamentos y administrar la solución lista para infusión lo antes posible. (2) (Ver Compatibilidades e Incompatibilidades). Estabilidad Hospital de Niños de la Santísima Trinidad - Comité de Farmacoterapéutica TE: 0351-4586400 int. 606 - email: farmacoterapeutica@hospitaldeninos.com.ar Gobierno de la Provincia de Córdoba Ministerio de Salud Hospital de Niños de la Santísima Trinidad Página 3 de 8 Informe Comité de Farmacoterapéutica Informe Nº: 4 Conservar entre 15-30 °C en recipientes resistentes a la luz. No usar si presenta color amarillo.(4, 9) En un estudio,(1) se demostró que el inyectable de furosemida (10 mg/mL) en una solución de albúmina humana al 25% fue estable por 48 horas a temperatura ambiente protegido de la luz y por 14 días en refrigeración. No se detectó crecimiento bacteriano ni fúngico.(1) En varios artículos científicos, publicados en revistas internacionales, (10, 11, 12, 13) se estudió la fotoestabilidad de furosemida y se demostró que es altamente fotolábil. Según el prospecto de Furosemida Fresenius, (14) después de la primera apertura el producto debe ser utilizado inmediatamente. En el mismo, se menciona que después de la dilución la estabilidad física y química está garantizada durante 24 horas a 25ºC protegido de la luz. Desde un punto de vista microbiológico, el producto debe ser utilizado inmediatamente. En caso contrario, el tiempo y las condiciones de almacenamiento de la dilución, previos a su utilización, son responsabilidad del usuario y normalmente no deben exceder 24 horas a una temperatura entre 2º y 8ºC, a no ser que la dilución se haya realizado en condiciones asépticas controladas y validadas.(14) Compatibilidades Si se administra con dextrosa al 5%, dextrosa al 10% por varias horas, puede disminuir el efecto de la furosemida, por lo que es conveniente diluir con solución fisiológica. (4, 5) Se puede administrar en paralelo: amicacina, aminofilina, ampicilina, cloruro de potasio, gluconato de calcio, dexametasona, digoxina, heparina, indometacina, lidocaína, prostaglandina E1, ranitidina, bicarbonato de sodio, tolazolina.(4) Incompatibilidades Las soluciones inyectables de furosemida son alcalinas y no deben mezclarese o diluírse con soluciones de glucosa u otras soluciones ácidas.(1) La furosemida es soluble en soluciones alcalinas y los productos comerciales están preparados con un buffer ligeramente alcalino. No deben mezclarse con soluciones ácidas con pH inferior a 5,5. (15) Puede precipitar cuando se mezcla con ácido ascórbico, epinefrina, norepinefrina, o tetraciclina. (15) El pH ácido de los ingredientes de aminoglucósidos puede causar turbidez transiente o precipitación franca cuando se agrega furosemida, dependiendo de cómo se emplee el aminoglucósido y de la concentración de los aditivos.(15) Se recomienda evitar la mezcla de aminoglucósidos con furosemida. La furosemida puede precipitar cuando se mezcla con infusiones de lactato de milrinona.(15) Es incompatible con: dobutamina, fluconazol, gentamicina, hidralazina, isoproterenol, midazolan, morfina.(4) Se ha descrito que la inyección de furosemida es visualmente incompatible con las inyecciones de hidrocloruro de diltiazem e hidrocloruro de dobutamina, hicrocloruro de dopamina, hidrocloruro de labetalol, hidrocloruro de midazolam, milrinona lactato, hidrocloruro de nicardipine, y bromuro de vecuronio. También se han observado incompatibilidades con soluciones de nutrición pareneral, con besilato de cistracurio y levofloxacina.(1) La furosemida no debe mezclarse en la jeringa con otros fármacos, ni infundir mezclada con otros medicamentos. Se debe administrar la solución lista para infusión lo antes posible.(2) Hospital de Niños de la Santísima Trinidad - Comité de Farmacoterapéutica TE: 0351-4586400 int. 606 - email: farmacoterapeutica@hospitaldeninos.com.ar Gobierno de la Provincia de Córdoba Ministerio de Salud Hospital de Niños de la Santísima Trinidad Página 4 de 8 Informe Comité de Farmacoterapéutica Informe Nº: 4 Resistencia y tolerancia a la acción de los diuréticos. Precauciones Hay circunstancias que reducen la eficacia de los diuréticos, exigiendo el empleo de dosis más elevadas. Entre las causas de resistencia se encuentran: a) los edemas (cardíacos, cirróticos o nefróticos), que aumentan la reabsorción de sodio en el túbulo proximal; b) la azoemia, que reduce el paso de los diuréticos a su lugar de acción, y c) la acción de los inhibidores de la síntesis de prostaglandinas, como la indometazina y otros AINE, que reducen la acción de la furosemida, (16) Según Florez,(16) el desarrollo de tolerancia puede tener diversas causas. La más frecuente es la aparición de hiperaldosteronismo secundario a la acción de los diuréticos; otras son la disminución de la tasa de filtrado glomerular en el caso de las tiazidas, triamtereno o la amilorida, y la aparición de estasis en el túbulo proximal, provocado por tiazidas y diuréticos del asa. La acidosis reduce la de los inhibidores de la anhidrasa carbónica. (16) Los diuréticos del asa estimulan la producción de renina; en parte es una acción directa, en parte es consecuencia del aumento de producción de prostaglandinas y también puede deberse a la contracción del volumen extracelular. (16) La respuesta a los diuréticos del asa disminuye con el tiempo, distinguiéndose dos fases en este proceso.(16) La primera aparece incluso durante la respuesta aguda y se la ha denominado fase de rebote o de freno, apreciándose una disminución en el aclaramiento de agua y de sodio (pero no en el de potasio y magnesio), que puede caer por debajo del valor control pasado el efecto diurético de las primeras horas. No hay explicaciones precisas sobre este mecanismo aunque se piensa en la posibilidad de que aumente compensatoriamente la reabsorción de ión sodio en el túbulo proximal, o en el túbulo distal, o exista una desensibilización de los receptores de los diuréticos en el asa de Henle.(16) La fase crónica se aprecia en los pacientes que toman los diuréticos durante períodos prolongados. Puede deberse a una hipertrofia del epitelio del túbulo distal con incremento de su función reabsortiva de sodio, de ahí que la pérdida de respuesta pueda ser vencida mediante la adición de tiazidas que actúan en este segmento de la neurona. (16) Según Martindale,(1) la administración de furosemida ha demostrado incrementar la actividad plasmática de la renina, las concentraciones plasmáticas de noradrenalina, y las concentraciones plasmáticas de arginina-vasopressina. Las alteraciones en el sistema renina-angiotensinaaldosterona pueden intervenir en el desarrollo agudo de tolerancia. La furosemida aumenta las concentraciones renales de prostaglandina, pero no se conoce si se debe a un aumento en su síntesis, a la inhibición de la degradación o a ambos. Las prostaglandinas parecen mediar la acción diurética/natriurética. Los efectos primarios parecen ser alteraciones en la hemodinámica renal con los incrementos subsiguientes en la excreción de electrolitos y líquidos.(1) En otra fuente consultada,(17) que hace referencia a la pérdida de potencia del diurético, se describe que el freno es el fenómeno en virtud del cual, tras la primera dosis aparece una disminución de la respuesta diurética, causada por la activación del sistema reninaangiotensina, que se evita restaurando la pérdida de volumen inducida por el diurético. Menciona además que la tolerancia a largo plazo se refiere al aumento de la reabsorción de sodio asociada a la hipertrofia de los segmentos distales de la neurona. El fenómeno puede producirse por el crecimiento de las células de la neurona inducido por la aldosterona.(17) Hospital de Niños de la Santísima Trinidad - Comité de Farmacoterapéutica TE: 0351-4586400 int. 606 - email: farmacoterapeutica@hospitaldeninos.com.ar Gobierno de la Provincia de Córdoba Ministerio de Salud Hospital de Niños de la Santísima Trinidad Página 5 de 8 Informe Comité de Farmacoterapéutica Informe Nº: 4 Contraindicaciones y precauciones Según SAP,(4) la furosemida administrada durante los primeros meses de vida puede incrementar el riesgo de ductus arterioso en neonatos prematuros con síndrome de distrés respiratorio, efecto que puede estar mediado por prostaglandina E. En casos aislados de prematuros con ductus arterioso y enfermedad de membrana hialina tratados de edema con furosemida, se ha observado formación de cálculos renales que han mejorado con el uso conjunto de clorotiazida (disminución de la hipercalciuria). También se ha detectado pérdida de la audición en neonatos que puede estar relacionada con altas concentraciones plásmaticas de furosemida secundaria a inmadurez renal en estos pacientes. Uso precautorio.(2) Furosemida está contraindicada en alergia al medicamento, así como en pacientes con insuficiencia renal. (2) Deberá realizarse un especial control clínico en pacientes con diabetes, gota (hiperuricemia) y trastornos de la audición (sordera), modificarse la dosificación en caso de insuficiencia hepática. No es recomendable una exposición prolongada al sol ante el riesgo de que puedan producirse manifestaciones de fotosensibilidad.(2) Efectos adversos Los efectos adversos de este medicamento son, en general, infrecuentes aunque moderadamente importantes. Los efectos adversos más característicos son: ocasionalmente (1-9%): alteraciones metabólicas: hipopotasemia, hiponatremia, alcalosis hipoclorémica, principalmente después de dosis altas o tratamientos prolongados, hipercalciuria, hiperuricemia y ataques de gota. Raramente (<1%): hiperglucemia, glucosuria, alteraciones digestivas (náuseas, vómitos, estreñimiento o diarrea), cefalea, calambres musculares, anorexia, mareos, visión borrosa, hipotensión ortostática, erupciones exantemáticas, fotodermatitis, pancreatitis, ictericia colestática, hipercolesterolemia, hipertrigliceridemia y reacciones de hipersensibilidad como nefritis intersticial. Excepcionalmente (<<1%): agranulocitosis, trombocitopenia, leucopenia y anemia aplásica; tinnitus y sordera con dosis altas y rápidas por vía parenteral.(2) Según SAP(4), anemia, leucopenia, erupciones cutáneas, hiperuricemia. Puede producir edema como efecto rebote si se le suprime bruscamente. Hiponatremia, hipokalemia, deshidratación, alcalosis metabólica, (uso crónico). Hipercalciuria y desarrollo de nefrocalcinosis y/o cálculos renales con uso prolongado. Se debe considerar el suplemento de potasio en pacientes tratados con digoxina en forma concomitante, dado que la hipokalemia aumenta el riesgo de intoxicación digitálica.(4) Toxicidad e interacciones Aumenta la nefrotoxicidad de la cefaloridina, ototoxicidad, incluyendo pérdida auditiva transitoria o permanente. El riesgo está aumentado en caso de insuficiencia renal o con el uso concomitante de aminoglucósidos.(4) Compite con los anticoagulantes orales, hipoglucemiantes orales, salicilatos en los sitios de unión con las proteínas, aumentando la concentración de estas drogas. Predispone a la colelitiasis si se la administra sola o conjuntamente a nutrición parenteral total.(4) Antibióticos aminoglucósidos (gentamicina): hay estudios en los que se ha registrado posible potenciación de la toxicidad del antibiótico (nefrotoxicidad, ototoxicidad), especialmente si se administran dosis elevadas de diurético. (2) Hospital de Niños de la Santísima Trinidad - Comité de Farmacoterapéutica TE: 0351-4586400 int. 606 - email: farmacoterapeutica@hospitaldeninos.com.ar Gobierno de la Provincia de Córdoba Ministerio de Salud Hospital de Niños de la Santísima Trinidad Página 6 de 8 Informe Comité de Farmacoterapéutica Informe Nº: 4 Antiinflamatorios no esteroídicos (ácido acetilsalicílico, flurbiprofeno, indometacina, naproxeno, piroxicam): hay estudios en los que se ha registrado posible inhibición del efecto diurético, debido a la inhibición de la síntesis de prostaglandinas. Hay un estudio con piroxicam, en el que se ha registrado la falta de respuesta terapéutica del diurético, hasta que la dosis del antiinflamatorio no se redujo a la mitad. (2) Betabloqueantes (propranolol): hay estudios en los que se ha registrado posible incremento de la acción y/o toxicidad del betabloqueante. (2) Bezafibrato: hay un estudio en el que se ha registrado posible potenciación de la toxicidad. Bloqueantes neuromusculares (tubocurarina): hay estudios en el que se ha registrado potenciación del efecto bloqueante neuromuscular. (2) Carbamazepina: hay un estudio en el que se ha registrado posible potenciación de la toxicidad. (2) Carbón activado: hay estudios en los que se ha registrado una disminución en la absorción oral del diurético. (2) Cefalosporinas (cefacetrilo, cefaloridina, cefalotina): hay estudios en los que se ha registrado posible potenciación de la nefrotoxicidad. (2) Cimetidina: hay estudios en los que se ha registrado posible potenciación de la acción y/o toxicidad del diurético, por un aumento de sus niveles séricos, preferentemente con dosis bajas de cimetidina. (2) Clofibrato: hay estudios en los que se ha registrado posible potenciación de la toxicidad de ambos, parece que debido a competencia por la unión a proteínas plasmáticas. (2) Corticoides (cortisona, hidrocortisona): aunque no existen estudios clínicos sobre esta interacción, puede darse una potenciación de la toxicidad, por adición de sus efectos hipokalemiantes. (2) Digitálicos (digoxina): hay estudios en los que se ha registrado posible potenciación de la toxicidad del digitálico con presencia de arritmias. (2) Fenitoína: hay estudios en los que se ha registrado posible inhibición del efecto diurético. (2) Hidrato de cloral: hay estudios en los que se ha registrado potenciación de la toxicidad por desplazamiento de la tiroxina de su unión a proteínas plasmáticas, que daría lugar a un estado hipermetabólico. (2) En casos aislados, la administración intravenosa de furosemida en las 24 horas anteriores a la administración de hidrato de cloral podría producir rubefacción, hiperhidrosis, ansiedad, nauseas, incremento de la presión arterial y taquicardia. Por tanto, no se recomienda la administración simultánea de furosemida e hidrato de cloral.(14) Inhibidores de la angiotensina convertasa (captoprilo, enalaprilo): hay estudios en los que se ha registrado posible potenciación de toxicidad con presencia de hipokalemia. (2) Probenecid: hay estudios en los que se ha registrado posible aumento de los niveles séricos del diurético. (2) Ranitidina: hay estudios donde se ha registrado posible aumento de la biodisponibilidad con aumento del área bajo curva del diurético. (2) Resinas de intercambio iónico (colestiramina, colestipol): hay estudios en los que se ha registrado disminución en la absorción oral del diurético. (2) Sales de litio (carbonato de litio): hay estudios en los que se ha registrado posible potenciación de la acción y/o toxicidad por acumulación de litio. (2) Teofilina: hay algún estudio en el que se ha registrado posible inhibición del efecto antiasmático, por reducción de sus niveles séricos. (2) Hospital de Niños de la Santísima Trinidad - Comité de Farmacoterapéutica TE: 0351-4586400 int. 606 - email: farmacoterapeutica@hospitaldeninos.com.ar Gobierno de la Provincia de Córdoba Ministerio de Salud Hospital de Niños de la Santísima Trinidad Página 7 de 8 Informe Comité de Farmacoterapéutica Informe Nº: 4 Terbutalina: hay estudios en los que se ha registrado posible potenciación de la toxicidad por adición de sus efectos hipokalemiantes. (2) En el vademécum PR Argentina,(18) se detallan las siguientes interacciones para Furosemida: Vía intravenosa (IV), con hidrato de cloral: hipertensión, taquicardia, náuseas. Efecto disminuido por: sucralfato, AINE, salicilatos, fenitoína; probenecid, metotrexato y otros fármacos con secreción tubular renal significativa. Potencia ototoxicidad de: aminoglucósidos, cisplatino y otros fármacos ototóxicos. Potencia nefrotoxicidad de: antibióticos nefrotóxicos, cisplatino. Disminuye efecto de: antidiabéticos, simpaticomiméticos con efecto hipertensor. Aumenta efecto de: relajantes musculares tipo curare, teofilina, antihipertensores (suspender furosemida 3 días antes de administrar un IECA o antagonista de receptores de angiotensina II). Aumenta toxicidad de: litio, digitálicos, fármacos que prolongan intervalo QT. Riesgo de hipocaliemia con: corticosteroides, carbenoxolona, regaliz, laxantes. Riesgo elevado de artritis gotosa secundaria a hiperuricemia con: ciclosporina A. Disminución de excreción renal de uratos por: ciclofosfamida. Disminución de función renal con: altas dosis de cefalosporinas. Mayor riesgo de nefropatía con: radiocontraste sin hidratación previa. Interferencias analíticas Este medicamento puede alterar los valores de las siguientes determinaciones analíticas: Sangre: aumento (biológico) de fosfatasa alcalina, ácido úrico, calcio, urea y glucosa; reducción (biológica) de tiroxina y liotiroxina. (2) Orina: aumento (biológico) de calcio.(2) Opiniones e interpretaciones: De acuerdo a la bibliografía consultada, una vez que se reconstituye Furosemida para ser administrada mediante bomba de infusión, sería conveniente que se protegiera de la luz. La velocidad de infusión no debería superar los 4 miligramos/minuto ya que como se mencionó anteriormente, la administración rápida favorecería la aparición de ototoxicidad. Respecto al desarrollo de tolerancia, se debería tener en cuenta, para evaluar el efecto terapéutico luego de una administración prolongada. Bibliografía 1− Martindale, The Complete drug referente. London pharm Press. 2005. Información provista por CIME FCQ, UNC 2− Consejo General de Colegios Oficiales de Farmacéuticos de España. BOT Tradicional. Base de datos del medicamento y parafaramacia. [CD. ROM] España. CGCOF. 2006. Información provista por CIMEFCQ, UNC Hospital de Niños de la Santísima Trinidad - Comité de Farmacoterapéutica TE: 0351-4586400 int. 606 - email: farmacoterapeutica@hospitaldeninos.com.ar Gobierno de la Provincia de Córdoba Ministerio de Salud Hospital de Niños de la Santísima Trinidad Página 8 de 8 Informe Comité de Farmacoterapéutica Informe Nº: 4 3− M E Valsecia, L A Malgor, “Farmacología Médica”, Volumen 2: Farmacología renal y Cardiovascular. Farmacología EndócrinaCapitulo 12: Farmacología Renal Drogas Diuréticas. disponible en http://med.unne.edu.ar/farmaco.html 4− Sociedad Argentina de Pediatría, “Vademecum Neonatal 200”0, disponible en http://www.sap.org.ar 5− “Administración de Medicamentos Vía Parenteral, Guía básica para el personal sanitario”, Servicio de Farmacia, Hospital Universitario Son Dureta, enero de 2001. Guía. FARHSD disponible en: http://www.elcomprimido.com/FARHSD/GUIA2000PAR.pdf 6− Furosemida. Guia de Prescripción Terapéutica Información de medicamentos autorizados en España, disponible en: http://www.imedicinas.com/GPTage/Open.php?Y2EwNHNlMDFzYjAxZ20wM21vMDE%3D 7− WHO Essential Medicines Library “Furosemide” disponible en http://apps.who.int/emlib/MedicineDisplay.aspx?Language=EN&MedIDName=148%40furosemide 8− Tabla de fármacos administrados en infusión intravenosa. Furosemida (como sal sódica) Guia de prescripción terapéutica disponible en: http://www.imedicinas.com/GPTage/Open.php?Y2FBNnNlMDVtbzExNQ %3D%3D). 9− American Society of Health-System Pharmacists. AHFS Drug Information. Medscape. (on-line) Disponible en: http://www.medscape.com Información provista por CIME, FCQ UNC. 10− Photostability studies on the furosemide-triamterene drug association. Disponible en: http://www.ncbi.nlm.nih.gov/pubmed/13679181? ordinalpos=1&itool=EntrezSystem2.PEntrez.Pubmed.Pubmed_ResultsPanel.Pubmed_DefaultReportPanel.Pubmed_R VDocSum 11− Evaluation Of Furosemide-cyclodextrin Inclusion Complex In Improving The Photostability Of Furosemide Am. Assoc. of Pharmac. Scientists. Disponible en: http://www.aapsj.org/abstracts/AM_2001/1959.htm Tao Zhou, M Gupta, Darshan K. Parikh, Sunil S. Jambhekar. Massachusetts Coll. of Pharm. & Health Sciences, Boston, MA, USA. 12− Carda-Broch S, Esteve-Romero J, García-Alvarez-Coque MC, “Furosemide assay in pharmaceuticals by Micellar liquid chromatography: study of the stability of the drug”, J Pharm Biom Anal. 2000 Oct;23(5):803-17. 13− Asker AF, Ferdous AJ. Photodegradation of furosemide solutions PDA J Pharm Sci Technol. 1996 MayJun;50(3):158-62 College of Pharmacy and Pharmaceutical Sciences, Florida A & M University, Tallahassee, USA. 14− Prospecto de Furosemida de Fresenius, 20 mg/2 ml solución inyectable. 15− “Furosemide” Base de Datos Hazardous Substance Data Bank (HSDB), National Library of Medicine, dsiponible en http://toxnet.nlm.nih.gov/cgi-bin/sis/search/f?./temp/~MqgjQi:1 16− Florez, Farmacología Humana, Cap 47 Diuréticos. 17− Lionel H. Opie,Bernard J. Gersh. Fármacos para el corazón. 6º ed. Española. Madrid. Elsevier Saunders. 2005. Información provista por CIME FCQ UNC. 18− PR Vademécum Argentina, (on line) disponible en: http://www.vademecum.es/principios_activos/ficha/C03CA01/FUROSEMIDA/?action=open Fecha de Emisión: 10/11/09 Comité de Farmacoterapéutica Hospital de Niños de la Santísima Trinidad Ministerio de Salud de la Provincia de Córdoba Hospital de Niños de la Santísima Trinidad - Comité de Farmacoterapéutica TE: 0351-4586400 int. 606 - email: farmacoterapeutica@hospitaldeninos.com.ar