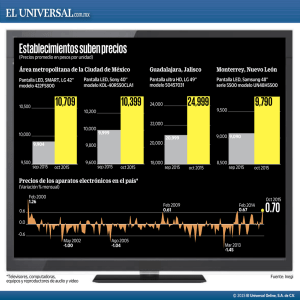
DISPOSITIVOS COMERCIALES. PROTOCOLOS DE ESCANEADO
Anuncio

SECCIÓN I. PRINCIPIOS DE FUNCIONAMIENTO E INTERPRETACIÓN DE LA TOMOGRAFÍA DE COHERENCIA ÓPTICA CAPÍTULO 3 DISPOSITIVOS COMERCIALES. PROTOCOLOS DE ESCANEADO Y ANÁLISIS DE RESULTADOS Introducción 3.1. Características diferenciales de las tecnologías OCT disponibles 3.2. OCT stratus y OCT Cirrus. Protocolos de adquisición y análisis macular 3.3. OCT Stratus y OCT Cirrus. Protocolos de adquisición y análisis de la capa de fibras nerviosas de la retina (CFNR) 3.4. OCT Stratus y OCT Cirrus. Protocolos de adquisición y análisis del nervio óptico 3.5. Tomografía de Coherencia Óptica en la infancia. Interpretación del análisis macular, de la CFNR y del disco óptico 3.6. OCT Spectralis (Heidelberg Instruments) 3.7. RTVue Fourier Domain OCT. Modelo: RT 100 (Optovue) 3.8. 3D OCT (Topcon) 3.9. Otros modelos de SD-OCT Introducción INTRODUCCIÓN Con la proliferación de distintos dispositivos OCT, se ha ampliado el abanico de posibilidades de análisis y presentación de datos. En las secciones siguientes del capítulo expondremos los protocolos de escaneado de los aparatos más habituales del mercado, aunque dada la continua renovación del software, lógicamente no podrán estar incluidas las versiones posteriores a la impresión de este libro. Se mencionará al OCT Stratus, como único dispositivo de dominio temporal (TD-OCT), ya que ha alcanzado una gran difusión, ha sido motivo de innume- rables publicaciones científicas y todavía continua siendo ampliamente utilizado. Haremos especial hincapié en los dispositivos de dominio espectral (SDOCT), tratando en cada apartado las características diferenciales y los principales protocolos de adquisición y análisis de imagen de los dispositivos más habituales en el mercado actual. Incluiremos también en este apartado los protocolos de adquisición y análisis de OCT de segmento anterior (OCT-SA) que algunos dispositivos presentan como complemento, aunque posteriormente se presentará con mayor detalle en el grupo de capítulos específicamente destinados a OCT-SA (capítulo 4). 3.1. Características diferenciales de las tecnologías OCT disponibles Francisco J. Muñoz Negrete, Diego Ruiz Casas, Diego Losada, Alfonso Almendral Gómez, Gema Rebolleda A modo de resumen, presentamos un cuadro con los datos diferenciales más importantes de los dispositivos OCT comercializados, siendo conscientes que, dado el rápido cambio y desarrollo que esta tecnolo- gía está sufriendo, cuando esta información llegue al lector habrán surgido variaciones al respecto (tabla 1). En las secciones sucesivas se expondrán con más detalle las diferentes características de los mismos. 62 TOMOGRAFIA DE COHERENCIA ÓPTICA TABLA 1. CARACTERÍSTICAS DISTINTIVAS DE DISPOSITIVOS OCT COMERCIALIZADOS Resolución Velocidad Transversa A-scan/seg (µm) Fabricante/ Distribuidor Resolución Axial (µm) OCT Stratus Carl Zeiss Meditec 10 20 400 OCT HD-Cirrus Carl Zeiss Meditec 5 15 27.000 Manejo con ratón. Imagen SLO. Segmentación MLI y EPR. Módulo OCT-SA. GPA. TSNIT ANR. Imágenes HD. RTVue OCT OptoVue/OftalTech 5 15 26.000 Segmentación múltiples capas retina. Módulo OCT-SA. Estudio complejo células ganglionares. Spectralis Heidelberg Eng./Bloss 4-7 14 40.000 SLO alta resolución. Eye tracking. Sistema reducción ruido Heidelberg. Imagen infrarroja, Módulo de AGF, ICG, autofluorescencia. EDI 3D OCT-1000 Topcon 5-6 20 18.000 Retinógrafo no midrático incorporado (3,1 megapixels) 3D OCT-2000 Topcon 5-6 20 27.000 Retinógrafo no midrático incorporado (12,3 megapixels). Módulo OCT-SA. Estereofotografia papila 3D OCT-2000 FA plus Topcon 5 20 50.000 Permite AFG y autofluorescencia SOCT Copernicus HR Optopol/Canon/AJL 3 12-18 52.000 Doppler vasos sanguíneos retinianos. DDLS glaucoma. Quistes intrarretinianos. Módulo OCT-SA SOCT Copernicus+ Optopol/Canon/AJL 5 12-18 27.000 Doppler vasos sanguíneos retinianos. DDLS glaucoma. Quistes intrarretinianos. Módulo OCT-SA RS-3000 OCT RetinaScan Nidek/Indo 4 20 53.000 SLO incorporado. Auto-tracking. Medida Complejo células ganglionares Spectral OCT and SLO OTI/OPKO 5 15 27.000 Microperimetría. Lente adicional OCTSA Bioptigen SDOCT Bioptigen 4,5 10 20.000 Portátil. Sonda Flexible. Investigación animal. Flujo doppler Caracterísiticas adicionales Tecnología TD OCT exclusivos de Segmento anterior Visante AS-OCT Carl Zeiss Meditec 18 60 2000 Exclusivo segmento anterior Slit-lamp OCT Heidelberg 25 75 200 OCT-SA adaptado a lámpara de hendidura 10 30 30.000 Segmento anterior. Plano corte 16 x 16 mm, profundidad 6 mm CASSIA SS 1000 TOMEY/AJL TD: time-domain (dominio tiempo); SLO (scanning laser ophthalmoscope); MLI: membrana limitante interna; DDLS: Disk Damage Likely Scale; EDI: enhanced depth imaging (visualización estructuras posteriores); EPR: epitelio pigmentario de la retina; HD: High definition; OCT-SA: tomografía de coherencia óptica de segmento anterior. GPA: glaucoma progression analysis; TSNIT: temporal-superior-nasal-inferior-temporal; ANR anillo neurorretiniano; AGF: angiofluoresceingrafía; ICG: verde indocianina. BIBLIOGRAFÍA 1. Kiernan DF, Mieler WF, Hariprasad SM. Spectral-domain optical coherence tomography: a comparison of modern highresolution retinal imaging systems.Am J Ophthalmol 2010;149:18-31. 2. Sakata LM, Deleon-Ortega J, Sakata V, Girkin CA. Optical coherence tomography of the retina and optic nerve - a review. Clin Experiment Ophthalmol. 2009; 37:90-99. 3. Savini G, Carbonelli M, Barboni P. Spectral-domain optical coherence tomography for the diagnosis and follow-up of glaucoma. Curr Opin Ophthalmol 2011;22:115-123. 3. DISPOSITIVOS COMERCIALES. PROTOCOLOS DE ESCANEADO Y ANÁLISIS DE RESULTADOS 63 3.2. OCT Stratus y OCT Cirrus. Protocolos de adquisición y análisis macular Diego Ruiz Casas, Julio José González-López, Francisco J. Muñoz Negrete, Agustín Martín Justicia, Manuel Cintrano, Gema Rebolleda INTRODUCCIÓN Expondremos algunas generalidades acerca de los protocolos de escaneado maculares más habituales con OCT Stratus (único dispositivo TD-OCT comercializado) y OCT Cirrus. Los equipos SD-OCT exploran un cuadrado de área macular (6 x 6 mm), obteniendo un cubo de datos para el análisis posterior de espesor y volumen. Proporcionan una amplia flexibilidad, dado que permiten escoger entre diferentes protocolos de exploración. En la mayoría de ellos se puede modificar el número de líneas y de barridos por línea para aumentar la resolución o para disminuir el tiempo de adquisición. Es posible escoger una línea de exploración, líneas siguiendo un patrón radial o líneas horizontales y modificar su longitud y angulación. El software macular analiza el grosor retiniano medio en 9 zonas, incluyendo una central de 1 mm de diámetro, el volumen macular y el grosor macular medio que refleja la estructura tridimensional de la retina. Una exploración OCT de la mácula debe comenzar con un protocolo de escaneado rápido que permita la medida de espesor y volumen y proporcione una representación gráfica para visualizar el estado general de la retina (áreas de engrosamiento, adelgazamiento, pliegues, tracciones, etc.) y la localización de las lesiones. Una vez localizadas las zonas de interés se aplican sobre las mismas protocolos de exploración con la mayor densidad de barridos posible para obtener imágenes de alta resolución, que aporten un estudio anatómico detallado. Los algoritmos de procesamiento de la imagen de la OCT han sido desarrollados para detectar automáticamente los límites internos y externos de la retina neurosensorial y realizar mediciones. Este proceso se denomina segmentación. Las medidas de grosor retiniano de Cirrus y Stratus no son superponibles, debido al diferente algoritmo de segmentación. Ambos dispositivos marcan como límite interno de la retina la membrana limitante interna (MLI), mientras que el límite externo para Stratus es la unión entre segmentos externos e internos de fotorreceptores y para Cirrus el epitelio pigmentario de la retina (EPR). Esto determina que Cirrus mida un grosor retiniano 43-61 µm mayor que Stratus y que las medidas de ambos dispositivos no puedan ser intercambiadas ni utilizadas indistintamente para seguimiento (espesor macular central medio en normales es 198,1 ± 17,3 µm en Stratus y 258 ± 16,8 µm en Cirrus). TD-OCT (STRATUS, CARL ZEISS MEDITEC) Protocolos de adquisición Stratus dispone de dos protocolos de adquisición de imágenes para mácula: mapa de grosor macular y mapa rápido de grosor macular. En el primero, el aparato realiza una serie de 6 a 24 barridos lineales equidistantes entre sí a través de un eje central común, centrados en la fóvea. Cada una de los barridos se compone de 512 capturas de modo-A. El centrado se realiza pidiendo al paciente que mire a un punto de fijación, que puede desplazarse de forma manual o substituirse por un LED de fijación externo para aquellos casos en los que el paciente no es capaz de fijar con la fóvea. El diámetro del círculo objetivo, que se corresponde con la longitud de cada una de las líneas, es de 6 mm. El número de líneas y su longitud pueden ajustarse hasta que se guarda la primera tomografía de la serie. La opción rápida presenta las siguientes diferencias con respecto al protocolo «Mapa de grosor macular»: – Se realizan 6 barridos obtenidos en 1,92 segundos. – No es posible ajustar de forma manual el número de líneas ni la longitud de las mismas. – Sólo precisa una alineación del paciente para la toma de los 6 barridos. – Dado que los 6 barridos se adquieren de forma consecutiva y en poco tiempo, puede mejorar la exactitud de la posición relativa de las líneas. – En cada exploración se realizan 768 barridos en modo-A (lo que corresponde a 128 barridos por línea), cifra significativamente inferior a los 512 por línea que se obtienen en el protocolo estándar. Sin embargo, pese a la menor resolución, puede ser suficiente para los protocolos de análisis del grosor macular. Protocolos de análisis Los protocolos de análisis cuantitativo ligados a estos dos protocolos de adquisición de imágenes son 64 Figura 1. Informe de grosor retiniano. La imagen de OCT muestra las líneas que el software ha identificado como MLI y unión de segmentos internos y externos de fotorreceptores. A la derecha, una fotografía muestra la mácula, y una gráfica muestra la orientación del corte. La gráfica inferior muestra el grosor macular para cada uno de los barridos A que forman la imagen. idénticos. La única diferencia es que los datos sólo se compararán con la base de datos normativa con el protocolo de adquisición «Mapa rápido de grosor macular». Figura 2. Mapa retiniano. Superior: Imagen de OCT y fotografía aneritra de la mácula. Inferior: Grosor medio de los sectores y mapa de grosor con código de colores. TOMOGRAFIA DE COHERENCIA ÓPTICA – Grosor retiniano: La gráfica de resultado muestra los datos de grosor retiniano (distancia entre la unión de los segmentos externos e internos de los fotorreceptores y MLI) para cada uno de los cortes. Pueden obtenerse los valores para cada uno de los barridos A de cada una de las imágenes (fig. 1). Cuando se analiza un «Mapa rápido de grosor macular» cada gráfica nos informa del percentil del grosor macular en cada punto, comparándolo con una base de datos de valores normales. Esta base de datos es aplicable a pacientes mayores de 18 años, y es independiente de su etnia. – Mapa retiniano: Este protocolo permite obtener mapas del grosor retiniano de un área circular centrada sobre la mácula. Los mapas se muestran mediante un código de colores, y con las cifras de grosor medio calculadas por cuadrantes en nueve sectores (fig. 2). El algoritmo calcula el grosor retiniano de forma individual para cada una de las líneas obtenidas, e interpola los resultados para construir los mapas circulares. Además, el grosor medio de cada uno de los sectores puede compararse con la base de datos normativa en caso de que las imágenes se hayan obtenido con el protocolo «Mapa de grosor macular rápido». El diámetro de los círculos concéntricos con los que se construyen los sectores de los mapas puede variarse entre 1,3 y 6 mm o 3. DISPOSITIVOS COMERCIALES. PROTOCOLOS DE ESCANEADO Y ANÁLISIS DE RESULTADOS 65 Figura 3. Grosor/Volumen retinianos, formato tabular. Superior: Fotografías aneritras de la mácula e imágenes de OCT de 128 barridos A. Medio: Mapa de grosor con código cromático. Inferior izquierdo: Mapas de grosores medios de los sectores. Inferior Derecha: Tabla con información sobre grosores y volúmenes de cada sector y diferencias entre sectores equivalentes de un ojo y otro. bien 1, 2,22 y 3,45 mm. Además, este protocolo también nos informa acerca del volumen total del área del mapa retiniano en mm2. Figura 4. Cambio de Grosor/Volumen retinianos. Superior: Fotografías aneritras de la mácula e imágenes de OCT de 128 barridos Medio: Cambio de grosor mediante código de colores. Inferior: Cambio de grosor medio por sector. – Grosor/Volumen retinianos: Permite obtener dos mapas retinianos centrados en la fóvea de cada ojo, en los que se ve representado el grosor y el volumen retinianos. El mapa superior representa siempre el grosor retiniano en forma de código de colores. En el mapa inferior podemos elegir ver el grosor medio en micrómetros o el volumen en mm3 de cada uno de los 9 sectores. Una vez más, podemos elegir el diámetro de los círculos entre 1, 3 y 6 mm o 1, 2,22 y 3,45 mm. – Grosor/Volumen retinianos, formato tabular: Permite obtener un informe como el anterior, junto con una tabla que incluye las medias de grosor y volumen para cada uno de los cuadrantes y las diferencias entre un ojo y otro (fig. 3). Si se aplica a una serie obtenida mediante el protocolo «Mapa rápido de grosor macular», todos estos datos se compararán con la base de datos normativa mediante el código cromático habitual. – Cambio de Grosor/Volumen retinianos: Permite observar las diferencias de grosor y volumen entre exámenes obtenidos en diferentes días. Los mapas superiores representan siempre los cambios de grosor mediante un código cromático. Los mapas inferiores muestran los cambios de grosor medio o de volumen entre los dos exámenes por cuadrantes (fig. 4). – Examen multicorte: Permite crear un informe que compare todos los cortes de una tomografía de un mismo día, o cortes de días diferentes (fig. 5). 66 TOMOGRAFIA DE COHERENCIA ÓPTICA Figura 5. Examen multicorte, con 6 imágenes de 512 barridos A, en un paciente con edema macular diabético. Apréciese la diferencia de resolución en comparación con las imágenes de 128 barridos A de los informes anteriores. SD-OCT (CIRRUS, CARL ZEISS MEDITEC) Como características particulares podemos reseñar: • El manejo para la toma de imágenes se realiza mediante un ratón eliminando la necesidad de un joystick y del movimiento del equipo. • Permite mover la zona de escaneado 30 x 36° sin ajustar la fijación del paciente. • No dispone de «tracking laser», pero permite escanear sobre la misma zona en estudios de seguimiento gracias a un registro de imágenes. • El mínimo cambio medible es de 5 µm. Protocolos de adquisición Tiene una cámara para monitorizar el iris (permite controlar los ejes X-Y centrando en pupila) y otra cámara SLO (scanning laser ophthalmoscopy) de 750 nm para visualizar el fondo de ojo (eje Z) durante la obtención de imágenes. Una vez centrados los ejes X, Y, Z podemos desplazar la zona de captura de imágenes y el centro de fijación sobre la imagen de fondo de ojo SLO. Antes de la adquisición, el paciente observa un punto de fijación sobre un fondo negro con forma de estrella verde. Durante la adquisición el punto de fijación permanece, pero el fondo cambia a un color rojo parpadeante y el paciente puede observar líneas brillantes de luz que corresponden a los escaneados, que debe ignorar fijando su mirada en el punto de fijación con forma de estrella verde. El módulo de mácula presenta los protocolos de adquisición tipo «Macular Cube» y «Line Raster» ajustables. Los protocolos de adquisición tipo «Macular Cube» permiten obtener datos de espesor y volumen macular en el área analizada. Hay dos tipos: – Macular Cube 512 x 128: escanea un área de 6 x 6 milímetros. Esto quiere decir que la imagen se obtiene a partir de 128 líneas (B-Scans) compuestas cada una de ellas por 512 A-Scans, excepto las líneas centrales horizontal y vertical que tienen 1024 A-Scans cada una. – Macular Cube 200 x 200: escanea un área de 6 x 6 milímetros con 200 líneas de 200 A-Scans cada una, excepto las líneas centrales horizontal y vertical que constan de 1000 A-Scans cada una. 3. DISPOSITIVOS COMERCIALES. PROTOCOLOS DE ESCANEADO Y ANÁLISIS DE RESULTADOS 67 Figura 6. Protocolo de Adquisición Macular Cube 512 x 128. En la esquina superior izquierda se muestra una imagen del segmento anterior, y en la inferior izquierda, una retinografía aneritra donde se representa el área en la cual se ha realizado el escaneado. En el centro se indica la calidad de la señal (máxima en este caso). Las imágenes de la derecha representan cortes horizontales (arriba) y verticales (en medio) del área escaneada, centrados en fóvea. Las imágenes inferiores, más pequeñas, representan los cortes horizontales superior e inferior. Comparando ambos protocolos, el Macular Cube 512 x 128 (fig. 6) presenta mayor resolución de izquierda a derecha (512 A-Scans frente a 200 AScans) pero menor vertical al estar los cortes mas espaciados (128 líneas frente a 200 líneas). También se puede utilizar la estrategia de escaneado tipo «Line Raster», con la que obtenemos pocos cortes, 1 ó 5, de gran resolución, que nos permiten discriminar nítidamente detalles de la macula en los cortes realizados. Generalmente se usan tras un análisis tipo Macular Cube con el que evaluaremos un área extensa de retina. Los protocolos de adquisición Line Raster son dos: – 5-Line Raster: escanea 5 líneas paralelas de igual longitud, cada línea se compone de 4096 AScans. El usuario puede modificar la longitud (3,6 ó 9 mm), espaciado (0,01-1,25 mm) o rotación (0-90°, 270-360°) de las líneas. Por defecto, el sistema analiza 5 líneas de 6 mm separadas 0,25 mm a 0° (horizontales). – HD (High Definition) 5-Line Raster: Este sistema de adquisición es prácticamente igual al anterior, pero cada línea está más resaltada, para obtener las imágenes con mayor resolución. Esto se consigue combinando los datos de múltiples líneas de 4096 AScans en la misma localización para disminuir el ruido de fondo de la imagen, se combinan 4 líneas (BScans) para cada una de las 5 líneas de alta definición. Dentro de este protocolo de puede seleccionar la adquisición de una sola línea de imagen, que es el resultado de la combinación de 20 líneas (B-Scans) en la misma localización y es el protocolo de adquisición que proporciona la mayor resolución del aparato (fig. 7). Figura 7. Protocolo de Adquisición HD 5-Line Raster. . En la esquina superior izquierda se muestra una imagen del segmento anterior, y en la inferior izquierda, una retinografía aneritra donde se representan las cinco líneas a escanear. Las imágenes de la derecha representan los 5 cortes realizados. 68 Protocolos de análisis El «macular cube» permite el análisis del volumen y espesor de la mácula, y genera un mapa de significación estadística de grosores en comparación con una base normativa, así como mapas de contorno de la MLI, EPR y MLI-EPR. En el algoritmo de segmentación del OCT Cirrus, el límite interno de la retina es identificado en la interfase vítreorretiniana y es detectado por el incremento de reflectividad que se produce entre una zona no reflectiva (vítreo) y una hiperreflectiva (MLI). El límite externo de la retina se localiza en la banda hiperreflectiva que genera el complejo EPR-coriocapilar, situado a continuación de una doble línea de reflectividad alta, que corresponde a la unión de los segmentos internos y externos de los fotorreceptores. Disponemos de diferentes protocolos de análisis que permiten diferentes opciones de visualización y de medida en función del protocolo de adquisición seleccionado. Figura 8. Protocolo de análisis Espesor Macular (Macular Thickness) en un paciente con edema macular diabético, drusas y membrana epirretiniana. En la esquina superior izquierda se muestra retinografía aneritra donde se representa el área en la cual se ha realizado el escaneado, con un mapa cromático de grosor retiniano superimpuesto. En la esquina superior derecha se muestran un mapa de grosor retiniano por sectores, con un código cromático que representa la comparación de los distintos valores con respecto a la población normal, así como una retinografía aneritra del área estudiada. En la esquina inferior izquierda se muestran dos cortes de OCT (horizontal arriba y vertical abajo) centrados en la fóvea. Los mapas tridimensionales de la derecha muestran el espesor entre EPR (arriba), MLI (centro) y EPR (abajo). TOMOGRAFIA DE COHERENCIA ÓPTICA Protocolos de análisis de datos del protocolo de adquisición «Macular Cube» – Espesor Macular: Proporciona imagen SLO de fondo de ojo para localización (X, Y) de las líneas y zonas analizadas sobre las que se pueden superponer la medida MLI-EPR en escala de colores o la localización de la fóvea establecida para análisis ETDRS. También aparecen mapas de superficie 3D de las capas MLI y EPR y del espesor MLI-EPR. Además genera un informe numérico de grosor macular en un subcampo central circular dividido en los nueve sectores definidos en el ETDRS. Consta de tres círculos concéntricos con diámetros de 1, 3 y 6 mm. Excepto en el círculo central, se dividen en los cuadrantes superior, nasal, inferior y temporal. El círculo central tiene un radio de 500 micras). El equipo informa del valor promedio del espesor macular en cada uno de estos sectores. La imagen de fondo de ojo de la OCT de la derecha muestra la superficie del área sobre la que se realizaron las mediciones. Los sectores ETDRS se representan siguiendo la escala de colores habitual en referencia a la base de datos normativa respecto a sujetos sanos de la misma edad (verde: espesor medio dentro de lo normal; amarillo: valores en el límite de la normalidad; rojo: espesor medio fuera de lo normal) (fig. 8). Existen diferentes opciones a realizar en las imágenes, como medidas manuales (fig. 9), activar límites de medida, editar las líneas de límites medida automática de EPR y MLI, retorno al centro, definir el centro de la macula, volver al centro o mostrar dos cortes ortogonales de imágenes de alta resolución. – Visualización Avanzada: Permite el análisis iconográfico en una representación multiplanar, pudiendo desplazar los B-Scan sobre los ejes X, Y, Z, Figura 9. Medida manual de la base de un desprendimiento de epitelio pigmentario de la retina sobre un corte B de un cubo macular de 512 x 128. 3. DISPOSITIVOS COMERCIALES. PROTOCOLOS DE ESCANEADO Y ANÁLISIS DE RESULTADOS Figura 10. Protocolo de análisis «Visualización Avanzada» en paciente con atrofia geográfica. Se pueden observar las líneas de medida de MLI (blanca), EPR (negra) y EPRfit (rosa). observando líneas de análisis de derecha a izquierda, de arriba abajo y de superficial a profundo. Podemos controlar la posición del corte sobre la imagen SLO de fondo de ojo. Sobre las imágenes podemos medir manualmente distancias, activar o desactivar los planos de medida (MLI y EPR), editar las diferentes líneas de medida (MLI, EPR y EPR fit, ésta última es una aproximación parabólica de la posición del EPR supuesta en base a la curvatura retiniana) y retorno al centro. También es posible modificar el corte superpuesto en cortes finos (slice), cortes más gruesos (slabs), MLI, EPR o EPRfit. En versiones previas de software daba la opción de representación 3D, que con las nuevas versiones se ha separado en un protocolo diferente de análisis más desarrollado (fig. 10). – Visualización 3D: Recientemente se ha mejorado y se ha separado del protocolo de visualización avanzada. Permite generar imágenes y videos 3D de los datos obtenidos mediante los protocolos de adquisición tipo macular cube. Estas imágenes pueden ser editadas para mostrar diferentes capas de retina e imágenes de fondo de ojo en distintas posiciones (fig. 11). – Cambio Macular Automático: Permite analizar el cambio de grosor macular entre exámenes repetidos en el tiempo. Para ello el equipo intenta superponer imágenes mediante un sistema que por transparencia permite ver simultáneamente la imagen actual y la que se obtuvo en el pasado. El aparato intenta realizar un autocentrado de las imágenes (fig. 12). 69 Figura 11. Protocolo de análisis «Visualización 3D» para un agujero macular estadio II-A. – Cambio Macular Manual: es similar al automático, pero permite un ajuste manual por identificación de puntos anatómicos de referencia en las imágenes. Figura 12. Protocolo de análisis «Cambio Macular» en un paciente con empeoramiento del edema macular diabético. En la imagen central derecha se observa el engrosamiento macular (representado con signo +) en los diferentes sectores del esquema ETDRS. 70 Figura 13. Protocolo de análisis Imágenes de «High Definition Images» para un paciente con agujero macular lamelar operado. TOMOGRAFIA DE COHERENCIA ÓPTICA Figura 14. Protocolo de análisis «High Definition» para un paciente operado de agujero macular. Ambos análisis de cambio permiten opciones de localizar y modificar centro foveal, restaurar valores originales, configurar colores, mostrar limites de EPR y MLI, sincronizar o desincronizar movimiento de imágenes sobre el cubo y modificar la superposición de imágenes. Protocolos de análisis de datos de los protocolos de adquisición «5-Line Raster» o «HD 5-Line Raster» – Imágenes de alta Definición: Permite analizar las 5 líneas de escaneado, observando los cortes con gran resolución (fig. 13). La imagen de cámara SLO permite localizar sobre el fondo de ojo la posición de la línea de escaneado. Si se obtuvo la imagen con protocolo de adquisición HD la imagen se muestra en blanco y negro para mayor resolución (fig. 14). Si se obtuvo un protocolo HD 1-Line Raster la imagen permite obtener la máxima resolución. También es posible tomar medidas manuales sobre las imágenes. Como ejemplo final de los diferentes protocolos de adquisición-análisis, mostramos un paciente afecto de vasculopatía polipoidea idiopática, patología que muestra en OCT lesiones a nivel de EPR, subretiniano e intrarretiniano multifocales. Podemos observar la diferente resolución de cada protocolo (fig. 15). Figura 15. Calidad de imagen en funcion del protocolo de adquisicion para un paciente con vasculopatia polipoidea idiopatica. A, Macular Cube 200 x 200. B, Macular Cube 512 x 128. C, 5-Line Raster. D, HD 5-Line Raster. E, HD 1-Line Raster. 3. DISPOSITIVOS COMERCIALES. PROTOCOLOS DE ESCANEADO Y ANÁLISIS DE RESULTADOS BIBLIOGRAFÍA 1. Bloom S, Singal I. The outer bruch membrane layer: A previously undescribed spectral-domain optical coherence tomography finding. Retina 2011; 31: 316-23. 2. Brennen PM, Kagemann L, Friberg TR. Comparison of Stratus OCT and Cirrus HD-OCT Imaging in Macular Diseases. Ophthalmic Surg Lasers Imaging 2009; 40: 25-31. 71 3. Gupta V, Gupta A, Dogra MR: Atlas of Optical Coherence tomography of macular diseases. New Delhi: Jaypee Editors; 2004. 4. OCT Stratus. Instrumento modelo 3000 y Stratus Review Software versión 6.0. Manual del usuario. Carl Zeiss Meditec 2008. 5. OCT Cirrus. Modelo 4000. Manual del usuario. Carl Zeiss Meditec 2011. 72 TOMOGRAFIA DE COHERENCIA ÓPTICA 3.3. OCT Stratus y OCT Cirrus. Protocolos de adquisición y análisis de la capa de fibras nerviosas de la retina (CFNR) Francisco J. Muñoz Negrete, Anastasios Koutsoulidis, Gema Rebolleda, Agustín Martín Justicia, Manuel Cintrano, Sara Ceballos Como se expondrá en posteriores capítulos, la medición del espesor de la capa de fibras nerviosas de la retina (CFNR) es de enorme utilidad en diferentes patologías del nervio óptico. En individuos normales el grosor medio de la capa de fibras de la retina que proporciona Cirrus es menor que Stratus (85,6 ± 14,6 µm frente a 98 ± 18 µm). Las diferencias entre ambos aparatos en las distintas neuropatías serán expuesta en las Secciones de Neurooftalmología y Glaucoma. TD-OCT (OCT STRATUS) Protocolos de adquisición de Tomografías Para la evaluación de la capa de fibras nerviosas de la retina (CFNR), la estrategia de adquisición de tomografías más utilizada es el protocolo rápido de la CFNR (Fast RNFL Thickness 3.4), que por la mayor velocidad de adquisición reduce los artefactos por movimientos oculares o parpadeo y además es la única que permite la comparación con una base de datos normativa. Realiza tres escaneos de 256 puntos sobre la cabeza del nervio óptico con un diámetro por defecto de 3,46 mm, que es alineado de forma manual alrededor de la papila y que se considera suficiente para englobar la totalidad de las fibras nerviosas de la retina. Dada la limitación de 400 escaneos axiales por segundo no nos permite generar un mapa topográfico de la CFNR alrededor de la papila, como el que se puede obtener con las SD-OCT. El tamaño de este círculo ha sido un tema ampliamente debatido. El diámetro de 3,46 mm se propuso en 1996 por Schuman por presentar mejor reproducibilidad, y desde entonces la mayoría de los dispositivos OCT lo han utilizado independientemente del tamaño papilar. Sin embargo, hay una gran variabilidad en el tamaño papilar y utilizando siempre el mismo diámetro fijo medimos la CFNR más cerca al borde de la papila en papilas grandes y más lejos en las pequeñas, habiéndose comprobado mediante estudios histológicos que el grosor de la CFNR disminuye conforme nos alejamos del margen del disco. De esta forma se podría correr el riesgo de sobreestimar el grosor de la CFNR en papilas grandes e infraestimarlo en pe- queñas. Sin embargo, los estudios histológicos no consideraron por separado papilas grandes y pequeñas, y es lógico pensar que un corte de 360° alrededor de la papila va a cortar todas las fibras nerviosas que salen de ella. Savini et al (2005) midiendo el tamaño de la papila con HRT II encontró que el tamaño no afectaba los valores del área bajo la curva ROC (ABC ROC) de ninguno de los índices de la OCT. Existe otro protocolo de estudio de la CFNR de mayor definición (512 puntos por escaneo), pero apenas se ha utilizado en la práctica clínica, dado que carece de base de datos de normalidad y requiere un mayor tiempo para adquisición de imágenes, lo que puede determinar artefactos por movimientos oculares, con la consiguiente pérdida de fiabilidad en la adquisición de la señal. Protocolos de Análisis de Tomografías Tanto los dispositivos TD-OCT como los SD-OCT analizan el espesor de la CFNR en diferentes sectores y de forma global. El protocolo de análisis más frecuentemente utilizado en la estrategia «Fast RNFL Thickness» es el «Análisis promedio de la CFNR» (RNFL Thickness Average Analysis). Estos datos se comparan con una base de datos normativa en función de la edad y el tamaño de la papila. Hay que tener en cuenta que esta base de datos incluye pacientes mayores de 18 años, por lo que no nos permite analizar la normalidad de la CFNR en la edad pediátrica (ver sección 3.5). La función de análisis de glaucoma en su comparación con la base de datos utiliza un código cromático verde, amarillo y rojo, para indicar los percentiles de distribución normal (fig. 1): Figura 1. Código cromático de normalidad. 3. DISPOSITIVOS COMERCIALES. PROTOCOLOS DE ESCANEADO Y ANÁLISIS DE RESULTADOS Figura 2. Stratus OCT: Tabla de datos de los diferentes parámetros que se cuantifican en la estrategia «Fast RNFL» con escala cromática de normalidad, dónde se aprecia reducción significativa del valor medio (Avg thickness), así como del espesor del cuadrante inferior en ambos ojo (Iavg). • El 1% de las mediciones de menor grosor se incluyen en el área roja (rojo < 1%, fuera de los límites normales). • El 5% de las mediciones de menor grosor se incluyen en el área amarilla o debajo (1% ≤ amarillo < 5%, sospechosa). • El 90% de las mediciones se incluyen en el área verde (5% ≤ verde ≤ 95%, dentro de límites normales). • El 5% de las mediciones de mayor grosor se incluyen en el área blanca (blanco > 95%, por encima límites normales). Es muy importante no tomar esta información con carácter absoluto e interpretar los datos aportados dentro de un contexto clínico, ya que para cualquier medición particular, 1 de cada 20 ojos normales (5%) se incluirán debajo del área verde. Esto sucede particularmente en ojos con miopía, en los que la comparación con la base normativa con frecuencia nos va a informar de presencia de valores fuera de lo normal 73 en el espesor de la CFNR peripapilar por la anatomía característica de la cabeza del nervio óptico. La estrategia «Fast RNFL» nos proporciona múltiples parámetros de medida en µm: medida global del espesor medio, por cuadrantes y en doce sectores horarios. Asimismo nos proporciona una tabla en la que busca asimetrías entre los sectores superior e inferior y asimetrías interoculares, proporcionando la clásica escala cromática de normalidad para cada uno de los diferentes parámetros. En la Sección dedicada a glaucoma se indicarán aquellos que tienen mayor valor predictivo de glaucoma. De todos ellos, como veremos más adelante, tan sólo se facilita en el Cirrus OCT el espesor medio y el diagrama en sector de los cuatro cuadrantes y de los sectores horarios. Dado que tanto la representación por cuadrantes como la de grosor TSNIT es muy similar a la que se presenta con OCT Cirrus, será comentada en el siguiente apartado. Para observar el cambio en el tiempo del espesor de la CFNR, inicialmente se utilizaba el protocolo «Análisis seriado de la CFNR» (RNFL Thickness Serial Analysis), que sólo permitía la representación del gráfico TSNIT de 4 exploraciones, lo que proporcionaba una visualización aproximada de cambios en el tiempo. En las últimas actualizaciones de software fue sustituida por el «Análisis Seriado avanzado GPA», en el que además de la información TSNIT, se ofrece una evaluación de la progresión mediante un análisis de tendencias, indicando la velocidad de cambio anual del espesor de la CFNR con su significación estadística y se ofrece una representación seriada en escala de color del espesor medio y de los cuadrantes superior e inferior de la CFNR (fig. 3). Los aspectos relativos a progresión en glaucoma serán expuestos con más detalle en el bloque de Glaucoma. Figura 3. Análisis Seriado GPA de la CFNR OCT-Stratus. En este paciente hipertenso ocular no se aprecia pérdida de la CFNR en ninguno de los ojos en el tiempo, siendo todos los valores normales (color verde). 74 SD-OCT (OCT HD-CIRRUS) Protocolos de adquisición de Tomografías El protocolo de estudio tanto de la CFNR como de la papila con OCT Cirrus es el «Optic disc cube 200 x 200», que escanea un área de 6 x 6 mm, capturando un cubo de datos de 200 x 200 barridos (40.000 puntos) en 1,5 segundos (27.000 A-scans/seg), siendo la resolución axial de 5 µm. El aparato identifica automáticamente el centro de la papila y crea un barrido modo B artificial en forma de círculo de 3,46 mm de diámetro (igual que con OCT Stratus) que contiene 256 A-scans. Para conseguir esta correcta alineación, el equipo identifica el límite de la banda de hiperreflectividad correspondiente al EPR. El siguiente paso consiste en la segmentación para identificar los límites de la capa de fibras nerviosas, el límite interno se sitúa en la interfase vitreorretiniana y el límite externo se localiza en el área TOMOGRAFIA DE COHERENCIA ÓPTICA de baja reflectividad más interna que corresponde a la capa de células ganglionares. De esta forma construye un mapa tridimensional del espesor de la CFNR con el código de color ya comentado, proporcionando la visualización de la CFNR dentro de los 6 x 6 mm2 de la región parapapilar. Cada pixel del mapa del espesor de la CFNR es entonces analizado con referencia a una base de datos normativa y esto nos proporciona un mapa de desviación del espesor de la CFNR. El SD-OCT por tanto analiza un mayor número de puntos en menos tiempo que el TD-OCT y localiza el centro de la papila de forma automática, evitando así errores de centrado. Todo ello determina una mayor precisión diagnóstica. Índices de Fiabilidad Para que la imagen adquirida sea fiable hay que tener en cuenta los factores siguientes: – Ausencia de scans descentrados. – Intensidad de la señal («Signal strength») > 6. – Ausencia de artefactos de movimiento. – Buen centrado alrededor de papila. Protocolo de análisis En la figura 4 presentamos el formato de impresión del protocolo «Optic disc cube» previo a la actualización 5.0 del software (no incluía el análisis de la papila). En los siguientes apartados se explicarán las distintas gráficas que aparecen. Mapas de espesor de la CFNR y de desviación respecto a la normalidad Figura 4. Representación OCT-Cirrus del análisis del espesor de la capa de fibras nerviosas peripapilar, previo a la actualización con el nuevo programa de análisis de la papila. En la parte lateral de arriba abajo se observan el mapa polarimétrico (RNFL thickness map), el mapa de desviación de la CFNR, el gráfico TSNIT con escala cromática y el tomograma de la CFNR. En la parte central superior se aprecia el diagrama por cuadrantes y sectores horarios. En el centro se insertan las dos retinografías de la paciente con papilas que cumplen la regla ISNT. En esta paciente todos los datos resultan normales, aunque en el mapa de desviación del grosor de la CFNR de OI, se aprecia un defecto cuneiforme superior de la CFNR que podría ser indicio de afectación precoz de la CFNR (flecha negra). Estos mapas se basan en todos los datos de grosor calculados para el cubo del disco óptico (200 x 200). El Mapa de grosor RNFL deriva de las mediciones de grosor medio y utiliza el patrón de color del polarímetro GDx (Zeiss), donde los colores fríos (azules, verdes) representan las áreas más delgadas y los colores cálidos (amarillos, rojos) representan las áreas más gruesas. Los mapas excluyen el disco óptico, que aparecía en azul liso en las primeras versiones y gris en las más recientes. En la parte lateral de la representación se observa el código de color que va de cero (azul) a 350 micras (blanco) (fig. 5). El Mapa de desviación del espesor de la CFNR («RNFL thickness deviation») deriva de las mediciones de grosor promedio de superpixeles e indica los resultados de la comparación estadística frente al ran- 3. DISPOSITIVOS COMERCIALES. PROTOCOLOS DE ESCANEADO Y ANÁLISIS DE RESULTADOS 75 Figura 5. Mapa de grosor RNFL (izquierda) con haces de fibras nerviosas arcuatos en color rojo. Mapa de desviación (centro) se observan pixeles de color amarillo-rojo en la arcada superior y en la región infrapapilar. A la derecha se observa la nueva versión del mapa de espesor con la papila en color gris. go de grosor normal de cada superpixel, superpuestos en la imagen de fondo de ojo. La imagen de fondo de ojo aparece en escala de grises para los valores normales y cada superpixel con valores de espesor en el percentil 5% ó 1% aparecería en color amarillo o rojo respectivamente (fig. 5 central). En el bloque de Glaucoma se presentarán ejemplos prácticos y el esquema sugerido por Leung y col para cuantificar los defectos observados en este mapa. Figura 7. Perfil TSNIT de ambos ojos dentro de la normalidad, en la gráfica superior se observa el perfil del grosor del anillo neurorretiniano y en el inferior el de la CFNR de ambos ojos. normalidad respecto a la edad. La representación por cuadrantes y sectores horarios es prácticamente idéntica en OCT Cirrus y Stratus. En Cirrus desaparece la tabla de datos, manteniéndose únicamente el valor del espesor medio y de la simetría interocular (fig. 6). Valores de grosor medio, por cuadrantes y sectores horarios Perfiles de grosor TSNIT Estos valores informan del grosor medio a lo largo del círculo de cálculo completo, al igual que por cuadrantes y horas de reloj. Además del valor numérico, se presentan los valores en la escala cromática clásica de Los Perfiles de grosor TSNIT (TSNIT: Temporal, Superior, Nasal, Inferior, Temporal) muestran el grosor en cada ubicación de barrido a lo largo del círculo peripapilar e incluyen como telón de fondo el código cromático de normalidad clásico. El perfil de OU central muestra el grosor de RNFL de los ojos izquierdo y derecho juntos, para permitir detectar asimetrías en regiones específicas. En la nueva actualización se proporciona también un perfil de grosor TSNIT del grosor del anillo neurorretiniano (fig. 7). BIBLIOGRAFÍA Figura 6. OCT Cirrus. Representación gráfica de la CFNR por cuadrantes y sectores horarios. En este paciente todos los datos están dentro de la normalidad (color verde). 1. Budenz DL, Anderson DR, Varma R, Schuman J, Cantor L, Savell J, Greenfield DS, Patella VM, Quigley HA, Tielsch J. Determinants of normal retinal nerve fiber layer thickness measured by Stratus OCT. Ophthalmology 2007; 114: 1046-1052. 2. Leung CK, Lam S, Weinreb RN, Liu S, Ye C, Liu L, He J, Lai GW, Li T, Lam DS. Retinal nerve fiber layer imaging with spectral-domain optical coherence tomography: analysis of the retinal nerve fiber layer map for glaucoma detection. Ophthalmology 2010; 11: 1684-1691. 3. Savini G, Zanini M, Carelli V, Sadun AA, Ross-Cisneros FN, Barboni P. Correlation between retinal nerve fibre layer thickness and optic nerve head size: an optical coherence tomography study. Br J Ophthalmol 2005; 89: 489-492. 4. Wollstein G, Ishikawa H, Wang J, Beaton SA, Schuman JS. Comparison of three optical coherence tomography scanning areas for detection of glaucomatous damage. Am J Ophthalmol 2005; 139: 39-43. 76 TOMOGRAFIA DE COHERENCIA ÓPTICA 3.4. OCT Stratus y OCT Cirrus. Protocolos de adquisición y análisis del nervio óptico Francisco J. Muñoz Negrete, Anastasios Koutsoulidis, Gema Rebolleda, Agustín Martín Justicia La OCT permite una valoración cualitativa y cuantitativa del nervio óptico que ha demostrado cierto paralelismo a la evaluación obtenida con otros instrumentos. En la TD-OCT se requiere la realización de una toma de imagen independiente de la de la CFNR, mientras que en la mayoría de los SD-OCT una sola toma es suficiente para estudiar la CFNR y el nervio óptico simultáneamente. OCT STRATUS Con OCT Stratus, para el estudio de la papila habitualmente se selecciona el protocolo de estudio «Fast optic disc», que realiza 6 barridos lineales de 4 mm de longitud equidistantes entre sí, dispuestos como los ejes de una rueda de carro, que atraviesan un eje central común. Cada scan lineal consiste en 512 A scan transversos y 1024 axiales por imagen. Se prefiere al protocolo «Optic disc», porque la adquisición de la imagen es más rápida y menos sensible a artefactos por movimientos oculares o parpadeo. Realiza dos mediciones cuantitativas de la papila. Una es el área del anillo neurorretiniano (sección transversal de la CFNR situada sobre la excavación), que se indica en rojo en la tomografía radial individual (parte izquierda de la pantalla). La otra medida es la Figura 1. Segmentación de la imagen OCT de la papila. Los círculos rojos son los límites del EPR y la línea azul que los une es la línea del disco, que delimita el diámetro del disco. Una segunda línea recta azul oscuro (línea de la excavación) se sitúa automáticamente 150 micras por delante de la línea del disco y separa las regiones de la excavación y del ANR. Una tercera línea azul clara dibuja el límite vítreo-retiniano. El área azul representa el ANR. distancia mínima entre la superficie de la CFNR y el EPR. A cada lado de la papila, el análisis calcula esta distancia (indicada en líneas amarillas) y estima la media para obtener la anchura media del nervio óptico (Average Nerve Width @ Disc) (fig. 1). Método de análisis de la papila El software de OCT Stratus utiliza un algoritmo de detección de límites para diferenciar automáticamente microestructuras como EPR, CFNR y límite retina-vítreo en base a su reflectividad. Para cada barrido del grupo, el análisis «Optic Nerve Head» (cabeza del nervio óptico) detecta la superficie anterior de la CFNR y el EPR. Detecta la superficie de la CFNR buscándola en cada barrido A desde delante hacia atrás, hasta que encuentra una reflectividad superior a un valor umbral. De la zona subyacente a la superficie de la CFNR, recorre cada barrido A en dirección posterior en busca de la máxima tasa de cambio de reflectividad, para encontrar la superficie del EPR. Una vez determinados estos límites, el algoritmo detecta y mide todas las estructuras anatómicas papilares basándose en los marcadores (puntos de referencia) a cada lado del disco en el punto en que termina el EPR. La línea recta trazada entre estos dos puntos de referencia se denomina «línea del disco» y mide el diámetro del disco (fig. 1) El diámetro de la excavación se mide en una línea paralela a la línea del disco (línea de la excavación), desplazada 150 micras por delante (de forma predeterminada, aunque este límite puede ajustarse manualmente). Una tercera línea curvada dibuja la interfase vitreorretiniana. El valor del «Area del Anillo Neurorretiniano» («Rim Area») se delimita por delante por la línea de la interfase vitreorretiniana, por detrás por la línea de la excavación y lateralmente por una línea vertical que se traza desde los puntos de referencia del EPR hasta la línea de interfase vitreorretiniana (fig. 1). Los resultados de estos algoritmos de detección y medición se muestran gráficamente en la imagen tomográfica. En la visualización de resultados, es posible ajustar la posición de los puntos de referencia del disco y, por ende, de las mediciones generadas. 3. DISPOSITIVOS COMERCIALES. PROTOCOLOS DE ESCANEADO Y ANÁLISIS DE RESULTADOS Leung probó cambiar la posición de la línea a 95 y 205 micras por encima del EPR, en vez de 150, y encontró que la mayor sensibilidad y especificidad se consiguen con la línea de referencia a 150 micras del EPR. El análisis «Optic Nerve Head» (Cabeza del nervio óptico) combina el análisis y la medición de cada barrido individual para formar una imagen y mediciones compuestas que abarcan toda la cabeza del nervio óptico. Debido a que tarda más en adquirir las imágenes es más susceptible a artefactos debidos a movimientos oculares y por ello apenas se utiliza. Mediciones individuales de imágenes tomográficas • «Rim Area» (Área del ANR: área de la sección transversal vertical): Se corresponde con el área roja situada encima de la línea de la excavación hasta la superficie anterior del disco. • «Average Nerve Width @ Disc» (Anchura media de la papila): Promedio de las anchuras del fascículo nervioso a cada lado del disco; se representa por una línea amarilla recta que abarca desde cada punto de referencia del disco al punto más próximo en la superficie anterior. • «Disc Diameter» (Diámetro de la papila): Línea recta azul clara entre los dos puntos de referencia del disco; se representa con una cruz azul dentro de un círculo. Los puntos de referencia del disco corresponden a los bordes superior e interior del EPR. Esta línea recibe el nombre de línea «RPE anatomic» o línea del disco. • «Cup Diameter» (Diámetro de la Excavación): Línea roja recta de guiones. Esta línea se extiende hacia el borde azul claro para representar el límite posterior de éste. • «Rim Length» (Horizontal) (Longitud horizontal del ANR): Diferencia entre el diámetro del disco y el de la excavación. Los puntos de referencia que toma automáticamente el aparato pueden ser modificados manualmente en caso de que el usuario crea que puede colocarlos con mayor exactitud después de su visualización. 77 de barrido individual. Debajo de la imagen compuesta aparece una tabla de datos con las mediciones globales de la papila. En el extremo derecho y en la parte inferior derecha hay herramientas para ajustar la imagen compuesta y su análisis y para grabar resultados de varios análisis, así como seleccionar resultados previamente grabados. Características y funciones de la imagen compuesta La imagen compuesta traza los contornos del disco en rojo y los de la excavación en verde. Muestra las líneas horizontal y vertical más largas tanto en la papila como en la excavación del mismo color que las delimita. Los cuadrantes nasal (N), inferior (I), temporal (T) y superior (S) se indican junto con el ojo (OD u OS). Para cada barrido se muestran los puntos de referencia del disco con una cruz roja dentro de un círculo y los bordes de la excavación con cruces verdes pequeñas (fig. 2). Figura 2. Imagen compuesta de la papila. El límite rojo es el del borde de la papila y el área delimitada en verde es el de la excavación. Mediciones de la imagen compuesta de la papila Análisis de la imagen compuesta de la papila El lado derecho de la visualización de resultados contiene una imagen compuesta de la papila generada a partir de todas las tomografías (fig. 2). No cambia a medida que se recorre cada barrido, aunque incorpora las modificaciones efectuadas en cada análisis En la parte inferior derecha de la hoja de impresión nos aparece una tabla (fig. 3), que contiene los datos siguientes: • VIRA: Vertical Integrated Rim Area (Área vertical integrada del ANR –volumen-): Es un cálculo estimado del volumen total de la CFNR en el ANR, que se 78 Figura 3. Tabla de datos de la hoja de impresión de la estrategia «Fast Optic disc». No proporciona datos de normalidad. realiza multiplicando el promedio de todas las áreas del ANR por la circunferencia del disco. • HIRW: Horizontal Integrated Rim Width (Anchura horizontal integrada del ANR –Área–): Es un cálculo del área total del ANR, que se realiza multiplicando el promedio de todas las anchuras del ANR por la circunferencia del disco. Ambos índices apenas han resultado de utilidad y han desaparecido en los SD-OCT. • Disc Area (Área de la papila): Área delimitada por el contorno rojo del disco en la imagen compuesta. • Cup Area (Área de la excavación): Área delimitada por el contorno verde de la excavación en la imagen compuesta. • Rim Area (Área del ANR): Diferencia entre el área del disco y el área de la excavación. El área de la papila y de la excavación varían mucho entre personas sanas, mientras el área del ANR presenta mayor valor y menos variabilidad, porque corresponde al número de axones. • Cup/Disc Area Ratio (CDR: Relación área excavación/disco): Proporción entre el área de la excavación y el área del disco. TOMOGRAFIA DE COHERENCIA ÓPTICA • Horizontal Cup/Disc Ratio (HCDR: Relación excavación/disco horizontal): Relación entre la línea horizontal más larga de un lado a otro de la excavación y la línea horizontal equivalente de un lado a otro de la papila. • Vertical Cup/Disc Ratio (VCDR: Índice relación excavación/disco vertical): Relación entre la línea vertical más larga de un lado a otro de la excavación y la línea vertical equivalente de un lado a otro de la papila. El aparato no nos proporciona información sobre la normalidad de los datos. Como se comenta en el capítulo 2, para obtener una imagen de calidad debemos tener en cuenta los siguientes factores: – Imagen de video clara. – Buen centrado de papila. – Evitar parpadeo o movimientos oculares durante la adquisición de la imagen. – Imagen del barrido centrada dentro de la ventana sin pérdida de sectores del mismo. – Intensidad de señal mayor de 6. Los artefactos más frecuentes y la forma de evitarlos se explican detenidamente en el capitulo 2, serían en resumen: – Identificación incorrecta del borde de la papila, generalmente por atrofia peripapilar. – Identificación errónea de la superficie retiniana. – Presencia de estructuras extrapapilares (opacidades vítreas, asas vasculares o restos de la arteria hialoidea) que se incluyen de forma automática dentro del ANR. – Por un error en el software, en papilas pequeñas no excavadas se asigna un valor de área de ANR 0 y excavación 1,0 (excavación total). Por otro lado, comparando la estimación automática que proporciona OCT Stratus con la evaluación subjetiva de la papila por exploradores expertos, hemos comprobado que tiende a supraestimar excavaciones pequeñas (fig. 4), mientras que en excavaciones grandes el grado de acuerdo es mayor. Figura 4. OCT Stratus, estrategia «Fast optic disc». En la figura central la excavación se observa de color verde, la medición automática del aparato es excavación horizontal 0,424 y vertical 0,562, considerablemente superiores a las que se aprecian en la retinografía de la derecha del mismo paciente. 3. DISPOSITIVOS COMERCIALES. PROTOCOLOS DE ESCANEADO Y ANÁLISIS DE RESULTADOS OCT CIRRUS Para el estudio de la papila con OCT Cirrus se utiliza el protocolo «Optic disc cube 200 x 200», exactamente el mismo que estudia la CFNR. El instrumento genera un cubo de datos de 6 x 6 mm después de realizar un barri- 79 do de 40.000 puntos (200 B-scan x 200 A-scan). Por tanto, a diferencia del OCT Stratus, que requiere realizar dos mediciones independientes para la CFNR y la papila, con OCT Cirrus se usa el mismo protocolo para medir ambos y se facilita una hoja de impresión única con los datos de la CFNR y de la papila (fig. 5). Figura 5. Hoja de impresión única de CFNR y papila con OCT Cirrus. En la parte superior se observa una señal de 7 (OD) y 8 (OI). En la tabla de datos se aprecia una asimetría patológica de la CFNR (rojo). En el mapa de desviación de la CFNR se observa un defecto de la CFNR (píxeles amarillos y rojos) en las arcadas temporales de ambos ojos, más marcado en OS. En el diagrama en sectores se aprecia sector horario patológico a la 1 h en ambos ojos y cuadrante superior patológico en OI. 80 Fiabilidad Para que la medida sea fiable se requiere que la intensidad de la señal sea mayor o igual a 6 y que no existan artefactos por movimientos oculares o parpadeo dentro de un radio de 1,73 mm alrededor de la papila, detectados por la observación de discontinuidad en los vasos sanguíneos o distorsión en la imagen OCT. Método de adquisición de tomografía El aparato detecta automáticamente el centro de la papila y extrae un B-scan en forma circular de 3,46 mm de diámetro centrado en ese punto, simulando así el círculo que se obtiene con el OCT Stratus. Se delimitan los límites anterior y posterior de la CFNR y se determina el espesor en cada barrido A 200 x 200. El dispositivo calcula el espesor de la CFNR en cada punto del círculo y genera la impresión ya comentada en la sección de la CFNR (2.3). La anchura del ANR alrededor de la circunferencia completa del disco óptico se determina midiendo el espesor del tejido neurorretiniano en el nervio óptico TOMOGRAFIA DE COHERENCIA ÓPTICA conforme las fibras nerviosas se incurvan para salir a través de la apertura de la membrana de Bruch. Se realiza así una medida de volumen tridimensional. Con este método, las medidas no se ven afectadas por cambios en función de que el disco óptico sea visto desde ángulos diferentes por entrar a través de la papila en una localización diferente. Adicionalmente, las medidas del disco y del área del ANR se corresponden con la anatomía como si fueran vistas a lo largo del eje del nervio óptico. Analiza los siguientes parámetros de forma automática, proporcionando el código cromático de normalidad clásico, al que añaden un nuevo color, el gris, cuando no son aplicables criterios de normalidad, por ejemplo en el área del disco, que puede ser normal tanto en micropapilas como en macropapilas (fig. 6): – Área del ANR. – Área del disco. – Relación Excavación/papila media. – Relación Excavación/papila vertical. – Volumen de la excavación. Como novedad, proporciona además una gráfica TSNIT del espesor del ANR y complementaria a la clásica gráfica TSNIT de la CFNR (fig. 6). Figura 6. Paciente con glaucoma OI preperimétrico. OCT Cirrus: Superior izquierda: Tabla de datos con escala de normalidad en la que se aprecian valores en el límite de la normalidad en varios parámetros de medida de papila (área del ANR y de la excavación tanto media como vertical). Aunque el grosor medio de la tabla de datos es normal en ambos ojos, en OI es 15 micras menor que en OD (una asimetría mayor de 9 micras se considera muy sugestiva de glaucoma). En el gráfico inferior se observa el gráfico TSNIT del grosor del ANR con marcada asimetría, debido a una reducción del espesor global del ANR en OI. En el diagrama sectorial (superior derecha) se observa OD normal y cuadrante inferior y hora 6 patológicos en OI. En las retinografías inferiores se observa la marcada asimetría papilar y el adelgazamiento del ANR inferior de OI, que se correlacionan con los datos de OCT. 3. DISPOSITIVOS COMERCIALES. PROTOCOLOS DE ESCANEADO Y ANÁLISIS DE RESULTADOS 81 Figura 7. Imágenes tomográficas horizontal, vertical y circular facilitadas en la hoja de impresión del estudio de nervio óptico y CFNR con OCT Cirrus. Figura 8. Paciente con «tilted disc» y atrofia peripapilar OD. En la tabla de la izquierda se observa un mayor área de ANR en OD que coincide con una mejor preservación de la CFNR en el diagrama de sectores de distribución de la CFNR (abajo izquierda). Sin embargo, el área del disco aumentada de OD indica que el área de atrofia peripapilar ha sido incluida en la medición del área de papila. En los márgenes inferior derecho e izquierdo de la hoja de impresión aparecen imágenes tomográficas horizontal, vertical y circular. En las versiones iniciales solo se facilitaba el tomograma circular (fig. 7). Cuando la salida del nervio óptico es excesivamente oblicua, resultan más difícil de interpretar y cuantificar las diferentes áreas de la papila mediante examen oftalmoscópico, fotografía u otras técnicas de imagen, que están más sujetas a posibles errores de interpretación. Sin embargo, la estrategia de adquisición y medida de OCT Cirrus previamente comentada puede permitir la obtención de medidas objetivas y fiables (fig. 8). A diferencia del estudio de la papila con TD-OCT, recientemente Mwanza et al (2010) han encontrado con Cirrus OCT una reproducibilidad intra e intervisita muy buena, lo que le convierte en una herramienta potencialmente útil para el diagnóstico y seguimiento del glaucoma. Esta reproducibilidad es igualmente buena en pacientes normales y en glaucomatosos, lo que resulta especialmente útil en la medida del área del disco, cuya reproducibilidad es baja con Stratus-OCT. BIBLIOGRAFÍA 1. Anton A, Moreno-Montanes J, Blazquez F, et al. Usefulness of optical coherence tomography parameters of the optic disc and the retinal nerve fiber layer to differentiate glaucomatous, ocular hypertensive, and normal eyes. J Glaucoma 2007; 16: 1-8. 2. Arnalich-Montiel F, Muñoz-Negrete FJ, Rebolleda G, SalesSanz M, Cabarga C. Cup-to-disc ratio: agreement between slit-lamp indirect ophthalmoscopic estimation and stratus optical coherence tomography measurement. Eye 2007; 21: 1041-1049. 3. De León Ortega J, Kakaty B, Girkin CA, Artifacts on the Optic Nerve Head Analysis of the Optical Coherence Tomography in Glaucomatous and Nonglaucomatous Eyes. J Glaucoma 2009; 18: 186-191. 4. Leung CK, Chan WM, Hui YL, et al. Analysis of retinal nerve fiber layer and optic nerve head in glaucoma with different reference plane offsets, using optical coherence tomography. Invest Ophthalmol Vis Sci 2005; 46: 891-899. 5. Mwanza JC, Chang RT, Budenz DL, Durbin MK, Gendy MG, Shi W, Feuer WJ. Reproducibility of peripapillary retinal nerve fiber layer thickness and optic nerve head parameters measured with cirrus HD-OCT in glaucomatous eyes. Invest Ophthalmol Vis Sci 2010; 51: 5724-5730. 82 TOMOGRAFIA DE COHERENCIA ÓPTICA 3.5. Tomografía de Coherencia Óptica en la infancia. Interpretación del análisis macular, de la CFNR y del disco óptico Susana Noval, Mays El-Dairi, Inés Contreras La tomografía de coherencia óptica (OCT) es una herramienta diagnóstica especialmente útil en la infancia, dada la inocuidad, rapidez y sencillez de la prueba. La exploración mediante oftalmoscopia o con lentes de contacto es insustituible para valorar el polo posterior, pero a menudo resulta complicado obtener detalles porque a los niños les cuesta mantener la mirada de forma prolongada. La OCT nos ha proporcionado un método rápido para evaluar los detalles de la mácula y el nervio óptico sin precisar una fuente de iluminación intensa. En general, es posible conseguir una buena colaboración a partir de los tres o cuatro años de edad. Los protocolos de adquisición maculares son más fáciles de realizar que los papilares, por lo que resultan especialmente útiles en los niños con menor capacidad de fijación o colaboración. das como referencia de normalidad pues nos ofrecen los valores comprendidos entre el percentil 5 y 95 para cada uno de los sectores de los mapas de grosor de capa de fibras nerviosas (CFNR) y macular. Todos estos estudios han aportado información adicional sobre las diferencias en base a varios factores como la edad o la raza (tabla 4). Con respecto a la edad, se ha estimado que para el conjunto de la población anualmente se reduce el grosor macular 0,53 µm y 0,16-0,44 µm el grosor de la CFNR. Sin embargo, el descenso no es acusado hasta la quinta década. Al comparar subgrupos de edad en la infancia se han encontrado pocas diferencias. Se ha observado que el grupo afro-americano presenta una excavación mayor que los niños caucásicos, con un grosor de la CFNR similar, por lo que debemos ser cautos en la interpretación de la relación excavación/papila como signo de glaucoma según las razas. VALORES DE REFERENCIA DE NORMALIDAD EN NIÑOS La principal limitación que tenemos actualmente para emplear la OCT en los niños es la ausencia de datos de referencia de normalidad, pues la mayoría de los modelos excluyen a menores de 18 años de su base normativa. Por ello la interpretación requiere un análisis detallado de las cifras absolutas sin contar con la imagen cromática normalizada que obtenemos en los adultos. Se han realizado varios estudios en niños sanos para obtener los valores de referencia para el OCTStratus. Las tablas 1 a 3 resumen los datos obtenidos en estas series y las figuras 1 y 2 pueden ser utiliza- Figura 1. Valor medio e intervalo de normalidad entre los percentiles 5 y 95 (OCT-Stratus) en niños. Izquierda: Valores de normalidad para el grosor de la CFNR. Derecha: Valores normales del grosor macular. TABLA 1. VALORES MACULARES NORMALES EN LA INFANCIA CON OCT-STRATUS OCT-STRATUS Volumen macular (mm3) Grosor macular central (µm) EEUU 3-17 años* 6,96 (6,39-7,62) 198 (160-237) Australia adolescentes Suecia 5-16 años * P5-P95. Grosor foveal mínimo (µm) 161,6 (115-266) 7,11 (6,28-7,79) 204 (162-243) 166 (130-194) 83 3. DISPOSITIVOS COMERCIALES. PROTOCOLOS DE ESCANEADO Y ANÁLISIS DE RESULTADOS TABLA 2. VALORES NORMALES DE LA CFNR EN LA INFANCIA OCT-STRATUS Medio Temporal Superior Nasal Inferior Australia 6 años 101,95 (97,9-105,9) 78,98 (73,9-84,1) 124,71 (117,8-131,6) 79,43 (72,8-86,1) 124,89 (117,7-132,1) Australia 12 años 104,57 (101,8-107,3) 71,13 (67,6-74,6) 131,09 (126,3-135,8) 86,40 (81,8-91,0) 129,84 (124,9-134,8) Australia adolescentes 103,6 (57,5-165) 74,6 (40,7-149) 129,7 (72,3-192) 82,0 (36,3-216) 128,3 (64,3-269) China 6-17 años 113,5 (9,8) 87,3 (15,4) 146,3 (16,3) 78,3 (16,1) 142,4 (18,4) EEUU 3-17 años* 106 (90-122) 78 (55-106) 137 (111-167) 81 (57-115) 127 (99-160) EEUU 4-17 años (91% hispanos) 107,0 (11,1) 72,5 (13,4) 135,4 (19,3) 83,0 (18,0) 136,9 (16,9) Francia 4-15 años# 104,33 (98,0-108,8) 73,79 ( 65-81) 130,72 (117-141) 79,01 (66-90) 132,99 (117-141) * P5-P95. # P25- P75. TABLA 3. VALORES NORMALES DEL ANÁLISIS DEL DISCO ÓPTICO EN LA INFANCIA OCT STRATUS Diámetro de disco (mm2) Diámetro excavación (mm2) Excavación/papila Australia 6 años 2,19 (2,16-2,22) 0,42 (0,40-0,44) 0,19 (0,185-0,20) Australia 12 años 1,89 (1,82-1,95) 0,63 (0,55-0,71) 0,33 (0,29-0,38) Australia adolescentes 2,34 (1,18-4,67) 0,46 (0,003-2,30) 0.21 (0,009-0,84) EEUU 3-17 años* 2,40 (1,83,3,24) 0,39 (0-1,08) 0,16 (0-0,40) * P5-P95. TABLA 4. FACTORES QUE AFECTAN A LOS VALORES DEL DISCO ÓPTICO, ESPESOR MACULAR Y DE LA CFNR PAPILA CFNR Edad MÁCULA Reducción a partir de los 50 años. Longitud axial Correlación positiva con área del disco Peso al nacer < 2.500 g Disco más pequeño Excavación mayor Mayor E/P Correlación negativa con grosor medio Correlación negativa con el volumen macular Raza (respecto a los niños caucásicos) Afro-americanos Excavación mayor ANR similar Mayor E/P Mayor grosor medio Este Asia Discos mayores Mayor excavación Menor ANR Mayor E/P (30-42%) Mayor grosor medio (3,2-12,1%), salvo el cuadrante nasal Oriente próximo No diferencias Volumen macular, grosor foveal y de los anillos internos de la mácula inferior Sexo No diferencias consistentes Refracción La mayoría de los estudios no han hallado diferencias 84 TOMOGRAFIA DE COHERENCIA ÓPTICA han analizado la ausencia de esta depresión en patologías como la aniridia, el albinismo, el nanoftalmos, la incontinencia pigmenti o la prematuridad. En todas ellas se describe como las capas retinianas internas persisten a nivel foveolar, manteniendo la retina la misma morfología que a nivel parafoveolar. Esto da lugar a un incremento en el grosor macular central, que no se relaciona con la agudeza visual, puesto que en muchos de estos casos se conserva una función visual normal y que ha dado lugar a un nuevo término: «Fóvea plana». Se ha estimado una prevalencia de fóvea plana del 3% entre los niños a término con agudeza visual normal (fig. 2). BIBLIOGRAFÍA Figura 2. Niño sano nacido a término con función visual normal y ausencia de depresión foveal en la exploración con OCT Stratus (imagen superior). Con el SD-OCT se puede apreciar la persistencia de las capas retinianas internas a nivel foveolar (medio) en comparación con la morfología foveolar habitual (imagen inferior). DEPRESIÓN FOVEAL Y FOVEA PLANA En la depresión foveal el tejido retiniano interno se desplaza a un lado dejando en el centro un área de conos altamente especializados. Varios trabajos 1. El-Dairi MA, Asrani SG, Enyedi LB, Freedman SF. Optical coherence tomography in the eyes of normal children. Arch Ophthalmol 2009; 127: 50-58. 2. Eriksson U, Holmstrom G, Alm A, Larsson E. A populationbased study of macular thickness in full-term children assessed with Stratus OCT: normative data and repeatability. Acta Ophthalmol Scand 2009; 87: 741-5. 3. Huynh SC, Wang XY, Burlutsky G, Rochtchina E, Stapleton F, Mitchell P. Retinal and optic disc findings in adolescence: a population-based OCT study. Invest Ophthalmol Vis Sci 2008; 49: 4328-4335. 4. Marmor MF, Choi SS, Zawadzki RJ, Werner JS. Visual insignificance of the foveal pit: reassessment of foveal hypoplasia as fovea plana. Arch.Ophthalmol. 2008; 126: 907-913. 5. Samarawickrama C, Huynh SC, Liew G, Burlutsky G, Mitchell P. Birth weight and optic nerve head parameters. Ophthalmology 2009; 116: 1112-1118. 3. DISPOSITIVOS COMERCIALES. PROTOCOLOS DE ESCANEADO Y ANÁLISIS DE RESULTADOS 85 3.6. OCT Spectralis (Heidelberg Instruments) Javier Lara Medina, Carmen Ispa Callén, Francisco J. Muñoz Negrete, Gema Rebolleda Spectralis OCT (Heidelberg Instruments, distribuidor en España: Bloss) es un instrumento formado por la combinación de un oftalmoscopio láser confocal y un SD-OCT con un sistema de fijación ocular láser (fig. 1). Es uno de los equipos de SD OCT más versátiles desde que tiene la opción de seis módulos: angiografía con fluoresceína, verde de indocianina, imagen de autofluorescencia, SLO libre de rojo, SLO infrarrojo y OCT. Permite también la captación de imágenes de gran ángulo y la opción de SA-OCT-SA. Tiene carácter modular, de forma que pueden adquirirse todas o partes de las opciones existentes. Características técnicas: – Velocidad escaneado: 40000 A-scan/seg. – Resolución axial: 7 µm y de 4 µm tras el tratamiento digital de las imágenes. – Resolución transversal: 14 micras. – Parámetro de fiabilidad: «Signal strength» (Q) > 15 dB. – Sistema de «eye tracking» activo y AutoRescan para escanear de forma precisa las mismas áreas a lo largo de diferentes exploraciones. – Posibilidad de objetivo de gran angular. Figura 1. Sistema HRA-OCT Spectralis. Se muestra el terminal de captura del instrumento, que puede ser desplazado libremente tanto horizontal como verticalmente para la adquisición de las imágenes. El sistema de guiado por rayo láser toma el fondo como referencia y guía el segundo rayo a la posición precisa del escaneado del OCT. Esta arquitectura mantiene constante el alineamiento del OCT permitiendo la adquisición de 1 a 100 B-Scans de un mismo punto retiniano, lo cual facilita la eliminación en la imagen final del moteado causado por el ruido. Además, el sistema conserva esta alineación en las sucesivas visitas del paciente, porl o que se puede cuantificar con precisión el cambio en las distintas mediciones obtenidas con el aparato en un mismo punto de la retina. Estas características se traducen en una alta repetibilidad y reproducibilidad en las mediciones realizadas con Spectralis. PROTOCOLOS DE ESTUDIO DE LA MÁCULA Spectralis OCT dispone de diversos protocolos predefinidos para la adquisición de las imágenes como son el cubo macular, el rastreo lineal y el patrón en estrella de 6 líneas. En la figura 2 se muestra la pantalla de adquisición de imágenes del Spectralis. En la zona de la izquierda se observa la imagen funduscópica en vivo mediante infrarrojos o durante la realización de una angiografía. La imagen infrarrojo tiene la facilidad de atravesar opacidades de medios, pudiendo ofrecer una imagen de alta calidad en presencia de cataratas e incluso con hemorragias vítreas moderadas. En dicha imagen se superpone una línea que indica la zona que esta siendo escaneada por el tomógrafo. La zona de escaneo puede ser movida con total libertad por el operador utilizando el ratón, de este modo, podemos Figura 2. Pantalla de captura de imágenes tomográficas del OCT Spectralis. 86 Figura 3. Imagen bidimensional de un paciente sano obtenida con Spectralis OCT. escanear cualquier área de la retina visualizada. En la parte derecha de la pantalla se muestra la tomografía de dicha zona en tiempo real. La elección del tipo de protocolo de escaneado se realiza en la parte inferior de la derecha donde disponemos de una serie de botones que corresponden a los distintos protocolos de adquisición. Todos estos protocolos son configurables, pudiéndose incrementar la densidad de escáneres a realizar en cada uno. Hay que señalar que a mayor densidad de escaneos se produce un aumento proporcional del tiempo necesario para la adquisición. Este hecho es importante ya que las leyes de la FDA limitan la exposición de los pacientes al láser de clase 1 que mantiene la fijación ocular. El oftalmólogo dispone de 300 segundos por paciente para obtener las imágenes, interrumpiéndose el láser tras este período durante un tiempo de espera. No debe olvidarse que este tiempo es acumulativo y es posible exceder el tiempo máxi- Figura 4. Representación tridimensional de un paciente afecto de membrana neovascular secundaria a coroidopatía central serosa. La flecha negra nos indica las distintas opciones que el Spectralis dispone para la visualización de la imagen. El software incluido con el aparato nos permite exportar como video el resultado tridimensional de la exploración de una forma sencilla (flecha blanca). TOMOGRAFIA DE COHERENCIA ÓPTICA mo de exposición cuando se realizan estudios múltiples de un paciente (autofluorescencia, angiografía fluoresceínica, OCT o angiografía con verde de indocianina) en una misma sesión. Aunque en principio este sistema de protección podría considerarse como una limitación del instrumento, en nuestra experiencia, el tiempo límite se supera en muy contadas ocasiones y no supone ningún problema para la exploración con Spectralis. Los escáneres obtenidos por el instrumento posteriormente son procesados mediante software para eliminar el ruido de las imágenes y mejorar la resolución de las mismas mediante el sistema denominado «Heidelberg Noise ReductionTM». Las imágenes pueden ser visualizadas de forma bidimensional corte a corte (fig. 3) o bien en forma tridimensional (fig. 4). El Spectralis-OCT dispone de una base de datos normalizada de grosor macular para pacientes sanos y una base normalizada para la capa de fibras nerviosas. Un estudio prospectivo realizado en 50 pacientes sanos de varias razas con edades comprendidas entre 20 y 84 años determinó que el grosor medio del campo central definido por el ETDRS en este OCT era de 270,2 ± 22,5 µm. No se lograron encontrar diferencias estadísticamente significativas en el grosor macular por la edad o por el sexo. En cambio, los pacientes asiáticos (279,5 ± 27,4 µm) y los caucásicos (272,7 ± 20,8 µm) mostraron mayor grosor que los sujetos de raza negra (256,5 ± 16,9 µm; P = 0,007). El OCT Spectralis al asociar un láser confocal con un sistema tomográfico permite realizar diversos métodos exploratorios en un mismo paciente de forma simultánea. El uso del sistema automático de alineación ocular basado en el láser confocal sirve para poder escanear tomográficamente un punto concreto de la retina asegurando la correspondencia punto a punto entre la imagen funduscópica y la imagen tomográfica. De este modo, se pueden obtener cortes seccionales en tiempo real de una determinada área retiniana durante la realización de una angiografía con fluoresceína o con verde de indocianina así como durante la exploración con autofluorescencia (fig. 5). Esta característica está permitiendo realizar estudios histológicos de la retina in vivo en diversas patologías; así se ha demostrado que la hiperfluorescencia observada durante una angiografía corresponde a alteraciones en la retina externa y en la capa del epitelio pigmentario de la retina. Otra aplicación sería en pacientes diabéticos, pudiendo localizar los microaneurismas hiperfluorescentes responsables del engrosamiento retiniano. También puede resultar muy útil esta característica en pacientes afectos de coroidopatía central serosa, ya que se puede determinar el 3. DISPOSITIVOS COMERCIALES. PROTOCOLOS DE ESCANEADO Y ANÁLISIS DE RESULTADOS Figura 5. El OCT Spectralis es capaz de realizar un estudio simultáneo de autofluorescencia (izquierda) y tomografía espectral (derecha) en un paciente con enfermedad de Stargardt. La flecha blanca señala como el sistema nos muestra la correspondencia entre la imagen de fondo y la tomografía. 87 Figura 7. Imagen del mismo paciente de la figura 6. Estudio comparativo entre dos visitas sucesivas mediante el «Thickness Profile» . La flecha blanca muestra la aparición de quistes en la capa nuclear externa de la macula que producen un aumento del grosor retiniano de 58 µm con respecto al mismo corte de una visita previa del paciente. Figura 6. Spectralis OCT. Estudio comparativo de espesor macular seleccionándose automáticamente los mismos cortes que los de un análisis de referencia. Se observa un leve edema retiniano (flecha blanca horizontal) en un paciente afecto de pars planitis. El software del instrumento nos permite realizar el seguimiento de una forma gráfica (flecha blanca vertical) como numérica (flecha negra). punto de fuga en la angiografía al mismo tiempo que se pueden analizar de forma cuantitativa y cualitativa los desprendimientos neurosensoriales asociados. El OCT Spectralis reconoce el patrón retiniano de un paciente cuando es reexplorado por el instrumento pudiendo analizar un mismo corte retiniano en sucesivas visitas del paciente. Simplemente hay que considerar una exploración como referencia y el OCT se encarga en las sucesivas visitas de obtener los mismos cortes para poder realizar estudios comparativos. Estos análisis comparativos pueden ser tanto del grosor retiniano (figs. 6 y 7) como de la capa de fibras nerviosas (fig. 8). En nuestra experiencia, el uso del sistema de reescaneado constituye una herramienta muy eficaz para el seguimiento de los pacientes con patología macular, ya que permite valorar fielmente la eficacia de los tratamientos y la progresión de la enfermedad. De este modo, en pacientes con membranas neovas- Figura 8. Paciente afecto de una neuropatía óptica por enfermedad de Wegener. En la parte superior es muestra el primer análisis de la papila durante la fase aguda de la enfermedad en la que se aprecia un edema de la capa de fibras nerviosas. En la sucesivas revisiones del paciente el OCT se encarga de obtener el mismo corte para realizar estudios comparativos. En la imagen inferior podemos observar la aparición de múltiples defectos en la capa de fibras nerviosas tras la neuritis óptica. culares se puede objetivar con relativa sencillez la presencia de una recidiva o bien la mejoría tras un tratamiento antiangiogénico (fig. 9). 88 Figura 9. La capacidad del OCT Spectralis de repetir los mismos cortes en visitas sucesivas tiene especial utilidad en el seguimiento de pacientes afectos de membranas neovasculares. PROTOCOLOS DE ESTUDIO DE LA CFNR También se incluye un software de análisis de capa de fibras nerviosas de la retina (CFNR) con base normativa. Este sistema realiza un rastreo circu- TOMOGRAFIA DE COHERENCIA ÓPTICA lar para el análisis de la capa de fibras utilizando un sistema de alineamiento fovea-disco (FoDi®), para evitar la variabilidad en las medidas debidas a cambios en la posición de la cabeza, del ojo o la rotación del mismo. En el formato de impresión, aparece la imagen infrarroja de papila, la imagen tomográfica con la segmentación de la CFNR, el gráfico TSNIT con código cromático, el diagrama sectorial por cuadrantes con la escala cromática habitual y otro diagrama con 6 sectores, en lugar de los 12 sectores horarios clásicos, en el que los sectores superior e inferior son desdoblados en superonasal, superotemporal, inferonasal e inferotemporal, manteniéndose los sectores nasal y temporal del diagrama de cuatro cuadrantes. El espesor medio aparece en el centro con el símbolo G (fig. 10). En el caso de la patología del nervio óptico, el Spectralis se encarga de manera automática de obtener el mismo corte alrededor de la cabeza del nervio óptico que la exploración considerada como referen- Figura 10. Formato de impresión de la CFNR, con FoDi®, que permite realizar los cortes de seguimiento en las mismas zonas. En la parte superior se observa la imagen infrarroja, seguida por la OCT con la segmentación de la CFNR, gráfico TSNIT y gráfico de espesor por cuadrantes y dividido en 6 sectores. En el gráfico inferior, la G representa el espesor medio de la CFNR. En este caso ambos ojos son clasificados como «borderline». 3. DISPOSITIVOS COMERCIALES. PROTOCOLOS DE ESCANEADO Y ANÁLISIS DE RESULTADOS 89 Figura 11. Examen de Asimetría de Polo Posterior. En las imágenes superiores en color aparece el mapa de espesor de la retina en polo posterior de cada ojo, con valores de espesor en una rejilla 8 x 8, y escala de color. En las imágenes superiores centrales se observa la asimetría de la rejilla entre ambos ojos. En la parte inferior se observa el mapa de asimetría S-I, es decir entre hemirretinas superior e inferior de cada ojo, tanto total (centro) como en cada uno de los recuadros de la rejilla (extremos), comprobándose un mayor grosor de la hemirretina superior. Se trata de un paciente con glaucoma preperimétrico. cia. Posteriormente, el software nos muestra de forma detallada la existencia de cambios en la capa de fibras entre todas las exploraciones realizadas a ese mismo paciente (fig. 8). pesor de la retina, por lo que puede verse alterado en cuadros que afecten a otras capas de la retina diferentes de la CFNR. Sería aconsejable que en el futuro se realizara un mapa de espesores de la CFNR o del complejo de células ganglionares, como en otros dispositivos OCT. ANÁLISIS DE ASIMETRÍA DEL POLO POSTERIOR EL OCT Spectralis realiza un mapa de espesor de la CFNR en la mácula, con un análisis de asimetría entre ambos ojos y ambas hemirretinas, que se basa en la naturaleza asimétrica del glaucoma. De esta forma puede establecerse una comparación punto por punto invertida con el campo visual. Nos proporciona un mapa de espesores en una rejilla 8 x 8 (fig. 12). Como crítica puede establecerse que mide todo el es- ANÁLISIS AXONAL NSITE Recientemente se ha incorporado una opción de análisis de imagen específica para Neuro-oftalmología (Nsite Axonal Analytics®), que permite enfocar el análisis en el sector temporal, el haz papilo macular (PMB). Las principales características vienen reflejadas en la tabla 1. TABLA 1 FUNCION Ventajas Programa Axonal Organiza patrones específicos para neurología Patrón RNFL-N Se centra más en la evaluación del sector temporal, que se afecta más precozmente Patrón PMB Se concentra en el haz papilo-macular y las fibras alrededor de la mácula. Escaneo isotrópico Volumen en Vertical Los escaneos se realizan perpendicularmente a las fibras nerviosas Patrón ONH-N Se utiliza para edemas papilares y neuritis ópticas en visión 3D EDI (Enhanced Depth Imaging) Especial para disco óptico. Permite la visualización de la lámina cribosa 90 TOMOGRAFIA DE COHERENCIA ÓPTICA Figura 14. Diagrama de cuadrantes de espesor, en el que los superiores e inferiores se dividen en TS, NS, TI y NI. Se añade además el parámetro N/T y el espesor del haz papilomacular (PMB), que es patológico en este paciente (única alteración del OCT que se observa en un paciente con neuritis óptica). Sistema EDI Figura 12. Escaneo PMB-20 siguiendo el sistema de alineamiento «fóvea-disco» (FoDi). La rejilla de 20° PMB se coloca automáticamente en el escaneo PMB-20 y se orienta automáticamente siguiendo el sistema de alineamiento FoDi (fovea to disc) (fig. 12). Los escaneos de volumen en esta aplicación son verticales para cortar las fibras nerviosas de forma perpendicular (escaneo isotrópico) que presenta las novedades siguientes: En el análisis del espesor de la CFNR utiliza la gráfica NITSN en lugar de la clásica TSNIT, que añade a la escala cromática de normalidad clásica (verdeamarillo-rojo) un cuarto color, el lila para indicar un espesor patológicamente elevado de la CFNR, lo que resulta de especial utilidad en casos de edema de papila (fig. 13). Al diagrama de 6 sectores de la CFNR, le añade los parámetros N/T (ratio del sector nasal/temporal) y PMB (papillo-macular bundle: sección del cuadrante temporal, entre –22° y +8°), constituyendo el círculo de clasificación RNFL-N (fig. 14) También facilita un programa de progresión, que compara en el tiempo todos los parámetros del RNFL-N. Figura 13. Gráfico NITSN con picos en el sector nasal lila (flecha azul) que se correlaciona con área nasal blanca de Cirrus. El sistema EDI (Enhanced Depth Imaging) permite enfocar en áreas posteriores, pudiendo así visualizarse la lámina cribosa y medirse el espesor coroideo. En este sentido, recientemente se ha propuesto que el Spectralis OCT podría ser utilizado para explorar la coroides. Para ello, hay que aproximar el instrumento muy cerca del ojo para obtener una imagen invertida de la parte central de la fóvea y así poder realizar mediciones manuales desde el borde externo del epitelio pigmentario de la retina hasta el borde interno de la esclera. El grosor coroideo medio a nivel subfoveal en ojos sanos se ha medido con esta técnica siendo la media de 287 ± 76 µm.3 Esta técnica ha permitido demostrar la existencia de un engrosamiento coroideo en pacientes con coroidopatía central serosa, lo cual explicaría el origen de la enfermedad por un aumento de presión hidrostática a nivel coroideo. Además, la visualización de la coroides podría ser de gran utilidad en pacientes ancianos o miopes con pérdidas injustificadas de visión, ya que en algunos casos se está observando que asocian a reducciones muy importantes del grosor coroideo a nivel macular. Por último, este Figura 15. Paciente con metástasis de carcinoma de mama a nivel macular. La imagen es obtenida mediante la técnica de mejora de imágenes coroideas con el OCT Spectralis. Se puede observar la invasión de la coroides por la masa homogénea asociada a un desprendimiento de la retina neurosensorial. 3. DISPOSITIVOS COMERCIALES. PROTOCOLOS DE ESCANEADO Y ANÁLISIS DE RESULTADOS modo de visualización también puede tener especial importancia en el estudio de pacientes con lesiones tumores a nivel coroideo (fig. 15). OCT-SA También existe la opción de adquirir imágenes de OCT-SA añadiendo una lente para exploración de polo anterior que se beneficia también de la disminución de ruido de la imagen que permite el eye-tracking. Dispone de un software para el análisis de polo anterior que permite explorar la estructura corneal, escleral y el ángulo, con un scan blanco a blanco que muestra los dos ángulos opuestos al mismo tiempo. En resumen, podríamos destacar de OCT Spectralis: – Elevada resolución de las imágenes. – Versatilidad del instrumento al poder combinar múltiples exploraciones en un mismo aparato. 91 – Eye-tracker. – Sistema de seguimiento con comparación muy precisa de las mismas zonas en todos la exploraciones. – El nuevo estudio NSite es muy prometedor en el campo de la Neuro-oftalmología. – El EDI puede facilitar el estudio de la lámina cribosa y la coroides. BIBLIOGRAFÍA 1. Grover S, Murthy RK, Brar VS, Chalam KV. Normative data for macular thickness by high-definition spectral-domain optical coherence tomography (spectralis). Am J Ophthalmol. 2009; 148: 266-271. 2. Kiernan DF, Mieler WF, Hariprasad SM. Spectral-domain optical coherence tomography: a comparison of modern highresolution retinal imaging systems. Am J Ophthalmol. 2010; 149: 18-31. 3. Margolis R, Spaide RF. A pilot study of enhanced depth imaging optical coherence tomography of the choroid in normal eyes. Am J Ophthalmol. 2009; 147: 811-815. 92 TOMOGRAFIA DE COHERENCIA ÓPTICA 3.7. RTVue Fourier Domain OCT. Modelo: RT 100 (Optovue) José Fernández-Vigo López, Ignacio Almorín Fernández-Vigo, Ana Macarro Merino CARACTERISTICAS DEL DISPOSITIVO La RTVue (OPTOVue) emplea el método de las OCT de dominio espectral (SD-OCT) de modo que la información de frecuencias de todas las profundidades de un punto de la retina se adquiere simultáneamente por una cámara CCD y un espectrómetro. Posteriormente, mediante una transformación de Fourier, la información de frecuencias es traducida a información de intensidades (fig. 1). Las características técnicas más destacadas del dispositivo son: Figura 1. Imagen general del dispositivo (OCT RTVue-100). • • • • • Tasa de imágenes: 256 a 4096 A-scan/imagen. Velocidad escaneo: 26.000 A-scan/seg. Resolución axial: 5 micras. Resolución transversa: 15 micras. Rango de exploración: – Profundidad: 2-2,3 mm. – Transversa: 2-12 mm. • Energía de exposición en la pupila: 750 microW. La gran velocidad de escaneo permite obtener mayor número de imágenes y disminuye los artefactos por movimiento, de manera que al promediar las imágenes en una sola («average frame») disminuye el ruido de fondo y se genera una imagen de mayor calidad. Además la mayor resolución axial mejora la delimitación de las distintas capas que conforman los tejidos. Permite realizar exploraciones tanto de polo posterior como anterior con el mismo aparato, adaptando de manera sencilla una lente al objetivo (fig. 2). Obtiene imágenes de la córnea que permiten mediciones precisas y sencillas, aunque todavía presenta limitaciones como el reducido campo de exploración por la gran magnificación de la imagen obtenida. Dispone de una amplia base de datos normativa que incluye edad, etnia y tamaño del disco. La mayor calidad y resolución de las imágenes, así como un algoritmo de segmentación mejorado permiten la medición del complejo de células ganglionares y la determinación de nuevos parámetros para el diagnóstico precoz del glaucoma. De igual manera, permite registrar con mayor precisión la posición de los vasos y el contorno de la papila en las exploraciones basales (baseline) para la orientación espacial de los sucesivos exámenes, mejorando así la fiabilidad en los análisis de progresión de enfermedad. PROTOCOLOS DE ANÁLISIS DE IMAGEN Figura 2. Lente para exploración del segmento anterior adaptada al objetivo. Los dividimos en dos grandes grupos: cuantitativos (proporcionan información medible y comparable de progresión de forma automática) y cualitativos (proporcionan información que puede ser medible de forma manual pero no comparable para análisis de progresión) (tabla 1). 3. DISPOSITIVOS COMERCIALES. PROTOCOLOS DE ESCANEADO Y ANÁLISIS DE RESULTADOS TABLA 1. MODALIDADES DE ANÁLISIS CON RTVU OCT A. Segmento anterior: a) Córnea: – Cuantitativos: – Cualitativos: * Paquimétrico * Cornea 3D, Line, Cross Line y Raster b) Ángulo: Cualitativo c) Cámara anterior: Cualitativo B. Segmento posterior: a) Retina: – Cuantitativos: – Cualitativos: – Baseline: b) Glaucoma: – Cuantitativos: – Baseline: * EMM5 y MM6 * Macula 3D, Grid, Raster, Line y Cross Line * Reference 3D * RNFL, ONH y GCC * 3D disk Recientemente se ha desarrollado una versión simplificada, el OCT iVue, con características similares respecto al equipo completo, manteniendo tanto velocidad de adquisición A-scan, como la resolución, pero que carece de algunas opciones, así en el módulo de retina no dispone de 3D Macula, en el módulo de glaucoma no dispone del análisis de papila ni del GCC y en el de segmento anterior no dispone de los estudios 3D Cornea ni «Cornea Cross line» de alta resolución. 93 Análisis del segmento anterior (RTVue OCT) Requiere la colocación de una lente diseñada para realizar un escáner telecéntrico en el que el haz de la OCT permanece siempre paralelo al eje central corneal (fig. 2). Hay disponibles 2 tipos, una de gran angular CAM-L para exploraciones rutinarias (proporciona un escaneado de hasta 8 mm de ancho y resolución axial de 15 micras) y otra de gran aumento CAM-S para cortes transversales de estructuras pequeñas (hasta 4 mm de ancho y resolución de 10 micras). Las exploraciones disponibles ofrecen gran libertad de movimiento por toda la superficie ocular, pudiéndose explorar la córnea, el limbo, la conjuntiva, el menisco lagrimal... así como la cámara anterior y sus estructuras (iris, cápsula anterior del cristalino, lentes fáquicas…). Una vez adquiridas las imágenes, se pueden realizar mediciones lineales, angulares y por áreas sobre ellas. Nos da básicamente un análisis cualitativo de la córnea. Córnea El estudio cuantitativo de la córnea se realiza mediante la exploración «Pachymetry» (fig. 3). Está compuesta por 8 scans meridionales repetidos 5 veces, de los que se promedian los tres más consistentes. Un algoritmo automático detecta los límites corneales anterior y posterior (también se puede realizar manualmente) y determina el perfil del grosor corneal. La repetibilidad de la prueba es excelente gracias al promedio de las mediciones y la alta resolución de la RTVue. El informe generado nos da: 1) Mapa de grosor corneal de 6 mm de diámetro, dividido por sectores y en escala de colores. El círculo de los 2 mm centrales no refleja el grosor de un solo punto sino el grosor medio de todos los puntos explorados en ese círculo. De ahí la alta repetibilidad antes mencionada. La fiabilidad del mapeado es mejor en la región central (5 mm centrales) y empeora periféricamente a medida que disminuye la reflectividad corneal. 2) Adelgazamiento focal excéntrico. Incluye los parámetros estadísticos de diagnóstico de queratocono de la RTVue. Otro aspecto a destacar es la posibilidad de medir el grosor del colgajo corneal en cirugía LASIK y su seguimiento en el postoperatorio. Ángulo Figura 3. Comparación de dos exámenes paquimétricos. En el mapa inferior se muestra la diferencia entre ambos exámenes. Se puede estudiar mediante el escáner prefijado «Angle». Se visualizan la línea de Schwalbe, la malla 94 TOMOGRAFIA DE COHERENCIA ÓPTICA 2) TISA 500: (Trabecular iris space area): área entre el iris y la malla trabecular con base de 500 micras. Además se puede emplear, por ejemplo, para analizar la posición de los hápticos de las lentes de apoyo angular. Cámara anterior Figura 4. Imagen del ángulo con su medición en grados. Ángulo estrecho con medida manual. El dispositivo permite explorar la cámara anterior aunque no medir su profundidad por la magnificación de la imagen. La medición es especialmente exacta en distintas circunstancias, por ejemplo, en la valoración del «vault» de las lentes precristalinianas y la distancia de las lentes de cámara anterior al iris (fig. 5). Análisis del segmento posterior Retina Figura 5. Imagen de la cámara anterior y posterior en relación con la ubicación de una lente fáquica (ICL). Medida del «vault». trabecular y el canal de Schlemm, pero no el espolón escleral y la raíz del iris, debido a la pérdida de señal que sufre el haz de luz de la OCT en el limbo. De esta manera podremos medir de manera manual dos parámetros para valoración del ángulo con RTVue: 1) AOD-SL (Angle opening distance-Schwalbe line): distancia desde la línea de Schwalbe al iris (fig. 4). Figura 6. Presentación «Grid». El corte que visualizamos representado en imagen grande y su localización en retina en relación a otros cortes. Edema macular cistoide. Para realizar valoraciones cualitativas y mediciones simples manuales disponemos de varios protocolos de exploración similares a los de otras OCT (líneas, rejillas, líneas radiales…) (figs. 6 y 7). Las imágenes de alta resolución de hasta 12 mm de longitud, nos facilitan la valoración de visu de la morfología, localización y afectación de capas retinianas de lesiones concretas. Para valoraciones cuantitativas y mediciones automáticas, disponemos de protocolos prefijados de exploración. En ellos, la RTVue 100 segmenta la retina en 3 localizaciones: MLI, capa plexiforme interna y unión IS/OS. Se puede calcular el grosor retiniano total, de la retina interna (MLI-IPL) y de la retina externa (IPL-IS/OS). También permite realizar un análisis volumétrico, donde se pueden mapear diferentes grosores retinianos y ser usados para cuantificar el volumen de dife- Figura 7. Presentación «Raster». El corte visualizado y su localización en retina. 3. DISPOSITIVOS COMERCIALES. PROTOCOLOS DE ESCANEADO Y ANÁLISIS DE RESULTADOS rentes lesiones como drusas o fluido subretiniano. En los desprendimientos de EPR, se estima la localización «normal» del EPR y se analiza cuantitativa y cualitativamente el nivel de elevación del EPR (mapas de elevación del EPR). Los diferentes protocolos de exploración retiniana son: a) EMM5 Es el mapeado principal retiniano en forma de rejilla. Se consigue mediante la superposición de 2 rejillas: una de 6 x 6 mm (13 b-scans horizontales y verticales de 807 a-scans cada uno) y otra superpuesta en el centro de 4 x 4 mm (8 b-scans horizontales y verticales de 512 a-scans cada uno) de manera que en la parte externa los espacios entre scan son de 0,5 mm y en la interna, de 0,25 mm. Se crea en 0,78 seg. En el informe generado se muestran la imagen macular SLO sobre la que se pueden superponer el mapeado 2D macular o el mapa del ETDRS y los bscans horizontales y verticales. Los mapas de presentación que ofrece son de grosores (total, retina interna o retina externa), de elevación (altura de EPR o MLI en relación a un plano de referencia) y de significación (desviación con respecto a la normalidad en relación a la base de datos normativa) y se acompaña de los valores numéricos en la tabla de valores maculares. Una función interesante es la de contorno de volumen y medidas, con la que podemos definir un nivel de umbral (en micras) para que, al sobrepasarse, se trace automáticamente un contorno de esa localización engrosada. Debajo se muestra el volumen que excede del umbral, que nos sirve además para evaluar de manera numérica la evolución de lesiones que ocupen espacio retiniano. 95 gundos para realizar una reconstrucción retiniana en 3 dimensiones. Útil para ciertas patologías traccionales de la retina de cara a la planificación quirúrgica o de manera didáctica para el paciente. d) Referencia 3D Consiste en un barrido de 7 x 7 mm centrado en fóvea (141 b-scans de 385 a-scan cada uno en 2,4 seg). Sirve como referencia para posteriores exploraciones con el mapa macular EMM5, por lo que debería de realizarse en la primera visita. Ofrece imágenes SLO de la mácula, así como mapas del grosor retiniano por cuadrantes y elevación del EPR mostrados en mapa de color. Se pueden delimitar las capas de la retina (de manera manual o automática) para comparaciones futuras. Glaucoma Para el análisis de glaucoma, la RTVue 100 ofrece exploraciones cuantitativas de la capa de fibras nerviosas (CFNR), nervio óptico y el complejo de células ganglionares (GCC). a) RNFL 3.5 Es el clásico barrido circular de la CFNR a 3,45 mm de la papila (4 b-scans circulares de 1024 ascans cada uno adquiridos en 0,15 segundos que se promedian). Genera un informe con la imagen infrarroja de papila y el b-scan circular donde podremos ver la segmentación de la CFNR. Se acompaña de una tabla de grosores por localización y su correspondencia en un gráfico circular y el histograma TSNIT según la base de datos normativa. b) MM6 b) ONH En este caso, a diferencia del anterior, el mapeado de la mácula es radial (12 b-scans de 1024 a-scans cada uno, en 0,27 seg). Genera el mismo informe que EMM5, excepto que no da los mapas de significación, ya que no se dispone de base de datos normativa para esta exploración. c) Mácula 3D Mediante un mapeo de tamaño ajustable, se toman 101 b-scans de 512 a-scans cada uno en 2,2 se- Es el mapeado de la cabeza del nervio óptico junto al de capa de fibras nerviosas (incluye el escaneado circular a 3,45 mm). El mapeado del nervio óptico es radial (12 b-scans radiales de 452 a-scans cada uno y 3,4 mm de longitud), mientras que el de la CFNR es circular (13 b-scans anulares concéntricos de 425 hasta 965 a-scans, separados 0,3 mm que van desde 1,3 hasta 4,9 mm del centro del nervio óptico). Todo esto se adquiere en tan solo 0,39 seg. Así, en el informe podremos ver la imagen basal, a elegir entre SLO (a la que podemos superponer el 96 mapa de RNFL-2D) o la infrarroja (IR) y los b-scans radiales y circulares. Se acompaña de una tabla de análisis estereométrico (áreas, volúmenes y relaciones del nervio óptico y grosores de capa de fibras nerviosas), del histograma TSNIT del grosor de la CFNR a 3,45 mm y el mapa de grosor de CFNR. Es importante señalar que existen 4 modos de trazar la línea de base del borde del disco, y que su elección modificará los resultados del análisis del ONH. Por defecto se señala la opción 3D, que corresponde a elegir como límites del disco los obtenidos de la exploración de referencia para el disco óptico (3D disk). Las otras dos (video y OCT) sólo se recomiendan si no hay exploración de referencia o bien para investigadores. Si no se seleccionase ninguna línea de referencia de límites del disco, no se podrán realizar análisis de seguimiento. La principal ventaja de esta exploración es que no depende del centrado por el explorador como en otras OCT ya que al hacer el mapeo del nervio óptico, se calcula su centro y se realizan los cálculos a partir de él. Por ello, el descentrado no afecta a la medida de las capas. c) GCC (Ganglionar Complex Cell) Numerosos estudios han sugerido que la determinación del porcentaje de pérdida de células ganglionares en la mácula puede ser útil en la detección precoz de glaucoma. Sin embargo, los algoritmos de segmentación de esta capa sólo estaban disponibles de manera experimental. La RTVue ha sido la primera OCT comercial que ha proporcionado un algoritmo de segmentación para esta capa. Posteriormente otros dispositivos comerciales también lo han incluido. La exploración consiste en un mapeado de 7 mm centrado 1 mm temporal a la fóvea (15 b-scans verticales de 400 a-scans cada uno y uno horizontal foveal de 467 a-scans, adquirido en 0,58 seg). En este scan se delimita automáticamente el complejo de células ganglionares (GCC) entre la CFNR y la capa plexiforme interna (IPL). En el informe podremos visualizar, además de los mapas de grosores (retina total, GCC o retina externa), los mapas de significación o desviación del grosor de la GCC. En éstos se puede evaluar tanto la desviación como la significación de ésta respecto a la base de datos normativa de grosores de GCC. Se ofrecen también datos del grosor medio de la GCC y dos nuevos parámetros cuantitativos de evaluación del grosor de esta capa: TOMOGRAFIA DE COHERENCIA ÓPTICA – FLV (pérdida de volumen focal): Es la suma total de la pérdida de GCC (en volumen) dividida por el área. Indica el porcentaje de tejido perdido por unidad de volumen. Algunos autores han encontrado que el FLV es el parámetro de la GCC más preciso para distinguir un ojo normal de uno con glaucoma (3). – GLV (pérdida de volumen global): Nos indica el porcentaje de la pérdida de grosor GCC. d) Disco 3D Consiste en un barrido de 4 x 4 mm centrado en nervio óptico (101 b-scans de 513 a-scans cada uno en 2,2 seg). Sirve como referencia para exploraciones posteriores con el estudio ONH. También se pueden delimitar los bordes del nervio óptico (manual o automático) sobre los que se compararán las futuras exploraciones para valorar la progresión. Análisis de progresión Para realizar los análisis de progresión, una de las novedades de esta OCT, es la posibilidad de generar los escaneados de referencia previamente mencionados, constituidos por barridos de mácula (Reference 3D) o nervio óptico (3D Disk) de gran densidad de bscans y una imagen de la superficie retiniana SLO que registran la posición de los vasos y la papila. Sobre ella se orientarán las exploraciones futuras para el análisis de progresión de enfermedad (fig. 14). Se pueden realizar los análisis de: 1) Comparación (cualitativa): Permite visualizar las dos exploraciones a evaluar. 2) Simetría (cuantitativa): compara de una misma exploración las medidas de grosor de OD vs OI, pero sólo expone los valores de cada exploración, no la diferencia entre ellos. 3) Cambio o progresión (cuantitativa): muestra las diferencias de grosor entre dos o más exploraciones sucesivas, acompañadas de mapas de grosores absolutos y de significación. FORMATOS DE IMPRESION En las figuras exponemos los informes que consideramos más representativos e ilustrativos de las exploraciones. Incluimos imágenes de exploraciones cualitativas. a) Segmento anterior: 1. Paquimétrico: permite la opción de análisis de progresión (fig. 3). 3. DISPOSITIVOS COMERCIALES. PROTOCOLOS DE ESCANEADO Y ANÁLISIS DE RESULTADOS 97 2. Ángulo: permite la medición de los parámetros AOD-SL y TISA 500 (fig. 4). 3. Cámara anterior (fig. 5). b) Segmento posterior: 1. Grid: solo permite el mapa de comparación (fig. 6). 2. Raster: solo permite el mapa de comparación (fig. 7). 3. MM5: permite los análisis de comparación, simetría y progresión (figs. 8 y 9). 4. MM6: Permite los análisis de comparación, simetría y progresión (figs. 10 y 11). 5. RNFL: permite cambio y simetría (figs. 12 y 14). 6. ONH: permite comparación, cambio y simetría. Además nos reúne un solo mapa el OD Y OI junto al examen de GCC (figs. 13 y 14). 7. GCC: permite comparación, cambio y simetría (fig. 13). Figura 8. Mapa MM5 en progresión. Representa tres exámenes y los compara con el de referencia. Figura 10. Mapa MM6 en progresión. Comparación de dos exámenes y mapa de diferencia en retina completa (abajo). Figura 9. Mapa MM5 en simetría. Comparación OD y OI y mapa de diferencia. Figura 11. Mapa MM6 en simetría. Comparación OD y OI y mapa de diferencia en retina completa (abajo). 98 Figura 12. Presentación RNFL. Progresión en dos exámenes distintos. Representación grafica y numérica. Se observan áreas rojas anormales en diferentes sectores de ambos ojos. TOMOGRAFIA DE COHERENCIA ÓPTICA Figura 13. Mapa unificado ONH y GCC de ambos ojos. Nos muestra en un solo mapa todos los datos de ambos exámenes y de ambos ojos con gráfico comparativo (abajo). El OD muestra un defecto localizado superior a mácula, con adelgazamiento de la CFNR superior e índice FLV alterado, mientras que el OI es completamente normal. Figura 14. Evaluación de progresión, que muestra el cambio en 4 exploraciones sucesivas tanto de parámetros de papila como de CFNR (Cortesía A Martín Justicia). 3. DISPOSITIVOS COMERCIALES. PROTOCOLOS DE ESCANEADO Y ANÁLISIS DE RESULTADOS PARÁMETROS DE FIABILIDAD La fiabilidad de los datos de la OCT depende básicamente de una correcta segmentación de las capas. Para ello debemos fijarnos en una serie de características: 1. SSI (signal strength intensity): Indica la intensidad de la señal y debe ser mayor de 30 (la pantalla presenta además una barra de calidad de la imagen con código de colores). 2. Centrado de la exploración: En las imágenes de fondo infrarrojas o SLO debemos observar que la zona a estudiar está incluida completamente y lo más centrada posible. Como ya hemos comentado previamente, el cálculo automático del centro de la papila en la RTVue prácticamente elimina el sesgo del centrado por el explorador. 3. Continuidad de la imagen: Debemos observar un b-scan continuo sin áreas oscuras (pérdida de información), ya que favorecen fallos en la segmentación: 1) Ausencia de parpadeos: Dado el bajo tiempo necesario para la adquisición, casi no hay artefactos de este tipo. 99 2) Segmentación de capas: Previo a la obtención de resultados debemos revisar que las capas se han delimitado de manera correcta en todos los b-scans obtenidos. BIBLIOGRAFÍA 1. Gabriele ML, Wollstein G, Ishikawa H, Xu J, Kim J, Kagemann L, Folio LS, Schuman JS. Three dimensional optical coherence tomography imaging: advantages and advances. Prog Retin Eye Res 2010; 29: 556-579. 2. Garas A Vargha P Holló G. Reproducibility of retinal nerve fiber layer and macular thickness measurement with the RTVue-100 optical coherence tomograph. Ophthalmology 2010; 117: 738-46. 3. Nam SM, Im CY, Lee HK, Kim EK. Accuracy of RTVue optical coherence tomography, Pentacam, and ultrasonic pachymetry for the measurement of central corneal thickness. Ophthalmology 2010; 117: 2096-2103. 4. Tan O, Chopra V, Tzu-Hui Lu A, Schuman J S, Ishikawa H, Wollstein G, Varma R, Huang D. Detection of Macular Ganglion Cell Loss in Glaucoma by Fourier-Domain Optical Coherence Tomography. Ophthalmology 2009; 116: 2305-2314. 100 TOMOGRAFIA DE COHERENCIA ÓPTICA 3.8. 3D OCT (Topcon) Esperanza Gutiérrez, Enrique Mencía CARACTERÍSTICAS DISTINTIVAS DEL DISPOSITIVO El tomógrafo de coherencia óptica (OCT) de Topcon Corporation 3D OCT-1000 de dominio espectral está combinado con una cámara no midriática de 3,1 megapixels (12,3 megapixels en el modelo 3D OCT-2000), que permite el registro de una retinografía de 45° (fig. 1). Utiliza un láser de diodo superluminescente con una longitud de onda de 850 µm y un ancho de banda de 50 nm como fuente de luz. lación de puntos (pin-point registration). Conectable y compatible con software IMAGEnet. Los nuevos modelos (2000) tiene una pantalla táctil e incorporan un nuevo algoritmo reductor de ruido y la tecnología IR/3D Trucking. Los datos se manejan a través de un PC externo. Parámetros de Fiabilidad: La intensidad de señal está graduada en una escala de 0 a 100. Para que una toma sea fiable se aconseja una señal por encima de 60. PROTOCOLOS DE ESCANEO Figura 1. Tomógrafo de coherencia óptica Topcon 3D OCT-100. CARACTERÍSTICAS TÉCNICAS GENERALES – Velocidad de escaneo: • 18.000 A-scans/seg (modelo 3D-OCT 1000). • 27.000 A-scan/seg (3D OCT-2000). • 50.000 A-scans/seg (3D-OCT FA Plus). – Resolución axial: 5 µm. – Resolución transversal: 20 µm. – Profundidad de foco: 2,3 mm (permitiría estudio de coroides). – Eye-tracker. – Captura panorámica: • Longitud del B-scan: la longitud de captura de la tomografía es variable de 3-12 mm en función de las necesidades del usuario. – Opciones añadidas: Angiofluoresceingrafía con cámara intercambiable, autofluorescencia con filtros SPAIDE, verde indocianina. Estas imágenes se importan sencillamente para realizar la corre- El protocolo en 3D está compuesto por múltiples exploraciones axiales (vertical x horizontal 256 µm x 256 µm) que cubren un área de 6 mm2. Incorpora un algoritmo de corrección para neutralizar los artefactos por movimientos oculares. El software incluye tres grupos de funciones: Captura, Análisis y Gestión de datos. En el modo de captura se muestran 2 ventanas con la imagen del OCT en vivo y la del retinógrafo infrarrojo. En la parte inferior izquierda aparecen las imágenes obtenidas, que pueden ser archivadas o no y en la derecha los parámetros de escaneo: fijación (mácula, papila, central), patrón (lineal, radial, circular, cruzado o 3D), tamaño (3-12 mm), profundidad (1,68 a 2,3 mm), y resolución (fig. 2). Figura 2. Pantalla de captura, en la ventana superior izquierda aparece la OCT en vivo, en la superior derecha la imagen del retinógrafo infrarrojo. En la zona inferior izquierda se muestran las miniaturas de la imágenes ya realizadas, y en la derecha los parámetros de captura. 3. DISPOSITIVOS COMERCIALES. PROTOCOLOS DE ESCANEADO Y ANÁLISIS DE RESULTADOS Figura 3. En el monitor del retinógrafo existe un símbolo en forma de paréntesis que indica el tamaño mínimo de pupila. 101 Figura 4. Rejilla de selección de pruebas, en el modo de miniaturas. Si se selecciona una prueba, en la ventana de la derecha aparecerán las características de la misma. El retinógrafo dispone de una panel de mandos que permite seleccionar la intensidad de la iluminación y del flash, la posición de la mentonera y el tipo de fijación (interna, con 5 opciones, o externa) y su posición. También dispone de un compensador dióptrico para ojos con alta miopía (–12 a –33 D) o hipermetropía (+9 D a +40 D). El ángulo estándar de la retinografía son 45°, pero existe un zoom digital de x2 y x4 aumentos. Todos estos parámetros se visualizan en el monitor del retinógrafo y en la ventana de captura. El tamaño mínimo de pupila son 4 mm, indicado por el paréntesis existente en el monitor (fig. 3). PROTOCOLOS DE ANÁLISIS DE LAS IMÁGENES (ANÁLISIS CUALITATIVO Y ANÁLISIS CUANTITATIVO) Análisis cualitativo Figura 5. Análisis en 2D, en la ventana superior izquierda se muestra la OCT en 2D, en la que la línea vertical indica el punto seleccionado en la retinografía, situada en la ventana superior derecha. En la ventana inferior derecha aparece el gráfico de reflectividad de ese punto. Puede hacerse directamente tras la captura o a partir de imágenes archivadas. Hay 3 modos de consulta del archivo, por rejilla de pacientes, por miniatura (Thumbnail) (fig. 4) o por fecha. En la zona derecha se muestra una miniatura con imagen y los parámetros de captura y calidad. Una vez cargada la imagen, se entra en el sistema de análisis, en el que se muestran 4 ventanas. a) Ventana de OCT principal, que puede mostrar la imagen en 2D o 3D, y en código de colores o en blanco y negro. En la imagen en 2D, con el ratón podemos movernos a lo largo de la zona escaneada y ver el B-scan correspondiente a la línea indicada en la retinografía (fig. 5). En la imagen en 3D se recrea la zona explorada en 3 dimensiones, y podemos girar la imagen en cualquier dirección (fig. 6). Figura 6. Análisis macular en 3D, en la ventana superior izquierda aparece la OCT en 3D, y en la superior derecha la retinografía con la proyección realizada a partir de los cortes de la OCT superpuesta. En la ventana inferior derecha se ve el Bscan correspondiente al corte señalado en la retinografía. 102 TOMOGRAFIA DE COHERENCIA ÓPTICA Figura 7. Análisis de la retinografía. Se pueden medir áreas, líneas y el cociente excavación papila. b) Ventana de la retinografía. El área rastreada se marca con un cuadrado. Puede superponerse una proyección creada a partir de los datos de la tomografía que se muestra en blanco y negro, y que utiliza los rasgos distintivos del fondo de ojo como los vasos para asegurar una correspondencia punto a punto de las imágenes de la tomografía y la retinografía. Si la correspondencia no es correcta, puede corregirse manualmente desde el submenú «Reposition» dentro de «Overlay». Una vez establecida la correspondencia, con el ratón pueden señalarse puntos en la retinografía, y ver el punto correspondiente en la tomografía (fig. 5). La correspondencia también se puede crear con imágenes de referencia importadas desde otras bases de datos (retinografías, angiografías). Para el análisis de la imagen disponemos de herramientas de medidas (lineal, área y papila/excavación) y de controles independientes para el rojo, verde y azul (fig. 7). c) Ventana auxiliar de OCT, cuando la ventana principal muestra la imagen en 2D, esta muestra el perfil de reflectividad de la señal A-scan correspondiente al B-scan de la ventana principal (fig. 5). Cuando la ventana principal muestra la imagen en 3D, la auxiliar puede mostrar el corte en 2D (B-scan) (fig. 6) o un mapa de superficie (fig. 8). Cuadro de control de la tomografía, en el que podemos seleccionar el tamaño de imagen (fig. 9) y la Figura 8. Análisis 3D. En la ventana superior derecha aparece la rejilla de grosor macular del ETDRS, y en la inferior el mapa de grosor correspondiente. Figura 9. El tamaño de la imagen de la OCT puede ajustarse con una relación 1:1 (arriba a la izquierda), 1:2 (arriba a la derecha), 1:4 (abajo a la izquierda) y 1:8 (abajo a la derecha) respecto a la imagen real. escala de color o reflectividad (por defecto, los umbrales seleccionados son el 25%, para eliminar el ruido de fondo, y el 75%, pero estos valores pueden modificarse para destacar pequeños detalles) (fig. 10). El botón «Align» corrige los artefactos debidos a los movimientos del ojo en el eje Z, y alinea la imagen de proyección creada desde los datos de las tomografías con la retinografía en color. Figura 10. La imagen de la OCT puede verse en código de colores (arriba a la izquierda) o blanco y negro (abajo a la izquierda). Con la escala de color se puede modificar este, tanto en color (arriba a la derecha) como en blanco y negro (abajo a la derecha). 3. DISPOSITIVOS COMERCIALES. PROTOCOLOS DE ESCANEADO Y ANÁLISIS DE RESULTADOS 103 Figura 12. Comparación entre dos OCT circulares para estudio de capa de fibras. Se muestran la OCT y la retinografía de cada examen y sobre esta última se ha superpuesto la rejilla de grosor de capa de fibras. Figura 11. Superior: Escaneo 3D. Con el menú Circle se puede colocar sobre la retinografía la rejilla correspondiente a la capa de fibras. Inferior: Si el circulo no está bien centrado, se puede centrar mediante el menú «Reposition». A la izquierda la imagen original, y a la derecha el círculo bien centrado. de retina disponemos de la opción avanzada en la que se añaden otras dos ventanas con la comparación en forma de mapa de grosor y gráfico con las dos líneas correspondientes al B-scan (fig. 13). Análisis cuantitativo En la imagen en 2D se pueden delimitar y medir la retina y la capa de fibras nerviosas, las distintas capas se separan mediante líneas blancas, y la posición de las misma puede modificarse manualmente. En la ventana en 3D se pueden delimitar las superficies y medir el volumen. Igualmente, se pueden separar y eliminar las distintas capas. Sobre la retinografía en color aparecen varios submenus, en «Overlay» podemos superponer la imagen de proyección de la tomografía (fig. 6) o rejillas con los valores de grosor retiniano. En el submenú Grid disponemos de varios tipos de rejillas: cuadrícula, esquema del ETDRS (Early Treatment Diabetic Retinopathy Study), y capa de fibras nerviosas (fig. 11). Todas ellas se pueden desplazar con la opción «Reposition» para situarlas sobre el área deseada (fig. 11). En el submenú «Circle» se muestra el grosor de la capa de fibras nerviosas en un círculo alrededor de la papila. Figura 13. Comparación macular avanzada, además de la OCT y retinografía de cada examen, a la derecha aparece el mapa y el gráfico comparativo del grosor retiniano. Reproducibilidad La reproducibilidad del Topcon 3D es alta. Leung et al encuentran un coeficiente de variabilidad inferior al 1% en todos las medidas maculares, excepto el espesor foveal (2,42%), siendo el del grosor macular total de 0,86%. Ho et al también encuentran una excelente reproducibilidad (coeficiente intraclase de 0,96 para la fóvea). REPRESENTACIÓN GRÁFICA MACULAR Comparación entre dos exámenes Una vez cargados ambos exámenes, en el modo básico se muestran dos ventanas de cada examen con las tomografías y retinografías seleccionadas dispuestas horizontalmente (fig. 12), pero en el análisis Segmentación: Aunque todos los aparatos definen el límite interno de la retina en la membrana limitante interna, el límite externo puede variar según el dispositivo: en el Topcon 3D está fijado en el extremo de los segmentos externos de los fo- 104 TOMOGRAFIA DE COHERENCIA ÓPTICA TABLA 1. GROSOR MACULAR EN SUJETOS NORMALES Numero sujetos Central Parafoveal Perifoveal Leung1 Giani3 Sull4 Mylonas5 35 31 40 10 Media ± DE Media ± DE Media ± DE Media ± DE 216 ± 18,0 229 ± 24 231 ± 10 261,82 ± 84,63 Nasal 294,2 ± 16,5 307,00 ± 83,06 296 ± 12 Temporal 277,1 ± 12,0 284,82 ± 59,61 280 ± 10 Superior 297,2 ± 14,4 275,11 ± 74,69 293 ± 12 Inferior 288,4 ± 13,7 305,21 ± 93,68 288 ± 12 Nasal 278,4 ± 15,3 266 ± 13 Temporal 244,3 ± 13,3 234 ± 16 Superior 258,4 ± 14,9 249 ± 13 Inferior 247,3 ± 12,2 240 ± 12 DE: desviación estándar. torreceptores, mientras que en el Cirrus y el RTVue100 está fijado en el epitelio pigmentario y en el Stratus en el limite entre los segmentos interno y externo de los fotorreceptores. Esto determina que las medidas varíen según el dispositivo. En la tabla 1 se describen los valores de grosor macular en sujetos normales, aunque las muestras de estos estudios son pequeñas. El mapa de grosor macular más usado es el correspondiente a la rejilla del ETDRS, y está compuesto por tres círculos concéntricos de 1, 3 y 6 mm de diámetro. El área 1 representa la fóvea, las áreas 2, 3, 4, y 5 forman el anillo interno y las áreas 6, 7, 8, y 9 forman el anillo externo. Figura 14. Informe de retina, incluye la imagen de OCT, la retinografía, el gráfico de espesor macular según la rejilla del ETDRS con los valores correspondientes a cada zona y un mapa de espesor en código de colores. En el informe de retina (fig. 14), se incluyen la imagen de la tomografía en 3D, la retinografía, y el mapa de grosor. Además, se pueden exportar e imprimir todas las imágenes de las ventanas, la pantalla completa, y crear animaciones de las imágenes en 3D. MÓDULO DE GLAUCOMA Las características principales del módulo de glaucoma son: • Patrón circular con sistema automático de centrado EYE TRACKER. • Análisis capa de fibras con patrón 3D con mapas ETDRS, Rejilla, y tipo GDX. • Base de Datos normativa, con representación de valores en escala cromática de normalidad clásica (fig. 15). • Análisis de Papila automático realizado sobre el B-scan y/o sobre la retinografía color a elección del usuario. • Sistema repetitividad de capturas en diferentes fechas automática. • Software para evolución de glaucoma GPS (Glaucoma Progression Software). En el informe se incluye la retinografía, la imagen OCT y los diagramas clásicos TSNIT, por cuadrantes y sectores horarios con la escala cromática habitual. En el modelo 1000, este formato solo está disponible para el rastreo circular. Si se ha realizado un rastreo en 3D, podemos estudiar el grosor de la CFNR mediante el submenú Circle, y puede corregirse el centrado, pero esta información no se puede trasladar al formato impreso. 3. DISPOSITIVOS COMERCIALES. PROTOCOLOS DE ESCANEADO Y ANÁLISIS DE RESULTADOS 105 Figura 15. Informe de capa de fibras, incluye la imagen de OCT, la retinografía, el gráfico de espesor con las zonas de normalidad y patológicas marcadas en color verde y rojo respectivamente, y a la derecha dos graficas circulares de 4 y 12 sectores con los valores de espesor de cada sector y el código de color correspondiente. Imagen derecha: Reconstrucción 3D de papila (cortesía Dr. A. Martín Justicia). OCT-SA 2. Al igual que en la mayoría de los SD-OCT, el dispositivo también permite realizar estudio de segmento anterior (OCT-SA), con las evaluaciones clásicas de paquimetría corneal y mapa de espesores, mapas de curvatura corneal, estructura corneal, mediciones de flaps, medición de Vault de lentes ICL y evaluación del ángulo camerular. BIBLIOGRAFÍA 1. Giani A, Cigada M, Choudhry N, et al: Reproducibility of retinal thickness measurements on normal and pathologic 3. 4. 5. eyes by different optical coherence tomography instruments. Am J Ophthalmol 2010; 150: 815-824. Ho J, Sull AC, Vuong LN, et al. Assessment of artifacts and reproducibility across spectral- and time-domain optical coherence tomography devices. Ophthalmology 2009; 116: 1960-70. Leung CK, Cheung CY, Weinreb RN, et al. Comparison of macular thickness measurements between time domain and spectral domain optical coherence tomography. Invest Ophthalmol Vis Sci 2008; 49: 4893-7. Mylonas G, Ahlers C, Malamos P, et al. Comparison of retinal thickness measurements and segmentation performance of four different spectral and time domain OCT devices in neovascular agerelated macular degeneration. Br J Ophthalmol 2009; 93: 1453-60. Sull AC, Vuong LN, Price LL, et al. Comparison of spectral/Fourier domain optical coherence tomography instruments for assessment of normal macular thickness. Retina 2010; 30: 235-245. 106 TOMOGRAFIA DE COHERENCIA ÓPTICA 3.9. Otros modelos de SD-OCT Francisco J. Muñoz Negrete, Alfonso Almendral, Diego Ruiz Casas, Diego Losada, Gema Rebolleda, Agustín Martín Justicia, Manuel Cintrano Gurrea, Sara Ceballos Del resto de aparatos comercializados o en vías de comercialización nos vamos a centrar en los siguientes: – Canon-Copernicus. – Retinascan RS-3000 (Nidek). – Spectral OCT/SLO (Opko/Oti Opko). – Bioptigen SD-OCT. CANON COPERNICUS Análisis – Módulo de Retina: Proporciona datos sobre el espesor y volumen de la retina, espesor y volumen de la CFNR, deformación del EPR, espesor segmento interno y externo de fotorreceptores. Incluye además un sistema de reconocimiento de vasos sanguíneos. Un aspecto único de su software es un programa para analizar quistes intraretinianos, que permite medir y monitorizar el volumen de los quistes (fig. 2). El SOCT Copernicus fue desarrollado inicialmente por Optopol (Zawiercie, Polonia) y ahora es distribuido por Canon y AJL. Existen dos modelos con características muy similares. El modelo SOCT Copernicus tiene una velocidad de escaneo menor (27.000 A-scan/seg) y una resolución axial de 5 µm. El modelo superior SOCT Copernicus HR, según los datos facilitados por la casa Optopol es el dispositivo SD-OCT de mayor velocidad de escaneo y mejor resolución axial (fig. 1). Figura 2. Análisis de quistes intrarretinianos con SOCT Copernicus (imagen cedida por AJL). Figura 1. SOCT Copernicus HR. A la derecha imagen 3D de alta resolución obtenida con este instrumento (Cortesía Optopol). Características Generales (SOCT Copernicus HR) – – – – – – – Velocidad de escaneo: 52.000 A-scan/seg. Resolución axial: 3 µm. Resolución transversa: 12-18 µm. Resolución A-scan: 1024 puntos. Resolución B-scan: 20000 A-scans. Anchura máxima B-scan: 10 mm. Densidad escaneo: 1050 A-scan/mm. – Módulo de Glaucoma: Incluye las evaluaciones habituales de la CFNR y de papila, con base de datos normativa y programas para evaluación de progresión. Como novedad incluye el estudio DDLS (Disk Damage Likelihood Scale) o escala de probabilidad de daño de papila. Se trata de una medida del anillo neurorretiniano que elimina los artefactos del tamaño de la papila y de la excavación y podría dar datos más fiables del daño glaucomatoso. – Módulo de Segmento anterior: Permite imágenes de córnea y Cámara anterior con una resolución de 3 µm. Su software permite obtener: • Mapa paquimétrico. • Medida del espesor del epitelio. • Espesor del colgajo de LASIK. • Medidas del ángulo de la cámara anterior. • Cristalino anterior. • PIO corregida. Como características diferenciales reseñadas por Sakata, pero que no figuran en la ficha técnica 3. DISPOSITIVOS COMERCIALES. PROTOCOLOS DE ESCANEADO Y ANÁLISIS DE RESULTADOS 107 mentario/ Membrana de Bruch (EPR/BM). La segmentación en 6 capas permite la confirmación visual de cambios morfológicos en cada una de las 6 capas. Análisis de Glaucoma Figura 3. Estudio doppler-OCT (imagen cedida por AJL). incorpora un sistema doppler para el estudio del flujo sanguíneo de los vasos retinianos (doppler-OCT) (fig. 3) y detección de defecto pupilar aferente relativo, aunque no hay literatura al respecto que refrende esto último. Para el análisis del nervio óptico tiene diversos protocolos de escaneado: círculo del disco óptico, mapa del disco y escaneo radial del disco óptico o de la mácula. Al igual que RTVue permite el estudio del complejo de células ganglionares, proporcionando un mapa de espesor y de desviación respecto a una base de datos normativa. Proporciona también una imagen SLO simultánea. El estudio de la CFNR es similar al de otros aparatos, también proporciona un mapa de desviación de la CFNR similar a la imagen de Cirrus, pero en lugar de pixels utiliza el código cromático habitual (verde normal en lugar de gris, amarillo y rojo) (fig. 4). RETINASCAN RS-3000 (NIDEK) Este dispositivo es comercializado en España por INDO. Proporciona un SD-OCT junto con un sistema de oftalmoscopio laser confocal (SLO). Tiene una velocidad de escaneo de 53000 A-scans/seg y una resolución axial de 4 µm y transversa de 20 µm. El SLO permite obtener imágenes de gran contraste de la retina en tiempo real y con un campo de 40° x 30°. Esto facilita la realización de la OCT en el objetivo exacto que pretendemos analizar. Además la opción auto-traking permite superponer los exámenes de OCT en la zona retiniana que fue analizada en exámenes previos, facilitando el seguimiento del paciente. Según las especificaciones técnicas suministrados por el fabricante, el tiempo de adquisición de imagen 3D es extraordinariamente rápido (1,6 segundos en el caso del mapa macular). Ofrece un mapa 3D de 9 x 9 mm y permite adquirir imágenes a través de una pupila de al menos 2,5 mm de diámetro Figura 4. OCT RS-3000. Defecto arciforme de CFNR en retinografía (flechas imagen izquierda) y en el mapa de desviación del complejo de células ganglionares (color rojo imagen derecha) (Imagen cedida por Nidek). Analisis de segmento anterior Se trata de un módulo opcional que realiza las medidas habituales de córnea y ángulo camerular (fig. 5). Análisis de Retina Permite diferentes tipos de escaneado: línea macular, cruz macular, múltiples escáneres de la mácula (X-Y 5 x 5), mapa macular (con reconstrucción en 3D). Una de las características novedosas del software de esta OCT es la posibilidad de segmentar la retina en 6 capas: 1) Membrana limitante interna (MLI), 2) Capa de fibras nerviosas/ capa de células ganglionares (CFNR/GCL), 3) Plexiforme interna/nuclear interna (PLI/NLI), 4) Capa plexiforme externa/nuclear externa, 5) Capa de fotorreceptores (IS/OS), 6) Epitelio pig- Figura 5. OCT RS-3000. Imagen del ángulo camerular. (cedida por Nidek). 108 SPECTRAL OCT/SLO (OPKO Instruments/OTI OPKO Health) Adquiere imágenes de SLO y OCT simultáneamente a través de la misma óptica, lo que proporciona una perfecta correlación punto por punto y en tiempo real entre los B-scans de la OCT y la imagen del fondo SLO en vivo (fig. 6). La imagen oftalmoscópica que obtenemos es de 29°. El software de análisis permite mostrar el espesor macular en el típico mapa ETDRS o en un patrón de 8 x 8 mm. Con la función «lock and track» se asegura que los exámenes posteriores se realicen siempre en la misma localización y con la misma orientación sin depender de la valoración subjetiva del clínico. Mediante la adición de una lente permite la obtención de imágenes de segmento anterior. TOMOGRAFIA DE COHERENCIA ÓPTICA lar es presentado como cuadrículas (o rejillas) de 5 x 5; 8 x 8 ó 6 x 6 mm o de forma más similar a como se presentaba en el OCT Stratus: zona foveal y cuadrantes. Los mapas retinianos pueden ser vistos como un cubo 3D, del que podemos aislar los cortes que deseemos. También se pueden aislar las distintas capas retinianas en un C-Scan. Como con otros SD-OCT, las medidas del espesor macular obtenidas con Spectral OCT/SLO de OPKO son mayores que con Stratus OCT, en este caso un promedio de 39,2 micras mayor. También induce menos artefactos que OCT Stratus (35% vs 26%). Estudio de Glaucoma Figura 6. Dispositivo SPECTRAL OCT/SLO (OPKO Instruments/ OTI OPKO Health) (Cortesía de Dr. Richard Rosen, New York Eye & Ear Infirmary). Para el análisis de la CFNR realiza mediante el escaneo circular habitual de 3,4 mm (512 A-scan/círculo) que se centra de forma manual en la papila. Una vez que el sistema captura 3 imágenes secuenciales en las que el espesor de la CFNR está dentro de un 5% de variación, el escaneo se detiene automáticamente. Obtiene las medidas clásicas de espesor medio, por cuadrantes y sectores horarios y lo compara con una base de datos normativa. La función test-retest del instrumento retiene los patrones vasculares alrededor de la papila para que en exploraciones sucesivas permita repetibilidad en la exploración. Una de las últimas versiones de software de glaucoma proporciona también un mapa de espesor de la CFNR 3D cubriendo un área de 5 mm de diámetro alrededor de la papila. El espesor de la CFNR es dividido en 6 anillos y 24 sectores (cada media hora de reloj) en lugar de los 12 convencionales. El espesor de la CFNR es mostrado por tanto en 144 áreas o zonas. El instrumento también proporciona un estudio topográfico de la papila. Características generales Otras opciones – Velocidad de escaneo: 27000 A-scans por segundo. – Resolución axial: 5 µm. – Resolución transversa: 15 µm Según los fabricantes la los escáneres de este OCT tienen una profundidad de hasta 2 mm, que le permitiría analizar coroides. Una característica distintiva es la capacidad para realizar microperimetrías, que permiten predecir la función visual de una zona concreta de la retina del paciente en función de hallazgos a nivel de su retina interna, en concreto analizando la zona de unión de la parte externa e interna de los fotorreceptores. Los datos obtenidos son posteriormente situados sobre la imagen de SLO o del mapa de espesor macular del OCT para correlacionar anatomía y función en diferentes puntos de la retina (fig. 7). Por último, es posible adquirir una lente adicional con la cual este OCT permite el estudio del segmento anterior, pudiéndose obtener las imágenes habituales Estudio de Retina El mapa topográfico de la retina es producido a partir de una secuencia de B-scans. El análisis macu- 3. DISPOSITIVOS COMERCIALES. PROTOCOLOS DE ESCANEADO Y ANÁLISIS DE RESULTADOS 109 Figura 7. Imágenes con OCT/SLO (OPKO Instruments/OTI OPKO Health). A la izquierda membrana epiretininana con edema macular cistoide. A la derecha microperimetrìa del mismo caso (Cortesía de Dr. Richard Rosen, New York Eye & Ear Infirmary). de alta resolución (conjuntiva, cornea y esclera, paquimetría y topografía corneal, medidas del ángulo de la cámara anterior). BIOPTIGEN SD-OCT (BIOPTIGEN) Este equipo es portátil y esta diseñado de modo que puede ser adaptado a una lámpara de hendidura o usado en quirófano. Puede ser utilizado en clínica o en experimentación, aunque su uso primordial es en investigación animal. Puede utilizar diferentes longitudes de onda. La longitud de onda de 1310 nm es de elección para recoger imágenes de tejidos externos ex vivo (como epidermis, mucosa oral…), ya que aporta una mayor capacidad de penetración en dichos tejidos a costa de una menor resolución. Es de especial aplicación en estudios experimentales con animales y estudios postmorten. A nivel oftalmológico es el utilizado para evaluación del segmento anterior. La longitud de onda de 820 nm es la que se empleará mayoritariamente en oftalmología, está idealmente diseñada para valorar la retina de pequeños animales (conejos y otros roedores), grandes animales (perros y cerdos) y humanos. Este aparato emplea interferometría espectral de alto rendimiento para obtener imágenes en tiempo real, con una resolución axial de 4 µm. Es capaz de realizar 20000 A-scans por segundo. Permite recoger datos de un área retiniana de 10 x 10 mm, en menos de 6 segundos, con no más de 80 micras de espacio entre B-scans. También presenta la posibilidad de medir el flujo sanguíneo mediante la opción doppler y de realizar imágenes del segmento anterior simplemente cambiando la posición del foco. Hasta el momento es el único sistema de OCT que permite utilizar una sonda flexible, que se puede manejar con la mano del clínico. Esto es especialmente útil a la hora de obtener imágenes en niños pequeños, animales o en el quirófano. El principal inconveniente es que actualmente su software apenas presenta aplicaciones destinadas a la clínica, como un sistema de medición de volúmenes retinianos o de análisis del nervio óptico. BIBLIOGRAFÍA 1. Forte R, Cennamo GL, Finelli ML, de Crecchio G. Comparison of time domain Stratus OCT and spectral domain SLO/OCT for assessment of macular thickness and volume. Eye (Lond) 2009; 23: 2071-2078. 2. Muni RH, Kohly RP, Sohn EH, Lee TC. Hand-held spectral domain optical coherence tomography finding in shaken-baby syndrome. Retina. 2010; 30(4 Suppl): S45-50. 3. Savini G, Carbonelli C, Barboni P. Spectral-domain optical coherence tomography for the diagnosis and follow-up of glaucoma. Curr Opin Ophthalmol 2011; 22: 115-123. 4. Sakata LM, DeLeón-Ortega J, Sakata V, Girkin CA. Optical coherence tomography of the retina and optic nerve –a review. Clin Exp Ophthalmol 2009; 37: 90-99.