T-4 Los átomos y el S.Periódico
Anuncio

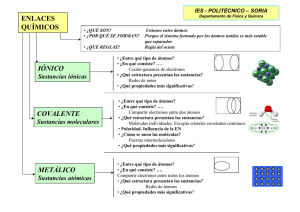
Colegio “La Inmaculada” Misioneras Seculares de Jesús Obrero Nueva del Carmen, 35. – 47011 Valladolid. Tel: 983 29 63 91 Fax: 983 21 89 96 e-mail: lainmaculadava@planalfa.es Área de Física y Química 3º de ESO Apuntes de Área TEMA 4 – LOS ÁTOMOS Y EL SISTEMA PERIÓDICO . Objetivos / Criterios de evaluación O.5.1 Conocer la importancia de la búsqueda de los elementos químicos. O.5.2 Diferenciar entre metales y no metales. O.5.3 Reconocer la existencia de las propiedades periódicas de los elementos y justificar su clasificación en la tabla periódica. O.5.4 Identificar el tipo de enlace que une los átomos en moléculas y cristales. O.5.5 Conocer los elementos que forman los seres vivos. O.5.6 Calcular la masa molecular relativa de las sustancias. O.5.7 Entender el concepto de mol. O.5.8 Utilizar los modelos moleculares para explicar la estructura de la materia. 1. Clasificación de los elementos Triadas de Dobereiner: Son agrupaciones de elementos químicos de 3 en tres de manera que las características del elemento intermedio son intermedias entre las de los elementos de los extremos. Octavas de Newlands: son ordenaciones de elementos en función de sus masas atómicas en las que se observa una repetición, para algunos electos, de las características de 7 en 7 elementos, como las notas musicales. La tabla de Medeleiev: es una agrupación de los elementos en orden creciente de masa atómica parecida a la de Newlands, en esta tala había más de 7 columnas. LA TABLA PERIÓDICA Está ordenada en función de los números atómicos de los elementos. Cada fila de la tabla se llama periodo y corresponde con elementos cuyos átomos más externos están en el mismo nivel de energía. Cada columna se llama grupo y corresponde con elementos con la misma configuración electrónica y parecidas características físicas y químicas. Hay 4 zonas distintas: 2 columnas de la izquierda: los elementos con configuración electrónica s (s 1 y s2) 6 columnas de la derecha: los elementos con configuración electrónica p (p 1 a p6) 10 columnas intermedias: los elementos con configuración electrónica d (d 1 a d10) 14 columnas separadas: los elementos con configuración electrónica f (f 1 a f14) Hay 4 tipos de elementos diferentes: Tema 4 – Los átomos y el sistema periódico. Colegio “La Inmaculada” Misioneras Seculares de Jesús Obrero Nueva del Carmen, 35. – 47011 Valladolid. Tel: 983 29 63 91 Fax: 983 21 89 96 e-mail: lainmaculadava@planalfa.es Área de Física y Química 3º de ESO Apuntes de Área Metales, no metales, metaloides y gases nobles Def. Gas noble: Gases que no suelen reaccionar con otros elementos. Def. carácter metálico: capacidad de los elementos químicos para ser buenos conductores del calor y la electricidad. Los metales además suelen tener alta densidad, y ser sólidos a temperaturas normales. Def. Reactividad: capacidad para reaccionar en presencia de otras sustancias. La reactividad disminuye de abajo hacia arriba y de izquierda a derecha salvo en los calcógenos y halógenos que vuelve a aumentar. Def. electronegatividad: es una medida de fuerza de atracción que ejerce un átomo sobre los electrones de otro. Aumenta en la tabla de izquierda a derecha y de abajo a arriba.. 2. El enlace químico En la naturaleza los elementos químicos aparecen la mayoría de las ocasiones unidos unos con otros de muy distintas maneras. Este hecho dificultó el descubrimiento de los elementos químicos. Def. Enlace químico: es la fuerza de tipo electrostática (debida a la existencia de cargas eléctricas) que mantiene unidos a los átomos. La regla del octeto Los gases nobles tienen ocho electrones en la última capa, 2 en orbitales s y 6 en orbitales p. y no se unen con otros elementos. La configuración con 8 electrones en la última capa es muy estable. Los átomos muy pequeños alcanzan la estabilidad con 2 átomos en la última capa (H, He, Li, Be, B) Para que un átomo sea estable debe tener 8 electrones en su capa de valencia (última capa electrónica). Su configuración electrónica tiende a parecerse a la del gas noble que tiene más cercano. Para lograr este objetivo pierde los electrones que le sobran o gana los que le faltan (que otro átomo debe cederle) 3. El enlace químico iónico Se realiza entre un metal y un no metal (elemento de la derecha de la tabla + elemento de la izquierda de la tabla) El metal cede electrones al no metal El metal se convierte en ión positivo (catión y el no metal en ión negativo (anión) Los iones de distinto signo se atraen y forman el enlace. Suelen formar cristales iónicos. Características de los compuestos iónicos: Tema 4 – Los átomos y el sistema periódico. Colegio “La Inmaculada” Misioneras Seculares de Jesús Obrero Nueva del Carmen, 35. – 47011 Valladolid. Tel: 983 29 63 91 Fax: 983 21 89 96 e-mail: lainmaculadava@planalfa.es Área de Física y Química 3º de ESO Apuntes de Área Sólidos a temperaturas ambientes y con alto punto de fusión. Conducen la electricidad disueltos en agua o fundidos. http://platea.pntic.mec.es/pmarti1/educacion/3_eso_materiales/b_iv/3eso_bloque_iv.htm# apartado_1 4. El enlace químico covalente Se realiza entre dos no metales (elementos de la derecha de la tabla) Los átomos compartes electrones hasta tener 8 e - alrededor. Dan lugar a dos tipos de sustancias: Sustancia covalentes moleculares: se forman por la unión de pocos átomos por enlace covalente: Son normalmente gaseosas o líquidas a temperatura ambiente, tienen bajos puntos de fusión. No conducen bien la electricidad. Cristales covalentes: se forman por la unión de muchos átomos por enlaces covalentes formando redes: Son normalmente sólidos a temperatura ambiente, tienen altos puntos de fusión. No conducen bien la electricidad. http://platea.pntic.mec.es/pmarti1/educacion/3_eso_materiales/b_iv/3eso_bloque_iv.htm# apartado_1 5. El enlace químico metálico Los átomos ceden electrones y se convierten en iones positivos (catión) Los electrones cedidos por todos los átomos forman una nube electrónica que mantiene unidos a los cationes y permite la conducción de electricidad. Características: Sólidos a temperaturas ambientes y con alto punto de fusión. Conducen la electricidad y el calor Son dúctiles y maleables. http://platea.pntic.mec.es/pmarti1/educacion/3_eso_materiales/b_iv/3eso_bloque_iv.htm# apartado_1 Tema 4 – Los átomos y el sistema periódico. Colegio “La Inmaculada” Área de Física y Química 3º de ESO Apuntes de Área Misioneras Seculares de Jesús Obrero Nueva del Carmen, 35. – 47011 Valladolid. Tel: 983 29 63 91 Fax: 983 21 89 96 e-mail: lainmaculadava@planalfa.es 6. Cantidad de sustancia Def. Fórmula química: Es la representación de la composición molecular de una sustancia. Expresa la abundancia relativa de cada elemento químico en el compuesto final. Def. Masa molecular: es la suma de las masas atómicas de los átomos que forman una molécula de un compuesto. Def. Composición centesimal: es la distribución porcentual de la abundancia relativa de la masa de cada elemento químico en la masa de un compuesto. Def. Mol: de una sustancia es la cantidad de masa cuyo peso en gramos es igual a la masa molecular de dicha sustancia. Un mol de una sustancia contiene 6,022·10 23 moléculas (o átomos o iones) de esa sustancia. Ese número se llama número de Avogradro (A). Def. Masa molar (M): es la masa de un mol de una sustancia, se expresa en g/mol y su número coincide con la masa molecular de la sustancia. número de moles= masa Masa molar n= m M Def. Volumen molar: Es el volumen ocupado por un mol de cualquier sustancia gaseosa que se encuentre en condiciones normales de presión y temperatura, es decir, 760 mm de Hg y 273 K. Su valor es 22,4 litros /mol. Volumen molar= 22,4 litros/mol Def. Molaridad: es una medida de la concentración de una disolución. Molaridad= moles de soluto Volumen de la disolución M= n V 7. Principios de la Formulación química Def.: Número de oxidación es el número entero que representa la cantidad de electrones que un átomo recibe (nº negativo) o da (nº positivo) cuando forma un compuesto. De esta forma, decir que el potasio está en un compuesto con número de oxidación +1 significa que ha cedido un electrón al resto de los átomos con quienes forma la molécula. En una fórmula química, se escribe a la izquierda el elemento más metálico y a la derecha el menos metálico 8. Formulación de compuestos binarios Óxidos: Tema 4 – Los átomos y el sistema periódico. Colegio “La Inmaculada” Misioneras Seculares de Jesús Obrero Nueva del Carmen, 35. – 47011 Valladolid. Tel: 983 29 63 91 Fax: 983 21 89 96 e-mail: lainmaculadava@planalfa.es Peróxidos: Haluros de oxígeno: Hidruros metálicos: Hidruros ni metálicos: Sales binarias: Tema 4 – Los átomos y el sistema periódico. Área de Física y Química 3º de ESO Apuntes de Área