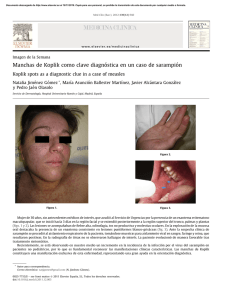
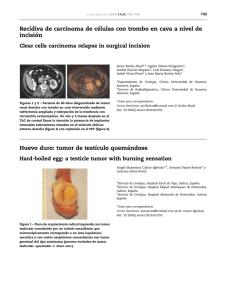
La inocencia de las cigüen˜as
Anuncio

Vol. 3 Núm. 2 Abril-Junio 2010 Editorial La inocencia de las cigüeñas 51 F. Antoja Ribó Originales Valor pronóstico postoperatorio del extremo aminoterminal del propéptido natriurético tipo B en el trasplante cardíaco 52 N. Avello Llano, B. Prieto García, B. Díaz Molina y F.V. Álvarez Menéndez Procedimiento de validación de magnitudes bioquímicas en un gasómetro. Aplicación al alcance flexible en la Norma ISO 15189 58 F.A. Bernabeu Andreu, M.A. Corcho Robleda, M. Redondo Fernández, L. Sivera Monzó, M.C. Coca Martín e I. Arribas Gómez A propósito de la adecuación de la demanda. Nefropatía diabética 63 A.J. Benítez Estévez y M. Calvo Malvar Estudio retrospectivo de 1.193 componentes monoclonales detectados en Palma de Mallorca 69 I. Llompart Alabern, E. Maffiotte Oramas, M. Belmonte Campayo, B. Barcelo Martín, B. Riera Bestard y P. Sastre Alzamora Nota técnica Cáncer medular de tiroides familiar: importancia del estudio molecular en el diagnóstico 76 S. López, A. Cerezo, M. Alramadan y M.D. Hernández Revisión Actuación del laboratorio ante la obtención de valores críticos 80 C. Herrera Rodrigo, C. Tapia-Ruano Díaz-Quetcuti, A. Buño Soto y M. García Montes Documento de consenso Consenso sobre especificaciones mínimas de la calidad analítica para magnitudes hematológicas y de bioquímica especial R. Calafell Clar, G. Gutiérrez Bassini, J.M. Jou Turallas, J. Morancho Zaragoza, F. Ramón Bauzá, C. Ricós Aguilá, A. Salas García y A. Buño Soto 87 Vol. 3 Num. 2 April-June 2010 Editorial The innocence of the Storks 51 F. Antoja Ribó Original articles Prognostics value of NT-proBNP after heart transplantation 52 N. Avello Llano, B. Prieto García, B. Díaz Molina and F.V. Álvarez Menéndez Validation procedure of biochemical parameters in a gasometer. Application to the flexible scope in the standard ISO 15189 58 F.A. Bernabeu Andreu, M.A. Corcho Robleda, M. Redondo Fernández, L. Sivera Monzó, M.C. Coca Martín and I. Arribas Gómez Adjusting of the demand. Diabetic nephropathy 63 A.J. Benítez Estévez and M. Calvo Malvar Restrospective study of 1.193 monoclonal gammopathies detected in Palma of Mallorca 69 I. Llompart Alabern, E. Maffiotte Oramas, M. Belmonte Campayo, B. Barcelo Martín, B. Riera Bestard and P. Sastre Alzamora Technical note Familial medullary thyroid carcinoma: Importance of the molecular analysis in the diagnosis 76 S. López, A. Cerezo, M. Alramadan and M.D. Hernández Review Laboratory action on obtaining critical values 80 C. Herrera Rodrigo, C. Tapia-Ruano Díaz-Quetcuti, A. Buño Soto and M. García Montes Consensus statement Consensus on the minimum analytical quality specifications for haematology and special biochemistry parameters R. Calafell Clar, G. Gutiérrez Bassini, J.M. Jou Turallas, J. Morancho Zaragoza, F. Ramón Bauzá, C. Ricós Aguilá, A. Salas García and A. Buño Soto 87 ARTICLE IN PRESS Rev Lab Clin. 2010;3(2):51 Revista del Laboratorio Clínico www.elsevier.es/LabClin EDITORIAL La inocencia de las cigüeñas The innocence of the storks Cuando se quiere que una investigación efectuada en el laboratorio se convierta en un manuscrito publicable, que comunique los hallazgos de forma fiable, los resultados experimentales se han de someter al análisis estadı́stico. Y, en esta faceta, a veces se producen disonancias, algunas muy notorias y otras más sutiles, que, si no se descubren y se enmiendan debidamente, pueden enturbiar un buen trabajo. En un jocoso libro que recopila anécdotas vividas por profesionales sanitarios, Arı́s1 expone una conclusión a la que humorı́sticamente llegó Bartels: en Alemania, en un mismo año, descendieron, de forma significativa, la tasa de nacimientos de la población humana y el número de ejemplares de cigüeñas. La correlación entre ambos datos era alta, lo que demostraba cientı́ficamente su relación. Ası́ pues, la baja natalidad se podı́a explicar por la disminución del número de repartidores de bebés. La culpa era de las cigüeñas. Es muy saludable, de vez en cuando, encontrar detalles de humor. Si leyéramos un supuesto artı́culo cientı́fico con esa conclusión tan extravagante, considerarı́amos, sin duda, que se trata de una parodia y como tal la aceptarı́amos. Nos resultarı́a fácil entenderlo ası́ porque sabemos muy bien que las cigüeñas no intervienen en los procesos relacionados con la reproducción humana y que, por tanto, en este caso, se habrı́a buscado una relación entre dos variables que es bien sabido que no se relacionan. Una buena correlación no siempre significa una relación entre causas. El trabajo estarı́a mal planteado, aunque se hubiera aplicado un tratamiento estadı́stico aparentemente correcto. Pero, ¿qué ocurre cuando el estudio se lleva a cabo con datos menos conocidos, de poblaciones que nos son menos familiares, obtenidos en estudios complejos? ¿cómo sabemos si el autor sabe certeramente entre qué grupos se puede establecer relaciones y entre cuáles no tiene sentido hacerlas? Esto sólo es posible si el investigador conoce muy bien lo que está estudiando y ha partido de un planteamiento bien estructurado. Las conclusiones que se obtienen al aplicar las pruebas estadı́sticas sólo tienen sentido cuando los datos están bien definidos. Más frecuentemente sucede la situación inversa. Muchos investigadores tienen definido muy claramente su estudio y manejan atinadamente los datos, pero no aciertan cuando escogen las pruebas estadı́sticas pertinentes. Ası́ pues, pueden llegar y de hecho llegan, a la redacción de las revistas cientı́ficas, manuscritos que adolecen de una manifiesta mala sincronı́a entre los datos obtenidos y su posterior análisis estadı́stico, ya sea por la confusión entre la descripción de una muestra y la información sobre sus valores en la población, la comparación improcedente entre grupos, la mala selección de las variables, la poca precisión de las medidas, la apreciación incorrecta del tamaño de la muestra, la extrapolación o generalización errónea de los resultados, la elección improcedente de las pruebas, la inadecuada potencia de las pruebas aplicadas, la aceptación de conclusiones equivocadas sobre la significación estadı́stica, o los errores en la conclusión final del estudio. Escrig2 cita dos casos recientes de artı́culos que, según su criterio, contienen errores en el tratamiento estadı́stico y han pasado el filtro de la revisión por pares en revistas de nivel bien acreditado. Lo atribuye a que los revisores suelen ser colegas con un alto perfil profesional pero quizás sin un buen conocimiento de análisis estadı́stico de datos, y cree que los fallos se originan cuando los autores no tienen claros algunos conceptos básicos pero disponen de programas estadı́sticos potentes, en los que sólo se necesita señalar y aceptar entre un abanico enorme de pruebas. Los autores han de ser muy cautos en la aplicación y posterior interpretación de los análisis estadı́sticos. Los revisores han de saber discernir a ciencia cierta la idoneidad del tratamiento. Y los editores, ante manuscritos difı́ciles de evaluar, han de incorporar un tercer revisor especialista en estadı́stica que dictamine definitivamente sobre la bondad de las herramientas empleadas. Algunas revistas ya lo hacen sistemáticamente y ası́ evitan artı́culos con conclusiones desatinadas. Todo sea para salvaguardar la calidad de los artı́culos publicados, el prestigio de la revista y, entre otras consecuencias, la inocencia de las cigüeñas. Bibliografı́a 1. Arı́s A. Tómese una antes de acostarse, 1a ed. Barcelona: Planeta; 1998. 2. Escrig Sos J. Errores de grueso calibre en la aplicación de pruebas estadı́sticas. Cir Esp. 2010;87:127–9. Felip Antoja Ribó Director 1888-4008/$ - see front matter & 2010 AEBM, AEFA y SEQC. Publicado por Elsevier España, S.L. Todos los derechos reservados. doi:10.1016/j.labcli.2010.03.002 ARTICLE IN PRESS Rev Lab Clin. 2010;3(2):52–57 Revista del Laboratorio Clínico www.elsevier.es/LabClin ORIGINAL Valor pronóstico postoperatorio del extremo aminoterminal del propéptido natriurético tipo B en el trasplante cardı́aco Noelia Avello Llanoa, Belén Prieto Garcı́aa, Beatriz Dı́az Molinab y Francisco V. Álvarez Menéndeza,c, a Servicio de Bioquı́mica Clı́nica, Hospital Universitario Central de Asturias, Oviedo, España Servicio de Cardiologı́a, Hospital Universitario Central de Asturias, Oviedo, España c Departamento de Bioquı́mica y Biologı́a Molecular, Universidad de Oviedo, Oviedo, España b Recibido el 17 de septiembre de 2009; aceptado el 7 de diciembre de 2009 Disponible en Internet el 18 de febrero de 2010 PALABRAS CLAVE Trasplante cardı́aco; Péptidos natriuréticos; Pronóstico Resumen Introducción: El trasplante cardı́aco es una opción terapéutica disponible para algunos pacientes con insuficiencia cardı́aca avanzada. Es importante establecer el pronóstico que presentan estos pacientes para poder diferenciar aquéllos con peor expectativa de vida y adoptar medidas adicionales en estos casos. Los péptidos natriuréticos cardı́acos han demostrado su utilidad diagnóstica y pronóstica en diferentes enfermedades. El objetivo de este estudio es valorar la utilidad del extremo aminoterminal del propéptido natriurético tipo B (NT-proBNP) postoperatorio en el pronóstico de los pacientes trasplantados cardı́acos a corto plazo. Materiales y métodos: Se determinó la concentración de NT-proBNP a los 15 dı́as postoperatorios en 50 pacientes que recibieron trasplante cardı́aco para valorar la utilidad pronóstica de mortalidad a 6 meses de seguimiento. Resultados: Los pacientes que fallecieron mostraron concentraciones de NT-proBNP significativamente superiores que los que sobrevivieron, con una mediana de la concentración de NT-proBNP a los 15 dı́as postrasplante de 20.632 ng/l (intervalo interculartı́lico: 6.183 a 37.925 ng/l) frente a 3.923 ng/l (intervalo interculartı́lico: 1.752 a 6.890 ng/l) respectivamente. Se observó que el hazard-ratio de mortalidad se multiplica por 8,5 veces (IC del 95%: 1,7 – 44,2) en el grupo de pacientes con concentraciones de NT-proBNP, cuantificadas a los 15 dı́as postrasplante, superiores al valor discriminatorio de 7.500 ng/l. & 2009 AEBM, AEFA y SEQC. Publicado por Elsevier España, S.L. Todos los derechos reservados. Autor para correspondencia. Correo electrónico: falvarezmen@gmail.com (F.V. Álvarez Menéndez). 1888-4008/$ - see front matter & 2009 AEBM, AEFA y SEQC. Publicado por Elsevier España, S.L. Todos los derechos reservados. doi:10.1016/j.labcli.2009.12.002 ARTICLE IN PRESS Valor pronóstico postoperatorio del extremo aminoterminal del propéptido natriurético tipo B en el trasplante cardı́aco 53 KEYWORDS Heart transplantation; Natriuretic peptides; Prognosis Prognostics value of NT-proBNP after heart transplantation Abstract Introduction: Cardiac transplantation is a widely accepted option for the treatment of end-stage congestive heart failure. In order to identify those patients at risk of short life expectancy, it could be worthwhile to establish an individual prognosis factor. The prognostic and diagnostic values of natriuretic peptides have been studied in different areas of clinical practice. The objective of this study was to evaluate the short-term prognostic ability of NT-proBNP concentration in heart transplantation patients. Materials and methods: The group studied consisted of 50 adult heart transplant patients. NT-proBNP concentration was measured in each patient 15 days after surgery to evaluate the prognostic value at 6 months follow up. Results: The non-survivor patients showed higher NT-proBNP concentrations than survivors, with a median of NT-proBNP concentration on the 15th day post-transplantation of 20632 ng/L (IIC: 6183 to 37925 ng/L) and 3923 ng/L (IIC: 1752 to 6890 ng/L) in the nonsurvivors and the survivors groups, respectively. The hazard ratio of mortality was 8.5 times higher (95% CI: 1.7 to 44.2) in those patients with NT-proBNP concentrations over 7500 ng/L on the 15th day post-transplantation. & 2009 AEBM, AEFA y SEQC. Published by Elsevier España, S.L. All rights reserved. Introducción Actualmente, el trasplante cardı́aco es una medida terapéutica altamente aceptada para ciertos pacientes que presentan insuficiencia cardı́aca avanzada1. Sin embargo, éste es un tratamiento que implica ciertos riesgos y que presenta una mortalidad mayor en el primer año postrasplante con respecto a los años posteriores2. Debido a esta circunstancia, resulta interesante establecer factores de pronóstico que permitan diferenciar el grupo de pacientes con peor expectativa de vida para adoptar medidas adicionales en estos pacientes. Actualmente, el registro de la International Society for Heart and Lung Transplantation (ISHLT)2 identifica como factores de pronóstico la mayor edad del donante y del receptor, la resistencia vascular pulmonar elevada, un alto ı́ndice de masa corporal del donante y una elevada relación entre el peso del donante y el peso del receptor. La concentración plasmática de los péptidos natriuréticos aumenta como respuesta al estiramiento de los cardiomiocitos que se produce durante la insuficiencia cardı́aca. Por este motivo, ası́ como por su elevado valor predictivo negativo en el diagnóstico diferencial de la disnea de novo, la determinación de los péptidos natriuréticos está incluida en el algoritmo para el diagnóstico de insuficiencia cardı́aca desde el año 20013. Está demostrada la asociación que existe entre la concentración del extremo aminoterminal del propéptido natriurético tipo B (NT-proBNP) y la concentración de creatinina4, por lo que parece conveniente tener en cuenta la concentración de creatinina en el momento de la determinación de NT-proBNP para estudiar la posible asociación. Después del trasplante cardı́aco, se normaliza la función del ventrı́culo izquierdo, pero los péptidos natriuréticos no vuelven de forma temprana a sus concentraciones normales. Las concentraciones séricas del péptido natriurético tipo B (BNP) descienden durante el primer año postrasplante, sin llegar a alcanzar valores de normalidad5,6. Se observa una concentración máxima de BNP a las 2–4 semanas siguientes a la intervención, que posteriormente disminuye hasta estabilizarse, aproximadamente a los 5 meses7. El NT-proBNP muestra un comportamiento similar8. Se ha estudiado la utilidad tanto del BNP como del NT-proBNP en diferentes situaciones clı́nicas en el contexto del trasplante cardı́aco (por ejemplo, en el rechazo agudo) sin resultados concluyentes9–12. Recientemente, las concentraciones de BNP se han relacionado con el sistema inmunitario y diferentes interleucinas13, tanto en pacientes trasplantados como no trasplantados. Asimismo, se ha descrito el valor predictivo del BNP en diferentes enfermedades ası́ como en pacientes trasplantados cardı́acos. Martı́nez-Dolz et al14 estudiaron las concentraciones de BNP en pacientes postrasplantados durante el primer año y describieron que un valor discriminatorio de 100 pg/ml permitı́a establecer 2 subgrupos con diferente pronóstico. Sin embargo, sólo Gardner et al15 han estudiado la utilidad pronóstica a corto plazo, sin llegar a proponer un punto de corte. El objetivo de este estudio ha sido describir el potencial valor pronóstico que tiene la medida de la concentración de NT-proBNP a corto plazo después del trasplante cardı́aco. Materiales y métodos Se seleccionaron de manera prospectiva los pacientes que recibieron un trasplante ortotópico en la Unidad de Trasplante Cardı́aco del Hospital Universitario Central de Asturias durante el perı́odo de tiempo comprendido entre julio de 2002 y diciembre de 2006. Se incluyeron tanto los que recibieron un trasplante urgente como los que recibieron un trasplante electivo. Se excluyeron del estudio un paciente al que se le realizó un trasplante cardiorrenal, con objeto de eliminar el trasplante renal como posible factor de confusión, y un paciente que falleció a la semana del trasplante. Antes de la realización del trasplante cardı́aco se solicitó a los ARTICLE IN PRESS 54 N. Avello Llano et al pacientes el consentimiento informado, que incluye la aceptación del posible empleo de muestras biológicas para investigación. El número total de pacientes trasplantados durante este tiempo fue de 50 (37 hombres y 13 mujeres), con un promedio de 54 años de edad en el momento del trasplante (desviación estándar [DE]: 9,5 años). En la primera visita de control, 15 dı́as tras el trasplante, se recogió de cada paciente una muestra de sangre periférica extraı́da en un tubo sin anticoagulante y con separador de gelosa. La sangre se centrifugó en frı́o durante 8 min a 2.000 g para separar el suero. Todas las muestras de suero se conservaron a 80 1C hasta el momento de su procesamiento. Las determinaciones de NT-proBNP se realizaron en el autoanalizador Elecsys 2010 (Roche Diagnosticss, Mannheim, Alemania) mediante un inmunoanálisis de electroquimioluminiscencia. La determinación de creatinina se realizó en un analizador modular DPP de Roche, mediante método Jaffé cinético con blanco de muestra compensado (Roche Diagnosticss, Mannheim, Alemania). La valoración de los resultados obtenidos se realizó retrospectivamente, teniendo en cuenta las variables recogidas durante el curso clı́nico del seguimiento postrasplante (NT-proBNP, creatinina), ası́ como los diagnósticos efectuados durante el perı́odo de estudio (causa de fallecimiento). Las variables cuantitativas que seguı́an una distribución de Gauss se describieron con la media aritmética y la DE y, en caso contrario, con la mediana y el intervalo intercuartı́lico (IIC). La comparación de los resultados entre el grupo de pacientes que fallecieron con respecto al grupo que sobrevivió se efectuó mediante la prueba U de MannWhitney. El rendimiento pronóstico se determinó mediante la curva receiver operating characteristic (ROC) para estimar sensibilidad y especificidad. La significación de la curva se evaluó a partir del intervalo de confianza (IC) del área bajo la curva y se interpretó como significativo si el lı́mite inferior del IC del área era superior a 0,5. Asimismo, se realizó el estudio de supervivencia mediante curvas de Kaplan-Meier y el cálculo del hazard-ratio mediante regresión de Cox. Se consideraron significativas aquellas pruebas estadı́sticas que aportaron valores de p inferiores a 0,05. El análisis de los datos se realizó por medio del paquete estadı́stico SPSS, v.15. Tabla 1 Resultados Se estudió el valor pronóstico de la concentración de NT-proBNP medida a 50 pacientes en la visita de seguimiento programada a los 15 dı́as de la intervención quirúrgica (media: 15,6 dı́as; DE: 3,7 dı́as). En la tabla 1 se describen las caracterı́sticas clı́nicas de estos pacientes. Se estableció un tiempo de seguimiento de 6 meses postrasplante para estudiar el valor pronóstico de la determinación realizada a los 15 dı́as del trasplante. Siete de estos 50 pacientes fallecieron en este tiempo (14%), lo que mostró un tiempo medio de supervivencia postrasplante de 1,6 meses (DE: 0,6 meses). Las causas de los fallecimientos fueron las siguientes: 3 pacientes por fallo primario, 2 pacientes por sepsis, un paciente por fallo multiorgánico y otro paciente por un hematoma subdural. La mediana de la concentración de NT-proBNP a los 15 dı́as postrasplante, en el grupo de pacientes que sobrevivieron, fue de 3.923 ng/l (IIC: 1.752 a 6.890 ng/l) mientras que en aquellos pacientes que fallecieron fue de 20.632 ng/l (IIC: 6.183 a 37.925 ng/l). Las diferencias entre ambos grupos fueron estadı́sticamente significativas (prueba U de Mann Whitney; po0,01) (fig. 1), con un área bajo la curva ROC de 0,82 (IC del 95%: 0,68 – 0,96; po0,01), que permitió establecer la sensibilidad y especificidad de diferentes puntos de corte. Por tanto, la determinación de NT-proBNP a los 15 dı́as del trasplante tiene una eficacia pronóstica de fallecimiento en los 6 meses siguientes al trasplante del 82% (fig. 2). Se seleccionó como posible punto de corte una concentración de NT-proBNP de 7.500 ng/l; por encima de ésta, la sensibilidad diagnóstica es del 71% (IC del 95%: 30 – 95%), la especificidad del 81% (IC del 95%: 66 – 91%) y el valor predictivo negativo del 94,6% (IC del 95%: 80,5 – 99,1%). Se realizó un análisis de supervivencia de Kaplan-Meier para la concentración discriminatoria de 7.500 ng/l, y se representó la supervivencia acumulada respecto al tiempo transcurrido estratificando a los pacientes en 2 grupos según el valor discriminatorio de NT-proBNP establecido previamente (fig. 3). Se observó que los pacientes que a los 15 dı́as postrasplante tenı́an concentraciones de NT-proBNP inferiores a 7.500 ng/l presentaron mejor pronóstico que aquéllos con concentraciones superiores, y estas diferencias fueron estadı́sticamente significativas (log-rank test, Caracterı́sticas clı́nicas de los pacientes estudiados Edad (años cumplidos) Sexo Creatinina Causa del trasplante cardı́aco Cardiopatı́a isquémica Miocardiopatı́a dilatada idiopática Cardiopatı́a valvular Retrasplante Otras causas DE: desviación estándar; IIC: intervalo intercuartı́lico. Expresado como media (DE). Supervivientes (n=43) Fallecidos (n=7) 54,1 (DE: 9,5) 72,1% hombres 1,23 mg/dl (IIC: 0,94 – 1,64) 56,2 (DE: 10,5) 85,7% hombres 1,6 mg/dl (IIC: 1,5 – 2,6) 53,5% (n ¼ 23) 20,9% (n ¼ 9) 4,7% (n ¼ 2) 4,7% (n ¼ 2) 16,3% (n ¼ 7) 71,4% ( ¼ 5) – – 14,3% (n ¼ 2) 14,3% (n ¼ 2) ARTICLE IN PRESS po0,01). El hazard-ratio de mortalidad calculado a partir de la regresión de Cox en el grupo de pacientes con concentraciones de NT-proBNP superiores a 7.500 ng/l a los 15 dı́as postrasplante se multiplica por 8,5 veces (IC del 95%: 1,7 – 44,2). Para estudiar la interacción con la creatinina, en primer lugar se realizó una correlación entre la concentración de NT-proBNP y la de creatinina, que no resultó significativa (Spearman, p ¼ 0,18). Posteriormente, se descartó la posible confusión con la creatinina mediante la inclusión en el análisis multivariante de esta variable dicotomizada según que la concentración de creatinina fuera inferior o superior a 1,5 mg/dl. No se observó interacción en el estudio multivariante mediante la introducción del producto de ambas variables (p ¼ 0,941). Supervivencia acumulada Valor pronóstico postoperatorio del extremo aminoterminal del propéptido natriurético tipo B en el trasplante cardı́aco 55 1,0 NT-proBNP<7500ng/L 0,8 Log-rank p<0,01 NT-proBNP≥7500ng/L 0,6 0,4 0,2 0,0 0 50.000 NT-proBNP (ng/L) 2 3 4 5 6 Tiempo postrasplante (meses) Figura 3 Representación de Kaplan-Meier de la supervivencia acumulada los primeros 6 meses postrasplante para los 50 pacientes trasplantados. De los 7 pacientes que fallecieron, 5 tenı́an concentraciones superiores a 7.500 ng/l, mientras que de los 43 pacientes que no fallecieron, 35 tuvieron concentraciones inferiores a 7.500 ng/l. 40.000 30.000 * * 20.000 Discusión 10.000 0 No Sí Fallecimiento Figura 1 Concentración del extremo aminoterminal del propéptido natriurético tipo B a los 15 dı́as del trasplante en función de la supervivencia de los pacientes a los 6 meses de éste. Dos resultados se han truncado en el grupo de los pacientes supervivientes. 1,0 0,8 Sensibilidad 1 0,6 0,4 0,2 0,0 0,0 0,2 0,4 0,6 1 - Especifidad 0,8 1,0 Figura 2 Curva ROC que valora la eficacia pronóstica, a los 6 meses, de la determinación del extremo aminoterminal del propéptido natriurético tipo B realizada a los 15 dı́as postrasplante. La utilidad pronóstica, tanto de morbilidad como de mortalidad, de los péptidos natriuréticos se ha demostrado ampliamente en situaciones clı́nicas muy diversas16–21. A su vez, la utilidad pronóstica de las determinaciones postoperatorias de NT-proBNP en diferentes tipos de intervenciones cardı́acas también se ha descrito previamente. En este caso, los resultados son contradictorios, ya que hay estudios que no encuentran relación entre la concentración de NT-proBNP en el perı́odo postoperatorio y la probabilidad de complicaciones22, mientras que otros estudios encuentran asociación entre las concentraciones de BNP y la presencia de complicaciones, lo que aportarı́a utilidad como factor pronóstico23. Sin embargo, en pacientes trasplantados cardı́acos sólo existe una referencia bibliográfica acerca de la utilidad del BNP o del NT-proBNP como factor pronóstico a corto plazo15. En un grupo de 26 pacientes se describió que la concentración de NT-proBNP a la semana postrasplante predice el pronóstico. Sin embargo, en ese trabajo no se estableció la eficacia pronóstica ni probables concentraciones discriminatorias, posiblemente debido al reducido tamaño muestral del estudio. En el presente trabajo, se evalúa por primera vez la utilidad pronóstica de la determinación de NT-proBNP realizada a los 15 dı́as postrasplante en un perı́odo de seguimiento postrasplante de 6 meses. Dada la cinética que siguen las concentraciones de NT-proBNP después del trasplante cardı́aco y a la espera de obtener un mejor rendimiento pronóstico, también se realizó la evaluación con las muestras extraı́das a las 4 semanas postrasplante. Como era de esperar, la eficacia pronóstica mejoró el 90% (IC del 95%: 81 – 99%) (datos no mostrados); sin embargo, se consideró más interesante seleccionar el primer tiempo (a los 15 dı́as postrasplante) sobre la base del interés de poder establecer un pronóstico con la mayor antelación posible después de la intervención quirúrgica para, de este ARTICLE IN PRESS 56 modo, estratificar los pacientes con peor pronóstico y anticiparse para adoptar medidas lo antes posible. Los pacientes que fallecieron habı́an presentado concentraciones de NT-proBNP a los 15 dı́as del trasplante muy superiores a las concentraciones de los que sobrevivieron. Las diferencias entre ambos grupos (fallecidos y supervivientes) fueron estadı́sticamente significativas (po0,01) (fig. 1). Se estableció que para una concentración de NT-proBNP superior a 7.500 ng/l el hazard-ratio de mortalidad se multiplica por 8,5 (IC del 95%: 1,6 – 43,7), sin observar asociación entre la concentración de NT-proBNP y la concentración de creatinina en este momento (a los 15 dı́as de la intervención). A la vista de estos resultados, podemos concluir que las concentraciones postoperatorias de NT-proBNP a los 15 dı́as de la intervención predicen el pronóstico de los pacientes que reciben un trasplante de corazón. Debido al reducido tamaño muestral del grupo de fallecidos (n=7), se utilizó como variable principal )muerte por cualquier causa*; las causas de fallecimiento fueron fallo primario, sepsis, fallo multiorgánico y hematoma subdural. La asociación entre la concentración de NT-proBNP y algunas de las causas de fallecimiento observadas en estos pacientes se ha descrito previamente. Por ejemplo, la elevación de NT-proBNP en casos de sepsis24 puede deberse a la dilatación ventricular inducida por la sepsis o a la liberación de endotoxinas25. Además, durante el primer año postrasplante, las infecciones y el fallo agudo del injerto son las principales causas de fallecimiento26. El fallo agudo del injerto se produce por una disfunción ventricular27 y, por tanto, resulta lógica la asociación con la concentración de NT-proBNP. Además, el fallo multiorgánico, tanto por su etiologı́a como por las consecuencias a nivel cardı́aco, podrı́a producir importantes elevaciones en los péptidos natriuréticos. Por tanto, aunque en todos los pacientes trasplantados existe una elevación posterior a la intervención quirúrgica, que aproximadamente se estabiliza a partir del primer mes postrasplante, los pacientes que fallecieron ya presentaban a los 15 dı́as concentraciones más elevadas que aquellos que aún sobrevivı́an a los 6 meses. Por tanto, se puede utilizar la concentración de NT-proBNP a los 15 dı́as postrasplante como marcador pronóstico de mortalidad para seleccionar un grupo de pacientes con mayor riesgo. Hay que tener cuenta que determinados pacientes dentro del grupo de los supervivientes (8 de 43) también presentaron concentraciones de NT-proBNP superiores a 7.500 ng/l a los 15 dı́as. No obstante, los resultados obtenidos en el presente estudio exploratorio son esperanzadores si se confirmase en estudios posteriores más amplios el importante valor predictivo negativo que parece tener el NT-proBNP en pacientes con concentraciones inferiores al valor discriminatorio establecido. Por otra parte, la utilidad del marcador como factor pronóstico de mortalidad, de forma independiente o combinado con otros parámetros, constituirı́a una herramienta de gran interés para el seguimiento del paciente con trasplante cardı́aco. Conflicto de intereses Los reactivos de este estudio han sido financiados parcialmente por Roche Diagnosticss (Mannheim, Alemania). N. Avello Llano et al Bibliografı́a 1. Hunt SA, Abraham WT, Chin MH, Feldman AM, Francis GS, Ganiats TG, et al. ACC/AHA 2005 Guideline update for the diagnosis and management of chronic heart failure in the adult. Circulation. 2005;112:e154–235. 2. Taylor DO, Edwards LB, Aurora P, Christie JD, Dobbels F, Kirk R, et al. Registry of the International Society for Heart and Lung Transplantation: Twenty-fifth official adult heart transplant report–2008. J Heart Lung Transplant. 2008;27:943–56. 3. Remme WJ, Swedberg K. Guidelines for the diagnosis and treatment of chronic heart failure. Eur Heart J. 2001;22: 1527–60. 4. De Filippi C, Van Kimmenade RR, Pinto YM. Amino-terminal proB-type natriuretic peptide testing in renal disease. Am J Cardiol. 2008;101:82–8. 5. Kirchhoff WC, Gradaus R, Stypmann J, Deng MC, Tian TD, Scheld HH, et al. Vasoactive peptides during long-term follow-up of patients after cardiac transplantation. J Heart Lung Transplant. 2004;23:284–8. 6. Geny B, Follenius M, Epailly E, Charpentier A, Brandenberger G, Eisenmann B, et al. Transient reduction without normalization of brain natriuretic peptide early after heart transplantation. J Thorac Cardiovasc Surg. 1998;115:473–5. 7. Hervas I, Arnau MA, Almenar L, Pérez-Pastor JL, Chirivella M, Osca J, et al. Ventricular natriuretic peptide (BNP) in heart transplantation: BNP correlation with endomyocardial biopsy, laboratory and hemodynamic measures. Lab Invest. 2004;84:138–45. 8. Avello N, Molina BD, Llorente E, Bernardo MJ, Prieto B, Álvarez FV. N-terminal pro-brain natriuretic peptide as a potential noninvasive marker of cardiac transplantation rejection. Ann Clin Biochem. 2007;44:182–8. 9. Wu AH, Johnson ML, Aaronson KD, Gordon D, Dyke DB, Koelling TM. Brain natriuretic peptide predicts serious cardiac allograft rejection independent of hemodynamic measurements. J Heart Lung Transplant. 2005;24:52–7. 10. Lindblade CL, Chun DS, Darragh RK, Caldwell RL, Murphy DJ, Schamberger MS. Value of plasma B-type natriuretic peptide as a marker for rejection in pediatric heart transplant recipients. Am J Cardiol. 2005;95:909–11. 11. Arnau-Vives MA, Almenar L, Hervas I, Osa A, Martı́nez-Dolz L, Rueda J, et al. Predictive value of brain natriuretic peptide in the diagnosis of heart transplant rejection. J Heart Lung Transplant. 2004;23:850–6. 12. O’Neill JO, McRae III AT, Troughton RW, Ng K, Taylor DO, Yamani MH, et al. Brain natriuretic peptide levels do not correlate with acute cellular rejection in De Novo orthotopic heart transplant recipients. J Heart Lung Transplant. 2005;24: 416–20. 13. Shaw SM, Fildes J, Yonan N, Williams SG. Does brain natriuretic peptide interact with the immune system after cardiac transplantation? Transplantation. 2007;84:1377–81. 14. Martı́nez-Dolz L, Almenar L, Moro J, Aguero J, Hervas I, Rueda J, et al. Prognostic value of brain natriuretic peptide in heart transplant patients. J Heart Lung Transplant. 2007;26:986–91. 15. Gardner RS, Chong KS, Murday AJ, Morton JJ, McDonagh TA. N-terminal brain natriuretic peptide is predictive of death after cardiac transplantation. Heart. 2006;92:121–3. 16. Doust JA, Pietrzak E, Dobson A, Glasziou P. How well does B-type natriuretic peptide predict death and cardiac events in patients with heart failure: Systematic review. BMJ. 2005;330:625. 17. Gardner RS, Ozalp F, Murday AJ, Robb SD, McDonagh TA. N-terminal pro-brain natriuretic peptide. A new gold standard in predicting mortality in patients with advanced heart failure. Eur Heart J. 2003;24:1735–43. ARTICLE IN PRESS Valor pronóstico postoperatorio del extremo aminoterminal del propéptido natriurético tipo B en el trasplante cardı́aco 57 18. Yu CM, Sanderson JE. Plasma brain natriuretic peptide–an independent predictor of cardiovascular mortality in acute heart failure. Eur J Heart Fail. 1999;1:59–65. 19. Schnabel R, Lubos E, Rupprecht HJ, Espı́nola-Klein C, Bickel C, Lackner KJ, et al. B-type natriuretic peptide and the risk of cardiovascular events and death in patients with stable angina: Results from the Athero Gene study. J Am Coll Cardiol. 2006;47:552–8. 20. McKie PM, Rodeheffer RJ, Cataliotti A, Martin FL, Urban LH, Mahoney DW, et al. Amino-terminal pro-B-type natriuretic peptide and B-type natriuretic peptide: Biomarkers for mortality in a large community-based cohort free of heart failure. Hypertension. 2006;47:874–80. 21. Januzzi JL, Van Kimmenade R, Lainchbury J, Bayes-Genis A, Ordonez-Llanos J, Santalo-Bel M, et al. NT-proBNP testing for diagnosis and short-term prognosis in acute destabilized heart failure: An international pooled analysis of 1256 patients: The International Collaborative of NT-proBNP Study. Eur Heart J. 2006;27:330–7. 22. Reyes G, Fores G, Rodrı́guez-Abella RH, Cuerpo G, Vallejo JL, Romero C, et al. NT-proBNP in cardiac surgery: A new tool for 23. 24. 25. 26. 27. the management of our patients? Interact Cardiovasc Thorac Surg. 2005;4:242–7. Cerrahoglu M, Iskesen I, Tekin C, Onur E, Yildirim F, Sirin BH. Nterminal proBNP levels can predict cardiac failure after cardiac surgery. Circ J. 2007;71:79–83. Chua G, Kang-Hoe L. Marked elevations in N-terminal brain natriuretic peptide levels in septic shock. Crit Care. 2004;8:R248–50. Vila G, Resl M, Stelzeneder D, Struck J, Maier C, Riedl M, et al. Plasma NT-proBNP increases in response to LPS administration in healthy men. J Appl Physiol. 2008;105:1741–5. Almenar-Bonet L. Registro Español de Trasplante Cardı́aco. XVIII Informe oficial de la sección de insuficiencia cardı́aca, trasplante cardiaco y otras alternativas terapéuticas de la Sociedad Española de Cardiologı́a (1984–2006). Rev Esp Cardiol. 2007;60:1177–87. Martı́nez-Dolz L, Almenar L, Arnau MA, Osa A, Rueda J, Vicente JL, et al. Análisis de los factores que pueden influir en la aparición del fallo agudo del corazón trasplantado. Rev Esp Cardiol. 2003;56:168–74. ARTICLE IN PRESS Rev Lab Clin. 2010;3(2):58–62 Revista del Laboratorio Clínico www.elsevier.es/LabClin ORIGINAL Procedimiento de validación de magnitudes bioquı́micas en un gasómetro. Aplicación al alcance flexible en la Norma ISO 15189 Francisco A. Bernabeu Andreua,, M.A. Corcho Robledaa, Mauricio Redondo Fernándezb, Liliana Sivera Monzóa, M. Carmen Coca Martı́na e Ignacio Arribas Gómeza a Servicio de Análisis Clı́nicos, Hospital Universitario Prı́ncipe de Asturias, Alcalá de Henares, Madrid, España Grupo ACMS Consultores, Madrid, España b Recibido el 2 de noviembre de 2009; aceptado el 16 de febrero de 2010 Disponible en Internet el 15 de abril de 2010 PALABRAS CLAVE ISO 15189; EP-9; Alcance flexible; Validación; Gasómetro Resumen Objetivos: Diseñar un procedimiento de validación de 4 magnitudes bioquı́micas en un gasómetro frente a un analizador acreditado que sea sencillo, consistente y aceptable según la Norma ISO 15189:2007 y que pueda servir como método de acreditación flexible. Métodos: Medición secuencial en los analizadores Dimension RxL y GEM 4000 de glucosa, sodio (Naþ), potasio (Kþ) y lactato en 91 muestras de plasma (heparina de litio) de pacientes entre marzo y junio de 2009 (EP-9). Se chequearon outliers y error sistemático. Los pares de resultados se estudiaron mediante análisis de regresión lineal y gráficos de Bland-Altman. El criterio de aceptación fue obtener un error sistemático inferior a las especificaciones de calidad definidas en el laboratorio acreditado. Resultados y discusión: Los resultados de glucosa y Kþ fueron aceptables según el procedimiento 6.1 de la guı́a EP-9, mientras que Naþ fue aceptable según el procedimiento 6.2. En cuanto a lactato, se detectó un error sistemático superior a la especificación del laboratorio. Conclusiones: Se han validado los métodos de determinación de glucosa, Naþ y Kþ en un gasómetro GEM 4000 mediante la aplicación de la norma EP-9 con respecto a los del Dimension RxL (métodos de referencia). El lactato no se pudo validar porque el error sistemático superó la especificación del laboratorio. Este procedimiento se propone como herramienta de validación de métodos para laboratorios acreditados con alcance flexible según la Norma UNE EN ISO 15189. Autor para correspondencia. Correo electrónico: fbernabeu.hupa@salud.madrid.org (F.A. Bernabeu Andreu). 1888-4008/$ - see front matter & 2009 AEBM, AEFA y SEQC. Publicado por Elsevier España, S.L. Todos los derechos reservados. doi:10.1016/j.labcli.2010.02.001 ARTICLE IN PRESS Validación de métodos en un laboratorio acreditado 59 & 2009 AEBM, AEFA y SEQC. Publicado por Elsevier España, S.L. Todos los derechos reservados. KEYWORDS ISO 15189; EP-9; Flexible scope; Validation; Gasometer Validation procedure of biochemical parameters in a gasometer. Application to the flexible scope in the standard ISO 15189 Abstract Objectives: Designing a 4 biochemical parameters validation procedure in a gasometer versus an accredited analyzer. This procedure is simple, robust and acceptable according to the standard ISO 15189: 2007 and that can serve as flexible accreditation method. Methods: Sequential measurement in Dimension RxL and GEM 4000 analysers of glucose, Naþ, Kþ and lactate in 91 patients plasma samples (Lithium heparin) between March and June 2009 (EP-9). Checked outliers and bias results pairs were studied using linear regression analysis and Bland-Altman graphics. The acceptance criterion was to get a bias lower than quality specifications defined in the accredited laboratory. Results and discussion: The results of glucose and Kþ were acceptable, following the procedure 6.1 of EP9 guideline, while for Naþ it was acceptable by the procedure 6.2. For lactate, a superior to the specification of the lab bias was detected. Conclusions: Measuring methods of glucose, sodium and potassium in a GEM 4000 gasometer applying standard EP9 versus Dimension RxL as reference methods have been validated. Lactate could not be validated because the bias exceeded the specification of the laboratory. This procedure is intended as validation tool of methods for laboratories accredited with flexible scope according to UNE EN ISO 15189 standard. & 2009 AEBM, AEFA y SEQC. Published by Elsevier España, S.L. All rights reserved. Introducción Desde hace unos años el sistema de gestión de la calidad por implantar en los laboratorios clı́nicos es una cuestión recurrente1. Hay defensores de la certificación por la Norma UNE EN ISO 9001, hay defensores de la acreditación por la Norma UNE EN ISO 15189 y hay quienes defienden que cada laboratorio debe utilizar un sistema de gestión de calidad acorde a sus necesidades y a los requerimientos por parte de sus clientes2. Muy recientemente tuvo lugar la 2009 Convocation of experts on Laboratory Quality. Uno de los grupos de trabajo debatió sobre la situación de los diferentes paı́ses europeos respecto a que con sus leyes se obligara a los laboratorios clı́nicos a acreditarse (Pan European Medical Laboratory Accreditation: Pros and cons [conclusiones pendientes de publicación]). No es fácil llegar a una situación de consenso entre las diferentes opciones enfrentadas3. Sin embargo, desde la óptica de un laboratorio con un alcance acreditado, sı́ resulta muy útil llegar a incluir en este la opción de )alcance flexible*4–6, mediante el cual el laboratorio acreditado puede ampliar el alcance a nuevos parámetros con la tecnologı́a ya acreditada para otros sin tener que comunicarlo previamente a la Entidad Nacional de Acreditación (ENAC). Llegar a conseguir la )confianza* de la ENAC exige la definición, la aplicación y la revisión constante de procedimientos de validación estrictos por parte del laboratorio. En este artı́culo proponemos: 1) un procedimiento de validación de 4 magnitudes bioquı́micas en un gasómetro frente a un analizador acreditado, que sea sencillo, consistente y aceptable según la Norma ISO 15189:2007, y 2) que este procedimiento pueda aplicarse como herramienta de validación en los laboratorios acreditados con alcance flexible. Material y métodos Se han seguido las recomendaciones de la guı́a de consenso CLSI para comparación de métodos mediante la utilización de muestras de pacientes, conocida como guı́a EP-9-A27. Se denomina Y al método que se está probando (GEM 4000, Instrumentation Laboratory) y X al método de comparación o de referencia (Dimension RxL, Siemens). Muestras Se han empleado muestras de sangre de 91 pacientes que acudieron al servicio de urgencias del hospital, recogidas entre los meses de marzo y junio de 2009. Las muestras se recogieron en jeringas de gasometrı́a con heparina de litio y se procesaron inmediatamente a su llegada en el analizador de gases GEM 4000. A continuación se centrifugaron a 3.500 rpm y se procesaron en el analizador Dimension RxL. Los parámetros estudiados fueron glucosa, lactato, sodio (Naþ) y potasio (Kþ). La tecnologı́a empleada en las determinaciones del Dimension RxL para glucosa y lactato fue espectrofotometrı́a y para Naþ y Kþ potenciometrı́a indirecta, mientras que en GEM 4000 para glucosa y lactato se empleó amperometrı́a y para Naþ y Kþ potenciometrı́a ARTICLE IN PRESS 60 F.A. Bernabeu Andreu et al directa. Todos los resultados obtenidos se encontraban dentro del rango de linealidad de los citados parámetros. Las muestras se analizaron por duplicado en ambos analizadores. El tiempo transcurrido entre el procesamiento en un analizador y el otro no superó los 20 min. Análisis de los resultados 1. Detección de valores extremos o outliers. El procedimiento seguido es el indicado en los puntos 4.1 y 4.4 de la EP-97. Se comparan las diferencias absolutas entre los duplicados de cada método8. Estas diferencias no deben superar el valor de 4 veces la media de las diferencias absolutas. Si se encuentra algún valor que exceda este lı́mite, se comprueba que las diferencias normalizadas (punto 4.1 de la EP-9) de los duplicados no superen el valor de 4 veces la media normalizada de las diferencias de cada método. 2. Relación lineal entre valores de ambos métodos. Se realizan 4 diagramas de dispersión mediante la utilización de escalas iguales: 1) entre los valores medios de ambos métodos; 2) entre los valores individuales de Y frente a los valores medios de X; 3) entre las diferencias entre la media de Y y la media de X para cada método frente a la suma de los valores medios de Y y de X dividida por 2, y 4) por último, un diagrama entre la diferencia entre cada valor individual de Y y de X frente a la misma suma del diagrama tercero. De acuerdo con la EP-9 (punto 4.2)7, se valora la relación lineal mediante inspección visual. 3. Coeficiente de correlación (r). Se calcula el r, y si es mayor o igual a 0,975 (o coeficiente de determinación mayor o igual a 0,95), se considera aceptable el rango de X, es decir, que el error de X está compensado por el rango de los datos, y posibilita la utilización del análisis de regresión simple para estimar la pendiente y la ordenada en el origen9. 4. Estimación de la dispersión. El punto 5.2 de la EP-97 recomienda la inspección visual de la dispersión constante, tras lo que se realiza un análisis de regresión según los puntos 6.1 o 6.2 de la citada guı́a. 5. Estimación del error sistemático predicho y sus intervalos de confianza (IC). La diferencia entre cada valor puntual de Y y la recta de regresión es lo que se denomina el residuo para ese punto. La desviación estándar de esos residuos es una medida de la dispersión de los puntos alrededor de la recta de regresión. Tabla 1 n Mı́nimo Máximo P20 P40 P60 P80 Interpretación. Se calculó el error del residual (error sistemático del residual según la guı́a EP-9 punto 6.1) y sus IC (de acuerdo con el error estándar de los residuales según el punto 6.1 de la EP-9). Si el error aceptable es superior al lı́mite superior del IC del error residual, se asume que el método evaluado tiene condiciones metrológicas aceptables (punto 7 de la EP-9). El análisis estadı́stico se ha realizado con la ayuda del paquete MedCalc para Windows versión 10.3.2.0 (MedCalc Software, Mariakerke, Bélgica). Resultados En la tabla 1 se muestran los resultados de los distintos parámetros analizados según la distribución de sus valores respectivos, agrupados por quintiles. Detección de outliers. En los parámetros glucosa, lactato y Kþ no se encontraron valores outliers, mientras que en el Naþ se encontró un valor (el 0,9% del total) que superaba los lı́mites establecidos, por lo que se eliminó del análisis. Linealidad y dispersión constante. Se comprobó que la glucosa, el lactato y el Kþ seguı́an una relación lineal (r40,975; coeficiente de determinación 40,95) con dispersión constante, por lo que se aplicó el procedimiento 6.1 de la guı́a EP-97 (tabla 2). En el caso del Naþ el valor de r fue de 0,88, con lo que no es aplicable el procedimiento 6.1 de la guı́a EP-97. En estos casos la citada guı́a recomienda con antelación aumentar el número de muestras por encima de 40. Dado que el número de muestras de este estudio ya era superior al recomendado por la guı́a EP-9 (n=91), se procedió a aplicar el procedimiento 6.2. En la tabla 3 se muestran los valores de los errores predichos calculados en distintos niveles crı́ticos de decisión clı́nica. Tabla 2 Resultados del análisis de regresión lineal Glucosa Lactato r 0,9937 0,9874 r2 0,9875 0,9750 Pendiente 1,006 0,8283 Ordenada en origen 0,8674 0,3196 Naþ Kþ 0,8805 0,7752 0,9204 9,0651 0,9818 0,9640 0,9618 0,1542 Kþ: potasio; Naþ: sodio; r: coeficiente de correlación; r2: coeficiente de determinación. Distribución de valores de los distintos parámetros Glucosa, mg/dl Lactato, mmol/l Naþ, mmol/l Kþ, mmol/l 91 67 320 94 117 137 167 91 1,0 12,6 1,6 2,1 2,5 3,2 91 126 148 135 137 139 140 91 2,9 6,6 3,5 3,8 4,0 4,4 Kþ: potasio; Naþ: sodio; P: percentil. ARTICLE IN PRESS Validación de métodos en un laboratorio acreditado Tabla 3 61 Error total aceptable en los niveles crı́ticos de decisión clı́nica Dato Glucosa Lactato Kþ Xc Lı́mite superior al 95% de confianza Lı́mite inferior al 95% de confianza Error total aceptable, concentración Error total aceptable, % 120 0,82 1,04 8,28 6,9 2 0,62 0,70 0,31 15,72 5,2 0,007 0,082 0,3 5,76 Naþ 135 0,70 1,80 4,58 3,39 148 2,43 3,41 5,02 3,39 Kþ: potasio; Naþ: sodio; Xc: nivel crı́tico de decisión. Error total aceptable=error sistemático71,96 error aleatorizado. Asimismo, se realizó un análisis gráfico mediante gráficos tipo Bland-Altman para verificar que no existı́an diferencias significativas entre pares de puntos entre los 2 equipos comparados (no mostrados). Se pudo corroborar que menos del 3% de los datos excedı́a las 2 desviaciones tı́picas; sin embargo, en el caso del lactato se observaba una deriva que evidenciaba que los valores del GEM 4000 eran inferiores a los del Dimension RxL, es decir, no se pueden superponer los datos de lactato de ambos analizadores. Discusión El Laboratorio de Urgencias del Hospital Universitario Prı́ncipe de Asturias está acreditado por la ENAC según la Norma ISO 15189:2007 con el número 630/LE1377. Su alcance10 incluye 42 parámetros con diferentes técnicas, como espectrofotometrı́a, potenciometrı́a, inmunoanálisis, crioscopia, amperometrı́a, dispersión de la luz, etc. Hay ocasiones en que los analizadores de bioquı́mica, a pesar de estar duplicados, se averı́an simultáneamente, y en ese momento un gasómetro puede resultar vital para suplir a los analizadores convencionales, ya que por su naturaleza el laboratorio de urgencias ha de responder a las demandas de resultados en plazos muy cortos durante las 24 h del dı́a los 365 dı́as del año. No obstante, para que el resultado sea fiable, el método o el analizador deben estar validados. Se han validado los métodos de determinación de Naþ y Kþ (potenciometrı́a directa) y glucosa (amperometrı́a) en un gasómetro GEM 4000 mediante la aplicación de la norma EP-97, y se han utilizado como referencia los métodos espectrofotométricos (glucosa) y la potenciometrı́a indirecta (Naþ y Kþ) ya acreditados para el analizador Dimension RxL. Como limitaciones del estudio, cabe citar que no se ha realizado la secuencia inversa en la medición de los replicados, como recomienda la EP-9, si bien este hecho probablemente no reporta ningún factor favorable al estudio. Tanto es ası́ que no ha sido posible la validación del lactato, porque los resultados en GEM 4000 fueron significativamente distintos a los de Dimension RxL. No obstante, puesto que tanto la imprecisión calculada (datos no aportados) como los datos de correlación con respecto al método de referencia resultaron excelentes, aun cuando la guı́a no contempla explı́citamente la ortodoxia de la utilización de una ecuación de regresión para conseguir la superposición deseada, desde nuestro punto de vista su uso es conceptualmente correcto, por lo que se propone utilizar una ecuación del tipo citado y que la entidad de acreditación correspondiente avale esta práctica. Merece también comentarse el hecho de que la validación del Naþ haya requerido el procedimiento 6.2 (más complicado). Se ha tenido que recurrir a este procedimiento alternativo debido a que este parámetro no reunı́a todos los criterios de linealidad, requisitos que se pueden resumir en el r de 0,8. La causa más probable de esta moderada correlación es que el rango de valores obtenidos para este catión es estrecho9, circunstancia que, por otra parte, es difı́cil de obviar en la práctica clı́nica habitual. De esta manera, queda cubierto el primer objetivo de nuestro trabajo, que era validar estas magnitudes en el gasómetro GEM 4000 para que ante una situación de urgencia pudieran llevarse a cabo las determinaciones en un analizador consistente y de tratamiento sencillo. Como valor añadido se obtiene la posibilidad de utilizar únicamente el espécimen sangre heparinizada sin necesidad de centrifugar para las determinaciones referidas, lo que llevarı́a consigo un ahorro tanto de muestra como de tiempo. Cabe destacar que a pesar del efecto matriz, los resultados obtenidos en los diferentes parámetros en el gasómetro, con excepción del lactato, permiten la superponibilidad de éstos con los del Dimension RxL, ya que los errores observados en este estudio son inferiores a las especificaciones analı́ticas establecidas en nuestro laboratorio. Para la validación de métodos hemos empleado la guı́a EP-97. El uso de la guı́a, si bien a priori puede parecer tedioso, una vez utilizada es fácil de estandarizar. Resulta llamativa la escasez de artı́culos que refieren la utilización de esta norma (16 referencias) para la cuantificación del error sistemático en la bibliografı́a consultada, aunque sı́ aparecen referencias de utilización de otras guı́as, como la EP-5 y la EP-10, para el cálculo de la imprecisión. En cualquier caso tan sólo aparece en la bibliografı́a un artı́culo publicado11 sobre validación de magnitudes bioquı́micas en un gasómetro comparado con un analizador bioquı́mico, aunque sı́ existen resultados de validación de los parámetros clásicos y especı́ficos de gasómetros, concretamente pH y calcio iónico12, y de analizadores bioquı́micos13. A pesar de que los procedimientos de la guı́a EP-9 no se corresponden con las recomendaciones sobre métodos estadı́sticos clásicos en cuanto a fiabilidad al comparar métodos14, la enorme utilidad de disponer y aplicar esta guı́a y su efectividad como instrumento de validación nos lleva a proponerla como herramienta de validación de métodos para laboratorios acreditados con alcance flexible ARTICLE IN PRESS 62 según la Norma UNE EN ISO 15189, al igual que para validación de métodos en laboratorios que aspiran a acreditarse. Los requisitos para la implantación de alcance flexible han sido objeto de normativas en diferentes normas y sociedades europeas5,6; sin embargo, la ENAC aún no ha marcado directrices sobre la implementación de alcance flexible para la ISO 15189, por lo que creemos que este procedimiento podrı́a incluirse en la futura nota técnica al respecto de la ENAC. Agradecimientos Queremos manifestar nuestro agradecimiento a todo el personal del Servicio de Análisis Clı́nicos del Hospital Universitario Prı́ncipe de Asturias, sin cuya colaboración no hubiera sido posible la acreditación ni la realización de este trabajo. F.A. Bernabeu Andreu et al 5. 6. 7. 8. 9. 10. Bibliografı́a 1. NCSL International 2995 Wilderness Place, Suite 107 Boulder, CO 80301-5404 USA. [consultado 31/1/2008]. Disponible en: http:// www.ncsli.org/accreditation/Laboratory_Accreditation.PDF. 2. IAF-ILAC-ISO/CASCO joint working group on image and integrity of conformity assessment December 2002. [consultado 22/1/ 2008]. Disponible en: http://www.iso.org/iso/iaf_ilac_commu nique.pdf)-ISO IAF/ILAC JWG/12. 3. Huisman W. Implementation of ISO 15189 in european countriespresent situation and some items for harmonisation in the future. Clin Chem Lab Med. 2009;47:S28. 4. Laboratorios de ensayo: acreditación para categorı́as de ensayo NT-18 Rev. 1 Junio 2004. [consultado 31/1/2008]. Disponible en: http://www.enac.es/web/enac/documentos-descarga?p_p_id= DOCUMENTOS_PORTLET_WAR_documentos&p_p_action=1 &p_p_state=normal&p_p_mode=view&p_p_col_id=column-2& p_p_col_pos=1&p_p_colcount=2&_DOCUMENTOS_PORTLET_ 11. 12. 13. 14. WAR_documentos__spage=%2FverDocumentos.do&_DOCUMENTOS_ PORTLET_WAR_documentos__sorig=%2FverDocumentos.do. EA requirements for the accreditation of flexible scopes. EA-2/ 15-Rev 00 Julio 2008. [consultado 18/9/2009]. Disponible en: http://www.eurolab.org/docs/EA/EA-2_15.pdf. EA position paper on the description of scopes of accreditation of medical laboratories. EA-4/17–Rev 00 Diciembre 2008. [consultado 18/9/2009]. Disponible en: http://www.renar.ro/ modules/accprocess/accprocess/Doc%20EA/EA-Series%204%20 Ghiduri%20pentru%20Laboratoare/EA-4-17%20Domeniu%20acre ditare%20laboratoare%20medicale.pdf. NCCLS. Method comparison and bias estimation using patient samples; approved guideline-second edition. NCCLS document EP9-A2 (ISBN 1-56238-472-4) NCCLS, 940 West Valley Road, Suite 1400, Wayne, Pennsylvania 19087 USA, 2002. Beyer WH, editor. CRC standard probability and statistics tables and formulae. Boca Raton Florida: CRC Press; 1991. Hald A. Statistical theory with engineering applications. Nueva York: Wiley Interscience; 1959. Alcance de la acreditación del Laboratorio de Urgencias del Servicio de Análisis Clı́nicos del Hospital Universitario Prı́ncipe de Asturias. [consultado 29/10/2009]. Disponible en: http://www. enac.es./web/enac/buscador?p_p_id=BIBLIO&p_p_action=0&p_ p_state=normal&p_p_mode=view&p_p_col_id=column-2&p_p_ col_pos=1&p_p_col_count=2&_BIBLIO_struts_action=%2Fext%2 Fbiblio%2Fview&_BIBLIO_folderId=112. Harff GA, Janssen WC, Rooijakkers ML. Evaluation of the radiometer whole blood glucose measuring system, EML 105. Eur J Clin Chem Clin Biochem. 1997;35:241–2. Couck P, Ghys T, Van Gastel E, Van Coillie M, Gorus F, Gerlo E. Preliminary performance evaluation of blood gas analyzers. Clin Chem Lab Med. 2006;44:1030–4. Van Gammeren AJ, Van Gool N, De Groot MJ, Cobbaert CM. Analytical performance evaluation of the Cobas 6000 analyzerspecial emphasis on trueness verification. Clin Chem Lab Med. 2008;46:863–71. Prieto L, Lamarca R, Casado A. La evaluación de la fiabilidad en las observaciones clı́nicas: el coeficiente de correlación intraclase. Med Clı́n. 1998;110:142–5. ARTICLE IN PRESS Rev Lab Clin. 2010;3(2):63–68 Revista del Laboratorio Clínico www.elsevier.es/LabClin ORIGINAL A propósito de la adecuación de la demanda. Nefropatı́a diabética Alfonso Javier Benı́tez Estévez y Mar Calvo Malvar Laboratorio de Análisis Clı́nicos, Hospital Universitario Nuestra Señora de Candelaria, Santa Cruz de Tenerife, España Recibido el 23 de octubre de 2008; aceptado el 18 de diciembre de 2009 Disponible en Internet el 27 de marzo de 2010 PALABRAS CLAVE Coste; Microalbuminuria; Nefropatı́a diabética; Adecuación de la demanda KEYWORDS Cost; Microalbuminuria; Diabetic nephropathy; Adjustment of the demand Resumen Introducción: La importancia de la determinación de albúmina en orina ha sido claramente establecida; sin embargo, existe controversia sobre las recomendaciones a seguir para su uso en el diagnóstico de la nefropatı́a diabética. El objetivo de este trabajo es evaluar los resultados y los costes del programa de escrutinio de la nefropatı́a diabética en nuestra área sanitaria. Material y métodos: Se ha realizado un estudio descriptivo retrospectivo sobre la demanda de escrutinios para detección de la nefropatı́a diabética en el año 2006. Para ello, se ha analizado una muestra de 1.111 escrutinios solicitados por los médicos de Atención Primaria. Los pacientes se han clasificado en los distintos estadios de la nefropatı́a diabética de acuerdo a la excreción urinaria de albúmina. Resultados: Solo el 39,7% de los escrutinios cumplieron con todos los criterios de prescripción especificados en el programa. La frecuencia de resultados positivos fue distinta según el sexo y el grupo de edad considerado. El coste por resultado positivo fue de 29,61h para varones mientras que resultó de 71,17h para mujeres, para un intervalo de edad de 12–70 años. Conclusiones: La adecuación de la demanda es necesaria para asegurar la eficiencia de la atención sanitaria. & 2008 AEBM, AEFA y SEQC. Publicado por Elsevier España, S.L. Todos los derechos reservados. Adjusting of the demand. Diabetic nephropathy Abstract Introduction: The importance of measuring albumin in urine is well established; however, there is still controversy regarding the recommendations to be used for detecting early renal impairment in diabetic patients. The objective of this work is to evaluate the results and the costs of the screening program for diabetic nephropathy in our health area. Material and methods: A retrospective descriptive study was carried out on the requests for screening for diabetic nephropathy in 2006. We performed 1111 diabetic nephropathy Autor para correspondencia. Correo electrónico: ALFONSOJBENITEZ@TERRA.ES (A.J. Benı́tez Estévez). 1888-4008/$ - see front matter & 2008 AEBM, AEFA y SEQC. Publicado por Elsevier España, S.L. Todos los derechos reservados. doi:10.1016/j.labcli.2009.12.003 ARTICLE IN PRESS 64 A.J. Benı́tez Estévez, M. Calvo Malvar screening tests requested by general practitioners. Patients were classified into different clinical nephropathy stages according to their albumin excretion rate. Results: Only 39.7% of the requests for diabetic nephropathy screening fulfilled all the prescription criteria specified in the program. The frequency of positive results was different in relation to sex and age groups. The cost per positive result was 29.61h for men, whereas it was 71.17h for women, in the 12–70 years age group. Conclusions: The adjustment of the demand is necessary to ensure the efficiency of health care. & 2008 AEBM, AEFA y SEQC. Published by Elsevier España, S.L. All rights reserved. Introducción La historia natural de la nefropatı́a diabética se entiende como una evolución progresiva que va desde alteraciones funcionales renales incipientes hasta la insuficiencia renal terminal, atravesando estadios intermedios marcados por la aparición de microalbuminuria y proteinuria1. Desde el punto de vista clı́nico, los primeros cambios funcionales renales en la diabetes mellitus tipo I son el incremento en la excreción urinaria de albúmina y la elevación del filtrado glomerular (Z120 ml/min/1,73 m2). Estos cambios ocurren poco después del diagnóstico, pero una vez que el control glucémico es el adecuado, la función renal vuelve a la normalidad. Después de 5–10 años de evolución de la enfermedad, algunos pacientes progresan a un estadio en el cual aumenta la excreción urinaria de albúmina sin existir cambios sustanciales en el filtrado glomerular. La existencia de microalbuminuria (30–300 mg/24 h) ya implica la existencia de nefropatı́a incipiente. De no mediar intervención terapéutica, la mayor parte de los pacientes con microalbuminuria progresarán a proteinuria (macroalbuminuria, Z300 mg/24 h), es decir, entrarán en fase de nefropatı́a diabética establecida. Cuando se produzca un descenso de la tasa de filtrado glomerular, virtualmente todos los pacientes progresarán hacia la insuficiencia renal terminal2,3. El curso clı́nico de la nefropatı́a en los pacientes con diabetes mellitus tipo II puede mostrar algunas diferencias comparándolo con el de los pacientes tipo I. Ello es debido en parte, tanto a la heterogeneidad de la enfermedad como al desconocimiento de la fecha exacta del comienzo de la misma. Ası́, es frecuente la presencia de HTA incluso precediendo al diagnóstico de la microalbuminuria y la existencia de otras enfermedades renales sobreañadidas a la nefropatı́a propiamente diabética. Esto puede ser debido a la edad más avanzada que poseen estos individuos y a la arterioesclerosis que muchos de ellos presentan4,5. El programa de escrutinio para la detección de la nefropatı́a diabética se centra fundamentalmente en la cuantificación de la excreción urinaria de la albúmina. Las recomendaciones vigentes en nuestra comunidad autónoma para elaboración de protocolos asistenciales se describen a continuación brevemente6: Para los pacientes con diabetes mellitus tipo I, el escrutinio se practicará anualmente de los 12–70 años. Para los pacientes con diabetes tipo II, se llevará a cabo anualmente desde el momento del diagnóstico y también hasta alcanzar los 70 años de edad. El escrutinio se realizará en la primera orina de la mañana mediante la determinación analı́tica del cociente albúmina/creatinina o mediante la determinación semicuantitativa de albúmina empleando tiras reactivas de quı́mica sólida. En caso de ser negativo el escrutinio (o30 mg/g de creatinina), este se repetirá anualmente. En caso de ser positivo, el escrutinio (Z30 mg/g de creatinina), se procederá a determinar la albumina en orina cronometrada de 24 h para confirmar el diagnóstico de nefropatı́a diabética en estadio de microalbuminuria o de proteinuria. El objetivo de este trabajo es evaluar los resultados y los costes del programa de escrutinio de la nefropatı́a diabética en nuestra área sanitaria. Material y métodos La selección de las solicitudes de análisis se ha realizado a partir de los registros de la base de datos del sistema de información del Laboratorio de Análisis Clı́nicos del Centro de Atención Especializada de Puerto de la Cruz, Rsigma versión 2.0, (Horus Hardware, Madrid). El periodo de tiempo considerado abarca desde el 1 de enero de 2006 al 31 de diciembre de 2006. Para el estudio solo se han considerado aquellos pacientes cuya solicitud de análisis fue realizada por médicos de Atención Primaria, a los que se les marcaba especı́ficamente el perfil de )control de diabetes* en el formulario y que además incluı́a la determinación de la excreción urinaria de albúmina, bien medida como el cociente albúmina/creatinina en orina aislada o bien cuantificando la albúmina en orina cronometrada. Cuando se solicitó la determinación de albúmina en orina cronometrada de 24 h se comprobó en el sistema de información del Laboratorio que dicho paciente no presentaba una nefropatı́a diabética diagnosticada previa (Z30 mg/g de creatinina) y que el carácter de la petición no era para el seguimiento del curso clı́nico de la enfermedad. Los procedimientos analı́ticos para la determinación de la albúmina y de la creatinina en orina se realizaron en un Sistema Analı́tico Modular PPE (Roche Diagnóstics, Barcelona) con reactivos comerciales: creatinina Jaffé (método picrato alcalino cinético sin desproteinización) y microalbumina urinaria (método inmunoturbidimétrico). La determinación de la glicohemoglobina A1c se llevo a cabo en un analizador Auto A1c HA8140 (Menarini Diagnostics, ARTICLE IN PRESS A propósito de la adecuación de la demanda. Nefropatı́a diabética Tabla 1 Definición cuantitativa de microalbuminuria y macroalbuminuria (proteinuria) Referencia Microalbuminuria Macroalbuminuria o proteinuria Orina aislada (mg/g creatinina) Orina de 24 h (mg/24 h) Orina cronometrada (mg/min) o30 30–299 Z300 o30 30–299 Z300 o20 20–199 Z200 Barcelona). Todos los procedimientos se ejecutaron de acuerdo a las directrices de los fabricantes. La clasificación de los resultados se realizó de acuerdo a criterios de interpretación clı́nica ampliamente aceptados (ver tabla 1)1,6,7. La estimación de los costes de la prueba de escrutinio (determinación de creatinina y de albúmina en orina) se ha calculado a partir de los costes de producción de nuestro Laboratorio8. Esto incluye considerar los costes directos de personal, reactivos y fungibles consumidos en el proceso de elaboración (fase preanalı́tica, fase analı́tica y fase postanalı́tica). El coste total de la prueba de escrutinio ha quedado establecido en 3,27h. El coste total de la albúmina ha sido de 3,195h (coste unitario teórico del reactivo/ determinación, 0,80h) y coste total de la creatinina ha sido de 0,075h (coste unitario teórico del reactivo/determinación, 0,025h). Las fuentes de datos para la contabilización de los costes han sido las siguientes: Datos de consumo de tiempo por proceso asignados según 65 organigrama funcional y desempeño de tareas, de los diferentes recursos humanos que constituyen la plantilla funcional de nuestro laboratorio. Datos de compras históricas de reactivos y fungibles (capı́tulo II), extraı́dos del sistema de información del Servicio de Suministros de la Dirección de Gestión del Hospital Universitario Nuestra Señora de Candelaria. El tratamiento estadı́stico se ha realizado con el programa informático de estadı́stica Rsigma Babel (Horus Hardware, Madrid), integrado dentro del propio sistema de información del laboratorio. 300 Varón Mujer 250 256 221 217 200 150 140 106 100 85 50 0 5 17 < 25 años Figura 1 33 32 26-40 años 41-55 años 56-70 años > 71 años Solicitudes de análisis estratificados por edad y sexo. Tabla 2 Análisis de la demanda de las pruebas de escrutinio Edad (años) Cociente albúmina/creatinina en orina aislada Microalbuminuria en orina cronometrada de 24 h Total 12–70 470 441 298 308 64 749 361 Resultados Para el estudio se seleccionó una muestra inicial de 1.157 pruebas de escrutinio para la detección de la nefropatı́a diabética. Posteriormente, fueron excluidos 45 al no estar disponibles los datos demográficos necesarios para el análisis. Solo a un único paciente se le solicitó 2 veces la prueba de escrutinio durante el periodo de tiempo que duró el estudio y dicha repetición fue excluida. Ası́, el tamaño de la muestra resultante fue de 1.111 escrutinios. Las solicitudes de análisis estratificados según edad y sexo se presentan en la figura 1. La mayor demanda de la prueba de escrutinio se produjo para ambos sexos en aquellos intervalos de edad más avanzada. Con respecto a la prescripción de la prueba, solo 441 (39,7%) cumplieron con todos los criterios especificados en el programa de escrutinio6: el intervalo de edad y la determinación del cociente albúmina/creatinina en orina (ver tabla 2). El resto de las peticiones, 670 (60,3%), no cumplieron con alguno de ellos: o bien se solicitó fuera del intervalo de edad recomendado o bien se prescribió la determinación de albumina en orina cronometrada de 24 h. La clasificación de los pacientes según el estadio de presentación se expone en la tabla 3. La nefropatı́a diabética fue más frecuente en varones que en mujeres, con un riesgo relativo de 1,8. En la figura 2 se recogen los costes anuales acumulados del programa de escrutinio. En ella, se han segregado los costes de aquellos individuos que no cumplı́an con el criterio de edad recomendada2. Los costes de obtener un resultado positivo (nefropatı́a en estadio de miroalbuminuria o proteinuria) se estimó en 29,61h para varones y en 71,17h para mujeres (intervalo de edad de 12–70 años). ARTICLE IN PRESS 66 A.J. Benı́tez Estévez, M. Calvo Malvar Tabla 3 Clasificación de pacientes según estadio de la nefropatı́a diabética Varón Sin nefropatı́a (o30 mg/g) Microalbuminuria (30–300 mg/g) Proteinuria (4300 mg/g) 1400 1200 1183,74 Mujer 12–70 años 470 años 12–70 años 470 años 326 33 3 120 20 0 370 17 0 208 13 1 1265,49 1000 800 725,94 600 457,8 400 200 0 Varón Mujer 12 – 70 años Figura 2 Varón Mujer > 70 años Coste total acumulado del programa de escrutinio. Discusión Según la Encuesta Nutricional de Canarias 1997–989, la prevalencia de la diabetes mellitus fue de un 6,75% para el conjunto de la población canaria (edad de 6–75 años), siendo del 0,9% para el grupo de edad de 6–24 años y elevándose hasta el 20,9% para el grupo de edad de 65–75 años. Este cambio de la prevalencia de la enfermedad según la edad justifica en cierta medida la variación de la demanda de las pruebas de escrutinio observada en nuestro estudio (fig. 1). El escrutinio de la nefropatı́a diabética puede realizarse mediante la determinación del cociente albúmina/creatinina en una muestra de orina aislada, o cuantificando la excreción urinaria de albúmina en una muestra de orina cronometrada. Este último procedimiento presenta como posible fuente de error una recolección incompleta de la orina durante el tiempo estipulado. La ventaja de la determinación del cociente albúmina/creatinina es que se puede llevar a cabo en cualquier muestra urinaria y los resultados son prácticamente superponibles a los obtenidos con las orinas cronometradas1,6. El programa también contemplaba la posibilidad de llevar a cabo la determinación semicuantitativa de albúmina empleando tiras reactivas de quı́mica sólida pero en ese momento dicha prueba no estaba disponible en el catálogo de pruebas del laboratorio. El análisis de los resultados del programa demuestra que solo se solicitó la determinación del cociente de albúmina/creatinina en el 58,9% de los casos para el intervalo de edad de 12–70. Otra discrepancia hallada es con respecto a la edad de selección de los candidatos para la prescripción de la prueba. Mientras que el procedimiento6 especifica un rango de edad entre 12–70 años, solo el 67,5% de las pruebas de escrutinio se realizaron de acuerdo a él (tabla 3). Incluso, situando el limite superior en 75 años según las recomendaciones de otros grupos de trabajo1, el porcentaje de pruebas correctamente solicitadas alcanzarı́a el 82,3% (tabla 4). Estos resultados nos inducen a pensar que el criterio de la edad del paciente no se tiene en cuenta a la hora de solicitar la prueba de escrutinio por parte del médico de atención primaria. En la figura 2, se puede observar que los costes de las pruebas de escrutinio solicitadas a pacientes por encima de la edad recomendada supusieron aproximadamente un tercio del total de programa. En este sentido, sorprende que el programa6 establezca un intervalo de edad para la solicitud de la prueba de escrutinio. Quizás esto se justifique por el largo curso de la evolución de la nefropatı́a diabética, que hace que resulte ineficiente el empleo de una prueba de escrutinio en pacientes con edades tan avanzadas no mejorando el outcome del paciente (ejemplo, ganancia de años de vida ajustados por calidad). En este caso, existirı́an otras determinaciones analı́ticas que en este caso concreto serı́an más oportunas (por ejemplo, la estimación de la velocidad de filtrado glomerular). Sin embargo, existen diversas recomendaciones internacionales al respecto (American Diabetes Association, National Kidney Foundation) que no establecen puntos de corte por edad a la hora de utilizar una prueba de escrutinio para la detección de la nefropatı́a diabética10–12. En resumen, la auditorı́a demuestra que el grado de cumplimiento con el programa de escrutinio vigente para nuestra comunidad autónoma6 fue más bien bajo (39,7%). Desde un punto de vista de la gestión del laboratorio clı́nico y sin discutir la validez o no de los criterios especificados en el programa, se podrı́a afirmar que existe inadecuación de la demanda. Se está haciendo algo distinto a lo que debiera hacer. La prevención de la evolución de la nefropatı́a diabética se basa fundamentalmente en el cumplimiento de los objetivos de control glucémico del paciente (tabla 5)13–15. Los resultados recogidos por nuestro estudio se presentan en la tabla 6. A partir de los 41 años, solo el 50–60% de los pacientes demostraron un buen control glucémico y entre el 20–25% necesitaron de intervención médica por presentar un control inadecuado. La elaboración de los programas asistenciales se basa en seleccionar las mejores evidencias cientı́ficas que existen sobre el tema, para posteriormente diseñar y desarrollar las intervenciones sanitarias (prevención, diagnóstico y tratamiento). En el caso que nos ocupa, no solo hay que hacer las ARTICLE IN PRESS A propósito de la adecuación de la demanda. Nefropatı́a diabética Tabla 4 67 Clasificación de pacientes según estadio de la nefropatı́a diabética Varón Sin nefropatı́a (o30 mg/g) Microalbuminuria (30–300 mg/g) Proteinuria (4300 mg/g) Tabla 5 12–75 años 475 años 12–75 años 475 años 386 41 3 60 12 0 462 21 1 116 9 0 Criterios de control glucémico Glucemia en ayunas (mg/dl) HbA1c (%) Tabla 6 EDAD (años) o25 26–40 41–55 56–70 471 Mujer Normal Objetivo Intervenir o110 o6 80–120 o7 o80 o 4140 48 Grado de cumplimiento con el objetivo glucémico según cifras de HB1Ac HBA1c (varones) HB1Ac (mujeres) o7% 7–8% 48% o7% 7–8% 48% 4 27 62 115 74 0 3 25 45 35 1 3 19 57 31 11 27 51 127 105 2 2 11 60 60 4 3 23 68 56 (80,0%) (81,8%) (58,5%) (53,0) (52,9%) (0,0%) (9,1%) (23,6%) (23,6%) (25,0%) cosas correctas (prescribir la prueba de escrutinio) sino hacer correctamente las cosas correctas (selección de pacientes, tipo de determinación, frecuencia de la solicitud, etc.). Solo a través de la adecuación de la demanda podremos llegar a ser eficientes en la atención sanitaria. Para finalizar se puntualizan algunas de las limitaciones del estudio: Para efectuar correctamente el diagnóstico de excreción urinaria aumentada de albúmina se deberá descartar, entre otros procesos: las infecciones urinarias, la fiebre, la insuficiencia cardiaca, las descompensaciones metabólicas y el ejercicio intenso. Mientras que el perfil de control diabético incluye el urinocultivo, eliminar otras causas de incremento de la excreción urinaria de albúmina no ha sido posible. Existen diversos trabajos que analizan los costes de la diabetes mellitus16. Sin embargo, las estimaciones de los mismos varı́an sustancialmente según se incluyan o no los diferentes apartados que conforman tanto los costes directos como indirectos. A tı́tulo de ejemplo, el estudio de CODE-217 fijó el coste de la determinación de la albúmina en orina en 14,78h, cifras muy superiores a las presentadas en nuestro estudio. Conflicto de intereses Los autores declaran no tener ningún conflicto de intereses. (20,0%) (9,1%) (17,9%) (26,3%) (22,1%) (64,7%) (84,4%) (60,0%) (49,8%) (47,5%) (11,8%) (6,3%) (12,9%) (23,5%) (27,1%) (23,5%) (9,4%) (27,1%) (26,7%) (25,3%) Bibiografı́a 1. Asociación Española de Nefrologı́a Pediátrica, Sociedad Española de Diabetes, Sociedad Española de Endocrinologı́a y Nutrición, Sociedad Española de Hipertensión Arterial, Liga Española para la Lucha Contra la Hipertensión Arterial, Sociedad Española de Medicina Familiar y Comunitaria, Sociedad Española de Medicina Rural y Generalista. Sociedad Española de Nefrologı́a. Documento de consenso 2002 sobre pautas de detección, prevención y tratamiento de la nefropatı́a diabética en España. Nefrologı́a. 2002;22:521–30. 2. Steinke JM, Sinaiko AR, Kramer MS, Suissa S, Chavers BM, Mauer M. The early natural history of nephropathy in type 1 diabetes. III. Predictors of 5-year urinary albumin excretion rate patterns in initially normoalbuminuric patients. Diabetes. 2005;54: 2164–71. 3. Stone ML, Graig ME, Chan AK, Lee JW, Verge CF, Donaghue KC. Natural history and risk factors for microalbuminuria in adolescents with type 1 diabetes. A longitudinal study. Diabetes Care. 2006;29:2072–7. 4. Bruno G, Merletti F, Biggeri A, Bargero G, Ferrero S, Pagano G, et al. Progresión to overt nephropaty in type 2 diabetes. Diabetes Care. 2003;26:2150–5. 5. Retnakaran R, Cull CA, Thorne KI, Adler AI, Holman RR. Risk factors for renal dysfuntion in type 2 diabetes. UK Prospective Diabetes Study 74. Daibetes. 2006;55:1832–9. 6. Atención Primaria. Servicio Canario de Salud. Diabetes. Control y seguimiento. http://www.gobiernodecanarias.org/ sanidad/scs/6/6_1/cardiovascular/diabetes/dbtes_control.jsp. [Consulta 2007-06-30]. ARTICLE IN PRESS 68 7. American Diabetes Association. Standards of Medical Care in Diabetes. Diabetes Care. 2005;28(Suppl 1):S4–36. 8. Benı́tez Estévez AJ, Calvo Malvar M. Implantación y desarrollo del sistema de los costes de la calidad en el laboratorio clı́nico. Quı́mica Clı́nica. 1999;18:5–18. 9. Servicio del Plan de Salud e Investigación del Servicio Canario de Salud. Encuesta Nutricional de Canarias 1997–1998. Volumen 2: Factores de riesgo cardiovascular. Consejerı́a de Sanidad y Consumo. Santa Cruz de Tenerife, 1999. 10. American Diabetes Association. Nephropathy in diabetes. Diabetes Care. 2004;27(Suppl 1):S19–83. 11. Kidney Disease Outcomes Quality Initiative. National Kidney Foundation. Part 5. Evaluation of Laboratory Measurements for Clinical Assessment of Kidney Disease. Am J Kidney Dis. 2002;39(Suppl 2):S76–110. 12. Eknoyan G, Hostetter T, Bakris GL, Hebert L, Levey AS, Parving HH, et al. Proteinuria and other markers of chronic kidney disease: a position statement of the National Kidney Foundation (NKF) and the national institute of diabetes and A.J. Benı́tez Estévez, M. Calvo Malvar 13. 14. 15. 16. 17. digestive and kidney diseases (NIDDK). Am J Kidney Dis. 2003; 42:617–22. The Diabetes Control and Complications Trial Research Group. The effect of intensive treatment of diabetes on the development and progression of long-term complications in insulindependent diabetes mellitus. N Engl J Med. 1993;329:977–86. Levin SR, Coburn JW, Abraira C, Henderson WG, Cowell JA, Emanuele NV, et al. Effect of intensive glycemic control on microalbuminuria in type 2 diabetes. Diabetes Care. 2000;23: 1478–85. Meigs JB, D’Agostino RB, Nathan DM, Rifai N, Wilson PWF. Longitudinal association of glicemia and microalbuminuria. Diabetes Care. 2002;25:977–83. López Bastida J, Serrano Aguilar P, Duque González B. Los costes económicos de la diabetes mellitus. Aten Primaria. 2002;29: 145–50. Mata M, Antoñanzas F, Tafalla M, Sanz P. El coste de la diabetes tipo 2 en España. El estudio CODE-2. Gac Sanit. 2002;16: 511–20. ARTICLE IN PRESS Rev Lab Clin. 2010;3(2):69–75 Revista del Laboratorio Clínico www.elsevier.es/LabClin ORIGINAL Estudio retrospectivo de 1.193 componentes monoclonales detectados en Palma de Mallorca Isabel Llompart Alabern, Elena Maffiotte Oramas, Mar Belmonte Campayo, Bernadı́ Barcelo Martı́n, Beatriu Riera Bestard y Pilar Sastre Alzamora Servicio de Análisis Clı́nicos, Hospital Universitario Son Dureta, Palma de Mallorca, España Recibido el 19 de noviembre de 2008; aceptado el 23 de diciembre de 2009 Disponible en Internet el 10 de abril de 2010 PALABRAS CLAVE Incidencia; Gammapatı́as monoclonales; Mieloma múltiple Resumen Introducción: El objetivo del estudio es realizar un análisis retrospectivo de los componentes monoclonales nuevos detectados durante los años 2004, 2005 y 2006 en el Laboratorio del Carmen, dependiente del Servicio de Análisis Clı́nicos del Hospital Universitario Son Dureta. Material y métodos: El material son los datos obtenidos de los pacientes a los que se realiza un proteinograma en el Laboratorio del Carmen durante los años 2004–2006. Se realizó un estudio epidemiológico de tasa de incidencia de componentes monoclonales (CM) en Baleares, su distribución, edad y sexo de los pacientes. También se registraron los isotipos de CM, ası́ como determinados parámetros analı́ticos como proteı́nas, hemoglobina, albúmina, creatinina, concentración de inmunoglobulinas. Se clasificaron los diagnósticos de los pacientes en función del tipo de patologı́a más frecuente asociado al CM. Resultados: Durante estos años, se atendieron en el laboratorio del Carmen 696.115 pacientes pertenecientes al Área Sanitaria de Mallorca, realizándose 83.305 electroforesis de proteı́nas séricas (11,96%), de los cuales solo el 1,43% obtuvo un resultado de inmunofijación electroforética positivo. La tasa de incidencia global es de 70,98 casos nuevos/100.000 habitantes/año. En el 62,8% de los pacientes con presencia de CM no consta ningún diagnóstico. & 2008 AEBM, AEFA y SEQC. Publicado por Elsevier España, S.L. Todos los derechos reservados. Autor para correspondencia. Correo electrónico: Isabel.llompart@ssib.es (I. Llompart Alabern). 1888-4008/$ - see front matter & 2008 AEBM, AEFA y SEQC. Publicado por Elsevier España, S.L. Todos los derechos reservados. doi:10.1016/j.labcli.2009.12.004 ARTICLE IN PRESS 70 I. Llompart Alabern et al KEYWORDS Incidence; Monoclonal gammopathies; Multiple myeloma Restrospective study of 1.193 monoclonal gammopathies detected in Palma of Mallorca Abstract Introduction: The aim of this study is to carry out a retrospective analysis of monoclonal gammopathies detected during the period of 2004, 2005 and 2006 in the ‘‘El Carmen’’ laboratory, which is part of the Clinical Laboratory of Son Dureta Hospital. We studied the most important aspects related to these patients and the study of the monoclonal gammopathies detected. Material and methods: An epidemiological study was carried out on all the data, in order to find the incidence of monoclonal gammopathies, as well as its distribution, and the age and sex of the patients. We also studied the immunochemical types of the monoclonal components, as well as some analytical parameters. The patient diagnosis was classified according to the most common pathology associated to the monoclonal component. Results: During these years, 696,115 patients belonging to the Healthy Area of Mallorca were seen in the ‘‘El Carmen’’ laboratory and 83,305 (11.96%) serum protein electrophoreses were performed. Only 1.43% had a positive result with electrophoretic immunofixation. The overall incidence was 70.98 new cases/100,000 inhabitants/year. The majority of patients (62.8%) with a monoclonal component had no diagnosis. & 2008 AEBM, AEFA y SEQC. Published by Elsevier España, S.L. All rights reserved. Introducción Las gammapatı́as monoclonales (GM) expresan el producto de la proliferación de un clono de células plasmáticas escapado al control normal de la homeostasis inmunoglobulı́nica. Estas células producen inmunoglobulinas (Ig) normales o sus fragmentos, cuyo aumento en sangre se detecta por la aparición de una banda homogénea en el trazado electroforético (componente monoclonal [CM])1. Sin lugar a dudas, el mayor interés clı́nico de las GM estriba en dos hechos: a) la posibilidad de encontrar bajo un común denominador, el CM, patologı́as tan dispares como una neoplasia o una infección, cuyo abordaje clı́nico-terapéutico difieren radicalmente; b) la diferente evolución de una GM, que puede mantenerse de forma estable a lo largo de los años, o bien corresponder a la fase inicial preclı́nica de un mieloma múltiple (MM), o una macroglobulinemia de Waldenstrom2. La GM más frecuente es la denominada GM de significado incierto (GMSI) caracterizada por una concentración de la proteı́na monoclonalo30 g/l, un porcentaje de células plasmáticas en médula óseao10% y carencia de sintomatologı́a clı́nica3,4. La prevalencia de la GMSI es de un 3%, en la población mayor de 50 años, y aumenta con la edad alcanzando una tasa de 10% en población mayor de 85 años5. Actualmente, se considera que la GMSI constituye una etapa premaligna del MM6. En los trabajos realizados en población española7, la probabilidad de que una GMSI evolucione a gammapatı́a maligna (GMM) era de un 8,5% a los 5 años y de un 19,2% a los 10 años; Kyle et al8,9, en estudios con mayor número de pacientes y mayor número de años de seguimiento, concluı́an que el riesgo de progresión a gammapatı́a maligna era del 10%, a los 10 años; del 21%, a los 20 años, y del 26%, a los 25 años, siendo la patologı́a que con más frecuencia se desarrollaba el MM. Por su parte el MM, aproximadamente el 1,1% de todos los tipos de cánceres y entre el 10–15% de los de tipo hematológico, posee el ı́ndice de mortalidad más elevado de todos los cánceres4. Ası́, si consideramos que el MM es una enfermedad grave con una media de supervivencia desde el diagnóstico de 33 meses, según reflejó Kyle10, podemos afirmar que la detección, tipificación y el seguimiento de los pacientes con GM es de gran importancia. Debido a que no existen parámetros que permitan predecir la transformación de una GMSI a gammapatı́a maligna, solo el control clı́nico-biológico periódico nos permitirá valorar la evolución de los pacientes y si tenemos en cuenta que la detección y monitorización del CM precisa de métodos electroforéticos, el laboratorio está en una situación privilegiada para obtener la información de la incidencia, distribución y evolución de los pacientes con GM y, por ello, debe tener una actitud activa en el estudio de las GM. No es fácil conocer la frecuencia de GM en una zona geográfica, por la dispersión existente para su detección entre los diversos servicios clı́nicos relacionados con esta patologı́a: Hematologı́a, Geriatrı́a, Laboratorio Clı́nico, Medicina Interna, Atención Primaria, etc. El Laboratorio del Carmen realiza los proteinogramas procedentes de la red de asistencia primaria correspondiente a 120 centros de salud y unidades básicas y, también, los proteinogramas procedentes del Hospital Universitario Son Dureta. El objetivo del trabajo es realizar un estudio retrospectivo de los CM nuevos detectados durante los años 2004, 2005 y 2006 en el Laboratorio del Carmen revisando los aspectos más relevantes en relación a estos pacientes y el estudio de GM detectadas. Material y métodos Población estudiada La población a estudio la constituyen los 560.202 habitantes que tienen como referencia al Laboratorio del Carmen, dependiente del Hospital Universitario Son Dureta (Palma de Mallorca). ARTICLE IN PRESS Estudio retrospectivo de componentes monoclonales detectados en Palma de Mallorca En función de las áreas de salud establecidas por el Instituto Balear de la Salud se ha realizado una división en 7 áreas geográficas. Si consideramos la población atendida, podemos definir siete zonas. Zona I: Palma (incluye Hospital Universitario Son Dureta), que atiende a una población de 346.720 habitantes. Zona II (oeste): con una población de 49.560 habitantes. Zona III (norte I): 24.692 habitantes. Zona IV (norte II): 40.691 habitantes. Zona V (Raiger): 39.230 habitantes. Zona VI (Pla): 30.691 habitantes. Zona VII (sur): una población de 28.618 habitantes. Las peticiones analı́ticas tienen diversa procedencia: pacientes atendidos en los centros de salud de Atención Primaria, en Consultas Externas de Atención Especializada, o pacientes del Hospital Universitario Son Dureta. Se recogieron, de forma retrospectiva, los datos de los 1.193 pacientes a los que se detectó y confirmó por primera vez un CM durante el periodo de 2004–06. La información incluida en una base de datos informatizada fue, el nombre del paciente, sexo, año de nacimiento, número de centro de salud y/o unidad básica de salud y/o Hospital Son Dureta, la fecha de detección del CM, tipo de CM, concentración de las Ig G, Ig A, Ig M, diagnóstico concentración de hemoglobina, proteı́na total, albúmina y creatinina. Solo se reflejó en la base de datos los CM nuevos, no se incluyen las visitas repetidas de los pacientes. Obtención de muestras Se extrajeron 20 cc de sangre venosa, obtenida en sistema de vacı́o sin aditivo. Posteriormente, se dejó coagular a temperatura ambiente y se centrifugó a 3.000 rpm durante 10 min, para obtener el suero en el que se realizaron las determinaciones. No se procesaron muestras de plasma para evitar la presencia de fibrinógeno que presenta movilidad electroforética similar a la de algunas Ig. 71 En el análisis estadı́stico, se realizó el test de KolmogorovSmirnov y la prueba T de Student para comparar los parámetros entre los grupos diagnósticos MM y GMSI. Todos los análisis estadı́sticos fueron llevados a cabo con el programa SPSS para Windows (Versión 11.0), y se consideró que existı́a significación estadı́stica cuando po0,05. Resultados En los años 2004, 2005 y 2006 se atendieron a 696.115 pacientes, el 52,6% eran hombres y el 47,4% mujeres, con una edad media de 69 años. Los proteinogramas realizados en función de las distintas zonas geográficas quedan reflejados en la tabla 1. En total, se realizaron 83.305 EPS, lo que significa que se solicitó una EPS al 11,96% de los 696.115 pacientes. Se tipificaron por inmunofijación 1.193 CM, por lo que la frecuencia de los CM nuevos detectados en los 83.305 EPS fue de 1,43% (tabla 2). Los resultados en función de las diferentes áreas geográficas divididas quedan reflejado en la figura 1. La tasa de incidencia global para la población dependiente del Laboratorio del Carmen, 560.202 habitantes es de 70,98 casos nuevos/100.000 habitantes/año. La incidencia en las 7 áreas queda reflejada en la figura 2. La tipificación por inmunofijación de los CM detectados queda reflejada en la tabla 3. En referencia a la cuantificación de Ig los resultados de imprecisión intraserie/interserie son inferiores al 5,6% para todas las concentraciones de Ig11. Tabla 1 Número de proteinogramas realizados por zonas geográficas y años Métodos analı́ticos 2004 La concentración de proteı́na total en suero se cuantificó mediante el método de Biuret, la albúmina por método colorimétrico con verde de bromocresol, y creatinina por método de Jaffé cinético. Todas las determinaciones bioquı́micas se realizaron en el analizador Advia 2.400 (Bayer Diagnostics). La hemoglobina se cuantificó por el método de la cianmetahemoglobina en el analizador ADVIA 120 (Bayer Diagnostics). La electroforesis de las proteı́nas séricas (EPS) se realizó mediante electroforesis capilar, utilizando el analizador Paragon CZE 2.000 (Beckman-Coulter Instruments). La cuantificación de las Ig G, A y M se llevó a cabo en el nefelómetro Immage, mediante inmunonefelometrı́a cinética siguiendo las instrucciones del fabricante y utilizando los reactivos suministrados por (Beckman-Coulter Instruments). La identificación del CM se realizó por inmunofijación sobre gel de agarosa (Helena). Métodos estadı́sticos Se ha utilizado el método epidemiológico descriptivo, usando como marcador la tasa de incidencia de los nuevos CM detectados en el laboratorio durante los años 2004–2006. Zona I (346.720 hab.) Zona II (49.560 hab.) Zona III (24.692 hab.) Zona IV (40.691 hab.) Zona V (39.230 hab.) Zona VI (30.691 hab.) Zona VII (28.618 hab.) Total 18.239 2.234 778 3.103 2.889 1.292 2.286 30.821 2005 14.540 2.602 782 2.270 2.756 1.208 1.374 25.532 2006 TOTAL 15.589 48.368 2.085 6.921 936 2.496 2.160 7.533 3.366 9.011 1.376 3.876 1.440 5.100 26.952 83.305 Tabla 2 Pacientes atendidos, proteinogramas e inmunofijaciones positivas 2004 2005 2006 Total Pacientes EPS IFEþ IFEþ/EPS (%) 235.570 223.670 236.875 696.115 30.821 25.532 26.952 83.305 443 419 331 1.193 1,44 1,64 1,22 1,43 EPS: electroforesis de proteı́nas séricas; IFEþ: inmunofijación positiva. ARTICLE IN PRESS 72 I. Llompart Alabern et al Si consideramos el valor de referencia de las Ig G: 700–1.600 mg/dl; Ig A: 70–400 mg/dl, e Ig M: 40–230 mg/dl, el resultado de las Ig en función del tipo de CM queda reflejado en la tabla 4. Se realiza el estudio de los parámetros analı́ticos, hemoglobina, albúmina, proteı́nas totales y creatinina, en los 2 grupos diagnósticos de MM y GMSI. Al comparar las medias para los grupos MM y GMSI, no se encontraron diferencias estadı́sticamente significativas para ninguno de los parámetros estudiados (po0,05), excepto para la hemoglobina. (tabla 5). En el 62,8% de los pacientes con presencia de CM no consta ningún diagnóstico. En el resto de pacientes, el diagnóstico de los pacientes se ha clasificado en función de las enfermedades que con mayor frecuencia están Zona IV (1,15%) Zona III (1,81%) Zona V (1,30%) Zona II (1,14%) relacionadas con la presencia de un CM. Los resultados quedan reflejados en la figura 3. Si establecemos una diferenciación entre aquellos pacientes con diagnóstico de carácter no hematológico y los clasificamos según las patologı́as que con mayor frecuencia presentan CM, los resultados quedan reflejados en la figura 4. Discusión El diseño experimental posiblemente no es el método más adecuado para un estudio epidemiológico, porque la selección de pacientes no se ha realizado al azar y, por tanto, está condicionado por la frecuencia con que los clı́nicos solicitan proteinogramas. De todas maneras, las muestras pueden dar una idea aproximada del Área Sanitaria de Mallorca, porque tienen tan diversa procedencia como revisiones rutinarias solicitadas en el centro de salud por el médico de cabecera a pacientes sin ninguna clı́nica, pacientes de Consultas Externas, Urgencias o pacientes ingresados en el Hospital Universitario Son Dureta. Tabla 4 Resultado de Inmunoglobulinas en función del tipo de CM Zona VI (1,38%) Zona I (1,84%) Zona VII (1,44%) Figura 1 Porcentaje de resultados de inmunofijaciones positivas respecto al n.1 de proteinogramas realizados según la zona geográfica. 120 100 80 107 Ig implicada elevada Ig implicada elevada y descenso de al menos una de las otras G A M 28,7% 86,0% 85,0% 37,5% 48,0% 25,5% CM: componente monoclonal; Ig: inmunoglobulina. Tabla 5 85 60 Tipo CM Resultados de parámetros analı́ticos 84 52 61 GMSI 66 55 Hb PT Albúmina Creatinina 40 20 0 Zona I Figura 2 Tabla 3 IgG k (%) IgG l (%) CB (%) CT (%) Zona II Zona III Zona IV Zona V Zona VI Zona VII Tasa de incidencia según la zona geográfica. MM n M7SD n M7SD 72 58 69 57 13,671,8 73,075,7 36,875,3 1,070,4 35 31 28 33 11,672,3 72,0713,1 38,574,6 1,471,4 Hb: hemoglobina; GMSI: gammapatı́a monoclonal de significado incierto; M: media; MM: mieloma múltiple; PT: proteı́na total; SD: desviación estandar. Distribución de isotipos de paraproteı́nas detectadas por inmunofijación 404 304 93 6 (30,3) (22,8) (7,0) (0,4) IgA k (%) IgA l (%) B. Oligo (%) C LL (%) 108 98 10 7 (8,1) (7,3) (0,7) (0,5) IgM k (%) IgM l (%) CP (%) 112 (8,4) 59 (3,7) 1 (0,07) B. Oligo: bandas oligoclonales; CB: componente biclonal; CLL: cadenas ligeras libres; CP: cadenas pesadas; CT: componente triclonal. ARTICLE IN PRESS Estudio retrospectivo de componentes monoclonales detectados en Palma de Mallorca Enf. Lipoproliferativas (2%) MW (0,75%) Amiloidosis (0,5%) Enf. Cadenas ligeras (0,5%) Plasmocitoma (0,5%) Otras hematológicas (3%) MM MGUS No hematológicas Figura 3 Distribución de los componentes monoclonales diagnosticados. 12% 19% 12% 43% 8% Hepatopatías Neoplasias Infecciones Neuropatías Otros Cardiopatías 6% Figura 4 Distribución de los componentes monoclonales asociados a patologı́as no hematológicas. El análisis de los 1.193 pacientes con presencia de CM nos permite valorar que es un grupo heterogéneo con edades entre 18–107 años en el que predominan los mayores de 40 años siendo la edad media del grupo estudiado de 69 años. La frecuencia de detección de gammapatı́as ha aumentado en la práctica, debido a la generalización de los estudios electroforéticos y a la utilización de sistemas de separación proteica cada vez más sensibles, precisos y fiables2. Hasta el año 1999, el Laboratorio del Carmen realizaba la electroforesis de proteı́nas sobre soporte de acetato de celulosa y se realizó un trabajo similar al actual obteniendo una tasa de detección de CM de 26,00 casos nuevos/100.000 habitantes/año12. En el trabajo desarrollado actualmente, la tasa de detección de CM es de 70,98 casos nuevos/100.000 habitantes/año. Este incremento tan importante se debe principalmente al mayor número de EPS realizadas y a la mejor resolución aportada por la electroforesis capilar. La tasa de incidencia global obtenida por nuestro laboratorio 70,98 casos nuevos/100.000 habitantes/año es muy similar a la obtenida por Maiz et al13, que hallan una incidencia de 67,8/ 100.000 habitantes/año. Sin embargo, son datos muy superiores a los obtenidos por Giraldo et al en Zaragoza2 con una incidencia de 36/100.000 habitantes/año, o Bergon et al14 en Madrid, con una incidencia de 10,1/100.000 habitantes/año. Posiblemente, la similitud de datos obtenidos con Maiz et al es debida a que la 73 selección del tipo de pacientes es muy similar, al igual que el elevado número de proteinogramas realizados 93.880 EPS, en el trabajo de Maiz et al, y 83.305 EPS, en el nuestro. El porcentaje de inmunofijaciones positivas con respecto al número de proteinogramas realizados es de 1,43%. La conclusión que podemos obtener de este dato es el elevado número de proteinogramas realizados sin una significación clı́nica relevante. La explicación está muy relacionada con la población seleccionada, lo que ha provocado una reacción por parte del laboratorio que mediante una campaña de concienciación a los médicos de atención primaria ha recomendado la solicitud del proteinograma solo en los casos de sospecha de GM. Esta acción ha provocado un descenso importante del número de proteinogramas solicitados en la actualidad de forma que (a falta de una valoración más profunda), podemos afirmar que el porcentaje de inmunofijación electroforética positivo obtenidos frente a los EPS solicitados en estos momentos, es muy superior al que publicamos en el trabajo actual. La tasa de incidencia según la zona geográfica es similar en todas ellas a excepción de las zonas I, V y VII. La zona I presenta la mayor población asignada y por tanto mayor n.1 de proteinogramas realizados lo que podrı́a explicar la elevada tasa de detección. Sin embargo para las zonas V y VII con una población asignada similar al resto de zonas (desde II-VII) la tasa de detección es superior, lo que exige un estudio del tipo de población adscrita a estas zonas. Si tenemos en cuenta que la incidencia es superior en raza negra, población de mayor edad y sexo varón15 podemos determinar que teniendo en cuenta que la tasa de varones y edad media es muy similar en todas las zonas, estos 2 factores no podrı́an explicar esta incidencia superior para las zonas V y VII. Por ello, podrı́amos pensar que una tasa de inmigración superior en esta zona podrı́a explicar la elevada incidencia. Actualmente, Atención Primaria en Baleares no tiene adscrita un número de historia clı́nica y, por tanto, un estudio de caracterı́sticas demográficas es complejo por lo que la justificación de las diferentes tasas de incidencia serán objeto de un estudio posterior. La distribución de CM detectados coincide con la publicada por trabajos de otros autores2,4,13 donde el CM más frecuente es el de Ig G kappa seguido de Ig A e Ig M. Los resultados obtenidos sobre la concentración de Ig en función del CM detectado, implican que ante la sospecha de un CM de tipo Ig A o CM de IgM, la concentración elevada de esa Ig A o Ig M (en ausencia de otras situaciones clı́nicas de carácter inflamatorio/infeccioso) permite sospechar la posible presencia de ese CM, ya que en el 86% de CM de tipo IgA la concentración de esta Ig está por encima de los valores de referencia, al igual que ocurre con los CM de tipo IgM en los que el valor de IgM está elevada en el 85% de los casos. Sin embargo, el valor de IgG no es un dato discriminante ante la sospecha de un CM IgG ya que solo en el 28,7% de los casos, la IgG está por encima del rango de referencia. Al estudiar conjuntamente en un CM el aumento de la Ig implicada y el descenso de las otras dos como signo de mayor invasión medular y pero pronóstico, es en el CM tipo Ig A en el que existe en un 48% de los casos un aumento de la concentración de Ig A conjuntamente con una disminución de la Ig G y /o Ig M. Si observamos que en el 62,8% de los pacientes que presentaban un CM no existe un diagnóstico, podemos afirmar que el hallazgo de este CM fue fortuito y la falta ARTICLE IN PRESS 74 de manifestaciones clı́nicas relacionadas con GM no llevó a estudios posteriores. Actualmente, no existe un protocolo consensuado entre Atención Primaria y Atención Especializada a diferencia de otras comunidades16, por lo que en muchas ocasiones a estos pacientes no se les realiza un estudio diagnóstico completo posterior. En los pacientes que presentaban un diagnóstico relacionado con la presencia del CM, el grupo mayoritario, era el de GMSI y, en segundo lugar, el grupo de pacientes con diagnostico de MM, resultados similares a los publicados en la bibliografı́a general sobre CM. Sin embargo, contrariamente a lo observado en otros estudios, al analizar nuestros valores para albúmina, proteı́na y creatinina, no encontramos diferencias estadı́sticamente significativas. Una posible explicación a este hecho podrı́a ser que nuestros datos corresponden al momento del diagnóstico de MM y GMSI. Sin embargo, en otros estudios similares, los autores realizan un seguimiento evolutivo a largo plazo de los pacientes estudiados, razón por la cual aparecen diferencias estadı́sticamente significativas entre ambos grupos (MM y GMSI) para los distintos parámetros estudiados. En nuestro caso, el único parámetro donde encontramos diferencias significativas, es la hemoglobina, pero esto podrı́a ser debido a la diferencia de valores de ésta entre el sexo masculino y femenino. A pesar de que se han introducido nuevos tipos de tratamiento, el MM es una enfermedad incurable y, dado que la concentración de la Ig monoclonal está relacionada directamente con la masa del clon de células que la produce (con excepción del mieloma no secretor), el CM constituye un marcador bioquı́mico esencial tanto en el momento del diagnóstico del MM17,18, como en la monitorización y en la evaluación de la respuesta al tratamiento4. Ası́, es muy importante que el laboratorio disponga de un fichero para registrar los datos evolutivos del paciente19, siendo fundamental reflejar en la ficha del paciente la cuantificación del CM realizada por densitometrı́a siempre que el tipo de CM lo permita15, de forma que la concentración del CM adquiere el significado de marcador tumoral para el seguimiento de estos pacientes. Del resto de pacientes cuyo CM se asoció a un diagnóstico sin relación con patologı́a hematológica, el grupo mayoritario lo constituı́an los pacientes que presentaban una hepatopatı́a, neoplasia o cardiopatı́a, al igual que el trabajo publicado por Giraldo et al2, confirmando la detección de estos CM de forma fortuita, que posiblemente tendrán un carácter transitorio, dato a evaluar con el seguimiento posterior de estos pacientes. Conclusión La detección y monitorización del CM precisa de métodos electroforéticos, lo que sitúa al laboratorio en una situación privilegiada para obtener la información de la incidencia, distribución y evolución de los pacientes con GM y debe provocar una actitud activa en el estudio de las GM. Parece existir una mayor incidencia de CM en la isla de Mallorca que en otras zonas de la geografı́a española, lo que podrı́a hacer pensar en la posible existencia de factores de riesgo que provoquen esta elevada casuı́stica. La tasa de incidencia superior en las zonas V y VII precisa de estudios posteriores que permitan explicar este hecho. I. Llompart Alabern et al La petición del proteinograma en población general no tiene justificación, por lo que es imprescindible que el laboratorio adopte medidas para racionalizar la solicitud de proteinogramas al laboratorio (estas medidas ya se han tomado y ha descendido considerablemente el número de proteinogramas solicitados). Es imprescindible elaborar un protocolo de estudio de CM entre Atención Primaria, Atención Especializada y los servicios de Análisis Clı́nicos e Inmunologı́a. Los resultados obtenidos en cuanto al diagnóstico de los pacientes son similares a los publicados por otros autores. Conflicto de intereses Los autores declaran no tener ningún conflicto de intereses. Bibliografı́a 1. Garcı́a M, Borque L. Sociedad Española de Bioquı́mica Clı́nica y Patologı́a Molecular. Comisión de Proteı́nas. Recomendaciones para el estudio de las gammapatı́as monoclonales en suero. Quı́mica Clı́nica. 2000;19:214–8. 2. Giraldo MP, Rubio-Félix D, Perella M, Gracia JA, Verruga JM, Giralt M. Gammapatı́as monoclonales de significado indeterminado. Aspectos clı́nico, biológicos y evolutivos de 397 casos. Sangre. 1991;36:377–82. 3. Durie BGM, Kyle RA, Belch A, Bensinger W, Bladé J, Boccadoro M, et al. Myeloma Management Guidelines: a consensus report from the Sicentific Advisors of the Internacional Myeloma Foundation. The Hematology Journal. 2003;4:397–8. 4. The Internacional Myeloma Working Group. Criteria for the classification of monoclonal gammopathies, multiple myeloma, and related disorders. A report of the International Myeloma Working Group. British Journal of Haematology. 2003;121: 749–57. 5. Kyle RA, Therneau TM, Rajkumar SV, Larson DR, Plevak BS, Offord JR. Prevalence of monoclonal gammopathy of undetermined significance. N Engl J Med. 2006;354:1362–9. 6. Steingrimsdottir H, Haraldsdottir V, Olaffson I, Gudnason V, Ogmundsdottir H. Monoclonal gammopathy: natural history studied with a restrospective approach. Haematologica. 2007;92:1131–4. 7. Bladé J, López-Guillermo A, Rozman C, Cervantes F, Salgado C, Aguilar JL, et al. Malignant transformation and life expectancy in monoclonal gammopathy of undetermined significance of undetermined significance. Br J Haematol. 1992;81:391–4. 8. Kyle RA, Rajkumar S, Vincent. Monoclonal gammopathy of undetermined significance and smouldering multiple myeloma: emphasis on risk factors for progression. Br J Haematol. 2007;139:730–43. 9. Kyle RA, Rajkumar S. Monoclonal gammopathies of undetermined significance: a review. Inmunological reviews. 2003;194: 112–139. 10. Kyle RA, Gertz MA, Witzig TE, Lust JA, Lacy MQ, Dispenzieri A, et al. Review of 1027 patients with newly diagnosed Multiple Myeloma. Mayo Clin Proceedings. 2003;78:21–33. 11. Llompart Alabern I, Fuentespina Vidal E, Font Tomás C, Riera Bestard B, Garcı́ia Raja A. Evaluación del nefelómetro Immage para la cuantificación de inmunoglobulinas IgG, IgA, IgM, y de proteı́na C reactiva. Analisis Clinicos. 2001;26:109–26. 12. Llompart I, Guix P, Quetglas P, Sastre P, Elorza MA, Fuentespina E. Estudio de gammapatı́as monoclonales en el área sanitaria de Mallorca en los últimos 8 años (1992–1999). Análisis Clı́nicos 2000; Libro de ponencias y comunicaciones cientı́ficas del IX Congreso Nacional del Laboratorio Clı́nico. S-34: 72. ARTICLE IN PRESS Estudio retrospectivo de componentes monoclonales detectados en Palma de Mallorca 13. Maiz D, Bal MJ, Fraga D, Bulnes MJ, López A, Arroyo JC. Incidencia de gammapatias monoclonales en el área sanitaria de Lugo durante los años 1994 a 2004. Quı́mica Clı́nica. 2006;25:397–402. 14. Bergón E, Bergón M. Retrospective study of monoclonal gammopathies detected in the clinical laboratory of a spanish healthcare district: 14-year series. Clin Chem Lab Med. 2007;45:190–6. 15. Singh J, Dudley A, Kulig K. Increased incidence of monoclonal gammopathy of undetermined significance in blacks and its agerelated differences with whites on the basis of a study of 397 men and women in a hospital setting. J Lab Clin Med. 1990;116:785–9. 75 16. Amor M, Sanchez P, Diez M, Batlle F, Martı́nez A. Gammapatı́as monoclonales. Guı́as Clı́nicas. 2006;6:1–2. 17. Durie BGM, Harrousseau JL, San Miguel J, Bladé J, Barlogie B, Anderson K, et al. International uniform response criteria for multiple myeloma. Leukemia. 2006;20:1467–73. 18. Durie BG, Jacobson J, Barlogie B, Crowley J. Magnitude of response with myeloma frontlinetherapy does not predict outcome: importance of time of progression in southwest oncology group chemotherapy trials. J Clin Oncol. 2004;22: 1857–63. 19. Bergon E, Garcı́a L. Frecuencia de gammapatias monoclonales en una muestra no seleccionada. Quim. Clin. 1997;16:135–41. ARTICLE IN PRESS Rev Lab Clin. 2010;3(2):76–79 Revista del Laboratorio Clínico www.elsevier.es/LabClin NOTA TÉCNICA Cáncer medular de tiroides familiar: importancia del estudio molecular en el diagnóstico Sara Lópeza,, Ana Cerezoa, Mubarak Alramadanb y Marı́a Dolores Hernándeza a Servicio de Análisis Clı́nicos, Hospital Virgen de la Luz, Cuenca, España Unidad de Endocrinologı́a, Hospital Virgen de la Luz, Cuenca, España b Recibido el 10 de julio de 2009; aceptado el 2 de marzo de 2010 Disponible en Internet el 15 de abril de 2010 PALABRAS CLAVE Cáncer medular de tiroides familiar; RET; Calcitonina KEYWORDS Familial medullary thyroid cancer; RET; Calcitonin Resumen El cáncer medular de tiroides familiar, neoplasia del tejido tiroideo poco prevalente, tiene su origen en una mutación del protoncogén RET. A continuación describimos un caso de presentación atı́pica y mutación poco frecuente (V804L), en el que la punción aspiración aguja fina y las técnicas de imagen no resultaron concluyentes y fueron las pruebas bioquı́micas y el análisis molecular del gen RET las que permitieron llegar al diagnóstico y establecer el pronóstico del caso ı́ndice y sus familiares. & 2009 AEBM, AEFA y SEQC. Publicado por Elsevier España, S.L. Todos los derechos reservados. Familial medullary thyroid carcinoma: Importance of the molecular analysis in the diagnosis Abstract Familial medullary thyroid cancer (FMTC) is a non-predominant thyroid neoplasia originating from a proto-oncogene RET mutation. The case presented is atypical in its form of presentation, a fairly uncommon mutation (V804L) and does not have conclusive fine-needle aspiration biopsy (FNAB) and image studies. Biochemical and RET molecular analysis has a high diagnostic and predictive value in the index and familial cases. & 2009 AEBM, AEFA y SEQC. Published by Elsevier España, S.L. All rights reserved. Introducción Autor para correspondencia. Correo electrónico: slopezm@sescam.jccm.es (S. López). El cáncer medular de tiroides familiar (CMTF) es una neoplasia poco frecuente de la glándula tiroidea, cuyo origen es el resultado de una mutación en el protoncogén RET. Puede presentarse aisladamente o asociada a otras 1888-4008/$ - see front matter & 2009 AEBM, AEFA y SEQC. Publicado por Elsevier España, S.L. Todos los derechos reservados. doi:10.1016/j.labcli.2010.03.001 ARTICLE IN PRESS Diagnóstico molecular 77 endocrinopatı́as en el MEN21, mostrando un patrón autosómico dominante con penetrancia casi completa y expresividad variable2. A continuación se describe un caso familiar de CMT de presentación atı́pica y mutación infrecuente3, resaltando la importancia de las pruebas moleculares en el diagnóstico y pronóstico del caso ı́ndice y sus familiares. lóbulo tiroideo, de 1 2 cm y 2 1,5 cm, objetivándose mediante TAC cérvicotorácico calcificaciones intranodulares sin evidencia de linfadenopatı́as cérvicomediastı́nicas o axilares. La punción aspiración con aguja fina bajo control ecográfico evidencia varios grupos celulares positivos para calcitonina y negativos para tiroglobulina no determinándose datos de atipia o malignidad celular, sin embargo, la insuficiencia y falta de representatividad de la muestra imposibilita el diagnóstico anatomopatológico de CMT. La PET evidencia una captación compatible con bocio multinodular difuso y el rastreo gammagráfico con somatostatina (OCTREOSCAM) objetiva una asimetrı́a tiroidea con aumento del lóbulo tiroideo izquierdo. Una analı́tica posterior confirma elevación de calcitonina (1.134 pg/ml) y CEA (76,2 ng/ml). Ante el diagnóstico de sospecha de CMT se solicita estudio de mutaciones en el protoncogén RET, detectándose una mutación germinal en heterocigosis que afecta al residuo 804 (V804L) en el exón 14. Tras la confirmación del diagnóstico, se realiza tiroidectomı́a total con linfadenectomı́a cervical radical, evidenciándose en el estudio anatomopatológico posterior, proliferación neoplásica de células C y afectación ganglionar en 3 de los ganglios extirpados. El seguimiento se realiza con calcitonina basal y tras estimulación con gluconato cálcico. Ante la persistencia de niveles elevados de CT tras estimulación varios meses postintervención, se realiza gammagrafı́a tiroidea que confirma presencia de tejido tiroideo residual funcionante y se decide ablación con yodo radiactivo dado que el remanente es pequeño y de difı́cil extirpación. Como se observa en la tabla 1, los valores de calcitonina se normalizan (24 meses postintervención). En la actualidad la paciente permanece estable. Debido a la alta penetrancia de la mutación y para determinar si se trata de un caso esporádico o familiar, se ofrece pruebas de cribado genético a familiares de primer grado por consanguinidad: 2 hermanos presentaron pruebas positivas, 2 hermanas negativas y en uno no se pudieron realizar por haber fallecido (fig. 1). Los no portadores de la mutación fueron excluidos del protocolo de seguimiento. En los casos positivos se continuó Caso clı́nico Mujer de 72 años que acude a consulta de digestivo por molestias abdominales y pérdida de peso en los últimos meses. Antecedentes personales sin interés. Alta prevalencia oncológica en antecedentes familiares (pulmón, gástrico, colon y próstata). Todos los estudios bioquı́micos y radiológicos (ecografı́a abdominal, gastroscopia y colonoscopia) resultan ser normales excepto la determinación de CEA de 40,7 ng/ml. Se solicitan nuevas determinaciones hormonales (gastrina, VIP, catecolaminas, metanefrinas, GH, ACTH, insulina, glucagón, péptido Cy). Estando todas ellas dentro de rango excepto la calcitonina de 858 pg/ml, se decide realizar una interconsulta a endocrino ante la sospecha de tumor neuroendocrino vs. CMT. Dentro de las pruebas de imagen realizadas, destaca la ecografı́a cervical que informa de 2 nódulos, uno en cada Tabla 1 Evolución de la concentración sérica de calcitonina Meses tras IQ 3 8 15 24 28 35 Tiempo (min) 0 1 2 3 5 8 8 5 5 8 8 110 78 59 20 114 69 14 92 58 47 15 80 35 41 13 8 13 20 37 Interpretación: nivel basal o14 pg/ml, nivel más alto de la curva no superior a 30 pg/ml. ? 72 43 11 ? 64 47 7 33 21 25 5 27 38 2 62 68 15 35 11 29 30 1 8m 39 66 40 3 Caso índice Pendiente de informe portador V804L Fallecido sin ser estudiado genéticamente Portador mutación No portador V804L Figura 1 Portadores de la mutación tras estudio molecular del protoncogén RET. ARTICLE IN PRESS 78 S. López et al el estudio molecular en la segunda generación, resultando portadores de la mutación los 2 hijos del caso ı́ndice y los 6 de sus 2 hermanos y no portadores, los 2 hijos del hermano fallecido. Se continúa el estudio en la tercera generación, presentando pruebas positivas uno de ellos, negativas 5 y están pendientes de informe genético, otros 5 que no pertenecen a nuestra área sanitaria. A todos los portadores de la mutación se les realizaron determinaciones de calcitonina basal y tras estimulación que resultaron ser anormalmente altas en el 33–55% de los casos respectivamente. Además para descartar el desarrollo de otras neoplasias asociadas a MEN2 se determinaron catecolaminas y metanefrinas en plasma y orina que resultaron normales en todos los casos. Excepto un hermano del caso ı́ndice, todos los familiares que resultaron ser portadores optaron por la tiroidectomı́a como primera opción y en ellos se confirmó, mediante anatomı́a patológica, hiperplasia neoplásica de células C y CMT. Discusión El CMT constituye el 5–10% de las neoplasias de origen tiroideo1,4 y el único que puede ser diagnosticado por pruebas genéticas. Siendo la esporádica, la forma más frecuente de presentación (75%), resulta de especial interés la forma hereditaria, bilateral y multicéntrica5, cuyo origen es resultado de una mutación germinal en el protoncogén RET. El protoncogén RET, situado en el cromosoma 10 (10q11,2), tiene 21 exones y codifica una proteı́na de la familia de los receptores de membrana con 3 dominios bien diferenciados (fig. 2): uno extracelular altamente conservado (péptido señal N-terminal, cadherin-like y dominio rico en cisteı́nas), otro transmembrana y otro intracelular (tirosin-quinasa)5,6 (fig. 2). La proteı́na RET juega un papel esencial en la migración y desarrollo de los tejidos que surgen de la cresta neural. Está expresado en células C del tiroides, médula adrenal, paratiroides, ganglios simpáticos y parasimpáticos, ganglios GDFN GRF-alfa NH2 Dominios cadherina-like Dominio rico en cisteínas entéricos y tracto urogenital6. Hay 3 isoformas del RET que desempeñan papeles distintos en la diferenciación tisular embrionaria7. Son numerosas las mutaciones conocidas que producen sobreexpresión del protoncogén RET e incremento de la transmisión de señales dando lugar a proliferación celular. Dependiendo de la localización de la mutación se pueden clasificar7,8 en: mutaciones que afectan al dominio extracelular (exones 10 y 11), responsables del 98% de los casos MEN2A y CMTF y mutaciones que afectan al dominio intracelular, responsables del 4% de CMTF exones (13, 14 [V804L mutación de nuestra paciente] y 15) y asociadas exclusivamente a pacientes con MEN2B (exones 15 y 16). El cribado de familiares de 1.er grado que clásicamente se realizaba mediante la determinación de calcitonina basal o tras estimulación9,10, está siendo sustituido por la detección genética de las mutaciones en el protoncogén RET ya que el estudio molecular se ha convertido en el gold estándar como prueba diagnóstica y predictiva del CMT, con sensibilidad y especificidad próximas al 100%11. El caso descrito es un CMT de tipo hereditario, bilateral y multicéntrico, de presentación clı́nica atı́pica, sin disfunción tiroidea, crisis hipertensivas u otros sı́ntomas neuroendocrinos (motivo de consulta: dolor abdominal y pérdida de peso) y una mutación poco frecuente (V804L). Aunque CT y CEA resultan anormalmente elevados, las técnicas de imagen: ecografı́as, TAC, PET y octreoscam, ası́ como la punción aspiración con aguja fina no son concluyentes por lo que el estudio genético del protoncogén RET fue determinante para el diagnóstico de CMT, confirmado por el estudio histológico posquirúrgico. El CMT es la primera manifestación neoplásica en la mayorı́a de los individuos MEN2, de modo que algunas familias han sido incluidas incorrectamente como CMTF con el consiguiente riesgo de no prevenir el feocromocitoma12. Concretamente la mutación V804L ha sido descrita y asociada fundamentalmente con CMTF, pero algunas series han apuntado que puede relacionarse con el desarrollo de feocromocitoma. Las pruebas genéticas y bioquı́micas fueron decisivas en el cribado familiar confirmándose que estamos ante un caso de CMTF con al menos 12 miembros portadores de la mutación, estando 5 pendientes de informe. Agradecimientos Franquelo R, Jefe de Servicio Análisis Clinicos, Hospital V. de la Luz, Cuenca. del Rı́o J.J, Servicio Anatomı́a Patológica, Hospital V. de la Luz, Cuenca. Garcı́a A, Especialista en Inmunologı́a, Hospital V. de la Luz, Cuenca. Dalmau, Marı́a. Dominios tirosin-kinasa Bibliografı́a COOH Figura 2 RET. 1. Sippel RS, Kunnimalaiyaan M, Chen H. Current Management of Medullary Thyroid Cancer. Oncologist. 2008;13:539–47. 2. Elisei R, Romei C, Cosci B, Agate L, Bottici V, Molinaro E. RET Genetic Screening in patients with Medullary Thyroid Cancer ARTICLE IN PRESS Diagnóstico molecular 3. 4. 5. 6. 7. and Their Relatives: Experience with 807 Individuals at One Center. Am J Physiol Endocrinol Metab. 2007;92:4725–9. Niccoli-Sire P, Murat A, Rohmer V, Franc S, Chabrier G, Baldet L, et al. Familial Medullary Thyroid Carcinoma with Noncysteine RET Mutations: Phenotype-Genotype Relationship in a Large Series of Patients. Am J Physiol Endocrinol Metab. 2001;86: 3746–53. Eng C. RET Proto-Oncogene in the Development of Human Cancer. Journal of Clinical Oncology. 1999;17:380. Forga Llenas L. Genética del carcinoma medular de tiroides. Endocrinol Nutr. 2007;54:371–8. Nacional Comprehensive Cancer Network. Thyroid carcinoma. Practice guidelines in Oncology-v. 2. NCCN Inc; 2006. Willem J, de Groot MD, Thera P, Links MD, Plukker MD, Lips MD, et al. RET as a diagnostic and therapeutic target in sporadic and hereditary endocrine tumors. Endocrin rewiews, doi:10.1210/ er.2006-0017. 79 8. Brandi ML, Gagel RF, Angeli A, Bilezikian JP, Beck-Peccoz P, Bordi C, et al. Guidelines for diagnosis and therapy of MEN type 1 and type 2. The journal of clinical endocrinology and metabolism. 2001;86:5658–71. 9. Demers LM, Spencer CA. Laboratory medicine practice guidelines: Laboratory support for the diagnosis of thyroid disease. The National Academy of Clinical Biochemistry. 2002(13):66–72. 10. Machens A, Hauptmann S, Dralle H. Medullary Thyroid Cancer Responsiveness to Pentagastrin Stimulation: An Early Surrogate Parameter of Tumor Dissemination? J Clin Endocrinol Metab. 2008;93:2234–8. 11. Carreño M, Girbés J, Malluguiza R, Serrano S, Tudela J, Alfayate R, et al. Utilidad del protoncogén RET en el diagnóstico del cáncer medular de tiroides de tipo hereditario. Correlación con los hallazgos quirúrgicos. Acta Otorrinolaringol Esp. 2001;52:57–63. 12. Martı́nez Férez IM, Villegas Portero R. Análisis de mutaciones en el gen RET. Ministerio de Sanidad y Consumo. 2008:22–7. ARTICLE IN PRESS Rev Lab Clin. 2010;3(2):80–86 Revista del Laboratorio Clínico www.elsevier.es/LabClin REVISIÓN Actuación del laboratorio ante la obtención de valores crı́ticos Cristina Herrera Rodrigoa,d, Concha Tapia-Ruano Dı́az-Quetcutib,d, Antonio Buño Sotoc y Miguel Garcı́a Montesa, a Área de Laboratorio, Hospital Moncloa (ASISA), Madrid, España Servicio de Bioquı́mica, Hospital Universitario Virgen de la Salud, Toledo, España c Servicio de Análisis Clı́nicos, Hospital Universitario La Paz, Madrid, España d Grupo de Trabajo de Valores Crı́ticos de la Asociación Española de Biopatologı́a Médica (AEBM) b Recibido el 15 de julio de 2009; aceptado el 7 de diciembre de 2009 Disponible en Internet el 21 de abril de 2010 PALABRAS CLAVE Valores crı́ticos; Valores de alerta; Notificación de valores crı́ticos KEYWORDS Critical values; Alert values; Critical values reporting Resumen En el laboratorio clı́nico se obtienen los resultados de los estudios solicitados a los pacientes. Los informes de estos resultados se entregan habitualmente al paciente o a su médico, en papel o mediante sistemas informáticos, en los plazos de respuesta establecidos de acuerdo con el resto del equipo asistencial y siguiendo las normas de la institución. En algunas ocasiones, los resultados obtenidos no permiten agotar esos tiempos de respuesta, sino que su trascendencia para la situación del paciente requiere la comunicación urgente al personal sanitario a cuyo cargo se encuentre. En estos casos, todo el personal con responsabilidad en el laboratorio debe conocer cómo detectar uno de estos valores crı́ticos y cómo actuar cuando lo encuentre. Se revisan los conceptos y la normativa correspondiente y se recomiendan procedimientos para la detección, la notificación y la documentación de valores crı́ticos. & 2009 AEBM, AEFA y SEQC. Publicado por Elsevier España, S.L. Todos los derechos reservados. Laboratory action on obtaining critical values Abstract The clinical laboratory performs the tests requested on patients. The laboratory reports these results to patients or their medical doctors in paper or electronic form, within the established response time and under the institutional regulations. Occasionally, the importance of the data obtained, forces to immediate communication with the health Autor para correspondencia. Correo electrónico: laboratorio@clinicamoncloa.es (M. Garcı́a Montes). 1888-4008/$ - see front matter & 2009 AEBM, AEFA y SEQC. Publicado por Elsevier España, S.L. Todos los derechos reservados. doi:10.1016/j.labcli.2009.12.001 ARTICLE IN PRESS Actuación del laboratorio ante la obtención de valores crı́ticos 81 personnel in charge. All laboratory staff must know how to detect and inform these critical values. We have reviewed regulations and common concepts, such as detection, reporting and documentation procedures of the critical values in clinical laboratory. & 2009 AEBM, AEFA y SEQC. Published by Elsevier España, S.L. All rights reserved. Introducción Evolución del concepto En 1972, Lundberg1 acuñó el concepto de )valores crı́ticos*. Los definió como indicadores de un estado fisiopatológico tan alejado de la normalidad que puede poner en peligro la vida del paciente si no se actúa rápidamente y para el que existe tratamiento. Fue el primero en reflejar la importancia de comunicar a tiempo este tipo de incidencia en las determinaciones analı́ticas2. A pesar de la escasa presencia de este concepto en la literatura médica, con el tiempo se aceptó que la comunicación de estos valores crı́ticos era una norma de buena práctica del laboratorio, se establecieron lı́mites crı́ticos para las determinaciones analı́ticas que requerı́an notificarse urgentemente al clı́nico y se puso de manifiesto la necesidad de que los laboratorios clı́nicos poseyeran un protocolo con los pasos por seguir cuando se produjera un valor alarmante en los resultados de una prueba analı́tica3. Autores como Hortin y Csako4 proponen el término valores de alerta en sustitución de los de valores crı́ticos o valores de pánico utilizados por Lundberg al considerar que estos términos inducen ansiedad en los pacientes y sus familias y no son adecuados en un contexto medicolegal. Además, con esta denominación, amplı́an el concepto para incluir no solo aquellos que ponen en peligro la vida del paciente, sino también aquéllos cuya rápida comunicación pueda suponer un beneficio para la evolución clı́nica del paciente o una reducción del gasto sanitario. Ejemplos de ello serı́an los niveles séricos elevados de antibióticos potencialmente nefrotóxicos o los niveles inadecuados de inmunosupresores en los receptores de trasplantes. Para estos autores, un importante número de los llamados valores de alerta no se considerarı́an médicamente significativos, sino que se deberı́an a problemas en la fase preanalı́tica o a interferencias en la fase analı́tica. Por esto, supondrı́a una oportunidad y una responsabilidad de los laboratorios usar estos valores para mejorar la calidad de sus procedimientos5. Esta ampliación del concepto permitirı́a ampliar la lista de valores que comunicar y aumentarı́a el flujo de información útil en beneficio del paciente, pero como contrapartida puede llegar a suponer un exceso de información que sature al clı́nico y al laboratorio y que reste fuerza a las comunicaciones más crı́ticas. Tillman y Barth6, en 2003, recogen ambos términos, pero aplican la definición original de Lundberg, no el concepto ampliado. Desde entonces, en la revisión de la literatura médica se aprecia que el término )valores crı́ticos* (critical values) es el que se ha impuesto claramente y el que proporcionará la mayorı́a de los resultados de búsqueda bibliográfica. Objetivo El objetivo de este escrito es revisar los distintos aspectos de la respuesta a la pregunta )¿Qué debe hacer el laboratorio ante la obtención de resultados extremos que pueden indicar una situación clı́nica crı́tica?*, ası́ como resaltar la necesidad de protocolizar la identificación y la rápida comunicación de los valores crı́ticos, no solo por ser algo obligado dentro de una polı́tica de calidad, sino por ser una responsabilidad del laboratorio en su aportación al cuidado del paciente. Definiciones Lista de valores crı́ticos Valor crı́tico, valor de pánico, resultado crı́tico de una prueba: resultados de pruebas de laboratorio que deben comunicarse de forma inmediata al médico responsable del paciente porque se considera que requieren una atención clı́nica urgente. Puede ser tanto un resultado de una prueba de rutina como de una prueba urgente. Lı́mites crı́ticos: cifras lı́mite alta y baja, más allá de las cuales los resultados de una prueba de laboratorio se consideran valores crı́ticos porque reflejan una amenaza para la vida del paciente si no se aplica el tratamiento adecuado. Valores de alerta, valores de alarma: resultados de pruebas de laboratorio cuya rápida comunicación pueda suponer un beneficio para la evolución clı́nica del paciente o una reducción del gasto sanitario, además de los que ponen en peligro la vida del paciente. El Colegio Americano de Patólogos (CAP), tras realizar el QProbes Study 2002, abandonó el intento de establecer por consenso una lista nacional estándar de valores crı́ticos, pero propuso una lista genérica que sirviera de punto de partida para que cada laboratorio desarrollase la suya5. La tabla adjunta muestra un ejemplo (tabla 1)3,18,21. El responsable del laboratorio debe ser el encargado de diseñar la lista de valores crı́ticos teniendo en cuenta las caracterı́sticas particulares de su centro y de la población a la que atiende, la prevalencia de enfermedades atendidas, las especialidades o los programas especiales existentes, por ejemplo, si atiende a trasplantes de médula ósea, Neonatologı́a, cirugı́a cardı́aca, obstetricia de alto riesgo, etc7. Para este proceso es esencial consultar con el resto de facultativos de las distintas especialidades implicadas, bien ARTICLE IN PRESS 82 C. Herrera Rodrigo et al Tabla 1 Ejemplo de lista genérica de valores crı́ticos en adultos3,18,21 Prueba: lı́mites crı́ticos. Unidades convencionales (sistema internacional) pH arterial o7,20 y 47,60 pCO2 arterial o20 y 460 mmHg pO2 arterial o40 mmHg o15 y 450 mEq/l (o15 y 450 mmol/l) CO2 total Calcio iónico o3,0 y 46,0 mg/dl (o0,75 y 41,50 mmol/l) Carboxihemoglobina 420% de saturación de hemoglobina (0,2 proporción de saturación de hemoglobina) Albúmina sérica o1,5 g/dl (15 g/l) Calcio total o6,5 y 413 mg/dl (o1,63 y 43,25 mmol/l) Creatinina 43,0 mg/dl (265,2 mmol/l) Glucosa o45 y 4450 mg/dl (o2,50 y 424,98 mmol/l) Lactato 436 mg/dl (44,0 mmol/l) Fósforo o1,0 mg/dl (0,323 mmol/l) Magnesio o1,0 y 44,7 mg/dl (o0,41 y 41,93 mmol/l) Potasio o2,5 y 46,5 mEq/l (o2,5 y 46,5 mmol/l) Sodio o120 y 4160 mEq/l (o120 y 4160 mmol/l) Urea 4100 mg/dl (435,7 mmol/l) Troponina I 40,5 ng/ml (40,5 mg/l) Digoxina 42,5 ng/ml (3,20 nmol/l) Paracetamol 450 mg/l (4331 mmol/l) Litio 42,0 mEq/l (2,0 mmol/l) Hemoglobina o7,0 y 420,0 g/dl Hematocrito o20 y 460% Recuento de leucocitos o1,5 y 450,0 103/ml Recuento absoluto de neutrófilos o500/ml Extensión de sangre para blastos: positiva Recuento de plaquetas o40 y 4999 103/ml Tiempo de protrombina 430 s o INR 45,0 Tiempo parcial de tromboplastina 478 s activada Fibrinógeno o100 mg/dl Hemocultivo: positivo Cultivo de LCR: positivo Tinción o cultivo para micobacterias: positivo Antı́genos capsulares en LCR: positivos Extensión de sangre para malaria: positivo Cultivo de heces: aislamiento inicial de Salmonella, Shigella, Campylobacter o (o70 y 4200 g/l) (o1,5 y 450,0 109/l) (o0,5 109/l) (o40 y 4999 109/l) (o2,94 mmol/l) Yersinia CO2: dióxido de carbono; INR: cociente internacional normalizado; LCR: lı́quido cefalorraquı́deo; pCO2: presión parcial de dióxido de carbono; pO2: presión parcial de oxı́geno. informalmente o bien a través de reuniones formales. Es muy beneficioso que el conjunto de los facultativos implicados o, en su defecto, un comité institucional que le dé el visto bueno, consensúen y aprueben la lista de valores crı́ticos. Esto asegura que la lista esté adaptada a las necesidades del centro y obtenga un mayor respaldo de todos los implicados3. Algunos resultados se pueden considerar crı́ticos y, por tanto, se pueden comunicar únicamente la primera vez que se produzcan o, si se repiten, después de transcurrido un perı́odo de tiempo determinado. Esto evita comunicaciones excesivas, pero solo se puede aplicar a pocos analitos y complica la lista de valores crı́ticos. En la práctica resulta más simple comunicar los valores repetidos que lograr discriminarlos, sobre todo si desde el laboratorio no se tiene acceso a todos los detalles clı́nicos para saber si un resultado repetido es o no inesperado8. Lo mismo ocurre con la introducción de valores crı́ticos especı́ficos para determinadas enfermedades, programas o especialidades: por una parte, satisface mejor las necesidades de estos y evita comunicaciones innecesarias, pero por otra parte, hace mucho más complicada la aplicación de la lista de valores crı́ticos. Para una identificación individualizada de estos valores crı́ticos, serı́a deseable que los facultativos del laboratorio tengan acceso de forma rápida y cómoda a los datos demográficos y al archivo histórico de resultados del paciente, el médico o el servicio peticionario, los resultados del resto de determinaciones analı́ticas, si está ingresado o no y en qué servicio, la historia clı́nica, etc. a través de la red informática del centro para poder ARTICLE IN PRESS Actuación del laboratorio ante la obtención de valores crı́ticos comparar esta información con las categorı́as de una lista ası́ confeccionada. Es importante que se realice una interpretación estricta de los lı́mites consensuados para estos resultados, por ejemplo, un valor de glucemia de 451 mg/dl serı́a un valor crı́tico, mientras que un valor de 449 mg/dl no lo serı́a si se ha establecido el lı́mite crı́tico en un valor superior a 450 mg/dl3. Es imprescindible diseñar cuidadosamente la lista de valores crı́ticos en cuanto a su amplitud, a su complicación y a su adecuado ajuste de los lı́mites crı́ticos, y respetar un equilibrio entre información necesaria y recursos existentes para comunicarla, recibirla y establecer las acciones derivadas de ella3,8,9. Un exceso de notificación saturarı́a tanto al laboratorio como a los receptores de la información10. Por todos estos motivos, no existe una lista aceptada universalmente, y cada laboratorio debe elaborar la suya. Procedimiento de notificación de valores crı́ticos Una vez aprobada la lista de valores crı́ticos, debe estar disponible para el conjunto de profesionales que emiten y reciben los resultados del laboratorio. Esto se puede conseguir al incluirla en el manual de calidad del laboratorio, en el manual de procedimientos del centro y en el sistema informático. El protocolo de valores crı́ticos debe ser un documento dinámico. Para ello, es fundamental que se revise y se actualice periódicamente para que refleje los cambios en las necesidades de la institución e incluya, si procede, las nuevas pruebas analı́ticas que se vayan introduciendo en la cartera de servicios. Es necesario controlar la forma en que se notifican estos resultados. El proceso comienza con el reconocimiento de que un resultado de laboratorio constituye un valor crı́tico y, por tanto, la vida del paciente puede estar en peligro si no se actúa con rapidez. Es importante que se notifique un valor crı́tico sólo si la muestra sobre la que se realiza la determinación es la adecuada, está en condiciones satisfactorias y no presenta posibles interferencias analı́ticas para ese analito (por ejemplo, ictericia, turbidez o hemólisis evidentes) u otras fuentes de error. Los problemas preanalı́ticos más frecuentes suelen ser contaminaciones de la muestra con fluidos parenterales, muestras obtenidas en tiempos incorrectos, retraso en el procesamiento de la muestra, inadecuado tratamiento en su transporte y contaminación de las muestras con anticoagulantes en el momento de la extracción. Ante la sospecha, lo que se debe comunicar es la necesidad de recoger otra muestra en las condiciones adecuadas para obtener un resultado válido. Serı́a imprudente comunicar un resultado crı́tico si no se ha comprobado previamente por repetición del análisis antes de su notificación. Serı́a admisible, en algún caso, para agilizar la notificación, avanzar el resultado como preliminar, pendiente de confirmación. Emitir un informe con valores incorrectos que no se correspondan con el estado clı́nico del paciente supone un 83 perjuicio para el paciente, la persistencia de datos falsos reflejados en su historia, el posible aumento del coste sanitario y una pérdida de credibilidad para el laboratorio. El protocolo de valores crı́ticos debe especificar a qué personal le corresponde informar y a quién le corresponde recibir la información. Lo ideal serı́a que el técnico que realiza y verifica la prueba informe al facultativo del laboratorio y que éste se lo notifique directamente al clı́nico encargado del paciente. Para agilizar la notificación, el protocolo puede permitir que otras personas reciban la información enviada desde el laboratorio, pues se sobreentiende que estas personas transmitirán la información al clı́nico tan pronto como sea posible. Generalmente, se admite que los profesionales sanitarios (residentes, enfermeras, etc.) transmiten la información de forma más fiable que el resto (personal administrativo, recepcionistas, etc.). Los medios más eficaces para hacer llegar la información sobre valores crı́ticos son el teléfono, los mensajes a través de buscapersonas y los informes de resultados en la red informática local con aviso luminoso en pantalla. Lo más general y conveniente es que se notifiquen por teléfono. Los mensajes de voz, los correos electrónicos o los faxes no aseguran que la información llegue a la persona apropiada en el tiempo adecuado y, además, podrı́an vulnerar la ley orgánica de protección de datos. Para que se pueda acceder a este tipo de contacto telefónico rápido, es imprescindible que exista en el laboratorio un directorio de teléfonos actualizado con todos los contactos importantes para estos casos: controles de enfermerı́a de cada planta, buscas de los médicos de guardia y coordinación de enfermerı́a, mensajes de megafonı́a, consultas externas que envı́an pacientes al laboratorio, etc., directorio que debe ser accesible para todo el personal del laboratorio. Se van desarrollando nuevas tecnologı́as como ayuda para detectar valores crı́ticos y para facilitar su comunicación por medio del sistema informático del laboratorio. Puede contar con sistema automático de aviso de valores crı́ticos dentro del laboratorio y sistema automático de aviso de valores crı́ticos fuera del laboratorio, directamente al clı́nico, mediante mensajes de móvil o mensajes en la pantalla del ordenador3,11. Ya en el año 1999, Kuperman et al12 publicaron la mejora que el uso de sistemas automáticos de aviso supone en cuanto al tiempo de demora del tratamiento de la alteración. En el caso de pacientes ambulantes, fuera del horario de consulta puede plantearse un problema importante. Cada clı́nica o médico con consulta externa deberı́a designar a una persona que acepte recibir esta información fuera del horario de la clı́nica o informar de un teléfono de contacto11. En último extremo se puede contactar directamente con el paciente y explicarle que alguno de los resultados obtenidos en sus análisis requiere que su médico o, en su defecto, el servicio de urgencias correspondiente lo conozcan lo antes posible. Por esto, es necesario que el laboratorio obtenga siempre un teléfono de contacto actualizado de cada paciente ambulante que atiende. En todos los casos de notificación oral es necesario que se confirme la recepción correcta de la información por parte de la persona con la que se contacta. Para ello, ésta debe tomar nota y repetir a su informante la información que ha ARTICLE IN PRESS 84 captado, lo que se ha denominado read-back13,14. Barenfanger et al16, en un estudio sobre notificación telefónica de valores crı́ticos, detectaron una tasa de errores del 3,5%. Ese riesgo se reduce mucho si se cumple con este requisito de la repetición del mensaje recibido, lo que tan solo consume una media de 12,8 s. Se aconseja incluir en el procedimiento de notificación un guión establecido para asegurar el read-back, e iniciar la comunicación con una frase como: )Voy a comunicarle un valor crı́tico y necesito que usted me lo repita*14,15. El personal de enfermerı́a realiza generalmente los point of care testing sin formación especı́fica en el laboratorio, pero sabe cómo contactar rápidamente con el médico responsable y puede ser también quien va a aplicar el tratamiento ordenado por éste. Por esto, la respuesta ante valores crı́ticos suele ser eficiente. Es conveniente, en cualquier caso, entrenar a este personal para reconocer los valores crı́ticos y reaccionar adecuadamente ante ellos3. En cuanto al plazo de aviso de un valor crı́tico, el laboratorio debe establecer, controlar y documentar el tiempo de demora en la comunicación de los valores crı́ticos y su reducción debe ser un objetivo de mejora17. Se ha publicado que los valores crı́ticos, en el caso de enfermos hospitalizados, deberı́an comunicarse a la persona responsable del enfermo en un plazo máximo de 40 min desde que se obtienen en el laboratorio18. Wagar19, en el Congreso Anual de la Sociedad Americana de Patologı́a Clı́nica (ASCP) de 2008, estimaba el intervalo aceptable entre la obtención del valor crı́tico y su comunicación entre 15 y 30 min. En otros estudios, el resultado tarda una media de 22 min en llegar a la planta en la que el paciente está ingresado o al médico peticionario, y la mediana es de 9 min. Las mayores demoras se producen en la comunicación a pacientes ambulantes o en casos en que no se dispone de información sobre el médico o el servicio peticionario20. En el Q-Probes Study 2002 se obtuvo una media de 6 min para ingresados y de 14 min para ambulantes5. En el protocolo de comunicación de valores crı́ticos del Laboratorio de la Clı́nica Mayo se recoge que el personal del laboratorio deberá comunicar estos valores telefónicamente en los 30 min siguientes a su obtención y, si no es posible el contacto en este tiempo, deberán seguir insistiendo hasta comunicarlo21. Cada laboratorio tendrá que establecer estos plazos de acuerdo con las caracterı́sticas y los recursos de su centro. Es inevitable que algunos intentos de comunicar la información sobre un valor crı́tico fallen. Es aceptable diferir la información después de haber agotado todas las posibilidades de comunicación, ya que no se puede afectar el funcionamiento de todo el laboratorio mientras se intenta conectar una y otra vez con alguien que reciba la información. En cualquier caso, no se debe abandonar completamente: es mejor una información tardı́a que ninguna información3. Documentación de la notificación El personal del laboratorio debe documentar todas las notificaciones, incluyendo los intentos fallidos. La documentación debe ser escrita, preferiblemente en formato electrónico, e incluir la identificación del paciente, el tipo de muestra, la determinación realizada y su resultado, C. Herrera Rodrigo et al la fecha y la hora de la notificación, la identificación de la persona que realiza la comunicación y de la persona que la recibe, la confirmación de la recepción correcta por parte de esta read-back, el medio por el que se notificó (teléfono, etc.) y, si no se ha conseguido la comunicación, una corta explicación, por ejemplo, que nadie contestó al teléfono3,22. Si se incluye esta información en el sistema informático del laboratorio, será más fácil acceder a ella y, además, simplifica el registro de la notificación, ya que muchos de los datos ya aparecen recogidos. En los casos en que no se logre la notificación, se deberán investigar las causas del fallo e iniciar una acción correctiva. La investigación y la acción correctiva deberán también estar documentadas22. Normativa La importancia que últimamente se da a la seguridad del paciente y a los protocolos de calidad ha sido decisiva en la mejora de la notificación de valores crı́ticos en el laboratorio. Distintos organismos internacionales han tratado este tema en sus recomendaciones y requisitos de acreditación. La Norma UNE-EN ISO 15189 recoge dentro de su apartado 5.8 sobre el informe de laboratorio, en el subapartado 5.8.7, que el laboratorio debe tener procedimientos para avisar inmediatamente a un médico (u otra persona responsable de la asistencia sanitaria al paciente) cuando los resultados de los análisis correspondientes a propiedades crı́ticas se encuentren dentro de los intervalos de alarma establecidos. Esto incluye los resultados recibidos sobre muestras enviadas para su análisis a laboratorios subcontratados. Y en el subapartado 5.8.8 incluye que, para que puedan satisfacerse las necesidades clı́nicas locales, el laboratorio debe definir las propiedades cuyos valores pueden ser alarmantes y los intervalos correspondientes de acuerdo con los médicos clı́nicos que utilizan el laboratorio. Esto es aplicable a todo tipo de análisis, incluyendo los correspondientes a propiedades nominales y ordinales23. La Joint Commission on Accreditation of Healthcare Organizations (JCAHO), en sus requisitos de calidad y seguridad para el paciente de su programa de acreditación, recoge, dentro del capı́tulo de Laboratorio en National Patient Safety Goals (NPSG) 02.01.01 sobre la mejora de la comunicación entre los cuidadores del paciente, que para la comunicación de resultados crı́ticos de pruebas, la persona que comunica el resultado verifica que este se recibe correctamente, registra qué persona lo recibe y confirma, cuando el receptor repite la información recibida, que la información que éste ha captado es correcta. La comunicación efectiva es oportuna, precisa, completa, sin ambigüedades y comprensible para el receptor, reduce errores y da lugar a la mejora de la seguridad del paciente. La JCAHO en el NPSG 02.03.01 recoge que el laboratorio define los test y los valores crı́ticos, que debe establecer el tiempo aceptable entre la solicitud de una prueba y la comunicación de un valor crı́tico y que debe medir, evaluar y, si es necesario, tomar las acciones necesarias para mejorar los plazos de comunicación de valores crı́ticos al médico responsable del paciente o, en su defecto, a otro personal responsable17. El CAP en su programa de acreditación de laboratorio de la Comisión de Acreditación de Laboratorio recoge en el apartado de informe de resultados las siguientes cuestiones: ARTICLE IN PRESS Actuación del laboratorio ante la obtención de valores crı́ticos GEN.41320 ¿Tiene el laboratorio procedimientos para la notificación inmediata al médico (o a otro personal clı́nico responsable del cuidado del paciente) cuando los resultados de ciertas pruebas caen dentro de los rangos establecidos como crı́ticos o de alerta? Esto incluye resultados obtenidos de especı́menes enviados a laboratorios de referencia para su análisis. Los valores crı́ticos o de alerta son aquellos que requieren atención clı́nica rápida para evitar al paciente un riesgo considerable de morbilidad o mortalidad. GEN.41330 ¿Hay documentación de la notificación al personal clı́nico adecuado de todos los valores crı́ticos? Los registros deben mantenerse mostrando la rápida notificación al personal clı́nico adecuado tras obtener resultados en el rango crı́tico. Esos registros deben incluir fecha, hora, responsable del laboratorio, persona notificada y resultado del test. Cualquier problema encontrado para realizar esta tarea debe investigarse para prevenir su recurrencia. GEN.41340 ¿Tiene el laboratorio una polı́tica sobre la verificación read-back de valores crı́ticos que se comunican verbalmente o por teléfono? Esta cuestión se aplica tanto a los resultados obtenidos en el propio laboratorio como a los recibidos de laboratorios de referencia22. The Clinical Laboratory Improvement Amendments (CLIA) del Departamento de Salud de EE. UU., en sus regulaciones Survey Procedures and Interpretive Guidelines for Laboratories and Laboratory Services (apéndice C), apartado 493: Exigencias de laboratorio, Sec. 493.1291, Sobre informe de laboratorio, subapartado K, punto g, recoge que el laboratorio debe alertar inmediatamente al individuo o a la entidad solicitante de la prueba y, de ser posible, al individuo responsable del uso de la prueba cuando el resultado de la prueba indica una situación que pone en peligro la vida del paciente24. Recomendaciones 1. Dentro de la polı́tica de calidad del laboratorio es obligado el establecimiento de protocolos escritos de comunicación de valores crı́ticos. 2. No existe una lista de valores crı́ticos aceptada universalmente. Cada lista debe ser hecha a la medida de la institución sanitaria para la que trabaja el laboratorio. Una lista genérica, obtenida con datos de diferentes laboratorios, puede servir de punto de partida sobre el que se busque un consenso con los clı́nicos y la aprobación de la institución. 3. El diseño adecuado de la lista de valores crı́ticos y el cumplimiento de los procedimientos de comunicación establecidos mejoran la seguridad de los pacientes y aseguran que la información llegue a los clı́nicos en tiempo adecuado en el caso de que ocurra alguna situación que ponga en peligro la vida del paciente. 4. Por el contrario, el abuso en la notificación de valores crı́ticos, debido a la inclusión de determinaciones que no sean realmente crı́ticas o al establecimiento de lı́mites poco ajustados, supone un uso inadecuado de recursos que puede saturar al laboratorio y a los clı́nicos, aumentar el gasto sanitario, perjudicar al enfermo y retrasar su alta médica. 5. El laboratorio debe establecer el plazo de aviso de un valor crı́tico, controlar y documentar el tiempo de 85 demora en su comunicación y hacer de su reducción un objetivo de mejora. 6. Es necesario documentar todas las notificaciones y sus confirmaciones o read-back, incluyendo los intentos fallidos, cuyas causas se deberán investigar y corregir. Conclusiones Los protocolos deben asegurar que la notificación de un valor crı́tico ponga en marcha la acción terapéutica adecuada para remediar la situación que ha generado ese valor. Más allá del cumplimiento y la mejora a través de las polı́ticas de calidad, el manejo adecuado de los valores crı́ticos es una responsabilidad del laboratorio en su aportación al cuidado del paciente. Todas las oportunidades son pocas para que los facultativos del laboratorio hagan más visible su papel asistencial en el cuidado del paciente25. Bibliografı́a 1. Lundberg GD. When to panic over abnormal values. Med Lab Observ. 1972;4:47–54. 2. Lundberg GD. Critical (panic) value notification: An established laboratory practice policy (parameter). JAMA. 1990;263:709. 3. Emancipator K. Critical values: ASCP practice parameter. Am J Clin Pathol. 1997;108:147–53. 4. Hortin GL, Csako G. Critical values, panic values or alert values? (letter) Am J Clin Pathol. 1998;109:496–7. 5. Howanitz PJ, Steindel SJ, Heard NV. Laboratory critical values policies and procedures: A College of American Pathologists QProbes study in 623 institutions. Arch Pathol Lab Med. 2002;126:663–9. 6. Tillman J, Barth JH. A survey of laboratory ‘‘critical (alert) limits’’ in the UK. Ann Clin Biochem. 2003;40:181–4. 7. Catrou PG. How critical are critical values? Am J Clin Pathol. 1997;108:245–6. 8. Dighe AS, Jones JB, Parham S, Lewandrowski KB. Survey of critical value reporting and reduction of false-positive critical value result. Arch Pathol Lab Med. 2008;132:1666–71. 9. Kost GJ. Critical limits for urgent clinician notification at US Medical Centers. JAMA. 1990;263:704–7. 10. Lum G. Critical limits (alert values) for physician notification: Universal or medical center specific limits? Ann Clin Lab Sci. 1998;28:261–71. 11. Kost GJ. Designing critical limit systems for knowledge optimization. Arch Pathol Lab Med. 1996;120:633–6. 12. Kuperman GJ, Teich JM, Tanasijevic MJ, Ma’Luf N, Rittenberg E, Jha A. Improving response to critical laboratory result with automation: Results of a randomised controlled trial. J Am Med Inform Assoc. 1999;6:512–22. 13. Lippi G, Giavarina D, Montagnana M, Salvagno GL, Cappelletti P, Guidi GC. National survey on critical values reporting in a cohort of Italian laboratories. Clin Chem Lab Med. 2007;45:1411–3. 14. Haverstick DM. Critical value called, read-back obtained. AJCP editorial. Am J Clin Pathol. 2004;121:790–1. 15. Valenstein PN, Wagar EA, Stankovic AK. Notification of critical results: A College of American Pathologist Q-Probes Survey of 121 Institutions. Arch Pathol Lab Med. 2008;132:1862–7. 16. Barenfanger J, Sautter RL, Lang DL, Collins SM, Hacek DM, Petersen LR. Improving patient safety by repeating (read-back) telephone reports of critical information. Am J Clin Pathol. 2004;121:801–3. ARTICLE IN PRESS 86 17. Jointcommission.org. Joint Commission on Accreditation of Healthcare Organizations. [actualizado 7/8/2008; consultado 6/3/2009]. Disponible en: http://www.jointcommission.org/NR/rdonlyres/ F04D6D9C-7EB8-46D2-B2E5-98E4A33F193E/0/08_LAB_NPSGs_Master. pdf. 18. Mghlabtest.partners.org. Massachusetts General Hospital. Pathology Service. Laboratory Handbook. [actualizado 13/8/2008; consultado 6/3/2009]. Disponible en: http://mghlabtest.part ners.org/CriticalValues.htm. 19. Wagar EA. Critical values reporting: An overview. (Com). American Society for Clinical Pathology (ASCP) 2008 Annual Meeting October 16–19, 2008, Baltimore, Maryland. 20. Dighe AS, Rao A, Coakley AB, Lewandrowski KB. Analysis of laboratory critical value reporting at a large academic Medical Center. Am J Clin Pathol. 2006;125:758–64. 21. Mayomedicallaboratories.com. Mayo Clinic. Mayo Medical Laboratories. Critical Values Policy Summary. [actualizado 2009; C. Herrera Rodrigo et al 22. 23. 24. 25. consultado 2/6/2009]. Disponible en: http://www.mayomedica llaboratories.com/articles/criticalvalues/criticalvalues.html. Cap.org. College of American Pathologist (CAP). Commission on Laboratory Accreditation. [actualizado 30/3/2005; consultado 1/1/2009]. Disponible en: http://www.cap.org/apps/cap. portal. International Organization for Standardization ISO 15189:2007: Medical laboratories: Particular requirements for quality and competence. Geneva, Switzerland. International Organization for Standardization; 2007. www.cms.hhs.gov/clia. Clinical Laboratory Improvement Amendments (CLIA). CLIA Regulations and Federal Register Documents. CLIA Regulations Part 493 (CDC site). [actualizado 7/6/2004; consultado 28/3/2009]. Disponible en: http:// wwwn.cdc.gov/clia/regs/subpart_k.aspx#493.1291. Catrou PG. The authors replies (letter). Am J Clin Pathol. 1998;109:497. ARTICLE IN PRESS Rev Lab Clin. 2010;3(2):87–93 Revista del Laboratorio Clínico www.elsevier.es/LabClin DOCUMENTO DE CONSENSO Consenso sobre especificaciones mı́nimas de la calidad analı́tica para magnitudes hematológicas y de bioquı́mica especial Rafael Calafell Clara,e, Gabriela Gutiérrez Bassinib,e, José Marı́a Jou Turallasb,e, Jorge Morancho Zaragozaa,e, Francisco Ramón Bauzác,e, Carmen Ricós Aguilác,e,, Ángel Salas Garcı́ac,e y Antonio Buño Sotod,e a Asociación Española de Farmacéuticos Analistas (AEFA), Madrid, España Sociedad Española de Hematologı́a y Hemoterapia (SEHH), Barcelona, España c Sociedad Española de Bioquı́mica Clı́nica y Patologı́a Molecular (SEQC), Barcelona, España d Asociación Española de Biopatologı́a Médica (AEBM), Madrid, España e Comité de Expertos Interdisciplinario sobre Especificaciones de la Calidad en el Laboratorio Clı́nico, Barcelona y Madrid, España b Recibido el 16 de febrero de 2010; aceptado el 18 de febrero de 2010 PALABRAS CLAVE Garantı́a externa de la calidad; Especificaciones de la calidad; Prestación analı́tica equivalente Resumen Introducción: Cuatro sociedades cientı́ficas españolas, organizadoras de programas de garantı́a externa de la calidad crearon un comité de expertos interdisciplinario, con el objeto de presentar a los laboratorios las especificaciones mı́nimas consensuadas, para asegurar una prestación equivalente en todo el territorio español. Material y métodos: Los programas estudiados son los de la Asociación Española de Farmacéuticos Analistas-Asociación Española de Biopatologı́a Médica, la Sociedad Española de Hematologı́a y Hemoterapia y la Sociedad Española de Bioquı́mica Clı́nica y Patologı́a Molecular. Se tomaron los datos de los años 2005 y 2006, en los que se obtuvieron 1.262.623 resultados que corresponden a 3.688 laboratorios y 24 perı́odos. Para cada magnitud se calculó la diferencia absoluta entre el resultado y el valor de comparación (media del grupo homogéneo), expresada en porcentaje, a lo que se denominó )error*. Se confeccionó la distribución de errores y se eligió el percentil 95 de la distribución de errores restante, como )especificación candidata*. Este valor se comparó con especificaciones preceptivas en Alemania y Estados Unidos y, en caso de ser superior a cualquiera de ellas, se incrementó el valor de la especificación candidata reiteradamente, hasta que el 90% de los laboratorios participantes en los programas tuviera el 75% de sus resultados dentro del valor resultante. Este valor se consideró como la especificación y se cerró el proceso. Resultados y conclusiones: Se definen especificaciones para 37 magnitudes biológicas (3 de inmunologı́a, 5 de fármacos, 15 de hormonas y marcadores tumorales, 14 de hematimetrı́a y coagulación). Las especificaciones propuestas son una declaración de Autor para correspondencia. Correo electrónico: carmen.ricos@terra.es (C. Ricós Aguilá). 1888-4008/$ - see front matter & 2010 AEBM, AEFA y SEQC. Publicado por Elsevier España, S.L. Todos los derechos reservados. doi:10.1016/j.labcli.2010.02.002 ARTICLE IN PRESS 88 R. Calafell Clar et al mı́nimos que todo laboratorio deberı́a cumplir, con objeto de asegurar prestaciones analı́ticas de utilidad clı́nica. Cuando un laboratorio no pueda alcanzar estas especificaciones de la calidad, es decir, si el error de sus resultados al participar en un programa de garantı́a externa de la calidad excede estas especificaciones mı́nimas, debe revisar inmediatamente el procedimiento afectado y tomar medidas correctivas, si procede. & 2010 AEBM, AEFA y SEQC. Publicado por Elsevier España, S.L. Todos los derechos reservados. KEYWORDS External quality assurance; Quality specifications; Equivalent analytical performance Consensus on the minimum analytical quality specifications for haematology and special biochemistry parameters Abstract Introduction: An Interdisciplinary Expert Committee was created by four Spanish Scientific Societies, organisers of external quality assurance programs, to provide laboratories a consensus of minimum analytical quality specifications with the aim of assuring similar analytical performance all over Spain. Material and method: A total of 1,262,623 results was obtained from 3688 laboratories and 24 periods studied (2005 and 2006). For each analyte, the absolute difference between the result and the comparative value (peer group mean), expressed in percentage, was calculated and named ‘‘error’’. From the error frequency distribution, the 95 percentile was considered as ‘‘candidate specification’’. This value was compared with the specification used in Germany and USA and, in the case of being higher than one of them, the ‘‘candidate specification’’ value was increased iteratively, until 90% of participating laboratories had 75% of their results within the ‘‘candidate specification’’. This value was considered to be the specification and the process ended. Results and conclusion: Specifications for 37 analytes (3 immunology, 5 therapeutic drug monitoring, 15 hormones and tumour markers, 14 haematology and coagulation are proposed. They are considered to be the minimum level of quality that each laboratory had to reach, to assure common analytical performance. If the results in the external quality assurance program exceed these specifications, an immediate review should be made and, if necessary, corrective actions should be taken. & 2010 AEBM, AEFA y SEQC. Published by Elsevier España, S.L. All rights reserved. Introducción En el año 2006, 3 sociedades cientı́ficas organizadoras de programas de garantı́a externa de la calidad con implantación en España (Asociación Española de Biopatologı́a Médica [AEBM], Asociación Española de Farmacéuticos Analistas [AEFA], y Sociedad Española de Bioquı́mica Clı́nica y Patologı́a Molecular [SEQC]) crearon un comité de expertos interdisciplinario para establecer las especificaciones mı́nimas de la calidad analı́tica1, y por debajo de éstas no se podrı́a garantizar la utilidad clı́nica de las determinaciones. En un primer documento se presentaron los datos para 24 magnitudes bioquı́micas básicas2. El modelo utilizado está fundamentado en la Conferencia de Consenso Internacional de Estocolmo3,4, que establece una jerarquı́a de criterios para definir especificaciones de la calidad; uno de éstos se deriva de los datos obtenidos en programas de garantı́a externa de la calidad, y otro considera los utilizados en normativas del laboratorio clı́nico5. En el año 2008 se integró una cuarta organización, la Sociedad Española de Hematologı́a y Hemostasia (SEHH), que sumó 2 expertos al grupo de trabajo. El punto de partida del presente documento son los datos procedentes de los programas de garantı́a externa de la calidad de AEFA-AEBM, SEHH y SEQC, indicativos de las prestaciones de los métodos analı́ticos actuales, en términos de inexactitud de los resultados de cada laboratorio. La filosofı́a de los autores ha sido estudiar las prestaciones en España, definir especificaciones mı́nimas de la calidad analı́tica unificadas y difundir la necesidad de corrección inmediata cuando no se alcanzan los valores propuestos. La organización de los programas es muy similar entre las sociedades (tabla 1). El tratamiento estadı́stico de los resultados se realiza de la misma forma: cómputo global, estratificado por método analı́tico y por instrumento. La distribución de participantes se complementa en titularidad Tabla 1 Organización de los programas Participación anónima Rigurosamente confidencial Periodicidad mensual Número de especı́menes: 12 (bioquı́mica), 24 (hematologı́a) Material sin valor asignado Concentración (o actividad) en el más amplio margen Proceso de datos informatizado Duración: un año natural Certificado de inscripción y de participación ARTICLE IN PRESS Consenso sobre especificaciones mı́nimas de la calidad analı́tica para magnitudes hematológicas y de bioquı́mica especial Tabla 2 Distribución de participantes expresada en porcentajes Tipo de laboratorio AEFA-AEBM SEQC SEHH Laboratorios hospitalarios Públicos y concertados Privados 13 8 5 59 45 14 72 55 17 Laboratorios no hospitalarios Públicos y concertados Privados 87 2 85 42 6 36 28 5 23 AEFA-AEBM: Asociación Española de Farmacéuticos AnalistasAsociación Española de Biopatologı́a Médica; SEHH: Sociedad Española de Hematologı́a y Hemostasia; SEQC: Sociedad Española de Bioquı́mica Clı́nica y Patologı́a Molecular. Tabla 3 Número de magnitudes incluidas en los programas (perı́odo 2005 y 2006) Programa AEFA-AEBM SEQC Bioquı́mica básica en suero y fármacos Bioquı́mica en orina 26þ6 31 Urianálisis (11) 9 11 4 2 12þurianálisis (7) 20 18 10 6 Proteı́nas Hormonas/inmunoanálisis Marcadores tumorales Otros AEFA-AEBM: Asociación Española de Farmacéuticos AnalistasAsociación Española de Biopatologı́a Médica; SEQC: Sociedad Española de Bioquı́mica Clı́nica y Patologı́a Molecular. 89 Se tomaron los datos de 2 años (2005 y 2006), en los que se obtuvieron 1.262.623 resultados que corresponden a 3.688 laboratorios y 24 perı́odos. Los resultados que obtuvieron todos los laboratorios participantes en los 3 programas durante los años 2005 y 2006 se almacenaron en una base de datos denominada datum8. El trabajo se realizó en varias etapas: en la primera (año 2007) se incluyeron 24 magnitudes bioquı́micas y los resultados se publicaron previamente2. En la segunda (año 2008) se añadieron 37 magnitudes biológicas (3 de inmunologı́a, 5 de fármacos, 15 de hormonas y marcadores tumorales y 14 de hematimetrı́a y coagulación); ésta es la etapa que se describe en el presente documento. En la tercera etapa se estudiarán las magnitudes no comunes a los diversos programas de las 4 sociedades. Las variables del datum fueron identificación numérica del laboratorio, ciclo (año), perı́odo, nombre de la magnitud, resultado del laboratorio y valor de comparación. Éste se definió mediante la media global de los resultados de los laboratorios, al analizar una misma muestra, en las magnitudes con resultados similares entre los diversos métodos analı́ticos. En las magnitudes con resultados muy dispares entre distintos métodos o instrumentos analı́ticos, el valor de comparación fue la media del grupo especı́fico. En la primera etapa se utilizó un modelo de cálculo sencillo (denominado en este artı́culo como procedimiento A), que se aplicó a cada magnitud y cada resultado conforme al siguiente esquema: Cálculo del error (diferencia absoluta entre el resultado y el valor de comparación, expresada en porcentaje) Confección de la distribución de errores Segregación de la distribución del 5% de los errores con mayor valor Elección del percentil 95 de la distribución de errores restante, como valor de la especificación y sector (tabla 2) y el número de magnitudes biológicas incluidas en los programas es similar (tabla 3). El objeto del trabajo es presentar a los laboratorios las especificaciones mı́nimas consensuadas, para asegurar una prestación equivalente en todo el territorio español. El documento se presentará también a la Administración Pública Estatal y Autonómica y a las entidades evaluadoras de la calidad, para que se utilice como referencia. Material y métodos Los programas estudiados en este trabajo, organizados por las 4 sociedades cientı́ficas (AEFA-AEBM, SEHH y SEQC), que cumplen con las recomendaciones de la International Federation of Clinical Chemistry (IFCC) como programas de garantı́a externa de la calidad6, tienen las siguientes caracterı́sticas comunes: Tienen más de 25 años de experiencia Cumplen la guı́a ISO/IEC 43-17 Son independientes de empresas comerciales Realizan formación sobre temas de calidad (promueven la implantación de sistemas de gestión de la calidad entre sus socios) Definen las especificaciones de la calidad dentro de cada organización. Redondeo de la especificación a valores enteros En la segunda etapa se empleó un modelo más complejo consistente en comparar, para cada magnitud, la DATUM Procedimiento A Especificación candidata CRITERIOS La especificación ¿Es plausible, para el fin esperado ? Sí Se acepta la especificación candidata No Se descarta la especificación candidata Figura 1 Fin Esquema de trabajo de la primera etapa. ARTICLE IN PRESS 90 R. Calafell Clar et al especificación )candidata* resultante del modelo anterior con especificaciones de obligado cumplimiento en Alemania9 y EE. UU.10 (figs. 1–3). Si son del mismo orden, en función Especificación de calidad preceptiva Elección del límite inferior (LI) de las especificaciones preceptivas Especificación de calidad candidata ¿Es posible realizar la comparación? No Procedimiento B Sí Se acepta la especificación candidata X Fin del criterio previamente decidido por el comité de expertos que se muestra en las figuras 2 y 3, se acepta la especificación candidata y el cálculo finaliza. Si la candidata resulta más restrictiva y, a juicio del comité, no es plausible su utilización en forma generalizada por parte de los laboratorios clı́nicos españoles, se acopla un segundo cálculo (procedimiento B en figura 4), consistente en incrementar el valor de la especificación candidata (valor )error prueba*) y contar el número de laboratorios que obtienen el 75% de sus resultados dentro de esta nueva especificación. Este proceso se reitera hasta que el 90% de los laboratorios participantes en los programas tenga el 75% de sus resultados dentro del valor error-prueba. Este valor se considera ahora como la especificación y se cierra el proceso. Resultados Figura 2 Esquema de trabajo de la segunda etapa. Comparación con especificaciones preceptivas en otros paı́ses. LI: lı́mite inferior de las especificaciones preceptivas. Para cada magnitud, se obtuvieron entre 5.158 y 54.528 resultados (34.523 de media). Las especificaciones preliminares para 24 magnitudes de bioquı́mica básica se debatieron en el año 2007 en el I Congreso Nacional del Laboratorio Clı́nico y, a nivel internacional, en el 20th International Congress of Clinical Chemistry and Laboratory Medicine (Fortaleza, Brasil 2008)11. También X ¿Existe especificación consensual previa publicada Sí No ¿Candidata igual o superior a LI? ¿Es diferente a la especificación consensual previa publicada? Se acepta la especificación candidata No Sí Fin Sí No ¿Hay razones para aceptar al candidato? No Sí ¿Se ejecutó previamente el procedimiento B? Sí No se acepta la especificación candidata No Procedimiento B Figura 3 Criterio de decisión del comité de expertos. LI: lı́mite inferior de las especificaciones preceptivas. ARTICLE IN PRESS Consenso sobre especificaciones mı́nimas de la calidad analı́tica para magnitudes hematológicas y de bioquı́mica especial Selección magnitud Tabla 4 Consenso especificaciones mı́nimas (magnitudes estudiadas en la segunda etapa) Seleccionar un valor de error (en %) de prueba inicial Sumar al valor inicial de prueba un incremento (0,01%) Contar el n.° de laboratorios que tienen como mínimo el 75% de sus resultados con un error inferior o igual al valor de error de la prueba ¿Es el n.° de laboratorios contados superior o igual al 90% del total de laboratorios? No 91 Sí Aceptar el error prueba como especificación candidata Fin del procedimiento B Figura 4 Cálculo acoplado a la comparación con especificaciones preceptivas. se publicaron en la Revista del Laboratorio Clı́nico, como se ha mencionado anteriormente2. Las especificaciones obtenidas para las 37 magnitudes de la segunda etapa se presentaron en el Simposio de Organizadores Europeos de Programas de Garantı́a Externa de la Calidad en el Laboratorio Clı́nico (Symposium, Berlı́n 2009)12 y se debatieron en el 2009 en el III Congreso Nacional del Laboratorio Clı́nico. Del total de 61 magnitudes estudiadas, en 31 se obtuvieron las especificaciones con el procedimiento A y en 30 se obtuvieron con el procedimiento B. Las 24 magnitudes de bioquı́mica básica estudiadas en la primera etapa obtuvieron las mismas especificaciones cuando se sometieron al modelo de cálculo utilizado en la segunda etapa. Las especificaciones propuestas para las 37 magnitudes de la segunda etapa se muestran en la tabla 4. Las diferencias entre las especificaciones propuestas y las de Alemania y EE. UU. se exponen en la figura 5. Por ejemplo, para hematocrito, la especificación )candidata* según el procedimiento A es del 7%; se compara con la especificación alemana (9%) y la norteamericana (6%) (fig. 2). Ésta es el lı́mite inferior de una especificación preceptiva; como que la candidata la supera, se acepta la candidata como especificación en España (fig. 3). Otro ejemplo es el antı́geno carcinoembrionario, en que la especificación candidata (19%), proveniente del procedimiento A (fig. 1), es susceptible de compararse frente a la única preceptiva (alemana) (fig. 2), que es del 24%. Como resultado de la comparación, al ser la candidata inferior a la perceptiva, y a juicio del comité de expertos no haber razones para aceptar esa divergencia (fig. 3), se ejecuta el procedimiento B (fig. 4). En la tabla 5 se muestra cómo, al incrementar paulatinamente el valor )error-prueba* se Magnitud Especificación Alfafetoproteı́na Antı́geno carcinoembrionario Antı́geno prostático especı́fico Concentración corpuscular media Hb Cortisol Digoxina Estradiol Fenitoı́na Fenobarbital Ferritina Fibrinógeno Folitropina Hematı́es Hematocrito Hemoglobina Hemoglobina corpuscular media Inmunoglobulina A Inmunoglobulina G Inmunoglobulina M INR Ión litio Leucocitos Lutropina Plaquetas Progesterona Prolactina Teofilina Testosterona Tiempo protrombina (%) Tiempo protrombina (ratio) Tiempo tromboplastina parcial (ratio) Tiempo tromboplastina parcial (segundos) Tirotropina Tiroxina libre Tiroxina total Triiodotironina Volumen corpuscular medio 22 21 17 9 25 27 25 12 18 22 36 16 5 9 5 6 24 20 23 28 19 11 19 16 29 28 15 35 33 25 20 32 17 23 20 24 7 Magnitudes en orden alfabético, especificación expresada en porcentajes. Hb: hemoglobina; INR: cociente internacional normalizado incrementa el porcentaje de laboratorios con el 75% de los resultados dentro del valor )error-prueba* hasta llegar al 90%, objetivo del procedimiento B. El último )valor prueba* cumple el criterio del comité de expertos y, una vez redondeado (del 20,9 al 21%), constituye la especificación de este consenso español para el antı́geno carcinoembrionario. Discusión El trabajo del comité de expertos se ha podido realizar gracias a las caracterı́sticas comunes de los programas de ARTICLE IN PRESS 92 R. Calafell Clar et al garantı́a externa de la calidad de las 4 sociedades, que las hacen compatibles. El modelo de cálculo permite combinar no sólo el factor resultado (procedimiento A), sino también el factor laboratorio (procedimiento B), y es comparable con especificaciones de obligado cumplimiento en otros paı́ses (Alemania y EE. UU.). Es un criterio del comité aplicar un modelo transparente (se trabaja con los resultados reales de los laboratorios españoles) y responsable (se averigua cuántos laboratorios quedarı́an afuera de las especificaciones propuestas). El 70% de los laboratorios contesta más del 75% de las respuestas posibles, con lo que se obtiene un promedio de 34.523 resultados por magnitud, como se ha mencionado anteriormente. Esto garantiza la representatividad del modelo de cálculo utilizado. Los resultados obtenidos se pueden considerar una foto real de la situación a nivel nacional. Las especificaciones propuestas son comparables a las especificaciones utilizadas en Alemania y EE. UU., como se ilustra en la figura 5. En ella se muestran las magnitudes ordenadas según el valor de las discrepancias entre las Tabla 5 Relación entre el valor )error-prueba* y el porcentaje de laboratorios con el 75% de resultados dentro del valor-prueba en la determinación de antı́geno carcinoembrionario Valor )error-prueba* Porcentaje de laboratorios con el 75% de resultados dentro del valor-prueba 19,01 20 20,90 87,8 88,5 90 especificaciones propuestas en este documento y las utilizadas en Alemania y EE. UU. Conclusiones Éste es un documento de consenso de 4 sociedades cientı́ficas nacionales del ámbito del laboratorio clı́nico, que versa sobre especificaciones de la calidad basadas en el )estado del arte* de los resultados de los programas de garantı́a externa de la calidad de AEFA-AEBM, SEHH y SEQC. El modelo actual es el fruto de una estrategia diseñada por un comité de expertos multidisciplinario; está fundamentado en la realidad constatada a través de los programas de garantı́a externa de la calidad españoles, y es comparable con especificaciones de obligado cumplimiento en paı́ses desarrollados. Las especificaciones propuestas son una declaración de mı́nimos que todo laboratorio deberı́a cumplir, con objeto de asegurar prestaciones analı́ticas de utilidad clı́nica. Cuando un laboratorio no pueda alcanzar estas especificaciones de la calidad, es decir, si el error de sus resultados al participar en un programa de garantı́a externa de la calidad excede estas especificaciones mı́nimas, debe revisar inmediatamente el procedimiento afectado y tomar medidas correctivas, si procede. Estas recomendaciones de consenso no implican cambios en las lı́neas que tradicionalmente recomienda cada sociedad, como especificaciones para mejorar las prestaciones de los laboratorios clı́nicos. El trabajo realizado aporta un criterio para armonizar los laboratorios en su implicación en sistemas de gestión de la calidad. Adicionalmente, simplifica la tarea de los auditores al evidenciar el cumplimiento de especificaciones comunes. En el espı́ritu de este comité está el colaborar en el futuro con otras sociedades, de otros campos del laboratorio 100 80 % de diferencia 60 40 20 0 -20 -40 Te o H f em Fe n TP it SA TS H Es tr H t D o ig o Pr x og C or T4 ti -T H b Le u Fe Fe rri no AF b P T4 -L T3 Te st Pl o aq Ig G Ig A TP % Ig M TT P Li s tio Fi br i -60 España vs USA Figura 5 España vs Alemania Diferencia entre las especificaciones de consenso en España y las utilizadas en Alemania y EE. UU. ARTICLE IN PRESS Consenso sobre especificaciones mı́nimas de la calidad analı́tica para magnitudes hematológicas y de bioquı́mica especial clı́nico, organizadoras de programas de garantı́a externa de la calidad de amplia implantación nacional. Bibliografı́a 1. ISO. Sistemas de gestión de la calidad. Fundamentos y vocabulario. UNE-EN-ISO 9000. Madrid: AENOR; 2005. 2. Buño A, Calafell R, Morancho J, Ramón F, Ricós C, Salas A. Consenso sobre especificaciones mı́nimas de la calidad analı́tica. Rev Lab Clin. 2008;1:35–9. 3. Kenny D, Fraser CG, Hyltoft Petersen P, Kallner A. Consensus agreement conference on strategies to set global quality specifications in laboratory medicine. Stockholm April 24–26, 1999. Scand J Clin Lab Invest. 1999;59:585. 4. SEQC, Comisión de la Calidad Analı́tica. Estrategias para establecer especificaciones globales de la calidad analı́tica en el laboratorio clı́nico SEQC 2000. (Traducción de Kenny D, Fraser CG, Hyltoft Petersen P, Kallner A. Strategies to set global quality specifications in laboratory medicine; 1999 Apr 24–26; Stockholm: Scand J Clin Lab Invest. 1999;475–575). 5. ISO. Identification and determination of analytical and clinical performance goals for laboratory methodologies. ISO/TR 15196. Geneva: ISO; 2001. 93 6. Mazziotta D, Harel D, Schumann G, Libeer JC. International Federation of Clinical Chemistry (IFCC)/Education and Management Division (EMD)/Committee of Analytical Quality(C-AQ). Guidelines for the requirements for the competence of EQAP organizers in medical laboratories. Version 2 2002. 7. ISO. Proficiency testing by interlaboratory comparisons—Part 1: Development and operation of proficiency testing schemes. ISO/IEC Guide 43-1. 2 ed. Geneve; 1997. 8. ISO. Geographic information-Spatial referencing by coordinates. ISO 19111. ISO. Geneve; 2nd edition, 2007. 9. Richtlinie der Bundesärztekammer zur Qualitätssicherung laboratoriumsmedizinischer Untersuchungen Deutsches Ärzteblatt 2008; 105:341–5. 10. HCFA/CLIA. Proficiency testing requeriments for analytical quality. Federal Register Feb 28, 1992;57:7002–6. 11. Ramón F, Ricós C, Salas A, Buño A, Calafell R, Morancho. Analytical quality specifications from Spanish external assurance schemes (m119) J. Clin Chem Lab Med 2008; 46, Special Suppl, pp S1–S859, August 2008. DOI 10.1515/CCLM.2008.405. 12. Ricós C, Ramón F, Salas A, Buño A, Calafell R, Morancho J, et al. Minimal analytical quality specifications-the Spanish experience. EQA News. 2009.