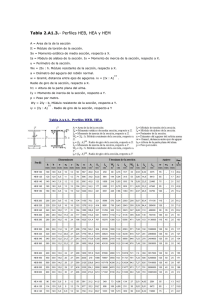
Descargar PDF >> ISSN 1888-3761
Anuncio

No 19. EVOLUCIÓN DE LOS COLOIDES SINTÉTICOS EN LA TERAPIA DE REEMPLAZO DE VOLUMEN EN EL PERIOPERATORIO Dra. Míriam de Nadal Hospital Universitari Vall d'Hebron. 1 . - I NTR O D U CCI Ó N ���������������������������������������������������������������������������������������� 3 2 . - AS P ECTOS GEN ERAL ES D E LOS COLOIDES��������������������������������������������� 4 3. - A L M I D ON ES�������������������������������������������������������������������������������������������� 5 3.1 . Ca rac te rísticas :��������������������������������������������������������������������������������� 5 3. 2 . H EA de te rce ra ge ne rac ión y ca ra cter í sti ca s di ferenci a l es d e los ac tuales produc tos ����������������������������������������������������������������� 6 3. 3 P e rfil de se guridad de los HEA������������������������������������������������������������7 B e nefic io/riesgo de los H EA en el pa ci ente cr í ti co ����������������������������� 8 Be nefic io/riesgo de los H EA en el pa ci ente qui r úrgi co ����������������������� 9 4.- GELATINAS����������������������������������������������������������������������������������������������������������������������������������� 10 5. - CO NC LU SI O N ES�������������������������������������������������������������������������������������� 12 6 . - B I BL I O GRAFÍ A��������������������������������������������������������������������������������������� 14 Fresenius Kabi España, S.A.U. Torre Mapfre - Vila Olímpica Marina, 16-18 - 08005 Barcelona Tel. 93 225 65 65 / Fax 93 225 65 75 www.fresenius-kabi.es Depósito legal: B-2111-2008 ISSN: 1888-3761 INFOCOLLOIDS no 19: EVOLUCIÓN DE LOS COLOIDES SINTÉTICOS EN LA TERAPIA DE REEMPLAZO DE VOLUMEN EN EL PERIOPERATORIO EVOLUCIÓN DE LOS COLOIDES SINTÉTICOS EN LA TERAPIA DE REEMPLAZO DE VOLUMEN EN EL PERIOPERATORIO Dra. Míriam de Nadal Hospital Universitari Vall d'Hebron. 1.- INTRODUCCIÓN La administración de fluidos en el periodo perioperatorio continúa siendo un tema controvertido. La ausencia de recomendaciones claras sobre el tipo de fluidoterapia, junto al debate entre cristaloides/coloides y sobre los distintos tipos de coloides, puede generar cierta confusión respecto cual sería la mejor estrategia para el reemplazo de volumen. Por un lado, nos enfrentamos a la falta de información sobre los efectos a largo plazo de la administración intraoperatoria de coloides y a sus potenciales efectos secundarios descritos en el paciente crítico. Por otro lado, debemos tener en cuenta las recientes revisiones sobre fluidoterapia perioperatoria, donde se recomienda evitar la sobrehidratación y guiar de forma estricta la administración de fluidos en base a objetivos hemodinámicos [1] . En este aspecto, aun existiendo una clara heterogeneidad entre las definiciones que los diferentes estudios dan a los términos restrictivo y liberal, revisiones sistemáticas recientes indican que una fluidoterapia restrictiva podría mejorar los resultados postoperatorios, sobre todo desde el punto de vista de reducción de complicaciones respiratorias [2‑3] . El posible papel que pueden jugar los coloides en la reducción global de la cantidad de fluidos, mayoritariamente en las intervenciones que cursan con hipovolemia, sigue todavía vigente. Los coloides sintéticos son sustancias polidispersas, es decir, formadas por partículas de diferentes pesos moleculares. La capacidad de los coloides para expandir el volumen plasmático está directamente relacionada con la presión coloidosmótica; si es mayor que la del plasma, la expansión del volumen plasmático superará al volumen perfundido. Las soluciones cristaloides, en cambio, poseen un volumen de distribución igual al volumen del líquido extracelular con una rápida difusión al espacio intersticial. Esta mayor eficiencia en la expansión de volumen confiere a los coloides una resucitación más precoz y un aumento de la perfusión tisular en comparación con los cristaloides [4] . La mayor eficiencia en la expansión de volumen confiere a los coloides una resucitación más precoz que con los cristaloides. A parte de sus efectos oncóticos, la presencia de estas moléculas en el espacio vascular puede tener también efectos secundarios, que dependerán principalmente de la integridad del endotelio vascular. En pacientes sépticos, donde las endotoxinas provocan una disrupción de la integridad del mismo, la distribución de los coloides puede hallarse alterada favoreciendo la extravasación de coloides y su acumulación en el espacio extravascular [5] . Según algunos autores, esto podría explicar los resultados adversos descritos en pacientes sépticos en los cuales se administraban algunas preparaciones de hidroxietilalmidones [6] . 3 3 Los hidroxietilalmidones (HEA) son coloides sintéticos que difieren en su peso molecular medio, sustitución molar y ratio C2/C6, permaneciendo en el tejido reticuloendotelial un tiempo prolongado. Entre las diferentes generaciones de almidones existen unas claras diferencias en términos de efectos sobre la coagulación o sobre la función renal. La tercera generación de HEA poseen unas características farmacocinéticas que confieren una menor acumulación plasmática y mayor grado de excreción renal [6] . Los coloides sintéticos deben considerarse fármacos y su prescripción debe regirse teniendo en cuenta su indicación, toxicidad y respuesta terapéutica [7] . Como todos los fármacos, los coloides tienen una dosis, unas indicaciones, unas contraindicaciones y unos efectos secundarios. Esta revisión tiene por objetivo actualizar el conocimiento sobre los distintos tipos de coloides sintéticos, particularmente los mas usados en la actualidad como son gelatinas y almidones, su indicación en la reposición de volumen y sus efectos secundarios, con un especial énfasis en su perfil de seguridad. 2.- ASPECTOS GENERALES DE LOS COLOIDES El término coloide se aplica a todas aquellos fluidos que contienen partículas de gran peso molecular que una vez administrados ejercen una presión oncótica en el espacio intravascular. Los coloides pueden ser sintéticos (gelatinas, dextranos e hidroxietilalmidones) o naturales (albúmina). Los coloides sintéticos están disponibles en diferentes formulaciones que les hacen variar en sus características farmacocinéticas y farmacodinámicas [8] . Los almidones proceden de la amilopectina del almidón, las gelatinas proceden de la degradación del colágeno animal y los dextranos son polisacáridos obtenidos de la sucrosa. Actualmente, los dextranos se hallan en desuso por sus efectos secundarios a nivel de alteraciones en la coagulación, función renal y reacciones alérgicas. Los coloides sintéticos, a diferencia de la albúmina, están compuestos por partículas de diferentes pesos moleculares, es decir son sustancias polidispersas. Los coloides sintéticos son sistemas con una alta dispersión molecular, de ahí que hablemos de peso molecular medio. El peso molecular medio se puede expresar como peso molecular medio en número (MWn) que es el 4 peso molecular medio de todas las moléculas oncóticamente activas o, más frecuentemente, por el peso molecular medio en peso (MWw) que es la media de los pesos moleculares y, por tanto, está más influido por la presencia de moléculas de alto peso molecular [8] . Cuanto más alto sea el cociente MWw/MWn mayor será la polidispersión de las moléculas. Las moléculas con peso molecular (PM) menor de 55.000 (umbral de filtración de los glomérulos) son rápidamente eliminadas por vía renal, ejerciendo por tanto su efecto oncótico durante menos tiempo. Las moléculas de menor PM (4560 kDa) son las primeras que se van a eliminar vía renal y gracias a las moléculas de mayor PM, que requieren de la hidrólisis enzimática de las amilasas plasmáticas, permiten alargar la duración de la permanencia intravascular del coloide [8] . INFOCOLLOIDS no 19: EVOLUCIÓN DE LOS COLOIDES SINTÉTICOS EN LA TERAPIA DE REEMPLAZO DE VOLUMEN EN EL PERIOPERATORIO 3.- A LMIDONES 3.1. Características: Los almidones son polisacáridos naturales modificados que proceden de la amilopectina del almidón de maíz o de la patata. La amilopectina está constituida por cadenas de glucosa ramificadas, análogas al glucógeno humano, que son rápidamente hidrolizadas por la amilasa plasmática por lo que, para conseguir un efecto clínico más prolongado, es preciso modificar químicamente su estructura. En los hidroxietilalmidones (HEA) se ha modificado la amilopectina sustituyendo los radicales hidróxilos de los carbonos C2 y C6 de las moléculas de glucosa por radicales hidroxietilo (Figura 1). Estos cambios de la estructura confieren las características farmacocinéticas a los almidones. Así, a mayor grado de sustitución molar (SM) (número de grupos hidroxietilo dividido por el número de moléculas de glucosa) y a mayor grado de sustitución en la posición C 2 (relación C 2 /C 6), mayor resistencia a su degradación por la amilasa y, por tanto, efecto clínico más prolongado. Es decir, un almidón con una SM de 0,4 y relación C2 /C6 de 9, tiene un efecto mucho más prolongado que otro con GS 0,45 y relación C2 /C6 de 6. El primer HEA se produjo en USA en 1970. Desde entonces, y con el objetivo de mantener su eficacia volémica y mejorar en cuanto a sus posibles C6 C5 o C4 C1 C3 C2 Figura 1. Hidroxietilalmidones (HEA). Sustitución de los hidroxietilos en las moléculas de glucosa en las posiciones C2 y C6 [8]. efectos secundarios, se han desarrollado varias generaciones de HEA difiriendo en su peso molecular medio (MW), sustitución molar (SM) y relación C2/C6. Los HEA se identifican mediante tres números, por ejemplo HEA 6% 130/0,4. El primer número indica la concentración de la solución, característica determinante del efecto expansor inicial: las soluciones de HEA al 6% son isooncóticas mientras que las soluciones al 10% son hiperoncóticas, con efecto expansor que excede considerablemente el volumen infundido (alrededor de un 145%). La concentración de los HEA puede ser al 6% y al 10% y determina el efecto volémico inicial de la solución. Los HEA al 6% son isooncóticos in vivo; 1 litro de solución remplaza 1 litro de sangre perdida. El aumento del volumen plasmático intravascular es equivalente al volumen perfundido. Los HEA al 10% son hiper-oncóticos; su efecto volémico excede al volumen infundido de la solución, aproximadamente un 145%. El segundo número es el peso molecular (MW) medio expresado en quilodaltons (KDa) y el tercero y mas significativo es el índice de sustitución molar (SM). Un grado de SM de 0,4 indica que existen 4 residuos hidroxietil por cada 10 subunidades de glucosa. Los almidones con este nivel de sustitución se denominan tetra-almidones, del mismo modo otros niveles de sustitución también se denominan hexa-almidones (0,6) o penta-almidones (0,5). Una menor hidroxietilación favorece una menor acumulación plasmática y tisular, disminuyendo los efectos secundarios fundamentalmente a nivel de coagulación y función renal. Los productos de degradación de los almidones antiguos con grado de SM elevado se acumulan en el plasma, a diferencia de la nueva generación de tetra-almidones. A lo largo de las generaciones el índice de SM ha ido disminuyendo, se ha evidenciado 5 5 Tabla 1: Características de las soluciones de hidroxietilalmidones (HEA) (9) Concentración y solvente Peso molecular medio (kDa) Sustitución molar Ratio C2/C6 4,5:1 HEA 670/0,75 6% balanceada 670 0,75 HEA 600/0,7 6% salina 600 0,7 5:1 HEA 450/0,7 6% salina 480 0,7 5:1 6% salina 200 0,62 9:1 6% salina 200 0,5 5:1 6% salina 130 0,42 6:1 6% balanceada 130 0,42 6:1 130 0,4 9:1 HEA 200/0,62 HEA 200/0,5 HEA 130/0,42 HEA 130/0,42 HEA 130/0,4 10% salina 10% balanceada 6% salina 10% salina HEA 130/0,4 6% balanceada 130 0,4 9:1 HEA 70/0,5 6% balanceada 70 0,5 3:1 que una menor hidroxietilación disminuye la protección frente a la degradación enzimática, pero favorece una menor acumulación plasmática y tisular y en consecuencia la disminución de los efectos secundarios especialmente a nivel de la coagulación y función renal. Por último, y como se ha detallado anteriormente y sin aparecer en la numeración del producto, el patrón de hidroxietilación (C2/C6) también tiene un impacto significativo en las propiedades farmacocinéticas. La relación C2/C6 también determina la vida media circulante, ya que a mayor proporción de grupos hidroxietilos en la posición del C2 frente al C6 de las moléculas de glucosa, más lenta será la degradación enzimática. La tabla 1 resume las características de los diferentes presentaciones de HEA. 3.2. H EA de tercera generación y características diferenciales de los actuales productos El desarrollo de nuevos HEA ha permitido mejorar sus propiedades farmacológicas y su seguridad manteniendo la eficacia volémica de las generaciones anteriores. La tercera generación de HEA, los tetra-almidones, se desarrollaron con un peso molecular menor (0,4) con el objetivo de intensificar su degradación y minimizar la retención en 6 los tejidos. Estos HEA de bajo peso molecular se degradan mas precozmente que los HEA antiguos, proporcionando una concentración mayor de partículas oncóticamente activas, favoreciendo una menor acumulación plasmática y tisular. En consecuencia, presentan menos efectos secundarios, especialmente a nivel de la coagulación y función renal. Una pequeña proporción de los actuales HEA sigue difundiendo al espacio intersticial, desde donde se redistribuye y se elimina. Otra fracción es captada por el sistema retículo-endotelial, donde se degrada más lentamente. Es importante destacar que tanto el grado de acumulación plasmática como tisular dependerá de la estructura, del tipo específico de HEA y de sus propiedades físico-químicas. Aunque los primeros HEA comercializados derivaban de la amilopectina extraída del almidón del maíz, posteriormente se han desarrollado otros productos derivados de la patata. Ambas soluciones, basadas en materiales distintos, poseen diferencias estructurales, que pueden alterar su bioequivalencia y afectar sus propiedades farmacocinéticas [9] (Figura 2). Estas diferencias se centran básicamente en la presencia de fosfato esterificado en los almidones derivados de la patata y un ratio C2/C6 distinto [10] (ver Tabla 2). Como se ha comentado anteriormente, un ratio C2/ C6 elevado contrarresta la hidrólisis por la amilasa plasmática, retardando la degradación. En cambio, el INFOCOLLOIDS no 19: EVOLUCIÓN DE LOS COLOIDES SINTÉTICOS EN LA TERAPIA DE REEMPLAZO DE VOLUMEN EN EL PERIOPERATORIO Tabla 2: Diferencias fisicoquímicas entre los HEA 130/0,4 derivados del maíz y los HEA 130/0,42 derivados de la patata Sustitución molar Ratio C2/C6 Grado de enramado HEA 130/0,4 derivado del maíz (1) HEA 130/0,42 derivado de la patata (2) 0,41 0,45-0,46 9,05:1 6,9-7,7 6,6% mol% 4,8-5,1 mol% Fosfato libre - 34-84 ppm Fosfato total 15 ppm 205-290 ppm (1): Voluven® (Fresenius Kabi, Bad Homburg, Germany). (2): Venofundin® (B Braun, Melsungen, Germany), Vitahes® (Serumwerk Bernburg; vBernburg, Germany) o PlasmaVolume Redibag® (Baxter, Unterschleißheim, Germany). ppm: partes por millón. Modificado de Sommermeyer y col. [10]. PM medio ligeramente superior de los productos derivados de la patata puede retardar su eliminación. resto cadenas lineares de amilosa (B). El grado de enramado del almidón derivado de la patata es pues inferior al almidón del maíz. El almidón derivado del maíz (HEA 130/0,4) está principalmente compuesto por amilopectina enramada (aproximadamente un 98%) (A). El almidón derivado de la patata (HEA 130/0,42) es una mezcla heterogénea de amilopectina (sobre un 75%) y el Existen datos clínicos y experimentales que demuestran que el HEA 6% 130/0,4 derivado del maíz podría tener efectos biológicos distintos comparado con el HEA 6% 130/0,42 derivado de la patata, con un aumento del flujo sanguíneo a nivel de la microcirculación y una potencial reducción de la inflamación pulmonar [11] . A 3.3 Perfil de seguridad de los HEA En la última década se han publicado diversos estudios describiendo efectos adversos con la administración de HEA (12-15). A raíz de estos trabajos, en Octubre del 2013 el comité de fármaco vigilancia (PRAC) de la Agencia Europea del Medicamento (EMA) concluyó que los HEA no deben usarse en pacientes sépticos, quemados o en pacientes críticos por el riesgo aumentado de lesión renal y mortalidad, pero que pueden seguir usándose para tratar la hipovolemia causada por sangrado agudo siempre y cuando se tomen las medidas pertinentes para reducir los riesgos potenciales y se lleven a cabo más estudios al respecto [16] . Para entender el origen y las consecuencias de esta recomendación es importante diferenciar los estudios de B Figura 2. Diferencias en la estructura de la amilopectina (A) (cadenas enramadas) y la amilopectina amilosa (B) (cadenas largas). Es importante diferenciar los estudios de beneficio/riesgo realizados en la UCI y los realizados en el perioperatorio en el paciente quirúrgico. 7 Balance hídrico (% peso) 30 CRYSTMAS CRISTAL CHEST 6S 20 Resucitación inicial Mantenimiento Recuperación 10 0 Tiempo Figura 3. Fluidoterapia en el paciente crítico La recomendación de la PRAC se fundamentó principalmente en estudios comparativos en paciente crítico, diseñados específicamente para evaluar los efectos del HEA versus el correspondiente cristaloide. Los dos estudios más importantes fueron el estudio 6S y el estudio CHEST. El estudio 6S [14] evaluó el HEA 6% 130/0,42 derivado de la patata con una solución de Ringer acetato versus Ringer acetato y el estudio CHEST [15], el HEA 6% 130/0,4 derivado del maíz en una solución salina versus salino. El primer estudio describe un aumento de mortalidad en los pacientes tratados con HEA, no corroborado en el estudio CHEST, y ambos concluyen que la administración de HEA puede provocar o agravar una insuficiencia renal aguda en un grado significativamente mayor que la administración de cristaloide. ellas es la indicación y el momento de la administración del coloide. Los datos basales de inclusión de los pacientes no son indicativos de hipovolemia ni de inestabilidad hemodinámica, sugiriendo que en el momento de inclusión se hallaban en fase de post resucitación (Figura 3). El estudio CRYSTMAS [17], en cambio, comparó durante las primeras horas de ingreso en pacientes inestables con hipovolemia documentada, el HEA 6% 130/0,4 derivado del maíz en una solución salina versus salino sin hallar diferencias en la incidencia de insuficiencia renal entre ambos grupos. Otro trabajo en pacientes en shock hipovolémico, el estudio CRISTAL [18], no halló diferencias en la mortalidad a los 28 días entre el uso de coloides y cristaloides y sí menor mortalidad a los 90 días en el grupo coloides. Tampoco hubo diferencias entre los grupos a nivel de la función renal. Estas diferencias parecen indicar que la administración de HEA en pacientes con hipovolemia y la fase de resucitación precoz no presenta los riesgos descritos cuando su administración se realiza en fase de mantenimiento y en pacientes sin indicadores de hipovolemia. Tanto el estudio 6S como el estudio CHEST han sido criticados por varias razones. La primera de Otras de las críticas realizadas al estudio 6S y CHEST han sido la falta de algoritmos de resucitación y la beneficio/riesgo realizados en la UCI (paciente crítico) y los realizados en el perioperatorio en el paciente quirúrgico. ENEFICIO/RIESGO DE LOS HEA EN EL B PACIENTE CRÍTICO 8 INFOCOLLOIDS no 19: EVOLUCIÓN DE LOS COLOIDES SINTÉTICOS EN LA TERAPIA DE REEMPLAZO DE VOLUMEN EN EL PERIOPERATORIO incorrecta dosificación del HEA, llegando en algunos casos a dosis mayores de las permitidas. Durante el 2013, varios metaanálisis sobre seguridad de los HEA en pacientes críticos [19‑23] incluyeron estos dos grandes estudios. La revisión del comité del estudio CHEST reevaluó la cantidad de diuresis y la necesidad de terapia de remplazo renal tras la administración de HEA 6% 130/0,4 y concluyó que no existían suficientes datos para elaborar una conclusión definitiva [19] . En cambio, otro metaanálisis describe que los coloides aumentan el uso de terapia de sustitución renal y transfusión [20] . Una nueva edición de la revisión sistemática elaborada por la Cochrane sobre el efecto de los HEA en la función renal, sigue recomendando la no administración de estos coloides en todo tipo de paciente crítico, tanto séptico como no séptico [23] . En general, los principales hallazgos descritos fueron que los pacientes asignados al grupo HEA tendrían un riesgo mayor de mortalidad y de someterse a terapia de sustitución renal. Cabe resaltar que ninguna de estas revisiones sistemáticas tuvo en cuenta la gran heterogeneidad de los estudios incluidos, en referencia tanto a las diferentes poblaciones de pacientes como a los distintos tipos de HEA (particularmente en términos de peso molecular, coeficiente de sustitución, material de procedencia y concentración). Esta prohibición puede conllevar a una administración de grandes cantidades de cristaloides, albúmina y/o concentrado de hematíes. En resumen, a pesar de las críticas recibidas y de las deficiencias metodológicas descritas en los estudio principales en los que se basó la recomendación de la PRAC, esta fue incorporada por la EMA y actualmente los HEA no deben usarse en pacientes sépticos, quemados o en pacientes críticos por el riesgo aumentado de lesión renal y mortalidad. Algunos autores advierten que esta prohibición puede conllevar una administración de grandes cantidades de cristaloides, albúmina y/o concentrados de hematíes en el futuro, y sugieren realizar un seguimiento teniendo en cuenta estas consideraciones [24]. BENEFICIO/RIESGO DE LOS HEA EN EL PACIENTE QUIRÚRGICO En el paciente quirúrgico también se ha revisado la seguridad renal de los HEA sin hallar los efectos secundarios descritos en el paciente crítico. Los dos últimos metaanálisis en pacientes en el contexto perioperatorio [25, 26] vienen a apoyar los resultados de la revisión de Van der Linden [6] , que evaluó también específicamente su uso en pacientes quirúrgicos y no halló aumento de riesgo de complicaciones. En cambio, describen que el uso de HEA 130/0,4 en el intraoperatorio se asoció a una disminución significativa de los pacientes transfundidos [27] . El primer metaanálisis, publicado en 2013, tiene además en cuenta la procedencia del almidón (maíz o patata) y evalúa exclusivamente los estudios realizados con HEA derivado del maíz en pacientes quirúrgicos [25]. Los autores concluyen que actualmente no existe evidencia de que este producto produzca cambios en la creatinina plasmática, el aclaramiento de creatinina o la incidencia de insuficiencia renal aguda. Tal como se ha detallado anteriormente, ambas soluciones poseen diferencias estructurales, que pueden alterar su bioequivalencia y afectar sus propiedades farmacocinéticas [9]. La otra revisión sistemática en pacientes exclusivamente quirúrgicos, publicada en 2014, tampoco halla un aumento de mortalidad ni de insuficiencia renal aguda con la administración de HEA comparado con otros coloides o cristaloides [26]. Estas revisiones centradas sólo en el contexto perioperatorio incluyen, en comparación con las realizadas en paciente crítico, un número significativamente menor de pacientes. Esto es debido a que los estudios en pacientes quirúrgicos son relativamente pocos si se comparan a los realizados en paciente crítico. Además, como la mayoría fueron realizados antes de la sospecha de efectos a largo plazo de los HEA, el seguimiento de los pacientes es relativamente corto. Ambos factores podrían explicar en parte los diferentes resultados entre 9 pacientes quirúrgicos y críticos, pero varios autores apuntan que la principal diferencia sería el tipo de población estudiada y la patología subyacente [5, 6]. Tanto el shock séptico como la hipoxia pueden degradar el glicocálix, resultando en la extravasación de moléculas grandes y fluido al espacio extravascular. En condiciones normales, el glicocálix endovascular actúa como una barrera selectiva para intercambio de fluidos y moléculas entre el espacio intravascular y el intersticio y su degradación provoca un edema tisular inmediato [7]. La extravasación de HEA, junto al aumento de requerimiento de aumento de volumen en pacientes sépticos, podría provocar una pérdida de su función oncótica intravascular creando una necesidad adicional de fluidoterapia y una gran cantidad de HEA extravascular. Ambas circunstancias podrían haber contribuido al aumento de mortalidad tardía observada en el estudio 6S. 4.- GELATINAS Las gelatinas, a diferencia de los almidones que tienen una procedencia vegetal, proceden de la degradación del colágeno animal. La obtención a partir de huesos de bovinos (incluidas vértebras) plantea la duda de la transmisión de priones [28]. Las gelatinas las hay de varios tipos, las dos más usadas son la gelatina poligelina 3,5% (Hemoce®) y la gelatina succinilada 4% (Gelafundina®). El peso molecular medio de estas gelatinas es aproximadamente de 30-35 KD, menor a los otros coloides. Las poligelinas están dispersas en una solución electrolítica que contiene Na+ 145, K+ 5.1, Ca++ 6.25, y Cl− 145 mmol/l. En caso de infundir volúmenes elevados pueden incrementar el calcio sérico [28]. Las gelatinas succiniladas están dispersas en soluciones que generalmente contienen Na+ 154, K+ 0.4, Ca++ 0.4, y Cl −120 mmol/l. 10 (alrededor de un 70-80%) y a consecuencia de su rápido paso al espacio intersticial, filtración glomerular y anclaje a proteasas tienen una duración de acción menor a los HEA, requiriendo mayor volumen para ejercer el mismo efecto [28] (Tabla 3). El volumen de expansión de las gelatinas es menor que el volumen infundido, alrededor del 70-80%, requiriendo mayor volumen para ejercer el mismo efecto que los HEAs. En cuanto a sus propiedades farmacocinéticas, todas las gelatinas tienen un poder de expansión de volumen similar y una vida media de aproximadamente 2,5 horas. Al cabo de 24 horas post administración, el 13% permanece en el espacio intravascular, el 16% en el espacio intersticial, el 71% se ha aclarado vía renal y una pequeña proporción queda anclada a las proteasas del sistema retículo endotelial. Respecto a los efectos secundarios de las gelatinas, el principal son las reacciones alérgicas. A pesar de que Gelafundina ®, por haber eliminado los enlaces de urea, muestra una menor incidencia de reacciones anafilácticas-anafilactoides que Hemocé ® (0,345% vs 0,852%), es mayor que los HEA (0,058%) [29, 30] . Clásicamente, se suponía que las gelatinas no alteraban de forma significativa la coagulación. Sin embargo, estudios con tromboelastografía demuestran que pueden alterar la función plaquetaria y la polimerización de fibrina [31] . Debido a su menor peso molecular, su efecto oncótico es menor al de otros coloides. El volumen de expansión es menor que el volumen infundido Los efectos sobre la función renal han sido mucho menos estudiados que los almidones. A diferencia de estos últimos, se han realizado pocos estudios INFOCOLLOIDS no 19: EVOLUCIÓN DE LOS COLOIDES SINTÉTICOS EN LA TERAPIA DE REEMPLAZO DE VOLUMEN EN EL PERIOPERATORIO Tabla 3. Características de las soluciones de gelatina. Gelatina succinilada 4% (Gelafundina®) Gelatina poligelina 3,5% (Hemoce®) Concentración (%) 4.0 3.5 PM Medio (KDaltons) 30 35 Efecto volémico inicial (%) 70 70 Efectividad volémica (horas) 1-3 1-3 Osmolaridad (mOsm/L) 274 301 aleatorizados comparativos entre gelatinas y cristaloides. Un estudio en pacientes críticos describe que su uso también puede asociarse con el riesgo de insuficiencia renal aguda [12]. Una revisión sistemática recient e evaluó los estudios comparativos entre gelatinas, albúmina y cristaloides, incluyendo más de 3000 pacientes críticos y quirúrgicos [32]. Los autores no hallan diferencias en la mortalidad o disfunción renal, aunque el periodo de estudio fue inferior a 24 horas en a mayoría de los estudios. En cambio, describen diferencias significativas en cuanto a la necesidad de productos alogénicos y reacciones adversas (principalmente A pesar de llevar más de 60 años utilizándose, su eficacia y seguridad no puede evaluarse con fiabilidad. prurito) en el grupo de gelatinas. Los autores concluyen que a pesar de llevar más de 60 años utilizándose, su eficacia y seguridad no puede evaluarse con fiabilidad en algunos tipos de pacientes por falta de evidencia, sugiriendo la necesidad de poder establecerla. 11 5.- CONCLUSIONES • Los coloides sintéticos deben considerarse fármacos y su prescripción debe regirse teniendo en cuenta su indicación, toxicidad y respuesta terapéutica. Los hidroxietilalmidones (HEA) poseen un mayor efecto oncótico y menos incidencia de reacciones alérgicas que las gelatinas. El desarrollo de nuevos HEA ha permitido mejorar sus propiedades farmacológicas favoreciendo una menor acumulación plasmática y tisular. En comparación con los almidones, las gelatinas han sufrido un menor desarrollo en los últimos años y sido menos estudiadas. • El contexto clínico del paciente y la integridad de la membrana vascular son factores determinantes a la hora de escoger el tipo de fluido para el remplazo de volumen. En el paciente crítico, y tras las últimas recomendaciones, las soluciones cristaloides balanceadas parecen ser las indicadas para tratar la hipovolemia absoluta o relativa. Sin embargo, en la resucitación aguda de la depleción de volumen y cuando su administración se limita a una estabilización hemodinámica inmediata, la seguridad de los HEA y de las gelatinas todavía no ha sido suficientemente demostrada. • En el paciente quirúrgico, en condiciones de euvolemia y con integridad del glicocálix, la infusión de coloides permitiría mantener mejor la expansión plasmática que los cristaloides. Esto podría explicar los beneficios de los coloides en la terapia dirigida por objetivos durante cirugía mayor. En pacientes quirúrgicos con hipovolemia o shock, los coloides restauran el volumen intravascular y la perfusión tisular más rápidamente que los cristaloides. En el 12 INFOCOLLOIDS no 19: EVOLUCIÓN DE LOS COLOIDES SINTÉTICOS EN LA TERAPIA DE REEMPLAZO DE VOLUMEN EN EL PERIOPERATORIO contexto perioperatorio, la toxicidad cualitativa asociada a los HEA no ha sido demostrada y todavía hay menos evidencia con otros coloides sintéticos como las gelatinas. • La prohibición absoluta de los coloides sintéticos puede conllevar una administración de grandes cantidades de cristaloides, albúmina y/o concentrados de hematíes, siendo necesarios nuevos estudios prospectivos teniendo en cuenta todos estos puntos. Otros aspectos importantes en la fluidoterapia, como la carga clorhídrica o la severidad de la alteración fisiopatológica subyacente, también deberían ser tenidos en cuenta para futuros estudios, tanto en el paciente crítico como en el quirúrgico. 13 6.- B IBLIOGRAFÍA 1. Grocott MP, Mythen MG, Gan TJ. Perioperative fluid management and clinical outcomes in adults. Anesth Analg 2005; 100(4):1093-106. 2. Corcoran T, Joy JE, Clarke S, Myles PS, Kwok M. Perioperative fluid management strategies in major surgery: a stratified meta-analysis. Anesthesia & Analgesia.2012;114: 640-51. 3. Boland M, Noorani A, Varty K, Coffey JC, Agha R, Walsh ST. Perioperative Fluid Restriction in Major Abdominal Surgery: Systematic Review and Meta-analysis of Randomized, Clinical Trials. World J Surg. 2013; 34:1193-202 4. Hartog CS, Bauer M, Reinhart K The efficacy and safety of colloid resuscitation in the critically ill. Anesth Analg 2011; 112(1): 156-64. 5. Raghunathan K, Shaw AD, Bagshaw SM Fluids are drugs: type, dose and toxicity. Curr Opin Crit Care 2013; 19(4):290-8. 6. Van Der Linden P, James M, Mythen M, et al. Safety of modern starches used during surgery. Anesth Analg 2013; 16(1):35-48. 7. Myburgh JA, Mythen MG Resuscitation fluids. N Engl J Med 2013; 369(13):1243-51. 8. Jungheinrich C The starch family: are they all equal? Pharmacokinetics and pharmacodynamics of hydroxyethyl starches. Transfus Altern Transfus Med 2007; 9(3):152-63 9. Westphal M, James MF, Kozek-Langenecker SK, et al . Hydroxyethyl starches: Different products – different effects. Anesthesiology 2009; 111(1):187-202. 10. Sommermeyer K, Cech F, Schossow R: Differences in chemical structures between waxy maize- and potato-starch-based hydroxyethyl starch volume therapeutics. Transfus Altern Transfus Med 2007; 9:127–33 11. Ertmer C, Kampmeier T, Van Aken H Fluid therapy in critical illness: a special focus on indication, the use of hydroxyethyl starch and its different raw materials. Curr Opin Anaesthesiol 2013; 26(3):253-60 12. Schortgen F, Lacherade JC, Bruneel F, Cattaneo I, Hemery F, Lemaire F, Brochard L. Effects of hydroxyethylstarch and gelatin on renal function in severe sepsis: a multicentre randomized study. Lancet 2001;357:911–6 13. Bayer O, Reinhart K, Sakr Y, Kabisch B, Kohl M, Riedemann NC, Bauer M, Settmacher U, Hekmat K, Hartog CS. Renal effects of synthetic colloids and crystalloids in patients with severe sepsis: a prospective sequential comparison. Crit Care Med 2011;39:1335–42 14. 15. 16. 17. 14 Perner A, Haase N, Guttormsen AB, Tenhunen J, Klemenzson G, Åneman A, Madsen KR, Møller MH, Elkjær JM, Poulsen LM, Bendtsen A, Winding R, Steensen M, Berezowicz P, Søe-Jensen P, Bestle M, Strand K, Wiis J, White JO, Thornberg KJ, Quist L, Nielsen J, Andersen LH, Holst LB, Thormar K, Kjældgaard AL, Fabritius ML, Mondrup F, Pott FC, Møller TP, Winkel P, Wetterslev J; 6S Trial Group; Scandinavian Critical Care Trials Group. Hydroxyethyl starch 130/0.42 versus Ringer’s acetate in severe sepsis. N Engl J Med 2012;367:124–34 Myburgh J, Li Q, Heritier S, Dan A, Glass P; Crystalloid Versus Hydroxyethyl Starch Trial (CHEST) Management Versus Hydroxyethyl Starch Trial (CHEST). Crit Care Resusc 2012;14:44–52 European Medicines Agency (EMA) PRAC confirms that hydroxyethyl-starch solutions (HES) should no longer be used in patients with sepsis or burn injuries or in critically ill patients. Press Release. Available from http://www.ema.europa.eu/ ema/index.jsp?curl=pages/news_and_events/news/2013/10/ ne ws_detail_001917.jsp&mid=WC0b01ac058004d5c1. Guidet B, Martinet O, Boulain T, Philippart F, Poussel JF, Maizel J, Forceville X, Feissel M, Hasselmann M, Heininger A, Van Aken H. Assessment of hemodynamic efficacy and safety of 6% hydroxyethylstarch 130/0.4 vs. 0.9% NaCl fluid replacement in patients with severe sepsis: the CRYSTMAS study. Crit Care 2012;16:R94 18. Effects of Fluid Resuscitation With Colloids vs Crystalloids on Mortality in Critically Ill Patients Presenting With Hypovolemic Shock The CRISTAL Randomized Trial. Annane D, Siami S, Jaber S et al. JAMA 2013 Nov 6;310(17):1809-17. 19. Gattas DJ, Dan A, Myburgh J, et al. Fluid resuscitation with 6 % hydroxyethyl starch (130/0.4 and 130/0.42) in acutely ill patients: systematic review of effects on mortality and treatment with renal replacement therapy. Intensive Care Med 2013; 39(4):558-68. 20. Haase N, Perner A, Hennings LI, et al. Hydroxyethyl starch 130/0.38-0.45 versus crystalloid or albumin in patients with sepsis: systematic review with meta-analysis and trial sequential analysis. Br Med J 2013; 346:f839 21. Patel A, Waheed U, Brett SJ: Randomised trials of 6 % tetrastarch (hydroxyethyl starch 130/0.4 or 0.42) for severe sepsis reporting mortality: systematic review and meta-analysis. Intensive Care Med 2013, 39:811-822 22. Zarychanski R, Abou-Setta AM, Turgeon AF, Houston BL, McIntyre L, Marshall JC, Fergusson DA: Association of hydroxyethyl starch administration with mortality and acute kidney injury in critically ill patients requiring volume resuscitation: a systematic review and meta-analysis. JAMA 2013, 309:678688. 23. Mutter TC, Ruth CA, Dart AB Hydroxyethyl starch (HES) versus other fluid therapies: effects on kidney function. Cochrane Database Syst Rev 2013 Jul 23;7:CD007594. 24. Meybohm P, Van Aken H, De Gasperi A, et al. Re-evaluating currently available data and suggestions for planning randomised controlled studies regarding the use of hydroxyethylstarch in critically ill patients - a multidisciplinary statement. Crit Care 2013; 17(4):R166. 25. Martin C, Jacob M, Vicaut E, et al. Effect of waxy maize-derived hydroxyethyl starch 130/0.4 on renal function in surgical patients. Anesthesiology 2013; 118(2):387-94. 26. Gillies MA, Habicher M, Jhanji S, et al. Incidence of postoperative death and acute kidney injury associated with i.v. 6% hydroxyethyl starch use: systematic review and meta-analysis. Br J Anaesth 2014 Jan; 112(1):25-34. 27. Kozek-Langenecker SA, Jungheinrich C, Sauermann W, et al. The effects of hydroxyethyl starch 130/0.4 (6%) on blood loss and use of blood products in major surgery: A pooled analysis of randomized clinical trials. Anesth Analg 2008; 107(2):38290. 28. Perioperative Crystalloid and Colloid Fluid Management in Children: Where Are We and How Did We Get Here? Bailey AG, McNaull PP, Jooste E, Tuchman JB. Anesth Analg 2010;110:375– 90 29. Laxenaire MC, Charpentier C, Feldman L. Anaphylactoid reactions to colloid plasma substitutes: incidence, risk factors, mechanisms. A French multicenter prospective study. Ann Fr Anesth Réanim. 1994;13(3):301-10. 30. Lundsgaard-Hansen P, Tschirren B. Clinical experience with 120.000 units of modified fluid gelatin. Dev Biol Stand. 1980;48:251-6. 31. Adamson JW. New blood, old blood, or no blood? N Engl J Med 2008; 358:1295-1296 32. D. O. Thomas-Rueddel DO, Vlasakov V, Reinhart K, et al. Safety of gelatin for volume resuscitation—a systematic review and meta-analysis. Intensive Care Med 2012; 38:1134–1142 INFOCOLLOIDS no 19: EVOLUCIÓN DE LOS COLOIDES SINTÉTICOS EN LA TERAPIA DE REEMPLAZO DE VOLUMEN EN EL PERIOPERATORIO FICHA TÉCNICA Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas. Ver la sección 4.8, en la que se incluye información sobre cómo notificarlas. 1. NOMBRE DEL MEDICAMENTO. Voluven® y Volulyte® 6% solución para perfusión. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA. Voluven® 6%: 1000 ml de solución para perfusión contienen: Poli (O-2-hidroxietil) almidón: 60,00 g (Sustitución molar: 0,38-0,45; Peso molecular medio: 130.000 Da). Cloruro de sodio: 9,00 g. Electrolitos: Na+: 154 mmol; Cl-: 154 mmol. Osmolaridad teórica: 308 mosmol/l. pH: 4,0-5,5. Acidez titulable: < 1,0 mmol NaOH/l. Volulyte® 6%: 1000 ml de solución para perfusión contienen: Poli (O-2-hidroxietil) almidón 60,00 g (Sustitución molar: 0,38-0,45; Peso molecular medio: 130.000 Da). Acetato sódico trihidrato: 4,63 g. Cloruro sódico: 6,02 g. Cloruro potásico: 0,30 g. Cloruro magnésico hexahidrato: 0,30 g. Electrolitos: Na+: 137,0 mmol/l; K+: 4,0 mmol/l; Mg++: 1,5 mmol/l; Cl-: 110,0 mmol/l; CH3COO -: 34,0 mmol/l. Osmolaridad teórica: 286,5 mosm/l. Acidez titulable: < 2,5 mmol NaOH/l. pH: 5,7-6,5. Para consultar la lista completa de excipientes, ver sección 6.1. 3. FORMA FARMACÉUTICA. Solución para perfusión. Solución transparente o ligeramente opalescente, incolora a ligeramente amarilla. 4. DATOS CLÍNICOS. 4.1. Indicaciones terapéuticas. Tratamiento de la hipovolemia causada por hemorragia aguda cuando el tratamiento sólo con cristaloides no se considere suficiente (ver secciones 4.2, 4.3 y 4.4). 4.2. Posología y forma de administración. Para perfusión intravenosa. El uso de soluciones de hidroxietil-almidón (HEA) se debe restringir a la fase inicial de restauración del volumen y no se deben utilizar durante más de 24 h. Los primeros 10-20 ml se deben perfundir lentamente y bajo estrecha vigilancia del paciente para detectar lo antes posible cualquier reacción anafiláctica/anafilactoide. La dosis diaria y la velocidad de perfusión dependen de la pérdida de sangre del paciente, del mantenimiento o restablecimiento de la hemodinámica y de la hemodilución (efecto dilución). La dosis máxima diaria es de 30 ml/kg de Voluven® o Volulyte® 6%. Se debe utilizar la dosis efectiva más baja posible. El tratamiento debe ser guiado por una monitorización hemodinámica continua, para que la perfusión se detenga en cuanto se hayan alcanzado los objetivos hemodinámicos adecuados. No se debe exceder la dosis máxima diaria recomendada. Población pediátrica: Los datos en niños son limitados por tanto, no se recomienda el uso de medicamentos que contengan hidroxietil-almidón en esta población. Para las instrucciones de uso referirse al epígrafe 6.6. 4.3. Contraindicaciones. - Hipersensibilidad a los principios activos o a alguno de los excipientes incluidos en la sección 6.1. - Sepsis. - Pacientes quemados. - Insuficiencia renal o terapia de reemplazo renal. - Hemorragia intracraneal o cerebral. - Pacientes críticos (normalmente ingresados en la unidad de cuidados intensivos). - Hiperhidratación. - Edema pulmonar. - Deshidratación. - Hiperpotasemia grave (Volulyte® 6%). - Hipernatremia grave o hipercloremia grave. - Insuficiencia hepática grave. - Insuficiencia cardiaca congestiva. - Coagulopatía grave. - Pacientes trasplantados. 4.4. Advertencias y precauciones especiales de empleo. Debido al riesgo de reacciones alérgicas (anafilácticas/anafilactoides), el paciente se debe monitorizar estrechamente y la perfusión se debe iniciar a velocidad baja (ver sección 4.8). Cirugía y trauma: No hay datos robustos de seguridad a largo plazo en pacientes sometidos a procedimientos quirúrgicos y en pacientes con trauma. Debe valorarse cuidadosamente el beneficio esperado del tratamiento frente a la incertidumbre con respecto a la seguridad a largo plazo. Se deben considerar otras opciones de tratamiento disponibles. La indicación para la reposición de volumen con HEA se tiene que valorar cuidadosamente, y es necesaria una monitorización hemodinámica para el control del volumen y de la dosis (ver también sección 4.2.). Se debe evitar siempre una sobrecarga de volumen debido a una sobredosis o a una perfusión demasiado rápida. Se debe ajustar cuidadosamente la dosis, en particular en pacientes con problemas pulmonares y cardiocirculatorios. Se deben controlar estrechamente los electrolitos séricos, el equilibrio hídrico y la función renal. Los medicamentos que contienen hidroxietil-almidón están contraindicados en pacientes con insuficiencia renal o terapia de reemplazo renal (ver sección 4.3). Se debe interrumpir el tratamiento con hidroxietil-almidón al primer signo de daño renal. Se ha notificado un incremento de la necesidad de terapias de reemplazo renal hasta 90 días después de la administración de hidroxietil-almidón. Se recomienda un seguimiento de la función renal en los pacientes durante al menos 90 días. Se debe tener especial precaución al tratar a pacientes con insuficiencia hepática o con trastornos de la coagulación sanguínea. En el tratamiento de pacientes hipovolémicos, también se debe evitar una hemodilución grave como consecuencia de la administración de altas dosis de soluciones de hidroxietil-almidón. En el caso de administración repetida, se deben controlar cuidadosamente los parámetros de coagulación sanguínea. Interrumpir el uso de hidroxietil-almidón al primer signo de coagulopatía. No se recomienda el uso de medicamentos que contengan hidroxietil-almidón en pacientes sometidos a cirugía a corazón abierto en asociación con bypass cardiopulmonar, debido al riesgo de hemorragia excesiva. En el caso de Volulyte®, se debe prestar especial atención a pacientes con anomalías electrolíticas como hipercalemia, hipernatremia, hipermagnesemia e hipercloremia. En alcalosis metabólica y en aquellas situaciones clínicas en que deba evitarse una alcalinización, deben ser elegidas soluciones salinas como un producto similar que contenga HES 130/0,4 en una solución de cloruro sódico 0,9% en lugar de soluciones alcalinizantes como Volulyte® 6%. Población pediátrica: Los datos en niños son limitados por tanto, no se recomienda el uso de medicamentos que contengan hidroxietil-almidón en esta población (ver sección 4.2). 4.5. Interacciones con otros medicamentos y otras formas de interacción. En el caso de Volulyte®, no se conocen interacciones con otros medicamentos o productos nutricionales hasta la fecha. Se debe prestar atención a la administración concomitante de medicamentos que pueden causar retención de sodio o de potasio. En el caso de Voluven® 6%, no se han realizado estudios de interacciones. En relación al posible aumento de la concentración de amilasa sérica durante la administración de hidroxietil-almidón y su interferencia con el diagnóstico de pancreatitis, ver la sección 4.8. 4.6. Fertilidad, embarazo y lactancia. Embarazo. No se dispone de datos clínicos sobre el uso de Voluven® y Volulyte® 6% durante el embarazo. Existen datos limitados de estudios clínicos sobre el uso de una dosis única de HEA 130/0,4 (6%) en mujeres embarazadas sometidas a cesárea con anestesia raquídea. No se ha detectado ninguna influencia negativa de HEA 130/0,4 (6%) en NaCl 0,9% en la seguridad de las pacientes; tampoco se detectó ninguna influencia negativa sobre los neonatos (ver sección 5.1). Estudios en animales con un producto similar que contiene HES 130/0,4 en una solución de cloruro sódico 0,9% no indican efectos perjudiciales respecto al embarazo, desarrollo embriofetal, parto o desarrollo postnatal (ver sección 5.3). No se ha observado evidencia de teratogenicidad. Volulyte® 6% o Voluven® 6% deben ser utilizados durante el embarazo sólo si el beneficio potencial justifica el riesgo potencial para el feto. Lactancia. Se desconoce si el hidroxietil almidón se excreta a través de la leche materna humana. No se ha estudiado la excreción del hidroxietil-almidón en la leche de animales. La decisión sobre continuar/discontinuar la lactancia o continuar/discontinuar la terapia con Voluven® o Volulyte® 6% se debe tomar teniendo en cuenta el beneficio de la lactancia para el niño y el beneficio de la terapia con Voluven® o Volulyte® 6% para la mujer. No se dispone actualmente de datos clínicos sobre el uso de Voluven® 6% en mujeres en periodo de lactancia. 4.7. Efectos sobre la capacidad para conducir y utilizar maquinaria. Voluven® o Volulyte® 6% no ejerce influencia sobre la capacidad para conducir o utilizar maquinaria. 4.8. Reacciones adversas. Las reacciones adversas se dividen en: muy frecuentes (≥ 1/10), frecuentes (≥ 1/100, < 1/10), poco frecuentes (≥ 1/1000, < 1/100), raras (≥ 1/10.000, < 1/1000), muy raras (< 1/10.000), frecuencia no conocida (no puede estimarse a partir de los datos disponibles). Trastornos de la sangre y del sistema linfático. Raras (a dosis elevadas): Con la administración de hidroxietil almidón pueden aparecer alteraciones de la coagulación sanguínea dependiendo de la dosis. Trastornos del sistema inmunológico. Raras: Los medicamentos que contienen hidroxietil-almidón pueden dar lugar a reacciones anafilácticas/anafilactoides (hipersensibilidad, síntomas leves de gripe, bradicardia, taquicardia, broncoespasmo, edema pulmonar no cardíaco). En el caso de que aparezca una reacción de intolerancia la perfusión se debe interrumpir inmediatamente e iniciar el tratamiento médico de emergencia apropiado. Trastornos de la piel y del tejido subcutáneo. Frecuentes (dosis dependiente): La administración prolongada de altas dosis de hidroxietil-almidón puede causar prurito (picor) que es un efecto indeseable conocido de los hidroxietil almidones. El picor puede no aparecer hasta semanas después de la última perfusión y puede persistir durante meses, en el caso de Volulyte®. Exploraciones complementarias. Frecuentes (dosis dependiente): La concentración del nivel de amilasa sérica puede aumentar durante la administración de hidroxietil almidón y puede interferir con el diagnóstico de la pancreatitis. La amilasa elevada es debido a la formación de un complejo enzima-sustrato de amilasa y hidroxietil-almidón sujeto a una baja eliminación y no debe considerarse diagnóstico de pancreatitis. Frecuentes (dosis dependiente): A altas dosis los efectos de dilución pueden dar lugar a la correspondiente dilución de los componentes de la sangre tales como los factores de coagulación y otras proteínas plasmáticas y a una disminución del hematocrito. Trastornos hepatobiliares. Frecuencia no conocida (no puede estimarse a partir de los datos disponibles): Daño hepático. Trastornos renales y urinarios. Frecuencia no conocida (no puede estimarse a partir de los datos disponibles): Daño renal. Notificación de sospechas de reacciones adversas. Es importante notificar las sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del Sistema Español de Farmacovigilancia de Medicamentos de Uso Humano, http://www.notificaram.es. 4.9. Sobredosis. Como con todos los sustitutos de volumen, la sobredosificación puede dar lugar a una sobrecarga del sistema circulatorio (ej. edema pulmonar). En este caso, se debe interrumpir inmediatamente la perfusión y si fuera necesario se debe administrar un diurético. 5. PROPIEDADES FARMACOLÓGICAS. Ver Ficha Técnica completa. 6. CARACTERÍSTICAS FARMACÉUTICAS. 6.1. Lista de excipientes. Hidróxido sódico (para ajuste de pH). Ácido clorhídrico (para ajuste de pH). Agua para preparaciones inyectables. 6.2. Incompatibilidades. En ausencia de estudios de compatibilidad, este medicamento no se debe mezclar con otros productos. En el caso de Voluven®, si en casos excepcionales se necesitara realizar una mezcla con otros medicamentos, se tiene que tener un especial cuidado en lo que se refiere a la compatibilidad (enturbiamiento o precipitación), inyección aséptica y una buena mezcla. 6.3. Periodo de validez. a) Caducidad del producto en su envase comercial: Para Voluven®- Botella de vidrio: 5 años, Bolsa Freeflex: 3 años, Bolsa de PVC: 2 años. Para Volulyte®- Frasco de vidrio: 4 años, Bolsa Freeflex: 3 años. b) Caducidad después de la primera apertura del envase: Se debe utilizar el producto inmediatamente después de abrir el envase. 6.4. Precauciones especiales de conservación. Este medicamento no requiere condiciones especiales de conservación. No congelar. 6.5. Naturaleza y contenido de los envases. Frascos de vidrio incoloro tipo II con tapón de caucho halobutilo y cápsula de aluminio. Para Volulyte®: 1 x 250 ml, 10 x 250 ml; 1 x 500 ml, 10 x 500 ml. Y para Voluven®: 10 x 250 ml, 10 x 500 ml. Bolsa de poliolefina (Freeflex) con sobrebolsa. Para Volulyte®: 1 x 250 ml, 20 x 250 ml, 30 x 250 ml. 35 x 250 ml, 40 x 250 ml. 1 x 500 ml, 15 x 500 ml, 20 x 500 ml. Y para Voluven®: 10 x 250 ml, 20 x 250 ml, 40 x 250 ml, 10 x 500 ml, 15 x 500 ml, 20 x 500 ml. Bolsa de PVC: 25 x 250 ml, 15 x 500 ml. Es posible que no todos los tamaños de envase sean comercializados. 6.6. Precauciones especiales de eliminación y otras manipulaciones. Para un solo uso. Para uso inmediato tras apertura del frasco o bolsa. No utilizar pasada la fecha de caducidad. La solución no utilizada se debe eliminar. Utilizar únicamente soluciones transparentes y libres de partículas y envases intactos. Retirar la sobrebolsa de la bolsa de poliolefina (freeflex) y bolsa de PVC previamente a su uso. La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él se realizará de acuerdo con la normativa local. 7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN. FRESENIUS KABI DEUTSCHLAND GmbH. 61346 Bad Homburg v.d.H. Alemania. 8. NÚMERO DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN. Voluven® 6%: 64.001. Volulyte® 6%: 70228. 9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN. Voluven® 6%: Fecha de la primera autorización: agosto 1999. Fecha de la última revalidación: Agosto 2004. Volulyte® 6%: Noviembre 2008. 10. FECHA DE LA REVISIÓN (PARCIAL) DEL TEXTO. 01/2014. 11. RÉGIMEN DE PRESCRIPCIÓN Y DISPENSACIÓN. Voluven® 6% y Volulyte®. Medicamento sujeto a prescripción médica. Uso hospitalario. Excluido de la financiación del SNS. 15 El tándem perfecto HidroxiEtilAlmidón 130/0,4/6% Solución Polielectrolítica Balanceada HidroxiEtilAlmidón 130/0,4/6% Solución Salina al 0,9% HidroxiEtilAlmidón 130/0,4/6% Solución Polielectrolítica Balanceada 2186 Ed.: Abril 2014 HidroxiEtilAlmidón 130/0,4/6% Solución Salina al 0,9%