alumno pendientes 1º bach curso 2009_10
Anuncio

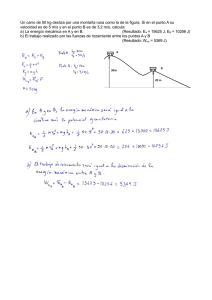
-1- IES Pedro de Tolosa.Departamento de Física y Química. Curso 2009_10 CURSO 2009/10 DEPARTAMENTO DE FÍSICA Y QUÍMICA. Actividades de recuperación: Física y Química de 1º bachillerato PRIMER CUATRIMESTRE. * Un resumen (escrito a mano) de los temas de química que se indican a continuación: Tema: TEORIA ATOMICO MOLECULAR DE LA MATERIA – Clasificación de la materia: Mezcla, sustancia pura, elemento, compuesto. Cambios físicos y químicos. – Leyes ponderales de la química. Ley de conservación de la materia, ley de las proporciones fijas. – Teoría atómico molecular de Dalton. – Masas atómicas y moleculares. Hipótesis de Avogadro. Concepto de mol y molécula. La cantidad de sustancia y su unidad, el mol. – Ecuación de estado de los gases ideales. – Composición centesimal. Determinación de fórmulas empíricas y moleculares. – Disoluciones. Concentración % en masa, volumen, molaridad, fracción molar. Tema: ESTRUCTURA ATÓMICA Y SISTEMA PERIÓDICO – Primeros modelos atómicos: Thomson y Rutherford. Características de los átomos. – Partículas subatómicas: electrón, protón y neutrón. Núcleo y corteza de los átomos. Isótopos. – Radiación Electromagnética. Parámetros característicos. Energía de un fotón. – Distribución electrónica en niveles energéticos. Los espectros atómicos y el modelo atómico de Bohr. – Introducción cualitativa al modelo cuántico. Números cuánticos. Configuraciones electrónicas. – Ordenación periódica de los elementos: su relación con los electrones externos. – El sistema periódico. Propiedades periódicas. Radio atómico. Reactividad, energía de ionización, afinidad electrónica y electronegatividad. Tema: REACCIONES QUÍMICAS. ESTEQUIOMETRÍA. – – – – – – – – – Reacciones químicas. Ecuaciones químicas. Tipos de reacciones químicas. Interpretación microscópica de las reacciones químicas. Velocidad de reacción. Factores de los que depende. Estequiometría de las reacciones. Reactivo limitante y rendimiento de una reacción. Relaciones estequiométricas de masa,mol y/o volumen utilizando factores de conversión Cálculos con volúmenes de gases. Cálculos en sistemas en los que intervienen disoluciones. Química e industria: materias primas y productos de consumo. Implicaciones de la química industrial. Valoración de algunas reacciones químicas que, por su importancia biológica, industrial o repercusión ambiental, tienen mayor interés en nuestra sociedad. Tema: QUÍMICA DEL CARBONO. – Orígenes de la química orgánica: superación de la barrera del vitalismo. – Posibilidades de combinación del átomo de carbono. – Grupos funcionales. Nomenclatura y formulación IUPAC de hidrocarburos (de cadena lineal y ramificada que contengan enlaces sencillos, dobles y triples), alcoholes, aldehídos, cetonas, ácidos carboxílicos y éteres. – Isomería de compuestos orgánicos * Resolver los ejercicios prácticos (problemas) de las fotocopias de las páginas siguientes: de la 2 a la 9 ambas inclusive. * Ambos trabajos han de entregarse antes del 11 de Enero de 2010. * Entre los días 25 y 29 de Enero se realizará una prueba escrita, (un examen) que consistirá en la realización de diversos ejercicios (problemas) similares a los que se entregaron para resolver. Alumnos con F y Q pendiente de 1º de Bachillerato. 1 -2- IES Pedro de Tolosa.Departamento de Física y Química. Curso 2009_10 PROBLEMAS: PRIMER CUATRIMESTRE. TEORIA ATOMICO MOLECULAR DE LA MATERIA 1. Señala la/s respuesta/s correcta/s. Una molécula es a) La parte más pequeña de un átomo b) Una parte del átomo c) La parte más pequeña de un compuesto que conserva las propiedades de éste d) Un tipo de isótopo 2. Se hacen reaccionar 20 g de S con 20 g de Fe para obtener FeS. Indique la masa de cada sustancia tras la reacción. (mFe/mS=1,74) 3. Cuando reacciona el hidrógeno con el oxígeno para formar agua, la relación de sus masas es m0/mH= 8. ¿Qué cantidad de agua se forma cuando hacemos reaccionar 20 g de hidrógeno con 4 g de oxígeno? 4. Para demostrar en el laboratorio una importante ley química se hacen reaccionar distintas masas de Zn con un exceso de ácido clorhídrico para obtener cloruro de cinc y posteriormente se calienta la disolución resultante a sequedad. Los resultados experimentales se recogen en la tabla: Masa de la cápsula Masa de la cápsula Masa de la cápsula vacía (g) con cinc (g) con cloruro de cinc (g) 60 62 64,17 75 78 81,27 ¿Qué ley evidencia esta experiencia? Utilice los datos experimentales para verificar la ley. 5. Una tira de cobre puro que tiene una masa de 3,178 g, se calienta fuertemente en corriente de oxígeno hasta que toda ella se convierte en óxido negro. El polvo resultante (un óxido de cobre) tiene una masa de 3,978 g. ¿Cuál es el porcentaje en masa de los componentes de este óxido? ¿Cuál es la fórmula empírica del óxido de cobre formado? Datos. Masas atómicas: MCu = 63,54 u. ; MO = 16 u. 6. Completar la siguiente tabla para la reacción del cloro con el sodio para dar cloruro de sodio: a b c 7. 8. 9. g de cloro g de sodio 159 41,67 264 20 195 g de cloruro de sodio 262 g de cloro sobrante 0 g de sodio sobrante 0 Cierta masa gaseosa ocupa un volumen de 500 mL a –10 ºC y 380 mm de Hg. ¿Qué volumen ocupará a la presión de 3 atm y temperatura de 300 K Un recipiente cerrado de 500 mL contiene dióxido de carbono a 1,2 atm y 27ºC. Calcular: a) La densidad del gas. b) Las moléculas de dióxido de carbono que escapan del recipiente al abrirlo si la presión exterior es de 1,0 atm. DATOS. Masas atómicas: A(C)= 12, A(O)=16 Defina mol Determina la masa de una molécula y de un mol de N2O5 Determina el número de moles que hay en un Kg de N2O5 El número de moléculas y el número de átomos de oxígeno que hay en 1 g de N2O5 Determina la masa de pentóxido de dinitrógeno (gas) que en C.N. ocupa un volumen de 200 mL. La masa de 1022 moléculas de dicho gas DATOS: Masas atómicas. A(N)=14;A(O)=16 a) b) c) d) e) 10. 0,496 g de una sustancia gaseosa que contiene un 80% de carbono y el resto de hidrógeno, ocupa en C.N. 370,35 mL. Determina la fórmula del compuesto DATOS: Masas atómicas. A(C)= 12 Alumnos con F y Q pendiente de 1º de Bachillerato. 2 -3- IES Pedro de Tolosa.Departamento de Física y Química. Curso 2009_10 11. Determine: a) La masa de una molécula de dióxido de carbono (CO2) a) La masa de un mol de CO2 b) El número de moles que hay en 0,44 g de CO2 c) El número de moléculas que hay en la anterior masa de CO2 d) El volumen, que ocupan las anteriores moléculas, medido en C.N. e) La densidad del CO2 en C.N. f) La densidad del gas a 37ºC y 380 mm de Hg g) La composición centesimal del CO2 12. Indica RAZONADAMENTE la veracidad o falsedad de las siguientes afirmaciones. a) “El número de moléculas que hay en un mol depende de la masa de la molécula” b) “Según Proust , cuando un elemento reacciona con otro para dar un compuesto la relación entre sus masas es constante y se puede expresar como una relación de números enteros sencillos” c) “En una reacción química los átomos se transforman en otros distintos, variando su masa y otras propiedades” d) “En una reacción química los átomos se transforman en otros distintos, variando su masa y otras propiedades” e) “La parte más pequeña de un átomo se llama molécula” f) “La densidad de un gas sólo depende de su naturaleza y de las condiciones de presión y temperatura” g) “Todos los gases ocupan en condiciones normales 22,4 L” 13. Cierto óxido de nitrógeno está constituido por un 36,84 % de nitrógeno y un 63,16 % de oxígeno. Por otra parte 4 g de este óxido gaseoso ocupa en C.N. 1,18 litros. Determine la fórmula molecular del gas. 14. Determine la masa de hidróxido de sodio (NaOH) comercial, de pureza 90% necesaria para preparar 100 ml de disolución 1,25 molar. Indique el material y el procedimiento para preparar dicha disolución. Masas atómicas. A(Na) = 23; A(O)= 16; A(H)= 1 15. Determinar la molaridad y la molalidad de una disolución de ácido sulfúrico de densidad 1,8 g/ml y de pureza el 80%. Masas atómicas. A(H)=1;A(S)=32;A(O)=16 16. Determine el volumen de ácido clorhídrico comercial, de densidad 1,2 g /ml y pureza el 30%, que hay que tomar para preparar 250 ml de disolución 0,3 M. a) Determina la molaridad y la fracción molar de una disolución de ácido nítrico (HNO3) comercial de densidad 1,4 g/ml y concentración el 60%. b) ¿Qué volumen de la anterior disolución debemos tomar para preparar 250 ml de disolución 0,5 M? DATOS Masas atómicas. A(N)=14; A(O)=16; A(H)=1 17. Se desea preparar un litro de disolución 1M de ácido sulfúrico a partir de un ácido comercial cuya etiqueta indica que su concentración centesimal es de 90% y su densidad 1,85 g/ml. Determinar: a) La molaridad del ácido comercial. b) El volumen necesario para preparar la disolución pedida c) El volumen de hidróxido de sodio 0,8 M necesario para neutralizar 20 ml de la disolución preparada (La sal obtenida es sulfato de sodio) A(S)=32; A(O)=16 18. Cierto ácido sulfúrico comercial indica en su etiqueta que su concentración centesimal es de 90% y su densidad 1,85 g/ml. Determinar: a) La molaridad y la molalidad del ácido comercial. b) El volumen de ácido comercial necesario para preparar 250 mL de disolución 0,75 M DATOS:A(S)=32; A(O)=16 Alumnos con F y Q pendiente de 1º de Bachillerato. 3 -4- IES Pedro de Tolosa.Departamento de Física y Química. Curso 2009_10 ESTRUCTURA ATÓMICA Y SISTEMA PERIÓDICO 1. 2. Contesta las siguientes preguntas: a) Definición de isótopo b) ¿Cuántos protones, neutrones y electrones tiene el elemento c) Escribe dos comentarios favorables al modelo de Bohr. 80 35 Br − Contesta las siguientes preguntas: a) Escribe la configuración electrónica de los siguientes elementos: 92 U Te 52 b) Completa la siguiente tabla: Nombre del elemento Símbolo del elemento Estroncio Sb Potasio S Rn 3. 4. Grupo al que pertenece Contesta las siguientes preguntas: a) ¿Qué nos indica el número cuántico secundario? b) ¿Qué relación hay entre el número cuántico principal y el secundario? c) ¿Qué diferencia hay entre el enlace covalente polar y el enlace covalente apolar? d) Propiedades de los compuestos moleculares: Completa la tabla: Elementos Si hay enlace, ¿tipo de enlace más probable? ¿Por qué? Nitrógeno carbono y oxígeno potasio y azufre platino 5. La masa atómica del cobre es de 63,546 u. Los dos isótopos de cobre que se encuentran en la naturaleza tienen las siguientes masas: 63 Cu , 62,9298 u; 65 Cu , 64,9278 u. Calcula el porcentaje de 63 Cu que se encuentra en la naturaleza. 6. Calcula la frecuencia y longitud de onda de un fotón azul 4,4.10-19 J de energía. Dato: h=6,63.10-34 J.s; 7. Cómo explica el modelo de Bohr el espectro atómico de emisión de los átomos en estado gaseoso. 8. Calcula la frecuencia y la longitud de onda de un fotón de energía 5'5.10-17 J. Alumnos con F y Q pendiente de 1º de Bachillerato. 4 -5- IES Pedro de Tolosa.Departamento de Física y Química. Curso 2009_10 9. Escribe la configuración electrónica del estado fundamental de los átomos e iones siguientes: S2-, Ca2+, F y Al. 10. El Li tiene dos isótopos de masas atómicas 6,015 y 7,016. La masa atómica promedio del Li es 6,940. Calcula el % de cada isótopo. 11. Se sabe que al absorber una radiación electromagnética determinada el electrón del átomo de hidrógeno puede pasar del nivel energético E1 = -13.6 eV al nivel E3 = -1'5 eV; ¿cuál será la frecuencia y el tipo de luz que utilizaremos para efectuar transición entre esos niveles? . 12. ¿Qué entendemos por orbital y cuál es el significado de los números cuánticos? 13. 109 Los isótopos de plata son 107 47 Ag y 47 Ag . La masa atómica del primero es 106,905 u y su riqueza en la plata natural es 51,94 %. ¿Cuál es la masa del otro isótopo si la masa atómica de la plata es 107,870 u?. 14. Da los cuatro números cuánticos que caracterizan al último electrón que forma parte de los átomos cuyos números atómicos son, respectivamente: 3, 7 y 14. 15. Un electrón está caracterizado por los números cuánticos (3,1,0,+1/2). Indica el significado de cada nº y la situación de ese electrón en el átomo. 16. Explica si los orbitales indican posiciones fijas, niveles de energía o ambas cosas. 17. Dos electrones tienen el número de spin s= -1/2 y s= -1/2 . ¿Estarán en el mismo orbital?. ¿Pueden estar en el mismo nivel energético?. 18. ¿Cuántos electrones diferentes puede haber con n=4 y l=3?. 19. El cobre aparece en la naturaleza constituido por dos isótopos de masa atómicas 62,930 y 64,928 respectivamente. El primero se encuentra en la naturaleza en la proporción del 69,1 %. Calcula la masa atómica media del cobre. 20. Si los números cuánticos de un e- son (3,1,–1,½) explica la diferencia con el electrón (2,1,–1,½). 21. El último e- de un átomo en estado fundamental es 3p4. Explica qué indica, cuales son los números cuánticos de ese electrón. ¿Cuántos electrones desapareados que tiene ese átomo?. 22. La diferencia de energía entre dos niveles de energía de un átomo es de 9'5.10-3 eV; calcula la frecuencia de la radiación absorbida o emitida cuando un electrón sufre dicha transición. Solución: 2’3.1012 Hz. . Tabla periódica. 1. ¿Qué son elementos representativos?. 2. Un elemento tiene 33 electrones. a) Escribe su configuración electrónica. b) ¿A qué grupo y periodo pertenece. c) ¿Cuántos e de valencia tiene?. d) ¿Con qué valencias puede actuar?. e) ¿Qué elemento es?. 3. Indica qué elemento está situado en el grupo 2 y 4º período; en el grupo 17 y 6º periodo; en el grupo 12 y 5º periodo; grupo 16 y 3º periodo. Escribe el electrón diferenciador de cada uno de ellos. 4. ¿Qué son elementos de transición interna?. 5. Escribe las configuraciones electrónicas de los 3 primeros halógenos y explica qué tienen en común. 6. En cada par indica quién tendrá menor radio: a) Cl ó Cl-; b) Na ó Na+; c) O2- ó S2-; d) Mg2+ ó Al3+; e) Au+ ó Au3+. Alumnos con F y Q pendiente de 1º de Bachillerato. 5 -6- IES Pedro de Tolosa.Departamento de Física y Química. Curso 2009_10 7. Ordena por orden creciente de carácter metálico: Fe, Bi, Ca, Cs, C, Na, O y F; Sol: F<O<C<Bi<Fe<Ca<Na<Cs 8. Indica de forma razonada que elementos tienen por configuración electrónica en su último nivel energético: a) ns2 np3; b) ns2 np5; c) ns2; d) ns2 np4 9. Escribe la configuración electrónica de los elementos del periodo 4 que tienen más de 3 electrones desapareados. (Sol: Cr (Ar) 4s2 3d4; el Mn…. Y el Fe .... 10. La configuración electrónica de un elemento es 1s2 2s2 ... 4p3; a) Halla su nº atómico. b) Periodo y grupo al que pertenece. c) Indica sus electrones de valencia y su nº de oxidación más frecuente. Sol: Z=33; Grupo 15, periodo 4. 5 electrones de valencia: 4s2 4p3; 311. Escribe la configuración electrónica del Zn, Ge, As, Se. Indica sus electrones de valencia y los iones estables que puede formar. 12. Indica los electrones perdidos por los átomos siguientes al adquirir la estructura de gas noble: Li, Mg, Al. Escribe los iones correspondientes y las configuraciones electrónicas de átomos e iones. 32 216X . 13. Indica toda la información que puedes sacar de 14. Para ionizar 20 g de Na se necesitan fotones de longitud de onda 300 nm. Calcula la energía de ionización necesaria para ionizar un átomo y un mol. ¿Cuánta energía se necesita para ionizar los 20 g de sodio?. 15. Escribe en orden creciente de energía los siguientes orbitales: 3p,3d, 4s, 6s, 5p,4f, 5s, 4p, 6p. Ejercicios formulación inorgánica. 1.- Escribe la fórmula de los siguientes elementos. Sodio, calcio, hierro, magnesio, neón, hidrógeno, cloro, argón, nitrógeno, oxígeno, kripton, yodo. 2.- Formula los óxidos: dióxido de plomo, óxido de fósforo (V), óxido de manganeso(VII), trióxido de diyodo, monóxido de carbono. 3.- Nombra siguiendo las nomenclaturas sistemática y de Stock los siguientes óxidos: Cr2O3; Au2 O; MnO2; NO; I2O7; HgO; Na2O; SO3 4.- Formula siguiendo la nomenclatura tradicional. Óxido cloroso; oxido clorico; óxido férrico; óxido perclórico 5.- Nombra siguiendo la nomenclatura tradicional. Sb2O3; MgO; FeO; Br2O3; Br2O5, Br2O7 6.- Formula los siguientes peróxidos: peróxido de litio, agua oxigenada, peróxido de sodio. 7.-Formula los siguientes hidruros: hidruro de plomo(IV), trihidruro de arsénico, hidruro de aluminio, hidruro de zinc, cloruro de hidrógeno. 8.- Nombra según la nomenclatura tradicional: HI(aq), H2S(aq), NH3, CH4, PH3 9.- Formula los siguientes compuestos: fluoruro de plata, disulfuro plomo, bromuro de oro(I); nitruro de calcio y cloruro de hierro (III). 10.- Nombra siguiendo la nomenclatura sistemática y de Stock los compuestos: NaCl; AlCl3; HgI; SnS2;PbCl4;Ni2S3 10.- Nombra los siguientes hidróxidos según la nomenclatura sistemática y tradicional: KOH, Mg(OH)2, Sn(OH)4, NH4HO. Alumnos con F y Q pendiente de 1º de Bachillerato. 6 -7- IES Pedro de Tolosa.Departamento de Física y Química. Curso 2009_10 11.- Escribe la fórmula: Hidróxido de litio, hidróxido de cromo(III), hidróxido férrico, hidróxido de aluminio, hidróxido amónico 12.- Formula los siguientes ácidos: ácido brómico, ácido carbónico, trioxoclorato(I) de hidrógeno, ácido hipocloroso, trioxonitrato(III) de hidrógeno, ácido nítrico, ácido perclórico. 13.- Nombra los siguientes ácidos por las dos nomenclaturas: sistemática y tradicional. HClO; H2SO3; H3PO3; HBrO3; H2CO3; HNO3 14.- Escribe la fórmula de los siguientes ácidos: ácido fosfórico, ácido sulfúrico, ácido metafosforoso, ácido arsénico, ácido perbrómico, trioxoseleniato(VI) de hidrógeno. 15.- Escribe la fórmula del los iones: ion manganeso(VII), ión hierro(II), ión calcio, ión amonio, ión sodio. 16.- Formula: ión cloruro, ión perclorato, ión hipoclorito, ión sulfuro, ión sulfito. 17.- Formula: ión fosfato, ión sulfuro, ión nitrito, ión peryodato, ión potasio. 18.- Formula las siguientes sales: sulfato de cobre(II), nitrato de plata, carbonato de magnesio, perclorato de cinc, nitrito de sodio. 19.- Formula las siguientes sales: cloruro amónico, carbonato de estaño(IV), fosfato de calcio, permanganato de potasio. 20.- Nombra las siguientes sales: CaCO3; Na2SO4; FeSO3; Zn(NO3)2; NaClO; 20.- Nombra: NaHCO3, KHS, MgHPO3, Pb(IO)2, NH4NO3. 21.- Formula: hidrógeno sulfato de zinc, dihidrógeno arseniato de radio, bicarbonato de sodio, bicarbonato de calcio. Completa la tabla siguiente: Fórmula As2 O3 Nom. sistemática Nombre Nom. Stock Nom. tradicional Tetrahidruro de plomo (IV) HBr HIO4 H3AsO4 Mg(BrO3)2 KMnO4 -------------------------Tetraoxo manganato(VII) de potasio. Sulfuro de aluminio ------------------------------------------------------------------------------------------------------------------------------------------------------------ Acido fosforoso Clorato de potasio REACCIONES QUÍMICAS. ESTEQUIOMETRÍA 1 En la reacción de síntesis del agua: explica qué enlaces se rompen y cuales se forman. 2 En la reacción de combustión del metano. Explica que enlaces se rompen y cuales se forman. 3 El óxido de aluminio reacciona con el ácido sulfúrico dando como productos de la reacción sulfato de aluminio y agua. Calcula la masa de ácido sulfúrico necesaria para que reaccionen 40 g de óxido de aluminio Alumnos con F y Q pendiente de 1º de Bachillerato. 7 -8- IES Pedro de Tolosa.Departamento de Física y Química. Curso 2009_10 4 En la reacción de combustión del metano. ¿Qué volumen de oxígeno necesitaremos para quemar completamente 150 l de metano medidos en c.n? ¿Cuántos litros de aire nos harían falta suponiendo que la composición volumétrica aproximada del aire es del 20% de oxígeno? 5 Calcula el volumen de disolución 0,8 M de ácido nítrico que reacciona con 50 cm3 de una disolución 2 M de hidróxido de magnesio. En el proceso se obtienen trioxonitrato(V) de magnesio y agua. 6 Una muestra de galena PbS, tiene una riqueza en mineral del 82 %. Calcula:La masa de óxido de plomo (II) que se obtendrá al calentar en presencia de oxígeno una tonelada de galena. 7 Se queman 6 g de metano. Los gases producidos dióxido de carbono y agua se recogen en un recipiente de 5 litros a una temperatura de 120ºC. Calcula La presión parcial de cada uno de los productos de la reacción. La presión total en el interior del recipiente. 8 Calcula la riqueza en carbonato de calcio de una caliza sabiendo que, al descomponer 82 g de ella se obtienen 12,54 litros de dióxido de carbono medidos en condiciones normales. [68,3 %]. 9 El acido sulfúrico reacciona con cloruro de sodio, produciendo ácido clorhídrico y sulfato de sodio. Calcula el volumen de disolución de ácido sulfúrico de densidad d= 1,84 g/cm3 y 98 % de riqueza que se necesita para obtener 20 g de ácido clorhídrico. [29,8 l]. 10 En la reacción de síntesis del amoniaco se hacen reaccionar 50 g de nitrógeno con 20 g de hidrógeno. Calcula el rendimiento de la reacción si se obtienen 32 g de amoniaco. 11 Calcula la masa de cal viva (óxido de calcio) que se puede obtener por descomposición de una tonelada de piedra caliza del 90 % en carbonato de calcio, si el rendimiento del proceso es del 75 %. 12 Calcula el volumen de hidrógeno, medido a 27 ºC y 700 mmHg que se desprenderá al tratar 50 g de aluminio con ácido clorhídrico en exceso, sabiendo que el rendimiento del proceso es del 75%. 13 A 600 ºC el carbonato de calcio se descompone en óxido de calcio y dióxido de carbono, hasta que la presión de este último es 5 atm. En un horno cerrado se introduce una tonelada de piedra caliza del 80% en carbonato cálcico. Calcula el rendimiento del proceso si se obtuvieron 100 m3 de dióxido de carbono 14 El permanganato de potasio reacciona con el ácido clorhídrico y produce cloruro de potasio, cloruro de manganeso(II),cloro gas y agua. Calcula a) la masa de permanganato que reacciona con 20 cm3 de disolución de HCl, 2M. b) El volumen de cloro que se obtiene si se recoge a una presión de 0,95 atm y 20ºC. 15 Calcula el calor desprendido en la síntesis de 10 moles de amoníaco: 3H2 + N2 2 NH3 + 92Kj ¿ y cuando se forman 100 g de amoníaco? ¿ y cuando reaccionan 50 g de hidrógeno? . 16 La reacción de combustión de la glucosa proporciona 2800 Kj/ mol. Expresa este valor en Kcal/mol 17 En disolución acuosa, el carbonato de sodio reacciona con el cloruro de calcio y se obtiene un precipitado de carbonato de calcio y cloruro de sodio. Si obtenemos 225 g de carbonato de calcio, calcula la masa de carbonato de sodio que utilizamos. [238’5 g]. 18 Se tuestan 10 Kg de cinabrio que contiene 75 % de Hg S para dar mercurio y dióxido de azufre. Suponiendo que todo el mercurio se recupera halla el volumen de dióxido de azufre a 1 atm y 27 ºC. El volumen de mercurio si su densidad es 13,6 g/ml. Soluciones. V(dióxido) = 793 l ; V(Hg)= 475,6 ml. Alumnos con F y Q pendiente de 1º de Bachillerato. 8 -9- IES Pedro de Tolosa.Departamento de Física y Química. Curso 2009_10 FORMULAR O NOMBRAR LOS SIGUIENTES COMPUESTOS ORGANICOS. 1.- 5-etil-2,3,3,4-tetrametil heptano 2.- 1,2-dimetil 4-propilcicloheptano 1.- CH3-CH2-CH-CH3 | CH3 2.- 3.- 2-metil 1,3-pentadieno. 4.- Ciclohexeno. 5.- Metil benceno. 6.- 1,3,3,4-tetrametil ciclohexano CH3 CH3 | 3.- CH3-CH-CH2-CH-CH2- C -CH3 | | | CH3 CH3 CH2 -CH3 4.- CH3 –CHOH–CH3 5.- CH3 –CH2 –CH2OH 7.- 3-metil 1,4-hexadiino. 8.- 1,3-butanodiol 6.- H–CHO 9.- 2-metil,2-propanol 10.- 1,3,5-trimetil 1-ciclohexanol 11.- etanodial 7.- CH3 -CH-CHOH-CH2-CH-CH3 | | CH3 CH2 -CH3 12.- metanol 8.- CH3 –COOH 13.- propanona 9.- CH3 –CO–CH2 –CH2 –CH3 14.- ciclohexanona 10.- CH3 –NH–CH2 –CH3 15.- 1,3-dimetilbenceno 11.- CH2OH –COOH 16.- 2,3-hexanodiona 12.- CH3 –CH2 –NH2 17.- 2-hidroxi-ácido propanoico 13.- CH≡C–C≡C–C≡CH 18.- metil-propil-amina 14.- CH2 OH–CH2 –CHOH–CH2-CH3 19.- 1,4-butanodiol 20.- ciclobuteno. 15.- COOH–COOH 21.- 1,2,3-propanotriol 16.- CH≡CH 22.- ácido metanoico 17.- CH3 OH (o bien: H-CH2OH) 23.- metanol. 18.- H-COOH 24.- etino. 19.- CH3 -CH2 -CHO 25.- ciclopropeno. 26.- ácido butanodioico 27.- 3-buten-2-ona Alumnos con F y Q pendiente de 1º de Bachillerato. 20.- 9 CH3 - IES Pedro de Tolosa.Departamento de Física y Química. Curso 2009_10 10- CURSO 2008/09 DEPARTAMENTO DE FÍSICA Y QUÍMICA. Actividades de recuperación: Física y Química de 1º bachillerato SEGUNDO CUATRIMESTRE. • Un resumen (escrito a mano) de los temas del curso pasado, que se indican a continuación: Tema: CINEMÁTICA. ESTUDIO DEL MOVIMIENTO. – Magnitudes necesarias para la descripción del movimiento: vector de posición, desplazamiento. Velocidad y aceleración. Componentes intrínsecas de la aceleración. – Estudio de los movimientos rectilíneos, uniforme y uniformemente acelerado, y circular uniforme. – Las aportaciones de Galileo al desarrollo de la cinemática y de la ciencia en general. Superposición de movimientos: tiro horizontal y tiro oblicuo. Tema: DINÁMICA – Concepto de fuerza como interacción. – Leyes de la dinámica de Newton. Impulso mecánico. Momento lineal y principio de conservación. – Interacción gravitatoria. Ley de la gravitación universal. Peso. Variación de la aceleración de la gravedad con la altura. – Estudio de algunas situaciones dinámicas de interés: peso, fuerzas de rozamiento. – Dinámica del movimiento rectilíneo uniforme, uniformemente acelerado y del movimiento circular uniforme. Tema: – – – – – – – ENERGÍA MECÁNICA Y TRABAJO. Transformación y energía. Distintas formas de energía. Trabajo mecánico y energía. Potencia. Energía debida al movimiento. Energía cinética. Teorema de las fuerzas vivas. Energía debida a la posición en el campo gravitatorio. Energía potencial gravitatoria. Energía potencial elástica. Energía mecánica. Conservación de la energía mecánica. Rendimiento de una máquina. Tema: ENERGÍA Y CALOR. – Energía interna y temperatura. Concepto de temperatura según la teoría cinética. – Principio de conservación de la energía. Degradación de la energía. – El primer principio de la termodinámica. – Calor y trabajo en las transformaciones de un gas. – Conversión de calor en Trabajo. – Efectos del calor: variación de T, cambios de estado, dilatación térmica. – Distintas formas de propagarse el calor. Tema: EL CAMPO ELÉCTRICO. – Fenómenos electrostáticos. – Naturaleza eléctrica de la materia. Conservación de la carga. – Interacción eléctrica. Ley de Coulomb. – Campo eléctrico. Intensidad del campo eléctrico. – Campo y potencial creado por una o por dos cargas puntuales en un punto. * Resolver los ejercicios prácticos (problemas) de las fotocopias de las páginas 11 a 15 (ambas inclusive). * Ambos trabajos han de entregarse antes del 30 de Abril de 2009. * Entre los días 26 y 30 de Abril se realizará una prueba escrita, (un examen) que consistirá en la realización de diversos ejercicios (problemas) similares a los que se entregaron para resolver. Alumnos con F y Q pendiente de 1º de Bachillerato. 10 - IES Pedro de Tolosa.Departamento de Física y Química. Curso 2009_10 11PROBLEMAS: SEGUNDO CUATRIMESTRE EJERCICIOS DE CINEMÁTICA. 1 2 Nos encontramos en reposo a 500 m de un ciclista que se acerca hacia nosotros a una velocidad de 40 km/h. ¿A qué distancia estará 16 segundos después?. Un automóvil parte de cierta localidad con una velocidad constante de 54 km/h. Media hora más tarde sale del mismo punto en su persecución otro vehículo a una velocidad constante de 72 Km/h. ¿A qué distancia del punto de partida lo alcanzará?. Solución a 108 Km. 3 Dos coches viajan por una carretera recta en la misma dirección. Sus velocidades son 108 y 90 Km/h respectivamente. Si inicialmente están separados 1500 m. ¿Cuánto tiempo tardan en encontrarse?. ¿Cuánto ha avanzado cada uno hasta encontrarse? 4 Dadas las siguientes gráficas. v(m/s) espacio (m) 20 10 B 14 C D 8 t(s) O 4 8 16 A 24 2 a) Tipo de movimiento en cada tramo. b) Desplazamiento entre los instantes t=4 y t=16 s. c) velocidad entre los instantes t=8 s y t=12 s. 5 6 7 8 E 5 8 t(s) 10 A) Tipo de movimiento en cada tramo B) Espacio total recorrido. Se lanza hacia arriba una bola con una velocidad de 12 m/s. a) ¿Cuánto tiempo tarda la bola en alcanzar el punto más alto? b) ¿Cuánto sube la bola? c? ¿Cuál es el intervalo de tiempo que transcurre entre los instantes en que la bola sale de la mano y vuelve a ella?. Dato: g=9'8 m.s-2. Una pelota se deja caer desde la cornisa de un edificio y tarda 0'25 s en recorrer la distancia de 2'7 m entre el borde superior y el inferior de un ventana. ¿A qué distancia de la cornisa se encuentra el borde superior de la ventana?. Datos: g=9'8 m/s2 Calcular un año-luz en millones de km. Velocidad luz = 300.000 Km/s. Solución: 9,46.106 millones de km. Un volante gira alrededor de su eje a 300 r.p.m. (300 vueltas/minuto). Calcular: a) la aceleración centrípeta de un punto situado a 4 cm del eje. b) nº de vueltas que da en 0’2 s. c) Tiempo que tarda en girar 50º. Un tren parte del reposo con aceleración de 3 m/s2 durante 11 s; a continuación mantiene la velocidad constante durante 8 s; finalmente frena con aceleración constante y se para a los 6 s de estar frenando. a) Dibuja la gráfica v-t; b) espacio total que recorre; c) velocidad media en todo el recorrido. 10 Las cabinas de la noria del parque de atracciones tardan 30 s en dar una vuelta. Sabiendo que el radio de la noria es 10 m. calcula: el periodo de giro. La velocidad de las cabinas en Km/h. La velocidad angular. 9 11 La atracción de feria gira a una velocidad angular de 5 vueltas por minuto. Cuánto tiempo tarda una persona en dar 15 vueltas. Con qué velocidad angular se desplaza en rad/s y en r.p.m?. 12 Un ciclista recorre una pista circular de 150 m de radio a una velocidad de 36 km/h. ¿Cuál es el período del movimiento?. ¿Y la velocidad angular en rad/s?. Cuánto tiempo tardará en recorrer 2 radianes 13 Un avión recorre por la pista del aeropuerto, antes de despegar, una distancia de 1 km y tarda 20 seg. en recorrerlo con aceleración constante. Determina: a) Velocidad en el momento del despegue. b) La distancia que recorre el avión durante el primer y último segundo en su recorrido por la pista. 14 Un cañón dispara un proyectil con una velocidad de 400 m/s y un ángulo de elevación de 30º. Calcular: a) la posición y la velocidad del proyectil a los 5 s; b) ¿en qué instantes el proyectil está a 1000 m de altura?; ¿qué Alumnos con F y Q pendiente de 1º de Bachillerato. 11 - IES Pedro de Tolosa.Departamento de Física y Química. Curso 2009_10 12velocidad tiene en esos instantes?; c) altura máxima alcanzada por el proyectil; d) velocidad en ese instante; e) alcance máximo; f) ¿con qué velocidad llega a la horizontal del punto de lanzamiento?; g) ecuación de la trayectoria. Dato: g= 10m/s2. 15 Damos una patada a un balón y sale con una velocidad de 60 km/h y un ángulo de 30º. a) Altura máxima que alcanza. b) Posición del balón a los 1,3 s. c) Velocidad en ese instante. d) Componentes de la velocidad cuando va a chocar con el suelo y módulo de la velocidad. e) Alcance máximo. 16 Un niño quiere lanzar un balón por encima de una pared de 35 m de altura, situada a 20 m de distancia. Para ello da una patada al balón que sale con una velocidad de 32 m/s y un ángulo de 60º. a) ¿Pasará el balón por encima de la casa?. b) En caso afirmativo determina cuál es la velocidad del balón cuando pasa por encima de la casa (componentes y módulo de la velocidad) y altura máxima que alcanza el balón. En caso negativo, determina con qué velocidad choca el balón con la casa (componentes y módulo de la velocidad) y a qué altura. Dato: g=9,8 m/s2 17 Dos equipos de baloncesto se encuentran empatados a puntos; quedan breves instantes para que finalice el partido; un jugador lanza el balón a canasta con una velocidad inicial de 12 m/s y formando un ángulo con la horizontal de 35º. La canasta está a 3 m de altura sobre un punto que dista del jugador 5 m. Indica si su equipo ha ganado el partido, sabiendo que el jugador, con los brazos estirados, lanzó el balón desde una altura de 2,71 m. 18 Un futbolista ejecuta el lanzamiento “a balón parado” de una falta desde una distancia de 20 m de la portería. La barrera de jugadores del equipo contrario, de altura madia 1’80 m, está a una distancia del balón de 9 m. La velocidad de salida del balón es 90 km/h. formando un ángulo de 15º con el suelo en dirección a puerta. A) ¿Será gol?. B) ¿Y si los de la barrera, temiendo el balonazo, se agachan?. Determina en este caso a qué altura entraría el balón en la portería. EJERCICIOS DE DINÁMICA. 1 Sobre un bloque de masa 21 kg que se mueve horizontalmente actúan las fuerzas F1 y F2 F1= 4,8 N y F2= 15 N, como se indica en la figura. Calcula la aceleración del bloque y expresa el resultado en forma vectorial. Los ángulos que forman con la horizontal son respectivamente 45 y 30 º respectivamente. 2 Una fuerza tiene de módulo 6 N, forma un ángulo con el eje positivo de las X de 30º y actúa sobre un cuerpo de 4 kg. Calcula la aceleración. 3 ¿Qué tipo de interacción existe, a) entre dos protones de un átomo de oxígeno; b) entre un electrón de un átomo y un protón del núcleo de ese átomo; c) entre los átomos de H en una molécula de agua; d) entre dos cuerpos electrizados; e) entre dos imanes; f) los cuerpos en caída libre; g) entre la Tierra y la Luna. 4 Un muelle de longitud 10 cm tiene de constante elástica 600 N/m. a) ¿Qué alargamiento produce una fuerza de 0,25 N?. ¿Qué longitud tiene el muelle en este caso?. b) Al colgar un cuerpo de 4 kg, ¿qué alargamiento produce? 5 Un coche de 1600 Kg inicialmente en reposo, arranca y alcanza una velocidad de 90 Km/h después de recorrer 150 m.¿Cuánto vale su aceleración supuesta constante?. ¿Cuál es la fuerza resultante? 6 Un cuerpo si cae desde mucha altura llega un momento en el cual su peso es igual a la resistencia del aire ¿qué tipo de movimiento tendrá entonces, uniforme o uniformemente acelerado? 7 En un ascensor de 800 kilos viaja un pasajero de 75 kg. El ascensor se eleva 3 m en 2 segundos con aceleración constante. A) Calcula la tensión del cable del ascensor y la fuerza que ejerce el suelo del Alumnos con F y Q pendiente de 1º de Bachillerato. 12 - IES Pedro de Tolosa.Departamento de Física y Química. Curso 2009_10 13ascensor sobre ese viajero. B) A continuación sube con velocidad constante. Calcula lo mismo que en el apartado a) 8 Una pelota de tenis de 50 g llega a un jugador con una velocidad de 20 m/s; después de ser golpeada sale con una velocidad doble, en sentido opuesto. Si la raqueta ha ejercido una fuerza media sobre la pelota de 200 N, ¿cuánto tiempo ha estado en contacto con la raqueta?. [0'015 s ]. 9 Un futbolista golpea durante 0'25 s un balón de 0,5 kg de masa, que se encuentra en reposo, de forma que le imprime una velocidad de 10 m/s. a Cuál es el módulo del momento lineal de la pelota antes y después de la patada?; b) ¿cuál es el impulso sobre la pelota?. [ 0; 5 Kg.m/s; 5 kg.m/s ] 10 Un tren consta de una máquina de masa M= 30 t y dos vagones de masas 20 t cada uno. La máquina proporciona una fuerza de tracción de 300000 N y el coeficiente de rozamiento es 0,3. Calcula la aceleración del tren y las tensiones en las uniones de los vagones entre sí y de los vagones con la máquina. 11 Sobre un plano inclinado 30º se tiene un cuerpo de 98 kg. El coeficiente de rozamiento es 0'2. Si se deja el bloque en libertad, a) ¿cuál es la fuerza mínima necesaria para mover el bloque hacia arriba?. b) Si se aplica una fuerza paralela al plano, hacia abajo de 20 N, ¿con qué aceleración bajará el bloque?. [647 N; 3'4 m.s-2 ]. 12 Un cubo de agua gira en un plano vertical de radio 75 cm. Calcula la mínima velocidad en la parte superior para que el agua no se derrame. [2'77 m.s-1 ]. 13 Se girar en un plano vertical una piedra de masa 50 g mediante una cuerda de 50 cm de longitud dando 120 vueltas por minuto. ¿Qué tensión soporta la cuerda cuando la piedra está en el punto más alto y en el más bajo de su trayectoria?¿ En qué punto será más fácil que se rompa la cuerda? 14 Calcula la fuerza de atracción gravitatoria entre la Tierra y un astronauta de 70 kg que se encuentre a 20000 Km de la superficie de la Tierra. ¿Cuál es el valor de g a esa altura?. Datos. G=6,67.10-11 SI; MT= 5,98 10 24 Kg. Rt= 6380 Km. 15 ¿A qué altura sobre la Tierra el valor de la aceleración de la gravedad es la cuarta parte que en la superficie terrestre?. ¿Cuánto pesa un cuerpo de 200 g situado en ese punto?. Datos: aceleración de la gravedad en la superficie terrestre 9,8 m.s-2 16 La masa del planeta Júpiter es unas 318 veces la de la Tierra y su radio es 11 veces superior. Calcula la aceleración de la gravedad en Júpiter. En la superficie terrestre g=9,8 N/kg. 17 Calcula la velocidad con la que un satélite artificial describe una órbita circular a una altura de 500 Km sobre la superficie terrestre. Halla, el periodo y la aceleración centrípeta. Datos: G, radio de la Tierra, masa de la Tierra. 18 Un satélite artificial describe una órbita circular con una velocidad de 18000 km/h. Halla la altura a la que se encuentra. Datos: G=6’67.10-11 N.m2/kg2. MT=5’98.1024 kg. RT=6370 km. 19 Un satélite se denomina geoestacionario cuando se encuentra siempre en la misma vertical sobre la superficie de la Tierra (para lo cual ha de tener la misma velocidad angular que la Tierra). ¿A que altura se ha de colocar un satélite para que sea geoestacionario?. La tierra realiza una vuelta en un día. Datos: G=6’67.10-11 N.m2/kg2. MT=5’98.1024 kg. RT=6370 km. 20 Un coche toma una curva de 60 m de radio en una carretera horizontal. El coeficiente de rozamiento de las ruedas con el suelo es 0,75. ¿Con qué velocidad máxima podría tomar la curva sin derrapar? 21 Una esfera de 100 g cae desde una altura de 5 m sobre la arena de la playa y se hunde en ella 30 cm. Determina: a) la aceleración de frenado, suponiéndola constante. b) la fuerza que ejerce la arena sobre la bola. C) el tiempo que tarda en detenerse desde que entra en contacto con la arena. d) Si se conserva la cantidad de movimiento de la esfera. Alumnos con F y Q pendiente de 1º de Bachillerato. 13 - IES Pedro de Tolosa.Departamento de Física y Química. Curso 2009_10 14- EJERCICIOS DE TRABAJO Y ENERGÍA. 1. Halla el trabajo necesario para arrastrar un objeto de 20 Kg una distancia de 12 m por una pista horizontal. La fuerza ejercida por la cuerda es de 80 N y forma un ángulo de 30º con la horizontal .El coeficiente de rozamiento entre el objeto y el suelo es 0,3. 2. Un proyectil de 2 g sale del cañón de un fusil a 300 m/s; a) calcula la energía cinética del proyectil a la salida del cañón; b) si la fuerza que actúa sobre el proyectil mientras está en el cañón es F = 340 N, determina la longitud del cañón. 3. Un proyectil de 400 g atraviesa una pared de 50 cm de grosor. Su velocidad en el momento de penetrar en la pared era de 400 m.s-1 y al salir, de 100 m.s-1. Calcula: a) el trabajo realizado por el proyectil; b) la resistencia de la pared. 4. Un motor de 25 CV. eleva un montacargas de 1000 kg a 50 m en 30 s. ¿Cuál es su rendimiento? Dato: 1 CV=735'5 vatios. 5. En la cima de una montaña rusa, el coche con sus ocupantes (masa total es 1500 kg) está a una altura del suelo de 40 m y lleva una velocidad de 5 m/s. Calcular la energía cinética del coche cuando está en la segunda cima que tiene una altura de 20 m. No hay rozamiento. 6. ¿Qué potencia desarrolla un animal de 100 N de peso si trepa a un árbol de 3 m en 3s? 7. Un objeto de 100 g atado a una cuerda de 2 m describe una circunferencia en un plano vertical. A) Velocidad mínima en el punto más alto. B) Velocidad mínima en el punto más bajo. C) Tensión de la cuerda en esos puntos. Suponer que no hay rozamiento y que la energía mecánica es constante. 8. Calcula el trabajo realizado por una grúa para elevar con velocidad constante de 6 km/h en 1 minuto un cuerpo de 400 Kg. 9. Una pelota de 65 g de masa golpea la pared de un frontón con una velocidad de 25 m/s y rebota con una velocidad de 22 m/s. ¿Qué cantidad de energía ha perdido?¿Cuánto ha variado su cantidad de movimiento (modulo)? 10. Un objeto de 5 kg se desplaza sobre una superficie horizontal a velocidad constante de 80 km/h. Sabiendo que recorre 220 cm en 2 segundos, determina: a) Si asciende a lo largo de un plano inclinado 30º, determina la altura que alcanzará. Suponer que no hay rozamiento. b) Si en lugar de ascender por un plano, ese cuerpo choca con un muelle de constante elástica 600 N/m, determina la máxima compresión del muelle. 11. Un ciclista pesa junto con la bici 70 kg; va a 24 km/h por una carretera recta horizontal. Si el coeficiente de rozamiento es 0’15, determina la potencia que desarrolla. 12. Un coche de 1600 kg se desplaza por una carretera horizontal a una velocidad constante de 60 km/h; si desarrolla una potencia de 30 CV, determina la fuerza de rozamiento. 13. Un bloque de 5 Kg desciende desde el reposo por un plano inclinado 30º con la horizontal. La longitud del plano es de 10 m y el coeficiente de rozamiento 0,1. Halla la pérdida de energía a causa del rozamiento y la velocidad del bloque en la base del plano. 14. Se tiene un plano inclinado 60º respecto a la horizontal cuya longitud es de 10 m. ¿Qué velocidad debe llevar al inicio del plano para que este llegue a la parte superior del plano inclinado con velocidad nula?. El coeficiente de rozamiento vale 0,1. 15. Un bloque de 4 Kg desciende desde el reposo por un plano inclinado 60º con la horizontal. ¿Con qué aceleración bajará? ¿Cuánto tiempo tardará entener una energía cinética de 800 J? 16. Un ciclista va a 24 km/h por una carretera horizontal a 24 km/h. El peso total del ciclista y la bici es 80 kg y el coeficiente de rozamiento es 0,12. Calcula: a) Fuerza que tiene que desarrollar el ciclista. b) ¿qué potencia desarrollar? Alumnos con F y Q pendiente de 1º de Bachillerato. 14 - IES Pedro de Tolosa.Departamento de Física y Química. Curso 2009_10 1517. Para mover un coche de 1500 kg por una carretera horizontal se necesita una potencia de 30 CV. A) ¿Cuánto vale la fuerza de rozamiento que actúa sobre el coche? B) ¿Qué potencia tendría que desarrollar el coche para subir con la misma velocidad por un plano inclinado 5º? 18. Una caja de 1 Kg lleva una velocidad de 3 m/s por un suelo horizontal y choca contra un muelle cuya constante es 50 N/m. Calcula la máxima compresión del muelle. EJERCICIOS DE CALOR. 1 En un calorímetro que contiene 0,4 l de agua a 20º C se añaden 200 g de un metal a 250º C. Si la temperatura de equilibrio es de 25 º C. ¿Cuál es el calor específico del metal? 2 En una vasija con 800 ml de agua a 5º C se añade un trozo grande de hielo a 0ºC y se aísla el conjunto. ¿Cuántos gramos de hielo se funden? 3 Para una misma masa de aire y agua. ¿Qué tarda más tiempo en calentarse o enfriarse el aire o el agua?. Calores específicos respectivos 1000 y 4180 unidades en S.I En que caso el calor suministrado a un sistema se transforma totalmente en un incremento de la energía interna del mismo. 4 EJERCICIOS CAMPO ELECTRICO. 1 Dos carga puntuales de 4µC y -6 µC están situadas en el eje OY en los puntos (0,1) y (0,-2) respectivamente. Las coordenadas están en m. Determina la fuerza que actúa sobre cada una de ellas sabiendo que la constante dieléctrica o permitividad del medio es ε=5. 10-12 unidades en el SI. 2 Una partícula de 2 µC está situada en el origen de coordenadas. Otra partícula m=0,5 g y carga q está situada en el eje Y a 1,2 m de altura. Determina la carga q para que la partícula m esté en equilibrio. 3 Dos cargas q1 = 8 nC, q2 = – 40 nC están situadas en el eje X, en los puntos (2,0) y (6,0) respectivamente. Determina en que punto del eje OX habrá que colocar una carga positiva q(+) para que esté en equilibrio. 4 Dos cargas puntuales q1 = 4 µC y q2 = -1 µC están en los puntos P1 (0,0) y P2(1,0), respectivamente. Calcula: Fuerza eléctrica a que está sometida una carga q3=8.10-6 C, situada en el punto A(4,0). Las coordenadas están expresadas en metros. K= 9.109 Unidades SI. 5 Supón que junto a la superficie terrestre existe, además de un campo gravitatorio g = 9,8 N/kg hay un campo eléctrico uniforme vertical y hacia arriba E = 104 N/C. En esa región colocamos una partícula de masa m = 10 g con velocidad inicial nula. Calcula la carga de esa partícula para que permanezca en reposo. 6 Una carga puntual de –5 nC está en el origen de coordenadas. Determina el campo eléctrico y el potencial que origina esta carga en los puntos: A(1,0); B(1,1); C(2,4). 7 Dos cargas puntuales de 3 µC y -12 µC están en el eje X. La 1ª en el origen de coordenadas y la 2ª a 40 cm a la derecha de la primera carga. Determina el campo eléctrico y el potencial que crean en los puntos (1,0) y (4,0). Las coordenadas están en metros. Alumnos con F y Q pendiente de 1º de Bachillerato. 15 - IES Pedro de Tolosa.Departamento de Física y Química. Curso 2009_10 16- Criterios de calificación. La calificación de la asignatura se hará atendiendo a los siguientes criterios. 1) Los alumnos que entreguen los resúmenes de los temas y los ejercicios resueltos: • El 20 % de la calificación final de la asignatura será de la resolución de estos ejercicios. No puntuarán los ejercicios plagiados total o parcialmente. • El 80% restante será de los dos exámenes de la asignatura. Si la nota del examen es mayor que teniendo en cuenta los ejercicios entregados se dejará la calificación del examen. 2) Los alumnos que no entreguen los ejercicios: tendrán la calificación que obtengan en los exámenes. 3) En cada uno de los exámenes se les pondrán al menos 7 ejercicios similares a los que se les ha mandado para que les entreguen resueltos de cada 10 propuestos. Si un alumno aprueba los dos exámenes se le hará la media aritmética de la calificación de los dos exámenes y esa será la calificación que obtiene. Si suspende uno o los dos exámenes, se fijará una fecha justo antes de los exámenes finales de 2º de Bachillerato, y deberán examinarse del temario que no hubiesen superado. Ha de tener como mínimo un 4 en cada una de las dos partes de la asignatura para poder aprobar. Aprueban la asignatura aquellos alumnos que al hacer la nota media de la parte de Física y de la parte de Química, tienen como mínimo un 5. Caso de no aprobar, en la convocatoria ordinaria de Septiembre serán examinados de los contenidos mínimos de esta materia. Los criterios de calificación serán los mismos que en Junio; podrán entregar antes del examen de septiembre las actividades propuestas si no lo hicieron durante el curso. Si no entregan las actividades, la calificación que obtengan en ese examen será la calificación que aparecerá en su boletín de notas. Estas actividades están en la página Web del IES “Pedro de Tolosa”. Para descargarlas entra en http//www.iesptolosa.net Departamentos didácticos. Física y Química. FQ - 1º BTO San Martín de Valdeiglesias, a 24 de septiembre de 2009 Alumnos con F y Q pendiente de 1º de Bachillerato. 16