departamento de ciencias naturales y educación
Anuncio

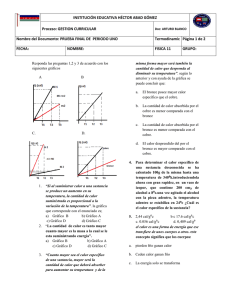
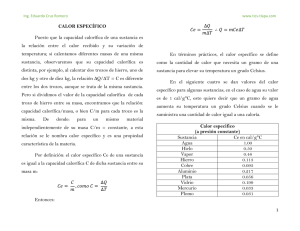
DEPARTAMENTO DE CIENCIAS NATURALES Y EDUCACIÓN AMBIENTAL NOMBRE DEL ESTUDIANTE: _____________________________________________________ GRADO: NOVENO ASIGNATURA: FÍSICA 9° PROFESOR: 4 PERIODO INDICADORES DE DESEMPEÑO CURSO _______ VALORACIÓN NUMÉRICA PROMEDIO 401. Demuestra habilidad para la formulación y resolución de problemas relacionados con el uso de herramientas matemáticas básica y fenómenos Termodinámicos 402. Elabora informes de laboratorio, trabajos orales y/o gráficos de calidad donde demuestra la comprensión con el uso de herramientas matemáticas básica y fenómenos Termodinámicos. Realiza la lectura de los indicadores de desempeño y de las acciones de mejora teniendo en cuenta tu desempeño durante el periodo. Para el proceso de nivelación es indispensable, tener los recursos necesarios como cuaderno, guías, textos de consulta, elementos de escritorio, entre otros; presentar todas las actividades en hojas de examen o como se solicite, debidamente marcadas y entregarlas al profesor, en la fecha que el colegio determine. “Las grandes cosas son el resultado de una multitud de cosas pequeñas” Le Corbusier. NIVEL/ ACTIVIDAD NIVEL BAJO NIVEL BÁSICO ACCIONES DE MEJORA Autoevaluar su desempeño a nivel actitudinal y conceptual, reflexionar sobre las deficiencias y fortalezas, haciendo registros de las estrategias para mejorar sus desempeños. Resolver el taller del anexo y entregarlo al profesor. Anotar la bibliografía consultada. Solucionar la evaluación anexa. Anotar la bibliografía consultada. Resolver el taller del anexo y entregarlo al profesor(a). Anotar la bibliografía consultada. CIENCIAS NATURALES Y EDUCACIÓN AMBIENTAL NOMBRE DEL ESTUDIANTE: ________________________________ FIRMA DE ESTUDIANTE: ____________________________________ NIVEL DE DESEMPEÑO: ____________________________________ ASIGNATURA: _____________________ PROFESOR (A) ____________________________________________ FECHA: __________________________ CURSO: - 4 PERIODO TALLER GRADO NOVENO CUARTO PERIODO 1. Los calores específicos del aluminio y del oro son, respectivamente, 0,22 cal/(g . K) y 126 J/(kg . K). ¿Cuál de los dos metales tiene mayor calor especifico? 2. En las cataratas del Niagara hay saltos de agua de hasta 50 m. Suponiendo que toda la energía que lleva el agua se convierta en calor, calcula el cambio de temperatura que produce el salto. Ce (agua) = 4180 J/(kg . K); g =10 m/s2. 3. Un cable de cobre tiene 100 m de largo cuando la temperatura es de 5°C. ¿Cuál es la longitud del cable, cuando la temperatura es de 25 °C? 4. Un disco de hierro tiene un radio de 11 cm a 0°C. ¿Cuánto aumenta su superficie cuando su temperatura se eleva hasta 300°C? 5. .En cuanto aumenta el área de una lámina circular de aluminio de radio 1 m, si la temperatura a las 6 a.m. es de14°C y al mediodía es de 24°C 6. ¿Por qué al estar de pie descalzos sobre una alfombra, sentimos el piso menos frío que si lo hacemos directamente sobre el baldosín? Justifica tu respuesta. 7. Si se pone en contacto un trozo de hielo con el extremo de una barra de hierro, se observa que después de cierto tiempo dicho extremo de la barra se siente frío si se toca con la mano. ¿Es posible afirmar que existe un flujo de frío del hielo hacia el hierro? 8. Cuando se frotan las manos una contra la otra, estas se calientan, ¿a qué se debe este fenómeno? 9. Un sistema se somete a un proceso adiabático. Si sobre él se realiza un trabajo de 1.500 J, ¿cuánto cambia la energía interna del sistema? 10. 9 En una compresión adiabática se realizan 395 J de trabajo sobre un gas. Calcula: a. La cantidad de calor liberado por el sistema. b. La variación de la energía interna del gas. 11. Si se suministran 204 calorías a 100 g de agua a 120 °C y a la presión normal, ¿cuál será la temperatura del agua? (justifica tu respuesta): 12. Para convertir en vapor a 100 °C, 10 g de agua que están a 20 °C, ¿cuántas calorías hay que suministrar? (justifica tu respuesta): 13. Explica el proceso por el cual un gas puede realizar trabajo. 14. ¿Qué relación hay entre el calor y la energía interna de una sustancia? Responda las siguientes preguntas de acuerdo a la información dada, justifique cada respuesta. 15. El calor de fusión del plomo vale 6,0 cal/gr. Y su temperatura de fusión es de 327ºC. Esta información significa que: a) Para elevar la temperatura de 1 gr. de plomo, desde 0ºC a 327ºC debemos suministrarle 6,0 calorías. b) Para fundir 6.0 gr de plomo necesitamos suministrarle 327 calorías. c) 1gr. de plomo, a 327ºC solamente puede estar en la fase líquida. d) 1 gr. de plomo sólido, a 327ºC, necesita 6 calorías para transformarse totalmente en plomo líquido. e) Si suministramos 6 calorías a 1 gr. de plomo sólido, a 327ºC, su temperatura aumenta en 1ºC. 16. Para cocer determinado alimento, debemos sumergirlo en cierta cantidad de agua y someterlo durante algún tiempo a una temperatura de 120ºC. ¿Qué debemos hacer para cocerlo?: a) Usar una olla común, ponerla al fuego y esperar a que el agua alcance los 120ºC de temperatura y esperar el tiempo necesario. b) Poner el alimento en una olla herméticamente cerrada, disminuirle bastante le presión en su interior, aumentar el fuego y esperar que el agua alcance los 120ºC y darle el tiempo necesario de cocción. c) Disminuir al máximo la cantidad de agua de la olla, agregar una determinada sustancia que eleve el punto de ebullición del agua, aumentar el fuego hasta obtener la temperatura de 120ºC, y darle el tiempo de cocción. d) Colocar el alimento dentro de una olla herméticamente cerrada, incrementar bastante la presión en su interior, colocar al fuego, esperar que el agua alcance los 120ºC de temperatura y darle el tiempo de cocción. e) Nunca lograríamos cocer el alimento en agua, ya que su punto de ebullición es de 100ºC. 17. Un gas ideal contenido en un recipiente experimenta el proceso termodinámico mostrado en la figura i. Señala cuál de las siguientes opciones es la correcta y por qué las otras opciones son incorrectas. a. Las temperaturas en A y B son iguales. b. De A a B, el ambiente hace trabajo sobre el gas. c. De B a C, el gas cede calor al ambiente. d. De C a D, la temperatura aumenta. e. De D a A, el gas cede calor al ambiente. 18. Se realizó un estudio con dos sustancias A y B que se calentaron en el laboratorio, y se obtuvieron las siguientes gráficasii. 4a. Después de 5 minutos de calentar, ¿cuál es la temperatura de cada una de las dos sustancias? b. ¿Cuánto tiempo necesita cada sustancia para alcanzar los 70 °C? c. ¿La sustancia B puede ser agua? Justifica la respuesta. d. ¿Pueden ser A y B la misma sustancia? ¿Por qué? e. ¿Cuál de ellas tiene mayor calor específico? 19. Completa la tabla y expresa la diferencia de temperaturas en °C y en ºK. EVALUACIÓN FÍSICA 9° PERÍODO 4 1. Dos cuerpos uno de cobre a 20°C y otro de aluminio a 60°C, se ponen en contacto, la temperatura de equilibrio es: 2. En 250g de agua a 15°C se depositan 200 g de hierro a 60°C, la temperatura final de la mezcla es: Ce agua = 1 cal / g. °C Ce hierro = 0.11 cal / g. °C 3. Se calientan 30 g de agua de 10 °C a 20 °C. Si el calor específico del agua es 1 cal/ g. °C, el calor ganado por el agua en el proceso es: 4. El punto normal de ebullición del agua es 100°C y el punto normal de fusión del agua es 0°C, se puede afirmar que en la escala de Fahrenheit, estos mismos puntos para el agua son: 5. Una varilla de aluminio tiene una longitud de 6m a 9°C.Si se incrementa la temperatura a 20°C,la variación en su longitud en metros es: (coeficiente de dilatación del aluminio 24x10-6). 6. El calor específico del agua es 1 cal/g ºC y del aluminio es de 0,22 cal/g ºC. De lo anterior se deduce que: 7. Una barra de aluminio de 3 g a una temperatura de 25 C recibe 12 calorías, su temperatura final es: 8. 0°C Equivalen en ºF - K i ii Tomado de hipertexto física 10, editorial Santillana página 280 Tomado de hipertexto física 10, editorial Santillana página 278