Enseñanza de la nomenclatura, sin casos particulares
Anuncio

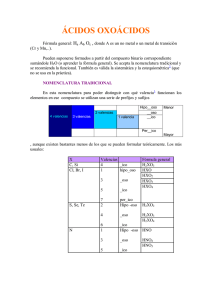
ENSEÑANZA DE LA NOMENCLATURA, SIN CASOS PARTICULARES IQ Luís Fernando Montoya Valencia Universidad Pontificia Bolivariana Centro de Ciencia Básica, Escuela de Ingenierías Circular 1ª Nº 70 – 01 Medellín. Colombia Luis.montoya@upb.edu.co Resumen. En la enseñanza de la química general hay una serie de temas que se plantean clásicamente como una colección de casos particulares y a veces su aplicación lleva a errores de forma y de fondo, entre estos temas, tenemos: nomenclatura; fórmulas y nombres de ácidos y sales. Para obviar esto se propone una serie de metodologías basadas en: uso de nemotecnia, orden alfabético, definiciones y fórmulas generales con respaldo en inducción matemática empírica. Palabras claves: Valor típico, valencia, grupos funcionales. Nomenclatura 1. CONSIDERACIONES GENERALES En general, los elementos existentes en la naturaleza pueden clasificarse como metales (M) y como no metales (η ηM) o metaloides. Los primeros tienden a perder electrones fácilmente adquiriendo carga positiva ya que son menos electronegativos; los no metales en cambio, tienden a ganar electrones adquiriendo carga negativa por ser más electronegativos. Todos los elementos, metales y no metales, pueden combinarse con hidrógeno (H) o con oxígeno (O) para formar compuestos binarios. Es de anotar que el oxígeno es el segundo elemento más electronegativo de la tabla periódica, solo superado por el flúor y podemos afirmar que tiene más tendencia a adquirir carga negativa, en cambio el hidrógeno tiene una electronegatividad intermedia entre los metales y los no metales por lo tanto no tiene muy definida su tendencia, puede ser positivo o negativo dependiendo con que se combine. Además los elementos, metales y no metales, pueden también combinarse con H y O para formar compuestos no binarios, los metales que son positivos exigen que el H y O sea negativo, en este caso en forma de (OH)1-, los no metales que son negativos no se pueden combinar con (OH)1-, en este caso compiten con H1+ y con O2-. Estas tendencias las podemos visualizar en el siguiente esquema basados en la tabla periódica, a continuación veremos un esquema de ella en la cual personalizamos los no metales ya que son solo 15, los que no están ahí obvio que son metales. Vamos a tapar el flúor porque es el único más electronegativo que el oxigeno y al oxigeno porque es formador de funciones. Nota: actualmente en la tabla periódica existen unos 110 elementos; químicamente hablando vamos a omitir los gases nobles y los elementos de las “tierras raras” y sobreviven para nuestro interés 76 elementos que se clasifican como metales (M), que son 61 y como no metales (η ηM) que son 15 únicamente. Existen varias maneras de dominar estos 76 elementos: • • • Se aprende los 76, en nuestra opinión si usted es “loco”, ya que cultura general química no son sólidos conocimientos de química. Se aprende los 61 metales (M), si está desocupado y no tiene nada más que hacer. Y los que no se sepa son los no metales (η ηM). Se aprende los 15 no metales (η ηM), si es práctico, y los que no se sepa son los metales ( M ); para que no se los tenga que aprender de memoria sugerimos lo que los psicólogos llaman NEMOTECNIA o MNEMOTECNIA (Arte de desarrollar la memoria), así: Como el flúor y sus vecinos son: III Boro IV Carbono Silicio V Nitrógeno P-fósforo As-arsénico VI Oxígeno S-azufre VII Flúor Cloro Selenio Bromo Telurio Observe que los no metales ( ηM) están formando una “escalera” Iodo At-astato Grupo VII: Como 7 es un número bíblico, a este grupo de los halógenos lo llamaremos el grupo de Cristo, ya que Cristo: Fue Clavado Brutalmente I Atado. A Dios lo que es de Dios, este acróstico fue implementado por un alumno de grado décimo del Colegio de la UPB. VII halógenos X2 Flúor Fue Cloro Clavado Brutalmente Bromo Iodo I At-astato Atado Grupo VI: Como está antes del de Cristo este es el grupo anti-Cristo y en este grupo está el azufre (según Chávez. el Diablo huele a azufre). Los podemos asociar con el acróstico: Ojala Satán Se Tenga. VI Oxígeno Ojala S-azufre Satán Selenio Se Telurio Tenga Grupo V: Este es el grupo de las relaciones colombo-argentinas en fútbol. ¿Será por el cinco cero?; sin embargo en las eliminatorias para el mundial del 98: No Pudo Asprilla. V Nitrógeno No P-fósforo Pudo As-arsénico Asprilla Grupo IV: Como ya tenemos 12 de los 15 no metales (η ηM), podemos afirmar que: SiC. Finalmente: IV Carbono C Silicio Si Grupo III: Bueno, ya acabamos. Boro H1- O2- III Bueno ya acabamos (OH)1- H1+ O2- H1+ y O2- III B IV C Si M (+) V VI O ηMS As Se Te VII F Cℓ Br I At 1.1. VALENCIA Es la capacidad de enlace que posee un elemento; de sus valores depende la proporción como se combinan los elementos para formar los compuestos, ya que siempre existe INTERCAMBIO DE VALENCIAS, es decir, si buscamos la fórmula del compuesto formado por los elementos X de valencia x y Y de valencia y, el compuesto tendrá la fórmula: X y Yx Ya que la valencia del elemento X se asigna como subíndice del elemento Y, y la valencia del elemento Y se asigna como subíndice del elemento X; esto es el intercambio de valencias, con este intercambio de valencia se busca la neutralidad eléctrica en una fórmula. Para los elementos representativos (grupos I a VII o grupos A) de la tabla periódica, la valencia está dada por el número de electrones desapareados en su distribución electrónica normal o en su(s) distribución(es) electrónica(s) excitada(s), donde cada distribución electrónica excitada consiste en el paso de un electrón de valencia apareado hacia un orbital de valencia disponible generando una mezcla especial de orbitales que se conocen como”orbítales Híbridos”. Así tenemos que las valencias de los elementos de un grupo se obtienen a partir del número del grupo con restas sucesivas de dos en dos así: • • • • • • • Grupo VII las valencias son: 7, 5, 3 y 1 (sería ilógico seguir con -1) Grupo VI las valencias son: 6, 4 y 2 (sería ilógico seguir con 0) Grupo V las valencias son: 5, 3 y 1 (sería ilógico seguir con -1) Grupo IV las valencias son: 4 y 2 (sería ilógico seguir con 0) Grupo III las valencias son: 3 y 1 (sería ilógico seguir con -1) Grupo II las valencias son: 2 (sería ilógico seguir con 0 ) Grupo I las valencias son: 1 (sería ilógico seguir con -1) Vamos a ubicar los valores de las diferentes valencias al menos para los no metales, así: Valencias V de los no metales ηM III IV V VI 3 1 4 2 5 3 1 6 4 2 VII 7 5 3 1 Cada elemento se debe identificar con un nombre que indique con cual valencia relativa está trabajando, para esto existen sufijos comparativos (que indican mayor – menor) y prefijos superlativos o exageraciones (que indican más mayor- menos menor). Si observamos el anterior listado de valencias observamos una franja central en la cual cada elemento no-metal posee dos valores de V que se pueden ordenar como mayor y menor, esta identificación se logra agregando a la raíz del nombre del elemento (∼ ∼) los sufijos comparativos: ico y oso y para las oxisales con los sufijos: ato – ito. III Valencias V IV V VI VII 7 de los no metales ηM mayor ∼ ico menor ∼ oso ∼ ato ∼ ito 3 1 4 2 5 3 1 6 4 2 5 3 1 Para los halógenos queda sin identificar la valencia 7 y esta se nombra usando el prefijo superlativo per, como per∼ ∼ico (o per ∼ ato para las oxisales) que significa “más mayor”. Igualmente los elementos de los grupos V-VI y VII poseen una valencia inferior sin identificar y esta se nombra usando el prefijo superlativo hipo, como hipo ∼ oso (o hipo ∼ ito para las sales) que significa “menos menor”, como se indica a continuación. Más mayor Valencias V mayor de los no menor metales η Menos menor per∼ ico ∼ ico ∼ oso hipo∼ oso per∼ ato ∼ ato ∼ ito hipo∼ ito III IV V VI 3 1 4 2 5 3 1 6 4 2 VII 7 5 3 1 Asocie para que no confunda ni olvide: si ordenamos alfabéticamente: mayor-menor; ico-oso y ato-ito, construimos por ABC la relación entre los sufijos, así: mAyor Ico Ato Mayor es a menor como ico es a oso y como ato es a ito mEnor Oso Ito La anterior asociación en orden alfabético, origina una antigua norma nemotécnica conocida como: “cuando el oso toca el pito, baila el mico con el gato” Para los elementos no representativos no es posible estructurar las valencias en forma general. Existen dos casos especiales en los cuales el elemento, dependiendo del valor de valencia puede actuar como metal o como no-metal y son: Cr Mn METAL V=3(ico) y V=2(oso) V=3(ico) y V=2(oso) No-METAL V=6(ico – ato) V=7(per ico, per ato) y V=6(ico-ato) 1.2. VALOR TIPICO (T) (esta definición es propiedad intelectual del autor) Trabajaremos con un Valor Típico (T) para los NO METALES. Dicho valor típico nos indica la “Deficiencia de la regla del octeto”. T es ÚTIL como subíndice del hidrógeno en los ácidos normales, donde un ácido es una fórmula que se inicia con H. Los valores de T son: Elementos del grupo VII, poseen 7 electrones de valencia, falta un electrón para cumplir la regla del octeto; por lo tanto T=1; de igual manera para los elementos del grupo VI, T=2, grupo V; T=3; grupo IV; T=4 y para el grupo III, T=3; este último no es 5, como podría pensarse ya que es más fácil perder tres electrones (para el boro ser isoelectrónico con el helio) que ganar 5 (para el boro ser isoelectrónico con el neón). Para estos valores de T existen dos excepciones: El N cuyo valor de T=1 (y no 3) y el C con T=2 (y no 4), estos elementos son tan excepcionales que originan dos ramas de la química, el Nitrógeno origina la química de aminoácidos y el Carbono la química orgánica. NOTA: Para los elementos del grupo I y II no se define valor de T ya que en estos grupos no hay no metales. Como hay dos casos particulares de comportamiento como metal y como no-metal, y T existe para los no metales, entonces tenemos que: Para el Cr no-metal (V=6), T=2 Para el Mn no- metal (V=7), T=1 y (V=6), T=2 El Manganeso es el único no-metal que posee 2 valores de T. Resumen que contiene toda la información anterior: no-metales valores de las valencias, prefijos superlativos, sufijos comparativos, valores de T, las excepciones de C y N y las anomalías de Cr y Mn H1- O2- H1+ O2- III B IV C T=2 Si ηM() V N T=1 P As 2 3 4 6 3 1 4 2 (OH)1- M (+) excepciones Cr Mn Mn Valor típico de los ηM Valencias V de los nometales ηM per∼ ico ∼ ico ∼ oso hipo∼ oso per∼ ato ∼ ato ∼ ito hipo∼ ito 1 H1+ y O2- VI O S Se Te VII F Cℓ Br I At 3 2 1 5 3 1 6 4 2 7 5 3 1 7 FORMULAS GENERALES 1.3. Se ha dicho que los elementos se combinan con H2 y O2 para formar compuestos binarios, estos compuestos son: M + H2 M + O2 η M + H2 η M + O2 HIDRURO ÓXIDO (conocido como óxido básico) ÁCIDO HIDRÁCIDO (sólo con nM muy electronegativo como: F, Cl, Br, I, S, Se, Te). Produce OTRO ÓXIDO ó ANHIDRIDO (conocido como óxido ácido) Los compuestos binarios obtenidos con oxígeno (óxidos y anhídridos) reaccionan con agua para producir dos grupos funcionales no binarios, así: Óxido + H2O HIDRÓXIDO ó BASE Anhídrido + H2O ÁCIDO OXÁCIDO1 RECURSO DIDÁCTICO: Para estructurar el orden de una fórmula partimos de las siguientes bases: • Toda fórmula está compuesta de dos partes: 1 Peligro: existe una metodología equivocada para generarlos sumando 1, 2 ó 3 moléculas de agua, ver numeral 3.2.2 “FOR” y “MULA” (lógico), la primera (“FOR”) está constituida por la parte positiva y la segunda (“MULA”) lo está por parte negativa. • Luego de establecido el orden, (la “FOR” y la “MULA”) hacemos el intercambio de valencias (sin egoísmo), teniendo en cuenta: ♦ La valencia del hidrógeno es 1 ♦ La valencia del oxígeno es 2 ♦ La valencia del elemento (M o ηM) es V ♦ La valencia de un ión (átomo o grupo de átomos con carga eléctrica), es el valor absoluto de su carga, ejemplo: la valencia del ión OH1- es V=1. NORMA NEMOTÉCNICA: La “MULA” (o sea la segunda parte de la fórmula) nos indica el nombre del grupo funcional menos en los ácidos, ya dijimos que son los que tienen H en “FOR”. Veamos las posibles combinaciones siguiendo siempre la siguiente metodología: 1) Identificar “FOR” y “MULA” 2) Identificar el grupo funcional 2a) Ácido que inicia por H y éste exige el subíndice T. 2b) Si no inicia con H la “MULA” manda. 3) Lograr neutralidad eléctrica (intercambiando de valencias) ♦ MyH Paso 1) M tiene que ser + ⇒ exige ser “FOR” H puede ser + ó - ⇒ se acomoda a ser “MULA” El orden de la fórmula es: MH Paso 2) Como no es un ácido (no inicia por H), la “MULA” manda, por tener Hidrógeno en la “MULA” esta función es un HIDRURO Paso 3) Hacer el intercambio de valencias y queda: M1HV Un hidruro es una fórmula con hidrógeno en la mula. ♦ MyO Paso 1) M tiene que ser + ⇒ exige ser “FOR” O es muy negativo ⇒ exige ser “MULA” El orden de la fórmula es: MO Paso 2) Como no es un ácido (no inicia por H), la “MULA” manda, por tener Oxigeno en la “MULA” esta función es un ÓXIDO Paso 3) Hacer el intercambio de valencias y queda: M2OV Un óxido es una fórmula con oxigeno en la mula. ♦ M con H y O Paso 1) M tiene que ser + ⇒ exige ser “FOR” H y O tienen que ser “MULA”, es decir como (OH)1El orden de la fórmula es: M(OH) Paso 2) Como no es un ácido (no inicia por H), la “MULA” manda, por tener Hidrógeno y Oxigeno en la “MULA” esta función es un HIDRÓXIDO Paso 3) Hacer el intercambio de valencias y queda: M1(OH)V Un hidróxido es una fórmula con hidrógeno y oxigeno en la mula. ♦ ηM y H Paso 1) ηM tiende a ser - ⇒ exige ser “MULA” Paso 2) Paso 3) ♦ ηM y O Paso 1) Paso 2) Paso 3) H puede ser + ó - ⇒ se acomoda a ser “FOR” El orden de la fórmula es: Hη ηM Como inicia por H, es un ácido y el Hidrógeno exige el subíndice T y por el momento queda H T ηM Haga el intercambio de valencias, y queda: HTηM1, éste es un ácido normal porque el número de hidrógenos es T. ηM tiende a ser - ⇒ tiende a ser “MULA” O es muy negativo (es muy electronegativo) ⇒ exige ser “MULA”, por lo tanto el ηM se voltea a ser “FOR” El orden de la fórmula es: ηMO Como no es un ácido (no inicia por H), la “MULA” manda, por tener Oxigeno en la “MULA” esta función es OTRO ÓXIDO, para evitar confusiones, especialmente con el cromo y el manganeso, ya que existen dos crómicos y dos mangánicos, mejor a este grupo funcional lo llamaremos ANHÍDRIDO Haga el intercambio de valencias y queda: ηM2OV. ♦ ηM con H y O Paso 1) O es muy negativo ⇒ exige ser “MULA” H puede ser + ó - ⇒ se acomoda a ser “FOR” ηM es intermedio entre H y O, por el momento el orden de la fórmula es Hη ηMO. Paso 2) Como inicia por H, es un ácido y el Hidrógeno exige el subíndice T y por el momento queda HTηMO Paso 3) Haga el intercambio de valencias y queda: HT ηM Oss NOTA: Aquí no podemos hacer un intercambio de valencias (son tres componentes), el número de oxígenos (empíricamente) está dado por la “semisuma (ss) entre T y V” del no metal (η ηM). Es decir: T + V Suma entre T y V del ηM Semi significa: dividido 2 2 Esta definición de semi-suma para el número de oxígenos es propiedad intelectual del autor Como este ácido tiene oxígenos se denomina ÁCIDO OXÁCIDO y es el OXIÁCIDO NORMAL u ORTO porque el número de hidrógenos es T. ss = NOTA: Existen dos Ácidos Oxácidos ANORMALES: el META y el PIRO, estos ácidos son anormales porque solo algunos no metales los presentan, su existencia depende del valor de T. En resumen podemos tener las siguientes fórmulas generales para los diferentes grupos funcionales en los cuales V es el valor de la valencia del metal o del no-metal, y T es el valor típico del no-metal. 1.3.1. HIDRURO M1HV Metal de valencia V con Hidrógeno de valencia 1. 1.3.2. ÓXIDO M2OV Metal de valencia V con Oxígeno de valencia 2. 1.3.3. ÁCIDO HIDRÁCIDO HTηM1 Hidrógeno de V=1 con no-metal de valor típico T (este es un ácido normal) 1.3.4. ANHÍDRIDO ηM2OV No-metal de valencia V con Oxígeno de valencia 2. 1.3.5. HIDRÓXIDO M1(OH)V Metal de valencia V con el grupo OH de valencia 1. 1.3.6. ÁCIDO OXÁCIDO Este puede ser de tres tipos: orto, meta y piro; en sus fórmulas generales (empíricas y son propiedad intelectual del autor) tenemos que: • ACIDO OXACIDO ORTO2 HT ηM Oss Donde ηM es el no-metal, de valencia V y valor típico T (este es un ácido normal), y ss es la “semisuma” entre T y V del no-metal. • ACIDO OXÁCIDO META3 : HT-2 ηM Oss- 1 Como se podrá observar, esta fórmula coincide con la fórmula del ácido orto si se le resta una molécula de agua, es decir, quitando 2 hidrógenos y 1 oxígeno. ≤ Nótese que si T 2 este tipo de ácido NO EXISTE. • ÁCIDO OXÁCIDO PIRO: H2T-2 η OT+v-1 Esta fórmula se obtiene tomando dos veces la fórmula del ácido orto y restándole una molécula de agua. Nótese que si T 1.4. < 2 este tipo de ácido NO EXISTE. FORMACIÓN DE SALES Los ÁCIDOS se descomponen en iones H+ y una parte negativa que la denominaremos radical del ácido (es la “mula” de la sal). NOTA: • Si el ácido que origina el radical es HIDRÁCIDO el radical es HALOIDEO. • Si el ácido que origina el radical es OXÁCIDO el radical es OXISAL. LAS BASES o HIDRÓXIDOS se descomponen en iones (OH)1- y una parte positiva que denominaremos “ión metálico” (es la “FOR” de la sal). Cuando un radical de un ácido (negativo o “mula”) se combina con un ión metálico (positivo o “FOR”) se forma una sal y su fórmula tiene en cuenta el INTERCAMBIO DE VALENCIAS, para lograr la neutralidad eléctrica. NOTAS: • Una sal se identifica fácilmente si tiene metal (en la “for”) y no-metal (en la “mula”). • La sal puede ser Haloidea u Oxisal dependiendo del radical que la forme. Si no hay Oxígenos en la “mula” es HALOIDEA. Si hay Oxígenos en la “mula” es OXISAL. 2 Con esta fórmula general se evita el trabajo memorístico denunciado en el numeral 3.2.1. y se evita los errores generados por dicho trabajo y además no tiene que emplear las adiciones de 1, 2 ó 3 moléculas de agua al anhídrido que generan errores como los denunciados en el numeral 3.2.2. 3 Según el diccionario de Química y Productos Químicos (Título Original: The Condensed Chemical Dictionary) de Gessner G. Hawley de Ediciones Omega, tenemos: “ORTO: Ácido hidratado en contraste con el meta”, si nos devolvemos podemos redefinir: META ácido deshidratado en contraste con el ORTO. “PIRO: prefijo que indica la formación por acción del calor de un ácido inorgánico obtenido por pérdida de una molécula de agua, a partir de dos moléculas de orto”, es decir PIRO = 2 ORTO - H2O. Mapa conceptual o algoritmo, que resume los diferentes grupos funcionales, la reacción de obtención y su nomenclatura: Nótese que cumple con un ordenamiento como el del “metro de Medellín”, posee dos líneas a y b y estaciones en cada línea. A) ácidos, inician por H y su subíndice es T B) no ácidos, no inician por H, la segunda parte de la fórmula define la función B) 1. M 1 H A) 1. H T nM ácido nM hídrico hidruro M ico/oso V ~ ~ M2 OV A) 2. H T nM O SSácido nM ico/oso M ico/oso óxido ~ B) 2. ~ nM 2 O V nM ico/oso óxido ~ o anhídrido B) 3. M 1 (OH) V A) 3. Ácido meta = orto deshidratado A) 4. Ácido piro = doble orto deshidratado B) 4. M T nM B) 5. M T V M ico/oso hidróxido nM uro M ico/oso ~ (nM O SS ) V ~ ~ nM ato M ico ~ ito ~ oso Ilustración: Combinar con H, con O, con H y O al metal Cu de valencia 2 (ico). La tendencia natural del Cu por ser un metal es la de adquirir carga positiva, por lo tanto cuando se combine con H y O éstos actúan como (OH)1-, así: Paso 1 Paso 2 Paso 3 For+ Mula- línea estación Cu función intercambio Con H+ - Cu+2 H- B 1 hidruro cúprico Cu1H2 Con O- - Cu+2 O- - B 2 óxido cúprico Cu2O2 CuO Con (OH)1- Cu+2 (OH)1- B 3 hidróxido cúprico Cu1(OH)2 (+) V=2 (ico) Combinar con H, con O, con H y O al no-metal S de valencia 6 (ico), como es azufre es un no-metal, tenemos que tener en cuenta su valor de T=2. La tendencia natural del S por ser un no-metal es la de adquirir carga negativa, por lo tanto cuando se combine con H y O éstos no actúan como (OH)1-, así: Paso 1 Paso 2 Paso 3 For+ Mula- línea Estación función intercambio Con H+ - H+ S- A 1 Ácido sulfhídrico V=6 Con O- - S+6 O- - B 2 óxido (ico) El S se “ voltea ”, el oxígeno lo S H2S - sulfúrico S2O6 SO3 También se puede llamar anhídrido sulfúrico obliga T=2 ss = 4 Con H+ - y O- + +6 -- H S O A 2 ácido sulfúrico A 2* Ácido meta sulfúrico A 2** Ácido piro sulfúrico H2SO4 H2-2SO4 –1 H0SO3, no existe H2 x 2-2S2O2 x 4 –1 H2S2O7 2. MÉTODOS DE TRABAJO 2.1. Dada la valencia y el grupo funcional, establecer la fórmula. • Hidruro con Sodio de V=1(sódico) Grupo funcional: Hidruro, de fórmula general: M1HV (línea B, estación 1) Metal: Na de V=1, por lo cual la fórmula queda: NaH (hidruro sódico) • Óxido con Hierro de V=2(ferroso) Grupo funcional: Óxido, de fórmula general: M2OV (línea B, estación 2) Metal: Fe de V=2, por lo cual la fórmula es: Fe2O2, al simplificar y queda: FeO (óxido ferroso) • Hidróxido con Cobre V=2(cúprico) Grupo funcional: Hidróxido, fórmula general: M1(OH)V (línea B, estación 3) Metal: Cu de V=2, por lo cual la fórmula es: Cu(OH)2 (hidróxido cúprico) • Anhídrido con Cloro de V=1(hipocloroso) Grupo funcional: Anhídrido, de fórmula general: ηM2OV (línea B, estación 2) No-metal: Cl de V=1, lo que nos da la fórmula: Cl2O1 (anhídrido hipocloroso) • Ácido Hidrácido del Cloro (clorhídrico) Grupo funcional: ácido hidrácido, de fórmula general: HTηM1 (línea A, estación1) En la F.G. se ve que no requiere conocer el valor de V. No-metal: Cl de T=1 por pertenecer al grupo VII, la fórmula es: HCl • Ácido Hidrácido del Azufre (sulfhídrico) Grupo funcional: ácido hidrácido, de fórmula general: HTηM1 (línea A, estación1) No-metal: S de T=2 por pertenecer al grupo VI, la fórmula es: H2S • Ácido Orto del Azufre de V=6 (sulfúrico) Grupo funcional: Ácido Oxácido Orto, fórmula general: HTηMOss,(línea A, estación 2) No-metal: S de T=2 y V=6, la semisuma entre 2 y 6 vale 4, entonces nos queda: H2SO4, este compuesto se llama ácido sulfúrico o ácido orto sulfúrico. El otro método de trabajo es establecer la valencia y el nombre conocida la fórmula. 2.2. En estos casos la fórmula nos da una estructuración del compuesto y en él debemos identificar: • • • Qué clase de elementos se combinan: Metal, no-metal, hidrógeno, oxígeno, grupo OH. Fórmula general del grupo funcional, línea y estación. La valencia con la cual trabaja el elemento en el compuesto. Evidentemente las dos primeras partes son de trabajo fácil y la última parte requiere un trabajo para determinar el valor de la valencia. A continuación se dan las siguientes pautas para determinar la valencia. 2.2.1. Para grupos funcionales simples: Hidruros, óxidos, ácido hidrácido, ácido oxácido, radical haloideo, radical oxisal, sal haloidea, hidróxidos, iones metálicos y anhídridos. La valencia del elemento se determina con el método de “suma de números de oxidación”. Número de oxidación es la carga real o aparente que presenta un elemento dentro de un compuesto. Para determinar los números de oxidación en los compuestos tenemos las siguientes normas, originadas con la metodología de “FOR” y “MULA”: • El número de oxidación del Oxígeno es -2, menos en el F2O que es +2, ya que el flúor es el único elemento de la tabla periódica que es más electronegativo que el Oxígeno (el flúor es mucho mas “MULA” que el oxígeno). • El número de oxidación del Hidrógeno es +1, menos en los hidruros que es –1, el hidrógeno es la “mula”. • La suma de los números de oxidación de una sustancia neutra es igual a cero. • La suma de los números de oxidación en un ión es igual a su carga. • La valencia del metal o no-metal es el valor absoluto de su número de oxidación. • Para los grupos funcionales ácido hidrácido, radical haloideo y sal haloidea, el número de oxidación del no-metal depende del valor típico T. En estos grupos, el número de oxidación del no-metal es -T, y en las sales haloideas, el número de oxidación del metal, si éste es polivalente, se determina por “suma de números de oxidación”, si el metal es monovalente, su única valencia corresponde a su número de oxidación pero con signo positivo, tendencia natural de los metales. Al efectuar la suma de los números de oxidación en un compuesto hay que tener en cuenta el número de veces que el elemento está en el compuesto. EJEMPLOS: Identificar el grupo funcional y determinar las valencias de: CaH2 (línea B, estación 1) Aquí tenemos que el Ca es un metal y está unido con el hidrógeno, por lo tanto el grupo funcional es Hidruro (hay H en la “MULA”). Determinación de la valencia del metal: x -1 CaH2 Sea X el número de oxidación del Calcio. La suma de los números de oxidación es igual a cero: 1(X) + 2(-1) = 0 ⇒ X = 2, el compuesto es hidruro cálcico. Fe(OH)3 (línea B, estación 3) Aquí tenemos que el Fe es un metal y está unido al grupo OH, por lo cual el compuesto es un Hidróxido (hay H y O en la “MULA”) Determinación de la valencia del metal: x -2 +1 Fe(OH)3 Sea X el número de oxidación del hierro. La suma de los números de Oxidación es igual a cero: 1(X) + 3(-2) + 3(+1) = 0 ⇒ X = 3, el compuesto se llama hidróxido férrico. PbO2 (línea B, estación 2) El Pb es un metal que pertenece al grupo IV (valencias 4 y 2) y está unido al Oxígeno, por lo tanto el grupo funcional es óxido (hay O en la “MULA”). Determinación de la valencia del metal: x -2 PbO2 Sea X el número de oxidación del plomo. La suma de los números de oxidación es igual a cero: 1(X) + 2 (-2) = 0 ⇒ X = 4, el compuesto se llama óxido plúmbico. HI (línea A, estación 1). Aquí tenemos no-metal con Hidrógeno, el grupo funcional es ácido hidrácido y no hay que determinar la valencia, ya que no depende sino de T, la fórmula general es: HTηM, el compuesto se llama ácido yodhídrico. Ag2S (línea B, estación 4) Ag es metal, S es no-metal. Siempre que se tenga metal y no metal tenemos una sal. Como no hay oxígenos entonces es haloidea, el S tiene número de oxidación -T (por ser sal haloidea). Determinación de la valencia del metal: x -2 Ag2S Sea X el número de oxidación del plomo. La suma de los números de oxidación es igual a cero 2(X) + 1(-2) = 0 ⇒ X = 1, este resultado es obvio, ya que la plata es monovalente, este compuesto se llama: sulfuro argéntico H2CO3 (Línea A, estación 2). Este es un ácido oxácido, recuerde que T del Carbono es 2 (en lugar de 4). Determinación de la valencia del no-metal: +1 x -2 H2CO3 Sea X el número de oxidación del carbono. 2(+1) + 1(X) + 3(-2) = 0 ⇒ X = 4, este compuesto se llama ácido carbónico o ácido orto carbónico, por ser orto el ácido normal se puede omitir la palabra orto. 2.2.2. Para las sales oxisales con metal monovalente (obvio que el metal posee solo un valor de V) El número de oxidación del metal es +V El número de oxidación del no-metal se determina por “suma de números de oxidación”. EJEMPLOS: Obtener la valencia del no-metal en las siguientes sales oxisales. K2(SO3) (línea B, estación 5). El número de oxidación del K es +1 `por pertenecer al grupo I. Determinación de la valencia del no-metal: +1 x -2 K2(S O3) Sea X el número de oxidación del azufre. 2(+1) + 2(X) + 5(-2) = 0 ⇒ X = 4, esta sal se llama sulfito potásico. [Mg(OH)]3(PO3) (línea B, estación 5). El número de oxidación del Mg es +2 (pertenece al grupo II). Determinación de la valencia del no-metal: +2 -2 +1 x -2 Sea X el número de oxidación del fósforo. [Mg (OH)] 3 (PO3) 3(+2) + 3(-2) + 3(+1) + 1(X) + 3(-2) = 0 ⇒ X = 3, la sal se llama fosfito básico magnésico. Cd(NO3)2 (línea B, estación 5). El número de oxidación del Cd es +2, es un metal que sólo tiene una valencia y vale 2. Determinación de la valencia del no-metal: +2 x -2 Cd(N O3)2 Sea X el número de oxidación del azufre. 1(+2) + 2(X) + 6(-2) = 0 ⇒ X = 5, la sal se llama nitrato cádmico. 2.2.3. Para sales oxisales con metal Polivalente: En este caso hay dos incógnitas. La valencia del metal y la del no-metal, es decir, si el metal posee dos o más valores de V, se requieren dos ecuaciones, este es el caso MÁS INTERESANTE. El procedimiento sugerido a seguir es: a. Con el número de OXÍGENOS DEL RADICAL (NO CONFUNDIR con el número de oxígenos total) y el valor de T, determinamos el valor de V para el no-metal. Hay dos ecuaciones potenciales: T+V Número de oxígenos = 2 De acuerdo a la estación 5 de la línea B, la carga del radical (ηMOss) es –T y por “suma de números de oxidación”, también podemos calcular la valencia del no-metal. b. Con “suma de números de oxidación” determinamos la valencia del metal. EJEMPLOS: Obtener la valencia del no-metal y del metal en las siguientes sales oxisales. Fe(ClO3)2 (línea B, estación 5) a. Valencia del no-metal (Cl) con T = 1 y número de oxígenos (tres). T+V =3 , como T=1, entonces V=5 (haga el cálculo) 2 b. Valencia del metal (Fe), por “suma de números de oxidación”: Determinación de la valencia del metal: x 5 -2 Fe(Cl O3)2 Sea X el número de oxidación del hierro. 1(X) + 2(+5) + 6(-2) = 0 ⇒ X = 2 (valor lógico para el Fe). CONCLUSIÓN: valencia del Cl = 5 (ato) y del Fe = 2 (oso). La sal se llama: clorato ferroso Au2(H2SiO4)3 (línea B, estación 5) a. Valencia del no-metal (Si) con T=4 y número de oxígenos (cuatro) T+V =4 , como T=4, entonces V=4 (haga el cálculo) 2 b. valencia del metal: Determinación de la valencia del metal: x +1 4 -2 Au2( H2Si O4)3 Sea X el número de oxidación del oro. 2(X) + 6(+1) + 3(+4)+ 12(-2) = 0 ⇒ X = 3, Conclusión: V del Si = 4(ato), V del Au = 3(ico). La sal se llama silicato diácido aurico. 3. APÉNDICE 3.1. Justificación del cambio metodológico. En vista de que en los textos existe una serie de metodologías que llevan a errores al aplicarlas y que generan cierto grado de dificultad para que el estudiante se apersone del conocimiento en una forma crítica y analítica, he planteado en este documento una metodología más integral que genere en forma general y amena la aplicabilidad para cada caso particular, logrando con ello subsanar los inconvenientes encontrados en las metodologías clásicas. A continuación planteo los casos encontrados en la literatura clásica que generan inconvenientes de aprendizaje y errores de aplicación, pero lo más importante no es mostrar problemas sino plantear soluciones a los casos encontrados. 3.2. Errores en textos clásicos 3.2.1. Caso No. 1, “Ácidos de memoria” En textos como ISBN-9684229852 de origen americano establecen: “Un ácido ternario común (sic) de cada no-metal se designa (en forma arbitraria (sic)) como ácido-ico, es decir, se nombra diciendo la raíz del ácido (sic) terminada en –ico. Los ácidos ternarios de este tipo se indican en la siguiente tabla. No hay ácidos ternarios de terminación -ico para los no metales que se omiten(sic). Es importante aprender los nombres y fórmulas de estos ácidos de memoria(sic) porque los nombres de los demás ácidos ternarios y sales se derivan de ellos”. Grupo periódico de elementos centrales IIIA IVA VA VIA VIIA H3BO3 H2CO3 HNO3 Ac. Bórico Ac. Carbónico Ac. Nítrico H4SiO4 H3PO4 H2SO4 HClO3 Ac. Silícico Ac. Fosfórico Ac. Sulfúrico Ac. Clórico H3AsO4 H2SeO4 HBrO3 Ac. Arsénico Ac. Selénico Ac. Brómico H6TeO6 (Sic) HIO3 Ac. Telúrico Ac. Yódico NOTA: Sic significa copia textual aunque no estoy de acuerdo . COMENTARIOS Sic 1, “Ácido ternario común”. El texto hace referencia al ácido normal o orto pero no menciona los ácidos anormales meta y piro que algunos no metales forman. Sic 2, “en forma arbitraria”. El autor desconoce que el sufijo ICO y el sufijo OSO son sufijos comparativos y se emplean para indicar con que valor relativo de valencia trabaja el no-metal. Sic 3, “La raíz del ácido terminada en ico”. Todos somos humanos, esto es un eleve, lo que termina en ico es la raíz del nombre del elemento. Sic 4, “No hay ácidos ternarios de terminación –ico para los no metales que se omiten”. Este comentario puede inducir a un sofisma de negar la existencia de algunos ácidos –ico que si existen y que generan sales que también existen como por ejemplo: Ácido Crómico: H2CrO4 y ácido Mangánico: H2MnO4. Sic 5, “Es importante aprender los nombres y fórmulas de estos ácidos de memoria”. Con esto lo único que consigue es hacerle creer al los estudiantes que la química está en un pedestal y que el profesor está inalcanzable en dicho pedestal y por lo tanto el “club de amigos de la química” sería una especie en vía de extinción. Esto es un paradigma innecesario. Sic 6, “H6TeO6 ácido telúrico”. Aquí alguien se equivocó porque el ácido telúrico tiene por fórmula H2TeO4, pero es dihidratado, H2TeO4. 2H2O, y a alguien le dio por contar: H hay 6, Te hay 1 y O hay 6 (factor común para reducir a la mínima expresión?) ...y sigue el texto: “Los ácidos que tienen un átomo de oxígeno menos por átomo central se nombran del mismo modo, con excepción que el sufijo ICO se cambia a OSO” COMENTARIO Esta es una tentativa de relacionar los ácidos –OSO con los ácidos –ICO (aprendidos de memoria). Sólo existe una discrepancia que es H6TeO5 cuando en realidad es H2TeO3. ...continúa el texto: “Los ácidos ternarios que tienen un átomo de oxígeno menos que los ácidos -OSO se nombran usando el prefijo HIPO y el sufijo –OSO” COMENTARIO Esta norma induce al estudiante a generar los ácidos HIPO-OSO para el Boro, para el Carbono y para el Silicio que no existen, además el ácido Hipoteluroso sería H6TeO4 que si existe pero su fórmula es H2TeO2. La efectividad de esta norma es del 67% (8 correctos de 12 posibles). ...y continúa el texto: “Los ácidos que contienen un átomo de oxígeno mas por átomo de no-metal central que el ácido –ICO se nombran con el prefijo PER y el sufijo –ICO”. COMENTARIO Esta norma induce a generar los ácidos PER-ICO para los no metales B, C, Si, N, P, As, S, Se y Te que no existen, también los ácidos PER-ICO para los no metales Cl, Br, I que si existen, pero no inducen al Permangánico (HMnO4) generador de las sales Permanganato de amplio uso como agente oxidante. Efectividad de esta norma: 13% (3 correctos de 13 posibles). 3.2.2. Caso No. 2. Ácidos orto, meta y piro, propuesta “general” con muchas excepciones. En textos como ISBN8430730249 de origen español hacen un intento de definir los ácidos orto (normal) y los anormales meta y piro, así: “Para las columnas impares”: PREFIJO Meta Piro Orto FORMA QUE INDICA 1 anhídrido + 1 H2O 1 anhídrido + 2 H2O 1 anhídrido + 3 H2O COMENTARIO Cuando ilustran su uso sólo lo aplican para los no metales B, P y As (los que tienen T = 3), pero nunca para Cl, Br, I, N (nosotros ya sabemos que por poseer T=1 estos ácidos son anormales y no existen para estos elementos). ...sigue el texto: “Para las columnas pares”: PREFIJO Meta Piro Orto FORMA QUE INDICA 1 anhídrido + 1 H2O 2 anhídrido + 1 H2O 1 anhídrido + 2 H2O COMENTARIO Cuando ilustran su uso lo aplican para el S, Se y Te, pero solo la definición orto y piro y nunca la del meta (nosotros ya sabemos que como T = 2 el meta no existe para ellos). Para el Silicio que si tiene meta (ya que T=4) no pueden usar las definiciones anteriores ya que no cumple la del piro, para el Silicio hay que definir que: Piro = 2 anhídrido + 3 H2O Vamos a generar los “ácidos ICO de memoria” sin memoria pero con A 2: HTnMOSS y vamos a efectuar el balanceo por tanteo de la reacción de obtención a partir del anhídrido para ver cuales cumplen la definición propuesta acido T V Cumple? Bórico 3 3 3 H3BO3 1B2O3 + 3H2O 2H3BO3 si Carbónico 2 4 3 H2CO3 1CO2 + 1H2O H2CO3 no Silícico 4 4 4 H4SiO4 1SiO2 + 2H2O H4SiO4 si Nítrico 1 5 3 H1NO3 11N2O5 + 1H2O 2 H1NO3 no fosfórico 3 5 4 H3PO4 P2O5 + 3H2O 2H3PO4 si Arsénico 3 5 4 H3AsO4 1As2O5 + 3H2O 2H3AsO4 si Sulfúrico 2 6 4 H2SO4 1SO3 + 1H2O H2SO4 no Selénico 2 6 4 H2SeO4 1SeO3 + 1H2O H2SeO4 no Telúrico 2 6 4 H2TeO4 1TeO3 + 1H2O H2TeO4 no Clórico 1 5 3 H1CℓO3 1Cl2O5 + 1H2O 2 H1CℓO3 no Brómico 1 5 3 H1BrO3 1Br2O5 + 1H2O 2H1BrO3 no yódico 1 5 3 H1IO3 1I2O5 + 1H2O 2H1IO3 no SS % de efectividad = 33.33% Sólo 4 buenos de 12 posibles