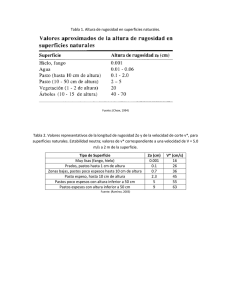
Diapositiva 1
Anuncio

LOS PASTOS EN LA NUTRICIÓN DE RUMIANTES Roque Gonzalo Ramírez Lozano LOS PASTOS EN LA NUTRICIÓN DE LOS RUMIANTES DIRECCIÓN DE PUBLICACIONES UNIVERSIDAD AUTÓNOMA DE NUEVO LEÓN LOS PASTOS EN LA NUTRICIÓN DE LOS RUMIANTES ROQUE GONZALO RAMÍREZ LOZANO DIRECCIÓN DE PUBLICACIONES UNIVERSIDAD AUTÓNOMA DE NUEVO LEÓN José Antonio González-Treviño Rector Jesús Áncer Rodríguez Secretario General Rogelio Villarreal Elizondo Secretario de Extensión y Cultura Juan Manuel Alcocer Director de la Facultad de Ciencias Biológicas Celso José Garza Acuña Dirección de Publicaciones Primera edición, marzo de 2007 © Roque Gonzalo Ramírez Lozano © Universidad Autónoma de Nuevo León ISBN: 970-694-329-3 Impreso en Monterrey, México (Coordinadora Nacional de las Fundaciones PRODUCE, A. C.) Sr. Carlos Baranzini Coronado COAHUILA Ing. Bernabe Iruzubieta Quezada CHIHUAHUA Ing. Pedro Ferreiro Maiz DURANGO C. P. Salvador Rodriguez Berumen NUEVO LEON Ing. Antonio Manuel Garda Garza TAMAU LI PAS Ing. Jaime Sanchez Ruelas M.C. Lorenzo J. Maldonado Aguirre Gerente Regional Secci6n Noreste A mis nietos A los tesistas de las Facultades de Ciencias Biológicas y Medicina Veterinaria y Zootecnia, Universidad Autónoma de Nuevo León, por su valiosa contribución en el desarrollo de las investigaciones que dan soporte científico a esta obra. ÍNDICE Capítulo 1. Importancia y descripción botánica de los pastos 1 Capítulo 2. Proteínas en los pastos 13 Capítulo 3. Glúcidos en los pastos 45 Capítulo 4. La lignina en los pastos 77 Capítulo 5. Digestibilidad en los pastos 93 Capítulo 6. Macrominerales en los pastos 122 Capítulo 7. Microminerales en los pastos 158 Capítulo 8. Consumo de pastos 188 9 PRESENTACIÓN Los pastos (gramíneas) son plantas monocotiledóneas, con hojas envolventes simples y acintadas, tallos huecos (cañas), flores hermafroditas sin cáliz ni corola, inflorescencias en espiga, racimos o panículas de espiguillas y frutos en cariopsis con una semilla de albumen harinoso. Tienen una enorme importancia económica por la calidad y la cantidad de productos que proporcionan al hombre y se distribuyen en todo el país. Se localizan prácticamente en cualquier tipo de vegetación primaria, desde matorrales hasta bosques de pino y encino, pasando por selvas bajas caducifolias y selvas altas perennifolias, y son también los componentes dominantes de los pastizales de origen secundario. Se considera que existen alrededor de 1000 especies mexicanas y alrededor de 200 gramíneas introducidas que están ampliamente distribuidas en México. Aproximadamente 70 especies son estrictamente endémicas de México. Sin embargo, hay cerca de 200 especies endémicas del sur de los Estados Unidos y del norte-centro de México. Como cualquier ser vivo, el grupo de las gramíneas desempeña un papel ecológico importante. Por ejemplo, por su sistema radicular y los tallos subterráneos que las caracterizan, se considera que son excelentes retenedoras y formadoras de suelo. Asimismo, a algunas especies se les reconoce por su alta capacidad colonizadora, pues llegan a establecerse en lugares que presentan poco desarrollo del suelo, escasa cubierta vegetal y/o que han sido recientemente desmontados. En los pastizales, donde generalmente las gramíneas son dominantes, éstas representan el hábitat natural y sustento alimenticio de diferentes herbívoros domésticos y silvestres. Esta obra está integrada por ocho capítulos: en el Capítulo1 se describe la importancia de los pastos como fuente de alimento para los herbívoros como los rumiantes y se describe su morfología y fisiología. En el Capítulo 2 se mencionan las proteínas como un componente importante de los pastos en la nutrición de rumiantes. Además, se incluye información científica relacionada con proteínas en pastos evaluados por los grupos de investigación de nuestro departamento. En el Capítulo 3 se discuten los glúcidos, como la celulosa y hemicelulosa que son los principales componentes de los pastos y que son la fuente más importante de energía y los principales precursores de grasa y azúcar (lactosa) en la leche. Asimismo, se detallan y discuten resultados de investigaciones realizadas en nuestros laboratorios. El Capítulo 4 se informa cómo la lignina en los pastos representa un componente antinutricional por su impacto negativo en la disponibilidad nutricional de la fibra de la planta. Resultados generados por nuestros ejemplifican la LOS PASTOS EN LA NUTRICIÓN DE LOS RUMIANTES 11 PRESENTACIÓN relevancia de la lignina sobre la digestibilidad de los pastos cultivados y nativos. En el Capítulo 5 se mencionan los procesos involucrados en la digestión de los pastos en los rumiantes, especialmente la de la pared celular y de la proteína cruda; además se incluyen datos científicos relacionados con la digestibilidad in situ de los pastos. Los Capítulos 6 y 7, respectivamente tratan sobre macro y microminerales. Se soportan científicamente con la inclusión y discusión de nueve minerales, contenidos en los pastos, y que son los más limitantes para la productividad del ganado. Finalmente, el Capítulo 8 incluye al consumo de pastos como un componente vital en la producción del ganado. 12 FACULTAD DE CIENCIAS BIOLÓGICAS, UANL Roque Gonzalo Ramírez Lozano, Ph.D. Profesor-Investigador Facultad de Ciencias Biológicas, Alimentos Universidad Autónoma de Nuevo León Capítulo 1 Importancia y descripción botánica de los pastos Introducción Familia Graminae (gramíneas) [nombre alternativo: Poaceae (R. Br.) Barnhart, poáceas]. Familia de los cereales, de la grama, del bambú y de la caña de azúcar. Es una familia muy importante que consta de unos 650 a 700 géneros y alrededor de 12,000 especies repartidas por todo el mundo, que viven incluso en las regiones más frías o tórridas; tal ha sido su éxito, que frecuentemente son dominantes en formaciones vegetales importantes como las sabanas, estepas y vegetación acuática. Muchas de ellas son la base de la alimentación animal, ya que dominan en los pastizales; y del hombre, puesto que a esta familia pertenecen los trigos (Triticum sp.), la cebada (Hordeum vulgare L.), el arroz (Oryza sativa L.), el maíz (Zea mays L.), el centeno (Secale cereale L.), las avenas (Avena sp.) y el resto de los cereales, que almacenan en sus frutos gran cantidad de glúcidos (almidón) y en menor proporción grasas y proteínas. De la 13 Figura 1.1. Aristida longiseta Steud. Es una planta perenne de tallos de 30 cm de alto, amacollados, a menudo en grandes macollos; láminas involutas, menos de 1.5 mm de ancho por 2-12 cm de largo, escabrosas hacia arriba, escabrosas hacia abajo, a menudo curveadas y flexuosas; vainas glabras o escaberulosas, pilosa cerca del cuello; lígula menos de 1 mm de largo. Tiene panícula estrecha, erecta pero no firme, poco floreada, ramificaciones ascendentes o apresadas a las inferiores algo curveadas, espiguillas aproximadamente de 2 mm de largo o más; primera gluma de 8-10 mm; segunda gluma del doble de la primera; columna teretada, de 12-15 mm de largo, callo pubescente; aristas aproximadamente iguales, de 6-8 cm de largo, divergentes. Es una planta nativa; se distribuye en llanuras y lomeríos bajos del pastizal mediano abierto, tiene tendencia a aumentar en pastizales sobrepastoreados, las aristas son largas pero blandas y no causan daño al ganado, aunque tiene un valor forrajero pobre. Se distribuye por el sur de EUA y el norte de México Ackerman-Beetle y JohnsonGordon, 1991). LOS PASTOS EN LA NUTRICIÓN DE LOS RUMIANTES CAPÍTULO 1 médula, rica en azúcares, del Saccharum officinarum L. se obtiene el azúcar de caña. Las gramíneas son plantas con flores del grupo de las monocotiledóneas (subclase Liliidae), como Aristida longiseta (Figura 1.1.) que tienen el embrión con una sola hoja desarrollada y que se polinizan típicamente por el viento. Las gramíneas son plantas herbáceas de crecimiento anual o perenne. Se caracterizan por estar estructuradas en cinco partes fundamentales: raíz, tallo, hoja, flor y fruto (Lebgue, 1991) Raíz 14 Las primeras raíces se denominan embrionarias y viven poco tiempo, pues son sustituidas por la raíz permanente, verdadera, la cual carece de nudos y escamas. Posteriormente, se desarrollan las raíces adventicias o secundarias, caracterizadas por un gran número de raíces fibrosas ramificadas y densas, que ofrecen un gran soporte a la planta y le facilitan su nutrición. Estas últimas raíces se caracterizan por presentar nudos y escamas. En general, las raíces pueden llegar a alcanzar hasta unos 30 cm de profundidad, pero se han encontrado algunas a una profundidad mayor. Tallo Existen dos tipos de tallos: aéreos y subterráneos, formados por nudos e internudos. Los nudos siempre son macizos, mientras que los internudos pueden ser huecos o rellenos. La mayoría de los tallos tienen la capacidad de producir una nueva planta, para lo cual utilizan yemas auxiliares. Por ejemplo, las plantas estoloníferas, de tallos decumbentes o rastreros que se ramifican por la superficie del suelo como la Brachiaria decumbens y la Estrella Africana. Existen también plantas con rizomas, tallos subterráneos que se reconocen por la presencia de nudos e internudos en forma irregular, producción de brácteas y presencia de raíces adventicias en los nudos como lo es el pasto Natural, Bermuda y Kikuyo. También hay plantas de crecimiento erecto como el pasto Elefante, Gigante y la Caña de azúcar, las cuales se reproducen por medio de tallos aéreos. Existen gramíneas con tallos duros, leñosos, endurecidos por sílice y lignina como el bambú. Hoja Es lanceolada y nace en los nudos de los tallos, de manera opuesta y una en cada nudo. Está compuesta por las siguientes partes: vaina, lígula, lámina y aurículas. La vaina nace en la parte superior del nudo; es una estructura cilíndrica que abraza el entrenudo. La lígula está formada por láminas membranosas representadas por una corona de pelos, ubicadas en la parte superior interna de la vaina. Las aurículas, estructuras finas de forma triangular, angostas, con el ápice oscuro. La lámina que es la hoja verdadera, con una nervadura central principal y secundarias paralelas, puede ser pubescente o glabra (sin pelos). FACULTAD DE CIENCIAS BIOLÓGICAS, UANL IMPORTANCIA Y DESCRIPCIÓN BOTÁNICA DE LOS PASTOS Flor Las flores, por lo general, son hermafroditas (órganos masculinos y femeninos juntos), reducidas y agrupadas en inflorescencia. Constan de un pistilo con un ovario simple, con dos estigmas en forma de plumas y tres anteras, los cuales están protegidos por la lema y la palea. Todos estos órganos en conjunto forman las florecillas, las que en conjunto con las glumas, constituyen la espiguilla; unidad base de la inflorescencia. Por lo general, existen tres tipos de inflorescencia: panícula, racimo y espiga. La panícula, consta de una espiguilla, más una prolongación ramificada (guineas); el racimo es una inflorescencia sencilla, pedicelada a lo largo de un eje sin ramificar (estrella) y la espiga, su inflorescencia está sentada sobre el eje y tiene espiguillas muy juntas (avena). Fruto El fruto de las gramíneas es el Cariópside, cubierto por la pared del ovario o pericarpio. El embrión esta embebido en el endospermo. Este tipo de fruto o semilla recibe el nombre de cariópside. El cotiledón recibe el nombre de escutelo. Las raíces seminales se encuentran en la región cotiledonar (Lebgue, 1991). Fisiología de las Gramíneas Los pastizales nativos son los más difíciles de todos los ti- pos, debido a su extrema variación. Las especies anuales tienen que tener condiciones específicas de humedad para germinar, crecer y producir semillas, por esta razón las especies anuales no se encuentran cada año. Asimismo, el manejo de las especies anuales tiene que ser de una naturaleza tal que permita la producción de semillas. Las especies perennes son más confiables debido a que ellas tienen la habilidad de entrar en latencia durante las épocas secas y pueden responder inmediatamente cuando la humedad esta disponible. También la latencia durante le invierno de las especies perennes puede ser rota en la primavera con la humedad residual en el suelo (Huss y Aguirre, 1976). Fotosíntesis La fotosíntesis es el proceso de nutrición de las plantas, mediante el cual a través de la energía de la luz transforman el agua que absorben de las raíces y el anhídrido carbónico que adquieren por las hojas, en sustancias orgánicas sencillas. También las cianobacterias y algunas algas realizan la fotosíntesis. En la fotosíntesis se producen compuestos orgánicos a partir del dióxido de carbono utilizando energía lumínica y agua, liberándose oxígeno como subproducto. Existen dos series de procesos, uno que se da en presencia de luz, y que recibe el nombre de fase luminosa, y otro que sucede sin luz, llamado fase oscura (Chapman, 1996). Fase luminosa.- En ella participa la luz solar. La clorofila, que es una sustancia orgánica, capta la energía solar. La luz provoca la ruptura de la molécula de agua, es decir se LOS PASTOS EN LA NUTRICIÓN DE LOS RUMIANTES 15 CAPÍTULO 1 16 rompe el enlace entre el hidrógeno y el oxígeno. En consecuencia, el oxígeno es liberado al medio ambiente. La energía no utilizada se almacena en una molécula especial denominada ATP (forma de almacenamiento de energía). EL hidrógeno sobrante de la ruptura de la molécula de agua también es almacenado en el ATP, para ser utilizado en la segunda etapa de la fotosíntesis, la fase oscura (Hattersley y Watson, 1992). Ecuación: 6CO2+6H2O+energía lumínica!C6H12O6+6O2 Fase oscura.- En la fase oscura, el dióxido de carbono del aire llega hasta los estomas de los cloroplastos, donde se forman las moléculas de la glucosa. Para que se pueda llevar a cabo este proceso se necesita energía, que se obtiene del ATP que se formó en la etapa luminosa. La fotosíntesis y la respiración son procesos básicos complementarios, ya que los reactivos de una son producto de otra (Lawler, 1993). Reacciones independiente de la luz Las reacciones que fijan carbono son también conocidas como reacciones “oscuras” o reacciones “independientes de la luz”. El anhídrido carbónico penetra en los unicelulares y autótrofos acuáticos sin necesidad de estructuras especiales. Las plantas terrestres deben protegerse de la desecación y han desarrollado aberturas especiales denominadas estomas que regulan la entrada y salida del gas por las hojas. El anhídrido carbónico de la atmósfera (o del agua en los organismos acuáticos) es capturado y modificado por la adición de hidrógeno para formar carbohidratos. (la fórmu- la general de los carbohidratos es [CH2O]n ). La transformación del anhídrido carbónico en un compuesto orgánico se conoce como fijación del carbono. La energía para ello proviene de la primera fase de la fotosíntesis. Los sistemas vivientes no pueden utilizar directamente la energía de la luz, pero pueden a través de una complicada serie de reacciones, convertirla en enlaces C-C y, esta energía puede ser luego liberada por la glucólisis y otros procesos metabólicos. A fines de la segunda guerra mundial, en los laboratorios de Berkeley (California), Melvin Calvin y sus colaboradores, usando Carbono-14 (del cual disponía en abundancia) y las, entonces nuevas, técnicas de intercambio iónico, cromatografía en papel y radioautografía mapearon completamente el ciclo del Carbono en la fotosíntesis, por estos trabajos resultó laureado con el premio Nobel en 1961, y el ciclo del carbono se conoce comúnmente como ciclo de Calvin, o de Calvin-Benson (Hattersley y Watson, 1992). El Ciclo de Calvin (o de los tres carbonos) se desarrolla en estroma de los cloroplastos. El anhídrido carbónico es fijado en la molécula ribulosa 1,5 bifosfato (RuBP). La RuBP tiene 5 carbonos en su molécula. Seis moléculas de anhídrido carbónico entran en el Ciclo de Calvin y, eventualmente, producen una molécula de glucosa. El primer producto estable del ciclo es el ácido 3fosfoglicérico (PGA), molécula de tres carbonos. Globalmente 6 moléculas de ribulosa bifosfato (RuBP) se combinan con 6 de anhídrido carbónico y dan 12 de 3fosfoglicérico. La enzima que cataliza esta reacción es la RuBP carboxilasa, posiblemente la proteína mas abundante FACULTAD DE CIENCIAS BIOLÓGICAS, UANL IMPORTANCIA Y DESCRIPCIÓN BOTÁNICA DE LOS PASTOS del mundo y se encuentra en la superficie de las membranas tilacoideas. La energía del ATP y el NADPH generados por los fotosistemas se usan para unir fosfatos (fosforilar) al 3PGA y reducirlo a fosfogliceraldehido (PGAL), también de tres carbonos. Del total de 12 moléculas transformadas, dos moléculas de 3-PGAL salen del ciclo para convertirse en glucosa. Las moléculas restantes de PGAL son convertidas por medio del ATP en 6 moléculas de RuBP (5 carbonos), que recomienzan el ciclo. La complejidad de los seres vivos, al igual que en el ciclo de Krebs cada reacción es catalizada por una enzima específica (Hattersley y Watson, 1992). desde el cual su energía puede transferirse al oxígeno dando como resultado “oxígeno singulet”, un potente oxidante, que puede causar daño indiscriminado a la planta e inclusive su muerte. Entre los mecanismos antioxidantes para protección de las plantas se encuentran: 1. Los carotenoides que son capaces de detoxificar a la planta del “oxígeno singulet” capturando su energía y disipándola en forma de calor. 2. Atenuación no fotoquímica de la energía solar, proceso en el cual interviene una proteína que se encuentra asociada al fotosistema II conocida por las siglas PsbS. El ciclo del carbono Fotorespiración La RuBP carboxilasa tiene una desventaja: tiene tanta facilidad para combinarse con el CO2 para activar la formación de azúcar como de combinarse con el O y dar glicolato—> y luego glicina, que termina —> serina + CO 2 en la mitocondria. Este proceso llamado Fotorespiración usa ATP y NADPH pero libera CO2 en lugar de fijarlo. Protección de las plantas contra el sol El proceso fotosintético es más eficiente con niveles promedio de luz solar. A pleno sol, especialmente a mediodía, las plantas absorben mucha más energía de la que pueden usar. Si no encuentra una forma de dispersar la energía de una manera segura la clorofila pasa a un estado hiperexitado, Las plantas incorporan el anhídrido carbónico de la atmósfera y de los océanos al transformarlo en compuestos orgánicos, convirtiendo la energía de la luz en enlaces C-C. Las Plantas también producen anhídrido carbónico por su respiración. Los animales producen anhídrido carbónico derivado de la utilización de los glúcidos y otros productos producidos por las plantas. En el balance entre el consumo de anhídrido carbónico que realizan las plantas y la producción del mismo por los animales intervine como “buffer” la formación de carbonatos en los océanos, que remueve el exceso de anhídrido carbónico del aire y del agua (ambos intervienen en el equilibrio del anhídrido carbónico). Los combustibles fósiles, como el petróleo y el carbón, como así también la madera generan anhídrido carbónico al ser utilizados. La actividad humana incrementa en grandes pro- LOS PASTOS EN LA NUTRICIÓN DE LOS RUMIANTES 17 CAPÍTULO 1 porciones la concentración de anhídrido carbónico en el aire. Dado que este, a diferencia de otros compuestos de la atmósfera absorbe el calor reflejado desde la Tierra, incrementa la temperatura global y produce lo que ha dado llamarse “efecto invernadero” (Lawler, 1993). Plantas tipo C3 y C4 18 La energía que posibilita la vida de la gran mayoría de los seres vivos en la tierra procede directa o indirectamente del sol, a través del proceso fotosintético; en líneas generales, este consiste en la reducción del CO2 atmosférico por medio del H+ del agua obtenido con la energía proveniente de las radiaciones electromagnéticas del sol, así la planta almacena la energía potencial química en los compuestos orgánicos. Los compuestos carbonados ricos en energía obtenidos así, son usados después como fuente energética por la propia planta y por otros organismos, que son incapaces de fabricar sus propios alimentos, pero si pueden aprovechar la materia vegetal. Debemos recordar que los azucares simples son los productos de la fotosíntesis. Sin embargo, en la mayoría de las plantas verdes (especialmente dicotiledóneas) se presentan inmediatas transformaciones posteriores en el estroma del cloroplasto, que los convierten en almidón, evitando su exportación al citoplasma como aldehído fosfoglicérico. No obstante, entre las monocotiledóneas hay especies como la cebolla (Allium cepa) maíz (Zea mays) caña de azular (Saccarum officinarum) y liliáceas en las que se puede encontrar glucosa almacenada (Struik et al., 1985). La actividad fotosintética se evalúa por el CO2 incorporado en una superficie durante un tiempo determinado y es corrientemente expresada en mg cm2 min-1 así como en g m2 min-1 o por día. La carboxilación primaria es catalizada por una de estas enzimas: ribulosadifosfato carboxilasa (o carbosidismutasa) y fosfoenolpiruvato carboxilasa, cuyas concentraciones y secuencia de acción varían segur las especies. Se determina así el sistema de fijación de CO2; vía ciclo Calvin, o C3 con la primera, y vía de Hatch-Slack, el del ciclo de los ácidos dicarboxílicos de 4 carbonos -C4 con la segunda; otra que mezcla ambas y se conoce como metabolismo de ácidos de las crasuláceas (MAC), con fijación en la oscuridad. Además de los sistemas de fijación de CO2, hay adaptaciones estructurales de las hojas que se reflejan en una diferente disposición de los elementos constituyentes según la disponibilidad de agua del medio: hidrófilos, mesófilos o xerófilos, o según el sistema de fijación de CO2 empalizada o Krantz (Struik et al., 1985). La vía de fijación del CO2, denominada C3 es la descrita por Calvin, la cual fue considerada inicialmente común a todas las plantas. En síntesis el CO2 se une a un compuesto de 5 carbonos que de inmediato se fragmenta en dos ácidos orgánicos de 3 carbonos. Mas tarde se descubrió la vía del C4 en que hay un proceso inicial donde el CO2, se une a un PEP dando un ácido de 4 carbonos en un determinado tipo de células (mesófilo), luego es transportado a las células mas internas (vainas del haz) en donde se desdobla, liberando el CO2 para la RU-DP del ciclo de Calvin para la realización del ciclo C3 (Lawler, 1993). FACULTAD DE CIENCIAS BIOLÓGICAS, UANL IMPORTANCIA Y DESCRIPCIÓN BOTÁNICA DE LOS PASTOS Este proceso presenta ventajas, entre ellas una mayor eficacia en la producción de materia seca en condiciones de mayor temperatura e iluminación y menor disponibilidad de agua. El ciclo C4 tiene particular interés desde el punto de vista de la productividad por su alta capacidad de asimilación y por estar relacionado con especies de alto rendimiento, generalmente tropicales o subtropicales, mono y dicotiledóneas, como el maíz (Zea mays), la caña de azúcar (Saccharum officinarum), los sorgos y especies correspondientes a los géneros Pennisetum, Amaranthus y Atriplex (Struik et al., 1985). El proceso fotosintético, como cualquier otro proceso fisiológico, es afectado por las condiciones del medio ambiente en el cual ocurre. La fase bioquímica debe desarrollarse dentro del margen determinado por la actividad de las enzimas que participan y la fase fisicoquímica esta directamente relacionado con la anterior. Algunos factores ambientales como intensidad y calidad de luz, cantidad de CO2 presente y temperatura, tienen importancia fundamental en la intensidad del proceso. Con respecto al nivel de CO2 y a la iluminación del medio que rodea a la planta, existe una determinada cantidad de especies en que la intensidad de la fotosíntesis iguala a la de la respiración. De este modo, en el exterior, no se detectan cambios en los gases que intervienen, tampoco hay ganancia de peso seco. A esta condición particular de las plantas, que depende en cierto grado del medio ambiente, ya que puede modificarse durante la ontogenia, se denomina “punto de compensación de CO2” o “de luz”, respectivamente. El valor para el CO2 es de 0 a 100 ppm y depende e la vía de fijación de CO2 usada (para C4 menor que para C3) y del medio en que se formó (en plantas heliófilas mayor que en umbrófilas) (Casler et al., 1987) . Las plantas tipo C4 posee pocas células mesofílicas entre las haces vasculares, comparado con 10 a 15 células mesofílicas en las plantas C3. Las células mesofílicas no están lignificadas en las especies templadas y por lo tanto su proporción tiene efecto marcado en la digestibilidad. Las principales diferencias entre las plantas C3 y C4 se listan en la Tabla 1. La generalización de que todas las plantas C4 poseen valor nutritivo menor que las plantas C3 no es totalmente cierto. Hay pocos ejemplos, pero al mismo tiempo muy importantes. Maíz y sorgo son plantas C4 de origen ancestral tropical que han sufrido manipulaciones y alteraciones genéticas. La gran mayoría de las gramíneas tropicales domesticadas son tipo C4, y C3 las de clima templado. Las leguminosas, (templadas y tropicales) son tipo C3. Las gramíneas como grupo, poseen un contenido relativamente alto de pared celular y bajo en lignina, llevando esto, a un consumo menor con relación a su digestibilidad. Las gramíneas también poseen compuestos secundarios (ciánidos, alcaloides endofíticos y endofíticos). Variedades o cultivares mejoradas de gramíneas pueden llegar a ser mas susceptibles a enfermedades, menos adaptados y de menor producción. Tal es el caso del mutante de maíz (Zea mays) de nervadura marrón (brown midrib) y de la festuca (Festuca arundinacea) libre de alcaloides (Casler et al., 1987). La introducción del gen responsable de la sustancia colorante soluble, localizada en la nervadura central de las hojas LOS PASTOS EN LA NUTRICIÓN DE LOS RUMIANTES 19 CAPÍTULO 1 pedregosidad, de inundaciones temporarias, de su pendiente, de su corto período de crecimiento, del tipo de distribución de lluvias o de 3ODQWDVFUDVDV &DUDFWHUtVWLFDV 3ODQWDV& 3ODQWDV& &$0 las temperaturas. La mayoría de es7HPSODGDVDUUR] 7URSLFDOHV 'HVpUWLFDV\FiOLGDV FHEDGDDYHQD VXEWURSLFDOHV\ FUDVXOiFHDV *UXSRGHSODQWDVUHSUHVHQWDWLYDV tas pasturas son pastoreadas direcUHPRODFKDWDEDFR GHVpUWLFDVPDt] FDFWiFHDV OHJXPLQRVDV VRUJRFDxDGHD]~FDU HXIRUELiFHDV tamente por el ganado, pero alguDYHFHVPiVTXHOD YHFHVPiVGpELOTXH 9HORFLGDGUHODWLYDGHUHVSLUDFLyQ 'LItFLOGHGHWHFWDU UHVSLUDFLyQRVFXUD ODUHVSLUDFLyQRVFXUD nas son utilizadas para heno el cual $EHUWXUDGHHVWRPDVDODOX] *UDQGH 3HTXHxD 3HTXHxDRQXOD )XHUWH 0X\GpELO )XHUWH ,QKLELFLyQSRU2 es obtenido en lugares muy diver3ULPHUSURGXFWRGHILMDFLyQ )RVIRJOLFHUDWR 2[DODFHWDWR 2[DODFHWDWR sos como las praderas, aperturas en 6DWXUDFLyQGHOX]ZP ! ,QIHULRUD& las laderas, bosques subtropicales 7HPSHUDWXUDySWLPD& )RWRVtQWHVLVPi[LPDPJ&2 GP K cerrados para su regeneración, pra 3XQWRGHFRPSHQVDFLyQGH&2 SSP deras alpinas, estepas, o muchos 9HORFLGDGPi[LPDGHFUHFLPLHQWRJ06GP G 3URGXFFLyQGH06WRQKD 3RFDLQIRUPDFLyQ otros tipos de tierra sin cultivar. 7DVDGHUHVSLUDFLyQ $OWD %DMD El heno natural está compuesto básicamente por gramíneas y espeAdaptado de: Van Soest, 1994 y Salisbury, y Ross, 1994 cies herbáceas pero en algunos casos los arbustos también son cortadel maíz, es responsable de un incremento significativo en dos y secados. Los campos de heno pueden ser privados o la mejora del valor nutritivo de los maíces europeos, llegánde propiedad comunitaria, esta última con derechos de los dose a encontrar diferencias de hasta 12 unidades digestibles ganaderos establecidos en el tiempo. Los distintos sistemas entre maíces americanos y europeos. tradicionales de producción de heno se describen en los estudios de caso; incluyen vastas áreas de tierras en bosques cerrados para su regeneración o protección como en la InPastizales naturales dia, donde está prohibido el pastoreo pero se permite el corte del forraje o en aperturas en laderas pronunciadas en las Las pasturas naturales se presentan bajo diversas formas, montañas del sub-Himalaya, las praderas en Turquía, las todas las cuales tienen en común el hecho de que el forraje estepas de Mongolia donde la producción cooperativa de no ha sido sembrado. Por lo general se encuentran en tierras ganado ha sido recientemente sustituida por un sistema priinapropiadas para cultivos arables ya sea a causa de su Tabla 1.1 Principales características diferenciales entre plantas C3, C4 y crasas (CAM) 20 FACULTAD DE CIENCIAS BIOLÓGICAS, UANL IMPORTANCIA Y DESCRIPCIÓN BOTÁNICA DE LOS PASTOS vado, en el Sahel o en el altiplano de Etiopía. Utilización y conservación de los pastos Tabla 1. 2. Rendimiento utilizado de los pastos según su uso 3pUGLGDUHQGLPLHQWRXWLOL]DEOH 3DVWRUHR 3pUGLGDVGXUDQWHODFRVHFKD )RUUDMH YHUGH SLFDGR +HQR (QVLODGR $OPDFHQDMH VHOODGR 3pUGLGDVGXUDQWHDOPDFHQDPLHQWR Al elegir un pasto forrajero verde, es 3pUGLGDVGXUDQWHWUDQVSRUWH conveniente examinar sus posibles 3pUGLGDWRWDOGHPDWHULDVHFD usos y el rendimiento final que pro)RUUDMHHIHFWLYDPHQWHRIUHFLGRDODQLPDO porcionará al ganado. En la Tabla 1.2. 5HQGLPLHQWRPi[LPRHIHFWLYRGHPDWHULDVHFD 5HQGLPLHQWRFRPRSRWHQFLDOGHPDWHULDVHFD se muestran las pérdidas asociadas con los diversos usos de los pastos. Existen varios grados de inter- Tomado de: Skerman y Riveros (1992). ferencia humana o mejoramiento que han sido usualmente aplicados a las praderas naturales reemplazadas por tierras arables mientras que, en algunos y más especialmente a las áreas cortadas para heno. El fuepaíses, tierras agrícolas marginales han sido revertidas a prago es una poderosa herramienta para el manejo de las praderas naturales ya que la productividad de los cultivos dederas naturales, sobre todo para el control de especies leñoclinaba. Los rastrojos autosembrados y pastoreados son sas y para la remoción del forraje envejecido. La introducción importantes en algunos sistemas. de animales, domesticados o salvajes tiene un gran efecto sobre la vegetación. La manipulación o presión de pastoreo Pastoreo y su control llevan a cambios en la composición botánica sin la introducción deliberada de especies. La limpieza de El pastoreo representa la forma más común de su uso de los los matorrales, los cercos, el drenaje, la aplicación de fertipastos forrajeros. Las plantas son seleccionadas por su abunlizantes y de elementos traza son intervenciones intensivas dancia, por soportar varias defoliaciones durante el pastoque modifican la vegetación natural de los campos de pasreo, resistencia al pisoteo y respuesta al uso de fertilizantes, toreo. La introducción de gramíneas y leguminosas sin maasí como su palatabilidad, accesibilidad y calidad nutritiva. yor cultivo constituye de cualquier manera otra etapa de las Sin embargo, se presentan varios problemas como pérdida modificaciones. Muchas buenas praderas naturales han sido de material por pisoteo, contaminación fecal, pastoreo se- LOS PASTOS EN LA NUTRICIÓN DE LOS RUMIANTES 21 CAPÍTULO 1 22 lectivo y la madurez temprana con relación al número de animales que la pastan, con lo que aumenta la proporción de tallos y se hace menos digestivos los pastos. En explotaciones intensivas y semintensivas, se requieren controles así como la subdivisión mediante cercas permanentes y temporales que pueden estar electrificadas. El pastoreo requiere menos mano de obra y se realiza en menos tiempo que otros métodos de alimentación. El animal elige su dieta tanto en calidad como en cantidad y los nutrientes se reintegran al suelo a través de las deposiciones. Para producir heno de buena calidad es imprescindible que los pastos se sequen rápidamente y no se expongan en demasía al sol. La recolección del heno con rastrillos puede provocar disminución de la calidad del heno por la pérdida de hojas. La lluvia puede provocar también pérdida de hojas y lixiviación de nutrientes. En condiciones normales, la henificación provoca una pérdida de hasta un 25 % de los nutrientes del pasto (Tabla 1). Un pasto de clima templado Cynodon dactylon para ser henificado en forma segura deberá reducirse su humedad hasta contener un 22 %. Heno Biotecnología de los pastos forrajeros La forma más común de almacenar los pastos es el heno. Se usa para nivelar el suministro de alimentos durante todo el año. Por lo general, es la forma más conveniente de almacenamiento. El objetivo es conservar la mayor cantidad posible de materia seca y de nutrientes al más bajo costo. El heno debe prepararse en el momento óptimo para obtener los rendimientos máximos y tener el porcentaje de materia seca digestible requerido para satisfacer las necesidades nutritivas del ganado. Lo ideal es cuando se corta al inicio de la etapa de floración. Si se corta antes, el valor nutritivo es mayor, pero el rendimiento disminuye y el contenido de humedad es demasiado alto, lo que dificulta el curado. Si se corta después de la floración, los aumentos en rendimiento no compensan el descenso en palatabilidad y valor nutritivo. El primer corte del heno de un pasto suele ser el de mejor calidad que los siguientes (Skerman y Riveros, 1992). La amplia distribución y desarrollo de los pastos en todo el mundo se debe, en gran medida, a la morfología de sus semillas que favorece su dispersión, a su elevada capacidad reproductiva y a su alta tolerancia a diferentes tipos de restricciones ambientales; por ejemplo, muchas de las plantas más tolerantes a la sequía se encuentran en la familia Poaceae. Casi todos los pastos de clima templado tienen un número cromosómico básico de siete (común en cereales como trigo, cebada, avena y centeno) mientras que en pastos tropicales el genoma haploide es de 8, 9 o 10 cromosomas (Aguado-Santacruz et al., 2004). La biotecnología implica un grupo de procedimientos y herramientas científicas y tecnológicas usadas para desarrollar con eficiencia y rapidez una amplia variedad de procedimientos y productos, mediante la manipulación de los seres vivos o partes de ellos. Reúne un conjunto de procesos de biología molecular y ce- FACULTAD DE CIENCIAS BIOLÓGICAS, UANL IMPORTANCIA Y DESCRIPCIÓN BOTÁNICA DE LOS PASTOS lular, genética, bioquímica y microbiología que permiten la manipulación de organismos para incrementar la productividad, mejorar características específicas de los seres vivos, producir nuevas variedades de organismos, disminuir riesgos en la producción y desarrollar nuevos productos, o bioprocesos para la obtención de estos, empleando sistemas biológicos. La biotecnología de los pastos incluye la micropropagación de plantas (plantas libres de patógenos o multiplicación masiva de genotipos particulares), la transformación genética, hibridación somática, empleo de biofertilizantes. Hasta el momento se han desarrollado sistemas de regeneración para alrededor de 70 pastos forrajeros y de césped, así como ornamentales y biocombustible. La generación de plantas genéticamente modificadas ha dado como resultado lo siguiente: 1. 2. 3. 4. 5. 6. 7. Mayor tolerancia a diferentes tipos de estrés ambiental Frutos con menores propiedades alergénicas, mayor resistencia al frío y mejor valor nutricional Flores con colores modificados Plantas bioremediadoras Árboles con mejor solubilización y fragmentación de la lignina Plantas de fibras coloreadas Plantas como bio-reactores para la generación de proteínas, glúcidos y aceites específicos (AguadoSantacruz, et al., 2004). Referencias Ackerman-Beetle, A. y Johnson-Gordon, D. 1991. Gramíneas de Sonora. SAGRH COTECOCA. Gobierno del Edo de Sonora, Hermosillo, Son. Aguado-Santacruz, G.A., Rascón-Cruz, G. Pons-Herández, J.L., GrajedaCabrera, O. y García-Moya, E. 2004. Manejo biotecnológico de gramíneas forrajeras. Técnica Pecuaria en México. 42: 261-276. Casler, M. D.; Talbert, H,; Forney, A.K.; Ehlke, N.J. and Reich, J.M. 1987 Genetic variation for rate of cell wall digestibility and related traits in first cut smooth bromegrass. Crop. Sci. 27.935-939. Chapman, G.P. 1996. The biology of Grasses. CAB International. pp 126140. Hattersley, P.W. y Watson, L. 1992. Diversification of phostosynthesis. pp. 58-116. In: Chapman, G.P. editor. Grass Evolution and Domestication. Cambridge University Press. p. 390. Huss, D. L. y E. L. Aguirre, 1976. Fundamentos de Manejo de Pastizales. Instituto Tecnológico y de Estudios Superiores de Monterrey. pp. 2145. Lawler, D.W. 1993. Photosynthesis: Molecular, Physiological and Environmental Processes, 2a edición. Logman. p. 318. Lebgue, T. A. Valerio. 1991. Gramíneas de Chihuahua. Manual de Identificación. Colección Textos Universitarios, Universidad Autónoma de Chihuahua, México. pp. 15-40. Nelson CJ, Moser LE . Plant factors affecting forage quality. En: Forage Quality, Evaluation and Utilization. National. Fahey C G Jr (Ed.) Conference on Forage Quality. Univ. of Nebraska. Lincoln Nebraska, EUA. p 123. Parson, A. J. and Penning, P. D. 1988. The effect of the duration of regrowth on photosynthesis, leaf death and the average rate of growth in a rotationally grazed sward. Grass Forage Sci. 43:15-27. Salisbury, F. B. y Ross C. W. 1994. Fisiología vegetal. Editorial Grupo Editorial Iberoamericana 759p. Skerman, P.J. y Riveros, F. 1992. Gramíneas Tropicales. Colección FAO: Producción y Protección Vegetal. No. 23. pp. 257-261 Struik,P. C.; Deinum, B. D. and Hoefsloot, J. M. P. 1985. Effects of temperature durig diffferent stages of development on growth and digestibility of forage maize (Zea mays L) Neth. J. Agric. Sci. 33:405420. Van Soest, P. J. 1994. Nutritional ecology of the ruminant. Cornell University Press. 2nd ed. 476 pp. LOS PASTOS EN LA NUTRICIÓN DE LOS RUMIANTES 23 24 Capítulo 2 Proteínas en pastos Introducción Las proteínas son compuestos orgánicos complejos de alto peso molecular. Al igual que los glúcidos y los lípidos contiene carbón, hidrógeno y oxígeno, además de que todos contienen nitrógeno generalmente contienen azufre. Las proteínas se encuentran en todas las células vivas, donde están conectadas a todas las fases de la actividad que constituye la vida de las células. Cada especie tiene sus propias proteínas, y un simple organismo contiene diferentes proteínas en sus propias células y tejidos. Por tanto, un gran número de proteínas ocurren en la naturaleza (McDonald et al., 1995). Las proteínas provean los aminoácidos requeridos para el mantenimiento de las funciones vitales como reproducción, crecimiento y lactancia. Los animales no rumiantes necesitan aminoácidos preformados en su dieta, pero los rumiantes pueden utilizar otras fuentes de nitrógeno porque tienen la habilidad especial de sintetizar aminoácidos y de formar proteína a partir del nitrógeno no proteico. Esta habilidad depende de los microorganismos en el rumen. Además, los rumiantes posean un mecanismo para ahorrar nitrógeno. Cuando el contenido de nitrógeno en la dieta es bajo, urea, un producto final del metabolismo de proteína en el cuerpo puede ser reciclado al rumen en grandes cantidades. Nitrógeno atmosférico Después del H y el O, el N es el cuarto elemento más abundante en la biosfera. Puesto que el N es un importante componente de los aminoácidos y las proteínas, es uno de los elementos nutritivos más importantes de las plantas y los animales en consecuencia, el intercambio del N comprende la transferencia de este elemento importante. El ciclo del N comprende la transferencia de este elemento entre la biosfera, la litosfera, la atmósfera y la hidrosfera en varias formas LOS PASTOS EN LA NUTRICIÓN DE LOS RUMIANTES 25 CAPÍTULO 2 26 químicas. Dentro de la atmósfera, el N existe en formas de moléculas diatómicas. Esta forma de N se encuentra en la atmósfera en combinación con el O en forma de óxidos nitrogenados dentro de la litosfera, el N existe principalmente como ion nitrato, NO3 y en menor grado, en forma de los nitritos, NO2, y como ion amonio, NH3 en la hidrosfera, el N casi siempre existe como N diatómico disuelto, N2 y como ion nitrato disuelto, NO3 la biosfera contiene N combinado en las proteínas de plantas y animales las proteínas son moléculas complejas de los organismos vivos que contienen C, H, O y N junto con pequeñas cantidades de S y otros elementos como se puede observar, el ciclo general incluye, un ciclo externo comprende la atmósfera, la litosfera, o la hidrosfera unidos por la biosfera, la litosfera y la hidrosfera al ciclo externo del N incluye la conversión del N atmosférico en ion nitrato y ion amonio la conversión de N molecular a estas formas iónicas se conoce con el nombre de fijación del N. Una forma de la fijación del N consiste en el proceso en el que N molecular se convierte en compuestos de N, O (óxidos nitrogenados) debido a la alta energía de los relámpagos en la atmósfera. Solo una pequeña cantidad de N se fija en esa forma este N fijado se transporta a la superficie terrestre por medio de la lluvia y penetra en la porción del nitrato del ciclo otro modo más importante de fijación es aquel en que los microorganismos (que a menudo están estrechamente relacionados con ciertas plantas) convierten el N molecular en formas (ion amonio, ion nitrito y ion nitrato) en las que se hace disponible al ciclo interno del nitrógeno. Este proceso de fijación se denomina fija- ción biológica y los microorganismos que participan en el se conocen como bacterias fijadoras de nitrógeno (Villavicencio, 1995). Dentro del ciclo interno, el ion nitrato sirve como fuente de N para la mayor parte de la vida vegetal acuática y terrestre. Las plantas incorporan el N a las proteínas vegetales. Los animales consumen muchas de las plantas, éstos convierten las proteínas vegetales en proteínas animales. Hay animales menores que pasan el N hasta animales, superiores siguiendo a lo largo de la cadena alimenticia. El ciclo interno se completa con la muerte y la desintegración de las plantas o los animales cuando estos sistemas mueren o emiten desechos (por ejemplos, el excremento animal), la descomposición de las proteínas produce ion amonio. Ciertos microorganismos del suelo y la hidrosfera utilizan el ión amonio y lo convierten finalmente en forma de ion nitrato depositado en el suelo o disuelto en el agua. El ion nitrato se intercambia entre el suelo y la hidrosfera mediante el proceso por el que el ion nitrato disuelto se transporta gracias a las aguas subterráneas. Otros microorganismos del suelo y la hidrosfera emplean el ion nitrato en un proceso que se denomina desnitrificación. La desnitrificación es un proceso biológico en el que ciertas bacterias convierten el ion N en nitrógeno molecular, N2. El N molecular que producen las bacterias desnitrificantes se convierte en nitrógeno disuelto o atmosférico. La entrada del nitrógeno molecular a la atmósfera, completa el ciclo de este elemento (Villavicencio, 1995). Como se mencionó con anterioridad, el N en forma de ion nitrato sirve como elemento nutritivo esencial para el FACULTAD DE CIENCIAS BIOLÓGICAS, UANL PROTEÍNAS EN PASTOS crecimiento de las plantas. Por supuesto las plantas constituyen el alimento fundamental del hombre. Para producir el suficiente alimento vegetal, utilizando los métodos modernos de agricultura, el hombre ha encontrado que es necesario alterar el ciclo del N, fijando una mayor cantidad de este elemento que la base se obtendría sin su intervención. El hombre ha propiciado una mayor fijación biológica mediante el cultivo intencional de cosechas que están relacionadas con las bacterias que fijan el N. Los cultivos más comunes de este tipo son las leguminosas, como la alfalfa. El cultivo de estas cosechas proporciona el N ya fijado para otras plantas. Además del incremento intencional de la fijación biológica, el hombre ha desarrollado métodos químicos que permiten la fijación del N. Este N químicamente fijado se incorpora a los fertilizantes con contenido de N que se utilizan mucho en la agricultura. El método que se utiliza para fijar químicamente el N se denomina proceso de haber y se logra haciendo reaccionar H gaseoso y N para producir amoniaco. Este proceso se puede representar mediante la ecuación química (Cunningham,1995): N2-3H2———2NH3 (amoniaco) Biosíntesis: organismos fijadores del N La fijación del N molecular mayor importancia en la biosfera puede ser llevado a cabo solamente por un limitado número de organismos. La mayoría leguminosas pueden fijar al N2 atmosférico, lo mismo que unas 250 o más especies de plan- tas no leguminosas. La fijación de N por las leguminosas requiere la cooperación de la planta huésped con la de bacterias presentes en sus módulos radicícolas; se le denomina fijación simbiótica del N. Plantas representativas fijadoras de N son los guisantes, las judías, el clavo, la alfalfa y la soya, entre las legumbres y el aliso, el arraclán marino y el mirto céreo entre las no leguminosas (Cunningham,1995). Metabolismo del N absorbido Pocos animales comen en forma constante, lo que quiere decir que el flujo de los nutrientes en el organismo es esporádico, no uniforme. La maquinaria metabólica debe estar preparada para manejar incrementos severos de los nutrientes, ser capaz de almacenarlos temporalmente para ponerlos en circulación durante las etapas de escasez. La absorción y metabolismo del N no es la excepción. Para este proceso, el hígado es el órgano clave pues sintetiza las proteínas, provee a la circulación de los aminoácidos cuando se necesitan y procesa el N para su excreción cuando existe en exceso. Su funcionamiento apropiado no solo depende de su capacidad de absorber y retener aminoácidos, sino de su capacidad de proveer una adecuada y cuidadosa liberación de ellos a todo el sistema. Nutrientes que contienen nitrógeno El N se encuentra en proteínas y otros compuestos, incluidos en la materia orgánica de un alimento. Las proteínas LOS PASTOS EN LA NUTRICIÓN DE LOS RUMIANTES 27 CAPÍTULO 2 28 están compuestas de una o más cadenas de aminoácidos. Hay 20 aminoácidos que se encuentran en proteínas. El código genético determina la estructura de cada proteína, que en su turno establece una función específica en el cuerpo. Algunos aminoácidos son esenciales y otros no esenciales. Los aminoácidos no esenciales pueden ser sintetizados en el cuerpo, pero los aminoácidos esenciales deben estar presentes en la dietas porque el cuerpo no los puede sintetizar. Parte del N en los alimentos se llama nitrógeno no proteico (NNP) porque el N no se encuentra como parte de la estructura de una proteína. Nitrógeno no proteico (por ejemplo amoniaco, urea, aminas, ácidos nucleicos, etc.) no tienen valor nutritivo para los animales de estomago sencillo. Sin embargo en los rumiantes, NNP puede ser utilizado por las bacterias del rumen para sintetizar aminoácidos y proteínas que benefician al animal. Un químico danés, J.G. Kjeldahl, desarrolló un método en 1883 para determinar la cantidad de nitrógeno en un compuesto. En promedio en proteínas el contenido de nitrógeno es 16%. Así, el porcentaje de proteína en un alimento es típicamente calculado como el porcentaje de nitrógeno multiplicado por 6.25 (100/16 = 6.25). Esta medida se llama la proteína cruda. La palabra cruda refiere a que no todo el nitrógeno en el alimento esta en forma de proteína. Usualmente la cifra para proteína cruda da un sobreestimado del porcentaje verdadero de proteína en un alimento. La proteína cruda en forrajes se encuentra de 5% (residuos de cosechas) hasta más de 20% (leguminosas de buena calidad). Subproductos de origen animal son usualmente muy ricos en proteína (más de 60% de proteína cruda). En seguida se describe la técnica de micro Kjeldahl que es bastante sensitiva y proporciona una buena estimación del contenido de N: Macro Kjeldahl El nitrógeno de las proteínas y otros compuestos se transforman a sulfato de amonio por medio de la digestión con ácido sulfúrico en ebullición. El residuo se enfría, se diluye con agua y se le agrega hidróxido de sodio. El amonio presente se desprende y a la vez se destila y se recibe en una solución de ácido bórico que luego es titulado con una solución de ácido estandarizado en presencia de un indicador apropiado. Material y equipo: 1.- Aparato de digestión y destilación macro-Kjeldahl 2.- Matraz balón de Kjeldahl de 800 ml. 3.- Matraces Erlenmeyer de 500 ml. 4.- Bureta automática Reactivos: 1. Solución indicadora: 0.1% rojo de metilo y 0.2% de bromocresol en alcohol etílico de 95%. 2. Ácido sulfúrico concentrado, 93-98% grado reactivo. 3. Solución de NaOH al 40%.- Disuelva 400 g de hidróxido de sodio por litro de solución. Se deben mezclar cantidades pequeñas de agua e hidróxido de sodio en forma FACULTAD DE CIENCIAS BIOLÓGICAS, UANL PROTEÍNAS EN PASTOS alterna y la solución se va mezclando con una varilla de vidrio hasta que el hidróxido de sodio quede completamente disuelto. Déjese la solución en reposo durante toda la noche para que se enfríe y luego viértala a una botella de polietileno. 4. Solución de H3BO3 al 4%. Disuelva 40 g de ácido bórico en suficiente agua para preparar 1 litro de solución. 5. NaSO4 ó K2SO4; tienen por objeto aumentar el punto de ebullición del H2SO4. 6. Mezcla catalizadora. Mezcle 7% de sulfato de cobre con sulfato de potasio (también se consigue la mezcla ya preparada). Puede usarse también como catalizador ciertos metales como el Selenio. 7. Zinc en gránulos. 8. Solución estándar de HCl 0.1 N. Mezcle 8.33 ml. de HCl concentrado. Con 200 ml de agua destilada, transfiera cuantitativamente esta solución a un matraz de aforación de 1 litro y afore con agua destilada. 9. Solución estándar de NaCO3 0.1N. Pese exactamente 0.53 g de NaCO3 y disuelva en agua destilada, transfiera cuantitativamente esta solución a un matraz de aforación de 100 ml y afore con agua destilada. La solución obtenida de esta manera, será exactamente 0.1 N. 10. Indicador rojo de metilo 0.1%. Pese 0.1 g de rojo de metilo y disuelva el 100 ml de alcohol etílico. Estandarización de la solución de HCl: En un matraz Erlenmeyer de 100 ml. tome una alicuota de 25 ml de la solución de NaCO3 0.1 N, agregue 3 ó 4 gotas del indicador rojo de metilo y titule con la solución de HCl, hasta aparición de un color rosa en la solución. Anote el volumen de HCl gastado. Determine la normalidad del HCl en la forma siguiente: NHCl = VNaCO3 . Na2CO3 VHCl Procedimiento: Se recomienda hacer las determinaciones por duplicado. 1. Pese por diferencia una muestra que contenga aproximadamente de 25-50mg. de nitrógeno. Cuando se trate de muestras de alimento, se pesan generalmente 1.0gr. para heces frescas, se pesan de 4-6 gr. para orina fresca, 5 ml. pero además se deben de pesar ya que la orina varía mucho en gravedad específica. Para evitar la pérdida de material en muestras sólidas, se pesa en un papel filtro, doblándolo con cuidado y depositándolo en el matraz balón de Kjeldahl donde se va a digerir. 2. Corra simultáneamente con las muestras, dos blancos con papel filtro en todos los pasos del procedimiento y réstele a la titulación de las muestras, la titulación del blanco. Generalmente el valor promedio del blanco sirve para las muestras que se corren durante el día. 3. Agregue 10 g de NaSO4 ó K2SO4, una punta de espátula de Selenio y de 8-10 perlas de vidrio. Si se usa la mezcla LOS PASTOS EN LA NUTRICIÓN DE LOS RUMIANTES 29 CAPÍTULO 2 4. 5. 30 6. 7. 8. de catalizadores agregue solo 10 g de la mezcla y las perlas de vidrio. Agregue 30 ml. de H2SO4 concentrado. Coloque los matraces en los calentadores del aparato Kjeldahl y póngalos a funcionar simultáneamente con el extractor del aparato. Mantenga en observación el proceso de digestión hasta que cese la formación de espuma. Si la espuma en una muestra determinada sube por el cuello del matraz, retírelo del calentador para que la espuma desaparezca y luego vuelva a colocarlo. Cuando se trata de muestras líquidas la formación de espuma es común. Continúe la digestión 30 minutos después de que la solución se aclare (de 60-90 minutos en total). Los matraces se deben de rotar ocasionalmente durante el procedimiento. Terminada esta fase, apague los calentadores y deje enfriar los matraces manteniendo prendido el extractor para permitir el escape de todos los gases. Antes de que se solidifique el residuo digerido, agregue con cuidado 200 ml. de agua destilada para diluir. Si el material residual se ha solidificado, disuelva éste mediante la rotación de los matraces antes de continuar el procedimiento. Aparte en matraces Erlenmeyer de 500 ml. agregue 100 ml. de ácido bórico al 4% y de 8-10 gotas de indicador rojo de metilo-verde de bromocresol y colóquelos bajo los condensadores del aparato con los extremos de las mangueras de destilación sumergidas en la solución. Abra la llave del agua de los condensadores y encienda los calentadores del sistema de destilación para que es- tén calientes cuando se inicie ésta. Así se evita que el ácido bórico suba hacia los matraces de destilación. 9. Agregue con cuidado y cerca del aparato una punta de espátula de Zinc y 100 ml. de NaOH. Al 45% a cada matraz, manteniéndolo inclinado para que la solución se deslice por un costado hasta el fondo, de esta manera evitará el inicio de la reacción y el escape del nitrógeno. Conecte rápidamente el matraz al condensador, ajustando bien el tapón. Mezcle el contenido del matraz rotándolo suavemente. 10. Continué la destilación hasta obtener 200 ml. de destilado en los frascos Erlenmeyer y después apague los calentadores, de no hacerlo así, puede devolverse el destilado a los matraces, lo que causaría la pérdida de todo el proceso. Nota: Retire los matraces Erlenmeyer antes de apagar la parrilla. 11. Apague las parrillas y cierre la llave del agua. 12. Titule el amonio recogido en los matraces Erlenmeyer con una solución estándar de HCl hasta obtener un color rosa tenue. Cálculos: Determine el % de nitrógeno y % de proteína en la forma siguiente: % Nitrógeno (N) = [(ml de HCl usados en la muestra) – (ml de HCl usados en el blanco)] x [(concentración del HCl ) x (1.014) x (100)/g de muestra FACULTAD DE CIENCIAS BIOLÓGICAS, UANL % Proteína = % N x 6.25 PROTEÍNAS EN PASTOS Conversión a base seca: 12. Titular con HCl 0.1N. 13. Realizar los cálculos ( igual que el Macro kjeldahl) (a) % de proteína en muestra “tal como ofrecido” x 100 % de materia seca en muestra “tal como ofrecido” % PC = [(ml de HCl gastados por la muestra) – (ml gastados por el blanco)] x (b) % de proteína en la muestra “parcialmente seco” x 100 [(Concentración del HCl) (1.014)]/ [(g de la muestra) (6.25) (100)] % de materia seca de la muestra “parcialmente seco” Adaptado de AOAC (1997). Adaptado de AOAC (1997) Para el Micro Kjeldahl se usa el siguiente procedimiento: Compuestos nitrogenados en los forrajes 1. Pese 200 mg (0.2g) de muestra, no colocar el papel filtro, (de envoltura de la muestra), transferir directamente la muestra a los matraces micro kjeldahl. 2. Añadir 4 ml de H2SO4 a cada matraz. 3. Añadir una cucharada completa de mezcla catalizadora. 4. Colocar los matraces en las unidades de digestión. 5. Digerir hasta limpiar (no residuos de carbón), aproximadamente 3 h 6. Enfriar completamente, agregar a cada matraz 20 ml de agua destilada. 7. Añadir unos pocos granos de zinc a cada matraz. 8. Añadir 20ml de solución de NaOH/Na2S203 (Preparado mezclando 450 g de NaOH con 80 g de tiosulfato de sodio (Na2S2O3) en 1 litro de agua destilada). 9. Abrir el generador de vapores y el agua para que ocurra la destilación. 10. Colocar los matraces en el aparato destilador. 11. Colocar 20 ml de ácido bórico en un matraz Erlenmeyer de 125 ml, colectar 30 ml del destilado (50 ml de volumen total). La proteína de las plantas se clasifica en dos categorías: 1) de las hojas y 2) de las semillas. Aproximadamente la mitad de la proteína es soluble y está localizada en los cloroplastos, mitocondria y citoplasma y más del 50% de la proteína soluble de las hojas está compuesta de la enzima ribulosa difosfato carboxilasa o Fracción I de la proteína. La proteína insoluble está asociada con las membranas, la mayoría de la cual está en los cloroplastos. La cantidad de cloroplastos en la membrana se incrementa con la edad de la hoja, solo declina rápidamente con la senescencia, con condiciones limitadas, como baja intensidad de luz o fuente de N, la mayoría de la proteína de los cloroplastos se encuentra en las membranas (Reid, 1994). Una gran parte (10-35%) del N en los forrajes está presente como nitrógeno no proteico (NNP) como aminoácidos libres, aminas, amidas, nucleótidos, péptidos, clorofilas y aminoácidos ligados a formas no proteicas, con pequeñas cantidades de alcaloides y N inorgánico. El nivel de NNP es alto en el forraje inmaduro y se incrementa con la fertilización de N. El nivel de aminoácidos libres disminuye con la LOS PASTOS EN LA NUTRICIÓN DE LOS RUMIANTES 31 CAPÍTULO 2 edad de la planta. Además hay una elevada diferencia en el nivel de aminoácidos individuales entre hojas y tallos. Algunos de los aminoácidos no proteicos que se encuentran en los pastos y leguminosas tienen un importante efecto inhibitorio o efectos tóxicos para los animales (Tabla 2.1.). Ejemplos de estos compuestos se encuentra la mimosina en Leucaena leucocepha; indospicina en especies de Indigofera; ácido ˜, ˜-diaminobutírico y ˜-aminopropinitrilo en especies Lathyrus, S-metilcisteina sulfoxida en Brasicas y aminoácidos conteniendo Se en plantas del pastizal que cau- Tabla 2.1. Compuestos nitrogenados de las plantas y hongos asociados con la toxicidad en rumiantes 32 )DFWRU )XHQWH (IHFWR $PLQRiFLGRVQRSURWHLFRV 0LPRVLQD /HJXPLQRVDV/OHXFRFHSKDOD ,QGRVSLFLQD ,QGLJRVHUD 'HSLODWRULRUHSURGXFWLYR WHUDWRJpQLFR +HSDWRWy[LFRWHUDWRJpQLFR ĮȕGLDPLQREXWtULFR /DWK\UXV9LFLD 1HXURWy[LFR 6HOHQRPHWLRQLQD 3ODQWDVGHOSDVWL]DO$VWUDJDOXV 6HPHWLOVHOHQRFLVWHLQD $FXPXODGRUHVGH6H 7R[LFLGDGFRQ6HHQIHUPHGDGGHO iONDOL 7R[LFLGDGFRQ6H 6HPHWLOFLVWHLQDVXOIR[LGR %DUDVVLFDVFROFROVDHWF $QHPLDKHPROtWLFD 3URWHtQDVVROXEOHV /HJXPLQRVDV 7LPSDQLVPR *OXFRVLQRODWRV &UXFtIHUDV%UDVVLFDV %RVLRJpQLFDV &LDQyJHQDV )DOODVHQODUHVSLUDFLyQSUREOHPDV FDUGtDFRV $ONDORLGHV 6RUJROHJXPLQRVDVHVSHFLHV DUEXVWLYDVQDWLYDV 3LUUROLFLGLQD &URWRODULD6HQHFLR+HOLRWURSLXP +HSDWRWy[LFDV (UJRW HUJRYDOLQD )HVWXFD SHUOROLQDOROLQDV 0LFRWR[LQDV +RQJR&ODYLFHSVHQJUDQRVSDVWRV )DOODVHQODUHSURGXFFLyQ FRQYXOVLRQHVJDQJUHQD 3DVWRV )DOODVHQODUHSURGXFFLyQ JDQJUHQDGLVPLQXFLyQGHODSHWLWR WR[LFLGDGGHIHVWXFDGHYHUDQR 3KDODULV $IHFWDSDODWDELOLGDGGLDUUHD QHXURWy[LFRHQFRQGLFLRQHVDJXGDV \FUyQLFDV 7HUPyJHQRV $FUHPRQLXPOROLDHHQU\JUDVV 7ULSWDPLQD ,QFRRUGLQDFLyQWDPEDOHR (VSRULGHVPLQD 3LWKRP\FHVFKDUWDUXPHQU\JUDVV +HSDWRWy[LFR 7R[LQDVOXSLQD SKRPRSVLQD 3KRPRSVLVOHSWRVWURPLIRUPLVHQ /XSLQXV +HSDWRWy[LFR san toxicidad al ganado. En seguida se discutirá los efectos de estos compuestos y ciertos alcaloides. Las aminas, las cuales son químicamente similares a los alcaloides, se encuentran en bajas concertaciones en las plantas, pero se incrementan en los ensilados, y las aminas como la histamina y tiramina, tienen fuertes efectos farmacéuticos en los animales. La alantoina y ácido alantóico, ocurren muy comúnmente en pequeñas cantidades en leguminosas y pastos y particularmente en las semillas; sus efectos en los animales aun no son entendidos. El nitrato es la única fuente de N inorgánico en las plantas, ocurre principalmente más en el tejido de los tallos que en las hojas. Mientras que el nitrato en la planta generalmente es rápidamente metabolizado en otros compuestos, NO3-N se acumula particularmente en ciertas especies, debido a la fertilización con N, sequía o las condiciones de sombreado y la aplicación de herbicidas. Altos niveles de NO3 en los pastos, productos de los pastos, y algunas Brasicas, pueden causar toxicidad en los animales rumiantes debido a su conversión en nitratos más tóxicos en el rumen. Variables ambientales que afectan la composición del N en las plantas El análisis de una gran cantidad de forrajes de diferentes partes del mundo tienen un contenido de proteína cruda promedio de 17% en leguminosas y de 11.5% en pastos (Minson, 1990). Los pastos tropicales tienen menos proteí- Fuente: Asplund (1994) FACULTAD DE CIENCIAS BIOLÓGICAS, UANL PROTEÍNAS EN PASTOS na que los de clima templado (valores promedio de 10.0 y 12.9%, respectivamente), con pequeñas diferencias entre poblaciones de leguminosas de clima tropical y templado (valores de 16.6 y 17.5%, respectivamente). El promedio de proteína cruda de 369 de pastos perennes de clima cálido colectados en el noreste de EUA fue de 7.6% (Reid et al., 1988). Existen diferencias significativas en el contenido de proteína entre especies de pastos y leguminosas y entre cultivares dentro de cada especie (Tabla 2.2.). Los efectos de la fertilización con N en el contenido y composición de N en los forrajes ha sido bien documentado por Minson (1990). Se ha reportado que hubo muy poco incremento en el contenido de proteína cruda y glúcidos solubles en agua (GSA) con la aplicación de 500 kg de N ha-1 año-1 con una variación de 29.5% a 30.4% con y sin aplicación de N, respectivamente. Además, la razón de proteína cruda a GSA cambió de 1:1.1 son fertilización de N a 1:0.5 con la aplicación de 500 kg de N. Sin embrago, si hubo marcados cambios en la composición química de los Tabla 2.2. Distribución de proteína en las hojas de los forrajes de clima templado /RFDOL]DFLyQLQWUDFHOXODU &ORURSODVWRV 0LWRFRQGULD &LWRSODVPD 1~FOHR 3DUHGFHOXODU GHODSURWHtQDWRWDO PHPEUDQD VROXEOH PHPEUDQD VROXEOH PHPEUDQD VROXEOH ensilados y probablemente, en la eficiencia de la utilización de N y la fibra por los microorganismos del rumen. Los pastos tropicales C4 típicamente tienen más bajo contenido de N que las especies de pastos de clima templado C3, pero muestran una mejor respuesta a la fertilización. Está bien documentado que muchos de los factores descritos hasta ahora que afectan el contenido y forma de N en los forrajes son fuertemente influenciados por variables climáticas como la temperatura, luz y agua. Van Soest (1994) reportó que temperaturas elevadas incrementan la actividad metabólica y la síntesis de compuestos estructurales, provocando disminución de NO3-N, proteína GSA de los forrajes. Además, la alta temperatura incrementa la formación de la pared celular y disminuye su digestibilidad en los forrajes. La gran intensidad de luz incrementa la producción de la cantidad GSA en las plantas y el sombreado lo reduce y promueve el desarrollo de la pared celular; sin embargo, las plantas sombreadas generalmente tienen alto contenido de proteína. La mayoría de los reportes sobre el efecto de la sequía o la provisión de agua muestran que con un moderado estrés en el suministro de agua se reduce el crecimiento de la planta y por tanto, se incrementa el contenido de proteína cruda, se reduce la fibra y se mejora la digestibilidad (Van Soest, 1994). Sin embargo, el efecto de los factores climáticos sobre la planta es difícil de predecir debido a que ninguno de ellos opera independiente uno de otro, ya que la calidad del forraje parece inconsistente de un año a otro. Los procedimientos tradicionales para producir heno por curado bajo el sol resultan en bajas pérdidas de nutrientes LOS PASTOS EN LA NUTRICIÓN DE LOS RUMIANTES 33 CAPÍTULO 2 34 por respiración y drenado del contenido celular causado por la lluvia (Van Soest, 1994). En la Tabla 2.3. se muestran las pérdidas de proteína que se producen por el secado de los forrajes comparados con las del forraje original (Minson, 1990). Las pérdidas en proteína cruda fueron mayores en la estación húmeda comparada con la estación seca. Un gran número de métodos, que incluyen el tratamiento con ácido propiónico, amoníaco y urea, son usados para conservar el heno reduciendo la actividad microbial y el calentamiento. La amonificación con amoníaco anhidro también incrementa el contenido de N del heno y mejora su digestibilidad y consumo. Sin embrago, algunos investigadores prefieren el uso de la urea para preservar el heno húmedo debido a su baja toxicidad. La urea en el heno es rápidamente convertida, por las ureasas de la planta, en amoníaco (NH3) reduciendo la temperatura de las pacas, incrementando el contenido de N y mejorando la digestibilidad in vitro de la materia seca y pared celular (Henning et al., 1990). Durante el ensilado del forraje se produce un gran rompimiento de la proteína de las hojas y la proteolisis continúa hasta alcanzar un pH de 4, conduciendo a una acumulación Tabla 2.3. Contenido de proteína en diferentes tipos de heno de pastos de clima templado 7UDWDPLHQWR &RQJHODPLHQWRDOFRUWH 6HFDGREDMRVRPEUD 6HFDGRHQWUtSRGH (QUROODGR 3URWHtQDFUXGD &RQGLFLRQHVDPELHQWDOHV (VWDFLyQVHFD (VWDFLyQK~PHGD 3URPHGLR NNP soluble. Los principales objetivos del proceso de ensilaje es lograr la anaerobiosis y la supresión del crecimiento clostridial debido a la rápida formación de ácido láctico. Los aditivos para el ensilado funcionan simulando la fermentación láctica, inhibiendo el crecimiento microbial (ácidos minerales, ácido fórmico, formaldehído, dióxido de sulfuro, etc.), inhibiendo el rompimiento anaeróbico (amoníaco, ácido propiónico) y proporcionando nutrientes en la forma de compuestos nitrogenados o minerales (McDonald, 1981). Las principales limitantes para la alimentación animal con pajas o rastrojos son los altos niveles de lignina en la pared celular y bajos niveles de proteína cruda. Valores de 4.0, 4.0, 3.0, 3.0 y 5.0% de proteína cruda en la paja de trigo, rastrojo de maíz, rastrojo, olote de maíz y paja de sorgo, respectivamente fueron reportados por Klopfenstein y Owen (1981). El procesamiento de los residuos de cosecha, como las pajas y rastrojos, con compuestos amoniacales es también efectivo, como se describió en los ensilados, en incrementar el contenido de N y la digestibilidad de la pared celular y el consumo voluntario (Corah, 1990). Los granos de cereales representan la principal fuente energética en las dietas para rumiantes, pero contienen limitadas cantidades de proteína cruda (10 a 13% en base seca). Para el procesamiento de los granos se han usado métodos físicos y químicos, así como el rolado y exprimido son usados en combinación con diferentes formas de tratamiento con calor (Crampling, R.C. 1990). La amonificación, como tratamiento químico, incrementa la concentración de N en el grano y, además, mejora la digestibilidad in vitro de FACULTAD DE CIENCIAS BIOLÓGICAS, UANL PROTEÍNAS EN PASTOS la proteína comparado con el tratamiento con ácido propiónico (Czarnecka et al., 1990). Funciones de la proteína en el rumiante Las proteínas forman el más basto e interesante grupo de sustancias orgánicas, y deben su enorme importancia biológica al hecho de que los protoplasmas celulares y todos los elementos histológicos, de cualquier organismo animal, las contienen en gran medida. La proteína es necesaria para la producción de leche, músculo, piel, pelo y para reemplazar la perdida inevitable de proteína empleada en el mantenimiento del peso corporal. Las proteínas contienen 22 diferentes aminoácidos y los rumiantes pueden estar imposibilitados para sintetizar algunos de estos aminoácidos en una proporción suficiente para satisfacer sus requerimientos óptimos. Esos se definen como aminoácidos indispensables o esenciales y deben ser absorbidos después de la digestión en el intestino delgado (McDonald et al., 1995). Hay grandes diferencias entre los tres tejidos (leche, músculo y pelo) en relación a los requerimientos de varios aminoácidos esenciales; la síntesis de proteína del músculo requiere casi el doble de la cantidad de arginina que la proteína de la leche. La síntesis de proteína del pelo requiere de cantidades muy grandes de aminoácidos sulfurados como metionina, cisteina y cistina. En animales no rumiantes la cantidad de aminoácidos esenciales disponibles para la absorción en el intestino delgado puede ser determinada analizando el alimento. Este simple método no puede ser apli- cado a los rumiantes debido a la presencia de microbios en el rumen que modifican la cantidad y proporciones de aminoácidos disponibles para la absorción (Minson, 1990). Tres grandes cambios ocurren para la proteína cruda en el rumen: 1) degradación de proteína cruda en amoníaco. Si el amoníaco producido está presente en altas concentraciones, este es absorbido, conduciendo a una perdida neta de proteína cruda. 2) La proteína microbial es sintetizada a partir de nitrógeno no proteico y azufre presente en el rumen. Esto puede conducir a una ganancia neta de proteína cruda con mayor entrada de proteína cruda al duodeno, de lo consumido y 3) Los microbios sintetizan proteínas, las cuales tienen un perfil diferente de aminoácidos a las proteínas que son degradadas en la dieta. El valor del forraje como generador potencial de aminoácidos puede ser determinado por análisis del nitrógeno (N) total y azufre (S). Los forrajes contienen nitrógeno en muchas formas diferentes a los aminoácidos (McDonald et al., 1995) y estos pueden ser convertidos en aminoácidos por los microbios del rumen. El termino proteína cruda (PC) es usado para describir todas las formas del nitrógeno presentes en la planta. Las plantas y animales contienen aminoácidos, generalmente en un promedio de 160 g. N/kg MS y a consecuencia de esto, el contenido de PC es calculado como 6.25 x N (Minson, 1990). Transformación de la proteína en el rumen Los proteínas de los alimentos son degradados por los mi- LOS PASTOS EN LA NUTRICIÓN DE LOS RUMIANTES 35 CAPÍTULO 2 36 croorganismos del rumen vía aminoácidos para formar amoniaco y ácidos orgánicos (ácidos grasos de cadenas múltiples). El amoniaco también viene de las fuentes de nitrógeno no proteico en los alimentos y de la urea reciclada de la saliva y a través de la pared del rumen. Niveles demasiado bajos de amoniaco causan una escasez de nitrógeno para las bacterias y reduce la digestibilidad de los alimentos. Demasiado amoniaco en el rumen produce una perdida de peso, toxicidad por amoniaco y en casos extremos, muerte del animal. El nivel de utilización de amoniaco para sintetizar proteína microbiana depende principalmente de la disponibilidad de energía generada por la fermentación de glúcidos. En promedio, 20 g de proteína bacteriana es sintetizada de 100 g materia orgánica fermentada en el rumen. El síntesis de proteína bacteriana puede variar entre 400 g día-1 a aproximadamente 1500 g día-1 según la digestibilidad de la dieta. El porcentaje de proteína en bacteria varía entre 38 y 55% (Figura 1). En general, bacteria contienen mas proteína cuando las vacas consumen mas alimentos y las bacteria, pegadas a partículas de alimentos, pasan más rápidamente del rumen al abomaso. Efecto de la proteína en la producción Estudios en rumiantes en pastoreo y en confinamiento, muestran que la producción con forrajes puede ser limitada, por deficiencia de proteína y que la producción puede ser mejorada proporcionando proteína suplementaria. Estos es- tudios serán brevemente resumidos de acuerdo al tipo de producción. Digestión de la proteína Las proteínas en el rumiante son degradadas hasta cierto punto en el rumen, junto con una liberación de N en forma de amoniaco o de otros compuestos. Esto puede ser considerado como un proceso obligatorio ya que la mayoría de los microorganismos del rumen utilizan preferentemente amoniaco como fuente de nitrógeno (Hungate, 1966). En el rumen existen especies de microorganismos que pueden utilizar aminoácidos y algunos péptidos, por lo que algunos gérmenes no precisan estos compuestos. No obstante sigue siendo cierto que la mayoría utiliza amoniaco (Figura 2.1.). Un factor primario que regula la tasa de liberación de amoniaco por desaminación degradativa en el rumen, es la solubilidad de la proteína, factor que es controlado por características físicas y químicas. La solubilidad de las proteínas encontrada en los alimentos naturales varía considerablemente y puede ser determinada en el rumen siguiendo el incremento que experimenta la concentración de amoniaco en el líquido ruminal. La medida de la proteína en los animales es sencilla, es la proporción de PC en el alimento, que no aparece en las heces; que es la proteína cruda digestible (PCD) contenida en la dieta. La PCD solo es un indicador relativo de la cantidad de PC disponible para el rumiante, pero éste no es adecuado por la secreción de nitrógeno metabólico fecal, y la tolerancia no es hecha por cambios ocurridos en el rumen. FACULTAD DE CIENCIAS BIOLÓGICAS, UANL PROTEÍNAS EN PASTOS Proteína en las heces Casi 80% de la proteína que alcanza el intestino delgado es digerido, el resto pasa a las heces. Otra fuente importante de nitrógeno en las heces son las enzimas digestivas secretadas en el intestino y el reemplazo rápido de las células del intestino (proteína metabólica de las heces). En promedio, por cada incremento de 1 kg de materia seca ingerida por el rumiante, hay un aumento de 33 g de proteína corporal perdida en el intestino y eliminado en las heces. Las heces de rumiantes son un buen fertilizante porque son ricas en materia orgánica y especialmente ricas en nitrógeno (12.2-12.6% de nitrógeno o equivalente a 14-16% proteína cruda) comparado con las heces de animales no rumiantes. 37 Clasificación de las proteínas Las proteínas se clasifican de acuerdo al tipo, forma, estructura, solubilidad y/o composición química (McDonald et al., 1995). Según Van Soest (1994), los tipos de proteína incluyen: (1) Albúminas, que son solubles en agua e insolubles en alcohol, (2) Globulinas, insolubles en agua y alcohol, pero solubles en soluciones salinas de concentración media, (3) Prolaminas, solubles en alcohol pero insolubles en agua y soluciones salinas, y (4) Glutelinas, solubles sólo en soluciones alcalinas. Mientras que muchas semillas pueden contener fracciones variables de los diferentes tipos de proteínas, las gramináceas cereales tienden a contener grandes Figura 2.1. Metabolismo de proteínas en el rumiante. cantidades de prolaminas y glutelinas, como las proteínas insolubles e hidrofóbicas características del maíz y el trigo, las cuales poseen bajas tasas de hidrólisis ruminal. Las dicotiledóneas, particularmente las leguminosas, tienden a contener globulinas y albúminas de gran potencial de solubilidad, por lo que son más sensibles a la desnaturalización por calor, lo que da insolubilidad en agua (Van Soest, 1994). LOS PASTOS EN LA NUTRICIÓN DE LOS RUMIANTES CAPÍTULO 2 Importancia y calidad nutritiva de la proteína microbial 38 La cantidad de proteína que llega al intestino delgado para su absorción, es la suma de la proteína sintetizada por microbios ruminales y la proteína de la dieta que escapa (proteína de escape) a la degradación ruminal (Van Soest, 1994), siendo referidos por la NRC (2000) como proteína cruda bacterial (PCB) y proteína de consumo indegradable (PCI), respectivamente. De toda la proteína que llega al duodeno, el 40 a 80% es PCB, dependiendo de factores como la dieta o el animal (Owens y Bergen, 1983). Originalmente, la calidad de la proteína y requerimientos de aminoácidos esenciales (AAE) fueron deducidos de los requerimientos de las especies no rumiantes, aunque después probaron en rumiantes; Asimismo, algunos estudios indicaron que las diferencias en la calidad de la proteína de la dieta para los rumiantes podría no ser detectada. Sin embargo, con el desarrollo de nuevas metodologías, como las que miden el flujo de la ingesta fue posible llegar a subdividir la digestión total de las actividades digestivas o de absorción en el retículo-rumen, abomaso, intestino delgado, intestino grueso, así como el ciego. Con otras metodologías como la aplicada por Storm y Orskov (1984) en la que nutrieron completamente a rumiantes por infusión parenteral con mezclas de aminoácidos (AA) de composición conocida, se puedo determinar los patrones de AAE más acertadamente para los rumiantes. Aún en la actualidad, es limitado el conocimiento en relación a los requerimientos cuantitativos de AA en rumian- tes, ya que la intervención microbial evita su estudio adecuado (Broderick, 1983). Durante el proceso de digestión ruminal, los microbios se multiplican y sintetizan, cantidades considerables, proteína microbial utilizando como fuente de nitrógeno (N) nitrógeno no proteico (NNP) y proteínas de la dieta (Owens y Bergen, 1983). El concepto de NNP como fuente de N para los microbios ruminales se basó en los resultados de las primeras investigaciones que sugirieron que la proteína de la dieta se fermenta en el rumen en compuestos nitrogenados simples y que son reincorporados a la proteína celular bacteriana como NH3-N (Hungate, 1966). Posteriormente, se demostró que el ganado alimentado con NNP puede crecer, reproducirse y lactar sin consumir AA o proteína de la dieta. Broderick (1994) realizó una comparación entre los AAE y los AA semiesenciales (AASE) que componen la proteína de la leche, proteína cruda microbial, grano de maíz, heno de alfalfa y las harinas de: hueso, carne, sangre, gluten de maíz, y soya. Concluyó que la proteína microbial es una fuente adecuada de AAE, inclusive, el contenido de lisina, metionina y cistina fue similar o más elevada que la proteína láctea. Aunque los resultados del estudio antes mencionado sugieren que una dieta de baja calidad proteica sería mejorada, si ésta proteína fuera degradada en rumen y convertida a PCB, Huber y Kung (1981) comprobaron que en caso de rumiantes de alta producción, la PCB sola, puede ser insuficiente para satisfacer las demandas de estos animales para la producción de proteína de origen animal. Los patrones de AAE de la PCB no son marcadamente afectadas por la dieta, pero la calidad de FACULTAD DE CIENCIAS BIOLÓGICAS, UANL PROTEÍNAS EN PASTOS la proteína no es ideal, ya que su valor biológico es de 66-87. Por lo tanto, un rumiante en producción o rápido crecimiento depende de la síntesis de PCB y de la proteína de la dieta que escapa de la digestión ruminal para suministrar AAE. Urea El amoniaco, la urea y el ácido úrico son los productos de excreción del exceso de nitrógeno resultante de la degradación metabólica de los aminoácidos por cualquiera de las tres vías. Los animales acuáticos excretan amoniaco. Cuando se dispone de menos agua, el amoniaco es convertido en productos menos tóxicos que requieren menos agua para su excreción. Uno de tales productos es la urea que es excretada por los organismos urecotélicos que constituyen la mayor parte de los vertebrados terrestres. El otro producto es el ácido úrico excretado por la aves y reptiles terrestres, organismos que se denominan uricotélicos. Los organismos vivientes que excretan amonio son los amoniotélicos. Proteína de escape y proteína de paso A la proteína de la dieta que escapa a la fermentación ruminal y se transporta al tracto digestivo bajo se le llama proteína de paso (PP) ó proteína de escape (PE), para diferenciarla de la proteína sintetizada por microbios ruminales y de las secreciones endógenas (NRC, 2000). Estos términos pueden ser confundidos. La proteína de la dieta que pasa al abomaso consiste de dos fracciones: (1) La proteína que evade al ataque de microorganismos en rumen y que mediante la ranura esofágica pasa al abomaso sin mezclarse completamente con el contenido ruminal, a la cual se le denomina proteína by-pass; ésta, es una característica de los rumiantes jóvenes y (2) La proteína que resiste el ataque microbial en el rumen, como resultado de la competición entre las tasas de digestión ruminal y la tasa de pasaje, a la cual se le llama PE (NRC, 2000). La cantidad de PE de la dieta puede ser una cantidad significativa que genere una respuesta de eficiencia en los rumiantes. El mejoramiento para los rumiantes donde se protege la calidad de la proteína o de los aminoácidos (AA) que llegan al tracto digestivo bajo, resulta de la combinación de 2 efectos: la gran cantidad de AA esenciales y de una elevada digestibilidad verdadera de las proteínas de calidad, comparada con la proteína cruda de los organismos ruminales (Van Soest, 1994). En los microorganismos ruminales, sólo el 60-70% de su nitrógeno (N) está en forma de proteína verdadera (aunque ésta es de buena calidad), los remanentes están compuestos de ácidos nucleícos y péptidoglucanos de su pared celular, que son indigestibles. La proteína de escape puede ser alterada por la manipulación de las tasas de digestión y la tasa de pasaje. La cantidad de proteína de escape del rumen es variable, depende: del tipo de proteína, su tasa de degradación, nivel de consumo, tasa de pasaje y otros factores. En contraste, los factores como tasas de pasaje y tasa de degradación no tienen efecto para la proteína de paso, ya que ésta nunca entra al rumen para sujetarse a degradación ruminal (Van Soest, 1994). LOS PASTOS EN LA NUTRICIÓN DE LOS RUMIANTES 39 CAPÍTULO 2 40 Debido a la complejidad en la medición de proteína de escape en los rumiantes, muchos sistemas in vitro han sido formulados para predecir la proteolisis ruminal de varias fuentes de proteínas (Brooderick, 1982). En estos se incluyen: mediciones de la solubilidad en varios solventes, pérdidas de proteína, acumulación de amoniaco o de aminoácidos in vitro, y pérdida de proteínas después de la incubación con varias enzimas proteolíticas. Las determinaciones in vivo y la respuesta animal son los únicos métodos aplicables para evaluar estos métodos planteados y determinar directamente la proteína de escape. Una combinación de la solubilidad con mediciones in situ pueden correlacionarse con los valores de escape, cuando se ajustan por comparación con alguna proteína de referencia. De los métodos antes mencionados, la solubilidad ha recibido mayor atención comercial en la investigación por ser un simple indicador de la degradabilidad. Generalmente, los componentes solubles son más rápidamente atacados y su digestión es más completa en el rumen, que los componentes insolubles. Sin embargo, esto se ha cuestionado, ya que ciertas proteínas, aunque solubles, parecen resistir la actividad de las proteasas in vitro. Las proteínas solubles de la harina de soya, harina de semillas y la caseína fueron hidrolizadas a diferentes tasas (Mahadevant et. al., 1980). Algunos estudios utilizando proteína soluble como indicador de disponibilidad ruminal demostraron un aumento en la producción de leche, pero otros estudios no demostraron una producción como respuesta; además, las estimaciones de degradación ruminal de la proteína insoluble en amorti- guadores ruminales, fluctúan del 35-50% (Tamminga, 1979) lo anterior sugiere, que la solubilidad es un pobre indicador del grado de degradabilidad ruminal a través de una variedad de dietas y condiciones de alimentación. Por otra parte, debido a que la composición de AAs de la fracción más soluble, usualmente difiere de la fracción insoluble, el paso al tracto digestivo bajo de algunos AA, puede ser más elevado para unos que para otros (Stern y Satter, 1982). Se han realizado una variedad de modificaciones químicas y físicas para incrementar la proteína de escape de las fuentes de proteína de la dieta, entre éstas: el tratamiento con formaldehído, con taninos, calor o formulación con fuentes de alimentos que son naturalmente bajos en disponibilidad ruminal, generando así, algunos tipos de proteína menos soluble y menos sujeta a la proteolisis; una proporción variable de estos complejos así formados, son divididos por las condiciones ácidas del abomaso (Van Soest, 1994). Se ha reportado que el 92% del N de la harina de sangre escapa a la degradación ruminal, comparado con un 21% de la harina de soya. Sin embargo, algunas fuentes de proteína resistentes a degradación ruminal, tales como: productos destilados, proteínas tratadas químicamente y materiales dañados por el calor, pueden tener un balance inferior de AAs o contener altas cantidades de N indigestible (Owens y Bergen, 1983). Por otra parte, cuando se alimenta con proteínas de alto pasaje o se produce una sobreprotección de la proteína por diversos tratamientos, se puede generar proteína totalmente indigestible y se forzaría a los microbios ruminales a que dependan de la urea reciclada, la que es inadecuada como única fuente para FACULTAD DE CIENCIAS BIOLÓGICAS, UANL PROTEÍNAS EN PASTOS apoyar a la fermentación, el crecimiento de éstos sería bajo, pudiéndose afectar el consumo de alimentos, así como su digestibilidad (Van Soest, 1994). Los forrajes frescos, contienen casi la mitad de proteína verdadera en forma hidrosoluble, rápidamente fermentable. Probablemente mucha de esta proteína es degradada en el rumen. La alta humedad de los ensilados representa una situación similar, aunque mucho de ese N hidrosoluble es NNP. En estos casos, el escape de N es de 10-30% de la cantidad total, pero considerando que cerca del 5-15% del N del forraje forma un complejo de N-lignina, totalmente indigestible, por lo tanto, la proteína de escape disponible es la diferencia, pudiendo ser sólo de 0-25% del N consumido de forrajes frescos y ensilados (Van Soest, 1994). Factores que incrementan la proteína de escape Naturaleza física de la proteína es de importancia crítica, si la proteína es soluble y se mueve con líquidos o es insoluble y se mueve con el material sólido. La materia líquida pasa del rumen mucho más rápida que el material sólido debido a presión osmótica y lavado hacia el exterior. El material sólido está en función del consumo de pared celular, ruminación y tamaño de la partícula (Van Soest, 1994). El tamaño de la partícula es importante. Si el forraje es deshidratado y molido, la alteración física tendría un gran efecto sobre el escape del rumen. La concentración de proteína en la dieta también influencia el escape del rumen, ya que el pasaje de cualquier ingre- diente es dependiente de su concentración en el rumen, por esta razón, se puede esperar que alimentos con altos contenidos de proteína provocarían el escape de grandes cantidades de la proteína de la dieta y que las proteínas menos degradadas podrían mostrar un gran escape (Van Soest, 1994). El consumo elevado de alimento provoca un pasaje rápido y por lo tanto, incrementa marcadamente la proteína de escape en ganado lechero (Tamminga et. al., 1979) y novillos, las mismas aplicaciones son consideradas para forrajes molidos y peletizados (Van Soest, 1994). La cantidad de PE en vacas lactantes comiendo 8.2 ó 12.9 kg de MS diariamente fue de 29 y 45%, respectivamente (Tamminga et al., 1979). Los rumiantes con alta producción consumen grandes cantidades de alimento y comúnmente tienen un gran porcentaje de PE que aquellos animales que consumen bajas o moderadas cantidades de alimento. Un 50% de incremento en el consumo de alfalfa duplica la cantidad de PE en borregos. El pH ruminal puede afectar la degradación proteica por alteración de la actividad de las enzimas proteolíticas y deaminasas, así como por la modificación de la solubilidad de las proteínas. El pH óptimo para la actividad de estas enzimas es entre 6 y 7 (Tamminga, 1979), un cambio en este rango, podría alterar la solubilidad de la proteína, alterando la degradabilidad ruminal (NRC, 2000). También la fibra puede limitar el acceso microbial a la proteína del forraje, y la digestión reducida de la fibra a un pH bajo podría también estar involucrada (Van Soest, 1994). En adición a los niveles de consumo, el tipo de dieta también influye en la proteína de escape. Ganado alimenta- LOS PASTOS EN LA NUTRICIÓN DE LOS RUMIANTES 41 CAPÍTULO 2 42 do con dietas de forraje, comparados con aquellos alimentados a base de dietas altas en concentrados, exhiben una elevada tasa y grado de degradación ruminal de la proteína in vitro (Rode, 1981) e in vivo. El tiempo de retención en rumen es otro factor que puede influir en la degradación de la proteína. Las proteínas retenidas por un corto tiempo son degradadas a un menor grado, que aquellas con gran tiempo de retención (NRC, 2000). El tiempo de retención de los ingredientes de la dieta varía entre animales, entre especies y entre los ingredientes de la dieta. El tiempo de retención es también influenciado por el tamaño de la partícula del alimento, así como el nivel de consumo (NRC, 2000); aunque, según Varga y Prigge (1982) el nivel de consumo tiene poco efecto sobre el tiempo de retención, siendo el impacto sobre la degradación de la proteína menor o sin efecto (McAllan y Smith, 1983). Se ha demostrado, que aumentando la tasa de dilución del fluido ruminal se incrementa el flujo de proteína hacia el abomaso en borregos y novillos. Parte de este aumento probablemente se deba a un incremento neto en la PCB y otra parte debido a un incremento en la cantidad de proteína de escape. La tasa de dilución del fluido ruminal ha sido incrementada por alimentación o infusión ruminal de saliva artificial, bicarbonato o cloruro de sodio (Van Soest, 1994). El tiempo de residencia ruminal puede verse afectado por la temperatura ambiental. Se ha demostrado que borregas en medio ambiente frío tuvieron una elevada tasa de pasaje de la digesta; esto, incrementa la PCB y la cantidad de PE. Posteriormente, Kennedy et al. (1982) encontraron que el porcentaje de PE en el rumen incrementó de 20 a 24% para el heno de alfalfa y de 40 a 49% para el heno de bermuda, cuando los borregos fueron expuestos a temperaturas frías. Por tanto, el incremento en la proteína de escape, puede deberse a: 1) disminución del tiempo de permanencia de los alimentos en el rumen y 2) al cambio de las características de fermentación ruminal. Requerimiento de N por los microbios Los microbios son el medio único de la conversión de NNP a proteína de alta calidad, pero ellos también son los responsables de la degradación de la proteína de alta calidad. La posibilidad de manipulación y maximización de la producción microbial ha sido sobreexpresada en la nutrición animal en favor de la protección y escape ruminal de la proteína. Estas últimas estrategias, sin embargo, hacen al rumiante más dependiente de la calidad de la dieta y brindan así una competencia con los no rumiantes. El aumento de la eficiencia microbial podría hacer al rumiante más independiente de la competencia por la fuente de alimento, la que permite un más eficiente uso del forraje (Van Soest, 1994). La optimización de la producción microbial requiere de óptima utilización del nitrógeno, hecho a través de manipulaciones y control de la salida de flujo del rumen utilizando fuentes proteicas con altas tasas de degradación. A partir de aumentos en consumo, esto está asociado con incremento en el escape, debido a que se ha incrementado la tasa de FACULTAD DE CIENCIAS BIOLÓGICAS, UANL PROTEÍNAS EN PASTOS paso y de recambio en el rumen. La eficiencia de la respuesta en rumiantes de altos consumos, es compleja. Los altos consumos promueven tanto la proteína de escape, como su síntesis, por enzima de la fracción de carbohidratos de la dieta, los cuales son fermentados. Los alimentos no son iguales con respecto al escape del rumen y en el grado en que ellos se deprimen durante la digestibilidad, y estos afectan significativamente la producción de energía de dietas comunes de rumiantes (Chalupa, 1977). El resultado neto de estos patrones de digestión es que dietas conteniendo cantidades de proteína y NNP entre ciertos rangos de que pueden resultar más o menos en la misma cantidad de proteína metabolizable que viene a ser aprovechada por el animal. Los factores que influencian esta cantidad vienen a ser idóneo para ser interna. El catabolismo de la proteína de la dieta y la producción microbial determinan la habilidad de los microbios para compartir por dietas de proteína de baja calidad y una reducción por las de alta calidad, mientras que sólo escapa la proteína de los alimentos no fermentados lo que tendría a sobrellevar el efecto ya mencionado. El límite compensación microbial en rumiantes alimentados con dietas con proteína de baja calidad es grupal por la eficiencia de reciclado de la urea, y en dietas altas en nitrógeno, por el catabolismo proteico. Este rango de consumo de proteína cruda va desde casi 8 a 16% de la dieta y puede resultar en aproximadamente la misma proteína neta desechada por el animal. Incrementos en la proteína de la dieta o en el consumo de nitrógeno están generalmente balanceados por las pérdidas en la orina. Este efecto es característico de la mayoría de la dietas ordinaria de rumiantes, pero pueden ser modificadas por muchos factores. Las cantidades absolutas de proteína para funciones fisiológicas de rumiantes para mantenimiento, crecimiento, y lactación no son conocidas. Esta incertidumbre está contabilizada por la falla del consumo dietario para corresponder a la cantidad de proteína que el animal actualmente recibe. La eficiencia de la fermentación ruminal en la proteína microbial está dirigida por dos fuerzas principales: 1) la tasa de fermentación, tales grupos de cantidades de alimento por unidad de tiempo unidad de tiempo y el plano funcional de nutrición por microbio; y 2) la tasa de paso, la cual favorece la pérdida del rumen de substratos de lenta fermentación y además remueve, más organismos maduros, reduciendo así la edad media de la población microbial. Esto también reduce la depredación de las bacterias por los protozoarios, dirigido a aumentar el potencial de crecimiento sobre una cantidad de substrato. La interacción entre el tiempo de paso y la calidad de la dieta puede hacer variablemente alta eficiencia microbial. Los requerimientos microbiales por el nitrógeno pueden excederse del equivalente proteico para el animal huésped, o alternativamente, en el empobrecido balance ruminal, los requerimientos del animal huésped pueden excederse a los requerimientos del rumen. Los requerimientos de las especies microbiales podrían también ser consideradas. Por ejemplo, los digestores de carbohidratos no estructurales, dependen de péptidos, mientras que los organismos celulolíticos dependen más de la amoniaco y de isoácidos. La disponibi- LOS PASTOS EN LA NUTRICIÓN DE LOS RUMIANTES 43 CAPÍTULO 2 lidad de péptidos probablemente mejora la eficiencia microbial. Proteína en pastos cultivados 44 México (Tabla 2.4.) solo durante el verano y otoño contienen niveles de PC en cantidades suficientes para satisfacer las demandas de PC para mantenimiento y producción (NRC, 2000) de los rumiantes en crecimiento. En estas regiones, las mayores precipitaciones se presentan durante el verano y otoño, a eso se debe a que el mayor contenido de PC de los pastos evaluados en la Tabla 2.4. se manifieste durante esas estaciones. Aparentemente, el híbrido buffel Nueces y cinco nuevas líneas del buffel (Cenchrus ciliaris), consideradas como al- El contenido de proteína cruda (PC) en muestras de pastos cultivados e introducidos al noreste de México varió de 7.7 a 11.9 % de la materia seca (MS) dependiendo de la estación del año, año, sitio de colecta y nivel de fertilidad del suelo, con una media de 9.4% (Tabla 2.4.). Estos niveles de PC son similares al valor promedio (10.0 %) de 560 pastos tropiTabla 2.4. cales, pero son inferiores a los vaContenido estacional de proteína cruda (% base seca) de pastos introducidos colectados en lores promedio de 340 diferentes municipios del Estado de Nuevo León, México en diferentes fechas leguminosas tropicales (16.6 %), 470 pastos de clima templado 3DVWRV /XJDU\IHFKDGHFROHFWD (VWDFLRQHV\DxRGHFROHFWD ,QYLHUQR 3ULPDYHUD 9HUDQR 2WRxR 0HGLDDQXDO (13.3%; Minson, 1992) y 270 ár boles y arbustos nativos (17 %; &HQFKUXVFLOLDULV&RP~Q 0DUtQ1/0p[LFR Ramírez-Lozano, 2003). Cuando &HQFKUXVFLOLDULV&RP~Q 0DUtQ1/0p[LFR el contenido de PC de los pastos &HQFKUXVFLOLDULV&RP~Q 7HUiQ1/0p[LFR &HQFKUXVFLOLDULV&RP~Q /LQDUHV1/0p[LFR es menor de 6 a 8 %, el apetito dis&HQFKUXVFLOLDULV1XHFHV 0DUtQ1/0p[LFR minuirá debido a la deficiencia de &HQFKUXVFLOLDULV/ODQR 0DUtQ1/0p[LFR &\QRGRQGDFW\ORQ&UX]D, /LQDUHV1/0p[LFR PC en el rumiante. El efecto se &\QRGRQGDFW\ORQ&UX]D, 0DUtQ1/0p[LFR debe a que el crecimiento &\QRGRQGDFW\ORQ&UX]D,, 0DUtQ1/0p[LFR 'LFKDQWKLXPDQQXODWXP /LQDUHV1/0p[LFR microbial en el rumen se ve limi'LFKDQWKLXPDQQXODWXP 0DUtQ1/0p[LFR tado por la deficiencia de PC (Van 3DQLFXPFRORUDWXP /LQDUHV1/0p[LFR Soest, 1994). Por tanto, los pastos 5K\QFKHO\WUXPUHSHQV 7HUiQ1/0p[LFR 3URPHGLRHVWDFLRQDO cultivados, no irrigados ni fertilizados, que crecen en el noreste de Datos tomados de: Ramírez et al. (2002); Ramírez et al. (2003); Ramírez (2003); Ramírez et al. (2004); Ramírez et al. (2005). FACULTAD DE CIENCIAS BIOLÓGICAS, UANL PROTEÍNAS EN PASTOS tas productoras de materia seca (MS), que fueron sembradas, bajo condiciones de temporal en Terán, N.L., México, durante el verano de 1999 y otoño de 1999 y 2000 (Tabla 2.5.) tuvieron niveles de PC de 7.0, 6.2 y 8.3 %, respectivamente. Solo en noviembre del 2000 las líneas tuvieron niveles marginalmente superiores de PC para satisfacer las demandas de mantenimiento de PC de rumiantes en pastoreo. Se ha probado que el contenido de PC de los pastos depende también de la disponibilidad de N en el suelo; la aplicación de fertilizantes nitrogenados aumenta generalmente el porcentaje de PC en los pastos (Minson, 1992). Al parecer, la aplicación de 120 kg de urea ha-1 como fertilizante, durante junio del 2000, a las líneas de buffel que aparecen Tabla 5, tuvo un efecto benéfico ya que provocó un aumento en el porcentaje promedio de PC de 7.0 (agosto 1999, noviembre 1999 y noviembre 2000) a 8.7 %. Por otra parte, Morales-Rodríguez (2003) reportó niveles de PC que variaron de 7 a 8 % de PC en base seca (Tabla 2.6.) en 84 nuevas líneas del pasto buffel (Cenchrus ciliaris) sembradas, bajo condiciones de temporal sin fertilizar, en Terán, N.L., México en noviembre del 2000. La PC fue más elevada en los genotipos identificados como 409220 (9.0 %), mientras que 364445 (6.0 %) fue el más bajo. En general la media fue de 7.7 %. Este valor es similar a otros reportes que evaluaron genotipos del pasto buffel colectados durante el otoño en la región del noreste de México; Ramírez et al (2001a) reportó 7.6 % in buffel Común; Ramírez et al (2001b) y García-Dessommes et al (2003b) reportaron 8.0 % and 7.4 %, respectivamente en el híbrido buffel Nueces. Cincuenta y seis genotipos tuvieron 8.0 %, 21 tuvieron 7.0 % y solo uno tuvo 6.0 % de PC. Por tanto, con excepción del genotipo 364445 (6.0 % CP), todos tuvieron suficiente PC para sostener la actividad microbial del rumiante si consume forraje con al menos 7.0 % de PC. Tabla 2.5. Contenido de proteína cruda (% base seca) del híbrido buffel Nueces y cinco nuevos genotipos de buffel (Cenchrus ciliaris) colectados en diferentes fechas en Terán, N,L., México *HQRWLSRV /XJDUGHFROHFWD Proteína en hojas y tallos )HFKDVGHFROHFWD $JRVWR 1RYLHPEUH 1RYLHPEUH -XQLR )HUWLOL]DGRV &HQFKUXVFLOLDULV1XHFHV 7HUiQ1/0p[LFR &HQFKUXVFLOLDULV 7HUiQ1/0p[LFR &HQFKUXVFLOLDULV 7HUiQ1/0p[LFR &HQFKUXVFLOLDULV 7HUiQ1/0p[LFR &HQFKUXVFLOLDULV 7HUiQ1/0p[LFR &HQFKUXVFLOLDULV 7HUiQ1/0p[LFR 3URPHGLR Datos tomados de: García-Dessommes et al. (2003ab) LOS PASTOS EN LA NUTRICIÓN DE LOS RUMIANTES El porcentaje de PC de los pastos generalmente disminuye a medida que maduran. Esta disminución se debe a un aumento en la proporción del tallo, cuyo contenido de PC es inferior al de las hojas (Minson, 1992). Lo 45 CAPÍTULO 2 Tabla 2.6. Contenido de proteína cruda (PC, % base seca) de 84 nuevos genotipos de pasto Cenchrus ciliaris colectados en Terán, N.L., México en noviembre del 2000. *HQRWLSRV 3& *HQRWLSRV 3& *HQRWLSRV 3& 46 *HQRWLSRV 3& 3URPHGLRGHWRGDVODVOtQHDV Datos tomados de: Rodríguez-Morales (2003) anterior se muestra en los datos que se aparecen en la Tabla 2.7.; sin excepción, en todos los pastos cultivados en el noreste de México, las hojas tuvieron mayor contenido de PC que los tallos. Lo anterior ha sido reportado con anterioridad por Hides et al. (1983) quienes mencionan que el tejido de la hoja es casi siempre la parte de mayor calidad del forraje. En los pastos las hojas se componen de la lámina y la vaina. En plantas dicotiledóneas, semejantes a las leguminosas, las hojas constan de lámina y pecíolo. Esos com- ponentes de la hoja diferencian en calidad y no deben ser considerados como una simple entidad. Poppi et al. (1981) reportaron que el ganado y ovejas consumieron 35 y 21% más de fracción de la hoja que de la fracción del tallo de zacate pangola (Digitaria decumbens) y Chloris gayana. Ambas fracciones, tallo y hoja fueron digeridas en igual extensión, por tanto, el aumento en el consumo fue atribuido a el corto tiempo en que la fracción de la hoja estuvo retenida en el rumen comparada con la fracción del tallo. Minson (1990) revisó un gran número de estudios y concluyó que el consumo de hojas fue más elevado que el consumo de tallos. Proteína en pastos nativos Entre especies de pastos, el contenido de PC está muy correlacionado con muchos de los atributos nutritivos de las plantas como digestibilidad, vitaminas, Ca y P. Sin embargo, todos ellos declinan hacia niveles deficientes a un mismo tiempo, por tanto, la PC sirve como una medida general aceptable de la calidad nutricional de los pastos (Ganskoop and Bohnert, 2001). Si se considera que un 7.5 % es un nivel adecuado de PC para mantenimiento los rumiantes (NRC, 2000), con excepción de pastos nativos como: Aristida longiseta e Hilaria belangeri, todos los pastos que aparecen en las Tablas 2.8. y FACULTAD DE CIENCIAS BIOLÓGICAS, UANL PROTEÍNAS EN PASTOS primavera, pero de 6.0 % en invierno. Estudios llevados a cabo en Sonora, México, (Martin-Rivera and Ibarra-Flores, 1989) repor3DVWRV /XJDU\IHFKDGHFROHFWD 3DUWHV (VWDFLRQHV 0HGLDDQXDO taron que B. gracilis, Aristida spp. ,QYLHUQR 3ULPDYHUD 9HUDQR 2WRxR y S. macrostachya durante el ve rano de 1989 tuvieron valores de &HQFKUXVFLOLDULV&RP~Q /LQDUHV1/0p[LFR +RMDV 7DOORV 5 y 10 %, 5 y 9 %, 7 y 10%, res&HQFKUXVFLOLDULV&RP~Q 0DUtQ1/0p[LFR +RMDV 7DOORV pectivamente. Sin embargo, &HQFKUXVFLOLDULV/ODQR 0DUtQ1/0p[LFR +RMDV 7DOORV Huston et al. (1981) reportaron &HQFKUXVFLODULV1XHFHV 0DUtQ1/0p[LFR +RMDV 7DOORV que el pasto P. hallii, cosechado &\QRGRQGDFW\ORQ /LQDUHV1/0p[LFR +RMDV en Texas, Estados Unidos, tuvo 7DOORV 'LFKDQWKLXPDQQXODWXP /LQDUHV1/0p[LFR +RMDV valores de PC de 7 % en verano y 7DOORV 3DQLFXPFRORUDWXP /LQDUHV1/0p[LFR +RMDV otoño. 7DOORV Datos tomados de: Ramírez et al. (2001ab); Foroughbackhch et al. (2001); Ramírez et al. (2003); Ramírez Las proteínas están constitui(2003); Ramírez et al. (2005). das de aminoácidos. Los aminoácidos ácido glutámico, ácido 2.9. pueden ser considerados de alto calidad nutricional, en aspártico y arginina son los principales componentes de las todas las estaciones del año para rumiantes en crecimiento. proteínas de los pastos. Asimismo, la concentración de PC Todos los pastos nativos exhibieron su más rápido inen los pastos es influenciada principalmente por el suminiscremento en PC en la estación de verano comparado con tro de N disponible del suelo y el estado de madurez de las otras estaciones. Estas fluctuaciones estacionales en el conplantas. Como se mencionó previamente, en los pastos la tenido de PC pueden ser inducidas por las precipitaciones concentración de PC declina marcadamente conforme se de verano. Otros estudios, en que evaluaron el contenido de incrementa la madurez, posiblemente debido al incremento PC en pastos nativos, han mostrado fluctuaciones relativo de la pared celular y el decremento del citoplasma estacionales también. Hendrichson y Briske (1997) repor(Clark y Woodmaress, 1992). Es probable que este efecto taron que H. berlangeri tuvo un valor de 13 % en verano y se pusiera de manifiesto durante el invierno y primavera en disminuyó a 2.0 % en invierno. Asimismo, Dittberner y los pastos que aparecen en las Tablas 2.8. y 2.9., respectivaOlson (1983) mostraron que B. gracilis, colectado en mente debido a que fue en estas estaciones donde se presenWyoming, Estados Unidos, tuvo valores de PC de 11 % en Tabla 2.7. Contenido de proteína cruda (% base seca) en las hojas y tallos de pastos cultivados introducidos y colectados en diferentes municipios y fechas en el Estado de Nuevo león, México LOS PASTOS EN LA NUTRICIÓN DE LOS RUMIANTES 47 CAPÍTULO 2 Tabla 2.8. Contenido estacional de proteína cruda (% base seca) en pastos nativos colectados en Marín, N.L., México en 1994 (VWDFLRQHV\DxRGHFROHFWD 3DVWRVQDWLYRV 0HGLDDQXDO $ULVWLGDORQJLVHWD ,QYLHUQR 3ULPDYHUD 9HUDQR 2WRxR %RXWHORXDJUDFLOLV &HQFKUXVLQFHUWXV +LODULDEHODQJHUL 3DQLFXPKDOOLL 6HWDULDPDFURVWDFK\D 3URPHGLRHVWDFLRQDO Datos tomados de: Ramírez et al. (2004) 48 Tabla 2.9. Contenido estacional de proteína cruda (% base seca) de pastos nativos colectados en Terán, N.L., México en 2001 y 2002 3DVWRVQDWLYRV %RXWHORXDFXUWLSHQGXOD %RXWHORXDWULILGD %UDFKLDULDIDVFLFXODWD 'LJLWDULDLQVXODULV &KORULVFLOLDWD /HSWRFKORDILOLIRUPLV 3DQLFXPKDOOLL 3DQLFXPREWXVXP 3DQLFXPXQLVSLFDWXP 6HWDULDJULVHEDFKLL 6HWDULDPDFURVWDFK\D 7ULGHQVHUDJURVWRLGHV 7ULGHQVPXWLFXV 3URPHGLRHVWDFLRQDO (VWDFLRQHV\DxRGHFROHFWD 0HGLDDQXDO ,QYLHUQR 3ULPDYHUD 9HUDQR 2WRxR FACULTAD DE CIENCIAS BIOLÓGICAS, UANL Datos tomados de: Cobio-Nagao (2004) PROTEÍNAS EN PASTOS taron los valores más bajos de PC, especialmente Bouteloua curtipendula (Figura 2.2) y Bouteloua trifida (Figura 2.3.), pero no así Brachiaria fasciculata (Figura 3.4.) el cual tuvo el más elevado nivel de PC, junto con Panicum obtusum. 49 Figura 2.2. Bouteloua curtipendula var. caespitosa (Goud et Kapadia). Nombre común: banderilla. Perenne; tallos tiesamente erectos, de 0.5-1 m de alto, usualmente fuertes y en grandes macollos, a menudo desde una base nudosa dura; estolones y rizomas no desarrollados; el ancho de las láminas variable pero más frecuentemente estrechas, típicamente gruesas y tiesas. Inflorescencia altamente variable, con pocas o numerosas ramas espigadas, con un promedio de 2-7 espiguillas por rama espigada; espiguillas variables de color bronceado, amarillo-café o poco coloreada a varios tonos de verde o púrpura; anteras usualmente amarillas o anaranjadas, raramente rojas o púrpura. Nativa; característica y común de pendientes pedregosas del Pastizal amacollado arbofrutescente, aunque se encuentra en otros tipos de pastizales y matorrales. Es productivo y de valor forrajero excelente (Ackerman-Beetle y Johnson-Gordon, 1991). Figura 2.3. Bouteloua trifida (Thruber). Nombre común: navajita china. Perenne; tallos densamente amacollados, erectos, de 10-35 cm de alto, casi siempre 20 cm, escaberulosos; vainas glabras o escaberulosas, la inferior más larga la superior más corta que los entrenudos; lígula ciliada, aproximadamente de 0.5 mm de largo; láminas plantas, acutadas, escabrosas, de 0.8-5 cm de largo por 0.5-1 cm de ancho. Espigas 3-6, de 1-3 cm de largo, apresadas o abiertas; espiguillas abiertas o semiapresadas; glumas acuminadas, glabras, la primera 3.5 mm de largo, la segunda 4.5 mm de largo, escasamente más ancha que la primera; cuerpo de la lema casi 2 mm de largo, glabra o pubescente hacia la base, los 3 lóbulos delgados, gradualmente estrechándose hacia las aristas, éstas casi 5 mm de largo; rudimento partido en la base, los lóbulos gradualmente estrechándose hacia las aristas, asi la longitud de la lema fértil. Nativa; se distribuye en los matorrales mediano parvifolio crasicaulescente y arbofrutescente. Valor forrajero bueno (Ackerman-Beetle y Johnson-Gordon, 1991). LOS PASTOS EN LA NUTRICIÓN DE LOS RUMIANTES CAPÍTULO 2 Requerimientos de proteína de los rumiantes 50 Figura 2.4. Brachiaria fasciculata (Sw.) Conocida como piojillo granadillo, almejita punta café (Figura 3). Es una planta anual, con tallos erectos o decumbentes y dispersos abajo, de 3 a 10 cm de alto, sus láminas son glabras o escasamente pubescentes, de 5 a 25 cm de largo por 5 a 20 mm de ancho, raramente si es alguna vez, ciliadas en los márgenes, Su lígula es un macollo de pelos blancos rígidos. La panícula generalmente es de 3 a 15 cm de largo, con ramas comprimidas o erecto-dispersas, sus ramas generalmente son simples, el eje principal de la panícula y ramas pueden ser escabrosas o con pelos largos, rígidos y esparcidos, posee ramillas cortas y pedicelos habitualmente peludos; las espiguillas son de 2.0 a 2.5 mm de largo, pueden estar teñidas de café amarillento o dorado en la madurez. La primera gluma es delgada de 1/3 a 1/4 del largo de la espiguilla, la segunda gluma y la lema estéril son generalmente reticulados con finas o gruesas venas cruzadas bajo la parte media, redondeados en el ápice o algo despuntados, la lema fértil es transversalmente rugosa entre las nervaduras, es casi del largo de la espiguilla, el ápice es obtuso, sin punta. Es un pasto nativo que se distribuye en pendientes rocosas abiertas, a orillas de arroyos arenosos, a menudo como maleza en suelos perturbados, en la Selva baja caducifolia. Su valor forrajero es pobre (Ackerman-Beetle y Johnson-Gordon, 1991). Las especies de este género son alrededor de veinticinco, distribuidas en las regiones tropical y subtropical de ambos hemisferios. Nueve especies son nativas de la región sur y suroeste de Estados Unidos. B. fasciculata es probablemente la especie más común dispersándose desde Florida a Arizona y hacia el sur en elevaciones menores hasta la parte norte de Suramérica (Gould y Shaw, 1992). La formulación de raciones para alcanzar los requerimientos de proteínas y aminoácidos en el rumiante, ha sido desarrollada de sistemas que estaban basados en proteína cruda digerible. Sin embargo, en la actualidad se hace necesario expresar los requerimientos proteicos en términos de proteína metabolizable o absorbida (PM). Estos métodos tienen en cuenta el impacto de la fermentación en rumen de los componentes proteicos en la dieta, y establecen alcanzar los requerimientos de N para la síntesis de proteína microbial en el rumen. Por tanto, la necesidad de proteína de desvío en el rumen en animales con una gran demanda para crecimiento o lactancia, también se ha calculado (NRC, 2000). Los sistemas de balanceo de este tipo requieren un conocimiento detallado de las características del alimento, y la aplicación de este acercamiento ha resultado en esfuerzos considerables para relacionar las características químicas de las materias primas del alimento con la fermentabilidad en el rumen. Los aspectos clave de la determinación de los valores de PM para los componentes del alimento, pueden ser definidos como: a) la contribución de la proteína en alimento a la proteína microbiana digerible real y b) la contribución de la fuente de proteína al suministro de proteína digerible no degradada. Los elementos esenciales de estos sistemas proteicos están resumidos en la Tabla 2.10. FACULTAD DE CIENCIAS BIOLÓGICAS, UANL PROTEÍNAS EN PASTOS Tabla 2.10. Determinación de valores de Proteína Metabolizable &RPSRQHQWH )DFWRUHVTXHDIHFWDQHO9DORUGHO$OLPHQWR 3URWHtQDGHJUDGDEOHHQHOUXPHQ 6ROXELOLGDG GHJUDGDGD ± IUDFFLyQ UiSLGDPHQWH GHJUDGDGDOHQWDPHQWH ËQGLFHGHVHFUHFLyQGHOUXPHQ 1LYHOGH$OLPHQWDFLyQ 6tQWHVLVGHSURWHtQDPLFURELDO 6XPLQLVWURGHHQHUJtDGHQWURGHOUXPHQ 6XPLQLVWURGH1GHQWURGHOUXPHQ 3URWHtQDGLJHULEOHQRGHJUDGDGD $OFDQFHGHODGHJUDGDELOLGDGGHOUXPHQ 3URSRUFLyQGH1LQVROXEOHHMHPSOROLJQLQDOLJDGD &RPSRVLFLyQGHDPLQRiFLGRGHOPDWHULDOGHVYLDGR 8VRGHDPLQRiFLGRV (ILFLHQFLDGHDEVRUFLyQ (ILFLHQFLDGHXWLOL]DFLyQSDUDPDQWHQLPLHQWRFUHFLPLHQWR ODFWDQFLD SUHxH] Referencias Ackerman-Beetle, A. y Johnson-Gordon, D. 1991. Gramíneas de Sonora. SAGRH COTECOCA. Gobierno del Edo de Sonora, Hermosillo, Son. AOAC. 1997. Official Methods of Analysis 17th edición. Association of Agricultural Chemists, Washington, DC. Asplund, J.M. 1994. Principles of protein Nutrition of ruminants. CRC Press. Boca Raton. EUA. p. 61. Broderick, G.A. 1983. Estimation of protein degradation using in situ and in vitro methods in protein requirements for cattle. F. N. Owens, editor. Symposium, at Oklahoma State Univ., Stillwater, pp. 72-80 Broderick, G.A. 1994. Quantifying forage protein quality. In. Forage quality, evaluation, and utilization. Fahey, C.G. jr. (editor). National Conference on Forage Quality. Univ. of Nebraska-Lincoln. Lincoln, Nebraska, EUA. pp: 200-228. Chalupa, W. 1977. Manipulating rumen fermentation. J. Anim. Sci. 46:585599. Clark, F.E. y Woodmansee, R.G. 1992. Nutrient cycling. In: Coupland, R.G. (editores) Natural Grasslands: Introduction and Western Hemisphere, Elsevier, Amsterdam, pp. 137-146. Cobio-Nagao, C. 2004. Composición química y digestibilidad de la materia seca de pastos nativos colectados en Gral. Terán, N. L. Tesis. Facultad de Ciencias Biológicas, Universidad Autónoma de Nuevo León. Corah, L.R. 1990. Ammoniation of low quality forages. Agric. Pract. 11: 35-42. Crampling, R.C. Processing cereal grain for cattle - a review. Livestock Prod. Sci. 19: 47-60. Czarnecka, M., Czarnecki, Z. y Zuromska, M. 1990. Effects of chemical preservation of high-moisture grain on carbohydrates and nitrogen compounds: in vitro experiments. Anim. Feed Sci. and Trech. 34: 343350. Cunningham J. 1995. Fisiología Veterinaria Interamericana Mc Graw-Hill. México. Dittberner, P.L., Olson, M.L. 1983. The plant information network (PIN) data base: Colorado, Montana, North Dakota, Utah, and Wyoming. FWS/OBS-83/86. Foroughbackhch, R. Ramírez, R.G., Hauad, L., Alba-Avila, J., García-Castillo, C.G. y Espinosa-Vázquez, M. 2001. Dry matter, crude protein and cell wall digestion of total plant, leaves and stems in llano buffelgrass (Cenchrus ciliaris). J. Applied Animal Research. 20:181188. Ganskoop, D., Bohnert, R. 2001. Nutritional dynamics of 7 northern Great Basin grasses. J. Range Manage., 54:640-647. García-Dessommes, G.J., Ramírez-Lozano, R.G., Foroughbakhch, R., Morales Rodríguez, R. y García-Díaz, G. 2003. Ruminal digestion and chemical composition of new genotypes of buffelgrass (Cenchrus ciliaris L.). Interciencia, 28: 220-224. García-Dessommes, G.J., Ramírez-Lozano R.G., Foroughbakhch, R., Morales-Rodríguez, R. y García-Díaz G. 2003. Valor nutricional y digestión ruminal de cinco líneas apomíticas del pasto buffel (Cenchrus ciliaris L.). Técnica Pecuaria en México, 41: 209-218. Gould, F.W. y R.B. Shaw. 1992. Gramíneas Clasificación Sistemática. AGT Editor, S.A. México, D.F. pp. 45-332. Henning, J.C., Dougherty, C.T., O´Leary, J., Collins, M. 1990. Urea for preservation of moist hay. J. Anim. Feed Sci. Tech. 31: 193-199. Hendrickson, J.R., Briske, D.D. 1997. Axillary bud banks of two semiarid perennial grasses: occurrence, longevity and contribution to population persistence. Oecologia. 110: 584-591. Hides, D.H., Lovatt, J.A. y Hayward, M.V. 1983. Influence of stage of maturity on the nutritive value of Italian ryegrasses. Grasses Forage LOS PASTOS EN LA NUTRICIÓN DE LOS RUMIANTES 51 CAPÍTULO 2 52 Sci. 38: 33-38. Huber, J.T. y Kung, L. Jr. 1981. Protein and nonprotein nitrogen utilization in dairy cattle. J. Dairy Sci. 64: 1170-1177. Hungate, R.E. 1966. The Rumen and its Microbes. Academic press, New York. Huston, J.E., Rector, B.S., Merril, L.B., Engdahal, B.S. 1981. Nutritional value of range plants in the Edwards Plateau region of Texas. Report B-1375. College Station, TX: Texas A& M University System, Texas Agricultural Experimental Station., p. 16. Kennedy, P.M., Christopherson, R.J. y Milligan, L.P. 1982. Effects of cold exposure on feed protein degradation, microbial protein synthesis and transfer of plasma urea to the rumen of sheep. Br. J. Nutr. 47:521. Klopfenstein, T.J. y Owen, F.G. 1981. Value and potential use of crop residues and by-products in dairy rations. J. Dairy Sci. 64: 1250-1257. Mahadevan, S., J. D. Erfle, and F. D. Saver. 1980. Degradation of soluble and insoluble proteins by Bacteriodes amylophylus protease and by rumen microorganisms. J. Anim. Sci. 50:723-730. Martín-Rivera, M., Ibarra-Flores, F. 1989. Manejo de Pastizales. En: Veinte años de investigación pecuaria en el CIPES. Proyecto No. P89017, Universidad de Sonora, México. McAllan, A.B., y Smith, R.H. 1983. Estimation of flows of organic matter and nitrogen components in postruminal digesta and effects of level of dietary intake and physical form of protein supplement on such estimates. Br. J. Nutr. 49:119-125. McDonald, P. 1981. The Biochemistry of Silage. John Wiley & Sons, NY. EUA. p. 167. McDonald, P., R.A. Edwards and J.F.D. Greenhalgh. 1995. Animal Nutrition. 5th ed. Logman Scientific & Technical. pp: 132-157. Minson, D.J. 1990. Forage in Ruminant Nutrition. Academic Press, San Diego, California, EUA. Minson, D.J, 1992, Composición química y valor nutritivo de gramíneas tropicales. En: Gramíneas Tropicales. P.J. Skerman y F. Riveros (editores). Colección FAO: Producción y Protección Vegetal. Morales-Rodríguez, R. 2003. Producción de materia seca y digestibilidad in situ del forraje de 84 genotipos del pasto buffel (Cenchrus ciliaris). Tesis de maestría. Facultad de Ciencias Biológicas, Universidad Autónoma de Nuevo León. NRC. 2000. Nutrient Requirements of Domestic Animals, Nutrient Requirements of Beef Cattle. 7 th edición. National Academy of Sciences. National Research Council, Washington, D.C. Owens, F.N. y Berger, W.G. 1983. Nitrogen metabolism of ruminant animals : Historical perspective, current understanding and future implications. J. Anim. Sci. 57:498-518. Poppi, D. P., Minson, D. J. y Ternouth, J. H. 1981. Studies of cattle and sheep eating leaf and stem fractions of grasses. I. The voluntary intake, digestibility, and retention time in the reticulo-rumen. Aust. J. Agric. Res. 32: 99-108. Ramírez, R.G., Foroughbackhch, R., Háuad, L. Alba-Avila, J., García-Castillo, C.G. y Espinosa-Vázquez, M. 2001. Seasonal dynamics of dry matter, crude protein and cell wall digestion in total plant, leaves and stems of common buffelgrass (Cenchrus ciliaris L.). J. Appl. Anim. Res., 19:40-49. Ramírez, R.G., Foroughbackhch, R., Háuad, L. Alba-Avila, J. García-Castillo, C.G. y Espinosa-Vázquez, M. 2001. Seasonal variation of in situ digestibility of dry matter, crude protein and cell wall of total plant, leaves and stems of Nueces buffelgrass (Cenchrus ciliaris). J. Appl. Anim. Res., 20:38-47. Ramírez R.G., González-Rodríguez, H. y García-Dessommes, G. 2002. Chemical composition and rumen digestion of forage from kleingrass (Panicum coloratum). Interciencia, 27:705-709. Ramírez, R.G., González-Rodríguez, H. y García-Dessommes, G.J. 2003. Nutrient digestion of common bermudagrass (Cynodon dactylon L.) Pers. growing in northeastern Mexico, J. Appl. Anim. Res. 23: 93102. Ramírez, R.G., García-Dessommes, G.J. y González Rodríguez, H. 2003. Valor nutritivo y digestión ruminal del zacate buffel común (Cenchrus ciliaris L.), Pastos y Forrajes 26: 149-158. Ramírez-Lozano, R.G. 2003. Nutrición de Rumiantes: Sistemas Extensivos. Trillas, México, D.F. p. 212. Ramírez R.G., Haenlein, G.F.W., García-Castillo, C.G. y Núñez-González M.A. 2004. Protein, lignin and mineral contents and in situ dry matter digestibility of native Mexican grasses consumed by range goats. Small Rumin. Res. 52: 261-269. Ramírez, R.G. y González-Rodríguez, H. García-Dessommes, G. and Morales-Rodríguez, R. 2005. Seasonal Trends in the Chemical Composition and Digestion of Dichanthium annulatum (Forssk.) Stapf. J. Appl. Anim. Res. (En prensa). Reid, L.M., Jung, G.A. y Allison, D.W. 1988. Nutritive quality of warm season grasses in the Northeast, W.V. Univ. Agric. Forestry Exp. Stn. Bull., p. 699. FACULTAD DE CIENCIAS BIOLÓGICAS, UANL PROTEÍNAS EN PASTOS Reid, R.L. 1994. Nitrogen compounds of forages and feedstuffs. En: Principles of Protein Nutrition of Ruminants. Asplum, J.M. (editor). CTS Press. Boca Ratón, EUA. pp. 43-64. Stern, M. D., and L.D. Satter. 1982. In vivo estimation of protein degradability in the rumen. Protein requirements for cattle: symposium. F. N. Owens, de. Oklahoma State Univ., Stillwater. Storm, E. y Ørskov, E.R. 1984. The nutritive value of rumen microorganisms in ruminants. 4. The limiting amino acids of microbial protein in growing sheep determined by a new approach. Br. J. Nutr. 52:613-620. Tamminga, S. 1979. Protein degradation in the forestomachs of ruminants. J. Anim. Sci. 49:1615-1622. Van Soest, P. J. 1994. Nutrional Ecology of the Ruminant. 2a edición. O and B Books., Inc., Corvallis, OR. Varga, G.A., y Prigge, E.C. 1982. Influence of forage species and level of intake on ruminal turnover rates. J. Anim. Sci. 55:1498-1506. 53 LOS PASTOS EN LA NUTRICIÓN DE LOS RUMIANTES 54 Capítulo 3 Glúcidos en pastos Introducción La edad de la planta y la madurez generalmente tienen una gran influencia sobre la calidad del forraje, aun más que los factores ambientales. Los factores ambientales, sin embargo, causan desviaciones en la calidad del forraje. Conforme la producción animal continua mejorando a través del mejoramiento genético, la necesidad de forrajes de alta calidad deberá incrementarse. Los productores controlan la calidad de forraje seleccionando la cosecha o la fecha de pastoreo. Esto deberá incrementar el énfasis de un mejor entendimiento del efecto de los factores del medio ambiente sobre la calidad del forraje. Desafortunadamente los mecanismos por los cuales los factores ambientales influencian la calidad de forraje no están bien entendidos, especialmente a nivel molecular y nuestro entendimiento no es suficiente para predecir la influencia de los factores del medio ambiente (Buxton y Fales, 1994). Usualmente, la temperatura tiene gran influencia sobre la calidad del forraje, más que otros factores ambientales y es, ésta área en particular, donde más información se hace necesaria. El incremento en la temperatura normalmente provoca la madurez, sin embargo los efectos primarios sobre la digestibilidad pueden ser a través del efecto de la relación hojas:tallos. Las altas temperaturas promueven el crecimiento del tallo sobre el crecimiento de las hojas. La digestibilidad de tallos y hojas es baja en los forrajes de clima cálido debido a las altas concentraciones de pared celular y bajo contenido de glúcidos no estructurales. Un aumento en las temperaturas puede tener un efecto positivo sobre la calidad del forraje, al elevar la concentración de proteína cruda. Los nutrientes del suelo solamente tienen pequeños efectos sobre la calidad del forraje. La fertilización con N, usualmente incrementan los niveles de proteína cruda de algunos forrajes no leguminosos. Las especies forrajeras con bajas concentraciones de N, tales como los pastos de invierno pueden mejorar la di- LOS PASTOS EN LA NUTRICIÓN DE LOS RUMIANTES 55 CAPÍTULO 3 gestibilidad, debido a que la fertilización con N puede estimular la actividad de los microbios del rumen. Adicionalmente, la aplicación de S a suelos deficientes de este, a menudo estimulan la digestibilidad. Las enfermedades foliares probablemente tienen los efectos más adversos en la calidad del forraje de la planta. Los pesticidas en las plantas pueden reducir la digestibilidad. Forrajes 56 En general, los forrajes son las partes vegetativas de los pastos que contienen una alta proporción de fibra (más de 30% de fibra detergente neutro). Son requeridos en la dieta en una forma física tosca (partículas de más de 1 o 2 mm de longitud). Usualmente los forrajes se producen: 1) en la finca; 2) pastoreados directamente, y 3) cosechados y preservados como ensilaje o heno. Según la etapa de crecimiento, pueden contribuir desde casi 100% (en animales no lactantes) a no menos de 30% (en vacas en la primera parte de lactancia) de la materia seca en la dieta. Las características generales de forrajes son los siguientes: 1. El volumen limita cuanto puede comer el rumiante. La ingestión de energía y la producción de leche pueden ser limitadas si hay demasiado forraje en la ración. Sin embargo, alimentos voluminosos son esenciales para estimular la ruminación y mantener la salud del rumiante. 2. Pueden contener de 30 hasta 90% de fibra detergente neutro (FDN). En general, entre más alto es el contenido de fibra, más bajo es el contenido de energía del forraje. 3. Según la madurez, las leguminosas pueden tener 15 a 23% de proteína cruda, los pastos, en cambio, contienen 8 a 18% proteína cruda (según el nivel de fertilización con nitrógeno) y los residuos de cosechas (pajas o rastrojos) pueden tener solo de 3 a 4% de proteína cruda. Desde un punto de vista nutricional, los forrajes pueden variar entre alimentos muy buenos (pasto joven y suculento, leguminosas en su etapa vegetativa) a muy pobre (pajas y rastrojos). Pastos y Leguminosas Forrajes de alta calidad pueden constituir dos terceras partes de la materia seca en la dieta del rumiante, que consume de 2.5 a 3% de su peso corporal (ejemplo, una vaca de 600 kg. puede comer 15 a 18 kg de materia seca de un forraje buena calidad). Las vacas comen más de una leguminosa que de pastos en la misma etapa de madurez. Sin embargo, forrajes de buena calidad, alimentados en dietas balanceadas, suministran mucho de la proteína y energía necesarias para la producción de leche. Las condiciones de suelos y clima típicamente determinan los tipos de forrajes más comunes en una región. Tanto pastos (raygrass, bermuda, festuca, etc.) y leguminosas (alfalfa, trébol, lespedeza) son ampliamente conocidos alrededor del mundo. Los pastos necesiten fertilizantes nitrogenados y condiciones adecuadas de humedad para cre- FACULTAD DE CIENCIAS BIOLÓGICAS, UANL GLÚCIDOS EN PASTOS cer bien. Sin embargo, las leguminosas son más resistentes a la sequía y pueden agregar 200 kg de N año-1 ha-1 al suelo porque conviven asociados con bacterias que pueden convertir N del aire a fertilizante nitrogenado. El valor nutritivo de los forrajes es altamente influido por la etapa de crecimiento cuando son cosechados o pastoreados. El crecimiento puede ser dividido en tres etapas sucesivas: 1) etapa vegetativa; 2) etapa de floración y 3) etapa de formación de semillas. Usualmente, el valor nutritivo de un forraje es más alto durante el crecimiento vegetativo y más bajo en la etapa de formación de semillas. Conforme avanza la madurez, la concentración de proteína, energía, calcio, fósforo y materia seca digestible en la planta se reducen mientras la concentración de FDN aumenta. Mientras aumenta la FDN, aumenta el contenido de lignina, así haciendo los carbohidratos menos disponibles a los microbios del rumen. Como resultado, el valor energético del forraje se reduce. Por tanto, cuando los forrajes son producidos con el propósito de alimentar ganado, deben ser cosechados o pastoreados en una etapa joven. El maíz y el sorgo, cosechados para ensilaje son dos excepciones, porque a pesar que el valor nutritivo de las partes vegetativas de la planta (tallo y hojas), en la formación de semillas una cantidad alta de almidón digestible se acumula en los granos. El rendimiento máximo de materia seca digestible de una cosecha forrajera se obtiene: 1) durante la primera parte de madurez en el caso de los pastos; 2) en la etapa de medio a madura botón para leguminosas y 3) antes de que los granos sean com- pletamente endentados como es el caso de maíz y sorgo. Hay poco que se puede hacer para prevenir la perdida del valor nutritivo de un forraje conforme avanza de su madurez. Por cada día de atraso de la cosecha después del momento óptimo de madurez, la producción animal potencial del ganado que consume el forraje será reducida. Sin embargo, hay varias estrategias que son disponibles para mantener la disponibilidad de forrajes con buen valor nutritivo: 1. Desarrollar una estrategia de pastoreo que corresponde al número de animales en los potreros y la tasa de crecimiento del pasto. 2. Sembrar una mezcla de pastos y leguminosas que tiene tasas diferentes de crecimiento y madurez durante la estación. 3. Cosechar en una etapa temprana de madurez y preservar como heno o ensilaje. 4. Alimentar los forrajes de menor calidad a las vacas secas o las vacas en las últimas etapas de lactancia y los forrajes buenos a las vacas iniciando su lactancia. Residuos de cosechas y subproductos agroindustriales Los residuos son las partes de las plantas que se quedan en el campo después de cosechar el cultivo principal (por ejemplo paca de maíz, paja de cereales, bagazo de caña de azúcar, heno de maní). Los residuos pueden ser pastoreados, procesados como un alimento seco, o convertidos a ensilaje. Algunas características generales de la mayoría de residuos son los siguientes: LOS PASTOS EN LA NUTRICIÓN DE LOS RUMIANTES 57 CAPÍTULO 3 1 Son alimentos baratos y voluminosos 2 Son altos en fibra indigestible debido a su contenido alto de lignina. Aunque los tratamientos químicos pueden mejorar su valor nutritivo 3 Bajos en proteína cruda 4 Requieren suplementación adecuada especialmente con proteína y minerales 5 Requieren estar picados cuando son cosechados o antes de alimentar 6 Pueden ser incluidos en las dietas de vacas no lactantes que tienen demandas menores para energía. Concentrados 58 No hay una buena definición de concentrados, pero pueden ser descritos por sus características como alimentos y sus efectos en las funciones del rumen. Usualmente concentrado refiere a: 1. Son bajos en fibra y altos en energía. 2. Pueden ser altos o bajos en proteína. Los granos de cereales contienen <12% proteína cruda, pero las harinas de semillas oleaginosas (soya, algodón, maní) llamados alimentos proteicos pueden contener hasta >50% de proteína cruda. 3. Tienen alta palatabilidad y usualmente son consumidos rápidamente. En contraste a los forrajes, los concentrados tienen bajo volumen por unidad de peso (alta gravedad específica). 4. No estimulen la ruminación. 5. Usualmente se fermentan más rápidamente que los forrajes en el rumen. Por lo que aumentan la acidez (reducen el pH) del rumen que puede interferir con la fermentación normal de fibra. 6. Cuando el concentrado forma más de 60-70% de la dieta puede provocar problemas de salud. Los rumiantes en lactancia también tienen altos requerimientos de energía y proteína. Considerando que las vacas pueden comer solo cierta cantidad cada día, los forrajes solos no pueden suministrar la cantidad requerida de energía y proteína. El propósito de agregar concentrados a la dieta del ganado lactando es la de proveer una fuente de energía y proteína para suplementar los forrajes y cumplir con los requisitos del animal. Así, los concentrados son alimentos importantes que permiten formular dietas que maximizan la producción lechera. Generalmente, la máxima cantidad de concentrados que una vaca puede recibir cada día no debe exceder de 12 a 14 kg. Tipos de glúcidos Los glúcidos son la fuente más importante de energía y de los principales precursores de grasa y azúcar (lactosa) en la leche. Los microorganismos en el rumen permiten al rumiante obtener energía de los glúcidos fibrosos (celulosa y hemicelulosa) que son ligados a la lignina en las paredes celulares las de plantas (Tabla 3.1.). La fibra resulta volu- FACULTAD DE CIENCIAS BIOLÓGICAS, UANL GLÚCIDOS EN PASTOS Tabla 3.1. Glúcidos contenidos en la plantas &RPSRQHQWHV $]~FDUHVVROXEOHV $OPLGyQ 3HFWLQD +HPLFHOXORVD &HOXORVD )XQFLyQ 1RHVWUXFWXUDOHV 1RHVWUXFWXUDOHV (VWUXFWXUDOHV (VWUXFWXUDOHV (VWUXFWXUDOHV )UXWRV 6HPLOODV /HJXPLQRVDV 3DVWRV ÈUEROHV\DUEXVWRV 7DOOXHORV\KRMDV Fuente: Robbins (2001). minosa y se retiene en el rumen debido a que la celulosa y la hemicelulosa se fermenten lentamente. Mientras que en la planta madura, el contenido de lignina de la fibra incrementa y el grado de fermentación de celulosa y hemicelulosa en el rumen se reduce. La presencia de fibra en la dieta es necesaria para estimular la ruminación. La ruminación aumenta la separación y fermentación de fibra, estimula las contracciones del rumen y aumenta el flujo de saliva hacia el rumen. La saliva contiene bicarbonato de sodio y fosfatos que ayudan a mantener la acidez (pH) del contenido del rumen a un pH casi neutral. Dietas bajas en fibra resultan en un porcentaje bajo de grasa en la leche y contribuyen a desordenes de digestión, tales como desplazamiento del abomaso y acidosis del rumen (Van Soest, 1994). Los glúcidos no estructurales (almidones y azucares) se fermentan rápida y completamente en el rumen. El contenido de carbohidratos no estructurales incrementa la densidad energética de la dieta, mejorando el suministro de energía y aumentando la proteína microbial producida en el rumen. Sin embargo, los glúcidos no estructurales no estimulen la ruminación o la producción de saliva y cuando se encuentran en exceso pueden inhibir la fermentación de la fibra. Por tanto, el equilibrio entre glúcidos estructurales y no estructurales es importante en alimentación de los rumiantes para la producción eficiente (Church, 1988). Producción de glucosa en el hígado Todo el propionato se convierte a glucosa en el hígado. Además, el hígado utiliza aminoácidos para síntesis de glucosa. Este es un proceso importante porque normalmente no hay glucosa absorbida del tracto digestivo y toda las azucares encontradas en leche (aproximadamente 900 g cuando una vaca produce 20 kg de leche) deben ser producidas por el hígado. Una excepción existe cuando la vaca esta alimentada con grandes cantidades de concentrados ricos en almidón o una fuente de almidón resistente a la fermentación ruminal. Posteriormente, el almidón escapa de la fermentación y alcanza el intestino delgado. La glucosa formada mediante la digestión en el intestino es absorbida, y transportada al hígado donde contribuye al suministro de glucosa de la vaca. La lactosa es una fuente alternativa de glucosa para el hígado. La lactosa se encuentra en ensilajes bien preservadas, pero la producción de lactosa en el rumen ocurre cuando hay un exceso de almidón en la dieta. Este no es deseable porque el ambiente del rumen resulta ácido, la fermentación de fibra se para y, en casos extremos, el LOS PASTOS EN LA NUTRICIÓN DE LOS RUMIANTES 59 CAPÍTULO 3 60 animal deja de comer (McDonald et al., 1995). Glúcidos y calidad de los pastos Síntesis de lactosa y grasa en el hígado Los glúcidos son el principal reservorio de energía fotosintética de las plantas, las características nutritivas de los glúcidos para la alimentación animal son variables y dependen de sus componentes de azúcar y sus uniones. Sin embargo, la variedad de azúcares y enlaces en las plantas es mucho más amplia que la de los tejidos animales. Los glúcidos de las plantas contienen muchos azúcares y enlaces no comunes para los sistemas animales (Akim, 1990). La disponibilidad nutricional depende de la capacidad para romper los enlaces glicosídicos en los glúcidos de las plantas y entre los glúcidos y otras substancias. Forman la mayor parte de la provisión de alimentos para los animales, y es la clase más abundante de componentes hallados en las plantas (Van Soest, 1994). Juegan papeles importantes en el metabolismo intermediario, transferencia de energía, almacenamiento y estructura de la planta. La energía fotosintética es fijada en los glúcidos vía ciclo de Calvin y sirven como substratos iniciales para casi todas las rutas intermedias de las plantas. La energía es transportada dentro de las plantas como el disacárido sacarosa, y guardada en polímeros tales como el almidón y las fructanas (Pontis y Del Campillo, 1985). Los glúcidos, además, constituyen la mayor parte de la pared celular de las plantas y como tales juegan un papel importante en la integridad estructural de células individuales, tejidos y órganos (Hatfield, 1989). Son extremadamente importantes desde una perspectiva nutricional, y son la principal fuente de energía en la dieta de un rumiante. En Durante la lactancia, la glándula mamaria tiene una alta prioridad para la utilización de glucosa. La glucosa se utiliza principalmente para la formación de lactosa (azúcar en la leche). La cantidad de lactosa sintetizada en la ubre es estrechamente ligada con la cantidad de leche producida cada día. La concentración de lactosa en la leche es relativamente constante y básicamente, agua se agrega a la cantidad de lactosa producida por las células secretorias hasta lograr una concentración de lactosa de aproximadamente 4.5%. Así, la producción de leche en las vacas lecheras es altamente influida por la cantidad de glucosa derivada del propionato producido en el rumen. También, glucosa se convierte a glicerol que se utiliza para la síntesis de grasa de leche. El acetato y ˜-hidroxibutirato se utilizan para la formación de ácidos grasos encontrados en la grasa de leche. La glándula mamaria sintetiza ácidos grasos saturados que contienen de 4 a 16 átomos de carbón (ácidos grasos de cadena corta). Casi la mitad de grasa de leche es sintetizada en la glándula mamaria. La otra mitad que es rica en ácidos grasos no saturados que contienen de 16 a 22 átomos de carbón (ácidos grasos de cadena larga) viene de lípidos en la dieta. La energía requerida para la síntesis de grasa y lactosa viene de la combustión de cetones, pero el acetato y la glucosa también pueden ser utilizadas como fuentes de combustible para las células de muchos tejidos (McDonald et al., 1995). FACULTAD DE CIENCIAS BIOLÓGICAS, UANL GLÚCIDOS EN PASTOS los rumiantes casi toda la digestión de glúcidos ocurre dentro del rumen (más del 90%), aunque bajo ciertas circunstancias, tales como altas tasas de paso; una cantidad significante de digestión de glúcidos puede ocurrir en intestino delgado e intestino grueso (Nocek y Tamminga, 1991). Los azúcares son rápidamente fermentados en el rumen para dar ácidos grasos volátiles (AGV) los cuales son absorbidos hacia la sangre a través de la pared ruminal. Los polisacáridos deben ser degradados en azucares simples antes de ser utilizados. Los polisacáridos no estructurales tales como el almidón y las fructanas, son rápida y enteramente degradados, dentro del rumen (Nocek y Tamminga, 1991), mientras que la degradabilidad de polisacáridos estructurales varía considerablemente. La celulosa y hemicelulosa son constituyentes de la pared celular y son degradados lenta e incompletamente. La degradabilidad de la celulosa de los forrajes varía de 25 a 90 %, mientras que la digestibilidad de la hemicelulosa varía de 45 a 90%. La degradación de ß-glucanas es intermedia a la celulosa (Van Soest et al., 1991). La habilidad para degradar y utilizar glúcidos estructurales confiere a los rumiantes un nicho ecológico único (Chesson y Fonsberg, 1988). Además de ser una fuente importante de energía en la dieta de los rumiantes, los glúcidos tienen otros papeles nutricionales como componentes de la fibra de la dieta. Los glúcidos estructurales son importantes para la función ruminal normal. La fibra estimula, como se mencionó previamente, la rumiación y la salivación y, promueve el intercambio de cationes que son importantes en la capacidad de amortiguación ruminal (Van Soest et al., 1991). La fibra también esta involucrada en la regulación del consumo voluntario (Mertens, 1993). Química de los glúcidos del forraje Los términos fibra y pared celular de la planta frecuentemente son usados indistintamente. Estos términos, sin embargo no son sinónimos y reflejan perspectivas funcionales diferentes (Van Soest, 1994). Las plantas son únicas, entre los organismos superiores, aunque poseen paredes celulares rígidas (Bartnicki-García, 1984). Las paredes de las células de las plantas pueden ser consideradas un compuesto, consistente de fibrillas de celulosa embebidas dentro de una matriz de lignina y polisacáridos hemicelulósicos (Monties, 1991). Además, la pared celular intacta contiene componentes tales como agua, solventes orgánicos y fenólicos, los cuales le dan propiedades únicas a la estructura. La composición macromolecular de las paredes celulares de las células varía considerablemente entre órganos, tejidos, y a nivel subcelular. La pared celular primaria es formada adyacente al plasmalema durante la elongación celular y consiste casi completamente de polisacáridos. La pared secundaria es formada durante la diferenciación celular interior a la pared primaria y varía grandemente en composición dependiendo del tipo de célula. Células individuales se pegan por la lamela media, la cual consiste principalmente de sustancias pécticas que sirven como un agente cementante intercelular (Varner y Lin, 1989). LOS PASTOS EN LA NUTRICIÓN DE LOS RUMIANTES 61 CAPÍTULO 3 62 La función más obvia de la pared celular es su papel en la morfogénesis. Las paredes celulares forman el diseño estructural de la arquitectura de la planta y dan soporte mecánico y estructural para los órganos de la planta (Varner y Lin, 1989). Además, las paredes juegan papeles importantes en el balance de agua, intercambio de iones, reconocimiento celular y protección de estrés biótico (Varner y Lin, 1989). En contraste, la fibra es una entidad nutricional, la cual es definida por sus propiedades biológicas y su composición química (Van Soest et al., 1991). El concepto de fibra, particularmente en los forrajes, se refiere al complejo de nutrientes de la dieta, los cuales son relativamente resistentes a la digestión y son lenta y parcialmente degradadas por los rumiantes (Chesson y Forsberg, 1988). En esta definición, los principales componentes de la fibra son celulosa, hemicelulosa y lignina. Esa definición se incluye pectinas y ß-glucanas, además de los componentes enlistados anteriormente. Los términos holocelulosa y lignocelulosa frecuentemente son usados en relación a la calidad del forraje. La holocelulosa se refiere colectivamente a la celulosa y hemicelulosa. Mientras que la lignocelulosa abarca la lignina, además de los polisacáridos estructurales. El término lignocelulosa frecuentemente es usado indistintamente con la fibra, especialmente en áreas de utilización no relacionados a la nutrición, tales como los biocombustibles. Biosíntesis de los glúcidos Los glúcidos son producidos a través del proceso fotosintético de fijación del carbón. La formación de tipos individuales de azucares, generalmente ocurre a través de la acción de las enzimas epimerasas, isomerasas, oxidoreductasas y/o descarboxilasas, de monosacáridos activados que salen del ciclo de Calvin o de la ruptura de carbohidratos de almacenamiento. La biosíntesis de los oligosacáridos y polisacáridos requieren azucares activados, en la forma de monosacáridos difosfato nucleósidos (Delmer y Stone, 1988). El patrón más predominante es de interconversiones de glucosa, derivada directamente de actividad fotosintética o de degradación de almidón. Hay unas cuantas rutas alternas tales como, la conversión de inositol o ácido glucorónico y vías de degradación que pueden reclamar el ácido galacturónico y galactosa a través de fosforilación directa. Extracción de glúcidos estructurales Para aislar la pared celular para análisis de la composición, los métodos de preparación de la pared deben tener presentaciones comunes de inactivación de enzimas hidrolíticas, reducción del tamaño de la partícula y retiro de contaminantes citoplasmáticos (Wilkie, 1985). El sistema detergente Van Soest (Van Soest, et al., 1991) es el más ampliamente usado para la extracción de los constituyentes de la pared celular, en el estudio de la calidad del forraje. El sistema detergente, sin embargo no ha desarrollado un método para aislar las paredes celulares por sí, sino más bien, como un método de partición de la materia seca del forraje en frac- FACULTAD DE CIENCIAS BIOLÓGICAS, UANL GLÚCIDOS EN PASTOS ciones basadas en su biodisponibilidad para los rumiantes. Consecuentemente, la fracción de fibra detergente ácido (FDA) la cual frecuentemente es usada, sinonímicamente, como pared celular, es de hecho, una subfracción de la pared celular, dado que los polisacáridos más solubles y nutricionalmente disponibles de la pared son retirados. La extracción neutro detergente, puede ser el método más apropiado para aislar células constituyentes de la pared celular. En seguida se describen las técnicas de laboratorio para la determinación de las fibras detergente neutro y ácido. Determinación de paredes celulares: fibra detergente neutro (FDN) El procedimiento detergente neutro para determinar los componentes de la pared celular es un método rápido para fibra total, en alimentos fibrosos vegetales. Aparentemente divide la materia seca al punto de que separa los constituyentes nutricionales solubles y accesibles, de aquellos que no son totalmente aprovechables, o que dependen de la fermentación microbiológica para su aprovechamiento. Este método no puede aplicarse a los alimentos que tienen alto contenido de proteína y bajo en fibra. Material y equipo: 1. Aparato Labconco para determinación de fibra cruda. 2. Vasos de Berzelius de 600 ml. 3. Crisoles con filtro de vidrio, tipo alto, con porosidad gruesa, con plato de 40mm, de diámetro y de 40 a 50 ml. de capacidad. 4. Matraz quitasato para filtrar y equipo para succión al vacío. 5. Horno de secado a 100 - 105° C. 6. Balanza analítica. Reactivos: 1. Solución neutra de detergente ó ( NDF).- Agregue 30 gr. de sulfato lauril sódico U. S . P., 18.61 g. de etilendiamino tetra- acetato disódico dihidratado; 6.81 g de borato de sodio, decahidrato; 4.56 g. de fosfato desódico anhidro y 10ml. de 2-etoxietanol ( etileno glicol, éter monoetílico) grado purificadi, en 1 litro de agua destilada. Agítese hasta dilución completa y controle el pH para que se mantenga entre 6.9 y 7.1. 2. Decahidro naftaleno: grado técnico. 3. Acetona: use un gramo libre de color y que no deje residuos al evaporarla. 4. Sulfito de sodio, anhidro: grado reactivo. Limpieza de los crisoles: Después de mucho uso, los crisoles tienden a obstruirse con materia residual que es resistente al filtrado corriente can ácido crómico. Una manera adecuada de limpiarlos es la de ponerlos a incinerar a 500° C y luego forzarles agua de abajo hacia arriba, en dirección opuesta a través del filtrado. LOS PASTOS EN LA NUTRICIÓN DE LOS RUMIANTES 63 CAPÍTULO 3 Cuando los crisoles se obstruyen con partículas minerales después de mucho uso, se prepara una solución caliente de 20% de KOH, 5% de Na3 PO4 y 0.5 % de etilenodiamino tetraacetato y se hace pasar forzado de abajo hacia arriba a través del filtrado de vidrio del crisol. Se debe evitar el uso continuo de la solución alcalina pues tiende a erosionar el vidrio. Procedimiento: Se recomienda hacer las determinaciones por duplicado. 64 1. Pesar 1 gr. de la muestra molida y deposítela en un vaso de berzelius de 600 ml. 2. Agregue en el orden señalado los siguientes reactivos: 100ml. de solución detergente neutro de ( NDF ), 2 ml. de decahidro naftaleno y 0.5 gr. de sulfito de sodio, anhidro ( antiespumante). 3. Caliente para que la solución hierva en 5 a 10 minutos y reduzca la temperatura cuando comience la ebullición para evitar la formación de espuma. Ajuste la temperatura para que la solución hierva a un nivel constante y manténgase en un reflujo durante 60 minutos, tomando el tiempo desde el instante en que la solución comienza a hervir. 4. Filtre la muestra con vacío a través de un crisol de vidrio de poro grueso, previamente tarado y pesado, colocado en un filtro con succión al vacío. Use poco vacío al principio aumentando en medida que se necesite. 5. Lave el vaso y la muestra en el crisol, utilizando un mínimo de agua caliente (80° C). 6. Elimine el vacó y afloje la capa de muestra que se ha compactado en el fondo del crisol y llénelo con agua caliente ( 80° C) repitiendo el lavado varias veces. Lave la muestra con acetona dos veces y déjese secar con el vacío puesto nuevamente. 7. Seque los crisoles a 105° C durante la noche y péselos a la mañana siguiente, después de enfriarlos en un desecador. 8. El residuo de fibra recuperada se registra en términos de paredes celulares. 9. Calcule el contenido celular (material soluble) sustrayendo este valor de 100. Cálculos: Determine el porciento de paredes celulares en base “parcialmente seco” o “tal como ofrecido” en la forma siguiente: % FDN = (peso del crisol + paredes celulares)-peso crisol x100 Peso de la muestra Conversión a base seca: % paredes celulares en muestra “tal como ofrecido” x 100 % materia seca de la muestra “tal como ofrecida” % paredes celulares en muestra “parcialmente seco” x 100 % materia seca de muestra “parcialmente seco” Adaptado de: Van Soest et al. (1991). FACULTAD DE CIENCIAS BIOLÓGICAS, UANL GLÚCIDOS EN PASTOS Determinación del contenido celular Material y equipo: Los nutrientes más aprovechables se encuentran encerrados por la pared celular y pueden agruparse bajo el nombre de contenido celular. Esta fracción incluye la proteína, carbohidratos solubles, minerales solubles y los lípidos. Un valor porcentual alto del contenido celular es también indicio del alto valor nutritivo en un alimento. El contenido celular equivale al valor resultante de la diferencia entre el porcentaje de paredes celulares y 100. 1. Aparato para la determinación de fibra cruda. 2. Vasos de Berzelius de 600 ml. 3. Crisoles con filtro de vidrio, de tipo alto con porosidad gruesa. Plato de 40mm. De diámetro y capacidad de 40 a 50 ml. 4. Matraz quitasato para filtrar y equipo para succión al vacío. 5. Horno de secado a 100- 105° C. 6. Balanza analítica. Cálculos: Reactivos: % Contenido celular en base seca: 100 - % FDN Conversión a base “tal como ofrecido” % Contenido celular en base seca x % materia seca “tal como ofrecido x 100 100 100 Adaptado de: Van Soest et al. (1991). Determinación de fibra detergente ácido (FDA) Este procedimiento permite una rápida determinación de la lignina-celulosa en los alimentos. Sin embargo, en esta fracción también aparece la sílice. La diferencia entre el valore de las paredes celulares y la fibra ácido detergente, da una estimación de la hemicelulosa, ya que esta diferencia también incluye una fracción de proteína adherida a las paredes celulares. El método de fibra por ácido detergente también se emplea como paso preliminar en la determinación de la lignina. 1. Solución ácido detergente FDA, H2 SO4. Grado reactivo, estandarizado a 1 N. Este se prepara agregando 27.15 ml de H2SO4 por litro de agua destilada. Agregue 20 g Cetil trimetil bromuro de amonio (CTAB), grado técnico por litro de la solución 1 N de H2SO4. 2. Decahidronaftaleno, grado técnico. 3. Acetona, grado reactivo. 4. Hexano, grado reactivo. Procedimiento: Se recomienda hacer las determinaciones por duplicado. 1. Pese por diferencia un gramo de muestra y deposítela en un vaso de Berzelius de 600 ml. LOS PASTOS EN LA NUTRICIÓN DE LOS RUMIANTES 65 CAPÍTULO 3 66 2. Agregue 100 ml de solución FDA a temperatura ambiente y 2 ml de decahidronaftaleno. 3. Coloque los vasos en las parrillas del aparato para determinación de fibra y caliente la solución para que hierva en un término de 5 a 10 minutos. Abra la llave del agua. Cuando se inicie la ebullición, baje el calor para evitar la formación de espuma y manténgase en reflujo durante 60 minutos, contados a partir del inicio de la ebullición que debe ser lenta durante todo el procedimiento. 4. Filtre la solución, con poca succión, a través de un crisol de vidrio de poco grueso, previamente tarado. Con una varilla de vidrio, afloje la capa de muestra que se ha compactado en el fondo del crisol y lávelo dos veces con agua caliente (90-100° C). Lave los lados del crisol de la misma manera. 5. Repita igualmente el lavado con acetona hasta que desaparezca totalmente el color, desintegrando cualquier grumo que se haya formado, para que el solvente entre en contacto con todas las partículas de fibra. 6. Lave la muestra con hexano mientras aun contenga acetona (el hexano se puede omitir si la formación de grumos no constituye un problema). Mantenga la muestra bajo succión hasta que se libere todo el hexano. 7. Seque la muestra a 100-105°c por 8 horas o durante toda la noche y péselos después de enfriarlos en un desecador. Cálculos: Determine el porciento de fibra detergente ácido en base “parcialmente seco” o “tal como ofrecido!” en la forma siguiente: % FDA = ( peso del crisol + fibra - peso del crisol ) x 100 Peso de la muestra Conversión a base seca: % FDA en muestra “tal como ofrecido” x 100 % materia seca en la muestra “tal como ofrecido” % FDA en muestra “parcialmente seco” x 100 % materia seca en la muestra “parcialmente seco” Adaptado de: Van Soest et al. (1991). Glúcidos estructurales en las diferentes plantas Hay una considerable variación entre las especies de plantas con respecto, a la concentración y composición de los carbohidratos estructurales. La concentración de celulosa es típicamente más alta, en las paredes de las leguminosas, que las de pastos. Esto refleja una concentración mucho más baja de hemicelulosa en leguminosas comparadas con los pastos (Buxton et al., 1987). La concentración de celulosa frecuentemente parece similar entre pastos y leguminosas (Cherney et al., 1988). Los pastos perennes de clima cálido contienen glúcidos estructurales en mayor proporción que los de clima templado. La hidrólisis de la hemicelulosa de los forrajes produce monosacáridos neutrales: glucosa, xilosa, arabinosa, manosa, galactosa, ramnosa, fructosa, y los ácidos urónicos, galacturónicos, glucorónicos, y 4-0-metilglucorónico (Aman y Graham, 1990). Las proporciones relativas de cada monosacárido varían entre especies, reflejando diferencias FACULTAD DE CIENCIAS BIOLÓGICAS, UANL GLÚCIDOS EN PASTOS en la estructura de los polisacáridos. La xilosa y arabinosa se producen de la mayoría de azucares neutrales aislados de hemicelulosas de pastos y leguminosas (Wedig et al., 1989b). Buxton et al. (1987) realizaron estudios comparativos en los azúcares estructurales neutrales, aislados de las bases de los tallos de leguminosas y pastos. La glucosa (predominantemente originaria de la celulosa) y la xilosa abarcaron de 67% y 20% de los azúcares neutrales neutralizados de la pared celular en leguminosas y 63% y 30% en pastos, respectivamente. Windhan et al. (1983) hallaron concentraciones similares de azúcares neutrales hemicelulósicos entre tres pastos de clima frío y tres de clima cálido cuando se ajustaron para la recuperación. Chesson (1993) reconoció que la degradación de los polisacáridos de la pared celular, es afectada tanto o más por interacciones entre polímeros de pared celular, como por las propiedades individuales de los polímeros entre sí. La celulosa es degradada en el rumen por un complejo de microorganismos anaerobios que incluyen bacterias, protozoarios y hongos. Las bacterias celulolíticas, de las cuales Ruminococcus flavefaciers, R. albus y Fibrobacter succionogenes son las más importantes, y son responsables de la digestión de celulosa que ocurre en el rumen. Aunque los protozoarios ciliados y los hongos que tienen actividad celulolítica han sido identificados en las poblaciones microbianas ruminales, su contribución a la degradación de la celulosa es relativamente menor (Dehority, 1993). Las bacterias celulolíticas se adhieren a la superficie de la pared celular, colocando a las enzimas en estrecha proximidad del substrato (White et al., 1993). La celulólisis es lograda por la acción de varias enzimas extracelulares que se unen a la superficie del organismo o son secretadas dentro del medio que lo rodea. Sin embargo, tres actividades enzimáticas básicas están involucradas: endo-ß-1,4-glucanasa la cual rompe al azar el polisacárido en oligosacáridos, exo-ß-1,4-glucanasa la cual ataca el extremo no reductor de los oligosacáridos, dando celobiosa y ß-1,4-glucosidasa, la cual hidroliza la celobiosa a glucosa (White et al., 1993). La cantidad en la cual la celulosa nativa es utilizada por los microorganismos ruminales es limitada por su asociación con la lignina y otros constituyentes de la pared celular. Hay, sin embargo, factores intrínsecos los cuales pueden limitar la velocidad a la cual la celulosa es digerida. La cristalinidad de la celulosa ha sido sugerida como un factor en reducir la accesibilidad de la celulosa al ataque enzimático (Kerley et al., 1992). La degradación de celulosa se ha demostrado que es inversamente proporcional, al grado de la cristalinidad para substratos purificados. Sin embargo, al momento, hay poca evidencia que indique que la cristalinidad es un factor limitante de la tasa de degradación de celulosas nativas por microbios ruminales (Hatfield,1993). La degradación de la hemicelulosa en el rumen ocurre en una manera análoga a la de la celulosa, pero involucra, un arreglo más amplio de las actividades enzimáticas. Las mismas bacterias celulolíticas enlistadas anteriormente son responsables para la mayoría de la degradación de celulosa en el rumen y son también las más importantes bacterias hemicelulósicas (Hespell, 1988). En adición, Butirivibrio LOS PASTOS EN LA NUTRICIÓN DE LOS RUMIANTES 67 CAPÍTULO 3 68 fibrisolvens, la cual tiene un papel relativamente menor en la degradación de celulosa, tiene un papel proporcionalmente mayor en la degradación de xilanas (White et al., 1993). Algunos hongos y protozoarios ruminales también tienen actividad hemicelulolítica, pero su actividad en la degradación de hemicelulosa es relativamente menor, comparada con las bacterias ruminales (Dehority, 1993). Las hemicelulosas aisladas son generalmente, digeridas por completo, por microorganismos ruminales, la degradación de hemicelulosa ocurre a través de actividades de endo y exo glicanasas, las cuales depolimerizan y solubilizan las principales cadenas de polisacáridos (White et al., 1993). Los grupos sustitutos y cadenas laterales, son removidas de los polisacáridos hemicelulósicos, y posteriormente degradados por actividades de varias glucosidasas (Dehority, 1993). Pared celular (FDN), celulosa y hemicelulosa en los pastos En la Tabla 3.2. se muestra el contenido estacional de FDN, celulosa y hemicelulosa de seis pastos cultivados sembrados en diferentes municipios del Estado de Nuevo León, México. La media de FDN de los pastos fue de 76 % con variación entre estaciones del año de 74 a 78 %. La celulosa fue ligeramente más elevada (34 % = media anual) que la hemicelulosa (31 %) en la mayoría de los pastos. Sin embargo, en Cynodon dactylon la hemicelulosa (34 %) fue más elevada que la celulosa (32 %). Debido a las pequeñas diferencias entre pastos en el contenido de celulosa y hemicelulosa, pudiera indicar que son digeridos por las bacterias en el rumen en una misma proporción. Las posibles diferencias que pudieran existir se deben a diferencias genéticas entre pastos. El contenido de FDN de los seis genotipos del pasto Cenchrus ciliaris (Figura 3.1.) que aparecen en la Tabla 3.3. fue similar entre cortes. Sin embargo, la celulosa duplicó, en todos los cortes, al contenido de hemicelulosa. La misma tendencia, en el contenido de FDN y sus constituyentes (celulosa y hemicelulosa), se muestra en los 84 nuevos genotipos del pasto C. ciliaris que aparecen en la Tabla 3.4. La celulosa es degradada en el rumen por un complejo de microorganismos anaeróbicos entre los que se incluye a bacterias, protozoarios y hongos. Bacterias celulolíticas como Ruminococcus flavefaciens, R. albus y Fibrobacter succinogens son las más importantes y son las responsable de la mayor parte de la digestión de la celulosa que ocurre en el rumen. La digestión de la hemicelulosa en el rumen ocurre de la misma manera que la celulosa. Las mismas bacterias mencionadas con anterioridad son responsables de la digestión de la hemicelulosa, aunque se incluye también a Butyrivibrio fibrisolvens, aunque tiene un papel mucho menor que las otras. Algunos hongos y protozoarios también digieren a la celulosa y hemicelulosa en el rumen, pero en mucho menor grado que las bacterias. Los pastos cultivados C. ciliaris, C. dactylon, D, annulatum y P. coloratum (Tabla 3.5.) y sembrados en el municipio de Linares, Nuevo León, México, contienen mas FDN en los tallos que las hojas; además, la celulosa es pre- FACULTAD DE CIENCIAS BIOLÓGICAS, UANL GLÚCIDOS EN PASTOS Tabla 3.2. Contenido estacional de fibra detergente neutro (FDN), celulosa y hemicelulosa (Hemicel; % base seca) en pastos cultivados colectados en diferentes municipios del Estado de Nuevo León, México en diferentes fechas 3DVWRV /XJDU\IHFKDGHFROHFWD &RQFHSWR (VWDFLRQHV 0HGLDDQXDO ,QYLHUQR 3ULPDYHUD 9HUDQR 2WRxR &HQFKUXVFLOLDULV&RP~Q 0DUtQ1/0p[LFR )'1 &HOXORVD +HPLFHO &HQFKUXVFLOLDULV&RP~Q 7HUiQ1/0p[LFR )'1 &HOXORVD +HPLFHO &HQFKUXVFLOLDULV&RP~Q /LQDUHV1/0p[LFR )'1 &HOXORVD +HPLFHO &\QRGRQGDFW\ORQ /LQDUHV1/0p[LFR )'1 &HOXORVD +HPLFHO &\QRGRQGDFW\ORQ 0DUtQ1/0p[LFR )'1 &HOXORVD +HPLFHO &\QRGRQGDFW\ORQ,, 0DUtQ1/0p[LFR )'1 &HOXORVD +HPLFHO 'LFKDQWKLXPDQQXODWXP 0DUtQ1/0p[LFR )'1 &HOXORVD +HPLFHO 'LFKDQWKLXPDQQXODWXP /LQDUHV1/0p[LFR )'1 &HOXORVD +HPLFHO 3DQLFXPFRORUDWXP /LQDUHV1/0p[LFR )'1 &HOXORVD +HPLFHO 5K\QFKHO\WUXPUHSHQV 7HUiQ1/0p[LFR )'1 &HOXORVD +HPLFHO 3URPHGLRHVWDFLRQDO )'1 &HOXORVD +HPLFHO Datos tomados de: Ramírez et al. (2002); Ramírez et al. (2003); Ramírez (2003); Ramírez et al. (2004); Ramírez et al. (2005); LOS PASTOS EN LA NUTRICIÓN DE LOS RUMIANTES 69 CAPÍTULO 3 Tabla 3.3. Contenido de fibra detergente neutro (FDN), celulosa y hemicelulosa (% base seca) del híbrido buffel Nueces y cinco nuevos genotipos de buffel (Cenchrus ciliaris) colectados en diferentes fechas en Terán, N,L., México *HQRWLSRV &RQFHSWR 70 )HFKDVGHFRUWH $JRVWR 1RYLHPEUH 1RYLHPEUH -XQLR )HUWLOL]DGRV &HQFKUXVFLOLDULV1XHFHV )'1 &HOXORVD +HPLFHOXORVD &HQFKUXVFLOLDULV )'1 &HOXORVD +HPLFHOXORVD &HQFKUXVFLOLDULV )'1 &HOXORVD +HPLFHOXORVD &HQFKUXVFLOLDULV )'1 &HOXORVD +HPLFHOXORVD &HQFKUXVFLOLDULV )'1 &HOXORVD +HPLFHOXORVD &HQFKUXVFLOLDULV )'1 &HOXORVD +HPLFHOXORVD 3URPHGLR )'1 &HOXORVD +HPLFHOXORVD FACULTAD DE CIENCIAS BIOLÓGICAS, UANL GLÚCIDOS EN PASTOS Tabla 3.4. Contenido de fibra detergente neutro (FDN), celulosa (Cel) y hemicelulosa (Hemi; % base seca) de 84 nuevos genotipos de pasto Cenchrus ciliaris colectados en Terán, N.L., México en noviembre del 2000. *HQRWLSRV )'1 &HO +HPL *HQRWLSRV )'1 &HO +HPL *HQRWLSRV )'1 &HO +HPL *HQRWLSRV )'1 &HO +HPL LOS PASTOS EN LA NUTRICIÓN DE LOS RUMIANTES 71 CAPÍTULO 3 dominantemente mayor en los tallos que en las hojas. Durante las estaciones húmedas (primavera y otoño) los pastos tuvieron un menor contenido de FDN comparados con las estaciones secas (invierno y verano). 72 que los pastos nativos que crecen en Terán, Nuevo León, México (Tabla 3.7.). Las diferencias pueden deberse a que pertenecen a distintos sitios y fueron cosechados en diferentes períodos de tiempo. En Marín precipitaron 516 mm durante el año de estudio y en Linares precipitaron 613 mm. Es Tabla 3.5. Contenido de fibra detergente neutro (FDN), celulosa y hemicelulosa (Hemicel; % base probable que el menor contenido de seca) en las hojas y tallos de pastos cultivados introducidos y colectados en diferentes pared celular en los pastos que cremunicipios y fechas en el Estado de Nuevo león, México cen en Linares se debiera a que hubo 3DVWRV /XJDU\IHFKDGHFROHFWD 3DUWHV &RQFHSWR (VWDFLRQHV 0HGLDDQXDO una mayor precipitación. El conte ,QYLHUQR 3ULPDYHUD 9HUDQR 2WRxR nido de celulosa fue similar al con &HQFKUXVFLOLDULV&RP~Q /LQDUHV1/0p[LFR +RMDV )'1 tenido de hemicelulosa en todos los &HOXORVD +HPLFHO pastos nativos (Tablas 3.6. y 3.7.). 7DOORV )'1 &HOXORVD Cenchrus incertus (Figura 3.2.) +HPLFHO &\QRGRQGDFW\ORQ /LQDUHV1/0p[LFR +RMDV )'1 tuvo un contenido de pared celular &HOXORVD +HPLFHO intermedio. 7DOORV )'1 El pasto Chloris ciliata (Figura &HOXORVD +HPLFHO 3.3.) tuvo un contenido de pared 'LFKDQWKLXPDQQXODWXP /LQDUHV1/0p[LFR +RMDV )'1 &HOXORVD celular intermedio, al compararlo +HPLFHO 7DOORV )'1 con los otros pastos nativos que cre &HOXORVD +HPLFHO cen en Gral. Terán, N.L., México. 3DQLFXPFRORUDWXP /LQDUHV1/0p[LFR +RMDV )'1 &HOXORVD +HPLFHO 7DOORV )'1 &HOXORVD +HPLFHO Datos tomados de: Ramírez et al. (2001ab); Foroughbackhch et al. (2001); Ramírez et al. (2003); Ramírez (2003); Ramírez et al. (2005); Los pastos nativos que crecen en Marín, Nuevo León, México contienen alrededor de 10 % más FDN (Tabla 3.6.) Medio ambiente de la planta y calidad No existe ningún factor que impacte la calidad del forraje como lo es la madurez de la planta, pero el medio ambiente de la planta modifica el impacto de la madurez. El medio ambiente de la FACULTAD DE CIENCIAS BIOLÓGICAS, UANL GLÚCIDOS EN PASTOS Tabla 3.6. Contenido estacional de fibra detergente neutro (FDN), celulosa y hemicelulosa (% base seca) en pastos nativos colectados en Marín, N.L., México en 1994 3DVWRVQDWLYRV $ULVWLGDORQJLVHWD %RXWHORXDJUDFLOLV &HQFKUXVLQFHUWXV +LODULDEHODQJHUL 3DQLFXPKDOOLL 6HWDULDPDFURVWDFK\D 3URPHGLRHVWDFLRQDO &RQFHSWR (VWDFLRQHV ,QYLHUQR )'1 &HOXORVD +HPLFHOXORVD )'1 &HOXORVD +HPLFHOXORVD )'1 &HOXORVD +HPLFHOXORVD )'1 &HOXORVD +HPLFHOXORVD )'1 &HOXORVD +HPLFHOXORVD )'1 &HOXORVD +HPLFHOXORVD )'1 &HOXORVD +HPLFHOXORVD 3ULPDYHUD 9HUDQR Datos tomados de: Ramírez et al. (2004) planta incluye aquellos factores bióticos y abióticos que influencian en el crecimiento y desarrollo de los forrajes. Los efectos acumulativos están integrados a través de los procesos fisiológicos y reflejados en la tasa de crecimiento del forraje, tasa de desarrollo, producción y calidad del forraje. Año con año las estaciones y las variaciones en el medio ambiente relacionadas a la localización geográfica alteran la calidad del forraje, aún cuando los forrajes son cosechados en estos morfológicos similares. Esto hace difí- cil la predicción de la calidad del forraje y difícil resulta un comportamiento inconsistente de los animales que consumen el forraje. 0HGLDDQXDO 2WRxR Las plantas raramente crecen en su ambiente ideal, en vez de eso experimentan fluctuaciones al medio ambiente y estrés que modifica su morfología y su tasa de desarrollo, limita su producción y altera su calidad. El estrés es causado cuando algún factor del medio ambiente no es ideal para el crecimiento de la planta y el desarrollo. Esto puede ser causado por numerosos factores pero aquellos que se deben de considerar son temperatura, déficit de agua, radiación solar, deficiencias de nutrientes y las plagas. Las paredes de las plantas celulares proveen la primera línea de defensa contra la mayoría de este estrés. Las células secundarias de la pared desarrollan, especialmente una lignificación, que es un aspecto importante de protección. La lignificación también restringe la accesibilidad de los nutrientes de la pared celular para los animales que las consumen. Las paredes celulares varían en digestibilidad, solamente están disponibles parcialmente, por otra parte los contenidos celulares son completamente digestibles. LOS PASTOS EN LA NUTRICIÓN DE LOS RUMIANTES 73 CAPÍTULO 3 Tabla 3.7. Contenido estacional de fibra detergente neutro (FDN), celulosa y hemicelulosa (% base seca) de pastos nativos colectados en Terán, N.L., México en 2001 y 2002 3DVWRVQDWLYRV 74 %RXWHORXDFXUWLSHQGXOD %RXWHORXDWULILGD %UDFKLDULDIDVFLFXODWD 'LJLWDULDLQVXODUHV &KORULVFLOLDWD /HSWRFKORDILOLIRUPLV 3DQLFXPKDOOLL 3DQLFXPREWXVXP 3DQLFXPXQLVSLFDWXP 6HWDULDJULVHEDFKLL 6HWDULDPDFURVWDFK\D 7ULGHQVHUDJURVWRLGHV 7ULGHQVPXWLFXV 3URPHGLRHVWDFLRQDO &RQFHSWR (VWDFLRQHV\DxRVGHFROHFWD ,QYLHUQR )'1 &HOXORVD +HPLFHOXORVD )'1 &HOXORVD +HPLFHOXORVD )'1 &HOXORVD +HPLFHOXORVD )'1 &HOXORVD +HPLFHOXORVD )'1 &HOXORVD +HPLFHOXORVD )'1 &HOXORVD +HPLFHOXORVD )'1 &HOXORVD +HPLFHOXORVD )'1 &HOXORVD +HPLFHOXORVD )'1 &HOXORVD +HPLFHOXORVD )'1 &HOXORVD +HPLFHOXORVD )'1 &HOXORVD +HPLFHOXORVD )'1 &HOXORVD +HPLFHOXORVD )'1 &HOXORVD +HPLFHOXORVD )'1 &HOXORVD +HPLFHOXORVD 3ULPDYHUD 9HUDQR 0HGLDDQXDO 2WRxR FACULTAD DE CIENCIAS BIOLÓGICAS, UANL El estrés causado por el medio ambiente tiene un gran efecto sobre la producción de forraje más que la digestibilidad o factores relacionados con la calidad. Algunas de estas relaciones fueron recientemente resumidas por Buxton y Casler (1993). El medio ambiente de la planta a menudo evidencia su gran influencia sobre la calidad del forraje alterando las relaciones entre los tallos y hojas, pero también causan otras modificaciones morfológicas y cambios en su composición química de las partes de la planta. Los cambios en la morfología de las plantas pueden alterar la accesibilidad del forraje, especialmente influenciando el consumo de los animales en pastoreo, afectando el tamaño potencial de la mordida. La altura de la cubierta vegetal es la variable más importante de la pradera que afecta el tamaño del mordisco (Hodgson, 1981), además de alterar la relación GLÚCIDOS EN PASTOS tallo:hoja. El medio ambiente de la planta influencia las tasas de maduración y la cantidad del material muerto. Los animales generalmente seleccionan lo más joven, los tejidos de hojas verdes más que los tallos y los tejidos muertos de las plantas. Muchos estreses reducen el crecimiento de la planta y su desarrollo, resultando en que la cantidad del forraje se mantiene por niveles muy bajos. El estrés que causa reducciones en la relación tallo:hoja decrece la calidad del forraje, debido al alto valor nutritivo de las hojas (Ramírez et al., 2001ab) Temperatura y calidad de los pastos Debido a que el valor nutritivo de los forrajes es gobernado por la cantidad y disponibilidad de productos metabólicos y anabólicos, incluyendo los contenidos celulares y la pared celular, por lo tanto cualquier factor que influencie estos productos también afecta la calidad del forraje. La temperatura usualmente tiene una gran influencia en calidad del forraje más que otros factores ambientales encontrados en las plantas. La temperatura de la planta es el resultado de interacciones complejas entre la planta y su medio ambiente y es influenciada por el flujo de la densidad de radiación, calor de conducción, calor de convección, calor latente y características anatómicas y morfológicas. Además, debido a las variaciones en la cobertura, aspectos particulares de las partes de las plantas y el resultado de diferencias en la carga de radiación, la temperatura de los tejidos pueden variar ampliamente en cualquier tiempo (Buxton y Fales, 1994). Efectos de la temperatura sobre el desarrollo de la planta En un sentido amplio, la temperatura (junto con la unidad del suelo) afecta la calidad del forraje en determinadas especies que crecen en ciertas regiones. La temperatura es el principal determinante de la adaptación geográfica de las especies de plantas. Esto se manifiesta particularmente en las temperaturas extremas encontradas por ontogenia de las plantas. Estos extremos pueden causar muerte de la planta o una severa debilidad. Bajo condiciones de campo, el estrés de la alta temperatura frecuentemente ocurre junto con el estrés de agua haciendo difícil separar los dos efectos. Dentro de una región o área, los efectos primarios de temperatura sobre la calidad de los pastos determinan la tasa de desarrollo de la planta y la influencia en proporción relativa de hojas y tallos. Un efecto secundario de la temperatura es encontrar diferencia en la morfología de los tejidos de las hojas y de los tallos. La temperatura tiene mayores efectos sobre la digestibilidad más que otras variables ambientales, las implicaciones económicas de los cambios en temperatura no deben ser ignorados Si esto ocurre, el largo de los estados vegetativos se reducirá en mucho en los pastos. La mayoría de las investigaciones sobre temperatura como factor en la partición del carbón, han padecido los efectos de la temperatura (principalmente bajas, Pollak, 1990) en los estatus de glúcidos de los residuos metabólicos tales como los órganos de almacenamiento (Farrar, 1988). Estos estudios han mostrado que la temperatura puede alte- LOS PASTOS EN LA NUTRICIÓN DE LOS RUMIANTES 75 CAPÍTULO 3 76 rar el metabolismo de los residuos o un descenso en las reacciones individuales (particularmente cuando la difusión es una tasa limitante como parte del crecimiento), cambiando las tasas de transporte activo entre membranas, afectando la actividad enzimática (Control fino), y cambiando la concentración de varias enzimas (control grosero) a través de las modificaciones de la expresión de los genes. Debido al desarrollo de las paredes celulares también representa una pérdida metabólica por fotocinato, la temperatura evidencia su influencia de una manera similar, una idea que es soportada por una evidencia fuertemente sugiere una gran conversión de fotocinato a componentes estructurales a altas temperaturas (Da Silva et al., 1987). La temperatura de las plantas usualmente se desvía a la temperatura del aire. Frecuentemente, si la temperatura del aire es por abajo de 35° C, la temperatura de los tejidos expuestos a la luz solar directa están por arriba de la temperatura del aire, especialmente si la humedad es alta. Si la temperatura del aire es por arriba de 35° C, los tejidos expuestos a la temperatura pueden permanecer abajo de la temperatura del aire, especialmente si la humedad es baja y si el agua del suelo esta disponible. Dentro de los regímenes de temperatura muchos forrajes crecen, la temperatura de las hojas expuestas a la luz solar estarían por arriba de la temperatura del aire. El tiempo nublado puede cambiar la relación en la temperatura del aire y la temperatura de las hojas y la temperatura de esas hojas es muy probable que este cerca de la temperatura del aire. Como resultado, el tiempo nublado puede causar que la temperatura del día sea subestimada cuando sea para predecir las respuestas en la planta. Cuando se cosecha en un estado de crecimiento en particular, altas producciones son usualmente obtenidas, cuando los forrajes están creciendo a temperaturas cercanas a los límites bajos de su rango óptimo (Fick et al., 1988). Las altas temperaturas decrecen el diámetro de los tallos aumentando la tasa de maduración y lignificación (Fick et al., 1988; Marten et al., 1988). Cuando hay crecimiento a temperatura arriba de la temperatura óptima para crecimiento, los pastos tienden a ser más cortos, durante la floración y a espigar más temprano que cuando crecen a temperaturas más frescas. Altas temperaturas de crecimiento también promueven el desarrollo de tallos más que el desarrollo de las hojas, y consecuentemente las relaciones hoja/tallo bajan. Efecto de la temperatura en la composición química y digestibilidad Los efectos negativos de una temperatura elevada sobre la digestibilidad del follaje de los pastos han sido sujetos a numerosos estudios en los últimos 30 años. En la gran mayoría de las plantas que florean, los controles del medio ambiente tales como largo del día y la temperatura modulan la tasa de desarrollo. Los extremos de la temperatura sobre los efectos de la temperatura normal es experimentado durante la estación de crecimiento mostró una disminución de 80 g kg-1 en la digestibilidad in vitro (DIVMS) del Festuca arnudinacea cuando la temperatura fue incrementada de 15/ 10° C a 25/20° C. Wilson y Minson (1980) resumieron los FACULTAD DE CIENCIAS BIOLÓGICAS, UANL GLÚCIDOS EN PASTOS resultados de varios experimentos relacionados con la temperatura y digestibilidad y concluyeron que las hojas de los pastos de clima templado muestran un promedio de disminución de 6.6 g kg-1 de DIVMS por cada grado centígrado de incremento en la temperatura durante el crecimiento. La disminución en la DIVMS asociada con elevadas temperaturas es más frecuentemente atribuida a altas concentraciones de los constituyentes de la pared celular, pero muy poco trabajo se ha intentado para probar el mecanismo involucrado en este fenómeno. La temperatura no solo puede aumentar la concentración de la pared celular, sino también puede reducir la digestibilidad de la pared celular. Es probable que la temperatura juegue un papel en la composición química y por lo tanto ésta esté relacionada con la digestibilidad de los constituyentes de la pared celular, pero pocos estudios han intentado documentar esto (Wilson, 1982). Los cambios en la concentración de la pared celular con la temperatura son muy pocos en relación con la materia seca (MS). Mientras que, generalmente, se ha asumido que los efectos de la temperatura sobre la digestibilidad están mediados por la lignina debido a la alta correlación entre lignina y digestibilidad. Una baja en la digestibilidad del forraje a altas temperaturas ha sido consistentemente asociada con un aumento substancial en la cantidad de pared celular indigestible (Fales, 1986). Otros mecanismos por los cuales las temperaturas pueden causar una reducción en la digestibilidad de la pared celular también han sido considerados. Wilson et al., (1991) hipotetizó que las variaciones de temperatura pueden alte- rar la digestión de la pared celular alterando el grosor de la célula. Paredes celulares gruesas son digeridas más lentamente que las paredes celulares delgadas como resultado de la cantidad relativa del área superficial en relación a la cantidad de material celular. Se observaron efectos consistentes de la temperatura sobre el grosor de las paredes celulares, cuando varios forrajes estuvieron creciendo a temperaturas de 22/16 o 32/26 °C, concluyeron que los efectos de las temperaturas sobre la anatomía de las hojas o tallos no fueron factores importantes en la diferencia que induce la temperatura en la digestibilidad del forraje. Especies de invierno y verano Se ha reportado que la distribución geográfica de especies C3 y C4 son determinadas por temperaturas regionales y estacionales, los tipos C4 son más numerosos en los climas más calientes y estaciones cálidas, Los pastos C4 han sido reconocidos por su relativamente baja digestibilidad y altas concentraciones de polisacáridos estructurales comparados con los pastos C3. De hecho, dentro de las Poaceae, la gran diferencia en digestibilidad y en la composición de la pared celular se debe a la temperatura. Dentro de la Festucoidae y las subfamilias tropicales Panicoidae, los primeros exhibieron la vía fotosintética C3 y los últimos tuvieron la vía C4. Los pastos de estaciones cálidas también, fueron de alto contenido de celulosa y hemicelulosa, más que los pastos de clima templado, este aspecto no ha sido suficiente para aclarar si las diferencias son verdaderamente taxonómicas LOS PASTOS EN LA NUTRICIÓN DE LOS RUMIANTES 77 CAPÍTULO 3 78 o son causadas por condiciones diferentes del medio ambiente, bajo las cuales la especie de estación cálida y estación templada usualmente crecen. Usando cámaras de crecimiento con temperaturas controladas de crecimiento, se ha demostrado que un incremento en la temperatura durante el crecimiento de los pastos de estación cálida (Brachiaria ruziziensis) incrementaron la producción de MS, tamaño, pero también en el número de brotes, en la relación hoja/tallo, y la concentración de nitrógeno orgánico (N) en la MS. Los autores también notaron una relación positiva entre la temperatura y la concentración de fibra cruda, tanto en la hoja como en el tejido del tallo y postularon que la temperatura por si misma es el principal factor que contribuye a la relativamente pobre calidad de los pastos en los climas cálidos (Buxton y Brasche, 1991). Deficiencias de agua y la calidad de los pastos Agua es un componente crucial de las células de las plantas y es necesario para todos los procesos metabólicos que dependen de su presencia. Una adecuada cantidad de agua se requiere para el mantenimiento de la presión de turgencia, la función de protección y la difusión de los solutos en las células. El agua provee el oxígeno durante la fotosíntesis y el hidrógeno usado para la reducción de bióxido de carbono. La cantidad de agua presente varía con el tipo de célula y con el estatus fisiológico. Las nuevas células formadas necesariamente están compuestas de agua, mientras que las células de consistencia fibrosa casi no contienen agua. En promedio, la concentración de agua en los pastos puede ser alrededor de 750 g kg-1, dependiendo de las especies y condiciones del medio ambiente, y declinan conforme avanza la madurez de la planta (Wilson, 1982). La mayor parte del agua de los pastos proviene del suelo a través de la raíz. Rosenberg et al. (1983) notó que las plantas funcionan como bomba de agua, moviendo el agua del suelo dentro de la atmósfera en respuesta a diferencias en el potencial del suelo, planta y aire. Alrededor de 1% del agua que entra a las plantas en crecimiento es retenida y la mayor parte se pierde a través de la transpiración. El agua en exceso a las necesidades metabólicas, usualmente se usa para importantes funciones en el movimiento de solutos de las raíces a los tallos y a las hojas y en el enfriamiento evaporativo de las plantas. La gran resistencia al movimiento del agua a través de la planta normalmente ocurre en los espacios aéreos dentro de las hojas. Los estomas ocupan alrededor del 1% de las superficies de las hojas, pero la mayoría de agua perdida por las hojas vivientes, pasa a través de los estos abiertos. Algo de agua también se pierde a través de la cutícula. Efectos generales del agua sobre los pastos Tanto el exceso o deficiencia de agua puede producir estrés en los forrajes. Un exceso de agua, el cual puede resultar de suelos anegados, impone un estrés debido a que en los suelos anegados se pierde el oxígeno por los microorganismos y por la respiración de la raíz, dejando a la raíz de los pastos FACULTAD DE CIENCIAS BIOLÓGICAS, UANL GLÚCIDOS EN PASTOS en un ambiente sin oxígeno. Aún que la anoxia puede grandemente reducir la producción de forraje, hay poca información de como esto impacta en la calidad de los pastos. La mayoría de las áreas productoras de pastos, el suelo seco es más común que el suelo acuoso. De hecho las preocupaciones más grandes relacionadas con los cambios de clima son las sequías en el futuro (Waggoner, 1993). El estrés por déficit de agua es usualmente la mayor limitación física para los pastos. Cuando la transpiración excede a la absorción de agua por las raíces, el déficit de agua se incrementa en la planta y el estrés puede ocurrir, el cual adversamente afecta muchas reacciones enzimáticas de la mayoría de los procesos fisiológicos. El déficit de agua causa un cierre de los estomas, reduce las tasas de transpiración, y aumenta la temperatura del pasto. El agrandamiento celular es particularmente sensitivo al déficit de agua. La división celular parece ser menos sensible que el agrandamiento celular (Levitt, 1980). La presión de turgencia juega un papel importante en el agrandamiento de las células, proporcionando la presión necesaria para que la pared de la célula se expanda. Conforme las paredes celulares se expanden, las presiones de turgencia decrecen, lo cual causa que el potencial del agua dentro de la célula, disminuya. Esto crea una diferencia entre el interior y exterior de la célula, lo cual mueve más agua dentro de las células. Los solutos deberán continuar acomodándose dentro de las células en crecimiento. La capacidad de los pastos para mantener una turgencia positiva o constante conforme el potencial de agua decrece, es una importante adaptación al déficit de agua. La mayoría de los mecanismos fisiológicos importantes permiten a las plantas mantener su turgencia bajo condiciones de estrés de agua en la osmoregulación, la cual es el potencial osmótico y puede resultar por la condensación de las células durante la pérdida de agua y de un incremento de solutos en las células bajo condiciones de estrés por agua. Los solutos que se encuentran en concentración incluyen azúcares solubles, aminoácidos orgánicos (Tuner y Jones, 1980). Bajo moderados a severos estrés la concentración del aminoácido, prolina, aumenta más que otros aminoácidos (Barker et al., 1993). La prolina puede servir como un almacén de N y una ayuda en la tolerancia a la sequía actuando como un soluto en la osmoregulación (Stewart y Hanson, 1980). Las tasas fotosintéticas son usualmente afectadas menos por la sequía que por las tasas de respiración y crecimiento, causando un incremento general en concentración de carbohidratos no estructurales. La translocación de los fotocinatos, sin embargo, es relativamente sensible al déficit de agua (Setter, 1993). El efecto varía dependiendo de las especies grado de estrés y el estado de desarrollo de la planta. Acumulación de los carbohidratos no estructurales y los almacenes de nitrógeno (N) pueden facilitar un rápido rebrote después de que el estrés de agua se ha liberado. Efectos del agua sobre la composición química y digestibilidad El alto potencial de producción está, usualmente, asociado negativamente en muchas plantas adaptadas a la sequía LOS PASTOS EN LA NUTRICIÓN DE LOS RUMIANTES 79 CAPÍTULO 3 80 Figura 3.1. Cenchrus incertus. M.A. Curtis. Nombre común es cadillo. Es pasto perenne, sin pelo en su totalidad. Cañas de 2a 100 cm de alto, hojas comúnmente plegadas pero a veces planas, de 2 a 5 mm de ancho; racimo de 4 a 10 de largo, los cadillos no están apiñonados, el cadillo es de 3 a 5 mm de ancho, el cuerpo es fino y densamente pubescente, la base es áspera. Las espinas son pocas, en su mayoría de menos de 5 mm de largo. Las espículas de 1 a 3 en cada cadillo (Gould, 1975). FACULTAD DE CIENCIAS BIOLÓGICAS, UANL GLÚCIDOS EN PASTOS Figura 3.2. Chloris ciliata. Chloris barbado. Perenne. Tallo erecto, delgado de 25-60 cm de alto. Glabros. Vainas glabras. Lígula ausente o una corona ciliada corta. Láminas largas agudas de 10-20 cm de largo y alrededor de 5 mm de ancho, glabras o escabrosas. Panículas con 3-5 (rara vez 6-7) ramas digitadas, algo flexuosas o extendidas que miden de 3.5 – 6 cm de largo. Espiguillas pardas, cercanamente insertas y apresadas sobre el raquis que va de escabroso a hirsuto. Las glumas son angostamente lanceoladas, glabras excepto por la nervadura central que es escabrosa y tienen márgenes hialinos, la primera gluma 1.3-1.7 mm de largo, la segunda gluma de 2-2.5 mm de largo. Lemma inferior fuertemente aplanada, elíptica, de 1.82.8 mm de largo. Arista de 0.9-2.7 mm de largo, los márgenes y quilla fuertemente ciliados. 2 Floretes estériles, el inferior cubre al superior truncado, glabro de 1.3-1.8 mm de largo con una arista de 0.9-1.4 mm de largo; florete estéril superior similar pero más pequeño, sin arista. Número de cromosomas 2n=40. Distribución: Texas: regiones 2 y 6 en tierra negra, pesada, algunas veces en suelos arenosos o arcillosos, frecuentemente a lo largo de las carreteras. En general: Texas, norte de México. Yucatán, Cuba y otras islas caribeñas, Argentina y Uruguay. Período de floración: marzo a octubre (Gould, 1975). 81 LOS PASTOS EN LA NUTRICIÓN DE LOS RUMIANTES CAPÍTULO 3 82 Figura 3.3. Cenchrus ciliaris (L.). Nombre común: zacate buffel. Perenne; tallos amacollados, de 60-100 cm de alto; vainas comprimidas, glabras o escasamente pilosas; lígula ciliada, diminuta, de 1.3-1.8 mm de largo; láminas escasamente escabrosas, a veces ligeramente pilosas, de 16-25 cm de largo por 7.8-20 mm de ancho. Inflorescencia densa, cilíndrica de 7-18 cm de largo por 1.3-1.6 cm de ancho; caquis flexible, escabroso, con entrenudos de 0.81.7 cm de ancho; abrojos alargados, variamente pubescentes, de 6.8-9.6 mm de largo por 2.8-4.5 mm de ancho; pedúnculo diminuta, densamente piloso, de 0.5-1.5 mm de largo por 1-2 mm deancho, cerdas erectas o dispersas, de 6-7 mm de largo por 0.5-0.7 mm de anch, largo-ciliadas, pubescentes en los márgenes internos, connotas únicamente en la base o ligeramente arriba de esta, antorsaente barbadas, a menudo con puntas plumosas, verticilo exterior de espinas semejantes a cerdas, más cortas que las espinas internas; 2-4 espiguillas por abrojo, de 5.5-6.8 mm de largo; primera gluma de 2.2-2.9 mm de largo por 1-1.5 mm deancho, delgada y membranosa, 1-nervada; pálea parcialmente incluída, de 2.5-5 mm de largo; flósculo fértil de 5.2-6.6 mm de largo por 1-1.5 mm de ancho cubriendo el cariópsis ovoide, turgente de 3 mm de largo. Introducido de Sur África; usualmente en Sonora se siembra en matorrales libres de heladas con 300 mm o más de precipitación media anual. Valor forrajero excelente, produce 2 ton. o más por hectárea, rebrotando en cualquier época del año cuando existe suficiente humedad. Naturalizados y comportándose como maleza en cultivos, terrenos baldíos y orillas de carreteras y caminos (Ackerman-Beetle y Johnson-Gordon, 1991). FACULTAD DE CIENCIAS BIOLÓGICAS, UANL GLÚCIDOS EN PASTOS (Blum, 1993). Así mismo, las características xeromórficas de las plantas decrecen en climas cálidos o secos, teniendo paredes celulares delgadas, cutícula delgada, y tejido altamente lignificado (Levitt, 1980). Estas características son generalmente asociadas con una baja digestibilidad. El estrés por agua, sin embargo generalmente tiene un pequeño efecto sobre la calidad del forraje más que sobre el crecimiento y desarrollo, y la mayoría de los efectos sobre la calidad del forraje son positivos primeramente debido a que la madurez se retrasa por estrés de agua. Radiación solar El primer paso en la utilización de la energía solar interceptada es su conversión a energía química por medio de la fotosíntesis. Durante este proceso se inicia el flujo de energía dentro del ecosistema de biosfera de la tierra. El carbón usado es fijado de CO2 atmosférico, representando al rededor de 0.03% del total de la composición gaseosa. La fotosíntesis ocurre cuando las hojas verdes están expuestas a la radiación en la parte visible del campo (radiación se encuentra en una longitud de onda de 400 a 700 nm). La energía en estas longitudes de onda representa aproximadamente la mitad del total de la radiación solar. Bajo condiciones ideales hasta 7% de la energía en la ración solar puede ser almacenada en productos fotosintéticos en las cosechas de rápido crecimiento (Noble, 1988). Para pastos durante toda la estación de crecimiento, sin embargo, el promedio es mucho más bajo (menos de 1%). Efectos de la radiación solar sobre la composición química y digestibilidad El sombreado típicamente tiene un pequeño efecto sobre la calidad de los pastos, comparado con la morfología o producción, esto fue ilustrado por Kephart et al. (1992) y Kephart y Boxton (1993). Ellos encontraron que imponiendo a un 63% de sombra sobre 5 pastos perennes redujeron en 43% la producción y de la hoja un 24% pero solo redujeron la concentración de FDN en 3% la concentración de lignina en la pared celular en 4 % y un incremento de la digestibilidad en el forraje en 5%. La concentración de N es mucho más sensitiva al sombreado que otras características de calidad ya que Kephart y Buxton (1993) encontraron que el 63% de la sombra aumenta la concentración de N en un 26%. La respuesta fue generalmente mayor en las hojas que en los tallos. Los componentes de la pared celular son depositados previamente en el siguiente orden: Hemicelulosa, celulosa, y lignina, aunque muchos se traslapan entre estas actividades (Bidlack y Buxton, 1992). La reducción en la composición de la pared celular por el sombreado se ve reflejada en un aumento en la digestibilidad de la MS en algunos estudios. Kephart y Buxton (1993) reportaron que la digestibilidad del forraje fue mejorada en un 5 % con un sombreado intenso. Así mismo, Soamarakoon et el. (1990) encontraron que la digestibilidad de la MS de los pastos desarrollados bajo sombra fue más alta que la de los pastos que crecen bajo la influencia de luz solar. Contrariamente Wilson y LOS PASTOS EN LA NUTRICIÓN DE LOS RUMIANTES 83 CAPÍTULO 3 84 Wong, (1982) encontraron una respuesta negativa de la digestibilidad del forraje con un aumento en el sombreado. Los fertilizantes son aplicados a los pastos forrajeros para una corrección de deficiencias en el suelo y para incrementar la producción. En las praderas, los nutrientes seleccionados frecuentemente son aplicados para manipular la composición botánica, para mantener un balance de las especies deseadas. La aplicación de fertilizantes puede tener efectos directos e indirectos sobre los animales induciendo cambios químicos, morfológicos ó fisiológicos en las plantas. Los efectos específicos, sin embargo, pueden ser extremadamente difíciles de diagnosticar por la utilización de un nutriente dado por el animal, pues su absorción es gobernada por el sistema digestivo y está consecuencia es influenciada por un complejo de interacciones de varios factores incluyendo la concentración en el pasto, el consumo e interacciones con otros nutrientes y el estatus fisiológico de los animales. Los requerimientos de nutrientes de los animales varía con la raza, madurez y nivel de producción, y el crecimiento de las plantas varía de acuerdo a criterios similares, el medio ambiente de la planta puede impactar la concentración de nutrientes de los forrajes. Belsky (1992) reporto que los forrajes creciendo bajo la sombra de los árboles de sábana contenían más altas concentraciones de N, P, K, Ca, B, Cu, y bajas concentraciones de Mn, Zn y Mo que en las plantas que no crecieron bajo sombra. Referencias Ackerman-Beetle, A. y Johnson-Gordon, D. 1991. Gramíneas de Sonora. SAGRH COTECOCA. Gobierno del Edo de Sonora, Hermosillo, Son. Akin, D.E., y Chesson, A. 1990. Lignification as the major factor limiting forage feeding value especially in warm conditions. p. 1753-1760. In Proc. XVI int. Grassland Congr., Vol. III. Nice, France, 4-11 October 1989, Association Francaise pour la production Fourragere, Versailles, France. Aman, P., y Graham, H. 1990. Chemical evaluation of polysaccharides in animal feeds. p. 161-177. In J. Wiseman and D.J.A. Cole (ed.) Feedstuff Evaluation. Butterwarths, London. Bartnicki-Garcia, S. 1984, Kindoms with walls. pol-8. In W. Dogger and S. Bartnicki-Garcia (ed.) Structure, function, and biosynthesis of plant cell walls. Proe. 7th Ann. Sym. in Botany, Univ. of CA, Riverside, 1214 Juanary, 1984. Barker, D.J., Sullivan, C.Y. y Moser, L.E. 1993 Water deficit effects on osmotic potential, cell wall elasticity, and proline in five grasses. Agron. J. 85:270-275. Belsky, A.J. 1992. Effects of trees on nutritional quality of understory gramineous forage in tropical savannas. T ropical Grassl. 26: 12-20 Bidlack, J.E., and D.R. Buxton. 1992. Content and deposition rates of cellulose, hemicellulose, and lignin during regrowth of forage grasses and legumes. Can. J. Plant Sci. J. Plant Sci. 72:807-88818. Blum, A. 1993. Selection for sustained production in water-deficit environments. In D.R. Buxton, R.M. Shibles, R.A. Forsberg, B.L. K.H. Asay, G.M. Paulsen, and R.F. Wilson (ed.) International crop science I. CSSA, Madison, WI. Buxton, D.R., Russell, J.R. y Wedin, W.F. 1987. Structural neutral sugars in legume and grass stems in relation to digestibility. Crop. Sci. 27: 1279-1285. Buxton, D.R., and M.R. Brasche. 1991. Digestibility of structural carbohydrates in cool-season grass and legume forages. Crop Sci. 31:1338-1345. Buxton, D.R., y Casler, M.D. 1993. Environmental and genetic effects on cell-wall composition and digestibility. p. 685-714. In: H.G. Jung, D.R. Buxton, R.D. Hatfield, and J. Ralph (editores) Forage cell wall structure and digestibility . ASA, CSSA, and SSSA, Madison, WI. Buxton, D.R., y Fales, S.L. 1994. Plant Environment and Quality. En: G.C. FACULTAD DE CIENCIAS BIOLÓGICAS, UANL GLÚCIDOS EN PASTOS Fahey, Jr. editor. Conference on Forage Quality, Evaluation and Utilization. Lincoln, NE. E.U.A. Cherney, J.H., Axtell, J.D., Hassen, M.M. y Anliker, K.S. 1988 Forage quality characterization of a chemically induced brown-midrib mutant in pearl millet. Crop Sci. 28: 783-787. Chesson, A., y forsberg, C.W. 1988. Polysaccharide degradation by rumen microorganisms. p. 251-284. In P.N. Honbson (editores). The Rumen Microbiall System. Elsevier Applied Sci. New York. Chesson, A. 1993. Mechanistic models of forage. cell wall degradation. p. 347-376. In H. G. Jung, D.R. Buxton, R.D. Hatfield, and J. Ralph (ed.) Forage cell wall structure and digestibility. ASA-CSSA-SSSA, Madison, WI. Church, D.C. 1988. The Ruminant Animal Digestive Physiology and Nutrition. Waveland Press, Inc. Illinois, Estados Unidos. Cobio-Nagao, C. 2004. Composición química y digestibilidad de la materia seca de pastos nativos colectados en Gral. Terán, N. L. Tesis. Facultad de Ciencias Biológicas, Universidad Autónoma de Nuevo León. Da Silva, J.H.S., Johnson, W.L. Burns, J.C. y Andrews, C.E. 1987. Growth and environment effects on anatomy and quality of temperate and subtropical forage grasses. Crop Sci. 27:1266-1273. Dehority, B.A. 1993. Microbial ecology of cell wall fermentation. p. 425453. In H. G. Jung, D.R. Buxton, R.D. Hatfield, and J. Ralph (ed.) Forage cell wall structure and digestibility. ASA-CSSA-SSSA, Madison, WI. Delmer, D.P., y Store, B.A. 1988. Biosynthesis of plant cell walls. p. 373420. In J. Preiss (ed.) The biochemistry of plants, vol. 14 Academic Press, New York. Fales, S.L. 1986. Effects of temperature on fiber concentration, composition, and vitro digestion kinetics of tall fescue. Agron. J. 78:963-966. Farrar, J.F. 1988. Temperature and the partitioning and translocation of carbon. p.203-235. In S.P. Long and F.I. Woodward (ed.) Plants and temperature. Soc. Exp. Biol., Cambridge, U.K. Fick, G.W., Holt, D.A. y Lugg, D.G. 1988. Environmental physiology and crop growth. p. 163-1194. In A.A. Hanson, D.K, Barnes, and R.R. Hill, Jr. (ed.) Alfalfa improvement. Agronomy Monogr. 29 ASA, CSSA, and SSSA, Madison, WI. García-Dessommes, G.J., Ramírez-Lozano, R.G., Foroughbakhch, R., Morales Rodríguez, R. y García-Díaz, G. 2003. Ruminal digestion and chemical composition of new genotypes of buffelgrass (Cenchrus ciliaris L.). Interciencia, 28: 220-224. García-Dessommes, G.J., Ramírez-Lozano R.G., Foroughbakhch, R., Morales-Rodríguez, R. y García-Díaz G. 2003. Valor nutricional y digestión ruminal de cinco líneas apomíticas del pasto buffel (Cenchrus ciliaris L.). Técnica Pecuaria en México, 41: 209-218. Gould, F. W. 1975. The grasses of Texas. Texas A & M University Press. Hatfield R.D., Ralph, J., Grabber, J. y Jung, H.J. 1993. Structural characterization of isolated corn lignins. p. A-319. In Abstr. Keystone Symposia, the extracellular matrix of plants: Molecular, cellular and developmental biology. Santa Fe, NM, 9-15 Jan., 1993. Hespell, R.B. 1988. Microbial digestion of hemicelluloses in the rumen. Microbiol. Sci. 5: 362-365. Hodgson, J. 1981. The influence of variation in the surface characterisitcs of the sward upon the short-term rate of herbage intake by calves and lambs. Grass Forage Sci. 36:49-57. Kephart, K.D., y Buxton, D.R. 1993. Forage quality responses of C3 and C4 perennial grasses to shade. Crop Sci. 33:831-837. Kephart, K.D., Buxton, D.R. y Taylor, S.E. 1992. Growth of C3 and C4 perennial grasses in reduced irradiance. Crop Sci. 32:1033-1038. Kerley, M.S., G.C. Fahey, Jr., J.M. Gould, and E.L. Iannotti. 1988. Effects of lignification, cellulose crystallinity and enzyme accessible space on the digestibility of plant cell wall carbohydrates by the ruminant. Food Microstructure 7: 59-65. Levitt, J. 1980. Response of plants to environmental stresses. Vol. 11. 2nd ed. Academic Press, New York, NY. Marten, G.C., Buxton, D.R. y Barnes, R.F. 1988. Feeding value (forage quality). p. 463-491. In A.A. Hansen, D.K. Barnes, and R.R. Hill, Jr. (ed.) Alfalfa and alfalfa improvement. Agronomy Monogr. 29. ASA, CSSA, and SSSA, Madison, WI. EUA. McDonald, P., Edwards, R.A. y Greenhalgh, J.F.D. 1995. Animal Nutrition. 5a edición. Logman Scientific & Technical. pp: 132-157. Mertens, D.R. 1993. Kinetics of cell wall digestion and passage in rumiants. p. 535-570. In H. G. Jung, D.R. Buxton, R.D. Hatfield, and J. Ralph (ed.). Forage cell wall structure and digestibility. ASA-CSSA-SSSA, Madison, WI. Monties, B. 1991. Plant cell as fibrous lignocellulosic composites: Relations with lignin structure and function. Anim. Feed Sci. Technol. 32:159175. LOS PASTOS EN LA NUTRICIÓN DE LOS RUMIANTES 85 CAPÍTULO 3 86 Morales-Rodríguez, R. 2003. Producción de materia seca y digestibilidad in situ del forraje de 84 genotipos del pasto buffel (Cenchrus ciliaris). Tesis de maestría. Facultad de Ciencias Biológicas, Universidad Autónoma de Nuevo León. Nobel, P.S. 1988. Principles underlying the prediction of temperature in plants with special reference to desert succulents. p. 1-23. In S.P. Long and F.I. Woodward (ed.). Plants and temperature. Soc. Exp. Biol., Cambridge, U.K. Nocek, J. E., and S. Tamminga. 1991. Site of digestion of starch in the gastrointestinal tract of dairy cows and its effect on mild yield and composition. J. Dairy Sci. 74:3598-3629. Robbins, C.T. 2001. Wildlife Feeding and Nutrition. 2a edición. Academic Press. San Diego, EUA. p. 248. Pollak, C.J. 1990. The response of plants to temperature change. J. Agric. Sci., Camb. 115:1-5. Ramírez, R.G., Foroughbackhch, R., Háuad, L. Alba-Avila, J., García-Castillo, C.G. y Espinosa-Vázquez, M. 2001. Seasonal dynamics of dry matter, crude protein and cell wall digestion in total plant, leaves and stems of common buffelgrass (Cenchrus ciliaris L.). J. Appl. Anim. Res., 19:40-49. Ramírez, R.G., Foroughbackhch, R., Háuad, L. Alba-Avila, J. García-Castillo, C.G. y Espinosa-Vázquez, M. 2001. Seasonal variation of in situ digestibility of dry matter, crude protein and cell wall of total plant, leaves and stems of Nueces buffelgrass (Cenchrus ciliaris). J. Appl. Anim. Res., 20:38-47. Ramírez R.G., González-Rodríguez, H. y García-Dessommes, G. 2002. Chemical composition and rumen digestion of forage from kleingrass (Panicum coloratum). Interciencia, 27:705-709. Ramírez, R.G., González-Rodríguez, H. y García-Dessommes, G.J. 2003. Nutrient digestion of common bermudagrass (Cynodon dactylon L.) Pers. growing in northeastern Mexico, J. Appl. Anim. Res. 23: 93102. Ramírez, R.G., García-Dessommes, G.J. y González Rodríguez, H. 2003. Valor nutritivo y digestión ruminal del zacate buffel común (Cenchrus ciliaris L.), Pastos y Forrajes 26: 149-158. Ramírez-Lozano, R.G. 2003. Nutrición de Rumiantes: Sistemas Extensivos. Trillas, México, D.F. p. 212. Ramírez R.G., Haenlein, G.F.W., García-Castillo, C.G. y Núñez-González M.A. 2004. Protein, lignin and mineral contents and in situ dry matter digestibility of native Mexican grasses consumed by range goats. Small Rumin. Res. 52: 261-269. Ramírez, R.G. y González-Rodríguez, H. García-Dessommes, G. and Morales-Rodríguez, R. 2005. Seasonal Trends in the Chemical Composition and Digestion of Dichanthium annulatum (Forssk.) Stapf. J. Appl. Anim. Res. (En prensa). Rosenberg, N.J., B.L. Blad, and S.B. Verma. 1983. Microclimate: The biological environment. 2nd ed. Wiley Interscience, New York, NY. Setter, T.L. 1993. Assimilate allocation in response to water deficit stress. In D.R. Buxton, R.M. Shibles, R.A. Forsberg, B.L. Blad, K.H. Asay, G.M. Paulsen, and R.F. Wilson (ed.) International crop science I. CSSA, Madison, WI. In press. Stewart, C.R. y Hanson, A.D. 1980. Proline accumulation as a metabolic response to water stress. p. 173-189. In N.C. Turner and P.J. Kramer (ed.) adaptation of plants to water and high temperature stress. John Wiley and Sons, New York, NY. Turner, N.C. y Jones, M.M. 1980. Turgor maintenance by osmotic adjustment: A review and evaluation. p. 87-103. In N.C. Turner and P.J. Kramer (ed.) Adaptation of plants to water and high temperature stress. John Wiley and Sons, New York, NY. Van Soest, P.J., Robertson, J.B. y Lewis, B.A. 1991. Methods for dietary fiber, neutral detergent fiber, and nonstarch polysaccharides in relation to animal nutrition. J. Dairy Sci. 74:3583-3597. Van Soest, P.J., 1993. Cell wall matrix interactions and degradatión-sessión synapsis. p.377-395.En H.G. Jung. D.R. Hatfield, and J. Ralph (ed). Forage Cell Wall Structure and Digestibility. ASA-CSSA-SSSA, Madison. WI. Van Soest, P.J. 1994. Nutrional Ecology of the Ruminant. 2a edición. O and B Books, Inc., Corvallis, OR. Varner, J.E., y Lin, L.S. 1989. Plant cell wall architecture. Cell. 56:233239. Waggoner, P.E. 1993. Preparing for climate change. In D.R. Buxton, R.M. Shibles, R.A. Forsberg, B.L. Blad, K.H. Asay, G.M. Paulsen, and R.F. Wilson (ed.) International crop science I. CSSA, Madison, WI. Wedig, C.L., Jaster, E.H. y Moore, K.J. 1989. Disappearance of hemicellulosic monosaccharides and alkali-solube phenolic compounds of normal and brown midrib sorghum x sudangrass silages fed to Holstein steers. J. Dairy Sci. 72:112-122. White, B.A., Mackie, R.I. y Doerner, K. C. 1993. Enzymatic hydrolysis of FACULTAD DE CIENCIAS BIOLÓGICAS, UANL GLÚCIDOS EN PASTOS forage cell walls. p. 455-484. In H.G. Jung, D.R. Buxton, R.D. Hatfield, and J. Ralph (ed.) Forage Cell Wall Structure and Digestibility. ASACSSA-SSSA, modison, WI. Wilkie. K.C.B. 1985. New perspectives on non-cellulosic cell-wall polysaccharides (chemial celluloses and pectic substances) of land plants. p. 1-38. En C.T. Brett and J.R. Hillman (ed.) Biochemistry of Plant Cell Walls. Cambridge University Press, Cambridge. Wilson, J.R. 1982. Environmental and nutritional factors affecting herbage quality. p. 111-131. In J.B. Hacker (ed.) Nutritional limits to animal production from pastures. CAB, Farnham, U.K. Wilson, J.R., Deinum, B. y Engels, F.M. 199l. Temperature effects on anatomy and digestibility of leaf and stem of tropical and temperate forage species. Neth. J. Agric. Sci. 39:31-48 Wilson, J.R., y Minson, D.J. 1980 Prospects for improving the digestibility and intake of tropical grasses. Trop. Grassl. 14;2253-257. Wilson, J.R. y Wong, C.C. 1982. Effects. of shade on some factors influencing nutritive quality of green panic and siratro pastures. Aust. J. Agric. Res. 33:937-950. Windham, W.R. Barton, F.E., y Himmelsbach, D.S. 1983. High-pressure liquid chromatographic analysis of component sugars in neutral detergent fiber for representative warm-and cool-season grasses. J. Agric.Food Chem. 31: 471-475. 87 LOS PASTOS EN LA NUTRICIÓN DE LOS RUMIANTES 88 Capítulo 4 La lignina en los pastos Introducción La lignina es un polímero formado de monolignoles derivados de la vía fenilpropanoide de las plantas vasculares. Se deposita en las paredes celulares de las plantas como parte del proceso de maduración de la célula. En los pastos, la lignina se considera como un componente antinutricional por su impacto negativo en la disponibilidad nutricional de la fibra de la planta. La lignina interfiere con la digestión de los polisacáridos de la pared celular al actuar como barrera física para las enzimas microbianas. Por tanto, la lignificación tiene un impacto directo, y a menudo importante, en el valor de la energía digestible (ED) del forraje. Hay un número de factores relacionados con la planta que afectan la lignificación de las plantas individuales y de las comunidades vegetales. La lignificación esta bajo control genético y hay considerables diferencias entre especies, y aun entre genotipos de la misma especie. Las diferencias genéticas en la lignificación se expresan primeramente a nivel celular y son afectadas por las actividades bioquímicas y fisiológicas de la célula. Conforme la célula se diferencia ocurren discrepancias en la lignificación, dependiendo de los tejidos y órganos que se estén desarrollando. La lignificación tiende a ser mas intensa en tejidos estructurales como el xilema y esclerénquima. Los órganos de la planta que contienen altas proporciones de estos tejidos, tales como los tallos, son menos digestibles que aquellos que contienen bajas concentraciones. La proporción de tejidos y órganos lignificados típicamente aumenta conforme la planta madura, por lo que a menudo hay una relación negativa entre la digestibilidad y madurez. Todos estos procesos de la planta responden a factores ambientales que pueden afectar la cantidad e impacto de la lignificación. La temperatura, humedad del suelo, luz y fertilidad del suelo pueden tener también efectos LOS PASTOS EN LA NUTRICIÓN DE LOS RUMIANTES 89 CAPÍTULO 4 directos o indirectos en la lignificación. Las practicas de manejo mas útiles para minimizar los efectos negativos de la lignificación son la manipulación de las comunidades vegetales para que contengan mas especies deseables y el manejo de la cosecha para mantener las plantas en estado vegetativo (Moore y Jung, 2001). Bioquímica de la lignina 90 La palabra lignina proviene del término latino lignum, que significa madera; así, a las plantas que contienen gran cantidad de lignina se las denomina “leñosas”. La lignina se caracteriza por ser un complejo aromático (no glúcido) del que existen muchos polímeros estructurales (ligninas). Resulta conveniente utilizar el término lignina en un sentido colectivo para señalar la fracción lignina de la fibra. Después de los polisacáridos, la lignina es el polímero orgánico más abundante en el mundo vegetal. Es importante destacar que la lignina es la única fibra no polisacárido que se conoce (Van Soest, 1994). La lignina realiza múltiples funciones que son esenciales para la vida de las plantas. Por ejemplo, posee un importante papel en el transporte interno de agua, nutrientes y metabolitos. Proporciona rigidez a la pared celular y actúa como puente de unión entre las células de la madera, creando un material que es notablemente resistente a los impactos, compresiones y flexiones. Realmente, los tejidos lignificados resisten el ataque de los microorganismos, impidiendo la penetración de las enzimas destructivas en la pared celular (Moore y Jung, 2001). Estructura química La molécula de lignina es una macromolécula, con un elevado peso molecular, que resulta de la unión de varios ácidos y alcoholes fenilpropílicos (cumarílico, coniferílico y sinapílico). El acoplamiento aleatorizado de estos radicales da origen a una estructura tridimensional, polímero amorfo, característico de la lignina. La lignina es el polímero natural más complejo en relación a su estructura y heterogenicidad. Por esta razón no es posible describir una estructura definida de la lignina; sin embargo, se han propuesto numerosos modelos que representan una aproximación de dicha estructura. Propiedades físicas Las ligninas son polímeros insolubles en ácidos y en álcalis fuertes, que no se digieren ni se absorben y tampoco son atacados por la microflora del colon. Pueden ligarse a los ácidos biliares y otros compuestos orgánicos (por ejemplo, colesterol), retrasando o disminuyendo la absorción en el intestino delgado de dichos componentes. El grado de lignificación afecta notablemente a la digestibilidad de la fibra. La lignina, que aumenta de manera ostensible en la pared celular de la planta con el curso de la maduración, es resistente a la degradación bacteriana, y su contenido en fibra reduce la digestibilidad de los polisacáridos estructurales (Jung et al., 1994). La lignina es un polímero sin una estructura definida, que contiene alcoholes (hydroxycinamyl) y puede contener además ácidos fenólicos y compuestos no fenólicos (Jung y FACULTAD DE CIENCIAS BIOLÓGICAS, UANL LA LIGNINA EN LOS PASTOS Allen, 1995). La lignina es frecuentemente mencionada como limitante de la digestión de la fibra, y a veces de la proteína. Sin embargo, investigaciones recientes sugieren que el contenido de lignina per se no sería responsable de la disminución de la digestión de la fibra, sino que la acción de la lignina consistiría en reducir el acceso de las enzimas hidrolíticas a la fibra digestible (Jung y Allen, 1995). Existen diversos métodos para estimar los contenidos de lignina de los alimentos, siendo el más conocido el de la digestión en ácido sulfúrico concentrado (72%). Este método ha sido criticado por considerarse que sobreestima la concentración de lignina de los forrajes, debido a que la proteína coprecipita con la lignina. El valor de conocer la concentración de lignina de un alimento dado reside en su relación aparente con la digestibilidad o la indigestibilidad de ese alimento (Cherney, 2000). En este contexto, el efecto de la lignina sobre la digestibilidad de la fibra parece ser mayor en gramíneas que en leguminosas (Jung y Allen, 1995), si bien esto puede ser un reflejo del uso del método lignina en detergente ácido (LDA), que subestima la concentración de lignina en gramíneas. En general, a medida que avanza el estado fenológico de un forraje dado, aumenta la concentración de lignina. En seguida se describe el método de lignina detergente ácido para determinar el contenido de lignina de los forrajes: Determinación de lignina por el método detergente ácido (LDA) Este procedimiento utiliza como primer paso, la técnica empleada para la determinación de fibra. El detergente extrae la proteína y otros materiales solubles en ácido que interfieren con la determinación de la lignina. El principio de este procedimiento estriba en que el residuo de la fibra ácido detergente, consiste principalmente de lignocelulosa de cuyo compuesto se disuelve y separa la celulosa por medio de la solución de H2SO4 al 72%; quedando la lignina y la ceniza no soluble en ácido. También la cutina, contenida en cantidades apreciables en ciertas muestras, se toma como si fuera parte de la lignina. Material y equipo: 1. Aparato para la determinación de fibra cruda. 2. Vasos de Berzelius de 600 ml. 3. Crisoles de vidrio de tipo alto, como porosidad gruesa, con plato de 40 mm de diámetro y capacidad de 40 a 59 ml. 4. Matraz quitasato para filtrar y equipo para succión al vacío. 5. Bandeja de vidrio. 6. Horno de incineración a 500° C. 7. Balanza analítica. Reactivo: 1. solución: Solución de H2SO4 al 72%. Para preparar un litro de 100 x 98.08 peso molecular x 12 moles = g de H2SO4 necesario % de H2SO4 en la solución del mismo. Pese el agua necesaria en un vaso de 2000 ml, en un recipiente aparte, pese el ácido que se va a necesitar. Lentamente y con precaución agregue el ácido (resbalándolo por las paredes del vaso) al agua contenida en el vaso de 2000 ml asentado en agua fría y agite ocasionalmente con una varilla de vidrio. Determine la gravedad específica de una LOS PASTOS EN LA NUTRICIÓN DE LOS RUMIANTES 91 CAPÍTULO 4 alícuota de 5 ml de la solución (20° C) con una pipeta volumétrica, colocando la muestra en una botella de pesar tapada y pesándola en una balanza analítica. Ajuste la gravedad específica a 1.634 a 20° C, mediante el agregado de cantidades pequeñas y medidas de agua o de ácido. Conversión a base seca: % de lignina en muestra “tal como ofrecido” x 100 % de materia seca en muestra “tal como ofrecida” % de lignina en muestra “parcialmente seco” x 100 % de materia seca de muestra “parcialmente seca” Tomado de: Van Soest et al. (1991). Procedimiento: 1. 2. 3. 92 4. 5. 6. 7. 8. Preparar el FDA de la muestra. Coloque los crisoles en la bandeja de vidrio y ésta en forma tal que tenga un extremo más levantado que el otro (2 cm) para que el ácido drene libremente. Cubra el contenido de los crisoles con el H2SO4 al 72% frío (15° C) y mézclese con una varilla de vidrio hasta formar una pasta suave, deshaciendo todos los grumos. Llene los crisoles hasta la mitad con el ácido y mézclese nuevamente, dejando la varilla de vidrio dentro del crisol. Vuélvase a llenar con H2SO4 al 72% y mézclese a intervalos de una hora mientras el ácido va drenando. No es necesario mantener los crisoles llenos todos el tiempo, con tres agregados es suficiente. Mantenga los crisoles a temperatura de 20 a 23° C. Después de 3 horas, filtre todo el ácido posible con vacío, lave el residuo otra vez con H2SO4 al 72% y extráigalo. Lave el contenido de los crisoles con agua caliente (8595° C) hasta que quede libre del ácido. Remuévales la varilla de vidrio. Seque los crisoles durante la noche a 100-105° C y luego pese. Incinere el contenido de los crisoles en la mufla a 500° C durante 3 horas; espere a que baje la temperatura a 250° C y páselos a un desecador a que terminen de enfriarse y luego péselos. Cálculos: Determine el porciento de lignina en base “tal como ofrecido” o “parcialmente seco” en la forma siguiente: LDA = (peso del crisol + lignina - peso del crisol + cenizas) Peso de la muestra x 100 Determinación de lignina, celulosa y sílice (cenizas insolubles) por permanganato Un método indirecto para la determinación de la lignina por medio del permanganato, permite la determinación de la celulosa y cenizas insolubles también. La determinación de cenizas insolubles es una manera de estimar el contenido de sílice que en muchos forrajes, que además es factor sobresaliente en la reducción de la digestibilidad. El método de la lignina por permanganato presenta una alternativa al método el ácido sulfúrico al 72%. Considerando que cada uno tiene sus propias ventajas. La selección del método depende de las muestras que se van a analizar y el uso que se les destine a los resultados. Las ventajas del método por permanganato sobre el método del ácido sulfúrico al 72% pueden resumirse en los pasos siguientes: 1. El procedimiento es más corto. 2. Los reactivos son menos corrosivos y no exigen normalización. 3. Los resultados están menos afectados por el daño que sufre la muestra debido al calor de los aparatos emplea- FACULTAD DE CIENCIAS BIOLÓGICAS, UANL LA LIGNINA EN LOS PASTOS dos y por consiguiente, se aproxima más al verdadero valor del contenido de lignina. 4. Sin embargo, la cutina que es una fracción importante en muchas de las cubiertas exteriores de las semillas, no se determina con este método. Una variación que se introduce en estos casos, es la de preparar el permanganato para celulosa y tratar la muestra con H2SO4 al 72% asbestos por espacio de 3 horas. Este procedimiento resulta en el fraccionamiento de la lignina cruda en las dos fracciones descritas seguidamente. Una desventaja que se le puede atribuir al método por permanganato, es que las partículas de mayor tamaño no las penetran completamente los reactivos y por lo tanto en estos casos, los resultados dan valores bajos. En consecuencia, los materiales con alto contenido de humedad deberán secarse parcialmente y molerse a través de un tamiz de 1 mm para reducir el tamaño de las partículas. Este método por lo tanto no es adecuado para heces y forrajes frescos que han sido molidos en un molino para carnes cuya forma física es inapropiada. Debido a la posibilidad de dañar la muestra con calor, es preferible usar H2SO4 al 72% para determinar lignina. Teoría del Método: Los materiales que interfieren con la determinación, se separan con la preparación de la fibra ácido detergente que esta compuesta principalmente por lignina, celulosa y mi- nerales insolubles. La lignina se oxida con una solución de ácido acético amortiguada con KMnO4 conteniendo hierro trivalente y plata monovalente como catalíticos. Los óxidos de manganeso y plata que se depositan, se disuelven con la solución alcohólica de ácido oxálico y HCl, permaneciendo la celulosa y los minerales insolubles. El contenido de lignina se determina en base a la pérdida en peso de la muestra, ocasionada por los tratamientos a que ha sido sometida; mientras que la celulosa se determina en base a la pérdida en peso al ser incinerada. El residuo de cenizas consiste principalmente de sílice y gran parte del material no silicato residual, puede eliminarse por medio del lavado con HBr concentrado. Material y equipo: 1. El necesario para determinar el FDA. 2. Bandeja de vidrio. 3. Horno de incineración a 500° C. Reactivos: 1. KMnO 4 saturado. Disuelva 50 g de KMnO 4 grado reactivo por litro de agua destilada. Manténgase esta solución protegida de la luz solar directa (guárdese en un frasco ámbar). 2. Solución buffer de lignina.- Para preparar 1 litro de solución, disuelva 6.0 gr. de nitrato férrico monohidratado (Fe (NO3)3, 9 H2O ) y 0.15 g de nitrato de plata en 100ml. LOS PASTOS EN LA NUTRICIÓN DE LOS RUMIANTES 93 CAPÍTULO 4 3. 4. 94 5. 6. de agua destilada. Combine esta mezcla con 500 ml de ácido acético glacial y 5.0 g de acetato de potasio, grado reactivo. Agregue 400 ml de alcohol butírico terciario, grado reactivo y mézclese la solución. Solución de KMnO4 combinada. Antes de ser usada, y a la vez mezcle la solución de permanganato de potasio saturada con la solución buffer de lignina en la relación 2:1 por volumen. La porción no utilizada de esta mezcla puede mantenerse por una semana en refrigeración en ausencia de luz. Esta solución puede utilizarse si mantiene el calor morado y está libre de precipitado. Solución desmineralizadora. Para preparar 1 litro de solución, disuelva 50 g de ácido oxálico dihidratado en 700 ml de alcohol etílico de 95%. Agregue 50 ml HCl concentrado (12 N) y 250 ml de agua destilada y luego mézclese bien. Alcohol etílico al 80 %. Para preparar 1 litro mezcle 155 ml. de agua destilada y 845 ml. de alcohol etílico de 95%. Ácido Bromhídrico, grado reactivo. Procedimiento: 1. Utilice el residuo de la determinación de fibra por el método ácido detergente (FDA) (aplicando en los cálculos el peso original de la muestra). 2. Coloque los crisoles que contienen el FDA en una bandeja de vidrio de poca profundidad que tenga aproximadamente una capa de 1 cm de espesor de agua fría. La fibra dentro de los crisoles no se debe mojar. 3. Agregue a los crisoles aproximadamente 25 ml. de la solución combinada de KMnO4 sin llenarlas demasiado. Ajuste el nivel del agua en la bandeja a manera de reducir la corriente de paso de la solución a través de los crisoles. Coloque una varilla corta de vidrio en cada crisol, con el objeto de remover su contenido, deshacer los grumos y bañar todas las partículas que se adhieren a las paredes internas del crisol con la solución de permanganato. 4. Deje permanecer los crisoles durante 90 minutos a temperatura de 20 a 25° C agregando, si fuera necesario, una cantidad adicional de la solución combinada de permanganato. Hay que recordar que el color morado lo debe conservar constantemente. 5. Traslade los crisoles al dispositivo de filtración al vacío y filtre todo el líquido remanente. No lave la muestra. Coloque los crisoles en bandejas de vidrio limpias y llénelos hasta la mitad con la solución desmineralizadora. Después de 5 minutos, filtre la porción líquida remanente y vuelva a llenar hasta la mitad con la misma solución. Se debe tomar la precaución de evitar el derrame debido a la formación de espuma. Repita la adición de la solución desmineralizadora hasta que el filtrado sea claro. Lave las paredes internas de los crisoles con una corriente fina de la solución desmineralizadora contenida en una piceta, hasta que el color de la fibra sea blanco. El tiempo necesario en este paso es de 20 a 30 minutos. 6. Llene y lave el contenido de los crisoles con alcohol etílico al 80 %; fíltrelo y repite este lavado por dos veces más. FACULTAD DE CIENCIAS BIOLÓGICAS, UANL LA LIGNINA EN LOS PASTOS 7. Lave y filtre la muestra con acetona, también dos veces, de igual manera como se hizo con el alcohol. Para obtener el contenido de Lignina: 1. Seque los crisoles durante la noche a 100 -105° C de temperatura. Luego déjese enfriar en un desecador y luego péselos. El contenido de lignina se calcula en base a la pérdida en peso original de la fibra obtenida por el método ácido detergente. 2. Para obtener el contenido de celulosa: Incinere la muestra procedente de la determinación de lignina a 500° C durante 3 horas; déjese enfriar en un desecador y pésela. La pérdida en peso equivale al contenido de celulosa. 3. Para obtener el contenido de sílice: Se puede obtener un valor supuesto del contenido de sílice mediante la percolación de cenizas en los crisoles, con HBr concentrado (48%) hasta que todo el color haya desaparecido. Se lava la muestra con acetona y se filtra. Luego se incinera a 500° C por tres horas. Se enfría en un desecador y se pesa (este paso no es necesario si el residuo de ceniza es menor del 2% de la muestra original). Precauciones: 1. Los crisoles que contienen la fibra con un alto contenido a su vez de lignina, necesitarán una mayor cantidad de la solución de KMnO4, pero evite el uso de cantidades innecesarias. 2. La aparición de un color amarillo o café es indicativo de que el permanganato se ha agotado. 3. Si el crisol está lleno, filtre la solución con ayuda del vacío y agrégele más solución. 4. Si persiste un color amarillo después de haber tratado la fibra con la solución desmineralizadora, es indicativo de que la remoción de lignina ha sido incompleta. Esto ocurre únicamente en materiales con alto contenido de lignina. 5. La cutina presente en algunas cubiertas de semilla y otras plantas, no se oxida con el permanganato y por lo tanto no aparecen como parte de la fracción de lignina, ni se blanquea con los tratamientos. 6. Las cubiertas de las semillas aparecen como manchas o vetas de color entre las partículas de celulosa y no deben confundirse con un proceso de oxidación incompleta. 7. Un exceso en el uso y por consiguiente en el paso de la solución de permanganato a través de los crisoles debe evitarse cuando se trata de muestras con un bajo contenido de lignina, principalmente con los pastos tiernos o inmaduros en cuyo caso, una sola aplicación de permanganato es suficiente. La fibra en los pastos inmaduros es rápidamente deslignificada y por lo tanto, existe el peligro de una pérdida de los carbohidratos contenidos en la celulosa, si se usa un exceso de la solución. 8. Se puede obtener una disminución en el tiempo de paso de la solución a través del crisol mediante el ajuste del nivel de agua en la bandeja, regulándose a una altura casi igual a la que tiene la solución dentro del crisol. LOS PASTOS EN LA NUTRICIÓN DE LOS RUMIANTES 95 CAPÍTULO 4 9. Las precauciones descritas anteriormente no es necesario tomarlas en cuenta al usar la solución desmineralizadora. Cálculos: Determine los procedimientos de lignina, celulosa y sílice en base “parcialmente seco” o “tal como ofrecido” en la forma siguiente: secundaria, es una incorporación aparente de algunos de los ester-arabinoxilanas ferulatos de la pared primaria dentro de la ligadura de las xilanas a lignina (Iiyama et al., 1990). % Lignina = (Peso FDA - peso residuo de fibra por KMnO4 ) Peso de muestra antes de determinar FDA Lignificación x 100 % Celulosa = (Peso residuo de fibra por KMnO4 - peso de cenizas) x 100 Peso de muestra antes de determinar FDA 96 mente lignificada. Esto puede explicar porque los microbios ruminales degradan la pared celular de las plantas desde el lumen hacia afuera, y porque la lámina media y la región de la pared primaria de células lignificadas nunca son completamente digeridas (Engels, 1989). La descomposición de lignina durante el engrosamiento de la pared % Sílice = peso de la ceniza después de lavado con HBr Peso de muestra antes de determinar FDA x 100 Conversión a base seca: (lignina, celulosa ó sílice) % analizada en muestra “tal como ofrecido” x 100 % materia seca en muestra “tal como ofrecido” % analizado en muestra “parcialmente seco” x 100 % materia seca en muestra “parcialmente seco” Tomado de: Van Soest et al. (1991) Desarrollo de la lignina La inclusión de la lignina en la pared celular comienza en la lámina media, dentro de la pared secundaria. El efecto de esto es que los polisacáridos más recientemente depositados en la pared secundaria no son lignificados. La lámina media y la región de la pared primaria es la más intensa- La lignificación de la pared celular procede desde la región de la pared primaria, dentro del engrosamiento de la pared secundaria. La lignina que es depositada cambia de lignina tipo guayacil a lignina rica en unidades siringyl (Terashima et al., 1993). En conjunción con esa deposición de un diferente tipo de lignina en estados posteriores de lignificación los pastos comienzan a incorporar relativamente grandes cantidades de éster p-cumarato de lignina dentro de la pared, presumiblemente en el engrosamiento de la pared secundaria (Jung y Vogel, 1992; Ralph et al., 1994). Los tallos de todos los forrajes presentan una concentración más elevada de pared celular que las hojas, y los tallos siempre incrementan el contenido de pared con la maduración (Jung y Vogel, 1992). La pared celular de las leguminosas son ricas en pectinas y tienen grandes cantidades de celulosa comparada con las xilanas que es observada en los zacates (Aman, 1993). El contenido de lignina de la pared celular FACULTAD DE CIENCIAS BIOLÓGICAS, UANL LA LIGNINA EN LOS PASTOS de las leguminosas es mayor que el de los pastos (Buxton y Fritz, 1985), aunque la magnitud de esta diferencia es exagerada por el procedimiento para determinar lignina (lignina detergente ácido; Hatfield et al., 1994). El cambio en la composición de la lignina es asociada con el desarrollo de la pared, un cambio de guayacil a lignina tipo siringyl, al parecer ocurre lo mismo en todos los forrajes (Buxton y Russell, 1988). Todas las especies de forrajes contienen ácidos fenólicos en la pared celular, los pastos tienen mayores concentraciones que las leguminosas (Jung y Deetz, 1993). Esta diferencia entre pastos y leguminosas es especialmente notable por los enlaces éster de los ácidos fenólicos, por cuanto los ácidos fenólicos involucrados en ambos enlaces son más similares en concentración entre los forrajes (Jung y Vogel, 1992). Los ésteres del ácido p-cumárico a lignina parecen estar presente en todos los forrajes, con mayores concentraciones en pastos que en leguminosas (Jung y Deetz, 1993). Relación entre la pared celular y su digestibilidad La lignina es el componente de la pared celular que es reconocido como limitante en la digestión de los polisacáridos de la pared celular en el rumen (Jung y Deetz, 1993). El efecto de la lignina sobre la digestibilidad de los pastos se asume que tiene una influencia directa sobre la digestibilidad de la pared más que sobre la digestibilidad de la materia orgánica total de los pastos (Van Soest, 1993). La lignina al parecer ejerce un efecto negativo sobre la digestibilidad de los polisacáridos de la pared celular para proteger los polisacáridos de hidrólisis enzimática (Jung y Deetz, 1993). El efecto de la lignina sobre la digestibilidad de la fibra se ha demostrado que es mayor en pastos que en leguminosas (Buxton y Russell, 1988). Varios estudios han demostrado la correlación negativa entre la concentración de lignina y la digestibilidad de la fibra o pared celular (Halim et al., 1989; Jung y Casler, 1991; Jung y Russelle, 1991; Jung y Vogel, 1992; Jung et al., 1994). La digestibilidad de la pared celular madura es menor que la de las paredes celulares inmaduras, con esto se asume que la composición de la lignina también afecta la digestibilidad de la pared celular (Jung y Allen, 1995). Contenido de lignina en pastos cultivados Generalmente los pastos contienen menos lignina que las leguminosas; sin embargo, conforme avanza la madurez, la lignina en las leguminosas permanece constante, pero en los pastos se incrementa. El promedio anual en el contenido de lignina de 13 pastos cultivados que se muestran en la Tabla 4.1. fue de 7 %. Con muy poca variación entre estaciones del año. Rhynchelytrum repens resultó con el mayor contenido de lignina y Cenchrus ciliaris Común y Cynodon dactylon (Cruza II) tuvieron el menor contenido. Debido a que la lignina es limita la digestión ruminal de los pastos, por tanto, R. repens puede ser el pasto con menor digestibilidad de los que se muestran en la Tabla 4.1. LOS PASTOS EN LA NUTRICIÓN DE LOS RUMIANTES 97 CAPÍTULO 4 tibilidad de los pastos de clima cálido está negativamente correlacionada con la concentración de lignina. 3DVWRV /XJDU\IHFKDGHFROHFWD (VWDFLRQHV\DxRGHFROHFWD ,QYLHUQR 3ULPDYHUD 9HUDQR 2WRxR 0HGLDDQXDO El contenido de lignina de los tallos duplica al de las hojas en los &HQFKUXVFLOLDULV&RP~Q 0DUtQ1/0p[LFR pastos cultivados cosechados en di&HQFKUXVFLOLDULV&RP~Q 0DUtQ1/0p[LFR &HQFKUXVFLOLDULV&RP~Q 7HUiQ1/0p[LFR ferentes municipios del Estado de &HQFKUXVFLOLDULV&RP~Q /LQDUHV1/0p[LFR Nuevo León, México (Tabla 4.4.). &HQFKUXVFLOLDULV1XHFHV 0DUtQ1/0p[LFR &HQFKUXVFLOLDULV/ODQR 0DUtQ1/0p[LFR Lo anterior pudiera implicar que las &\QRGRQGDFW\ORQ&UX]D, /LQDUHV1/0p[LFR hojas son mucho más digestibles &\QRGRQGDFW\ORQ&UX]D, 0DUtQ1/0p[LFR &\QRGRQGDFW\ORQ&UX]D,, 0DUtQ1/0p[LFR que los tallos debido a estos últimos 'LFKDQWKLXPDQQXODWXP /LQDUHV1/0p[LFR contienen más lignina. La lignifica'LFKDQWKLXPDQQXODWXP 0DUtQ1/0p[LFR 3DQLFXPFRORUDWXP /LQDUHV1/0p[LFR ción tiende a ser más extensa en te5K\QFKHO\WUXPUHSHQV 7HUiQ1/0p[LFR jidos estructurales como el xilema 3URPHGLRHVWDFLRQDO y esclerénquima. Los órganos de la Datos tomados de: Ramírez et al. (2002); Ramírez et al. (2003); Ramírez (2003); Ramírez et al. (2004); planta que contienen altas proporRamírez et al. (2005). ciones de estos tejidos, tales como los tallos, son menos digestibles que En general, el promedio de todos los genotipos del pasto aquellos que contienen bajas concentraciones. La proporCenchrus ciliaris tuvieron 4.5 % (Tablas 4.2. y 4.3.) y fue ción de tejidos y órganos lignificados por lo general aumenmenor al de la mayoría de los pastos cultivados que se muesta conforme la planta madura, por lo que a menudo hay una tran en la Tabla 1, con excepción de C. ciliaris común y C. relación negativa entre la digestibilidad y la madurez. Todactylon (Cruza II), ambos cosechados en Marín, N.L., dos estos procesos de la planta responden a factores amMéxico en 1994. Bajos niveles de lignina en los genotipos bientales que pueden afectar la cantidad e impacto de la ligpuede implicar una mayor utilización de la materia seca por nificación. Las temperaturas, humedad del suelo, cantidad parte de la flora microbial provocando una mayor producy calidad de luz y estado nutricional del suelo pueden tamción de ácidos grasos volátiles. Lo anterior ha sido corrobobién tener efectos directos o indirectos en la lignificación. rado por Akin et al. (1990) quienes reportaron que la digesLos estrés ambientales (bióticos o abióticos) que causan una Tabla 4.1. Contenido estacional de lignina (% base seca) de pastos introducidos colectados en diferentes municipios del Estado de Nuevo León, México en diferentes fechas 98 FACULTAD DE CIENCIAS BIOLÓGICAS, UANL LA LIGNINA EN LOS PASTOS Tabla 4.2. Contenido de lignina (% base seca) del híbrido buffel Nueces y cinco nuevos genotipos de buffel (Cenchrus ciliaris) colectados en diferentes fechas en Terán, N,L., México *HQRWLSRV /XJDUGHFROHFWD )HFKDVGHFROHFWD $JRVWR 1RYLHPEUH 1RYLHPEUH -XQLR )HUWLOL]DGRV &HQFKUXVFLOLDULV1XHFHV 7HUiQ1/0p[LFR &HQFKUXVFLOLDULV 7HUiQ1/0p[LFR &HQFKUXVFLOLDULV 7HUiQ1/0p[LFR &HQFKUXVFLOLDULV 7HUiQ1/0p[LFR &HQFKUXVFLOLDULV 7HUiQ1/0p[LFR &HQFKUXVFLOLDULV 7HUiQ1/0p[LFR 3URPHGLR Pastos como Hilaria belangeri (Figura 4.1.), Leptochloa filiformis (Figura 4.2.) y Panicum hallii (Figura 4.3.) resultaron con valores intermedios de lignina. Lo que los sitúa como poastos nativos de buena digestibilidad y valor forrajero. Datos tomados de: García-Dessommes et al. (2003ab) reducción en la relación tallo:hoja, por lo general, decrecen la calidad del forraje, debido a que las hojas son más nutritivas que los tallos (Moore y Jung, 2001).. Contenido de lignina en pastos nativos Los pastos nativos (Tablas 4.5. y 4.6.) por lo general contienen más lignina que los pastos cultivados (Tablas 4.1., 4.2. y 4.3.). Lo anterior pudiera deberse a que los pastos nativos tienen una mayor relación tallo:hoja que los pastos cultivados. Al haber más tallos aumentan su contenido de lignina. Destaca por su alto contenido de lignina, en todas las estaciones del año, el pasto Aristida longiseta, pero Digitaria insularis tuvo el menor contenido. Estacionalmente no hay mucha diferencia entre la mayoría de los pastos nativos. Referencias Ackerman-Beetle, A. y Johnson-Gordon, D. 1991. Gramíneas de Sonora. SAGRH COTECOCA. Gobierno del Edo de Sonora, Hermosillo, Son. Akin, D.E., Rigsby, L.L., Lyon, C.E. y Windham, W.R. 1990. Relationship of tissue digestion to textural strength in bermudagrass and alfalfa stems. Crop Sci. 30:990-993. Aman, P. 1993. Composition and structure of cell wall polysaccharides in forages. In: H.G. Jung, D.R. Buxton, R.D. Hatfield, and J. Ralph (editores). Forage Cell Wall Structure and Digestibility ASA-CSSA-SSSA, Madison, WI. EUA. p 183. Buxton, D.R. y Fritz, J.O. 1985. Digestibility and chemical composition of cell walls from grass and legume stems. In Proc. 15th. Int. Grassl. Science Council of Japan, Nishi-nasuno, Tochigi-ken, Japan. pp. 10231024 Buxton, D.R. y Russell, J.R. 1988. Lignin constituents and cell wall digestibility of grass and legume stems. Crop Sci. 28:553-560. Cherney, D.J.R. 2000. Forage Evaluation in ruminant nutrition. CABI Publishing, Wallingford, UK. pp. 281-300. Cobio-Nagao, C. 2004. Composición química y digestibilidad de la mate- LOS PASTOS EN LA NUTRICIÓN DE LOS RUMIANTES 99 CAPÍTULO 4 Tabla 4.3. Contenido de lignina (PC, % base seca) de 84 nuevos genotipos de pasto Cenchrus ciliaris colectados en Terán, N.L., México en noviembre del 2000. *HQRWLSRV 100 /LJQLQD *HQRWLSRV /LJQLQD *HQRWLSRV /LJQLQD *HQRWLSRV /LJQLQD 3URPHGLRGHWRGDVODVOtQHDV Datos tomados de: García-Dessommes et al. (2003ab) ria seca de pastos nativos colectados en Gral. Terán, N. L. Tesis. Facultad de Ciencias Biológicas, Universidad Autónoma de Nuevo León. Engels, F.M. 1989. Some properties of cell wall layers determining ruminant digestion. In: A. Chesson and E.R. Orskov (editores). PhysicoChemical Characterization of Plant Residues for Industrial and Feed Use. Applied Science Publishers, London. p. 80. Halim, R.A., Buxton, D.R. Hattendorf, M.J. y Carlson, R.E. 1989. Waterstress effects on alfalfa forage quality after adjustment for maturity differences. Agron. J. 81:189. García-Dessommes, G.J., Ramírez-Lozano, R.G., Foroughbakhch, R., Morales Rodríguez, R. y García-Díaz, G. 2003. Ruminal digestion and chemical composition of new genotypes of buffelgrass (Cenchrus ciliaris L.). Interciencia, 28: 220-224. García-Dessommes, G.J., Ramírez-Lozano R.G., Foroughbakhch, R., Morales-Rodríguez, R. y García-Díaz G. 2003. Valor nutricional y digestión ruminal de cinco líneas apomíticas del pasto buffel (Cenchrus ciliaris L.). Técnica Pecuaria en México, 41: 209-218. Gould, F. W. 1975. The grasses of Texas. Texas A & M University Press. Gould, F.W. y R.B. Shaw. 1992. Gramíneas Clasificación Sistemática. AGT FACULTAD DE CIENCIAS BIOLÓGICAS, UANL LA LIGNINA EN LOS PASTOS Tabla 4.4. Contenido de lignina (% base seca) en las hojas y tallos de pastos cultivados y colectados en diferentes municipios y fechas en el Estado de Nuevo león, México 3DVWRV /XJDU\IHFKDGHFROHFWD 3DUWHV /LQDUHV1/0p[LFR 0DUtQ1/0p[LFR 0DUtQ1/0p[LFR 0DUtQ1/0p[LFR /LQDUHV1/0p[LFR /LQDUHV1/0p[LFR /LQDUHV1/0p[LFR +RMDV 7DOORV +RMDV 7DOORV +RMDV 7DOORV +RMDV 7DOORV +RMDV 7DOORV +RMDV 7DOORV +RMDV 7DOORV &HQFKUXVFLOLDULV&RP~Q &HQFKUXVFLOLDULV&RP~Q &HQFKUXVFLOLDULV/ODQR &HQFKUXVFLOLDULV1XHFHV &\QRGRQGDFW\ORQ 'LFKDQWKLXPDQQXODWXP 3DQLFXPFRORUDWXP (VWDFLRQHV ,QYLHUQR 3ULPDYHUD 0HGLDDQXDO 9HUDQR 2WRxR Datos tomados de: Ramírez et al. (2001ab); Foroughbackhch et al. (2001); Ramírez et al. (2003); Ramírez (2003); Ramírez et al. (2005). Tabla 4.5. Contenido estacional de lignina (% base seca) en pastos nativos colectados en Marín, N.L., México en 1994 3DVWRVQDWLYRV (VWDFLRQHV\DxRGHFROHFWD ,QYLHUQR 3ULPDYHUD $ULVWLGDORQJLVHWD %RXWHORXDJUDFLOLV &HQFKUXVLQFHUWXV 0HGLDDQXDO 9HUDQR 2WRxR +LODULDEHODQJHUL 3DQLFXPKDOOLL 6HWDULDPDFURVWDFK\D 3URPHGLRHVWDFLRQDO Datos tomados de: Ramírez et al. (2004) LOS PASTOS EN LA NUTRICIÓN DE LOS RUMIANTES 101 CAPÍTULO 4 Tabla 4.6. Contenido estacional de lignina (% base seca) de pastos nativos colectados en Terán, N.L., México en 2001 y 2002 3DVWRVQDWLYRV %RXWHORXDFXUWLSHQGXOD %RXWHORXDWULILGD %UDFKLDULDIDVFLFXODWD 'LJLWDULDLQVXODULV &KORULVFLOLDWD /HSWRFKORDILOLIRUPLV 3DQLFXPKDOOLL 3DQLFXPREWXVXP 3DQLFXPXQLVSLFDWXP 6HWDULDJULVHEDFKLL 6HWDULDPDFURVWDFK\D 7ULGHQVHUDJURVWRLGHV 7ULGHQVPXWLFXV 3URPHGLRHVWDFLRQDO (VWDFLRQHV 0HGLDDQXDO ,QYLHUQR 3ULPDYHUD 9HUDQR 2WRxR 102 Datos tomados de: Cobio-Nagao (2004) Editor, S.A. México, D.F. pp. 45-332. Hatfield, R.D., Jung, H.G Ralph, J.. Buxton, D.R y Weimer, P.J. 1994. A comparison of the insoluble residues produced by the Klason lignin and acid detergent lignin procedures. J. Sci. Food Agric. 65:51-57. Jung, H.G., y. Casler, M.D. 1991. Relationship of lignin and esterified phenolics to fermentation of smooth bromegrass fibre. Anim. Feed Sci. Technol. 32:63. Jung, H.G., y Russelle, M.P. 1991. Light source and nutrient regime effects on fiber composition and digestibility of forages. Crop Sci. 31:1065. Jung, H.G. y Vogel, K.P. 1992. Lignification of switchgrass (Panicum virgatum L.) and big bluesteam (Andropogon gerardii Vitman) plant parts during maturation and its effect on fibre degradability. J. Sci. Food Agric. 59:169-174. Jung, H.G. y Deetz, D.A. 1993. Cell wall lignification and degradability. In: H.G. Jung, D.R. Buxton, R.D. Hatfield, and J. Ralph (editores) Forage Cell Wall Structure and Digestibility. ASA-CSSA-SSSA, Madison, WI. EUA. p. 315. Jung, H.G., Smith, R.R. y Endres, C.S. 1994. Cell wall composition and degradability of stem tissue from lucerne divergently selected for lignin and in vitro dry matter disappearance. Grass Forage Sci. 49:295. Jung, H.G. y Allen, M.S 1995. A review of lignin in forages. J Anim. Sci. 73:2774-2790. Iiyama, K., Lam, T.B.T. y Stone, B.A. 1990. Phenolic acids bridges between polysaccharides and lignin in wheat internodes. Phytochemistry (Oxf.) 29:733-740. Moore, H.J. y Jung, H.G. 2001. Lignin and fiber digestion. J. Range Manage. 54: 420-430. Morales-Rodríguez, R. 2003. Producción de materia seca y digestibilidad in situ del forraje de 84 genotipos del pasto buffel (Cenchrus ciliaris). Tesis de maestría. Facultad de Ciencias Biológicas, Universidad Autónoma de Nuevo León. Ralph, J., Hatfield, R.D., Quideau, S., Helm, R.F., Grabber, J.H. y Jung, H.G. 1994. Pathway of p-coumaric acid incorporation into maize lignin as revealed by NMR. J. Am. Chem. Soc. 116:9448-9452. Ramírez, R.G., Foroughbackhch, R., Háuad, L. Alba-Avila, J., García-Cas- FACULTAD DE CIENCIAS BIOLÓGICAS, UANL LA LIGNINA EN LOS PASTOS tillo, C.G. y Espinosa-Vázquez, M. 2001. Seasonal dynamics of dry matter, crude protein and cell wall digestion in total plant, leaves and stems of common buffelgrass (Cenchrus ciliaris L.). J. Appl. Anim. Res., 19:40-49. Ramírez, R.G., Foroughbackhch, R., Háuad, L. Alba-Avila, J. García-Castillo, C.G. y Espinosa-Vázquez, M. 2001. Seasonal variation of in situ digestibility of dry matter, crude protein and cell wall of total plant, leaves and stems of Nueces buffelgrass (Cenchrus ciliaris). J. Appl. Anim. Res., 20:38-47. Ramírez R.G., González-Rodríguez, H. y García-Dessommes, G. 2002. Chemical composition and rumen digestion of forage from kleingrass (Panicum coloratum). Interciencia, 27:705-709. Ramírez, R.G., González-Rodríguez, H. y García-Dessommes, G.J. 2003. Nutrient digestion of common bermudagrass (Cynodon dactylon L.) Pers. growing in northeastern Mexico, J. Appl. Anim. Res. 23: 93102. Ramírez, R.G., García-Dessommes, G.J. y González Rodríguez, H. 2003. Valor nutritivo y digestión ruminal del zacate buffel común (Cenchrus ciliaris L.), Pastos y Forrajes 26: 149-158. Ramírez-Lozano, R.G. 2003. Nutrición de Rumiantes: Sistemas Extensivos. Trillas, México, D.F. p. 212. Ramírez R.G., Haenlein, G.F.W., García-Castillo, C.G. y Núñez-González M.A. 2004. Protein, lignin and mineral contents and in situ dry matter digestibility of native Mexican grasses consumed by range goats. Small Rumin. Res. 52: 261-269. Ramírez, R.G. y González-Rodríguez, H. García-Dessommes, G. and Morales-Rodríguez, R. 2005. Seasonal Trends in the Chemical Composition and Digestion of Dichanthium annulatum (Forssk.) Stapf. J. Appl. Anim. Res. (En prensa). Terashima, N., Fukushima, K.L. He, F. y Takabe, K. 1993. Comprehensive model of the lignified plant cell wall. In: H.G. Jung, D.R. Buxton, R.D. Hatfield, and J. Ralph (editores). Forage Cell Wall Structure and Digestibility. ASA-CSSA-SSSA, Madison, WI. EUA. p. 247. Van Soest, P.J., Robertson, J.B. y Lewis, B.A. 1991. Methods for dietary fiber, neutral detergent fiber, and nonstarch polysaccharides in relation to animal nutrition. J. Dairy Sci. 74:3583-3597. Van Soest, P.J. 1993. Cell wall matrix interactions and degradation session synopsis. In: H.G. Jung, D.R. Buxton, R.D. Hatfield, and J. Ralph (Ed.) Forage Cell Wall Structure and Digestibility. p 377. ASA-CSSASSSA, Madison, WI. 103 Figura 4.1. Hilaria belangeri. Steud. Nombre común es mezquite. Son plantas en ramillete, sacando estolones delgados que producen nuevos ramilletes, los internudos de los estolones son alambrosos, de 5 a 20 cm de largo, las cañas son erectas, delgadas de 10 a 30 cm de alto, vellosas en los nudos, hojas planas de 1 a 2 mm de ancho, ásperas, más o menos pilosas, usualmente cortas, amacolladas en su base, frecuentemente formando un ramillete rizado, pero algunas veces, más largo y erecto. Las espigas usualmente de 2 a 3 cm de largo con 4 a 8 masas de espículas. Se distribuye muy bien en Texas y Arizona, EUA y el norte de México (Gould, 1975). LOS PASTOS EN LA NUTRICIÓN DE LOS RUMIANTES CAPÍTULO 4 104 Figura 4.2. Leptochloa filiformis (Lam.). Comúnmente conocida como zacate salado. Es un pasto anual, delgado con tallos decumbentes y dispersos en la base o erectos, menos de 1 m a más de 10 cm de alto; sus láminas generalmente son papiloso-híspidas o pilosas, delgadas y planas, midiendo de 1 a 7 mm de ancho; con lígulas cortas, de 1 a 2 mm de largo, son membranáceas, pestañosas. Las vainas son redondeadas, glabras o más o menos papiloso-pilosas con pelos largos débiles. La inflorescencia es extremadamente variable en tamaño, pero por lo general de la mitad a un tercio de la longitud de la planta, presenta ramas muy delgadas, de 3 a 8 cm de largo, laxamente esparcidas en el culmo y más o menos dispersas. Las espiguillas miden de 2 a 3 mm de largo y presenta de 2 a 3 flosculadas, con un color de rojo a morado, sus glumas subyúgales, con 1 nervadura, angostas, de 1 a 2 mm de largo, están acuminadas y escabrosas en la quilla, casi del largo de la espiguilla, las lemas miden de 1 a 2 mm de largo, y se encuentra comprimido-pubescente en las nervaduras, y no posee arista. Es una planta nativa; considerada como maleza de cultivos, se distribuye frecuente en pendientes secas, canales, orillas de arroyos, caminos, suelos perturbados y orillas de lagunas y represas; esta planta es solo consumida por el ganado cuando es tierna. Su valor forrajero es pobre (AckermanBeetle y Johnson-Gordon, 1991). El género Leptochloa alberga alrededor de setenta especies, distribuidas en las partes calientes de ambos hemisferios; once especies reportadas para Estados Unidos, todas nativas (Gould y Shaw, 1992). Figura 4.3. Panicum hallii (Vasey). Nombre común: panizo rayado. Perenne; en pequeños macollos, glauco-verdosa, erecta, 5-60 cm de alto; tallos simples o escasamente ramificados desde los nudos inferiores, glabros excepto los nudos comprimido-pubescentes; hojas comúnmente más o menos amontonadas hacia la base, láminas se enrollan o tuercen; las vainas inferiores más largas que los entrenudos cortos, escasamente pilosohirsutas hasta glabras; lígula cerca de 1.5 mm de largo; láminas erectas o casi erectas, de 4-15 cm de largo por 2-6 mm de ancho, planas, usual y escasamente papiloso-ciliadas hacia la base, de lo contrario glabras o con unos cuantos pelos largos y delicados en la superficie superior o escasamente papiloso-hirsutas en la superficie inferior, frecuentemente con un margen delgado, cartilaginoso y blanco. Panículas usualmente largo-comprimidas y excediendo mucho a las hojas, de 6-20 cm de largo, más bien flabeladas estrechamente en su contorno, las pocas ramas tensamente ascendentes, soportando ramillas cortas, comprimidas con espiguillas próximas en pedicelos cortos y comprimidos; espiguillas de 3-3-7 mm de largo por 1-1.5 mm de ancho, turgentes; primera gluma de la mitad a dos tercios de la longitud de la espiguilla, acuminada, 3-5 nervada; segunda gluma y lema estéril fuertemente 5-7 nervadas, 1.7-2 mm de largo, ovales, obtusas, color café olivo oscuro al madurar. Nativa; en cañones, lomeríos rocosos y pedregosos, sitios bajos y suelos húmedos, valor forrajero bueno (Ackerman-Beetle y Johnson-Gordon, 1991). FACULTAD DE CIENCIAS BIOLÓGICAS, UANL Capítulo 5 Digestibilidad de los pastos Introducción La digestión es el proceso de degradación de las macromoléculas del alimento en compuestos más simples que pueden ser absorbidos en el tracto gastrointestinal. La digestión en los mamíferos se lleva a cabo a través de dos estrategias. En un primer suceso, la digestión es mediada por la hidrólisis ácida en el estómago y por enzimas digestivas en el intestino delgado. En el segundo suceso, la digestión ocurre por un metabolismo fermentativo de los componentes de la dieta llevado a cabo por los microbios que ocupan ciertos compartimientos en el tracto digestivo. Virtualmente todos los mamíferos practican ambos tipos de digestión, pero el grado de énfasis en una u otra estrategia varía considerablemente. Las especies de herbívoros se caracterizan por la presencia de un sitio de fermentación extensiva en el tracto alimentario. En algunos animales, (por ejemplo el caballo) el principal sitio de fermentación ocurre en el intestino grueso (ciego y colon). En otros, la fermentación ocurre principalmente en un compartimiento modificado del estomago delantero. Los rumiantes, por supuesto, son animales que han logrado su máxima capacidad fermentativa en el estomago delantero. Aun cuando los rumiantes están caracterizados porque la fermentación ocurre principalmente en el retículo-rumen, la digestión que se lleva a cabo en abomaso e intestino delgado también son procesos vitales para el rumiante (Merchen y Bourquin, 1995). Estructura y funcionalidad del aparato digestivo del rumiante Boca.- Es el vestíbulo del aparato digestivo. Es una cavidad comprendida entre los huesos maxilares y palatinos, alargados según el eje de la cabeza, y con dos aberturas, una anterior y otra posterior. LOS PASTOS EN LA NUTRICIÓN DE LOS RUMIANTES 105 CAPÍTULO 5 Esófago.- Es un largo tubo músculo-membranoso, colocado entre la faringe y el estómago, el cual está encargado de conducir los alimentos durante la deglución. Sale de la parte inferior de la faringe y se dirige de arriba abajo y de adelante atrás, detrás de la laringe y de la tráquea en el borde inferior del cuello. 106 Estomago.- Es de gran tamaño y se divide en varios compartimientos. Su capacidad varía ampliamente con la edad y tamaño del animal. Consta de cuatro compartimentos o divisiones, llamadas rumen, retículo, omaso y abomaso. El rumen se considera el primer estomago, el retículo el segundo y así sucesivamente. El rumen, retículo y omaso pueden representar regiones que perdieron sus glándulas gástricas al mismo tiempo que sufrieron extensas modificaciones filogenéticas en tamaño y forma. En el caso de los bovinos, el estómago, del animal adulto alcanza una capacidad total de 120 a 200 litros, distribuidos de la siguiente manera: retículo-rumen 80 %, omaso 8 % y abomaso 12 %. De estas partes sólo el abomaso posee glándulas secretoras, siendo totalmente equiparable al estómago de los no rumiantes. El rumen es un órgano musculoso, rugoso y ovoide que se extiende desde el diafragma a la pelvis llenando casi por completo el lado izquierdo de la cavidad abdominal (100 litros de capacidad media en la vaca). Se divide en cuatro sacos por invaginaciones musculares de las paredes, llamados pilares. Son los llamados saco dorsal y ventral. Su mucosa posee numerosas papilas compuestas de células epiteliales escamosas estratificadas que sufren una profunda descamación, las cuales aumentan considerablemente la superficie de absorción por parte del rumen. El número y tamaño de las papilas depende del tipo del alimento ingerido. Así, las papilas son pequeñas y poco numerosas en animales con alimentación de tipo lácteo, aumentando en número y tamaño cuando además se les suministra forraje. La cavidad retículo-rumen sirve de hábitat a una vasta población microbiana. Es así como este órgano hace las veces de una verdadera cámara de fermentación microbiana, donde los nutrientes sufren su primer proceso degradativo. El retículo forma en gran medida una unidad estructural y digestiva con el rumen, ocupando la posición más craneal del estómago. Su mucosa está dispuesta en celdillas más o menos hexagonales, cubiertas de numerosas papilas cónicas. Comunica con el rumen a través del atrio vestibular y con el omaso por el orificio retículo-omasal. En el retículo destaca la llamada gotera o surco esofágico, disposición especial formada a partir de la desembocadura esofágica que está constituida por un surco alargado, limitado por dos labios, cuya función es decisiva en el transporte de líquidos, especialmente leche en el lactante. El omaso es una cámara pequeña, redondeada y tiene una capacidad de aproximadamente 10 kg, cuya mucosa presenta numerosos pliegues, colocados a maneras de hojas de un libro, que están cubiertas de papilas córneas, cortas, que sugiere una especie de molturación, que van desde el techo y las paredes laterales hacia el suelo. Posee dos orificios, el retículo omasal antes citado y el omaso-abomasal FACULTAD DE CIENCIAS BIOLÓGICAS, UANL DIGESTIBILIDAD EN PASTOS que, como su nombre indica, comunica el omaso con el abomaso. Ambos dada su disposición sobre la curvatura menor de la cavidad, están muy cerca uno de otro. Durante el paso de la ingesta por el omaso los procesos de fermentación microbiana no se detienen. La función principal de este órgano es, sin embargo, la absorción de agua, sales minerales y ácidos grasos contenidos en la ingesta. El abomaso, es como ya se ha señalado, el estómago glandular propiamente dicho, donde se inicia la digestión de los alimentos sobre la base de las enzimas digestivas del animal. La mucosa interna presenta dos zonas, una parte interna o fúndica que rodea el orificio omaso-abomasal y la zona pilórica que rodea el píloro que es estrecha y tubular. La zona fúndica presenta varios pliegues no modificables que conducen espiralmente el alimento en dirección al píloro, los cuales desaparecen en el límite de esta zona con la pilórica. Los vacunos adultos segregan alrededor de 30 litros diarios de jugo gástrico. Esta secreción contiene diversas enzimas digestivas, entre otras, pepsina y lipasas, como también considerables cantidades de ácido clorhídrico (Asplund, 1994). Intestino Delgado.- Es la parte más estrecha y delgada del intestino, su calibre es uniforme y su longitud variable, pero siempre es de muchos metros. Es cilíndrico, enrrollado en espiral, y presenta dos curvaturas llamadas gran y pequeña curvatura, esta es la que sirve para la inserción del mesenterio. Presenta tres partes o porciones iguales: duodeno, yeyuno e ileon, la cual se comunica con el ciego. El duode- no es la primera porción de intestino delgado y es donde se vierten las secreciones digestivas biliares y pancreáticas, las que, en unión con los jugos gástrico e intestinal, desdoblan los nutrientes de la ingesta en sus formas absorbibles. En la digestión, a cargo de las enzimas digestivas, las condiciones del pH imperante en el intestino juegan un papel importante. En el caso del rumiante, la neutralización es más lenta, debido probablemente a las grandes cantidades de ácido clorhídrico secretadas con el jugo gástrico, como también a la menor alcalinidad y menor contenido de bicarbonato de las secreciones digestivas biliares y pancreáticas. En la unión del intestino delgado con el intestino grueso se localiza el ciego, el cual es un saco lateral de unos 10 litros de volumen. Este compartimiento está conectado al conducto digestivo por una sola abertura. Tanto las condiciones de pH como de anaerobiosis en esta cavidad dan lugar a un nuevo proceso de fermentación microbiana de aquellos nutrientes que hasta aquí no han sido digeridos o absorbidos por el animal. Sin embargo, dicha fermentación no es de fundamental importancia para el rumiante, tanto por su escaso volumen como por el bajo índice de absorción que en el intestino grueso tienen a los compuestos resultantes de este proceso (Merchen, 1988). Intestino Grueso.- Continúa al intestino delgado, del cual se distinguen fácilmente por su calibre, que es muchas veces mayor, y por una serie de estrangulaciones y dilataciones o bombeamientos, que le dan un aspecto especial. Comienza en una dilatación o reservorio muy vasto, llamado ciego, el LOS PASTOS EN LA NUTRICIÓN DE LOS RUMIANTES 107 CAPÍTULO 5 cual continua con la parte llamada colon, que consta de dos secciones: el colon replegado y el colon flotante, terminando con el recto. La principal función del intestino grueso, es la absorción de agua. Es así como el total de materia seca del contenido intestinal aumenta desde 7% en el sector próximo del intestino grueso hasta un 15 a 18% en las heces. 108 Recto.- Es la continuación del colon flotante. Se le da el nombre de recto, por su disposición en dirección recta, de adelante hacia atrás. Se termina en el ano que es abertura posterior del tubo digestivo, que lo hace comunicar con el exterior. El recto sirve como una bolsa de depósito, donde se almacenan excrementos en el intervalo de las defecaciones. Su estructura es una capa carnosa, gruesa, que es de color rosado, presenta numerosos pliegues longitudinales y transversales. Carece de capa serosa, salvo en la parte anterior a la entrada del bacinete. Ano.- Es la abertura posterior del tubo digestivo. Está situado debajo de la cola. En su contorno se parece a la abertura de una bolsa que se cierra por medio de un nudo corredizo, formando un rodete, tanto más saliente mientras el animal es más joven y vigoroso. Su estructura es mucosa en su cara interna, que es de transición entre la piel y la mucosa verdadera, después musculosa, en forma de rodete carnoso, rojizo, llamado esfínter del ano: es la capa que mantiene cerrado el ano en los intervalos de las defecaciones, y exteriormente una capa de piel fina sin pelos que es untosa y suave, por la gran canti- dad de glándulas sebáceas que contiene (Hofmann, 1988). Microorganismos del rumen El rumen provee un ambiente apropiado, con un suministro generoso de alimentos, para el crecimiento y reproducción de los microorganismos. La ausencia de oxigeno (anaerobio) en el rumen favorece el crecimiento de especies especiales de bacteria, entre ellos las que pueden digerir las paredes celulares de plantas (celulosas y hemicelulosas) para producir azucares sencillos (glucosa). Los microorganismos fermentan glucosa para obtener la energía para crecer y producen ácidos grasas volátiles (AGV) como productos finales de fermentación. Los AGV cruzan las paredes del rumen y sirven como fuentes de energía para el rumiante. Mientras que crecen los microorganismos del rumen, producen aminoácidos, fundamentales para proteínas. Las bacterias pueden utilizar amoniaco o urea como fuentes de nitrógeno para producir aminoácidos. Sin la conversión bacteriana, el amoníaco y la urea serian inútiles para los rumiantes. Sin embargo, las proteínas bacterianas producidas en el rumen son digeridas en el intestino delgado y constituyen la fuente principal de aminoácidos para el animal (Yokohama, 1988). Población microbiana Las bacterias constituyen la mitad de la biomasa en el rumen normal y son responsables de la actividad metabólica. Los hongos constituyen hasta el 8% de la biomasa FACULTAD DE CIENCIAS BIOLÓGICAS, UANL DIGESTIBILIDAD EN PASTOS intraruminal y se ubican en la ingesta de lento movimiento evitando su rápido lavado. Y contribuyen a la digestión de pastos de baja calidad. Los protozoos son los organismos más notables en el rumen, forman gran proporción de la biomasa, entre un 20 – 40 %, pero su contribución es menor por la gran retención y la menor actividad metabólica. Su tiempo de generación es grande y la supervivencia en el rumen depende de las estrategias que reducen el lavado (Van Soest, 1994). Leucaena, fenoles vegetales como la cumarina (1,2benzopirona), la canavanina, análoga a la arginina, componente de la leguminosa Canavalia ensiformis, que inhibe algunas bacterias del rumen, pero es hidrolizada por otras. El rumen incluye entre 1010 y 1011 bacterias/ml, y más del 75 % se asocia a partículas alimenticia. La densidad general no varía con la dieta, pero el número de las diferentes especies es asociado a la disponibilidad del sustrato para la fermentación (Tabla 5.1.). Bacterias Tabla 5.1. Número y volumen de microorganismos en el rumen Las bacterias del rumen son las que realizan varias de las funciones vitales para el desarrollo del huésped. Las fibras y otros polímeros insolubles vegetales que no pueden ser degradados por las enzimas del animal son fermentados a AGV, principalmente acético, propiónico y butírico, y a gases como CO2 y CH4. Los AGV atraviesan las paredes del rumen y pasan a la sangre, luego son oxidados en el hígado y pasan a ser la mayor fuente de energía para las células. La fermentación esta acoplada al crecimiento microbiano y las proteínas de la biomasa constituyen la principal fuente de nitrógeno para el animal. Además de las funciones digestivas, los microorganismos del rumen sintetizan aminoácidos y vitaminas, principalmente del complejo B, siendo la principal fuente de esos nutrientes esenciales para el animal (Mackie et al., 2000). También algunas bacterias degradan componentes tóxicos de la dieta como los aminoácidos mimosina y sus derivados, componentes del forraje de *UXSR 1~PHURPO 9ROXPHQ &HOXODU %LRPDVD 0JPO 7J GHELRPDVD WRWDO PLQ %DFWHULDVSHTXHxDV [ 6HOHQRPRQDV [ 2VFLOORVSLUDIODJHOODWHV [ 3URWR]RRVFLOLDGRV (QWRGLQLD [ [ K [ [ ,VRWULFKD(SLGLQLD [ [ K +RQJRV [ [ K 'DVK\WULFKD'LSORGLQLD Las bacterias del rumen son predominantemente anaerobias estrictas, pero también coexisten con anaerobias facultativas, adheridas a las paredes del rumen, estas usan el O2 que proviene del torrente circulatorio y son muy importantes en las funciones del rumen siendo las mas importantes las que fermentan la celulosa. Muchas de las bacterias del rumen son altamente especializadas, poseen numerosos requerimientos nutricionales que le deben ser LOS PASTOS EN LA NUTRICIÓN DE LOS RUMIANTES 109 CAPÍTULO 5 110 aportados por el sistema. Otras, por el contrario, emplean pocas fuentes de energía y otro grupo son más inconstantes en el requerimiento de energía. Cuando dos o más microorganismos combinan sus capacidades metabólicas para degradar una sustancia que no puede ser catabolizada en forma individual por ninguno de los dos se llega al concepto de sintrofia, en el rumen existen grupos sintróficos relacionados a la degradación de fibras, incluyendo, por ejemplo a los celulolíticos, hemicelulolíticos y los microorganismos que los suceden, como las bacterias metanogénicas. Los más competitivos presentan adhesión al sustrato y almacenamiento de energía dentro de la célula (Forsberg et al., 2000). Las bacterias del rumen se caracterizan en base a su morfología, productos de fermentación, sustrato que utilizan, relación molar (G+C) % de su DNA y por su movilidad (Tabla 5.2.). Bacterias celulolíticas La degradación de la celulosa es la principal función del rumen. Las bacterias activas en el rumen se adhieren a fragmentos vegetales y segregan sus enzimas hidrolíticas que liberan oligosacaridos solubles, principalmente celobiosa, utilizada por la microflora calulolítica y por otros microorganismos que no degradan la celulosa. Si esta no se hidroliza puede producirse una inhibición de otro grupo de bacterias al no estar presente el sustrato que requieren. Es posible que la glucosa, otro producto de la celulólisis, pueda inhibir la actividad de algunas enzimas también. Muchas de las es- pecies celulolíticas pueden también degradar la fracción mal llamada hemicelulosa. Bacterias amilolíticas La mayoría de ellas no usan la celulosa. Las enzimas amilolíticas se encuentran muy distribuidas entre las bacterias y son las que aseguran la conversión de materiales amiláceos, como granos de cereales, en AGV. Con la presencia de amoniaco el proceso es más eficiente (Forsberg et al., 2000). Hongos Los flagelados poseen zoosporas móviles y colonizan regiones dañadas de los tejidos vegetales a las dos horas de la ingestión, en respuesta a materiales solubles. A las 22 horas más del 30% de las partículas mayores se ven invadidas por rizoides. Su rol principal es facilitar la desaparición de la pared celular de la célula vegetal. Se han identificado especies de 4 géneros: Neocallimastix, Caecomyces (formalmente Sphaeromona), Pyromyces (formalmente Phyromonas) y Orpinomyces. Su ciclo de vida implica un cuerpo fructificante (esporangio) originado a partir de una zoospora móvil que se adhiere a las fibras y desarrolla esporangios y filamentos rizoidales, que penetran la matriz lignocelulósica, donde actúan las enzimas. Los hongos liberan un complejo celulósico más soluble que el de las bacterias y atacan partículas rugosas a las que fermentan más rápidamente que FACULTAD DE CIENCIAS BIOLÓGICAS, UANL DIGESTIBILIDAD EN PASTOS Tabla 5.2. Características de algunas bacterias del rumen 2UJDQLVPR 0RUIRORJtD 0RYLOLGDG 6XVWUDWR 3URGXFWRVGHIHUPHQWDFLyQ )LEUREDFWHUVXFFLQRJHQHV %DFLOR &HOXORVD 6XFFLQDWRDFHWDWRIRUPLDWR %XW\ULYLEULRILEULVROYHQV %DFLORFXUYDGR &HOXORVD $FHWDWR IRUPDWR ODFWDWR EXWLUDWR + \ &2 5XPLQRFRFFXVDOEXV &RFR &HOXORVD $FHWDWRIRUPDWR+\&2 &ORVWULGLXPORFKKHDGLL %DFLORHVSRUD &HOXORVD $FHWDWRIRUPDWREXWLUDWR+\&2 5XPLQRFRFFXV)ODYHIDFLHQV &RFR &HOXORVD $FHWDWRVXFFLQDWR\+ &ORVWULGLXPSRO\VDFFKDURO\WLFXP %DFLORHVSRUD &HOXORVD\DOPLGyQ $FHWDWRIRUPLDWREXWLUDWR\+ %DFWHURLGHVUXPLQLFROD %DFLOR $OPLGyQ )RUPDWRDFHWDWR\VXFFLQDWR 5XPLQREDFWHUDP\ORS+LOXV %DFLOR $OPLGyQ )RUPDWRDFHWDWR\VXFFLQDWR 6HOHQRPRQDVUXPLQDQWLXP %DFLORFXUYDGR $OPLGyQ $FHWDWRSURSLRQDWR\ODFWDWR 6XFFLQRPDVDP\ORO\WLFD 2YDODGR $OPLGyQ $FHWDWRSURSLRQDWR\VXFFLQDWR 6WUHSWRFRFFXV%RULV &RFR $OPLGyQ /DFWDWR 6HOHQRPRQDVODFWLO\WLFD %DFLORFXUYDGR /DFWDWR $FHWDWR\VXFFLQDWR 0HJDVS+DHUDHOVGHQLL &RFR /DFWDWR $FHWDWR SURSLRQDWR EXWLUDWR YDOHUDWR FRSURDWR+\&2 9LHOORQHOODSiUYXOD &RFR /DFWDWR $FHWDWRSURSLRQDWR\+ /DFKQRVSLUDPXOWLSDUXV %DFLORFXUYDGR 3HFWLQD $FHWDWRIRUPDWRODFWDWR+\&2 $QDHURYLEULROLSRO\WLFD %DFLOR /LSROLWLFR $FHWDWRSURSLRQDWR\VXFFLQDWR (XEDFWHULXPUXPLQDQWLXP %DFLOR ;LODQR )RUPDWREXWLUDWRODFWRVD\&2 /DFWREDFLOOXVUXPLQLV %DFLOR $]XFDUHV /DFWRVD /DFWREDFLOOXVYLWXOLQXV %DFLOR $]XFDUHV /DFWRVD 0HWKDQREUHYLEDFWHU UXPLQDQWLXP %DFLOR 0HWDQyJHQRV &+GH+&2RIRUPDWR 0HWKDQRPLFURELXPPRELOH %DFLOR 0HWDQyJHQRV &+GH+&2RIRUPDWR (XEDFWHULXPR[LGRUHGXFHQV %DFLOR $URPiWLFRV /DFWRVD\+ las bacterias. Alimentos altamente molidos o concentrados presenta menos hongos. Los hongos producen AGV, gases y trazas de etanol y lactato. · Protozoarios · Su principal función es ingerir partículas del tamaño de las bacterias, como almidón, fibras, cloroplastos. La mayoría · de los componentes son Ciliata, los organismos unicelulares más complejos. Su biomasa es similar a la de las bacterias, pero pueden sobrepasarla más de 3 veces según la dieta, o inclusive desaparecer. Las diferentes especies varían en tamaño, entre 25 a 250 micras, agrupándose en 17 géneros de la sub clase Entodiniomorphes y dos géneros de la sub clase Holotriches, que difiere en su morfología y metabolismo. Las especies presentes varían con la especie animal, la localidad y la dieta. Los tiempos de generación oscilan entre 0.5 a 2 días. Los más lentos pueden llegar a desaparecer con los fluidos del rumen, varios permanecen adheridos a fragmentos de alimento, por lo que son más retenidos que las bacterias y una gran parte pueden ser lisados en el rumen. Los ciliados difieren de las bacterias en varios aspectos: Son muy móviles e invaden a los alimentos recién ingeridos tan rápido como las bacterias a pesar de estar en menor número. Pueden almacenar glúcidos adicionales en forma de polímeros insolubles, la amilopectina. Son mas fácilmente destruidos por la acidez, los Holotriches son los más sensibles que los LOS PASTOS EN LA NUTRICIÓN DE LOS RUMIANTES 111 CAPÍTULO 5 · · 112 Entodinomorphes. No pueden sintetizar aminoácidos a partir de compuestos simples de nitrógeno y dependen de las bacterias, empleando los aminoácidos luego de fagocitarlas (1 % de las bacterias son fagocitadas en cada minuto). Son responsables, en gran parte, de la producción de amonio en el rumen. Los ciliados no son esenciales para los procesos de fermentación pero ayudan a que sean más eficientes. Ciliados celulolíticos.- Pocos géneros de Epidinium están implicados en la fragmentación de los restos vegetales. Estos segregan enzimas que causan la separación de las células y la fragmentación del material. Más de la mitad de la actividad celulolítica del rumen se asocia con los ciliados. La mayor actividad se da cuando la enzima es liberada luego de la lisis celular que ocurre por exposición al O2 en la ruminación o por hipotonía causada luego de la ingestión de agua. Ciliados amilolíticos.- Todos los Entodiniomorphes usan almidón cuyo exceso almacenan como amilopectina. Pero uno de los dos géneros Holotriches no puede usar almidón. La mayoría prefiere azucares solubles y se mueven rápidamente hacia ellos. Otras fuentes de energía: los ciliados son responsables del 30-40 % de la lipólisis. Incrementan el contenido de ácidos grasos saturados. Un 75 % de los lípidos microbianos están normalmente asociados con los ciliados. No son muy importantes en la degradación de proteínas de la dieta, usan las de las bacterias fagocitadas. El rumen es un complejo ecosistema, el cual se encuentra en forma dinámica, influenciado por el ingreso desde el exterior del alimento, agua, otros microorganismos etc., la salida de los materiales al intestino, y por las complejas interacciones que se dan dentro de este. Hay que tener en cuenta que funciona como una cámara de fermentación en donde rigen condiciones casi anaeróbicas (existe aproximadamente un 0.6% de oxigeno), con condiciones reductoras, pH levemente ácido, y temperatura alrededor de 39º C. La principal fuente de energía se obtiene por medio de la fermentación de glúcidos. Así los microorganismos obtienen energía, con liberación de AGV, hidrógeno, dióxido de carbono, agua, metano, según el caso que sea. Los AGV más importantes son el ácido acético, el ácido propiónico y el ácido butírico. Es mayor el aprovechamiento energético cuando se produce ácido propiónico que cuando se produce ácido acético, dado que en este último se libera H2 y CH4, que son formas de energía disipada. El animal aprovecha los AGV como principal fuente de energía por medio de la absorción de los mismos, a través de la pared ruminal. Hay que mencionar que es de gran importancia el efecto que tiene el pH de rumen, dado que infiere en los distintos procesos químicos, niveles de poblaciones, interacciones, sistemas de regulación, entre otros (Mackie et al., 2000). pH del rumen y su regulación Los valores de pH fluctúan en el rumen, influenciado por distintos factores, como por ejemplo el tipo de alimento y FACULTAD DE CIENCIAS BIOLÓGICAS, UANL DIGESTIBILIDAD EN PASTOS tiempo de consumo. Los valores fisiológicos normales de pH se encuentran entre 5.4 y 6.9. Tres aspectos se deben de tener en cuenta como factores de regulación: 1. Influencia de los AGV en el aumento de la acidez. En los procesos fermentativos se producen estos AGV. Se alcanza la mayor acidez luego de aproximadamente 3 horas de la ingestión, siendo en general mayor cuando los procesos de fermentación son más intensos. 2. La cantidad de saliva secretada durante la masticación y la rumia. Dado que la saliva tiene un pH entre 8.1 y 8.3, que la hace de agente neutralizante de ácidos grasos, propiedad conferida por las sales que contiene (bicarbonatos, fosfatos de sodio y potasio). La cantidad de saliva secretada fluctúa entre 100 y 180 litros en un bovino. 3. La velocidad de absorción de AGV funciona como amortiguador de la acidez que estos producen. A menor grado de disociación, mayor es la velocidad. Si el pH baja, se reduce el grado de disociación y por lo tanto, al aumentar la velocidad de absorción, se logra una cierta estabilización del pH. El proceso de ruminación es importante en de la dinámica de la regulación del pH debido al gran aporte de saliva al medio. Durante este proceso se aporta tres veces más saliva que cuando se produce la masticación. El tiempo de rumia es afectado por el tipo de alimento y sus propiedades físicas y químicas (Merchen, 1988). Digestión microbial y fermentación en el rumen La digestión microbial y la síntesis de los componentes microbiales en el rumen requiere ciertas condiciones que tiene que proporcionar el animal hospedero. Estas incluyen la retención de la digesta y los microbios ruminales por períodos prolongados de tiempo, anaerobiosis, temperatura constante (39º C), pH neutral o ligeramente ácido (5.5. a 7.0) y remoción de los productos terminales. En muchas circunstancias este medio ambiente es cercanamente controlado por mecanismos tales como el tipo y cantidad de alimento consumido, secreción salival durante el consumo y ruminación, mezclado del alimento vía ruminal llevado a cabo por contracciones, difusión/secreción de materiales (urea, bicarbonato) hacia el rumen, absorción de los productos finales (ácidos grasos volátiles [AGV], amoniaco), y pasaje de residuos no digeridos y células microbiales fuera del rumen. Los microbios ruminales están bien adaptados para fermentar una gran variedad de glúcidos incluyendo azúcares, almidones y polisacáridos complejos de las paredes celulares (celulosa, hemicelulosas, pectinas). Los productos finales de la fermentación llevada a cabo por la gran población de microbios ruminales son los tres principales AGV (acético, propiónico y ácido butírico), metano y dióxido de carbono (Baldwin y Allison, 1983). Una porción de la proteína de la dieta también es degradada y fermentada por los microorganismos del rumen resultando con la producción adicional de AGV y pequeñas cantidades de ácidos grasos de cadena ramificada (isovalerato, isobutirato, 2-metilbutirato) LOS PASTOS EN LA NUTRICIÓN DE LOS RUMIANTES 113 CAPÍTULO 5 114 y amoniaco. Los AGV producidos en el rumen son absorbidos en el sitio y proveen al animal hospedero del 50 a 80 % de la energía total metabolizable. Los microorganismos ruminales también sintetizan cantidades substanciales de proteína que puede ser digerida postruminalmente. Las pérdidas de energía y las posibles de proteína ocurren en conjunción con el metabolismo microbial fermentativo. En general, alrededor del 75 % de la energía del substrato fermentable (glúcidos) se recupera como AGV que el rumiante hospedero puede utilizar. La energía restante contenida en el substrato original se pierde durante la fermentación a través de tres rutas principales: 1) calor de combustión y productos finales que no son utilizados por el hospedero (principalmente metano), 2) calor producido durante la fermentación del substrato y 3) calor producido por la asimilación de los componentes del substrato por las células microbiales. Estas pérdidas son tolerables cuando el substrato fermentable consiste de materiales que de alguna manera no están disponibles para el hospedero (polisacáridos de la pared celular), pero en gran medida la eficiencia puede comprometerse, con la cual los rumiantes utilizan otros glúcidos y una gran cantidad de proteínas que pueden ser rápidamente digeridas por procesos hidrolíticos/ enzimáticos (Merchen, 1988).. Digestión en el intestino delgado La cantidad de nutrientes que llegan al intestino delgado en los rumiantes es relativamente mucho menor de la que in- gresa en la dieta debido a la gran fermentación que se lleva a cabo en el rumen. Los animales que consumen dietas a base de forraje, aparentemente solo del 5 al 8 % de los glúcidos rápidamente digeribles, escapan a la digestión ruminal. Otros nutrientes provenientes de la dieta que llegan al intestino delgado son los lípidos de las plantas y proporciones variables de glúcidos de la pared celular y proteína que no son degradadas por los microbios ruminales. En adición a estos contribuyentes de la dieta, cantidades substanciales de células microbiales de origen ruminal entran al intestino delgado (Van Soest, 1994). La digestión en estos sitios es intervenida por la presencia de ácido en el abomaso y la presencia de más de 40 enzimas digestivas (Langer y Snipes, 1991). La digestión enzimática es iniciada por secreciones de la mucosa abomasal, pero ocurre principalmente en el intestino delgado donde es mediada por enzimas pancreáticas e intestinales (Merchen, 1988). Es probable que existan ciertas limitaciones para que se lleven a cabo la digestión de los nutrientes microbiales y de la dieta que alcanzan el intestino delgado cuando los animales están consumiendo dietas con alto contenido de forraje (Ørskov y Kay, 1987) otro que no corresponda a los residuos de paredes celulares no fermentadas. Una gran digestión de estos nutrientes puede ser asistida por la más o menos continua naturaleza digestiva en el rumiante. Los animales en pastoreo y aquellos que consumen ad libitum invierten una gran proporción de su tiempo en la ruminación. Estas actividades, acompañadas con la gran cantidad de digesta en el retículo-rumen, resulta en un flujo FACULTAD DE CIENCIAS BIOLÓGICAS, UANL DIGESTIBILIDAD EN PASTOS de la digesta hacia el tracto postruminal en una forma más o menos continua. Esto, por su parte, estimula la liberación continua de secreciones digestivas hacia el abomaso e intestino delgado. Digestión microbial y fermentación en el ciego y colon Los rumiantes obtienen cierto beneficio durante la fermentación secundaria en el ciego y colon proximal. Estos compartimientos, están caracterizados por la presencia de una población microbial activa. Cuando las dietas son a base de forraje, los principales substratos que ingresan al ciego y colon son los materiales indigestibles compuestos por la pared celular de las plantas y componentes indigestibles de las células bacteriales. Estos substratos son más refractarios que aquellos que entran en otros segmentos del trato digestivo, aunque la susceptibilidad de los residuos de las paredes celulares al ataque microbial puede ser mejorada una vez que quedan expuestas a la digestión abomasal e intestinal y por reducciones en el tamaño de partícula del alimento. La digestión en el ciego es ayudada estrictamente por la actividad microbial; no hay enzimas digestivas asociadas con la mucosa del ciego y colon (Merchen, 1988). La digestión en el ciego es menos intensiva que en otros sitios del tracto digestivo debido a que los substratos que llegan a este sitio son más refractarios y porque el tiempo de retención es más corto que en el rumen (7 a 8 horas). Los conteos de bacterias viables en el contenido del ciego se encuentran en un intervalo de 107 a 109 g-1 de material dige- rido. Las especies de bacterias importantes en el ciego y colon son idénticas a aquellas del retículo-rumen (Tabla 5.2.) aunque los números relativos varían. Los protozoarios están ausentes en el ciego de los rumiantes. Las condiciones fisicoquímicas del ciego son similares a las del retículo-rumen; el pH es de neutral a ligeramente ácido (6.0-7.7) y las concentraciones totales de AGV se encuentran en un intervalo de 60 a 90 %, de los que típicamente son observados en el rumen (Merchen y Bourquin, 1995). Digestibilidad de los polisacáridos estructurales (pared celular) Los principales polisacáridos estructurales de la pared celular de los forrajes incluyen substancias pécticas, hemicelulosas y celulosa. Las substancias pécticas son escasas en los pastos, pero se encuentran en grandes cantidades en las leguminosas, algunas veces comprenden un poco más de 100 g kg-1 de la materia seca (MS). Las substancias pécticas se encuentran en altas concentraciones en la lámina media, especialmente en las plantas dicotiledóneas. Bajas concentraciones de substancias pécticas se encuentran en la pared celular primaria. No ocurre deposición de pectina durante el engrosamiento de la pared celular secundaria (Lam et al., 1990). Las hemicelulosas representan un grupo muy diverso de polisacáridos que incluyen a las (glucurono) arabinoxylanas, xyloglucanas, gluconomananas y enlaces mixtos de glucanas. Las arabinoxylanas son los polisacáridos hemicelulolíticos predominantes en las pared celulares pri- LOS PASTOS EN LA NUTRICIÓN DE LOS RUMIANTES 115 CAPÍTULO 5 116 marias de los pastos, mientras que las xyloglucanas son las más abundantes hemicelulosas en la pared celular primaria de las leguminosas. Las glucuronoarabinoxylanas son los principales polisacáridos hemicelulolíticos depositados durante el engrosamiento secundario de las paredes celulares de los pastos y leguminosas (Chesson y Foresberg, 1988). Usualmente las hemicelulosas contribuyen en una mayor proporción al total de los polisacáridos en las paredes celulares secundarias que en las paredes celulares primarias (Chesson, 1990). Las hemicelulosas del forraje son menos digeridas por los rumiantes que las pectinas. El grado de digestión de las hemicelulosas varía considerablemente y es dependiente de factores tales como genotipo, estado de madurez y prácticas de alimentación. La celulosa es el polisacárido más abundante en las paredes primarias y secundarias de los forrajes. La celulosa sintetizada durante el engrosamiento de las paredes celulares es considerablemente más cristalina que la celulosa de las paredes celulares primarias (Lam et al., 1990). Al igual que las hemicelulosas, la celulosa del forraje no es digerida completamente. Hojas vs tallos Las hojas y los tallos de los forrajes difieren considerablemente en su composición química y digestibilidad. Generalmente las hojas contienen más proteína y baja concentración de polisacáridos estructurales y lignina que los tallos de todos los forrajes. La digestibilidad in vitro e in situ de las hojas, usualmente es considerablemente mayor que la de los tallos. La mayor digestibilidad observada en las hojas se debe a que las hojas contienen menos pared celular y los polisacáridos de la pared celular son más digestibles (Jung y Vogel, 1992). La magnitud de las diferencias en digestibilidad de hojas y tallos está positivamente correlacionada con el incremento en el nivel de madurez del forraje (Albrecht et al., 1987). De hecho, en las primeras etapas de crecimiento de los pastos, la digestibilidad in vitro de los tallos puede ser ligeramente mayor que las de las hojas. Factores que afectan el grado de digestión de la pared celular El incremento en la madurez fisiológica de las plantas forrajeras provoca una tremenda reducción en la relación hoja:tallo (Albrecht et al., 1987). En los pastos, el contenido de pared celular y lignina aumentan conforme aumenta la madurez (Jung y Vogel, 1992). Consecuentemente, las digestibilidades de hojas y tallos declinan conforme se incrementa la madurez. El incremento en el nivel de consumo en rumiantes, está asociado con una reducción en el grado de digestión de la materia seca y de los polisacáridos de la pared celular. A altos consumos, disminuciones en la digestibilidad de la pared celular es dos o tres veces mayor que los glúcidos no estructurales. La disminución en la digestibilidad resulta debido a que hay un menor grado de digestión resultado de que hay un menor tiempo de residencia del alimento en el FACULTAD DE CIENCIAS BIOLÓGICAS, UANL DIGESTIBILIDAD EN PASTOS rumen y en todo el tracto digestivo (Staples et al., 1984) Los efectos asociativos se refieren a las diferencias no aditivas en digestibilidades de los ingredientes de dietas comparadas con las digestibilidades determinadas para los mismos ingredientes cuando son consumidos individualmente. Digestibilidades de ingredientes pueden ser aditivos en consumos a nivel de mantenimiento, pero hay efectos asociativos negativos cuando hay altos consumos con dietas conteniendo una mezcla de forraje y concentrados (Moe, 1981). Existe varias teorías para explicar los efectos asociativos negativos de los glúcidos no estructurales sobre la digestión de la fibra: 1) Existe una preferencia de los microorganismos ruminales por los glúcidos no estructurales en vez de los estructurales, 2) un decremento en el pH ruminal por una rápida digestión de los glúcidos no estructurales y 3) hay una competencia por los nutrientes esenciales resultado en una proliferación de los microorganismos que prefieren digerir los glúcidos no estructurales. Sin embargo, se han observado efectos asociativos positivos cuando los animales consumen diferente fuentes de forrajes, por ejemplo una combinación de pastos y leguminosas (Hunt et al., 1985). En la Tablas 5.1. a la 5.10. las características de la digestibilidad in situ de la fibra detergente neutro (FDN) y proteína cruda (PC), respectivamente se determinaron utilizando la técnica de la bolsa nylon que a continuación se describe: Técnica de la digestibilidad in situ La técnica in situ llamada también técnica de la bolsa nylon, técnica in sacco, técnica de la bolsa de fibra artificial. En esta técnica, la suspensión del material alimenticio en el rumen proporciona un íntimo contacto con el medio ambiente ruminal. No hay mejor vía para simular el ambiente ruminal (temperatura, pH ruminal, buffer, sustratos, enzimas) dentro de un régimen alimentario, que el mismo rumen, aunque el alimento no está sujeto a una total experiencia ruminal, por ejemplo: masticación, ruminación y pasaje. Esta técnica se ha utilizado por muchos años y es la base para predecir la digestión en diferentes sistemas de alimentación (Waldo y Glenn, 1984). No obstante, el incremento en su popularidad ha sido sujeto a una evaluación extensiva y criticada con respecto a los muchos factores inherentes que influyen en la digestión (porosidad de la bolsa, contaminación bacteriana, dieta del animal, entre otros). Varios aspectos de la técnica in situ interactúan en la naturaleza y pueden influir en la interpretación de los resultados. Se usaron borregos (Rambouillet x Pelibuey) castrados y fistulados del rumen. Durante la prueba los borregos fueron alimentados con heno de alfalfa a libre acceso. Se usaron bolsas nylon (5x10 cm y 53 mm de tamaño de poro) que contenían 4 g de muestra molida. Las bolsas se introdujeron y suspendieron en la parte ventral del rumen con una secuencia de incubación de 4, 8, 12, 24, 36 y 48 horas. Al finalizar, fueron lavadas con agua circulante hasta que el agua quedó clara. Posteriormente, fueron secadas en una estufa a 55° C durante 48 h. La desaparición del material en la hora cero, fue estimada en bolsas sin incubar en el rumen, lavándolas de la misma manera que las de los demás perío- LOS PASTOS EN LA NUTRICIÓN DE LOS RUMIANTES 117 CAPÍTULO 5 dos. Al residuo de cada bolsa en cada período de incubación se le determinó su contenido de FDN y PC. El porcentaje de desaparición de la FDN Y PC se estimó usando la siguiente ecuación: Desaparición, % = ((peso inicial-peso final)/peso inicial) x 100 Para determinar las características de la digestión de la FDN y PC los porcentajes de desaparición de cada fracción fueron usados en la siguiente ecuación: p = a + b (1-e-ct ), 118 donde p es la tasa de desaparición a un tiempo t, a es un intercepto representando la porción de la FDN o PC solubilizada al inicio de la incubación (t = 0), b es la porción de la FDN o PC lentamente degradada en el rumen, c es la tasa constante de desaparición de la fracción b, y t es el tiempo de incubación. Los parámetros no lineales a, b y c y la degradabilidad efectiva de la FDN (DEFDN) y PC (DEPC) = (a+b) c/(c+k)(e(ct)T ) fueron calculadas por medio del paquete computacional NEWAY, k es la tasa de salida de sólidos del rumen de los borregos y T es la fase lag (tiempo en que los microorganismos inician la degradación de la FDN o PC en el rumen). La DEFDN y DEPC fueron estimadas usando un valor de k de 2%, el cual representan un nivel de consumo bajo (Ørskov, 2000). Digestibilidad de la pared celular de pastos cultivados La degradabilidad efectiva de la FDN (DEFDN) fue variable entre los pastos cultivados que aparecen en la Tabla 5.3. La media anual más elevada lo tuvo C. ciliaris cosechado en Marín, N.L., México en 1994. Sin embargo, en ese mismo año, D. annulatum proveniente de la misma región, resulto con la media anual más baja. También hubo diferencias entre estaciones del año, aparentemente, durante las estaciones húmedas (verano y otoño) la DEFDN fue más elevada comparada con la de las estaciones secas (invierno y primavera). Como se mencionó previamente, con el aumento en la madurez de la planta se incrementa el contenido de lignina que es el principal causante de la reducción en la digestión de la pared celular. Un factor externo que también limita la degradabilidad de la pared celular (FDN) es la pared cuticular presente en la superficie de la planta. La cutícula es indigestible para los microorganismos y, por tanto, sirve como una barrera que previene el acceso de los microorganismos a la superficie exterior de la planta. La presencia de la pared cuticular necesita que los microorganismos ruminales ataquen a la superficie interior de la planta de las células rotas. La cutícula se incrementa bajo condiciones de altas temperaturas, luz y acidez. Y es se encuentra en grandes concentraciones en la base axial de las hojas (Wilson, 1990). En un estudio conducido por Puoli et al. (1991) encontró que la adición de 75 kg de N proveniente de urea ha-1 incrementó el consumo de materia seca del ganado consu- FACULTAD DE CIENCIAS BIOLÓGICAS, UANL DIGESTIBILIDAD EN PASTOS Tabla 5.3. Variación estacional de la degradabilidad efectiva fibra detergente neutro (DEFDN, % materia seca), y las características de la digestibilidad in situ en pastos cultivados colectados en diferentes municipios del Estado de Nuevo León, México en diferentes fechas 3DVWRV /XJDU\IHFKDGHFROHFWD &RQFHSWR (VWDFLRQHV DEFDN = calculada a una tasa de intercambio ruminal de 2 % h-1 a = es un intercepto representando la porción de la FDN solubilizada al inicio de la incubación (t = 0) b = es la porción de la FDN lentamente degradada en el rumen, c = es la tasa constante de desaparición de la fracción b Datos tomados de: Ramírez et al. (2002); Ramírez et al. (2003); Ramírez (2003); Ramírez et al. (2004); Ramírez et al. (2005). 0HGLDDQXDO ,QYLHUQR 3ULPDYHUD 9HUDQR 2WRxR &HQFKUXVFLOLDULV&RP~Q 0DUtQ1/0p[LFR '()'1 D E FK &HQFKUXVFLOLDULV&RP~Q 0DUtQ1/0p[LFR '()'1 D E FK &HQFKUXVFLOLDULV&RP~Q 7HUiQ1/0p[LFR '()'1 D E FK &HQFKUXVFLOLDULV&RP~Q /LQDUHV1/0p[LFR '()'1 D E FK &\QRGRQGDFW\ORQ /LQDUHV1/0p[LFR '()'1 D FK &\QRGRQGDFW\ORQ 0DUtQ1/0p[LFR '()'1 D E FK &\QRGRQGDFW\ORQ,, 0DUtQ1/0p[LFR '()'1 D E FK 'LFKDQWKLXPDQQXODWXP 0DUtQ1/0p[LFR '()'1 D E E FK 'LFKDQWKLXPDQQXODWXP /LQDUHV1/0p[LFR '()'1 D E FK 3DQLFXPFRORUDWXP /LQDUHV1/0p[LFR '()'1 D E FK 5K\QFKHO\WUXPUHSHQV 7HUiQ1/0p[LFR '()'1 D E FK LOS PASTOS EN LA NUTRICIÓN DE LOS RUMIANTES 119 CAPÍTULO 5 miendo pastos, pero la digestibilidad de la materia seca y pared celular no fueron afectadas por la fertilización con N. Similar respuesta fue reportada por García-Dessommes et al. (2003) quienes observaron que nuevos genotipos del pasto Cenchrus ciliaris, fertilizados con N proveniente de urea a razón de 120 kg ha-1 y sembrados en Terán, Nuevo León, México (Tabla 5.4.), tuvieron más baja DEFDN, comparados con los mimos genotipos, pero no fertilizados. La característica más importante en el incremento de la madurez fisiológica de la mayoría de los forrajes es la tre- Tabla 5.4. Degradabilidad efectiva de la fibra detergente neutro (DEFDN, % materia seca) y las características de la digestibilidad in situ del híbrido buffel Nueces y cinco nuevos genotipos de buffel (Cenchrus ciliaris) colectados en diferentes fechas en Terán, N,L., México *HQRWLSRV &RQFHSWR 120 )HFKDVGHFRUWH $JRVWR 1RYLHPEUH 1RYLHPEUH -XQLR )HUWLOL]DGRV &HQFKUXVFLOLDULV1XHFHV '()'1 D E FK &HQFKUXVFLOLDULV '()'1 D E FK &HQFKUXVFLOLDULV '()'1 D E FK &HQFKUXVFLOLDULV '()'1 D E FK &HQFKUXVFLOLDULV '()'1 D E FK &HQFKUXVFLOLDULV '()'1 D E FK FACULTAD DE CIENCIAS BIOLÓGICAS, UANL DEFDN = calculada a una tasa de intercambio ruminal de 2 % h-1 a = es un intercepto representando la porción de la FDN solubilizada al inicio de la incubación (t = 0) b = es la porción de la FDN lentamente degradada en el rumen, c = es la tasa constante de desaparición de la fracción b Datos tomados de: García-Dessommes et al. (2003ab) DIGESTIBILIDAD EN PASTOS Tabla 5.5. Degradabilidad efectiva de la fibra detergente neutro (DEFDN, % base seca) y las características de la digestibilidad in situ de las hojas y tallos de pastos cultivados introducidos y colectados en diferentes municipios y fechas en el Estado de Nuevo león, México 3DVWRV /XJDU\IHFKDGHFROHFWD 3DUWHV &RQFHSWR (VWDFLRQHV ,QYLHUQR &HQFKUXVFLOLDULV&RP~Q 0HGLDDQXDO 9HUDQR 2WRxR /LQDUHV1/0p[LFR +RMDV '()'1 D E FK 7DOORV '()'1 3ULPDYHUD D E FK +RMDV '()'1 &HQFKUXVFLOLDULV&RP~Q 0DUtQ1/0p[LFR D E FK 7DOORV '()'1 D E &\QRGRQGDFW\ORQ FK /LQDUHV1/0p[LFR +RMDV '()'1 D E FK 7DOORV '()'1 D E FK /LQDUHV1/0p[LFR +RMDV '()'1 D E FK 7DOORV '()'1 'LFKDQWKLXPDQQXODWXP D E 3DQLFXPFRORUDWXP FK /LQDUHV1/0p[LFR +RMDV '()'1 D E D E FK 7DOORV '()'1 FK LOS PASTOS EN LA NUTRICIÓN DE LOS RUMIANTES menda reducción de la relación entre la hoja y el tallo. En los pastos, las hojas y los tallos incrementan su contenido de pared celular y lignina conforma avanza la madurez (Jung y Vogel, 1992). Consecuentemente, las digestibilidades de las hojas y tallos de los pastos declinan conforma la madurez del forraje se incrementa, aunque la velocidad de decremento es mayor en los tallos que en las hojas (Albrecht et al., 1987). Similar pa- 121 DEFDN = calculada a una tasa de intercambio ruminal de 2 % h-1 a = es un intercepto representando la porción de la FDN solubilizada al inicio de la incubación (t = 0) b = es la porción de la FDN lentamente degradada en el rumen, c = es la tasa constante de desaparición de la fracción b Datos tomados de: Ramírez et al. (2001ab); Foroughbackhch et al. (2001); Ramírez et al. (2003); Ramírez (2003); Ramírez et al. (2005); CAPÍTULO 5 trón de respuesta se observa en los pastos cultivados que se muestran en la Tabla 5.5. debido a que la DEFDN fue mayor en las hojas que en los tallos y en invierno cuando los pastos están maduros la disminución de la DEFDN en los tallos fue mayor que en las hojas. Digestibilidad de la pared celular de pastos nativos 122 La DEFDN de los pastos de la flora nativa del noreste de México fue diferente entre especies y entre estaciones del año dentro de la misma especie (Tablas 5.6. y 5.7.). La pared celular de los pastos P. hallii y S. macrostachya fue más degradada por los microorganismos del rumen que las de los otros pastos. Aristida longiseta tuvo la menor DEFDN (Tabla 4). En general, durante el invierno los pastos tuvieron la menor DEFDN. Pastos nativos como B. trifida y B. curtipendula tuvieron los más bajos valores de DEFDN comparados con otros pastos nativos que crecen en el municipio de Terán, Nuevo León, México. Panicum obtusum resulto con el valor más elevado (Tabla 5). En general, durante la época húmeda (verano y otoño) los pastos tuvieron la DEFDN más elevada comparada con la de la época seca (invierno y primavera). El hecho de que los pastos nativos contienen gran cantidad de hemicelulosa en la pared celular y que es muy similar a la celulosa, pudiera implicar la baja DEFDN de los pastos nativos comparados con los cultivados. Se ha reportado que la xilosa, un importante componente de las hemicelulosas, siempre está presente en grandes concentraciones en los te- jidos menos degradables de las plantas (Harris et al., 1980). Degradabilidad de la proteína cruda de los pastos La nutrición de la proteína (N) en rumiantes es un proceso complejo que es grandemente impactado por eventos que ocurren en el estomago delantero e intestino del gado del rumiante. La proteína y el N no proteico (NNP) de la dieta es degradada en el rumen y convertidos en amoníaco, la cual pude ser usada por los microorganismos del rumen como un precursor para la biosíntesis de aminoácidos y proteína microbial. La proteína microbial es subsecuentemente digerida en el intestino delgado del hospedero y sirve como una importante fuente de aminoácidos que pueden ser usados para la síntesis de proteína en productos animales. Por tanto, el grado de degradación de un ingrediente en particular o de una dieta, puede ser un factor limitante en el proceso de suplementación de aminoácidos para el hospedero y, consecuentemente, en la productividad del animal. Uno de los factores que más influencia tienen sobre la degradabilidad de la proteína en el rumen es el grado de madurez del forraje. Se ha encontrado que conforme avanza la madurez de los pastos, usualmente resulta en un decremento en el consumo voluntario y del grado de digestión de la proteína en el rumen (Merchen y Bourquin, 1994). En la Tabla 5.8. se muestra que la degradabilidad efectiva de la proteína cruda (DEPC) de los pastos cultivados en la región noreste de México fue diferente entre especies y entre estaciones del año dentro del mismo pasto. En invierno, FACULTAD DE CIENCIAS BIOLÓGICAS, UANL DIGESTIBILIDAD EN PASTOS Tabla 5.6. Tendencia estacional de la degradabilidad de la fibra detergente neutro (DEFDN, % base seca) y las características de la digestibilidad in situ en pastos nativos colectados en Marín, N.L., México en 1994 3DVWRVQDWLYRV $ULVWLGDORQJLVHWD %RXWHORXDJUDFLOLV &HQFKUXVLQFHUWXV +LODULDEHODQJHUL 3DQLFXPKDOOLL 6HWDULDPDFURVWDFK\D &RQFHSWR '()'1 D E FK '()'1 D E FK '()'1 D E FK '()'1 D E FK '()'1 D E FK '()'1 D E FK (VWDFLRQHV ,QYLHUQR 3ULPDYHUD la estación seca la DEPC fue más baja en todos los pastos. El pasto C. dactylon Cruza II tuvo la media anual más elevada y D. annulatum (Figura 5.1.), ambos cultivados en Marín, Nuevo León, fue el más bajo. Cynodon dactylon (Figura 5.2.) tuvo una DEPC superior a la media lo que lo sitúa como un pasto de buena digestibilidad. La DEPC fue afectada negativamente por la fertiliza- 0HGLDDQXDO 9HUDQR 2WRxR DEFDN = calculada a una tasa de intercambio ruminal de 2 % h-1 a = es un intercepto representando la porción de la FDN solubilizada al inicio de la incubación (t = 0) b = es la porción de la FND lentamente degradada en el rumen, c = es la tasa constante de desaparición de la fracción b Datos tomados de: Ramírez et al. (2004) ción con N en forma de urea a los genotipos del pasto C. ciliaris que fueron sembrados en el municipio de Gral. Terán, Nuevo León, México. En las fechas en que los genotipos no fueron fertilizados las plantas tuvieron una mayor DEPC. El genotipo 443 tuvo una DEPC similar a la del híbrido Nueces, que en este estudio se usó como control (Tabla 5.9.). Todos estos genotipos, que fueron sembrados bajo condi- LOS PASTOS EN LA NUTRICIÓN DE LOS RUMIANTES 123 CAPÍTULO 5 Tabla 5.7. Tendencia estacional de la degradabilidad efectiva de la fibra detergente neutro (DEFDN, % base seca) y las características de la digestibilidad in situ en pastos nativos colectados en Terán, N.L., México en 2001 y 2002 3DVWRVQDWLYRV &RQFHSWR 124 %RXWHORXDFXUWLSHQGXOD %RXWHORXDWULILGD %UDFKLDULDIDVFLFXODWD 'LJLWDULDLQVXODUHV &KORULVFLOLDWD /HSWRFKORDILOLIRUPLV 3DQLFXPKDOOLL 3DQLFXPREWXVXP 3DQLFXPXQLVSLFDWXP 6HWDULDJULVHEDFKLL 6HWDULDPDFURVWDFK\D 7ULGHQVHUDJURVWRLGHV 7ULGHQVPXWLFXV (VWDFLRQHV\DxRVGHFROHFWD ,QYLHUQR 3ULPDYHUD '()'1 D E FK '()'1 D E FK '()'1 D E FK '()'1 D E FK '()'1 D E FK '()'1 D E FK '()'1 D E FK '()'1 D E FK '()'1 D E FK '()'1 D E FK '()'1 D E FK '()'1 D E FK '()'1 D E FK 9HUDQR 0HGLDDQXDO 2WRxR FACULTAD DE CIENCIAS BIOLÓGICAS, UANL DEFDN = calculada a una tasa de intercambio ruminal de 2 % h-1 a = es un intercepto representando la porción de la FDN solubilizada al inicio de la incubación (t = 0) b = es la porción de la FDN lentamente degradada en el rumen, c = es la tasa constante de desaparición de la fracción b Datos tomados de: Cobio-Nagao (2004) DIGESTIBILIDAD EN PASTOS Tabla 5.8. Variación estacional de la degradabilidad efectiva proteína cruda (DEPC, % materia seca), y las características de la digestibilidad in situ en pastos cultivados colectados en diferentes municipios del Estado de Nuevo León, México en diferentes fechas 3DVWRV /XJDU\IHFKDGHFROHFWD &RQFHSWR (VWDFLRQHV ,QYLHUQR 3ULPDYHUD 9HUDQR 0HGLDDQXDO 2WRxR &HQFKUXVFLOLDULV&RP~Q 0DUtQ1/0p[LFR '(3& D E FK &HQFKUXVFLOLDULV&RP~Q 0DUtQ1/0p[LFR '(3& D E FK &HQFKUXVFLOLDULV&RP~Q 7HUiQ1/0p[LFR '(3& D E FK &HQFKUXVFLOLDULV&RP~Q /LQDUHV1/0p[LFR '(3& D E FK &\QRGRQGDFW\ORQ /LQDUHV1/0p[LFR '(3& D E FK &\QRGRQGDFW\ORQ 0DUtQ1/0p[LFR '(3& D E FK &\QRGRQGDFW\ORQ,, 0DUtQ1/0p[LFR '(3& D E FK 'LFKDQWKLXPDQQXODWXP 0DUtQ1/0p[LFR '(3& D E FK 'LFKDQWKLXPDQQXODWXP /LQDUHV1/0p[LFR '(3& D E FK 3DQLFXPFRORUDWXP /LQDUHV1/0p[LFR '(3& D E FK 5K\QFKHO\WUXPUHSHQV 7HUiQ1/0p[LFR '(3& D E FK 125 DEPC = calculada a una tasa de intercambio ruminal de 2 % h-1 a = es un intercepto representando la porción de la PC solubilizada al inicio de la incubación (t = 0) b = es la porción de la PC lentamente degradada en el rumen, c = es la tasa constante de desaparición de la fracción b Datos tomados de: Ramírez et al. (2002); Ramírez et al. (2003); Ramírez (2003); Ramírez et al. (2004); Ramírez et al. (2005); LOS PASTOS EN LA NUTRICIÓN DE LOS RUMIANTES CAPÍTULO 5 126 Figura 5.1. Dichanthium annulatum. Staff. (Forsk.) Nombre común es Pretoria. Es un zacate perenne, caña erecta y estolonífera, de aproximadamente 100 cm de longitud. Los hábitos de la planta y la florescencia son muy similares al Dichanthium aristatum pero las espigas, aristas y ramas tienden a ser más cortas. El carácter morfológico para diferenciar a estas dos especies, es que el eje de florescencia y la base de las ramas son lisas, en oposición al eje pubescente y la base de las ramas del D. aristatum. El número de cromosomas es: 2n = 40. Aun cuando, es originario de África, se distribuye muy bien en el sur de Texas y norte de México. (Gould, 1975). Figura 5.2. Cynodon dactylon (L.) Pers. Nombre común bermuda. Es un pasto perenne, formador de tapetes, estolonífero y rizomatoso; el rizoma es robusto, rastrero y extensivo. La caña principalmente es estolonífera, únicamente los rebrotes floríferos se mantienen erectos y son de 10 a 50 cm de alto; la parte inferior de la hoja es redondeada y lisa, excepto por masas de pelo en cualquier lado del collar y adentro del área ligular. La lígula es una membrana ciliada de 0.2 a 0.5 mm de largo. Las hojas son lineales, planas o plegadas, sin pelillos. La florescencia es usualmente de ramas en arreglos de espigas digitales de 3 a 5, las ramas son lisas o escabrosas de 2 a 6 cm de largo, floríferas en la base con numerosas espículas sin aristas, estrechamente intrincadas de 2 en fondo. La palea es estrecha ligeramente más corta que la lema, con dos nervios colocados estrechamente. El número de cromosomas: 2n = 36 (Gould, 1975). ciones de temporal, destacaron por su gran producción de materia seca cuando fueron comparados con el buffel común. Sin excepción, la DEPC de las hojas, de todos los pastos cultivados que aparecen en la Tabla 5.10. es mayor en aproximadamente un 10 % que la de los tallos. Sin embargo, durante el invierno (época seca) la diferencia entre hojas y tallos fue más acentuada. Cenchrus ciliaris cosechado en el Municipio de Linares, Nuevo León, México, tuvo el porcentaje anual de DEPC más elevado en hojas y tallos, en cambio Panicum coloratum resulto con los valores más bajos. La DEPC de los pastos nativos que crecen en el noreste de México y sur de Texas, Estados Unidos, fue variable en- FACULTAD DE CIENCIAS BIOLÓGICAS, UANL DIGESTIBILIDAD EN PASTOS Tabla 5.9. Degradabilidad efectiva de la proteína cruda (DEPC, % materia seca) y las características de la digestibilidad in situ del híbrido buffel Nueces y cinco nuevos genotipos de buffel (Cenchrus ciliaris) colectados en diferentes fechas en Terán, N,L., México *HQRWLSRV &RQFHSWR )HFKDVGHFRUWH $JRVWR -XQLR )HUWLOL]DGRV '(3& D E FK &HQFKUXVFLOLDULV '(3& D E FK &HQFKUXVFLOLDULV '(3& D E FK &HQFKUXVFLOLDULV '(3& D E FK &HQFKUXVFLOLDULV '(3& D E FK &HQFKUXVFLOLDULV '(3& D E FK 1RYLHPEUH &HQFKUXVFLOLDULV1XHFHV 1RYLHPEUH DEPC = calculada a una tasa de intercambio ruminal de 2 % h-1 a = es un intercepto representando la porción de la PC solubilizada al inicio de la incubación (t = 0) b = es la porción de la PC lentamente degradada en el rumen, c = es la tasa constante de desaparición de la fracción b Datos tomados de: García-Dessommes et al. (2003ab LOS PASTOS EN LA NUTRICIÓN DE LOS RUMIANTES tre especies y entre estaciones del año (Tablas 5.11. y 5.12.). Panicum hallii tuvo la media anual más elevada y A. longiseta la más baja. Otros pastos tuvieron valores intermedios. En general, un poco menos del 50 % de la proteína de los pastos es indegradable (100DEPC) en el rumen. Por tanto, esta proteína puede representar al N que es digerido y absorbido en intestino delgado contribuyendo al suministro de aminoácidos provenientes de la dieta, que son usados para la formación de proteína de los tejidos en el hospedero. El pasto S. grisebachii tuvo el contenido de DEPC más elevado, pero B. curtipendula y P. unispicatum fueron los más bajos del conjunto de pastos nativos que se muestran en la Tabla 5.12. y que crecen en el municipio de Gral. Terán, Nuevo León, México. Asimismo, la DEPC fue variable entre pastos y entre estaciones del año. Las diferencias en gran medida dependen del estado de madurez y del contenido de proteína cruda que 127 CAPÍTULO 5 Tabla 5.10. Degradabilidad efectiva de la proteína cruda (DEPC, % base seca) y las características de la digestibilidad in situ de las hojas y tallos de pastos cultivados introducidos y colectados en diferentes municipios y fechas en el Estado de Nuevo león, México 3DVWRV /XJDU\IHFKDGHFROHFWD 128 3DUWHV &RQFHSWR (VWDFLRQHV ,QYLHUQR 3ULPDYHUD 9HUDQR 0HGLDDQXDO 2WRxR &HQFKUXVFLOLDULV&RP~Q /LQDUHV1/0p[LFR +RMDV '(3& D E FK 7DOORV '(3& D E FK &HQFKUXVFLOLDULV&RP~Q 0DUtQ1/0p[LFR +RMDV '(3& D E FK 7DOORV '(3& D E FK &\QRGRQGDFW\ORQ /LQDUHV1/0p[LFR +RMDV '(3& D E FK 7DOORV '(3& D E FK 'LFKDQWKLXPDQQXODWXP /LQDUHV1/0p[LFR +RMDV '(3& D E FK 7DOORV '(3& D E FK 3DQLFXPFRORUDWXP /LQDUHV1/0p[LFR +RMDV '(3& D E FK 7DOORV '(3& D E FK FACULTAD DE CIENCIAS BIOLÓGICAS, UANL DEPC = calculada a una tasa de intercambio ruminal de 2 % h-1 a = es un intercepto representando la porción de la PC solubilizada al inicio de la incubación (t = 0) b = es la porción de la PC lentamente degradada en el rumen, c = es la tasa constante de desaparición de la fracción b Datos tomados de: Ramírez et al. (2001ab); Foroughbackhch et al. (2001); Ramírez et al. (2003); Ramírez (2003); Ramírez et al. (2005). DIGESTIBILIDAD EN PASTOS Tabla 5.11. Tendencia estacional de la degradabilidad de la proteína cruda (DEPC, % base seca), ) y las características de la digestibilidad in situ en pastos nativos colectados en Marín, N.L., México en 1994 3DVWRVQDWLYRV &RQFHSWR (VWDFLRQHV $ULVWLGDORQJLVHWD '(3& D E FK %RXWHORXDJUDFLOLV '(3& D E FK &HQFKUXVLQFHUWXV '(3& D E FK +LODULDEHODQJHUL '(3& D E FK 3DQLFXPKDOOLL '(3& D E FK 6HWDULDPDFURVWDFK\D '(3& D E FK 3ULPDYHUD 0HGLDDQXDO 2WRxR ,QYLHUQR 9HUDQR DEPC = calculada a una tasa de intercambio ruminal de 2 % h-1 a = es un intercepto representando la porción de la PC solubilizada al inicio de la incubación (t = 0) b = es la porción de la PC lentamente degradada en el rumen, c = es la tasa constante de desaparición de la fracción b Datos tomados de: Ramírez et al. (2004. LOS PASTOS EN LA NUTRICIÓN DE LOS RUMIANTES 129 CAPÍTULO 5 Tabla 5.12. Variación estacional de de la degradabilidad efectiva de la proteína cruda (DEPC, % base seca) y las características de la digestibilidad in situ de pastos nativos colectados en Terán, N.L., México en 2001 y 2002 3DVWRVQDWLYRV 130 %RXWHORXDFXUWLSHQGXOD %RXWHORXDWULILGD %UDFKLDULDIDVFLFXODWD 'LJLWDULDLQVXODUHV &KORULVFLOLDWD /HSWRFKORDILOLIRUPLV 3DQLFXPKDOOLL 3DQLFXPREWXVXP 3DQLFXPXQLVSLFDWXP 6HWDULDJULVHEDFKLL 6HWDULDPDFURVWDFK\D 7ULGHQVHUDJURVWRLGHV 7ULGHQVPXWLFXV &RQFHSWR (VWDFLRQHV\DxRVGHFROHFWD ,QYLHUQR '(3& D E FK '(3& D E FK '(3& D E FK '(3& D E FK '(3& D E FK '(3& D E FK '(3& D E FK '(3& D E FK '(3& D E FK '(3& D E FK '(3& D E FK '(3& D E FK '(3& D E FK 3ULPDYHUD 9HUDQR 0HGLDDQXDO 2WRxR FACULTAD DE CIENCIAS BIOLÓGICAS, UANL contenga el pasto (Minson 1992). En la Tabla 5.12. se muestra que durante las estaciones húmedas (verano y otoño), los pastos resultaron con la mayor DEPC, en contraste, durante la época seca (invierno y primavera) los pastos tuvieron los valores más bajos. DEPC = calculada a una tasa de intercambio ruminal de 2 % h-1 a = es un intercepto representando la porción de la PC solubilizada al inicio de la incubación (t = 0) b = es la porción de la PC lentamente degradada en el rumen, c = es la tasa constante de desaparición de la fracción b Datos tomados de: Cobio-Nagao (2004) DIGESTIBILIDAD EN PASTOS Referencias Figura 5.3. Digitaria insularis (L.). (Figura 6) Conocido como zacate amargo. Es perenne, con tallos de 1.0 a 1.5 m erectos o decumbente-dispersos, casi siempre con muchos nudos que se originan en una base nudosa-rizomatosa y ramificada; entrenudos más o menos cortos, catáfilos, densa y suavemente peludos, las vainas aquilladas hacia el ápice, más largas que los entrenudos; escasamente papiloso-pilosas o papiloso-hirsutas con un mechón de pelos. La lígula es delgada de 3 a 4 mm de largo, las láminas son planas, acuminadas o con un ápice atenuado, ligeramente escabrosas en los márgenes. Panícula casi siempre de 12 a 30 cm de largo con numerosas ramas erectas; espiguillas de 3 a 4 mm de largo excluyendo los pelos. La primera gluma es diminuta, glabra, como escama, la lema estéril incospicuamente con cinco nervaduras, más o menos peluda en los internervios y vellosa en los márgenes; la cariópsis es del largo de la espiguilla, lanceolada, atenuada en una punta o arista corta de color café oscuro o marrón al madurar. Planta nativa: común en pendientes rocosas, abiertas o parcialmente sombreadas en los pastizales mediano arbofrutescente y amacollado arbofrutescente, matorral arbofrutescente y otros; es poco abundante y posee un valor forrajero pobre (Ackerman-Beetle y JohnsonGordon, 1991). Ackerman-Beetle, A. y Johnson-Gordon, D. 1991. Gramíneas de Sonora. SAGRH COTECOCA. Gobierno del Edo de Sonora, Hermosillo, Son. Albretch, K.A. Wedin, W.F. y Buxton, D.r. 1987. Cell-wall composition and digestibility of alfalfa ítems and leaves. Cerp Sci. 27: 735-741. Asplund, J.M. 1994. Principles of protein Nutrition of ruminants. CRC Press. Boca Raton. EUA. pp. 3-28. Baldwin, R.L., y Allison, M.J. 1983. Rumen Metabolism. J. Anim. Sci. 57 (suplemento 2): 461-477. Chesson, A. y Fpresberg, C.W. 1988. Polysaccharide degradation by rumen microorganisms. En: P.N. Hobson (editor). The Rumen Microbial Ecosystem. Elsevier Applied Science. Londres, RU. pp. 251-284. Chesson, A. 1990. Nutritional significance and nutritive value of plant polyssacharides. En: J. Wiseman y D.J.A. Cole (editores). Feedstuff Evaluation. Butterworths, Inc., London RU. pp. 179-195. Cobio-Nagao, C. 2004. Composición química y digestibilidad de la materia seca de pastos nativos colectados en Gral. Terán, N. L. Tesis. Facultad de Ciencias Biológicas, Universidad Autónoma de Nuevo León. Forsberg, C.W., Forano, E. y Chesson, A. 2000. Microbial Adherence to the Plant Cell Wall and Enzymatic Hydrolisis. En: P.B. Cronjé (editor). Ruminant Physiology, Digestion, Metabolism, Growth and Reproduction. CABI, Publishing, Wallingford, Reino Unido. pp. 7998. Harris, P.J., Hartley, R.D. y Lowry, K.H. 1980. Phenolic constituents of mesophyll and non-mesophyll cell walls from leaf laminae of Lolium perenne. J. Sci. Food Agric. 31:959-962. Hofmann, R.R. 1988. Anatomy of the Gastro-Intestinal Tract. En: The ruminant animal, Digestive Physiology and Nutrition. D.C. Church (editor). Waveland Press, Inc. Illinois, Estados Unidos. pp. 14-43. Hunt, C.W., Paterson, J.A. y Wiliams, J.E. Intake and digestibility of alfalfa-tall fecue combination diets fed to lambs. J. Anim. Sci. 60:301306. García-Dessommes, G.J., Ramírez-Lozano, R.G., Foroughbakhch, R., Morales Rodríguez, R. y García-Díaz, G. 2003. Ruminal digestion and chemical composition of new genotypes of buffelgrass (Cenchrus ciliaris L.). Interciencia, 28: 220-224. García-Dessommes, G.J., Ramírez-Lozano R.G., Foroughbakhch, R., Morales-Rodríguez, R. y García-Díaz G. 2003. Valor nutricional y diges- LOS PASTOS EN LA NUTRICIÓN DE LOS RUMIANTES 131 CAPÍTULO 5 132 tión ruminal de cinco líneas apomíticas del pasto buffel (Cenchrus ciliaris L.). Técnica Pecuaria en México, 41: 209-218. Gould, F. W. 1975. The grasses of Texas. Texas A & M University Press. Jung, H.G. y Vogel, K.P. 1992. Lignification of switchgrass (Panicum virgatum L.) and big bluesteam (Andropogon gerardii Vitman) plant parts during maturation and its effect on fibre degradability. J. Sci. Food Agric. 59:169-174. Lam, T.B.T., Iiayama, K. y Stone, B.A. 1990. Primary and secondary walls of grasses and other forage plants: Taxonomic and structural considerations. En D.E. Akin, L.G. Ljungdhal, J.R. Wilson y P.J. Harris (editores). Microbial and Plant Opportunities to Improve Hemicellulose Utilization by Ruminants. Elsevier Sci. Publishing Co., Inc., NY., Estados Unidos. pp. 43-69. Langer, P. y Snipes, R.L. 1991. Adaptations of Gut Structure to Function in Herbivores. En: T. Tsuda, Y. Sasaki y R. Kawashima (editors). Physiological Aspects of Digestion and Metabolism in Ruminants. Academic Press, Inc. San Diego, Estados Unidos. pp. 349-384. Mackie, R.I., Aminov, R.I., White, B.A. y McSwenney, C.S. 2000. Molecular Ecology and Diversity in Gut Microbial Ecosystems. En: P.B. Cronjé (editor). Ruminant Physiology, Digestion, Metabolism, Growth and Reproduction. CABI, Publishing, Wallingford, Reino Unido. pp. 61-78. Minson, D.J, 1992, Composición química y valor nutritivo de gramíneas tropicales. En: Gramíneas Tropicales. P.J. Skerman y F. Riveros (editores). Colección FAO: Producción y Protección Vegetal. Merchen, N.R. 1988. Digestion, Absorption and Excretion in Ruminants. En: The ruminant animal, Digestive Physiology and Nutrition. D.C. Church (editor). Waveland Press, Inc. Illinois, Estados Unidos. pp. 173-201. Merchen N.R. y Bourquin, L.D. 1994. Processes of digestion and factors influencing digestion of forage based diets by ruminants. En G.C. Fahey, Jr. (editor). Forage Quality, Evaluation, and Utilization. University of Nebraska, Lincoln, NE. Estados Unidos. Pp. 564-612. Moe, P.W. 1981. Energy metabolism of dairy cattle. J.Dairy Sci. 64:11201139. Morales-Rodríguez, R. 2003. Producción de materia seca y digestibilidad in situ del forraje de 84 genotipos del pasto buffel (Cenchrus ciliaris). Tesis de maestría. Facultad de Ciencias Biológicas, Universidad Autónoma de Nuevo León. Ørskov, E.R. y Kay, R.N.B. 1987. Non-microbial digestion of forages by herbivores. En: J.B. Hacker y J.H. Ternouth (editors). The Nutrition of Herbivores. Academic Press, Inc, Orlando Fl. Estados Unidos. pp. 267-280. Ørskov, E.R. 2000. The in situ technique for the estimation of forage degradability in ruminants. En: D.I. Givens, E. Owen, R.F.E. Axford, y H.M. Omed (editores). Forage Evaluation in Ruminants, CAB International, Wallinford RU. pp. 175-188. Puoli, J.R., Jung, G.A. y Reid, R.L. 1991. Effectos of nitrogen and sulfur on digestión and nutritive quality of warm-season grass hays for cattle and sheep. J. Anim. Sci. 69:843-852. Ramírez, R.G., Foroughbackhch, R., Háuad, L. Alba-Avila, J., García-Castillo, C.G. y Espinosa-Vázquez, M. 2001. Seasonal dynamics of dry matter, crude protein and cell wall digestion in total plant, leaves and stems of common buffelgrass (Cenchrus ciliaris L.). J. Appl. Anim. Res., 19:40-49. Ramírez, R.G., Foroughbackhch, R., Háuad, L. Alba-Avila, J. García-Castillo, C.G. y Espinosa-Vázquez, M. 2001. Seasonal variation of in situ digestibility of dry matter, crude protein and cell wall of total plant, leaves and stems of Nueces buffelgrass (Cenchrus ciliaris). J. Appl. Anim. Res., 20:38-47. Ramírez R.G., González-Rodríguez, H. y García-Dessommes, G. 2002. Chemical composition and rumen digestion of forage from kleingrass (Panicum coloratum). Interciencia, 27:705-709. Ramírez, R.G., González-Rodríguez, H. y García-Dessommes, G.J. 2003. Nutrient digestion of common bermudagrass (Cynodon dactylon L.) Pers. growing in northeastern Mexico, J. Appl. Anim. Res. 23: 93102. Ramírez, R.G., García-Dessommes, G.J. y González Rodríguez, H. 2003. Valor nutritivo y digestión ruminal del zacate buffel común (Cenchrus ciliaris L.), Pastos y Forrajes 26: 149-158. Ramírez-Lozano, R.G. 2003. Nutrición de Rumiantes: Sistemas Extensivos. Trillas, México, D.F. p. 212. Ramírez R.G., Haenlein, G.F.W., García-Castillo, C.G. y Núñez-González M.A. 2004. Protein, lignin and mineral contents and in situ dry matter digestibility of native Mexican grasses consumed by range goats. Small Rumin. Res. 52: 261-269. Ramírez, R.G. y González-Rodríguez, H. García-Dessommes, G. and Morales-Rodríguez, R. 2005. Seasonal Trends in the Chemical Composition and Digestion of Dichanthium annulatum (Forssk.) Stapf. J. Appl. Anim. Res. (En prensa). FACULTAD DE CIENCIAS BIOLÓGICAS, UANL DIGESTIBILIDAD EN PASTOS Staples, C.R., Fernando, R.L., Fahey, G.C., Jr., Berger, L.L. y Jaster, E.H. 1984. Effects of imtake of a mixed diet by dairy steers on digestion events. J. Dairy Sci. 67:905-1006. Van Soest, P.J. 1994. Nutrional Ecology of the Ruminant. 2a edición. O and B Books, Inc., Corvallis, OR., Estados Unidos. pp. 230-252. Waldo, D. R., y Glenn, B. P. 1984. Comparison of new protein systems for lactating dairy cows. J. Dairy Sci. 67:1115. Wilson, J.R. 1990. Influence of plant anatomy on digestión of fiber breakdown. En D.E. Akin, L.G. Ljungdhal, J.R. Wilson y P.J. Harris (editores). Microbial and Plant Opportunities to Improve Hemicellulose Utilization by Ruminants. Elsevier Sci. Publishing Co., Inc., NY., Estados Unidos. pp. 99-117. Yokohama, M.T. 1988. Microbiology of the Rumen and Intestine. En: The ruminant animal, Digestive Physiology and Nutrition. D.C. Church (editor). Waveland Press, Inc. Illinois, Estados Unidos. pp. 125-144. 133 LOS PASTOS EN LA NUTRICIÓN DE LOS RUMIANTES 134 Capítulo 6 Macrominerales en los pastos Introducción Los macrominerales son requeridos virtualmente para todos los procesos vitales del organismo animal. Y su requerimiento es aquellos minerales que su requerimiento es mayor a 1.0 mg kg-1. Una deficiencia de macrominerales esenciales en los animales resulta en anormalidades que sólo pueden ser corregidas con suplementos de la deficiencia mineral. En adición a los requerimientos para las funciones de los mamíferos, los rumiantes alimentados a base de pastos, son dependientes de un adecuado suministro de minerales para una óptima actividad microbial del rumen, y por lo tanto una mejor utilización del forraje. Los pastos proveen una importante fuente de minerales para los rumiantes. Bajo ciertas circunstancias, pueden proveer adecuadas cantidades de todos los minerales esenciales requeridos por estos animales. Sin embargo, en otras ocasiones, los pastos tienen deficiencias en uno o más minerales y requieren su- plementos para un óptimo rendimiento y/o salud del animal. Severas deficiencias minerales ocurren en grado variable, pero las deficiencias marginales de minerales son probablemente mucho más comunes. El desequilibrio marginal de minerales puede presentarse sin manifestación clínica, sino más bien sólo como una pequeña disminución en las funciones metabólicas, afectando substancialmente el crecimiento, reproducción o salud (McDowell, 2003). Factores que afectan el contenido mineral de los pastos Las concentraciones de los elementos minerales en los pastos dependen de la interacción entre varios factores, entre los que se cuentan, el suelo, la especie forrajera, el nivel de madurez, el rendimiento, el manejo de los pastos, y el clima. La mayor parte de las deficiencias que ocurren naturalmente en los herbívoros están asociadas con regiones específicas y las características del suelo. La tasa de absorción LOS PASTOS EN LA NUTRICIÓN DE LOS RUMIANTES 135 CAPÍTULO 6 de minerales del suelo por los pastos puede ser modificada, por las características del drenaje que tenga el suelo, y disminuyendo la disponibilidad por aumentos del pH. Para la mayoría de los elementos minerales, existen plantas que fungen como “acumuladoras”, es decir, que contienen niveles sumamente altos de un mineral específico. Al madurar las plantas, su contenido mineral disminuye a consecuencia de un proceso natural de dilución y a la traslocación de los nutrientes al sistema de raíces (Rojas y Rovalo, 1986). Según Underwood y Suttle (1999), generalmente los elementos K, Mg, Na y Cl disminuyen su concentración en forma directamente proporcional con la maduración de la planta. 136 Disponibilidad de minerales en los pastos La capacidad de un pasto para proveer a los animales un adecuado suministro de minerales depende del contenido del mineral y también de la biodisponibilidad de este. La biodisponibilidad de un mineral se define como la proporción del elemento ingerido que es absorbido, transportando a su sitio de acción, y convertido fisiológicamente en su forma activa. Determinar la concentración de la mayoría de los minerales en el forraje es relativamente simple; sin embargo, es difícil medir con precisión la biodisponibilidad para especificar las funciones en el animal. Por alguna razón, la concentración dietética de un mineral dado, debe estar por debajo del requerimiento del animal para una función específica si el mineral va a ser absorbido y utilizado con máxima eficiencia. El cuerpo intenta mantener las con- centraciones del mineral dentro de un rango bastante estrecho por medio de mecanismos de control homeostático, lo que reduce la absorción o incrementa la excreción (Ammerman et al., 1995). Requerimientos biológicos Los requerimientos minerales para los microbios para una adecuada fermentación en los rumiantes son generalmente más bajos que aquellos requeridos por el hospedero. Los microbios no tienen un requerimiento estructural de Ca o P, como lo tienen generalmente los vertebrados para la formación de huesos, pero necesitan H, C, O, N, P y S que son los mayores elementos de la composición celular orgánica. Las proteínas representan la mayor fuente de N y S. Proporciones de N y S son alrededor de 12:1 relativo al contenido de aminoácidos esenciales. La flora ruminal y consecuentemente los rumiantes, pueden requerir algunos elementos en cantidades más grandes que los necesarios por otras plantas y animales, por ejemplo, el Co es usado como B12 por la flora ruminal (Elliot, 1980), y Ni, el cual es requerido por microorganismos y también es un cofactor en las ureasas (Spears, 1994). Minerales en la fermentación ruminal El P en los rumiantes es un elemento de máxima importancia para el metabolismo adecuado y salud de la microflora ruminal. Por lo tanto, en los rumiantes dos tipos de requerimientos de P deben ser actualmente considerados: uno para FACULTAD DE CIENCIAS BIOLÓGICAS, UANL MACROMINERALES EN LOS PASTOS el animal y otro para los microorganismos del rumen. El P es parte de los ácidos nucleicos (DNA y RNA) que se encuentran en todas las células bacterianas. En las células bacterianas del rumen el 10.3 % del DNA y el 9.64% del RNA esta constituido por este mineral. La mayor parte del RNA de las células se encuentra en el ribosoma y el contenido ribosomal en las bacterias se relaciona directamente al crecimiento bacteriano, y por lo tanto, la actividad celulolítica. El Zn es esencial para todos los sistemas biológicos vivientes. La falta de disponibilidad de Zn para las bacterias inhibe la multiplicación de éstas, además de afectar la capacidad de las bacterias celulolíticas para adherirse a la pared celular del tejido vegetal y ejercer activamente su capacidad celulolitíca. En cambio, el Mn es requerido para el crecimiento de la mayoría de las células y para ejercer una función importante en las reacciones de descarboxilación del ciclo del ácido tricarboxílico o de Krebs. Además, se ha demostrado que estimula la fijación de CO2 en la producción de ácido succinico por bacterias ruminales (Durand y Kawashima, 1980). Funciones generales de los minerales en los tejidos del rumiante Los minerales desarrollan muchas funciones que guardan una relación directa o indirecta con el crecimiento animal. Contribuyen a mantener la rigidez de los huesos y de los dientes, y representan una parte importante de las proteínas y lípidos del organismo animal. Además, los minerales con- servan la integridad celular mediante las presiones osmóticas y son un componente de muchos sistemas enzimáticos que catalizan las reaccione metabólicas en los sistemas biológicos. Cuando menos 15 elementos minerales son nutricionalmente esenciales para el ganado. Los nutrientes minerales mayores (macrominerales) son Ca, P, Mg, K, Na, S, Cl, I, Fe, Mo, Cu, Co, Mn, Zn, y Se (NRC, 2000). Varios factores afectan los requerimientos de estos minerales en los suplementos o ingredientes alimenticios, entre ellos, las interrelaciones entre elementos minerales y con otros nutrientes, el consumo de suplemento mineral, la raza y la adaptación del ganado (McDowell, 2003). Los perfiles de minerales en el suelo y tejidos del ganado (sangre, hígado, hueso y pelo) ayudan solamente a avalar los resultados obtenidos cuando se detectan deficiencias o intoxicaciones en los resultados de análisis de forrajes y agua que consume el ganado, los cuales son los mejores indicadores de deficiencias en pastoreo. En los tejidos, el análisis sanguíneo provee una retrospectiva confiable en la determinación de deficiencias o excesos minerales, aunque no mas que los proveería el análisis de hueso e hígado, ofreciendo la ventaja de su disponibilidad y fácil manejo sin sacrificar el animal (Miller, 1985). Los animales disponen de tres fuentes primarias para la obtención de elementos inorgánicos en los sistemas pecuarios: alimento, agua y suplementos minerales. Aun cuando las plantas pueden proporcionar una buena parte de los minerales necesarios, la suplementación de minerales constituye una practica necesaria en los animales bien nutridos, LOS PASTOS EN LA NUTRICIÓN DE LOS RUMIANTES 137 CAPÍTULO 6 según el tipo de sistema de producción zootécnica en particular y los objetivos de producción que la misma empresa se plantee (Underwood y Suttle, 1999). Sin embargo, El contenido mineral del forraje depende primariamente de la especie forrajera, abundancia del elemento en el suelo y de las condiciones persistentes durante el crecimiento de la planta, y en consecuencia, sobre su captación de minerales (Valdez et al., 1988). Requerimiento de macrominerales 138 Muchos factores afectan los requerimientos de minerales de rumiantes en pastoreo. Entre ellos se incluyen tipo y nivel de producción, edad y forma química del elemento en el alimento, interrelación con los otros minerales, consumo de suplemento mineral, raza y adaptación del animal. Los requerimientos de minerales dependen del nivel de productividad (McDowell, 2003). Los requerimientos mínimos de minerales (NRC, 2000) para ganado bovino de carne no son los niveles requeridos para máxima productividad. Los niveles críticos de tolerancia indican los niveles de cada mineral que provocan una intoxicación o el nivel al que afectan la utilización de otros minerales. Calcio Formas químicas del Ca en los pastos Este elemento abunda en la mayoría de los suelos y las plan- tas raramente muestran su deficiencia en condiciones naturales. En suelos calcáreos y en suelos limosos el Ca puede estar presente en la forma de carbonato de Ca y, en suelos áridos y semiáridos el Ca puede ocurrir como limos (Whitehead, 2000). El Ca es importante en la síntesis de pectina de la lámina media de la pared celular. También está involucrado en el metabolismo o formación del núcleo y las mitocondrias. Es un elemento de extraordinaria importancia para la mayoría de las plantas por lo que una reducción severa determina el deterioro y muerte de éstas. Las regiones meristemáticas son las primeras afectadas porque una reducción de Ca impide la formación de nuevas paredes celulares, con lo que se imposibilita la división de las células. La división celular incompleta, o mitosis, sin formación de nuevas paredes se traduce en la producción de células plurinucleadas, lo que es típico de la deficiencia. Existen paredes celulares, particularmente en estructuras de soporte como tallos y pecíolos, que se tornan quebradizas o rígidas; ello obstaculiza la expansión de las células. La clorosis de las márgenes de hojas jóvenes, el “encorvamiento” de puntas foliares (la enfermedad “punta marchita”) y la formación de raíces atrofiadas e incoloras son síntomas característicos de deficiencia de Ca. Puesto que la mayor parte del Ca de la planta se inmoviliza una vez depositado, su deficiencia es más impactante en tejidos jóvenes; los tejidos viejos pueden resultar inafectados. Se ha observado una interesante paradoja en algunas plantas de Rusia. A pesar de que estas plantas se cultivan en suelos fuertemente calcáreos, con frecuencia muestran sín- FACULTAD DE CIENCIAS BIOLÓGICAS, UANL MACROMINERALES EN LOS PASTOS tomas de deficiencia de Ca y niveles anormalmente al hecho de que en suelos fuertemente calcáreos, no hay hierro disponible, y la planta sufre de deficiencia de hierro. Una de las consecuencias de esta deficiencia es una reducción de la absorción del calcio. Así que, debido a este curioso mecanismo, un exceso de calcio se traduce en deficiencia de este nutrimento. El Ca sólo es útil en funciones catalíticas menores, involucrándose (aunque por lo regular no exclusivamente) como activador de unas cuantas enzimas, como la fosfolipasa. Es probable que esta capacidad se requiera sólo en cantidades mínimas, así que probablemente nunca se desarrolle una deficiencia en esta función. Acaso tenga un importante papel como desintoxicante de ácido oxálico: cristales de oxalato cálcico se observa a menudo en las vacuolas de las células vegetales (Blevins, 1994). Síntomas de deficiencia de Ca en los rumiantes Funciones del Ca en los rumiantes Contenido de Ca en pastos cultivados Aproximadamente el 99% del total de Ca del cuerpo se encuentran en huesos y dientes. El resto del Ca se encuentra en los tejidos blandos y mayormente en el plasma sanguíneo y esta involucrado con funciones vitales como el control de la excitabilidad de los nervios y músculos, y es necesario para la coagulación normal de la sangre en la transformación de la protrombina en trombina. Además, la presencia de Ca es necesaria para la activación de ciertas enzimas como la tripsina y la adenosina trifosfatasa (McDowell, 2003). El contenido estacional de Ca en pastos cultivados que crecen en el noreste de México varió de 5 a 7 g kg-1 con una media anual de 6 g kg-1. Pastos como C. ciliaris Común y C. dactylon tuvieron las medias anuales con mayor contenido de Ca (Tabla 6.1.). Minson (1992) reportó que la media de 360 muestras de pastos tropicales cultivadas en el mundo fue de 4 g kg-1. Este valor es similar al encontrado en nuevos genotipos del pasto buffel, sembrados bajo condiciones de temporal y sin fertilización en Terán, N.L., México cosechados en agosto y noviembre de 1999 y noviembre del 2000 Un consumo inadecuado de Ca puede causar debilidad de los huesos, reducción en el crecimiento, baja en la producción de leche (McDowell, 1992). Los forrajes con la posible excepción del silo de grano, contienen el Ca adecuado para el ganado de engorda y ovinos, hay que tomar en cuenta que se puede encontrar en una forma indisponible para el animal como lo es el oxalato de Ca El aporte adecuado depende no solo de la cantidad suministrada, sino también del estado de la vitamina D en el animal (Underwood y Suttle, 1999). Las deficiencias de Ca pueden ser prevenidas o superadas, con el tratamiento de suplementación directa en el animal, ya sea en la dieta o en el agua, o indirectamente con el tratamiento apropiado de fertilizantes para el suelo. LOS PASTOS EN LA NUTRICIÓN DE LOS RUMIANTES 139 CAPÍTULO 6 medios lo tuvieron Dichanthium annulatum y Panicum coloratum. Aparentemente, la composición mineral de los pastos varía dependiendo del suelo, planta (especie), variedad, parte de la planta y muchos otros factoTabla 6.1. res que constituyen el componente Contenido de Ca (g kg-1) en pastos cultivados colectados en diferentes fechas y municipios del recurso forrajero. Kawas-Gardel noreste de México za (1995) al evaluar el contenido de 3DVWRVLQWURGXFLGRV /XJDU\IHFKDGHFROHFWD (VWDFLRQHV 0HGLDDQXDO Ca en 22 especies de pastos culti ,QYLHUQR 3ULPDYHUD 9HUDQR 2WRxR vados de clima cálido, cosechados durante las épocas de lluvia en 1993 &HQFKUXVFLOLDULV&RP~Q 7HUiQ1/0p[LFR &HQFKUXVFLOLDULVFRP~Q /LQDUHV1/0p[LFR y 1995, en cuatro regiones geográ&\QRGRQGDFW\ORQ,, 0DULQ1/0p[LFR ficas del litoral Golfo de México, &\QRGRQGDFW\ORQ /LQDUHV1/0p[LFR también reportó variaciones en el 'LFKDQWKLXPDQQXODWXP /LQDUHV1/0p[LFR 3DQLFXPFRORUDWXP /LQDUHV1/0p[LFR contenido de Ca entre especies en 5K\QFKHO\WUXPUHSHQV 7HUiQ1/0p[LFR un intervalo de 2.3 a 4.4 g kg-1 sien3URPHGLR do Cynodon dactylon el de mayor Datos tomados de: Ramírez et al. (2002); Ramírez et al. (2003); Ramírez-Lozano (2003); Ramírez et al. contenido y Pennisetum purpureum (2004); Ramírez et al. (2005). el menor, respectivamente. (Tablas 6.2 y 6.3.). Sin embargo, cuando los genotipos que aparecen en la Tabla 6.2. fueron fertilizados con 120 kg de urea ha-1, sorpresivamente el contenido de Ca se incrementó al doble, de 4 a 8 g kg-1. 140 Minson (1992) reportó que en las hojas el contenido de Ca duplica a los tallos, por lo que el consumo selectivo de las hojas pudiera conducir a dietas con porcentajes de Ca más elevados. Sin embargo, con el proceso de maduración se produce una disminución en el contenido de Ca en las hojas y de los tallos. Sin embargo, en la Figura 6.1. el Ca de las hojas de los cuatro pastos cultivados triplican al de los tallos. Cynodon dactylon tuvo el mayor contenido de Ca en las hojas y en todas las estaciones del año, por el contrario Cenchrus Ciliaris tuvo el menor contenido. Valores inter- Contenido de Ca en pastos nativos Los pastos nativos que crecen en Marín, N.L., México cosechados en 1994 (Tabla 6.4.) tuvieron mayor contenido de Ca que los cultivados que aparecen en las Tablas previas y los reportados por Kawas-Garza (1996). Panicum hallii tuvo el mayor contenido estacional y A. longiseta tuvo el menor. Sin embargo, los pastos nativos que crecen en Terán, N.L., México cosechados en otoño del 2001 invierno, primavera FACULTAD DE CIENCIAS BIOLÓGICAS, UANL MACROMINERALES EN LOS PASTOS y verano del 2002 (Tabla 6.5.) tuTabla 6.2. vieron contenidos inferiores de Ca. Contenido de Ca (g kg-1; base seca) del híbrido buffel Nueces y cinco nuevos genotipos de buffel (Cenchrus ciliaris) colectadas en diferentes fechas en Terán, N,L., México Brachiaria fasciculata, Digitaria insulares, Panicum obtusum y *HQRWLSRV )HFKDVGHFROHFWD Panicum unispicatum tuvieron el $JRVWR 1RYLHPEUH 1RYLHPEUH -XQLR mayor contenido y Bouteloua )HUWLOL]DGRV curtipendula, Chloris ciliata, Setaria grisebachii y Tridens &HQFKUXVFLOLDULV1XHFHV eragrostoides fueron menores. &HQFKUXVFLOLDULV &HQFKUXVFLOLDULV Armienta-Trejo (1995) al evaluar el &HQFKUXVFLOLDULV contenido de Ca de cuatro pastos &HQFKUXVFLOLDULV nativos en diferentes regiones del &HQFKUXVFLOLDULV estado de N.L., México reportó va3URPHGLR lores intermedios dentro de un intervalo de 2.1 a 7.9 g Ca kg-1 mate- Datos tomados de: García-Dessommes et al. (2003ab) ria seca en Bouteloua trifida e Hilaria mutica, respectivamente. intercambiables y la cantidad disponible tiene una relación Aparentemente, todos los pastos que aparecen en las importante con la intemperizacion de los minerales y el graTablas 6.1. a la 6.5. contienen niveles de Ca en cantidades do de lixiviación. Es absorbido como Mg+2. Entre los minesuficientes para cubrir los requerimientos del ganado bovirales importantes del Mg están biotita, dolomita, augita, serno de carne en crecimiento y al inicio de la lactación y capentina hornoblenda y olivita. Por su alcalinidad, el Mg bras adultas (Tabla 6.6.). La mayoría de los pastos nativos mejora a los terrenos ácidos. El Mg en la planta es esencial tuvieron concentraciones de Ca para satisfacer los requeripara la formación de clorofila y activador de enzimas asomientos de borregos adultos en máxima producción. ciadas al metabolismo energético (Foth, 1985). Magnesio Formas químicas del Mg en el suelo y forraje Funciones del Mg en el rumiante El Mg en el suelo se encuentra disponible como cationes El Mg juega un papel importante en las funciones LOS PASTOS EN LA NUTRICIÓN DE LOS RUMIANTES 141 CAPÍTULO 6 Tabla 6.3. Contenido de Ca (g kg-1; base seca) de 84 nuevas líneas de pasto Cenchrus ciliaris colectadas en Terán, N.L., México en noviembre del 2000. *HQRWLSRV 142 &DJNJ *HQRWLSRV &DJNJ *HQRWLSRV &DJNJ *HQRWLSRV &DJNJ 18(&(6 3URPHGLRGHWRGDVODVOtQHDV Datos tomados de: Morales-Rodríguez et al., 2005b neuromusculares, composición estructural del esqueleto y activación de numerosas enzimas involucradas en aspectos metabólicos (McDowell et al., 1995). El Mg es el segundo catión más importante de los fluidos intracelulares. Una deficiencia clínica de Mg se manifiesta rara vez en rumian- tes en etapas de desarrollo, ya que solo requieren 1 mg kg-1 en la materia seca de la dieta. Los rumiantes en lactación requieren aproximadamente 2 g kg-1 en su dieta para la prevención de hipomagnesemia o tetania de los pastizales. La tetania de los pastizales ocurre FACULTAD DE CIENCIAS BIOLÓGICAS, UANL MACROMINERALES EN LOS PASTOS Figura 6.1. Contenido estacional de Ca (g kg-1 base seca) en las hojas y tallos de cuatro pastos cultivados y cosechados en Linares, N.L., México en 1998 y 1999 Datos tomados de: Ramírez et al. (2003); Ramírez-Lozano (2003); Ramírez et al. (2005a). 143 Tabla 6.4. Contenido estacional de Ca (g kg-1 base seca) en pastos nativos colectados en Marín, N.L., México en 1994 3DVWRVQDWLYRV (VWDFLRQHV 0HGLDDQXDO ,QYLHUQR 3ULPDYHUD 9HUDQR $ULVWLGDORQJLVHWD %RXWHORXDJUDFLOLV &HQFKUXVLQFHUWXV +LODULDEHODQJHUL 3DQLFXPKDOOLL 6HWDULDPDFURVWDFK\D 3URPHGLRHVWDFLRQDO Datos tomados de: Ramírez et al. (2004) LOS PASTOS EN LA NUTRICIÓN DE LOS RUMIANTES 2WRxR CAPÍTULO 6 Tabla 6.5. Contenido estacional de Ca (g kg-1 base seca) en pastos nativos colectados en Terán, N.L., México en 2001 y 2002 (VWDFLRQHV\DxRGHFROHFWD 3DVWRVQDWLYRV ,QYLHUQR 3ULPDYHUD 144 9HUDQR 2WRxR 0HGLDDQXDO %RXWHORXDFXUWLSHQGXOD %RXWHORXDWULILGD %UDFKLDULDIDVFLFXODWD 'LJLWDULDLQVXODUHV &KORULVFLOLDWD /HSWRFKORDILOLIRUPLV 3DQLFXPKDOOLL 3DQLFXPREWXVXP 3DQLFXPXQLVSLFDWXP 6HWDULDJULVHEDFKLL 6HWDULDPDFURVWDFK\D 7ULGHQVHUDJURVWRLGHV 7ULGHQVPXWLFXV 3URPHGLRHVWDFLRQDO Tabla 6.6. Requerimientos de macrominerales para rumiantes (OHPHQWR &DJNJ 0JJNJ .JNJ 1DJNJ 3JNJ %RYLQRVGHFDUQH &UHFLPLHQWR\ ,QLFLRGHOD WHUPLQDFLyQ ODFWDFLyQ ± *DQDGROHFKHUR %RUUHJRVDGXOWRV Tomado de: McDowell (2003). FACULTAD DE CIENCIAS BIOLÓGICAS, UANL &DEUDV DGXOWDV MACROMINERALES EN LOS PASTOS principalmente en bovinos y ovinos en lactación y se caracteriza por la baja concentración sérica de Mg. Los signos iniciales de tetania de los pastizales, son nerviosismo, reducción de la ingesta de alimentos, incoordinación y convulsiones musculares. Además de provocar una hipocalcemia leve (Underwood y Suttle, 1999). La fertilización de pastizales con altos contenidos de potasio es asociada con el aumento en la incidencia de hipomagnesemia. Así como los forrajes que contienen altos niveles de sodio y potasio, ácidos orgánicos y bajos en carbohidratos insolubles. En los rumiantes maduros, en el retículo-rumen es el sitio donde ocurre la mayor parte de la absorción de Mg. Es evidente que la absorción del Mg en el rumen ocurre por un proceso de activación de enlaces de sodio. La suplementación de sodio en ovinos aumenta la absorción de Mg. Las necesidades mínimas para el crecimiento de los ovinos y los bovinos pueden ser obtenidas, generalmente por los pastos o las dietas conteniendo 0.10% de Mg (McDonald et al., 1995). La tetania de los pastizales se puede prevenir con la suplementación de Mg, y dado que el suplemento es poco palatable se recomienda mezclarlo con melaza u otros alimentos palatables para aumentar el consumo de Mg suplementario. También se puede hacer un polvoreo foliar de la vegetación con MgO antes o durante los períodos de mayor deficiencia, siempre y cuando se aplique a no menos de 17 kg h-1 y a no más de diez días de intervalos. La inyección subcutánea de una dosis de 400 ml de una solución de 25% de sulfato de Mg o la inyección endovenosa de una dosis similar de lactato de Mg, restaura el Mg del suero de la vaca afectada a niveles casi normales en cerca de diez minutos. La toxicosis por Mg, debido a la ingesta de alimentos naturales, no ha sido reportada y no parece ser posible. La toxicosis ocurrirá mayormente por el uso de niveles excesivos de Mg suplementario (NRC, 2000). Contenido de Mg en pastos cultivados El contenido de Mg en pastos tropicales de diferentes partes del mundo es muy variable. Minson (1992) reportó que el nivel de Mg en 280 pastos tropicales varió de 0.4 a 9.0 g kg1 base seca, con una media de 3.6 g kg-1. Kawas-Garza (1996) al evaluar el contenido de Mg en 22 pastos tropicales cultivados cosechados en diferentes regiones del litoral del golfo de México reportó un intervalo de 0.5 a 2.1 g kg-1 con una media de 1.5 g kg-1 base seca. Sin embargo, los pastos cultivados que aparecen en la Tablas 7, 8 y 9 tuvieron concentraciones de Mg dentro de un intervalo más corto: de 1 a 5 g kg-1. Es probable que las diferencias en el contenido de Mg se deban a que los pastos fueron cultivados en diferentes sitios y diferentes períodos de tiempo; además de las diferencias propias entre especies. Aparentemente, el ganado bovino de leche y borregos adultos consumiendo los pastos, que aparecen en la Tabla 6.7. pudieran padecer deficiencias de Mg, con excepción de verano, manifestada por una posible hipomagnesemia tetánica debido a que la mayoría de las plantas tuvieron concentraciones de Mg marginalmente bajas para cubrir los re- LOS PASTOS EN LA NUTRICIÓN DE LOS RUMIANTES 145 CAPÍTULO 6 querimientos del ganado (Tabla 6.6.). Individualmente, pastos como Cynodon dactylon y Rhynchelytrum repens contienen niveles de Mg para satisfacer los requerimientos de rumiantes adultos. 146 Una tendencia similar a la de los genotipos reportados en la Tabla 6.8. se muestra en aquellos de la Tabla 6.9. El contenido de Mg varió de 2 a 5 g kg-1 con una media de 3 g kg-1. El ganado bovino en crecimiento requiere 1.0 g kg-1 de Mg en la dieta. Por tanto, los rumiantes consumiendo cualquiera de los 84 genotipos no sufriría defiTabla 6.7. -1 Contenido de Mg (g kg ) en pastos cultivados colectados en diferentes fechas y municipios ciencia de Mg. del noreste de México En los pastos tropicales, a diferencia del Ca, el contenido de Mg 3DVWRVLQWURGXFLGRV /XJDU\IHFKDGHFROHFWD (VWDFLRQHV 0HGLDDQXDO en la hoja y tallo son similares ,QYLHUQR 3ULPDYHUD 9HUDQR 2WRxR (Minson, 1992). El mismo patrón &HQFKUXVFLOLDULV 7HUiQ1/0p[LFR entre hojas y tallos se muestra en &HQFKUXVFLOLDULVFRP~Q /LQDUHV1/0p[LFR los pastos C. ciliaris, C. dactylon, &\QRGRQGDFW\ORQ,, 0DULQ1/0p[LFR &\QRGRQGDFW\ORQ /LQDUHV1/0p[LFR D. annulatum y P. coloratum cose'LFKDQWKLXPDQQXODWXP /LQDUHV1/0p[LFR chados estacionalmente, bajo con3DQLFXPFRORUDWXP /LQDUHV1/0p[LFR diciones de temporal, en Linares, 5K\QFKHO\WUXPUHSHQV 7HUiQ1/0p[LFR 3URPHGLR N.L., México durante 1998 y 1999, los cuales contienen en promedio Datos tomados de: Ramírez et al. (2002); Ramírez et al. (2003); Ramírez-Lozano (2003); Ramírez et al. (2004); Ramírez et al. (2005). 2.3 y 2.4 g Mg kg-1 de materia seca en hojas y tallos, respectivamente (Figura 6.2.). El contenido de Mg se incrementó considerablemente en los genotipos que aparecen en la Tabla 6.8., cuando fueContenido de Mg en pastos nativos ron fertilizados con urea a razón de 120 kg de urea ha-1. Whitehead (2000) también reportó que los pastos Aun cuando los pastos nativos que crecen en Marín y Terán, incrementan su contenido de Mg cuando son fertilizados N.L., México (Tablas 6.10. y 6.11., respectivamente) concon N en forma de urea, presumiblemente debido a que la tienen niveles de Mg inferiores a los de los pastos cultivamayor parte del N es tomado por la planta en forma de nidos, el ganado de carne en crecimiento, alimentado con estrato. FACULTAD DE CIENCIAS BIOLÓGICAS, UANL MACROMINERALES EN LOS PASTOS Muchas enzimas, por ejemplo varias de las implicadas en la síntesis proteica, no operan eficientemente en ausencia de potasio, aunque no *HQRWLSRVGHEXIIHO /XJDUGHFROHFWD )HFKDVGHFROHFWD parece enlazarse a ellas de la mane$JRVWR 1RYLHPEUH 1RYLHPEUH -XQLR )HUWLOL]DGRV ra usual. Su efecto acaso se ejerza sobre la conformación proteica de&HQFKUXVFLOLDULV1XHFHV 7HUiQ1/0p[LFR &HQFKUXVFLOLDULV 7HUiQ1/0p[LFR terminando la exposición de los si&HQFKUXVFLOLDULV 7HUiQ1/0p[LFR tios activos. Sin embargo, esto no &HQFKUXVFLOLDULV 7HUiQ1/0p[LFR &HQFKUXVFLOLDULV 7HUiQ1/0p[LFR parece explicar la alta especificidad &HQFKUXVFLOLDULV 7HUiQ1/0p[LFR del potasio, el que puede ser reem3URPHGLR plazado sólo ocasional e ineficazmente por el sodio. El K se necesita Datos tomados de: García-Dessommes et al. (2003ab) en grandes cantidades; por ejemplo, se requiere mucho más K que Mg para la activación de una tos pastos, pudiera no padecer deficiencia de Mg (Tabla 6.6.). enzima dependiente. El K se enlaza iónicamente a la piruvato Sin embargo, pastos como A. longiseta (Tabla 6.10.) y quinasa, que es esencial en la respiración y el metabolismo Bouteloua curtipendula y B. trifida (Tabla 6.11.), en todas de carbohidratos; de manera que este elemento es muy imlas estaciones contienen cantidades de Mg insuficientes para portante en todo el metabolismo de las plantas. satisfacer las demandas del ganado de carne en crecimienLa deficiencia de K generalmente se empieza a manifesto. En verano y otoño, que son las estaciones de mayor pretar con una clorosis típicamente moteada de las hojas macipitación en esta región del noreste de México, los porcenduras que luego se distribuye a las jóvenes, pues este eletajes de Mg fueron también más elevados. mento es muy móvil en las plantas. Se producen áreas necróticas a lo largo de los márgenes y en las puntas de las Formas químicas del K en el suelo y forraje hojas, las que se enroscan de una manera característica y puede producirse un extenso ennegrecimiento o El K no parece tener función estructural en las plantas, pero chamuscamiento de las hojas. La deficiencia de K se manidesempeña numerosos papeles catalíticos, que en su mayofiesta con frecuencia por hábitos de crecimiento en roseta o ría no están claramente definidos; se desconoce además la achaparramiento. Otras consecuencias son la reducción del naturaleza exacta de los grandes requerimientos de potasio. Tabla 6.8. Contenido de Mg (g kg ; base seca) del híbrido buffel Nueces y cinco nuevos genotipos de buffel (Cenchrus ciliaris) colectados en diferentes fechas en Terán, N,L., México -1 LOS PASTOS EN LA NUTRICIÓN DE LOS RUMIANTES 147 CAPÍTULO 6 Tabla 6.9. Contenido de Mg (g kg-1; base seca) de 84 nuevos genotipos del pasto Cenchrus ciliaris colectados en Terán, N.L., México en noviembre del 2000. *HQRWLSRV 0JJNJ 148 *HQRWLSRV 0JJNJ *HQRWLSRV 0JJNJ *HQRWLSRV 0JJNJ 18(&(6 3URPHGLRGHWRGDVODVOtQHDV Datos tomados de: Morales-Rodríguez et al., 2005b FACULTAD DE CIENCIAS BIOLÓGICAS, UANL MACROMINERALES EN LOS PASTOS Figura 6.2. Contenido estacional de Mg (g kg-1 base seca) en las hojas y tallos de cuatro pastos cultivados y cosechados en Linares, N.L., México en 1998 y 1999 crecimiento caudinal, el debilitamiento del tallo y la baja resistencia a patógenos, de manera que las plantas deficientes, en especial cereales, fácilmente son acamadas (se tienden ante la intemperie) y atacadas por las enfermedades. Debido a la reducción de la síntesis proteica y el daño a al respiración, los compuestos de bajo peso molecular, como aminoácidos y azúcares tienden a acumularse a niveles inusualmente altos, mientras que se reducen las proteínas y los polisacáridos (Blevins, 1994). Funciones del K en el rumiante El K es el tercer elemento mineral de mayor abundancia en el cuerpo animal y el principal catión de los fluidos intracelulares. También es un constituyente del fluido extracelular, Tabla 6.10. mediante el cual influencia la actiContenido estacional de Mg (g kg-1 base seca) en pastos nativos colectados en Marín, N.L., vidad muscular. El K es necesario México en 1994 para el balance osmótico, el equili3DVWRVQDWLYRV (VWDFLRQHV\DxRGHFROHFWD 0HGLDDQXDO brio ácido-base, varios sistemas ,QYLHUQR 3ULPDYHUD 9HUDQR 2WRxR enzimáticos y el balance del agua (McDowell, 2003). El requerimien$ULVWLGDORQJLVHWD to para rumiantes oscila de 0.5 a 1%, %RXWHORXDJUDFLOLV &HQFKUXVLQFHUWXV bajo condiciones normales y con +LODULDEHODQJHUL estrés hasta de 1.2% particularmen3DQLFXPKDOOLL te en vacas lecheras bajo estrés ca6HWDULDPDFURVWDFK\D 3URPHGLRHVWDFLRQDO lórico, según estudios realizados en la Florida (Underwood y Suttle, Datos tomados de: Ramírez et al. (2004) 1999). Datos tomados de: Ramírez et al. (2003); Ramírez-Lozano (2003); Ramírez et al. (2005a). LOS PASTOS EN LA NUTRICIÓN DE LOS RUMIANTES 149 CAPÍTULO 6 requieren 6 g kg-1 de K en sus dietas para no padecer deficiencia. Todos los pastos que aparecen en la Tablas 6.12., 6.13. y 6.14. contienen niveles de K para sustentar las 2WRxR 0HGLDDQXDO demandas metabólicas de K de ru miantes en crecimiento. Sin embar go, Kawas-Garza (1996) reportó un intervalo mucho mayor (1.0-22.5 g kg-1 en la materia seca) en las con centraciones de K en 22 pastos tro picales cultivados cosechados en varias regiones del litoral del golfo de México. Aparentemente, los pastos tu vieron mayor contenido de K en verano cuando se registran las mayores precipitaciones. Aunque la madurez tuvo muy poco efecto en el contenido de K de los pastos que aparecen en la Tabla 6.12. Whitehead (2000) también encontró que los cambios, en las concentraciones de K conforme avanza la madurez de los pastos, son menos consistentes que los cambios en el contenido de N, P o S. Sin embargo, hay una amplia diferencia, en el contenido de K, entre especies de pastos (Tabla 6.12.) y en la fecha de colecta dentro de una misma especie o si son o no fertilizados con N en forma de urea (Tabla 6.13.). Aparentemente, el contenido de K en los patos también varía entre genotipos de una misma especie. En la Tabla Tabla 6.11. Contenido estacional de Mg (g kg-1 base seca) en pastos nativos colectados en Terán, N.L., México en 2001 y 2002 (VWDFLRQHV\DxRGHFROHFWD 3DVWRVQDWLYRV 150 ,QYLHUQR 3ULPDYHUD 9HUDQR %RXWHORXDFXUWLSHQGXOD %RXWHORXDWULILGD %UDFKLDULDIDVFLFXODWD 'LJLWDULDLQVXODUHV &KORULVFLOLDWD /HSWRFKORDILOLIRUPLV 3DQLFXPKDOOLL 3DQLFXPREWXVXP 3DQLFXPXQLVSLFDWXP 6HWDULDJULVHEDFKLL 6HWDULDPDFURVWDFK\D 7ULGHQVHUDJURVWRLGHV 7ULGHQVPXWLFXV 3URPHGLRHVWDFLRQDO Datos tomados de: Ramírez et al. (2004) El nivel sugerido como máximo tolerable es de 3% de K. El exceso de K es excretado rápidamente por lo que la intoxicación por K es baja en condiciones normales. El alto contenido de K en los forrajes durante épocas criticas del año, pueden ser antagonistas a la absorción y/o utilización del Mg y por eso puede influenciar la incidencia de tetania de los pastos (NRC, 2000). Contenido de K en pastos cultivados El K es el elemento más abundante en las planas como lo es el Ca en los animales. Los bovinos de carne en crecimiento FACULTAD DE CIENCIAS BIOLÓGICAS, UANL MACROMINERALES EN LOS PASTOS Tabla 6.12. Contenido de k (g kg ; base seca) en pastos cultivados colectados en diferentes fechas y municipios del noreste de México -1 3DVWRVLQWURGXFLGRV &HQFKUXVFLOLDULV /XJDU\IHFKDGHFROHFWD (VWDFLRQHV 0HGLDDQXDO ,QYLHUQR 3ULPDYHUD 9HUDQR 2WRxR 7HUiQ1/0p[LFR &HQFKUXVFLOLDULVFRP~Q /LQDUHV1/0p[LFR &\QRGRQGDFW\ORQ,, 0DULQ1/0p[LFR &\QRGRQGDFW\ORQ /LQDUHV1/0p[LFR 'LFKDQWKLXPDQQXODWXP /LQDUHV1/0p[LFR 3DQLFXPFRORUDWXP /LQDUHV1/0p[LFR 5K\QFKHO\WUXPUHSHQV 7HUiQ1/0p[LFR 3URPHGLR Datos tomados de: Ramírez et al. (2002); Ramírez et al. (2003); Ramírez-Lozano (2003); Ramírez et al. (2004); Ramírez et al. (2005). Tabla 6.13. Contenido de K (g kg-1; base seca) del híbrido buffel Nueces y cinco nuevos genotipos de buffel (Cenchrus ciliaris) colectados en diferentes fechas en Terán, N,L., México /tQHDVGHEXIIHO )HFKDVGHFROHFWD $JRVWR 1RYLHPEUH 1RYLHPEUH -XQLR )HUWLOL]DGRV &HQFKUXVFLOLDULV1XHFHV &HQFKUXVFLOLDULV &HQFKUXVFLOLDULV &HQFKUXVFLOLDULV &HQFKUXVFLOLDULV &HQFKUXVFLOLDULV 3URPHGLR Datos tomados de: García-Dessommes et al. (2003ab) LOS PASTOS EN LA NUTRICIÓN DE LOS RUMIANTES 6.14. se muestra el contenido de K en 84 nuevos genotipos del pasto buffel que fueron sembrados bajo condiciones de temporal en el municipio de Gral. Terán, N.L., México. Aun cuando pertenecen a una misma especie, ciliaris hubo diferencias que variaron en un intervalo de 9 a 32 g kg-1 base seca con una media de 20 g kg-1 base seca. Al parecer, los pastos C. ciliaris, C. dactylon, D. annulatum y P. annulatum que aparecen en la Figura 6.3., tiene más K en los tallos que en las hojas. Sin embargo, conforma avanza la madurez, esta tendencia tiende a ser menor. En invierno y primavera, aunque el K fue menor que en otras estaciones, y los tallos siguen siendo mayores que las hojas, las diferencias entre partes fueron muy pequeñas. Contenido de K en pastos nativos El contenido de K en los pastos nativos que crecen Marín N.L., México también varió entre espe- 151 CAPÍTULO 6 Tabla 6.14. Contenido de K (g kg ; base seca) de 84 nuevos genotipos de pasto Cenchrus ciliaris colectados en Terán, N.L., México en noviembre del 2000. -1 *HQRWLSRV .JNJ *HQRWLSRV 152 .JNJ *HQRWLSRV .JNJ *HQRWLSRV .JNJ 18(&(6 3URPHGLRGHWRGDVODVOtQHDV necesidades metabólicas de K del ganado. Variaciones en el contenido de K entre especies y entre estaciones del año también se reportan en los pastos que crecen en el municipio de Gral. Terán, N.L., México (Tabla 6.16.). Bouteloua curtipendula, B. trifida y Tridens muticus tuvieron niveles, durante todo el año, por debajo de los requerimientos del ganado en crecimiento. Sin embargo, el resto de los pastos tuvo niveles de K para sostener las actividades metabólicas del ganado de carne en crecimiento. En general, durante las estaciones húmedas (verano y otoño) los pastos tuvieron mayor contenido de K comparados con las estaciones secas (invierno y primavera). Datos tomados de: Morales-Rodríguez et al., 2005 cies y entre estaciones del año (Tabla 6.15.). Aristida longiseta, B. gracilis y H. belangeri resultaron con concentraciones deficientes de K para cubrir las demandas del ganado de carne en crecimiento (Tabla 6.6.). Sin embargo, en C. incertus, P. hallii y S. macrostachya fue ampliamente suficiente, en todas las estaciones del año, para cubrir las Sodio Formas químicas del Na en el suelo y forraje El Na, junto con el Ca, K y Mg contribuye al mantenimiento del potencial osmótico, y como resultado las plantas de- FACULTAD DE CIENCIAS BIOLÓGICAS, UANL MACROMINERALES EN LOS PASTOS ficientes de Na son más susceptibles a la sequía. El Na está también involucrado en el mantenimiento del pH de la planta neutralizando los ácidos orgánicos, incluyendo los grupos acídicos de varios polímeros, tales como la pectina (Whitehead, 2000). Se ha descubierto su utilidad en el crecimiento de muchas plantas, particularmente las halófitas (que gustan de sales). Aquellas plantas que responden a él tienden a acumular grandes cantidades, mientras que otras, sin respuesta ante él, lo absorben muy poco. La halófita Atriplex, una planta del desierto, parece requerir sodio para una glucólisis eficiente. Algunas plantas se enfrentan con el problema de vivir en suelos ricos en sodio. Los mangles ejemplifican una Datos tomados de: Ramírez et al. (2003); Ramírez-Lozano (2003); Ramísolución a este problema; ellos no absorben sodio. Ciertas rez et al. (2005a). especies de Atriplex, por otra parte, absorben grandes cantidades de sodio pero no se presenta acumulación tóxica porque el sodio Tabla 6.15. es nuevamente desechado por transContenido estacional de K (g kg-1 base seca) en pastos nativos colectados en Marín, N.L., porte activo hacia células glanduMéxico en 1994 lares especiales de las superficies foliares. Se ha demostrado recien3DVWRVQDWLYRV (VWDFLRQHV 0HGLDDQXDO temente que el sodio es un ,QYLHUQR 3ULPDYHUD 9HUDQR 2WRxR nutrimento esencial para plantas $ULVWLGDORQJLVHWD que poseen la vía fotosintética C4 y %RXWHORXDJUDFLOLV la anatomía de Kranz. La razón de &HQFKUXVLQFHUWXV +LODULDEHODQJHUL este requerimiento, o de su relación 3DQLFXPKDOOLL con la fotosíntesis C4, es desconoci6HWDULDPDFURVWDFK\D 3URPHGLRHVWDFLRQDO da. Figura 6.3. Contenido estacional de K (g kg-1 base seca) en las hojas y tallos de cuatro pastos cultivados y cosechados en Linares, N.L., México en 1998 y 1999 Datos tomados de: Ramírez et al. (2004) LOS PASTOS EN LA NUTRICIÓN DE LOS RUMIANTES 153 CAPÍTULO 6 Funciones del Na en el rumiante 154 El Na al igual que el Cl y K, actúan en el mantenimiento de la presión osmótica y en la regulación del equilibrio ácidobase. El Na funciona como electrolito en el fluido corporal y se relaciona con el metabolismo del agua a escala celular, la toma de nutrientes y la transmisión de impulsos nerviosos. Para rumiantes, el requerimiento de Na es entre 0.04 y 0.25% de la dieta, siendo el nivel mas alto el requerido por vacas lecheras lactantes, el requerimiento debe ser entre 0.10 y 0.20% y que no debe exceder de 0.27% (McDowell, 2003). La deficiencia de Na es más probable que ocurra durante las siguientes circunstancias: (1) durante la lactación debido a la deposición de Na en la leche, (2) en animales de crecimiento rápido, (3) bajo condiciones de clima tropical o clima semiárido caliente, (4) en animales consumiendo pastos fuertemente fertilizados con K, el cual reduce los niveles de Na. Aun después de una prolongada deficiencia, los niveles de Na en la leche permanecen altos. Debido a esto los animales en lactación son más susceptibles a la deficiencia de Na en la dieta. El primer signo de deficiencia de Na y Cl es el ansia por la sal, demostrado por un constante lamer de madera, tierra y sudor de otros animales, y el consumo de agua. Una prolongada deficiencia produce perdida de apetito, mala apariencia, baja producción de leche, perdida de peso y reducción del crecimiento. Los signos mas pronunciados de deficiencia son: incoordinación, temblor corporal, debilidad y perdida del ritmo cardiaco, lo cual puede conducir a la muerte (McDowell, 2003). Los iones de Na y Cl se absorben en el tracto gastrointestinal de los rumiantes. Las necesidades de Na y Cl en rumiantes son el orden de 0.1 – 0.2 % de la materia seca, para cada uno de los elementos. El Na y en menor grado el Cl, no siempre se encuentran en las raciones normales en cantidades suficientes. Por consiguiente, lo normal es suplementar las raciones con sal común. El exceso de Cl en la ración puede producir acidosis y el exceso de sodio alcalosis. Contenido de Na en pastos cultivados El contenido de Na en los pastos tropicales es muy variable entre especies (Kawas-Garza, 1996). Minson (1992) reportó que en 192 muestras de pastos tropicales cultivados en diversas partes del mundo varió de 0.1 a 18.0 g kg-1 en la materia seca, con una media de 2.6 g kg-1. El 52 % de las muestras contenía 1.0 g kg-1 de Na, y otro 18 % osciló entre 4.0 y 8.0 g kg-1. Las grandes diferencias en el contenido de Na entre pastos puede deberse a que algunas especies son acumuladoras de Na y otras no lo son (Underwood y Suttle, 1999). El ganado bovino de carne en crecimiento requiere 0.8 g -1 kg o menos para cubrir sus necesidades de Na (McDowell, 2003). Con excepción de los pastos nativos que crecen en el municipio de Marín y Linares, N.L., México (Tabla 6.20.) y algunos cultivados de la Tabla 6.17., todos los pastos que aparecen en las Tablas 6.18., 6.19. y 6.21. fueron deficiente en Na para sustentar las necesidades de rumiantes en crecimiento. FACULTAD DE CIENCIAS BIOLÓGICAS, UANL MACROMINERALES EN LOS PASTOS La deficiencia de Na no provoca efectos adversos en los rumiantes que la padecen, por lo que las necesidades reales pudieran ser considerablemente inferiores a las recomendadas. Además, los vacunos poseen grandes reservas de Na y lo conservan de manera muy eficaz cuando reciben dietas deficientes en Na. Las vacas que no están en ordeña deben pasar por lo menos seis meses con una alimentación de pastos deficientes en Na para que adquieran esa deficiencia. Sin embargo, en el caso del ganado en ordeña, puede producirse una disminución en la producción de leche a los dos meses de recibir una dieta con bajo contenido de Na, dado que las vacas no son capaces de reducir la cantidad de Na contenida en la leche (Underwood y Suttle, 1999). Aparentemente, la aplicación de fertilizantes nitrogenados en forma de urea no tienen efecto sobre el contenido de Na en los pastos (Whitehead, 2000). Similares resultados fueron reportados por García-Dessommes (2003b) al comparar genotipos del pasto Cenchrus ciliaris (L.) sembrados en diferentes épocas en el municipio de Gral. Terán, N.L., México y que fueron fertilizados con 120 kg de urea ha-1 e irrigados (Tabla 6.18.). Los pastos C. ciliaris, C. dactylon, D. annulatum y P. coloratum contienen más Na en sus hojas que en los tallos (Figura 6.4.). Sin embargo, conforme avanza la madurez, el contenido de Na en tallos y hojas es muy parecido. De cualquier manera, los rumiantes consumiendo, ya sea solo las hojas o solo los tallos, de estos cuatro pastos, no desarrollarían un síndrome de deficiencia debido a que todas las partes y en todas las estaciones tienen Na en cantidades sufi- cientes para cubrir las demandas del ganado. Contenido de Na en pastos nativos Estacionalmente, todos los pastos nativos que crecen en los municipios de Marín Gral. Terán, Nuevo León, México y que se muestran en la Tablas 6.20. y 6.21. fueron deficientes en Na para cubrir las necesidades de rumiantes en crecimiento (0.8 g kg-1 en la materia seca; McDowell, 2003). Contrariamente, Armienta-Trejo (1995) reportó que los pastos nativos: Aristida raemexicana (2.2), Bouteloua trifida (1.3), Hilaria mutica (1.8) y Setaria macrostachya (1.5 g kg-1), que crecen en diferentes regiones del Estado de N.L., México, contienen niveles de Na en cantidades sustentables para los rumiantes en crecimiento. Fósforo Formas químicas del P en el suelo y forraje El fósforo en el suelo se clasifica en orgánico e inorgánico. En fósforo orgánico se encuentra principalmente en el humus y otros materiales orgánicos que pueden o no estar asociados con él. El fósforo orgánico en suelo se encuentra en tres formas principales: fosfolípidos, ácidos nucleicos y fosfatos de inositol. La fracción inorgánica se encuentra en numerosas combinaciones con el Fe, Al, Ca, F y otros elementos; estos son pocos solubles en agua. El fósforo inorgánico se encuentra en forma de iones ortofosfatos y H2PO4. LOS PASTOS EN LA NUTRICIÓN DE LOS RUMIANTES 155 CAPÍTULO 6 Tabla 6.16. Contenido estacional de K (g kg-1 base seca) en pastos nativos colectados en Terán, N.L., México en 2001 y 2002 (VWDFLRQHV\DxRGHFROHFWD 3DVWRVQDWLYRV ,QYLHUQR %RXWHORXDFXUWLSHQGXOD %RXWHORXDWULILGD %UDFKLDULDIDVFLFXODWD 'LJLWDULDLQVXODUHV &KORULVFLOLDWD /HSWRFKORDILOLIRUPLV 3DQLFXPKDOOLL 3DQLFXPREWXVXP 3DQLFXPXQLVSLFDWXP 6HWDULDJULVHEDFKLL 6HWDULDPDFURVWDFK\D 7ULGHQVHUDJURVWRLGHV 7ULGHQVPXWLFXV 3URPHGLRHVWDFLRQDO 3ULPDYHUD 9HUDQR 2WRxR 0HGLDDQXDO 156 Datos tomados de: Ramírez et al. (2002); Ramírez et al. (2003); Ramírez-Lozano (2003); Ramírez et al. (2004); Ramírez et al. (2005). Tabla 6.17. Contenido de Na (g kg-1; base seca) en pastos cultivados colectados en diferentes fechas y municipios del noreste de México 3DVWRVLQWURGXFLGRV /XJDU\IHFKDGHFROHFWD &HQFKUXVFLOLDULV&RP~Q 7HUiQ1/0p[LFR (VWDFLRQHV ,QYLHUQR 3ULPDYHUD 0HGLDDQXDO 9HUDQR 2WRxR &HQFKUXVFLOLDULVFRP~Q /LQDUHV1/0p[LFR &\QRGRQGDFW\ORQ,, 0DULQ1/0p[LFR &\QRGRQGDFW\ORQ /LQDUHV1/0p[LFR 'LFKDQWKLXPDQQXODWXP /LQDUHV1/0p[LFR 3DQLFXPFRORUDWXP /LQDUHV1/0p[LFR 5K\QFKHO\WUXPUHSHQV 7HUiQ1/0p[LFR 3URPHGLR Datos tomados de: Ramírez et al. (2002); Ramírez et al. (2003); Ramírez-Lozano (2003); Ramírez et al. (2004); Ramírez et al. (2005). FACULTAD DE CIENCIAS BIOLÓGICAS, UANL El contenido de fósforo inorgánico en los suelos es casi siempre mayor que la del fósforo orgánico, encontrándose que su contenido en suelos minerales es usualmente mayor en las capas superficiales que en el subsuelo, a causa de la acumulación de materia orgánica que se alcanza en las capas superiores del perfil del suelo (Paul y Clark, 1996). El P en la planta ocupa una posición clave en el metabolismo. El P desempeña un papel importante en las transformaciones de energía y participa en el metabolismo de las grasas y proteínas. Es un constituyente esencial de muchos compuestos vitales como los nucleótidos, las lecitinas, la mayor parte de las enzimas, ácido nucleico, fitina, y fosfolípidos. El fósforo es asociado con la pronta maduración de los cultivos, particularmente de los cereales y su carencia es acompañada por la marcada reducción del crecimiento en la planta. Se le considera esencial en la formación de la semilla, se le encuentra en grandes cantidades en las semillas y frutos. El P es rápidamente movilizado en las plantas y cuando se presenta una deficiencia el elemento MACROMINERALES EN LOS PASTOS Tabla 6.18. Contenido de Na (g kg ; base seca) del híbrido buffel Nueces y cinco nuevos genotipos de buffel (Cenchrus ciliaris) colectados en diferentes fechas en Terán, N,L., México -1 *HQRWLSRV )HFKDVGHFROHFWD $JRVWR 1RYLHPEUH 1RYLHPEUH -XQLR )HUWLOL]DGRV &HQFKUXVFLOLDULV1XHFHV &HQFKUXVFLOLDULV &HQFKUXVFLOLDULV &HQFKUXVFLOLDULV &HQFKUXVFLOLDULV &HQFKUXVFLOLDULV 3URPHGLR Datos tomados de: García-Dessommes et al. (2003ab) contenido en los tejidos más viejos es transferido a las regiones merismaticas. Su deficiencia en grano o paja, es provocada por un escaso desarrollo en raíces y tallo (Whitehead, 2000). La deficiencia de fósforo en la planta acarrea retardo en la división celular y hay menor crecimiento. Esto se ve como un color verdinegro en la planta asociado con coloración púrpura en la etapa de crecimiento de las plántula, después las plantas se tornan amarillas (Foth, 1985). Funciones del P en los rumiantes El organismo del rumiante contiene alrededor de 0.7-1.0% de P de su peso vivo. Alrededor de 86% de la cantidad total de P ocurre como un componente estructural del esqueleto y dientes (NRC, 1989), el remanente es ampliamente distribuido en el cuerpo, especialmente en las células rojas, músculo y tejido nervioso. El P en el esqueleto está sujeto a un continuo intercambio, lo que le permite actuar como reservorio, el cual puede ser utilizado para otras funciones metabólicas cuando la dieta es baja en P. El reemplazo en el esqueleto ocurre cuando la concentración de P en la dieta excede a las necesidades metabólicas inmediatas. Aun cuando haya un alta concentración de P en la dieta, algo de movilización ocurre en el esqueleto al inicio de la lactación, cuando la producción de leche, la cual contiene de 0.9-1.0 g P l-1 es elevada (Follet y Wilkinson, 1995). Sin embargo, la velocidad al la cual el P puede ser movilizado del esqueleto disminuye conforme el animal envejece. En el tejido suave, el P ocurre en la forma de ésteres de fosfato, ácidos nucleicos, fosfolípidos, fosfoproteinas y fosfatos inorgánicos. Como en las plantas, el P tiene una función importante en el metabolismo energético a través del fosfáto de alta energía del ATP y, como constituyente de los ácidos nucleicos, es esencial para la división y crecimiento celular. Los fosfolípidos participan como componentes de las lipoproteínas de las membranas celulares y en el transporte de los ácidos grasos en todo el organismo (McDonald et al., 1995). Los fosfatos inorgánicos son esenciales en el control del pH de la sangre y otros fluidos del cuerpo y en el mantenimiento del balance osmótico (Underwood y Suttle, 1999). La sangre contiene alrededor de 350-450 mg P l-1, la mayoría del cual está presente en los glóbulos rojos. El plas- LOS PASTOS EN LA NUTRICIÓN DE LOS RUMIANTES 157 CAPÍTULO 6 Tabla 6.19. Contenido de Na (g kg-1; base seca) de 84 nuevos genotipo de pasto Cenchrus ciliaris colectados en Terán, N.L., México en noviembre del 2000. *HQRWLSRV 1DJNJ *HQRWLSRV 1DJNJ *HQRWLSRV 1DJNJ 158 *HQRWLSRV 1DJNJ 18(&(6 3URPHGLRGHWRGDVODVOtQHDV Datos tomados de: Morales-Rodríguez et al., 2005b FACULTAD DE CIENCIAS BIOLÓGICAS, UANL MACROMINERALES EN LOS PASTOS Figura 6.4. Contenido estacional de Na (g kg-1 base seca) en las hojas y tallos de cuatro pastos cultivados y cosechados en Linares, N.L., México en 1998 y 1999 Datos tomados de: Ramírez et al. (2003); Ramírez-Lozano (2003); Ramírez et al. (2005a). ma normalmente contiene P inorgánico en una concentración dentro de un intervalo de 40-80 mg l-1, aunque no es enteramente controlado (NRC, 1989; Underwood y Suttle, 1999) y hay una pequeña porción de P orgánicamente ligada con proteínas, lípidos y carbohidratos (Fontenot y Church, 1979). En los rumiantes el P es requerido no solo para el metabolismo del animal sino también para la síntesis de la masa microbial en el rumen. Como resultado, una deficiencia de P pude limitar la digestibilidad, en el rumen, de la pared celular de las plantas, particularmente de la celulosa (Durand y Komisarczuk, 1988). Deficiencia de P en los rumiantes La deficiencia de P es más probable que ocurra en bovinos que en ovinos. Sin embargo, en ambos tipos de animales, la defiTabla 6.20. Contenido estacional de Na (g kg-1 base seca) en pastos nativos colectados en Marín, N.L., ciencia es más probable que ocurra México en 1994 al final de la estación de crecimiento, cuando el forraje está maduro, 3DVWRVQDWLYRV (VWDFLRQHV 0HGLDDQXDO especialmente después de un perío ,QYLHUQR 3ULPDYHUD 9HUDQR 2WRxR do prolongado de sequía y, cuando el suelo es marcadamente ácido o $ULVWLGDORQJLVHWD %RXWHORXDJUDFLOLV calcáreo, o tiene una alta capacidad &HQFKUXVLQFHUWXV para retener P en formas insolubles +LODULDEHODQJHUL 3DQLFXPKDOOLL (Cornforth, 1984). Los síntomas de 6HWDULDPDFURVWDFK\D deficiencia de P en los animales in3URPHGLRHVWDFLRQDO cluyen disminución del consumo de Datos tomados de: Ramírez et al. (2004) LOS PASTOS EN LA NUTRICIÓN DE LOS RUMIANTES 159 CAPÍTULO 6 tración de P en el forraje declina en mayor medida que la del Ca conforme incrementa la madurez. El estatus de P en los animales rumiantes se puede determinar a 2WRxR 0HGLDDQXDO partir de la concentración del P in orgánico en el plasma de la sangre. La concentración normal es de 40 a 60 mg l-1 para los bovinos y 60 a 80 mg l-1 para becerros menores de un año. Contenidos por debajo de es tos límites sugiere que es deficien te en P. Sin embargo, hay cierta in certidumbre en la interpretación de los valores marginales, dado que la concentración de P en el plasma es influenciada por otros factores, tales como frecuencia en la alimentación, estrés y ejercicio (Langlands, 1987). Para remediar la deficiencia de P en los animales en pastoreo se puede proporcionar con bloques o lamederos conteniendo una fuente de P como CaHPO4 in la fuente de agua o suplementado en el alimento (Underwood y Suttle, 1999). Tabla 6.21. Contenido estacional de Na (g kg-1 base seca) en pastos nativos colectados en Terán, N.L., México en 2001 y 2002 3DVWRVQDWLYRV 160 (VWDFLRQHV\DxRGHFROHFWD ,QYLHUQR 3ULPDYHUD 9HUDQR %RXWHORXDFXUWLSHQGXOD %RXWHORXDWULILGD %UDFKLDULDIDVFLFXODWD 'LJLWDULDLQVXODUHV &KORULVFLOLDWD /HSWRFKORDILOLIRUPLV 3DQLFXPKDOOLL 3DQLFXPREWXVXP 3DQLFXPXQLVSLFDWXP 6HWDULDJULVHEDFKLL 6HWDULDPDFURVWDFK\D 7ULGHQVHUDJURVWRLGHV 7ULGHQVPXWLFXV 3URPHGLRHVWDFLRQDO Datos tomados de: Ramírez et al. (2004) alimento, baja tasa de crecimiento, disminución de la producción de leche, disfunción reproductiva, letargo y escasa ganancia de peso. Los animales con síntomas de deficiencia crónica algunas veces desarrollan anormalidades en el esqueleto, como raquitismo en animales jóvenes y osteomalacia en animales adultos. Los animales deficientes en P pueden desarrollar “pica” o apetito depravado y masticación de madera, hueso y otros materiales inusuales (NRC, 1989; McDonald et al., 1995; Underwood y Suttle, 1999). La deficiencia de P es más común que la de Ca, la cual induce síntomas similares, parcialmente debido a que la concen- Contenido de P en pastos cultivados El P es el mineral más comúnmente deficiente en forrajes pastoreados por el ganado (McDowell, 2003). Esto es especialmente cierto en áreas tropicales y subtropicales, y para FACULTAD DE CIENCIAS BIOLÓGICAS, UANL MACROMINERALES EN LOS PASTOS la mayor parte de América Latina. En condiciones de pastoreo, ya sea en agostaderos o praderas sin fertilización, los niveles de fósforo de las gramíneas se encuentran muy por debajo de los requerimientos del animal. Los forrajes maduros por lo general contienen menos de 1.5 g P kg-1 en la materia seca, mientras que los requerimientos de los bovinos de carne son por lo general superiores al 2.0 g P kg-1 en la materia seca (NRC, 2000). El P también es deficiente en los pastos cultivados que crecen en zonas semiáridas del noreste de México. Con excepción del pasto Cynodon dactylon (Cruza II) todos los pastos cultivados que aparecen en las Tablas 6.22., 6.23., 6.24. contienen niveles de P insuficientes para cubrir los requerimientos de rumiantes en crecimiento. Rhynchelytrum repens (Figura 6.3.) tuvo el valor más bajo. Similar tenden- cia se muestra en los pastos nativos que aparecen en las Tablas 6.25. y 6.26. Los pastos C. ciliaris, C. dactylon, D. annulatum y P. coloratum contienen más P en las hojas que en los tallos. Aun cuando el P disminuye conforme avanza la madurez de la planta, no hay una gran variación entre estaciones del año (Figura 6.5.). Sin embargo, las diferencias en el suministro de agua parecen tener un mayor y más consistente efecto que las diferencias en temperatura del suelo sobre el contenido de P en los pastos; dado que se ha reportado (Greene et al., 1987) que la concentración de P en el forraje disminuye con la sequía debido a que las condiciones de aridez y el aumento en la madurez también repercuten en bajas concentraciones de P en el forraje (Spears, 1994). Por tanto, el P es un nutriente limitante en el noreste de México y sur de Texas, EUA para el crecimiento y desarrollo óptimo de los Tabla 6.22. -1 rumiantes en pastoreo. Pastos como Contenido de P (g kg , base seca) base seca) en pastos cultivados colectados en diferentes fechas y municipios del noreste de México Panicum obtusumn (Figura 6.2.) y Panicum unispicatum (Figura 6.3.3) 3DVWRVLQWURGXFLGRV /XJDU\IHFKDGHFROHFWD (VWDFLRQHV 0HGLDDQXDO resultaron con contenido de P para ,QYLHUQR 3ULPDYHUD 9HUDQR 2WRxR cubrir marginalmente los requeri mientos de mantenimiento del ga&HQFKUXVFLOLDULV 7HUiQ1/0p[LFR &HQFKUXVFLOLDULVFRP~Q /LQDUHV1/0p[LFR nado en crecimiento. &\QRGRQGDFW\ORQ,, 0DULQ1/0p[LFR &\QRGRQGDFW\ORQ /LQDUHV1/0p[LFR 'LFKDQWKLXPDQQXODWXP /LQDUHV1/0p[LFR 3DQLFXPFRORUDWXP /LQDUHV1/0p[LFR 5K\QFKHO\WUXPUHSHQV 7HUiQ1/0p[LFR 3URPHGLR Datos tomados de: Ramírez et al. (2002); Ramírez et al. (2003); Ramírez-Lozano (2003); Ramírez et al. (2004); Ramírez et al. (2005). LOS PASTOS EN LA NUTRICIÓN DE LOS RUMIANTES 161 CAPÍTULO 6 Figura 6.1. Rhynchelytrum repens (Willd.) Hubb. Nombre común: zacate Rosado. Perenne; de corta duración, de 5-109 cm de alto, cespitosa, poco densa; tallos geniculados, ascendentes y arraigándose en los nudos; hojas lineares, planas, nudos y vainas pubescentes;lígula un arco denso de cilios; láminas tubuladas, glabras o poco pilosas, 6-20 cm de largo por hasta 5-7 mm de ancho. Panícula delicada de reflejos rosados, luego plateados, de ejes tenues, pedicelos rematados en platillo y con largos pelos; espiguillas muy caducas, ovoides, comprimidas, cubiertas de largos pelos sedosos, rectos, aplicados; primera gluma de 10.8 mm de largo, obtusa, pilosa, un poco distanciada, segunda gluma de 3.5-4 mm de largo, navicular, semidura, 5-nervada, gibosa y prolongada en rostro obtuso de margen ciliado entre cuyos 2 lóbulos hay una arista de 0.5mm de largo, menos el rostro, de base tuberculosa; lema estéril en todo igual a la segunda gluma, un poco menos gibosa, también afistulada y largamente pilosa; pálea ciliada, tenue, de 3 mm de largo. Introducida de África; invasora en los pastizales de la entidad; crece en las lluvias de invierno y verano. Valor forrajero regular (Ackerman-Beetle y Johnson-Gordon, 1991). 162 Tabla 6.23. Contenido de P (g kg-1; base seca) del híbrido buffel Nueces y cinco nuevos genotipos de buffel (Cenchrus ciliaris) colectados en diferentes fechas en Terán, N,L., México *HQRWLSRV )HFKDVGHFROHFWD $JRVWR 1RYLHPEUH 1RYLHPEUH -XQLR )HUWLOL]DGRV &HQFKUXVFLOLDULV1XHFHV &HQFKUXVFLOLDULV &HQFKUXVFLOLDULV &HQFKUXVFLOLDULV &HQFKUXVFLOLDULV &HQFKUXVFLOLDULV 3URPHGLR Datos tomados de: García-Dessommes et al. (2003ab) FACULTAD DE CIENCIAS BIOLÓGICAS, UANL MACROMINERALES EN LOS PASTOS Tabla 6.24. Contenido de P (g kg-1; base seca) de 84 nuevos genotipos de pasto Cenchrus ciliaris colectados en Terán, N.L., México en noviembre del 2000. *HQRWLSRV 3JNJ *HQRWLSRV 3JNJ *HQRWLSRV 3JNJ *HQRWLSRV 3JNJ 18(&(6 3URPHGLRGHWRGDVODVOtQHDV Datos tomados de: Morales-Rodríguez et al., 2005 LOS PASTOS EN LA NUTRICIÓN DE LOS RUMIANTES 163 CAPÍTULO 6 Figura 6.5. Contenido estacional de P (g kg-1 base seca) en las hojas y tallos de cuatro pastos cultivados y cosechados en Linares, N.L., México en 1998 y 1999 Datos tomados de: Ramírez et al. (2003); Ramírez-Lozano (2003); Ramírez et al. (2005a). 164 Tabla 6.25. Contenido estacional de P (g kg-1 base seca) en pastos nativos colectados en Marín, N.L., México en 1994 3DVWRVQDWLYRV (VWDFLRQHV\DxRGHFROHFWD 0HGLDDQXDO ,QYLHUQR 3ULPDYHUD 9HUDQR 2WRxR $ULVWLGDORQJLVHWD %RXWHORXDJUDFLOLV &HQFKUXVLQFHUWXV +LODULDEHODQJHUL 3DQLFXPKDOOLL 6HWDULDPDFURVWDFK\D 3URPHGLRHVWDFLRQDO Datos tomados de: Ramírez et al. (2004) FACULTAD DE CIENCIAS BIOLÓGICAS, UANL MACROMINERALES EN LOS PASTOS Azufre Formas químicas del S en el suelo y forraje Figura 6.2. Panicum unispicatum. Flugge. Perenne, con tallo de 50-80 cm de alto, que nacen simples o en pequeños grupos a partir de rizomas gruesos y escamosos. Lígula ciliada con pelos duros. Láminas con 3-4 de mm de ancho. Dispersamente hirsuta sobre ambos márgenes a escabrosa o casi glabra, glabra ampliamente redondeada y algo cordada en la base. Inflorescencia generalmente un único y delgado racimo espigad unilateral delgada de 7-20 cm de largo. Racimos secundarios frecuentemente producidos en las axilas de las hojas más superiores. Espiguillas glabras, elípticas, obovadas de 2.9-3.3 mm de largo, primera gluma comúnmente está ausente o muy corta en las espiguillas sésiles, generalmente está bien desarrollada en las espiguillas pediceladas, lem del florete superior color paja o pardo claro. Número de cromosomas no reportado. Distribución: Texas: porción sureste región 2 y 3 en suelos arenosos infrecuente. En general: desde el sur de Texas y Cuba hasta Venezuela y Argentina. Períodos de floración: verano y otoño (Gould, 1975). El azufre se presenta como sulfato en la fracción mineral de muchos suelos, pero a menudo se presenta también en forma de azufre elemental o sulfuros de hierro (FeS, FeS2) que no están disponibles para las plantas. Numerosos microorganismos del suelo son capaces de oxidar el azufre o los sulfuros a sulfato e hidrolizar los compuestos orgánicos de azufre que acaso constituyan una buena parte de éste de los suelos más fértiles. En áreas industrializadas (y áreas cercanas a fenómenos naturales como géiseres o volcanes productores de azufre gaseoso) el dióxido y el trióxido de azufre (SO2 y SO3) atmosféricos pueden ser fuentes importantes de nutrición de azufre. Ciertamente, es muy difícil demostrar deficiencia de este elemento en plantas de invernadero cultivadas en grandes ciudades industriales debido al alto contenido de azufre del aire, ya que el azufre que éste transporta es absorbido directamente por la planta o se disuelve en el medio nutritivo (Kowalenko, 1993). El azufre tiene funciones algo más especializadas que cualquiera de los otros dos nutrimentos aniónicos mayores, nitrógeno y fósforo. Forma parte de los aminoácidos cistina, cisteína y metionina, y es un importante constituyente de proteínas, así como de algunos compuestos de actividad biológica como el glutatión, la biotina, la timina y la coenzima A. El azufre está con frecuencia en forma de grupos sulfhidrilos (-SH) oxidables, los cuales forman el sitio acti- LOS PASTOS EN LA NUTRICIÓN DE LOS RUMIANTES 165 CAPÍTULO 6 Tabla 6.26. Contenido estacional de P (g kg-1 base seca) en pastos nativos colectados en Terán, N.L., México en 2001 y 2002 (VWDFLRQHV 3DVWRVQDWLYRV 166 ,QYLHUQR 3ULPDYHUD 9HUDQR 2WRxR 0HGLDDQXDO %RXWHORXDFXUWLSHQGXOD %RXWHORXDWULILGD %UDFKLDULDIDVFLFXODWD 'LJLWDULDLQVXODUHV &KORULVFLOLDWD /HSWRFKORDILOLIRUPLV 3DQLFXPKDOOLL 3DQLFXPREWXVXP 3DQLFXPXQLVSLFDWXP 6HWDULDJULVHEDFKLL 6HWDULDPDFURVWDFK\D 7ULGHQVHUDJURVWRLGHV 7ULGHQVPXWLFXV 3URPHGLRHVWDFLRQDO vo de algunos agentes redox y de transferencia de electrones. También es importante en la formación de puentes disulfuro (S-S), involucrados en la formación y estabilización de la estructura terciaria de las enzimas y otras proteínas. Muchos inhibidores o venenos poderosos actúan atacando a grupos sulfhidrilos; su acción puede a menudo reducirse o atenuarse mediante la adición excesiva de algunos compuestos SH que inmovilicen al inhibidor (Millard et al., 1985). La mayor parte del azufre del organismo de los animales y de los alimentos, se encuentra en las proteínas que incluyen aminoácidos que contienen azufre, cistina, cisteina y metionina; solo una pequeña cantidad de azufre se encuentra en forma inorgánica, principalmente sulfatos (Underwood y Suttle, 1999). Las cantidades excesivas de sulfatos reducen la ingestión de alimentos y afectan negativamente a los animales al disminuir la utilización de otros minerales como el zinc y el FACULTAD DE CIENCIAS BIOLÓGICAS, UANL MACROMINERALES EN LOS PASTOS manganeso. Las necesidades de azufre estimadas para el ganado vacuno son de 0.20%; el máximo debe limitarse a 0.35% de la ración. Referencias Figura 6.3. Panicum obtusum (H.B.K.). Nombre común: zacates Guía. Perenne; presentándose en pequeños macollos dispersos a partir de un rizoma nudoso y produciendo estolones a veces de 2 m o más de largo, con entrenudos largos y geniculados, hinchados, nudos conspicuamente vellosos, a menudo con agrupaciones semejantes a botones de escamas peludas en la base de las erectas ramas extravaginales, éstas agrupaciones se producen algunas veces cuando la rama no está desarrollada; culmos resistentes, comprimidos, de 2-8 cm de alto, simples; a menudo decumbentes en la base, glabros, nudos glabros; vainas más cortas que los entrenudos, glabras o las inferiores y aquellas de los estolones algunas veces vellosas; lígulas membranosas, aproximadamente de 1mm de largo; láminas de 3-20 cm de largo por 2-7 mm de ancho, erectas, firmes, habitualmente involutos, setáceas hacia la punta, glabras en ambas superficies o algunas veces con unos cuantos pelos largos en la superficie adaxial en la base. Panícula habitualmente corto-exerta, de 3-12 cm de largo por 1 cm de ancho, las pocas ramas semejantes a racimos, densamente floreadas; espiguillas corto-pediceladas a lo largo de un lado del caquis ligeramente aplanado, de 3-3.8 mm de largo por 1.5-1.8 mm de ancho y aproximadamente 2 mm de grueso, obovoides, despuntadas, glabras, habitualmente parduzcas; primera gluma casi de largo de las espiguillas, 2-nervada; segunda gluma y lema estéril sublinguales, 5-7nervadas, lema abrazando una pálea más bien firme y una flor estaminada; cariópsis de 3-3.5 mm de largo por 1.5-1.7 mm de ancho, subagudo y brillante, pero muy obscuramente pubescente en el ápice. Nativa; en suelos arenosos y gravosos, generalmente a lo largo de ríos, arroyos y canales de irrigación; en Pastizales mediano abierto y mediano arbofrutescente. Valor forrajero bueno (Ackerman-Beetle y Johnson-Gordon, 1991). Ackerman-Beetle, A. y Johnson-Gordon, D. 1991. Gramíneas de Sonora. SAGRH COTECOCA. Gobierno del Edo de Sonora, Hermosillo, Son. Armienta-Trejo, G.T. 1995. Perfil mineral del suelo, forraje y tejidos del ganado en agostaderos del Estado de Nuevo León. Tesis de Doctorado. Facultad de Medicina Veterinaria y Zootecnia, Universidad Autónoma de Nuevo León. San Nicolás, N.L., México. Blevins, D.G. 1994. Uptake, translocation and function of essential mineral elements in crop plants. In: Boote, K.J. et al. (editors) Physiology and Determiantion of Crop Yied. American Society of Agronomy, Madison, EUA, pp. 259-275. Ammerman, C.B., Baker, D.H. y Lewis, A.J. 1995. Bioavailability of Nutrients for Animals: Amino Acids, Minerals and Vitamins. Academic Press, San Diego, EUA. p. 83. Bowen, E. J. 1981. Hierro: elemento vital para las plantas y animales. Agricultura de las Américas 30 :36-41. Bowen, E. J. y B.A; Krtky. 1983. Microelementos: Causas de deficiencia y toxicidad. Agricultura de las Américas. 36: 8-11. Conforth, I.S., 1984. Mineral nutrients in pasture species. Proceedings of The New Zealand Society of Animal Production: 44: 135-137. Durand, M. and R. Kawashima. 1980. Influence of mineral in rumen microbial digestion. In: Digestive Physiology and Metabolism in Ruminants. Avi. Publishing Company, Inc. Westport, Connecticut. p. 375. Durand, M. y Komisarczuk, S., 1988. Influence of major mineral son rumen microbiota. J. of Nutrition 151:413-426. Follet, R.F. y Wilkinson, S.R. 1995. Nutrient management forages. In: Barnes, R.F., Miller, D.A. y Nelson, C.J. (editores) Forages, 5a edición, vol. II. Iowa State Univ. Press, Ames, pp. 55-82. Fontenot, J.P. y Church, D.C., 1979. The macto (major) minerals. In: Church, D.C. (editor). Digestive Physiology and Nutrition of Ruminants, Vol. 2. Nutrition, 2a edición. O & B Books, Corvalis, Oregon, pp. 56-99. LOS PASTOS EN LA NUTRICIÓN DE LOS RUMIANTES 167 CAPÍTULO 6 168 Foth, Dh.H. 1985. Fundamentos de la ciencia del suelo. 3ª. Ed. Compañía Editorial Continental. México. Pp. 313-314. García-Dessommes, G.J., Ramírez-Lozano, R.G., Foroughbakhch, R., Morales Rodríguez, R. y García-Díaz, G. 2003. Ruminal digestion and chemical composition of new genotypes of buffelgrass (Cenchrus ciliaris L.). Interciencia, 28: 220-224. García-Dessommes, G.J., Ramírez-Lozano R.G., Foroughbakhch, R., Morales-Rodríguez, R. y García-Díaz G. 2003. Valor nutricional y digestión ruminal de cinco líneas apomíticas del pasto buffel (Cenchrus ciliaris L.). Técnica Pecuaria en México, 41: 209-218. Gissel-Nielsen, G., Grupa, U.C., Lamand, M. y Westermarck, T. 1984. Selenium in soils and plants and its importante in livestock and human nutrition, Advances in Agronomy. 37: 397-460. Greene, L.W., Pinchak, W.E. y Heitschmidt, R.K. 1987. Seasonal dynamics of mineral in forages at the Texas Experimental Ranch. J. Range manage. 40:502-506. Gould, F. W. 1975. The grasses of Texas. Texas A & M University Press. Kawas-Garza, J.J. 1996. Determinación del perfil mineral de especiees forrajeras de cuatro zonas geográficas del litoral del golfo de México. Tesis de Doctorado. Facultad de Medicina Veterinaria y Zootecnia, Universidad Autónoma de Nuevo León. San Nicolás, N.L., México. Kowalenko, C.G. 1993. Extraction of available sulfur. In: Carter, M.R. (editor). Soil Sampling and Methods of Analysis. Lewis Publishers, Boca Raton, pp. 65-74. Langelands, P.J., 1987. Assessing the nutrient status of herbivores. In: Hacker, J.B. and Ternouth, J.H. (editores). The Nutrition of Herbivores. Academic Press, Sydney. pp. 363-390. Marschner, H. 1993. Zn uptake from soils. In: Robson, A.D. (editores). Zinc in Soil and Plants. Kluwer Academic Publishers, Dordrecht, pp. 59-77. Marschner, H. 1995. Mineral Nutrition of Higher Plants, 2a edición, Academic Press, Londres R.U. p. 889. McBride, M.B. 1994. Environmental Chemistry of Soils. Oxford University Press, N.Y. p. 406. McDowell, L.R. 2003. Minerals in Animal and Human Nutrition, 2a edición. Elsevier Science, Amsterdam, Holanda. pp. 35-37. McDonald, P., Edwards, R.A., Greenhalgh J.F.D., Morgan, C.A., 1995. Animal Nutrition. 5a edición. Longman Scientific and Technical, p. 607. Miller, E.R. 1985. Mineral x disease interactions. J. Anim. Sci. 60: 1500- 1507. Millard, P. Gordon A.H., Richardson, A.J. y Chesson, A. 1987. Reduced ruminal degradation of rygrass caused by J. of Sci. of Food and Agricultural 40: 305-314. Morales-Rodríguez, R., Ramírez, R.G., García-Dessommes, G.J. y González-Rodríguez, H. 2005. Nutrient Content and In Situ Disappearance in 78 Genotypes of Buffelgrass (Cenchrus ciliaris L.). J. Appl. Anim. Res. (En prensa). NRC, 1989. National Research Council. Nutrient Requirements of Dairy Cattle, 6a edition. National Academic Press, Washington, DC. p. 157. NRC, 2000. National Research Council. Nutrient Requirements of Beef Cattle, 7a edition. National Academic Press, Washington, DC. p. 175. Paul, E.A. y Clark, F.E. 1996. Soil Microbiology and Biochemistry, 2ª edición. Academic Press, San Diego. Ramírez R.G., González-Rodríguez, H. y García-Dessommes, G. 2002. Chemical composition and rumen digestion of forage from kleingrass (Panicum coloratum). Interciencia, 27:705-709. Ramírez, R.G., González-Rodríguez, H. y García-Dessommes, G.J. 2003. Nutrient digestion of common bermudagrass (Cynodon dactylon L.) Pers. growing in northeastern Mexico, J. Appl. Anim. Res. 23: 93102. Ramírez-Lozano, R.G. 2003. Nutrición de Rumiantes: Sistemas Extensivos. Trillas, México, D.F. p. 212. Ramírez R.G., Haenlein, G.F.W., García-Castillo, C.G. y Núñez-González M.A. 2004. Protein, lignin and mineral contents and in situ dry matter digestibility of native Mexican grasses consumed by range goats. Small Rumin. Res. 52: 261-269. Ramírez, R.G. y González-Rodríguez, H. García-Dessommes, G. and Morales-Rodríguez, R. 2005. Seasonal Trends in the Chemical Composition and Digestion of Dichanthium annulatum (Forssk.) Stapf. J. Appl. Anim. Res. (En prensa). Romheld, V. y Marschner, H. 1991. Functions of micronutrients in plants. In: Mortvendt, J.J. (editor) Micronutrients in Agriculture, 2a edición. Soil Science Society of America, Madison, pp. 297-328. Rojas, M. y Rovalo, M. 1986. Fisiología Vegetal. Editorial. McGrawHill. México. p. 115. Spears, W.J. 1994. Minerals in forage. Fahey, C.G. jr. (ed.). Forage Quality, Evaluation and Utilization. pp: 281-3117. National Conference on Forage Quality. Univ. of Nebraska. Lincoln, Nebraska, E.U. pp. Tisdale, S.L. y W.L; Nelson. 1982. Fertilidad de los suelos y fertilizantes. FACULTAD DE CIENCIAS BIOLÓGICAS, UANL MACROMINERALES EN LOS PASTOS 1ª edición. Unión Tipografía Hispanoamericana. México. pp. 101-107. Underwood, E.J. y Suttle, N.F., 1999. The Mineral Nutrition of Livestock, 3a edición. CAB International, Wallingford, p. 600. Valdez, J.L., L.R. McDowell and M. Koger. 1988. Mineral status and supplementation of grazing beef cattle under tropical conditions in Guatemala. II. Macroelements and animal performance. J. Prod. Agric. 1: 356-361. Whitehead, D.C. 2000. Nutrient Elements in Grasslands. Soil-Plant-Animal relationships. CABI Publishing, Wallingford, Reino Unido. p. 135. 169 LOS PASTOS EN LA NUTRICIÓN DE LOS RUMIANTES 170 Capítulo 7 Microminerales en los pastos Introducción Los microminerales, participan en muchos sistemas enzimáticos, que hacen eficiente la utilización metabólica de los nutrientes principales de la dieta, es decir, sustancias energéticas, fibra y proteínas. Son un conjunto de elementos presentes en cantidades traza en el organismo, con concentraciones del orden de picogramos a nanogramos por gramo de tejido húmedo, algunos de ellos están presentes por casualidad y no parecen tener funciones especiales, otros, son imprescindibles para ciertas funciones muy importantes (Cu, Zn, Mn, Fe, Co, Se, I). Pese a hallarse como vestigios, son esenciales para el mantenimiento del metabolismo normal. Los microminerales son utilizados en la síntesis de vitaminas, producción hormonal, actividad enzimática, formación de colágenos, síntesis de tejidos, transporte de oxígeno y muchos otros procesos fisiológicos relacionados con el crecimiento, salud y reproducción. No pueden estable- cerse reglas generales en cuanto a su disponibilidad en los pastos ya que estos dependen en gran medida de los suelos en los que son cultivados, pero se ha encontrado que los animales los requieren en cantidades menores a 1.0 mg kg-1 de materia seca en la dieta. Aspectos fisiológicos Los microminerales son componentes de muchos tejidos y de una o más actividades enzimáticas y sus deficiencias conducen a una gran variedad de consecuencias patológicas y defectos metabólicos. Una serie de elementos que no son requeridos (o se requieren sólo en pequeñas cantidades) pueden causar toxicidad en los bovinos de carne. La concentración máxima de minerales es definida como aquel nivel dietario, que administrado durante un período limitado no impedirá el com- LOS PASTOS EN LA NUTRICIÓN DE LOS RUMIANTES 171 CAPÍTULO 7 172 portamiento animal y no genera residuos tóxicos en alimentos humanos derivados del animal (McDowell, 2003). La base fisiológica de la deficiencia de los microminerales es muy compleja. Algunos elementos están comprometidos en una enzima en particular, otros en muchas y la carencia de uno de estos elementos afecta a uno o más procesos metabólicos. Una deficiencia en la dieta no conduce, necesariamente, a una enfermedad clínica. Varios factores predisponen a la enfermedad clínica en el animal, entre los que se encuentran: la edad en que aparece la deficiencia, diferencias genotípicas en cuanto a los requerimientos, discontinuidad en las demandas debido a cambios ambientales, el desafío debido a infecciones concomitantes o demandas en la producción, variaciones individuales en respuesta a la deficiencia y el volumen de las reservas funcionales. Una deficiencia puede dividirse en cuatro fases: depleción, deficiencia, disfunción y enfermedad clínica. El término relativo de depleción describe el fallo en la dieta para mantener el estado corporal del micromineral, y puede mantenerse durante semanas o meses sin aparecer efectos clínicos, cuando existen reservas corporales sustanciales. La depleción se produce cuando los requerimientos netos de un determinado elemento esencial son superiores a la absorción neta de dicho elemento a nivel intestinal. El organismo en este estado puede responder mejorando la absorción intestinal o disminuyendo las pérdidas endógenas. Hay un descenso del elemento en cuestión en los lugares de depósito como el hígado, por lo que las concentraciones plasmáticas pueden permanece constantes. Si la carencia en la dieta persiste, eventualmente hay una transición del estado de depleción al de deficiencia, el cual está señalado por indicadores bioquímicos que indican que los mecanismos homeostáticos no pueden mantener niveles constantes de los minerales necesarios para las funciones fisiológicas constantes. Después de períodos variables de tiempo, las concentraciones o actividades de las enzimas empiezan a declinar hasta llegar a la fase de disfunción. Puede haber un período adicional retrasado, la fase subclínica, antes de que los cambios en las funciones celulares se manifiesten como enfermedad clínica. El diagnóstico de las deficiencias minerales, particularmente la deficiencia de microminerales dependerá, en gran medida, de la interpretación de los criterios bioquímicos para valorar el status de minerales. Esto se debe a que las deficiencias de uno o más microelementos conducen a signos clínicos inespecíficos tales como pérdida de peso, retraso en el crecimiento, anorexia y menor capacidad reproductiva. Las cantidades de algunas sustancias existentes en las pasturas, alimentos y tejidos corporales son sumamente pequeñas y su cálculo difícil y costoso. En virtud de estas dificultades se ha llegado a la conclusión de que quizás lo más aplicable sea describir síndromes individuales según la respuesta a la administración de suplementos dietéticos que incluyan el nutriente esencial. Los ensayos dosis-respuesta ayudan a establecer una unión entre un microelemento y ciertos signos clínicos y, de gran importancia, dan una indicación de la importancia económica de una suplementación FACULTAD DE CIENCIAS BIOLÓGICAS, UANL MICROMINERALES EN LOS PASTOS adecuada del elemento en la dieta. El diagnóstico etiológico definitivo de las deficiencias de microminerales dependerá de la respuesta obtenida en el crecimiento y salud de los individuos, al tratamiento parenteral o suplementación en la dieta. Algunos minerales, sin estar en deficiencia, producen al ser administrados diariamente una mejora en la producción individual por efecto estimulante sobre algún parámetro digestivo o bien por balancear mejor el exceso de otro mineral, entre otros posibles factores. Por lo tanto, la administración de minerales en los sistemas productivos debe ser considerada desde el punto de vista fisiológico pero también productivo (Underwood y Suttle, 1999). Metodología para el análisis mineral de los pastos Las muestras que llegan al laboratorio se someten al siguiente proceso de preparación. 1. Limpieza de la muestra: la muestra fresca si contiene polvo o vestigios de contaminación se lava con abundante agua destilada, y se deja secar un poco al aire. 2. Secado de la muestra: se toma una cantidad de muestra de aproximadamente 100 g, y se somete a un secado en estufa durante 24 a 48 horas a una temperatura entre 60 y 80° C. 3. Molienda: una vez seca la muestra, se muele y homogeniza en molino Wiley, se pasa por un tamiz plástico de 2 mm y se almacena para posterior análisis. 4. Almacenamiento: las muestras se almacenan en bolsas plásticas exentas de humedad, quedando listas para análisis químico. Digestión Húmeda La muestra seca y molida se somete a una digestión húmeda donde se efectúa la liberación de los elementos minerales (P, K, Ca, Mg, S, Mn, Cu, Fe, Zn y Na ) esta digestión se hace con una mezcla de HNO3 concentrado del 65% y HClO4 concentrado al 70%. (250 ml HNO3+100 ml HClO4). Relación de Mezcla 2.5:1. Para el procedimiento se pesan 0.5 g de muestra seca y molida, se lleva a un tubo de ensayo de 2.5 cm de diámetro x 35 cm de altura, se agrega de 2.5 a 3.0 ml de mezcla ácida dependiendo del cultivo, luego se coloca en la placa de digestión. (La temperatura no debe pasar de 200° C (a mayor temperatura se puede volatilizar algo del P). Se toma como punto final de la digestión cuando aparecen humos blancos y ya el digerido se encuentra totalmente transparente. En este punto deben haber aproximadamente 0.5 ml de solución. Se deja enfriar, se agregan 24.5 ml de agua destilada, se filtra en papel de filtro cuantitativo (Whatman 40 o similar). En este filtrado se encuentran listos para lectura el P, S, K, Ca, Mg, Mn, Cu, Fe, Zn y el Na. El residuo contiene los materiales insolubles y la Sílice cruda (SiO2). De este filtrado se toman las alícuotas correspondientes para el análisis químico. Las determinaciones de Cu, Mn, Fe, Zn y Na, se realizan directamente del filtrado de la digestión usando un espectrofotómetro de absorción atómica. LOS PASTOS EN LA NUTRICIÓN DE LOS RUMIANTES 173 CAPÍTULO 7 La determinación de K, Ca y Mg: del filtrado de la digestión se toman 0.5 ml, se le agregan 48.5 ml agua destilada y 1 ml de Oxido de Lantano al 5%. De esto resulta una relación de Dilución de 50/0.5 ml, se agita y se lee en el espectrofotómetro de absorción atómica. La determinación de P se hace por colorimetría. La determinación de S se hace por turbidimetría con Cloruro de Bario. La determinación de B se hace por colorimetría con Azometina-H. Cobre Formas químicas del Cu en el suelo y forraje 174 El Cu se encuentra en el suelo principalmente como ión cúprico (Cu—) absorbidos por las arcillas minerales, y como parte ligada, con la materia orgánica, cantidades más pequeñas de sales neutras insolubles, compuestos hidrosolubles y minerales de cobre también pueden estar presentes. (Tisdales y Nelson, 1982). La concentración de Cu en la solución del suelo debe de ser de 4 a 6 mg kg-1 en los suelos minerales y de 20 a 30 mg kg-1 en los suelos orgánicos. Normalmente una concentración de 7 mg kg-1, de cobre disponible en el suelo seco proporciona la cantidad mínima requerida por la mayoría de los cultivos. (Bowen y Krtky, 1983). El Cu en la planta es componente estructural de ciertas enzimas oxido reductoras, como la Tirosinasa, la citocromooxidasa y oxidasa del ácido ascórbico. La deficiencia de Cu reduce la síntesis de proteína y resulta en una acumulación de aminoácidos en los tejidos de la planta. (Bowen, 1985). Funciones del Cu en el rumiante El Cu es necesario para la formación de la hemoglobina, la cual se encuentra presentes en la ceruplasmina, la cual participa en la liberación del hierro desde las células al plasma. Es componente de algunas proteínas de la sangre como eritrocupreina, la cual se encuentra en los eritrocitos donde participa en el metabolismo del oxigeno. Juega un papel importante en numerosos sistemas enzimáticos por ejemplo, componente de la citocromo oxidasa que es importante en la fosforilación oxidativa; además, forma parte de ciertos pigmentos fundamentales como la furacina. También es necesario por la pigmentación del pelo, piel y lana. (McDonald et al, 1995). Los síntomas de deficiencia, en el animal son: anemia, retraso del crecimiento, alteraciones en los huesos, decoloración del pelo y lana, trastornos gastrointestinales, lesiones en el tronco encefálico y la medula espinal. Lesiones nerviosas en corderos jóvenes y se manifiesta por incoordinación motora. (McDonald et al, 1995). La deficiencia de Cu en el ganado vacuno en pastoreo se considera como uno de los problemas de mayor importancia practica en muchas partes del mundo. Es consecuencia de la ingestión de cantidades demasiado bajas de Cu o de sustancias que interfieren su utilización, presentes en los pastos, como molibdeno y los sulfatos (Underwood y Suttle, 1999). FACULTAD DE CIENCIAS BIOLÓGICAS, UANL MICROMINERALES EN LOS PASTOS Debido a las múltiples interacciones del Cu, se han agrupado las deficiencias de Cu en 4 categorías: cuando el alimento contiene: 1) niveles altos de Mo (más de 20 mg kg-1), 2) nivel bajo de Cu o un nivel de Mo considerablemente alto (por ejemplo, una proporción de menos de 2:1), 3) deficiencia de Cu (menos de 5 mg kg-1), y 4) nivel normal de Cu y bajo en Mo, con un nivel alto de proteína soluble (que proviene de pastos verdes) ya que ésta incrementa la cantidad de sulfuros producidos en el rumen, resultando en sulfuro de Cu y el rumiante no puede utilizarlo. La absorción del Cu y, por consiguiente, las necesidades de este mineral son notablemente afectadas por los demás componentes de la dieta. Las necesidades de Cu en la ración del ganado bovino de carne son de 5 mg kg-1 en la materia seca de la dieta normalmente, y notablemente superiores cuando existen Mo y S (McDowell, 2003). Contenido de Cu en pastos cultivados La concentración de Cu presente en 94 muestras de pastos tropicales cultivados en diversas partes del mundo varió de 3 a 100 mg kg-1 en la materia seca, con una media de 15 mg kg-1 en la materia seca. El 26 % de los pastos fueron deficientes en Cu para cubrir los requerimientos del ganado de carne en crecimiento (10 mg kg -1 en la materia seca; McDonald, 2003; Tabla 7.1.). Sin embargo, este valor puede ser demasiado elevado, pues no se encontró variación en el crecimiento de los animales en pastoreo cuando se les suministró Cu, pese a que los niveles de Cu presentes en los pastos eran considerablemente inferiores (3 a 8 mg kg-1 en la materia seca) al nivel recomendado de 10 mg kg-1 en la materia seca (Minson, 1992). Tabla 7.1. Requerimientos de microminerales para rumiantes (OHPHQWR &XPJNJ )HPJNJ 0QPJNJ =QPJNJ %RYLQRVGHFDUQH &UHFLPLHQWR ,QLFLRGHOD \ ODFWDFLyQ L Ly %RUUHJRVDGXOWRV &DEUDVDGXOWDV ± ± ± ± Tomado de McDowell (2003). 175 En muchas regiones del mundo, después del P, la deficiencia de Cu es la más importante para animales en pastoreo (McDowell, 2003). Lo anterior es corroborado en los pastos cultivados cosechados en diferentes municipios del noreste de México que contienen niveles de Cu insuficientes para cubrir los requerimientos para el ganado de carne en crecimiento (Tablas 7.2., 7.3., 7.4). Además, los pastos nativos que crecen en estas regiones (Tabla 7.5. y 7.6.), también acusan de deficiencia en Cu. Aparentemente, la fertilización con urea, la cual tiene poco efecto sobre el pH del suelo, por lo general tiene muy poco efecto en la concentración de Cu en el forraje (Whitehead, 2000). Lo anterior es corroborado con los resultados reportados por García-Dessommes et al. (2003b) LOS PASTOS EN LA NUTRICIÓN DE LOS RUMIANTES CAPÍTULO 7 Tabla 7.2. Contenido de Cu (mg kg-1) base seca) en pastos cultivados colectados en diferentes fechas y municipios del noreste de México 3DVWRVLQWURGXFLGRV /XJDU\IHFKDGHFROHFWD (VWDFLRQHV 0HGLDDQXDO ,QYLHUQR 3ULPDYHUD 9HUDQR 2WRxR &HQFKUXVFLOLDULV 7HUiQ1/0p[LFR &HQFKUXVFLOLDULVFRP~Q /LQDUHV1/0p[LFR &\QRGRQGDFW\ORQ,, 0DULQ1/0p[LFR &\QRGRQGDFW\ORQ /LQDUHV1/0p[LFR 'LFKDQWKLXPDQQXODWXP /LQDUHV1/0p[LFR 3DQLFXPFRORUDWXP /LQDUHV1/0p[LFR 5K\QFKHO\WUXPUHSHQV 7HUiQ1/0p[LFR 3URPHGLR Datos tomados de: Ramírez et al. (2002); Ramírez et al. (2003); Ramírez-Lozano (2003); Ramírez et al. (2004); Ramírez et al. (2005). 176 quienes reportaron que no hubo una substancial diferencia en la concentración de Cu entre seis genotipos del pasto Cenchrus ciliaris (Tabla 7.3.) cosechados en diferentes fechas sin y con fertilización con 120 kg de urea ha-1. Tabla 7.3. Contenido de Cu (mg kg-1; base seca) del híbrido buffel Nueces y cinco nuevos genotipos de buffel (Cenchrus ciliaris) colectados en diferentes fechas en Terán, N,L., México *HQRWLSRV )HFKDVGHFROHFWD $JRVWR 1RYLHPEUH 1RYLHPEUH -XQLR )HUWLOL]DGRV &HQFKUXVFLOLDULV1XHFHV &HQFKUXVFLOLDULV &HQFKUXVFLOLDULV &HQFKUXVFLOLDULV &HQFKUXVFLOLDULV &HQFKUXVFLOLDULV 3URPHGLR Datos tomados de : García-Dessommes et al. (2003ab) FACULTAD DE CIENCIAS BIOLÓGICAS, UANL Los 84 genotipos del pasto buffel que aparecen en la Tabla 7.4. tuvieron una composición de Cu muy parecida a los genotipos de la Tabla 7.3. Además en todos los casos fueron deficientes para satisfacer las demandas de Cu de rumiantes en crecimiento que son 10 mg kg-1 en la materia seca de la dieta. Con excepción del pasto C. dactylon, en los otros tres pastos que aparecen en la Figura 7.1., las hojas contienen más Cu que los tallos. La madurez en los pastos promueve la disminución del contenido de Cu en los pastos cultivados y reduce la diferencia entre partes de la planta. Se ha reportado que hay un rápido consumo durante el crecimiento y una dilución gradual conforme la planta madura. Por ejemplo, los niveles de Cu en los forrajes pueden reducirse en un 50% conforme la planta madura (Underwood y Suttle, 1999). Contenido de Cu en pastos nativos De todo los pastos nativos que aparecen en las Tablas 7.5. y 7.6., Panicum hallii fue el único pasto nativo, que crece en el municipio de Marín, N.L., México, que tuvo, en todas las estaciones del año (Tabla 7.5.), niveles de Cu para cubrir los requerimien- MICROMINERALES EN LOS PASTOS Tabla 7.4. Contenido de Cu (mg kg-1; base seca) de 84 nuevos genotipos de pasto Cenchrus ciliaris colectados en Terán, N.L., México en noviembre del 2000. *HQRWLSRV &XPJNJ *HQRWLSRV &XPJNJ *HQRWLSRV &XPJNJ *HQRWLSRV &XPJNJ 18(&(6 3URPHGLRGHWRGDVODVOtQHDV Datos tomados de: Morales-Rodríguez et al., 2005 LOS PASTOS EN LA NUTRICIÓN DE LOS RUMIANTES 177 CAPÍTULO 7 Figura 7.1. Contenido estacional de Cu (mg kg-1 base seca) en las hojas y tallos de cuatro pastos cultivados y cosechados en Linares, N.L., México en 1998 y 1999 contenido mineral dentro de los suelos, 2) madurez de la planta y 3) variaciones estacionales (McDowell, 2003). Hierro Formas químicas del Fe en el suelo y forraje Datos tomados de: Ramírez et al. (2003); Ramírez-Lozano (2003); Ramírez et al. (2005a). 178 tos de bovinos de carne en crecimiento (Tabla 7.1.). Las diferencias en la concentración de Cu pueden deberse a 1) diferencias entre especies de plantas, 2) tipos de suelo y Tabla 7.5. Contenido estacional de Cu (mg kg-1 base seca) en pastos nativos colectados en Marín, N.L., México en 1994 3DVWRVQDWLYRV (VWDFLRQHV\DxRGHFROHFWD ,QYLHUQR 3ULPDYHUD 9HUDQR 0HGLDDQXDO 2WRxR $ULVWLGDORQJLVHWD %RXWHORXDJUDFLOLV &HQFKUXVLQFHUWXV +LODULDEHODQJHUL 3DQLFXPKDOOLL 6HWDULDPDFURVWDFK\D 3URPHGLRHVWDFLRQDO Datos tomados de: Ramírez et al. (2004) El hierro en el suelo es el elemento químico más común en la corteza terrestre. Se encuentra en los suelos en tres formas: metal libre, ferrosa (Fe+) y férrica (Fe++) así como en las estructuras reticulares de los silicatos primarios y en las arcillas minerales. (Bowen y Krtky, 1983). El hierro en la planta es fisiológicamente activo en forma férrica (Fe++) por las raíces. Este elemento es esencial para la formación de clorofila, aunque no forma parte de su molécula. Actúa como catalizador en las reacciones de síntesis de la clorofila. Participa en varias reacciones de oxidoreducción en las plantas y en esencial para la síntesis de las proteínas y varias reacciones metabólicas. El hierro tiene funciones especificas en la activación de varios sistemas meristemáticos: hidrogenasa fumárica, catalasa, oxidasa y citocromos. (Bowen, 1981). El principal síntoma de deficiencia es clorosis intervenal, la cual se caracteriza por un amarillamiento de la lamina de la hoja permaneciendo verdes los tejidos de conducción y zonas inmediatamente adyacentes. (Foth, 1985). Funciones del Fe en el rumiante En el rumiante más del 90% de Fe existente en el organis- FACULTAD DE CIENCIAS BIOLÓGICAS, UANL MICROMINERALES EN LOS PASTOS Tabla 7.6. Contenido estacional de Cu (mg kg-1 base seca) en pastos nativos colectados en Terán, N.L., México en 2001 y 2002 3DVWRVQDWLYRV (VWDFLRQHV ,QYLHUQR %RXWHORXDFXUWLSHQGXOD %RXWHORXDWULILGD %UDFKLDULDIDVFLFXODWD 'LJLWDULDLQVXODUHV &KORULVFLOLDWD /HSWRFKORDILOLIRUPLV 3DQLFXPKDOOLL 3DQLFXPREWXVXP 3DQLFXPXQLVSLFDWXP 6HWDULDJULVHEDFKLL 6HWDULDPDFURVWDFK\D 7ULGHQVHUDJURVWRLGHV 7ULGHQVPXWLFXV 3URPHGLRHVWDFLRQDO 3ULPDYHUD 9HUDQR 2WRxR mo, está combinado con las proteínas, sobre todo con la hemoglobina. También se encuentra en el plasma sanguíneo unido a ala proteína transferritina (llamada también siderofilina) la cual transporta el Fe en el organismo. Se almacena en forma de ferretina, en hígado, bazo, riñón y médula ósea, o en forma de hemosiderina. También forma parte de muchas enzimas, incluidas los citocromos y las flavoproteinas. (McDonald et al, 1995) La hemoglobina, mioglobina y varias enzimas respiratorias contienen Fe quelatado en forma de un complejo de porfirina-hemoglobina, que se une a un componente proteico que es distinto para cada uno de estos compuestos activos. La hemoglobina funciona como transportador de globina que estabilizan el Fe en estado ferroso permitiéndole ligarse de forma reversible con el O2. La hemoglobina trans- porta oxigeno entre los pulmones y los tejidos. Los hematíes y la hemoglobina se destruyen y remplazan constantemente. El Fe mantiene un metabolismo muy activo en el organismo. El Fe liberado en la destrucción normal de los hematíes se emplea para la resíntesis de hemoglobina que tiene lugar en la medu la ósea para reemplazar a la hemoglobina catabolizada. Debido al eficiente reciclado del Fe, las necesidades en este mineral de los animales domésticos, son relativamente bajas (25-40 mg kg-1 de materia seca de la dieta). El Fe es absorbido en la luz intestinal por las células de la mucosa. La absorción esta relacionada con las necesidades orgánicas y es mas eficiente en los animales jóvenes que en los adultos. Los compuestos hem presentes en los alimentos de origen animal, como la harina de pescado, se absorben mejor que el hierro de los alimentos de origen vegetal, que contienen principalmente sales inorgánicas de hierro. La magnitud de absorción se ve afectada por los quelatados, algunos de los cuales (ácido ascórbico o cisteina) favorecen la absorción, en tanto que otros la inhiben. La absorción del Fe se reduce por otros iones bivalentes (Zn, 0HGLDDQXDO oxigeno en los procesos respiratorios debido a que los enlaces entre el hierro y la LOS PASTOS EN LA NUTRICIÓN DE LOS RUMIANTES 179 CAPÍTULO 7 180 Mn, Co) que se consideran compiten por los puntos de enlace en la mucosa intestinal. Los fosfatos y fitatos interfieren la absorción del hierro al formar sales de hierro insolubles. El Cu interviene de forma muy importante en la utilización del hierro, ya que el cobre se encuentra en la enzima ferroxidasa que facilita la liberación del hierro de la ferritina en las células de la mucosa intestinal. Las necesidades de Fe son bajas en los animales adultos, 25-40 ppm en base seca en las raciones de rumiantes. La administración de compuestos de Fe a las hembras gestantes, puede servir para incrementar los niveles de hemoglobina en sangre y las reservas de hierro de los animales recién nacidos, si bien, no aumenta el contenido de hierro de la leche por la administración del mismo (Underwood y Suttle, 1999). La anemia es el síntoma principal de la deficiencia de Fe con depleción de sus reservas en el organismo, es decir, la reducción de hematíes y menor contenido en hemoglobina en sangre (McDonald, 2003). Contenido de Fe en pastos cultivados Es del conocimiento común que los animales más jóvenes requieren más Fe que los adultos. Las deficiencias de Fe para rumiantes en pastoreo son raras a menos que ocurra pérdida de sangre (por parásitos o enfermedad). Al parecer la mayoría de los pastos cultivados que aparecen en las Tablas 7.7., 7.8. y 7.9. contienen concentraciones de Fe en cantidades suficientes para satisfacer las necesidades del ganado vacuno en crecimiento (50 mg kg-1 en la materia seca de la dieta). Sin embargo, existe variación en la tendencia estacional en el contenido de Fe en los pastos cultivados. En invierno y primavera (época seca) los pastos tuvieron menor contenido de Fe que en verano y otoño (época húmeda). Lo anterior puede ser explicado a que existe evidencia que la capacidad de los suelos para sostener un determinado nivel de productividad en un sistema no es constante y tiende a fluctuar con el tiempo. Dicha fluctuación afecta la composición física, química y la fertilidad de los suelos al igual que la disponibilidad de minerales en los mismos. Esta situación se refleja en forma natural cuando se notan variaciones en la producción de forraje verde, alteraciones de los ciclos normales de crecimiento de los pastos y baja capacidad de los mismos para adaptarse a condiciones medioambientales adversas. La relación suelo-planta-animal es uno de los factores que determina que tanto los pastos como los animales que los aprovechan, contengan en su composición orgánica una concentración determinada de minerales, la que en algunos casos, puede ser deficitaria o excesiva según la cantidad acumulada. En los sistemas de pastoreo, los proveedores naturales de minerales para el ganado son los pastizales y el agua de bebida. Los pastos, a su vez, los obtienen de los compuestos asimilables presentes en el suelo donde crecen, razón por la cual su presencia y disponibilidad resultan críticos en las explotaciones que basan su sistema productivo en el pastoreo. Aparentemente en suelos alcalinos, como los del municipio de Gral. Terán, N.L., México la aplicación de fertili- FACULTAD DE CIENCIAS BIOLÓGICAS, UANL MICROMINERALES EN LOS PASTOS Tabla 7.7. Contenido de Fe (mg kg-1 base seca) en pastos cultivados colectados en diferentes fechas y municipios del noreste de México 3DVWRVLQWURGXFLGRV /XJDU\IHFKDGHFROHFWD (VWDFLRQHV 0HGLDDQXDO ,QYLHUQR 3ULPDYHUD 9HUDQR 2WRxR &HQFKUXVFLOLDULV 7HUiQ1/0p[LFR &HQFKUXVFLOLDULVFRP~Q /LQDUHV1/0p[LFR /LQDUHV1/0p[LFR 'LFKDQWKLXPDQQXODWXP /LQDUHV1/0p[LFR 3DQLFXPFRORUDWXP /LQDUHV1/0p[LFR 5K\QFKHO\WUXPUHSHQV 7HUiQ1/0p[LFR &\QRGRQGDFW\ORQ,, 0DULQ1/0p[LFR &\QRGRQGDFW\ORQ 3URPHGLR Datos tomados de: Ramírez et al. (2002); Ramírez et al. (2003); Ramírez-Lozano (2003); Ramírez et al. (2004); Ramírez et al. (2005). Tabla 7.8. Contenido de Fe (mg kg-1; base seca) del híbrido buffel Nueces y cinco nuevos genotipos de buffel (Cenchrus ciliaris) colectados en diferentes fechas en Terán, N,L., México 3DVWRVLQWURGXFLGRV &HQFKUXVFLOLDULV /XJDU\IHFKDGHFROHFWD (VWDFLRQHV ,QYLHUQR 7HUiQ1/0p[LFR &HQFKUXVFLOLDULVFRP~Q /LQDUHV1/0p[LFR 3ULPDYHUD 0HGLDDQXDO 9HUDQR 2WRxR /LQDUHV1/0p[LFR 'LFKDQWKLXPDQQXODWXP /LQDUHV1/0p[LFR 3DQLFXPFRORUDWXP /LQDUHV1/0p[LFR 5K\QFKHO\WUXPUHSHQV 7HUiQ1/0p[LFR &\QRGRQGDFW\ORQ,, 0DULQ1/0p[LFR &\QRGRQGDFW\ORQ 3URPHGLR Datos tomados de: García-Dessommes et al. (2003ab). LOS PASTOS EN LA NUTRICIÓN DE LOS RUMIANTES zantes nitrogenados en forma de urea tienen efecto en el contenido de Fe en nuevos genotipos del pasto buffel. García-Dessommes et al. (2003b) reportó que al aplicar 120 kg de urea ha-1 al suelo, el contenido de Fe en los pastos se incrementó ligeramente comparado con los no fertilizados (Tabla 7.8.). Aun cuando los 84 nuevos genotipos del pasto Cenchrus ciliaris que aparecen en la Tabla 7.9. contienen distintas concentraciones de Fe, todos tienen cantidades suficientes para cubrir las demandas de bovinos de carne en crecimiento. Además, los animales pastando, reciben cantidades adicionales de Fe al ingerirlo de los pastos contaminados con partículas de suelo que son ricas en Fe. Las concentraciones de Fe en animales y plantas son muy similares, alrededor de 100 a 150 mg kg-1 base seca. Sin embargo, es claro que el requerimiento es mucho mayor para rumiantes en crecimiento que para manteni- 181 CAPÍTULO 7 Tabla 7.9. Contenido de Fe (mg kg-1; base seca) de 84 nuevos genotipos de pasto Cenchrus ciliaris colectados en Terán, N.L., México en noviembre del 2000. *HQRWLSRV 182 )HPJNJ JHQRWLSRV )HPJNJ *HQRWLSRV )HPJNJ *HQRWLSRV )HPJNJ 18(&(6 3URPHGLRGHWRGDVODVOtQHDV Datos tomados de: Morales-Rodríguez et al., 2005b FACULTAD DE CIENCIAS BIOLÓGICAS, UANL MICROMINERALES EN LOS PASTOS miento (Underwood y Suttle, 1999). Aparentemente, el contenido de Fe en las hojas es dos veces mayor que los tallos en los pastos C. ciliaris, C. dactylon, D. annulatum y P. coloratum (Figura 7.2.), con muy poca variación entre pastos y entre estaciones del año. Por tanto, las hojas de los pastos representan una buena fuente de Fe para los rumiantes adultos. Contenido de Fe en pastos nativos Aun cuando el contenido de Fe en los pastos nativos que crecen en Marín, N.L., México (Tabla 7.10.) fue variable entre estaciones y entre pastos, todos tuvieron concentraciones para cubrir las demandas metabólicas de Fe de rumiantes adultos (Tabla 1). Aristida longiseta tuvo el mayor Figura 7.2. Contenido estacional de Fe (mg kg-1 base seca) en las hojas y tallos de cuatro pastos cultivados y cosechados en Linares, N.L., México en 1998 y 1999 Datos tomados de: Ramírez et al. (2003); Ramírez-Lozano (2003); Ramírez et al. (2005a). contenido de Fe, pero Hilaria belangeri fue el más bajo. Durante las estaciones húmedas (primavera y otoño), los pastos resultaron con mayor contenido de Fe. Los pastos nativos que crecen en el municipio de Gral. Terán, N.L., México también tuvieron concentraciones de Fe que variaron entre especies de plantas y entre estaciones del año (Tabla 7.11.). Sin embargo, todos tuvieron, en todas las estaciones, concentraciones de Fe para cubrir las demandas de rumiantes adultos (50 mg kg-1 en la materia seca de la dieta). Bouteloua curtipendula tuvo el menor contenido y Panicum obtusum el mayor. Manganeso Formas químicas del Mn en el suelo y forraje El Mn se presenta de diversas formas en el suelo, el ión manganeso reducido (Mn2+) es la forma en que generalmente se absorbe. El Mn, como el Fe, llega a ser deficiente en suelos oxidados o alcalinos porque se convierte en forma inaprovechable (McBridge, 1994). El Mn se involucra mucho en funciones catalíticas: es el metal activador de algunas enzimas respiratorias de reacciones del metabolismo del nitrógeno y la fotosíntesis; se necesita para el funcionamiento de la nitrato reductasa, por cuya razón las plantas deficientes en Mn requieren NH3. También se necesita para la operación de algunas enzimas en el metabolismo de la hormona ácido indolacético. El papel más importante del Mn en la fotosíntesis reside en la secuencia de reacciones LOS PASTOS EN LA NUTRICIÓN DE LOS RUMIANTES 183 CAPÍTULO 7 Tabla 7.10. Contenido estacional de Fe (mg kg-1 base seca) en pastos nativos colectados en Marín, N.L., México en 1994 3DVWRVQDWLYRV (VWDFLRQHV ,QYLHUQR 3ULPDYHUD 0HGLDDQXDO 9HUDQR 2WRxR $ULVWLGDORQJLVHWD %RXWHORXDJUDFLOLV &HQFKUXVLQFHUWXV +LODULDEHODQJHUL 3DQLFXPKDOOLL 6HWDULDPDFURVWDFK\D 3URPHGLRHVWDFLRQDO Datos tomados de: Ramírez et al. (2004) 184 Tabla 7.11. Contenido estacional de Fe (mg kg-1 base seca) en pastos nativos colectados en Terán, N.L., México en 2001 y 2002 3DVWRVQDWLYRV (VWDFLRQHV ,QYLHUQR 3ULPDYHUD 9HUDQR 2WRxR 0HGLDDQXDO %RXWHORXDFXUWLSHQGXOD %RXWHORXDWULILGD %UDFKLDULDIDVFLFXODWD 'LJLWDULDLQVXODUHV &KORULVFLOLDWD /HSWRFKORDILOLIRUPLV 3DQLFXPKDOOLL 3DQLFXPREWXVXP 3DQLFXPXQLVSLFDWXP 6HWDULDJULVHEDFKLL 6HWDULDPDFURVWDFK\D 7ULGHQVHUDJURVWRLGHV 7ULGHQVPXWLFXV 3URPHGLRHVWDFLRQDO FACULTAD DE CIENCIAS BIOLÓGICAS, UANL mediante las cuales se derivan electrones del agua y se libera oxígeno. El Mn también puede tener un papel estructural en los cloroplastos, los que se tornan susceptibles a la luz en su ausencia y finalmente pierden su estructura y se desintegran bajo condiciones de disminución extrema de Mn. La estructura de mitocondrias y núcleos no parecen afectarse del mismo modo, lo que indica que el papel del Mn en los cloroplastos, a diferencia del Fe, tal vez sea bastante específico. Los síntomas de deficiencia de Mn consisten en la formación de manchas necróticas sobre las hojas y necrosis e cotiledones de plántulas de leguminosas. La movilidad del Mn es compleja y depende de las especies y de la edad de la planta, así que los síntomas pueden aparecer primero en hojas jóvenes o maduras. Las enfermedades deficitarias típicas son la “mancha gris” de la avena, los “amarillamientos moteados” de la remolacha azucarera y la “mancha fangosa” de los guisantes (Romheld y Marschner, 1991). Funciones del Mn en el rumiante El Mn es difícilmente absorbido por las MICROMINERALES EN LOS PASTOS plantas y animales. Como componente de diversas enzimas, el Mn realiza funciones bioquímicas especificas en el organismo por ejemplo, interviene en el metabolismo de los carbohidratos y grasas. Es necesario como cofactor de la enzima que cataliza la conversión del ácido mevalónico en escualeno y es necesario para la síntesis del colesterol; protege la integridad de la membrana celular (Underwood y Suttle, 1999). Las consecuencias de la deficiencia son malformaciones del esqueleto, retraso del crecimiento, trastornos de la reproducción y anormalidades en los recién nacidos. La suplementación de Fe y Mn es menos importante en regiones tropicales donde la mayoría de los suelos son ácidos (McDowell, 2003). Contenido de Mn en pastos cultivados Todos los pastos cultivados cosechados en Gral. Terán, N.L., México contienen suficiente Mn, en todas las estaciones del año, para las necesidades metabólicas de bovinos de carne en crecimiento (20 mg kg-1 en la materia seca de su dieta); aunque C. ciliaris y R. repens (Tabla 7.12.) fueron marginalmente suficientes. En verano cuando las precipitaciones en la región fueron más abundantes, los pastos tuvieron mayor contenido de Mn. Durante las otras estaciones el Mn fue similar entre ellas. Aparentemente el contenido de Mn en los pastos, que crecen en suelos ácidos no es afectado con la fertilización con N en forma de urea (Whitehead, 2000). Sin embargo, los seis genotipos evaluados por García-Dessommes et al. (2003b) si respondieron con la fertilización con urea debido a que se incrementó su contenido de Mn comparado con los no fertilizados (Tabla 7.13.). Lo anterior pudo haberse debido a que los suelos de Gral. Terán, N.L., México son ligeramente alcalinos. Además, todos los genotipos en todos los cortes tuvieron suficiente Mn para las necesidades de rumiantes en crecimiento. e ha reportado que las concentraciones de Mn en los forrajes de todo el mundo varían de 1.0 a 2670 mg kg-1, con una media de 86 mg kg-1 (MacPherson, 2000). Los 84 genotipos de la Tabla 14 que fueron sembrados bajo condiciones de temporal sin fertilización, resultaron con Mn en cantidades menores a la media mundial, pero fueron suficientes para las necesidades metabólicas de los rumiantes, aun cuando unos pocos resultaron solo marginalmente suficientes. Se ha reportado que no existe un patrón consistente en el contenido de Mn entre hojas y tallos de los forrajes. Asimismo, se menciona que la variabilidad entre partes de las planta puede ser atribuible a la disponibilidad de Mn en los suelos (MacPherson, 2000). Sin embargo, los pastos C. ciliaris, C. dactylon, D. annulatum y P. coloratum (Figura 7.3.) el Mn fue más elevado en las hojas que en los tallos. Contenido de Mn en pastos nativos Aun cuando, el contenido de Mn es variable entre especies de pastos nativos que crecen en el noreste de México, no hay una clara tendencia en la concentración estacional de LOS PASTOS EN LA NUTRICIÓN DE LOS RUMIANTES 185 CAPÍTULO 7 Tabla 7.12. Contenido de Mn (mg kg-1 base seca) en pastos cultivados colectados en diferentes fechas y municipios del noreste de México 3DVWRVLQWURGXFLGRV /XJDU\IHFKDGHFROHFWD (VWDFLRQHV 0HGLDDQXDO ,QYLHUQR 3ULPDYHUD 9HUDQR 2WRxR &HQFKUXVFLOLDULVFRP~Q /LQDUHV1/0p[LFR &\QRGRQGDFW\ORQ,, 0DULQ1/0p[LFR &\QRGRQGDFW\ORQ /LQDUHV1/0p[LFR 'LFKDQWKLXPDQQXODWXP /LQDUHV1/0p[LFR 3DQLFXPFRORUDWXP /LQDUHV1/0p[LFR 5K\QFKHO\WUXPUHSHQV 7HUiQ1/0p[LFR &HQFKUXVFLOLDULV 7HUiQ1/0p[LFR 3URPHGLR Datos tomados de: Ramírez et al. (2002); Ramírez et al. (2003); Ramírez-Lozano (2003); Ramírez et al. (2004); Ramírez et al. (2005). 186 Tabla 7.13. Contenido de Mn (mg kg-1; base seca) del híbrido buffel Nueces y cinco nuevos genotipos de buffel (Cenchrus ciliaris) colectados en diferentes fechas en Terán, N,L., México *HQRWLSRV )HFKDVGHFROHFWD $JRVWR 1RYLHPEUH 1RYLHPEUH -XQLR )HUWLOL]DGRV &HQFKUXVFLOLDULV1XHFHV &HQFKUXVFLOLDULV &HQFKUXVFLOLDULV &HQFKUXVFLOLDULV &HQFKUXVFLOLDULV &HQFKUXVFLOLDULV 3URPHGLR Datos tomados de: García-Dessommes et al. (2003ab). FACULTAD DE CIENCIAS BIOLÓGICAS, UANL Mn (Tablas 7.15. y 7.16.). Lo anterior también fue reportado por Minson (1990). Asimismo, todos los pastos nativos, en todas las estaciones, tuvieron suficiente Mn para cubrir las necesidades de rumiantes en crecimiento. Formas químicas del Zn en el suelo y forraje El Zn está ampliamente distribuido en los suelos, pero como muchos otros metales llegan a ser menos aprovechable conforme aumenta el pH. El resultado es un cierto grado de deficiencia, muy generalizado, particularmente en suelos neutros o alcalinos. El Zn tiene relación directa con la síntesis del ácido indolacético y como tal su deficiencia puede causar cambios sustanciales en la forma y hábito de crecimiento de ciertas especies, produciendo plantas atrofiadas y de baja altura, con pobre desarrollo de la dominancia apical. Además, es un activador obligado de numerosas e importantes enzimas en las que incluyen las deshidrogenasas del ácido láctico, ácido glutámico, alcohol y pirimidín nucleótido. El Zn parece estar implicado MICROMINERALES EN LOS PASTOS Tabla 7.14. Contenido de Mn (g kg-1; base seca) de 84 nuevas líneas de pasto Cenchrus ciliaris colectadas en Terán, N.L., México en noviembre del 2000. /tQHDV 0QJNJ /tQHDV 0QJNJ /tQHDV 0QJNJ /tQHDV 0QJNJ 18(&(6 3URPHGLRGHWRGDVODVOtQHDV Datos tomados de: Morales-Rodríguez et al., 2005b LOS PASTOS EN LA NUTRICIÓN DE LOS RUMIANTES 187 CAPÍTULO 7 Figura 7.3. Contenido estacional de Mn (mg kg-1 base seca) en las hojas y tallos de cuatro pastos cultivados y cosechados en Linares, N.L., México en 1998 y 1999 miento y crecimiento radical pobremente diferenciado (Marschner, 1995). Funciones de Zn en el rumiante Datos tomados de: Ramírez et al. (2003); Ramírez-Lozano (2003); Ramírez et al. (2005a). 188 en la síntesis de proteínas, puesto que su deficiencia puede traducirse en un sustancial incremento de compuestos nitrogenados solubles (Romheld y Marschner, 1991). Los síntomas de deficiencia de Zn incluyen atrofiamiento y reducción notable del tamaño de la hoja, que conduce a al “hoja pequeña”. Una carencia de zinc produce la enfermedad “yema blanca” del maíz y puede conducir a una considerable reducción de la floración y la fructificación así como empequeñeci- Es el componente integral de las varias enzimas como las lactato, malato y glutamato deshidrogenasas, fosfatasa alcalina, carboxipeptidasas A y B y la carbónico anhidrasa. Como componente de las RNA y DNA polimerasas interviene en las síntesis de proteína (McDonald et al., 1995). Las enzimas que contienen Zn participan en procesos primarios del metabolismo proteico y división celular, habiéndose observado las siguientes manifestaciones de la deficiencia de Zn en los animales: retraso del crecimiento, menor consumo de alimentos, mala transformación del fo- Tabla 7.15. Contenido estacional de Mn (mg kg-1 base seca) en pastos nativos colectados en Marín, N.L., México en 1994 3DVWRVQDWLYRV (VWDFLRQHV ,QYLHUQR 3ULPDYHUD 0HGLDDQXDO 9HUDQR 2WRxR $ULVWLGDORQJLVHWD %RXWHORXDJUDFLOLV &HQFKUXVLQFHUWXV +LODULDEHODQJHUL 3DQLFXPKDOOLL 6HWDULDPDFURVWDFK\D 3URPHGLRHVWDFLRQDO Datos tomados de: Ramírez et al. (2004) FACULTAD DE CIENCIAS BIOLÓGICAS, UANL MICROMINERALES EN LOS PASTOS Tabla 7.16. Contenido estacional de Mn (mg kg-1 base seca) en pastos nativos colectados en Terán, N.L., México en 2001 y 2002 3DVWRVQDWLYRV (VWDFLRQHV ,QYLHUQR 3ULPDYHUD 9HUDQR 2WRxR 0HGLDDQXDO %RXWHORXDFXUWLSHQGXOD %RXWHORXDWULILGD %UDFKLDULDIDVFLFXODWD 'LJLWDULDLQVXODUHV &KORULVFLOLDWD /HSWRFKORDILOLIRUPLV 3DQLFXPKDOOLL 3DQLFXPREWXVXP 3DQLFXPXQLVSLFDWXP 6HWDULDJULVHEDFKLL 6HWDULDPDFURVWDFK\D 7ULGHQVHUDJURVWRLGHV 7ULGHQVPXWLFXV 3URPHGLRHVWDFLRQDO Datos tomados de: Ramírez et al. (2004) rraje, menor rendimiento en la reproducción y anomalías en la piel y pelo. La cicatrización de las heridas se retrasa en los animales deficientes de Zn. Deficiencias de Zn (bajos niveles en suelo, plantas y animales) han sido reportadas en la mayoría de los países latinoamericanos (McDowell, 2003). Los efectos tempranos de una deficiencia de Zn incluyen una reducción en el consumo de alimento, la tasa de crecimiento y la conversión alimenticia. Signos visuales de una deficiencia severa incluyen, piel seca, escamosa y partida. En los casos de una deficiencia marginal de Zn la función reproductiva de animales machos y hembras se ve afectada. Contenido de Zn en pastos cultivados La concentración de Zn en 119 muestras de pastos tropica- les cultivados en diferentes partes del mundo varió de 15 a 120 mg kg-1, con una media de 36 mg kg-1. Las diferencias entre especies de pastos pudieran deberse a diferencias en el contenido de Zn en los suelos, diferencias entre especies y estado de madurez. Sin embargo, en general los pastos de clima cálido tienden a tener menos Zn que los de clima templado y, los pastos en general, son inferiores que las leguminosas (Minson, 1992). El nivel de Zn en la dieta de bovinos de carne en crecimiento es de 30 mg kg-1 (McDonald, 2003) para que no padezcan síntomas de deficiencia. Todos los pastos cultivados que aparecen en la Tabla 7.17. tuvieron suficiente Zn, en todas las estaciones, para las necesidades metabólicas de bovinos de carne en crecimiento. Aun cuando hubo diferencias entre especies de pastos, no hay una clara diferencia entre estaciones en la concentración de Zn. Lo anterior también ha sido reportado por MacPherson (2000). La influencia de la fertilización con N sobre la concentración de Zn en los forrajes depende principalmente si el fertilizante cambia el pH del suelo. Aparentemente, la fertilización con N en forma de urea no tuvo influencia sobre el pH de los suelos de Gral. Terán, N.L., México debido a que la concentración de Zn fue similar en los genotipos fertilizados (120 kg urea ha-1) que los no fertilizados (Tabla 7.18.). Además, fueron insuficientes para las necesidades de Zn de los bovinos de carne en crecimiento (30 mg kg-1 en la materia seca de la dieta). El 20 % de los 84 nuevos genotipos que aparecen en Tabla 7.19. no tienen suficiente en Zn para satisfacer las LOS PASTOS EN LA NUTRICIÓN DE LOS RUMIANTES 189 CAPÍTULO 7 Tabla 7.17. Contenido de Zn (mg kg base seca) en pastos cultivados colectados en diferentes fechas y municipios del noreste de México -1 3DVWRVLQWURGXFLGRV /XJDU\IHFKDGHFROHFWD (VWDFLRQHV 0HGLDDQXDO ,QYLHUQR 3ULPDYHUD 9HUDQR 2WRxR &HQFKUXVFLOLDULVFRP~Q /LQDUHV1/0p[LFR &\QRGRQGDFW\ORQ,, 0DULQ1/0p[LFR &\QRGRQGDFW\ORQ /LQDUHV1/0p[LFR 'LFKDQWKLXPDQQXODWXP /LQDUHV1/0p[LFR 3DQLFXPFRORUDWXP /LQDUHV1/0p[LFR 5K\QFKHO\WUXPUHSHQV 7HUiQ1/0p[LFR &HQFKUXVFLOLDULV 7HUiQ1/0p[LFR 3URPHGLR Datos tomados de: Ramírez et al. (2002); Ramírez et al. (2003); Ramírez-Lozano (2003); Ramírez et al. (2004); Ramírez et al. (2005). 190 Tabla 7.18. Contenido de Zn (mg kg-1; base seca) del híbrido buffel Nueces y cinco nuevos genotipos de buffel (Cenchrus ciliaris) colectados en diferentes fechas en Terán, N,L., México *HQRWLSRV )HFKDVGHFROHFWD $JRVWR 1RYLHPEUH 1RYLHPEUH -XQLR )HUWLOL]DGRV &HQFKUXVFLOLDULV1XHFHV &HQFKUXVFLOLDULV &HQFKUXVFLOLDULV &HQFKUXVFLOLDULV &HQFKUXVFLOLDULV &HQFKUXVFLOLDULV 3URPHGLR necesidades de rumiantes adultos. Además, 23 % son marginalmente suficientes. Por tanto, el Zn puede ser limitante para los rumiantes que consuman los nuevos genotipos del pasto C. ciliaris sembrados, bajo condiciones de temporal, en el municipio de Gral. Terán, N.L., México. MacPherson (2000) reporta que las hojas de los pastos contienen más Zn que los tallos. Por el contrario, pastos cultivados como C. ciliaris, C. dactylon, D. annulatum y P. coloratum, sembrados en el municipio de Linares, N.L., México bajo condiciones de temporal contienen más Zn en los tallos que en las hojas (Figura 7.4.). Además, no hay una clara diferencia entre estaciones del año. Datos tomados de: García-Dessommes et al. (2003ab). FACULTAD DE CIENCIAS BIOLÓGICAS, UANL Contenido de Zn en pastos nativos Aparentemente los pastos nativos de la flora del noreste de México contienen más Zn (Tablas 7.20. y 7.21.) que los pastos cultivados de la misma región (Tablas 7.17., 7.18. y 7.19.). Además, hay una clara diferencia entre estaciones en el contenido Zn. En general, los pastos tuvieron más Zn en las estaciones húme- MICROMINERALES EN LOS PASTOS Tabla 7.19. Contenido de Zn (mg kg-1; base seca) de 84 nuevos genotipos de pasto Cenchrus ciliaris colectados en Terán, N.L., México en noviembre del 2000. *HQRWLSRV =QPJNJ *HQRWLSRV =QPJNJ *HQRWLSRV =QPJNJ *HQRWLSRV =QPJNJ 18(&(6 3URPHGLRGHWRGDVODVOtQHDV Datos tomados de: Morales-Rodríguez et al., 2005b LOS PASTOS EN LA NUTRICIÓN DE LOS RUMIANTES 191 CAPÍTULO 7 das (verano y otoño) que en las secas (invierno y primavera). Asimismo, Todos los pastos y en todas las estaciones contienen suficiente Zn para satisfacer las necesidades de bovinos de carne en crecimiento (30 mg kg-1 en la materia seca de la dieta). En particular Setaria grisebachii (Figura 7.1.), Setaria macrostachya (Figura 7.2.) y Tridens eragrostoides (Figura 7.3.) resultaron con cantidadces adecuadas de Zn para las necesidades de rumiantes en crecimiento. Cobalto diversos compuestos afines que actúan en el metabolismo de compuestos de un carbono (grupos metilo, formilo, formaldehído y carboxilo). Esta imprescindible necesidad de Co, sin embargo, es tan baja que no puede demostrarse con facilidad. Probablemente 1 parte en 1012 sea suficiente, lo que está más allá de los límites de purificación o cuantificación. El Co parece ser necesario para las bacterias implicadas en la fijación simbiótica del nitrógeno y muchos sistemas simbióticos fijadores del nitrógeno son incapaces de sobrevivir sin una suplementación de cobalto o de nitrógeno (Marschner, 1995). Formas químicas del K en el suelo y forraje Funciones del Co en el rumiante 192 Es necesario para algunos organismos, particularmente algas y otros microorganismos. Es un componente de la B12 y Figura 4. Contenido estacional de Zn (mg kg-1 base seca) en las hojas y tallos de cuatro pastos cultivados y cosechados en Linares, N.L., México en 1998 y 1999 Datos tomados de: Ramírez et al. (2003); Ramírez-Lozano (2003); Ramírez et al. (2005a). La única función fisiológica comprobada de Co es su papel como parte integrante de la molécula de la vitamina B12. Es necesario para los microorganismos del rumen para la síntesis de esta vitamina, que a su vez es necesaria para los tejidos del animal hospedador. Por lo que el requerimiento de Co por el rumiante es único entre especies animales debido a que este elemento es usado y requerido por los microbios del rumen que lo convierten en vitamina B 12 (cianocobalamina) y sus análogos. Sin embargo, el requerimiento del animal huésped es específicamente para vitamina B12 (NRC, 2000). Una deficiencia de Co en rumiantes en condiciones de pastoreo, depende geográficamente y geológicamente y se manifiesta por la apatía, indiferencia y emaciación del ganado en pastoreo. La falta de apetito es, en parte, responsable de una deficiencia de Co. FACULTAD DE CIENCIAS BIOLÓGICAS, UANL MICROMINERALES EN LOS PASTOS Tabla 7.20. Contenido estacional de Zn (g kg-1 base seca) en pastos nativos colectados en Marín, N.L., México en 1994 3DVWRVQDWLYRV (VWDFLRQHV ,QYLHUQR 3ULPDYHUD 0HGLDDQXDO 9HUDQR 2WRxR $ULVWLGDORQJLVHWD %RXWHORXDJUDFLOLV &HQFKUXVLQFHUWXV +LODULDEHODQJHUL 3DQLFXPKDOOLL 6HWDULDPDFURVWDFK\D 3URPHGLRHVWDFLRQDO Datos tomados de: Ramírez et al. (2004) Tabla 7.21. Contenido estacional de Zn (mg kg-1 base seca) en pastos nativos colectados en Terán, N.L., México en 2001 y 2002 La deficiencia en Co se presenta en los rumiantes en pastoreo con diferentes grados de intensidad, y se caracteriza por trastornos no específicos como reducción en la ingestión de alimentos, perdida de peso, retraso del crecimiento, consunción de los músculos del esqueleto, emaciación, degeneración grasa del hígado, etc. Las manifestaciones clínicas de la deficiencia en Co son semejantes a las de la mal nutrición y no son lo suficientemente especificas como para permitir hacer el diagnostico. La suplementación de sales mineralizadas es la mejor manera de proveer este elemento (McDowell, 2003). Selenio Formas químicas del Se en el suelo y forraje 3DVWRVQDWLYRV (VWDFLRQHV ,QYLHUQR 3ULPDYHUD 9HUDQR 2WRxR 0HGLDDQXDO %RXWHORXDFXUWLSHQGXOD %RXWHORXDWULILGD %UDFKLDULDIDVFLFXODWD 'LJLWDULDLQVXODUHV &KORULVFLOLDWD /HSWRFKORDILOLIRUPLV 3DQLFXPKDOOLL 3DQLFXPREWXVXP 3DQLFXPXQLVSLFDWXP 6HWDULDJULVHEDFKLL 6HWDULDPDFURVWDFK\D 7ULGHQVHUDJURVWRLGHV 7ULGHQVPXWLFXV 3URPHGLRHVWDFLRQDO Datos tomados de: Ramírez et al. (2004) Ha suscitado mucho interés porque se comporta en algunas plantas como sucedáneo del azufre. Se forman aminoácidos que lo contienen, en forma parecida a al cisteina (seleniocisteina) y la metionina (seleniometionina), que inhiben la síntesis o las propiedades catalíticas de las proteínas. Por otra parte, ciertas plantas del género Astragalus (una leguminosa) acumulan grandes cantidades de este elemento y parecen tener un metabolismo de selenio bien desarro- LOS PASTOS EN LA NUTRICIÓN DE LOS RUMIANTES 193 CAPÍTULO 7 194 Figura 7.1. Setaria grisebachii (Fourn.). Nombre común: tempranero anual. Anual; hasta 1 m de alto, usualmente mucho más corta; tallos delgados, ramificándose en la base, lidos o escaberulosos bajo los nudos y la panícula; nudos cubiertos con pelos cortos aplicados; vainas más largas que los entrenudos, escabrosas y escasamente hispidulosas arriba, glabras abajo, márgenes ciliados, cuello híspido; lígula corta, densamente ciliada; láminas planas, lanceoladas, estrechándose hacia abajo, acuminadas hacia arriba, la mayoría de 12 cm de largo por 1 cm de ancho, escabrosas e hispidulosas sobre ambas superficies. Panícula delgada, 3-18 cm de largo, cilíndrica, interrumpida, ocasionalmente lobulada, frecuentemente púrpura, el eje escabrosopubescente, con la excepción de su parte inferior, llevando pelos muy blancos de menos de 1mm de largo; espiguillas casi sésiles, agrupaas a lo largo del eje principal o nacidas sobre pedicelos cortos a lo largo de ramas ascendentes de tanto como 2.5 cm de largo; setas solitarias bajo cada espiguilla, flexuosas, escabrosas antrorsamente, el eje angulado, a menudo flojamente torcido, de 5-15 mm de largo; espiguillas ovadas, agudas, 1.5-2.2 mm de largo; primera gluma 1/3 del largo de la espiguilla, ancha encerrando la espiguilla en la base, 3-nervada, segunda gluma muy obtusa, entera, casi igualando la lema fértil, 5-nervada; lema estériligualando a la fértil, ligeramente surcada, 5-nervada, encerrando una pálea hialina de cerca de 1/3 de su propia longitud; lema fértil cerca de 2mm de largo, muy finamente rugosa transversalmente. Nativa; maleza en jardines, céspedes y cultivos; prefiere la sombra de arbustos y árboles, presente en muchos Matorrales, Pastizales y Bosques del Estado. Valor forrajero pobre (Ackerman-Beetle y Johnson-Gordon, 1991). FACULTAD DE CIENCIAS BIOLÓGICAS, UANL MICROMINERALES EN LOS PASTOS 195 Figura 7.2. Setaria macrostachya (H.B.K.). Nombre común: tempranero de llanuras. Perenne; 60-120 cm de alto; tallos robustos, erectos o geniculados, comprimidos, raramente ramificados arriba, escabrosos bajo la panícula y nudos; vainas comprimidas, aquilladas, glabras, en el cuello glabrado; lígula densamente ciliada, 2-4 mm de largo, láminas mayormente planas, 15-20 cm de largo por 7-15 mm de ancho, fuertemente escabrosas arriba, escaberulosas abajo, generalmente con unos pocos pelos blancos en la garganta. Panícula densamente floreada, 10-39 cm de largo por 1-2 cm de diámetro, estrictamente cilíndrica, de un grueso casi uniforme desde la base hasta el ápice, ocasionalmente interrumpida o lobulada abajo, el eje angulado, escabroso, escasamente villota y puberulenta, pelos tanto como 3 mm de largo, ramas cortas; setas usualmente solitarias bajo de casa espiguilla, 10-20 mm de largo, suaves, antrorsamente escabrosas; espiguillas 2-2.3 mm de largo, ovadas, gibosas; primera gluma cerca de 1/3-1/2 del largo de la espiguilla (3) 5-7 nervada, segunda gluma 2/3-3/4 del largo de la espiguilla, 5-7 nervada; lema estéril 5-nervada, tan larga como la fuertemente arrugada lema fértil; pálea estéril tan larga como la ovada y convexa pálea fértil. Nativa; por lo general creciendo en la sombra, muy apetecido por el ganado. Valor forrajero excelente (Ackerman-Beetle y Johnson-Gordon, 1991). LOS PASTOS EN LA NUTRICIÓN DE LOS RUMIANTES CAPÍTULO 7 196 Figura 7.3. Tridens eragrostoides (Vasey & Scribn.) Nash. Nombre común: zacates tridens. Perenne; densamente amacollada; tallos delgados, rígidamente erectos, por lo general de 50-100 cm de alto, nudos glabros o escasamente barbados con pelos largos y suaves; vainas glabras, escabrosas o escasamente pilosas; lígula una membrana delgada y glabra; láminas alargadas, generalmente de 1.5-5 mm de ancho, escabrosas y ocasionalmente escasamente pilosas, angostándose lo mismo en la base y en el ápice, con una punta larga y delgada. Panícula abierta, generalmente de 10-30 cm de largo, ramas inferiores habitualmente laxas y colgantes, desnudas de espiguillas en la base, típicamente 6-12 cm de largo, ramificadas o permaneciendo simples; espiguillas de 37 mm de largo, 5-12 flosculadas, habitualmente en pedicelos de 2.5 mm o más de largo; glumas y lemas delgadas, a menudo coloreadas de morado, glumas glabras, agudas o acuminadas, 1 nervadas, segunda gluma de 2-3 mm de largo, primera gluma ligeramente más corta; lemas a menudo puberulentas en las nervaduras a muy puberulentas sobre la parte media; ápice de la lema redondeado o en muesca, nervadura media excurrente como un mucrón, nervaduras laterales raramente alcanzando los márgenes y diminutamente mucronadas; lema inferior de la espiguilla de 2-2.3 mm de largo, aquellas de arriba más cortas suscesivamente; páleas más cortas que las lemas, no agrandadas a convexas en la base, glabras o escabrosas en las nervaduras; cariópsis de 1-1.3 mm de largo. Nativa; no muy común, presente al norte del Estado. Valor forrajero regular (Ackerman-Beetle y Johnson-Gordon, 1991). FACULTAD DE CIENCIAS BIOLÓGICAS, UANL MICROMINERALES EN LOS PASTOS llado, no el todo semejante al del azufre. Ciertas plantas tienen una tolerancia considerable, o incluso una necesidad de selenio, y su presencia indica un alto nivel de este elemento en el suelo. Se ha propuesto que el efecto benéfico del selenio para ciertas plantas se debe, en realidad, a la anulación (mediante el selenio) de la toxicidad del fósforo a la cual estas plantas son susceptibles (Gissel-Nielsen et al., 1984). Se disponible en los suelos de origen calcáreo o alcalinos. Existen varios grados de toxicidad. La toxicidad crónica se caracteriza por los siguientes signos generales: perdida de apetito, adelgazamiento, torpeza, pelo áspero, pérdida de pelo de la cola, crecimiento alargado de las pezuñas y muerte eventual. En los casos de toxicidad aguda, los animales sufren de ceguera, dolor abdominal, salivación y algo de parálisis (McDowell, 2003; NRC, 2000). Funciones del Se en el rumiante Yodo (I) Como elemento esencial guarda relación funcional con la vitamina E, ya que ambos participan en la defensa de la célula contra los daños oxidativos debido a los metabolitos reactivos de los lípidos. Forma parte de la enzima de la sangre glutatión peroxidasa, y es necesario para la integridad y el funcionamiento normal del páncreas (McDonald et al., 1995). Los signos de una deficiencia de Se en rumiantes incluyen una reducción en el crecimiento y distrofia muscular de origen nutricional, conocida también como enfermedad del músculo blanco en corderos y becerros, y un bajo desempeño reproductivo en animales adultos. La suplementación de cantidades adecuadas de selenio también reduce la incidencia de retenciones placentarias (McDowell, 2003; NRC, 2000). Sin embargo, excesos de Se en los forrajes e intoxicaciones del ganado en algunas regiones de México y Estados Unidos se relacionan con cantidades excesivas de El I es un componente esencial de las hormonas tiroideas, tiroxina (T4) y triiodotironina (T3). Hay ciertas sustancias que pueden aumentar los requerimientos de I; éstas incluyen los tiocianatos derivados del trébol blanco y glucosinatos de las crucíferas como nabos y mostacillas, los subproductos de la soja y la semilla de algodón. Pero estos efectos pueden revertirse fácilmente con el agregado de I a las sales minerales (McDonald et al., 1995). Los bovinos son bastante resistentes a esta deficiencia. El signo cardinal de la carencia de I es el bocio, y la manifestación clínica más importante es la muerte de los recién nacidos, en algunos de los cuales de comprueba alopecia y aumento visible y palpable de la glándula tiroides. Si durante los primeros días se ayuda a mamar a estos animales, suelen recuperarse (McDowell, 2003). El tratamiento debe emprenderse con el mayor cuidado, ya que la administración de dosis excesivas puede ejercer efectos tóxicos. El ingreso recomendado en bóvidos es de LOS PASTOS EN LA NUTRICIÓN DE LOS RUMIANTES 197 CAPÍTULO 7 0.8 1 mg kg-1 MS para vacas preñadas y en período de lactancia, y de 0.1 a 0.3 mg kg-1 MS para vacas no gestantes y terneros (Underwood y Suttle, 1999). Referencias 198 Ackerman-Beetle, A. y Johnson-Gordon, D. 1991. Gramíneas de Sonora. SAGRH COTECOCA. Gobierno del Edo de Sonora, Hermosillo, Son. Bowen, E. J. 1981. Hierro: elemento vital para las plantas y animales. Agricultura de las Américas 30 :36-41. Bowen, E. J. y B.A; Krtky. 1983. Microelementos: Causas de deficiencia y toxicidad. Agricultura de las Américas. 36: 8-11. Foth, Dh.H. 1985. Fundamentos de la ciencia del suelo. 3ª. Ed. Compañía Editorial Continental. México. Pp. 313-314. García-Dessommes, G.J., Ramírez-Lozano, R.G., Foroughbakhch, R., Morales Rodríguez, R. y García-Díaz, G. 2003. Ruminal digestion and chemical composition of new genotypes of buffelgrass (Cenchrus ciliaris L.). Interciencia, 28: 220-224. García-Dessommes, G.J., Ramírez-Lozano R.G., Foroughbakhch, R., Morales-Rodríguez, R. y García-Díaz G. 2003. Valor nutricional y digestión ruminal de cinco líneas apomíticas del pasto buffel (Cenchrus ciliaris L.). Técnica Pecuaria en México, 41: 209-218. Gissel-Nielsen, G., Grupa, U.C., Lamand, M. y Westermarck, T. 1984. Selenium in soils and plants and its importante in livestock and human nutrition, Advances in Agronomy. 37: 397-460. MacPherson, A. 2000. Trace-mineral status of forages, En: Forage Evaluation in Ruminant Nutrition. D.I. Givens, E. Owen, R.F.E. Axford y H.M. Omed (editores). CAB International. Wallinford, Reino Unido. pp. 345-372. Marschner, H. 1995. Mineral Nutrition of Higher Plants, 2a edición, Academic Press, Londres R.U. p. 889. McBride, M.B. 1994. Environmental Chemistry of Soils. Oxford University Press, N.Y. p. 406. McDowell, L.R. 2003. Minerals in Animal and Human Nutrition, 2a edición. Elsevier Science, Amsterdam, Holanda. pp. 35-37. McDonald, P., Edwards, R.A., Greenhalgh J.F.D., Morgan, C.A., 1995. Animal Nutrition. 5a edición. Longman Scientific and Technical, p. 607. Minson, D.J. 1990. Forage in Ruminant Nutrition. Academic Press, San Diego, California, EUA. Minson, D.J, 1992, Composición química y valor nutritivo de gramíneas tropicales. En: Gramíneas Tropicales. P.J. Skerman y F. Riveros (editores). Colección FAO: Producción y Protección Vegetal. Morales-Rodríguez, R. 2003. Producción de materia seca y digestibilidad in situ del forraje de 84 genotipos del pasto buffel (Cenchrus ciliaris). Tesis de maestría. Facultad de Ciencias Biológicas, Universidad Autónoma de Nuevo León. NRC, 2000. National Research Council. Nutrient Requirements of Beef Cattle, 7a edition. National Academic Press, Washington, DC. p. 175. Ramírez R.G., González-Rodríguez, H. y García-Dessommes, G. 2002. Chemical composition and rumen digestion of forage from kleingrass (Panicum coloratum). Interciencia, 27:705-709. Ramírez, R.G., González-Rodríguez, H. y García-Dessommes, G.J. 2003. Nutrient digestion of common bermudagrass (Cynodon dactylon L.) Pers. growing in northeastern Mexico, J. Appl. Anim. Res. 23: 93-102. Ramírez-Lozano, R.G. 2003. Nutrición de Rumiantes: Sistemas Extensivos. Trillas, México, D.F. p. 212. Ramírez R.G., Haenlein, G.F.W., García-Castillo, C.G. y Núñez-González M.A. 2004. Protein, lignin and mineral contents and in situ dry matter digestibility of native Mexican grasses consumed by range goats. Small Rumin. Res. 52: 261-269. Ramírez, R.G. y González-Rodríguez, H. García-Dessommes, G. and Morales-Rodríguez, R. 2005. Seasonal Trends in the Chemical Composition and Digestion of Dichanthium annulatum (Forssk.) Stapf. J. Appl. Anim. Res. (En prensa). Romheld, V. y Marschner, H. 1991. Functions of micronutrients in plants. In: Mortvendt, J.J. (editor) Micronutrients in Agriculture, 2a edición. Soil Science Society of America, Madison, pp. 297-328. Tisdale, S.L. y W.L; Nelson. 1982. Fertilidad de los suelos y fertilizantes. 1ª edición. Unión Tipografía Hispanoamericana. México. pp. 101-107. Underwood, E.J. y Suttle, N.F., 1999. The Mineral Nutrition of Livestock, 3a edición. CAB International, Wallingford, p. 600. Whitehead, D.C. 2000. Nutrient Elements in Grasslands. Soil-Plant-Animal relationships. CABI Publishing, Wallingford, Reino Unido. p. 135. FACULTAD DE CIENCIAS BIOLÓGICAS, UANL Capítulo 8 Consumo de pastos Introducción Siendo el consumo un componente vital en la producción, se han escrito muchos trabajos sobre las variables que lo afectan entre los que se destacan los factores propios del animal (estado fisiológico, potencial productivo), factores del alimento, pastos (calidad, cantidad, especie) y factores ambientales. El conocimiento de estos elementos ayuda a comprender mejor la interacción entre la planta, el animal y medio ambiente. El consumo de alimento es uno de los mecanismos homeostáticos mejor regulados del organismo animal (Robbins, 2001). La regulación del consumo ocurre a diferentes niveles. Por ejemplo, el animal debe balancear la adquisición de nutrientes para cubrir las demandas metabólicas diarias y estacionales regulando la incidencia y el consumo entre comidas. Tal sistema debe monitorear varias condiciones ambientales (fotoperíodo y disponibilidad de alimento, llenado ruminal y absorción de nutrientes, grasa corporal y la energía corporal y necesidades de nutrientes). Estos mecanismos de monitoreo y control deben incorporarse jerárquicamente que permitan el mantenimiento del balance energético en los diferentes ambientes nutricionales (Leiboitz y Standley, 1986). Bases del control del consumo Generalmente, los animales consumen alimentos para proveer a sus propios tejidos de nutrientes que son requeridos para los procesos de mantenimiento corporal, crecimiento (deposición de grasa en animales adultos), producción de leche y trabajo. Sin embargo, debido a la variedad de ingredientes que componen una dieta y que son consumidos por el animal, no es probable que la composición de nutrientes proporcionados pudieran exactamente reunir la proporción de nutrientes requeridos por el animal. Por tanto, proveer el requerimiento exacto de un nutriente puede dar como resul- LOS PASTOS EN LA NUTRICIÓN DE LOS RUMIANTES 199 CAPÍTULO 8 200 tado la deficiencia o exceso de otro. El animal para de comer debido a limitaciones físicas o metabólicas, de esta manera el animal tiene que decidir hasta que punto las desventajas o las deficiencias o excesos de ciertos nutrientes pesan más que las ventajas de tratar de satisfacer los requerimientos energéticos del animal, los cuales, se cree que son las fuerzas impulsoras del consumo (Emmans, 1997). En dietas a base de pastos, se asume que, el llenado ruminal es la causa principal que limita el consumo, y que se manifiesta por una combinación del volumen y el tiempo durante el cual el alimento no digerido permanece en el tracto digestivo (Allen, 1996). Se ha sugerido que es restringido por el llenado ruminal hasta un punto de equilibrio regulado por la digestibilidad del alimento, más allá de la cual, la relación entre consumo y digestibilidad se hace negativa y controlada por los requerimientos del propio animal (Romney y Gill, 2000). El punto de equilibrio, es por tanto, dependiente de los requerimientos energéticos del animal y de la relación entre la digestibilidad y la naturaleza de las fuerzas que constriñen la baja digestibilidad de una dieta en particular bajo estudio. Un mejor entendimiento de esta última relación pudiera conducir a incrementar la eficiencia en la predicción, particularmente en dietas compuestas por un gran número de ingredientes. Características de los pastos que afectan al consumo Factores físicos Estructura de la planta.- Los factores físicos son los que generalmente tienen mayor influencia en el incremento del volumen del estómago, ocupado por la ingestión de un alimento, y el grado al cual el volumen es disminuido debido a la digestión y pasaje de la ingesta. El contenido fibroso de las paredes celulares es el principal factor a este respecto, debido a que estas estructuras son menos solubles y toman más espacio en el rumen, que el contenido celular. Los pastos contienen una gran proporción de su materia orgánica (35-80%) compuesta por paredes celulares, las cuales proporcionan la integridad estructural de las plantas (Figura 8.1.). Los glúcidos estructurales (celulosa, hemicelulosa y pectinas) son degradados por los microbios ruminales, lo cual posibilita al rumiante a utilizar una fuente de energía que generalmente no es eficientemente usada por los no rumiantes. La distribución de las diferentes moléculas dentro de la planta y de sus enlaces entre ellas son factores importantes que afectan la habilidad con la cual los microorganismos pueden degradar las células (Jung y Allen, 1995) y, por tanto, el espacio ocupado en el tracto digestivo. Además, las características físicas de la pared celular o las mismas partículas fibrosas como el origen del tejido, forma, flotación y gravedad específica, afectan la velocidad a la cual las partículas son degradadas y su facilidad de pasaje (Wilson y Kennedy, 1996). La resistencia a la pulverización (reducción del tamaño de partícula) esta positivamente correlacionada con el contenido de la fibra; sin embargo, la relación entre la fibra determinada usando la solución detergente neutro (FDN) y consumo de materia seca (CMS) no siempre es constante. FACULTAD DE CIENCIAS BIOLÓGICAS, UANL CONSUMO DE PASTOS Reid et al. (1988) demostró un efecto significativo de diferentes tipos de forrajes (pastos C3 o C4 o leguminosas) sobre la pendiente e intercepto de las regresiones entre CMS y FDN en el ganado bovino y ovino, indicando que el efecto de llenado ruminal usando la FDN puede variar dependiendo del tipo de forraje. Esto puede ser explicado por las diferencias en distribución molecular de los diferentes polisacáridos estructurales. Minson (1990) observó que para grupos de forrajes con similar digestibilidad de la MS, el contenido de fibra es mayor en leguminosas comparadas con pastos de clima templado comprados con los de clima cálido y hojas comparadas con tallos. Willson y Kennedy (1990) sugirieron que la baja digestibilidad de los pastos tropicales comparados con los de clima templado o leguminosas refleja un entrelazamiento y, por tanto, una estructura celular rígida. Estos autores también sugirieron que la mayor digestibilidad de las leguminosas comparadas con los pastos pueda deberse al largo de sus hojas. Las partículas de los pastos, son inherentemente más lagas y voluminosas, con una baja gravedad específica funcional (GEF) y son fácilmente entrelazadas, mientras que los bocados de las leguminosas son cortos y de alta GEF y, por tanto, desaparecen del rumen muy rápidamente. Por tanto, el consumo potencial es dependiente no solo del contenido de fibra, sino también, de la estructura original de la planta y la manera en la cual es degradada durante la digestión (Romney y Gill, 2000). El contenido de MS de los alimentos también puede influenciar el especio ocupado dentro del tracto digestivo. El Figura 8.1. Tridens muticus (Torr.) Wash. Nombre común: zacate tridens delgado. Perenne; amacollada, tallos de 20-50 cm de alto; láminas angostas, involutas y ocasionalmente planas, raramente de 2 mm de ancho, a menudo cubiertas de na pelusilla blanca azulosa; cuello y lígula generalmente largo-peludos; lígula habitualmente con aurículaslaterales. Panícula generalmente de 6-26 cm de largo, racimosa, angosta y espiciforme, las espiguillas más bien distantes, no aglomeradas; espiguillas de 9-13 mm de largo 5-8 (10) flosculadas; glumas marcadamente lanceoladas y ovadas, muy delgadas y hialinas, 1-nervadas, la segunda gluma raramente con cortas nervaduras laterales, adyacentes ambas, más cortas que el flósculo inferior; lemas aproximadamente del largo de las glumas, delgadas, hialinaso teñidas de morado, con un ápice marcadamente redondeado, hasta ocasionalmente en muesca o mucronato. Nativa; presente en pendientes rocosas, secas, en pastizales, matorrales y Bosque esclerófilo al noreste de la entidad. Valor forrajero regular (Ackerman-Beetle y Johnson-Gordon, 1991). presecado de los pastos antes de ensilarlos, consistentemente, ha demostrado que los ensilados son consumidos en mayor cantidad comparados con los pastos que no han sido secados previamente (Teller et al., 1993) y en algunas ocasiones el consumo aumenta hasta un 44% (Romney et al., 1997). Una explicación es que la efectividad de la mordida durante LOS PASTOS EN LA NUTRICIÓN DE LOS RUMIANTES 201 CAPÍTULO 8 el consumo y por tanto la velocidad del rompimiento de las partículas fue mejorado con el material deshidratado. Sin embargo, las ventajas en términos de producción animal han sido menos evidentes en años recientes (Forbes, 1995), debido a que conforme el control de la fermentación en los silos se ha mejorado, y los pastos han sido cosechados en estados de madurez prematura, dando materiales con más alta digestibilidad, por los cuales los efectos del deshidratado no son muy eficaces. La práctica del deshidratado continúa debido a la estrategia de reducir el escurrimiento más que para mejorar el valor nutritivo. Estructura de la pradera 202 En animales en pastoreo, la distribución de las plantas puede restringir el consumo, no solo por el espacio del alimento que ocupa en el tracto digestivo, sino también, por la limitada cantidad de forraje que el animal puede tomar en un período de 24 horas. Características tales como densidad y altura de las plantas, pueden influenciar su consumo, ya sea por la capacidad de aprehensión y por tanto, tamaño de mordida, la cual ha mostrado ser el principal factor el consumo diario de alimento (Hodgson et al., 1991). Por tanto, en animales de pastoreo no solo la estructura de la planta, sino también, las características del agostadero deben ser tomados en cuenta para predecir el consumo de alimento. Factores fisiológicos Un gran número de neurotransmisores (norepinefrina, epinefrina, dopamina, seratonina, y ácido gamaaminobutírico) y hormonas (insulina, colecistoquinina, neurotensina, glucagón, calcitonina y el factor de liberación de la hormona de crecimiento) controlan el balance de nutrientes y el consumo de alimento (Ritter et al., 1986). Estos compuestos estimulan varios sitios del cerebro (hipotálamo, corteza cerebral, sistema nervioso autónomo, cerebelo) que regulan el consumo. Ingvartesen et al. (1992) observó una disminución en el consumo debido a la gestación, lo cual es consistente con resultados previos reportados en la literatura y propusieron que las hormonas están involucradas en la regulación del consumo, además de las limitaciones físicas resultantes del incremento en el tamaño del o los fetos diminuyendo espacio en el rumen. Factores metabólicos No todas las diferencias en el consumo entre pastos pueden ser explicados por factores que pueden influenciar el espacio ocupado en el tracto digestivo. Por ejemplo, generalmente es aceptado que el almacenado de los pastos resulta en una disminución del consumo (Forbes, 1995). Sin embargo, posterior a las mejoras en las técnicas de almacenamiento y conservación de los ensilados, el bajo consumo del silo comparado con el heno, es considerado como un problema menor. Los ácidos orgánicos y substancias nitrogenadas como las aminas, producidos durante el proceso del ensilaje y los aditivos usados para mejorar la calidad nutritiva del silo, algunas veces han sido implicados como los responsables FACULTAD DE CIENCIAS BIOLÓGICAS, UANL CONSUMO DE PASTOS en la disminución del consumo observado cuando el pasto fresco, recién cosechado, es ensilado. Infusiones ruminales de los constituyentes individuales o mezclas de ellos han indicado que no hay un constituyen en particular que sea el responsable por el bajo consumo, pero los efectos aditivos de un gran número de substancias pueden ser los responsables. Interacciones entre los pastos y factores propios del animal Tamaño del animal El tamaño del animal es el factor más correlacionado con el consumo de alimento. Los animales de talla grande consumen mayores cantidades de alimento; sin embargo, la relación no es isométrica, aunque usando escalas alométricas con la masa muscular, el consumo es comúnmente expresado en base al peso metabólico del animal (PV0.75). Aunque no es de sorprenderse, ya sea, que parámetros relacionados con el procesado de la fibra están también relacionados con el tamaño del animal. Welch (1982) encontró que el tiempo de ruminación por gramo de FDN disminuyó exponencialmente con el peso vivo del animal. Illus y Gordon (1991) mostraron que el tiempo que se requiere para romper las grandes partículas de la fibra en partículas más pequeñas, tienen una escala menor en el tiempo de retención con un PV0.27, mientras que el paso de la digesta hacia el bajo tracto digestivo es isométrico con el peso vivo. Las relaciones alométricas tienen una gran influencia en las variaciones atribuibles a la masa corporal (Illus, 1998) y pudieran ser incorporadas a modelos para mejorar la predicción del consumo. Los animales jóvenes en crecimiento, aparentemente son capaces de consumir más cantidad de alimento que los animales adultos con un mismo peso y el consumo parece estar alométricamente relacionado con PV0.60, en vez de PV0.75, este último se asume que corresponde a animales adultos. Esta diferencia refleja el efecto de la tasa metabólica y, por ende, el estado fisiológico del animal sobre el consumo. Animales en pastoreo El factor animal también puede influenciar el consumo durante el pastoreo. El consumo en animales en pastoreo es dependiente del grado de ingestión (tamaño y número de mordidas) y del tiempo de pastoreo. Aun cuando la estructura de la pradera y la masa de pasto disponible afecta estos parámetros, como fue descrito previamente, los animales son capaces, dentro de ciertos límites de alterar el comportamiento durante el pastoreo, incrementando el tiempo de pastoreo donde el pasto es escaso y, por consiguiente, se incrementa la actividad de pastoreo. El efecto del estatus fisiológico sobre el consumo en pastoreo, también ha sudo demostrado; por ejemplo, cuando la disponibilidad de forraje es alta, el consumo se incrementa hasta 460 g MO kg1 , incrementos en la producción de leche también han sido observados (Stakelum y Dillon, 1991). Los efectos han sido observados en la tasa de consumo y/o tiempo de pastoreo (Romney y Gill, 2000). LOS PASTOS EN LA NUTRICIÓN DE LOS RUMIANTES 203 CAPÍTULO 8 204 Nivel de consumo El tamaño y número de mordidas no son independientes. Newman et al. (1994) resaltó que para un determinado pasto se requiere un tiempo dado de masticación, un incremento en el tamaño de mordida causará un incremento en el tiempo de masticación, decremento en el número de mordidas resultando en ritmos iguales de consumo. El hecho de que los animales puedan alterar su ritmo de consumo se ha demostrado cuando los animales aumentan su consumo posterior a un ayuno prolongado (Dougherty et al., 1989). Esta observación ha demostrado que los animales raramente consumen alimento hasta un límite máximo, aunque ha habido algunos indicios de que los animales incrementan su nivel de consumo cuando se les ha restringido el tiempo de pastoreo (Romney et al., 1996) posterior a que aprendieron que solo se les permitirá pastorear por un periodo limitado de tiempo. Tiempo usado para el pastoreo Cuando la estructura de la planta limita el tamaño de la mordida y, por tanto, el grado de consumo, el tiempo dedicado al consumo puede ser alterado, para compensar la disminución en el tamaño de la mordida. Sin embargo, al parecer existe un período máximo de pastoreo que el rumiante usa para llevar a cabo la ingestión de alimento. Weston (1996) reportó que los ovinos y bovinos pastorean de 13 a 15 h d-1, mientras que Forbes (1996) sugirió que los rumiantes consumen alimento hasta un máximo de 12 h d-1. Por consiguiente, si el tamaño de la mordida es menor a cierto límite, los animales no serán capaces de lograr su máxima capacidad de llenado. Illus (1998) sugiere que esto ocurre como consecuencia de que el tiempo oral del procesado del alimento llega a un límite máximo, lo cual involucra la prensión, masticación y ruminación. Sin embargo, este límite, en su caso, es dependiente del estado fisiológico, debido a que el incremento en la producción de leche resulta en un incremento en el tiempo de pastoreo. Experiencias adversas durante el pastoreo Un gran número de autores han demostrado que los rumiantes disminuyen la ingestión de alimento en respuesta a una indisposición resultante por el consumo de toxinas, tales como alcaloides (Thompson y Stuedermann, 1993), taninos condensados (Provenza, 1995a) y glucosinolatos (Duncan y Milne, 1993) y ensilajes de baja calidad (Buchanan-Smith, 1990). La aversión para un alimento en particular se incrementa dependiendo de la severidad del daño y disminuye conforme incrementa el espacio de ingestión y el daño causado por el alimento (Ralphs y Cheng, 1993). La aversión hacia los alimentos disminuye conforme el tiempo pasa y el proceso recuperativo contrarresta la aversión, resultando en un consumo cíclico de alimentos nutritivos conteniendo toxinas. Un marcado descenso es seguido por un incremento gradual. Respuestas similares fueron observadas en animales que consumieron granos, lo que aparenta ser el resultado de problemas causados por los ácidos orgánicos producidos durante la digestión del almidón. FACULTAD DE CIENCIAS BIOLÓGICAS, UANL CONSUMO DE PASTOS Provenza (1995a) menciona que aun cuando la presencia de alimentos tóxicos en lugares donde los rumiantes tienen libre acceso a sus alimentos, se manifiestan pocos casos de toxicosis, ya que esos animales son capaces de limitar el consumo de plantas nutritivas que contienen taninos, dependiendo de la concentración de la toxina. El concluyó que los animales son capaces de reconocer los alimentos basados en experiencias previas. Así, la preferencia por un alimento en particular depende no solo del sabor, sino también, de las consecuencias de tal alimento en la ecología ruminal (Provenza, 1995b). Interacciones entre los componentes de la dieta La suplementación puede ser considerada como una medida para incrementar el suministro de nutrientes, para los animales que no son capaces de consumir los nutrientes necesarios en los pastos debido a las limitaciones físicas del llenado ruminal. La suplementación, generalmente, tiene un efecto positivo en el consumo de MS (CMS), pero puede tener efectos positivos o negativos en el consumo de la dieta base. Efectos negativos en el CMS. Comúnmente se manifiesta un efecto de substitución cuando el consumo de los alimentos fibrosos disminuye y varía al mismo grado que varía la digestibilidad de la dieta base, entre otros factores. Bajo ciertas circunstancias, el efecto puede ser explicado de acuerdo a las reglas simples de la aditividad, donde la fibra es remplazada 1:1; sin embargo, esto no puede considerase como una explicación generalizada. Forbes (1995) sugiere que el grado de substitución en ganado lechero varía de 0.4 a 0.8 con una media aproximada de 0.5. Aunque Thomas (1989) encontró un efecto lineal al incrementar el nivel de substitución. En otro trabajo (Sutton et al., 1992) demostraron un incremento en el grado de substitución conforme el nivel de suplementación se incrementó y una relación positiva con la calidad del forraje (Forbes, 1995). Suplementos ricos en glúcidos rápidamente fermentables pueden tener un mayor efecto inhibitorio en el consumo de fibra comparados con suplementos lentamente fermentables, debido a la disminución en la digestibilidad de los forrajes fibrosos. La rápida fermentación resulta en una inhibición de la celulólisis, la cual ha sido atribuida a la disminución en el pH o aun mecanismo de retroalimentación inhibitorio de las enzimas digestivas claves (Murphy, 1989). Efectos positivos en el CMS. Bajo ciertas circunstancias, la suplementación puede ser usada para incrementar el consumo de pastos de pobre calidad nutritiva proporcionando un nutriente limitante. Willson y Kennedy (1996) notaron que en dietas a base de pastos, el grado de fermentación microbial baja si el contenido de amoniaco ruminal disminuye por debajo de 50 ml N l-1. Asimismo, Wilson (1990) sugirió que, alimentos con un contenido de proteína cruda (PC) menor a 62 g PC kg-1 de la MS la digestión de la fibra es inhibida, y reporta una serie de pruebas en las cuales el consumo de forraje se ha incrementado de 14 a 77%, una vez que se proporcionó proteína suplementaria. En casos donde la concentración de N LOS PASTOS EN LA NUTRICIÓN DE LOS RUMIANTES 205 CAPÍTULO 8 amoniacal limita la fermentación microbial, el sumiTabla 8.1. nistro de N a los microorganismos incrementa la diFactores de las plantas y animales que afectan el consumo de forraje gestión de la MO en el rumen, lo que conduce a que se incremente la degradación y tasa de pasaje de los $OWRFRQVXPR %DMRFRQVXPR pastos de baja calidad nutritiva, por medio de la re)DFWRUHVGHODVSODQWDV &RQWHQLGRGHILEUD %DMR $OWR moción de los obstáculos físicos permitiendo que el &ODVHVGHSDVWRV &OLPDWHPSODGR& &OLPDFiOLGR& &RQWHQLGRGH06 (QVLODMHFRQDOWRFRQWHQLGR (QVLODMHFRQEDMRFRQWHQLGR animal que el animal consuma más alimento. Leng (VWUXFWXUDGHOSDVWL]DO $OWDGHQVLGDGGHSODQWDVySWLPD %DMD GHQVLGDG GH SODQWDV EDMD DOWXUD GH ORV IRUUDMHV SDUD HO DOWXUD GH ORV IRUUDMHV SDUD ORV DQLPDOHVTXHORVSDVWRUHDQ SDVWRUHRGHORVDQLPDOHV (1990) notó que los productores en países subdesa0pWRGRGHFRQVHUYDFLyQ 6LORELHQIHUPHQWDGR 6LORPDOIHUPHQWDGR rrollados reconocen el beneficio de agregar peque)DFWRUHVGHORVDQLPDOHV (VWDGRILVLROyJLFR $QLPDOHVHQFUHFLPLHQWR ÒOWLPRWHUFLRGHODJHVWDFLyQ ñas cantidades de follaje verde a dietas constituidas 7DPDxR $QLPDOHVGHWDOODJUDQGH $QLPDOHVGHWDOODSHTXHxD 1LYHOGHFRQVXPR /DV FDUDFWHUtVWLFDV GH ORV /DV FDUDFWHUtVWLFDV GHO IRUUDMH a base de pajas de baja calidad nutritiva. Y sugirió IRUUDMHV RSWLPL]DQ HO WDPDxR GH OLPLWDQHOWDPDxRGHODPRUGLGDH OD PRUGLGD PLQLPL]DQGR OD LQFUHPHQWDQODPDVWLFDFLyQ PDVWLFDFLyQ que lo anterior pudiera deberse a la provisión de una ([SHULHQFLDVSUHYLDV 6XSOHPHQWDFLyQ FRQ EORTXHV 3UHVHQFLD GH DOFDORLGHV WDQLQRV SDUDODPHU FRQGHQVDGRVJOXFRVLQRODWRV fuente de fibra altamente colonizada para sembrar bacterias a la fibra menos digestible o a través de mecanismos que incrementan la concentración de Digestibilidad in vitro amoniaco por arriba del nivel crítico. En la Tabla 8.1. se muestra un resumen de los factores de las plantas y de los La relación entre el grado de digestión y el consumo a traanimales que afectan el consumo de forraje. vés de sus efectos en la tasa de pasaje ha resultado que un gran número de autores usen técnicas in vitro de la tasa de Predicción del consumo digestión y métodos in situ de degradabilidad para medir el consumo. Los parámetros usados incluyen la medición de Composición química volúmenes de gas o desaparición de la MS en diferentes períodos de tiempo durante la fermentación; así como meLos componentes químicos más usados para estimar el condidas derivadas de curvas ajustadas al gas producido. sumo de pastos incluyen la medición del contenido de la Blümmel et al. (1997) calculó un factor particionante, repared celular (FDN) y el contenido de ligno-celulosa (FDA; flejando la variación de la producción de ácidos grasos de Van Soest, 1994). En la Tabla 8.2. se muestran varios parácadena corta por unidad de substrato degradado y mostró metros de los alimentos para predecir el consumo. que éste estaba involucrado en un 11% de la variación del CMS. 206 FACULTAD DE CIENCIAS BIOLÓGICAS, UANL CONSUMO DE PASTOS Tabla 8.2. Algunos parámetros de los alimentos para predecir el consumo &RQFHSWR 3DUiPHWURV )'1)'$ 3URGXFFLyQ GH JDV GHVDSDULFLyQ GH OD PDWHULD VHFDJUDGRGHGLJHVWLyQ 3URSRUFLyQ GH KRMDV GHQVLGDG GH YROXPHQ HQHUJtD GH PROLGR JUDGR GH GLJHVWLyQ D FRUWR SOD]R &RPSRVLFLyQTXtPLFD 'LJHVWLELOLGDGLQYLWUR (VWUXFWXUDItVLFDGHODVSODQWDV ciertas circunstancias, puede tener efectos benéficos en ovinos pero no en bovinos (Osafo et al., 1997). El tratamiento químico con urea se ha estado usando en países subdesarrollados como un medio efectivo para incrementar el valor nutritivo de los forrajes y, por consiguiente, el consumo. Ejemplos de manipulación del consumo se muestran en la Tabla 8.3. Nutrientes esenciales Pastos de baja calidad nutritiva En lugares donde los alimentos de baja calidad conforman la mayor parte de las dietas, el consumo es constreñido debido a la disminución en el grado de digestión a la cual la fibra es digerida y, por ende, su paso a través del tracto digestivo. Por ejemplo, los rastrojos y pajas que son ofrecidos particularmente, durante la época seca en los trópicos, tienden a tener un alto contenido de fibra y bajo nivel de N, lo cual puede limitar el grado de digestión de la fibra. Mientras que la suplementación con ingredientes de mejor calidad puede incrementar el consumo total de la dieta base o la manera en la cual ésta es ofrecida puede también influenciar el consumo. Métodos físicos simples para incrementar el consumo incluyen la cantidad de alimento ofrecido que permita al animal seleccionar las partes más palatables y nutritivas, con lo cual se incrementa la cantidad de la dieta consumida así como el consumo. El picado del pasto, bajo El consumo de los rumiantes puede disminuirse debido al bajo contenido de N, S, P, Mg, Na, Co y Se en el forraje. Sin embargo, el tamaño de las reservas corporales de estos elementos es desconocido y, por ende, no existe información del grado al cual estos nutrientes pueden ser liberados hacia el torrente sanguíneo. La falta de información de las reservas minerales en los rumiantes y la velocidad de movilización está asociado con el papel tradicional de la mayoría de los nutricionistas de rumiantes, quienes solo están interesados en estimar las cantidades recomendadas de varios elementos para su uso en la formulación de dietas, sin tomar en cuenta las reservas corporales (Minson y Wilson, 1994). En las Tablas 8.4. y 8.5. se muestran los procedimientos para determinar el consumo de forraje, ya sea para rumiantes en confinamiento o indirectamente para animales en pastoreo, respectivamente. LOS PASTOS EN LA NUTRICIÓN DE LOS RUMIANTES 207 CAPÍTULO 8 Tabla 8.3. Formas de modificar el consumo de forrajes de baja calidad nutritiva &RQFHQWRV 0RGRGHDFFLyQ 6XSOHPHQWDFLyQFRQSHTXHxDVFDQWLGDGHVGH1 ,QFUHPHQWRHQODFDQWLGDGRIUHFLGD 3LFDGR 7UDWDPLHQWRFRQiFLGRVRFRQiOFDOLV 7UDWDPLHQWRFRQXUHD ,QFUHPHQWD OD GLJHVWLyQ UXPLQDO \ WDVD GH SDVDMH GRQGHODIHUPHQWDFLyQPLFURELDOHVOLPLWDGDGHELGR DOEDMRVXPLQLVWURGH1 3HUPLWH DO DQLPDO VHOHFFLRQDU SRUFLRQHV PiV GLJHVWLEOHV 'LVPLQX\H HO WDPDxR GH SDUWtFXOD LQFUHPHQWD OD WDVDGHSDVDMH3XHGHVHULQHIHFWLYRVLODVHOHFFLyQ GHOIRUUDMHHVXQSUREOHPD ,QFUHPHQWDODGLJHVWLELOLGDGGHODILEUD ,QFUHPHQWD OD GLJHVWLELOLGDG GH OD ILEUD \ KD\ XQ DSRUWH DGLFLRQDO GH 1 DPRQLDFDO SDUD ORV PLFURRUJDQLVPRV 208 Tabla 8.4. Procedimientos para determinar el consumo de forraje de animales en confinamiento &RQFHSWR &RPHQWDULR $,QIRUPDFLyQUHTXHULGD )RUUDMH D ,GHQWLILFDFLyQGHHVSHFLHV E &RQGLFLRQHVGHFUHFLPLHQWR F (VWDGRGHFUHFLPLHQWR G 3URSRUFLyQGHODPH]FOD H KRMDVWDOORVPDWHULDOPXHUWR I )RUPDItVLFD $QLPDO D (VSHFLHV\VH[R E 3HVR\FRQGLFLyQ F +LVWRULDOUHFLHQWH G (VWDQGDUL]DU H 3URSRUFLRQDUDJXD I 3URSRUFLRQDUPLQHUDOHV %3URSyVLWRSDUDPHGLUHOFRQVXPR D 3RWHQFLDOGHODGLHWD E )RUUDMHRIUHFLGRFUHFLPLHQWR F )RUUDMHRIUHFLGRPDQWHQLPLHQWR G 5HVSXHVWDVGHFDD &GLVHxRVH[SHULPHQWDOHVFRP~QPHQWHXVDGRV 1RPEUHFRP~QQRPEUHFLHQWtILFR\FXOWLYDU (VSHFLILFDUIHUWLOLGDGFRQGLFLRQHVGHHVWUpVWLSRGHVXHOR 3URSRUFLRQDUODPDGXUH]ILVLROyJLFD (VSHFLHVVHSDUDGDVPDQXDOPHQWHSURSRUFLRQHFRPRGH06 6HSDUDGRVPDQXDOPHQWHSURSRUFLRQHFRPRGH06 3LFDGRWDPDxRPROLGRWDPDxRGHODPDOODODUJRUDQJR 8VHDQLPDOHVH[SHULPHQWDOHVVLPLODUHV $OLQLFLRSHVHVHPDQDOPHQWHDODPLVPDKRUD 6LHOKLVWRULDOHVOOHYDGRGLDULDPHQWH $OLPHQWDU FRQ XQ IRUUDMH FRP~Q GH XQD D GRV VHPDQDV DQWHV GHODSUXHEDGHVSDUDVLWDUVLHVQHFHVDULR (QIRUPDFRQWLQXDRGRVYHFHVSRUGtD 6DOHVGHPLQHUDOHVWUD]DRIRVIDWRGLFiOFLFR $OLPHQWDUDXQQLYHO $OLPHQWDUDXQQLYHOGHD $OLPHQWDUDXQQLYHOGHD 5DQJRGHWUDWDPLHQWRVGHD! &RPSOHWDPHQWH DO D]DU EORTXHV FRPSOHWRV DO D]DU FXDGUR ODWLQR\GLVHxRVFUX]DGRV FACULTAD DE CIENCIAS BIOLÓGICAS, UANL CONSUMO DE PASTOS Tabla 8.4. Continuación \ '(YHQWRVGLDULRV 'tD DOLQLFLDO DOLQLFLDO \ DO DO (&ROHFWDGHPXHVWUDV )RUUDMHFRQVXPLGR 5HFKD]RV 'HVSHUGLFLRVRFXUULGRVSRUHOPDQHMRSHURUHFXSHUDGRV )3UHSDUDFLyQGHODVPXHVWUDV 6LIXHURQVHFDGDVDODLUHOLEUH 'LVPLQXFLyQGHOWDPDxRGHSDUWtFXODV 6XEPXHVWUDV 0DWHULDOHQH[FHVR *$QiOLVLV 0DWHULDVHFD06 0XHVWUDVGHOD06 $FWLYLGDG 3HVH ORV DQLPDOHV FRQGLFLyQ FRUSRUDO LQLFLH FRQ OD GLHWD H[SHULPHQWDO 3HUtRGRGHDMXVWHSDUDHOIRUUDMHQRUPDODMXVWHDXQFRQVXPR DGOLELWXPVLVHTXHGDFRUWRHQXQGtDDJUHJXHDOLPHQWRVLHV HQH[FHVRDORVWUHVGtDVUHGX]FDODFDQWLGDGRIUHFLGD 8VH XQ SHUtRGR GH DMXVWH PD\RU VL VH WUDWD GH HQVLODGRV R VL KD\XQIDFWRUDQWLQXWULFLRQDOSUHVHQWH 3HVHORVDQLPDOHV 0HGLFLyQ GHO FRQVXPR D ORV GtDV REWHQJD XQD PXHVWUD GLDULD GH DFXHUGR DO GHO IRUUDMH RIUHFLGR JXiUGHOD HQ XQ UHFLSLHQWHKHUPpWLFDPHQWHFHUUDGR &ROHFWHORVUHFKD]RVGLDULRVGHFDGDDQLPDOSpVHOR\JXiUGHOR HQXQUHFLSLHQWHSURSLRSDUDFDGDDQLPDO 3HVHORVDQLPDOHV 2EWHQJD PXHVWUDV GLDULDV SDUD REWHQHU GH D NJ SRU SHUtRGRFROHFWH\PH]FOHHQUHFLSLHQWHVHOODGR $OILQDOGHOSHULRGRGHFROHFFLyQVHTXH&SHVHPH]FOH\ REWHQJD XQD VXEPXHVWUD J R DOPDFHQH HO SHVR WRWDO HQ UHFLSLHQWHVKHUPpWLFDPHQWHFHUUDGRV &ROHFWH WRGR GXUDQWH HO SHULRGR LQFOX\HQGR UHFKD]RV VL VRQ PtQLPRVFROpFWHORVDOILQDOGHOSHULRGRVLVRQH[FHVLYRVKDJD YDULDVFROHFWDVFROyTXHORVHQEROVDVGHSDSHO\GHVKLGUiWHORV D&GXUDQWHGtDV 7DOFRPRFRQVXPLGRUHFKD]RV\GHVSHUGLFLRV 3HVHDQWHVGHPROHU 8VHXQDSLFDGRUDRXQPROLQR:LOH\PDOODGHPP 0H]FOH FRPSOHWDPHQWH DOHDWRULDPHQWH REWHQJD J PXpODORVXVDQGRXQDPDOODGHPPDOPDFHQHHQUHFLSLHQWHV KHUPpWLFDPHQWHFHUUDGRV (OLPLQHHOPDWHULDOUHFKD]DGR\GHGHVSHUGLFLRHQH[FHVR 7DOFRPRFRQVXPLGRUHFKD]RVGHVSHUGLFLRV 'HWHUPLQH OD PDWHULD VHFD SDUFLDO GHO IRUUDMH WDQ SURQWR FRPR VHDSRVLEOHHYLWHFDPELRVGHKXPHGDGGHVSXpVGHOPROLGR\ SDUD ORV UHFKD]DV \ GHVSHUGLFLRV $MXVWH OD 06 GHO VLOR SDUD SUHYHQLUSpUGLGDVSRUYRODWLOL]DFLyQ 9XHOYD D VHFDU WRGDV ODV PXHVWUDV SDUD SUHYHQLU OD IRUPDFLyQ +&iOFXORV &RQVXPRGHPDWHULDVHFD&06 06FRQVXPLGDJGtD 06FRQVXPLGD;$OLPHQWRFRQVXPLGR 1~PHURGHGtDV 06UHFKD]DGDJGtD 06UHFKD]DGD;5HFKD]RWRWDO 1~PHURGHGtDV 06GHVSHUGLFLDGDJGtD 06GHVSHUGLFLDGD;'HVSHUGLFLRWRWDO 1~PHURGHGtDV &06JGtD 06&RQVXPLGD±06UHFKD]DGD±06GHVSHUGLFLDGD &RQVXPRGHRWURV;FRQVWLWX\HQWHVLQFOX\HQGRPDWHULDRUJiQLFD &RQVXPRGLDULRGH; 06FRQVXPLGD;±06UHFKD]DGD;±06GHVSHUGLFLDGD; )RUPDVGHH[SUHVDUHO&06 (QODPD\RUtDGHORVH[SHULPHQWRVGRQGHODVFRPSDUDFLRQHVVRQHQWUHHVSHFLHVUD]DV\ORVSHVRVYLYRVGHORVDQLPDOHV VRQ VLPLODUHV H[SUpVHOR FRPR SRUFHQWDMH GHO SHVR YLYR NJ NJ (Q H[SHULPHQWRV FXDQGR ODV FRPSDUDFLRQHV VRQ HQWUH HVSHFLHV GH DQLPDOHV TXH GLILHUHQ DPSOLDPHQWH HQ VX SHVR YLYR FDEUDV YV YDFDV YV HOHIDQWHV HO XVR GHO SHVR PHWDEyOLFRHVHODGHFXDGR LOS PASTOS EN LA NUTRICIÓN DE LOS RUMIANTES 209 CAPÍTULO 8 Tabla 8.5. Procedimientos para determinar el consumo de forraje en forma indirecta para animales en pastoreo &RQFHSWR &RPHQWDULR $,QIRUPDFLyQUHTXHULGD )RUUDMH D ,GHQWLILFDFLyQGHHVSHFLHV E &RQGLFLRQHVGHFUHFLPLHQWR F 3DVWXUDGLVSRQLEOH G 3URSRUFLyQGHODPH]FOD H KRMDVWDOORVPDWHULDOPXHUWR $QLPDO D (VSHFLHV\VH[RHVWDGRILVLROyJLFR E 3HVR\FRQGLFLyQ F +LVWRULDOUHFLHQWH G 3URSRUFLRQHDJXD D 3URSRUFLRQDUPLQHUDOHV %3URSyVLWRSDUDPHGLUHOFRQVXPR D &RPSDUDFLyQGHIRUUDMHV E &RPSDUDFLyQGHODELRPDVD F &RPSDUHD\E &GLVHxRVH[SHULPHQWDOHVFRP~QPHQWHXVDGRV '0DUFDGRGHODILEUD )XHQWH 'LHWD 3UHSDUDFLyQ 210 ((YHQWRVGLDULRV 1RPEUHFRP~QQRPEUHFLHQWtILFR\FXOWLYDU (VSHFLILFDUIHUWLOLGDGFRQGLFLRQHVGHHVWUpVWLSRGHVXHOR (VWLPHODELRPDVDNJKD (VSHFLHVVHSDUDGDVPDQXDOPHQWHSURSRUFLRQHFRPRGH06 6HSDUDGRVPDQXDOPHQWHSURSRUFLRQHFRPRGH06 8VHDQLPDOHVH[SHULPHQWDOHVVLPLODUHV $OLQLFLR\DOILQDOGHOPXHVWUHRHVWLPHODFRQGLFLyQFRUSRUDO 6LHOKLVWRULDOHVOOHYDGRGLDULDPHQWH (QIRUPDFRQWLQXDRGRVYHFHVSRUGtD 6DOHVGHPLQHUDOHVWUD]DRIRVIDWRGLFiOFLFRRRWURV &DUDFWHUtVWLFDVGRPLQDQWHVGHODHVSHFLH %LRPDVD GRPLQDQWH FDUDFWHUtVWLFDV PHQRV LPSRUWDQWHV GHO GRVHO %LRPDVD\HVWUXFWXUDLPSRUWDQWHGHOGRVHO &RPSOHWDPHQWHDOD]DUEORTXHVFRPSOHWRVDOD]DU 8VHXQDGLHWDSDUDFDGDWUDWDPLHQWRPX\VLPLODUDODGXUDFLyQ GHOSHUtRGRH[SHULPHQWDO 2EWHQHU PXHVWUDV HVRIiJLFDV FROHFWH WRGR OD PXHVWUD UHWHQLHQGRODVDOLYD ([WUDLJD OD GLHWD FRQ XQD VROXFLyQ GHWHUJHQWH QHXWUR ODYH OD ILEUD KDJD HO PDUFDGR VHTXH \ HPSDTXH HQ FiSVXODV GH JHODWLQD FACULTAD DE CIENCIAS BIOLÓGICAS, UANL CONSUMO DE PASTOS Tabla 8.5. Continuación 'tD $FWLYLGDG 0XHVWUHSDUDHVWLPDUODELRPDVDNJKD 'RVLILTXH DGPLQLVWUH RUDOPHQWH FiSVXODV GH JHODWLQD PDUFDGRUOtTXLGRLQLFLDQGRDODVSDUDGRVSUREDGRUHVSRU SDUFHODREWHQJDPXHVWUDVIHFDOHV>REWHQJDGHOVXHORDODVK RUHFWDOPXHVWUDVJHQIUHVFR\VXEVHFXHQWHVPXHVWUDV D ODV \ K@ \ DOPDFpQHODV EDMR UHIULJHUDFLyQ 2EWHQJD D XQD GLHWD GH FDGD SDUFHOD K UHWHQJD OD VDOLYD UiSLGDPHQWH DOPDFHQH HO PDVWLFDGR HQ 1 OtTXLGR DOPDFHQH EDMR UHIULJHUDFLyQ \ E REWHQJD PXHVWUDV IHFDOHV D \K 2EWHQHUDXQD GLHWDGHFDGDSDUFHOD\EPXHVWUDVIHFDOHVD ODV\K 2EWHQHUDXQD GLHWDGHFDGDSDUFHOD\EPXHVWUDVIHFDOHVD ODV\K 2EWHQJDPXHVWUDVGHODELRPDVDGHOIRUUDMHNJKD )&ROHFWDGHPXHVWUDV )RUUDMH D %LRPDVD 'HVKLGUDWHHQHVWXID&SHVH\HOLPLQH E 6HSDUDFLyQ +DFHUOR HQ IUHVFR R DOPDFHQDU EDMR UHIULJHUDFLyQ \ VHSDUDUOR SRVWHULRUPHQWH FRQJHOH VHTXH EDMR FRQJHODPLHQWR SHVH \ PXHODDWUDYpVGHXQDPDOODGHPP 'LHWDPDVWLFDGR 6HTXH EDMR FRQJHODPLHQWR REWHQJD VXEPXHVWUDV SHVH \ PXHODDWUDYpVGHXQDPDOODGHPPYXHOYDDUHIULJHUDU +HFHV 6HTXH EDMR FRQJHODPLHQWRPXHOD D WUDYpV GH XQD PDOOD GH PPSDUDHODQiOLVLVGHOPDUFDGRU\SDUDDQiOLVLVTXtPLFRV *$QiOLVLV 'LJHVWLELOLGDGGHODGLHWD (VWLPH GHO PDVWLFDGR FRQJHODGR OD GHVDSDULFLyQ LQ YLWUR GH OD 06R02',906SRUXQSHUtRGRGHIHUPHQWDFLyQGHR K OD H[DFWLWXG HV PX\ LPSRUWDQWH 0DUFDGRUHV LQWHUQRV R OD UHJUHVLyQLQYLWURLQYLYRVRQRWUDVRSFLRQHVVLVRQSURSLDPHQWH YDOLGDGDV 0DUFDGRU (VWLPHODFRQFHQWUDFLyQGHOPDUFDGRUHQFDGDPXHVWUDIHFDO +&iOFXORV $MXVWH OD FRQFHQWUDFLyQ GHO PDUFDGRU D XQ PRGHOR DSURSLDGR SDUD FDGD DQLPDO SDUD HVWLPDU ODV YDULDEOHV TXH DEDMR VH PXHVWUDQ8VHHVWLPDGRUHVGHODPHGLDSDUDFDGDSDUFHODSDUDHODQiOLVLVGHYDULDQ]D D ([FUHFLyQIHFDOGH06JGtD E 7DVDGHSDVDMHK F 7LHPSRPHGLRGHUHWHQFLyQK G /OHQDGRUXPLQDOJ &iOFXORGHOFRQVXPRGH06 &06JGtD ([FUHFLyQIHFDOGH06JGtD ',906GHODGLHWD &RQVXPRGHRWURV;FRQVWLWX\HQWHVLQFOX\HQGRPDWHULDRUJiQLFD &RQVXPRGLDULRGH; &06SURSRUFLyQGH;HQODPXHVWUDPDVWLFDGD )RUPDVGHH[SUHVDUHO&06 (QODPD\RUtDGHORVH[SHULPHQWRVGRQGHODVFRPSDUDFLRQHVVRQHQWUHHVSHFLHVUD]DV\ORVSHVRVYLYRVGHORVDQLPDOHV VRQ VLPLODUHV H[SUpVHOR FRPR SRUFHQWDMH GHO SHVR YLYR NJ NJ (Q H[SHULPHQWRV FXDQGR ODV FRPSDUDFLRQHV VRQ HQWUH HVSHFLHV GH DQLPDOHV TXH GLILHUHQ DPSOLDPHQWH HQ VX SHVR YLYR FDEUDV YV YDFDV YV HOHIDQWHV HO XVR GHO SHVR PHWDEyOLFRHVHODGHFXDGR LOS PASTOS EN LA NUTRICIÓN DE LOS RUMIANTES 211 CAPÍTULO 8 Referencias 212 Ackerman-Beetle, A. y Johnson-Gordon, D. 1991. Gramíneas de Sonora. SAGRH COTECOCA. Gobierno del Edo de Sonora, Hermosillo, Son. Allen, M.S. 1996. Physical constraints on voluntary intake of forages by ruminants. J. Anim. Sci. 74:3063-3075. Blümmel, M. Steingass, H. y Becker, K. 1997. The relationship between in vitro gas production, in vitro microbial biomass yield and 15N incorporation and its implications for the prediction of voluntary feed intake of roughages. British J. of Nutrition. 77: 911-921. Buchanan-Smith, J.G. 1990. An investigation into palatability as a factor responsible for the reduced intake of silage by sheep. Animal Production, 50:253-260. Dougherty, C.T., Bradley, N.W., Cornelius, P.L. y Lauriault, L.M. 1989. Short term fasts and the ingestivo behavior of grazing cattle. Grass and Forage Science, 40: 69-77. Duncan, A.J. y Milne, J.A. 1993. Effects of oral administration of brassica secondary metabolitos, allycyanide, allyl isothicynate and dimethyl disulphide, on the voluntary intake and metabolism of sheep. British J. of Nutrition, 70: 631-645. Emmans, G.C. 1997. A method to predict food intake of domestic animal from birth to maturity as a function of time. J. of Theoretical Biology 186: 189-199. Forbes, J.M. 1995. Voluntary Food Intake and Diet Selectioon in Farm Animals. CAB International, Wallingford, Reino Unido. Forbes, J.M. 1996. Integration of regulatory signals controlling forage intake of ruminants. J. Anim. Sci. 74: 3029-3035. Hodgson, J., Fournes, T.D.A., Armstrong, R.H., Beattie, M.M. y Hunter, E.A. 1991. Comparative studies of the ingestivo behavior and herbage intake of sheep and cattle grazing indigenous hill plant communities. J. of Applied Ecology 28: 205-227. Illus, A.W. y Gordon, I.J. 1991. Prediciton of intake and digestion in rumiants by a model of rumen kynetics integrating animal size and plant characteristics. J. Agricultural Science, 116: 145-157. Illus, A.W. 1998. Advances and retreats in specifying the constrains on intake in grazing ruminants. En: Buchanan-Smith, J.G., Bailey, L. y McCaughey, P. (editores) Proceedings of XVIII Internacional Grassland congreso, Vol. III. Association Management Centre, Calgary, Canadá, pp. 39-44. Ingvartesen, K.L., Anderson, H.R. y Foldager, J. 1992. Effect of sex and pregnancy on feed intake capacity of growing cattle. Acta Agriculturae Scandinavica, Section A, Animal Science, 42: 40-46. Jung, H.G. y Allen, M.S. 1995. Characteristics of plant cell walls affecting intake and digestibility of forages by ruminants. J. Anim. Sci. 73: 27742790. Leibowitz, S.F. y Stanley, B.G. 1986. Neurochemical controls of appetite. En: Feeding Behavior and Humeral Controls. R.C. Ritter, S. Ritter y C.P. Barnes (editores). Academic Press, San Diego, California, Estados Unidos, pp. 191-234. Leng, R.A. 1990. Factors affecting the utilization of poor quality forages by ruminants particularly under tropical conditions. Nutrition Research Reviews 3: 277-303. Minson, D.J. 1990. Forage in Ruminant Nutrition. Academia Press, San Diego, California, Estados Unidos. Minson, D.J. y Willson, J.R. 1994. Prediciton of intake as an element of forage quality. En: Fahey, G.C. Jr. (editor). Forage Quality, Evaluation, and Utilization, pp. 533-563 Murphy, M. 1989. The influence on non-structural carbohydrates on rumen microbes and rumen metabolism in milk producing cows. Ph.D. thesis, Swedish University of Agricultural Sciences, Uppsala. Newman, J.A., Parsons, A.J. y Penning, P.D. 1994. A note on the behavioral strategies used by grazing animals to alter their intake rate. Grass and forage Science, 49: 502-505. Osafo, E.L.K., Owen, E. Said, A.N., Gill, M y Sherington, J. 1997. Effects of the ammont offered and chopping on intake and selection of soghum stover by Ethiopian sheep and cattle. Animal Science, 65: 55-62. Provenza, F.D. 1995a Post ingestive feedback as an elementary determinant of preference and intake of rumiants. J. Range Manage. 48: 2-17. Provenza, F.D. 1995b. Role of learning in food preferences of ruminants. Greenhalgh and Reid revisited. In: von Engelhardt, W., LeonhardMarek, S. Breves, G. y Giesecke, D. (editors) Ruminant Physiology: Digestion, Metabolism, Growth and Reproduction Proceedings of the Eight International Symposium on Ruminant Physiology. Ferdinand Enke Verlag, Stuttgardt, Alemania, pp. 233-247. Ralphs, M.H. y Cheney, C.D. 1993. Influence of cattle age, lithium chloride dose level and food type in the retention of food aversions. J. Anim. Sci. 71: 373-379. Reid, R.L., Jung, G.A. y Thayne, W.A. 1988. Relatioships between nutritive quality and fiber components of cool season and warm season forages: FACULTAD DE CIENCIAS BIOLÓGICAS, UANL CONSUMO DE PASTOS a retrospective study. J. of Anim. Sci. 66: 1275-1291. Ritter, R.C., Ritter, S. y Barnes, C.P. (editores) 1986. Feeding Behavior and Humeral Controls. Academic Press, San Diego, California, Estados Unidos. Robbins, C.T. 2001. Wildlife Feeding and Nutrition. Academic Press, San Diego, Estados Unidos, pp. 323. Romney, D.L. y Gill, M. 2000. Intake of forages. En: Forage Evaluation in Ruminant Nutrition. D.I. Givens, E. Owen, R.F.E. Oxford y H.M. Omed (editores). CAB International, Wallingfor, Reino Unido, pp. 43-62. Romney, D.L., Blunn, V. y Leaver, J.D. 1997. The responses of lactating dairy cows to diets based on grass silage of high or low DM and supplemented with fast and slowly fermentable energy sources. En: Proceedings of the British Society of Animal Science, Edinburgo, Escocia, p. 84. Stakelumn, G. y Dillon, P. 1991. Influence os sward structure and digestibility on the intake and performance of lactating and growing cattle. En: Mayne, C.S. (editor), Management Issues for the British Grassland Farmer in the 1990s. Occasional Symposium of the British Grassland Society No. 25. Hurley, pp. 30-42. Sutton, J.D., Aston, K., Beever, D.E. y Fisher, W.J. 1992. Body composition and performance or autumn-calving Holsterin-Fresian dairy cows during lactation: food intake, milk constituents output and liveweight. Animal Production, 54: 473-480. Teller, E., Vanbelle, M. y Kamatali, P. 1993. Chewing behavior and voluntary grass silage intake by cattle. Livestock Production Science, 33: 215-227. Thomas, C. 1987. Factors affecting substitution rates in dairy cows on silage based rations. En: Haresign, L.W. y Cole, D.J.A. (editores) Recent Advances in Animal Nutrition. Butherworth-Heinemann, Oxford, pp. 205-218. Thompson, F.N. y Studermann, J.A. 1993. Pathophysiology of fescue toxicosis. Agricultural Ecosystems and the Environment, 44: 263-281. Van Soest, P.J. 1994. Nutricional Ecology of the Ruminant, 2ª edición, Cornell University Press, Ithaca, NY, Estados Unidos. Welch, J.G. 1982. Ruminantion, particle size and pasaje from the rumen. J. of Anim. Sci. 54: 885-894. Weston, R.H. 1996. Some aspects of constraintss to forage consumption by ruminants. Australian J. of Agricultural Research, 47: 175-197. Wilson, J.R. y Kennedy, P.M. 1996. Plant and animal constraints to voluntary feed intake associated with fiber characteristics and particle breakdown and passage in ruminants. Australian J. of Agricultural Research, 47: 199-225. LOS PASTOS EN LA NUTRICIÓN DE LOS RUMIANTES 213