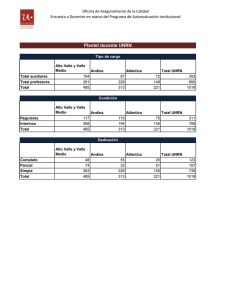
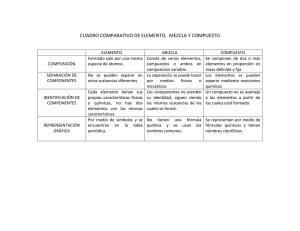
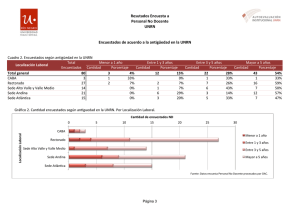
Reacciones químicas y principios de estequiometría
Anuncio

¿Porqué estudiamos las reacciones? Reacciones químicas y principios de estequiometría Dra. Patricia Satti, UNRN y Primero: examinarlas y familiarizarnos con las reacciones químicas y sus ecuaciones balanceadas. y Segundo: pensar en cómo podríamos predecir los productos de algunas de estas reacciones conociendo únicamente sus reactivos. La clave para predecir los productos formados por una combinación dada de reactivos es reconocer patrones generales de reactividad química. Reconocer un patrón de reactividad hace que nuestra comprensión sea más amplia que si nos limitamos a memorizar un gran número de reacciones sin relación entre sí. REACCIONES QUÍMICAS Dra. Patricia Satti, UNRN REACCIONES QUÍMICAS Ley de conservación de la Masa (Ley de Lavoisier, 1783) Estequiometría y En química, la estequiometría (del griego "στοιχειον" = stoicheion (elemento o parte) y "μετρον"=métron, (medida) es el cálculo de las relaciones cuantitativas entre reactivos y productos en el transcurso de una reacción química (El primero que enunció los principios de la En una reacción química la masa total de los reactantes es igual a la masa total de los productos. Es decir, en la naturaleza nada se crea ni se destruye, sólo se transforma o se reordena. estequiometría fue Jeremias B. Richter en 1792) y La estequiometría de reacciones químicas es el estudio de los aspectos cuantitativos de las reacciones. Dra. Patricia Satti, UNRN REACCIONES QUÍMICAS Masa de los Reactivos Dra. Patricia Satti, UNRN Masa de los Productos REACCIONES QUÍMICAS Ley de las proporciones definidas (Ley de Proust, 1799) “Cuando los elementos se combinan para formar compuestos lo hacen siempre en proporciones en peso definidas”. La ley de las proporciones definidas constituyó una poderosa arma en la búsqueda de la composición y las reacciones químicas. Dra. Patricia Satti, UNRN REACCIONES QUÍMICAS y La reacción química es sólo un Estequiometría y La estequiometría de reacciones químicas es el estudio de los aspectos cuantitativos de las reacciones. y Reacción química: proceso en el cual una o varias sustancias puras (REACTIVOS o REACTANTES) se transforman para formar una o más sustancias nuevas (PRODUCTOS). y Se representan mediante ecuaciones químicas. Dra. Patricia Satti, UNRN 6 REACCIONES QUÍMICAS y Como toda ecuación, la ecuación química reordenamiento de átomos. (e.q.), tiene dos miembros. y En la reacción química se conserva el número de átomos. y Las sustancias al lado izquierdo se denominan REACTANTES o REACTIVOS y las del lado derecho, PRODUCTOS. y En la reacción química NO se interviene sobre los núcleos. y La REACCIÓN QUÍMICA se representa, en forma abreviada, mediante una ECUACIÓN QUÍMICA. Dra. Patricia Satti, UNRN REACCIONES QUÍMICAS y El signo = se reemplaza por y su significado es “se transforma en”. Dra. Patricia Satti, UNRN REACCIONES QUÍMICAS La ecuación química y En la ecuación se trata de incorporar el máximo de información posible. Una Ecuación química es una representación simbólica de una Reacción química y El estado en que participan reactantes y productos, se indica en forma abreviada y entre paréntesis inmediatamente después de la fórmula o del símbolo. y Ejemplos. CH4 + 2 O2 → CO2 + 2 H2O y En la e.q. tanto los REACTANTES como PRODUCTOS se representan mediante la FÓRMULA del compuesto ó el SÍMBOLO del elemento. Dra. Patricia Satti, UNRN REACCIONES QUÍMICAS y La ecuación debe escribirse en forma balanceada. Esto requiere que para cada elemento se cumpla: H2O (l) anteponiendo a cada FÓRMULA un N° que permita cumplir con el requisito indicado en el punto anterior. Dra. Patricia Satti, UNRN REACCIONES QUÍMICAS H2O (s) H2SO4(aq) donde (s) o con una flecha hacia abajo (↓) = sólido; (l)= líquido; (g) o con una flecha hacia arriba (↑) = gas (aq) ó (ac) = en solución acuosa Dra. Patricia Satti, UNRN REACCIONES QUÍMICAS ¿Qué información nos da la ecuación química? N2 (g) 1 moléc. de N2 2 át. de Nitróg 28 uma de N2 y El balance de una e.q. se logra CO (g) + 3 H2 (g)→ 3 moléc. de H2 6 át. de Hidróg 6 uma de H2 2 NH3 (g) 2 moléc. de NH3 2 át. de Nit y 6 át. de Hid 34 uma de NH3 y Se conserva la masa y la cantidad de átomos de cada tipo. y También puedo hacer “relaciones cruzadas”: y 28 uma de N2 reaccionan con 6 átomos de hidrógeno para dar 2 moléculas de NH3 y Todo esto es a nivel MICROSCÓPICO Dra. Patricia Satti, UNRN REACCIONES QUÍMICAS A nivel macroscópico N2 (g) + 3 H2 (g)→ y El balance de una ecuación química se logra 2 NH3 (g) 1 mol de moléc. de N2 3 moles de moléc. de H2 2 moles de moléc. de NH3 6,022 x 1023 moléc. de N2 3 x 6,022 x 1023 moléc. de H2 28 g de N2 6 g de H2 22,4 L de N2 (en CNPT) 3 x 22,4 L de H2 (en CNPT) 2 x 6,022 x 1023 moléc. de NH3 34 g de NH3 2 x 22,4 L de NH3 (en CNPT) yTambién acá puedo hacer relaciones cruzadas y Lo que no puedo es mezclar el nivel micro con el nivel macro Dra. Patricia Satti, UNRN REACCIONES QUÍMICAS + O2 (g) → reactivos (o reactantes) H2O (g) + Dra. Patricia Satti, UNRN REACCIONES QUÍMICAS Balanceo de ecuaciones (tanteo) La ecuación química C4H10 (g) anteponiendo a cada FÓRMULA un N°que permita cumplir con el requisito del punto anterior. y Este número, en general, se determina “ensayando”(Por tanteo) y en casos más complicados se recurre a métodos específicos para balancear ecuaciones. y Una vez balanceada la ecuación es necesario saber INTERPRETARLA para poder realizar los cálculos cuantitativos. CO2 (g) productos monóxido de nitrógeno + oxígeno → dióxido de nitrógeno Paso 1: Escriba la reacción usando símbolos químicos. NO2 Ecuación balanceada NO 2 C4H10 (g) + 13 O2 (g) → 10 H2O (g) + 8 CO2 (g) O2 NO NO2 Coeficientes estequiométricos. Indican la proporción en moles o en moléculas, NO EN GRAMOS Dra. Patricia Satti, UNRN REACCIONES QUÍMICAS 2 NO + 1 O2 → 2 NO2 Paso 2: Balancee la ecuación química. Dra. Patricia Satti, UNRN REACCIONES QUÍMICAS y Ej.1: escribir y equilibrar la reacción que muestre la combustión del gas propano (C3H8) en el aire. En esta reacción el propano reacciona con oxígeno y se produce agua y dióxido de carbono Recomendaciones para balancear y No introduzca átomos “extraños” para balancear. NO + O2 → NO2 + O 5 O2 (g) → 48H2O (g) + 63 CO2 (g) 2 C3H8 (g) + 10 y No cambie fórmulas tratando de balancear la ecuación. NO + O2 → NO23 y Balancee primero, los elementos que aparecen en sólo un compuesto en cada lado de la ecuación. y Balancee los elementos libres por último. Dra. Patricia Satti, UNRN REACCIONES QUÍMICAS Interpretación cuantitativa de la ecuación anterior: 1 mol de C3H8(g) reaccionan completamente con 5 moles de O2(g) para producir: 3 moles de CO2(g) y 4 moles de H2O(g) Mientras no se especifique otra cosa, la reacción se supondrá COMPLETA , ES DECIR QUE OCURRE EN UN 100% Dra. Patricia Satti, UNRN REACCIONES QUÍMICAS Dra. Patricia Satti, UNRN REACCIONES QUÍMICAS Balance Ejemplo 2 y El óxido nítrico, NO, se forma a partir de N2 y de O2. y Esta reacción ocurre en motores de combustión, hornos de soplado, en tormentas eléctricas y cada vez que el aire se calienta fuertemente. y Para la reacción de formación del óxido nítrico: y a) identifique reactantes y producto y b) escriba la ecuación (balanceada) y c) interprétela en términos de: y y y partículas (moléculas o átomos) moles masa Dra. Patricia Satti, UNRN REACCIONES QUÍMICAS Balance Ejemplo 3 c) Interpretación de la ecuación y En el flash de una cámara fotográfica y Los números que preceden las fórmulas en la ecuación química se denominan COEFICIENTES ESTEQUIOMÉTRICOS. Dra. Patricia Satti, UNRN REACCIONES QUÍMICAS ocurre el siguiente cambio: un alambre de magnesio reacciona con oxígeno y produce óxido de magnesio. A consecuencia de este cambio se produce un calentamiento del sistema y una iluminación. Describa la ecuación completa de la reacción Dra. Patricia Satti, UNRN REACCIONES QUÍMICAS c) Interpretación de la ecuación Dra. Patricia Satti, UNRN REACCIONES QUÍMICAS Dra. Patricia Satti, UNRN REACCIONES QUÍMICAS Tipos de reacciones químicas y La clasificación de las reacciones químicas en general no es excluyente, por eso una reacción química puede a veces ser incluida en varios de los tipos de la clasificación. En la mayoría de los textos, las reacciones se clasifican en Reacciones químicas y Reacción de Simple Desplazamiento y Reacción de Doble Desplazamiento y Reacción de Combinación o Síntesis y Reacción de Descomposición Dra. Patricia Satti, UNRN 25 REACCIONES QUÍMICAS Tipos de reacciones químicas Dra. Patricia Satti, UNRN REACCIONES QUÍMICAS Simple Desplazamiento y Un elemento desplaza a otro elemento en un compuesto: Simple Desplazamiento Zn + 2 HCl ZnCl2 + H2 Doble Desplazamiento Dra. Patricia Satti, UNRN REACCIONES QUÍMICAS Dra. Patricia Satti, UNRN REACCIONES QUÍMICAS Serie de actividad Simple Desplazamiento y En las reacciones de simple desplazamiento un metal en estado fundamental o no combinado desplaza a otro metal de un compuesto debido a que tiene una mayor actividad química. y Serie de Actividad: y Es una serie de metales “acomodados” por orden de reactividad química. y Los metales por debajo del hidrógeno en la serie de actividad no reaccionan con ácidos. Dra. Patricia Satti, UNRN REACCIONES QUÍMICAS Aplicación del concepto de actividad y Metales activos: Incluye la mayoría de metales de los grupos I, II. y Los elementos más activos desplazan de los compuestos a los menos activos. Zn(s) + CuCl2(ac) Cu(s) + ZnCl2(ac) Cu(s) + ZnCl2(ac) Zn(s) + CuCl2(ac) Zn(s) + HCl(ac) H2(g) + ZnCl2(ac) Más activo K Na Ca Mg Al Zn Fe Ni Sn Pb H Cu(s) + HCl(ac) Cu Ag Au H2(g) + CuCl2(ac) Dra. Patricia Satti, UNRN REACCIONES QUÍMICAS y Metal y una solución acuosa Cu(s) + metal1 2AgNO3(ac → solución acuosa1 2Ag(s) + metal2 Cu(NO3)2(ac) solución acuosa2 Li> K> Ba> Sr> Ca> Na y Los metales activos reaccionan directamente con el agua: → 2NaOH(ac) + H2(g) 2Na + 2H2O(l) Cl Br I Cl2(g) + NaF(ac) Dra. Patricia Satti, UNRN ácido acuoso ZnSO4(ac) + H2(g) solución acuosa hidrógeno gas y Metal activo y agua Más activo Cl2(g) + 2NaBr(ac) Zn(s) + H2SO4(ac) → metal y Serie de actividad para no-metales: F y Metal y ácido en solución acuosa Ca(s) + 2H2O(l) → 2NaCl(ac) + Br2(l) → No Reaccionan metal REACCIONES QUÍMICAS Dra. Patricia Satti, UNRN agua → Ca(OH)2(ac) + hidróxido de metal H2(g) hidrógeno gas REACCIONES QUÍMICAS Ejemplo: sustitución del hidrógeno del ácido por hierro Dra. Patricia Satti, UNRN REACCIONES QUÍMICAS Sustitución del hidrógeno del agua por el sodio Sustitución de Ag por Cu Dra. Patricia Satti, UNRN REACCIONES QUÍMICAS Doble Desplazamiento y Hay un intercambio entre elementos de dos compuestos: H2SO4 + 2NaOH Dra. Patricia Satti, UNRN REACCIONES QUÍMICAS Dra. Patricia Satti, UNRN NaSO4 + 2H2O REACCIONES QUÍMICAS Reacciones de Neutralización Reacciones de Neutralización y Una reacción de neutralización es un caso especial de reacción de doble desplazamiento. y Una reacción de neutralización es un caso especial de reacción de doble desplazamiento HCl(ac) + NaOH(ac) → NaCl(ac) + H2O(l) y En una reacción de neutralización, un ácido fuerte y una base fuerte reaccionan para formar un compuesto iónico (sal) y agua. Ecuación iónica completa y Según la definición original: ácido – sustancia que libera iones hidrógeno H+. H+(ac)+ Cl-(ac)+ Na+(ac)+ OH-(ac) → Na+(ac)+ Cl-(ac) + H2O(l) y Según la definición original: base – sustancia que libera iones OH-. Ecuación iónica neta HCl(ac) + NaOH(ac) → REACCIONES QUÍMICAS Reacciones de Precipitación y Se produce cuando se mezclan soluciones de dos electrolitos fuertes que reaccionan para formar un sólido insoluble. y Si no se forma un precipitado no hay reacción. Esto se puede preveer de acuerdo a las reglas de solubilidad. AgNO3(ac) + NaCl(ac) → AgCl(s) + NaNO3(aq) Ecuación iónica completa Ag+(ac)+NO3-(ac)+Na+(ac)+ Cl-(ac) → Na+(ac)+NO-3(ac)+ AgCl(S)↓ Ecuación iónica neta H+(ac)+ OH-(ac) → H2O(l) NaCl(ac) + H2O(l) Dra. Patricia Satti, UNRN Iones no participantes o espectadores Dra. Patricia Satti, UNRN REACCIONES QUÍMICAS Reacciones de Formación de gas • Otro tipo de reacción de doble desplazamiento comprende la formación de sustancias no ionizadas, como el agua y el dióxido de carbono. Por ejemplo, cualquier carbonato, aún en estado sólido o en solución acuosa, reacciona con un ácido para formar agua y dióxido de carbono, más una sal, según la siguiente ecuación: CaCO3(ac) + 2HCl(ac) → CaCl2(s) + H2O (l) + CO2(g) Iones espectadores Ag+(ac)+ Cl-(ac) → AgCl(S) ↓ Dra. Patricia Satti, UNRN REACCIONES QUÍMICAS Dra. Patricia Satti, UNRN REACCIONES QUÍMICAS Tipos de reacciones químicas Tipos de reacciones químicas y Reacción de Combinación o Síntesis A+Z → AZ y Reacción de Descomposición AZ → A+Z Combinación yReacción de oxidación-reducción y Ejemplo especial, reacciones de Descomposición combustión Dra. Patricia Satti, UNRN REACCIONES QUÍMICAS REACCIONES QUÍMICAS Óxido Reducción o Redox Óxido Reducción y Hay un intercambio de electrones entre dos compuestos: gana electrones CuSO4 + Zn Dra. Patricia Satti, UNRN ZnSO4 + Cu pierde electrones y Un átomo de alguna de las sustancias que reaccionan cede electrones a un átomo de otra de las sustancias que reaccionan. y Se dice que una sustancia se oxida si pierde electrones. y Se dice que una sustancia se reduce si gana electrones. Fe 0 + 2 HCl → +1 -1 FeCl2 +2 -1 + H22 0 Perdió electrones = se oxidó Ganó electrones = se redujo Dra. Patricia Satti, UNRN REACCIONES QUÍMICAS Dra. Patricia Satti, UNRN REACCIONES QUÍMICAS Óxido Reducción o Redox Óxido Reducción o Redox 3 H2 S + 4 HClO3 → 3 H2SO4 + 4 HCl +1 -2 +1 +5 -2→ +1 +6 -2 +1 -1 y El átomo o grupo de átomos que en una reacción redox cede electrones (se oxida) es el agente reductor ya que provoca la reducción de otra sustancia que toma esos electrones. y El átomo o grupo de átomos que en una reacción redox gana electrones (se reduce) es el agente oxidante ya que hace que otra sustancia se oxide al quitarle electrones. Perdió electrones = se oxidó Ganó electrones = se redujo Fe2O3 + 3 CO → 2 Fe + 3 CO2 5 H2O2 + 2 KMnO4 + 3 H2SO4 → →5 O2 + 2 MnSO4 + K K22SO SO44++ 8 H H22O O Dra. Patricia Satti, UNRN REACCIONES QUÍMICAS Reacciones de combustión y Son ejemplos particularmente importantes de reacciones redox y En una reacción de combustión, el oxígeno reacciona con otra sustancia, desprendiéndose gran cantidad de energía, a menudo en forma de luz y calor CH4 + 2 O2 ⇒ CO2 + 2 H2O 2KMnO KMnO4 + +16 HCl → 2 MnCl2 + 5Cl Cl2 + 8H H2O +2KCl + KCl Dra. Patricia Satti, UNRN REACCIONES QUÍMICAS y Durante nuestra vida estamos acostumbrados a utilizar cobre en monedas, plomería y cables.El cobre se obtiene de minerales sulfurados tales como sulfuro de cobre(I), mediante procesos de varias etapas. y Después de una etapa inicial de molienda, el mineral se tuesta (se calienta fuertemente con oxígeno) para formar un óxido de cobre(I) en polvo y dióxido de azufre gaseoso. El mechero se enciende cuando el gas que contiene reacciona con el oxígeno del aire La combustión completa de un compuesto orgánico siempre da dióxido de carbono y agua Dra. Patricia Satti, UNRN 47 REACCIONES QUÍMICAS Dra. Patricia Satti, UNRN REACCIONES QUÍMICAS y 2 Cu2S(s) + 3 O2(g) → 2 Cu2O(s) + 2 SO2(g) y Para obtener cobre a partir del mineral mencionado, el óxido de cobre(I) obtenido se hace reaccionar con carbono. y Esta reacción produce cobre y monóxido de carbono. Combinación y 2 sustancias (elementos o compuestos) se combinan para formar un compuesto: 2H2 + O2 Dra. Patricia Satti, UNRN REACCIONES QUÍMICAS Dra. Patricia Satti, UNRN REACCIONES QUÍMICAS y Cuando hay una reacción de combinación entre un metal y un no metal, como en esta ecuacion el producto es un sólido iónico. y Hay muchos ejemplos de estas reacciones, por ejemplo, el Mg metálico arde en aire con mucho brillo para producir óxido de magnesio, 2 Mg(s) + O2(g) → 2MgO(s) y Esta reacción es la que ocurre en el flash de una cámara fotográfica: un alambre de magnesio reacciona con oxígeno y produce óxido de magnesio. A consecuencia de este cambio se produce un calentamiento del sistema y una iluminación. Dra. Patricia Satti, UNRN 2H2O REACCIONES QUÍMICAS y En este caso cuando el magnesio reacciona con oxígeno, el magnesio pierde electrones y forma el ion magnesio, Mg2+. El oxígeno gana electrones y forma el ion óxido, O2-. y Además de una combinación es una reacción de óxido reducción Dra. Patricia Satti, UNRN REACCIONES QUÍMICAS Combinación de yodo con zinc y No-metal y oxígeno gaseoso: S(s) + O2(g) → SO2(g) no-metal + oxígeno gas → óxido de no-metal El producto es un compuesto binario. Otros ejemplos N2(g) + 3H2(g) → 2NH3(s) CaO(s) + H2O(l) → Ca(OH)2(s) yodo Dra. Patricia Satti, UNRN REACCIONES QUÍMICAS zinc Yoduro de zinc Dra. Patricia Satti, UNRN REACCIONES QUÍMICAS Descomposición – Particularidades Descomposición 1) DESCOMPOSICIÓN TÉRMICA y Un compuesto se descompone en partes (la energía absorbida se suministra mediante calor) 2H2O 2H2 + O2 2 Ag2O (s) Î 4 Ag (s) + O2 (g) 2) DESCOMPOSICIÓN ELECTROLÍTICA (la energía absorbida se suministra mediante electricidad) 2 H2O (l) Î 2H2 (g) + O2 (g) Dra. Patricia Satti, UNRN REACCIONES QUÍMICAS Dra. Patricia Satti, UNRN REACCIONES QUÍMICAS DESCOMPOSICIÓN TÉRMICA y Muchos compuestos sufren reacciones de descomposición cuando se calientan. Por ejemplo, muchos carbonatos metálicos se descomponen por calor para formar óxidos metálicos y dióxido de carbono. yLa descomposición del CaCO3 o caliza es un proceso comercial importante. Las conchillas de moluscos o la piedra caliza se calientan para preparar CaO. CaCO3(s) → CaO(s) + CO2(g) Otros ejemplos 2KClO3(s) → 2KCl(s) + 3O2(g) PbCO3(s) → PbO(s) + CO2(g) Cu(OH)2(s) → CuO(s) + H2O(l) Dra. Patricia Satti, UNRN yEl consumo de cal viva se utiliza, por ejemplo, en la fabricación de vidrio que se obtiene por fusión a aprox. 1500°C de arena de sílice (SiO2), carbonato de sodio (NaCO3) y caliza REACCIONES QUÍMICAS y La descomposición de azida de sodio desprende rápidamente nitrógeno gaseoso, por esto esta reacción se usa para inflar las bolsas de aire de seguridad de los automóviles. Dra. Patricia Satti, UNRN REACCIONES QUÍMICAS DESCOMPOSICIÓN ELECTROLÍTICA 2NaN3(s) → 2Na(s) + 3N2(g) yEl sistema está diseñado de forma que un impacto cause el encendido de un casquillo detonador, que a su vez hace que la azida se descomponga explosivamente. yUna cantidad pequeña de azida (aproximadamente 100 g) forma una cantidad grande de gas (unos 50 L) Dra. Patricia Satti, UNRN REACCIONES QUÍMICAS Dra. Patricia Satti, UNRN REACCIONES QUÍMICAS