La termodinámica, fija su atención en los intercambios de energía
Anuncio
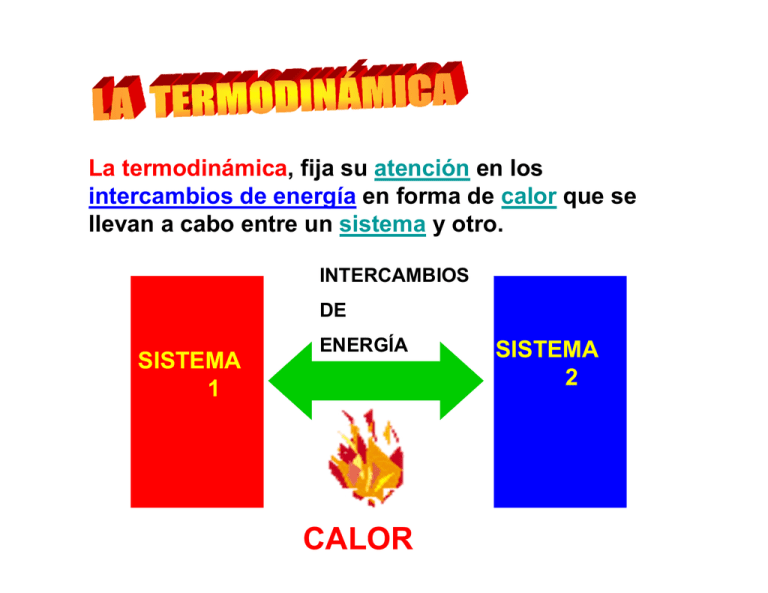
La termodinámica, fija su atención en los intercambios de energía en forma de calor que se llevan a cabo entre un sistema y otro. INTERCAMBIOS DE SISTEMA 1 ENERGÍA CALOR SISTEMA 2 LA TERMODINÁMICA Basa su análisis en LEYES que son LEY CERO 1º LEY DE LA TERMODINÁMICA 2º LEY DE LA TERMODINÁMICA LE Y C E R O “Si tenemos dos cuerpos llamados A y B, con diferente temperatura uno de otro, y los ponemos en contacto, en un tiempo determinado t, estos alcanzarán la misma temperatura, es decir, tendrán ambos la misma temperatura.” EN TIEMPO t A Alcanzarán = TEMPERATURA B LE Y C E R O “Si luego un tercer cuerpo, que llamaremos C se pone en contacto con A y B, también alcanzará la misma temperatura y, por lo tanto, A, B y C tendrán la misma temperatura mientras estén en contacto” A B C = TEMPERATURA MIENTRAS ESTÉN EN CONTACTO 1º LEY DE LA TERMODINÁMICA “La energía no se crea ni se destruye, sino que, durante un proceso solamente se transforma en sus diversas manifestaciones” Se refiere al concepto de energía interna, trabajo y calor. Si sobre un sistema con una determinada energía interna, se realiza un trabajo mediante un proceso, la energía interna del sistema variará. ENERGÍA INTERNA EL TRABAJO SISTEMA Hace variar su A la diferencia de la energía interna del sistema y a la cantidad de trabajo le denominamos calor. El calor es la energía transferida al sistema por medios no mecánicos. SISTEMA El trabajo y el calor no son más que diferentes manifestaciones de energía Trabajo sobre el sistema RECIPIENTE DE VIDRIO CON AGUA TEMPERATURA CALOR 2 º LEY DE LA TERM O DINÁM ICA "No existe un proceso cuyo único resultado sea la absorción de calor de una fuente y la conversión íntegra de este calor en trabajo". Clausius, ingeniero francés, también formuló un principio para la Segunda ley: "No es posible proceso alguno cuyo único resultado sea la transferencia de calor desde un cuerpo frío a otro más caliente" Metabolismo Celular Catabolismo Anabolismo (Degradación) (Síntesis) Energía Procesos Metabólicos Objetivos Crecimiento Reparación Mantenimiento Del Organismo El anabolismo se comporta como un metabolismo constructivo o positivo, ya que es fundamental para el mantenimiento de todos los tejidos y para el crecimiento de células nuevas. Por otra parte, se obtiene energía de reserva para ser utilizada cuando sea necesario Catabolismo Son los procesos donde las células descomponen o “degradan” las macromoléculas de carbohidratos, grasas y proteínas y las transforman en sustancias más simples. De esa forma se libera la energía almacenada en ellas y puede utilizarse como combustible para realizar las distintas funciones orgánicas como, por ejemplo, mantener la temperatura normal del cuerpo, respirar o caminar. Definición • Es una magnitud • Es el grado de que mide la parte de desorden que la energía que NO poseen las puede utilizarse moléculas que para producir un integran un cuerpo. TRABAJO. Bolitas separadas por divisiones Quito una división……Quito un º o índice de restricción AUMENTA LA ENTROPÍA Quito otra división……Quito otro º ó índice de restricción La entropía de este sistema ha aumentado al ir quitando las restricciones pues inicialmente había un orden establecido y al final del proceso (el proceso es en este caso el quitar las divisiones de la caja) no existe orden alguno dentro de la caja. La entropía es en este caso una medida del orden (o desorden) de un sistema o de la falta de grados de restricción. ENTROPÍA ENTROPÍA ENTROPÍA INICIAL FINAL LA ENTROPÍA LA PODEMOS DEFINIR ENTONCES COMO EL CAMBIO DE CONDICIONES DE UN SISTEMA LA ENTROPÍA ES UN PROCESO IRREVERSIBLE ¿Para qué me sirve el concepto de Entropía? Como concepto importante en los problemas del rendimiento energético del CUERPO HUMANO Es la cantidad de energía que un sistema puede intercambiar con su entorno. Entalpía (del griego thalpein calentar), tal palabra fue acuñada en 1850 por el físico alemán Clausius. La entalpía es una magnitud de termodinámica simbolizada con la letra H. La variación de entalpía expresa una medida de la cantidad de energía absorbida o cedida por un sistema termodinámico, o, lo que es lo mismo, la cantidad de energía que tal sistema puede intercambiar con su entorno. Usualmente la entalpía se mide, dentro del Sistema Internacional de Unidades, en joules. La entalpía se define mediante la siguiente fórmula: H=U+pV Donde: •U es la energía interna. •p es la presión del sistema. •V es el volumen del sistema.











