optasid prosp.2
Anuncio

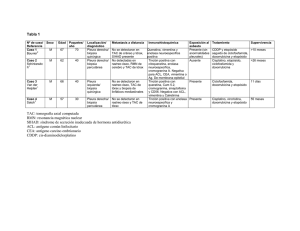
OPTASID ETOPOSIDO Venta bajo receta archivada Industria Japonesa Inyectable COMPOSICION Cada ampolla contiene: Etopósido..........................................................................................................................100 mg Alcohol bencílico...............................................................................................................150 mg Polietilenglicol 300..........................................................................................................3250 mg Acido cítrico........................................................................................................................10 mg Polisorbato 80...................................................................................................................400 mg Etanol absoluto c.s.p............................................................................................................5 ml ACCION TERAPEUTICA Citostático. INDICACIONES OPTASID®, combinado con otros agentes quimioterápicos, está indicado para el tratamiento de los tumores testiculares refractarios previamente tratados quirúrgica, quimio o radioterapéuticamente y como tratamiento del carcinoma pulmonar de células pequeñas. ACCION FARMACOLOGICA El efecto predominante de OPTASID® es la inhibición de la síntesis de ADN. El etopósido actúa en la porción G2 del ciclo celular en células de mamíferos y además, detiene la metafase de fibroblastos de pollo. Según la dosis de etopósido, se observan dos tipos de respuesta: con altas concentraciones (≥10 µg/ml) se observa la lisis de las células que entran en mitosis, mientras con bajas concentraciones (0,3 a 10 µg/ml), las células son inhibidas cuando entran en la profase. FARMACOCINETICA La administración intravenosa de etopósido registra una disponibilidad bifásica con una vida media de distribución de alrededor de 1,5 horas y una vida media terminal de 4 a 11 horas. El clearance total varía entre 33 y 48 ml/min ó 16 a 36 ml/min/m2 y, como la vida de eliminación terminal, son independientes de la dosis por encima de 100 a 600 mg/m2. Los valores de ABC y Cmáx también aumentan linealmente con la dosis y el etopósido no se acumula en el plasma con dosis de 100 mg/m2 durante 4 ó 5 días. El volumen promedio de distribución en estado estable es de 18 a 29 litros o de 7 a 17 l/m2. El etopósido atraviesa poco la barrera hematoencefálica y sus concentraciones en tumores cerebrales son inferiores a las de tumores de otros órganos y en el plasma. Las concentraciones de etopósido son superiores en el pulmón normal que en las metástasis pulmonares, aunque son similares en el miometrio normal o tumoral. La unión proteica del etopósido es alta (97%), desplazable únicamente por fenilbutazona, salicilato sódico y aspirina. Del 42 al 67% de etopósido administrado por vía intravenosa se recupera en la orina y entre ® 0 y 16% en las heces; la recuperación urinaria es del 8 a 35% las primeras 24 horas (55% en los niños), menos del 50% en forma de etopósido. El clearance renal promedio de etopósido es de 7 a 10 ml/min/m2 ó 35% del clearance corporal total por encima de un rango de dosis de 80 a 600 mg/m2. De este modo, el etopósido es depurado por mecanismos renal y extrarrenal, principalmente el metabolismo y menos significativamente (6%), la excreción biliar. En los adultos, el clearance de etopósido tiene relación con el clearance de creatinina, las concentraciones de albúmina sérica y el clearance no renal. En los niños, los niveles elevados de TGP sérica se asocian con reducciones del clearance total. POSOLOGIA Y FORMA DE ADMINISTRACION OPTASID® debe administrarse únicamente en forma lenta, por vía intravenosa. La dosis indicada se debe diluir en solución fisiológica o dextrosa al 5% hasta lograr una concentración de 0,4 mg/ml o menor, preferentemente 0,25 mg/ml. La administración debe durar más de 30 minutos (preferentemente 60 minutos) y sólo aplicarse por vía intravenosa. La extravasación puede provocar necrosis tisular. La dosis habitual de OPTASID® combinado con otros agentes quimioterápicos para tratar el cáncer testicular es de 50 a 100 mg/m2/día durante 5 días, ó 100 mg/m2/día en días alternos 1, 3 y 5 del ciclo. La dosis para tratar el carcinoma pulmonar de células pequeñas es de 35 mg/m2/día durante 4 días ó 50 mg/m2/día durante 5 días de duración del ciclo. Los ciclos de quimioterapia deben repetirse con intervalos de 3 a 4 semanas para permitir la adecuada recuperación de cualquier manifestación de toxicidad. La dosis total por ciclo de tratamiento no debe exceder los 400 mg/m2 por vía intravenosa. La repetición de los ciclos y el ajuste de la dosis dependen del criterio médico. La medicación es estable a la temperatura ambiente en solución de dextrosa o en solución fisiológica, en concentraciones de 0,2 mg/ml durante 72 horas y en concentraciones de 0,4 mg/ml durante 4 horas como mínimo. Soluciones más concentradas, como ser 1 mg/ml, forman cristales y no deben ser administradas. La dosificación debe ajustarse teniendo en cuenta los efectos depresores medulares de los tratamientos concomitantes, quimio o radioterapéuticos. CONTRAINDICACIONES Hipersensibilidad conocida al medicamento. Disfunción hepática grave. Embarazo. Lactancia. ADVERTENCIAS La toxicidad más importante causada por etopósido es la depresión de la médula ósea, razón por la cual deben efectuarse exámenes hematológicos al comenzar la terapia y previo a cada uno de los posteriores ciclos, evaluando plaquetas, hemoglobina y leucocitos. Ante un descenso de las plaquetas a menos de 50.000/mm3 o de los neutrófilos por debajo de los 500/mm3, se debe interrumpir el tratamiento hasta la recuperación hematológica. Se recomienda precaución por la producción de reacciones anafilácticas, como fiebre, escalofríos, taquicardia, broncoespasmo, disnea e hipotensión, que indican la discontinuación de la terapia y la administración del tratamiento correspondiente (agentes presores, corticoides, antihistamínicos, expansores de la volemia, etc.). El etopósido es mutagénico y teratogénico, por ello, para la administración durante el embarazo debe evaluarse atentamente la relación riesgo-beneficio de su aplicación. PRECAUCIONES Generales. En todos los casos, antes de iniciar la terapia con OPTASID® o repetir cada uno de los ciclos, se deben evaluar los potenciales beneficios y riesgos de reacciones adversas que, en su mayoría, revierten con la discontinuación de la terapia cuando se detectan precozmente. Pruebas de laboratorio. Se recomiendan controles hematológicos en estado basal y después de cada uno de los ciclos del tratamiento. Carcinogénesis, mutagénesis, compromiso de la fertilidad. El etopósido es potencialmente carcinogénico en humanos. Raramente se informaron casos de leucemia aguda con fase preleucémica en pacientes tratados con etopósido. El potencial mutagénico y genotóxico del etopósido fue demostrado en células de mamífero ocasionando aberraciones en el número y estructura de los cromosomas en células embrionarias de roedores y hematopoyéticas humanas. Embarazo. En estudios de experimentación, el etopósido aumentó la incidencia de muertes intrauterinas y malformaciones fetales, y también disminuyó el peso fetal total. Evaluar relación riesgo/beneficio de su administración. Lactancia. Se desconoce si el etopósido es excretado en la leche materna humana pero, por su potencial de generar reacciones adversas serias, deben considerarse las prioridades y decidir la suspensión de la lactancia o de la terapia. Pediatría. No se determinaron la eficacia y seguridad de su uso en niños. La inyección de OPTASID® contiene polisorbato 80 entre sus excipientes, sustancia que demostró causar en prematuros, un síndrome de riesgo caracterizado por insuficiencia renal y hepática, deterioro pulmonar, trombocitopenia y ascitis. REACCIONES ADVERSAS Hematológicas. Frecuentes: depresión de la médula ósea con anemia, leucopenia, trombocitopenia. Gastrointestinales. Frecuentes: náuseas, vómitos, diarreas. Ocasionales: dolor abdominal, estomatitis, constipación, disfagia, disfunción y toxicidad hepática. Cardiovasculares. Raras: hipotensión arterial. Alérgicas. Ocasionales: rash, urticaria y/o prurito, fiebre, escalofríos, taquicardia, broncoespasmo, disnea y/o hipotensión arterial. Raras: edema facial y lingual, tos, diaforesis, cianosis, constricción de la garganta, laringoespasmo, dorsalgia, pérdida de la conciencia, rash máculopapular con perivasculitis. Piel y anexos. Frecuente: alopecia reversible, pigmentación SOBREDOSIFICACION No se conocen antídotos para la sobredosificación de etopósido. Ante la eventualidad de una sobredosificación, concurrir al Hospital más cercano o comunicarse con los centros de Toxicología: HOSPITAL DE PEDIATRIA RICARDO GUTIERREZ: (011) 4962-6666/2247. HOSPITAL ALEJANDRO POSADAS: (011) 4654-6648/4658-7777. PRESENTACION OPTASID® inyectable para uso intravenoso se presenta en envases con 1 ampolla de 5 ml. CONDICIONES DE CONSERVACION Y ALMACENAMIENTO Manténgase a temperaturas inferiores a 25°C y al abrigo de la luz. "Este medicamento debe ser usado exclusivamente bajo prescripción y vigilancia médica y no puede repetirse sin nueva receta médica". NO DEJE MEDICAMENTOS AL ALCANCE DE LOS NIÑOS INSTRUCCIONES PARA LA APERTURA DE LA AMPOLLA 1 Sostener con una mano la ampolla, por el cuerpo, dejando libre y hacia arriba la porción superior que contiene el punto celeste. 2 Con la otra mano tomar la ampolla de forma de asir con el dedo pulgar el punto celeste y presionar ligeramente hacia abajo para cortar la ampolla a nivel del cuello. Gador Al Cuidado de la Vida Gador Elaborado por: Nippon Kayaku Co., Ltd. de Tokio, Japón Representante en la Argentina: Gador S.A. Darwin 429 - C1414CUI - Buenos Aires - Tel: 4858-9000. Directora Técnica: Olga N. Greco - Farmacéutica. Especialidad Medicinal autorizada por el Ministerio de Salud y Ambiente. Certificado N° 38.728 12416501-8