NEFRECTOMÍA LAPAROSCÓPICA DE DONANTE VIVO PARA
Anuncio

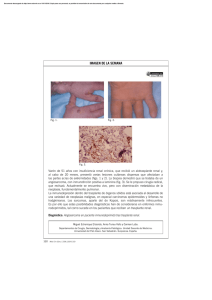
trasplante Arch. Esp. Urol., 57, 10 (1.091-1.098), 2004 NEFRECTOMÍA LAPAROSCÓPICA DE DONANTE VIVO PARA TRASPLANTE RENAL. LOS DOS PRIMEROS AÑOS DE EXPERIENCIA. A. Alcaraz, A. Rosales, J. Palou, J. Caffaratti, M. Montlleó, J. Segarra, J. Ponce de León, J. Huguet, C. Errando, JM. Díaz, L. Guirado y H. Villavicencio. Servicios de Urología y Nefrología. Fundació Puigvert. Barcelona. España. Correspondencia Resumen.- OBJETIVO: La cirugía laparoscópica ofrece ventajas potenciales a la hora de disminuir el dolor postoperatorio, menor estancia hospitalaria, más rápida convalecencia y unos mejores resultados cosméticos. Estas ventajas pueden hacer aumentar la donación renal, haciendo que esta donación sea aceptada por más candidatos. MÉTODOS: Exponemos nuestra experiencia en los 2 primeros años (marzo de 2002 a febrero de 2004) en trasplante renal de donante vivo con riñón obtenido mediante nefrectomía laparoscópica. Se analizan los resultados de los primeros 38 procedimientos. La técnica quirúrgica utilizada es la nefrectomía laparoscópica transperitoneal. Se utilizan cuatro puertos para la cirugía, tres de ellos colocados al inicio de la Antonio Alcaraz Asensio Servicio de Urología. Fundació Puigvert C/ Cartagena, 340 08025 Barcelona. (España) e-mail: aalcaraz@fundacio-puigvert.es Trabajo recibido: 30 de agosto 2004 misma, habitualmente, dos de 10-12mm y uno de 5mm. El riñón es obtenido al final de la cirugía a través de una incisión de 6,5 cm en línea media periumbilical. RESULTADOS:La supervivencia, tanto de donante como de receptor, es del 100%. La supervivencia del injerto trasplantado es del 97,6%. No hemos presentado ningún caso de retraso en la función inicial del injerto. Donante: El tiempo medio actual es de 161 minutos (115-260). La pérdida hemática media ha sido de 270ml (1001200). En tres casos, fue necesario trasfundir al paciente 2 concentrados de hematíes. La estancia media fue de 5,1 días (3-11). El tiempo medio de nuestra serie de isquemia-caliente fue de 3,2 min (210). En cuatro casos, fue necesario reconvertir la cirugía laparoscópica a cirugía abierta. Receptor: Hemos presentado tres complicaciones de importancia que requirieron su resolución quirúrgica: un bajo flujo arterial, 1 fístula uretero vesical y 1 estenosis de uretra media. Función renal inicial: A partir del primer mes (creatinina media 147nmol/l) aunque con tendencia a mejorar, siendo la función renal al año (creatinina media 126nmol/l) la que consideramos óptima post-trasplante. Las cifras de creatinina media en el primer día postoperatorio de 192 mmol/l y el nadir de creatinina en el segundo día con cifras de 152 mmol/l. CONCLUSIÓN: Pensamos que la nefrectomía laparoscópica de donante vivo es una alternativa real a la nefrectomía por cirugía abierta, al ser una técnica con mejor recuperación para el donante y con igual capacidad de preservar la función renal en el receptor. 1.092 A. Alcaraz, A. Rosales, J. Palou y cols. Palabras clave: Trasplante renal. Donante vivo. Nefrectomía laparoscópica. Summary.- OBJECTIVES: Laparoscopic surgery offers potential advantages in terms of diminishment of postoperative pain, shorter hospital stay, faster convalescence, and better cosmetic results. These advantages may increase kidney donation, making donation be accepted by more candidates. We report our first 2 years` experience with laparoscopic donor nephrectomy. METHODS: Between March 2002 and February 2004 we performed 38 laparoscopic living donor nephrectomies for kidney transplantation. The technique of choice was the transperitoneal laparoscopic approach with four trocars, usually three of them from the start of the procedure —two 10-12 mm and one 5 mm—, and a 6.5 cm perumbilical midline incision for kidney retrieval at the end of the procedure. RESULTS: Receptor and donor survivals were 100%. Graft survival was 97.6%. There was not any case of delayed graft function. Donor: Mean operative time was 161 minutes (115260). Mean estimated blood loss was 270 ml (1001200). Three patients required blood transfusions, 2 units of packed red blood cells each. Mean hospital stay was 5.1 days (3-11). Mean warm ischemia time was 3.2 min. (2-10). Conversion to open surgery was necessary in four cases. Receptor: there have been three significant complications requiring surgical repair: one case of low arterial flow, one vesico ureteral leak, and one midurethra stenosis. Initial renal function: mean serum creatinine at one month was 147mmol/l, with a trend to improve to 126 mmol/l at one year, which is considered optimum. First postoperative day mean serum creatinine was 192mmol/l and the nadir was on second postoperative day with a value of 152mmol/l. CONCLUSIONS: We believe laparoscopic living donor nephrectomy is a real alternative to open surgery because it offers better recovery to the donor with the same capacity to preserve renal function in the receptor. Keywords: Kidney trasplant. Living donor. Laparoscopic nephrectomy. INTRODUCCIÓN El trasplante renal es el único tratamiento existente para la insuficiencia renal terminal que permite al paciente un estilo de vida sin diálisis. Por otra parte, mejora la expectativa de vida de los pacientes con insuficiencia renal menores de 70 años. El trasplante a partir de un riñón procedente de un donante vivo obtiene mejores resultados que el trasplante renal de riñón procedente de cadáver, tanto en lo que se refiere a la supervivencia del injerto como a la supervivencia del paciente (1). El trasplante renal de donante vivo tiene mejor relación coste-efectividad que el trasplante con riñón procedente de cadáver o la diálisis (2). Schweitzer et al (3) han calculado que el trasplante renal de donante vivo sin complicaciones es más rentable económicamente que la diálisis a partir de los 1,7 años. Durante la última década, ha habido un interés creciente por la técnicas quirúrgicas minimamente invasivas, siendo sustituidos procedimientos agresivos por otras técnicas menos mórbidas, tales como la laparoscopia. Este tipo de cirugía laparoscópica, ofrece ventajas potenciales a la hora de disminuir el dolor postoperatorio, menor estancia hospitalaria, más rápida convalescencia y unos mejores resultados cosméticos. Estas ventajas de la cirugía laparoscópica pueden hacer aumentar la donación renal, haciendo que esta donación sea aceptada por más candidatos. Desde la irrupción de la laparoscopia en la nefrectomía del donante vivo, en el centro pionero de la misma, Johns Hopkins, el inicio de este programa ha supuesto triplicar la donación de vivo. Dos tercios de los donantes de este centro, declaran haber sido influidos por el hecho de que la donación fuera realizada a través de la cirugía laparoscópica. Kuo y Jonhson (4) demuestran como la laparoscopia es la mayor responsable de este incremento de donaciones, de manera que el 47% de los donantes, únicamente lo fueron por el hecho de que la cirugía fuera laparoscópica. En 1995, la primera nefrectomía laparoscópica de donante fue realizada con éxito en el Hospital Johns Hopkins (5). En este momento, esta técnica ha sido adoptada en múltiples centros en Estados Unidos y en Europa. En España, la primera nefrectomía de donante vivo realizada por un grupo exclusivamente urológico, fue el 13 de marzo de 2002 en la Fundació Puigvert de Barcelona, dos días después de la realiza- NEFRECTOMÍA LAPAROSCÓPICA DE DONANTE VIVO PARA TRASPLANTE RENAL. LOS DOS PRIMEROS AÑOS DE EXPERIENCIA. da en el Hospital Clínic de Barcelona por un equipo multidisciplinario. La justificación máxima del inicio de este programa es la disminución de nuestra lista de espera y, por tanto el tiempo en ella en espera de un trasplante, que actualmente es cercano a los 3 años. Por otra parte, nos permite el trasplante en un subgrupo de pacientes jóvenes que por la actual distribución etaria de los donantes de cadáver es más difícil que puedan ser trasplantados. Un último motivo para el desarrollo del programa de donante vivo, es la posibilidad de incluir en trasplante a paciente prediálisis, que sin duda son los pacientes en que se obtienen mejores resultados a largo plazo. 1.093 en el lado izquierdo que en lado derecho, debido a que es necesario la retracción del hígado para la exposición del riñón derecho. A este hecho, es necesario añadir que la longitud de vena que se puede obtener en el lado izquierdo es superior, debido a la dificultad técnica que representa el obtener un rodete de cava en la extracción del riñón derecho mediante la técnica laparoscópica. Por este motivo, en nuestra serie, solamente hemos realizado la nefrectomía derecha para donación en dos casos. Incluso en el caso de que encontremos un pedículo doble en el lado izquierdo, preferimos la nefrectomía del riñón izquierdo a la del riñón derecho, por la mayor longitud de vena que obtendremos en el mismo. En nuestra serie, hemos trasplantado 6 casos con pedículo múltiple, dos de ellos con tres arterias (ambos pasaron desapercibidos en el estudio con RM). PACIENTES Y MÉTODOS La evaluación del donante para nefrectomía laparoscópica es similar a la evaluación del donante para cirugía abierta. En nuestro centro, empleamos las “Guidelines de la American Society of Trasplantation”, para la evaluación del potencial donante de riñón (6). La única contraindicación relativa para la operación laparoscópica que no existe en el caso de la cirugía abierta es la historia de cirugía mayor en la parte superior del abdomen que pudiera resultar en la presencia de abundante adherencias, haciendo del acceso laparoscópico poco seguro. En nuestra serie actual, no hemos debido excluir a ningún paciente por este motivo. En nuestro centro, se requiere junto a la demostración de un perfecto estado de salud, certificado por un médico ajeno a los Servicios de Nefrología y Urología, la validación de la normalidad psicológica y ausencia de presiones sobre el donante, determinada por el Servicio de Psicología de nuestra Institución. Es condición excluyente el no presentar una perfecta función renal, demostrando un filtrado glomerular superior a 80 ml/min. Asimismo, se realiza por parte del servicio de Urología, el estudio anatómico renal. En los primeros 38 casos, hemos realizado su estudio mediante urografía endovenosa y resonancia magnética vascular (RM). El estudio vascular y urográfico también nos sirve para decidir que riñón utilizar. No obstante, consideramos la nefrectomía laparoscópica más sencilla Durante estos dos primeros años de experiencia (marzo de 2002 a febrero de 2004) en trasplante renal de donante vivo con riñón obtenido mediante nefrectomía laparoscópica, hemos realizado 38 procedimientos. La terapia inmunosupresora utilizada fue el esquema triple de FK (0,05 mg / kg / 12 horas), Micofenolato (1 gr / 12 horas) y Prednisona (1 mg / kg / día). El elevado índice inicial de rechazos nos obligó a aumentar la dosis de FK hasta 0,1 mg / kg / 12 horas (12-15 ng/ml), lo cual nos ha permitido a una frecuencia de rechazo de 15,8%, que consideramos aceptable para un índice de compatibilidades HLA en nuestra serie de 3,3. En nuestra serie utilizamos la heparinización 3 minutos antes del “clipaje” arterial y posterior reversión mediante protamina una vez clipada la arteria, con el objetivo de evitar coagulaciones intrarrenales, como potencialmente pudieron ocurrir en un caso de una isquemia caliente de 10 minutos en nuestra serie. Técnica quirúrgica Describimos a continuación la técnica quirúrgica utilizada en la nefrectomía del riñón izquierdo. El paciente es colocado en posición de lumbotomía, intentando abrir la distancia entre la duodécima costilla y la cresta ilíaca. Se le coloca una sonda de Foley del 16ch. Se administran antibióticos de amplio espectro una hora antes de la cirugía y se colocan dispositivos de compresión intermitente en ambas extremidades inferiores. La anestesia general es utilizada de 1.094 A. Alcaraz, A. Rosales, J. Palou y cols. forma rutinaria. En todos los puntos de presión, son colocados paños para evitar compresiones. Se utilizan cuatro puertos para la cirugía, tres de ellos colocados al inicio de la misma, habitualmente, dos de 10-12mm y uno de 5mm. El riñón es obtenido al final de la cirugía a través de una incisión de 6,5 cm en línea media periumbilical. utilizaremos los diferentes elementos de corte. Estos elementos de corte han ido variando con nuestra experiencia. Al inicio, utilizábamos ultracision, elemento de gran seguridad, y con el cual obtuvimos magníficos resultados. Posteriormente, evolucionamos al empleo de electrobisturí monopolar y la utilización del ligasure, lo cual nos permitió ganar en rapidez. La cirugía comienza marcando la posición de los diferentes puertos (Figura 1), así como dibujando la incisión periumbilical para la obtención del riñón. Por motivos de seguridad para el paciente, preferimos obtener el riñón mediante la introducción de la mano en el momento del clipaje y sección de los vasos. Para ello, utilizamos un dispositivo de mano, con el que dibujamos su circunferencia de forma que no impida la colocación de los puertos. La cavidad peritoneal es insuflada con dióxido de carbono con una presión entre 12 y 15 mm de mercurio. El colon izquierdo, bazo y la cola del páncreas son movilizados medialmente. Es identificada la vena gonádica y el uréter que se diseca hasta la bifurcación de los vasos ilíacos izquierdos. Seguimos la disección de la vena gonádica hasta la vena renal, procediéndose a la ligadura y sección de las venas gonadal y adrenal. Es importante la disección venosa en su máxima longitud y la ligadura o coagulación y sección de las prácticamente constantes venas lumbares. En este momento, procedemos a la sección del uréter y liberación del polo renal inferior progresando en nuestra disección sobre la aorta hasta identificar la arteria renal que es disecada en toda su extensión hasta su embocadura aórtica. Es importante, en este momento, no realizar tracciones sobre la misma que acabarían en el espasmo de la arteria. El primer puerto se coloca en línea paramedia, a nivel del ombligo, desplazado hacia el flanco izquierdo, aproximadamente a 8 cm. Servirá para la colocación de la óptica durante la mayor parte de la cirugía. El puerto donde colocaremos el trócar de 5mm, con el que mayoritariamente utilizaremos la pinza bipolar en nuestra mano izquierda, es colocado en línea paramediana, aproximadamente 10 cm por encima del de la óptica. El tercer puerto será de 10-12 mm, es colocado a la derecha de la óptica, en el cual FIGURA 1. Colocación de los diferentes puertos en la nefrectomía laparoscópica izquierda. Una vez completada la disección vascular, procedemos a la movilización total del riñón. Es en este momento que realizamos la laparotomía media de 6,5 cm e introducimos la mano utilizando un dispositivo de mano (actualmente, el Lap-Disc®). No obstante, en algunos casos no hemos utilizado ningún dispositivo de mano y simplemente la introducimos dentro de la cavidad celíaca. Esta maniobra nos permite la tracción del riñón y aumentar nuestra precisión y seguridad a la hora de “clipar” los vasos. Utilizamos para la ligadura de la arteria, los clips tipo hemolock®. La vena es seccionada con una endo-GIA vascular. Una vez seccionados los vasos, se procede a la extracción del riñón y su perfusión en banco. El tiempo medio de isquemia caliente en nuestra serie ha sido de 3,2 minutos, lo cual es absolutamente comparable a la de las series de cirugía abierta. Se revisa la hemostasia con una presión del neumoperitoneo menor de 10 mm y los puertos son retirados bajo visión directa. Se procede al cierre de la laparotomía media. Dejamos un drenaje aspirativo en la fosa lumbar durante 24 horas. NEFRECTOMÍA LAPAROSCÓPICA DE DONANTE VIVO PARA TRASPLANTE RENAL. LOS DOS PRIMEROS AÑOS DE EXPERIENCIA. Durante la cirugía, es frecuente la necesidad de utilizar un cuarto puerto de 5 mm en el flanco izquierdo a nivel del polo inferior del riñón con el objetivo de poder separar cranealmente el riñón y permitir la mejor disección vascular, así como la posterior liberación de su polo superior. RESULTADOS La supervivencia, tanto de donante como de receptor, es del 100%. La supervivencia del injerto trasplantado es del 97,6%. No hemos presentado ningún caso de retraso en la función inicial del injerto. Sufrimos la pérdida de un riñón en la sexta semana post-trasplante, a las 4 semanas del alta hospitalaria. El paciente sufrió una hemorragia retroperitoneal aguda con inestabilidad hemodinámica que obligó a la trasplantectomía a pesar de ser un riñón funcionante en un estudio mediante TAC realizado una hora antes de dicha cirugía. Donante: En nuestra serie de nefrectomías laparoscópicas de donante vivo hemos ido reduciendo el tiempo quirúrgico de manera que el tiempo medio actual es de 161 minutos (115-260). La pérdida hemática media ha sido de 270 ml (100-1200). En tres casos, fue necesario trasfundir al paciente 2 concentrados de hematíes. La estancia media fue de 5,1 días (3-11). El tiempo medio de nuestra serie de isquemia caliente fue de 3,2 min (2-10). Estos datos son comparables a las series iniciales de las instituciones pioneras en este tipo de nefrectomías de donante vivo (7-10), excepto en la estancia hospitalaria, lo cual atribuimos a las diferencias en los sistemas de salud norteamericano y español. Las complicaciones más importantes en el donante han sido las intraoperatorias. En cuatro casos, fue necesario reconvertir la cirugía laparoscópica a cirugía abierta. En tres de ellos, debido a la pérdida de los clips arteriales una vez seccionada la arteria. El cuarto caso de reconversión se debió a una lesión intraoperatoria de la pared de la vena renal. No han existido complicaciones mayores post-operatorias. Dentro de las complicaciones menores ha habido infecciones de la herida quirúrgica, dos de ellos de la minilaparotomía media y un caso de la incisión subcostal en uno de los pacientes reconvertidos a cirugía abierta. 1. 095 Receptor: En cuanto a los trasplantes renales, han sido realizados en situación heterotópica en su gran mayoría con anastomosis a vasos ilíacos externos y ureteroneocistostomía tipo Ledbetter-Politano con una duración media de 79 minutos (55-220). Las anastomosis vasculares han sido realizadas preservando el riñón en frío entre dos paños que contienen hielo picado, con el objetivo de reducir al máximo el tiempo de isquemia templada inherente a todos los trasplantes. A ello también ha contribuido la rapidez de ejecución del trasplante. La pérdida hemática durante el trasplante ha sido de 240 ml (60-630), sin que en ningún caso fuera preciso trasfundir al paciente. La estancia media fue de 11,4 días (9-22). Hemos presentado tres complicaciones de importancia. En un caso, fue necesaria la revascularización renal exitosa mediante reanastomosis arterial por un bajo flujo del injerto detectado mediante ecodoppler. En otro caso, se presentó una fístula urinaria detectada por alto débito del drenaje por lo que se decidió reintervención a las 8 horas del trasplante realizándose nueva anastomosis ureterovesical que resolvió el caso. Un último caso presentó una estenosis de uréter proximal que tras fracasar su tratamiento endourológico mediante dilatación con balón fue resuelta mediante anastomosis uretero-ureteral utilizando el uréter propio ipsilateral del receptor. Función renal inicial La figura 3 muestra la evolución de la creatinina sérica desde la primera semana hasta el primer año del trasplante, donde se evidencia la estabilización de dicha función renal a partir del primer mes (creatinina media 147nmol/L) aunque con tendencia a mejorar, siendo la función renal al año (creatinina media 126nmol/L) la que consideramos óptima post-trasplante. El número de trasplantes de donante vivo realizados en la Institución de forma previa a la introducción de la nefrectomía laparoscópica era limitado, por lo que no tenemos un grupo control de cirugía abierta para comparar los resultados con los obtenidos con nefrectomía laparoscópica. No obstante, la evaluación de los 6 últimos trasplantes realizados en el periodo 1998-2001, han mostrado cifras de creatinina similares a los 3 meses (creatinina media 143 mmol/L) y al año (creatinina media 136 mmol/L). 1.096 A. Alcaraz, A. Rosales, J. Palou y cols. DISCUSIÓN Las ventajas de la cirugía laparoscópica sobre la abierta en cuanto a la disminución del dolor postoperatorio, menor estancia hospitalaria, menor convalecencia y mejores resultados cosméticos han quedado claramente reflejados en la literatura (1114). Las mayores dudas surgen a la hora de establecer si el riñón obtenido por laparoscopia es en condiciones óptimas de función y si las complicaciones y riesgos de la cirugía laparoscópica justifican su utilización. La primera preocupación en la nefrectomía laparoscópica del donante vivo es la potencial repercusión en la función inicial del injerto. Las dos series iniciales de nefrectomía de donante vivo mostraron una preocupante incidencia de pérdida temprana del injerto (2,9% para la Universidad de Maryland y 5,4% para Johns Hopkins), acompañado de una mayor incidencia de complicaciones ureterales, por encima en ambas series del 10% (15,16). Series publicadas por Nogueira et al (11), por Ratner et al (12) y Stifelman et al (13) mantienen viva la discusión sobre la influencia de la laparoscopia en la función inicial del injerto. Wolf et al (14), en un estudio randomizado y prospectivo, en el cual se analizan los niveles de creatinina diarios durante la primera semana, al mes y a los tres meses, no encontraron diferencias en la función renal del injerto, bien sea el riñón obtenido mediante nefrectomía laparoscópica mano asistida o mediante cirugía abierta. No obstante, lo más importante es que GRAFICO 1: Evolución de la creatinina sérica del receptor desde la primera semana hasta el primer año del trasplante. En rojo, serie laparoscópica (n=38). En naranja, serie con riñones obtenidos mediante cirugía abierta (n=6). ni al principio ni actualmente, se han encontrado diferencias en la función renal a largo término, analizado al año y a los tres años, dependiendo de la forma de extracción renal (laparoscópica o cirugía abierta) (12,17). A la hora de buscar una explicación de porque se producía una peor función inicial del injerto durante los primeros 3 meses del trasplante, la mayor parte de explicaciones se dirigían al efecto del neumoperitoneo en el flujo renal sanguíneo y la repercusión de este en su posterior función. Estudios experimentales indicaron que el neumoperitoneo y su concomitante aumento de presión intraabdominal, disminuían el flujo renal (4, 18-22). Es más, esta disminución del flujo sanguíneo renal es mayor a nivel cortical que a nivel medular, tal y como demostraron Chiu et al (23). (Gráfico 1) El primer paso para obtener una buena función renal inicial es tener isquemias calientes mínimas; en nuestro caso, la isquemia caliente media fue de 3,2 minutos (2-10), así como trabajar con isquemias frías cortas y evitar la isquemia templada preservando el riñón en frío durante el trasplante. Junto con ello, es obligatorio utilizar medidas como la alta infusión endovenosa de cristaloides (3,5 – 4 litros intraoperatoria) (Figura 2), protección renal con manitol y utilización de drogas como dopamina y furosemida de FIGURA 2: Imagen quirúrgica en la que se aprecia la dilatación de la vena renal consecuencia de la alta perfusión endovenosa durante la cirugía, que tiene como objeto contrarrestar el efecto de la presión intraabdominal en el flujo renal. NEFRECTOMÍA LAPAROSCÓPICA DE DONANTE VIVO PARA TRASPLANTE RENAL. LOS DOS PRIMEROS AÑOS DE EXPERIENCIA. 1.097 TABLA I. Serie de trasplante renal de donante vivo con nefrectomía laparoscópica de la Fundació Puigvert. Principales características y complicaciones de la serie. Tiempo medio (min) Sangrado (ml) Estancia (días) Complicaciones Nefrectomía de donante vivo n=38 161 (115-260) 270 (100-1200) 5,1 (3-11) 4 reconversiones por sangrado Trasplante renal n=38 79 (55-220) Cirugía 3 infecciones de herida quirúrgica 1 revascularización por bajo flujo 240 (60-630) 13,4 (9-22) 1 fístula urinaria 1 estenosis ureteral efecto diurético en el donante. Estas medidas intraoperatorias junto con el manejo perioperatorio nos ha permitido que ninguno de nuestros trasplantados haya presentado necrosis tubular aguda. Asímismo, nos ha permitido obtener cifras de creatinina media en el primer día post-operatorio de 192mmol/L y el nadir de creatinina en el segundo día con cifras de 152mmol/L. Estas cifras comparadas con las de centros de referencia como Johns Hopkins son absolutamente competitivas. Es importante destacar que estas alteraciones en la función inicial del injerto se han detectado, fundamentalmente, en las series iniciales. Grupos de gran experiencia, como la Universidad de Maryland (24) proponen una serie de medidas para intentar mejorar este flujo renal durante la cirugía laparoscópica del donante. Las medidas por las que se aboga, es un aumento de la perfusión endovenosa intraoperatoria, medida que posteriormente de forma experimental queda comprobada su eficacia por parte de London et al (20). La segunda medida, es el intento de evitar el espasmo de la arteria renal con la manipulación mediante la utilización de papaverina tópica periarterial. Esta medida también queda comprobada de forma experimental en el estudio de Zacherl (25). A estas medidas se añaden otra serie de maniobras quirúrgicas importantes como son la liberación tardía de la cara posterior renal y evitar tracciones de la arteria renal. Otras maniobras, tales como intentar disminuir la presión intraabdominal pasando de los 15mm mercurio a los 10mm de mercurio, no han demostrado ser de eficacia clínica (26). La segunda gran preocupación a la hora de obtener el riñón para trasplante mediante laparoscopia son las complicaciones quirúrgicas, en especial aquellas complicaciones intraoperatorias graves que en la literatura sajona se califican como “amenazante para la vida”. Es necesario conocer que existe una mortalidad estimada de 0,03%. En cuanto a la frecuencia de complicaciones en general, es conveniente revisar la mayor serie de este tipo de donantes (738 pacientes) publicada por Jacobs y cols. (27) en la cual, las complicaciones no difieren en exceso de las que se pueden tener por vía abierta. Refieren en esta serie la incidencia de 1-2% de reconversiones a cirugía abierta por lesión vascular. Las complicaciones más importantes en el donante en nuestra serie han sido las intraoperatorias (Tabla I). En cuatro casos, fue necesario reconvertir la cirugía laparoscópica a cirugía abierta. Durante los primeros 15 casos utilizábamos los clips metálicos y en dos ocasiones tuvimos que reconvertir la cirugía al producirse pérdida de los mismos con la subsecuente hemorragia. La utilización de estos clips plásticos que simulan el mecanismo de una pinza umbilical (hemolock) nos permiten una mayor seguridad en el manejo de esta nefrectomía. No obstante, en el trasplante número 37, volvimos a perder los clips arteriales. Probablemente, el motivo de estas pérdidas de clips arteriales es la excesiva ambición de conseguir el máximo de arteria para el trasplante renal, por lo que se colocan estos clips muy cerca de la pared aórtica, lo cual facilita su pérdida. 1.098 A. Alcaraz, A. Rosales, J. Palou y cols. Creemos que la extracción del riñón con la mano introducida en la cavidad abdominal es una medida que aporta gran seguridad a la hora de “clipar” y seccionar los vasos del pedículo renal, permitiendo obtener una buena longitud vascular al elongarlos y, sobretodo, un rápido control vascular en caso de pérdida de los clips arteriales. En conclusión, pensamos que la nefrectomía laparoscópica de donante vivo es una alternativa real a la nefrectomía por cirugía abierta, al ser una técnica con mejor recuperación para el donante y con igual capacidad de preservar la función renal en el receptor. No obstante, es necesario conocer que se trata de un procedimiento de cirugía laparoscópica avanzada, que requiere un entrenamiento adecuado y que incluye la capacidad, por parte del cirujano, de resolver las potenciales lesiones vasculares del pedículo de forma rápida y eficaz para preservar el injerto. BIBLIOGRAFIA y LECTURAS RECOMENDADAS (*lectura de interés y **lectura fundamental) 1. 2. 3. 4. 5. 6. 7. 8. 9. Annual Report of the US Scientific Registry of Transplant Recipients and Organ Procurement and Transplantation Network-Transplant Data: 1988-1996. Rockville, Maryland: United Network for Organ Sharing and Division of Transplantation, Bureau of Health Resources and Services Administration, United States Department of Health and Human Services, 1997. EGGERS, P.: “Comparison of treatment costs between dialysis and transplantation.” Semin Nephrol, 12:284, 1992. SCHWEITZER, E.J.; WILAND, A.; EVANS, D. y cols.: “The shrinking renal replacement therapy “break-even” point.” Transplantation, 66:1702, 1998. KUO, P.C.; JOHNSON, L.B.: “Laparoscopic donor nephrectomy increases the supply of living donor kidneys: A center-specific microeconomic analysis.” Transplantation, 69:2211, 2000. RATNER, L.E.; CISECK, L.J.; MOORE, R.G. y cols.: “Laparoscopic live donor nephrectomy.” Transplantation, 60:1047, 1995. KASISKE, B.L.; RAVENSCRAFT, M.; RAMOS, E.L. y cols.: “The evaluation of living renal transplant donors: Clinical practice guidelines. Ad Hoc Clinical Practice Guidelines Subcommittee of the Patient Care and Education Committee of the American Society of Transplant Physicians.” J. Am. Soc. Nephrol, 7:2288, 1996. RATNER, L.E.; MONTGOMERY, R.A.; KAVOUSSI, L.R.: “Laparoscopic live donor nephrectomy: the four year Johns Hopkins University experience.” Nephrol Dial Transplant, 14:2090, 1999. FLOWERS, J.L.; JACOBS, S.; CHO, E. y cols.: “Comparison of open and laparoscopic live donor nephrectomy.” Ann. Surg., 226:483, 1997. ODLAND, M.D.; NEY, A.L.; JACOBS, D.M. y cols.: “Initial experience with laparoscopic live donor nephrec- 10. 11. 12. 13. **14. 15. 16. 17. 18. 19. *20. 21. *22. 23. 24. 25. 26. **27. tomy.” Surgery, 126:603, 1999. WOLF, J.S.; TCHETGEN, M.B.; MERION, R.M.: “Hand-assisted laparoscopic live donor nephrectomy.” Urology, 52:885, 1998. NOGUEIRA, J.M.; CANGRO, C.B.; FINK, J.C.y cols.: “A comparison of recipient renal outcomes with laparoscopic versus open live donor nephrectomy.” Transplantation, 157:722, 1999. RATNER, L.E.; MONTGOMERY, R.A.; MALEY, W.R. y cols.: “Laparoscopic live donor nephrectomy: the recipient.” Transplantation, 69:2319, 2000. STIFELMAN, M.D.; HULL, D.; SOLA, R.E. y cols.: “Hand assisted laparoscopic donor nephrectomy: a comparison with the open approach.” J. Urol., 166, 444, 2001. WOLF, J.S. Jr.; MERION, R.M.; LEICHTMAN, A.B. y cols.: “Randomized controlled trial of hand-assisted laparoscopic versus open surgical live donor nephrectomy.” Transplantation, 27; 72: 284, 2001. FLOWERS, J.L.; JACOBS, S. CHO, E. y cols.: “Comparison of open and laparoscopic live donor nephrectomy.” Ann. Surg., 226:483, 1997. RATNER, L.E.; BISHOFF, J.T.; MONTGOMERY, R.A. y cols.: “Laparoscopic live donor nephrectomy: long-term results.” J. Urol. suppl., 159:182, 1998. PHILOSOPHE, B.; KUO, P.C.; SCHWEITZER, E.J. y cols.: “Laparoscopic versus open donor nephrectomy: Comparing ureteral complications in the recipients and improving the laparoscopic technique.” Transplantation, 68:497, 1999. HARMAN, P.K.; KRON, I.L.; McLACHLAN, H.D. y cols.: “Elevated intra-abdominal pressure and renal function.” Ann. Surg., 196:594, 1982. KIRSCH, A.J.; KAYTON, M.L.; HENSLE, T.W. y cols.: “Renal effects of CO2 insufflation: Oliguria and acute renal dysfunction in a rat pneumoperitoneum model.” Urology, 43:453, 1994. LONDON, E.T.; HO, H.S.; NEUHAUS, A.M. y cols.: “Effect of intravascular volume expansion on renal function during prolonged Co2 pneumoperitoneum.” Ann. Surg., 231:195, 2000. CISEK, L.J.; GOBERT, R.M.; PETERS, C.A.: “Peumoperitoneum produces reversible renal dysfunction in animals with normal and chronically reduced renal function.” J. Endourol., 12:95, 1998. BURGOS, F.J.; PASCUAL, J.; BRIONES, G. y cols.: “Influence of laparoscopic live donor nephrectomy in ischemia-reperfusion syndrome and renal function after kidney transplantation: an experimental study.” Transplant Proc., 35: 1664, 2003. CHIU, A.W.; CHANG, L.S.; BIRKETT, D.H. y cols.: “The impact of pneumoperitoneum, pneumoretroperitoneum, and gasless laparoscopy on the systemic and renal hemodynamics.” J. Am. Coll. Surg., 181:397, 1995. JACOBS, S.C.; CHO, E.; DUNKIN, B.J. y cols.: “Laparoscopic live donor nephrectomy: the University of Maryland 3-year experience.” J. Urol., 164:1494, 2000. ZACHERL, J.; THEIN, E.; STANGL, M. y cols.: “The influence of periarterial papaverine application on intraoperative renal function and blood flow during laparoscopic donor nephrectomy in a pig model.” Surg. Endosc. June 13, 2003. HAWASLI, A.; OH, H.; SCHERVISH, E. y cols.: “The effect of pneumoperitoneum on kidney function in laparoscopic donor nephrectomy.” Am. Surg. 69:300, 2003. JACOBS, S.; CHO, E.; FOSTER, C. y cols.: “Laparoscopic donor nephrectomy: the University of Maryland 6-year experience.” J. Urol. 171:47, 2004.