EXTRACCIÓN Y CUANTIFICACION DEL ARN DE LA LEVADURA
Anuncio

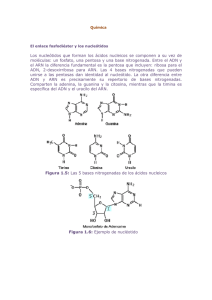
Prácticas de Bioquímica II Práctica: Cuantificación del ARN EXTRACCIÓN Y CUANTIFICACION DEL ARN DE LA LEVADURA Objetivos: Al finalizar el trabajo práctico los cursantes estarán en capacidad de: - Extraer ARN a partir de células de levadura. - Realizar la hidrólisis ácida de los ácidos nucleicos. - Determinar cuantitativamente y de manera indirecta el ARN presente en la levadura por el método de Bial. - Relacionar el contenido de Ribosa con la presencia del ARN en el material biológico analizado. Introducción: Los ácidos nucleicos son las biomoléculas responsables del almacenamiento y transmisión de la información genética del individuo. Son un grupo de compuestos que poseen en su estructura bases nitrogenadas: adenina, citosina, timina, guanina y uracilo; pentosas: ribosa y 2-desoxirribosa, y grupos fosfato. El tipo de bases nitrogenadas y pentosa presente dependerán del tipo de ácido nucleico. El ADN y el ARN difieren en el tipo de base y la pentosa que forman parte de su estructura. Los ácidos nucleicos se encuentran normalmente unidos a proteínas sencillas del tipo histonas y protaminas, denominándosele a esta combinación nucleoproteínas, que no son más que uno de los tipos de proteínas conjugadas que existen en las células. Existen las desoxi-nucleoproteínas y las ribo-nucleoproteínas, aunque éstas se encuentran en todos los tipos de células, no se encuentran en ellas en las mismas proporciones, por ejemplo, las células de levadura son ricas en ribo-nucleoproteínas, mientras que las células del timo del ternero son ricas en desoxi-nucleoproteínas. Su extracción a partir de las diferentes células, puede hacerse con soluciones alcalinas diluidas, soluciones buffer (pH 4-11) y soluciones de cloruro de sodio. 1 Easy PDF Creator is professional software to create PDF. If you wish to remove this line, buy it now. Prácticas de Bioquímica II Práctica: Cuantificación del ARN El material genético de organismos unicelulares como la levadura (Saccharomyces cerevisiae) puede ser extraído con relativa facilidad. La ruptura de las membranas se puede realizar con un álcali diluido y calentamiento. Una vez liberados los ácidos nucleicos, estos son precipitados en medio ácido y etanol (alcohol acidulado), hidrolizados con H2SO4 y calentamiento, y finalmente aislados por centrifugación. Los nucleótidos de ARN pueden ser identificados y cuantificados de manera indirecta utilizando la prueba de Bial ya que esta reacción detecta la presencia del furfural producido en medio ácido por la ribosa. El reactivo de Bial contiene orcinol disuelto en HCl concentrado. El ácido provoca la formación del furfural y el orcinol se condensa con este último para producir cromógenos de color verde-azul. CH2OH OH O H H H OH H OH Ribosa O H+ CH3 CHO H+ + OH HO furfural FeCl3 Compuestos de color verde-azul Reactivo de Bial Figura 1. Reacción de Bial con el furfural formado a partir de ribosa. La absorbancia del cromógeno formado es medida con el espectrofotómetro a 660 nm junto con la de patrones de ribosa de concentración conocida, que permitan calcular la concentración de nucleótidos de RNA presentes en la levadura. MATERIALES Y REACTIVOS - Levadura fresca o liofilizada. NaOH 1% Ácido acético glacial. Etanol acidulado: 200 mL de etanol + 1 mL de ácido clorhídrico concentrado. H2SO4 concentrado. Estándar de ribosa 1 mg% Reactivo de Bial: disolver 3 g de orcinol en 100 mL de HCl concentrado y agregar 0,3 mL de FeCl3 al 10 %. Preparar a diario. Baño de agua hirviente. Centrífuga 2 Easy PDF Creator is professional software to create PDF. If you wish to remove this line, buy it now. Prácticas de Bioquímica II - Práctica: Cuantificación del ARN Tubos de ensayo. Cilindro graduado 25 mL. Pipetas graduadas 10, 5, 2, y 1 mL. Beakers 100 mL. Tubos de Centrífuga. Varilla de vidrio. Fiola de 50 mL. PARTE EXPERIMENTAL: Extracción de las nucleoproteínas. Diluir 5 mL. de NaOH (1%) en 25 mL de agua destilada. Añada 10 g de levadura (si es fresca, 5 g si es liofilizada) cortada en pequeños pedazos. Resuspender la pasta de levadura en el NaOH. Calentar en baño María a 90ºC por 30 minutos y agitar ocasionalmente, para facilitar la extracción de las nucleoproteínas. Centrifugar el líquido resultante por 10 minutos a 3500 rpm. Reservar el sobrenadante (contiene ribonucleoproteínas) y añadir a 2 ó 3 gotas de ácido acético hasta neutralizar el medio. Compruebe la neutralización con papel tornasol. Si aparece precipitado, vuelva a centrifugar por 10 minutos a 3500 rpm. Evaporar el sobrenadante en una plancha de calentamiento hasta que quede un volumen de aproximadamente 10 mL. Dejar enfriar. Agregarlo en un Beaker que contenga 20 mL de alcohol acidulado, agitar vigorosamente para precipitar las ribonucleoproteínas. Centrifugar de nuevo y deseche el sobrenadante. Resuspender el residuo de ribonucleoproteínas con 5 mL de etanol al 95% para lavar y eliminar impurezas y centrifugue por 5 minutos a 3500 rpm. Resuspender el precipitado en 5 ó 10 mL de agua destilada en un tubo de ensayo. Hidrólisis de las nucleoproteínas. Verter la suspensión de ribonucleoproteínas en un beaker y añada 1 mL de ácido sulfúrico y caliente en baño María a 100ºC durante 20 minutos. 3 Easy PDF Creator is professional software to create PDF. If you wish to remove this line, buy it now. Prácticas de Bioquímica II Práctica: Cuantificación del ARN Determinación cuantitativa de ARN. Esta determinación se basa en la medición de color generado por la ribosa presente, mediante la formación de furfural en medio ácido y su condensación con el orcinol. Procedimiento: 1. Prepare 100 mL de una dilución 1:100 del hidrolizado de nucleoproteínas. 2. A partir de un estándar de ribosa de 3 mg% prepare 10 mL de tres estándares de 2,5, 2 y 1,5 mg%. 3. Utilizando la información contenida en la tabla anexa, coloque en seis tubos de ensayo los reactivos que allí se indican y en las cantidades señaladas. Reactivos Agua destilada Tubo 1 Blanco 1 mL Tubo 2 Tubo 3 Tubo 4 Tubo 5 1,5 mg% 2 mg% 2,5 mg% 3 mg% --------- Tubo 6 muestra --- Dilución 1:100 --- --- --- --- --- 1 mL Estándar de Ribosa --- 1 mL 1 mL 1 mL 1 mL --- Reactivo de Bial 2 mL 2 mL 2 mL 2 mL 2 mL 2 mL 4. Mezclar bien y calentar en baño de agua hirviente por 10 minutos. 5. Enfriar y leer la absorbancia de los tubos en el espectrofotómetro a 660 nm. 6. Anote los resultados obtenidos y calcule la concentración de ribosa en la muestra problema) Cálculo de la concentración de ribosa Para cuantificar los nucleótidos de ARN presentes en la muestra problema se utilizará el método de los mínimos cuadrados, este se aplica a funciones de comportamiento lineal para calcular valores de “y” o “x” a partir de la ecuación de la recta: Y=m x+b Donde “m” es la pendiente y “b” el intercepto. Para la cuantificación se deben realizar los siguientes cálculos: 4 Easy PDF Creator is professional software to create PDF. If you wish to remove this line, buy it now. Prácticas de Bioquímica II Práctica: Cuantificación del ARN 1. Anote los datos obtenidos en la tabla anexa y calcule las sumatorias que se indican. (x) Concentración x= x2 x y (y) Absorbancia y= x2 = (x y) = 2. Calcule el valor de “b” utilizando la siguiente expresión: [ x [ x2 (x y)] y] b= [ (x)]2 n x2 n = Nº de observaciones (Nº de observaciones = 4) 3. Calcule el valor de “m” utilizando la siguiente expresión: [ x y] [n (x y)] m= [ (x)]2 n x2 4. sustituya los valores resultantes en la siguiente ecuación: Y=m x+b Donde “Y” = absorbancia de la muestra 5 Easy PDF Creator is professional software to create PDF. If you wish to remove this line, buy it now. Prácticas de Bioquímica II Práctica: Cuantificación del ARN 5. Determine la concentración de ARN como ribosa (x) para el valor de absorbancia de la muestra (y) obtenido con el espectrofotómetro, despejándolo de la ecuación de la recta: Y–b x= m Para convertir el resultado (mg% de ribosa) en mg% de ARN se debe multiplicar el valor obtenido para x por 2,22. Este factor se obtiene de la división del peso molecular promedio de un ribonucleótido (300 g/mol) entre el peso molecular de la ribosa (150 g/mol). Por último se corrige la concentración de ARN multiplicando por el factor de dilución aplicada a la muestra (100). ANEXO Detección de ADN La presencia de ADN se puede verificar mediante la reacción del Dische o difenilamina, en la cual la 2-desoxirribosa del DNA reacciona con ácido sulfúrico para producir aldehído hidroxilevulínico o 4-hidroxipentanal. Este compuesto reacciona con la difenilamina originando como producto un compuesto químico de color azul (figura 2). Esta reacción es específica ya que sólo la 2-desoxirribosa produce el 4hidroxipentanal en medio fuertemente ácido. CHO CH2OH OH O H H OH H H + H H CH2 CH2 CHOH CH3 4-hidroxipentanal 2-Desoxirribosa 6 Easy PDF Creator is professional software to create PDF. If you wish to remove this line, buy it now. Prácticas de Bioquímica II Práctica: Cuantificación del ARN CHO CH2 CH2 CHOH CH3 + N H H+ difenilamina Compuestos de color azul 4-hidroxipentanal Reacciones de la prueba de Dische o difenilamina AUTOEVALUACIÓN 1 ¿Porqué la determinación de ribosa y 2-desoxirribosa representa una forma indirecta de reconocer la presencia y cantidad de ácidos nucleicos? 2. Mencione otras muestras biológicas a partir de las cuales podamos cuantificar ácidos nucleicos. 3. Mencione otros componentes químicos que podamos cuantificar para medir indirectamente la concentración de ADN y ARN. Bibliografía A.V. Chechetkin, V.I. Voroniaski, G.G. Pokusay. Prácticas de Bioquímica del ganado y aves de corral. Alemany, M; Font, S. Práctica de Bioquímica. Edit Alhambra. España 1.983 Plummer, David. Bioquímica práctica. Mc Graw Hill. 1981. Robyt, John; White Bernard. Bioquemical Techniques. Waveland Press. 1987. 7 Easy PDF Creator is professional software to create PDF. If you wish to remove this line, buy it now.