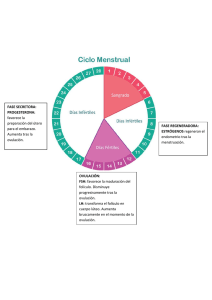
EFECTO DEL TRATAMIENTO CON ALTRENOGEST ORAL
Anuncio

EFECTO DEL TRATAMIENTO CON ALTRENOGEST ORAL, BENZOATO DE ESTRADIOL y hCG SOBRE LA SINCRONIZACION DEL CELO Y OVULACIÓN EN YEGUAS CRIOLLAS EN EL CRIADERO LAS TINAJAS, MUNICIPIO DE PUERTO BERRIO ANTIOQUIA. JUAN CARLOS ECHEVERRI HOYOS UNIVERSIDAD DE CIENCIAS APLICADAS Y AMBIENTALES U.D.C.A. FACULTAD DE CIENCIAS AGROPECUARIAS MEDICINA VETERINARIA Y ZOOTECNIA BOGOTA D.C. 2008 2 EFECTO DEL TRATAMIENTO CON ALTRENOGEST ORAL, BENZOATO DE ESTRADIOL y hCG SOBRE LA SINCRONIZACION DEL CELO Y OVULACIÓN EN YEGUAS CRIOLLAS EN EL CRIADERO LAS TINAJAS, MUNICIPIO DE PUERTO BERRIO ANTIOQUIA. JUAN CARLOS ECHEVERRI HOYOS Tesis de grado presentada como requisito para optar al título de Médico Veterinario Zootecnista Director Juan José Molina Echeverri Médico Veterinario Zootecnista Jorge Torres Vanégas Médico Veterinario UNIVERSIDAD DE CIENCIAS APLICADAS Y AMBIENTALES U.D.C.A FACULTAD DE CIENCIAS AGROPECUARIAS MEDICINA VETERINARIA Y ZOOTECNIA BOGOTA D.C. 2008 3 Nota de aceptación ___________________ ___________________ ____________________ Jurado ________________ Jurado Bogotá, Mayo de 2008 4 _____________________ Director _____________________ Director ______________________ Decano de Carrera Bogotá, mayo de 2008 5 DIRECTIVAS DE LA UNIVERSIDAD DE CIENCIAS APLICADAS AMBIENTALES Rector: Dr. Germán Anzola Montero Vicerrector Académico Dr. Carlos Adolfo Arenas Vicerrector de Investigaciones Dr. Ramses Hakin Murad Decana de M.V.Z. Dra. Sandra Ujueta Rodríguez 6 AGRADECIMIENTOS Al Dr. Jorge Torres Vanegas. Médico Veterinario Universidad de Ciencias Aplicadas y Ambientales U.D.C.A. Por su gran ayuda, colaboración y disposición en la dirección de este trabajo. Al Dr. Juan José Molina Echeverri. Médico Veterinario Zootecnista. Director de investigación Laboratorios Intervet. Por su colaboración en todo el proceso de realización del trabajo, realización del protocolo para el estudio y dirección del trabajo. Al Dr. Jorge Iván Molina Echeverri. Médico Veterinario Zootecnista. Veterinario Agropecuaria Las Tinajas por la colaboración para la realización del trabajo en este criadero. A Laboratorios Intervet por permitirnos realizar la investigación con sus productos y su nombre. A todos los docentes que a lo largo de la carrera compartieron sus conocimientos sobre reproducción animal. 7 A Gustavo Posada, propietario del criadero Las Tinajas en Puerto Berrio (Antioquia) por permitirme utilizar las yeguas de su criadero en el presente estudio. Al Dr. Pedro David Mújica por la ayuda prestada durante todo el proceso de la realización del trabajo de campo. A todos los trabajadores de la empresa Las Tinajas que colaboraron en el manejo de los animales. Al Dr. Mauricio Ruge Suárez por ser el docente que durante la carrera guío los conocimientos de reproducción. A todas las personas que de alguna forma contribuyeron en la realización y culminación de este trabajo. Juan Carlos 8 DEDICATORIA A mis abuelos que desde pequeño formaron en mí la pasión por los animales y han dado su apoyo incondicional. A mi mamá por ser esa fuerza que tengo para seguir adelante con mis logros. A mis hermanas por darme esa compañía y apoyo cuando la he necesitado. A mi papá que me dio todo el apoyo para el estudio, se ha preocupado durante toda la vida por sacarme adelante y darme todas las enseñanzas necesarias para ser una mejor persona cada día. A mis compañeros que durante la carrera me acompañaron durante todo el proceso de formación universitaria y compartieron conmigo todo los momentos universitarios. A mis amigos que me acompañaron durante los momentos de recreo y estudio y que hicieron más agradable la etapa universitaria. A todas las personas que de cualquier forma estuvieron involucradas con mi formación y aportaron para ser mejor cada día y llegar a ser un buen Médico Veterinario Zootecnista. Juan Carlos. 9 CONTENIDO Pag RESUMEN 17 INTRODUCCION 18 OBJETIVO GENERAL 22 Objetivos específicos 22 1 MARCO TEÓRICO 23 1.1 Pubertad 23 1.2 ANATOMIA DEL TRACTO REPRODUCTIVO DE LA HEMBRA EQUINA 24 1.2.1 Vulva 25 1.2.2 Clítoris 25 1.2.3 Labios mayores y labios menores 26 1.2.4 Vestíbulo Vaginal 27 1.2.5 Vagina 27 1.2.6 Útero 28 1.2.7 Oviducto 30 1.2.8 Ovarios 32 1.2.8.1 Túnica albugínea 32 1.2.8.2 Médula ovárica 33 1.2.8.3 Corteza ovárica 33 10 1.2.8.4 Estroma Ovárico 33 1.2.8.5 Epitelio germinal 34 1.2.8.6 Fosa ovárica 34 1.2.9 Folículo ovárico 34 1.2.9.1 Células de la teca 35 1.2.9.2 Pared folicular 35 1.2.9.3 Células de la granulosa 35 1.2.9.4 Folículo primordial 36 1.2.9.5 Folículo secundario 36 1.2.9.6 Folículo terciario o vesicular 37 1.2.9.7 Líquido folicular ( en el antro) 37 1.2.9.8 Líquido folicular (entre las células de la granulosa) 37 1.2.9.9 Zona pelúcida 38 1.2.9.10 Folículo de De graff 39 1.2.9.11 Cuerpo hemorrágico 39 1.2.9.12 Cuerpo blanco 40 1.3 FISIOLOGÍA REPRODUCTIVA 42 1.3.1 Introducción 42 1.3.2 Hormonas de la reproducción 46 1.3.2.1 Hormonas hipotalámicas 47 1.3.2.2 Hormonas de la adenohipófisis 48 11 1.3.2.3 Hormona folículo estimulante (FSH) 48 1.3.2.4 Hormona luteinizante (LH) 49 1.3.2.5 Hormonas Neurohipofisiarias 51 1.3.3 Oxitocina 52 1.3.4 Relaxina 53 1.3.5 Inhibinas y Activitas 53 1.3.5.1 Inhibinas 53 1.3.5.2 Activinas 54 1.3.6 Prostaglandinas F2α 54 1.3.7 Progesterona 55 1.3.8 Estrógenos 55 1.3.9 Ciclo estral 56 2 REGUMATE® 61 2.1 Ventajas del uso de Regumate® 62 3 MATERIALES 64 4 METODOLOGÍA 65 4.1 Metodología estadística 65 5 CRONOGRAMA DE ACTIVIDADES 66 6 ANÁLISIS 68 6.1 ANÁLISIS ESTADISTICO 68 7 RESULTADOS 69 8 DISCUSIÓN 78 12 9 CONCLUSIONES 81 10 RECOMENDACIONES 83 11 BIBLIOGRAFÍA 84 ANEXOS 91 13 LISTA DE FIGURAS Pág Figura 1. Fotografía tracto reproductivo de la yegua. 24 Figura 2. Clasificación fisiológica y morfológica de los folículos ováricos. 41 Figura 3. Secuencia regular del ciclo estral de la yegua. 56 Figura 4. Perfiles hormonales y su relación con el desarrollo folicular y relación de retroalimentación asociada con varios órganos reproductivos. Figura 5. Diagrama del ciclo estral. 59 60 14 LISTA DE TABLAS Pag Tabla 1. Hormonas involucradas en la reproducción equina 43 Tabla 2. Reproducción en la hembra de diferentes especies. 45 Tabla 3. Cronograma de actividades. 66 Tabla 4. Días a la ovulación de cada una de las yeguas después del tratamiento con Regumate®. 70 Tabla 5. Análisis estadístico de días a la ovulación después del tratamiento con Regumate®. 70 Tabla 6. Días que se demoro el folículo desde finalizado el suministro de Altrenogest hasta llegar a 35mm. 72 Tabla 7. Análisis estadístico de los días que tardaron los folículos para llegar a 35mm. después del tratamiento con Regumate®. 73 Tabla 8. Horas desde la inyección de Chorulon® hasta la ovulación para cada una de las yeguas 74 Tabla 9. Análisis estadístico de las horas desde la inyección de Chorulon® hasta la ovulación 74 Tabla 10. Tamaño del folículo al momento de la ovulación 75 Tabla 11. Análisis estadístico del tamaño del folículo al momento de ovulación. 75 Tabla 12.Crecimiento folicular en mm desde el día en que aparece el folículo ovulatorio y la ovulación del mismo. 76 Tabla 13. Análisis estadístico del crecimiento folicular diario durante el tratamiento. 77 15 LISTA DE GRÁFICAS Pág Gráfica 1. Días pos tratamiento en que las yeguas alcanzaron 35 mm de diámetro folicular y la ovulación de el lote tratado 69 Gráfica 2. Crecimiento folicular de las yeguas una vez terminado el suministro de Altrenogest 71 Gráfica 3. Días que tardaron los folículos para llegar a 35 mm. Después de terminado el tratamiento con Regumate®. 73 Gráfica 4. Horas a la evolución pos administración de Chorulon® para cada una de las yeguas. 74 Gráfica 5. Tamaño del folículo al momento de la ovulación. 77 16 LISTA DE ANEXOS Anexo 1. Agropecuaria las Tinajas (Puerto Berrio - Antioquia) Anexo 2. Brete para palpación. Anexo 3. Toma de ecografías. Anexo 4. Grupo de yeguas del estudio. Anexo 5. Grupo de yeguas del estudio en su manada Anexo 6. Yeguas del estudio 17 EFECTO DEL TRATAMIENTO CON ALTRENOGEST ORAL, BENZOATO DE ESTRADIOL y hCG SOBRE LA SINCRONIZACION DEL CELO Y OVULACIÓN EN YEGUAS CRIOLLAS DE PASO COLOMBIANO EN EL CRIADERO LAS TINAJAS, MUNICIPIO DE PUERTO BERRIO ANTIOQUIA.1 Juan José Molina Echeverri2 Juan Carlos Echeverri Hoyos3 Jorge Torres Vanegas4 2008 RESUMEN Uno de los principales problemas existentes en la práctica de campo es la necesidad del uso de la ecografía para hacer diagnósticos precisos de los ovarios y determinar el momento exacto de la ovulación, razón por la cual, la técnica de inseminación artificial en yeguas se ha circunscrito a zonas urbanas donde los propietarios de yeguas de alto valor económico pagan el trabajo realizado, quedando fuera de esta tecnología, las yeguas de trabajo localizadas en la periferia de la ciudad y zonas rurales donde la presencia de un profesional con ecógrafo es prácticamente nula. El presente trabajo pretendió demostrar que el método de sincronización de la ovulación utilizando Altrenogest oral (Regumate®) durante 10 días, unido a la aplicación de Benzoato de estradiol el día de inicio del primero y la aplicación de hCG una vez se detectara la presencia de un folículo de 35 mm es efectivo para realizar un manejo reproductivo más sencillo. Se trabajó con un grupo de 10 yeguas en el criadero las Tinajas en Puerto Berrio Antioquia en donde se obtuvo una media 18.2 días entre el inicio del tratamiento y la ovulación; un diámetro del folículo al momento de ovular de 37.9 mm y un tiempo entre la aplicación de hCG (en folículos mayores de 35 mm) y la ovulación máximo de 54 horas. Se puede concluir que este tratamiento es eficaz para lograr la sincronización de la ovulación en yeguas criollas en el lugar geográfico donde se realizó la investigación. Palabras claves: Sincronización, Anestro, Ciclo estral, Chorulon®, Altrenogest oral 1 Trabajo de grado en la modalidad de investigación Director. Médico Veterinario Zootecnista Laboratorio Intervet 3 Estudiante último semestre, carrera Medicina Veterinaria y Zootecnia 4 Director. Médico Veterinario docente U.D.C.A. 2 18 INTRODUCCIÓN La industria equina en nuestro país ha venido tomando un papel preponderante dentro de las explotaciones pecuarias, no solo por la valiosa labor que realizan los equinos en todas las áreas de trabajo donde son requeridos, sino también por el alto valor económico que ha venido ganando en los últimos años la raza de Paso Criollo Colombiano. Debido a esto, se han desarrollado nuevas técnicas para mejorar la parte productiva y reproductiva de esta raza, y es en este último aspecto donde es necesario avanzar para aprovechar todo el potencial genético que ya existe en nuestro país con esta raza. De esta forma, con la finalidad de controlar el ciclo estral en la yegua, se han desarrollado una serie de protocolos hormonales y de manejo con el fin de manipular los procesos fisiológicos del aparato reproductivo de la hembra equina y consecuentemente mejorar los resultados reproductivos. Sin embargo, el avance en nuestro país ha sido muy poco. En cuanto al momento de la ovulación, se ha generalizado el uso de Gonadotropina coriónica humana (hCG) para favorecer el crecimiento final y la ovulación del folículo, sin embargo, para usar este protocolo, la hembra debe ya estar en la etapa de celo y además requiere un tamaño folicular mínimo de 35 mm de diámetro para lograr el efecto deseado (ALVARENGA 2006). Actualmente, uno de los principales problemas existentes en la práctica de campo 19 es la necesidad del uso de la ecografía para hacer diagnósticos precisos de los ovarios y determinar el momento exacto de la ovulación, razón por la cual, la técnica de inseminación artificial en yeguas se ha circunscrito a zonas urbanas donde los propietarios de yeguas de alto valor económico pagan el trabajo realizado, quedando fuera de esta tecnología, las yeguas de trabajo localizadas en la periferia de la ciudad y zonas rurales donde la presencia de un profesional permanente y con disponibilidad de ecógrafo es prácticamente nula. Con este incremento en la industria equina nacional en los últimos años, vemos como la cantidad de animales registrados en las asociaciones equinas regionales con verificación de parentesco por ADN aumentaron de solo 908 en el año 1996 y 2066 en 1997 a cifras de 8058 y 9027 en los años 2004 y 2005 respectivamente (FEDEQUINAS 2006), este crecimiento aumentó la demanda de trabajos de Médicos Veterinarios dedicados a la clínica y por supuesto a la reproducción de esta raza. Actualmente se hace más evidente la necesidad de contar con técnicas y productos farmacológicos que garanticen, con la mayor precisión posible, el tiempo exacto en que un animal debe ser servido o inseminado; en este caso, se usan productos análogos de la prostaglandina F2α para inducir la aparición del celo en las yeguas y análogos de la hormona luteinizante (LH), en este caso mediante la utilización de la Gonadotropina Coriónica humana (hCG) para la inducción de la ovulación (MOLINA 2004) 20 La ultrasonografía se convirtió en una herramienta de gran ayuda para el trabajo veterinario ya que es una técnica no invasiva que permite mejorar la evaluación de los eventos reproductivos y facilitar el uso de nuevas biotecnologías reproductivas, sin embargo, el alto costo de esta tecnología ha hecho que sea imposible su masificación, quedando solo circunscrita a las zonas urbanas y suburbanas, por lo cual, la gran mayoría de animales que se encuentran en áreas rurales del país, deben ser trabajadas con métodos tradicionales donde el trabajo veterinario es mínimo. Una de las mejores opciones para facilitar el mejoramiento genético de la raza de caballos de Paso Criollo Colombiano, es el desarrollo o adecuación de técnicas de manejo farmacológico que permitan la manipulación del ciclo estral y el control del momento de la ovulación para poder realizar los trabajos sin la necesidad, al menos en parte, de elementos “costosos” como el caso de Ecógrafo, que impiden el trabajo de estas técnicas a lo largo del territorio colombiano. Uno de los métodos ampliamente utilizados en otros países, y en otras especies como la bovina, es el uso de protocolos de sincronización a base de progestágenos sintéticos de larga acción o acción constante (WILDE, 2002) que traten de imitar la vida normal de un cuerpo lúteo. Una vez la acción de este progestágeno desaparece, se permite el crecimiento normal de un folículo pudiéndose prever, al menos en teoría, el tiempo en que este folículo alcanza 21 tamaño preovulatorio (SQUIRES, 1975), momento en el cual su ovulación puede ser inducida en forma predecible con el uso de hCG y así determinar el mejor momento para servir o inseminar artificialmente a esta hembra, sin la necesidad de un monitoreo constante (MOLINA 2004). 22 OBJETIVO GENERAL: Determinar el efecto del tratamiento con Altrenogest oral, Benzoato de Estradiol y Gonadotropina Coriónica Humana (hCG) sobre la sincronización de celos y ovulación en yeguas Criollas de Paso Colombiano en el criadero Las Tinajas, municipio de Puerto Berrio Antioquia. OBJETIVOS ESPECIFICOS: Determinar el tiempo que tarda el folículo en alcanzar un tamaño preovulatorio (35 mm) después de finalizado el tratamiento con Regumate® (Altrenogest oral) y Benzoato de Estradiol. Determinar el tiempo de ovulación de los folículos preovulatorios (35mm) después de la administración de Chorulon® (hCG). Determinar un protocolo de sincronización de celos y de ovulación para hacer Inseminación a ciegas en yeguas Criollas de Paso Colombiano. 23 1. MARCO TEORICO 1.1 PUBERTAD El enfoque moderno de la reproducción equina exige un amplio conocimiento de los órganos que conforman el tracto reproductivo de la hembra, su funcionamiento y el rol que desempeñan las diferentes hormonas sobre las estructuras anatómicas, las cuales están íntimamente relacionadas y tienen una actividad dinámica entre sí. Pero antes de hablar de las estructuras anatómicas y su función reproductiva, es necesario identificar el momento en que la yegua alcanza la pubertad, correspondiendo al período fisiológico en que la hembra es capaz de manifestar secuencias completas de comportamiento sexual (HAFEZ, 1996), producir su primera ovulación y tener la capacidad de quedar preñada. La pubertad es alcanzada en las yeguas criollas colombianas entre los 18 y 36 meses de edad, influyendo en la presentación de la pubertad factores ambientales, nutricionales y sanitarios que aumentan o disminuyen este intervalo de tiempo (HAFEZ, 1996). Luego que la yegua alcanza su madurez y competencia reproductiva, inicia el ciclo estral, el cual está influenciado por las condiciones climáticas del lugar donde se encuentra, en el caso de países con estaciones se denomina ciclo poliéstrico 24 estacional, dado que la hembra presenta varios ciclos reproductivos en una determinada estación del año, generalmente entre abril y octubre; mientras que en países tropicales y subtropicales se caracteriza el ciclo por la presentación de varios calores en el año, siendo mayor la dinámica reproductiva en épocas de verano en donde las horas luz diarias son mayores, denominándose en este caso ciclo poliéstrico anual (HAFEZ, 1996). 1.2 ANATOMÍA DEL TRACTO REPRODUCTIVO DE LA HEMBRA EQUINA. El tracto reproductivo de la yegua (figura 1) es un complejo sistema de órganos que interactúan entre sí con el propósito de: producir un óvulo, proveer un medio ideal para la fecundación, mantener la preñez y por último facilitar el proceso del parto, y en este contexto el aparato reproductor de la hembra está conformado por la vulva, vagina, útero, dos (2) trompas Uterinas, de Falopio u oviductos y dos (2) ovarios, los cuales serán descritos a continuación (CORREDOR y cols., 2005). Figura 1 Fotografía Tracto Reproductivo de la Yegua. Fuente: Archivo del Laboratorio de Reproducción Animal Embrionar 25 1.2.1 Vulva La vulva (pudendum femininum) es la porción externa de los genitales de la hembra, se extiende desde la vagina hasta el exterior. La unión de la vagina y la vulva se marca por la presencia del orificio uretral externo, así como un pliegue inmediatamente caudal al orificio uretral externo, un vestigio del himen (FRANDSON, 1995) Este órgano del aparato reproductor consta de un vestíbulo con sus anexos y labios. El vestíbulo de la vagina a lo largo de los años se ha considerado como una parte anatómica de la vagina, sin embargo, según la Nómina Anatómica Veterinaria (NAV) menciona esta estructura separadamente de la vagina y la vulva, la cual puede describirse como la porción tubular del conducto reproductor que se ubica entre la vagina y los labios de la vulva, este es común tanto para el sistema reproductor como para el urinario y en la yegua puede llegar a medir de 10 a 12 cm de longitud (FRANDSON, 1995). 1.2.2 El clítoris Es el homólogo del glande del pené en el macho y se localiza ventralmente a un centímetro dentro del labio, está constituido de tejido eréctil con abundantes 26 nervios sensoriales, se le encuentra erecto durante el estro y está formado de unas partes muy similares(a excepción de la uretra y su músculo). El cuerpo tiene unos 5cm. de largo y su diámetro es aproximadamente el del dedo pequeño de una mano humana. Está insertado en el arco isquial por dos pilares. El glande es redondo y termina en un extremo libre que ocupa la fosa del clítoris en la comisura ventral de la vulva (GROSSMAN, 2001) Está cubierto por un tegumento pigmentado, delgado, similar y continuo con el que recubre la fosa; constituye así el prepucio del clítoris. El órgano está compuesto del tejido eréctil similar al del cuerpo cavernoso del pene (SISSON Y GROSSMAN, 2001). La yegua durante el estro contrae frecuentemente los labios exponiendo al clítoris erecto, lo cual en reproducción equina es denominado como guiño vulvar y es uno de los signos cardinales del celo, estro o calor en esta especie (GUINTHER, 1992). 1.2.3 Labios mayores y labios menores La vulva se encuentra conformada por dos (2) comisuras y dos (2) labios. Los labios mayores son cada uno de los dos labios que cubren a los correspondientes labios menores en los bordes de la hendidura vulvar formando pliegues de la piel de tejido adiposo, recubiertos por piel lisa, delgada y pigmentada, 27 abundantemente provista de glándulas sebáceas y sudoríparas, cuya función es proteger el tracto genital interno a través de su cierre total evitando con ello la entrada de agentes patógenos y heces (HAFEZ, 2002). 1.2.4 Vestíbulo vaginal Es la parte terminal del tracto genital. Se continúa en sentido craneal, con la vagina y, externamente, en el borde pudendo (hendidura vulvar), de 5 a 7cm ventral al ano. No hay línea externa de demarcación entre la vagina y el vestíbulo. El tubo tiene de unos 10 a 12cm de longitud, medido desde el orifico uretral externo a la comisura ventral. Está relacionado dorsalmente, con el recto y el ano; centralmente, con el ligamento sacrotuberal ancho, el músculo semimembranoso y la arteria pudenda interna (SISSON Y GROSSMAN, 2001). El anillo vestibulovaginal se considera la unión del vestíbulo y la vagina, debido a la constricción de los músculos vulvar y vaginal que rodean esta área forman una barrera que minimiza la entrada de material contaminante al tracto (BLANCHARD y cols, 2003). 1.2.5 Vagina Canal que se extiende horizontalmente a través de la cavidad pelviana desde el cuello del útero hasta la vulva. Este órgano posee forma tubular, es de paredes delgadas y es completamente elástica, llega a medir de 25 a 30cm. de longitud. 28 Se encuentra conformada por una porción anterior y otra posterior. La vagina anterior está recubierta por epitelio cilíndrico simple que produce altas secreciones bajo la influencia de los estrógenos, con el objeto de facilitar la cópula y la función inmunológica por la gran concentración de macrófagos. La vagina posterior está recubierta por epitelio estratificado escamoso similar al de la piel (GUINTHER, 1992). La vagina tiene múltiples funciones en la reproducción, sin embargo, la principal función es la de recibir el órgano copulatorio y servir como receptáculo del eyaculado en la mayoría de las especies domesticas, sin embargo, en la yegua la eyaculación se produce en el cuerpo del útero, sitio en el cual van a permanecer los espermatozoides hasta ser transportados a los oviductos para la posterior fecundación (GUINTHER, 1992). 1.2.6 Útero El útero es un órgano muscular hueco, que se continúa por delante con las trompas uterinas y se abre por detrás en la vagina. Está situado principalmente en la cavidad abdominal, pero se extiende una corta distancia en el interior de la cavidad pelviana. Presenta forma de T y consta de un cuello (cérvix), un cuerpo y dos cuernos (HAFEZ, 2002). 29 Cuello o cérvix, en la yegua se considera como un pliegue que se proyecta de 2.5 a 5 cm del endometrio a la vagina. En realidad, el cuello es un robusto esfínter de músculo liso, firmemente cerrado excepto en el periodo de celo y en el acto del parto. En el primer caso el cuello se distiende en forma ligera por la acción de los estrógenos liberados en el estro, lo que permite que los espermatozoides penetren en el útero y puedan llegar a fertilizar un óvulo (SISSON Y GROSMAN, 2001). El cuello uterino tiene varias funciones en el proceso reproductivo. Transporte de espermatozoides. Tras ser eyaculados, los espermatozoides se orientan hacia la abertura interna. Después del apareamiento ó la inseminación artificial, en las criptas cervicales se depositan grandes cantidades de espermatozoides. El cuello uterino puede actuar como su depósito y de este modo proporcionar dosis de ellos a las vías superiores del aparato reproductor femenino (HAFEZ Y HAFEZ, 2002). Cuello uterino durante la preñez. Durante la preñez, el conducto cervical está ocluido por un moco turbio, espeso, altamente viscoso y no arborizante, que actúa como una barrera eficaz contra el transporte de espermatozoides y la invasión de la luz uterina por bacterias, lo cual impide las infecciones del útero (HAFEZ Y HAFEZ, 2002). 30 Cuerpo del útero, se extiende desde la unión uterotubárica del cérvix, su longitud varía de 35 a 50cm., se encuentra conformado por una membrana mucosa interna, una capa intermedia de músculo liso y una capa serosa externa. El útero realiza varias funciones entre las cuales, las más importantes las desarrolla el endometrio y los líquidos que secreta, interviniendo en el transporte de espermatozoides en el sitio de la eyaculación hasta el sitio de fecundación en el oviducto, regulación del funcionamiento del cuerpo amarillo e inicio de la implantación, gestación, parto e involución post-parto (SISSON Y GROSMAN, 2001). Cuernos uterinos, estos son cilíndricos cuando están moderadamente distendidos y su longitud es de aproximadamente 25cm. La extremidad anterior de cada uno forma una terminación obtusa que recibe la trompa uterina, posteriormente aumenta de calibre, convergen y se unen con el cuerpo del útero (SISSON Y GROSMA, 2001). 1.2.7 Oviductos Son conductos sinuosos que se extienden desde los ovarios hasta las puntas de los cuernos uterinos, con los que se continúan; llegan a medir de 20 a 30cm de longitud y se dividen en tres segmentos que varían en diámetro y tipo de epitelio, así: 31 El infundíbulo, corresponde a la abertura en forma de embudo cerca de los ovarios. En la yegua el infundíbulo está separado del ovario por varios pliegues en la mucosa, se encuentra conformado por epitelio cilíndrico ciliado. Su principal función es la de capturar el óvulo por acción de los estrógenos (GUINTER, 1993). Las fimbrias se encuentran libres excepto en un punto del polo superior del ovario. Esto asegura una estrecha aproximación de las fimbrias y la superficie ovárica (HAFEZ Y HAFEZ, 2002). El ámpula, ocupa aproximadamente la mitad de la longitud del oviducto y mide de 3 a 5mm. de diámetro, posee un revestimiento mucoso que tiene entre 20 y 40 pliegues ramificados elevados longitudinalmente, lo cual aumenta notablemente el área de luz, posee un peristaltismo descendente lo cual facilita la caída del óvulo para su posterior encuentro con el espermatozoide en la unión con el istmo (HAFEZ Y HAFEZ, 2002) El istmo, es la porción proximal estrecha del oviducto, que conecta este con la luz uterina, tiene un diámetro de 0.5 a 1mm., está conformado por pliegues con bordes bajos que van disminuyendo de tamaño hasta llegar a la unión uterotubárica. Esta porción posee un peristaltismo ascendente, el cual facilita el avance de los espermatozoides hasta el ámpula para la fecundación (HAFEZ, 1996). 32 1.2.8 Ovarios Los ovarios son glándulas bilaterales, ubicados debajo de la cuarta o quinta vértebra lumbar en la cavidad abdominal, están suspendidos por el ligamento ancho del útero o mesovario, poseen forma de fríjol (o de riñón) debido a la presencia de una fosa ovulatoria bien definida (HAFEZ, 1996), su tamaño varía dependiendo el contenido folicular, en fase de anestro oscila desde 4x2x2 cm. hasta 8x4x4 cm., tendiendo al tamaño mayor en yeguas viejas y grandes, dado que están en gran parte formados por tejido fibroso (ALLEN, 1994). La estructura del ovario de la yegua se encuentra conformada por: Túnica Albugínea, Médula Ovárica, Corteza Ovárica, Estroma Ovárico, Epitelio germinal y Fosa Ovárica (ALLEN, 1994). 1.2.8.1 Túnica Albugínea Cápsula densa de tejido conjuntivo fibroso que cubre la totalidad del ovario y corresponde a la capa más externa del ovario. Las células de tejido conjuntivo cercanas a la superficie están dispuestas de manera más o menos paralela a la superficie ovárica, y son un tanto más densas que las células situadas hacia la médula (SISSON Y GROSMAN, 2001). 33 1.2.8.2 Médula Ovárica La médula ovárica se encuentra conformada por tejido conjuntivo fibroelástico irregularmente dispuesto, y extenso sistema vascular y nervioso que llegan al ovario a través del hilio (SISSON Y GROSMAN, 2001). 1.2.8.3 Corteza Ovárica El tejido conjuntivo de la corteza contiene fibroblastos, fibras de colágeno y reticulares, vasos sanguíneos, vasos linfáticos y fibras de músculo liso. La corteza ovárica contiene folículos ováricos, cuerpos amarillos o ambos, en diferentes etapas de desarrollo o regresión (FRANSON, 1995). 1.2.8.4 Estroma Ovárico Células de tipo mesenquimatoso embrionario mal diferenciado, capaces de experimentar complejos cambios morfológicos durante la vida reproductiva; las células del estroma pueden dar origen a células de la teca interna o a células intersticiales (FRANSON, 1995). 34 1.2.8.5 Epitelio Germinal Capa de epitelio aplanado con abundantes micro vellosidades. Los cordones de células epiteliales germinativas invaden el estroma del ovario y al final forman islotes conocidos como folículos primitivos (FRANSON, 1995). 1.2.8.6 Fosa Ovárica En la yegua la ovulación ocurre en una zona limitada, Fosa ovárica, en esta el ovario comienza su desarrollo de la manera típica y el epitelio germinal cubre la totalidad del ovario, pero durante el periodo neonatal, este epitelio se concentra en esta zona. Esta fosa tiene menor irrigación sanguínea que el resto del folículo, evitando así mayores hemorragias (FRANDSON, 1995). 1.2.9 FOLÍCULO OVÁRICO A diferencia de las células sexuales masculinas, que forman cuatro espermatozoides a partir de cada célula sexual primaria, la maduración de la célula sexual primaria femenina da por resultado sólo un óvulo y tres células rudimentarias, denominadas cuerpos polares o polocitos. Por lo común, la división que produce el primer cuerpo polar es de naturaleza meiótica, o sea, una división en la cual los cromosomas se reducen a la mitad de la cantidad (de diploide a haploide). Entonces el óvulo sufre la división mitótica, en la que se separa el 35 segundo cuerpo polar. El primero puede también dividirse por mitosis o amitóticamente antes de que estos cuerpos polares se degeneren (FRANDSON, 1995). El crecimiento y maduración folicular representa una sucesión de transformaciones subcelulares y moleculares de diversos componentes del folículo como oocito, granulosa y teca (TESTART y cols., 1982) regidas por varios factores intraováricos e intrafoliculares y señales hormonales que conducen a la secreción de andrógenos y estrógenos. Los folículos ováricos se encuentran conformados por varios componentes, dentro de los cuales están: 1.2.9.1 Células de la teca: Se encuentra conformada por una porción externa y una porción interna, cuya función es producir andrógenos en respuesta a la concentración basal creciente de LH. Tienen receptores para LH desde etapas tempranas del crecimiento folicular y después de la ovulación se transforman en células tecaluteínicas (TESTART y cols., 1982). 1.2.9.2 Pared folicular: Formada por granulosa y teca separadas por una lámina basal. Experimenta cambios de desarrollo relacionados con la organogénesis de una glándula endocrina/exocrina que sintetiza hormonas esteroides (TESTART y cols., 1982). 36 1.2.9.3 Células de la granulosa: En los folículos antrales, por medio de microfibrillas las células de la granulosa se unen a la lámina basal y las células de la teca se unen a la lámina reticular. En folículos preovulatorios, hay conexión entre proyecciones de células de la granulosa a través de la lámina basal rota. Después de la ovulación, la capa granulosa es invadida por vasos y material conjuntivo (BLANCHARD, y cols. 2003). . 1.2.9.4 Folículo primordial: Folículos con oocitos de localización central y una sola capa de células de la granulosa, están separados entre si por estroma, constituido por fibroblastos, haces de colágeno y fibras reticulares. Se diferencian a partir de células germinales primordiales (oogonios) y permanecen en una profase meiótica suspendida hasta que reanudan su maduración, antes de que ocurra ovulación o atresia (BLANCHARD, y cols. 2003). Los folículos primordiales (figura 2) están formados por membrana basal o dos capas de células de la granulosa (o ambas) y un oocito reticular. La formación del oocito temprano es regulada por la red ovárica, tubular (BLANCHARD, y cols. 2003). 1.2.9.5 Folículo secundario: Proliferación de células aplanadas de la granulosa del folículo primordial, las cuales asumen aspecto poliédrico irregular. Las células foliculares secretan líquido, que se acumula en un espacio entre ellas llamado 37 antro. Las células foliculares que rodean el oocito se disponen en un polo del antro (cúmulo oóforo o prolígero ) y se desprenden hacia esta cavidad formando el folículo maduro (folículo de De Graaf), que se aproxima a la superficie ovárica (BLANCHARD, 2003). 1.2.9.6 Folículo terciario o vesicular: Bajo la influencia de gonadotropinas hipofisiarias, las células de la granulosa de folículos de capas múltiples secretan un líquido llamado licor folicular o albuminoso que se acumula en los espacios intercelulares (BLANCHARD, 2003). 1.2.9.7 Líquido folicular (en el antro): El antro (cavidad llena de liquido) está separado de la teca vascularizada por una membrana basal, de permeabilidad selectiva. Contiene esteroides, glucosaminoglucanos y muchos metabolitos. Como sodio y potasio en concentraciones similares a las séricas. Algunos componentes tienen actividad fisiológica: inhibidor de la maduración de oocitos, inhibidor de la unión de LH, Inhibinas, y diversas enzimas y ácido sulfúrico de condroitina. Contiene, sólo en folículos grandes, un elevado porcentaje de 17-estradiol en la fase folicular y progesterona durante la ovulación. La elevada concentración de progesterona después de la oleada de LH inhibe la actividad de la aromatasa localmente en el ovario (BLANCHARD, 2003). 1.2.9.8 Líquido folicular (entre las células de la granulosa): Es viscoso y rico en ácido hialurónico dentro de las células de la granulosa y especialmente en el 38 complejo monticular, el cual se acumula a medida que se acerca la ovulación hay proliferación de licor, el cual es estimulado por estrógenos. El líquido contiene receptores para FSH y estradiol. La FSH estimula la acumulación de cAMP, ocurriendo un aumento en la reactividad de las células de la granulosa a la FSH, sin cambio en el número de receptores para dicha hormona, pero para esto se requiere estradiol. Sólo en una fase tardía del desarrollo folicular se adquieren receptores para LH y ciclasa de adenilato reactiva a LH. Los andrógenos son aromatizados para su conversión en estrógenos. El 17-estradiol incrementa la capacidad de la FSH de inducir receptores para LH. La separación entre granulosa y teca se pierde al disolverse la membrana basal, formándose después de la ovulación células luteínicas, las cuales son fuente importante de progesterona en el cuerpo amarillo (INTERVET, 2007). 1.2.9.9 Zona pelúcida: Gruesa capa acelular gelatinosa de glucoproteína entre la superficie del oocito en crecimiento; constituida por polisacáridos, mucopolisacáridos, proteínas y glucoproteínas (HAFEZ, 2002). Además de lo anterior tiene microvellosidades y prolongaciones de las células foliculares incluidas que aumentan mucho el número conforme se diferencian las células de la granulosa y el oocito, esto incrementa el área superficial durante el crecimiento de este último (HAFEZ, 2002). Esta zona pelúcida tiene funciones importantes en las fases iniciales de la fecundación, cuando el espermatozoide debe reconocerla, establecer contacto con 39 ella y atravesarla antes de llegar a la membrana plasmática del ovulo, además también tiene funciones fisicoquímicas y de antigenicidad (HAFEZ, 2002). 1.2.9.10 Folículo de De Graff: Las células foliculares aumentan de tamaño y el antro se llena de licor folicular, el oocito es presionado contra un lado y rodeado por una acumulación de células foliculares; en el resto de la cavidad folicular se ha formado un epitelio de espesor más o menos uniforme llamado membrana granulosa. También se han formado las tecas internas y externas (HAFEZ, 2002). Posteriormente este folículo de Graff da origen al Folículo preovulatorio: Estructura en forma de vesícula que sobresale de la superficie del ovario debido a la rápida acumulación de líquido folicular y adelgazamiento de la capa granulosa. El líquido albuminoso, de textura viscosa se forma a partir de las secreciones de las células de la granulosa y proteínas plasmáticas transportadas hacia el interior del folículo por trasudación. El montículo ovárico se desprende del estrato granuloso, adelgazado y extensamente disociado. El oocito queda libre en el líquido albuminoso rodeado por una masa irregular de células (HAFEZ, 2002). 1.2.9.11 Cuerpo hemorrágico y Cuerpo amarillo: La cavidad folicular se llena de linfa y sangre de los vasos rotos de la teca, sangre de los líquidos foliculares y sangre de pequeños vasos que se rompen en la ovulación. Esto actúa como un “tapón” que sella la cavidad residual después que se ha liberado el oocito. 40 Comienzan a proliferar vasos intactos y células de tejido conjuntivo de la teca circundante (SISSON Y GROSMAN, 2001). La transformación de un folículo roto en un cuerpo amarillo conlleva a la formación de pliegues característicos de la capa de la granulosa, se da bajo la influencia de hormona luteinizantes apareciendo células luteínicas, de forma poliédrica o sin límites celulares definidos, están dispuestas en masas irregulares, en este momento se le conoce como el Cuerpo Amarillo (SISSON Y GROSMAN, 2001). 1.2.9.12 Cuerpo blanco: Tejido fibroso de color blanco que se forma a partir del cuerpo amarillo de ovulaciones previas (SISSON Y GROSMAN, 2001). En el crecimiento folicular intervienen la proliferación y la diferenciación –inducidas por hormonas- de células de la teca y de la granulosa, lo que en última instancia causa un incremento en la capacidad de los folículos de producir estradiol y de reaccionar a las gonadotropinas. La producción de estradiol determina cual folículo adquirirá los receptores de LH necesarios para la ovulación y luteinización (SISSON Y GROSMAN, 2001). 41 Figura 2 Clasificaciones Fisiológica (arriba) y Morfológica (abajo) de los Folículos Ovárico. Fuente: DVORAK, M. y TESARIK, J. 1980. En Biology of the Ovary: MOTTA P.P. and HAFFEZ E.S.E. London, Martinus Nijhoff P, folículo primordial; PM, folículo primario; S, folículo secundario; T, folículo terciario. 42 1.3 FISIOLOGÍA REPRODUCTIVA 1.3.1 Introducción Hay dos sistemas que regulan el proceso reproductivo: el endocrino y el nervioso, jugando ambos un papel específico. Es esencial que haya una sutil interrelación entre ambos para que se produzca la cascada de fenómenos que darán lugar finalmente al nacimiento y cría con éxito de una descendencia sana (GUINTER, 1992). Los estímulos medioambientales son registrados por los sentidos y transmitidos al cerebro. Las percepciones sensoriales pueden ser de distinta naturaleza. Los ojos (la luz o la visión de otros congéneres), la nariz (los olores sexuales), el tacto registran información del medio ambiente, y los nervios óptico, olfatorio, y sensoriales transmiten mensajes al cerebro. El cerebro es capaz de traducir la información y, en caso necesario, reaccionar enviando un impulso nervioso a través de las fibras nerviosas a los órganos de destino (GUINTER, 1992). El sistema hormonal es un sistema regulador que envía información por medio de mensajes químicos. Está regulado por bucles de retroalimentación e impulsos del sistema nervioso y otros órganos (GUINTER, 1992). Se puede definir una hormona como una sustancia química, producida en una glándula o tejido corporal, que estimula una reacción específica en tejidos sensibles a la misma. La acción del sistema hormonal se puede subdividir de acuerdo con la forma en que las hormonas (tabla 1) alcanzan las células diana. 43 Cuando actúan de forma autocrina, la célula productora es a la vez la diana. En forma paracrina, las hormonas actúan sobre las células u órganos próximos. Las hormonas endocrinas son transportadas a través de la sangre, mientras que las exocrinas son excretadas (al tracto digestivo, urinario, piel, etc.) antes de alcanzar los órganos diana. Hasta ahora, la mayoría de información disponible versa sobre las funciones endocrinas del sistema hormonal. A pesar de que durante la última década las funciones paracrina y autocrina han recibido más atención de los investigadores, muchos aspectos relativos a éstas permanecen desconocidos (GUINTER, 1992). Tabla 1 Origen, función principal y estructura química de las hormonas involucradas en la reproducción. (INTERVET, 1999) Nombre Origen Melatonina Glándula pineal Función principal Estructura Química Indicador de la duración Indolamina día/noche Estimula la liberación GnRH Hipotálamo de FSH y LH por la Péptido (10 aminoácidos) Hipófisis Hembra: estimula el FSH Hipófisis anterior desarrollo y maduración de los folículos Glicoproteína 44 Hembra: estimula la maduración de los folículos, LH Hipófisis anterior induce la ovulación, Glicoproteína formación y mantenimiento del cuerpo lúteo en el ovario Induce el comportamiento Ovario (granulosa Estrógenos De celo. Estimula la descarga Esteroide del folículo) preovulatoria de LH Inhibe la descarga Inhibina Ovario (granulosa) Péptido hipofisiaria de FSH Prepara el endometrio para La anidación de un embrión. Esteroide Progesterona Ovario (cuerpo Mantiene la gestación. Lúteo) Disminuye la liberación de GnRH y por ello impide nuevas ovulaciones Prostaglandina Útero Regresión del cuerpo lúteo Ácido Liposoluble F2α La yegua en los países tropicales como en Colombia se considera poliéstrica anual, lo cual se entiende como la presencia de muchos calores a lo largo del año, adicionalmente existe una estrecha relación entre la duración del día y el periodo anovulatorio. La ovulación se minimiza o suprime en invierno y es máxima en verano. La duración del ciclo varía con la estación (HUGHES 1972). 45 La pubertad en la yegua, como en el resto de especies domésticas, corresponde a la edad a la cual un animal alcanza la competencia para la reproducción, iniciando con la edad al primer estro, primera ovulación y edad a la cual puede quedar preñada sin efecto que la deteriore (tabla 2). Fisiológicamente se inicia cuando las fibras del hipotálamo son capaces de producir pulsos elevados de GnRH. La pubertad depende del estado de nutrición, crecimiento, desarrollo corporal, raza, factores genéticos, medio-ambientales y sociales (HUGHES 1972). Tabla 2: Reproducción en la hembra de diferentes especies. Datos recopilados de referencias estándar, incluidos en los de DUKES, PAYNE, ROBERTS Y SPECTOR. Promedio Inicio de la de edad al Duración del Duración del pubertad primer ciclo estral estro 21 días 5 días 1 a 2 días antes que (19 a 21 días) (4½ a 7½ días) termine el celo 14 a 22 21 días 18 horas 10 a 15 horas luego de meses (18 a 24 días) (12 a 28 horas) terminado el celo 8 a 10 21 días 2 días 30 a 36 horas después meses (18 a 24 días) (1 a 5 días) de iniciado el celo Animal Tiempo de ovulación servicio 24 meses Yegua (10 a 36 2 a 3 años meses) Vaca Cerda 4 a 24 meses 3 a 7 meses 46 Durante la estación reproductiva las yeguas entran en celo cada 21 (18-24) días como media. El celo dura unos 5 (3-9) días y la ovulación tiene lugar 24-48 horas antes del final del mismo. La fecundación tiene lugar en el oviducto y se puede producir hasta 30 horas después de la ovulación (WOODS, 1990). El transporte del óvulo desde el ovario al útero dura unos 3 días. La implantación del blastocisto tiene lugar a los 2 meses de la fecundación. La gestación dura 11 meses (310 – 365) días. El primer celo posparto, también llamado celo del potro, tiene lugar a los 5-15 días del parto. Posteriormente comienza de nuevo el ciclo normal. (BERGFELT y cols, 2007). 1.3.2 HORMONAS DE LA REPRODUCCIÓN El sistema endocrino ha evolucionado para permitir la coordinación y la regulación de los procesos fisiológicos a través de mensajeros químicos llamados hormonas. Las hormonas se han definido tradicionalmente como productos químicos sintetizados en órganos endocrinos específicos, transportados por el sistema vascular y capaces de actuar sobre órganos diana distantes a bajas concentraciones (CUNNINGHAM, 2003) Las hormonas peptídicas y esteroideas se consideran de las importantes para la reproducción; Las hormonas peptídicas se componen de una cadena de aminoácidos. A este grupo pertenecen las hormonas tróficas (alimentarías, de 47 mantenimiento) así como por ejemplo las hormonas liberadoras del hipotálamo y toda una serie de péptidos y polipéptidos producidos por el lóbulo anterior de la hipófisis (ENGELHARDT, 2005). El ciclo estral es controlado por cinco hormonas importantes y su comportamiento es peculiar durante este (CAMPOS, 2000). 1.3.2.1 Hormonas hipotalámicas La actividad gonadal está bajo el control del hipotálamo y de la pituitaria anterior .El hipotálamo es una estructura relativamente pequeña que se sitúa en la base media central del cerebro. El hipotálamo tiene agregados de neuronas que en conjunto se llaman núcleos, los cuales secretan hormonas peptídicas importantes para el manejo de la actividad pituitaria, estos péptidos se mueven hacia la pituitaria directamente, pasando a través de los axones de las neuronas o por medio de un sistema portal vascular sanguíneo. La pituitaria responde a los péptidos hipotalámicos produciendo hormonas esenciales para el control de las gónadas (CUNNINGHAM, 2003) Las hormonas del hipotálamo que regulan la reproducción son la hormona liberadora de gonadotropinas (GnRH o LHRF), Adrenocorticotropa (ACTH) y el factor inhibidor de prolactina. El hipotálamo es también la fuente de oxitocina y vasopresina, que están almacenadas en la neurohipófisis (lóbulo posterior de la 48 hipófisis) (HAFEZ y HAFEZ, 2000) 1.3.2.2 Hormonas de la adenohipófisis La hipófisis se localiza en la silla turca, una depresión ósea en la base del cerebro. La glándula se subdivide en: lóbulo anterior, intermedio y posterior, es de resaltar que en los equinos la parte intermedia es bien desarrollada a diferencia de las otras especies. (HAFEZ y HAFEZ, 2002). La adenohipófisis produce tres hormonas importantes en los procesos de reproducción de la hembra (MELVIN, 1999), la hormona estimulante del folículo (FSH) y la luteinizante (LH) y la prolactina (PRL). La FSH y la LH ejercen un efecto sinérgico en el desarrollo y en la ovulación de los folículos (GUYTON, 1996); la principal función de la FSH es estimular el crecimiento de los folículos, la LH es importante para el proceso ovulatorio y para la luteinización de la granulosa, lo que resulta en la formación del cuerpo lúteo (GINTHER, 1992). La PRL se relaciona con el desarrollo del tejido secretor de la glándula mamaria y el mantenimiento de la lactación (MELVIN, 1999). 1.3.2.3 Hormona Folículo Estimulante (FSH) La FSH estimula el crecimiento folicular durante el inicio del proestro y directa o indirectamente provoca elevación de los estrógenos ováricos. La rápida elevación 49 de FSH junto con LH durante el estro parece ser requisito necesario para el crecimiento y maduración de los folículos de De Graff, necesarios para la ovulación. La FSH no causa la secreción de estrógeno del ovario por sí sola, sino que necesita de la presencia de LH para estimular la producción de estrógenos. (HAFEZ y HAFEZ, 2000). En las yeguas en un ciclo normal ocurren dos oleadas de FSH, aproximadamente entre los días 20 y 11 antes de la ovulación; hacia la ovulación ocurren oleadas continuas de FSH y LH, lo cual estimula el crecimiento folicular aproximadamente de 2 mm. de diámetro hasta llegar a un folículo preovulatorio de 35 a 42 mm de diámetro (HAFEZ, 1996). Se cree que la oleada de hormona folículo-estimulante que ocurre en el periodo de estro tardío-diestro temprano inicia el reclutamiento y crecimiento de un promedio de 20 folículos; y la oleada que ocurre en la mitad del diestro es muy importante para el desarrollo subsecuente de folículos destinados a la ovulación, 10 a 13 días posterior a la segunda oleada de FSH (HAFEZ, 1996). 1.3.2.4 Hormona Luteinizante (LH) Con el celo se inician los picos de estrógenos, que a su vez inician la liberación de LH; después de la ovulación se forma un cuerpo lúteo en cada sitio de la ovulación. La formación ocurre rápidamente y para el día 4 ó 5 de ciclo estral, ya 50 está completamente formado, y un incremento detectable de progesterona en sangre indica la fase de diestro (GUINTER, 1992). En el control de la secreción de LH participan dos mecanismos a) un componente hipofisiario del sistema nervioso central, encargado de un ritmo circanual basal de la liberación de la hormona, asociada a un parámetro ambiental e independiente de influencias ováricas, probablemente relacionadas con el fotoperiodo y es el estimulo que hace que las yeguas en países estaciónales no ciclen en las temporadas de invierno; y b) un componente ovárico de carácter esteroidal que modifica el ritmo primario de luteotropina durante la temporada reproductiva, que sería el caso de las hembras de los países tropicales en donde ciclan todo el año (GARCÍA Y GUINTHER, 1979). Normalmente los niveles de la LH aumentan al inicio del celo y mantienen este ascenso gradualmente hasta alcanzar su mayor concentración hacia los días uno ó dos luego de la ovulación, este asenso en los niveles puede estar relacionado con la estimulación de la maduración del folículo por medio del estro (GARCÍA Y GUINTER, 1979). Se observa una relación inversa entre los niveles de LH y progesterona, lo cual sugiere una retroalimentación negativa, pero no hay tal relación entre las concentraciones de FSH y progesterona (GARCÍA Y GUINTER, 1979). 51 El asenso luteotrópico se observa en el estro y se mantiene hasta días después de la ovulación, donde alcanza su pico más alto y luego del día tres se observa un descenso gradual en los niveles de LH, hasta alcanzar los valores normales de diestro en donde se mantiene hasta el nuevo celo (GESCHWIND Y COLS., 1975). Es posible que las altas concentraciones persistentes de LH plasmáticas se deban a una vida media prolongada de la variante endógena y a la vez está, se relaciona íntimamente a la cantidad relativamente grande de segundas ovulaciones detectadas en muchos ciclos estrales (GESCHWIND y cols., 1975). 1.3.2.5 Hormonas neurohipofisiarias Las hormonas de la hipófisis posterior difieren de la otras hormonas hipofisiarias en que ellas no se originan en la hipófisis, sino que únicamente se almacenan ahí hasta que se necesiten (HAFEZ y HAFEZ, 2000), las dos hormonas importantes liberadas por la neurohipófisis son la vasopresina y la oxitocina (CUNNINGHAM, 2003.) Estas hormonas se producen verdaderamente en el hipotálamo y luego son transferidas a la hipófisis posterior, no a través de un sistema vascular, sino a lo largo de los axones del sistema nervioso (CALDANI y cols., 1993). 52 1.3.3 LA OXITOCINA Es sintetizada en el núcleo supraóptico del hipotálamo y es transportada por los axones de los nervios hipotalámico hipofisiarios, en pequeñas vesículas rodeadas de una membrana. La vesículas son almacenadas en las terminaciones nerviosas junto a los lechos capilares hasta que son liberadas a la circulación, la oxitocina también se produce en el cuerpo amarillo; por lo tanto tiene dos lugares de origen : el hipotálamo y el ovario (NOAKES, 2001). La oxitocina tiene un papel muy importante dentro de la reproducción; durante la fase folicular del ciclo estral y durante las últimas etapas de la gestación estimula las contracciones uterinas, que facilitan el transporte del espermatozoide al oviducto durante el estro, el estiramiento uterino durante el parto que es causado por el paso del feto que estimula una liberación refleja de oxitocina (reflejo de Ferguson). Sin embargo la acción más conocida de la oxitocina es la liberación refleja de la leche. (HAFEZ y HAFEZ, 2000). La oxitocina ovárica está involucrada en la función lútea. Esta actúa en el endometrio para inducir la liberación de prostaglandinas F 2α, que tiene una acción luteolítica. (BEHRENS y cols, 1993). 53 1.3.4 RELAXINA La Relaxina en la yegua es producida en la placenta (CUNNINGHAM, 2003). La principal acción biológica de la relaxina es la dilatación del cuello uterino y la vagina antes del parto. (HAFEZ y HAFEZ, 2000), la Relaxina puede ser importante para el mantenimiento de la gestación por su acción sinérgica con la progesterona. (AMANN, 2004) 1.3.5 INHIBINAS Y ACTIVINAS Estas hormonas fueron aisladas de líquidos gonadales debido a sus efectos en la producción de FSH, las Inhibinas y activinas son reguladoras pancreáticas ya que modulan la señal endocrina de LH (AMANN, 2004). 1.3.5.1 Inhibinas: Las gónadas son la fuente principal de producción de Inhibinas y de proteínas relacionadas, que contribuyen a la regulación endocrina del sistema reproductor. Las células de Sertoli en el macho y las células de la granulosa en la hembra las producen. Estas no son esteroides, sino proteínas que cuentan de dos subunidades con puentes de disulfuro alfa y beta, son secretadas por la sangre venosa en las hembras, desempeñan una función importante en la regulación 54 hormonal de la foliculogénesis ovárica durante el ciclo estral (SAMPER, 2000). Las Inhibinas actúan como señales químicas a la hipófisis con respecto al número de folículos que crecen en el ovario. Las Inhibinas reducen la secreción de FSH a un nivel tal, que mantiene el número de ovulaciones específico para cada especie, ya sea para especies de solo una cría como la yegua ó varias crías. (HAFEZ y HAFEZ, 2000) 1.3.5.2 Activinas: El líquido folicular contiene una fracción que estimula en lugar de inhibir la secreción de FSH. Las activinas son potentes dímeros liberadores de FSH (dímeros de las subunidades beta) y están presentes en líquidos gonadales por ejemplo el líquido folicular. (HAFEZ y HAFEZ, 2000) 1.3.6 PROSTAGLANDINA F2α Es un potente agente luteolítico endógeno que al finalizar el periodo de diestro provoca la regresión del cuerpo lúteo, lo que ocasiona una marcada disminución de las concentraciones sanguíneas de progesterona. Estas bajas concentraciones de progesterona pueden servir como estimulo que ocasionara liberación de FSH, LH y prolactina por la hipófisis (CUNNINGHAM, 2003). En yeguas cíclicas normales, las concentraciones en el plasma de la vena uterina 55 y en lavados uterinos aumenta desde el día ocho hasta los días 14 a 16, cuando ocurre la luteólisis y las concentraciones plasmáticas de progesterona disminuyen, la cantidad de PGF2-alfa unida a receptores del cuerpo lúteo es máxima en el día 14 del ciclo y el 18 de la preñez (CUNNINGHAM, 2003). 1.3.7 PROGESTERONA Esta importante hormona es producida en gran parte por el cuerpo amarillo, aunque también se encuentra en la corteza suprarrenal, placenta y testículos. En general, la progesterona ejerce su acción sobre los tejidos previamente preparados por estrógenos algunas veces en conjunción sinérgica con ellos (FRANDSON, 1995). Durante los primeros 120 días de preñez la progesterona proviene del ovario, y en el resto de la gestación la placenta es la encargada de producir esta hormona y mantener la preñez hasta el momento del parto (FRANDSON, 1995). 1.3.8 ESTRÓGENOS El termino estrógeno se refiere a un grupo de compuestos que actúan como hormonas sexuales femeninas y estimulan las glándulas sexuales accesorias de la hembra. La estrona, el estradiol y el estriol son estrógenos producidos por la 56 placenta ó el ovario de los mamíferos (FRANDSON, 1995). La acción de los estrógenos sobre las glándulas accesorias puede ser bien relacionada con la conducta peculiar del estro; estimulando por ejemplo, la actividad muscular de los conductos uterinos y el útero a los que sensibiliza a la acción de la progesterona (FRANDSON, 1995). El recubrimiento epitelial de la vagina y la vulva estimulado por los estrógenos en algunas especies se cornifica durante el estro. Los estrógenos más abundantes son los factores importantes en la ocurrencia de la libido, impulso sexual que en la hembra se relaciona con el consentimiento de monta (FRANDSON, 1995). 1.3.9 CICLO ESTRAL Figura 3. Secuencia regular del ciclo estral de la yegua. (MOTTERSHEAD, 2001). 57 El ciclo estral en las yeguas, corresponde al intervalo entre el comienzo de un periodo de celo hasta el inicio del siguiente, se regula de manera directa por la acción de hormonas del ovario y de forma indirecta por otras secretadas por el lóbulo anterior de la hipófisis. El ciclo se divide en fase folicular y fase luteal, las cuales varían en longitud según la raza y estación (MOTTERSHEAD, 2001). La onda folicular se inicia con la emergencia simultánea y el desarrollo de muchos folículos. Luego de la emergencia, los folículos crecen paralelamente durante aproximadamente 6 días, o hasta que el folículo de mayor tamaño mida 23 mm. Durante el desarrollo de la onda se presentan una serie de eventos que la caracterizan (BERGFELT, y cols. 2007). En este sentido, un evento importante es la desviación, que es la tasa de crecimiento que empieza a diferenciar un folículo de otro. Luego de ocurrida la desviación uno de los folículos, usualmente el de mayor tamaño, llega a ser dominante, y continúa creciendo hasta el diámetro preovulatorio, los folículos restantes no continúan su crecimiento y regresan, denominados folículos subordinados (BERGFELT, y cols. 2007). El ciclo ovárico de la yegua se divide en dos periodos, el estro y diestro. Biológicamente, el estro es el espacio de tiempo durante el cual la yegua admite al semental, mientras que el diestro es el resto de días en que no lo admite (BERGFELT, y cols. 2007). 58 Durante la fase de estro, el óvulo se desprende del ovario, por lo que está en disposición de ser fecundado por el espermatozoide del semental. Por otra parte, durante la fase de diestro el útero está preparado para acoger el óvulo fecundado (en el caso de que hubiese tenido lugar su fecundación). Si el óvulo no es fecundado, esta fase previa a la gestación termina, iniciándose una nueva fase de estro que proporciona otra oportunidad para el apareamiento y para la fecundación. Una vez que el huevo fecundado ha penetrado en el útero, el ciclo estral se interrumpe y la yegua mantiene una actividad sexual equivalente a la del diestro (MELVIN, 1999). Durante el celo o estro, el tracto genital está relajado y su superficie lubricada por un revestimiento de mucus fluido. Los labios vulvares están engrosados y dilatados y su superficie humedecida con moco procedente de la vagina. Los músculos de la vulva permiten a la yegua aumentar o disminuir el diámetro longitudinal de la misma. En esta fase, y resumidamente, lo que ocurre es que el óvulo se desprende del folículo, coincidiendo con una conducta de aceptación del semental. El óvulo, junto con el líquido y restos del folículo roto, penetra en la trompa de Falopio, en la que se halla en disposición de ser fecundado por el semen del semental. Teóricamente, el semen debe hallarse en la trompa de Falopio antes de que tenga lugar la ovulación (FRANDSON, 1995). El diestro es una fase de preparación para que pueda desarrollarse el embrión, el 59 cual llega al útero el quinto o sexto día después de su fecundación. Durante este tiempo, la mucosa del útero se ha modificado pasando desde un estado de humedad a un estado seco y pegajoso (FRANDSON, 1995). Figura 4. Perfiles Hormonales y su Relación con el Desarrollo Folicular (parte superior) y Relaciones de Retroalimentación Asociadas con varios Órganos Reproductivos (parte inferior) (BERGFELT, 2000) 60 La duración del estro varia con la yegua y de un ciclo estral a otro en la misma yegua. Bajo los siguientes factores el estro pude verse afectado: 1) la capa serosa que rodea el ovario obliga al folículo a emigrar para llegar a la fosa ovulatoria y reventarse; 2) el folículo preovulatorio requiere una cantidad de tiempo mayor para alcanzar el tamaño máximo debido a que la cantidad de receptores para FSH es menor que en otras especies, por último la ovulación es demorada por que las concentraciones de LH son menores comparadas con las de FSH (HAFEZ, 1996). Figura 5. Diagrama del ciclo estral Fuente: ROMANO y cols. Braz J Vet Res Anim Sci [On Line], 1998. 61 2. REGUMATE® Es un progestágeno sintético (Altrenogest), programador y sincronizador del ciclo estral en ganado equino; es una solución del aceite vegetal para la administración oral, Regumate® es Altrenogest al 0.4% en presentación de 360 ml en un envase presurizado con un aplicador. Al presionar y soltar el aplicador se obtienen 5 ml. Esta es la dosis diaria para una yegua que pesa entre 450 y 500 kg (0.044 mg de Altrenogest por kg de peso vivo) y se administra por vía oral, con una jeringa directamente (a través del espacio interdentario) en la parte posterior de la lengua o sobre el grano. El programa de tratamiento con Regumate® es en realidad muy flexible y puede adaptarse a cada yegua y a cada necesidad en particular. El estro se puede suprimir por el tiempo que se desee (INTERVET, 2004). La administración de Regumate® tiene infinidad de aplicaciones en yeguas, ya que es una manera eficaz de controlar el ciclo estral (LEE, 2003). En yeguas de recría Regumate® se utiliza para regular el estro en la etapa de transición, para sincronizar el estro en yeguas cíclicas, para mejorar el tono uterino y mantener la gestación en yeguas que se sospeche de insuficiencia lútea primaria. Está indicado también para evitar el aborto en yeguas gestantes que enfermen de cólico, para aquellas que vayan a ser transportadas sobretodo distancias largas, o bien que presenten endotoxemia o dolor crónico (INTERVET, 2004). 62 El mecanismo mediante el cual Regumate® logra este efecto no está totalmente esclarecido, sin embargo, puede explicarse de manera muy sencilla como la retroalimentación negativa que ejerce sobre la liberación de GnRH (hormona gonadotrópica) del hipotálamo, La disminución de los niveles de GnRH produce a su vez, inhibición de LH (hormona luteinizante) de la hipófisis anterior y en teoría, hay retardo en la maduración folicular, en la ovulación y se inhibe el comportamiento de estro (la yegua manifiesta el estro permaneciendo estática, levanta la cola, orina, espejea y separa los miembros posteriores) (INTERVET, 2004). 2.1 Ventajas del uso de Regumate® Sobre las progesteronas inyectables: Cualquier persona puede administrar Regumate®. Regumate® no produce inflamaciones o abscesos que inutilicen al animal para el entrenamiento o el trabajo (Intervet, 2004). Sobre los anabólicos esferoidales Regumate® no produce comportamiento agresivo ni masculinización. Regumate® no produce cambios en el aspecto físico. 63 Regumate® no tiene efectos secundarios. Una yegua que ha estado bajo el tratamiento con Regumate® puede retirarse de las competencias y dedicarse a la recría en cualquier momento. Regumate® no produce inflamaciones o abscesos que inutilicen al animal para el entrenamiento ó el trabajo. (INTERVET, 2004). 64 3. MATERIALES 10 Yeguas criollas colombianas con edades entre 5 y 10 años e historial clínico reproductivo. Criadero Las Tinajas, Puerto Berrio Antioquia. 1 Ecógrafo Sonovet 2000, sonda LV 4-7 MHz 65mm y de 4 pulgadas. Criadero Las Tinajas 11 Ecografías/animal Total: 110 Ecografías. 50 ml de Regumate®/animal Total: 500 ml. de Regumate®. Intervet. 10 mg (2 ml.) de Benzoato de estradiol/animal Total: 20 ml. de Benzoato de estradiol. 1 Dosis por 1500UI de Chorulon®/animal Chorulon®. Intervet. 20 Jeringas/10 ml. 20 Jeringas/3 ml. 20 Jeringas/5 ml. Total: 10 dosis por 1500 UI de 65 4. METODOLOGÍA: El trabajo se realizó en el criadero Las Tinajas, ubicado en el municipio de Puerto Berrio, Antioquia a 150 metros sobre el nivel del mar, con temperatura promedio de 28 grados Celsius. Se contó con 10 yeguas de la raza Criolla de Paso Colombiano, con edades entre 5 y 10 años e historial clínico reproductivo normal. Las yeguas están todas en pastoreo permanente y no recibieron ninguna suplementación nutricional antes ni durante el trabajo. Este procedimiento se realizó para desarrollar un protocolo base para mejorar las dificultades que se presentan en criaderos donde no se tiene facilidad de detección de celos y llegar a realizar una inseminación artificial más efectiva. 4.1 METODOLOGÍA ESTADÍSTICA: Se hizo por medio de estadística descriptiva (razón por la cual no hay grupo testigo), teniendo en cuenta: proporción, varianza, desviación estándar y coeficiente de variación; los resultados serán publicados a través de Infovet (medio informativo de laboratorios Intervet) y en la revista Fedequinas (sujeto a su aceptación). Las variables de interés que se consideraron durante el tratamiento son, tamaño del folículo al día de ovulación, días a la ovulación a partir del día 0 de tratamiento, porcentaje de yeguas en los días de la ovulación y porcentaje del tamaño del folículo al día de ovulación. 66 5. CRONOGRAMA DE ACTIVIDADES Las actividades realizadas están descritas en la tabla No 3. Tabla 3. Cronograma de Actividades DIA ACTIVIDAD -6 Ecografía -3 Ecografía 0 Ecografía Regumate oral 5 ml Benzoato de estradiol 10 mg, vía intramuscular 1 Regumate® oral 5 ml 2 Ecografía Regumate® oral 5 ml 3 Regumate® oral 5 ml 4 Ecografía Regumate® oral 5 ml 5 Regumate® oral 5 ml 6 Ecografía Regumate® oral 5 ml 7 Regumate® oral 5 ml 67 8 Ecografía Regumate® oral 5 ml 9 Regumate® oral 5 ml 10 Ecografía 11 12 Ecografía 13 Ecografía 14... Ecografía. Una vez el folículo tenga 35 mm de diámetro se aplicara 1500 UI de Chorulon® y se hicieron ecografías cada 12 horas hasta la ovulación 68 6. ANÁLISIS 6.1 ANÁLISIS ESTADÍSTICO La evaluación de la eficiencia del progestágeno sintético Altrenogest (Regumate®), Benzoato de estradiol (Estrozoo) y Gonadotropina Coriónica humana (hCG) (Chorulon®) en yeguas criollas del criadero Las Tinajas en Puerto Berrio, Antioquia, buscando sincronizar el ciclo estral de los animales tratados, se hizo por medio de estadística descriptiva en donde se tuvieron en cuenta los elementos como: promedio, varianza, desviación estándar y coeficiente de variación. Las variables de interés a considerar fueron: Crecimiento folicular durante la investigación. Días a la ovulación desde el día cero de la investigación. Tamaño del folículo a la ovulación. 69 7. RESULTADOS Las yeguas en el presente trabajo presentaron una buena tasa de sincronización de la ovulación, en promedio esta fue 18.2 días después de iniciado el tratamiento con Altrenogest tal como se ven el gráfico 1, igualmente, el tiempo transcurrido entre el inicio del protocolo sincronizador y el momento en que las yeguas alcanzaron un diámetro de 35 mm fue de 16.1dias (Gráfico1) Gráfico1. Días pos tratamiento en que las yeguas alcanzaron 35 mm de diámetro folicular y a la ovulación del lote tratado D í a s YEGUAS 70 Tabla 4. Días a la ovulación de cada una de las yeguas después del tratamiento con Regumate®. Yeguas 1 2 3 4 5 6 7 8 9 10 Días a ovulación 18 19 17 17 22 17 23 17 19 13 Tabla 5. Análisis estadístico de Días a la ovulación después del tratamiento con Regumate®. Días a la ovulación Media 18,2 Mediana 17,5 Moda 17 Desviación estándar 2,82055944 Varianza de la muestra 7,955555556 Coeficiente de variación 0,117354586 Rango 10 Mínimo 13 Máximo 23 71 El tamaño folicular de las yeguas en el estudio posterior a la terminación del suministro del Altrenogest fue ascendente tal como lo muestra el gráfico 2, en donde las yeguas iniciaron con un folículo dominante y continuaron su crecimiento hasta alcanzar 35 mm de diámetro, momento en el cual recibieron la inyección de hCG y posteriormente hasta la ovulación. Gráfico 2. Crecimiento folicular de las yeguas una vez terminado el suministro de Altrenogest. Tamaño folicular en mm # yeguas Una vez las yeguas alcanzaron 35 mm de diámetro, lo cual ocurrió 6.1 días en promedio después de finalizado el Altrenogest (gráfico 3, tabla 6 y 7), recibieron la aplicación de Chorulon®, induciendo la ovulación 54 horas en promedio en la totalidad de las yeguas (Gráfico 4, tablas 8 y 9). 72 Gráfica 3. Días que tardaron los folículos para llegar a 35mm. Después de terminado el tratamiento con Regumate®. Días Yeguas Tabla 6. Días que se demoro el folículo de cada una de las yeguas desde finalizado el suministro de Altrenogest hasta llegar a 35mm. Yegua 1 2 3 4 5 6 7 8 9 10 Días a los 35 mm 5 7 5 5 10 5 10 5 7 2 73 Tabla7. Análisis estadístico de los días que tardaron los folículos para llegar a 35mm. después del tratamiento con Regumate®. Días a los 35mm Media 6,1 Mediana 5 Moda 5 Desviación estándar Varianza de la muestra Coeficiente de variación 2,469817807 6,1 0,410419424 Rango 8 Mínimo 2 Máximo 10 Gráfico 4. Número de horas a la ovulación pos administración de Chorulon® para cada una de las yeguas. 74 Tabla 8. Número de horas desde la inyección de Chorulon® hasta la ovulación para cada una de las yeguas. Yeguas 1 2 3 4 5 6 7 8 9 10 Horas a la ovulación pos Chorulón 72 36 48 48 48 48 96 60 36 48 Tabla 9. Análisis estadístico de las horas desde la inyección de Chorulon® hasta la ovulación. Media 54 Mediana Moda Desviación estándar Coeficiente de variación Rango Mínimo Máximo 48 48 18.110 1.575 60 36 96 Las yeguas tratadas tuvieron un tamaño de folículo ovulatorio de 37.9 mm presentando valores mínimos de 34 mm y máximos de 41 mm tal como se observa en el gráfico 5; tabla 10 y 11. 75 Tabla 10. Tamaño del folículo al momento de la ovulación. Yeguas 1 2 3 4 5 6 7 8 9 10 Tamaño a la ovulación (mm) 37 34 39 37 39 38 38 41 36 40 Tabla 11. Análisis estadístico del tamaño del folículo al momento de la ovulación tamaño ovulación Media 37,9 Mediana 38 Moda 37 Desviación estándar Varianza de la muestra Coeficiente de variación 2,024845673 4,1 0,433637384 Rango 7 Mínimo 34 Máximo 41 76 Gráfico 5. Tamaño del folículo (mm) al momento de la ovulación. YEGUAS Tamaño del Folículo al momento d ela ovulación 45 40 35 30 25 20 15 10 5 0 Tamaño del Folículo al momento d ela ovulación 1 2 3 4 5 6 7 8 9 10 DÍAS El crecimiento folicular diario medido entre la primera ecografía realizada al folículo dominante de las yeguas y la última, demostró un crecimiento de 2.83 mm diarios después de la aplicación de hCG como se ve en la tabla 12 y 13. Tabla 12. Crecimiento folicular en mm desde el día en que aparece el folículo ovulatorio y la ovulación del mismo. Yeguas 1 2 3 4 5 6 7 8 9 10 Primera medición en mm. 22 17 24 17 19 25 16 27 24 34 Última medición en mm. 37 37 48 37 39 38 38 41 37 40 Días transcurridos 6 7 5 5 8 5 9 6 6 2 Crecimiento folicular diario en mm. 2,5 2,9 4,8 4,0 2,5 2,6 2,4 2,3 2,2 3,0 77 Tabla 13. . Análisis estadístico del crecimiento folicular diario durante el tratamiento. Crecimiento Folicular Diario Media 2,831 Mediana 2,6 Moda 2,5 Desviación Estándar 0,8 Varianza de la muestra 0,7 Coeficiente de asimetría 1,655 Mínimo 2.2 Máximo 4.8 78 8. DISCUSIÓN Los resultados obtenidos con el esquema de sincronización utilizando Altrenogest (Regumate®), Benzoato de estradiol (Estrozoo®) y hCG (Chorulon®) fueron adecuados ya que el total de las yeguas tratadas ovularon de forma sincrónica (18.2 días después de iniciado el tratamiento) con una desviación estándar de 2.8. Este dato concuerda con lo reportado por CAÑON y AVILA, (2007), quienes usando el mismo tratamiento pero en yeguas en anestro y en la Sabana de Bogotá reportaron una duración de 20.5 días al igual que concuerdan con MORRIS y ALLEN, (2001) quienes trabajando con protocolos para realizar inseminación artificial y transferencia de embriones indicaron que los días de ovulación de las yeguas tratadas se encuentran en un rango de 16 a 22 después de iniciado el tratamiento y en 1983, SQUIRES y cols, encontraron que el intervalo entre la finalización del tratamiento a la ovulación de las yeguas tratadas con Altrenogest se redujo de forma significativa en comparación con las yeguas del grupo control. La duración en días entre un diámetro de 35mm y la ovulación tuvo una media de 54 horas con unas desviación estándar de 18.11 reportado con DUCHAMP y cols. (1987), lo que GRIMMETT concuerda con lo y PERKINGS, (2001) quienes encontraron que tras la administración de hCG en folículos mayores a 35mm ocurre la ovulación 50 horas después en el 89% de los casos. 79 Por otro lado , las yeguas tardaron en promedio 6.1 días después de finalizado el tratamiento en tener un folículo de 35mm (con un rango de 8 días), lo que indica que este es el mejor momento para usar un inductor de ovulación, tipo hCG tal como lo mencionan DUCHAMP y cols (1987) y BARRIER-BATTUT y cols (2001) quienes describieron la importancia del uso de gonadotropinas coriónicas con el objetivo de inducir la ovulación en aquellas yeguas con folículos mayores a 38mm, lo que según ellos, coincidía con el 3er ó 4to día de celo. De igual forma estos autores recomiendan el uso de administraciones pulsátiles de hormonas gonadotrópicas para inducir ovulación al igual que la aplicación de implantes de liberación lenta de análogos de GnRH aunque terminan su análisis recomendando la aplicación simple de una inyección de GnRH o de hCG, tal como se uso en el presente protocolo. En el presente trabajo se obtuvo un tamaño folicular promedio al momento de la ovulación de 37.9 mm. Este dato concuerda con lo reportado por CAÑON y AVILA, (2007) quienes en su estudio con 15 yeguas criollas en la sabana de Bogotá, encontraron una media de diámetro folicular al momento de la ovulación de 36.8 mm. De igual forma (GLAZAR y cols. 2004) hicieron un estudio con 21 yeguas que estaban entre 3 y 9 años, haciendo un monitoreo ultrasonográfico comparando el uso de Altrenogest entre el día 5 y 15 pos ovulación mas una inyección de 250 mg. de prostaglandina (Estrumate®) versus la misma aplicación de Altrenogest adicionada de una dosis de prostaglandina los días 5 y 15 mas un implante de GnRH el primer día pos ovulación y removido 2 días después; en esta 80 investigación, confirmaron que la administración de GnRH a las yeguas indujo la luteinización y ovulación de los folículos durante el periodo de diestro. En una investigación realizada en el laboratorio de Reproducción y Biotecnología Animal de la Universidad de Colorado se confirmó que la administración de Altrenogest y Gonadotropinas es muy efectiva para inducir la ovulación de folículos mayores de 35 mm en yeguas (SQUIRES y cols. 1993). En el presente estudio después de la aparición del folículo ovulatorio y su ovulación, este tuvo una tasa de crecimiento de 2.8 mm por día, lo cual concuerda con lo reportado por GINTHER y cols. (1993), quienes encontraron un crecimiento folicular en la etapa del metaestro entre 2 y 5 mm y de 3 a 5 mm durante el periodo de diestro. Sin embargo se debe aclarar que en el reporte de GINTHER y cols. el crecimiento folicular final no se vio afectado por la aplicación de ningún compuesto hormonal mientras que en el presente trabajo, las yeguas recibieron una aplicación de hCG cuando estos alcanzaron al menos 35 mm, lo que pudo haber incrementado la tasa de crecimiento final de folículo o disminuido el diámetro máximo que este hubiera tenido si no hubiera recibido ningún tratamiento, sin embargo, esto no se investigó en el presente trabajo. 81 9. CONCLUSIONES En el presente trabajo se evaluó la eficiencia del Altrenogest junto con Benzoato de estradiol y a la Gonadotropina Coriónica humana como método para sincronizar la ovulación en yeguas criollas, el cual fue eficiente ya que se consiguió la ovulación de casi todas las yegua en un rango corto de tiempo, lo cual puede ser importante para la elaboración de protocolos de campo para manejo reproductivo equino en aquellas situaciones en que el monitoreo ecográfico o transrectal no pueda ser hecho con la regularidad que se requiere. El resultado obtenido en este trabajo en cuanto al tiempo de ovulación de folículos mayores a 35mm que reciben una aplicación de hCG indica el beneficio que puede tener el uso de este medicamento hormonal para fijar la ovulación en programas de Inseminación artificial en yeguas de la raza criolla. Es importante mencionar que existen pocos reportes sobre el uso de Regumate en el manejo reproductivo en condiciones no estacionales, aunque es un producto de uso frecuente en países con reproducción luminodependientes por lo cual este trabajo, al igual que uno hecho en la misma universidad en la Sabana de Bogotá, propone nuevos usos y nuevos 82 protocolos de trabajo para las yeguas criollas en Colombia, facilitando las labores reproductivas especialmente en aquellas zonas de difícil acceso o apartadas de las grandes ciudades. Uno de los principales resultados obtenidos con el protocolo evaluado fue conseguir una correcta sincronización de la oleada folicular, al igual que una ovulación inducida de forma sincrónica en todas las yeguas que recibieron el protocolo propuesto. 83 10. RECOMENDACIONES Realizar nuevas investigaciones con el protocolo Altrenogest oral, Benzoato de estradiol y Gonadotropina Coriónica humana en yeguas criollas de otras localidades colombianas para determinar posibles variaciones debidas al ambiente, manejo nutricional, etc. Ya que el Altrenogest es utilizado para inducir la aparición de celo y ovulación en yeguas estacionales en épocas de no reproducción, se recomienda realizar mas estudios de campo para comprobar su eficacia en yeguas posparto que generalmente se encuentran en anestro y lograr su preñez lo antes posible. Realizar una nueva investigación que involucre los análisis de preñeces obtenidas con este y otros protocolos sincronizadores, ya que el presente trabajo solo se limito a medir el grado de sincronía de algunos eventos hasta finalizada la ovulación. 84 11. BIBLIOGRAFÍA ALVARENGA, M.A. BIANCO, C. Y MOREIRA, G.L. 2006. Avances en hormonoterapia de la yegua. V Seminario Internacional de Reproducción en Grandes Animales. CGR. ALLEN, W.R. Exogenous Hormonal control of the mare’s oestrus cycle. Symposium Reproduction Horse. Gent, Belgium. 1990. AMANN, R. 2004. Weaknesses in reports of “fertility” for horses and other species. Rev theriogenology 63:698-715. BARRIER, J. y BATTUT, R. 2001. Use of buserelin to induce ovulation in the cyclic mare. Theriogenology 2001; 55 1679-1696 BLANCHARD, T. VARNER, D. SCHUMACHER, J. LOVE, C. BRINSKO, S. RIGBY, S. 2003. Manual of Equine Reproduction. Segunda edición. Ed. Mosby. Estados Unidos. Pag. 1 – 15. BEHRENS, C.AURICH, J. KLUG, E. NAUMANN, A. HOPPENH. 1993. Inhibition of gonadotropin release in mares during the luteal phase of the oestrous cycle by endogenous opioids. J. Reprod. Fert. 98: 509-514. 85 BERGFELT, DR, MEIRA, C. FLEURY, J.J. FLEURY, P.D. DELLAQUA, J.A. ADAMS, G.P. 2007. Ovulation synchronization following commercial application of ultrasound-guided follicle ablation during the estrous cycle in mares. Department of Animal Health and Biomedical Sciences, University of Wisconsin, Madison, WI 53706, USA. bergfelt@svm.vetmed.wisc.edu. Theriogenology. 68(8):1183-91. BERGFELT, D. 2000. Estrous synchronization. In: Samper J (ed) Equine breeding Management and artificial insemination. WB Saunders Philadelphia, pp. 165-177. BERGFELT, D.R. 2000 Equine Breeding Management and Artificial Insemination. Saunders, CALDANI, M.CARATY, A. PELLETIER, J. THIERY,Y. 1993. LH pulsatile release and its control. En Reproduction in Mammals and Man. C. Thibaulth. 79 – 96p. CAMPOS, R. 2000. Reproducción animal. Bogotá. UNAD. 240p. CAÑON, K.E. ÁVILA, L.C. 2007. Evaluación de la eficiencia del Altrenogest, Benzoato de Estradiol y Gonadotropina córionica humana (hCG) administrados a yeguas criollas en estado de anestro. Tesis de grado. UDCA. CORREDOR, N.J. ROSAS, L. I. 2005. Utilización de Preloban y Chorulon como 86 método de sincronización del celo e inducción de la ovulación, en un protocolo de inseminación artificial a tiempo fijo en yeguas criollas de las Provincias del Tundama y Sugamuxi. Tesis de grado. Escuela de Medicina Veterinaria y Zootecnia. Universidad Pedagógica y Tecnológica De Colombia. Tunja. CUERVO, ARANGO, J. NEWCOMBE, J.R. 2008. Repeatability of preovulatory follicular diameter and uterine edema pattern in two consecutive cycles in the mare and how they are influenced by ovulation inductors. Department of Veterinary Clinical Sciences, Royal Veterinary College, University of London, Hawkshead Lane, North Mymms, Hatfield AL9 7TA, UK. Theriogenology. Apr 1;69(6):681-7. CUNNINGHAM, J. 2003. Fisiología veterinaria. Tercera edición. Ed. Elsevier. Madrid. 305-323p. DUCHAMP, G. 1987. Alternative solutions to hCG for induction of ovulation in the mare. Reprod Fertil; Suppl 35: 221-228 DVORAK, M. y TESARIK, J. 1980. En Biology of the Ovary: MOTTA P.P. and HAFFEZ, E.S.E. London, Martinus Nijhoff ENGELHARDT,W. 2005. Fisiología veterinaria.Ed.Acribia.Zaragoza.p.704 87 FRANSON, R.D. 1995. Fisiología de la Reproducción en la Hembra. In: Spurgeon TL (Ed.), Anatomia y Fisiología de los Animales Domésticos. McGraw-Hill Interamericana, México, pp. 426-428, 432-436. GLAZAR, B.S. 2004. Deslorelin on Day 8 or 12 postovulation does not luteinize follicles during an artificially maintained diestrous phase in the mare. En : Theriogenology (Vol. 62, No. 1-2, julio): p.57-64. GUINTHER, O.J. 1993. Reproductive Biology in the Mare. Basic and Applied Aspects. Equiservices, Cross Plains, Wisconsin, USA, 1993. GRIMMERT, J.B. PERKINS, N.R. 2001. Human chorionic gonadotrophin (hCG): the effect of dose on ovulation and pregnancy rate in thoroughbred mares experiencing their first ovulation of the breeding season. HAFEZ, E.S.E. HAFEZ, B. 2002. Reproducción e inseminación artificial en animales. 7ª. ed. Madrid: McGraw Hill,. 450 p. HOLST, W. 1985. Prolonged spring oestrus in mares: The use of progestogens with specificreference to proligestone. Theriogenology 1985;24(6):609-17. HUGHES, J.P. STABENFELDT, G.H. EVANS, J.W. 1972. Clinical and endocrine aspects of the oestrous cycle of the mare. Proceedings of the Annual Convention 88 of the American Association of Equine Practitioners. 119-51. GARCIA, M.C. FREEDMAN, L. GINTHER, J. 1979. Interaction of seasonal and ovarian factors in the regulation of LH and FSH secretion in the mare. J. Reprod. Fert., Suppl.27:103-111 GESCHWIND, I.I. DEWEY, R. HUGHES, J.P. EVANS, J.W. STABENFELDT, G.H. 1975 Plasma LH levels in the mare during the estrus cycle. J. Reprod. Fertil. Suppl.23, 207. GUINTHER, O.J. 1992. Reproductive biology of the mare: Basic and applied aspects. Segunda Edición. Ed. Equiservices. Wisconsin. 82-91p. GUYTON, A.C. HALL, E. 1996. Medical physiology. Ed. W.B. Saunders Co. Philadelphia, Pennsylvania. 192-197p. INTERVET, 2004. Boletín Veterinario. Linea de Equinos. Año 1, número 5. Marzo Abril. INTERVET, 2004. Línea de Equinos. Boletín Veterinario. 1(5): 2p. INTERVET, 2007. Compendium de Reproducción Animal. Novena Edición. 89 LEE, S. 2003. Efficacy of oral altrenogest for postponing ovulation in the mare. A thesis Submitted to the Office of Graduate Studies of Texas A&M University in partial fulfillment of the requirements for the degree of MASTER OF SCIENCE. p.43 – 46. MELVIN, J. 1999. Fisiología de los animals domésticos de Dukes. Quinta ed. México. Ed. Limusa. 534-545p. MOLINA, C.L. CUBIDES, O.I. 2004. Estudio comparativo de prostaglandinas, gonadotropina y progesterona-estrogenos en la sincronización del ciclo estral en la yegua. Trabajo de grado. Facultad de Medicina Veterinaria y Zootecnia. Universidad Tecnológica de los Llanos Orientales. MOTTA, P.P. HAFEZ, E.S.E.2001. Biology of the ovary.Londres NOAKES, D.E. PARKINSON, T.J. ENGLAND, G.C.W. 2001. Arthur´s Veterinary Reproduction and obstetrics. 8a edición. Ed. Saunders. Londres. 2001. 191 – 198p MOTTERSHEAD, J. The mares estrous cycle. 2001. <http://www.equinereproduction.com/articles/estrous.htm>Acceso en 5 junio, 2003. RUTTEN, D.R. CHAFFAUX, S. VALON, M. DELETANG, F. HAAS, V. 1986. 90 Progesterone therapies in mares with abnormal oestrous cycles. Veterinary Record; 119: 569-71. SAMPER, J.C. 2000. Equine breeding management and Artificial insemination. Ed. W.B. Saunders Co. Philadelphia, Pennsylvania. 125- 128p. SISSON, S. GROSSMAN, J.D. 2001 Anatomía de los animales domésticos, Robert Getty. Quinta edición. Ed. Masson, S.A. Barcelona, España. Tomo 1. Pag 605-612. SQUIRES, E.L. GUINTER, O. J. 1975. Follicular and luteal development in pregnant mares. J. Reproduction and Fertility supply 23.249 SQUIRES, E. HESSEMAN, C. WEBEL, S. VOSS, J. 1983. Relationship of Altrenogest to ovarian activity hormone concentrations and fertility of mares. J. Animal Science. 56: 901-910. VASQUEZ, B. 2006 Informe de Gestión. Revista Fedequinas. #42 marzo – abril. WILDE, O, de la VEGA, A. CRUZ M. 2002. Uso de un dispositivo intravaginal para el control de estro en yeguas. Zootecnia Tropical 20 No 4. WOODS, J. BERGFELT, D.R. GINTHER O.J. 1990. Effects of time of insemination relative to ovulation on pregnancy rate and embryonic-loss rate in mare. Equine Vet 91 ANEXOS Anexo 1. Agropecuaria las Tinajas (Puerto Berrio - Antioquia) Anexo 2. Brete para palpación. 92 Anexo 3. Toma de ecografías. Anexo 4. Grupo de yeguas estudio. 93 Anexo 5. Grupo de yeguas estudio en su manada Anexo 6. Yeguas del estudio