POLÍTICA ANTIBIÓTICA para la PCM
Anuncio

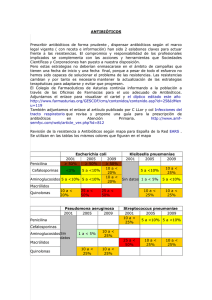
ANTIBIÓTICOS Y POLÍTICA ANTIBIÓTICA EN LA POLICLÍNICA MIRAMAR Existen pruebas de que hace más de 2500 años, los honderos baleares ya conocían las propiedades terapéuticas del ungüento fabricado con piel de butifarrón oreado para el tratamiento de heridas de guerra infectadas, y, a lo largo de los siglos, abundan en la literatura médica occidental referencias a la aplicación de tierras y extractos de plantas en infecciones locales; sin embargo, hubo que esperar hasta la introducción de las sulfamidas en 1936, la producción en masa de penicilina desde 1941 y el descubrimiento de la estreptomicina en 1944 para disponer de armas eficaces contra el gran enemigo de la humanidad, la infección. La euforia que supuso disponer de los primeros antibióticos se calmó rápidamente porque pocos años después de la introducción de la penicilina aparecieron cepas de Staphylococcus aureus productoras de betalactamasa (penicilinasa), enzima que al hidrolizar la molécula del antibiótico lo inactiva, rápidamente los farmacólogos respondieron con la síntesis de penicilinas resistentes como la oxacilina. Esto, por desgracia, no resolvió el problema, pero dio el pistoletazo de salida de una carrera antibiótica que dura hasta nuestros días, y en la que nosotros (me refiero ahora a los médicos que trabajamos en la Policlínica Miramar) tenemos un papel crucial. Actualmente, en nuestro medio, más del 80% de los Staphylococcus aureus, el 50% de las Escherichias coli, el 40% de los haemophylus influenciae y el 12% de los Streptococcus pneumoniae son resistentes a la penicilina. En los últimos 10 años se ha perdido la fe en la infinita capacidad de la ciencia farmacológica para sintetizar nuevos fármacos que superen la habilidad de las bacterias para hacerse resistentes y ha habido un replanteamiento de las estrategias antimicrobianas. En los hospitales han ido apareciendo: enterobacterias productoras de betalactamasa de espectro ampliado (BLEA), Staphylococcus aureus resistentes a meticilina (MRSA), Enterococcus faecium con sensibilidad intermedia a vancomicina (VRIEF) e incluso Staphylococcus aureus con sensibilidad intermedia a glucopéptidos (GISA o VISA). Todo ello, aparte de consideraciones teóricas y posibles consecuencias de futuro, tiene implicaciones inmediatas de enorme trascendencia, porque las infecciones por patógenos multirresistentes producen mayor mortalidad, estancia hospitalaria más prolongada y asistencia más costosa. A partir de la evidencia de que la presión antibiótica aumenta el riesgo de aparición de resistencias hoy se acepta que la lucha contra las infecciones va más allá del tratamiento individual de cada paciente, y que, para obtener buenos resultados a corto y medio plazo se debe: prevenir y detectar la aparición de patógenos resistentes, evitar su diseminación a otros pacientes del hospital y controlar de forma eficiente el empleo de los antibióticos. 1 Antibióticos Desde la aparición de la penicilina hasta la actualidad se han desarrollado una gran variedad de antibióticos con el objeto de ampliar el espectro de actividad y resolver las resistencias que han ido apareciendo. Aunque pueda parecer que existen muchos mecanismos de acción y estructuras moleculares, la realidad es que todos los mecanismos de acción pueden resumirse en 5 grandes apartados y que la mayoría de los antibióticos pertenecen a un pequeño número de estructuras moleculares. Mecanismos de acción - - - Inhibición de la síntesis y reparación de la pared bacteriana. Mediante la interrupción del proceso de producción y de unión de los peptidoglicanos que la forman. Alteración de la permeabilidad de la membrana bacteriana. Inhibición de la síntesis de proteinas bacterianas. Interferencia en el metabolismo de los ácidos nucleicos bacterianos. Interferencia en pasos metabólicos esenciales para los microorganismos. Grupos farmacológicos a) Antibióticos betalactámicos. Penicilinas Las penicilinas de espectro limitado (fenoximetilpenicilina, bencilpenicilina) se pueden usar, en infecciones por bacterias gram positivas sensibles, treponemas, neisserias y anaerobios; sin embargo, la incomodidad de sus presentaciones las han hecho casi desaparecer de la práctica clínica en occidente. Las aminopenicilinas (ampicilina, amoxicilina) son derivados semisintéticos con espectro ampliado a los bacilos gram negativos. La ampicilina tiene una biodisponibilidad oral relativamente baja, por eso se reserva para tratamientos parenterales intrahospitalarios. La adición de ácido clavulánico (un inhibidor de la betalactamasa) amplia el espectro de la amoxicilina lo cual la hace muy interesante en el tratamiento de infecciones hospitalarias, pero no tanto en tratamientos ambulatorios, porque además, la alta incidencia de efectos secundarios gastrointestinales (pirosis, diarreas) hace que muchoas pacientes abandonen el tratamiento. Otra modificación en la molécula de penicilina condujo a la aparición de las penicilinas isoxazólicas (meticilina, oxacilina, cloxacilina) de las que, en nuestro medio, usamos sólo la cloxacilina, y únicamente en infecciones estafilococias de tejidos blandos. Modificaciones posteriores dieron lugar al grupo de las carboxipenicilinas (carbenicilina) y las ureidopenicilinas (piperacilina) que tienen actividad frente a la Pseudomonas aeruginosa. Los efectos adversos más frecuentes de las penicilinas son las erupciones cutáneas y la diarrea. La incidencia de reazcciones alérgicas graves es de 1-4 por cada 10.000 tratamientos. Una anamnesis cuidadosa sobre episodios anteriores puede reducir este riesgo; no obstante, sólo se confirma la alergia con una prueba en una proporción muy baja de los pacientes que refieren un antecedente. 2 Cefalosporinas Las primeras cefalosporinas se obtuvieron en 1948 a partir del Cefalosporium acremonium y se caracterizaban por su actividad frente a Staphylococcus aureus. Su núcleo activo es el ácido 7aminocefalosporínico a partir del cual se han sintetizado hasta 33 fármacos con utilidad clínica. Aunque existen diversas clasificaciones posibles la más extendida es la que hace referencia a su aparición cronológica, de este modo podemos hablar de: - cefalosporinas de primera generación: (cefazolina, cefalotina etc.) efectivas frente a infecciones por cocos grampositivos y algunos bacilos gramnegativos como Escherichia coli, Proteus mirabilis y Klebsiella pneumoniae. - cefalosporinas de segunda generación: (cefuroxima, cefoxitina etc.) con una actividad mayor frente a enterobacilos gramnegativos y Haemophilus influenzae. - cefalosporinas de tercera generación: (cefotaxima, ceftriaxona y ceftazidima entre otras). Muy activas frente a enterobacilos gramnegativos, Haemofilus influenzae y, en algunos casos, Pseudomonas aeruginosa. - cefalosporinas de cuarta generación: (cefepime) con gran resistencia a betalactamasas y excelente actividad frente a Pseudomonas aeruginosa. El efecto adverso más frecuente d elas cefalosporinas es la diarrea, además un 5-10% de los pacientes alérgicos a penicilina lo son también a cefalosporinas. Excepto la cefuroxima en infecciones respiratorias, la cefalexina en otitis y ciertas infecciones de orina y la ceftriaxona en el tratamiento de la gonococia, el resto de las cefalosporinas debería ser de uso estrictamente intrahospitalario. Monobactámicos Los monobactámicos (aztreonam) son fármacos que, a diferencia de las penicilinas y de las cefalosporinas, tienen un solo anillo, lo que los hace insensibles a las betalactamasas. Son activos frente a Pseudomonas aeruginosa y otros bacilos gramnegativos, pero no tienen actividad contra los cocos ni contra las bacterias anaerobias, de manera que presentan un perfil semejante al de los aminoglucósidos. Su uso es hospitalario y restringido generalmente a los pacientes con infecciones graves por bacilos gram negativos a lergia a betalactámicos. Carbapenémicos Los carbapenémicos (imipenem, meropenem y ertapenem) se consiguieron mediante la sustitución de un átomo de azufre por uno de carbono en el anillo betalactámico. Son antibióticos de muy amplio espectro, con actividad frente a bacterias grampositivas, gramnegativas y anaerobias. Todos ellos son de uso exclusivo hospitalario. Hay que señalar que el ertapenem no es activo frente a la Pseudomonas aeruginosa. b) Aminoglucósidos Son fármacos obtenidos de distintas cepas de Streptomices (estreptomicina, tobramicina y amikacina) o de especies del género Micromonospora (gentamicina). Introducidos muy pronto en terapéutica venían a complementar el espectro de las 3 mayor actividad frente a clostridios. Están indicados únicamente en algunas infecciones por estafilococos resistentes a meticilina. En tejidos adonde los glicopéptidos llegan con dificultad, como el parénquima pulmonar, el antibiótico indicado en estos casos es el linezolid primeras penicilinas al ser muy activos frente a las enterobacterias y la Pseudomonas aeruginosa. Además tienen un efecto sinérgico con los betalactámicos y las quinolonas probablemente porque la alteración que éstos producen en la pared bacteriana favorece la entrada de aquellos y su acción. En general es preciso reservarlas para el tratamiento de infecciones por bacilos gran negativos resistentes. El uso de la neomicina se debe limitar a la aplicación tópica en dermatología, no tiene ninguna utilidad en el tratamiento de la gastroenteritis, con o sin diarrea. El uso tópico de antibióticos aminoglucósidos sólo está indicado en algunas infecciones cutáneas y oculares. Un uso indiscriminado en forma de pomadas o colirios favorece la aparición de mutantes resistentes. La estreptomicina se reserva para el tratamiento de la tuberculosis. Hay que recordar que los aminoglucósidos son oto y nefrotóxicos (ninguno de ellos en mayor o menor medida que otro). El riesgo de nefrotoxidad es mayor en presencia de insuficiencia renal y en paciente de edad avanzada. Los aminoglucósidos están contraindicados en el primer trimestre de embarazo porque producen sordera en el RN y en la miastenia por el riesgo de bloqueo neuromuscular. d) Macrólidos y lincosánidos Son dos grupos de fármacos químicamente diferentes pero con mecanismos de acción y espectro de actividad semejantes. Actúan inhibiendo la síntesis proteica en la y son útiles en infecciones por cocos grampositivos, una amplia variedad de anaerobios y algunos germenes gramnegativos. Hay que destacar entre los macrolidos la azitromicina y la claritromicina y entre los lincosánidos la clindamicina. Los macrólidos son muy útilies en el tratamiento de neumonías de la comunidad y en casos de pacientes con alergía a penicilina. La clindamicina tiene un uso hospitalario limitado al tratamiento de infecciones por gérmenes anaerobios en ciertos casos y de forma ambulatoria se indica únicamente en ciertas infecciones odontogénicas de pacientes alérgicos a la penicilina. La espiramicina, muy usada en odontología no tiene ninguna particularidad que la haga de elección en el tratamiento de las infecciones bucales. c) Glucopéptidos Vancomicina y teicoplanina. Son fármacos de estructura química compleja cuyo espectro se limita a bacterias grampositivas y al Clostridium difficile. La teicoplanina tiene menor actividad frente a estafilococos coagulasa negativos que la vancomicina y e) Polipeptídicos Colimicina (colistina) y Polimixina B. Actúan alterando el componente lipídico de la membrana bacteriana. Tienen acción preferente frente a bacterias aerobias gramnegativas. Son bastante tóxicos por lo que, en general, se usan por 4 vía tópica en el tratamiento de infecciones cutáneas y oftálmicas. La colistina se usa en forma de aerosol para tratar la colonización de las vías aéreas por bacilos gram negativos multirressistentes en pacientes con enfermedades pulmonares crónicas (fibrosis quística) o instrumentación respiratoria prolongada. f) Tetraciclinas Destaca la doxiciclina. Tienen acción bacterisotática y actúan inhibiendo la síntesis de proteínas bacterianas. Con un espectro inicial muy amplio que incluía bacterias grampositivas y gramnegativas su uso masivo determinó la aparición de resistencias. Hoy día son de elección en el tratamiento de las infecciones por Chlayidia spp, Rickettsia spp y Micoplasma spp. La doxiciclina afecta al crecimiento óseo de los dientes y está contraindicada en gestantes y niños menores de 12 años. g) Cloranfenicol y análogos Son antibióticos con un espectro amplio, pero elevada toxicidad y que, por su carácter inductor enzimático interfieren con el metabolismo de muchos fármacos lo que limita su uso. h) Sulfamidas Las indicaciones de uso de las sulfamidas son prácticamente nulas porque la incidencia de efectos adversos es relativamente elevada. El uso del cotrimoxazol (trimetoprim-sulfametoxazol o TMP-SMX) se limita actualmente al tratamiento de la salmonelosis en niños y en la prevención y tratamiento de la infección respiratoria por Pneumocystis carinii en enfermos de SIDA. Sin embargo el trimetoprim ha demostrado en varios ensayos clínicos su utilidad en el tratamiento de las infecciones urinarias. Ünicamente hay que recordar que en tratamientos muy prolongados puede producir anemia megaloblástica por déficit de ácido fólico. i) Quinolonas Las quinolonas vieron la luz por primera vez en 1962 con la síntesis del ácido nalidíxico, obtenido a partir de la cloroquina. Con un espectro dirigido preferentemente hacia bacilos gramnegativos, fueron inicialmente utilizadas en el tratamiento de las infecciones urinarias; sin embargo, en 1973 su historia dio un giro radical al obtenerse el primer derivado fluorado que inauguraba un nuevo grupo de antibióticos de amplio espectro, las fluoroquinolonas. Su clasificación, al igual que la de las cefalosporinas es cronológica: - quinolonas de primera generación: (ácido nalidíxico, ácido pipemídico), prácticamente en desuso. - quinolonas de segunda generación: (norfloxacino, ciprofloxacino), antibióticos de espectro muy amplio con buena actividad frente a microorganismos atípicos como Legionella spp o Chlamydia spp. y aceptable actividad frente a Pseudomonas aeruginosa. El norfloxacino se emplea en el tratamiento de infecciones del tracto urinario, mientras que el ciprofloxacino habría que reservarlo para infecciones hospitalarias complicadas por gérmenes resistentes. - quinolonas de tercera generación: (levofloxacino), aumentan la actividad frente a 5 cocos grampositivos, especialmente neumococo. - quinolonas de cuarta generación: (moxifloxacino), aportan cobertura de bacterias anaerobias y tienen una excelente actividad sobre el neumococo. En empleo de quinolonas de 3ª y 4ª generación fuera del hospital casi nunca está justificado. Dado que pueden afectar al cartílago de crecimiento las quinolonas se consideran contraindicadas en niños y durante el embarazo. Tampoco se recomienda el uso de quinolonas en pacientes epilépticos. j) Oxazolidinonas Linezolid. Inhibe la síntesis proteica. Se metaboliza en el hígado y no requiere ajuste de dosis en caso de insuficiencia renal. Tiene muy buena penetración en los tejidos. Su espectro de actividad abarca prácticamente a todos los gérmenes grampositivos y, especialmente a: MRSA, GISA y VRIEF. Apenas presenta efectos secundarios relevantes. su uso fuera del hospital porque es el tratamiento indicado para erradicar el MRSA de los pacientes (o el personal) portadores. n) Metronidazol Se utiliza como antiprotozoario y es activo frente a las bacterias anaerobias. De forma ambulatoria se usa en el tratamiento de la vaginosis en dosis única. Sus indicaciones hospitalarias han sido desplazadas por otros antibióticos más potentes. Se sigue usando en el tratamiento de la enfermedad inflamatoria intestinal. o) Bacitracina Se utiliza por vía tópica en infecciones cutáneas superficiales, pero puede producir reacciones de hipersensibilidad y dermatitis de contacto. l) Nitrofuranos La nitrofurantoína es un antiséptico urinario que puede estar indicado en el tratamiento o la profilaxis de la cistitis cuando no se pueden utilizar otras alternativas. p) Antiparasitarios Parasitosis cutáneas: pediculosis y sarna. El lindano puede producir reacciones de hipersensibilidad cutánea y tiene una baja tasa de respuestas, así que mejor no usarlo. La permetrina en loción o en gel es muy eficaz en la pediculosis y se absorbe menos por la piel Parasitosis intestinales El mebendazol tiene un espectro antihelmíntico muy amplio y es de elección en las infestaciones por oxiuros, ascaris lumbricoides y Trichuris. El pamoato de pirantel se considera una alternativa para estas infestaciones m) Mupirocina Es de uso tópico y bactericida sobre gram positivos y algunos gram negativos. Se la recomienda para el tratamiento de forúnculos, impétigo y foliculitis, pero se debería limitar q) Antituberculosos Isoniacida, rifampicina, piracinamida, etambutol Estreptomicina, capreomicina y protionamida sólo se usan cuando los primeros han producido una k) Fosfomicina Es una alternativa en el tratamiento de la cistitis no complicada, con la ventaja de que puede emplearse una dosis única. 6 toxicidad inaceptable o cuando ha aparecido resistencia. La isoniacida produce hepatopatía clínica en un 0,8-2,3% de los pacientes y elevación de las transaminasas en un 10-20%. La hepatotoxicidad suele ser reversible a terminar el tratamiento. La rifampicina tiñe de naranja la orina el sudor y las lágrimas y es un potente inductor del metabolismo hepático. El mayor riesgo del etambutol es la neuritis óptica. En cuanto a la estreptomicina, la La asociaciones a dosis fijas de isoniacida + rifampicina y de isoniacida + piracinamida + rifampicina son eficaces y mejoran el cumplimiento, pero no se usan en quimioprofilaxis. Antifúngicos Para el tratamiento de las tiñas o dermatofitosis a menudo basta con la aplicación tópica de alguno de los derivados imidazólicos durante 2-4 semanas. Dado que tienen una eficacia similar y que están prácticamente desprovistos de toxicidad, la elección se puede basar en el precio. El tratamiento sistémico está indicado cuando no hay respuesta al tratamiento tópico o cuando la micosis afecta a las palmas y las plantas, al cuero cabelludo, a la barba o a las uñas. Se consideran de elección la terbinafina, el itraconazol y la griseofulvina. En caso de onicomicosis, antes del tratamiento por vía oral se puede probar una aplicación tópica de tioconazol o de amorolfina. Para el tratamiento de las micosis sistémicas existen varias familias de antifúngicos de uso hospitalario. MACRÓLIDOS POLIÉNICOS Anfotericina B Anfotericina B Desoxicolato Anfotericina B liposomal (Ambisome®) Anfotericina B complejo lipídico (Abelcet®) Nistatina AZOLES Itraconazol Fluconazol Voriconazol LIPOPÉPTIDOS. EQUINOCANDINAS Caspofungina Anidulofungina Micafungina La anfotericina sigue siendo el fármaco de referencia en el tratamiento de las infecciones sistémicas graves y también el patrón con el que establecer comparaciones con los otros antifúngicos. Las formulaciones lipídicas son menos tóxicas que la Anfotericina B desoxicolato, pero no han podido demostrar mayor eficacia. El Ambisome® muestra menos reacciones con la infusión y menos nefrotoxicidad que el Abelcet®. Dosis Anfotericina B desoxicolato 0,5-0,7 mg/kg/día en pacientes estables. 0,8-1 mg/kg/día en pacientes inestables Dosis máxima total 2 gramos. 7 Antivíricos Para el tratamiento de las infecciones mucocutáneas de herpes simple, el aciclovir por vía oral es eficaz y mejora el curso de la enfermedad. En las recurrencias del herpes genital su eficacia es menor, pero puede ser útil para la profilaxis si las recurrencias son muy frecuentes. En caso de herpes labial recurrente el tratamiento profiláctico con aciclovir sólo confiere una protección relativa. La aplicación tópica también tiene una utilidad marginal o nula en el tratamiento de los brotes. se dan en las primeras horas horas de evolución de la gripe. Las dosis elevadas de vitamina C no son eficaces para la prevención ni para el tratamiento del resfriado. Comparados con los analgésicos simples, los cócteles de analgésicos con antihistamínicos o cafeína no tienen ventajas y producen somnolencia. Dado que el herpes zoster es un cuadro autolimitado y que en muchos casos responde bien al tratamiento sintomático, no es necesario tratar a todos los pacientes; sin embargo, aciclovir, famciclovir y valaciclovir reducen la neuralgia postherpética y el dolor asociado al herpes zóster y actualmente se recomiendan en pacientes de edad avanzada y los que presentan erupción moderada o intensa, dolor moderado o intenso y afectación ocular. El tratamiento debe iniciarse durante las primeras 48 horas. Para la prevención de la gripe se aconseja administrar la vacuna recomendada cada año por la OMS a diversos grupos de población: personas mayores de 65 años, enfermos cardiovasculares, enfermos pulmonares crónicos, bronquiectasias, tuberculosis y asma, nefrópatas crónicos e inmunodeprimidos, pacientes con enfermedades endocrinas (especialmente diabetes) y personal sanitario. Con una administración correcta queda protegido un 70-90% de la población vacunada. Zanamivir y oseltamivir son inhibidores de la neuraminidasa de los virus de la gripe A y B. Comparados con placebo disminuyen la duración de los síntomas en uno o dos días y sólo son eficaces si 8 Aparición de patógenos resistentes Mecanismos genéticos de la resistencia Hay grupos de bacterias que no son afectados por determinados antimicrobianos, este hecho se define como resistencia natural. Otras especies son en principio sensibles, pero pueden aislarse ocasionalmente variedades (cepas) de las mismas que no lo son y que crecen normalmente en presencia del antibiótico. En este caso se habla de resistencia adquirida. Los primeros casos de resistencia adquirida se detectaron poco después de iniciarse el empleo de las sulfamidas. Su aparición fue consecuencia de la capacidad de las bacterias de evolucionar y adaptarse al medio en que habitan. Las cepas resistentes emergen en una determinada especie y en una situación geográfica concreta; pero su capacidad para compartir información genética acaba diseminando la resistencia a otros géneros y la movilidad actual de las poblaciones humanas se encarga de esparcirlas por el planeta. Llamamos resistencia cruzada a la que aparece frente a varios antibióticos de forma simultánea, si son todos de un mismo grupo o poseen una estructura química similar se tratará de resistencia cruzada homóloga, en caso contrario estaremos hablando de resistencia cruzada heteróloga y suelen ser antibióticos que tienen un mecanismo de acción parecido o comparten un mismo sistema de transporte. La resistencia a antibióticos implica necesariamente un cambio genético en la bacteria. Se denomina gen de resistencia a aquel que posee la nueva capacidad de conferir al germen inmunidad al antibiótico. Existen dos mecanismos principales para explicar la aparición de un gen de resistencia: a) Mutación. El gen de resistencia aparece por modificación de otro gen bacteriano normal, y codifica una variante de la proteína original con diferente actividad o estructura. b) Transferencia. Un origen frecuente de los genes de resistencia son las bacterias que han desarrollado resistencias por mutación y que son capaces de trasmitir esa información genética. Parecería lógico suponer que los genes de resistencia a antibióticos, se encuentren, al menos inicialmente, localizados en el cromosoma bacteriano; sin embargo, una característica habitual de muchos de ellos es su localización en elementos extracromosómicos autónomos que se denominan plásmidos. Los plásmidos tienen la capacidad de transferirse de una bacteria a otra por el proceso llamado conjugación bacteriana. Uso de antibióticos y generación de resistencias Se acepta habitualmente que las mutaciones y las transferencias de información genética tienen lugar al azar. El papel del antibiótico sería el de seleccionar las mutaciones al constituir una fuerza que sólo favorece a los mutantes resistentes. Por lo tanto, en sentido estricto, el uso de antibióticos no determina la aparición de resistencias, sino que selecciona mutantes y, finalmente, provoca su éxito evolutivo. En algunos casos, una sola mutación puede ser suficiente para la aparición del fenotipo resistente de alto nivel pero casi siempre se requieren varias. 9 Diversos autores han analizado el impacto clínico y económico del desarrollo de resistencias antibióticas y han observado que éstas implican, de manera casi constante, una mayor mortalidad, un incremento en la estancia hospitalaria y un mayor costo del proceso. Así, la resistencia de Enterobacter spp. a cefalosporinas de tercera generación implica un incremento de 5 veces en el riesgo relativo de muerte, de 1,5 veces en la estancia hospitalaria y de 1,5 veces en los gastos de hospitalización. Optimización y racionalización del tratamiento antibiótico “El ideal es tener a todos los pacientes infectados tratados con el antibiótico más eficaz, menos tóxico y más barato, durante el tiempo preciso para lograr la curación y prevenir la recidiva” (David M. et al., (1997) La realidad es que alrededor del 50% de los antibióticos pautados son incorrectos, se administran a dosis no óptimas o durante periodos de tiempo insuficientes. Existen medidas para racionalizar el empleo de antibióticos en las UCC: a) Creación de protocolos estrictos para el tratamiento de las infecciones. Se recomienda la participación activa de los facultativos implicados para lograr mayor adhesión y mejor cumplimiento y se ha propuesto el uso de sistemas de prescripción asistidos por ordenador. b) Restricción de antibióticos o grupos de ellos. Se trata de limitar el uso de antibióticos específicos o grupos farmacológicos. c) Combinación de antibióticos. Se ha propuesto el uso combinado de antibióticos de diferentes clases, asumiendo que en estas condiciones serían necesarias mutaciones consecutivas complejas para la adquisición de resistencia. Esta aproximación ha sido ampliamente ensayada especialmente para el control de infecciones por Pseudomonas aerugoinosa, pero no cuenta con ensayos clínicos que aporten datos en términos de eficacia o de reducción en la aparición de resistencias que la sustenten. d) Optimización de las pautas y rutas de administración. Entendiendo que el empleo de concentraciones insuficientes de antibiótico podría contribuir a la selección de mutantes se han propuesto modificaciones en las pautas de administración. Para aquellos antibióticos cuya actividad es dependiente de la relación entre el pico máximo de concentración en el tejido y la concentración mínima inhibitoria (CIM) para el germen (aminoglucósidos, quinolonas) lo que interesa es conseguir picos de concentración elevados, de unas 10-12 veces la CIM, deberemos emplear, por tanto, dosis únicas diarias. Para aquellos antibióticos en los que la actividad depende del tiempo que la concentración del antibiótico en el tejido se encuentra por encima de la CIM (betalactámicos) lo que interesa es conseguir concentraciones lo más estables posible, al menos durante la mitad del tiempo de intervalo entre dosis la concentración del antibiótico debe ser superior a la CIM. En 10 este caso el tipo de administración teoricamente idóneo es la perfusión continua limitada pero en lineas generales prometedora. e) Rotación de antibióticos. La introducción de un nuevo antibiótico de amplio espectro con frecuencia se sigue de un uso excesivo del mismo. Cuando se supera un valor umbral aparece la resistencia lo que hace que el antibiótico en cuestión sea abandonado y sustituido por otro. Con la intención de romper este círculo se ha sugerido la rotación. El objetivo final es mantener el conjunto de antibióticos a utilizar por debajo del umbral de aparición de resistencias. Desde un punto de vista práctico pueden introducirse tantos grupos farmacológicos como se desee pero hay que tener en cuenta que la rotación debe afectar tanto al tratamiento empírico como al dirigido, de manera que los esquemas terapéuticos han de simplificarse. Para lograr el objetivo es esencial elegir antibióticos para cada ciclo que no estén relacionados en su mecanismo de acción con los otros. Un esquema clásico, que incluye tres grupos de antibióticos, podría comenzar con la introducción de penicilinas de amplio espectro que en una segunda fase son sustituidas por carbapenémicos y finalmente por cefalosporinas de 3ª o 4ª generación. La duración de cada ciclo está por establecer; aunque, en términos generales, se aceptan como adecuados periodos de 2 a 4 meses. La experiencia clínica de la eficacia de la rotación antibiótica es Optimización y racionalización de la profilaxis antibiótica La incidencia de infección de la herida quirúrgica (IHQ) puede cifrarse en torno a un 3,4%. Además su aparición condiciona de manera importante el curso del postoperatorio incrementando la mortalidad de un 1,3% hasta un 5,8%. Los pacientes con IHQ tienen estancias hospitalarias más largas (incremento medio de 8,5 días) y un coste adicional importante. Entre las medidas que han demostrado su eficacia en el control de la IHQ destaca la correcta profilaxis antibiótica peroperatoria. En general, la IHQ resulta de la contaminación de los tejidos durante la cirugía por la flora cutánea o por la flora endógena acantonada en las mucosas del paciente y el riesgo individual depende del balance entre el inóculo bacteriano y su reserva biológica para eliminarlo. Las bases de la profilaxis antibiótica se conocen desde hace décadas; sin embargo, la aparición de nuevos agentes farmacológicos, de vías de administración alternativas, de procedimientos quirúrgicos modernos y de resistencias antimicrobianas anteriormente desconocidas, hacen necesaria una reevaluación. Otras medidas antimicrobianas Existen técnicas e intervenciones de utilidad ampliamente demostrada para el control de las infecciones nosocomiales que no se usan tanto como debieran, mientras que otras, frecuentemente empleadas carecen de evidencia científica. a) Descontaminación selectiva (DDS) digestiva 11 Alrededor del 40% de los pacientes que necesitan ventilación mecánica en la UCI desarrollan una infección respiratoria y un 30% de ellos fallecen por esta causa. Si se emplea la pauta de DDS más eficaz (combinación de antibiótico tópico más sistémico) la incidencia de infección respiratoria se reduce en un 60% y la mortalidad en un 20%. La DDS se basa en la constatación de que más del 50% de las infecciones adquiridas en las UCI son endógenas secundarias, es decir, se producen a partir de poblaciones bacterianas que previamente han colonizado al paciente. Los ensayos clínicos realizados han demostrado la eficacia de esta técnica. La limitación teórica de la DDS es la generación de resistencias. En consecuencia su uso debe limitarse a los pacientes de alto riesgo, y, a unidades con alta incidencia de patógenos multirresistentes. cirugía que presentan hiperglucemia en el postoperatorio la incidencia de infecciones nosocomiales, incluyendo sepsis por catéter, neumonía, infección urinaria e IHQ es mayor. En base a ello, algunos autores habían propuesto el control estricto de la glucemia durante y después de la cirugía como método para evitar la IHQ, pero ha sido recientemente cuando se ha demostrado que es un método seguro y eficaz para reducir la incidencia de infecciones nosocomiales en pacientes intervenidos. b) Rasurado preoperatorio El rasurado del campo quirúrgico la noche anterior a la intervención se asocia con un incremento significativamente mayor de la IHQ que con el empleo de cremas depilatorias o, simplemente con ninguna actuación, por eso hoy en día se recomienda evitar el rasurado en la medida de lo posible, y, cuando sea estrictamente necesario, realizarlo inmediatamente antes de la cirugía. c) Control estricto de la glucemia Es un hecho conocido que en los pacientes diabéticos sometidos a 12