Rev Hematol Mex 2014_15 (Suppl 1)
Anuncio

Programa educativo
Rev Hematol Mex 2014;15 (Supl. 1):S1-S90.
ANORMALIDADES MOLECULARES Y CITOGENETICAS EN LA
LEUCEMIA MIELOIDE AGUDA
(LMA) Y SUS APLICACIONES EN
LAS DECISIONES TERAPEUTICAS
ACTUALES
Dr. Alvaro Aguayo
Instituto Nacional de Ciencia Médicas y Nutrición SZ
Vasco de Quiroga 15, Colonia, Sección XVI, CP: 014000, México, D.F.
alvaroaguayo@hotmail.com
La leucemia mieloide aguda (LMA)
representa un grupo heterogéneo
de enfermedades. Cada uno de los
subtipos de LMA tiene características epidemiológicas y biológicas
que se traducen, muchas veces, en
tratamientos y pronóstico diferentes.1 La disección y entendimiento
cada vez mas profundo de todos
los factores de pronóstico conocidos hasta hoy, que necesariamente
incluyen muchos asociados a la
biología de la LMA, ha permitido
el diseño de estrategias mas racionales de tratamiento, incorporando
ya nuevos agentes de los llamados
biológicos o de blancos moleculares en los diferentes tipos de LMA.
Hemos aprendido, durante ya algún
tiempo, que las translocaciones,
eliminaciones y las inversiones
cromosómicas se observan con
mayor consistencia en aproximadamente dos tercios de todos los
casos de LMA y se han asociado
de una manera mucho mas clara
a la evolución y pronóstico que
otras co-variables 2. Con el entendimiento mas profundo y detallado
de la biología molecular que se ha
producido durante las últimas dos
décadas, estas anormalidades citogenéticas estructurales han dado
pistas valiosas sobre la ubicación de
genes que se sabe, o se sospecha,
son responsables de la inducción
y/o sostenimiento de la leucemia.
En la mayoría de los casos, la LMA
es el resultado de una caprichosa
combinación de genes, por ejem-
plo, cuando segmentos de dos
genes diferentes se fusionan para
dar lugar a una estructura quimérica
que consiste en el extremo 5 ‘de un
gen y el extremo 3’ de otro dando
lugar a proteínas con actividad desordenada que afectan la maquinaria
celular en su totalidad.
Las excepciones a este concepto, sin embargo, existen. En
los casos de LMA que carecen
de anomalías citogenéticas (CG)
obvias por estudio de cariotipo de
bandas G convencional, llamados
de citogenética “normal” o diploide
se están ahora empezando a caracterizar los genes implicados en la
transformación maligna. En conjunto, estas observaciones apoyan la
idea de que la LMA es heterogénea
a nivel molecular y sugieren que, si
bien los clínicos tendrán que seguir
tomando en cuenta las características citogenéticas, deberán ahora
que considerar ya las alteraciones
moleculares para optimizar el tratamiento de los pacientes.
Tradicionalmente se reconocen
4 grupos de pronóstico 2 basados en
el cariotipo deacuerdo al estudio de
grupo del SWOG.2
1. Riesgo bajo o CG favorable (20% de los pacientes
con LMA): t(15;17), inv(16),
t(16;16), del 16q, ó t(8;21).
2. Riesgo intermedio (46%): +8,
-Y, +6, del(12p) ó cariotipo
normal.
3. Alto riesgo o CG desfavorable
(30%): -5/del(5q), -7/del(7q),
inv(3q), anormalidades de 11q,
20q, del (9q), t(6;9), t(9;22), anormalidades del 17p y cariotipo
complejo definido por la presencia de > 3 alteraciones CG.
4. Riesgo desconocido (4%): No
se reúnen lo criterios de metafases analizables.
RIESGO ALTO o CG DESFAVORABLE. La consistencia de los
estudios en relación a la LMA con
citogenética de alto riesgo es muy
clara desde un punto de vista prác-
tico, el pronóstico de este grupo es
muy malo independientemente de
la alteraciones moleculares asociadas. Por ejemplo un paciente con
-5, -7 o CG compleja tendría un
pronóstico similar que un paciente
con CG normal o de bajo riesgo
pero con la presencia de FLT3-ITD.
Así que uno trata al paciente a la
luz de esta información y quizá no
espere los resultados moleculares
que probablemente no den mas información o cambien el manejo que
seguramente incluirá dosis altas de
citarabina seguido de un trasplante
alogénico de células progenitoras
hematopoyéticas, si esta disponible
(a menos que se tenga disponible un
protocolo de investigación con un
inhibidor de FLT3, por ejemplo).3
La respuesta completa en pacientes con LMA de riesgo CG
desfavorable se ha calculado en
55% o menor con un riesgo relativo
de muerte mayor cuando se compara con el grupo de RG favorable,
de 3.3 (95% CI 2.43-4-55). Los
pacientes con -5/5q-; -7/7q- y cariotipo complejo tienen aun peores
perspectivas con RC de 37% y peor
supervivencia que el resto del grupo
con CG desfavorable.
RIESGO BAJO O CG FAVORABLE. En este grupo se empezó
a sospechar que había “algo mas
allá” del rearreglo estructural o
numérico de los cromosomas. Aquí
se incluye a la t(15;17) conocida
por su excelente pronóstico. Otras
traslocaciones de “bajo riesgo”
incluidas en este grupo, en principio, tienen buen pronóstico. Como
la t(8;21) y la t(16;16), inv(16) y
del(16q) conocidas como portadoras del “core-binfing factor” (CBF).
Pero ¿por qué no todos los pacientes
se benefician de tener estas traslocaciones?. Existe un subgrupo de
pacientes que evolucionan “menos
bien” cuando son portadores de
estas alteraciones cromosómicas.
Schnittger y cols, estudiaron el
papel de las mutaciones de KIT en
S1
Volumen 15, Suplemento 1, 2014
Revista de Hematología
el codón D816. La presencia de la
mutación en KIT en pacientes con
la t(8:21) tuvo un impacto negativo
en la supervivencia global (mediana
de 304 vs 1836 días, P=.006) y en
la supervivencia libre de progresión
(244 vs 744 días, P.003). 4 Estos
hallazgos han sido confirmados
y ampliados por Paschka y cols.
quienes analizaron las mutaciones
en los exones 17 y 8 de KIT en una
cohorte de pacientes con LMA con
Inv(16)(p13q22) y t(8;21)(q22;q22).
Las mutaciones en el exón 17 de
KIT se asociaron con un mayor
riesgo de recaída, en tanto que
las mutaciones en los 2 exones,
17 y 8, afectaron negativamente
la supervivencia global y libre de
enfermedad sobre todo en pacientes
con inv(16).5 De confirmarse estos
datos en grupos grandes multicéntricos internacionales, existiría
un grupo de pacientes con estas
modificaciones moleculares en
presencia de CG de riesgo favorable
que quizá deban ser considerados
para consolidaciones mas agresivas,
incluso con trasplante de células
progenitoras hematopoyéticas.
RIESGO INTERMEDIO. Este
es, quizá, el grupo mas interesante
de esta monografía. Incluye a los
pacientes que se presentan con
CG diploide o “normal”. Desde el
punto de vista molecular, existe una
heterogeneidad de comportamientos biológicos que pueden ayudar
al clínico en la toma de decisiones
trascendentales para sus pacientes,
por lo que su entendimiento se
vuelve indispensable.
En este sentido se han reportado
varias alteraciones moleculares con
impacto en el pronóstico de los pacientes como FLT3, NPM1, CEBPA,
TET2, ASXL1, IDH1-2, DNMT3A,
PHF6, WT1, TP53, EZH2, RUNX1,
PTEN, KIT y la familia RAS. 6,7
Un estudio reciente evaluó un
extenso análisis mutacional de 18
genes en 398 pacientes menores de
60 años con LMA. Casi todos los
S2
pacientes en este grupo tuvieron
una alteración somática (97.3%). La
mayor heterogeneidad de alteraciones moleculares fue encontrada en
el grupo de riesgo intermedio. De
ellas la duplicación en tándem (ITD)
de FLT3, ASXL1, PHF6 y TET2 se
asociaron con menor supervivencia
global. La mutación en R140Q de
IDH1 tuvieron mejor supervivencia.
El análisis multivariado, como ha
sido demostrado en otros estudios,
mostró que FLT3-ITD es el principal predictor de mala evolución
en pacientes con LMA de riesgo
intermedio. Cuando se analizaron
los pacientes con FLT3-ITD de
tipo silvestre, TET2, ASXL1, PHF6
y MLL-PTD se asociaron independientemente con mal pronostico.
Por otro lado los pacientes con LMA
de riesgo intermedio con mutaciones de NPM1 combinado IDH1 ó
IDH2 mutados demostraron una
mejor supervivencia global a 3 años
comparado con el grupo de NPM1,
también mutado pero combinado
con IDH1 ó IDH2 de tipo silvestre.8
Estos datos son extraordinariamente relevantes ya que el uso del
perfil mutacional diseca subgrupos
dentro del grupo de pacientes
con LMA de riesgo intermedio
definido por CG. Con el análisis
de mutaciones estos pacientes se
pudieron re-clasificar en cuanto a
su pronóstico.
La supervivencia a 3 años del
grupo de riesgo favorable fue de
85%, el de riesgo intermedio de
42% y el de riesgo desfavorable
de 13%, mejor que la clasificación
CG sola: 58%, 36% y 11% respectivamente. Al final del estudio,
mezclando riesgo definido por CG
mas análisis mutacional el grupo
de CG favorable se incrementó de
19% a 26% con una SG a 3 años
del 64%, el grupo de CG intermedia
baja de 63% a 35% con una SG a
3 años de 42% y el de alto riesgo
aumenta del 18% al 39% con una
SG del 12%.8
Todo lo anterior tiene un aspecto muy práctico ya sugiere que
podemos ofrecer tratamientos mas
agresivos, como dosis altas de antraciclenos, dosis altas de citarabina
en inducción o trasplante de células
progenitoras hematopoyéticas, de
una manera mucho mas racional
y exacta. De hecho este estudio
mostró que el subgrupo de pacientes con mutaciones en DNMT3A,
NPM1 o MLL se beneficiaron del
uso de dosis altas de antraciclenos
en inducción con SG a 3 años de
44% comparado con 25% cuando
se dieron dosis estándar de antraciclenos a este grupo.8,9
Otros estudios, por ejemplo, han
mostrado la utilidad de combinaciones de drogas como el estudio de
Schlenk et al. en pacientes con LMA
y citogéntica diploide. Los pacientes portadores de la combinación
de NPM1 con FLT3 de tipo silvestre
se benefició significativamente del
uso de ácido trans-retinoico (ATRA)
combinado en la inducción con
daunorrubicina, citarabina y etopósido comparado con aquellos con
la misma firma molecular pero que
no recibieron ATRA en inducción.10
Finalmente, Neubauer et al,
reportaron recientemente una
tendencia hacia una mejor supervivencia en pacientes con LMA y
RAS mutado cuando se comparó
con el grupo de RAS mutado, pero
que no recibieron dosis altas en la
consolidación.11
Los datos anteriores revelan
que el análisis mutacional en las
LMAs puede proporcionar un mayor
conocimiento del proceso leucémico en sí mismo, pero desde el
punto de vista mas práctico puede
desmenuzar y re-distribuir de una
manera mas detallada, y por lo
tanto eficiente, a los pacientes a
tratamientos mas “razonables” y
que, con el solo análisis de CG,
hubieran tenido una evolución mas
desfavorable que lo esperado con el
conocimiento actual.
Libro Educativo 55 Congreso Nacional de la Agrupación Mexicana para el Estudio de la Hematología, A.C.
REFERENCIAS
1.
Döhner H, Estey E, Amadori S, et.
al. Diagnosis and management of
acute myeloid leukemia in adults:
Recommendations from an international expert panel, on behalf of
the European LeukemiaNet. Blood
2010;115(3):453-474.
2. Slovak M, Kopecky KJ, Cassileth PA,
et al. Karyotypic analysis predicts
outcome of preremision and postremision therapy in adulta cute
myeloid leukemia: A Southwest
Oncology Group/Eastern Cooperative Oncology Group. Blood
2000;96(13):4075-83.
3.
Estey E. Treatment of acute myeloid leukemia. Haematologica
2009;94(1):10-15
4. Schnittger S, Kohl TM, Haferlach T,
et al. KIT-D816 mutations in AML1ETO-positive AML are associated
with impaired event-free and overall
survival. Blood 2006;107(5):179199.
5. Paschka P, Marucci G, Ruppert AS, et
al. Adverse Prognostic Significance of
KIT Mutations in Adult Acute Myeloid
Leukemia With inv(16) and t(8;21): A
Cancer and Leukemia Group B Study.
J Clin Oncol 2006;24(24):3904-11.
6. Mawad R, Estey E. Curr Oncol Rep
2012;14(5):359-68
7. Mrózek K, Marcucci G, Paschka P, et
al. Blood 2007;109(2): 431-448
8. Patel JP, Gönen M, Figueroa M, et
al. Prognostic relevance of integrated genetic profiling in acute
myeloid leukemia. N Engl J Med.
2012;366(12):1079-89
9. Fernandez HF, Sun Z, Yao X, et al.
Anthracycline dose intensification
in acute myeloid leukemia. N Engl J
Med 2009;361:1249-59.
10. Schlenk RF, Döhner K, Kneba M, et
al. Gene mutations and response to
treatment with all-trans retinoic acid
in elderly patients with acute myeloid
leukemia. Results from the AMLSG
Trial AML DH98B. Haematologica
2009;92(1): 54-60.
11. Neubauer A, Maharry K, Mrózek
K, et al. Patients with acute myeloi leukemia and RAS mutations
benefit most from postremission
high-dose cytarabine: A Cancer and
Leukemia Group B Study. J Clin Oncol
2008;26(28):4603-9.
Membrane receptors in haemostasis and thrombosis
Eduardo ANGLES-CANO, M.D.,
Sc.D.
Inserm UMR_S1140 « Innovative
Therapies in Haemostasis»
Faculty of Pharmaceutical and
Biological Sciences, Paris Descartes
University
Eduardo.Angles-Cano@inserm.fr
The concept of the cell membrane
as a “fluid mosaic model” matching the existence of dispersed
monomeric proteins floating in
the hydrophobic dimension of the
lipid bilayer has evolved over the
last 40 years since its original description by Singer and Nicolson.1
Current concepts indicate that the
cell membrane is constituted by an
asymmetric lipid bilayer that varies
considerably in thickness due to its
content in many species of proteins,
lipids and other molecules. Their
spatial organization is imposed
by electrostatic interactions. Some
proteins display large structural
domains outside the transmembrane region and create thereby steric
hindrance and interaction outside
the bilayer.2
Receptors and effectors are
localized in membrane domains.
Because of the fluidity of the lipid
bilayer, the components of membranes can form nonhomogeneous
ordered structures or membrane
domains that differ in lipid and/or
protein composition from the surrounding membrane. A large variety
of biochemical stimuli may generate these ordered structures called
“rafts” having highly differentiated
molecular composition and supermolecular architecture. The size of
these evanescent structures in intact
cells varies considerably from the
nanometre to the micrometre range
and their short-term lifespan ranges
from microseconds to milliseconds
or seconds. 3 These domains serve
as scaffold for molecular interac-
tions that are dynamic in time and
space. For instance, ligands in the
surrounding milieu may match specific receptors that transduce signals
and couple events in the outer or
the inner membrane leaflets. Thus,
in addition to boundary, biological
membranes play multiple functional
roles. As indicated above, membrane molecules are organized in
protein complexes forming regions
of functional specialization. In the
vascular tree and circulating blood
these properties are intrinsic to the
functioning of the haemostatic system and to the physiopathology of
thrombosis.4
Cell surface receptors in haemostasis. Membrane proteins that
capture specific proteins from the
surrounding milieu and trigger
thereby intracellular signals are
considered as membrane receptors.
Ligands to these receptors may have
an effector function or may behave
as signalling molecules that trigger changes in the function of the
cell. This process is called signal
transduction. Protease-activated
receptors (PARs), the protein C receptor and the urokinase receptor
uPAR are well-known examples and
will be the object of a brief account
in this chapter.
Protease-activated receptors.
A significant number of serine
proteases of the hemostatic system
display a signaling function besides
their functionning in clot formation
and lysis. This signaling activity
is exercised by their interaction
with proteinase-activated receptors (PARs). The family of PARs
include four members: PAR1, PAR2,
PAR3 and PAR4, that are members
of the G-protein-coupled seventransmembrane domain receptor
family. As with other G proteincoupled receptors, activated PARs
induce G protein-mediated signal
transduction, stimulating intracellular calcium mobilization, and
cell particular functions (spreading,
S3
Volumen 15, Suplemento 1, 2014
Revista de Hematología
migration, mediators secretion…).
PARs mediate hemostasis, thrombosis, inflammation, embryonic
development and progression of
certain malignant cancers. PARs
harbor a cryptic ligand sequence
within their N-terminus that is
exposed following proteolytic
cleavage. 5 PARs are cleaved by
serine proteinases within the extracellular N-terminus, allowing the
new N terminus to bind and activate
the receptors themselves. The newly
formed PAR N-terminus functions
as a tethered ligand that binds
intramolecularly to the receptor to
trigger transmembrane signalling.
This sequence acts as a ligand that
binds to a receptor sequence and
thereby triggers transmembrane
signaling. This unique mechanism
of activation suggests that PAR activation by serine proteases would
induce a similar signalling response.
However, this is not the case.
The most well known and prototype activation of PARs is the
thrombin activation of PAR-1. It
has recently been reported that
activated protein C (APC) factor Xa,
and high concentrations of plasmin transduces signalling through
PAR-1 on the cell surface. PAR-1
activation by thrombin results in cell
migration, wound healing and an
angiogenic response. Interestingly,
thrombin at high concentrations
may disrupt the endothelial barrier
via PAR-1 activation, whereas APC
appears to improve endothelial barrier function. Activation of PAR-1
by APC requires formation of a complex with the endothelial protein C
receptor (EPCR).
The affinity of plasmin for PAR1 is 10-fold lower than that of
thrombin. Thus, the activation of
PAR-1 would be possible only when
plasmin is concentrated on the cell
surface. Increased plasminogen
activation on the cell surface may
increase the cell surface plasmin
concentration and may lead to
S4
plasmin-mediated PAR-1 activation and subsequent cell signaling
and cell actions: spreading, stress
fibre formation and migration of
endothelial cells. This activity of
plasmin requires its lysine-binding
sites in kringle domains and the
catalytic activity of plasmin.6
Endothelial protein C receptor.
The protein C pathway provides
useful effector function in haemostasis and inflammation.4 The
endothelial protein C receptor
(EPCR) is required to allow transformation of protein C into activated
protein C (APC). EPCR is therefore
a key receptor that regulates APC’s
diverse activities. As an anticoagulant activated protein C regulates
coagulation, maintains blood fluidity and prevent thrombosis; as an
anti-inflammatory activated protein
C is cytoprotective, anti-apoptotic,
stabilizes the endothelial barrier
and prevents vascular damage.
Based on this knowledge, potential
therapeutic strategies have been
developed in thrombosis, inflammation and ischemic stroke.7,8
EPCR was originally described as
an endothelial receptor. However, it
has been detected in other blood
cell types, placental throphoblast
and bone marrow stem cells. EPCR
has a molecular mass of around 46
kDA, representing 238 amino acids.
including a small cytoplasmic end,
the transmembrane domain and a
large extracellular region. EPCR is
able to bind both protein C and APC
with a high affinity (Kd = 30 nM)
in a calcium-dependent manner.
The EPCR/PC complex is adjacent
to the thrombomodulin-thrombin
complex so that a high local APC
generation is achieved. APC cleaves
and inactivates cofactors Va and
VIIIa, in interaction with protein S,
and thereby shuts down coagulation. Occurrence of thrombosis in
patients with partial deficiencies
in protein C or thrombomodulin
and in carriers of a factor VLeiden
that is poorly degraded by APC,
underscores the pathophysiological
relevance of this pathway. Recent
evidence indicates que factor VII
is also a ligand for EPCR. 9 Membrane localization of PAR-1 with
EPCR in caveolae (a form of lipid
raft) is required for selective PAR1
signaling by APC. Cytoprotection
of brain endothelium by APC in
vitro required endothelial protein
C receptor (EPCR) and proteaseactivated receptor-1 (PAR-1).10
Urokinase-type plasminogen
activator receptor (uPAR). The
urokinase plasminogen activator
(uPA) is a serine protease originally
isolated from human urine. It is
expressed and released by the leukocytes, epithelial cells and tumor
cells. Urokinase is secreted as a
single-chain molecule (sc-uPA) that
must be activated in order to display
full protease activity in its two-chain
form (tc-uPA). The epidermal growth
factor-domain of uPA contains an
interaction sequence for binding to
the receptor uPAR.
The uPAR receptor is a glycoprotein of 55 kDa consisting of 3
homologous cysteine-rich domains
(D1, D2 and D3). The receptor for
urokinase has no transmembrane domain. It is anchored to the
membrane via a glycosylphosphatidylinositol. The uPAR receptor is
not only involved in the activation
of plasminogen to plasmin via uPA
but is also capable of modulating
various processes such as adhesion, migration, differentiation, or
cell proliferation.11 To this purpose,
uPAR can transmit an intracellular
signal by interacting with integrins,
receptors coupled to G proteins,
caveolin (and lipid rafts) or vitronectin. Thus, several intracellular
signaling pathways can be activated
by the uPAR/uPA complex alone
or in contact with vitronectin and
can coordinate together proteolysis, adhesion and cell signaling.12
Furthermore, uPAR acts as a potent
Libro Educativo 55 Congreso Nacional de la Agrupación Mexicana para el Estudio de la Hematología, A.C.
regulator of tumour cell migration
and invasion and can also promote
proliferation and survival. Clinical
applications of uPAR for diagnosis
and follow up of cancer patients
have been the object of several
studies. 13
References
1.
Singer SJ, Nicolson GL. The fluid mosaic
model of the structure of cell membranes. Science 1972;175:720-31.
2. Engelman DM. Membranes are
more mosaic than fluid. Nature
2005;438:578-80.
3. Sonnino S, Prinetti A. Membrane
domains and the “lipid raft” concept. Current medicinal chemistry
2013;20:4-21.
4. Versteeg HH, Heemskerk JW, Levi
M, Reitsma PH. New fundamentals
in hemostasis. Physiological reviews
2013;93:327-58.
5. Canto I, Soh UJ, Trejo J. Allosteric
modulation of protease-activated
receptor signaling. Mini reviews in
medicinal chemistry 2012;12:804-11.
6. Syrovets T, Lunov O, Simmet T. Plasmin as a proinflammatory cell activator. Journal of leukocyte biology
2012;92:509-19.
7. Gleeson EM, O’Donnell JS, Preston
RJ. The endothelial cell protein C
receptor: cell surface conductor of
cytoprotective coagulation factor
signaling. Cellular and molecular life
sciences : CMLS 2012;69:717-26.
8. Bouwens EA, Stavenuiter F, Mosnier
LO. Mechanisms of anticoagulant
and cytoprotective actions of the
protein C pathway. Journal of thrombosis and haemostasis : JTH 2013;11
Suppl 1:242-53.
9. Montes R, Puy C, Molina E, Hermida
J. Is EPCR a multi-ligand receptor?
Pros and cons. Thrombosis and haemostasis 2012;107:815-26.
10. Mosnier LO, Zlokovic BV, Griffin
JH. The cytoprotective protein C
pathway. Blood 2007;109:3161-72.
11. Blasi F, Sidenius N. The urokinase
receptor: focused cell surface proteolysis, cell adhesion and signaling.
FEBS letters 2010;584:1923-30.
12. Smith HW, Marshall CJ. Regulation
of cell signalling by uPAR. Nature reviews Molecular cell biology
2010;11:23-36.
13. Boonstra MC, Verspaget HW, Ganesh
S, et al. Clinical applications of the
urokinase receptor (uPAR) for cancer
patients. Current pharmaceutical
design 2011;17:1890-910.
DOSIS INTERMEDIAS DE CITARABINA EN EL TRATAMIENTO DE
LA LEUCEMIA MIEOLOBLASTICA
AGUDA
Carlos Best Aguilera, José Abelardo
García Balderrama, Yvonne Magaly
Fernández Figueroa
Hospital General de Occidente SSJ
carlosbest@gmail.com
Resumen: Las evidencias clínicas y
básicas acumuladas respecto al rol
de las dosis intermedias de Ara C en
la Leucemia Mieloblástica Aguda,
no son nuevas, sin embargo los
ensayos clínicos más recientes con
mayor número de sujetos y mejor
diseño experimental soportan la
noción de que esta modalidad terapéutica es igual de eficaz y menos
tóxica respecto a las dosis altas de
Ara C, que corresponden a la dosis
máxima tolerada. Aquí se revisan
estos conceptos y se anotan datos
no publicados en población mexicana utilizando esta aproximación
terapéutica.
Summary: The clinical and basic
evidence accumulated regarding
the role of the intermediate-dose
Ara-C in acute myelogenous leukemia, are not new, however the
most recent clinical trials with larger
numbers of subjects and better
experimental design, support the
notion that this therapeutic modality
it is equally effective and less toxic
compared to the high dose Ara C,
corresponding to the maximum
tolerated dose. Here these concepts
are reviewed and unpublished
Mexican population data using this
therapeutic approach are noted.
Optimización de la dosis de Ara
C y fundamentos farmacológicos.
La Citarabina (Ara C) se introdujo
en el tratamiento de la Leucemia
Mieloblástica Aguda (LMA) desde
1968 y todavía constituye el agente
más activo en el tratamiento de la
enfermedad.1 Sin embargo, a pesar
de estar disponible desde hace más
de cuatro décadas y ser objeto de
múltiples ensayos clínicos y básicos
la forma de administración y las
dosis óptimas de esta droga siguen
evolucionando constantemente y
no han sido del todo dilucidadas.
Los regímenes utilizados difieren
ampliamente en el rango de dosis
utilizada que va de los 10 mg/m2 a
3000 mg/m2. Lo mismo ocurre con
los intervalos de tiempos y duración
de la infusión en diferentes contextos y ensayos clínicos. Respecto a
esto último, el intervalo de 12 horas
que es usual en la administración de
las dosis altas de Ara C constituye
una ventana de escape para que las
células madre leucémicas, cuya fase
S del ciclo celular sea menor a este
tiempo, escapen de la exposición a
la pro droga.2
Dada la amplia variedad de
dosis para el Ara C aún carecemos
de una definición universal para
los rangos que denotan dosis bajas, dosis convencionales, dosis
intermedias y dosis altas. No obstante los siguientes rangos suelen
ser referidos de la siguiente manera:
10-25 mg/m2 se refiere a dosis
bajas, 100-400 mg/m2 son dosis
convencionales, 500-1000 mg/m2
dosis intermedias y 2000-3000 mg/
m2 dosis altas.
Estudios farmacológicos que
datan de varias décadas atrás y
otros más recientes, han establecido que dosis de 500 a 1000 mg/
m2 saturan la enzima intracelular
deoxicitina cinasa activadora del
Ara C. De acuerdo a estas investigaciones, un incremento mayor
no conduce a una mayor actividad
anti leucémica, solamente a una
más pronunciada toxicidad. Uno de
estos estudios evaluó tres grupos de
dosis 3000, 1500 y 750 mg/m2 y no
encontró cambios significativos en
S5
Volumen 15, Suplemento 1, 2014
Revista de Hematología
la acumulación intracelular del metabolito activo del Ara C (AraCTP).
Se notó, que esta concentración
es también dependiente del tiempo
de infusión. No obstante que comparativamente los niveles de Ara C
en plasma fueron menores en las
infusiones inferiores a 3 gramos,
la acumulación del metabolito
activo en las células leucémicas
no cambio respecto a las dosis
altas de Ara C.4 Sin embargo, los
mecanismos celulares responsables
de la resistencia a la droga, como
un incremento en la enzima neutralizante del metabolito activo del
Ara C, la inhibición del ingreso del
Ara C a la célula por una alteración
en la capacidad del sistema de
transporte transmembranal, la disminución en la incorporación del
metabolito activo de la droga en la
molécula del ADN o una reparación
más rápida y efectiva del daño al
ADN,1 pueden requerir incrementos
adicionales en las dosis
La tradicional inducción a la
remisión en sujetos jóvenes basada
en el esquema de 7 días de citarabina a dosis de 100 a 200 mg/m2
y 3 días de antraciclinicos ha sido
retada por varios ensayos clínicos
basados en dosis altas de Ara C3.
No obstante el mayor énfasis de la
utilidad de las dosis altas de Citarabina 3000 mg/m2 (que es la dosis
máxima tolerada) ha sido hecho en
la consolidación y en los casos de
recaída o enfermedad refractaria.
Por otra parte, en lo que no
existe controversia es en el principio general de obtener el mayor
beneficio terapéutico con la menor
toxicidad posible. Además, una
menor toxicidad permite una mejor continuación del tratamiento,
lo que hace posible una mayor
exposición a través del tiempo de
las células leucémicas a las drogas
activas. Posiblemente, el mejor
ejemplo en este sentido lo tenemos
con el posicionamiento en marcha
de las dosis bajas de dexametasona
S6
vs las dosis altas en el tratamiento
del Mieloma Múltiple.
Uno de los ensayos clínicos
más significativos por el número
de pacientes y diseño experimental
comparó la efectividad en la inducción a la remisión en dos ciclos,
basada en dos esquemas de dosis
de Ara C, estableciendo un grupo de
dosis intermedias (ciclo 1: 200mg/
m2 en infusión continua de 24
horas días 1-7 y ciclo2: 1000 mg/
m2 en infusión de 3 horas cada 12
horas días 1-6) contra un grupo de
dosis altas de Ara C (ciclo1: 1000
mg/m2 en infusión de 3 horas cada
12 horas días 1-5 y ciclo 2: 2000
mg/m2 en infusión de 6 horas cada
12 horas días 1, 2, 4 y 6). No se encontraron diferencias significativas
entre el grupo de dosis intermedias
y dosis altas de Ara C respecto a la
tasa de remisión completa (80%
y 82% respectivamente), probabilidad de recaída, sobrevida libre
de evento a 5 años (34% y 35%),
o sobrevida global (40% y 42%).
El grupo con dosis altas de Ara C
tuvo mayor incidencia de efectos
tóxicos grado 3 y 4, hospitalización
prolongada y retraso de la recuperación en la cuenta de neutrófilos
y plaquetas.5
La evidencia recopilada, indicaría que las dosis altas de Ara C
a niveles de 2000-3000 mg/m2 se
sitúan por encima de la curva de
máximo efecto terapéutico y agregan toxicidades serias sin aportar
efectos anti leucémicos adicionales
demostrables.6
Otros ensayos clínicos recientes
que involucran números significativos de pacientes han llegado a
conclusiones similares.7,8
En relación a la duración de la
terapia post remisión, los estudios
han comparado un número limitado
de ciclos de dosis altas de Ara C
contra la extensión del tratamiento
post remisión, pero basada en dosis
habituales de la misma y demostraron la superioridad de las primeras.
Aunque a la luz de la farmacología
de la droga esto resulta una comparación injusta y podría contar para
las limitaciones en los resultados
de los tratamientos actuales sustentados en una terapia post remisión
limitada y confinada usualmente a
un promedio de tres ciclos de dosis
altas de Ara C.9
Dosis intermedias de Ara C en
el tratamiento de LMA: Experiencia
de una sola institución mexicana.
Como se ha descrito anteriormente,
existe suficiente evidencia clínica
y básica para desalentar la utilización de las dosis altas de Ara C en
favor de las dosis intermedias. Paralelamente y desde hace 19 años,
nuestro grupo ha implementado un
plan de tratamiento que descansa
en dos premisas: la utilización de
dosis intermedias de Ara C y la extensión de la terapia post remisión
basada en una columna vertebral
de Citarabina a dosis intermedias.
En relación al último punto este
plan de tratamiento denominado
con el acrónimo AMED no debe
ser entendido como terapia de mantenimiento, sino más bien como
una terapia intensiva, extendida y
sustentada en dosis de Ara C farmacológicamente optimizadas, que
otorga mayor tiempo de exposición
y menor toxicidad que la exhibida
por las dosis altas de Ara C.
Brevemente el plan de tratamiento involucra: Ara C 500 mg/
m2 en infusión de 12 horas por 3
días, asociado de forma alternativa
y cíclica a doxorrubicina, etoposido
y dosis altas de 6MP por vía oral.
En la última actualización de los
resultados que comprende de Enero
de 1997 a Abril de 2013 se habían
tratado 34 pacientes con LMA no
M3, con una mediana de edad de
32 años y un promedio de ciclos
de AMED administrados de 8.3
(planeado a 9 ciclos). La sobrevida
global documentada fue de 59% a
una media de 57 meses y un rango
de 6 a 182 meses. La superviven-
Libro Educativo 55 Congreso Nacional de la Agrupación Mexicana para el Estudio de la Hematología, A.C.
cia libre de leucemia es de 65%
con mediana de 47.5 meses y un
rango de 5 a 172 meses (figura 1).
Notablemente no se documentaron
muertes en relación a la extensión
con el esquema AMED (datos no
publicados en extenso).
Estos resultados son notoriamente contrastantes respecto a los
informados en las grandes series publicadas. No obstante la mayoría de
los ensayos suelen concluir con la
consolidación sustentada en dosis
altas de Ara C o bien con trasplante
de medula ósea cuando está disponible. Los escasos estudios que
han abordado el mantenimiento
en LMA han adoptado regímenes de la Leucemia Linfoblástica
Aguda y éstos se fundamentan en
dosis bajas de antimetabolitos.
Contrariamente, nuestro plan de
tratamiento utiliza dosis intermedias
de Citarabina capaces aprovechar al
100% los mecanismos enzimáticos
de activación de la pro droga y
expone durante un mayor intervalo
de tiempo a la población de células
leucémicas, lo que disminuye el
número de células fuera de la fase
S, susceptibles de escapar a la exposición al fármaco. Lo anterior se
logra sin tener niveles plasmáticos
demasiado elevados de la droga y
por ende menor toxicidad. Optimizando así el uso de la Citarabina.
Conclusiones. Suficiente evidencia clínica y farmacológica se
ha acumulado hasta la fecha, favoreciendo el uso de dosis intermedias
de Ara C, lo cual constituye un uso
más racional del fármaco respecto
a la cuestionada administración de
las dosis máximas toleradas de Ara
C (3000 mg/m2).
La experiencia en nuestro grupo,
con pacientes mestizos mexicanos
apoya la utilización de las dosis
intermedias de Ara C sobre las dosis
altas. Posiblemente el incremento
en la dosis de Ara C por arriba de la
necesaria para saturar la maquinaria
metabólica intracelular responsable
de la activación de la pro droga,
solo se justifique en los casos de
enfermedad refractaria o resistente.
Referencias.
1.
2.
3.
4.
Figura. Sobrevida Libre de Leucemia
con el Protocolo AMED
Wolfgang Hiddemann, Eberhard
Schleyer, Christa Uhrmeister, Carlo
H. Aul, Georg Maschmeyer, Achim
Heinecke, et al. High-dose versus intermédiate-dose cytosine
arabinoside in combination with
mitoxantrone for the tratment of relapsed and refractory acute myeloid
leukemia-preliminary clinical and
pharmacological data of a randomized comparison. Cancer Treatment
Reviews 1990:17:279-285.
Richard L Momparler. Optimization
of cytarabine (ARA-C) therapy for
acute myeloid leukemia. Experimental Hematology & Oncology 2013:
2:20:2-5.
Roelof Willemze, Stefan Suciu, Giovanna Meloni, Boris Labar, Jean-Pierre Marie, Constantijn J.M. Halkes, et
al. High-Dose Cytarabine in Induction
Treatment Improves the Outcome
of Adult Patients Younger Than
Age 46 Years With Acute Myeloid
Leukemia: Results of the EORTCGIMEMA AML-12 Trial. J Clin Oncol
2014:32:219-228.
William Plunkett, Jan O. Liliemark,
Theresa M. Adams, et al. Saturation
of 1-β-D-Arabinofuranosylcytosine
5´-Triphosphate Accumulation in Leukemia Cells during High-dose 1-β-DArabinofuranosylcytosine Therapy.
5.
6.
7.
8.
9.
Cancer Research 1987:47:3005-3011.
Bob Löwenberg, M.D., Thomas Pabst,
M.D., Edo Vellenga, M.D., Wim van
Putten, M.Sc., Harry C. Schouten,
M.D., Carlos Graux, M.D, et al. Cytarabine Dose for Acute Myeloid Leukemia. N Engl J Med 2011:364:1027-36.
Bob Lowenberg. Sense and nonsense of high-dose cytarabine for
acute myeloid leukemia. Blood,
2013:121:1:26-28.
Schaich M, Röllig C, Soucek S, Kramer
M, Thiede C, Mohr B, Oelschlaegel
U, et al. Cytarabine dose at 36 g/m2
compared with 12 g/m2 within first
consolidation in acute myeloid: results of patients enrolled onto prospective randomized AML96 study. J
Clin Oncol.2011:29:19:2696-2702.
Miyawaki S, Ohtake S, Fujisawa S,
Kiyoi H, Shinagawa K, Usui N, et al. A
randomized comparison of 4 courses
of standard-dose multiagent chemotherapy versus 3 courses of high
dose cytarabine alone in postremission therapy for acute myeloid leukemia in adults: the JALSG AML201
study. Blood. 2011:117:8:2366-2372.
Mayer RJ, Davis RB, Schiffer CA,
Berg DT, Powell BL, Schulman P, et
al. Intensive postremission chemotherapy in adults with acute
myeloid leukemia. N Engl J Med.
1994:331:14:896-903.
Novel Therapies in CLL
Jennifer R Brown MD PhD
Dana-Farber Cancer Institute
Associate Professor of Medicine,
Harvard Medical School
Email: jbrown2@partners.org
Historically CLL has been thought
of as a chronic disease best treated
palliatively with little hope of disease modifying therapy that might
alter survival. The observation that
rituximab improved overall survival
in combination with fludarabinecyclophosphamide in the German
CLL Study Group CLL8 study was
the first hint of more powerful
therapy that might truly improve
outcomes. Now, within the last
year, multiple clinical trials in CLL
have been reported that showed an
S7
Volumen 15, Suplemento 1, 2014
Revista de Hematología
overall survival benefit for a novel
agent as compared to or in combination with standard therapy, and
the excitement about these agents
is palpable. These include small
molecule inhibitors of key pathways
involved in the pathogenesis of
CLL, specifically the B cell receptor (BCR) pathway (especially BTK
and PI3K), and the anti-apoptotic
pathway (especially BCL-2), as well
as the antibody obinutuzumab
(GA-101). We will consider each,
focusing on the molecules most
advanced in clinical development.
BCR Pathway Inhibition. Constitutive activation of the BCR pathway
is quite common in CLL, even
though activating somatic mutations
are rare1, and kinases within this
pathway, particularly BTK and PI3K,
have been very successfully targeted
in the clinic. Earlier studies looked
at dasatinib as an inhibitor of LYN,
fostamatinib as an inhibitor of SYK,
and everolimus as an inhibitor of
mTOR.1 These agents typically had
nodal response rates of about 50%
and progression free survivals (PFS)
of about 6 months. An unusual
pattern of response was initially
noted in these early studies and
subsequently abundantly confirmed with idelalisib and ibrutinib.
Specifically, soon after initiation
of the drug, patients have rapid
improvement in clinical well-being
and reduction in lymphadenopathy,
yet with a similarly rapid increase in
lymphocyte count. The lymphocyte
count often continues to rise for
the first 1-2 months before leveling
off and then slowly coming down.
This phenomenon is thought to represent redistribution of cells from
lymph nodes and bone marrow
into peripheral blood, and has led
to a revision of the CLL response
criteria such that isolated increase
in lymphocyte count is not considered disease progression, and
patients who meet all criteria for
partial response (PR) except for a
S8
still elevated lymphocyte count are
considered PR with lymphocytosis
(PR-L). At present the significance
of the ongoing lymphocytosis is
unclear, but early data suggest that
these PR-L responses are as durable
as PRs by standard IWCLL criteria.2
BTK Inhibition. The importance
of the Bruton’s tyrosine kinase (BTK)
in B cell biology is underscored by
the human disease X-linked agammaglobulinemia, which is caused
by mutations in BTK and results in
an absence of B cells. Covalent BTK
inhibitors that bind to cysteine 481
irreversibly are showing excellent
activity in CLL, with approval of
ibrutinib expected in early 2014,
and two other molecules in clinical
trials.
Ibrutinib. Ibrutinib is an irreversible inhibitor of BTK that is not
particularly specific, with the capacity to inhibit 19 other kinases with
low IC50, but is quite potent against
BTK, with IC50 0.5 nM.3 Ibrutinib
induces modest apoptosis in CLL
cells in vitro in addition to inhibiting
their homing and migration. The
phase 1 clinical study of ibrutinib
included all B cell malignancies
and demonstrated complete BTK
occupancy 24 hours post-dose at
recommended phase 2 doses. In
addition, 11 CLL patients out of 16
showed response, including two
complete responses. The phase
1b/2 program in CLL was therefore
initiated and included cohorts of
relapsed refractory CLL patients
treated at 420 mg (n=51) or 840 mg
daily (n=34) as well as a previously
untreated older cohort treated primarily at 420 mg daily (n=31).4,5
IWCLL response rates were high,
as most patients resolved their
lymphocytosis, and PFS was 75%
in the relapsed refractory cohort at
26 mos4, and 96% in the untreated
cohort at 22 mos.5 Most of the
relapses thus far have been in the
higher risk 17p and 11q deletion
patients, however, with 26 mo
PFS 57% and 73%, respectively.4
Ibrutinib was well-tolerated with
diarrhea, nausea and rash being
some of the most common side
effects. The most concerning side
effect is the potential for bleeding
especially when combined with
warfarin, but so far this has proven
manageable. In early January 2014,
Pharmacyclics announced that the
RESONATE registration trial comparing ibrutinib to ofatumumab in
relapsed CLL met its primary PFS
endpoint as well as its secondary
OS endpoint and was stopped early.
A MD Anderson combination
study of ibrutinib with rituximab
in high risk relapsed CLL has reported a similar 18 month PFS of
78%, while in a phase 1b study of
ibrutinib with BR or with FCR, the
combinations were well tolerated
and the 15 month PFS in the BR
arm was 78%. It is of interest that
the PFS is similar for the single
agent as for the combinations with
rituximab or BR. These are of course
relatively small phase 2 studies that
cannot be directly compared, and
the similarity could be entirely due
to differences in patient selection,
yet this observation does raise the
question of how much the rituximab
or the BR is adding to single agent
ibrutinib. It is particularly interesting in light of data reported at ASH
2013, suggesting that ibrutinib may
inhibit ADCC through its ability to
inhibit ITK and could therefore interfere with rituximab’s mechanism
of action.
Other BTK Inhibitors. CC-292
is a more specific inhibitor of BTK
than ibrutinib and is currently finishing up its phase 1 study, with a
recommended phase 2 dose of 500
mg BID6. Response rates at that
dose are high, 50-70%, but median
follow-up is still short. ONO4059 is
the other BTK inhibitor in phase 1,
with 19 patients enrolled and accrual
ongoing. Additional BTK inhibitors
are in preclinical development.
Libro Educativo 55 Congreso Nacional de la Agrupación Mexicana para el Estudio de la Hematología, A.C.
PI3K Inhibitors. The catalytic
subunit of PI3 kinase has four
different class 1 isoforms which
show different cell type specificity. The alpha and beta isoforms
have broad expression and their
knockout phenotype is embryonic
lethal in mice, while delta and
gamma have expression limited to
hematopoietic cells, with knockout
mouse phenotypes that are mostly
due to impaired B cell function in
the case of delta, and impaired T
cell and neutrophil function in the
case of gamma. As a result the
PI3K inhibitors most studied in CLL
to date have been targeted at the
delta isoform, with limited data in
pan-PI3K inhibitors.
Idelalisib. Idelalisib, previously
known as CAL101 or GS1101, is
a potent specific inhibitor of the
delta isoform and the first PI3K
inhibitor to enter clinical trials in
CLL. In a very large phase 1 study
in hematologic malignancies, the
recommended phase 2 dose was
selected to be 150 mg BID. 54
heavily pretreated CLL patients
with a median of 5 prior regimens
were enrolled in this study and
showed a nodal response rate of
81%, IWCLL PR rate of 39%, and
PR-L rate of 33%. The relatively
high PR-L rate reflects that in this
study the redistribution lymphocytosis did not resolve quickly in
many patients. PFS in the entire
study population was 15.8 months,
and 32 months in those treated at
150 mg BID or higher.7 A phase 2
study of idelalisib with rituximab
in 64 previously untreated CLL
patients including 9 patients with
17p deletion showed a 97% ORR
with 19% complete remissions
and PFS 93% at 24 months. The
primary toxicities with idelalisib
have included increase in hepatic
transaminases, usually readily manageable by interrupting the drug,
rash and diarrhea including colitis
in a subset of patients.
The first registration trial
of idelalisib was also stopped early
for efficacy. In this study, idelalisib
with rituximab was compared to
placebo with rituximab in comorbid
CLL patients with historically short
remission durations.8 The idelalisibrituximab arm showed an ORR of
81% and the hazard ratio for PFS
was 0.15 (p<0.0001). 44% of patients had high risk 17p deletion and
this subset had equivalent responses
to the remaining study population.
Overall survival was also significantly improved, with 3 deaths on
the idelalisib arm vs 9 on the placebo arm. These results have been
submitted for FDA consideration,
and two other registration trials in
relapsed CLL are ongoing, assessing
idelalisib – ofatumumab vs ofatumumab alone, and idelalisib-BR vs
BR alone.
Other PI3K Inhibitors. The other
PI3K inhibitor most advanced in
clinical trials in CLL is IPI-145, a
potent inhibitor of both the delta
and gamma isoforms. Whether
inhibition of gamma in addition to
delta will enhance efficacy, toxicity
or both is not clear. The maximum
tolerated dose of IPI-145 is 75 mg
BID but the dose moving forward
in CLL is 25 mg BID, since high
efficacy has been seen even at 25
mg BID and the delta isoform is fully
inhibited at that dose.9 Nodal response rates are very high, 90-98%,
with PR rates 47%, likely due to
ongoing lymphocytosis in many of
the patients at this early follow-up.
Early results however suggest that
lymphocytosis may resolve more
quickly with IPI-145 than with idelalisib. A registration trial comparing
IPI-145 to ofatumumab in relapsed
refractory CLL has been initiated.
Experience with other PI3K
inhibitors is currently quite limited. Our group has led a phase
1b expansion cohort of a pan-PI3K
inhibitor, SAR245408, at the solid
tumor maximum tolerated dose
(MTD), 600 mg. The same pattern
of response with lymphocytosis was
observed, and the PR rate was 40%,
with four patients showing PFS
greater than 15 months. Additional
work with other agents will likely be
needed to determine whether inhibiting the alpha or gamma isoforms
adds to delta inhibition in CLL.
BCL-2 Inhibition: ABT199.
BCL-2 is nearly universally overexpressed in CLL and has been
recognized for some time as an
excellent therapeutic target in CLL.
Targeting this molecule with inhibitors has proven more challenging
than targeting kinases however. The
first generation inhibitor had activity
but was limited by thrombocytopenia that was an on target effect
of inhibiting BCL-XL in platelets.
Currently a second generation
inhibitor which is specific solely
for BCL2 is completing its phase
1 study. This drug, ABT199, is
extremely potent, and the primary
toxicity in the phase 1 study thus far
has been tumor lysis syndrome that
has resulted in a couple deaths on
these studies. The current dosing
scheme now involves slow weekly
escalation of dose in an inpatient
setting up to 400 mg daily as the
maximum dose for CLL. ABT-199
has been very effective, with ORR
84% with 23% complete remissions and 43 of 67 patients still on
study at a median of 11 months.
This drug shows the ability to clear
bone marrow resulting in complete
remissions and even MRD negative
complete remissions, which is very
exciting. However, the safety issues
around its administration are still
being sorted out, and registration
trials are delayed.
Anti-CD20 Antibody: Obinutuzumab. Obinutuzumab (GA101)
is the newest CD20 antibody to be
approved in CLL. As a humanized,
glycoengineered type II IgG1 antibody against CD20, obinutuzumab
causes more direct cell killing,
S9
Volumen 15, Suplemento 1, 2014
Revista de Hematología
likely through a lysosomal mediated
mechanism, and confers enhanced antibody-dependent cellular
cytotoxicity (ADCC), with reduced
complement dependent cytotoxicity
(CDC). Obinutuzumab very rapidly
clears B cells from peripheral blood
in patients, and also caused neutropenia in early studies.
Obinutuzumab in combination
with chlorambucil was recently approved for the initial therapy of CLL
by the US FDA on the basis of the
stage 1 results of the CLL11 study of
the German CLL Study Group. In
stage 1, chlorambucil with obinutuzumab (G-clb) was compared to
chlorambucil alone.10 The overall
trial enrolled 781 previously untreated CLL patients with comorbidities
and randomized them 1:2:2 to chlorambucil alone, chlorambucil with
rituximab (R-clb), or G-clb. G-clb
improved ORR, CR, PFS and OS
compared to clb alone (9% deaths
vs 20% for clb, HR 0.41, p=0.002).
The direct comparison of G-clb
to R-clb is likely of greater interest
however. This comparison showed
that G-clb improved ORR, CR, and
molecular response compared to
R-clb, and resulted in a marked
increase in PFS, from 16.3 months
with R-clb to 26.7 mos with Gclb.10 The large difference in PFS
between these anti-CD20 antibodies is impressive, and suggests that
the difference in molecular mechanism between obinutuzumab and
rituximab is likely significant in
CLL. The safety of obinutuzumab
was largely similar to rituximab,
with the exception of an increased rate of (manageable) infusion
reactions during the first dose and a
small increase in neutropenia (33%
with G-clb vs 28% with R-clb).
Also recently reported in abstract form are the results of a phase
1b parallel cohort safety study of
obinutuzumab in combination with
fludarabine-cyclophosphamide and
in combination with bendamustine,
S10
both in previously untreated patients. The bendamustine-GA101
arm enrolled 20 patients, seventeen
of whom completed six cycles of
therapy with side effects as expected
including neutropenia and infusion
reactions. The ORR was 90% with
20% CR and 25% CRi and no patients have relapsed with a median
followup of 13.6 months. The FC-G
arm enrolled 21 patients, 14 of
whom finished all six cycles of therapy. Most discontinuations were
for cytopenias, although the overall
rate of cytopenias was similar to
the G-benda arm. Infections and
elevation in hepatic transaminases
were more frequent on the G-FC
arm. The ORR on G-FC was 62%
with 10% CR and 14% CRi; these
results were somewhat confounded
by four patients included in the denominator who either had missing
data or were not evaluable. To date
no patients have progressed with a
median follow-up of 10.7 months.
Overall these results suggest that
additional combination studies
of obinutuzumab are warranted,
including with either chemoimmunotherapy or other novel agents.
Summary: The Future of CLL
Therapy. The current time is extremely exciting in CLL, given these
highly potent novel agents. It is
anticipated that within three years,
three new drugs will be approved
by the FDA for CLL: obinutuzumab
(with chlorambucil) for upfront
therapy, ibrutinib likely in early
2014 for relapsed therapy and
idelalisib (with rituximab) likely
in later 2014. Many questions remain about how best to use these
agents, much less all the additional
agents that will be following on
their heels, likely including IPI-145
and ABT-199 among many others.
We do not yet know whether
these agents would be best used
as sequential single agents, in
combinations with antibodies or
each other, or in combination with
chemoimmunotherapy. Although
much interest has focused on removing chemoimmunotherapy from
CLL therapy, it remains possible
that novel agents together with our
most potent chemoimmunotherapy, FCR, might prove curative in a
subset of patients. However such
regimens would likely be too toxic
for elderly patients or those with
comorbidities, who may be better
served either by single agents or
antibody combinations. An additional unknown issue is whether an
optimal sequence exists for these
drugs; the answer to that question
likely depends on resistance mechanisms which are just beginning
to be elucidated. Ultimately we
may wish to combine multiple
novel agents in an effort to achieve complete remissions and MRD
negativity without the side effects
of chemoimmunotherapy. As we
strive to answer these questions in
the coming years, the excitement
of the leaps and bounds in CLL
therapy is likely to continue, to the
great benefit of our patients.
References
1.
2.
3.
4.
5.
Brown JR: Ibrutinib in chronic lymphocytic leukemia and B cell malignancies. Leuk Lymphoma 55:263-9,
2014
Cheson BD, Byrd JC, Rai KR, et al:
Novel targeted agents and the need
to refine clinical end points in chronic
lymphocytic leukemia. J Clin Oncol
30:2820-2, 2012
Honigberg LA, Smith AM, Sirisawad
M, et al: The Bruton tyrosine kinase
inhibitor PCI-32765 blocks B-cell activation and is efficacious in models
of autoimmune disease and B-cell
malignancy. Proc Natl Acad Sci U S A
107:13075-80, 2010
Byrd JC, Furman RR, Coutre SE, et al:
Targeting BTK with ibrutinib in relapsed chronic lymphocytic leukemia. N
Engl J Med 369:32-42, 2013
O’Brien S, Furman RR, Coutre SE,
et al: Ibrutinib as initial therapy for
elderly patients with chronic lymphocytic leukaemia or small lymphocytic
lymphoma: an open-label, multicen-
Libro Educativo 55 Congreso Nacional de la Agrupación Mexicana para el Estudio de la Hematología, A.C.
tre, phase 1b/2 trial. Lancet Oncol
15:48-58, 2014
6. Brown JR, Harb WA, Hill BT, et al: Phase 1 Study Of Single Agent CC-292,
a Highly Selective Bruton’s Tyrosine
Kinase (BTK) Inhibitor, In Relapsed/
Refractory Chronic Lymphocytic Leukemia (CLL). Blood 122:1630, 2013
7. Brown JR, Furman RR, Flinn I, et
al: Final results of a phase I study
of idelalisib (GSE1101) a selective
inhibitor of PI3K{delta}, in patients
with relapsed or refractory CLL. JCO
31:7003, 2013
8. Furman RR, Sharman JP, Coutre SE, et
al: Idelalisib and Rituximab in Relapsed Chronic Lymphocytic Leukemia.
N Engl J Med, 2014
9. Flinn I, Patel M, Kahl BS, et al:
Preliminary Safety and Efficacy
Of IPI-145, a Potent Inhibitor Of
Phosphoinositide-3-Kinase-δ,γ, In
Patients With Chronic Lymphocytic
Leukemia. Blood 122:677, 2013
10. Goede V, Fischer K, Busch R, et al:
Obinutuzumab plus Chlorambucil
in Patients with CLL and Coexisting
Conditions. N Engl J Med, 2014
POLICITEMIA VERA
Francisco Cervantes
Servicio de Hematología, Hospital
Clínic, Barcelona, España
FCERVAN@clinic.ub.es
La policitemia vera (PV) es una
neoplasia mieloproliferativa crónica caracterizada por una intensa
proliferación eritroide asociada
en la mayoría de los pacientes a
la presencia de la mutación adquirida V617F del gen JAK2. Con
tratamiento adecuado, la supervivencia de los sujetos con PV es
de más de 15 años. Sin embargo,
las complicaciones trombóticas
constituyen una causa frecuente
de morbilidad, siendo los factores
de riesgo fundamentales para el
desarrollo de las mismas la edad >
60 años y la historia de trombosis
previa. Además, existe una cierta
tendencia a la hemorragia. Por
tanto, el objetivo principal del
tratamiento de la PV es prevenir
Policitemia vera
Edad < 60 años
Edad > 60 años
No historia trombosis
Historia trombosis
Sangrías hastaHto 45%
+ AAS 100 mg/día 2
+ corrección fact. riesgo vascular3
Hidroxiurea1
+ AAS 100 mg/día2
+ corrección fact. riesgo vascular 3
Continuar sangrías para mantener
Hto bajo control
Mala tolerancia a sangrías
Esplenomegalia sintomática
Trombocitosismarcada
Trombosis
Hemorragia
Hto< 45%
Plaquetas < 400 x10 9/L
Leucocitos < 10 x10 9/L
1: En pacientes <40 años o embarazadas: interferón
2: Si no existe contraindicación
3: Hipertensión arterial, diabetes, tabaquismo e hipercolesterolemia
Figura. Algoritmo terapéutico de la policitemia vera
las complicaciones trombohemorrágicas evitando, en lo posible,
la administración de fármacos con
potencial leucemógeno. De manera general, el tratamiento de la
PV se basa en las flebotomías para
mantener el hematócrito por debajo del 45% y en la aspirina a dosis
bajas como antiagregante plaquetario. En los pacientes con alto
riesgo de trombosis se recomienda
administrar asimismo tratamiento
citorreductor, siendo la hidroxiurea el agente de primera línea. En
caso de resistencia o intolerancia
a la hidroxiurea puede administrarse busulfán en sujetos de
edad avanzada (por encima de los
65-70 años). El interferón-α sería
una opción no quimioterápica a
considerar en pacientes jóvenes
con necesidad de citorreducción.
El tratamiento citorreductor se administra también a los individuos
con requerimientos frecuentes de
sangrías o que presentan síntomas
por la PV, como prurito resistente
al tratamiento sintomático, síntomas constitucionales o por la
esplenomegalia. El tratamiento de
la PV debe, pues, individualizarse
según la edad de los pacientes y
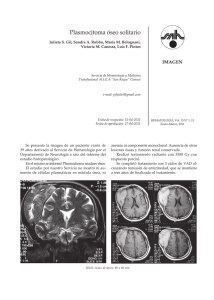
sus manifestaciones clínicas actuales o previas. La figura muestra
un algoritmo terapéutico de la
PV basado en estas premisas. En
todos los casos es obligado un
control estricto de los factores
de riesgo vascular, tales como la
hipertensión arterial, la diabetes, la hipercolesterolemia y el
tabaquismo. En la actualidad se
están ensayando nuevos fármacos
para la PV en pacientes con alto
riesgo de trombosis y resistencia
o intolerancia a la hidroxiurea. El
interferón pegilado se ha mostrado
eficaz en la obtención de respuestas hematológicas y es capaz de
conseguir respuestas moleculares.
Otros fármacos actualmente en
fase de ensayo son los inhibidores
de JAK2. Así, ruxolitinib obtuvo
un 59% de respuestas completas
y un 38% de respuestas parciales
en un estudio que incluyó 34 pacientes resistentes o intolerantes
a la hidroxiurea. Aunque se trata
de resultados preliminares, estos
datos sugieren que ruxolitinib
podría ser una buena opción de
segunda línea para la PV.
S11
Volumen 15, Suplemento 1, 2014
Revista de Hematología
Referencias
Spivak JL. Polycythemia vera: myths,
mechanisms, and management.
Blood 2002; 100: 4272-90
Landolfi R, Marchioli R, Kutti J, et al. Efficacy and safety of low-dose aspirin
in polycythemia vera. N Engl J Med
2004; 350: 114-124.
Barbui T, Barosi G, Birgegard G, et al.
Philadelphia–negative classical myeloproliferative neoplasms: Critical
concepts and management recommendations from European LeukemiaNet. J Clin Oncol 2011; 29:761-70.
Barosi G, Mesa RA, Finazzi G, et al. Revised
response criteria for polycythemia
vera and essential thrombocythemia: a ELN and IWG-MRT consensus
project. Blood 2013, 121:4779-81.
Marchioli R, Finazzi G, Specchia G, et al.
Cardiovascular events and intensity
of treatment in polycythemia vera. N
Engl J Med 2013; 368:22-33.
Kiladjian JJ, Cassinat B, Chevret S, et
al. Pegylated interferon-alfa-2a
induces complete hematologic and
molecular responses with low toxicity in polycythemia vera. Blood
2008;112:3065-72.
Verstovsek S, Passamonti F, Rambaldi A, et al.
Long-term efficacy and safety results
from a phase II study of ruxolitinib in
patients with polycythemia vera. ASH
Annual Meeting 2012; 120: 804.
LABORATORY CONTROL OF
NEW ANTICOAGULANTS
Jacqueline Conard1,2, Meyer-Michel
Samama1,3
1
Biological Hematology, Hotel-Dieu
hospital, Rene-Descartes University,
Paris
2
Department of Vascular Medicine,
Saint Joseph hospital, Paris
3
Biomnis Clinical Research Laboratory, Ivry
New oral anticoagulants (NOACs)
are direct anticoagulants which
specifically inhibit Thrombin (FIIa)
(dabigatran) or Factor Xa (FXa) (rivaroxaban, apixaban, edoxaban).1
Some other anti-Xa drugs are coming soon, such as betrixaban.2
These agents have been administered for prevention of venous
S12
thrombosis in orthopedic surgery (hip and knee replacement),
for prevention in medicine, for
treatment of deep vein thrombosis
(DVT) or pulmonary embolism
(PE) and for prevention of stroke in
non-valvular atrial fibrillation (AF).
They have been shown to have a
favourable benefit-risk ratio since
they were at least as efficacious
as classical anticoagulants with
less intra-cranial bleeding and
low propensity for food and drug
interactions than vitamin K antagonists.1 However, since they induce
hypocoagulability,bleeding cannot
be excluded. Increased risk of gastro-intestinal risk has been observed
and uncontrollable bleedings and
deaths have been reported.3
Thousands of patients have been
included in the different clinical
trials and no biological monitoring
was required, that was considered
as an advantage. However, in the
‘real life’, it is clear that some laboratory control might be useful in
some clinical situations: in case of
bleeding, recurrent stroke, before
an invasive procedure or emergency
surgery or to verify compliance. In
addition, a control of coagulation
performed from time to time might
be questioned to improve the benefit-risk ratio of long-term treatments
with these agents.
IMPACT OF NOACs ON COAGULATION TESTS. Direct FIIa or
FXa inhibitors influence routine
coagulation tests such as Prothrombin time (PT) and Activated Partial
Thromboplastin Time (APTT) and
specific tests have been developed.
Available data have been obtained
in normal plasmas spiked with
increasing concentrations of the
different agents or from plasmas of
volunteers who received the agents
or of treated patients.
A recommendation concerning
coagulation assays that can be used
in patients with NOACs has been
delivered by the Subcommittee
on Control of Anticoagulation of
the Scientific and Standardisation
Committee of the International
Society on Thrombosis and Haemostasis.4
Impact of the different NOAC
on common coagulation tests is
summarized in Tables 1 and 2.
1. Dabigatran etexilate
Dabigatran is mainly excreted
by the kidney (80%). In patients
with a normal renal function, peak
levels are observed after 2 to 3 hours
and the half-life is 12-14 hours. Potential drug interactions exist with
P-gp inhibitors and inducers. In patients with abnormal renal function,
the half-life is longer and may be
responsible for accumulation of
the drug and bleeding, especially
in elderly. Thus, the dose of dabigatran is decreased when patients
are older than 75 and when there
is a moderate renal insufficiency.
When dabigatran is prescribed for
long periods, a deterioration of a
moderately abnormal to a severe
renal function may lead to accumulation and potential bleeding.
It is not prescribed when Cockroft
Creatinine clearance is less than
30 ml/min.
1.1 Global tests
Prolongation of PT is dosedependent but it depends on the
thromboplastin reagent used for the
test.5,6,7 However, INR (International
Normalized Ratio) calculated for
VKA is not suitable and should not
be used because the mechanism
of action of direct anticoagulants
is different: it does not induce a
decrease in vitamin-K dependent
factors but a direct inhibition of a
specific factor.
APTT is more prolonged with
dabigatran than with other NOACs.
All factors of the extrinsic (II, V,
VII, X) and of the intrinsic coagulation pathway (VIII, IX, XI, XII) are
influenced by dabigatran.
Tests based on thrombin clottability are prolonged with dabigatran:
Libro Educativo 55 Congreso Nacional de la Agrupación Mexicana para el Estudio de la Hematología, A.C.
Table I. Potential influence of NACOs on routine coagulation tests.
TEST
DABIGATRAN
Anti-IIa
RIVAROXABAN
Anti-Xa
APIXABAN
Anti-Xa
PT prolongation
+
INR
not applicable
APTT prolongation
++
Thrombin time
+
Ecarin time
+
Fibrinogen clotting time
+
Coagulation factors
FII, V, VII, X
+
FVIII, IX, XI, XII
++
++
not applicable
+
0
0
0
±
not applicable
±
0
0
0
+
++
+
++
Table 2. Potential influence of NACOs on coagulation tests performed for thrombophilia screening.
Thrombophilia
Assay
Antithrombin activity
Protein C activity
Protein S activity
Lupus anticoagulant
DRVVT
APC resistance
Amidolytic + FIIa
Amidolytic + FXa
Clotting
Amidolytic
Clotting
Clotting
Clotting
Clotting
thrombin time, fibrinogen by chronometric method, anti-IIa assay
used for heparins. In addition, tests
based on thrombin inhibition for the
screening for thrombophilia are influenced too. Antithrombin activity
by amidolytic assay when performed in the presence of thrombin
results in an overestimation of the
AT level while assay based on FXa
inhinition is not influenced. Protein
C and protein S activity assays using
clotting methods as well as APC
resistance test cannot be used in
patients treated by dabigatran. In
contrast, PC amidolytic ssays for
PC and genetic assays for FV Leiden
and FII G20120A are appropriate.
A normal result of PT or APTT
at trough means the absence of an
overdose for dabigatran.
1.2 Specific tests
Thrombin time is very sensitive
to dabigatran but too sensitive to
measure plasma levels in treated
Dabigatran
IIa inhibitor
Rivaroxaban
Xa inhibitor
↑
No influence
No influence
↑
↑ ↑
No influence
No influence
↑ ↑
↑ ↑
↑ ↑
↑ ↑
partients. APTT is not sensitive
enough. Ecarin clotting time and a
modified clotting time, Hemoclot
TT, were found to be good candidates for this purpose.6,8 Results should
be expressed in ng/mL. Concentrations of dabigatran at Cmax depend
on indication and dose administered; they were 105±85 ng/ml after
orthopedic surgery.5
Values of coagulation tests associated with an increased bleeding
risk during dabigatran treatment for
atrial fibrillation have been proposed at trough: Hemoclot > 60 sec
(normal 28-34 sec), APTT > 80 seconds (baseline x by 2 to 3), ecarin
clotting time: baseline x by 3 to 4.9
Hemoclot is the best choice as
demonstrated by the positive correlation with dabigatran 220 mg/day
administered to normal volunteers.6
In addition, APTT and Hemoclot
have been compared to Liquid
chromatography- tandem mas (LC-
MS/MS) spectrometry in patients
treated with dabigatran.10 A good
correlation was found between
LC-MS/MS and Hemoclot and this
latter test has been recommended
for concentrations of dabigatran >
50 ng/ml. For lower concentrations,
LC-MS/MS was preferred.
2. Factor Xa inhibitors : rivaroxaban, apixaban.
Rivaroxaban and apixaban are
associated with lower renal excretion than dabigatran (respectively
67 and 25% vs 80%) and half-lives
are slighly shorter (7-13 and 8-13
hours). Potential drug interactions
have been observed with CYP 3A4
and P-gp inhibitors and inducers.
2.1 Global tests
PT is prolonged and results vary
with the thromboplastin used.11-14
INR (International Normalized
Ratio) calculated for VKA is not
suitable and should not be used. A
modification of the INR adapted for
rivaroxaban has been proposed but
is not validated.15
APTT is more prolonged with
rivaroxaban and the response is
curvilinear meaning a steep increase
at low concentrations followed by a
plateau at concentrations higher than
400 mg/ml. In contrast, PT and APTT
are not sensitive enough to detect
apixaban in spiked plasmas.16Thus,
a normal APTT at trough in a patient
treated with apixaban cannot exclude an overdosage.
Screening for thrombophilia
should also take into consideration
the drug administered and the type
of the assay.17(Table 1 and 2).
Routine Anti-Xa assay used for
Low Molecular Weight Heparins is
calibrated with LMWH and should
not be used as such, for evaluation
of direct oral FXa inhibitors.
Thrombin generation has been
performed after in vitro addition of
different amounts of rivaroxaban.18
Results were dose-dependent but
the method used is not avalable in
any laboratory.
S13
Volumen 15, Suplemento 1, 2014
Revista de Hematología
2.2 Specific tests
A new modified anti-Xa amidolytic activity assay has been
developed using plasma calibrators
with known amounts of rivaroxaban
or apixaban.16-19 Results at Cmax
(2 to 3 hours) and trough (before
a new intake) may be able to detect a drug accumulation and the
responsiveness of the patient to
the treatment. They vary with the
different doses administered in the
different indications.
Liquid chromatography- tandem
mas (LC-MS/MS) spectrometry
has also been used to measure
rivaroxaban in plasma from treated patients.20 A linear correlation
was observed between this test
and the amidolytic anti-Xa assay
from Biophen.PT performed using
Innovin did not correlate well with
the LC-MS/MS method. The authors
recommend use of the amidolytic
assay for concentrations > 30 ng/
ml and LC-MS/MS for low concentrations (< 30 ng/ml.
WHAT IS THE RELEVANCE OF
A BIOLOGICAL CONTROL DURING NOACs
Pharmacokinetic and pharmacodynamic studies have suggested
reliable predictive responses to
NOACs.13,21,22 Thus, they are administered at fixed dose. However,
biological tests show inter-individual variability. Important variations
of dabigatran plasma concentrations have been observed after
orthopedic surgery when measured
at 4, 8, 12, 16 and 24 hours. In
addition, half-life of these NOACs
is short (7 to 14 hours), with a peak
activity after 2 to 4 hours after ingestion. Thus, the time of the assay
is very dependent on the time the
agent is administered.23
The detection of an overdose
may predict a severe bleeding. It
can result from an excessive dose
depending on the age and low
weight of the patient (more than
75, below 60 kg) or an abnormal
S14
or deteriorating renal function since
these agents have a renal excretion.
To evaluate the usefulness of a
biological control, different questions have to be answered: what are
the expected values in a treatment
with a favourable benefit-risk ratio?
What are the values showing an
excess of the drug and an increased
risk of bleeding? What should be the
resulting strategy: change the dose,
change the anticoagulant?
Expected values in the different
indications in patients treated with
dabigatran, rivaroxaban, apixaban
have been determined.21, 22
Values in some patients with
severe bleedings have been published.3
A recent study has shown that
control of coagulation may be
useful in some patients. In the
RELY-study where 2 doses of dabigatran etexilate were compared
to warfarin in patients with nonvalvular atrial fibrilation, the higher
dose was associated with a greater
reduction of stroke (39%) at the
cost of an increase risk in major
bleeding (16%).24 In a sub-study,
the concentration of dabigatran
has been measured by a validated
high performance liquid chromatography tandem mass spectrometry
method and compared with the risk
of stroke and the risk of bleeding.25
Dose-response relationships for
stroke prevention and bleeding
were observed. A more than 5-fold
variation of plasma concentrations
were observed, indicating a wide
therapeutic range. The risk of stroke
was inversely correlated to trough
concentrations of dabigatran (collected 10 to 16 hours after the
previous dabigatran dose) and the
bleeding risk was increased. Renal
function was the predominant characteristic that determined plasma
concentration. The conclusion of
the authors is that a subset of AF
patients with age > 75 and/or with
poor renal function an individual
adjustement of dabigatran dose
might improve benefit risk balance. Thus, it is the first time that a
biological control is recognized as
a useful tool for tailoring the dose
in some patients.
Next step should be the comparison of stroke or bleeding events in
patients with or without any control
and the therapeutic strategy when
results of NOACs concentrations are
not in the expected range.
CONCLUSION. Impact of
NOACs on blood coagulation is
now well known. Routine tests
such as PT or APTT are more or
less influenced by NOACs. These
tests are available in all laboratories
at any time day or night but there
interest is limited for dabigatran
or rivaroxaban and they can be
misleading with apixaban since
high levels of this latter agent may
be associated with normal results.
Specific coagulation tests for anti-IIa
and anti-Xa direct anticoagulants
are now available and will probably
soon be available in many laboratories. In addition, in the future,
drug levels could also be measured
directly by noncoagulation tests
such as high-performance liquid
chromatography-tandem mass
spectrometry.
So, specific tests are available
and expected values at trough or
at Cmax have been determined in
different indications for the different
drugs. It might be anticipated that a
biological control at trough once in
a while ( every 3 month for instance)
could be useful to detect an excess
concentration of the drug It could be
associated with the Cockroft creatinine clearance to check the renal
function, and maybe determination
of hemoglobin to detect a gastrintestinal silent bleeding.
The selection of the most appropriate clotting assays will be based
on the drug used and the availability
of the tests. The clinical relevance of
these tests is still not well clarified
Libro Educativo 55 Congreso Nacional de la Agrupación Mexicana para el Estudio de la Hematología, A.C.
and no guidelines for adjustment of
the treatment are available. Thus, at
present, the general use of a biological control is refrained because the
strategy to be followed if a result is
above or below the expected values
is unknown: dose change or drug
change.
References
1.
2.
3.
4.
5.
6.
7.
Chan NC, Paikin JS, Hirsh J, Lauw MN,
Ginsberg JS. New oral anticoagulants
for stroke prevention in atrial fibrillation : impact of study design, double
counting and unexpected findings
on interpretation of study results
and conclusions. Thromb Haemost
2014, 111: prepublished on line :
February 20.
Chan NC, Hirsh J, Ginsberg JS, Eikelboom JW. Betrixaban (PRT054021) :
pharmacology, dose selection and
clinical studies. Future Cardiol 2014;
10: 43-52.
Samama MM, Conard J, Lillo-LeLouët A. Hemorrhagic accidents of
the new oral anticoagulants and
coagulation assays. J Mal Vasc 2013;
38: 259-270.
Baglin T, Hillarp A, Tripodi A, Elalamy
I, Buller H, Ageno W. Measuring oral
direct inhibitors 5ODIs) of thrombin
and factor Xa : a recommendation
from the Subcommittee on Control
of Anticoagulation of the Scientific
Subcommittee of the International
Society on Thrombosis and Haemostasis. J Thromb Haemost 2013 Jan 24.
Doi : 10.111/jth.12149. [Epub ahead
of print].
Freyburger G, Macouillard G, Lebrouche S, Sztark F. Coagulation
parameters in patients receiving
dabigatran etexilate or rivaroxaban: two observational studies in
patients undergoing total hip or
total knee replacement. Thromb Res
2011;127:457-65.
van Ryn J, Stangier J, Haertter S,
Liesenfeld KH, Wienen W, Feuring
M, Clemens A. Dabigatran etexilate-a novel, reversible, oral direct
thrombin inhibitor: interpretation
of coagulation assays and reversal
of anticoagulant activity. Thromb
Haemost, 2010; 103: 1116-27.
Lindahl, TL, Baghaei F, Blixter IF,
Gustafsson KM, Stigendal L, Sten-
8.
9.
10.
11.
12.
13.
14.
15.
Linder M et al. Effects of the oral,
direct thrombin inhibitor dabigatran
on five common coagulation assays.
Thromb. Haemost, 2011; 105: 371-8.
Stangier J, Feuring M. Using the HEMOCLOT direct thrombin inhibitor
assay to determine plasma concentrations of dabigatran. Blood Coagul
Fibrinolysis 2012; 23: 138-43.
Huisman MV, Lip GY, Diener HC,
Brueckmann M, van Ryn J, Clemens
A. Dabigatran etexilate for stroke
prevention in patients with atrial
fibrillation: resolving uncertainties
in routine practice. Thromb Haemost
2012; 107: 838-47.
Douxfils J, Dogné JM, Mullier F, Chatelain B, Rönquist-Nii Y, Malmström
RE, Hjemdahl P. Comparison of
calibrated dilute thrombin time and
aPTT tests with LC-MS-MS for the
therapeutic monitoring of patients
treated with dabigatran etexilate.
Thromb Haemost 2013; 110: 543-9.
Samama MM, Martinoli JL, LeFlem L,
Guinet C, Plu-Bureau G, Depasse F et
al. Assessment of laboratory assays
to measure rivaroxaban--an oral,
direct factor Xa inhibitor. Thromb.
Haemost. 2010; 103: 815-25.
Hillarp A, Baghaei F, Fagerberg Blixter
I, Gustafsson KM, Stigendal L, StenLinder M et al. Effects of the oral,
direct factor Xa inhibitor rivaroxaban
on commonly used coagulation
assays. J Thromb Haesmost 2011;9:
133-9.
Mueck W, Schwers S, Stampfuss J.
Rivaroxaban and other novel oral
anticoagulants : pharmacokinetics
in healthy subjects, specific patient
populations and relevance of coagulation monitoring. Thrombosis J
2013; 11: 10-17.
Samama MM, Contant G, Spiro TE,
Perzborn E, LeFlem L, Guinet C, et al.
Evaluation of the prothrombin time
for measuring rivaroxaban plasma
concentrations using calibrators and
controls: the results of a multicenter
field trial. Clin Appl Thromb Hemost
2012;18:150-8
Tripodi A, Chantarangkul V, Guinet
C, Samama MM. The International
Normalized ratio calibrated for
rivaroxaban has the potential to
normalize prothrombin time results
for rivaroxaban-treated patients :
16.
17.
18.
19.
20.
21.
22.
results of an in vitro study. J Thromb
Haemaost 2011; 9: 226-8.
Gouin-Thibault I, Flaujac C, Delavenne X, Quenet S, Horellou S, Laporte S
et al. Assessment of apixaban plasma
levels by laboratory tests: suitability
of three anti-Xa assays. A multicentre
French GEHT study. Thromb Haemost
2014; 111: 240-48.
Douxfils J, Mullier F, Loosen C, Chatelain C, Chatelain B, Dogné JM. Assessment of the impact of rivaroxaban
on coagulation assays: Laboratory
recommendations for the monitoring
of rivaroxaban and review of the literature. Thromb Res 2012; 6: 956-66.
Gerotziafas GT, Elalamy I, Depasse
F, Perzborn E, Samama MM. In vitro
inhibition of thrombin generation, after tissue factor pathway activation,
by the oral,direct factor Xa inhibitor
rivaroxaban. J Thromb Haemostas
2007; 5: 886-8
Samama MM, Contant G, Spiro TE,
Perzborn E, Guinet C, Gourmelin
Y, et al. Rivaroxaban anti-factor Xa
chromogenic assay field trial laboratories. Evaluation of the anti Xa chromogenic assay for the measurement
of rivaroxaban plasma concentrations using calibrators and controls.
Thromb Haemost 2012;107:379-87.
Douxfils J, Tamigniau A, Chatelain B,
Chatelain C, Wallemacq P, Dogné JM,
Mullier F. Comparison of Calibrated
chromogenic anti-Xa assay and PT
tests with LC-MS/MS for the therapeutic monitoring of patients treated
with rivaroxaban. Thromb Haemost
2013; 110: 723-31.
Mueck W, Borris LC, Dahl OE, Haas
S, Huisman MV, Kakkar AK et al.
Population pharmacokinetics and
pharmacodynamics of once- and
twice-daily rivaroxaban for the
prevention of venous thromboembolism in patients undergoing total
hip replacement. Thromb Haemost
2008;100:453-61.
Mueck W, Lensing AW, Agnelli G,
Decousus H, Prandoni P, Misselwitz
F. Rivaroxaban: population pharmacokinetic analyses in patients treated
for acute deep-vein thrombosis and
exposure simulations in patients with
atrial fibrillation treated for stroke
prevention. Clin Pharmacokinet
2011;50:675-86.
S15
Volumen 15, Suplemento 1, 2014
Revista de Hematología
23. Heibuchel H, Verhamma P, Alings
M, Antz M, Hacke W, Oldgren J et al.
EHRA Practical Guide on the use of
new oral anticoagulants in patients
with non-valvular atrial fibrillation:
executive summary. Europ Heart J
2013; 34: 2094-2106.
24. Connolly SJ, Ezekowitz MD, Yusuf S,
et al. Dabigatran versus warfarin in
patients with atrial fibrillation. N Engl
J Med. 2009; 361: 1139-51.
25. Reilly PA, Lehr T, Haertter S, Connolly SJ, Yusuf S, Eikelboom JW et
al. The effect of dabigatran plasma
concentrations and patient characteristics on the frequency of ischemic
stroke and major bleeding in atrial
fibrillation patients in the RE-LY
trial. JACC 2013 ; doi: 10.1016/j.
jacc.2013.07.104.
TRANSFUSIÓN DE PLAQUETAS:
PROFILÁCTICA VERSUS TERAPÉUTICA
Dra. Ana Emilia del Pozo
Médica Especialista en Hematología
Médica Especialista en Hemoterapia e Inmunohematología
Asesora del Centro Regional de
Hemoterapia y Banco de Sangre de
Cordón Umbilical
De Referencia Nacional Garrahan.
Buenos Aires, Argentina
HISTORIA. El rol de las plaquetas
como causa de la hemorragia
aparece descripto en la publicación de Duke WW en la revista
JAMA, en el año 1910. Ésta, según mi búsqueda, resultó ser la
primera comunicación escrita
que establece esa relación; en ella
también se describe el método
para evaluar el tiempo de sangría
y el de coagulación.1 Realizando,
en el mismo estudio, el conteo de
plaquetas con el método de Wright
and Kinnicutt: Tr assn. Am Phys,
May, 1910. Para ese método el
recuento normal de plaquetas era
de 225.000 a 325.000 plaquetas
por cm3; lo cual muestra lo cercano a la precisión de ese antigua
método.
S16
Sin embargo, es importante
tener en cuenta que a la sazón
no existían los bancos de sangre
y las plaquetas transfundidas eran
las que formaban parte de la sangre
entera; la transfusión de plaquetas
solo fue posible como tal, cuando
se introdujeron la bolsas de plástico
para colección y almacenamiento
de sangre las que permitieron la
preparación de los diferentes componentes de la sangre. Esto sucedió
en el año 1950 y sus creadores fueron Carl Walter y WP Murphy, Jr.2
Cuando estas bolsas se diseñaron como múltiples, hicieron
posible preparar los componentes
en circuito cerrado. En 1953 el
desarrollo de las centrífugas refrigeradas produce un notable avance
en la calidad de lo concentrados
de plaquetas. De allí en más todos
ustedes conocen la evolución que
nos llevó a la situación actual en
que las plaquetas se producen con
diferentes métodos, a saber: a partir
de plasma rico en plaquetas, por
aféresis de donantes únicos, y de
Buffy coat (manual o automatizado)
Todos ellos brindan excelentes productos si se realizan bajo programas
de garantía de la calidad.
Esta brevísima reseña tiene
la intención de hacer notar que,
así como la transfusión de sangre
tiene ya cien años de historia de
demostrada su eficacia para mejorar el transporte de oxígeno, la de
plaquetas se remonta a la década
de 1950. Si bien esa descripción
de Duke en 1910 señaló la relación
entre trombocitopenia y sangrado,
mostrando que los pacientes con
trombocitopenia cesaban su hemorragia al recibir transfusiones,
el primer estudio controlado fue
el que realizaron Gaydos LA y
colaboradores en 1962 –cincuenta
años mas tarde– sobre la relación
entre el número de plaquetas y el
sangrado en pacientes con Leucemia; en este estudio de cohorte, los
pacientes fueron seguidos desde su
diagnóstico de Leucemia Mieloide
o Linfoide Aguda hasta su muerte;
los autores encontraron que la hemorragia se asociaba a un recuento
de plaquetas menor de 20.000/µL y
concluyeron que cuando menor era
el número de plaquetas mayor era
la frecuencia del sangrado.3
Fue relevante también la
comunicación de Hersh y colaboradores en su publicación enm
1965, en la que analizan retrospectivamente las causas de muerte
en Leucemia Aguda4 Los estudios
mencionados y algunos subsiguientes no tuvieron en cuenta el efecto
de la aspirina sobre las plaquetas,
resultado que quedó establecido
luego de los trabajos de John R.
Vane de 1971 sobre la función de
las prostaciclinas y la interrupción
de la producción de prostaglandinas y tromboxanos mediante el
ácido acetil salicílico.5 Algo que ya
había sido advertido por AJ. Quick
en una publicación previa, aunque
no fue tenido en cuenta.6
ANTECEDENTES Y EVOLUCIÓN DE LA TERAPÉUTICA. Dos
estudios fueron clave en el
inicio del concepto de transfusión profiláctica de plaquetas,
en 1974 Highby respaldó el
uso de tratamiento profiláctico
para prevenir la hemorragia, 7 y
en 1979 Murphy y colaboradores
publicaron un estudio aleatorizado
en el que dividieron a la población
de pacientes con leucemia en dos
ramas, en una de ellas se transfundía a los pacientes cuando tenían
hemorragias y en la otra cuando
el recuento plaquetario era menor
de < 20.000/µL. El incremento de
plaquetas en los pacientes del
grupo profiláctico fue significativamente mejor (p < 0.00001);
sin embargo la mortalidad fue igual
en ambos grupos. Finalmente los
autores concluyen que los datos
obtenidos no les permitieron sacar
conclusiones acerca de los diferentes abordajes.
Libro Educativo 55 Congreso Nacional de la Agrupación Mexicana para el Estudio de la Hematología, A.C.
Todos los estudios reportados
hasta ese momento tuvieron factores de confusión como la fiebre, el
tipo de sangrado, el uso de antibióticos u otras drogas cuya inclusión
es indispensable para sacar conclusiones en estos pacientes.
Si bien no se contaba con evidencia para establecer un umbral
de tratamiento profiláctico con
transfusión de plaquetas, estuvo
muy difundido hasta avanzada la
década de 1990 que un conteo de
20.000/µL, debía ser el disparador
de una solicitud de transfusión.
Cuando ya se conocía que
la aspirina inactivaba la función
plaquetaria, y por lo tanto no se
utilizaba en pacientes con plaquetopenia, Slichter y Harker
pudieron mostrar, midiendo la pérdida de sangre por materias fecales
en pacientes con diferentes conteos
plaquetarios que el umbral de sangrado en pacientes estables estaba
en 5.000/µL y no en 20.000/µL.8
Un trabajo esencial para los que
prescriben transfusiones es el publicado
por Gmur J y colaboradores en 1991
en pacientes con Leucemia Aguda en
el cual mostraron que los pacientes
estables con un recuento de ≥ 5000
plaquetas excepcionalmente sangraba.
Dado que una de las circunstancias en
las que el sangrado puede dar lesiones
irreversibles es el del SNC, los pacientes fueron controlados en forma muy
cercana y diariamente se les realizó
fondo de ojo.9
En 1986 los Institutos Nacionales de la Salud de EEUU (NIH)
convocaron a una Conferencia de
Consenso sobre el uso terapéutico
de plaquetas a las que asistieron
los mas destacados investigadores
del campo. Allí se discutieron con
mucha crudeza los aspectos relacionados con el uso inapropiado
de este componente y se expusieron
las reacciones adversas que estas
pueden provocar en los pacientes.
Los resultados del consenso fueron
publicados en 1987 en JAMA10
En la sección Perspectiva de
la revista Blood11 Ernest Beutler
analiza el tema de la transfusión
de plaquetas, la validez de los
umbrales establecidos y las dificultades que había que enfrentar para
romper con paradigmas establecidos por notables hematólogos.
Toma las publicaciones de Gmur y
Slichter como puntos de partida de
la evidencia disponible hasta ese
momento y hace una fuerte crítica
a las interpretaciones erróneas del
trabajo de Gaydos.
Desde 1993 hasta el presente
han aparecido numerosos estudios
controlados sobre la utilización
de plaquetas, su uso profiláctico
versus terapéutico, en diferentes
condiciones clínicas en pacientes
hematológicos y no hematológicos.
En 1997, Heckman y colaboradores presentaron los estudios
de un trabajo aleatorizado en el
que compararon los efectos de los
efectos del uso de transfusión de
plaquetas con umbrales de 10.000/
µL Vs 20000/µL, encontrando solo
pequeñas diferencias entre los dos
grupos no estadísticamente significativas. En ninguno de los grupos
hubo muertes por hemorragia.12
Las evidencias obtenidas hasta
ese momento fueron suficientes para
establecer un umbral de ≥ 10.000/µL
para indicar tratamiento profiláctico.
DISCUSIÓN Y LAS PREGUNTAS ACTUALES. Si bien es muy
importante el avance en el conocimiento acerca del uso de las
plaquetas para tratar a los pacientes
con sangrado por trombocitopenia
producida por quimioterapia o por
enfermedades hematológicas u oncológicas, las preguntas críticas son
aún respondidas de diferente forma
y con diversas aproximaciones:
1. Es necesario o no establecer
políticas de transfusiones profilácticas para evitar el sangrado?
2. Cual es la dosis óptima de
plaquetas para prevenir el sangrado?
3. Cuál es el recuento de plaquetas óptimo para realizar
la profilaxis en las diferentes
situaciones clínicas?
Recientemente se han publicado
los resultados de estudios multicéntricos aleatorizados y controlados,
en pacientes adultos y pediátricos,
que otorgaron mayor evidencia clínica y, sin embargo la controversia
aún continúa en lo que hace a cual
sería la mejor dosis, a la utilización
de soluciones aditivas, al tipo de
producto, entre otros aspectos aun
no resueltos.
Las transfusiones de plaquetas
pueden ser prescriptas en forma
profiláctica, con la intención de
reducir el riesgo de hemorragia en
ausencia de sangrado, o bien para
tratar el sangrado activo. Algunos
autores opinan que las transfusiones profilácticas son innecesarias
pero nadie puede oponerse a una
transfusión en presencia de hemorragia, aunque es indispensable
que se establezca qué es sangrado
activo o hemorragia activa, y qué
rol juegan en ese síntoma el número
de plaquetas; así como cuál podría
ser la eficacia de la transfusión para
corregirlo. Algunos autores opinan
que la indicación debería restringirse a pacientes con hemorragias
activas, teniendo en cuenta el grado
2 de la escala de sangrado de la
OMS (WHO bleeding scale).
Uno de los estudios desarrollados es uno de los que se encuadró
dentro del Biomedicalfo Safer
Transfusion Collaborative BEST
13 para evaluar la utilización de
diferentes dosis de plaquetas en
pacientes hemato-­oncológicos; otro
de los estudios se hizo para recabar
información de 126 centros de 14
países acerca del uso de plaquetas
ABO incompatibles y la presencia
en esos concentrados de aglutininas anti A y anti B14; hallazgos
recientes mostraron la asociación
entre la incompatibilidad ABO
mayor o menor y el acortamiento
S17
Volumen 15, Suplemento 1, 2014
Revista de Hematología
de los intervalos transfusionales.15
Sin embargo se insiste en la falta
de evidencia de un mejor resultado al utilizar componentes ABO
compatibles.
El estudio PLADO (Prophylactic
PLAtelet DOse Study) publicó sus
resultados en Blood en 201216 Los
pacientes hematológicos y oncológicos, y/o sometidos a trasplante
de CPH fueron tratados con 3 diferentes dosis de terapia profiláctica
utilizando un umbral de 10.000//
µL. Los resultados mostraron que
si bien se mostraron tendencias
no hubo diferencias significativas
en los resultados basadas en las
características de los productos y
las dosis empleadas. Sin embargo se insiste en la necesidad de
continuar la investigación en este
sentido. Como parte de los datos
del estudio PLADO, fue publicado
un trabajo en el que se mostró que
los riesgos de sangrado en niños,
sometidos a tratamientos que inducen trombocitopenia, fue mayor
que en adultos, sin embargo los autores concluyen que es probable
que ese sangrado se debiera a
otras causas diferentes del conteo
plaquetario.17
Otro estudio, llamado TOPPS
(Trial of Prophylactic Platelets Study)
realizado en el RU y Australia, liderado por Simon J Stanworth, evaluó
si las transfusiones terapéuticas
eran tan efectivas y seguras como
las profilácticas, utilizando para la
medida del sangrado, el grado 2 o
mayor de la escala de medición
de hemorragia de la OMS, la cual
es universalmente reconocida para
esa medida. Los resultados fueron
muy recientemente publicados en
el NEJM18.
Los autores concluyen que habría respaldo para continuar con el
uso profiláctico de plaquetas para
la prevención del sangrado. Sin
embargo un significativo número de
sujetos del estudio presentan hemorragia a pesar de la profilaxis, acerca
S18
de lo cual los autores estiman que
son necesarios estudios dedicados
a su análisis.
Es clara entonces la indicación de productos plaquetarios
en el tratamiento de los procesos
hemorrágicos asociados a plaquetopenias, la discusión que persiste
es acerca de: la utilización de la
terapéutica con concentrados de
plaquetas como medida profiláctica para evitar el sangrado, las
características que debe tener el
componente, así como las dosis
necesarias o la mejor dosis eficaz
con ese propósito.
La indicación de plaquetas debido a consumo solo es apropiada
cuando el sangrado es muy importante, y la indicación en la PTI solo
es adecuada cuando la hemorragia
está localizada en el SNC, sangrado
ocular o del aparato digestivo.
Existen guías clínicas para el uso
de plaquetas basadas en la evidencia
clínica disponible19 20 para solo dar
algunas citas; sin embargo, como
ya vimos, lo cierto es que no se
tiene aún de toda la evidencia
necesaria para establecer, definitivamente, umbrales o criterios para
cada tipo de patología en diferentes
pacientes. Para ello siempre deberá
primar la visión clínica del médico
que prescribe el producto ya que no
se debe transfundir para modificar
un número de plaquetas, sino la
condición clínica de un paciente,
la que está rodeada de numerosas
variables como las particularidades
de la enfermedad de base (Ej.: tipo
de leucemia), la actividad pro-­
coagulante en algunas leucemias,
la hipercelularidad, el tipo de drogas
que se utilizan en su tratamiento
(l-­asparaginasa) el tipo de sangrado,
la temperatura corporal, la presencia
de infecciones concomitantes, el
nivel de hemoglobina, el antibiótico
u otros medicamentes utilizados, la
edad del paciente, entre otros.
En el Hospital de Pediatría Prof.
Dr. JP Garrahan, se utilizan desde
1997 los umbrales de profilaxis de
10.000/µL para pacientes estables
y, desde 2007 se tiene una tabla
basada en evidencia clínica (Guías
Nacionales para el Uso Apropiado
de la Sangre y sus Componentes) en
la que se establecen umbrales para
diferentes situaciones en caso de
procedimientos invasivos (Punción
Lumbar, tipo de cirugía, entre otros),
que en el año 2011 fueron publicadas en la pagina de Internet
dentro de las Guías de Atención
Pediátrica (GAP) del hospital,
aprobadas por el comité de transfusiones del hospital21. En ningún
caso se comunicó deceso de pacientes por hemorragia debido a las
políticas establecidas, ya que en los
casos hematológicos con complicaciones, ya sea por trasplante de
CPH, por infecciones refractarias,
por refractariedad de plaquetas
asociada a drogas o inmunológica,
se estableció un tratamiento basado
en la clínica.
Por otra parte los componentes
plaquetarios tienen particularidades
que exigen un estricto programa de
calidad para la preparación de los
concentrados de plaquetas, desde
la captación del donante, hasta la
conservación y la preparación del
componente; es por ello que todo
estudio que se realice para estimar
eficacia en el incremento del número de plaquetas circulantes o
en la efectividad del control de la
hemorragia, la fuente del producto
también debe considerarse una
variable fundamental.
No pueden soslayarse los
aspectos relacionados con la disponibilidad del componente y
los problemas en ese sentido vinculados con el corto tiempo de
almacenamiento que toleran las
plaquetas. Slichter y colaboradores
acaban de publicar en Blood un
excelente trabajo de investigación
acerca de la potencialidad y viabilidad de las plaquetas obtenidas por
diferentes sistemas de aféresis.22
Libro Educativo 55 Congreso Nacional de la Agrupación Mexicana para el Estudio de la Hematología, A.C.
En los resultados se confirman
hallazgos previos que establecen
que la heterogeneidad y sobrevida
de las plaquetas 23 , la reproducibilidad de la recuperación en fresco y
la sobrevida en el mismo sujeto. 24
El estudio muestra que es probable que haya diferencias en
la sobrevida y viabilidad de los
productos dependiendo del tipo
de procesamiento que utilizan las
diferentes máquinas de aféresis,
en especial al procedimiento de
elutriación que utilizan algunas de
ellas, así como en el tipo de bolsas
de colecta que emplean.
Finalmente si la duración en el
banco de los productos plaquetarios
pudiera alargarse, la disponibilidad
aumentaría, sin embargo persiste el riesgo transfusional de
infecciones y otros problemas consecuentes, como la sensibilización
a anticuerpos de las plaquetas y del
sistema HLA. Es posible que en un
futuro se obtengan productos mas
seguros con las técnicas de inactivación viral, cuya utilización no
incluye hoy todos los componentes
de la sangre.
Si bien esta tecnología está parcialmente disponible, aún no llena
todos los requisitos para resolver
los problemas que involucra un
componente seguro.
Nuevos estudios y nuevas
evidencias son necesarios para
responder todas las preguntas que
aun carecen de respuesta.
REFERENCIAS BIBLIOGRÁFICAS
1.
2. 3. Duke WW. The relation of blood platelets to hemorrhagic disease: description of a method for determining
the bleeding time and coagulation
time and report of three causes of
hemorrhagic disease relieved by
transfusion. JAMA 1910; 55:1185-­‐92
http://www.aabb.org/resources/
bct/Pages/highlights.aspx
Gaydos LA, Freireich EJ, Mantel N.
The quantitative relation between
paltelet count and hemorrhage.
NEngl J Med 1962;266:905-­‐9.
4. Hersch EM, Bodey GP, Nies BA,
Rreirich EJ. Causes of death in acute
leukemia: A ten-­year study of 414
patients from 1954-­‐1963. JAMA
1965; 193: 99-­‐103.
5. John R. Vane. Inhibition of prostaglandin synthesis as a mechanism of
action for aspirin-­‐like drugs. 1971
Nature-­‐New Biology 231 (25): pp.
232-­‐5.
6. Quick AJ: Salicylates and bleeding:
The aspirin tolerance test. Am J Med
Sci 252265, 1966.
7 . H i g h b y DJ. T h e p ro p hy l a c t i c
treatment of thrombocytopenic
leukemic patients with platelets:
A double-­‐blind study. Transfusion
1974; 14: 140-­‐6.
8. Slichter SJ, Harker LA: Thrombocytopenia: Mechanisms and management. Clin. Haematol 7:523, 1978.
9. Gmur J, Burger J, Schaz U, et al. Safety
of stringent prophylactic platelet
transfusion policy for patients with
acute leukemia. Lancet 1991; 338:
1223-­‐6.
10 . Platelet transfusion therapy. JAMA
257: 1777, 1987.
11. Beutler E. Platelet transfusion: the
20,000/microliter trigger. Blood
1993; 81:1411−1413.
12. Heckman KD, Weiner GJ, Davis CS,
Strauss RG, Jones MP, Burns CP.
Randomized study of prophylactic
platelet transfusion threshold during
induction therapy for adult acute
leukemia: 10,000/microL versus
20,000/microL. J Clin Oncol.1997
Mar;15(3):1143-­‐9.
13. Heddle NM, Cook Rj, Tinmouth A,
SToP Study Study Investigators of the
BEST Collaborative. A randomized
controlled trial comparing standard
and low-­‐dose strategies for transfusion of platelets (SToP) to patients
with thrombocytopenia. Blood 2009
Feb 12; 113(7): 1564-­‐73 .
14. Lozano M, Heddle N, Williamson LM.,
Wang G, AuBuchon JP, Dumont LJ.
Practices associated with ABO-­‐incompatible platelet transfusions: a BEST
Collaborative international survey.
15. Dunbar NM, Ornstein DL, Dumont
LJ. ABO incompatible platelets: risks
versus benefit. Curr Opin Hematol
2012 Nov; 19(6):475-­‐9.
16. Triulzi JD, Assman SF, Strauss RG, Ness
PM, Hess JR, Kaufman RM, Granger
17. 18. 19.
20 .
21.
22.
S, Slichter Sherril J. The impact of
platelet characteristics on oostransfusion platelet increment and clinical
bleeding in patients with hypoproliferative thrombocytopenia. Blood.
2012 June 7; 119(23): 5553-­‐5562.
Josephson CD. Granger S, Assmann
SF, Castillejo MI, Strauss RG, Slichter
SJ Steiner ME, Jourmeycake JM,
Thornburg CD, Bussel J, Grabowski
EF, Neufeld EJ, Savage W, Sloan SR.
Bleeding risks are higher in children
versus adults given prophylactic
platelet transfusions for treatment-­‐
induced hypoproliferative thrombocytopenia. Blood 2012 July 26:120
(4) 748-­‐760.
Simon J. Stanworth, M.D., D.Phil.,
Lise J. Estcourt, M.B., B.Chir., Gillian
Powter, B.A., Brennan C. Kahan,
M.Sc., Claire Dyer, B.N., Louise Choo,
Ph.D., Lekha Bakrania, B.Sc., Charlotte Llewelyn, Ph.D., Timothy Littlewood, M.B., B.Ch., M.D., Richard
Soutar, M.B., Ch.B., M.D., Derek
Norfolk, F.R.C.P., F.R.C.Path., Adrian
Copplestone, M.B., B.S., Neil Smith,
M.B., Ch.B., Paul Kerr, M.B., Ch.B.,
Ph.D., Gail Jones, M.D., Kavita Raj,
M.D., Ph.D., David A. Westerman,
M.B., B.S., Jeffrey Szer, M.B., B.S.,
Nicholas Jackson, M.B., B.S., M.D.,
Peter G. Bardy, M.B., B.S., Dianne
Plews, M.B., Ch.B., Simon Lyons,
M.B., Ch.B., Linley Bielby, B.N.,
M.H.A., Erica M. Wood, M.B., B.S.,
and Michael F. Murphy, M.B., B.S.,
M.D., for the TOPPS Investigators* A
No-­Prophylaxis Platelet-­Transfusion
Strategy. NEJM May 9 2013. (Vol 368
No 19)
http://www.transfusionmedicine.
ca/resources/clinical-­‐guide-­‐transfusion
http://www.aahi.org.ar/publicaciones/guias-­‐nacionales-­‐para-­‐el-­‐
uso-­‐de-­‐la-­‐sangre/guias-­‐nacionales-­‐para-­‐el-­‐uso-­‐apropiado-­‐de-­‐
la-­‐sangre-­‐y-­‐sus-­‐componentes/
Guías de Atención Pediátrica (GAP
2011) http://www.garrahan.gov.
ar/index.php/equipo-­‐de-­‐salud/
guias-­‐clinicas/151-­‐gap-­‐2011-­‐
u s o - ­‐ d e - ­‐ t ra n s f u s i o n e s - ­‐ e n - ­‐
pediatria?showall=&start=4
Sherrill J. Slichter, Jill Corson, Mary
Kay Jones, Todd Christoffel, Esther
Pellham, S. Lawrence Bailey, and
S19
Volumen 15, Suplemento 1, 2014
Revista de Hematología
Doug Bolgiano. Exploratory studies
of extended storage of apheresis platelets in a platelet additive solution
(PAS). Blood. 2014;123(2):271-­‐280.
23. Rock G, Tittley P, Adams GA. Donor variables affecting survival of
autologous platelets. Transfusion.
1986;26(1):30-36.
24. Murphy S. Radiolabeling of PLTs to
assess viability: a proposal for a standard. Transfusion. 2004;44(1):131-­
‐133.
Anemia de los procesos
crónicos
Dr. José Luis Delgado Lamas, Dr.
Raúl Delgado Chávez.
delgadojoseluis54@live.com.mx
Definición. Es la anemia que
ocurre como consecuencia o complicación, aguda o crónica de la
respuesta inmune natural y adquirida, a través del despliegue de
citoquinas sobre la homeostasis
del hierro.1,2.
La inflamación es el denominador común y se le ha llamado
también anemia de la inflamación,
de las enfermedades crónicas o anemia arregenerativa con secuestro
de hierro o anemia con disfunción
del hierro.2,3
Causas. Se observa en niños y
adultos4en padecimientos infecciosos: bacterianos, parasitarios,
micóticos, virales (VIH) o granulomatosos, en cualquier parte de
la economía, por intrascendentes
que parezcan; en las 120 enfermedades autoinmunes, como la
artritis reumatoide, la enfermedad
de Still, el Sjögren, las vasculitis
Takayasu o la arteritis temporal, la
de pequeños vasos: vascultis leucocitoclástica o el Churg-Strauss,
el Lupus Eritematoso Generalizado,
la espondilitis anquilosante, la polimialgia, la enfermedad de Crohn,
enfermedad inflamatoria intestinal,
los sindromes de activación macrofágica, la linfohistiocitosis.1,3,5 En las
neoplasias hematológicas, como el
Linfoma de Hodgkin, el Mieloma
S20
Múltiple, en tumores sólidos, en
carcinomatosis5 y en otros padecimientos donde la inflamación e
hipoxia (hipoxia<>inflamación) o
sus mecanismos son protagonistas,
como en la obesidad, el envejecimiento, la arterioesclerosis, la
insuficiencia cardiaca congestiva crónica, el alcoholismo, el
síndrome metabólico, la Diabetes, la Neumonía, la enfermedad
pulmonar obstructiva crónica, la
Insuficiencia Renal Crónica etc.6-10
Epidemiología. Ocurre hasta en
el 52 % de pacientes hospitalizados no deficientes de hierro1,3,5,7,10
en el 60 % de los pacientes con
neoplasias no hematológicas antes
de quimioterapia o radioterapia1,8
para algunos autores correlaciona
en forma inversa con la respuesta
y con la supervivencia1,26 aunque
siendo multifactorial no es posible
discernir con claridad todos los
factores. Aparece en el 30 % de
pacientes con Artritis Reumatoide
sin causales pero con marcadores de inflamación: elevación de
Proteína C Reactiva, la velocidad
de sedimentación globular o los
niveles de IL-6; 10,27 si se asocia a
pobre ingesta o sangrado crónico
se eleva al 70%.
Es la primera causa de anemia
en pacientes hospitalizados y la
segunda causa después de la deficiencia de hierro en México y en
otros países en población abierta11-13. En EUA la encuesta nacional
de salud mostró que un 1/3 de los
pacientes adultos de mas de 60
años cursan con esta variedad de
anemia, pero otro tercio como de
causa “desconocida.14 En México la
encuesta Nacional de Salud y Nutrición 2012 encontró que 7 millones
de personas entre niños, escolares,
adultos y mujeres cursaban con
anemia, sabiendo que la deficiencia
de hierro es prevalente y que por
cada sujeto deficiente hay al menos 2 con deficiencia de hierro sin
anemia, la magnitud del problema
es enorme y se asocia a que 14 de
las 32 entidades federativas tienen
al 30 y 50% de sus habitantes con
inseguridad alimentaria.12
Metabolismo del hierro. Se ha
reconocido siempre que el hierro
debe ser estrictamente regulado, se
requiere como elemento esencial
para el transporte y conservación de
oxigeno y su restricción para evitar
su estado libre y la formación de
radicales que dañen los lípidos, las
membranas, los ácidos nucleicos y
lesionen a órganos blanco hígado,
corazón, páncreas.
El balance de hierro se logra
limitando la absorción y reciclando
el hierro celular. Se requieren 20 mg
de hierro diarios para producir 2
millones de eritrocitos por segundo
y solo dispone de 1 mg al día por
absorción, por lo que el hierro se
recicla de los almacenes del reticuloendotelio de los macrófagos
del hígado, bazo, médula ósea,
peritoneo, pulmón, piel y placenta;
la transferrina dá 200 ciclos de ida
y vuelta en 8 días de su vida media,
recambiando el hierro cada 3 hs,
enfatizando que el mayor abasto
de hierro para eritropoyesis es por
esta vía.1-9
El hierro sirve en múltiples funciones metabólicas y enzimáticas
(Ciclo de Krebs, Hemoglobina,
mioglobina, citocromos, catalasas,
peroxidasas) como catalizador y
como nutriente celular y bacteriano.
El hierro inorgánico de la dieta
se absorbe del enterocito duodenal
hipóxico a pH 4, así: se reduce de
hierro férrico a ferroso por el citocromo B duodenal o DCYTB, lo
toma el transportador divalente de
metales o DMT-1(proteína de 531
aa); en dietas con carne, el hierro se
absorbe como Hem y se libera por
una oxidasa HO-1, ambos quedan
en la poza lábil de hierro, controlado por las proteínas reguladoras
IRP-1 e IRP-2, van a mitocondrias, a
ferritina o al otro lado del enterocito
a su base lateral, al DMT-1, se oxida
Libro Educativo 55 Congreso Nacional de la Agrupación Mexicana para el Estudio de la Hematología, A.C.
por la Hefaestina membranal (150
kd) o la ceruloplasmina circulante
(130 kd) para ser llevado de la proteína membranal Ferroportina (FPN,
el único exportador celular de hierro, del gen SLC40 A1, cromosoma
2q32)) al receptor-1 y 2 (TfR-1 TfR2) y luego a la transferrina diférrica.
Asi circula unido a la transferrina a
los sitios de depósito macrofágico,
capturando la transferrina por sus
receptores, a endosomas donde la
clatrina en medio ácido reduce el
hierro y va a la poza lábil de cada
compartimiento. (Figuras 1 y 2).
Fisiopatologia. Para controlar la
absorción y distribución del hierro,
existe un péptido pequeño de 84
aminoácidos unido por 4 puentes
disulfuro, producido en el hígado,
conocido como pro-hepcidina degradada por furina a hepcidina (HP)
de 25 aminoácidos 2.7 kd y determinada por el cromosoma 19 en el
gen conocido como HAMP (hepatic
Figura 1. Captura de hierro por la célula
duodenal.
Figura 2. Flujo de hierro en el Macrófago
Cuadro 1. Algoritmo diagnostico.
Anemia
Evidencia clínica de enfermedad inflamatoria, VSG, PCR, IL-6,
Hepcidina, Insuficiencia renal, Neoplasia
Saturación de transferrina <15%
Excluir otras causas de anemia
Ferritina <30ng/ml
Ferritina >30 <100
Ferritina>100
Cuantificar receptor soluble
de transferrina
sTf R/log Ferritina >1.5
Anemia deficiencia
de hierro
sTf R/log Ferritina <1
Anemia mixta def
Fe y enf crónicas
Anemia de proceso
crónico
New Engl. J. Med 2005;352:1011-1023
antimicrobial peptide); su nombre
se debe a que fue descubierto
mientras se estudiaba en la orina,
una beta defensina (péptido antimicrobiano), su RNAm fue encontrado
altamente expresado en el hígado,
y menos en macrófagos alveolares,
corazón, células beta del páncreas
y tejido graso 9 se identificó que
es excretado en la orina hasta 100
veces más en enfermos sépticos,
uniendo inflamación e inmunidad
natural.9.16 Es el regulador negativo
del metabolismo del hierro.
La HP aumenta por varios
estímulos:(Cuadro: 2) el aumento
en la concentración de hierro
plasmático y tisular, el aumento de
ferritina, la normoxemia, la actividad eritropoyética, la obesidad, el
envejecimiento, los traumas graves,
quemaduras y las enfermedades
inflamatorias.9,16-20,24,28,32 Por lo tanto disminuye en las anemias por
deficiencia de hierro, la hipoxia, la
flebotomía, la terapia con eritropoyetina, la deficiencia de cobre, la
matriptasa (proteasa de serina, que
degrada la Hemojuvelina) y la hematopoyesis ineficaz en Talasemia,
Mielodisplasia y anemias sideroblásticas, por la liberación del factor
GF-15 del eritroblasto.9,16-20,24,25,37
Una carga oral de hierro de 65
mg. a voluntarios sanos produce
aumento de la hepcidina en suero
5 veces arriba de su valor previo
a las 4 hs y permanece 2 h, causa
hipoferremia tardía a las 24 h. 9,19,20
Su nivel es mayor en la tarde
que en la mañana, en hombres que
en mujeres, circula libre o unida a
albúmina y alfa 2 macroglobulina,
su vida media es de un par de
horas y se excreta por el riñón. La
HP se une a la FPN y en minutos
internaliza a la molécula que es
degradada por lisosomas y ubiquitina, así impide la movilización de
hierro del enterocito, del hígado,
de los macrófagos, del eritroblasto
y del sinciciotrofoblasto que da a la
circulación fetal, cesando la exportación celular de hierro.1-11
S21
Volumen 15, Suplemento 1, 2014
Revista de Hematología
endotelio de sinusoides hepáticos
por su receptor, BMPR y su co-receptor la Hemojuvelina-Neogenina,
para introducirla al parénquima
hepático y estimular la vía SMAD1,5,8-SMAD-4 (son-mother against
decapentaplegic) se fosforilan las
proteínas para activar en el núcleo
los genes de la HP y aumentar su
síntesis. La falta de via SMAD en
ratones homocigotos mueren de
sobrecarga de hierro por falta de
HP. La transferrina diférrica (holotransferrina) y los receptores TfR1 y
El exceso de hepcidina durante
la vida fetal causa grave deficiencia
de hierro y produce muerte perinatal en ratones. Su ausencia, como
en mutaciones heterocigotas de
FPN confirman el papel crítico de
la interaccion HP-FPN, causando
sobrecarga de hierro.11,15,19-25
Existen 2 vías de activación de la
síntesis de Hepcidina en el hígado:
1.- La captura de la Proteína
Morfogenética del hueso (BMP6
de la superfamilia del factor transformador del crecimiento)) en el
Cuadro 2. Resúmen de los mecanismos y endógenos que facilitan la formación
de hepcidina
Exceso de hierro
Inflamación
Infección
Daño Tisular
Hierro/Transferrina Hierro Hepático
BMP HJV HFE TfR2
IL-6, IL-22, IFN-Tipo I
SMADs
STAT 3
Aumento de Hepcidina
GDF-15
TWSG
Aumento eritropoyesis
Reticulo
endoplásmico
TOLL-4
HIF-2ª
Matriptasa
Hipoxia
Supresión de Hepcidina
supresión de BMP
Matriptasa
Deficiencia de hierro
TfR2 potencian la señalización de
esta via.18,19,20
2.- La inflamación por medio de
la IL-6, liposacáridos y leptinas a través de receptores Toll-4 estimulan la
producción de HP a través de la via
Janus kinasa - STAT3 (transducción
de señales y activador de transcripción ) aumentan a 7 veces el valor
de la HP y otras citoquinas como
IFN, FNTa, IL-1, IL-2, IL-10, IL-22 y
coincide con reducción del hierro
plasmático en voluntarios humanos.
Los dos mecanismos se potencian y
uno no es pleno sin el otro.21
En la anemia de los procesos
crónicos, hay aumento en los
niveles de HP (reactante de fase
aguda tipo II) que restringe la
disponibilidad del hierro, como
protector de alarma, que limita el
crecimiento bacteriano, lo que es
exagerado para el huésped, ya que
el hierro permanece secuestrado en
macrófagos y hepatocitos y no es
disponible para eritropoyesis a pesar de otros mecanismos, como los
Factores inducibles por hipoxia 1 y
2-alfa y la eritropoyetina (EPO) que
estimulan los receptores intestinales
y los propios.16,17,18,21
En algunas condiciones predomina una citoquina sobre otra
por ejemplo en la enfermedad de
Crohn y en la insuficiencia cardíaca predomina el factor de necrosis
tumoral, el uso de monoclonales
Mecaninsmos fisiopatológicos de la clínica y bioquímica de las anemias en los procesos crónicos
Autoinmunidad local y general. Daño renal.
Anemia enf. Crónicas
Quemaduras, Sepsis,virus,hongos parásitos choque
Edad obesidad ICCV
Inflamación<> Hipoxia
Cascada de citoquinas
eritropoiesis
retis, Fe+
S22
Padecimientos agudos: Trauma, Alergia.
<30+STf
Destruccion
<25+Ferritina
Fe*disponible
>200/normal
%HRC
Absorción
CHr
Hepcidina
Secuestro Fe*
Índice:sTfR/logF
Epo
Hemosider
Sensibilidad
Siderobásicos
Libro Educativo 55 Congreso Nacional de la Agrupación Mexicana para el Estudio de la Hematología, A.C.
modulan este factor (Infliximab,
Humira), en el Mieloma Múltiple
sin insuficiencia renal, predomina
las BMP-2 y la IL-6 y correlacionan con la HP en suero/orina;
en el Linfoma de Hodgkin, en la
enfermedad de Castleman, en autoinmunidad y el envejecimiento,
la IL-6 correlaciona con los valores
de hepcidina, proteína C reactiva y
ferritina; y de ahí el uso del Tocilizumab , el inhibidor del receptor
de IL-6.27,28,31,36
Otros mecanismos paralelos y
simultáneos a la liberación de citoquinas proinflamatorias son:
a).- La reducción de la vida
media de los eritrocitos, hasta 2.5
veces, por IFN-g que estimulan la
eritrofagocitosis; la sepsis misma
altera la reologia y la oxidación erítrocítica; en ratones transgénicos el
IFN-g del estroma medular, reduce
la formación de brotes eritroides(
UFB-E), lo que sucede también en
la inyección peritoneal de brucela
abortus, destruida por calor.1,3,6,11
b).- La reducción en la síntesis
de hemoglobina en desproporción
al grado de anemia: en el cocultivo
de unidades formadores de colonias
eritroides (UFC-E) con suero de
pacientes con artritis reumatoide
anémicos, se bloquea su proliferación, pero no sucede si no están
anémicos, lo que ocurre si se agregan monocitos de sangre periférica;
efecto del FNT y la IL-6. En arteritis de células gigantes el estroma
medular produce menos factor de
células tronco y de Factor estimulante de granulocitos y macrófagos
(FEC-GM) que en controles.1,5,7-11
c.- La insuficiente producción
de EPO: en 80 pacientes con
anemia de la insuficiencia renal,
con hemoglobina menor de 10 g/
dl, los niveles de EPO fueron mas
altos que los controles sin anemia,
pero 50% mas bajos que los deficientes de hierro, con hematocritos
comparables, lo mismo sucede en
diabéticos, en VIH con anemia y en
40 % de sujetos con hepatopatías
crónicas, se reconoce como efecto
del FNT.1,19,20,26
d).- La pobre respuesta eritropoyética, por falta de hierro
disponible, secuestrado en los depósitos, la supresión de citoquinas
a la eritropoyesis y el bloqueo de IL1b, IL-1b IFN-g, IFN-a y FNT-a a la
poca cantidad de eritropoyetina.3-9
Diagnóstico. El diagnóstico ocurre al excluir causas nutricionales,
deficiencias y pérdidas por otras
vías, identificando cuando se superponen.38,39 La anemia es de tipo
arregenerativo, sin reticulocitos,
normocítica normocrómica entre 7
y 11 g/dl. de hemoglobina, a veces
la cronicidad las hace hipocrómicas
en un 10 a 20%. Cursan con hierro
sérico bajo, transferrina baja y poca
saturación, ferritina alta o normal,
receptor soluble de la transferrina
normal, la relación entre el receptor
soluble de transferrina y el log de la
ferritina mayor de 1.5 es por déficit
de hierro y si es menor de 0.8 es por
inflamación, (Cuadro 1) hepcidina
alta, ausencia de sideroblastos en
médula ósea y aumento del hierro
en los macrófagos 22,29,31-33. Los
equipos modernos, determinan el
porcentaje de eritrocitos hipocrómicos, mas del 6% con menos de
18 pg/ml sugiere déficit de hierro
asociado y el contenido de hemoglobina de los reticulocitos menor de
25 pg.,tiene 75% de sensibilidad y
mayor valor predictivo que la ferritina y la saturación de transferrina
en el diagnóstico de deficiencia y
mas de 25 pg en la anemia crónica
33,34,40
. La fracción de reticulocitos
inmaduros también revela la reciente eritropoyesis, tienen mayor
RNA, aumentan antes que la cuenta
total de reticulocitos, pero no hay
rangos de referencia y no está estandarizada.
Tratamiento. Aunque la mejoría
de la enfermedad que origina el
proceso, facilitara la recuperación
de la anemia, la gran mayoría de
las condiciones serán crónicas y
se acompañaran de este trastorno
del hierro. Se han hecho estudios
cooperativos para usar EPO en diferentes modalidades, con hierro oral
o intravenoso o nada, y aunque se
ha observado mejoría en los valores
de hemoglobina y reducción de HP,
también se han identificado riesgos
indeseables como trombosis venosa
periférica, infartos del miocardio y
crecimiento de algunos tumores,
al parecer no tanto por los valores
de hemoglobina conseguidos, sino
por el uso mismo de la EPO, además del riesgo de causar aplasia de
serie roja y mayor sobrecarga de
hierro tóxico26,30,34,35 Hay en proceso productos sintéticos anti-HP
que cursan aun fases preclínicas,
y otros que actúan en diferentes
etapas del metabolismo del hierro,
facilitando su liberación del SRE
como anticuerpos contra los iniciadores de las vías de activación antes
descritas. 31,35,36
Sin embargo no conocemos las
implicaciones clínicas de bloquear
mecanismos ancestrales de la inmunidad natural, en procesos de
respuesta protectora.
1. Referencias.
Little J.A. Benz E.J. Anemia of chronic
disease.Ch:35 Hematol. Basic Princ.
and Pract. Hoffman Ed. 5th Edition
2013, pp:
2. Torre-L. E. Salazar-P J. Anemias
Secundarias,Cap.11:Fundamentos
de Hematología. 5ª.Ed.2014.Panamericana pp.151-163.
3. Finberg K. E. Regulation of systemic
iron homeostasis. Curr. Opin . Hematol. 2013; 20:208–214.
4. Witmer C M. Hematologic manifestations of systemic disease: IDA,
ACD,DIC. Pediatr. Clin. N. Am. 2013;
60:1337–1348.
5. Wessling-Resnick M. Iron homeostasis and the inflammatory response.
Annu Rev Nutr 2010; 30: 105–122.
6. Collis J. O. Diagnosis and management of anaemia of chronic disease:
Current status. Brit. J. Haematol.
2011;154:289-300.
S23
Volumen 15, Suplemento 1, 2014
Revista de Hematología
7.
8.
9.
10.
11.
12.
13.
14.
15.
16.
17.
18.
19.
20.
21.
22.
S24
Gangat, N..Wolanskyj A. P. Anemia
of Chronic Disease. Semin. Hematol.
2013; 50: 232–238.
Drakesmith H, Prentice AM. Hepcidin
and the iron-infection axis. Science
2012; 338:768–772.
Ganz T. Systemic Iron Homeostasis.
Physiol. Rev. 2013; 93: 1721–1741,
Roy Cindy N. Anemia of Inflammation. Hematology. American
Society of Hematology. Education
Book 2010: 276-280.
Ganz T. Nemeth E. Hepcidin and iron
homeostasis. Review Biochimica
et Biophysica Acta 1823, 2012;
1434–1443
Mundo V, Shamah T.Rivera-DJA,
Epidemiología de la inseguridad alimentaria. Salud Pública Méx.2013;55
2:S206-S213.
Bryce R.M. Salas A. Acosta D.JiménezA. I..The prevalence, correlates and
impact of anemia among older
people in Cuba, Dominican Republic, Mexico and Puerto Rico and
Venezuela. Brit. J. Haematol.2013;
160;387-398.
Balarajan Y, Ramakrishnan U, Özaltin E, , Anaemia in low-income and
middle-income countries. Lancet
2011; 378: 2123–35.
Camaschella C Iron and hepcidin: a
story of recycling and balance. Hematology. Am. Soc.of Hem. Education
Book 2013:1-10
Mastogiannaki M.,Matak P Peyssonnaux C. The gut in iron homeostasis..
Blood 2013;122: 885-892.
Wilkinson N., Pantopoulos K.: IRP-1
regulates erythropoiesis, iron homeostasis controlling HIF2a. Blood.
2013;122:1658-68.
Haase V. H. Regulation of erythropoiesis by hypoxia-inducible factors. Blood Reviews 2013; 27:41–
53.
anz T.Nemeth E. Hepcidin and disorders of iron metabolism. Annu. Rev.
Med. 2011; 62: 347–60.
Ganz T.: Hepcidin and iron regulation 10
years later. Blood 2011;117:4425-4433.
Eltzschig, H. K. Carmeliet, P.. Hypoxia
and Inflammation. N. Engl. J. Med.
2011;364:656-65.
Galesloot TE, Vermeulen SH, GeurtsM. AJ. Hepcidin: reference ranges
in the general population. Blood
2011;117: 218–25.
23. McCranor B. J.Langdon J.M., Prince
O D.The role of IL-6 and hepcidin
in anemia with age. Haematologica
2013; 98;1633-40.
24. Goodnough JB, Ramos E, Nemeth E,
Ganz T. Detection,management of
iron restricted erythropoiesis. Blood
2011;116:4754.
25. Aigner E, Felder TK,Oberkofler H,
Glucose as a regulator of iron by
increasing hepcidin. J. Nutr. Biochem.
2013; 24:112–117
26. Weiss G, Goodnough LT. Anemia of
chronic disease. N. Eng. J. Med. 2005;
352:1011–23.
27. TanakaT,Narazaki M. Kishimoto
T.Therapeutic targeting Interleukin6R Annu.Rev.Pharmacol.Toxicol.
2012; 52:199–21.
28. Cheng HL, Bryant C, Cook R, The
relationship between obesity and
hypoferraemia in adults. Obes. Rev.
2012;13: 150–61..
29. Thomas C.Thomas L. Biochemical and Hematologic Indices in
Functional Iron Deficiency. Clin.
Chem.2002;48:1066–1076.
30. Magwood J.S. Lebby A., Chen B.
Emerging drugs for treatment of
anemia of CKD Expert. Opin. Emerg.
Drugs 2013;18:421-9.
31. Sun CC,Vaja V, Babitt JL, Targeting
hepcidin-ferroportin axis anemia
of chronic disease. Am. J. Hematol.
2012;87:392–400.
32. Ruiz RE, Valenzuela,JA, Ponce
G.Morales-F G Aguilar-M,K Ramírez V.
Alemán-M H Insufficient amounts and
distribution of protein intake in healthy
older adults in a developing country Clinical Interven. Aging. 2013;1143–1148.
33.Schoorl M.Snijders D Schoorl M.
Impairment of reticulocyte Hb and
hepcidin-25 induction in patients
CA pneumonia. Scand. J. Clin. Lab.
Invest. 2013; 73: 54–60.
34. Fleming R.E, Ponka P. Iron overload in
human disease. N Engl J Med 2012;
366:348–359.
35. Higashijima Y. Tanaka T Nangaku
M. Hypoxia-inducible factor prolylhydroxylase inhibitors and its therapeutic potential for the treatment
of erythropoiesis - stimulating agentresistant anemia. Expert. Opin.Drug
Discov. 2013; 8:965-976
36. Camaschella C. Treating iron overload. N. Engl. J. Med. 2013; 368:2325.
37. Yang Q, Jian J, Katz S 17beta-Estradiol inhibits hepcidin through
estrogen factor Endocrinology
2012;153:3170–3178.
38. Perlstein TS, et al. Prevalence of
25-hydroxyvitamin D deficiency in
elderly persons with anemia. Blood.
2011; 117:2800–6.
39. Romero G.F.Aguilar A.M. Gray S.C.y
cols..Anormalidades hematológicas
en LEG. La Rev. Inv. Clin. Méx. 1988;
40:119-124.
40. Thomas D.W., Hinchliffe R.. Briggs
C. Guideline for the laboratory
diagnosis of FID. Brit. J. Haematol
2013;161,639-648.
La anemia por deficiencia
de hierro en los países en
vías de desarrollo: Retos y
oportunidades
Dr. Eric Dillmann
Universidad de Calgary, Canadá
En el año 2006 la Organización
Mundial de la Salud (OMS) estimó
que aproximadamente 2 billones
de personas en el mundo padecían
algún grado de anemia habiendo
definido esta por una concentración
de hemoglobina por debajo de los
niveles aceptados por la OMS como
normales.1,2
La anemia nutricional causada
por la deficiencia de hierro, continúa siendo en la actualidad una
de las deficiencias nutricionales
de mayor prevalencia en todo el
mundo. La mayor incidencia de esta
condición se presenta en los países
con un bajo nivel de desarrollo
socio-económico. La OMS considera que en términos generales
al menos la mitad de los casos de
anemia corresponden a deficiencia
de hierro aun cuando estos no se
hayan documentado con pruebas
de laboratorio específicas para medir los niveles de hierro.1,3
Si bien la mayoría de los estudios epidemiológicos realizados se
han enfocado en mujeres y niños
los reportes de la OMS indican
que todos los grupos de edad en
Libro Educativo 55 Congreso Nacional de la Agrupación Mexicana para el Estudio de la Hematología, A.C.
ambos sexos se ven afectados
y por lo tanto esta condición es
causa de una carga de morbilidad
ostensible principalmente en los
países económicamente más vulnerables, En estos países más de la
mitad de las mujeres embarazadas
padecen anemia y una proporción
aun mayor son deficientes de hierro. En este grupo poblacional las
consecuencias son entre otras un
mayor riesgo de hemorragias e infecciones puerperales, una mayor
mortalidad materna y perinatal y
también bajo peso en los recién
nacidos.4,5
Además de lo anteriormente
mencionado, a nivel de población
general, la deficiencia de hierro
con o sin anemia trae consigo
consecuencias muy negativas para
la salud de las personas y particularmente afecta negativamente el
desarrollo físico y mental de los
niños y adolescentes.6
La prevalencia de anemia por
deficiencia en forma endémica
también limita severamente el
desarrollo de los países y se estima
que casi un 30% del total de las
causas que limitan la capacidad de
trabajo de las personas en el mundo
son atribuibles a esta condición. En
varios estudios realizados en diversas partes del mundo desde hace
más de tres décadas se ha visto que
la suplementación con hierro ha
permitido revertir este fenómeno.7,8
Existen en la literatura médica
numerosos reportes vinculando
diversas alteraciones metabólicas
a la deficiencia de hierro a nivel
tisular aun en ausencia de anemia.
Estas alteraciones se expresan en
síntomas que ahora se reconocen
como parte del espectro clínico de
la enfermedad.9
Aun cuando la etiología y tratamiento de la anemia por deficiencia
de hierro son bien conocidos ya
por muchos años, y a lo largo de
este tiempo se han identificado soluciones simples y accesibles para
su prevención el problema persiste
casi de manera inmutable. Parte una
parte este fracaso estriba en que
regularmente se subestima la magnitud de la incidencia de anemia
en la población, además de que la
deficiencia de hierro sin anemia no
se ha abordado sistemáticamente
como un problema importante de
salud. La otra parte podría atribuirse
a un enfoque equivocado de las
estrategias de prevención de la
anemia nutricional.
La anemia por deficiencia de
hierro, al igual que la mayoría de
las deficiencias nutricionales que
preocupan a la salud pública, es
consecuencia de la pobreza. Aun en
los países altamente desarrollados
esta condición afecta a los grupos
poblacionales más vulnerables
desde el punto de vista económico.
Ante esta perspectiva es de
esperarse que las soluciones al
problema sean de características
multidisciplinarias. La experiencia
práctica en el trabajo de desarrollo
de programas de salud ha permitido
observar una y otra vez que las intervenciones de prevención ligadas
únicamente a la administración de
hierro tienen solamente un efecto
limitado y pasajero. Así pues, las
estrategias destinadas a prevenir la
anemia por deficiencia de hierro
para ser exitosas deberán de ser
amplias y sustentables. Por amplitud se entiende la participación de
diversos sectores de la sociedad
especialmente incluyendo en forma
igualitaria a las comunidades locales. La sustentabilidad se alcanza
solamente con esfuerzos conjuntos
enfocados a la reducción de la
pobreza, a mejorar el acceso a alimentos diversificados, a promover
la educación en prácticas alimentarias y sanitarias adecuadas y desde
luego a mejorar los servicios de
atención primaria de la salud.
Para planear intervenciones
efectivas en la lucha para disminuir
sustancialmente la deficiencia de
hierro también se necesita urgentemente contar con información
confiable sobre el estado nutricional de la población. Solamente así
se podrán implementar las acciones
adecuadas y se podrá contar con los
indicadores precisos para monitorear su eficacia e impacto.
Especialmente cuando la deficiencia de hierro tiende a ser de
características endémicas, resulta
necesario implementar programas
relacionados a la fortificación de
alimentos y a la suplementación
con hierro. Estas dos iniciativas
representan en sí mismas retos difíciles. Por otra parte la identificación
y seguimiento de casos mediante
técnicas de laboratorio simples,
confiables y económicas representa
todavía un escollo que aun no ha
sido superado.
La experiencia práctica indica
que las iniciativas más exitosas
para el control de la anemia por
deficiencia de hierro han ocurrido
en aquellos países en los que el
problema se ha abordado en forma
multisectorial y en donde se han
llevado a cabo estudios de investigación aplicada a las intervenciones
nutricionales. Esta colaboración
conjuntamente con las investigaciones han aportado los elementos
necesarios para desarrollar, evaluar
y refinar los programas de detección
de la anemia y en caso necesario diseñar e implementar estrategias de
suplementación y de fortificación
de alimentos efectivas.
Para países como México, en
donde aún prevalecen discrepancias
a nivel de desarrollo socio-económico resulta importante disponer
de información epidemiológica
amplia, actualizada y confiable en
relación a la anemia nutricional.
Esta información hará posible
que las instancias de salud pública del país, conjuntamente con
grupos y organizaciones ligadas
al cuidado de la salud, vean que
las estrategias orientadas a dis-
S25
Volumen 15, Suplemento 1, 2014
Revista de Hematología
minuir esta condición se dirijan
de una forma apropiada, efectiva
y dentro de parámetros costoeficaces.
De manera no menos importante también proveerá una
oportunidad valiosa a los profesionistas de la salud para continuar
investigaciones y desarrollar modelos de estrategias novedosos y
eficaces que sin duda tendrán un
efecto positivo muy significativo en
la salud del país.
Referencias
1.
2.
3.
4.
5.
6.
7.
8.
9.
S26
WHO, UNICEF, UNU. Iron deficiency
anaemia: assessment, prevention,
and control. A guide for programme
managers. Geneva, World Health
Organization, WHO/NHD/01.3.
2001.
World Health Organization. Report
of WHO/UNICEF/UNU consultation
on indicators and strategies for iron
deficiency and anemia programmes.
Draft IDAREP 01. Geneva: WHO, 1994
ACC/SCN. Third report on the world
nutrition situation. Geneva, United
Nations Administrative Committee
on Coordination/Sub-Committee on
Nutrition, 1997.
Schorr TO, Hediger ML. Anemia and
iron-deficiency anemia: compilation
of data on pregnancy outcome. American Journal of Clinical Nutrition, 59,
1994; (Suppl.):492S-501S.
Brabin BJ, Hakimi M, Pellertier D. An
analysis of anemia and pregnancyrelated maternal mortality. J Nutr.
2001;131:604S-614S
Grantham-McGregor S, Ani C. A review of studies on the effect of iron
deficiency on cognitive development
in children. Journal of Nutrition,
2001, 131:649S–666S.
Basta S et al. Iron deficiency anemia
and the productivity of adult males
in Indonesia. American Journal of
Clinical Nutrition, 1979; 32:916-925.
Haas JD, Brownlie T 4th. Iron deficiency and reduced work capacity:
a critical review of the research to
determine a causal relationship. J
Nutr 2001; 131:676S-688S.
The British Nutrition Foundation. Iron: Nutritional and PhysiologicalSignificance. London, England:
Chapman & Hall; 1995.
Anemia de Fanconi. Fenotipo
clínico, celular y molecular
Dra. Sara Frias
La anemia de Fanconi (AF), es una
enfermedad recesiva, los individuos
afectados son homocigotos o doble
heterocigotos para mutaciones en
uno de los 16 genes responsables de
la enfermedad. Se presenta en todas
las razas y grupos étnicos; la frecuencia estimada para homocigotos
es aproximadamente de 1/200 000
nacimientos y la de heterocigotos
es de 1/300.
Es un trastorno que implica una
falla en la médula ósea, que afecta
la producción de todo tipo de células sanguíneas, esta pancitopenia
tiene consecuencias graves en la
salud del paciente. La disminución
en los glóbulos blancos predispone
a infecciones, la de glóbulos rojos
produce anemia y la de plaquetas
puede causar coagulación deficiente. Otras características clínicas
frecuentes son: hiperpigmentación
generalizada en la piel o bien manchas obscuras o de color café con
leche; talla baja y malformaciones
en miembros superiores como, radio ausente o hipoplásico, pulgares
ausentes o malformados, clinodactilia, polidactilia y dedos cortos o
ausencia de huesos en los mismos.
Pueden tener también alteraciones
oculares, gentiales y renales, entre
otras y una muy alta predisposición
a cáncer, sobre todo leucemia y
tumores de cabeza y cuello. Por
estas características, los pacientes
tienen una esperanza de vida de 20
años en general.
A nivel celular, presentan inestabilidad cromosómica espontánea.
Las células de los pacientes con
AF presentan una frecuencia de
aberraciones cromosómicas (AC)
espontánea promedio de 0.3 aberraciones por célula, mientras que
los individuos normales presentan
0.04 aberraciones. Una caracterís-
tica única es su hipersensibilidad
a agentes inductores de enlaces
cruzados en el DNA, como la mitomicina C , diepoxibutano, cisplatino
entre otros; la frecuencia inducida
de AC aumenta hasta 10 veces
más que la espontánea en células
AF, mientras que en las normales
sólo se duplica ante estos agentes.
Este comportamiento celular se ha
convertido en el estándar de oro
que permite el diagnóstico citogenético de esta enfermedad. En la AF
existe también hipersensibilidad al
oxígeno y a las especies reactivas
del metabolismo del oxígeno que a
concentraciones normales elevan el
número de AC, disminuyen la tasa
de proliferación y detienen el ciclo
celular en la fase G2.
En las células AF, se han detectado baja concentración de
interleucina 6 y la del factor de
necrosis tumoral alfa (TNF-α) es
ocho veces mayor a la normal. Estas
alteraciones, sobre todo en el TNF-α
se ha relacionado con una apoptosis incrementada en las células AF,
principalmente a nivel de células
hematopoyéticas. Generalmente
los pacientes AF tienen una médula
ósea con marcada hipocelularidad.
A nivel molecular, la principal
característica es su deficiencia
en la reparación del DNA, específicamente se puede asociar la
inestabilidad cromosómica en AF
con deficiencias en la reparación
de rupturas de doble hebra y de enlaces cruzados del DNA, mediante
recombinación homóloga. La vía
de reparación deficiente en estos
pacientes, se le ha denominado
FA/BRCA, debido a que posee e
interactúa con proteínas identificadas en pacientes con cáncer de
mama. La vía FA/BRCA consta de
16 proteínas codificadas por los 16
genes AF, llamados FANCA, FANCB,
FANCC, FANCD1, FANCD2, FANCE, FANCF, FANCG, FANCI, FANCJ,
FANCL, FANCM, FANCN, FANCO,
FANCP y FANCQ. El gen FANCD1
Libro Educativo 55 Congreso Nacional de la Agrupación Mexicana para el Estudio de la Hematología, A.C.
es el mismo gen BRCA2 identificado
paralelamente en cáncer de mama y
de hecho otros 4 genes AF, se identifican como genes de susceptibilidad
a desarrollar cáncer de mama y
ovario. La vía FA/BRCA actúa en
la reparación de enlaces covalentes
cruzados (ECC) del DNA, mediante
la formación de un complejo “core”
de 8 proteínas AF y 2 proteínas asociadas: FAAP20 and FAAP24. Este
primer complejo “rio arriba” se activa por la proteína señalizadora ATR,
en presencia de ECC y enseguida
ubiquitiniza a otras dos proteínas
AF, las FANCD2 Y FANCI. Una vez
se ubiquitina el complejo I-D2, se
activa la acción de las proteínas
“rio abajo”, que activa 4 proteínas
AF y otras más que se encargan
de realizar la reparación del DNA
dañado, primordialmente mediante
recombinación homóloga, que es
libre de error.
Cuando alguno de los genes
FANC está mutado bialélicamente,
se presenta la anemia de Fanconi,
por lo que se presume que esta
vía FA/BRCA, está implicada en
diversas funciones vitales, como
la estabilización de las horquillas
de replicación, la reparación del
DNA, la protección contra procesos cancerígenos (por lo cual
se consideran estos genes como
supresores de tumor) y finalmente
como genes guardianes de la integridad y mantenimiento de células
troncales hematopoyéticas. A pesar
del gran cúmulo de conocimientos
generados recientemente sobre los
defectos moleculares de la AF, hasta
ahora hay poco conocimiento sobre
la asociación entre la vía FA/BRCA
y el fenotipo clínico y celular sobre
todo a nivel de células troncales y
progenitoras hematopoyéticas.
El trasplante en leucemia
aguda, ¿es la mejor opción
de curación?
David Gómez-Almaguer
Servicio de Hematología, UANL,
Hospital Universitario “Dr José E.
González” , Monterrey, N.L.
dr_gomezalmaguer@gmail.com
INTRODUCCION. Las leucemias
agudas constituyen un grupo heterogéneo de enfermedades que se
caracteriza por la infiltración de la
medula ósea con células neoplásicas del sistema hematopoyético, su
etiología sigue siendo desconocida.1,2 En México la incidencia anual
de LA en la población general fue
alrededor de 2/100 000 habitantes/
año con una tasa de mortalidad de
3/100 000 habitantes/año.3
La LLA es la variedad más
común en menores de 15 años,
representando un 30% de todos
los canceres diagnosticados en
este grupo de edad. Su incidencia
varia de 3 a 4/100 000 niños, con
un pico de incidencia entre los de
2 y 5 años en EUA a 5.6/100 000
niños en Costa Rica,4,5 en México se
encuentra en 4.95/100 000 niños;2
en la actualidad la tasa de supervivencia en este grupo es del 80% en
países desarrollados.6
En los adultos la LLA representa
el 20% de todas las leucemias, con
un pico a los 65 años de edad y una
incidencia en los EUA reportada
en 1.5/100 000 habitantes/año,
en nuestro país no se encuentra
disponible esta información actualizada. A pesar de la adaptación
de los protocolos pediátricos para
el tratamiento de LLA de adulto,
que han llevado a obtener mejores
resultados, todavía hay una brecha
significativa en la tasa de éxito entre
los dos grupos, la sobrevida en el
adulto es tan solo de un 30-40%7 y
por ello es el grupo mas susceptible
a someterse a un trasplante de células hematopoyéticas (TCH).
Los factores pronósticos en
niños y adultos se utilizan para la
estratificación del riesgo y sirven
para decidir si el trasplante es la
mejor opción de tratamiento;8 la
edad es un factor de mal pronós-
tico que actúa como una variable
continua,9 la cuenta elevada de
glóbulos blancos al momento del
diagnóstico se asocia a una respuesta desfavorable al tratamiento; otro
factor de riesgo es el inmunofenotipo, el cual se establece según los
parámetros antigénicos detectados
por medio de la citometría de flujo;
en los niños el inmunofenotipo de
células B corresponde a un 85% y
el Pre-B a un 20%,1 mientras que
en adultos un 70% corresponde a
LLA de células B , 25% es de células
T y 5 % es de células B maduras (
Burkitt).1 En comparación con los
adultos jóvenes la LLA de células
T es menos común en ancianos,
20% vs 10 % respectivamente, en
este último grupo de edad la hiperleucocitosis y la invasión al sistema
nervioso central (SNC) al momento
del diagnóstico es menos frecuente
que en el niño y el adulto joven, el
TCH parece ser muy importante en
este tipo de leucemia. Con respecto
a la citogenética y marcadores moleculares, el cromosoma Filadelfia
positivo (Ph+) en menores de 20
años es encontrado en un 5% y en
el adulto es la anormalidad más
frecuente y clínicamente significativa, ocurriendo en un 30% a 40%
de estos pacientes, la presencia
del cromosoma Filadelfia positivo
incrementa con la edad, pero algunos estudios han encontrado que
después de los 65 años el cromosoma Ph+ disminuye;9 a pesar del
advenimiento de los inhibidores de
la cinasa de tirosina, el TCH sigue
siendo la mejor opción para aspirar
a la curación en estos pacientes sin
importar la edad. La presencia de
enfermedad mínima residual (EMR)
también se considera un factor de
mal pronóstico, ya que un porcentaje >0.1% después del periodo
de tratamiento inicial se asocia
a una mayor tasa de recaída;10 la
tendencia actual sugiere que estos
pacientes deben ser considerados
como candidatos para un TCH antes
S27
Volumen 15, Suplemento 1, 2014
Revista de Hematología
de que la carga tumoral sea mayor.
La LMA es un grupo heterogéneo de leucemias que surgen de
los precursores de las células mieloides, eritroides, megacariocítica
y monocíticas. Esta LA es la más
común en los adultos, principalmente en los mayores de 65 años.11
La incidencia se incrementa con la
edad, con una media de 67 años.
La incidencia anual en los EUA es
3.7/ 100 000 habitantes/año; en
México se reportó en 0.9/100 000
habitantes/año.22 De acuerdo con
la FAB hay ocho tipos de LMA,
desde M0 hasta M7; sólo la M3
(promielocitica) tiene características
clínicas, pronóstico y modalidad
de tratamiento distintos.13
TRASPLANTE. El trasplante de
células hematopoyéticas (TCH) si es
la modalidad terapéutica mas eficaz
para curar a la leucemia aguda,
sin embargo, existen dificultades
diversas y obstáculos para su uso
generalizado, a saber: 1) Disponibilidad de células hematopoyéticas
suficientes y adecuadas, 2) Origen
o donador de estas células, 3) La
elección del momento ideal para
el trasplante, 4) Régimen de acondicionamiento ideal, 5) Personal y
unidad especializada, 6) Costo y
toxicidad del procedimiento
ORIGEN Y DISPONIBILIDAD
DE CELULAS HEMATOPOYETICAS.
El TCH habitual es aquel en el cual
obtenemos una cantidad adecuada
de células CD34 de un donador relacionado, usualmente un hermano
HLA idéntico en 10 antígenos ( ABC,
DR,DQ) . La cifra ideal de células
es igual o mayor a 3 x 10(6) por Kg,
en nuestra experiencia infundir una
cifra mayor de 5 millones por Kg es
aún mejor para minimizar riesgos,
toxicidad y mejorar supervivencia a
largo plazo.14 Elegir a un varón como
donador, puede ser importante para
aminorar el riesgo de enfermedad
del injerto vs huésped.
En casos de alto riesgo, como serían leucemias en segunda remisión
S28
o refractarias, el contar con células
de un donante no relacionado,
cordón umbilical o haploidénticas
puede aumentar la posibilidad de
obtener un efecto del injerto vs la
leucemia, incrementando de este
modo la posibilidad de curación.
Actualmente, el uso de células de
origen haploidéntico tiene un papel
cada vez más relevante y particularmente útil en nuestro contexto,
por su amplia disponibilidad de
donadores. Esta alternativa de trasplante es cada vez menos peligrosa;
se está identificando con mayor
precisión el proceso de rechazo al
injerto y desarrollo de EICH. En el
caso de este último, las células T
alorreactivas responsables de parte
de su desarrollo, han sido propuestas como aquellas portadoras de las
cadenas en el receptor de células
T, y en contraparte, aquellas con
cadenas como linfocitos con efecto
injerto vs. tumor. La utilidad de este
descubrimiento se esta investigando
clínicamente por el grupo originado en la ciudad de Perugia, Italia
depletando magnéticamente estas
células antes de la infusion, con
excelentes resultados preliminares.15 Otro enfoque relevante a los
trasplantes haploidenticos ha sido
el descubrimiento de la utilidad de
la ciclofosfamida como un agente
que limita la respuesta agresiva
contra el hospedero, disminuyendo
radicalmente células T alorreactivas
in vivo cuando se utiliza en el tercer
y cuarto día después de su infusión,
a diferencia del otro grupo utilizando depleción ex vivo, no obstante,
con resultados alentadores y de una
manera mucho más económica.16
Adicionalmente, las células NK
alorreactivas y la compatibilidad de
su receptor KIR (Killer immunoglobulin-like recetor, el cual reconoce
alelos HLA clase I) han demostrado
tener un rol importante por su capacidad para reconocer y eliminar
células neoplásicas en el receptor.
Recientemente se ha descubierto
un mayor efecto injerto vs. tumor
a mayor incompatibilidad en KIR y
HLA clase I (o “ligando KIR”) clínicamente.17 Estos descubrimientos,
ademas de reflejar lo poco que se
sabe de estas complejas interacciones celulares, tienen el potencial
de cambiar la panorámica en los
trasplantes haploidénticos, aumentando su seguridad y efectividad,
acercando esta poderosa arma
terapéutica a más pacientes en un
mejor momento.
LA ELECCION DEL TRASPLANTE Y EL REGIMEN DE
ACONDICIONAMIENTO. El momento ideal para llevar a cabo el
TCH es cuando la enfermedad se
encuentra en su mínima expresión,
es decir en remisión completa. Si
bien el TCH es la modalidad de
tratamiento mas eficaz en la LA,
la toxicidad potencial y muerte
relacionada al procedimiento nos
indican que se debe de elegir cautelosamente al paciente ideal. En el
caso de la leucemia aguda mieloblástica el trasplante es ideal para
los pacientes con riesgo intermedio
y alto. Pacientes con inversión del
cromosoma 16, translocación 8:21
o variante M3 solo se trasplantarían
en caso de recaída. En casos de
alto riesgo el trasplante debe de ser
considerado al momento de obtener
remisión completa. No es necesario
esperar, ni administrar varios ciclos
de consolidación , usualmente
un ciclo de consolidación basta
para ganar tiempo y proceder a
la búsqueda del donador. En el
caso de la LA linfoblástica se debe
de considerar el trasplante en la
mayoría de los pacientes adultos en
buen estado físico que cuenten con
donador. En niños y adolescentes
solo en pacientes con enfermedad
mínima residual positiva al final de
la inducción a remisión o en casos
de muy alto riesgo.18,19
En relación al régimen de acondicionamiento, no existe diferencia
importante entre el de intensidad
Libro Educativo 55 Congreso Nacional de la Agrupación Mexicana para el Estudio de la Hematología, A.C.
reducida o el convencional mieloablativo. Por ello es ideal en nuestro
medio utilizar el de intensidad
reducida por su menor toxicidad
y menor costo. Para casos de leucemia activa y refractaria, que son
los pacientes de mayor riesgo, ha
emergido la utilización de quimioterapia combinada con radioterapia
restringida a médula ósea y tejido
linfoide, con ello evitamos daño a
otros tejidos y aumentamos notablemente la posibilidad de curación.20
Esta modalidad la hemos utilizado
con éxito en casos que anteriormente no se consideraban para un
trasplante
OTROS FACTORES. Ciertamente existen otros factores que
inciden en el resultado final para
curar a un paciente con leucemia
que es sometido a un trasplante. La
experiencia del centro en cuestión
es importante, a mayor número
de pacientes trasplantados suele
aumentar la eficacia. el trasplante
ambulatorio tiene ventajas interesantes, ya que al parecer se asocia
a mejor supervivencia y menos
injerto vs huésped. El costo es importante, especialmente en nuestro
país, cualquier idea que disminuya
costos sin afectar calidad en resultados debe ser bienvenida.
CONCLUSION. El TCH es la
opción terapéutica mas eficaz para
obtener la curación en pacientes
con leucemia aguda, especialmente
en pacientes adultos. En niños con
enfermedad residual positiva al
término de la quimioterapia inicial,
el TCH también es la mejor opción.
La referencia temprana de estos pacientes a un TCH es muy importante
por no decir indispensable. A pesar
de los avances en este campo , los
resultados en pacientes mas allá de
una primera remisión completa son
todavía desalentadores.20
Referencias
1.
Itakura H, Coutre SE.Acute lymphoblastic leukemia in adults.In Greer
JP,Foerster J,Rodgers G,Paraskevas
2.
3.
4.
5.
6.
7.
8.
9.
10.
11.
12.
13.
14.
F, Glader B.Wintrobe´s Clinical Hematology.Vol 2 Philadelphia,PA:
Lippincott Williams&Wilkins; 2009;
2:1820-1842.p.22
Dores GM, Devesa SS, Curtis RE, Linet
MS, Morton LM. Acute leukemia incidence and patient survival among
children and adults in the United
States, 2001-2007. Blood. 2011.
Sanchez M OM, Barriento J. Leucemia Linfoblastica Aguda. Medicina
Interna de Mexico. 2007;23(1):26-33.
Belson M, Kingsley B, Holmes A.
Risk factors for acute leukemia in
children: a review. Environ Health
Perspect. 2007;115(1):138-45.
Santamaria-Quesada C, Vargas M,
Venegas P, Calvo M, Obando C,
Valverde B, et al. Molecular and
epidemiologic findings of childhood
acute leukemia in Costa Rica. J Pediatr Hematol Oncol. 2009;31(2):131-5.
Foa R. Acute lymphoblastic leukemia:
age and biology. Pediatr Rep. 2011;3
Suppl 2:e2.
Rowe JM. Prognostic factors in adult
acute lymphoblastic leukaemia. Br
J Haematol. 2010;150(4):389-405.
Stock W. Adolescents and young
adults with acute lymphoblastic leukemia. Hematology Am Soc Hematol
Educ Program. 2010;2010:21-9.
Annino L, Goekbuget N, Delannoy A.
Acute lymphoblastic leukemia in the
elderly. Hematol J. 2002;3(5):219-23.
Yamaji K, Okamoto T, Yokota S, Watanabe A, Horikoshi Y, Asami K, et al.
Minimal residual disease-based augmented therapy in childhood acute
lymphoblastic leukemia: a report
from the Japanese Childhood Cancer
and Leukemia Study Group. Pediatr
Blood Cancer. 2010;55(7):1287-95.
Abdel-Wahab O, Levine RL. Recent
advances in the treatment of acute
myeloid leukemia. F1000 Med Rep.
2010;2:55.
Craig CM, Schiller GJ. Acute myeloid
leukemia in the elderly: conventional
and novel treatment approaches.
Blood Rev. 2008;22(4):221-34.
Deschler B, Lubbert M. Acute myeloid leukemia: epidemiology and
etiology. Cancer. 2006;107(9):2099107.
Gómez-Almaguer D, Gómez-Peña A,
Jiame-Pèrez JC et al. Higher doses
of CD34+ progenitors are associa-
ted with improved overall survival
without increasing GVHD in reduced
intensity conditioning allogeneic
transplant recipients with clinically
advanced disease. J Clin Apher.
2013;28:349-55.
Norelll H, Moretta A, Silva-Santos B,
Moretta L. At the Bench: Preclinical
rationale for exploiting NK cells and
γδ T lymphocytes for the treatment
of high-risk leukemia. J Leukoc Biol
2013;94:1123-39.
Luznik L, O’Donnell PV, Fuchs EJ. Posttransplantation cyclophosphamide
for tolerance induction in HLA-haploidentical bone marrow transplantation. Semin Oncol 2012;39:683-93.
Moretta A, Pende D, Locatelli F, Moretta L. Activating and inhibitory iller
immunoglobulin-like receptors (KIR)
in haploidentical haemopoietic stem
cell transplantation to cure high-risk
leukemias. Clin Exp Immunol. 2009;
157:325-31.
Gutiérrez-Aguirre CH, Gómez-Almaguer D, Cantú-Rodríguez OG et al.
Non-myeloablative stem cell transplantation in patients with relapsed acute lymphoblastic leukemia:
results of a multicenter study. Bone
Marrow Transplant 2007;40:535-39.
Gutiérrez-Aguirre CH, Cantú-Rodríguez OG, González.LLano O et al.
Non-myeloablative hematopoietic
stem cell transplantation is of limited value in advanced or refractory
acute myeloblastic leukemia. The
Mexican experience. Hematology
2007;12:193-7
Forman SJ, Rowe JM. The myth of second remission of acute leukemia in
the adult. Blood 2013; 121:1077-82.
15.
16.
17.
18.
19.
20.
LEUCEMIA LINFOBLASTICA EN
NIÑOS
Dr. Oscar González Llano
Experiencia de un Hospital Universitario
Hospital Universitario, UANL
ogzzll25@hotmail.com
La leucemia linfoblástica aguda
(LLA) es la neoplasia más frecuente
en pediatría y también una de las
enfermedades malignas en las que
se ha logrado un mayor avance
S29
Volumen 15, Suplemento 1, 2014
Revista de Hematología
en el pronóstico de los enfermos.
Existen para su atención múltiples
protocolos de quimioterapia diseñados principalmente por los más
importantes grupos médicos que
atienden a niños con cáncer.
A partir de febrero del 2010,
decidimos en la atención de nuestros pacientes pediátricos con LLA
emplear un régimen de tratamiento
basado en el protocolo publicado
en la revista “Pediatric Blood and
Cancer” en el año 2009 con el
título “Treatment Strategies and
Regimens of Graduated Intensity
for Childhood Acute Lymphoblastic
Leukemia in Low-Income Countries:
A Proposal.”
Nuestro objetivo principal
era mejorar resultados previos,
empleando un protocolo que pudiéramos seguir de acuerdo a las
características de nuestro hospital.
Siempre hemos pensado que no
obstante existir protocolos de manejo que ofrecen resultados realmente
muy impresionantes, éstos son
logrados con niños, hospitales y
recursos diferentes a los nuestros.
Los pacientes se separaron en
dos grupos, riesgo habitual y riesgo
alto, los criterios para definir riesgo
habitual fueron: tener edad al
diagnóstico entre 12 y 120 meses,
leucocitos menor de 50 x 109/L, sin
evidencia de blastos en el líquido
cefalorraquídeo inicial y sin presentar en el análisis citogenético,
hipodiploidia o cualquiera de las siguientes translocaciones: 9:22, 1:19
y 4:11. Al final de la inducción, a
todos los pacientes se les determinó la enfermedad mínima residual
(EMR) por citometría de flujo, los
niños de riesgo habitual con EMR
positiva (>0.01%), fueron tratados
desde entonces con el protocolo
de riesgo alto.
Dos de las características más
importantes de este protocolo son
la administración de solo dos dosis
de antraciclinas (casi cinco meses
después del diagnóstico) en los ni-
S30
ños de riesgo habitual y la exclusión
de las dosis altas de metotrexato
(DAM) tanto en los niños de riesgo
alto como en los de riesgo habitual.
Desde febrero del 2010 y hasta
enero de este año han sido diagnosticados 107 pacientes, cinco
de ellos fueron excluidos por haber
sido trasladados a otro hospital
durante la inducción a la remisión.
Para el análisis se incluyeron 102
enfermos, 53 varones y 49 mujeres), con una mediana de edad de
5 años, la mediana de leucocitos
fue de 10 x 109/L. Al diagnóstico,
el 52% de los pacientes correspondían al riesgo alto, el 54% de ellos
tenía > 50 x 109/l leucocitos; seis
pacientes (6.1%) fallecieron durante
el primer mes de tratamiento. La
mediana de seguimiento fue de 16
meses (rango 0.2 – 45.8).
Al final de la inducción se
evaluaron 90 pacientes, el 25%
de los niños de riesgo habitual y
el 67% del grupo de riesgo alto
tuvieron una EMR positiva. Veintitrés pacientes recayeron con una
mediana de 10.7 meses. En relación
con la EMR, recayó el 35% de los
niños que tenían una EMR positiva
contra un 18% de los que la tenían negativa. Encontramos como
algo inusual, que el 47.8% de las
recaídas ocurrieron en el sistema
nervioso central (SNC) y 39.1%
en la médula ósea. El 57% de las
recaídas a médula ósea ocurrieron
en niños con EMR positiva contra
el 11% cuando la prueba fue negativa; sin embargo, con respecto
a la recaída en SNC, el 55.6% de
éstas ocurrieron en pacientes con
EMR negativa contra el 42.9% de
EMR positiva.
Dieciocho de los noventa
pacientes que fueron evaluados
fallecieron, 39% de ellos por sepsis,
33% por enfermedad refractaria y el
resto por otras causas.
La mediana de supervivencia
global (SG), no fue alcanzada. La
probabilidad de SG calculada por
el método de Kaplan-Meier fue de
73% a 36 meses; cuando se separó
por riesgo, los niños del grupo de
riesgo habitual tenían 81% contra
el 64% en aquellos de riesgo alto.
Esta diferencia fue más marcada y
estadísticamente significativa al separarlos de acuerdo a la EMR, aquí
fue del 89.8% con la prueba negativa y 66.1% para los que tenían
la EMR positiva. El mejor grupo de
enfermos corresponde por lo tanto
a aquellos niños de riesgo habitual
con EMR negativa, con una SG a
tres años del 87%, mientras que su
contraparte, aquellos en riesgo alto
y con EMR positiva es del 64.8%.
Por otro lado, la mediana de
supervivencia libre de recaída
(SLR), ocurrió a los 43.7 meses (IC
95%, 34.4-53), los pacientes de
riesgo habitual presentaron a los
36 meses una SLR de 73.9% y los
de riesgo alto de 40.2%. Igual que
en el caso de la SG, el factor más
importante fue la EMR, se estimó
en 73.4% para aquellos con EMR
negativa y 40.3% para los casos
con EMR positiva, sin embargo esta
diferencia no fue estadísticamente
significativa como si sucedió en la
SG. Con respecto a SLR, los mejores
casos, es decir, aquellos de riesgo
habitual y EMR negativa tuvieron
a los 3 años un 74.4 % y el grupo
más desfavorable, riesgo alto y EMR
positiva un 37.4 %.
Finalmente, la SG de los pacientes que sufrieron una recaída,
independientemente del riesgo, del
sitio y de la EMR, fue de 50.6% a
3 años contra el 87.7% de los que
no recayeron.
Nosotros observamos con la información obtenida tres situaciones
importantes, primera, el inusual
porcentaje de niños de riesgo alto
de acuerdo a los criterios aceptados, poco más de la mitad de los
pacientes de este grupo lo fueron
por la cifra de leucocitos al diagnóstico, pensamos que este dato
puede estar relacionado con un
Libro Educativo 55 Congreso Nacional de la Agrupación Mexicana para el Estudio de la Hematología, A.C.
retraso en el referimiento a nuestro
hospital por el médico de primer
contacto. Presentamos también en
este congreso los primeros datos
de una encuesta prospectiva realizada a los padres de los últimos
24 pacientes diagnosticados con
LLA, donde reportamos que la
mediana del tiempo transcurrido
desde los primeros síntomas hasta
el diagnóstico fue de 24 días y el 45
% de los enfermos acudieron más
de 30 días después de los primeros
síntomas, más de la mitad de los
casos habían sido valorados por dos
o más médicos.
Otra consideración tiene que
ver con el valor predictivo que
tuvo en este grupo de pacientes la
determinación de la EMR, valor que
ya ha sido demostrado en muchas
publicaciones, tal vez la mayor
trascendencia se muestre en el
pequeño grupo de niños de riesgo
habitual con una EMR positiva,
donde su identificación sería muy
importante para tomar la mejor
decisión terapéutica.
La exclusión de las DAM en
nuestro protocolo es la más importante diferencia al compararnos
con otros protocolos, por ejemplo
el del seguro popular que se utiliza
en nuestro país. Es probable que
la tasa alta de recaídas en el SNC
observada en nuestro grupo esté
relacionada al hecho de no aplicar
este esquema en nuestros pacientes. Para nosotros, logísticamente
resulta muy complicado administrar
este esquema de quimioterapia al
menos de la manera en la que más
se reporta su uso. Es conveniente
mencionar también que el concepto
de DAM es al menos, muy variable,
la dosis y el número de aplicaciones
del metotrexato, el tiempo de infusión, las horas transcurridas para el
inicio del rescate, la dosis y la vía
de administración del ácido folínico
son muy diversas, de tal suerte que
una tarea a desarrollar sería la de
determinar cuál de las diferentes
opciones debería ser la utilizada
de acuerdo a las características de
cada hospital.
Finalmente, podemos concluir
entonces que debe ser muy importante continuar insistiendo en
la comunidad médica, los que
podemos hacerlo en escuelas de
Medicina por ejemplo, en lo trascendente que resulta el sospechar
tempranamente el diagnóstico de la
enfermedad neoplásica más común
en niños. Creemos también que la
determinación de la EMR al final
de la inducción debe ser un estudio
que debe ser practicado de manera
rutinaria por el importante valor
pronóstico que igual que en nuestro
grupo ya ha sido establecido. En
cuanto a la administración de la
DAM en los protocolos de los niños
con LLA, la intención de cada uno
de los grupos tal vez debiera ser la
de documentar la mejor opción para
aplicarla de acuerdo a las características de cada uno de los hospitales
donde estos niños son atendidos.
Referencias
1.
2.
3.
4.
Figura 1. Supervivencia global de 90
pacientes de acuerdo a su enfermedad
mínima residual.
5.
6.
7.
Figura 2. Supervivencia libre de recaída
de 90 pacientes de acuerdo a su enfermedad mínima residual.
Hunger S, Sung L, Howard S.
Treatment Strategies and Regimens
of Graduated Intensity for Childhood
Acute Lymphoblastic Leukemia in
Low-Income Countries: A Proposal.
Pediatr Blood Cancer 2009;52:559565.
Kapoor G, Sinah R, Abedin S. Experience With High Dose Methrotexate
Therapy in Childhood Acute Lymphoblastic Leukemia in a Tertiary
Care Cancer Centre of a Developing Country. Pediatr Blood Cancer
2012;59:448-453.
Cohem IJ, Wolff JE. How Long Can
Folinic Acid Rescue Be Delayed After
High-Dose Methotrexate Without
Toxicity? Pediatr Blood Cancer
2014;61:7-10.
Graca M, Devesa S, Curtis R. Acute
leukemia incidence and patient survival among children and adults in
the united states, 2001-2007. Blood.
2012;119:34-43.
Moricke A, Reiter A, Zimmerman
M. Risk-adjusted therapy of acute
lymphoblastic leukemia can decrease treatment burden and improve
survival: treatment results of 2169
unselected pediatric and adolescent patients enrolled in the trial
ALL-BFM 95. Blood 2008;111:44774489.
Van der Valden VH, Boeck N, Van
Wering ER. Detection of minimal
residual disease in acute leukemia. J Biol Regul Homeost Agents.
2004;18:146-54.
Scrideli CA, Assumpcao JG, Ganazza
MA. A simplified minimal residual
disease polymerasa chain reaction
method at early treatment points
can stratify children with acute lymphoblastic leukemia into good and
poor outcome groups. Hematologica
2009;94:781-9.
S31
Volumen 15, Suplemento 1, 2014
Revista de Hematología
Resultados del tratamiento
de la leucemia linfoide aguda pediátrica en Cuba tras
10 años de aplicación del
protocolo ALLIC-BFM 2002
González-Otero
A 1,
Machín-García S 1 , FernándezNodarse R2, Cedré-Hernández T3,
Hernández JL 4, Pérez-García S 5,
Jaime-Fagundo JC 1, MenéndezVeitía A 1, Arencibia-Núñez A 1,
Gutiérrez-Díaz A1, Campos-Díaz
M 4, Martínez-Cárdenas L 3, Rosell E 2, Márquez-Hernández E 6,
Macías-Abraham C1, Marzán V1,
Amor-Vigil AM1, Labaut-Sánchez
K1, Guerchicov-de Svarch E1.
1
Instituto de Hematología e Inmunología, Habana, Cuba. 2Hospital
“Juan Manuel Márquez”, Habana,
Cuba. 3Hospital “José Luis Miranda”, Villa Clara, Cuba. 4Hospital
“Pepe Portilla”, Pinar del Río, Cuba.
5
Hospital “Paquito González”,
Cienfuegos, Cuba 6Hospital Pediátrico de Centro Habana, Habana,
Cuba.
otero@infomed.sld.cu
Introducción El protocolo ALLICBFM 2002 incluye más de 20
países en varios continentes y
toma en consideración las características clínicas, moleculares
y la respuesta terapéutica para
establecer los grupos de riesgo.
El tratamiento aplicado fue similar al esquema BFM 2000 sin
detección de enfermedad mínima
residual
Este trabajo presenta
los resultados tras 10 años de
aplicación.
Material y Métodos Se realizó
un estudio prospectivo, multicéntrico, que incluyó 251 niños con
leucemia linfoide aguda procedentes de cinco hospitales del
occidente y centro del país. Todos
los pacientes recibieron tratamiento
de acuerdo al protocolo ALLICBFM 2002 durante el período
comprendido entre enero de 2002
y diciembre de 2011. La mediana
S32
de tiempo de seguimiento de los
sobrevivientes fue 5,5 años (0,5 10,2 años); la edad fue 4,9 años;
y predominó el sexo masculino
(58,8 %).
Resultados y Discusión La leucemia de precursores B representó
el 81,1 % y la alteración molecular
más frecuente fue la TEL-AML1
(23,7 %). La remisión se alcanzó
en el 91 % de los enfermos, de
ellos 22 % presentó una recaída
(medular: 15,7 %; SNC: 5,2 %;
testicular: 3 %). La recaída ocurrió
antes de los 18 meses de iniciado el
tratamiento en 48,9 % de los casos.
Falleció el 27,5 % de los pacientes; 5,6 % durante la inducción;
5,2 % en primera remisión y 16,3
% en recaída. Al momento de la
evaluación el 67 % se encontraba
en remisión continua y 5,5 % en
segunda remisión. La sobrevida
global a los 5 y 10 años fue 71,9 %
y 66,6 % respectivamente; mientras
la sobrevida libre de eventos fue de
64,5 % y 63,3 %. La supervivencia
global a los 3 años de los pacientes en recaída fue de 26,2 %. La
supervivencia fue superior en los
pacientes con leucocitos menor
de 20 x 109/L; inmunofenotipo B;
ausencia de reordenamientos de los
genes BCR-ABL y MLL; y respuesta
favorable a la prednisona y al tratamiento de inducción. Los resultados
del tratamiento fueron comparables
a los obtenidos en el resto del grupo
y a lo descrito internacionalmente.
Se deben mejorar los resultados
durante la etapa de inducción y
tener alternativas para los pacientes
en recaída.
Linfoma no Hodgkin primario de sistema nervioso
central
Dr. Cesar Homero Gutiérrez Aguirre
Servicio de Hematología del Hospital Universitario “Dr. José Eleuterio
González” U.A.N.L., Monterrey,
N.L., México.
hematohu@yahoo.com
Introducción
El sistema nervioso central (SNC)
puede ser afectado por linfoma no
Hodgkin (LNH) de 2 formas, en
forma secundaria como involucro
del cerebro por enfermedad diseminada de otra parte del organismo o
en forma primaria sin evidencia de
enfermedad sistémica.
El linfoma no Hodgkin primario
del sistema nervioso central (LNHPSNC) fue descrito inicialmente por
Bailey en 1929 como sarcoma histiocítico del SNC y fue hasta 1974
cuando se describió el origen linfoide de esta neoplasia.1 Es un tumor
maligno potencialmente curable,
poco frecuente, que se caracteriza
por tener un curso clínico agresivo
y puede afectar cerebro, médula
espinal, meninges y ojos, representa
el 3% de todos los tumores de cerebro y el 2% de todos los casos de
LNH.2 Esta enfermedad se observa
más frecuentemente entre los 60 y
65 años de edad,3 aunque se puede
presentar en niños y adultos jóvenes
inmunocompetentes o inmunocomprometidos.4
Etiología e histología. Como
ocurre en el LNH que afecta otros
sitios del cuerpo, la etiología del
LNH-PSNC es desconocida, sin
embargo se han descrito como
principales factores de riesgo los
estados de inmunosupresión congénitos o adquiridos. El uso de
micofenolato mofetil en pacientes
que han recibido un trasplante de
riñón, pulmón, hígado o corazón
aumenta el riesgo de LNH-PSNC
entre 1% y 7%5. Una característica
importante es que la infección por
virus de Epstein Barr se observa
en prácticamente el 100% de los
casos de LNH-PSNC en pacientes
con SIDA en contraste con solo el
20% de los casos de LNH sistémico
en pacientes con SIDA.
La variedad histológica del
LNH-PSNC corresponde en 95%
de los casos a un LNH difuso de
células B grandes CD20+, MUM-
Libro Educativo 55 Congreso Nacional de la Agrupación Mexicana para el Estudio de la Hematología, A.C.
1positivo en 95%, BCL-6 en 80%
y CD 10 en 10% de los casos. Este
linfoma ha sido reconocido por la
OMS como un subtipo histológico
único debido a las características
genéticas y terapéuticas del tumor.6 Otras variedades histológicas
menos frecuentes que se pueden
presentar como linfoma primario
de SNC son el linfoma de células
T, linfoma linfoblástico, linfoma de
la zona marginal, Burkitt, linfocítico
de células pequeñas e incluso el
linfoma de Hodgkin.3
Manifestaciones clínicas. Las
manifestaciones clínicas del LNHPSNC dependen del sitio anatómico
afectado, lo más común es que se
observe una tumoración única periventricular o en los ganglios basales
en 60% de los casos.7 En pacientes
inmunocomprometidos se pueden
observar varias tumoraciones al
momento del diagnóstico.1 Los síntomas más comunes son disfunción
cognitiva, cambios de personalidad,
desorientación, cefalea, letargo,
confusión, hemiparesia o síntomas
de focalización. Otras manifestaciones clínicas menos frecuentes
incluyen crisis convulsivas en 20%
de los casos, disfunción de pares
craneales y síntomas oculares. Los
ojos son afectados solo en el 10%
de los casos de LNH-PSNC, generalmente se manifiesta como visión
borrosa, dolor ocular, fotofobia y
cuerpos extraños en el campo visual. La afección a médula espinal
es poco frecuente.
Diagnóstico. Como ocurre en
otras presentaciones del LNH, las
células del LNH-PSNC son altamente sensibles a esteroides por
lo que estos deberán ser evitados
en pacientes en los que se sospecha esta neoplasia hasta tener
un diagnóstico histológico, con
excepción de aquellos pacientes
con hipertensión intracraneal en
donde a juicio del médico sea
urgente iniciar tratamiento. El
diagnóstico temprano favorecerá
el pronóstico general del paciente,
esto es importante ya que algunos
estudios han encontrado que el
diagnóstico puede retrasarse incluso hasta 3 meses después de que
iniciaron los primeros síntomas1. La
evaluación inicial del paciente con
diagnóstico probable de LNH-PSNC
debe incluir una revisión clínica
completa con exploración oftalmológica, estudios de imagen como
resonancia magnética de cerebro
contrastada con gadolinio, TAC
de tórax, abdomen y pelvis, eco
testicular y estudios de laboratorio
como análisis citológico de líquido
cefalorraquídeo, serología para HIV,
hepatitis B y C, deshidrogenasa
láctica, función renal y hepática y
aspirado de médula ósea.
La resonancia magnética con o
sin gadolinio es el estudio de imagen más útil. En 60% de los casos
la resonancia demuestra una lesión
única homogéneamente isointensa
o hipointensa en T1 e hiperintensa
en T2, de bordes bien definidos o
irregulares acompañada en el 90%
de los casos de edema a su alrededor. La tumoración capta de manera
homogénea el gadolinio administrado en forma intravenosa. Desde
el punto de vista radiológico no es
posible distinguir el LNH-PSNC
de otros procesos neoplásicos o
infecciosos que afectan el cerebro.
Finalmente el diagnóstico histológico se establece mediante
una biopsia estereotáxica que se
considera el procedimiento diagnóstico de elección. Con la biopsia
estereotáxica se obtiene el diagnostico hasta en 90% de los casos
generalmente sin complicaciones.1
Una vez obtenido la biopsia
es importante realizar el análisis
morfológico e inmunofenotipo
del tumor. Microscópicamente el
LNH-PSNC se caracteriza por crecimiento angiocéntrico, difuso de
células grandes con escaso citoplasma basófilo, núcleo con cromatina
fina y varios nucléolos prominentes.
El inmunofenotipo se caracteriza
por la expresión de marcadores de
células B maduras (CD19, CD20,
CD79a, PAX5). En la mayoría de los
casos las células tumorales también
expresan BCL6, MUM1 y con menor frecuencia CD10.
El análisis del líquido cefalorraquídeo (LCR) idealmente debe ser
incluido en la evaluación general
del paciente con LNH-PSNC, a
menos de que este contraindicada
la punción lumbar debido a hipertensión intracraneal. El análisis de
LCR debe incluir la concentración
de proteínas y glucosa, conteo celular, citología, citometría de flujo y
en algunos casos la cuantificación
de cadenas ligeras libres kappa o
lambda.
El análisis citológico e inmunofenotipo por citometría de
flujo (CD20, CD10, BCL6, MUM1
y MIB1) de las células obtenidas
del LCR son útiles para determinar
si hay involucro de leptomeninges,
sin embargo esto no substituye la
biopsia de la tumoración en el diagnóstico de LNH-PSNC. De hecho
aun utilizando citometría de flujo,
solo en el 24% de los pacientes se
pueden identificar las células neoplásicas en LCR.8
En el diagnóstico diferencial
se incluyen patologías benignas
y malignas como el involucro
secundario del SNC por linfoma,
tumores neuroepiteliales como
glioma y glioblastoma multiforme,
carcinoma metastásico, procesos
autoinmunes como la esclerosis
múltiple, vasculitis y procesos infecciosos como la toxoplasmosis
entre otros.
Factores pronósticos. El LNHPSNC es clasificado como estadio
IE de acuerdo a la escala de AnnArbor, sin embargo para estimar el
pronóstico del paciente se utiliza
la escala descrita por el Grupo
Internacional para el Estudio del
Linfoma Extranodal que incluye
5 parámetros de mal pronóstico:
S33
Volumen 15, Suplemento 1, 2014
Revista de Hematología
edad mayor de 60 años, ECOG
mayor de 1, deshidrogenasa láctica
elevada, proteínas elevadas en LCR
y localización del tumor en áreas
profundas del cerebro (periventricular, ganglios basales, cerebelo o
tallo cerebral). La supervivencia a
2 años es de 80% para pacientes
con 0 a 1 factor de riesgo, 48%
para pacientes con 2 a 3 factores
y 15% para pacientes con 4 a 5
factores.9 Otra escala pronostica
es la desarrollada en base a un
estudio realizado en el Memorial
Sloan-Kettering Cancer Center, en
donde se observó que 2 variables,
la edad y el estado funcional (Karnofsky) influyen en el pronóstico
del paciente, clasificando a los
pacientes en clase 1 (< 50 años),
clase 2 ( ≥50 años, Karnofsky ≥ 70)
y clase 3 ( ≥50 años, Karnofsky ≤
70) con una mediana de supervivencia general en años de 8.5, 3.2
y 1.1 respectivamente.10
Tratamiento. Uno de los principales problemas en el tratamiento
del LNH-PSNC es sin duda la barrera hematoencefálica que impide
el libre paso de los medicamentos
administrados de manera sistémica
hacia la tumoración. Algunas de las
características de los medicamentos que permiten su paso por esta
barrera son el peso molecular, su
lipofilia y falta de ionización. Los
medicamentos que tienen actividad
contra las células neoplásicas del
LNH-PSNC los podemos dividir en
3 grupos de acuerdo a su capacidad
de penetrar la barrera hematoencefalica: 1) medicamentos que
tienen poca penetración a cerebro
pero que pueden administrarse
a dosis mayores para lograr una
concentración adecuada en el
tumor cerebral como la citarabina
y el metotrexate, 2) medicamentos
que tienen poca penetración a
cerebro y que no pueden administrarse a dosis elevadas debido a su
toxicidad como las antraciclinas,
agentes alquilantes y alcaloides de
S34
la vinca y 3) medicamentos que
tienen penetración adecuada a
cerebro y pueden alcanzar niveles
terapéuticos adecuados en el tumor
como ifosfamida, temosolamida y
nitrosoureas.3 Debido a esta barrera, a lo largo de la historia se han
utilizado diferentes modalidades
terapéuticas, incluyendo resección
quirúrgica, radioterapia, quimioterapia con diferentes combinaciones
de medicamentos, quimioterapia
intratecal y trasplante de células
hematopoyéticas. En la actualidad
el tratamiento de elección del LNHPSNC es la quimioterapia sistémica
combinada o no con radioterapia o
quimioterapia intratecal.
Resección quirúrgica. Tradicionalmente la opinión general ha sido
que la resección quirúrgica no es
el tratamiento de elección para el
LNH-PSNC ya que no aumenta la
supervivencia debido a la naturaleza infiltrativa del tumor, además
cuando se localiza en regiones
anatómicas profundas del cerebro,
el procedimiento quirúrgico puede
dejar secuelas neurológicas irreversibles. Sin embargo un estudio
realizado por el GPSG-1 (German
PCNSL Study Group-1) analizó de
manera retrospectiva el beneficio
de la cirugía en 526 pacientes con
LNH-PSNC tratados con dosis altas
de metotrexate, 411 de esos pacientes recibieron además radioterapia
cerebral total. El procedimiento
quirúrgico había sido realizado
para biopsia diagnóstica en 379
pacientes, resección subtotal en
70, resección total en 67 y desconocido en 10 pacientes. El estudio
encontró que los pacientes que
fueron solo biopsiados tuvieron
una supervivencia menor que los
que pacientes con resección parcial
o total del tumor11 (18 meses vs
32 meses). De cualquier forma, el
paciente siempre debe ser evaluado
en forma individual y el tratamiento
quirúrgico se reserva para casos
seleccionados con enfermedad deli-
mitada, superficial y con importante
efecto de masa intracraneal.
Radioterapia. La radiación
cerebral total o parcial como monoterapia fue el tratamiento de elección
para pacientes con LNH-PSNC
por mucho tiempo, sin embargo
debido a la pobre supervivencia
que se logra y alto índice de recaídas esta modalidad terapéutica ha
sido paulatinamente reemplazada
por esquemas de quimioterapia
combinada. Los efectos tardíos de
la radiación cerebral total pueden
dejar secuelas que afectan el estado
funcional y cognitivo además de la
calidad de vida de los pacientes.
La neurotoxicidad relacionada a
radiación cerebral total se observa
en prácticamente todos los pacientes
mayores de 60 años y hasta en 63%
de los pacientes menores de 60 años.
En un estudio de 80 pacientes con
LNH-PSNC tratados con quimioterapia basada en metotrexate se
comparó la neurotoxicidad en los
pacientes que recibieron consolidación con radiación total de cerebro
contra los que no la recibieron, se incluyeron solo pacientes que lograron
remisión y tenían una supervivencia
de al menos 2 años. En este estudio
se observó que los pacientes que
recibieron radiación tenían más alteraciones funcionales en la atención,
habilidades motoras y desempeño
neurosicológico que aquellos tratados sin radiación, concluyendo que
el uso de radiación incrementa el
riesgo de neurotoxicidad.12 Por otra
parte, es controversial si el uso de
dosis reducidas de radiación cerebral
tienen también efectos neurotóxicos13 aunque esto se ha relacionado
con alto índice de recaídas.
En la actualidad el uso de radioterapia como monoterapia se limita
más a pacientes que no pueden
recibir quimioterapia sistémica debido a enfermedades coexistentes
o mal estado físico3 o que tienen
mala respuesta por enfermedad
quimioresistente.
Libro Educativo 55 Congreso Nacional de la Agrupación Mexicana para el Estudio de la Hematología, A.C.
Quimioterapia. La quimioterapia es actualmente el tratamiento
de elección para LNH-PSNC, principalmente aquellos esquemas que
incluyen dosis altas de metotrexate,
ya que esta neoplasia es altamente
sensible a metotrexate, incluso más
sensible que el LNH ganglionar de
la misma histología.6 El metotrexate
se ha administrado solo o combinado con otros medicamentos o
radiación, en dosis que varía de
1gr/m2 hasta 8 g/m2 ya que no existe
una dosis terapéutica bien definida,
sin embargo algunos autores han
encontrado que con dosis ≥1 g/m2
es suficiente para alcanzar niveles
citotóxicos de metotrexate en el
parénquima cerebral. 2,14 Generalmente durante la inducción se
administran 4 a 8 ciclos de dosis
altas de metotrexate de acuerdo al
esquema que se esté utilizando y
a la respuesta observada. En estos
pacientes es importante vigilar
estrechamente la función renal,
antes de administrar cada ciclo
de metotrexate el paciente debe
ser hidratado y evitar la combinación de sustancias nefrotóxicas
incluyendo medicamentos y el
medio de contraste intravenoso
utilizado en estudios de imagen,
además no se debe olvidar utilizar
el rescate con leucovorin a las 24
hrs de administrado el metotrexate. En un estudio donde se utilizó
metotrexate como monoterapia se
logró remisión completa en 52%
de los pacientes que recibieron
inducción con metotrexate 8g/m2
cada 15 días con un máximo de 8
ciclos.15 Sin embargo debido a que
la supervivencia libre de enfermedad utilizando metotrexate como
monoterapia en muchos pacientes
no es mayor de 12 meses, se desarrollaron esquemas combinados de
quimioterapia con el objetivo de
curar o prolongar la remisión. Un
estudio publicado por DeAngelis
en el 2002 fue pionero en analizar
un esquema terapéutico combina-
do de dosis altas de metotrexate (5
ciclos quincenales de 2.5 gr/m2)
con vincristina y procarbacina (100
mg/m2/d/7días) en la inducción y
radioterapia cerebral total (45 Gy)
seguida de dosis altas de citarabina
(3 gr/m2/d/2 días) en la consolidación logrando una respuesta de
94% y mediana de supervivencia
libre de enfermedad de 24 meses.16
Debido a estos resultados, el esquema de DeAngelis ha sido uno de
los más utilizados en el tratamiento
del LNH-PSNC. En la actualidad,
tratando de evitar la neurotoxicidad
de la radiación cerebral, se han
desarrollado diferentes esquemas
de quimioterapia combinados sin
radiación. Rubenstein y colaboradores publicaron los resultados
del estudio CALGB 50202 de quimioterapia sin radiación en 44
pacientes con diagnóstico reciente
de LNH-PSNC17. En el estudio los
autores utilizaron un esquema
de inducción con metotrexate,
rituximab y temozolamida con respuesta completa del 66% seguido
de consolidación con etopósido y
citarabina con supervivencia libre
de enfermedad a 2 años de 57%.
Estos resultados son comparables
con estudios previos en donde se
utilizó radiación cerebral.
Quimioterapia intratecal. La
administración de metotrexate
intratecal en el tratamiento del
LNH-PSNC es controversial. La infiltración meníngea por LNH-PSNC
ocurre en el 37% de los pacientes,
funcionando como un santuario
para las células tumorales, lo que
incrementa el riesgo de recaída.
Cuando se administra metotrexate
intravenoso, la concentración entre
plasma y LCR es de 100:1. La vida
media del metotrexate es diferente cuando se administra por vía
intravenosa (4 horas) que cuando
se administra por vía intratecal
(48 horas). Sin embargo a pesar de
todo esto, los estudios realizados
comparando el tratamiento con y
sin quimioterapia intratecal no han
encontrado beneficio de su administración. Las guías de tratamiento
actuales no recomiendan la quimioterapia intratecal como parte del
tratamiento del LNH-PSNC aunque
algunos médicos la utilizan cuando
la citología del LCR es positiva para
LNH-PSNC.3
Rituximab. El Rituximab es
un anticuerpo monoclonal IgG,
quimérico murino/humano con
actividad anti-CD20 cuyo uso ha
sido aprobado para el tratamiento
de varios subtipos de LNH. Estudios
previos han demostrado mejoría en
la supervivencia de pacientes con
LNH de células B grandes sistémico
cuando este anticuerpo se combinó
con CHOP pero sin disminuir la
incidencia de recaídas en SNC,
probablemente debido a que menos
del 1% del rituximab administrado
por vía intravenosa penetra a cerebro. Sin embargo se ha observado
que el rituximab intravenoso si
presenta actividad antitumoral en
las lesiones cerebrales ya existentes
de LNH probablemente debido a
alteración de la barrera hematoencefálica. Un estudio demostró que
la administración intraventricular
de 10 a 25 mg de rituximab es bien
tolerada y presenta respuesta adecuada cuando hay infiltración en
LCR, compartimentos intraoculares
y en pequeñas lesiones del cerebro
presentando además efecto sinérgico al combinarlo con metotrexate.
Este procedimiento terapéutico ha
sido recomendado principalmente
para pacientes con enfermedad
meníngea manifestada con más de
20,000 células/mL de LCR.2
Un estudio multicéntrico que
incluyó 52 pacientes con LNHPSNC demostró remisión completa
en 60% de los pacientes y supervivencia libre de enfermedad de 77%
al utilizar 5 a 7 ciclos de R-MPV
(Rituximab 500 mg/m2, Metotrexate 3.5 g/m 2, Vincristina 1.4 mg/
m2, procarbacina 100 mg/m2/d),
S35
Volumen 15, Suplemento 1, 2014
Revista de Hematología
como consolidación utilizaron
radiación cerebral total (Pacientes
en remisión: 23.4 Gy, Pacientes sin
remisión: 45 Gy) y posteriormente
2 ciclos de dosis altas de citarabina
(3 g/m2/d/2 días). Actualmente el
grupo RTOG conduce un estudio
(RTOG 1114) comparando R-MPV
con y sin dosis reducida de radiación cerebral.18
En conclusión, aun no se encuentra bien definida la utilidad
del rituximab administrado por vía
intravenosa o intratecal en el tratamiento de LNH-PSNC por lo que se
requiere de más ensayos clínicos.
Trasplante autólogo de células
hematopoyéticas. Existen poca
información sobre la utilidad del
trasplante autólogo en el tratamiento de LNH-PSNC ya que la
mayoría de los estudios publicados
son no randomizados. El principio
del autotrasplante es el mismo que
en otras enfermedades, administrar dosis altas de quimioterapia
para alcanzar niveles terapéuticos
en el tejido tumoral. Esta opción
terapéutica ha sido utilizada como
consolidación después de un esquema de inducción con dosis
altas de metotrexate o bien como
tratamiento de rescate en pacientes
con recaída o enfermedad refractaria. El esquema de consolidación
con BEAM (carmustina, etopósido,
citarabina y melfalan) seguido de
autotrasplante ha sido poco efectivo
ya que estas drogas tienen poca
penetración a SNC. Los mejores
resultados se han obtenido al utilizar esquemas de consolidación,
y recate con autotrasplante, que
incluyen ciclofosfamida, carmustina, tiotepa, etopósido, citarabina
y busulfan, con supervivencia a 3
años de 50 a 77%.
Tratamiento de recaída. En
los meses siguientes al término
de su tratamiento entre un 30%
y un 50% de los pacientes con
LNH-PSNC presentan recaída. Sin
tratamiento estos pacientes tienen
S36
una supervivencia de solo 2 meses
y con tratamiento la mediana de
supervivencia se eleva a 14 meses.
Los pacientes que la primera vez
respondieron adecuadamente a
dosis altas de metotrexate pueden
responder hasta en 90% de los
casos al mismo esquema de quimioterapia. Existen múltiples esquemas
empleados en ensayos clínicos
que incluyen medicamentos como
temozolamida, VP16, Ifosfamida,
Citarabina, rituximab, radioterapia,
etc, sin embargo la supervivencia
libre de enfermedad en muchos
de estos pacientes generalmente es
solo de 2 a 10 meses.
Conclusión. El LNH-PSNC es
una neoplasia maligna que tiene
un curso clínico agresivo pero es
potencialmente curable. Actualmente el tratamiento estándar es
la administración de dosis altas de
metotrexate con o sin radioterapia
cerebral. Con los esquemas actuales de quimioterapia se logra una
supervivencia del 40% al 50% y
muchos de estos pacientes estarán
curados de su enfermedad, por lo
que es importante definir cuál es
el tratamiento más efectivo y menos neurotóxico con la finalidad
de disminuir las secuelas a largo
plazo. Se requieren estudios randomizados para evaluar el papel
de la quimioterapia intratecal,
el trasplante autólogo de células
hematopoyéticas y otras alternativas terapéuticas como el uso de
rituximab, sin embargo el número
reducido de pacientes con esta patología dificulta desarrollar grandes
estudios.
Referencias
1.
2.
Baraniskin A, Deckert M, Schulte-Altedorneburg G, Schlegel U, Schroers
R. Current strategies in the diagnosis
of diffuse large B-cell lymphoma of
the central nervous system. Brit J
Haematology. 2011;156:421–432.
Rubenstein JL, Gupta NK, Mannis
GN, LaMarre AK, Treseler P. How I
treat CNS lymphomas. Blood. 2013;
122:2318-2330.
3.
4.
5.
6.
7.
8.
9.
10.
11.
12.
13.
Prodduturi P, Bierman PJ. Current
and Emerging Pharmacotherapies
for Primary CNS Lymphoma. Clinical Medicine Insights: Oncology.
2012;6:219–231.
Yoon JH, Kang HJ, Hyery K et al.
Successful Treatment of Primary
Central Nervous System Lymphoma
without Irradiation in Children: Single
Center Experience. J Korean Med Sci
2012;27:1378-1384.
Schabet M. Epidemiology of primary CNS lymphoma. J Neurooncol.
1999;4:199-201.
Ponzoni M, Issa S, Batchelor TT,
Rubenstein JL. Beyond high-dose
methotrexate and brain radiotherapy: novel targets and agents for
primary CNS lymphoma. Annals of
Oncology. 2013;0:1–7.
Deckert M, Brunn A, MontesinosRongen M, Terreni MR, Ponzoni M.
Primary lymphoma of the central
nervous system—a diagnostic challenge. Hematol Oncol. 2013;doi:
10.1002/hon.2087.
Schroers R, Baraniskin A, Heute C
et al. Diagnosis of leptomeningeal
disease in diffuse large B-cell lymphomas of the central nervous system by
flow cytometry and cytopathology.
Eur J Haematol. 2010;85:520-528.
Ferreri A, Blay JY, Reni M et al. Prognostic Scoring System for Primary
CNS Lymphomas: The International
Extranodal Lymphoma Study Group
Experience. J Clin Oncol. 2003;
21:266-272.
Abrey LE, Ben-Porat L, Panageas KS et
al. Primary Central Nervous System
Lymphoma: The Memorial SloanKettering Cancer Center Prognostic
Model. J Clin Oncol. 2006;24:57115715.
Weller M, Martus P, Roth P, Thiel E,
Korfel A. Surgery for primary CNS
lymphoma? Challenging a paradigm.
Neuro-Oncology. 2012;14:1481–
1484.
Doolittle ND, Korfel A, Lubow MA
et al. Long-term cognitive function,
neuroimaging, and quality of life in
primary CNS lymphoma. Neurology.
2013;81:84-92.
Batchelor TT. Flying Solo: Chemotherapy Without Radiation for Primary CNS Lymphoma. J Clin Oncol.
2013;31:3051-3053.
Libro Educativo 55 Congreso Nacional de la Agrupación Mexicana para el Estudio de la Hematología, A.C.
14. Skarin AT, Zuckerman KS, Pitman
SW, et al. High-dose methotrexate
with folinic acid in the treatment of
advanced non-Hodgkin lymphoma
including CNS involvement. Blood.
1977;50(6): 1039-1047.
15. Gerstner ER, Carson KA, Grossman
SA, Batchelor TT. Long-Term Outcome in PCNSL Patients Treated
With High-Dose Methotrexate and
Deferred Radiation. Neurology.
2008;70:401-2.
16. DeAngelis LM, Seiferheld W, Schold
SC, Fisher B, Schultz CJ. Combination
Chemotherapy and Radiotherapy
for Primary Central Nervous System
Lymphoma: Radiation Therapy Oncology Group Study 93-10. J Clin Oncol.
2002;20:4643-4648.
17. Rubenstein JL, His ED, Johnson JL et
al. Intensive Chemotherapy and Immunotherapy in Patients With Newly
Diagnosed Primary CNS Lymphoma:
CALGB 50202 (Alliance 50202). J Clin
Oncol. 2013;31:3061-8.
18. Morris P., Correa D., Yahalom J, et
al. Rituximab, Methotrexate, Procarbazine, and Vincristine Followed
by Consolidation Reduced-Dose
Whole-Brain Radiotherapy and Cytarabine in Newly Diagnosed Primary
CNS Lymphoma: Final Results and
Long-Term Outcome. J Clin Oncol.
2013;31:3971-9.
Papel del ruxolitinib en pacientes con mielofibrosis
primaria: presente y perspectivas futuras
Dra. Patricia Guzmán Uribe
Clínica de Neoplasias Mieloproliferativas Crónicas, Departamento de
Hematología y Oncología, Instituto
Nacional de Ciencias Médicas y
Nutrición Salvador Zubirán (INMCMNSZ), México, DF.
pgu29@hotmail.com
RESUMEN. El descubrimiento de
la mutación JAK2V617F en 2005
y su asociación con las neoplasias
mieloproliferativas ha impulsado
el desarrollo de nuevas estrategias
de tratamiento que incluyen a los
inhibidores de JAK. Un mayor
entendimiento de la fisiopatología
de la mielofibrosis ha demostrado
que una gran variedad de proteínas reguladoras (diferentes a JAK)
participan también en la génesis de
estas neoplasias. Ruxolitinib, el primer inhibidor de JAK1/2 aprobado
por la FDA y actualmente disponible para su uso clínico, es efectivo
en la reducción de la esplenomegalia, mejoría de los síntomas y
calidad de vida, con un perfil de
toxicidad aceptable. Asimismo, se
empieza a dilucidar una ventaja en
la supervivencia de los pacientes
tratados con ruxolitinib, resultados
que habrán de ser confirmados
con un seguimiento más largo. Sin
embargo, la mielofibrosis continúa
siendo a la fecha una enfermedad
incurable para aquellos pacientes
no candidatos a trasplante, por lo
que el uso de combinaciones con
fármacos que poseen mecanismos
de acción diferentes parece prometedor.
ABSTRACT. The discovery of
the JAK2V617F mutation in 2005
and its association with myeloproliferative neoplasms has prompted
the development of new treatment
strategies that include JAK inhibitors. A better understanding of the
pathophysiology of myelofibrosis
has shown that a variety of regulatory proteins (other than JAK)
are also involved in the genesis of
these neoplasms. Ruxolitinib, the
first FDA approved JAK1/2 inhibitor
currently available for clinical use,
it´s effective in reducing splenomegaly, improving symptoms and
quality of life with an acceptable
toxicity profile. Also, an advantage
in survival for these patients seems
to be related to the use of the JAK
inhibitor. However, results must be
confirmed with a longer follow-up.
To date, myelofibrosis remains an
incurable disease for non transplant
eligible patients, so the use of drug
combinations that have different
mechanisms of action seems promising.
INTRODUCCIÓN. Desde el
descubrimiento del gen de fusión
BCR-ABL1 en LGC (Bartram et
al, 1983), se han identificado
múltiples tirosin cinasas con potencial oncogénico de interés para
una gran variedad de neoplasias
hematológicas con componente
mieloproliferativo (FIP1L1-PDGFRa, KIT-D816V, etc).1
En las neoplasias mieloproliferativas (NMP) clásicas BCR-ABL1
negativas (Policitemia Vera, Trombocitemia Esencial y Mielofibrosis
Primaria), el descubrimiento e identificación de la mutación de JAK2
V617F en 2005 como parte de
su patogénesis, desencadenó una
avalancha de estudios clínicos con
el objeto de esclarecer su participación en los eventos fisiopatogénicos
de tales enfermedades y a la vez
desarrollar nuevas moléculas dirigidas específicamente para inhibir
dicha mutación.
ALTERACIÓN DE LA VIA JAK/
STAT Y FAMILIA DE RECEPTORES
JAK. La familia de cinasas tipo Janus
(JAK) es de vital importancia para la
señalización de diversos factores de
crecimiento y citocinas (Eritropoyetina, Factor estimulante de colonias
de granulocitos, trombopoyetina,
IL-3, IL-5)2 Dicha señalización se
lleva a cabo a través de la vía STAT
(signal transducers and activators
of transcription) que incluye varios
factores de transcripción que cuando
son fosforilados por las cinasas tipo
JAK, regulan la expresión de genes
involucrados en la proliferación,
apoptosis, migración, diferenciación,
así como la producción de proteínas
angiogénicas e inflamatorias.1
Cada miembro de la familia JAK
desempeña funciones específicas,
sin embargo, es de hacer notar
que existe cierta actividad cruzada
entre ellas. En 2005, diversos grupos identificaron una mutación
somática altamente recurrente en
pacientes con NMP, que afectaba
el dominio pseudoquinasa del gen
S37
Volumen 15, Suplemento 1, 2014
Revista de Hematología
JAK2, específicamente en la posición 617 (V617F), ocasionando
un incremento en la proliferación
y/o disminución en la apoptosis de
células neoplásicas de forma independiente a la unión del ligando
con su receptor.3-5
En Mielofibrosis primaria (MFP),
la frecuencia de la mutación se
ha reportado hasta en 60% de los
pacientes,6 y aunque en modelos
murinos la mutación V617F es suficiente para reproducir un fenotipo
mieloproliferativo, in vivo esto no
es completamente cierto. Se sabe
que otras alteraciones moleculares
(W515 L/K de MPL, LNK o CBL) que
participan en la vía STAT pueden
contribuir al desarrollo y progresión de este tipo de neoplasias,7-9
lo cual sugiere que la inhibición
exclusiva de JAK es insuficiente
para modificar la historia natural
de la enfermedad y eventualmente
producir su curación.1
CONSIDERACIONES PRE-TRATAMIENTO EN MIELOFIBROSIS
PRIMARIA. Dentro de las NMP,
la MFP se caracteriza por la participación de diversas citocinas
(IL-6, TGF-B, TNF-a, VEGF, etc)
que favorecen el estado inflamatorio, el desarrollo de fibrosis y
son responsables de los síntomas
clásicos (fiebre, pérdida de peso,
diaforesis nocturna) y caquexia.
La producción de tales citocinas
está ligada a diversas vías de señalización, incluidas JAK1 y JAK210,11
por lo que el uso de fármacos que
inhiban la cascada inflamatoria,
especialmente en las células neoplásicas que albergan la mutación
V617F ha sido objeto de múltiples
estudios clínicos.
En MFP, la decisión acerca de
cuándo y qué tratamiento iniciar depende de la evaluación cuidadosa
de diversos factores: establecimiento del riesgo (D-IPSS-P), edad,
desempeño físico, comorbilidades,
tipo de sintomatología presente (síntomas B, esplenomegalia,
S38
citopenias), meta de tratamiento
(paliativo vs curativo) y perfil de
seguridad de las estrategias disponibles.12 La posibilidad de cura en
pacientes con mielofibrosis sigue
estando limitada a un pequeño grupo que se considera candidato a un
trasplante alogénico de progenitores
hematopoyéticos, especialmente si
son catalogados con un riesgo
intermedio-2 o alto.1 Cuando los
síntomas constitucionales son la
principal queja del paciente, los
tratamientos convencionales incluyen el uso de hidroxiurea, agentes
inmunomoduladores, por mencionar algunos, con efectos marginales
y transitorios.
INHIBIDORES DE JAK DE USO
CLÍNICO Y EN DESARROLLO.
Debido al alto número de pacientes
que no son candidatos a trasplante
alogénico y que permanecen sintomáticos a pesar de los tratamientos
convencionales, se abrió un espacio
de oportunidad para el desarrollo
de nuevos tratamientos con mayor
eficacia y que fueran dirigidos
contra las principales vías presuntamente implicadas en la génesis
de la enfermedad, específicamente
inhibidores de la vía JAK-STAT.10
(Tabla 1)
Sin embargo, a pesar del entusiasmo inicial, es importante
mencionar que la evidencia más
reciente sugiere que aunque las
mutaciones de JAK2 en conjunto
con otras anormalidades epigenéticas pueden contribuir al inicio
y progresión de las NMP, ninguna
de ellas por si misma puede ser
considerada como el evento causal.
RUXOLITINIB (INCB018424)
Descripción general y efectos
clínicos. Es el primer inhibidor de
JAK2 aprobado por la FDA para el
tratamiento de la mielofibrosis. Se
considera un inhibidor potente y
selectivo contra JAK1 y JAK2, con
excelente biodisponibilidad vía
oral y que ha sido extensamente
probado en estudios clínicos fase III.
Los estudios pivote que han
dilucidado la efectividad y los
efectos adversos de ruxolitinib son
el estudio COMFORT-I (Controlled
Myelofibrosis Study with oral JAK
inhibitor treatment) que fue diseñado para evaluar la actividad de
ruxolitinib a dosis de 15 o 20 mg
dos veces al día en 309 pacientes
con MFP o post-PV o TE,13 mientras
que el estudio COMFORT-II comparó la actividad de ruxolitinib en 219
pacientes con MF tanto primaria
como post-PV o TE contra la mejor
terapia disponible.14
La proporción de pacientes con
al menos una reducción del 35% en
el volumen esplénico detectado por
imagen a la semana 24 en el estudio
COMFORT-I fue de 41.9% en el
brazo de ruxolitinib vs 0.7% en el
grupo placebo, mientras que a la semana 48 en el estudio COMFORT-II
fue de 28% vs 0% en el grupo con
la mejor terapia disponible.
En relación al control de los
síntomas, de acuerdo la escala
de evaluación de los síntomas en
MF (MFSAF)15 o en el caso de los
estudios COMFORT mediante la
escala total de síntomas (TSS, una
versión modificada del MFSAF) fue
posible determinar la reducción y
en algunos casos la desaparición
completa de los síntomas comúnmente asociados a la enfermedad.
En el COMFORT-I 45.9% de los
pacientes en el brazo de ruxolitinib
reportaron una reducción ≥50%
en la TSS a la semana 24 de seguimiento, comparados con sólo 5.3%
en el grupo placebo (p<0.001)13.
Es interesante mencionar que el
grado de reducción en el volumen
esplénico correlacionó con la
mejoría de los síntomas evaluados
durante el estudio16 y mejor aún el
impacto positivo en la calidad de
vida se mantuvo a 96 semanas de
seguimiento.17
La magnitud de la reducción en
el tamaño del bazo y los cambios en
los síntomas reportados no fueron
Libro Educativo 55 Congreso Nacional de la Agrupación Mexicana para el Estudio de la Hematología, A.C.
Tabla 1. Descripción general de los inhibidores de JAK disponibles o en estudio clínico.
INHIBIDOR
ACTIVIDAD ANTI-JAK
OTROS BLANCOS
TERAPÉUTICOS
ESTADO ACTUAL
Ruxolitinib
(INCB018424)
JAK2, JAK1, JAK3
-
Uso clínico
COMFORT-I y II
Fedratinib (SAR302503)
JAK2, JAK1, JAK3
FLT3
JAKARTA (III), estudio Fase II, Fase I/II (escalamiento de dosis)
Momelotinib (CYT387)
Pacritinib (SB1518)
Lestaurtinib (CEP701)
JAK2, JAK1, JAK3
JAK2, JAK1, JAK3
JAK3, JAK2
JNK1, CDK2
FLT3
FLT3
Fase III vs Ruxolitinib
Fase III (PERSIST-1, PERSIST-2)
Fase I/II
diferentes entre los pacientes con
y sin la mutación JAK2V617F.13,14
Eventos adversos. En relación
a los eventos adversos, la anemia
y trombocitopenia se consideran
efectos “esperados” de las terapias
dirigidas a inhibir JAK2, debido a la
dependencia tanto del receptor de
eritropoyetina como de trombopoyetina hacia la vía de JAK2.
En el estudio COMFORT-I los
eventos adversos más comunes
de cualquier grado observados
en >20% de los pacientes fueron
trombocitopenia grado 3/4 (12.9%
vs 1.3%), fatiga (25.2% vs 33.8%),
anemia grado 3/4 (45.2% vs 19.2%),
diarrea (23.2% vs 21.2%) y edema
periférico (18.7% vs 22.5%). De forma relevante, tanto la anemia como
la trombocitopenia fueron manejables y rara vez se asociaron con la
suspensión definitiva del fármaco
(11% en el grupo de ruxolitinib vs
10.6% en el grupo con placebo).13
En el estudio COMFORT-II el
evento adverso no hematológico
de cualquier grado más frecuentemente reportado en el brazo con
ruxolitinib fue diarrea (24% vs
11%), mientras que la anemia y
trombocitopenia se presentaron de
forma más frecuente en el grupo de
ruxolitinib comparado con la mejor
terapia disponible.14
En ambos estudios, la toxicidad hematológica se manejó con
reducción de la dosis, suspensión
temporal del medicamento y transfusiones de paquetes globulares en
los casos severos. (Tabla 2)
De forma interesante, otros
eventos adversos que han llamado
la atención han sido las infecciones,
particularmente las ocasionadas
por herpes virus y micobacterias,
que aunque poco frecuentes, por
lo general llevan a la suspensión
temporal del fármaco y la implementación oportuna del tratamiento
apropiado. (Tabla 3)
Posología. De la información
obtenida con los estudios previos, ahora se sabe que la dosis
recomendada para el inicio de la
terapia con ruxolitinib depende
de la cuenta plaquetaria, y se ha
establecido que aquellos pacientes con cuentas > 200,000/mm3
pueden iniciar con 20mg dos
veces al día, para aquellos con
cuentas entre 100,000 - 200,000/
mm 3 la dosis es de 15mg dos
veces al día y para pacientes con
cuentas plaquetarias entre 50,000
a 100,000/mm3 la dosis no debe
exceder de 5mg cada 12 horas.
Asimismo, se recomienda realizar
estudios de control (que incluya
una biometría hemática con diferencial) cada 2 a 4 semanas hasta
que se haya alcanzado una meseta
con la dosis especificada. Existe
poca información en relación a
la seguridad del ruxolitinib en
pacientes con trombocitopenia
severa, dado que los estudios fase
III que llevaron a su aprobación
no incluyeron pacientes con estas
características.18 (Tabla 4)
De forma general, se recomienda
no realizar incrementos a la dosis
inicial durante las primeras 4 semanas
de tratamiento y posterior a ello, si
la cuenta plaquetaria lo permite y se
considera que no se ha obtenido un
beneficio en relación al tamaño del
bazo o la presencia de síntomas, es
posible realizar incrementos de 5mg
cada dos semanas, teniendo como
dosis máxima 25 mg por vía oral
cada 12 horas. Se sugiere continuar el
tratamiento tanto como se mantenga
el beneficio obtenido en relación a
la esplenomegalia o la disminución
de la sintomatología. Sin embargo, si
después de 6 meses de tratamiento
con ruxolitinib no se ha obtenido
una respuesta objetiva en cualquiera
de los dos parámetros mencionados
anteriormente, es posible considerar
la suspensión del mismo.18
Uso de Ruxolitinib en poblaciones especiales. Para pacientes
con insuficiencia renal con depuraciones de creatinina por debajo
de 40ml/min, se sugiere reducir la
dosis inicial al 50% y en aquellos
que se encuentran en hemodiálisis,
la dosis se debe administrar de
acuerdo a la cuenta de plaquetas
y preferentemente después de la
sesión de diálisis. En insuficiencia
hepática, se recomienda asimismo
reducir la dosis inicial al 50% y
mantener una vigilancia estrecha de
las pruebas funcionales hepáticas.
Al momento, no hay estudios
controlados que justifiquen el uso de
ruxolitinib en mujeres embarazadas.
S39
Volumen 15, Suplemento 1, 2014
Revista de Hematología
Tabla 2. Eventos adversos hematológicos más frecuentemente reportados en los estudios COMFORT.
Parámetro
Anemia
Trombocitopenia
COMFORT-I
Ruxolitinib
N=155
Placebo
N=151
Ruxolitinib
N=146
COMFORT-II
Mejor Terapia Disponible
N=73
%
%
%
%
%
%
%
%
Todos los
grados
≥ Grado 3
Todos los
grados
≥ Grado 3
Todos los
grados
≥ Grado 3
Todos los
grados
≥ Grado 3
83.2
71.0
44.5
13.5
43.7
21.2
15.9
2.0
81.5
68.5
40.4
8.9
49.3
28.8
20.5
6.8
Tabla 3. Otros eventos adversos reportados con el uso de Ruxoltinib.
COMFORT-I
Ruxolitinib
N=155
Todos los
grados
Infecciones
%
Infecciones del tracto
urinario
Placebo
N=151
≥ Grado 3
%
9.7
Herpes zoster
1.9
Alteraciones metabólicas
Aumento de peso
9.0
Alteraciones del sistema nervioso
Mareo
19.4
Cefalea
15.5
%
0
Todos los
grados
%
5.3
Ruxolitinib
N=146
≥ Grado 3
%
Todos los
grados
%
Todos los
grados
≥ Grado 3
%
15.1
%
2.1
6.8
0
0
1.3
0.7
6.8
0.7
0
0
0.6
1.3
0.7
11.0
2.1
1.4
0.7
0.6
0
7.9
6.0
0
0
10.3
11.6
0
1.4
9.6
5.5
2.7
0
Cuenta plaquetaria al inicio del
tratamiento
Dosis recomendada de
Ruxolitinib
Mayor de 200,000/mm3
100,000 to 200,000/mm3
50,000 to 100,000/mm3
20 mg oral dos veces al día
15 mg oral dos veces al día
Máximo 5 mg oral dos veces al día
Modificado de Referencia 18.
S40
≥ Grado 3
1.3
Tabla 4. Dosis recomendada para el inicio de la terapia con Ruxolitinib de acuerdo
a la cuenta plaquetaria.
En estudios preclínicos, se observó
que ruxolitinib fue embriotóxico
en roedores, con incremento en las
pérdidas fetales y retraso en el crecimiento intrauterino. El potencial
teratogénico de ruxolitinib en humanos es desconocido. De tal forma, su
uso debe evitarse durante el embarazo y /o lactancia. En mujeres en edad
reproductiva, se recomienda el uso
de métodos de planificación familiar.
COMFORT-II
Mejor terapia
disponible
N=73
En adultos de 65 años o más,
no existen recomendaciones en
relación a ajuste de dosis y en población pediátrica se desconoce la
seguridad y eficacia del fármaco.18
Beneficio potencial y modificación de la supervivencia con el
uso de Ruxolitinib. En el estudio
COMFORT-I, al momento del
primer análisis la mortalidad en el
brazo de ruxolitinib fue de 6.5%
comparado con 9.1% en el brazo de
placebo (HR 0.67, p=0.33). Aunque
esta diferencia no fue estadísticamente significativa, al extender el
período de seguimiento 4 meses
más (mediana de seguimiento 51
semanas) se observó que la mortalidad en el brazo de ruxolitinib era
de 8.4% comparado con 15.7%
en el brazo del grupo placebo
(HR=0.5, p=0.04). Esta ventaja en la
supervivencia persistió después de
2 años de seguimiento,17 e incluso
con extensión del seguimiento a 3
años.19 Lo mismo se observó en la
fase de extensión de tratamiento
del estudio COMFORT-II en el que
con una mediana de seguimiento
de 112 semanas, la mortalidad en
el brazo de ruxolitinib fue de 14%
vs 22% en el brazo del grupo con la
mejor terapia disponible (HR=0.51,
Libro Educativo 55 Congreso Nacional de la Agrupación Mexicana para el Estudio de la Hematología, A.C.
P=0.041) sugiriendo una ventaja en
la supervivencia global a favor de
ruxolitinib.20
Más aún, en la actualización a
3 años del estudio COMFORT-II, se
demostró que la ventaja en la supervivencia en el brazo de ruxolitinib
persiste con una reducción en el
riesgo de muerte del 52% comparado con la mejor terapia disponible
(p=0.009). La probabilidad de estar
vivo a 144 semanas fue de 81% en
el brazo de ruxolitinib vs 61% en el
brazo de mejor terapia disponible.20
Estos datos sugieren que la ventaja en supervivencia con el uso de
ruxolitinib parece estar asociada
con la reversión del estado catabólico propio de la mielofibrosis,
mejoría en el desempeño físico
asociado a la reducción de la esplenomegalia así como en los síntomas
constitucionales (incremento de
peso y modificación de los perfiles
metabólicos).
Impacto del ruxolitinib en la historia natural de la MFP. De la mano
con la mejoría en la supervivencia
global, recientemente se presentó
un estudio de 450 pacientes comparando la supervivencia global de los
pacientes tratados con ruxolitinib
en el COMFORT-II vs pacientes
obtenidos de la base de DIPSS. El
análisis de supervivencia mostró un
mejor pronóstico para los pacientes
de la cohorte del COMFORT-II comparados con el control histórico de
acuerdo al DIPSS. La probabilidad
de supervivencia acumulada a 10
años desde el diagnóstico inicial
fue de 28.6% en el COMFORT-II vs
11.2% en la base de DIPSS, observando que aquellos pacientes que
se les iniciaba ruxolitinib en algún
punto de su evolución tenían una
mejor supervivencia que aquellos
que continuaban con tratamientos
considerados estándar durante todo
el seguimiento.21 (Tabla 5)
Efectos del Ruxolitinib sobre
la morfología de la médula ósea
en MFP. Existen pocos datos con-
Tabla 5. Impacto de Ruxolitinib en la historia natural de la MF. Estudio comparativo.
Cohorte COMFORT-2
Cohorte DIPSS
100
30 (30%)
29.3
(14.4-45.9)
350
258 (86%)
9.8%
(6.5-14)
Pacientes
Muertes (%)
Probabilidad de supervivencia a
10 años (95% CI)
Prueba de logrank
Hazard ratio
(95% CI)
fiables disponibles que evalúen el
cambio en la morfología de la médula ósea en pacientes con MF. En
un estudio del MDACC en el que
se examinaron los efectos a largo
plazo del ruxolitinib en relación
a la mejoría o empeoramiento
del grado de fibrosis, se observó
una mejoría y/o estabilización del
grado de fibrosis comparado con
los pacientes tratados con la mejor
terapia disponible. Sin embargo,
se requieren estudios prospectivos
con seguimientos más largos para
poder establecer conclusiones en
este rubro. (Figura 1)
Empleo de Ruxolitinib previo a
trasplante. Existe poca información
con respecto al uso de ruxolitinib como puente al trasplante
alogénico. Tres reportes recientes
demostraron buena tolerancia, buenas tasas de injerto y mejoría del
estado funcional de los pacientes
previo al trasplante, sin embargo,
se requieren estudios más grandes,
prospectivos que establezcan el
papel del ruxolitinib en este escenario.23-25
Suspensión del Ruxolitinib y
recidiva de los síntomas. Al suspender ruxolitinib se ha reportado el
regreso de los síntomas en un lapso
aproximado de una semana, algo
que los pacientes refieren como
empeoramiento del estado funcional. En un estudio de la Clínica
Mayo 11% (5/51) de los pacientes
experimentaron el regreso de los
síntomas al suspender el fármaco,
incluyendo la esplenomegalia y en
P=0.0148
0.61 (0.4-0.91)
algunos casos descompensación
hemodinámica.26
Ruxolitinib en combinación
con otros fármacos. Recientemente
se ha iniciado el estudio de ruxolitinib asociado a otros fármacos
con diferentes mecanismos de
acción.27 Existe evidencia in vitro y
en modelos murinos que sugieren
que la combinación de diversos
fármacos puede ser potencialmente
benéfica. Uno de los estudios más
comentados es la combinación de
un inhibidor de desacetilasa de histonas (panobinostat) con ruxolitinib,
que ha demostrado efectos sinérgicos in vitro en líneas celulares con
la mutación JAK2V617F así como
en modelos murinos. De lo anterior
se han derivado estudios clínicos
que se encuentran en marcha y que
han arrojado resultados preliminares que demuestran un perfil de
toxicidad aceptable, sin embargo
es necesario esperar estudios fase
III que permitan determinar el papel
de esta combinación en pacientes
con MF.28 (Tabla 6)
Conclusiones. Mucho tiempo ha
transcurrido desde la descripción
original de las neoplasias mieloproliferativas y sin embargo la MF sigue
siendo una enfermedad incurable.
El descubrimiento de la mutación
JAK2V617F y el desarrollo de los
inhibidores de JAK lidereado por
Ruxolitinib son considerados pasos
importantes en el tratamiento de
la MF. Ruxolitinib ha demostrado
mejorar la esplenomegalia, los
síntomas constitucionales, la cali-
S41
Volumen 15, Suplemento 1, 2014
Revista de Hematología
Modificado de Referencia 22.
Figura 1. Cambios en la fibrosis medular con Ruxolitinib.
dad de vida e inclusive a mostrado
una ventaja en supervivencia tanto
comparado con placebo como con
la mejor terapia disponible. Sin embargo, se requiere un seguimiento
más largo para poder establecer
conclusiones definitivas en esta
área. Asimismo, un conocimiento
más profundo de la fisiopatogenia
de la MF en conjunto con la utilización de fármacos que actúan
a diferentes niveles conducirá al
desarrollo de uno o varios agentes
que permitan finalmente cambiar la
historia natural de la enfermedad.
Referencias
1.
2.
3.
4.
5.
S42
Sonbol MB, Firwana B, Zarzour A y col.
Comprehensive review of JAK inhibitors in myeloproliferative neoplasms.
Ther Adv Hematol, 2013; 4: 15-35.
Ward AC, Touw I, Yoshimura I. The
Jak-Stat pathway in normal and
perturbed hematopoiesis. Blood.
2000; 95:19-29.
Baxter EJ, Scott LM, Campbell PJ
y col. Acquired mutation of the
tyrosine kinase JAK2 in human
myeloproliferative disorders. Lancet.
2005;365:1054-1061.
Levine R, Wadleigh M, Cools J y col.
Activating mutation in the tyrosine
kinase JAK2 in polycythemia vera,
essential thrombocythemia, and
myeloid metaplasia with myelofibrosis. Cancer Cell. 2005; 7:387-397.
Kralovics R, Passamonti F, Buser AS
y col. A gain-of-function mutation
of JAK2 in myeloproliferative disor-
Tabla 6. Ruxolitinib en combinación con otros fármacos.
Combinación
Estudio
Lenalidomida
Pomalidomida
Ruxolitinib y Lenalidomida para pacientes con MF
Ruxolitinib y Pomalidomida. Terapia combinada en pacientes
con MF primaria y secundaria (POMINC)
Danazol
Ruxolitinib y Danazol en el tratamiento de anemia en pacientes
con MF
Panobinostat
Panobinostat y Ruxolitinib en MF (PRIME trial)
ders. N Engl J Med. 2005;352:17791790.
6. Oh ST, Gotlib J. JAK2 V617F and beyond: role of genetics and aberrant
signaling in the pathogenesis of myeloproliferative neoplasms. Expert Rev
Hematol. 2010;3:323-337.
7. Pikman Y, Lee BH, Mercher T y col.
MPL W515L is a novel somatic activating mutation in myelofibrosis
with myeloid metaplasia. PLoS Med.
2006; 3:e 270.
8. Oh ST, Simonds EF, Jones C y col. Novel
Mutations in the inhibitory adaptor
protein LNK drive JAK-STAT signaling in
patients with myeloproliferative neoplasms. Blood. 2010; 116:988-992.
9. Grand FH, Hidalgo-Curtis CE, Ernst T
y col. Frequent CBL mutations associated with 11q acquired uniparental
disomy in myeloproliferative neoplasms. Blood. 2009;113:6182-6192.
10. Verstovsek S, Kantarjian H, Mesa
RA y col. Safety and efficacy of
INCB018424, a JAK1 and JAK2 inhibitor, in myelofibrosis. N Engl J Med.
2010;363:1117-1127.
11. Tefferi A, Vaidya R, Caramazza D y col.
Circulating interleukin IL-8, IL-2R, IL12 and IL-15 levels are independently
prognostic in primary myelofibrosis: a
comprehensive cytokine profiling study. J Clin Oncol. 2011;29:1356-1363.
12. Gangat N, Caramazza D, Vaidya R y
col. DIPSS-Plus: a refined dynamic
international prognostic scoring
system for primary myelofibrosis that
incorporates prognostic information
from karyotype, platelet count, and
transfusion status. J Clin Oncol.
2011;29:392-397.
13. Verstovsek S, Mesa R, Gotlib J y col. A
double-blind placebo-controlled trial
of ruxolitinib for Myelofibrosis. NEJM
2012;366: 799-807.
14. Harrison C, Kiladjian J, Al-Ali H y col.
JAK inhibition with ruxolitinib versus
best available therapy for myelofibrosis. NEJM 2012;366: 787-98.
15. Mesa R, Schwager S, Radia D y col.
The myelofibrosis symptom assesment form (MFSAF): an evidence
– based brief inventory to measure
quality of life and symptomatic res-
Libro Educativo 55 Congreso Nacional de la Agrupación Mexicana para el Estudio de la Hematología, A.C.
16.
17.
18.
19.
20.
21.
22.
23.
24.
ponse to treatment in myelofibrosis.
Leuk res. 2009; 33:1199-1203.
Mesa R, Gotlib J, Gupta V y col.
Effect of ruxolitinib therapy on
myelofibrosis-related symptoms and
other patient reported outcomes in
COMFORT-I: a randomized, doubleblind, placebo-controlled trial. J Clin
Oncol. 2013;31:1285-1292.
Vertovsek S, Mesa R, Gotlib J y col.
Long-term outcome of ruxolitinib
treatment in patients with myelofibrosis: durable reductions in spleen
volumen, improvements in quality
of life, and overall survival advantage in COMFORT-I (abstract). Blood
(ASH Annual Meeting Abstracts).
2012;120:800.
Full prescribing information of ruxolitinib. http://www.accessdat a .fd a . g o v / d r u g s a t fd a _ d o c s /
label/2011/202192lbl.pdf.
Vertovsek S. Long-term Outcomes
of Ruxolitinib Therapy in Patients
With Myelofibrosis: 3-Year Update
From COMFORT-I. (abstract) Blood
(ASH Annual Meeting abstracts).
2013; 396.
Cervantes F, Kiladjian J, Niederwieser
D y col. Long term efficacy, safety and
survival findings from COMFORT II, a
phase 3 study comparing ruxolitinib
with best available therapy for the
treatment of myelofibrosis (abstract). Blood (ASH Annual Meeting
abstracts). 2012;120:801
(Passamonti F y cols. Impact of Ruxolitinib on the Natural History of
Patients With Primary Myelofibrosis:
A Retrospective Comparison of the
DIPSS and the COMFORT-2 Cohorts.
(abstract) Blood (ASH Annual Meeting abstracts). 2013; 4066)
Kvasnicka y col. Effects of Five Years
of Ruxolitinib Therapy on Bone Marrow Morphology in Patients With
Myelofibrosis and Comparison with
Best Available Therapy. (abstracts)
Blood (ASH Annual Meeting Abstracts) 2013; 4055.
Robin y col. Ruxolitinib Before Allogeneic Hematopoietic Stem Cell
Transplantation (HSCT) in Patients
With Myelofibrosis. (abstracts) Blood
(ASH Annual Meeting Abstracts)
2013; 306.
Kröger y col. Ruxolitinib as Pretreatment Before Allogeneic Stem
25.
26.
27.
28.
Cell Transplantation for Myelofibrosis
(abstracts) Blood (ASH Annual Meeting Abstracts) 2013; 392.
Lebon y col. Ruxolitinib for Patients
With Primary Or Secondary MF Before Allo-HSCT: A Retrospective Study
of the Société Française De Greffe
De Moelle Et De Thérapie Cellulaire
(SFGM-TC). (abstracts) Blood (ASH
Annual Meeting Abstracts) 2013;
2111.
Tefferi A, Litzow MR, Pardanani A y
col. Long term outcome of treatment
with ruxolitinib in myelofibrosis. New
Engl J Med. 2011;365:1455-1457.
Keohane C et al. Treatment and management of myelofibrosis in the era
of JAK inhibitors. Biologics: targets
and therapy 2013;7:189-98.
Ribrag V y col. Phase 1b, Dose-Finding Study of RUX Plus Panobinostat
in Pts With MF. (abstracts) Blood
(ASH Annual Meeting Abstracts)
2013; 4045.
Experiencia en el manejo
de pacientes con Leucemia
Promielocítica con Trióxido de Arsénico (Arsenin®).
Instituto de Hematología
e Inmunología. La Habana,
Cuba
Hernández-Padrón C, DorticosBalea E, González-Otero A,
Cano-Izquierdo L, Machín-García
S, Ávila-Cabrera O, Serrano-Mirabal
J, Menéndez-Veitía A, EspinosaEstrada E, Simón-Pita A, Amor-Vigil
A, Lavaut-Sánchez K, Lam-Díaz R,
Hernández-Ramírez P.
Instituto de Hematología e Inmunología. La Habana, Cuba
chdezp@infomed.sld.cu
Desde el año 2000 en nuestro
Instituto se comenzó a utilizar el
trióxido de arsénico en los pacientes que tenían una recaída de la
Leucemia Promielocítica, debido a
los excelentes resultados obtenidos,
en que en el 80% de éstos enfermos
se logró una nueva remisión molecular y en los resultados señalados
en la literatura internacional con el
trióxido de arsénico como droga
de primera línea en el tratamiento
de la leucemia promielocítica, al
inicio de la enfermedad, es que nos
motivamos a la realización de esta
investigación.
Entre los años 2008 y 2011
en el Instituto de Hematología
e Inmunología de La Habana se
trataron 51 pacientes con Leucemia Promielocítica de reciente
diagnóstico, el objetivo fue evaluar la efectividad del trióxido de
arsénico (Arsenin®) como droga de
primera línea en el tratamiento de
esta enfermedad, estudiar el comportamiento clínico-hematológico
de los enfermos, identificar las
principales reacciones adversas
y complicaciones, determinar el
tiempo promedio para la remisión
hematológica y comparar los
resultados con los del protocolo
LPM-2003 (ATRA + Antraciclina).
Las principales reacciones adversas fueron hepatotoxicidad y
cardiotoxicidad; solo 3 enfermos
suspendieron definitivamente
el medicamento y pasaron al
esquema anterior, el LPM-2003.
Hubo 5 muertes precoces. Los 43
pacientes que cumplieron el tratamiento alcanzaron la remisión
hematológica a los 42.8 días. No
hubo diferencias significativas en
el tiempo para lograr la remisión
hematológica, en la sobrevida
global ni en la libre de eventos
con el protocolo LPM-03. Todos
los pacientes que completaron
el tratamiento con Arsenin® han
suspendido el tratamiento y no
ha habido que lamentar recaídas.
La sobrevida global de los 51
pacientes a los dos años es del
90.1% y la de los que cumplieron
el tratamiento con el Arsenin® es
del 100%. Se concluyó que el
Arsenin® es eficaz como droga de
primera línea en el tratamiento
de la enfermedad de reciente
diagnóstico. Este tratamiento se ha
generalizado a centros de varias
provincias del país.
S43
Volumen 15, Suplemento 1, 2014
Revista de Hematología
Monoclonal B-cell Lymphocytosis : U pdate on
Diagnosis, Clinical Outcome, and Counseling
Neil E. Kay, Sameer A. Parikh, M.D.,
M.D., Tait D. Shanafelt, M.D.
Division of Hematology, Department of Medicine, Mayo Clinic,
Rochester, MN
Corresponding Author:
Tait Shanafelt, MD
Division of Hematology, Department of Medicine Mayo Clinic
Email: shanafelt.tait@mayo.edu
ABSTRACT. Monoclonal B-lymphocytosis (MBL) is defined as a
clonal B-cell disorder characterized
by <5x109/L B-lymphocytes in the
peripheral blood with a characteristic immunophenotype, and no
lymphadenopathy or organomegaly.
The vast majority of MBL express
the immunophenotype of chronic
lymphocytic leukemia (CLL, CLLlike MBL), although non-CLL MBL
also exists. CLL-like MBL, which is
the focus of this review, is divided
into low-count MBL (median B-cell
count 0.001 x 109/L, typically identified in population-based screening
studies using highly sensitive flow
cytometry assays) and high-count
MBL (clinical MBL, median B-cell
count of 2.9 x 109/L, typically identified during the workup of low-level
lymphocytosis). Low-count MBL
has an exceedingly small risk of
progression to CLL and these individuals do not require any specific
follow-up. In contrast, individuals
with high-count MBL have a 1-2%
per year risk of progression to CLL
requiring therapy, and have a higher
risk of infectious complications and
secondary malignancies. Although
the overall survival of high-count
MBL patients collectively is similar
to the age- and sex-matched general population, 5-year survival for
CD38-positive high-count MBL is
approximately 10-20% lower than
the general population. This review
S44
summarizes the key concepts in the
classification, diagnosis, and biology of CLL-like MBL and addresses
several important issues in clinical
management.
BACKGROUND AND DEFINITIONS. The 1996 National
Cancer Institute-Working Group
(NCI-WG) criteria defined chronic
lymphocytic leukemia (CLL) as a
clonal lymphoproliferative disorder
characterized by >5x10 9/L lymphocytes in the peripheral blood
that co-express CD19, CD5 and
CD23, and have weak expression
of CD20, CD79b, and surface
immunoglobulin.1,2 In the past 25
years, widespread use of three- and
four-color flow cytometry has made
it possible to detect monoclonal Bcells at very low levels in apparently
healthy individuals. In a public
health study conducted by the US
Center for Disease Control in the
1990s, 11/1926 (0.6%) individuals
in the general population aged
40–76 years were identified with
a clonal population of B-cells with
a CLL phenotype. 3,4 Subsequent
studies also identified clonal Bcell populations with a non-CLL
phenotype, such as in other lowgrade Non-Hodgkin lymphoma
(e.g. marginal zone lymphoma) in
the general population.5 Using bio
specimens from the prostate, lung,
colon and ovary observational cohort study, investigators were able
to demonstrate the presence of an
MBL clone in virtually all (44 out
of 45) patients who subsequently
developed CLL.6 This study convincingly demonstrated that almost
all patients with CLL are preceded
by MBL. In 2005, a subcommittee
of the International Familial CLL
consortium proposed the term “monoclonal B-lymphocytosis” (MBL)
in order to classify and permit the
study of individuals with a low-level
circulating clonal B-lymphocytosis
that does not meet the definition
of CLL.7
In alignment with this proposal,
the 2008 International Working
Group of CLL (iwCLL) revised the
diagnostic criteria for CLL and also
formally recognized MBL as a separate entity.8 In contrast to the 1996
NCI-WG criteria which defined
CLL as >5x109/L lymphocytes in
the peripheral blood with a characteristic immunophenotype, the
2008 iwCLL guidelines revised it to
>5 x 109/L B-lymphocytes. Patients
with <5x109/L B-lymphocytes in the
peripheral blood were considered
to have the small lymphocytic
leukemia (SLL) variant of CLL if
pathologic lymphadenopathy was
present, and MBL if there was no
lymphadenopathy, splenomegaly,
hepatomegaly or cytopenias. Individuals with a clonal B-cell process
consistent with MBL but without a
CLL immunophenotype were classified as non-CLL phenotype MBL
if they were CD5+, or CD5-ve MBL
if they did not express CD5. The
natural history and management of
non-CLL phenotype MBL and CD5ve MBL are distinct from CLL-like
MBL but are beyond the focus of this
review. The current diagnostic criteria for MBL are shown in Table 1.
PREVALENCE . The size of the Bcell clone has an important impact
on its clinical relevance making it
important to distinguish between
low-count MBL (typically identified
through population-screening) and
high-count MBL (recognized during
the evaluation of low-level lymphocytosis). Early population-based
screening studies using 2-color flow
cytometry identified a monoclonal
B-cell population in 0.1-3% of the
general population.4,9,10 Subsequent
studies using 4- to 8-color flow cytometry identified MBL in up to 6% of
the general population.11-13 A large
population-based study utilizing
8-color flow cytometry to examine
5 x 106 B-cells per individual found
73/608 (12%) individuals over the
age of 40 to have CLL-phenotype
Libro Educativo 55 Congreso Nacional de la Agrupación Mexicana para el Estudio de la Hematología, A.C.
MBL.14 A summary of all the studies
reporting on the prevalence of MBL
to date can be found in Table 2.
The median B-cell count in the
peripheral blood of individuals
with low-count MBL is only 0.001
x 109/L.15 This is in contrast to the
median B-cell count of 2.9 x 109/L
observed in high-count MBL.16,17
Over 95% of individuals with
high-count MBL have an absolute
B-cell count more than 0.45 x 109/L.
Given these facts and the important differences in the biology and
outcomes of individuals with lowcount MBL and high-count MBL,
a 0.5 x 109/L threshold has been
proposed to discriminate between
these conditions.15 Prospective studies following individuals with both
low- and high-count MBL for an extended period of time are needed to
confirm the biologic and prognostic
importance of this threshold.
The change in the lower boundary of what constitutes CLL from an
ALC >5x109/L to B-cells >5x109/L
redefined many patients previously
classified as CLL to high-count MBL.
A population-based study in Olmsted County, Minnesota evaluated
the incidence of CLL and high count
MBL from 2000-2010. The incidence of high count MBL was 3.5
per 100,000 individuals according
to the iwCLL2008 criteria. Of the
123 patients who were classified
as Rai stage 0 CLL by the NCI1996
criteria, 36 were reclassified as MBL
by the iwCLL2008 criteria.18 This
reclassification also shifted the stage
distribution at diagnosis for those
who remained in the CLL category
with an increased proportion of
patients with Rai I/II stage disease
at diagnosis. Reclassifying some of
the lowest risk patients from Rai 0 to
MBL also changed the natural history of those patients who remained
in the Rai stage 0 category under
iwCLL2008, resulting in a shorter
time to first treatment.18
RISK FACTORS FOR DEVELOPING MBL. Few risk factors for
development of MBL or CLL have
been identified. Consistent with
the fact that CLL has the strongest
family history of any hematologic
cancer, the prevalence of MBL in
families where at least two first
degree relatives are affected by CLL
(e.g. familial CLL; MBL prevalence
Table 1. Diagnostic criteria for monoclonal B-cell lymphocytosis
1. Documentation of clonal B-cell population by one or more of the following:
a.Light chain restriction – kappa:lambda ratio >3:1 or <0.3:1 or >25%
B-cells lacking or expressing low-level surface immunoglobulin
b. Heavy chain monoclonal IGHV rearrangements
2. Absolute B-cell count < 5 x 109/L
3. Presence of a disease-specific immunophenotype*
4. No other features of a lymphoproliferative disorder or autoimmune/infectious
condition:
a. Normal physical exam (no organomegaly or lymphadenopathy)
b. Absence of B-symptoms such as fatigue, night sweats or weight loss
c. No evidence of an underlying autoimmune/infectious disease
*: CLL-like phenotype MBL cells co-express CD5, CD19, CD23, CD20 (dim) and
surface immunoglobulin (dim).
Atypical-CLL phenotype MBL cells express CD5 with CD19, but are either CD23
negative or express CD20 (bright) or surface immunoglobulin (bright).
Non-CLL phenotype MBL cells do not express CD5, but are CD20 positive, and
express surface immunoglobulin (bright)
It is important to exclude mantle cell lymphoma which characteristically has
t(11;14).
Abbreviations used: IGHV: immunoglobulin heavy chain gene
12%-18%) is 2-3 fold higher than
the general population.19-21 Studies
suggest that relatives of patients with
sporadic CLL also have an increased
prevalence of MBL.22 Increasing
age and male gender are both associated with an increased risk of
developing MBL. Several groups
have identified, heritable germline
gene polymorphisms associated
with increased risk of CLL,23,24 and
initial studies suggest these single
nucleotide polymorphisms may
confer this risk by increasing the
likelihood of developing MBL.25
Recent studies have shown
that up to a third of patients with
CLL will demonstrate stereotyped
B-cell receptors (BCR) characterized by non-random combinations
of immunoglobulin heavy-chain
variable (IGHV) genes.26 Structural
similarity of these BCR suggests
that these receptors may bind to a
similar yet unidentified antigen(s)
with potential relevance to disease pathogenesis. Approximately
25% of CLL patients demonstrate
stereotyped complementarity determining region 3 (CDR3) sequences
as compared to <5% of individuals
with low-count MBL.13 One recent
study found CDR3 stereotypy in
5.5% individuals with low-count
MBL compared to 22% in highcount MBL and 20% in Rai 0 CLL.27
Chronic infections may also contribute to the risk of developing CLL
in some patients. In a populationbased study of 4249 CLL patients
conducted in Denmark from 1977
to 1997, prior history of pneumonia
was associated with significantly increased CLL risk (odds ratio [OR] =
1.4) compared to 15,690 frequencymatched controls.28 Analysis from
the Surveillance, Epidemiology
and End Results (SEER) database
also suggested patients with CLL
(n=10,171) were at increased risk
for sinusitis, pharyngitis, bronchitis,
pneumonia, influenza, cellulitis,
and herpes zoster (OR ranging from
S45
Volumen 15, Suplemento 1, 2014
Revista de Hematología
Table 2. Prevalence of monoclonal B-cell lymphocytosis
Reference
Study
Population
N
Median Age,
years
Flow Cytometry
No. of Markers assessed No. of cells
colors
exami-ned
CLL-like MBL Non-CLL-like
phenotype MBL phenotype
prevalence
prevalence
Frequency of MBL among healthy residential population and blood donors
Shim et al
20074
US general
population
1926
53 (40-78)
2
CD19 or CD20,
CD45, CD3, CD5
NR
0.6%
NR
Rachel et al
20079
US blood
donors
5141
45 (18-79)
2
CD19, CD5
In select samples:
CD2, CD3, CD4,
CD7, CD8, CD10,
CD14, CD20,
CD23, κ, λ
NR
0.14%
NR
Italy general 1725
population
55 (18-102)
5
CD5, CD19,
CD20, κ, λ
5x105
5.2%
2.3%
Spain outpatient clinic
62 (40-97)
8
CD3, CD5, CD8,
CD10, CD19,
CD20, CD23,
CD45, CD56, κ,
λ, Bcl2
5x106
12%
2.3%
Dagklis
et al
200913
Nieto et al
200914
608
Frequency of MBL among outpatient clinic patients, excluding familial CLL patients
Rawstron et UK outpatient 910
al 200210
clinic
Ghia et al
200411
Rawstron
et al
200812
>40
4
CD20, CD76b,
CD19, CD5, κ, λ,
CD5
2x105
3.5%
1.0%
500
74 (65-98)
4
2x105
4.4%
2%
UK outpatient 1520
clinic
74 (60-80)
4
CD5, CD19, κ, λ
or CD5, CD20,
CD79b, CD19
CD19, CD5, κ, λ
5x105
5.1%
1.8%
Italy outpatient clinic
Frequency of MBL among clinically unaffected relatives of CLL patients
Rawstron et Healthy first
al 200221 degree relatives of 21 CLL
families
Marti et al
200320
First degree
relatives of 9
kindreds of
familial CLL
59
NR (23-86)
4
CD20, CD76b,
CD19, CD5, κ, λ,
CD5
NR
13.6% in
first-degree
relatives
NR
33
NR
2
CD19 or CD20,
CD45, CD3, CD5
NR
18%
NR
NR (18-84)
4
CD20, CD79b,
CD19, CD5
3x105
3.6%
0.6%
Matos et al First degree 167
200922 relatives of 42
families with
sporadic CLL
Abbreviations Used: NR: not reported
1.08-1.24) relative to 122,531 frequency-matched controls.29 A link
between infection and risk of CLL
was also observed in a nationwide
analysis of 4 million adult males
S46
admitted to the Veterans Affairs
Hospitals.30 In a recent study, MBL
was identified in 35/123 individuals
with chronic hepatitis C (HCV)31:
significantly higher than would be
expected in the general population.
Interestingly, 16/35 had atypical
CLL-MBL, 13/35 had CLL-like MBL
and 6/35 had CD5-ve MBL. The
authors concluded that persistence
Libro Educativo 55 Congreso Nacional de la Agrupación Mexicana para el Estudio de la Hematología, A.C.
of the HCV antigen may signal
through the BCR chronically, and
lead to an expansion of clonal B-cell
population. Further work is ongoing
to determine which specific antigenic stimuli can lead to MBL and
should provide clues on the stimuli
that lead to CLL.
BIOLOGIC INSIGHTS.
Although both CLL-like MBL and
CLL share the same immunophenotypic markers, there are limited
studies that describe the underlying
biologic differences. It was initially
thought that low-count MBL was
always a monoclonal process;
however, single-cell analytic studies
have showed that low-count MBL
can be oligoclonal or polyclonal.32
A recent study identified constitutive activation of lymphoid enhancer
binding factor-1 (LEF-1) and the Wnt
pathway in both CLL patients and
MBL patients (absolute B-cell count
of 0.7-2.4 x 109/L), but not in normal
B-cells suggesting a role for that
pathway in the pathogenesis of MBL
and CLL.33 The IGHV gene usage
profile and genetic abnormalities
detected by fluorescence in-situ
hybridization [FISH] risk category
are generally similar between highcount MBL and Rai 0 CLL (Table 3),
although they are markedly different in individuals with low-count
MBL. 12,16,34,35 In low-count MBL,
both IGHV 4-34 and IGHV 3-23
genes are under-represented, and
IGHV 1-69 usage is absent whereas
these IGVH gene families are much
more common in CLL.13,14
In addition to the known common recurrent genetic alterations
identified by FISH,36 recent genetic
studies in CLL using massively parallel sequencing has identified novel
mutations in NOTCH1, SF3B1,
MYD88, ZMYM3, MAPK1, FBXW7,
and DDX3X genes. 37 Of these,
NOTCH1 (present in approximately
10-15% of CLL patients) and SF3B1
(present in approximately 10-15%
CLL patients) have been shown to
be independent predictors of poor
outcomes in CLL patients.38,39 In a
small study of 63 high-count MBL
patients, SF3B1 mutation was detected in only 1 (1.5%) patient, and 2
(3.2%) patients harbored NOTCH1
mutations.40,41 A recent study compared the IGHV gene repertoire
and FISH risk category between
low-risk MBL, high-risk MBL and
CLL. Investigators demonstrated
that low-count MBL clones appear
to display a much lower frequency
of chromosomal alterations that are
restricted to del13q and trisomy 12,
with a high prevalence of IGHV
mutated cases. In contrast, del11q
was seen more often in high-count
MBL, and del17p and NOTCH1
mutations were only found in CLL.42
This data supports the notion that
evolution from low-count MBL to
high-count MBL and subsequently
CLL occurs in a stepwise fashion,
with gradual acquisition of high-risk
genetic abnormalities.
GENERAL APPROACH TO THE
WORK-UP OF LYMPHOCYTOSIS
A general approach to evaluate
an individual with lymphocytosis is
shown in Figure 1. It is important
for clinicians to recognize that
individuals found to have non-CLL
phenotype MBL require a complete evaluation for an underlying
lymphoproliferative disorder appropriate for the histologic profile
of the clonal B-cells. For most
cases of non-CLL phenotype MBL,
this involves the typical non-Hodgkin lymphoma staging evaluation
including computed tomography
scans of the chest, abdomen and
pelvis, and bilateral bone marrow
biopsy.
Before classifying individuals as
CLL phenotype MBL, it is important
to consider whether they may have
SLL (Table 1 and Figure 1). One study
examined the clinicopathological
features of 36 patients incidentally
found to have extramedullary tissue
biopsies containing CLL-type cells
and who had <5×109/L peripheral
blood monoclonal B cells.43 Lymph node biopsies were performed
to evaluate lymphadenopathy in
20 patients and for staging of a
non-hematologic neoplasm in 16
patients. After a median follow-up
of 23 months, 21 untreated patients
had no or stable lymphadenopathy,
3 had regressed lymphadenopathy,
and 12 had developed progressive
lymphadenopathy and/or received
therapy for CLL/SLL. Features associated with progression included
lymph nodes >15 mm in size and
presence of proliferation centers in
the biopsied tissue.
It is well recognized that computed tomography (CT) scans at
the time of diagnosis will upstage ~25% of patients with newly
diagnosed, Rai stage 0 CLL.44 One
recent study of 240 patients with
Binet Stage A CLL according to the
1996 NCI-WG criteria evaluated the
effects of whole-body CT on disease
classification.45 Of the 240 cases of
Binet A CLL, 69 patients had highcount MBL when classified using
2008 iwCLL guidelines. CT scans
identified a lymph node >1.5 cm
in 29 individuals with high count
MBL resulting in re-classification to
SLL. After a median follow-up of 35
months, however, only 5/66 of the
patients with high count MBL had
progressed to CLL requiring therapy
with no difference observed based
among the individuals with MBL
patients who were re-classified to
SLL based on imaging. Collectively
these studies suggest that there may
be a “nodal equivalent” of MBL, but
indicate that there is no current clinical justification for routine CT scans
in patients with CLL phenotype MBL.
There are limited data on the
clinical management of patients
with MBL. Ideally, these individuals
should be seen by a hematologist/
oncologist at least once, with
particular attention to a thorough
family history, review of systems
S47
Volumen 15, Suplemento 1, 2014
Revista de Hematología
Table 3. IGHV Mutation Analysis, IGHV gene usage and FISH analysis in high-count monoclonal B-cell lymphocytosis
Reference
N
Median B-cell
count,
x 109/L,(range)
IGHV mutation status
FISH Results
Mutated IGHV Gene Usage 13qdel (%) Trisomy 12 11qdel (%) 17pdel (%)
IGHV (%)
(%)
Rawstron et al
200812
309
3.3 (0.01-4.9)
90
3-07, 3-23, 4-34
58
21
6
3
Shanafelt et al
200935
302
2.8 (0.02-4.9)
77
3-07, 1-69,
4-34, 3-23
44
18
2
3
Rossi et al
200916
123
2.8 (0.2-4.9)
80
4-34, 3-23,
1-69, 3-30
35
18
0
4
Molica et al
201134
105
3.9 (1.0-4.9)
70
3-23, 4-34,
1-69, 3-30
70
15
2
0
Henriques et al
201342
51
2 (0.3-4.9)
73%
3-23
31
20
4
0
Abbreviations Used: IGHV: immunoglobulin heavy chain gene; FISH: fluorescence in-situ hybridization
Clinically identified lymphocytosis, ALC >5000/µL
Peripheral Blood Flow Cytometry
Work up for an infectious or
autoimmune condition¶
Clonal B-cell population present
Non-CLL phenotype
Phenotype* consistent with CLL
Absolute Bcell count
<5000/µL
≥5000/µL
Lymphadenopathy,
splenomegaly or
hepatomegaly
CLL
No
High-count
MBL
Complete staging for non-Hodgkin lymphoma with bilateral
bone marrow biopsy and imaging studies as indicated
Treat underlying disorder if
present
Yes
SLL
Manage according
to the 2008 iwCLL
guidelines
¶: Treat the underlying infectious and autoimmune condition appropriately, if lymphocytosis does not resolve, consider peripheral blood flow
cytometry
*: Phenotype of CLL cells is as follows: positive for CD19, CD5 and CD23, and weak expression of CD20, CD79b, and surface immunoglobulin.
Abbreviations Used: MBL: monoclonal B-lymphocytosis; SLL: small lymphocytic leukemia; CLL: chronic lymphocytic leukemia; ALC: absolutelymphocyte count; iwCLL: International working group of CLL
Figure 1. A schematic approach to incidentally discovered lymphocytosis
S48
Libro Educativo 55 Congreso Nacional de la Agrupación Mexicana para el Estudio de la Hematología, A.C.
and physical examination. A bone
marrow aspirate and biopsy is not
required at the time of diagnosis.
Additionally, there are no formal
recommendations to test for various
prognostic markers available to
predict time to treatment and overall
survival (as are available in CLL) for
individuals with MBL, outside of a
research setting. Individuals who
have low-count MBL have an exceedingly low risk of progression to
CLL requiring therapy, and therefore
could be followed by their regular
primary care physician for routine
medical care. For individuals with
high-count MBL, patients should be
educated about B-type symptoms
including fevers, night sweats,
weight loss, fatigue, and counsel
about the risks of progression to
CLL requiring therapy (which is
approximately 1-2% per year). Annual follow-up by a hematologist/
oncologist is generally advised to
monitor the B-cell clone size, and
assess for clinical progression of
disease. General recommendations
for follow-up of MBL are summarized in Table 5.
KEY QUESTIONS REGARDING
THE NATURAL HISTORY AND
CLINICAL Management of
Patients with MBL
I. What is the Natural History
of MBL?
Since the prevalence of lowcount MBL is at least 100 times
more than CLL, it is apparent that
only a subset of patients with lowcount MBL progress to overt CLL.
Few studies have longitudinally
studied progression of low-count
MBL. After a median follow-up of
34 months, Fazi et al evaluated
76 low-count MBL individuals
with 5-color flow cytometry and
demonstrated that 90% of MBL
were stable over time.46 In another
study of 78 individuals with lowcount MBL, expansion of CLL cells
occurred in 7.5% (3/40 for whom
data was available) after a median
follow-up of 65 months. No patient with low-count MBL had yet
experienced a progression to CLL
requiring therapy.47
A larger number of studies have
evaluated clinical outcomes in patients with high-count MBL. Given
that the threshold to distinguish
high-count MBL from Rai 0 CLL was
somewhat arbitrarily selected, rather
than focusing on what proportion of
individuals with MBL progress to
meet criteria for a CLL diagnosis;
a more appropriate and clinically
relevant question is “what is the
rate of progression of high-count
MBL to CLL requiring therapy?”.
Several studies 12,16,34,35,48-50 have
reported the rate of progression of
high-count MBL to CLL requiring
treatment and are summarized in
Table 4. The median duration of
follow-up in these studies ranged
from 1.5-6.7 years. The rate of progression to CLL requiring treatment
was heterogenous and ranged from
0% to 5% per year. The vast majority
of these studies were retrospective,
where accurate determination of
clinical features in some patients
is not always possible. Also, in a
few studies, it appeared that the
rate of progressive CLL requiring
treatment was higher in the first few
Table 4. Progression of high-count monoclonal B-cell lymphocytosis to CLL requiring treatment
Reference
N
Rawstron et al 200812
Shanafelt et al 200935
Rossi et al 200916
Molica et al 201134
Fung et al 200748
Kern et al 201149
Xu et al 200950
Median follow-up, Rate of progression
years (range)
185, UK
302, USA
123, Italy
6.7 (0.2-11.8)
1.5 (0.3-7.9)
3.6 (NR)
1.1% per year
1.4% per year
4% per year in the
first 7 years, and then
0%
124, Italy
46, Canada
298, Germany
20, China
2.8 (0.2-10)
2.5 (0.1-10)
NR
3.8 (1.5-11.3)
2.5% per year
0%
5% per year
4% per year
Abbreviations used: NR: not reported
Table 5. General recommendations for follow-up of monoclonal B-cell lymphocytosis
Factors to consider
Low-count MBL
High-count MBL
Risk of progression requiring therapy
Extremely low
1-2% per year
Patient counseling
History and physical
examination
Yes
no modification to general medical care
Yes
Annually
CBC with differential
Screen for second nonhematologic malignancies
Routine
Age appropriate cancer
screening
Annually
Age appropriate cancer
screening; consider whole
body skin exam for skin
cancer screening
Follow-up of infectious
complications
No
Yes
S49
Volumen 15, Suplemento 1, 2014
Revista de Hematología
years after diagnosis. Based on the
number of patients and follow-up
of the series described in Table 4,
current knowledge suggests that
the best estimate of high-count MBL
progressing to CLL requiring therapy
is approximately 1-2% per year.51
II. What are the risk factors of
progression from MBL to CLL requiring therapy?
Whereas the risk factors for
disease progression in CLL (such
as non-del13q14 FISH abnormality, unmutated IGHV, positive
expression of CD38, ZAP-70 and
CD49d) have been well defined,
there are limited studies examining
the role of these risk factors on
the natural history of high-count
MBL. In a retrospective study from
Mayo Clinic of 302 high-count
MBL patients, expression of CD38
was associated with faster progression, but there were insufficient
events to assess the impact of IGHV
mutation, ZAP-70 expression or
chromosomal abnormalities.17 Rossi
et al studied the impact of several
prognostic markers among 123
patients with high-count MBL, and
found that IGHV mutation analysis,
CD38 and CD49d expression and
FISH analysis predicted for a faster
time to progression on univariable
analysis.16 However, on multivariable analysis, only high-risk FISH
category (trisomy 12 or del17p)
remained significant. Kern et al
showed that among 298 high-count
MBL patients, ZAP-70 expression,
unmutated IGHV, and trisomy 12
or del11q were associated with
progression on univariable analysis.
However, on multivariable analysis
only unmutated IGHV status remained significant (median time to
CLL requiring therapy in unmutated
IGHV was 1.9 years vs. not reached,
p-value=0.02).49
Several studies have also reported on overall survival in patients
with high-count MBL.12,52 In the
UK series of high-count MBL,
S50
62/185 (34%) died after 6.7 years of
follow-up. However, only 4 deaths
(2%) were attributed to progressive
CLL.12 In a retrospective study of
312 individuals with high-count
MBL seen at Mayo Clinic, overall
survival was not significantly different from age- and sex-matched
general population.52 This is in contrast to individuals with Rai 0 CLL
whose OS was significantly inferior
to the general population. Notably,
however, the survival of individuals
with high-count MBL relative to
the population was influenced by
biologic characteristics of the B-cell
clone. Individuals with high-count
MBL who were CD38 negative had
a survival identical to the general
population, but 5-year survival for
CD38-positive high-count MBL was
approximately 10-20% lower than
the general population. Together
these findings lend support to considering both the B-cell count27,28
and biologic characteristics of the
clone in future efforts to better
determine the exact association of
the diagnostic criteria for MBL to
clinical outcome.
Bennett et al reported on the
outcomes of individuals with lowcount MBL detected during routine
screening of normal 60-80 year old
patients seen in the clinic.47 They
identified 78 individuals with lowcount MBL and 126 age-matched
controls that did not have any abnormal circulating B-cells. Among
individuals for whom follow-up
data were available, 9/40 deaths
(23%) were recorded in the MBL
group compared to 36/126 (29%)
deaths among controls, after a
median follow-up of 5.5 years.
This report suggests that individuals
with low-count MBL have no significant difference in overall survival
compared to age- matched general
population.
III. Are Patients with MBL at
Increased Risk of Other Complications Associated with CLL?
Infections and MBL. Infections
are a major source of morbidity and
mortality in patients with CLL, and
are directly or indirectly related to
the cause of death in 30-50% of CLL
patients.53,54 In addition to hypogammaglobulinemia that is thought
to occur from defective functioning
of the non-malignant B-cells, abnormalities in T-cell function, and
neutrophil and monocyte function
have also been reported.55,56 Recent
studies evaluating the risk of infection in high-count MBL suggest that
these individuals are at a higher
risk for infectious complications.
In a case control study from Mayo
Clinic, infection risk was compared
among local cohorts of individuals
with high-count MBL (n=154),
newly diagnosed CLL (n=174) and
adult patients seen in the general
medicine clinic (n=689). After a
median follow-up of 4 years for
patients with MBL and CLL, and 3
years for controls, hospitalization
due to serious infections was noted
to occur more among individuals
with MBL (16%) and CLL (18%)
than controls (2.6%). On Cox proportional hazards analysis of all
1017 patients (controls, MBL and
CLL), male sex (hazard ratio [HR]
=2.3), major co-morbid health
problems (HR=1.7), the presence
of CLL (HR=3.2), treatment for
progressive CLL (HR=2.4) and the
presence of MBL (HR=3.0) were
independently associated with risk
of hospitalization for infection.57 In
contrast, individuals with low-count
MBL do not seem to have a higher
risk for developing infections compared to the general population.47
MBL and Second Malignancy.
An association between CLL and
increased risk of second cancers
has long been recognized. In a
large retrospective study of 16,367
CLL patients enrolled in the SEER
program followed for 5.2 years,
11% developed a second solid
tumor. This rate was significantly
Libro Educativo 55 Congreso Nacional de la Agrupación Mexicana para el Estudio de la Hematología, A.C.
higher than that for the general
population (OR:1.20).58 In a more
recent study of more than 2.3
million patients with various solid
malignancies in the SEER database,
overall survival was compared in
patients with and without preexisting CLL. After adjusting for
age, sex, race, and disease stage,
patients with cancers of the breast,
colorectum, kidney, prostate and
lung had an inferior overall survival if they had pre-existing CLL
compared to patients without a
diagnosis of CLL.59
Whether patients with highcount MBL are at increased risk for
second malignancy has also been
explored. A recent study from the
Mayo Clinic evaluated the risk of secondary non-hematologic cancers
among locally dwelling individuals
with MBL (n=125), CLL patients
(n=153) and controls (n=596) seen
in the general medicine clinic at
Mayo Clinic from 2004 to 2009.60
After a median follow-up of 4.2
years, 16% of individuals with MBL
developed non-hematologic malignancy as compared to 4% controls
(HR=5.0). The MBL cohort had a
higher incidence of cancer of the
breast, lung, and nervous system
than that of the control cohort. In
contrast to these findings in individuals with high-count MBL, 78
individuals with low-count MBL
identified in a hospital outpatient
clinic did not suggest a higher risk
of developing a secondary nonhematologic malignancy.47
Collectively, these observations
regarding risk for serious infection
and second malignancy suggest that
there is a clinical phenotype to highcount MBL that goes beyond their
risk for progression to CLL. Indeed,
the findings suggest that the risk of
hospitalization for infection and/or
second malignancy may be higher
than the likelihood of progression
to CLL requiring treatment. Further
follow-up and validation of these
preliminary findings will hopefully
allow us to derive more insight into
the risk of non-hematologic malignancy and infection in individuals
with both high-count MBL and
low-count MBL.
IV. Can Individuals with MBL Serve as a Stem Cell Transplant Donor?
Allogeneic transplant is now a
well-established therapy for patients
with CLL. For CLL patients who
meet the International consensus
criteria for transplant,61 a matched
sibling is the preferred donor source. As discussed above, CLL has a
strong genetic predisposition with
~10% of patients having one or
more first degree relative affected
by CLL. Moreover, ~15-18% of
patients from CLL families19-21 and
15% of relatives over the age of 60
with sporadic (i.e, non-familial)
CLL have MBL.22 Accordingly ~1
out of every 7 relatives undergoing
HLA typing to serve as a sibling
donor may have unrecognized
MBL if evaluated using sensitive
screening assays.62 A number of
cases of transfer of MBL donor
clones to CLL patients undergoing
transplant have been reported.63-65
While identifying an MBL clone
in a given donor among patients
with multiple matched siblings
may allow more optimal selection
among multiple suitable donors,
the more difficult and important
question of whether it should
preclude a sibling donor in favor
of an unrelated donor in a patient
who has only one matched sibling
(or preclude transplant altogether)
are complex and as yet unresolved
questions. Cases of transfer of a
CLL-like clone to unrelated donors
to children undergoing SCT have
also been documented raising the
broader question of whether all
patients preparing to donate stem
cells (including unrelated donors)
should be screened for MBL.66
CONCLUSION. The formal
recognition of MBL as a separate
diagnostic entity in the 2008 iwCLL
guidelines has made it important for practicing hematologists/
oncologists to be familiar with
MBL. Two distinct types of MBL
exist – one that is detected using
highly-sensitive flow cytometry
assays in population screening and
the other detected in a health-care
setting due to lymphocytosis. New
evidence suggests that the clonal B
cell biologic characteristics (such
as IGHV mutation status, chromosomal abnormalities detected
by FISH and IGHV gene usage)
of high-count MBL closely mirror
those of Rai 0 CLL, whereas lowcount MBL has a distinct clinical
and biologic profile. Patients with
high-count MBL progress at a rate
of 1-2% per year to CLL requiring
therapy, whereas individuals with
low-count MBL have a very low
risk of progression. Recent studies
suggest that the risks of serious infection and/or second malignancy
among individuals with high-count
MBL are greater than the likelihood
they will progress to CLL requiring
treatment. Additional studies are
needed to better understand the
risks of infection, second malignancies, and appropriate clinical
management of patients with MBL.
REFERENCES
1.
2.
3.
Cheson BD, Bennett JM, Rai KR, et
al. Guidelines for clinical protocols
for chronic lymphocytic leukemia:
recommendations of the National
Cancer Institute-sponsored working
group. American journal of hematology. 1988;29(3):152-163. Prepublished on 1988/11/01 as DOI.
Cheson BD, Bennett JM, Grever
M, et al. National Cancer Institutesponsored Working Group guidelines
for chronic lymphocytic leukemia:
revised guidelines for diagnosis and
treatment. Blood. 1996;87(12):49904997. Prepublished on 1996/06/15
as DOI.
Vogt RF, Shim YK, Middleton DC, et
al. Monoclonal B-cell lymphocytosis
as a biomarker in environmental
health studies. British journal of
S51
Volumen 15, Suplemento 1, 2014
Revista de Hematología
haematology. 2007;139(5):690-700.
Prepublished on 2007/11/21 as DOI
10.1111/j.1365-2141.2007.06861.x.
4. Shim YK, Vogt RF, Middleton D, et
al. Prevalence and natural history
of monoclonal and polyclonal B-cell
lymphocytosis in a residential adult
population. Cytometry Part B, Clinical cytometry. 2007;72(5):344-353.
Prepublished on 2007/02/03 as DOI
10.1002/cyto.b.20174.
5. Nieto WG, Teodosio C, Lopez A,
et al. Non-CLL-like monoclonal Bcell lymphocytosis in the general
population: prevalence and phenotypic/genetic characteristics.
Cytometry Part B, Clinical cytometry.
2010;78 Suppl 1:S24-34. Prepublished on 2010/09/21 as DOI 10.1002/
cyto.b.20543.
6. Landgren O, Albitar M, Ma W, et al.
B-cell clones as early markers for
chronic lymphocytic leukemia. The
New England journal of medicine.
2009;360(7):659-667. Prepublished
on 2009/02/14 as DOI 10.1056/
NEJMoa0806122.
7. Marti GE, Rawstron AC, Ghia P, et al.
Diagnostic criteria for monoclonal Bcell lymphocytosis. British journal of
haematology. 2005;130(3):325-332.
Prepublished on 2005/07/27 as DOI
10.1111/j.1365-2141.2005.05550.x.
8. Hallek M, Cheson BD, Catovsky D,
et al. Guidelines for the diagnosis
and treatment of chronic lymphocytic leukemia: a report from the
International Workshop on Chronic
Lymphocytic Leukemia updating
the National Cancer Institute-Working Group 1996 guidelines. Blood.
2008;111(12):5446-5456. Prepublished on 2008/01/25 as DOI 10.1182/
blood-2007-06-093906.
9. Rachel JM, Zucker ML, Fox CM, et
al. Monoclonal B-cell lymphocytosis
in blood donors. British journal of
haematology. 2007;139(5):832-836.
Prepublished on 2007/10/27 as DOI
10.1111/j.1365-2141.2007.06870.x.
10. Rawstron AC, Green MJ, Kuzmicki
A, et al. Monoclonal B lymphocytes
with the characteristics of “indolent” chronic lymphocytic leukemia are present in 3.5% of adults
with normal blood counts. Blood.
2002;100(2):635-639. Prepublished
on 2002/07/02 as DOI.
S52
11. Ghia P, Prato G, Scielzo C, et al. Monoclonal CD5+ and CD5- B-lymphocyte
expansions are frequent in the peripheral blood of the elderly. Blood.
2004;103(6):2337-2342. Prepublished on 2003/11/25 as DOI 10.1182/
blood-2003-09-3277.
12. Rawstron AC, Bennett FL, O’Connor
SJ, et al. Monoclonal B-cell lymphocytosis and chronic lymphocytic
leukemia. The New England journal
of medicine. 2008;359(6):575-583.
Prepublished on 2008/08/09 as DOI
10.1056/NEJMoa075290.
13. Dagklis A, Fazi C, Sala C, et al. The
immunoglobulin gene repertoire
of low-count chronic lymphocytic
leukemia (CLL)–like monoclonal B
lymphocytosis is different from CLL:
diagnostic implications for clinical
monitoring. Blood. 2009;114(1):2632. 10.1182/blood-2008-09-176933.
14. Nieto WG, Almeida J, Romero A,
et al. Increased frequency (12%)
of circulating chronic lymphocytic
leukemia-like B-cell clones in healthy
subjects using a highly sensitive
multicolor flow cytometry approach.
Blood. 2009;114(1):33-37. Prepublished on 2009/05/08 as DOI 10.1182/
blood-2009-01-197368.
15. Rawstron AC, Shanafelt T, Lanasa
MC, et al. Different biology and
clinical outcome according to the
absolute numbers of clonal B-cells
in monoclonal B-cell lymphocytosis
(MBL). Cytometry Part B, Clinical
cytometry. 2010;78 Suppl 1:S19-23.
Prepublished on 2010/09/21 as DOI
10.1002/cyto.b.20533.
16. Rossi D, Sozzi E, Puma A, et al. The
prognosis of clinical monoclonal B
cell lymphocytosis differs from prognosis of Rai 0 chronic lymphocytic
leukaemia and is recapitulated by
biological risk factors. British journal
of haematology. 2009;146(1):64-75.
Prepublished on 2009/05/15 as DOI
10.1111/j.1365-2141.2009.07711.x.
17. Shanafelt TD, Kay NE, Rabe KG, et
al. Brief report: natural history of
individuals with clinically recognized
monoclonal B-cell lymphocytosis
compared with patients with Rai
0 chronic lymphocytic leukemia.
Journal of clinical oncology : official
journal of the American Society of
Clinical Oncology. 2009;27(24):3959-
18.
19.
20.
21.
22.
23.
24.
3963. Prepublished on 2009/07/22
as DOI 10.1200/JCO.2008.21.2704.
Norman AD CT, Hanson CA, Kay, NE,
Zent CS, Ding W, Cerhan J, Achenbach
SJ, Rabe KG, Vachon CM, Hallberg EJ,
Shanafelt TD, Slager SL Incidence of
chronic lymphocytic leukemia and
monoclonal B-cell lymphocytosis in
Olmsted county, 2000-2010: impact
of the 2008 International Workshop
on CLL Guidelines Proceedings of
the 104th Annual Meeting of the
American Association for Cancer Research; 2013 Apr 6-10; Washington,
DC. 2013:Abstract Number 2287.
Goldin LR, Lanasa MC, Slager SL,
et al. Common occurrence of monoclonal B-cell lymphocytosis
among members of high-risk CLL
families. British journal of haematology. 2010;151(2):152-158.
Prepublished on 2010/08/27 as DOI
10.1111/j.1365-2141.2010.08339.x.
Marti GE, Carter P, Abbasi F, et al. Bcell monoclonal lymphocytosis and
B-cell abnormalities in the setting
of familial B-cell chronic lymphocytic leukemia. Cytometry Part B,
Clinical cytometry. 2003;52(1):1-12.
Prepublished on 2003/02/25 as DOI
10.1002/cyto.b.10013.
Rawstron AC, Yuille MR, Fuller J, et
al. Inherited predisposition to CLL is
detectable as subclinical monoclonal
B-lymphocyte expansion. Blood.
2002;100(7):2289-2290. Prepublished on 2002/09/20 as DOI 10.1182/
blood-2002-03-0892.
Matos DM, Ismael SJ, Scrideli CA,
de Oliveira FM, Rego EM, Falcao RP.
Monoclonal B-cell lymphocytosis in
first-degree relatives of patients with
sporadic (non-familial) chronic lymphocytic leukaemia. British journal of
haematology. 2009;147(3):339-346.
Prepublished on 2009/08/28 as DOI
10.1111/j.1365-2141.2009.07861.x.
Berndt SI, Skibola CF, Joseph V, et
al. Genome-wide association study
identifies multiple risk loci for chronic lymphocytic leukemia. Nature
genetics. 2013. Prepublished on
2013/06/19 as DOI 10.1038/ng.2652.
Slager SL, Camp NJ, Conde L, et al.
Common variants within 6p21.31
locus are associated with chronic
lymphocytic leukaemia and, potentially, other non-Hodgkin lymphoma
Libro Educativo 55 Congreso Nacional de la Agrupación Mexicana para el Estudio de la Hematología, A.C.
25.
26.
27.
28.
29.
30.
31.
32.
subtypes. British journal of haematology. 2012;159(5):572-576.
Prepublished on 2012/10/03 as DOI
10.1111/bjh.12070.
Crowther-Swanepoel D, Corre T, Lloyd
A, et al. Inherited genetic susceptibility to monoclonal B-cell lymphocytosis. Blood. 2010;116(26):5957-5960.
Prepublished on 2010/09/22 as DOI
10.1182/blood-2010-07-294975.
Agathangelidis A, Darzentas N, Hadzidimitriou A, et al. Stereotyped
B-cell receptors in one-third of
chronic lymphocytic leukemia: a
molecular classification with implications for targeted therapies. Blood.
2012;119(19):4467-4475. Prepublished on 2012/03/15 as DOI 10.1182/
blood-2011-11-393694.
Vardi A, Dagklis A, Scarfo L, et al.
Immunogenetics shows that not all
MBL are equal: the larger the clone
the more similar to CLL. Blood. 2013.
Prepublished on 2013/04/19 as DOI
10.1182/blood-2012-12-471698.
Anderson LA, Landgren O, Engels
EA. Common community acquired infections and subsequent risk
of chronic lymphocytic leukaemia. British journal of haematology. 2009;147(4):444-449. Prepublished on 2009/09/04 as DOI
10.1111/j.1365-2141.2009.07849.x.
Landgren O, Rapkin JS, Caporaso
NE, et al. Respiratory tract infections and subsequent risk of chronic lymphocytic leukemia. Blood.
2007;109(5):2198-2201. Prepublished on 2006/11/04 as DOI 10.1182/
blood-2006-08-044008.
Landgren O, Gridley G, Check D,
Caporaso NE, Morris Brown L.
Acquired immune-related and inflammatory conditions and subsequent chronic lymphocy tic
leukaemia. British journal of haematology. 2007;139(5):791-798.
Prepublished on 2007/10/19 as DOI
10.1111/j.1365-2141.2007.06859.x.
Fazi C, Dagklis A, Cottini F, et al.
Monoclonal B cell lymphocytosis in
hepatitis C virus infected individuals.
Cytometry Part B, Clinical cytometry.
2010;78 Suppl 1:S61-68. Prepublished on 2010/09/21 as DOI 10.1002/
cyto.b.20545.
Lanasa MC, Allgood SD, Volkheimer
AD, et al. Single-cell analysis reveals
33.
34.
35.
36.
37.
38.
39.
oligoclonality among ‘low-count’
monoclonal B-cell lymphocytosis.
Leukemia. 2010;24(1):133-140.
Prepublished on 2009/12/01 as DOI
10.1038/leu.2009.192.
Gutierrez A, Jr., Tschumper RC, Wu X,
et al. LEF-1 is a prosurvival factor in
chronic lymphocytic leukemia and is
expressed in the preleukemic state
of monoclonal B-cell lymphocytosis.
Blood. 2010;116(16):2975-2983.
Prepublished on 2010/07/03 as DOI
10.1182/blood-2010-02-269878.
Molica S, Mauro FR, Giannarelli D,
et al. Differentiating chronic lymphocytic leukemia from monoclonal
B-lymphocytosis according to clinical
outcome: on behalf of the GIMEMA
chronic lymphoproliferative diseases working group. Haematologica.
2011;96(2):277-283. Prepublished
on 2010/10/26 as DOI 10.3324/
haematol.2010.030189.
Shanafelt TD, Kay NE, Jenkins G, et
al. B-cell count and survival: differentiating chronic lymphocytic leukemia
from monoclonal B-cell lymphocytosis based on clinical outcome. Blood.
2009;113(18):4188-4196. Prepublished on 2008/11/19 as DOI 10.1182/
blood-2008-09-176149.
Dohner H, Stilgenbauer S, Benner
A, et al. Genomic aberrations and
survival in chronic lymphocytic leukemia. The New England journal of
medicine. 2000;343(26):1910-1916.
Prepublished on 2001/01/03 as DOI
10.1056/NEJM200012283432602.
Wang L, Lawrence MS, Wan Y, et
al. SF3B1 and Other Novel Cancer Genes in Chronic Lymphocytic
Leukemia. New England Journal of
Medicine. 2011;365(26):2497-2506.
doi:10.1056/NEJMoa1109016.
Del Giudice I, Rossi D, Chiaretti S, et
al. NOTCH1 mutations in +12 chronic
lymphocytic leukemia (CLL) confer
an unfavorable prognosis, induce a
distinctive transcriptional profiling
and refine the intermediate prognosis of +12 CLL. Haematologica.
2012;97(3):437-441. Prepublished
on 2011/12/31 as DOI 10.3324/
haematol.2011.060129.
Rossi D, Bruscaggin A, Spina V, et al.
Mutations of the SF3B1 splicing factor in chronic lymphocytic leukemia:
association with progression and
40.
41.
42.
43.
44.
45.
46.
fludarabine-refractoriness. Blood.
2011;118(26):6904-6908. Prepublished on 2011/11/01 as DOI 10.1182/
blood-2011-08-373159.
Rasi S, Monti S, Spina V, Foa R, Gaidano G, Rossi D. Analysis of NOTCH1
mutations in monoclonal B-cell
lymphocytosis. Haematologica.
2012;97(1):153-154. Prepublished
on 2011/10/14 as DOI 10.3324/
haematol.2011.053090.
Greco M, Capello D, Bruscaggin A,
et al. Analysis of SF3B1 mutations in
monoclonal B-cell lymphocytosis. Hematological oncology. 2013;31(1):5455. Prepublished on 2012/03/31 as
DOI 10.1002/hon.2013.
Henriques A, Rodriguez-Caballero A,
Nieto WG, et al. Combined Patterns
of IGHV Repertoire and Cytogenetic/
Molecular Alterations in Monoclonal
B Lymphocytosis versus Chronic
Lymphocytic Leukemia. PloS one.
2013;8(7):e67751. Prepublished on
2013/07/12 as DOI 10.1371/journal.
pone.0067751.
Gibson SE, Swerdlow SH, Ferry JA, et
al. Reassessment of small lymphocytic lymphoma in the era of monoclonal B-cell lymphocytosis. Haematologica. 2011;96(8):1144-1152.
Prepublished on 2011/05/07 as DOI
10.3324/haematol.2011.042333.
Muntanola A, Bosch F, Arguis P,
et al. Abdominal computed tomography predicts progression in
patients with Rai stage 0 chronic
lymphocytic leukemia. Journal of
clinical oncology : official journal
of the American Society of Clinical
Oncology. 2007;25(12):1576-1580.
Prepublished on 2007/03/14 as DOI
10.1200/JCO.2006.08.4194.
Gentile M, Cutrona G, Fabris S, et al.
Total body computed tomography
scan in the initial work-up of binet
stage a chronic lymphocytic leukemia
patients: Results of the prospective,
multicenter o-cll1-gisl study. American journal of hematology. 2013.
Prepublished on 2013/04/05 as DOI
10.1002/ajh.23448.
Fazi C, Scarfo L, Pecciarini L, et al. General population low-count CLL-like
MBL persists over time without clinical progression, although carrying the
same cytogenetic abnormalities of
CLL. Blood. 2011;118(25):6618-6625.
S53
Volumen 15, Suplemento 1, 2014
Revista de Hematología
47.
48.
49.
50.
51.
52.
53.
54.
S54
Prepublished on 2011/08/31 as DOI
10.1182/blood-2011-05-357251.
Bennett FL, Dalal S, Jack AS, Hillmen
P, Rawstron AC. Five-Year Follow-up
of Monoclonal B-Cell Lymphocytosis
(MBL) in Individuals with a Normal
Blood Count: Expansion of the
Abnormal B-Cell Compartment but
No Progressive Disease. ASH Annual
Meeting Abstracts. 2009;114(22):59
Fung SS, Hillier KL, Leger CS, et al.
Clinical progression and outcome
of patients with monoclonal B-cell
lymphocytosis. Leukemia & lymphoma. 2007;48(6):1087-1091.
Prepublished on 2007/06/20 as DOI
10.1080/10428190701321277.
Kern W, Bacher U, Haferlach C, et al.
Monoclonal B-cell lymphocytosis is
closely related to chronic lymphocytic
leukaemia and may be better classified as early-stage CLL. British journal
of haematology. 2012;157(1):86-96.
Prepublished on 2012/01/10 as DOI
10.1111/j.1365-2141.2011.09010.x.
Xu W, Li JY, Wu YJ, et al. Clinical
features and outcome of Chinese
patients with monoclonal B-cell
lymphocytosis. Leukemia research.
2009;33(12):1619-1622. Prepublished on 2009/03/03 as DOI 10.1016/j.
leukres.2009.01.029.
Shanafelt TD, Ghia P, Lanasa MC,
Landgren O, Rawstron AC. Monoclonal B-cell lymphocytosis
(MBL): biology, natural history and
clinical management. Leukemia.
2010;24(3):512-520. Prepublished
on 2010/01/22 as DOI 10.1038/
leu.2009.287.
Shanafelt TD, Kay NE, Rabe KG, et
al. Survival of patients with clinically
identified monoclonal B-cell lymphocytosis (MBL) relative to the age- and
sex-matched general population.
Leukemia. 2012;26(2):373-376.
Prepublished on 2011/08/13 as DOI
10.1038/leu.2011.211.
Wadhwa PD, Morrison VA. Infectious
complications of chronic lymphocytic
leukemia. Seminars in oncology.
2006;33(2):240-249. Prepublished
on 2006/04/18 as DOI 10.1053/j.
seminoncol.2005.12.013.
Francis S, Karanth M, Pratt G, et al.
The effect of immunoglobulin VH
gene mutation status and other
prognostic factors on the inciden-
55.
56.
57.
58.
59.
60.
61.
ce of major infections in patients
with chronic lymphocytic leukemia.
Cancer. 2006;107(5):1023-1033.
10.1002/cncr.22094.
Kay NE. Abnormal T-cell subpopulation function in CLL: excessive
suppressor (T gamma) and deficient
helper (T mu) activity with respect to B-cell proliferation. Blood.
1981;57(3):418-420. Prepublished
on 1981/03/01 as DOI.
Zeya HI, Keku E, Richards F, 2nd, Spurr
CL. Monocyte and granulocyte defect
in chronic lymphocytic leukemia.
The American journal of pathology.
1979;95(1):43-54. Prepublished on
1979/04/01 as DOI.
Moreira J, Rabe KG, Cerhan JR, et
al. Infectious complications among
individuals with clinical monoclonal
B-cell lymphocytosis (MBL): a cohort
study of newly diagnosed cases
compared to controls. Leukemia.
2013;27(1):136-141. Prepublished
on 2012/07/12 as DOI 10.1038/
leu.2012.187.
Hisada M, Biggar RJ, Greene MH,
Fraumeni JF, Jr., Travis LB. Solid
tumors after chronic lymphocytic
leukemia. Blood. 2001;98(6):19791981. Prepublished on 2001/09/06
as DOI.
Solomon BM, Rabe KG, Slager SL,
Brewer JD, Cerhan JR, Shanafelt TD.
Overall and cancer-specific survival of patients with breast, colon,
kidney, and lung cancers with and
without chronic lymphocytic leukemia: a SEER population-based study.
Journal of clinical oncology : official
journal of the American Society of
Clinical Oncology. 2013;31(7):930937. Prepublished on 2013/01/24 as
DOI 10.1200/JCO.2012.43.4449.
Solomon BM, Rabe KG, Moreira J,
et al. Risk of Cancer in Patients with
Clinical Monoclonal B-Cell Lymphocytosis (MBL): A Cohort Study of
Newly Diagnosed Patients Compared
to Controls. ASH Annual Meeting
Abstracts. 2012;120(21):2893.
Dreger P, Corradini P, Kimby E, et al.
Indications for allogeneic stem cell
transplantation in chronic lymphocytic leukemia: the EBMT transplant
consensus. Leukemia. 2007;21(1):1217. Prepublished on 2006/11/17 as
DOI 10.1038/sj.leu.2404441.
62. Del Giudice I, Mauro FR, De Propris
MS, et al. Identification of monoclonal B-cell lymphocytosis among
sibling transplant donors for chronic
lymphocytic leukemia patients.
Blood. 2009;114(13):2848-2849.
Prepublished on 2009/09/26 as DOI
10.1182/blood-2009-06-228395.
63. Pavletic SZ, Zhou G, Sobocinski K, et al. Genetically identical
twin transplantation for chronic
lymphocytic leukemia. Leukemia.
2007;21(12):2452-2455. Prepublished on 2007/08/31 as DOI 10.1038/
sj.leu.2404928.
64. Perz JB, Ritgen M, Moos M, Ho AD,
Kneba M, Dreger P. Occurrence of donor-derived CLL 8 years after sibling
donor SCT for CML. Bone marrow
transplantation. 2008;42(10):687688. Prepublished on 2008/08/06 as
DOI 10.1038/bmt.2008.230.
65. Hardy NM, Grady C, Pentz R, et al.
Bioethical considerations of monoclonal B-cell lymphocytosis: donor
transfer after haematopoietic stem
cell transplantation. British journal of
haematology. 2007;139(5):824-831.
Prepublished on 2007/11/21 as DOI
10.1111/j.1365-2141.2007.06862.x.
66. Ferrand C, Garnache-Ottou F, Collonge-Rame MA, et al. Systematic donor
blood qualification by flow cytometry would have been able to avoid
CLL-type MBL transmission after
unrelated hematopoietic stem cell
transplantation. European journal of
haematology. 2012;88(3):269-272.
Prepublished on 2011/12/16 as DOI
10.1111/j.1600-0609.2011.01741.x.
La Terapia Celular; entre la
panacea y la charlatanería
Dr. Abel Lomeli Guerrero
Abel.lomeli@gmail.com
Existe en la actualidad un consenso
general acerca de la importancia
y el papel que desempeñan las
células tronco (“stem cells”) en la
plasticidad y reparación tisular, así
como sobre el hecho de que sin
estas células, la vida no es posible.
Sin embargo, en la última década,
la aplicación de estas células, así
como la regulación, o falta de la
Libro Educativo 55 Congreso Nacional de la Agrupación Mexicana para el Estudio de la Hematología, A.C.
misma, en estrategias terapéuticas
en una gran variedad de patologías
y enfermedades frecuentemente
terminales o con muy pocas y pobres posibilidades de tratamiento,
ha sido objeto de discusiones,
revisiones críticas y un torrente de
publicaciones, tanto científicas,
como de tipo propagandístico,
puramente comercial en donde no
se identifica la frontera entre ensayo
clínico y tratamiento pagado.
Las células tronco se encuentran y pueden obtenerse de tejido
embrionario, de cordón umbilical
y de tejidos adultos como: sangre
periférica, médula ósea, hígado,
tejido graso, etc. Estas células no
se encuentran especializadas en
ningún tipo celular y comparten la capacidad de reproducirse
indefinidamente, así como de diferenciarse hacia cualquier tipo de
célula especializada.1 Lo primero
ofrece la posibilidad de expansión
y lo segundo constituye el interés
principal por su capacidad de diferenciarse en varios tipos celulares.
En el embrión incipiente, en la
fase de blástula o blastómera, durante las cuatro primeras divisiones
celulares, las células son Totipotenciales, es decir, son capaces de
diferenciarse en cualquier tipo de
célula necesaria para formar un
cuarpo humano, es decir, pueden
diferenciarse hacia cualquiera de
las tres capas germinales: Ectodermo, mesodermo y endodermo, así
como hacia células extraembrionarias, como el tejido del cordón
umbilical. Después de las cuatro
primeras divisiones, pierden su
capacidad totipotencial y se convierten en Pluripotenciales, pueden
diferenciarse hacia cualquiera de
las tres capas germinales, pero ya
no hacia tejido extraembrionario;
más tarde, durante el desarrollo
embrionario, estas células pueden
diferenciarse solo en células de dos
de las capas germinales, y luego,
solo hacia una de ellas (células
Multipotenciales) y, finalmente,
al formarse, en la etapa final de
la diferenciación, las diferentes
lineas celulares, ya no pueden
diferenciarse hacia otro tipo de
célula (Nulipotenciales, células
especializadas).
La aplicación de células capaces de diferenciarse en células
altamente diferenciadas, por supuesto parece muy atractiva en
el tratamiento de enfermedades
por ejemplo, neurodegenerativas,
en las que hay pérdida progresiva
de células funcionales, o en otras
patologías con pérdida aguda o
progresiva de células funcionales
como en el infarto del miocardio,
lesiones traumáticas medulares,
daños por isquemia, lesiones degenerativas osteocondrales, etc. En
las que no hay una terapia efectiva.
Sin embargo, no todas las células
tronco parecen buenos candidatos
para su aplicación en humanos.Las
células Totipotenciales derivadas de
embriones vivos, antes de la 5ª división celular en la fase de blástula,
son las que tienen mayor capacidad
de diferenciarse, mayor capacidad
de expansión (indefinidamente),
pero tienen la desventaja de su alta
capacidad para desarrollar tumores
y su alta inmunogenicidad, que
requiere de inmunosupresión para
evitar el rechazo, sin mencionar los
aspectos éticos de usar embriones
vivos como fuente de recolección.
El uso de células pluripotenciales derivadas de cordón umbilical,
parece más atractivo, y su recolección y conservación para futuros
tratamientos, se limita al propio
niño o a sus padres; se consideran
libres de la la posibilidad de la
eventual formación de tumores y no
requieren de inmunosupresión para
prevenir rechazo en la reaplicación
al propio donador. Su viabilidad
no se altera con la conservación
en congelación con aditivos como
el dimetilsulfóxido, después de
períodos de 18 a 20 años.
Las células tronco adultas
(ASCs) autólogas, sobre todo mesenquimales y hematopoyéticas,
son las mas promisorias, ya que
no conllevan el riesgo de la génesis de tumores, son fácilmente
recolectadas de la cresta ilíaca del
paciente y pueden ser aplicadas
sin medicación inmunosupresora
para prevenir el rechazo. Estudios reciente muestran que
estas células multipotenciales
pueden diferenciarse hacia todos
los tipos celulares, sugiriendo
pluripotencialidad; 2 ;pueden ser
reprogramadas a un estado pluripotencial forzando la expresión de
factores de transcripción embrionarios; sin embargo, en cualquier
caso de manipulación y expansión,
como es el caso de las células pluripotenciales inducidas, existe el
gran riesgo de producir aneuploidias que limitan la capacidad de
diferenciación y aumenta el riesgo
de génesis de tumores.3
Uno de los mayores reservorios
de células tronco adultas (ASCs)
es la médula ósea; se obtienen
por aspiración en la cresta ilíaca;
el volúmen de médula ósea es
filtrada y procesada por centrifugación de gradientes; el “buffy
coat”, con el mayor contenido de
células tronco, es sometido a separación celular, para concentrar
las células, en sistema cerrado. La
cantidad de células tronco en estos
preparados, es escasa; las células
tronco mesenquimales constituyen
aproximadamente el 1% de las
células tronco hematopoyéticas,
por lo que, dependiendo de la edad
del enfermo (donador) se requieren
de 150 a 200 ml de aspirado de
médula ósea (a mayor edad menor
cosecha de células tronco).4
Para caracterizar a las células
tronco mesenquimales (MSCs), el
comité para células tronco tisulares,
de la Sociedad Internacional de
Terapia Celular ha definido, como
criterios mínimos:5
S55
Volumen 15, Suplemento 1, 2014
Revista de Hematología
1.- La MSC debe ser adherente al
plástico en condicones estándar
de cultivo
2.- Debe expresar las moléculas
de superfice: CD105; CD73 y
CD90 y no expresar: CD45,
CD34, CD14, o CD11b, CD79a
y HLA-DR
3.- In vitro debe ser capaz de
diferenciarse a osteoblasto,
adipocito y condroblasto
La célula tronco hematopoyética (HSC) se define por la expresión
de CD34 de superficie en la citofluorometría.
Existen pruebas firmes de que
las ASCs y sobre todo las MSCs son
capaces de migrar hacia un tejido
lesionado o dañado (cardíaco, nervioso, etc.), fenómeno denominado
“homing”;6 el factor derivado de
células de estroma (SDF-1) parece
jugar un papel importante como
factor quimiotáctico atrayendo
MSCs hacia el tejido dañado (“patotrofismo”). La migración al sitema
nervioso central (SNC) se ve limitada por la barrera hemato-encefálica
que la impide. En algunos estudios
se ha encontrado que aproximadamente el 8% de las células
administradas por vía intravenosa
pasan la barrera hemato-encefálica
y son encontradas en el SNC.7,8
La diferenciación de las células
tronco adultas hacia células neuronales solo se ha logrado in vitro
y en modelos animales, usando
múltiples factores de crecimiento.
Las células tronco son capaces
de reproducirse en forma indefinida; las células tronco embrionarias
pueden cultivarse indefinidamente
por muchos años; las ASCs también pueden cultivarse, pero por
tiempo limitado, posiblemente
como resultado del acortamiento
de los telómeros cromosómicos
con cada división celular; las células tronco derivadas de sujetos
jóvenes sobreviven mayor tiempo
(hasta 41 doblajes), comparadas
con las células de sujetos viejos (24
S56
doblajes); otro aspecto importante
en la capacidad de expansión es
la diferenciación hacia diferentes
lineas; el envejecinmiento tiene un
efecto negativo en la plasticidad
de las ASCs autólogas, limitando
su aplicación en el tratamiento de
enfermedades relacionadas a la
edad.9 Por otra parte, enfermedades
crónicas, como Diabetes, esclerosis
lateral amiotrófica o insuficiencia
renal, se sabe que reducen el potencial angiogénico de las células
tronco, limitando aún más su uso
en estas enfermedades.10
En conclusión, las células tronco
constituyen un recurso de gran valor
en investigación terapéutica experimental en medicina regenerativa.
Es importante resaltar que al tratar el
tema con los pacientes debe enfatizarce el carácter experimental de su
aplicación, más que como un tratamiento o aplicación clínica. A nivel
experimental hay una gran actividad
con futuro promisorio, en cuanto a su
aplicación clínica, permanece en una
etapa de estudios de fase temprana.
Debe advertirse a los pacientes
en relación a las terapias comerciales con “células tronco” por la
falta de datos serios en eficacia y
seguridad.
Existe una gran esperanza y
grandes expectativas, alimentada
por la abundancia de notas en los
medios sobre el uso de las “células
madre”, como un recurso de regeneración de células especializadas
con el fin de recobrar la función
orgánica perdida y en patologías
con muy pocas o nulas posibilidades terapéuticas; sin embargo, este
ambicioso objetivo terapéutico es
el más difícil y menos probable
de alcanzar en el corto y mediano
plazo; la información al paciente
debe ser pues, manejada con
absoluta transparencia en este sentido, proporcionandole un cuadro
realista tanto de los conocimientos
actuales como de lo que realmente
se puede lograr.11
1.-
Referencias
De Munter JP, Walters EC. Autologous
stem cells in neurology: is there a
future? J Neurol Transm 2013; 120:
65-73
2.- Stadtfeld M, Hochedlinger K, Induced
pluripotency: history, mechanisms
and applications. Genes Dev 2010;
24: 2239-2263
3.- Mayshar Y, Ben-David U, Lavon N et
al. Identification and classification of
chromosomal aberrations in human
induced pluripotent stem cells. Cell
stem cell 2010; 7: 521-531
4.- Yang B, Strong R, Sharma S et al.
Therapeutic time window and dose
response of autologous bone marrow mononuclear cells for isquemic
stroke. J Neurosci Res 2011; 89: 833839
5.- Dominici M, Le Blanc K, Mueller I
et al. Minimal criteria for defining
multipotent mesenchymal stromal
cells. The International society for
cellular therapy position statement.
Cytotherapy 2006; 8: 315-317
6.- Pittenger MF, Martin BJ, Mesenchymal stem cells and their potential as
cardiac therapeutics. Circ Res 2004;
95: 9-20
7.- Jackson JS, Golding JP, Chapon C,
Jones WA, Bhakoo KK. Homing of
stem cells to sites of inflammatory
brain injury after intracerebral and
intravenous administration: a longitudinal imaging study. Stem cell Res
Ther 2010; 1: 17
8.- Stamatovic SM, Keep RF, Andjelkovic AV. Brain endothelial cell-cell
junctions: how to “open# the blood
brain barrier, Curr Neuropharmacol
2008; 6: 179-192
9.- Asumda FZ, Chase PB. Age related
changes in rat bone marrow mesenchymal stem cell plasticity. BMC Cell
Biol 2011; 12: 44
10.- Dimmeler S, Leri A. Aging and disease
as modifiers of efficacy of cell therapy. Circ Res 2008; 102: 1319-1330
11.- Connick P, Patani R, Chandran S. Stem
cells as a resourse for regenerative
neurology. Pract Neurol 2011; 11:
29-36
Leucemia mielomonocitica
cronica
Oscar de Jesús Pérez Ramírez
oscarjpr@gmail.com
Libro Educativo 55 Congreso Nacional de la Agrupación Mexicana para el Estudio de la Hematología, A.C.
DEFINICION. La Leucemia Mielomonocítica Crónica (CMML) es
una enfermedad hematopoyética
clonal de las células tronco que
está clasificada como una neoplasia
mieloproliferativa / mielodisplásica
por la Clasificación de neoplasias
hematológicas 2008 de la Organización Mundial de la Salud (OMS).
Se caracteriza por la presencia de
monocitosis absoluta > 1 x 109/L en
sangre periférica y la presencia de
cambios mielodisplásicos y mieloproliferativos en la médula ósea.1
La monocitosis en ausencia de
cambios displásicos deberá persistir por 3 meses para establecer el
diagnóstico de CMML2 y se deben
excluir causas de monocitosis
reactiva antes de iniciar el estudio
de neoplasia hematológica (figura
1). Entre las causas de monocitosis
no maligna se incluyen: Infecciosas
como tuberculosis, infecciones
crónicas por hongos, endocarditis
infecciosa, infecciones virales,
infestaciones por protozoarios;
Enfermedades de tejido conectivo
como lupus eritematoso sistémico,
sarcoidosis y enfermedades por
depósito de lípidos; Recuperación
de una infección aguda grave o
regeneración medular postquimioterapia. Una vez que estas causas
fueron descartadas, es necesario
considerar enfermedades hematopoyéticas clonales. Primero buscar
el gen de fusión BCR-ABL1 o el
cromosoma Filadelfia para descartar Leucemia Mieloide Crónica. En
caso de encontrar eosinofilia en
sangre periférica analizar rearreglos
de los Factores A y B de crecimiento
derivados de Plaquetas (PDGFRA,
PDGFRB) o Receptor 1 del Factor de
Crecimiento Fibroblástico (FGFR1)
Monocitosis absoluta en sangre periferica persistente por
mas de 3 meses >1 X 109/l
Asociacion con otras anormalidades en sangre
periferica o historia previa de enfermedad maligna
hematologica o quimioterapia sistemica previa
Si
No
Estudio de medula osea para
buscar cmml u otra enfermedad
primaria medular
CMML
<5% Blastos en sp
y <10% Blastos en mo
CMML-1
Figura 1.
Excluir causas infecciosas o
procesos autoinmunes
cuya presencia asigna la enfermedad a la categoría de la OMS
“Neoplasia Mieloide y Linfoide
con eosinofilia y anormalidades
de PDGFRA, PDGFRB o FGFR1”,
Finalmente identificar cambios
displásicos cuando menos en una
línea hematopoyética, si no se encuentra mielodisplasia o es mínima
el diagnóstico de CMML puede
hacerse, basado en los criterios
mencionados en la tabla 1.3 Una
vez establecido el diagnóstico de
CMML esta se subdivide de acuerdo
al número de blastos y promonocitos en sangre periférica y médula
ósea, en CMML-1 (blastos periféricos <5% y en médula ósea <10%)
y CMML-2 (blastos periféricos 5 –
19% y en médula ósea 10 – 19%).
La presencia de ≥ 20% de blastos
clasifica a la enfermedad como
leucemia mieloide aguda3. Una
variante mieloproliferativa y otra
mielodisplásica han sido diferenciadas en la CMML basándose en
un número de leucocitos definido
arbitrariamente en 13 x 109/L.4 La
variante mieloproliferativa se presenta con cuenta de leucocitos de
mas de 13 x 109/L, se ha asociado
con menor supervivencia y mayor
nivel de progresión a leucemia aguTabla 1. Criterios diagnosticos de leucemia mielomonocitica cronica
Realidad BCR-ABL O FISH
Para t(9;22), PDGFRA,
PDGFRB, FGFR1
1.
Monocitos en sangre periferica >
1 X 109/L
2.
No Cromosoma Filadelfia o gen
de fusión BCR-ABL1
Medula osea
3.
4.
No rearreglo PDGFRA o PDGFRB
Menos de 20% de blastos en
sangre periférica o médula ósea
Displasia presente en uno o mas
de las líneas mieloides. Si la mielodisplasia es mínima o ausente,
CMML puede ser diagnosticada
si: se demuestra una anormalidad
citogenética o molecular en la
célula tronco hematopoyética o
la monocitosis es persistente por
mas de 3 meses y se excluye otra
causa de monocitosis
Otra neoplasia hematologica
o > 20% blastos (lam)
5-19% Blastos en sp
Y 10-19% Blastos en mo
CMML-2
5.
S57
Volumen 15, Suplemento 1, 2014
Revista de Hematología
da que la variante mielodisplásica5
que tiene leucocitos < a 13 x 109/L.
Por definición el número de
monocitos son mayores o igual a
1 x 109/L en pacientes con CMML,
sin embargo, el rango mas común
se encuentra entre 2 a 5 x 109/L y algunas veces excede los 80 x 109/L.6
EPIDEMIOLOGIA. Es una enfermedad rara cuya incidencia es
alrededor de 1 caso/ 100,000 habitantes por año.7 La mediana de edad
al diagnóstico es de 65 a 75 años,
la enfermedad es excepcionalmente
diagnosticada antes de los 50 años
de edad, con predominio en el
género masculino de 1.3 – 3.1.8,9
ETIOLOGIA. La causa de la
CMML es desconocida, carcinogénicos ocupacionales, ambientales y
radiación ionizante se ha asociado
en algunos casos.10
DATOS CLINICOS. El inicio de la
enfermedad es usualmente insidioso
y el diagnóstico es fortuito en muchos
casos. Los síntomas cuando están
presentes son variables, en los individuos con CMML tipo Mielodisplasia
están relacionados con las citopenias,
principalmente anemia que se encuentra en un tercio de los pacientes,
infecciones y hemorragias. En contraste los pacientes con CMML tipo
mieloproliferativo pérdida de peso,
diaforesis nocturna, malestar abdominal por esplenomegalia suelen ser
las manifestaciones. Ocasionalmente
hepatomegalia, infiltración cutánea
(leucemia cutis) y derrame en serosas
principalmente pleura.11
SANGRE PERIFERICA , H I S TO PATO L O G I A ,
I N M U N O H I S TO Q U I M I CA E
INMUNOFENOTIPO. No existe
un dato patognomónico para el
diagnóstico de CMML. En sangre
periférica monocitosis es lo característico. Los monocitos generalmente
son adultos sin algún dato morfológico que resalte pero pueden
presentar granulación anormal o
rara lobulación del núcleo o patrón
de la cromatina.12 Otros cambios en
S58
la sangre periférica son variables.
Los leucocitos pueden ser normales
o estar levemente disminuidos, con
neutropenia, pero en casi la mitad
de los casos están incrementados no
solo por monocitos, sino también
por neutrofilia.13 Los promielocitos
y mielocitos son generalmente
<10% de los leucocitos. Disgranulopoyesis, incluyendo neutrófilos
hipolobulados o alteraciones en
la lobulación del núcleo, anormal
granulación del citoplasma, es presente en muchos casos, pero estos
cambios son menos importantes en
pacientes que tienen leucocitosis.
En algunos casos puede ser difícil
hacer la diferencia entre neutrófilos hipogranulares con monocitos
displásicos. Leve basofília puede
presentarse. El número de eosinófilos generalmente es normal o con
leve incremento. Anemia frecuentemente normocítica o algunas veces
macrocítica es común. El número
de plaquetas es variable, pero trombocitopenia moderada es frecuente.
Plaquetas grandes atípicas pueden
observarse.13
En el aspirado la médula ósea se
encuentra hipercelular en el 75%
de los casos, pero puede ser normocelular e incluso hipocelular.8,14
La proliferación de los granulocitos
es el hallazgo mas notable en la
médula ósea, pero incremento en
los precursores eritroides puede ser
encontrado también.14 Proliferación
de la línea monocítica esta invariablemente presente, pero puede ser
difícil verlos en la biopsia o aspirado
de médula ósea. Disgranulopoyesis
similar a la encontrada en la sangre,
esta presente en la médula ósea y
diseritropoyesis, con sideroblastos
en anillo, núcleo de forma irregular y cambios megaloblastoides se
presenta en la mitad de los pacientes.15 Los hallazgos de la biopsia de
médula ósea en los pacientes con
CMML-1 y CMML-2 generalmente
son hipercelulares con relación alta
Mieloide: Eritroide 9.5 ±1.9 y 11.7
3.33 respectivamente. Eritropoyesis es fácilmente determinada por
tinciones de H&E, especialmente
en CMML-1. Diseritropoyesis no
es significativa en CMML. Los
cambios megaloblastoides se presentan en grado variable en 55%
de los pacientes con CMML-1 y
33% de casos con CMML-2. La
Disgranulopoyesis es más difícil de
apreciar en biopsia de médula ósea
comparado con el aspirado. La localización anormal de precursores
inmaduros esta presente en 57% de
pacientes con CMML-1 y en todos
los casos de CMML-2. El número de
megacariocitos se puede encontrar
normal, aumentado o en ocasiones
disminuido, variando en tamaño de
normal a pequeño. Ellos muestran
variación en la lobulación del núcleo tanto con hipolobulación o
hiperlobulación. Los linfocitos están
aumentados en la mas de la tercera
parte de los pacientes con CMML.
En 65% de los paciente con CMML1 tienen leve a moderado grado de
fibrosis reticulínica, mientras que
ésta se presenta en el 66.7% de
los pacientes con CMML-2.16 En
inmunohistoquímica las células son
positivas para CD33, CD13, MPO,
con expresión variable de CD14,
CD68R y CD123 negativas.17
ANORMALIDADES CROMOSOMICAS Y MOLECULARES. No
hay algún alteración citogenética
característica, las mas frecuentes
incluyen monosomía del 7 (3.9 a
8.5%), trisomía de 8 (4.1 a 6.3%),
cariotipo complejo incluyendo 3 o
mas anormalidades (4.4 a 6.3%),
trisomía 21 (1 a 2 %), isocromosoma 17 (1 a 2 %), deleción 5q
(1.5%) y deleción 20q (0.7 a 1%).18
19
Pérdida de la heterocigocidad debido a disomia uniparental ha sido
descrito en 50% de los pacientes
con CMML.20
Anormalidades moleculares de
los pacientes con CMML se dividen
en las siguientes categorías: a) mutaciones en control epigenético de
Libro Educativo 55 Congreso Nacional de la Agrupación Mexicana para el Estudio de la Hematología, A.C.
transcripción, como modificaciones
de histonas (EZH2, ASXL1, UTX), metilación de DNA (TET2, DNMT3A) o
ambas (IDH1, IDH2);21 b) mutaciones
en la maquinaria del empalmosoma
(SF3B1, SRSF2, U2AF35, U2AF65);22
c) Mutaciones en los genes que
regulan la señalización de citosinas
8JAK2, KRAS, NRAS, CBL Y FLT3);23
d) mutaciones en factores de transcripción y ensamble de nucleosomas
(RUNX1, SETBP1);24 e) mutaciones en
genes de respuesta al daño de DNA
(TP53).25
ESTRATIFICACION DE RIESGO. Varios modelos de riesgo
específicos de CMML han sido
desarrollados, la gran mayoría de
estos sistemas de puntaje incluyen
una variedad de características clínicas basales, como hemoglobina,
cuenta de plaquetas, cuenta absoluta de monocitos, cuenta total de
leucocitos y porcentaje de blastos
en médula ósea. Recientemente, el
impacto de las alteraciones citogenéticas y moleculares han mejorado
los índices pronósticos. El grupo español de mielodisplasia desarrollo
un nuevo modelo de puntaje que
incluye 3 categorías: bajo riesgo
(cariotipo normal o pérdida de cromosoma Y como alteración única),
alto riesgo (presencia de trisomía de
8 o anormalidades del cromosoma
7 o cariotipo complejo), y riesgo
intermedio (todas las otras anormalidades), además los subtipos
de la FAB y OMS y dependencia de
transfusión de eritrocitos, separo a
los pacientes en 4 grupos de riesgo
con una mediana de supervivencia
de 72, 31, 13 y 5 meses respectivamente.26
Itzykson y colaboradores, publicaron un puntaje pronóstico
en donde se considera el estado
de mutación ASXL1. Un puntaje
pronóstico fue calculado basado
en los siguientes cinco parámetros:
edad >65 años, leucocitos > 15
x 109/L, anemia, plaquetas <100
x 109/L y la mutación de ASXL1,
a cada parámetro se le asignó 2
puntos, excepto a los leucocitos
que se le asignaron 3 puntos. Esto
dividió a los pacientes en riesgo
bajo (0 a 4 puntos), intermedio (5
a 7 puntos) y alto ( 8 a 12 puntos).
La mediana de supervivencia total
fue de 14.4 meses en alto riesgo,
38.5 en intermedio y no alcanzada al término del estudio en bajo
riesgo.27 Patnaik y colaboradores,
desarrollaron un puntaje pronóstico incluyendo cuenta absoluta de
monocitos, presencia de blastos
circulantes, hemoglobina <10g/dl
y plaquetas <100 x 109/L, desarrollando 3 categorías de riesgo: bajo
riesgo (0 factores), intermedio (un
factor de riesgo) y alto riesgo (2 o
mas factores) con medianas de supervivencia de 32, 18.5 y 10 meses
respectivamente.28
TRATAMIENTO. Como un
síndrome mielodisplásico, el transplante alogénico de células tronco
permanece como la única opción
curativa en CMML. Esquemas de
tratamiento se muestran en la figuras 2 y 3.
El tratamiento debe ser iniciado
cuando la enfermedad este sintomática o progrese y principalmente
si alguno de los siguientes eventos
se presentan: a) anemia grave (Hb
menor de 10g/dl); b)porciento
de blastos en sangre periférica
>5% (incluyendo mieloblastos,
monoblastos y promonocitos); c)
cuenta de plaquetas £50 x 109/L;
d) cuenta de leucocitos ³30 x 109/L;
e)granulocitos inmaduros ³10% en
sangre periférica; f)manifestaciones
extramedulares de la enfermedad
como cutánea o ganglionar; g)
esplenomegalia sinomática.
La estrategia de tratamiento deberá decidirse por el fenotipo de la
enfermedad y el número de blastos
en médula ósea.
Pacientes con CMML mielodisplásico y menos de 10% de blastos
en médula ósea pueden ser tratados
con terapia de soporte para corregir
citopenias. En casos de anemia
grava Hb £10g/dl y niveles de eritropoyetina £500mU7dl deberán
recibir agentes estimulantes de eritropoyesis. Factores de crecimiento
mieloides deberán ser considerados
solo para pacientes con neutropenia
grave febril. Pacientes con blastos
³10% en médula ósea o ³5% en
sangre, deberán ser integrados a tratamiento con agentes hipometilantes
(5-azacitidina o decitabina). Pacientes menores de 60 años deberán ser
considerados para alo transplante.
Pacientes con CMML mieloproliferativa con bajo número de
blastos deberán ser tratados con
terapia citorreductora. Hidroxiurea
es el medicamento de elección
para control proliferativo de células
mielomonocíticas y reducir la organomegalia. Los pacientes resitentes
a hidroxiurea deberán recibir trata-
Monocitos > 1g/l
Eliminar BCR-ABL
Eosinofilia
PDGFR / FGFR
Celulas cebadas kit
Otros: asxl1
Cariotipo complejo
Si (NLM-Eo)
Imatinib
SI (SM)
¿TKI?
Si
Transplante
Figura 2.
S59
Volumen 15, Suplemento 1, 2014
Revista de Hematología
Cuenta de leucocitos
<13 g/l
>13 g/l
IPSS
Factores
de mal
pronóstico
Bajo, INT1
Mejor tratamiento
de soporte
INT2, Alto
Si
<70 Años tph o hipometilantes
>70 Años hipometilantes
No
Hidroxiurea
Figura 3.
mientos citolíticos para evitar un
rápido incremento en la cuenta de
leucocitos. Etoposido, dosis bajas
de citarabina han sido reportados
útiles en estos casos. Agentes hipometilantes deberán ser usados
en el contexto de pruebas clínicas.
Pacientes con alto número de blastos, deberán recibir tratamiento con
poliquimioterapia seguido de ser
posible con alotransplante.29
1.
2.
3.
4.
S60
Referecnicas
Vardiman JW, Thiele J, Arber DA, et
al. The 2008 revision of the World
Health Organization (WHO) classification of myeloid neoplasms
and acute leukemia: Rationale and
important changes. Blood 2009;
114: 937-951
Elliott, M.A. Chronic neutrophilic
leukaemia and chronic myelomonocytic leukaemia: WHO defined.
Best Practice & Research. Clinical
haematology, 2006; 19, 571–593.
Orazi, A., Bennett, J., Germing, U.,
Brunning, R., Bain, B. & Thiele, J.
Chronic myelomonocytic leukaemia.
In: WHO Classification of Tumours of
Haematopoietic and Lymphoid Tissues (ed. by S. Swerdlow, E. Campo,
N. Lee Harris, E.S. Jaffe, S.A. Pileri, H.
Stein, J. Thiele & J. Vardiman), 2008;
pp. 76–79. IARC Press, Lyon.
Bennett, J.M., Catovsky, D., Daniel,
M.T., Flandrin, G., Galton, D.A., Gralnick, H., Sultan, C. & Cox, C. The chronic myeloid leukaemias: guidelines
for distinguishing chronic granulo-
cytic, atypical chronic myeloid, and
chronic myelomonocytic leukaemia.
Proposals by the French–American–
British co-operative leukae- mia
group. British Journal of Haematology, 1994; 87: 746–754.
5. Breccia, M., Latagliata, R., Mengarelli, A., Biondo, F., Mandelli, F. & Alimena, G. (2004) Prognostic factors in
myelodysplastic and myeloproliferative types of chronic myelomonocytic
leukaemia: a retrospective analysis of
83 patients from a single institution.
Haematologica, 89, 866–868.
6. Muramatsu H, Makishima H, Maciejewski JP. Chronic myelomonocytic
leuke- mia and atypical chronic myeloid leukemia: Novel pathogenetic
lesions. Semin Oncol 2012;39:67–73.
7. Osca-Gelis G, Puig-Vives M, Saez M et al.
Incidence and survival of chronic myelomonocytic leukemia in Girona (Spain):
a population-based study, 1993-2007.
Leuk Res 2012; 36 (10): 1262-6.
8. Storniolo AM, Moloney WC, Rosenthal DS, Cox C, Bennet JM. Chronic myelomonocytic leukemia. Leukemia 1990; 4: 766-770
9. Beran M. Chronic myelomonocytic leukemia. Cancer Treat Res
2008;142:107– 132.
10. Aul C,Bowen DT, Yoshida Y. Pathogenesis, etiology and epidemiology of
myelodysplastic syndromes. Haematologica 1998; 83: 71 – 86.
11. Parikh SA and Tefferi A. Chronic myelomoncytic leukemia: 2013 update
on diagnosis, risk stratification, and
management. Am J Haematol. 2013;
88: 968-974.
12. Kouides PA, Bennett JM. Morphology
and classification of myelodysplastic
síndromes and their pathologic variants.
Semin Hematol 1996; 33: 95 – 110.
13. Martiat P, Michaux JL, Rodhain J.
Philadelphia-negative (Ph-) chronic
myeloid leukemia (CML): comparison
with Ph+ CML and chronic myelomonocytic leukemia. The Groupe
Francais de Cytogenetique Hematologique. Blood 1991; 78: 205 – 211.
14. Michaux JL, Martiat P. Chronic myelomonocytic leukemia (CMML) –a
myelodysplastic or myeloproliferative síndrome? Leuk Lymphoma 1993;
9: 35 – 41.
15. Germing U, Gattermann N, Minning
H, Heyll A. Aul C. Problems in the
classification of CMML – dysplastyc
versus proliferative type. Leuk Res
1998; 22: 871 – 878.
16. Nye-Thane Ngo, Irvin A. Lampert
and Kikkeri N. Naresh. Bone marrow
trephine morphology and immunohistochemical findings in chronic
myelomonocytic leukaemia. British
Journal of Haematology, 2008;141,
771–781
17. MarianA, Rollins-Raval, Christine G
Roth. The value of immunohistochemistry for CD14, CD123, CD33,
myeloperoxidase and CD68R in
the diagnosis of acute and chronic
myelomonocytic leukaemias. Histopathology 2012; 60: 933–942.
18. Bacher U, Haferlach T, Kern W, et al.
Conventional cytogenetics of myeloproliferative diseases other than CML
contribute valid information. Ann
Hematol 2005;84:250–257.
19. Haase D, Germing U, Schanz J, et
al. New insights into the prognostic
impact of the karyotype in MDS and
correlation with subtypes: Evidence
from a core dataset of 2124 patients.
Blood 2007;110:4385–4395.
20. Grand FH, Hidalgo-Curtis CE, Ernst T,
et al. Frequent CBL mutations associated with 11q acquired uniparental
disomy in myeloproliferative neoplasms. Blood 2009;113:6182–6192.
21. Ernst T, Chase A, Zoi K, et al.
Transcription factor mutations in
myelodysplas- tic/myeloproliferative neoplasms. Haematologica
2010;95:1473–1480.
22. Patnaik MM, Lasho TL, Finke CM,
et al. Spliceosome mutations invol-
Libro Educativo 55 Congreso Nacional de la Agrupación Mexicana para el Estudio de la Hematología, A.C.
23.
24.
25.
26.
27.
28.
29.
ving SRSF2, SF3B1, and U2AF35 in
chronic myelomonocytic leukemia:
Preva- lence, clinical correlates, and
prognostic relevance. Am J Hematol
2013;88: 201–206.
Gelsi-Boyer V, Trouplin V, Adelaide
J, et al. Genome profiling of chronic
myelo- monocytic leukemia: Frequent alterations of RAS and RUNX1
genes. BMC Cancer 2008;8:299.
Damm F, Itzykson R, Kosmider O, et
al. SETBP1 mutations in 658 patients
with myelodysplastic syndromes,
chronic myelomonocytic leukemia
and sec- ondary acute myeloid leukemias. Leukemia 2013;27:1401–1403.
Itzykson R, Solary E. An evolutionary perspective on chronic myelomonocytic leukemia. Leukemia
2013;27:1441–1450.
Such E, Germing U, Malcovati L, et
al. Development and validation of a
prog- nostic scoring system for patients with chronic myelomonocytic
leukemia. Blood 2013;121:3005–
3015.
Itzykson R, Kosmider O, Renneville
A, et al. Prognostic score including
gene mutations in chronic myelomonocytic leukemia. J Clin Oncol
2013;31:2428– 2436.
Patnaik MM, Padron E, Laborde RR,
et al. Mayo prognostic model for
WHO- defined chronic myelomonocytic leukemia: ASXL1 and spliceosome compo- nent mutations and
outcomes. Leukemia 2013;27:1504–
1510.
Francesco Onida, Giovanni Barosi,
Giuseppe Leone, Luca Malcovati, Enrica Morra, Valeria Santini,
Giorgina Specchia, and Sante Tura.
Management recommendations for
chronic myelomonocytic leukemia:
consensus statements from the SIE,
SIES, GITMO groups. Haematologica
2013; 98(9): 1344 – 1352.
MANEJO DE TROMBOCITEMIA
ESENCIAL EN LA ERA DE JAK2
Dr. Gustavo Jony Ramos Blas
Hospital de Especialidades del
Centro Médico Nacional Siglo XXI,
IMSS. México, DF.
Av. Cuauhtémoc 330, Col. Doctores. México, DF.
dr.ramosblas@gmail.com
INTRODUCCION. La trombocitemia esencial (TE) se clasifica
actualmente como una neoplasia
mieloproliferativa crónica, la cual
es una categoría heterogénea de
enfermedades clonales de la célula tronco hematopoyética que
también incluyen la pocitemia
vera (PV), la mielofibrosis primaria
(MFP), la leucemia mieloide crónica
(LMC) y las neoplasias mieloproliferativas atípicas (no clasificables).
Estas entidades característicamente
se presentan con una baja frecuencia y pueden estar interpoladas
entre sí, así como con otro tipo
de procesos hematológicos, tanto
benignos como malignos. [1]
El descubrimiento de la mutación del gen de la cinasa de Janus
2 (JAK2 V617F), una cinasa esencial
para el desarrollo normal de eritrocitos, granulocitos y plaquetas,
la cual está presente en muchos
pacientes con PV, TE y MFP, permitió conocer algunos mecanismos
moleculares involucrados en la
alteración de la hematopoyesis
que ocurre en estas enfermedades,
así como servir como herramienta
diagnóstica para poder distinguirlas
de otros procesos mieloproliferativos (específicamente LMC) y una
oportunidad para desarrollar terapias blanco que evitarían los efectos
tóxicos asociados con los agentes
quimioterápicos utilizados de forma
convencional en su tratamiento
(hidroxiurea, preparados de interferones y, en casos más agresivos,
quimioterapia). [2,3]
En los últimos 5 años se han
desarrollado diversos inhibidores
de JAK2, reportándose su utilidad
en los pacientes con mielofibrosis
primaria y secundaria a PV y TE;
sin embargo, el empleo de estos
fármacos también se ha extendido
a pacientes con PV y TE. [4]
De manera adicional, se han
descubierto eventos epigenéticos que están involucrados en el
fenotipo de las neoplasias mielopro-
liferativas y que podrían contribuir
en la transformación leucémica
de estas entidades. Algunas de las
alteraciones descritas, incluyen
mutaciones en ASXL1, DNMT3A,
EZH2, IDH1, IDH2 y TET2. Estos
podrían ser más adelante potenciales blancos terapéuticos como
parte de la terapia epigenética de
estas entidades. [5 – 9]
GENERALIDADES DE LAS NEOPLASIAS MIELOPROLIFERATIVAS
CRÓNICAS. Los desórdenes mieloides se clasifican clásicamente
en leucemia mieloide aguda (LMA)
y desórdenes mieloides crónicos
(DMC), basados en la presencia
o ausencia, respectivamente, de
los hallazgos definitorios de LMA
que incluyen la presencia de 20%
o más blastos en sangre periférica
o médula ósea [10]. Las neoplasias
mieloproliferativas (NPM) constituyen una subcategoría de los DMC
e incluyen a LMC, TE, PV y MFP
[11]
. Estas 4 entidades clínico-patológicas fueron descritas entre 1845
y 1934 y, por su comportamiento
clínico y de laboratorio, inspiraron
en 1951 a William Dameshek a
agruparlas como NMP [11]. Entre
1967 y 1981, Fialkow y colaboradores utilizaron el locus ligado a X
de glucosa 6 fosfato deshidrogenasa
como un marcador celular para
establecer a las NMP clásicas como
trastornos clonales de la célula
tronco hematopoyética. [12]
En 2005, 4 grupos independientes reportaron el descubrimiento
de una nueva mutación puntual
en el gen de JAK2 en pacientes con
NMP. Esta mutación (JAK2V617F)
induce la activación constitutiva
de la tirosin cinasa JAK2 y en
modelos animales demostró tener
un papel importante en la patogénesis de estas entidades [13 – 16].
Después del descubrimiento de
JAK2V617F, otros investigadores
han descubierto mutaciones en
genes relacionados con las vías
se señalización de factores de
S61
Volumen 15, Suplemento 1, 2014
Revista de Hematología
crecimiento hematopoyéticos,
incluyendo las mutaciones en el
exón 12 de JAK2, mutaciones de
MPL (receptor de trombopoyetina),
y, más recientemente, mutaciones
en la proteína de adaptación LNK.
[17 – 20]
Actualmente, la TE, PV y MFP se
catalogan operacionalmente como
NMP crónicas BCR-ABL negativas,
las cuales tienen su origen en una
célula tronco hematopoyética transformada, que lleva a proliferación
clonal. En términos de diagnóstico,
el sistema de clasificación de la
Organización Mundial de la Salud
(OMS) para tumores hematopoyéticos, considera a la eritrocitosis
clonal como específica de PV, y utiliza la morfología de la médula ósea
para distinguir entre TE y MFP. [21]
JAK2 V617F. JAK2 pertenece
a la familia JAK de tirosín cinasas
(TC), junto con JAK1, JAK3 y TYK2.
Estas moléculas fueron descritas
por primera vez en 1989 mediante
técnicas de reacción en cadena de
la polimerasa de ADN complementario de células hematopoyéticas.
Las cinasas JAK tienen dos dominios
TC, de ahí su nombre derivado del
dios Romano de dos caras Janus.
El dominio JH1 (JAK-Homology
1, por sus siglas en inglés) es el
dominio activo TC; el dominio JH2
está adyacente al dominio JH1 y es
catalíticamente inactivo, de ahí que
también se llame pseudo-dominio
cinasa. Es bien sabido que el propósito del dominio JH2 es regular la
actividad del dominio JH1, porque
la deleción del dominio JH2 lleva
a incremento en la actividad TC
de JAK2 y JAK3, con fosforilación
incrementada de moléculas de señalización intracelular, tales como
STAT5 (signal transducer and activator of transcription, por sus siglas
en inglés). [4,22,23]
Las moléculas de JAK están asociadas con porciones intracelulares
de receptores de citocinas, tales
como MPL, receptor de eritropo-
S62
yetina (EPO), factor estimulante de
colonias de granulocitos (FEC-G)
y receptores de interferones (IFN)_/_/_. En condiciones fisiológicas,
la unión del ligando putativo al
receptor induce la dimerización
del receptor y la activación de JAK,
con la consiguiente fosforilación
de proteínas blanco y activación
de vías de señal intracelular, incluyendo STAT5, PI3K/Akt/mTOR
(Phosphatidylinositol 3-kinase/Akt/
mammalian target of rapamycin) y
MAPKs (mitogen-activated protein
kinases). La activación de estas
vías lleva a incremento en la proliferación celular y resistencia a la
apoptosis. [4,22,23]
Neubauer y colaboradores reportaron que JAK2 es esencial
para la eritropoyesis, debido a que
embriones de ratones deficientes
de JAK2 murieron después de 12.5
días después asociado a la ausencia
de eritropoyesis definitiva [24]. En
otro estudio se demostró que los
progenitores mieloides provenientes del hígado fetal de embriones
deficientes de JAK2 no respondían
a eritropoyetina, trombopoyetina
(TPO), interleucina 3 (IL-3), factor
estimulante de colonias de granulocitos-macrófagos e interferón-_.
Esto indica que JAK2 es esencial
para la señalización a través del
receptor de EPO, TPO y receptores
de citocinas que portan una cadena
b común (CD131). [25]
La mutación JAK2 V617F representa una mutación somática de
guanina (G) por timina (T) de JAK2
en el nucleótido 1849, en el exón
14, resultando en la sustitución de
valina (V) por fenilalanina (F) en el
codón 617 [16,26]. La asociación de
JAK2V617F con NMP fue reportada
por vez primera en 2005 y de manera subsecuente, la mutación ha
sido demostrada en otros trastornos
mieloides incluyendo las neoplasias mieloproliferativas atípicas y
síndromes mielodisplásicos, así
como líneas celulares de leucemia
aguda incluyendo la eritroleucemia
humana (HEL). [14,26]
Se considera que la mutación
JAK2V617F condiciona una activación constitutiva de la cinasa JAK2.
De hecho, células de pacientes
con NMP positivas a la mutación,
muestran fosforilación incrementada de JAK2 y de vías de señal
intracelular como STAT5 y Akt. El
residuo V617 se localiza en un asa
del dominio JH2 que interactúa con
el dominio JH1. El residuo V617F,
posiblemente por interacción con la
fenilalanina del residuo F595, altera
la interacción y lleva a incremento
en la actividad del dominio JH1.
[4,27,28]
Rinaldi y colaboradores reportaron que JAK2 nuclear se detectaba
preferentemente en la fracción de
células hematopoyéticas CD34+
de pacientes con NMP, pero no en
granulocitos, eritrocitos y megacariocitos. Esto se ha demostrado
en modelos en ratones en donde
JAK2V617F únicamente inicia
enfermedad cuando se expresa en
células tronco hematopoyéticas
inmaduras. [29]
Muchas series de casos han
publicado la prevalencia de la
mutación JAK2V617F, la cual es
más común en PV (97%), comparado con TE (50-60%) y MFP
(50%) [13 – 16]. La carga de mutación
de JAK2 pareciera estar asociada
con un comportamiento clínico y
pronóstico diferente. Los pacientes
con PV generalmente son homocigotos para la mutación de JAK2, y
aquellos con una carga mutacional
alta tienen más frecuentemente
esplenomegalia y trombosis [4, 30 –
32]
. En TE, JAK2V617F se presenta
generalmente en heterocigosidad, y
los pacientes con TE y JAK2V617F
positivo muestran algunas características clínicas similares a PV, por
ejemplo, incremento en el hematocrito, y pueden eventualmente
evolucionar a PV, lo cual sugiere
que ambas son parte del mismo
Libro Educativo 55 Congreso Nacional de la Agrupación Mexicana para el Estudio de la Hematología, A.C.
espectro de enfermedad. [4,33,34]
Algunos estudios también han
asociado una carga alélica alta
de JAK2V617F con MF temprana/
prefibrótica, así como con prurito,
gran esplenomegalia y altos conteos
celulares [35]. Los métodos de reacción en cadena de la polimerasa en
tiempo real cuantitativos (RQ-PCR)
que determinan la carga alélica de
JAK2V617F han sido desarrollados
recientemente para monitorear
el curso de la enfermedad en pacientes con NMP positivos para
la mutación [36 – 38]. De manera
interesante, los estudios recientes
demuestran que la carga alélica de
JAK2V617F es significativamente
menor en pacientes con TE que en
aquéllos con PV o MFP (independientemente de si el espécimen es
sangre periférica o médula ósea) y
podría servir como un recurso de
diagnóstico para discriminar entre
PV o MFP de TE. [39]
Estas observaciones llevaron a
algunos investigadores a sugerir que
TE, PV y MFP JAK2V617F positivas
serían, por tanto, enfermedades
evolucionando de acuerdo a un
modelo continuo en el cual las 3
entidades son etapas diferentes de
una NMP: esto es, MFP representa
la fase acelerada de una NMP crónica, la cual incluye TE y PV, y la
LMA secundaria podría ser la fase
aguda. En este modelo, la carga alélica de JAK2V617F se incrementa
progresivamente de acuerdo con
los cambios en el fenotipo, con una
carga alélica baja que induce trombocitosis aislada y niveles altos que
están acompañados de incrementos en hemoglobina, leucocitosis
y esplenomegalia y, finalmente,
transformación fibrótica. [3]
En relación a la asociación
de complicaciones vasculares y
la mutación de JAK2, Campbell
y colaboradores reportaron una
pequeña influencia de complicaciones vasculares en pacientes con TE y
JAK2V617F positivo (11 de 414 en
pacientes V617F-positivo contra 2
de 362 pacientes V617F-negativo).
La presencia de la mutación de
JAK2 no se asoció con un riesgo
incrementado de desarrollar trombosis (ni arterial ni venosa) [33].
Resultados similares fueron reportados por el grupo GIMEMA, quienes
encontraron que la mutación de
JAK2 al diagnóstico no fue predictor
de ocurrencia de trombosis durante
el seguimiento de 867 pacientes
con TE. [40]
MANEJO DE LA TROMBOCITEMIA ESENCIAL EN LA ERA DE
JAK2. La TE es la más común dentro
de las NMP, con una incidencia
anual de 1.5-2 / 100,000 hab. La
mediana de edad de presentación
es de 55-60 años, aunque el diagnóstico se ha incrementado en los
últimos años en los adultos jóvenes. La entidad es más frecuente
en mujeres (1.5-2.0 veces más
que en varones). La morbilidad y
mortalidad de esta enfermedad está
predominantemente relacionada a
complicaciones tromboembólicas,
vasomotoras y, menos comúnmente, hemorrágicas. [1,4,21]
Al menos la mitad de los pacientes con TE son asintomáticos al
diagnóstico, pero durante el curso
de la enfermedad pueden ocurrir
las complicaciones vasomotoras,
trombóticas o hemorrágicas en
muchos pacientes. Puede haber esplenomegalia palpable en 25% de
los casos al diagnóstico. Las manifestaciones vasomotoras, las cuales
aparecen asociadas a la interacción
de las plaquetas con el endotelio e
inflamación de pequeñas arteriolas, se manifiestan generalmente
como síntomas en el sistema nervioso central o las extremidades.
Aproximadamente 10%-25% de los
pacientes tienen historia de eventos
tromboembólicos al momento de
ser diagnosticados con TE. [1,3,4]
La TE descubre como anormalidad incidental de laboratorio en
70% de pacientes que son diagnosticados antes de los 40 años.
Aproximadamente 4%-10% de
pacientes jóvenes con TE sufrieron
alguna complicación trombótica
o hemorrágica previa al diagnóstico. [41]
El diagnóstico de TE de acuerdo
con los criterios de la OMS 2008
requiere la ausencia de BCR-ABL
(para excluir la posibilidad de LMC),
ausencia de diseritropoyesis (para
excluir síndrome mielodisplásicos o
síndromes de sobreposición asociados con trombocitosis) y, de manera
muy importante, ausencia en médula ósea de cambios morfológicos
consistentes con mielofibrosis en
fase temprana o pre-fibrótica (los
megacariocitos en TE generalmente
son grandes, hiperlobulados y de
apariencia madura, y generalmente
no se acompañan de proliferación
mieloide o eritroide). [21]
CRITERIOS DIAGNOSTICOS
PARA TROMBOCITEMIA ESENCIAL (OMS 2008) [21] . Para el
diagnóstico son requeridos los
siguientes 4 criterios mayores:
Cuenta plaquetaria sostenida >
450 x 109/L
Biopsia de médula ósea que
muestre proliferación principalmente de megacariocitos, con
incremento en el número de megacariocitos grandes y maduros; no
debe haber incremento significativo
de granulopoyesis (con desviación
a la izquierda en la maduración
neutrofílica) o eritropoyesis
No reunir criterios de la OMS
2008 para PV, MFP, LMC, SMD u
otras neoplasias mieloides
Demostración de JAK2V617F
o de otro marcador clonal, o en
ausencia de un marcador clonal, no
evidencia de trombocitosis reactiva
La transformación a mielofibrosis es una complicación reconocida
para PV y TE, resultando en trastornos ahora llamados mielofibrosis
post-PV y mielofibrosis post-TE, de
acuerdo a lo revisado en la nomen-
S63
Volumen 15, Suplemento 1, 2014
Revista de Hematología
clatura por el Grupo Internacional
de Trabajo para la Investigación
y Tratamiento de la Mielofibrosis
(IWG-MRT, por sus siglas en inglés).
Si bien los criterios para mielofibrosis post-TE no están del todo
estandarizados, se han propuesto
y aceptado los siguientes criterios
para dicha entidad: [42]
CRITERIOS REQUERIDOS
1. Documentación previa de
diagnóstico de TE de acuerdo
con los criterios de la OMS.
2. Fibrosis de médula ósea grado
2-3 (en escala de 0-3) o grado
3-4 (en escala de 0-4)
CRITERIOS ADICIONALES (AL
MENOS 2 SON REQUERIDOS)
1. Anemia (según corresponda
por edad, género y altitud) y un
descenso de 2 g/dL del nivel de
hemoglobina basal
2. Reacción leucoeritroblástica
en sangre periférica
3. Incremento en esplenomegalia
(definida como un incremento
en la esplenomegalia palpable
de > 5 cm por debajo del
borde costal izquierdo, o la
apariencia de una nueva esplenomegalia palpable
4. Incremento en niveles de LDH
5. Desarrollo de más de 1 de
3 síntomas constitucionales:
pérdida de peso > 10% en los
últimos 6 meses, diaforesis o
fiebre inexplicable (> 37.5 °C)
En un estudio reciente del IWGMRT se evaluaron 1104 casos de
pacientes diagnosticados como
TE y por revisión patológica se
concluyó que 891 casos cumplían
los criterios de la OMS para TE
y 180 para MF temprana/prefibrótica. Estos resultados tuvieron
significancia estadística para la
peor supervivencia global, mayor
tasa de transformación leucémica
y progresión a fibrosis en el grupo
de MF temprana en relación con
el de TE; sin embargo, el riesgo de
trombosis fue similar para ambos
grupos. Con base en lo anterior, se
S64
ha reiterado en las últimas publicaciones la importancia de confirmar
el diagnóstico de TE verdadera en
cualquier paciente con diagnóstico
previo de TE. [43]
En TE (definida de acuerdo con
los criterios de la OMS 2008), la
expectativa de vida es cercana a lo
normal y el riesgo de progresión a
leucemia o fibrosis, en los primeros
10 años del diagnóstico, es menor
del 1%. Esto es particularmente
cierto en pacientes jóvenes sin
historia de trombosis [43]. El IWGMRT ha definido como factores de
pobre pronóstico: edad > 60 años (2
puntos), cuenta de leucocitos > 11 x
109/L (1 punto) e historia de trombosis (1 punto). El IPSET (international
prognostic score for essential thrombocythemia) utiliza esos 3 factores
de riesgo y clasifica a los pacientes
en 3 categorías de riesgo: bajo (0
puntos), intermedio (1-2 puntos) y
alto (3 o más puntos). Asimismo, el
estudio del IWG-MRT identificó la
cuenta plaquetaria > 1000 x 109/L e
historia de trombosis como predictores de transformación leucémica,
y la ausencia de JAK2V617F, mayor
edad y anemia como predictores de
progresión a MF. [43,44]
Si bien la edad > 60 años y la
historia previa de trombosis son los
principales factores de riesgo para
trombosis y definen el riesgo alto
tradicionalmente en TE, el IWGMRT documentó en su estudio
previo a la edad > 60 años, historia
de trombosis, factores de riesgo
cardiovascular, cuenta leucocitaria > 11 x 109/L y la presencia de
JAK2V617F como predictores independientes de trombosis arterial, y
al género masculino como predictor
de trombosis venosa [45]. El riesgo
de trombosis fue de 1.03%/año en
riesgo bajo, 2.35%/año en riesgo
intermedio y 3.56%/año en riesgo
alto. [45,46]
Con respecto a las complicaciones hemorrágicas, el estudio del
IWG-MRT reportó que éstas ocu-
rrían comúnmente en individuos
de mayor edad, con historia previa
de hemorragia o que estuvieran
recibiendo terapia con aspirina.
La trombocitosis extrema (> 1000
x 109/L ó > 1500 x 10 9/L), en
ausencia de terapia con aspirina,
no se relacionó con hemorragia
excesiva. [47]
En vista del riesgo relativamente
alto de trombosis residual, en ciertos grupos de pacientes con TE, se
recomiendan hacer algunas modificaciones en el tratamiento estándar.
Por ejemplo, se puede optimizar la
terapia antiplaquetaria cambiando
el esquema de dosis baja de aspirina
de una toma al día por dos tomas
al día, basados en la observación
de que tal modificación vence la
resistencia bioquímica a la aspirina.
La intensificación de la terapia citorreductora constituye otra opción
terapéutica con el potencial de
poder reducir el riesgo de trombosis
recurrente. Lo anterior con base en
lo observado en pacientes con PV
en quienes la terapia citorreductora
afecta favorablemente el riesgo de
trombosis. [46,48]
TRATAMIENTO DE ELECCIÓN
PARA PACIENTES QUE REQUIEREN TERAPIA CITORREDUCTORA.
Los principales fármacos citorreductores actualmente empleados
en el tratamiento de pacientes con
TE de riesgo alto son hidroxiurea,
anagrelide e interferón alfa. Sólo
hidroxiurea y anagrelide han sido
estudiados en estudios aleatorizados. El primer estudio fue realizado
en Italia y evaluó 114 pacientes con
TE quienes fueron aleatorizados
para recibir hidroxiurea contra
no terapia citorreductora, documentándose mayores episodios de
trombosis (14 vs 2, p = 0.003) en el
grupo control. Este estudio sentó las
bases para considerar a la hidroxiurea como terapia estándar para
pacientes con TE de riesgo alto. [49]
El segundo estudio fue efectuado en Reino Unido y comparó
Libro Educativo 55 Congreso Nacional de la Agrupación Mexicana para el Estudio de la Hematología, A.C.
hidroxiurea + aspirina contra anagrelide + aspirina en 809 pacientes
con TE de riesgo alto. En este estudio se documentaron mayores
episodios de trombosis arterial,
hemorragia mayor y mielofibrosis
en el grupo de anagrelide + aspirina
(p = 0.004, 0.008 y 0.01, respectivamente); sin embargo, los episodios
de trombosis venosa fueron menos
frecuentes en el grupo tratado con
anagrelide (p = 0.006). [50]
Recientemente Gisslinger y colaboradores reportaron en el estudio
ANAHYDRET que anagrelide es no
inferior a hidroxiurea como terapia
citorreductora y para prevención
de complicaciones trombóticas en
pacientes con TE diagnosticados
de acuerdo con los criterios de la
OMS 2008. [51] Asimismo, Gugliotta
y colaboradores reportaron recientemente el empleo de anagrelide
+ hidroxiurea en pacientes con TE
de riesgo alto con pobre respuesta
a la monoterapia, con resultados
satisfactorios. [52]
Interferón alfa ha sido evaluado
en 27 estudios clínicos incluyendo
292 pacientes con TE de riesgo
alto, con tasas de respuesta global
de reducción plaquetaria del 85%,
reducción de esplenomegalia (cuando estuvo presente) en 66% de los
pacientes [53]. Samuelsson y colaboradores publicaron en 2006 los
resultados de interferón alfa pegilado
en el tratamiento de pacientes con
TE, reportando una reducción de la
cuenta plaquetaria en 29 de 42 pacientes (69% de respuesta completa),
pero sólo 19 pacientes mantuvieron
la respuesta a 2 años. [54]
Desde 2011 iniciaron los
primeros estudios con el uso de inhibidores de JAK2 en el tratamiento
de PV y TE refractarios a tratamiento
convencional con hidroxiurea. En el
caso de TE, el criterio de inclusión
fue una cuenta plaquetaria > 600
x 109/L [4].
En el estudio INCB018424 la
dosis empleada del fármaco fue de
25 mg dos veces/día. Los criterios
de respuesta fueron evaluados de
acuerdo a las recomendaciones del
European LeukemiaNet. En pacientes con TE, el fármaco INCB018424
condicionó una reducción rápida y
sostenida en la cuenta plaquetaria,
con buena tolerancia. La mediana
de cuenta plaquetaria basal fue
de 884 x 109/L y la mediana de
reducción fue de 558 x 109/L a
los 6 meses de tratamiento. Entre
11 pacientes con cuenta de leucocitos > 10 x 109/L al inicio del
tratamiento, todos normalizaron
la cuenta de leucocitos. Hubo
mejoría en el tamaño del bazo
(100%), prurito (75%), dolor óseo
(55%), diaforesis (46%) y parestesias periféricas (40%). La respuesta
por criterios estándar fue de 62%
(41% de respuesta completa y
21% de respuesta parcial) y por los
criterios del European LeukemiaNet
la respuesta global fue 90% (13%
de respuesta completa y 77% de
respuesta parcial). [55]
El otro estudio con inhibidores
de JAK2 fue el CEP-701, en el cual
se incluyeron pacientes con TE de
riesgo alto JAK2V617F positivo.
Este estudio incluyó 12 pacientes
con TE, de los cuales el 25% había
presentado episodios trombóticos
previos. La mediana de la carga
alélica de JAK2V617F fue de 40%.
El objetivo primario de este estudio
fue la reducción de la carga alélica
de JAK2V617F. No se observó mejoría en la cuenta de leucocitos ni
plaquetas y, de hecho, en algunos
pacientes se observó incremento
en las cuentas de leucocitos y
plaquetas durante el tratamiento.
La reducción de la carga alélica de
JAK2V617F > 15% fue observada
en 20% de los pacientes evaluables.
Como principales efectos secundarios del fármaco se reportaron
eventos gastrointestinales. Dentro
de los eventos adversos severos se
reportaron trombosis venosa grave
(n = 3), trombosis arterial (n = 2) y
un episodio de trombosis venosa
profunda no severa. El estudio concluyó que la actividad de CEP-701
era limitada en pacientes con TE y
que no era suficiente para reducir
el riesgo de trombosis. [56]
CONCLUSIONES: RECOMENDACIONES DE MANEJO GENERAL
DE PACIENTES CON TROMBOCITEMIA ESENCIAL CON BASE EN
LA EVIDENCIA
1. Pacientes > 60 años o con
historia de trombosis mayor
o hemorragia mayor o con
cuenta plaquetaria > 1500 x
109/L deberían recibir terapia
citorreductora. Los pacientes
con historia de trombosis venosa requieren anticoagulación
sistémica, adicional a la terapia
citorreductora (la duración
de la terapia anticoagulante
dependerá de si el evento es
provocado o no. En caso de
ser un evento trombótico no
provocado, la anticoagulación
deberá ser indefinida)
2. La meta de la terapia citorreductora será mantener cuenta
plaquetaria entre 400 y 600
x 109/L. La cifra más baja se
recomienda para pacientes
con historia de evento de
trombosis mayor. Una cuenta
de plaquetas de 600 x 109/L
puede ser un límite apropiado
para pacientes con riesgo alto
de toxicidad (ya que requerirán
dosis mayores a las estándar)
3. El grupo GIMEMA considera
candidatos de terapia citorreductora a aquéllos pacientes
con edad entre 40 y 60 años
si tienen cuenta plaquetaria >
1000 x 109/L y tienen factores
de riesgo cardiovascular o
trombofilia familiar, o sufren
sintomatología vasomotora
severa, como eritromelalgia,
a pesar de terapia antiplaquetaria
4. La terapia citorreductora de
elección es hidroxicarbamida
S65
Volumen 15, Suplemento 1, 2014
Revista de Hematología
(hidroxiurea). Para pacientes menores de 40 años de
edad que son candidatos a
terapia citorreductora, interferón o anagrelide pueden ser
considerados tratamientos de
primera línea. En caso de efectos secundarios que afecten la
calidad de vida del paciente o
exista mayor riesgo de toxicidad con el uso de interferón o
anagrelide, se recomienda el
empleo de hidroxiurea
5. Interferón y anagrelide deberían ser considerados como
terapia de segunda línea en
pacientes con TE de riesgo
alto, refractarios o intolerantes
a hidroxiurea. Los criterios de
resistencia o intolerancia a hidroxiurea fueron establecidos
por el IWG-MRT e incluyen:
cuenta plaquetaria > 600 x
109/L después de 3 meses con
al menos 2-2.5 g/día de hidroxiurea; cuenta plaquetaria
> 400 x 109/L y leucocitos <
2.5 x 109/L o hemoglobina < 10
g/dL con cualquier dosis de hidroxiurea; presencia de úlceras
en las piernas u otras manifestaciones mucocutáneas
inaceptables con cualquier
dosis de hidroxiurea; fiebre
relacionada a hidroxiurea
6. Está recomendada dosis baja
de aspirina para pacientes
con manifestaciones microcirculatorias o con un evento
vascular arterial mayor reciente
(accidente cerebrovascular
isquémico, ataque isquémico
transitorio, oclusión arterial periférica, infarto del miocardio,
angina inestable) o evidencia
clínica o de laboratorio de
enfermedad arterial coronaria.
En caso necesario, podrán administrarse hasta dos dosis/día
de aspirina
7. Clopidogrel (a dosis de 75 mg/
día), debería reservarse para
pacientes que tienen contrain-
S66
dicación mayor para el empleo
de aspirina (intolerancia o alergia a aspirina, gastritis o úlcera
péptica documentada)
8. La terapia antiplaquetaria debería ser interrumpida
inmediatamente en caso de
hemorragia clínicamente significativa y mantener suspendida al
menos una semana antes de cirugía electiva (intervenciones de
alto riesgo de hemorragia o en
las cuales la menor hemorragia
puede resultar en complicaciones que comprometan la vida,
como neurocirugía). No se deberán prescribir o auto-administrar
fármacos anti-inflamatorios no
esteroideos en asociación con
terapia antiplaquetaria
9. En mujeres fértiles con TE de
bajo riesgo, se recomienda
terapia antiplaquetaria, particularmente en presencia de
10.
11.
12.
13.
historia de síntomas microvasculares o con pérdidas
gestacionales previas
Todas las embarazadas deberían recibir terapia profiláctica
con heparina de bajo peso molecular por 6 semanas durante
el puerperio
Mujeres con TE de riesgo alto
deberían recibir profilaxis con
heparina de bajo peso molecular durante el embarazo y
al menos 6 semanas durante
el puerperio
Las mujeres con un episodio
trombótico (periférico, placentario) durante el embarazo,
deberían recibir heparina de
bajo peso molecular a dosis
terapéutica hasta al menos 6
semanas en el puerperio
Mujeres embarazadas que
son candidatas a terapia citorreductora, deberían recibir
Figura 1. Tomado de: Leukemia (2013) 27, 1617–1620
Figura 2. Tabla de resultados de estudios clinicos con inhibidores de jak2 en te.
Tomado de: Clinical Lymphoma, Myeloma & Leukemia, Vol. 11, No. S1, S28-36©
2011
Libro Educativo 55 Congreso Nacional de la Agrupación Mexicana para el Estudio de la Hematología, A.C.
interferón. En presencia de
efectos secundarios que pongan en peligro la vida, estas
pacientes podrían recibir anagrelide o hidroxiurea
14. En pacientes con TE refractaria
a hidroxiurea, los inhibidores
de JAK2 pueden llevar a una
mejoría en la cifra plaquetaria
y en síntomas constitucionales;
sin embargo, su papel como
primera línea en esta entidad
aún no es claro
Referencias
1.
Tefferi A, Barbui T. bcr/abl negative,
classic myeloproliferative disorders:
diagnosis and treatment. Mayo Clin
Proc. 2005;80:1220-32
2. Schafer AI. Molecular basis of the
diagnosis and treatment of polycythemia vera and essential thrombocythemia. Blood 2006;107:421422
3. Kiladjian JJ. The spectrum of JAK2positive myeloproliferative neoplasms. Hematol Am Soc Hematol
Educ Program. 2012;2012:561-566
4. Santos F, Verstovsek S. JAK2 inhibitors: are they the solution?. Clin
Lymphoma, Myeloma Leuk 2011.
Jun;11 Suppl 1:528-36
5. Abdel-Wahab O, Mullally A, Hedvat
C, et al. Genetic characterization of
TET1, TET2, and TET3 alterations
in myeloid malignancies. Blood.
2009;114(1):144-147
6. Carbuccia N, Murati A, Trouplin V, et
al. Mutations of ASXL1 gene in myeloproliferative neoplasms. Leukemia
2009;23(11):2183-2186
7. Delhommeau F, Dupont S, Della
Valle V, et al. Mutation in TET2 in
myeloid cancers. N Engl J Med.
2009;360(22):2289-2301
8. Gelsi-Boyer V, Trouplin V, Adelaide J,
et al. Mutations in polycomb-associated gene ASXL1 in myelodysplastic
syndromes and chronic myelomonocytic leukaemia. Br J Haematol.
2009;145(6):788-800
9. Langemeijer SM, Kuiper RP, Berends M,
et al. Acquired mutations in TET2 are
common in myelodysplastic syndromes. Nat Genet. 2009;41(7):838-842
10. Vardiman JW, Brunning RD, Harris
NL. WHO histological classification
11.
12.
13.
14.
15.
16.
17.
18.
19.
20.
21.
of chronic myeloproliferative diseases. In: Jaffe ES, Harris NL, Stein H,
et al. World Health Organization
Classification of Tumors: Tumours of
the Haematopoietic and Lymphoid
Tissues. Lyon France: International
Agency for Research on Cancer
(IARC) Press: 2001:17-44
Dameshek W. Some speculations on
the myeloproliferative syndromes.
Blood 1951;6:372-375
Fialkow PJ. Cell lineages in hematopietic neoplasia studied with
glucose-6-phosphate dehydrogenase
cell markers. J Cell Physiol Suppl.
1982;1:37-43
Baxter EJ, Scott LM, Campbell PJ,
et al. Acquired mutation of the
tyrosine kinase JAK2 in human
myeloproliferative disorders. Lancet
2005;365:1054-61
James C, Ugo V, Le Couedic JP, et
al. A unique clonal JAK2 mutation
leading to constitutive signalling
causes polycythaemia vera. Nature
2005;434:1144-8
Kralovics R, Passamonti F, Buser AS,
et al. A gain-of-function mutation of
JAK2 in myeloproliferative disorders.
N Engl J Med 2005;352:1779-90
Levine RL, Wadleigh M, Cools J, et al.
Activating mutation in the tyrosine
kinase JAK2 in polycythemia vera,
essential thrombocythemia and myeloid metaplasia with myelofibrosis.
Cancer Cell 2005;7:387-97
Beer PA, Campbell PJ, Scott LM, et al.
MPL mutations in myeloproliferative
disorders: analysis of the PT-1 cohort.
Bloor 2008;112:141-9
Pikman Y, Lee BH, Mercher T, et
al. MPLW515L is a novel somatic
activating mutation in myelofibrosis
with myeloid metaplasia. PLoS Med
2006;3:e-270
Scott LM, Tong W, Levine RL, et al.
JAK2 exon 12 mutations in polycythemia vera and idiopathic erythrocytosis. N Engl J Med 2007;356:459-68
Oh ST, Simonds EF, Jones C, et al.
Novel mutations in the inhibitory
adaptor protein LNK drive JAK-STAT
signaling in patients with myeloproliferative neoplasms. Blood
2010;116:988-92
Swerdlow SH, Campo E, Harris NL, et al.
WHO Classification of Tumours of Haematopoietic and Lymphoid Tissues. 5th
22.
23.
24.
25.
26.
27.
28.
29.
30.
31.
32.
Ed. Geneva, WHO;2008.(IARC WHO
Classification of Tumours n.2)
Kim E, Abdel-Wahab O. Focus on the
epigenome in the myeloproliferative
neoplasms. Hematol Am Soc Hematol Educ Program. 2013;2013:538544
Gäbler K, Behrmann, Haan C. JAK2
mutants (e.g., JAK2V617F) and their
importance as drug targets in myeloproliferative neoplasms. JAK-STAT
2:3.2013;e25025:1-17
Neubauer H, Cumano A, Muller M,
et al. JAK2 deficiency defines an
essential development checkpoint
in definitive hematopoiesis. Cell
1998;93:397-409
Parganas E, Wang D, Stravopodis D,
et al. JAK2 is essential for signaling
through a variety of cytokine receptors. Cell 1998;93:385-95
Tefferi A. Classification, Diagnosis
and Management of Myeloproliferative Disorders in the JAK2V617F
era. Hematol Am Soc Hematol Educ
Program. 2006;2006:240-245
Lindauer K, Loerting T, Liedl KR, et al.
Prediction of the structure of human
Janus kinase 2 (JAK2) comprising
the two carboxi-terminal domains
reveals a mechanism for autoregulation. Protein Eng 2001;14:27-37
Dusa A, Mouton C, Pecquet C, et al.
JAK2V617F constitutive activation
requires JH2 residue F595: a pseudokinase domain target for specific
inhibitors. PLoS One 2010;5:e11157
Rinaldi CR, Rinaldi P, Alagia A, et
al. Preferential nuclear accumulation of JAK2V617F in CD34+ but
not in granulocytic, megakaryocytic or erythroid cells of patients
with Philadelphia-negative myeloproliferative neoplasia. Blood
2010;116:6023-6
Scott LM, Scott MA, Campbell PJ,
et al. Progenitors homozygous for
the V617F mutation occur in most
patients with polycythemia vera,
but not essential thrombocythemia.
Blood 2006;108:2435-7
Tefferi A, Lasho TL, Schwager SM, et
al. The clinical phenotype of wildtype, heterozygous, and homozygous
JAK2V617F in polycythemia vera.
Cancer 2006;106:631-5
Vannucchi AM, Antonioli E, Guglielmelli P, et al. Clinical profile of
S67
Volumen 15, Suplemento 1, 2014
Revista de Hematología
33.
34.
35.
36.
37.
38.
39.
40.
41.
42.
S68
homozygous JAK2V617F mutation
in patients with polycythemia vera
or essential thrombocythemia. Blood
2007;110:840-6
Campbell PJ, Scott LM, Buck G, et al.
Definition of subtypes of essential
thrombocythemia and relation to polycythemia vera base don JAK2V617F
mutation status: a prospective study.
Lancet 2005;366:1945-53
Wolanskyj AP, Lasho TL, Schwager
SM, et al. JAK2 mutation in essential thrombocythemia: clinical
associations and long-term prognostic relevance. Br J Haematol
2005;131:208-13
Keohane C, Radia D, Harrison C.
Treatment and management of
myelofibrosis in the era of JAK inhibitors. Biologics: Targets and Therapy
2013;7:189-198
Passamonti F, Rumi E, Pietra D, et al.
Relation between JAK2V617F mutation status, granulocyte activation,
and constitutive mobilization of
CD34+ cells into peripheral blood in
myeloproliferative disorders. Blood
2006;107:3676-82
Tefferi A, Strand JJ, Lasho TL, et
al. Bone marrow JAK2V617F allele burden and clinical correlates
in polycythemia vera. Leukemia
2007;21:2074-5
Kittur J, Knudson RA, Lasho TL, et
al. Clinical correlates of JAK2V617F
allele burden in essential thrombocythemia. Cancer 2007;109:2279-84
Park SH, Chi H-S, Cho Y-U, et al.
The allele burden of JAK2V617F
can aid in differential diagnosis of
Philadelphia Chromosome-Negative
Myeloproliferative Neoplasm. Blood
Res 2013;48:128-32
Carobbio A, Finazzi G, Antonioli E,
et al. JAK2V617F allele burden and
thrombosis: a direct comparison
in essential thrombocythemia and
polycythemia vera. Exp Hematol
2009;37(9):1016-1021
Zhou J, Ye Y, Zeng S, et al. Impact of
JAK2V617F mutation on hemogram
variation in patients with non-reactive elevated platelet counts. PLoS
One 2013;8(2):e57856
Barosi G, Mesa RA, Thiele J, et al.
Proposed criteria for the diagnosis of post-polycythemia vera and
post-essential thrombocythemia
43.
44.
45.
46.
47.
48.
49.
50.
51.
myelofibrosis: a consensus statement from the international working
group for myelofibrosis research and
treatment. Leukemia 2008;22:437438
Barbui T, Thiele J, Passamonti F, et
al. Survival and disease progression
in essential thrombocythemia are
significantly influenced by accurate morphologic diagnosis: an
international study. J Clin Oncol
2011;29:3179-3184
Passamonti F, Thiele J, Girodon F,
et al. A prognostic model to predict
survival in 867 World Health Organization-defined essential thrombocythemia at diagnosis: a study
by the International Working Group
on Myelofibrosis Research and
Treatment. Blood 2012;120:11971201
Carobbio A, Thiele J, Passamonti F,
et al. Risk factors for arterial and
venous thrombosis in WHO-defined
essential thrombocythemia: an international study of 891 patients. Blood
2011;117:5857-5859
Barbui T, Finazzi G, Carobbio A, et
al. Development and validation of
an International Prognostic Score of thrombosis in World Health
Organization-essential thrombocythemia (IPSET-thrombosis). Blood
2012;120:5128-5133
Finazzi G, Carobbio A, Thiele J, et al.
Incidence and risk factors for bleeding in 1104 patients with essential
thrombocythemia or prefibrotic
myelofibrosis diagnosed according
to the 2008 WHO criteria. Leukemia
2012;26:716-719
Tefferi A . Overcoming “aspirin resistance” in MPN. Blood
2012;119:3377-3378
Cortelazzo S, Finazzi G, Ruggeri M,
et al. Hydroxyurea for patients with
essential thrombocythemia and a
high risk of thrombosis. N Engl J Med.
1995;332:1132-1136
Harrison CN, Campbell PJ, Buck G,
et al. Hydroxyurea compared with
anagrelide in high-risk essential
thrombocythemia. N Engl J Med.
2005;353:33-45
Gisslinger H, Gotic M, Holowiecki J, et
al. Anagrelide compared with hydroxyurea in WHO-classified essential
thrombocythemia: the ANAHYDRET
52.
53.
54.
55.
56.
study, a randomized controlled trial.
Blood 2013;121:1720-1728
Gugliotta L, Besses C, Griesshammer
M, et al. Combination therapy of
hydroxycarbamide with anagrelide
in patients with essential thrombocythemia in the evaluation of Xagrid
efficacy and long-term safety study.
Haematologica 2013 (Epub ahead
of print)
Lengfelder E, Griesshammer M,
Hehlman R. Interferon-alpha in
the treatment of essential thrombocythemia. Leuk Lymphoma.
1996;22(suppl 1):135-142
Samuelsson J, Hasselbalch H, Bruserud O, et al. A phase II trial of
pegylated interferon a-2b therapy for polycythemia vera and essential thrombocythemia. Cancer
2006;106:2397-405
Quintas-Cardama A, Vaddi K, Lui P,
et al. Preclinical characterization
of the selective JAK1/2 inhibitor
INCB018424: implications for the
treatment of myeloproliferative
neoplasms. Blood 2010;115:3109-17
Hexner EO, Serdikoff C, Jan M, et
al. Lestaurtinib (CEP701) is a JAK2
inhibitor that suppresses JAK2/STAT5
signaling and the proliferation of
primary erythroid cells from patients
with myeloproliferative disorders.
Blood 2008;111:5663-71.
LEUCEMIA DE CELULAS PELUDAS
Dr. José Ramón Rivas Llamas.
Jefe del Departamento de Hemovigilancia del Estado de Sinaloa.
Servicios de Salud de Sinaloa.
rivas@cln.megared.net.mx
Introducción. La leucemia de células peludas(LCP), leucemia de
células vellosas, también llamada
tricoleucemia o reticuloendoteliosis leucémica, es una enfermedad
linfoproliferativa crónica de células
B que involucra a la médula ósea
(MO) y al bazo, con mielofibrosis
reactiva y citopenias en sangre
periférica.1,2
En 1923 fue reconocida por
Ewald quién la denominó leukämische reticuloendotheliose y
la primera descripción detallada
Libro Educativo 55 Congreso Nacional de la Agrupación Mexicana para el Estudio de la Hematología, A.C.
la hicieron Bouroncle y cols. en
1958, quiénes la llamaron “retículoendoteliosis leucémica”. En
1966, Schrek y Donnelly, fueron
los primeros en usar la descripción
de “leucemia de células peludas”,
debido a las proyecciones irregulares del citoplasma de unas células
mononucleares anormales observadas en sangre periférica y MO.1 En
1984, Quesada y cols. reportaron
efectividad en el tratamiento de
esta enfermedad con Interferón
(IFN) y ese mismo año Spiers y
cols. informaron que la Pentostatina, un análogo de los nucleósidos
de las purinas (ANP) era capaz de
inducir remisiones completas en
algunos pacientes; en 1990 Piro y
cols. reportaron que la Cladribina,
otro ANP, produjo una remisión
completa en 11 de 12 pacientes
con LCP, con un solo ciclo del
medicamento.3,4
La LCP es una enfermedad rara
que representa alrededor del 2% de
todas las leucemias de los adultos
en los Estados Unidos de Norteamérica; alrededor de 600 nuevos
casos se diagnostican anualmente
en ese país. Se observa con mayor
frecuencia en hombres caucásicos
en edad media, con un predominio
de 4-5:1 de los hombres sobre las
mujeres y una mayor incidencia
hereditaria entre los judíos de
Europa central. Se han descritos
casos familiares y la enfermedad es
rara en personas con ascendencia
africana o asiática. Le edad media
a la presentación de la enfermedad
es 52 años y no se ha descrito en
niños o adolescentes.1,3,5,6,7
En México, Ruiz-Argüelles y
cols., en 1996, reportaron 27
casos de LCP (16 hombres y 11
mujeres) que significaron el 1.12%
de los 2,387 casos de leucemia en
adultos, predominantemente en
los estados del norte del país, en
donde las actividades agrícolas se
encuentran más desarrolladas.8 En
2012 Ruiz Delgado y cols. en Mé-
xico informaron 29 pacientes con
edad promedio de 62 años (rango
29-83), siendo 21 hombres y 8
mujeres.9 Ese mismo año, también
en México, González Rodríguez y
cols. reportaron 33 casos de LCP
con un promedio de edad de 44
años (rango 23-75).10
Biología. En la LCP se han
descrito cierto número de anormalidades cromosómicas, sin embargo
ninguna de ellas se ha observado en
forma consistente5. Las anormalidades genéticas incluyen deleciones
monoalélicas y mutaciones p53 y
BCL-6. Las alteraciones citogenéticas más comunes son la deleción
11q, deleción 17p, trisomía 12, deleción 13q y ganancias o pérdidas
de algún alelo en los cromosomas
5 y 14. No se conoce claramente
el significado clínico de estas alteraciones.1,11
En 2011, Tiacci y cols. informaron que la mutación BRAF V600E
se encontró en los 42 pacientes que
se diagnosticaron de LCP, siendo
negativa en otros padecimientos linfoproliferativos, lo que podría tener
implicaciones para su patogénesis,
diagnóstico y como blanco terapéutico,12 habiendo sido confirmado
recientemente por Blombery y cols.
y Chung y cols., sugiriendo que
las células de la LCP provienen de
progenitoras hematopoyéticas que
se diferencian a células B comprometidas que finalmente dan lugar
a la proliferación clonal de células
B de la LCP. Un producto inhibidor
de la mutación BRAF V600E, como
el vemurafenib puede ser un medicamento muy específico para esta
enfermedad.13,14
Las células vellosas de hecho
son de origen linfático, específicamente de linaje B y representan una
expansión clonal de células B maduras con características fenotípicas
de activación. Poseen rearreglos
clonales de inmunoglobulinas
y expresan los antígenos pan-B
CD19, CD20 y CD 22, así como
inmunoglobulinas de superficie,
tanto IgG como isotipos de cadenas
pesadas. Estas células característicamente expresan CD11c, CD25
y CD103, siendo negativas para
CD5 y CD10.1,11 La LCP proviene
de un sitio similar en el esquema
ontogénico de células B maduras,
sin ser células plasmáticas.
Cuadro clínico. Los pacientes con LCP característicamente
presentan citopenias periféricas,
esplenomegalia y células vellosas
circulantes. En numerosas publicaciones se menciona que la debilidad
y la fatiga se presentan en el 50% de
los casos, dolor en el cuadrante superior izquierdo o manifestaciones
de sangrado en el 10 al 15% y algunos autores describen infiltración
a la piel hasta en el 10%.5 La pancitopenia se presenta en la mitad de
los pacientes y el hallazgo de ellas
frecuentemente muestra citopenias
en diferentes combinaciones. En un
trabajo de Turner y cols. en 1978, de
102 pacientes con LCP, 86 (84.3%)
presentaron anemia, 84 (82.3%)
trombocitopenia y 78 (76.4%) neutropenia. El 25% de los pacientes
refirieron fatiga y debilidad y otro
25% presentaron equimosis debido
a la trombocitopenia, o infecciones
secundarias a la neutropenia.1
En 2011, Jones y cols. informaron de los principales hallazgos
clínicos y por laboratorio de los
pacientes con diagnóstico de LCP
al momento del diagnóstico.15
La neutropenia y la monocitopenia predisponen a estos
pacientes a infecciones oportunistas como Mycobacterium kansaii,
Pneumocystis carinii, Aspergillus,
histoplasma, Cryptococcus y Toxoplasma gondii1. En una cuarta parte
de los pacientes la esplenomegalia
dio manifestaciones de saciedad
temprana o plenitud abdominal.
La esplenomegalia es un signo
constante que está presente al inicio
de la enfermedad en el 90% de los
pacientes.1
S69
Volumen 15, Suplemento 1, 2014
Revista de Hematología
Algunos pacientes presentan
esplenomegalia asintomática como
hallazgo clínico, o una cuenta de
sangre periférica anormal como
hallazgo en una evaluación de un
padecimiento no relacionado con
la enfermedad. Las adenomegalias
palpables son raras, sin embargo
se pueden encontrar crecimientos
ganglionares internos en un estudio
tomográfico computarizado en un
tercio de los pacientes.1
Laboratorio. El diagnóstico se
basa en la identificación de los linfocitos característicos en la sangre,
MO y bazo. El estudio morfológico
al microscopio muestra que las
células peludas son mononucleares
con un núcleo central o excéntrico
que puede ser redondo, ovoide,
reniforme o plegadoy presenta una
cromatina de patrón reticular fino,
con un citoplasma escaso de color
azul-grisáceo que muestra proyecciones delgadas que dan lugar a
su nombre6 . Ocasionalmente se
observan inclusiones o gránulos en
el citoplasma que corresponden al
complejo laminar de los ribosomas,
como se confirma con el microscopio electrónico. La neutropenia
y la monocitopenia son comunes,
afectando a más del 80% de los
pacientes.1,2
Médula ósea. El estudio microscópico de las células peludas en la
MO muestra que tienen un núcleo
redondo, ovalado o en forma de
huso, separadas por grandes cantidades de citoplasma con una fina
red de fibras que dan la apariencia
de “huevo estrellado”. La infiltración medular con células vellosas
puede ser difusa o focal y puede haber dificultad para su apreciación.
La MO puede ser hipocelular con
escasa infiltración de estas células,
mezcladas con tejido hematopoyético residual. El aspirado medular
puede ser difícil debido a marcada
fibrosis por reticulina.1,6
La LCP es poco diagnosticada y
la mayoría de las veces se confunde
S70
con anemia aplástica (AA). El diagnóstico diferencial, además de la
AA, debe hacerse con la variante de
LCP, linfoma esplénico con linfocitos vellosos, leucemia de linfocitos
grandes granulosos, leucemia prolinfocítica B, síndrome mielodisplásico
hipoplásico, hemoglobinuria paroxística nocturna, leucemia linfocítica
crónica atípica, hiperesplenismo y
mielofibrosis primaria.3
Bazo. La esplenomegalia ocurre
en alrededor del 90% de los casos
de LCP, siendo el peso medio del
bazo de 1,300 g. Macroscópicamente muestra una superficie suave
de color rojo oscuro. Al microscopio de luz se aprecia que las células
peludas involucran a la pulpa roja
esplénica y por lo tanto se presenta
atrofia de la pulpa blanca, que es
reemplazada. Además, se encuentran lagos en la pulpa roja, también
llamados pseudosinusoides. Éstos
son espacios llenos de sangre con
infiltrado de células vellosas que
irrumpen en los sinusoides normales.1
Citometría, inmunofenotipo e
inmunohistoquímica. Las células
peludas expresan los antígenos panB CD19, CD20 y CD22, pero no
el CD21. Típicamente coexpresan
CD11c, CD25 y CD103. El CD103
es de gran sensibilidad y especificidad para el diagnóstico de LCP. En
el 26% de las células vellosas hay
una débil expresión del CD10 y en
5% una baja expresión del CD5.1,2
La citometría de flujo en la sangre periférica es un procedimiento
muy útil en el diagnóstico de la LCP.
En un estudio de 1993 de Robbins y
cols. 92% de 161 pacientes con LCP
tenían células identificables por citometría de flujo, mientras que solo
en el 80% de los mismos pacientes
se pudieron identificar morfológicamente. En 2001, Tytherleigh y
cols. informaron que la citometría
de flujo con CD45-PECy5 (clona
J33) fue muy útil para la detección
de LCP.1
La inmunohistoquímica de
la biopsia de MO es útil para la
detección de enfermedad residual
mínima. El L26 (anticuerpo CD20)
y el DBA.44 pueden ser usados para
teñir a las células peludas en forma
rutinaria en las muestras de parafina
de los cortes de MO1.
Indicaciones para tratamiento.
Los mayores avances en el tratamiento de la LCP se han realizado
en los últimos 25 años, inicialmente
con la llegada del IFN, seguido por
los ANP. Antes de estos avances,
la esplenectomía era el único tratamiento efectivo, logrando muy
poco beneficio con la quimioterapia convencional para leucemia
linfoide crónica o linfoma. 1 La
mayoría de los pacientes requería
esplenectomía y un tercio de los
que se operaban necesitaban un
tratamiento adicional; la mayoría
de los pacientes con enfermedad
progresiva eran manejados con
Clorambucil, con resultados relativamente buenos: en 1983, la
supervivencia a 5 años con este
esquema terapéutico era de 68%.7,16
El esperar y observar la evolución de la enfermedad es una
actitud apropiada para pacientes
con LCP asintomáticos y en quiénes
no hay citopenias significativas, ya
que el tratamiento temprano no
confiere una ventaja en la supervivencia.Solo debe considerarse
dar tratamiento a pacientes sintomáticos: con neutropenia severa o
significativa, anemia, trombocitopenia, esplenomegalia sintomática,
otros síntomas debidos a la actividad de la LCP, como la fiebre o la
sudoración profusa nocturna y las
infecciones recurrentes o graves.
Otras indicaciones de tratamiento
incluyen a la leucocitosis con
alto porcentaje de células vellosas
(cuentas leucocitarias >20x109/L),
grandes adenomegalias y/o dolorosas, vasculitis o infiltración ósea.1,2,5
Cladribina. La Cladribina (2-clorodeoxiadenosina o 2-CdA) es un
Libro Educativo 55 Congreso Nacional de la Agrupación Mexicana para el Estudio de la Hematología, A.C.
ANP resistente a la desaminación
por la enzima desaminasa de
adenosina (ADA por sus siglas en
inglés). Se administra por infusión
intravenosa (IV) continua a dosis de
0.09 mg/kg diluidos en 500 mL de
solución salina al 0.9% diariamente
por un período de 7 días. Se puede
administrar por vía IV o subcutánea
en diferentes esquemas. Los eventos
adversos incluyen fiebre, anemia,
trombocitopenia y neutropenia.
La inmunosupresión, como se
evidencia por el estudio de subpoblaciones linfocitarias, se presenta
por aproximadamente 6 a 12 meses
después de un ciclo de Cladribina.
Las complicaciones infecciosas
que se han observado después de
administrar el medicamento incluyen el herpes simple, herpes zoster,
citomegalovirus, Staphylococcus,
Streptococcus β-hemolítico, Streptococcus pneumoniae, Escherichia
coli, micrococcus, Branhamella
catarrhalis, Mycobacterium tuberculosis y Mycobacterium chelonei.
La Cladribina no debe administrarse
a pacientes con infección activa o
sin control.1,2,5
Pentostatina. La Pentostatina
(2-deoxicoformicina) es un potente
inhibidor de la ADA dando lugar a
la muerte linfocitaria. Se administra
a dosis de 4 mg/m2 de superficie
corporal (SC) cada semana, por 3
a 6 meses, hasta respuesta máxima. Los eventos adversos incluyen
fiebre, náuseas, vómito, fotosensibilidad y keratoconjuntivitis.1,2,4,5
Recientemente, Else y cols. y
Dearden y cols. informaron sus
resultados con ambos agentes.
Revisaron los expedientes de 233 y
242 pacientes respectivamente tratados con Cladribina o Pentostatina
después de un seguimiento de 16
años. Los autores han tenido gran
experiencia con ambos productos
y concluyeron que no había una
diferencia significativa con el uso
de ellos, estimando que las respuestas completas fueron del 80%
y la supervivencia media libre de
enfermedad fue de 16 años. En los
pacientes que hubo recaída, las segundas respuestas fueron elevadas y
las remisiones muy duraderas. Para
aquellos pacientes que permanecen
en remisión por 5 años, aproximadamente el 25% tendrá una recaída
alrededor de los 15 años.17,18
Interferón-alfa. El interferón-alfa
(IFN-α) induce respuestas parciales
en la mayoría de los pacientes con
LCP, pero las remisiones completas
se logran solo en la minoría de los
pacientes. Es útil en el tratamiento
de los pacientes que presentan
infecciones activas y que no son
candidatos a tratamiento con ANP
debido a que originan supresión
de células T. También ha sido útil
en pacientes que han presentado
fracaso con el uso de ANP.1,2,5
El interferón-α-2b (IFN-α-2b)
se administra a una dosis de 2
millones de unidades /m2 de SC en
inyección subcutánea tres veces a
la semana por 12 meses. También
se puede administrar a una dosis
de 3 millones de unidades por m2
de SC diario por 6 meses y después
disminuir a tres veces por semana
por otros 6 meses.1
Esplenectomía. La esplenectomía fue el primer tratamiento
estándar usado en la LCP, resultando en una rápida recuperación
de las citopenias en sangre periférica. Posterior a la esplenectomía,
aproximadamente del 40 al 60% de
los pacientes normalizan sus cuentas sanguíneas y el 90% presenta
una mejoría en por lo menos un
parámetro hematológico. La indicación actual para la esplenectomía
incluye a las infecciones activas o
no controladas, el sangrado por
trombocitopenia severa, dolor intenso o ruptura del bazo y falla a la
quimioterapia (QT), incluyendo la
Cladribina.1,2,5
Rituximab. Las células peludas expresan antígenos pan-B,
incluyendo el CD20, por lo que el
Rituximab se ha usado en pacientes
con LCP refractarios o en recaída a
la QT.1,5,16,19
Inmunotoxina BL-22. En 2001,
Kreitman y cols. demostraron la
eficacia de la inmunotoxina recombinante BL-22 en el tratamiento de
la LCP. Esta molécula contiene el
dominio variable de un anticuerpo
monoclonal anti-CD22, unido a
un fragmento de exotoxina de las
Pseudomonas.1,5,20
Experiencia en México. RuizDelgado y cols. en 2012 informaron
de su experiencia con 29 pacientes
con diagnóstico de LCP, 18 tratados con IFN de los cuales 7 (39%)
lograron remisión completa (RC),
mientras que los 11 (100%) tratados
con Cladribina consiguieron RC;
tres pacientes recayeron a los 2, 3
y 6 años después del primer ciclo
de tratamiento. La supervivencia
global a 217 meses fue del 91%9
(Fig. 2). En relación a la experiencia
de González-Rodríguez en 2012,
con 23 pacientes diagnosticados de
LCP, tratados con diferentes medicamentos de primera línea, tuvieron
RC de 77.3% y RP de 18.2%; la
supervivencia global a 1,877 días
fue del 82.6% y al momento de la
revisión 15 (65.2%) continuaban
vivos, con 4 fallecidos (2 en RC,
Cuadro 1. Características clínicas y de
laboratorio en pacientes con LCP sin
tratamiento
Esplenomegalia
60 – 70%
Hepatomegalia
40 – 59%
Adenomegalias abdomina10%
les por TAC
Anemia Hb <100 g/l
Trombocitopenia
<100x109/l
70%
80%
Cuenta leucocitaria
<5x109/l
Neutropenia <1x109/l
Monocitopenia <0.1x109/l
Células vellosas en sangre
periférica (frotis)
65%
75%
90%
95%
Tomado de referencia 15
S71
Volumen 15, Suplemento 1, 2014
Revista de Hematología
Tomado de referencia 6
Figura 1. Célula típica en sangre periféricade la LCP vista al microscopio de luz
(aumento 100 x coninmersión en aceite)
Tomado de referencia 9
Figura 2. Supervivencia global en meses
de 29 pacientes con LCP tratado con IFN
y/oCladribina.
1 en RP y 1 con LCP activa), 4
pacientes se perdieron durante el
seguimiento. La Cladribina fue el
tratamiento que produjo la mayor
tasa de respuestas.10
S72
Tratamiento de apoyo. Los
pacientes tratados con ANP deben recibir profilaxis para la
infección por Pneumocystis carinii
con cotrimazole y trimetoprim
con sulfametoxazol, hasta por
6 meses después de completado el tratamiento. Los pacientes
neutropénicos pueden necesitar
tratamiento profiláctico para infecciones bacterianas y micóticas,
así como factores estimulantes de
colonias de granulocitos. Puede ser
necesario que los productos sanguíneas que se vayan a transfundir
sean previamente irradiados en los
pacientes tratados con ANP para
reducir el riesgo de enfermedad de
injerto contra huésped.16,18,19
Enfermedad residual mínima.
Alrededor del 50% de los pacientes
que respondieron al tratamiento
con ANP y morfológicamente se encuentran en remisión completa aún
tienen enfermedad residual mínima
(ERM), como se puede comprobar por inmunohistoquímica o
citometría de flujo, significando aproximadamente el 10% de la
celularidad de MO. Sin embargo el
significado de este hallazgo no es
claro ya que la presencia de EMR
cursa asintomática y no siempre es
predictiva de recurrencia clínica,
aunque algunos autores si lo consideran, con recaídas del 20 al 30%
de los casos a 5 años y de 48% a
los 10 años.2,3 La identificación de
ERM se puede realizar con inmunohistoquímica con marcadores para
DBA.44 y CD204. El uso de Rituximab puede ser útil para eliminar la
ERM o enfermedad resistente y es
relativamente seguro.6
1.
2.
3.
4.
5.
6.
7.
8.
9.
10.
11.
12.
13.
14.
Referencias
Goodman, G.R., Bethel, K.J. and Saven,
A. Hairy cell leukemia: an update. Curr
Opin Hematol 2003; 10: 258-66.
Dearden, C. and Else, M. Hairy cell
leukemia. Curr Oncol Rep 2006; 8:
337-42.
Wanko, S.O. and De Castro, C. Hairy
cell leukemia: An elusive but treata-
15.
ble disease. The Oncologist 2006; 11:
780-9
Grever, M.R. and Lozanski, G. Modern
strategies for hairy cell leukemia. J
Clin Oncol 2011; 29: 583-90.
Riccioni, R., Galimberti, S., Petrini, M.
Hairy cell leukemia. Curr Treat Opt
Oncol 2007; 8: 129-34.
Grever, M.R. How I treat hairy cell
leukemia. Blood 2010; 115: 21-8.
Best-Aguilera, C. Avances en el tratamiento de la leucemia de células
peludas. Rev Hematol 2010; 11: 65-6.
Ruiz-Arguelles, G.J., Cantu-Rodriquez, O.G., Gomez-Almaguer, D. et
al. Hairy cell leukemia is infrequent
in Mexico and has a geographic distribution. Am J Hematol 1996; 52:
316-8.
Ruiz-Delgado, G.J., Tarin-Arzaga, L.C.,
Alarcón-Urdaneta, C. et al. Treatment
of hairy cell leukemia: Long term
results in a developing country. Hematology 2012; 17: 140-3.
González-Rodríguez, K.T., VargasRuiz, A.G. and López-Karpovitch, X.
Respuesta terapéutica y supervivencia en pacientes con leucemia
de células peludas en una Institucion
de tercer nivel. Gac Med Mex. 2012;
148: 425-9.
Krstevska, S., Genadieva-Stavrik, S.,
Sotirova, T. el al. Hairy cell leukemia
treatment: Where we are now?. Mat
Soc Med 2011; 23: 227-9.
Tiacci, E., Trifonov, V., Schiavoni, G.
et al. BRAF mutations in hairy-cell
leukemia. New Engl J Med 2011; 364;
2305-15.
Blombery, P.A., Wong, S.Q., Hewitt,
C.A. et al, Detection of BRAF mutations in patients with hairy cell leukemia and related lymphoproliferative
disorders. Haematologica 2012; 97:
780-3.
Chung, S.S., Park, J.H., Kim, E. et al.
BRAF v600e mutations occurs in
the hematopoietic stem cell compartment in hairy cell leukemia. Abs
816, 55th Annual Meeting of the
American Society of Hematology
(ASH), New Orleans, Lo. 2013.
Jones, G., Perry-Jones, N., Wilkins,
B. et al. Revised guidelines for the
diagnosis an management of hairy
cell leukemia and hairy cell leukemia
variant. Br J Haematol 2011; 156:
186-95.
Libro Educativo 55 Congreso Nacional de la Agrupación Mexicana para el Estudio de la Hematología, A.C.
16. Naik, R.R. and Saven, A. My treatment
approach to hairy cell leukemia.
Mayo Clin Proc 2012; 87: 67-76.
17. Else, M., Dearden, C.E., Matutes, E.
et al. Long-term follow-up of 233
patientes with hairy cell leukemia,
treated initially with pentostin or
cladribine, at a median of 16 years
from diagnosis. Br J Haematol 2009;
145: 733-40.
18. Dearden, C.E., Else, M. and Catovsky,
D. Long-term results for pentostatin
and cladribine treatment of hairy
cell leukemia. Leuk Lymph 2011; 52:
S21-S24.
19. Thomas, D.A., O’Brien, S., BuesoRamos, C. et al. Rituximab in relapsed
or refractory hairy cell leukemia.
Blood 2003; 102: 3906-11.
20. Kreitman, R.J., Wyndham, H.W.,
Bergeron, K. et al. Efficacy of the
anti-cd22 recombinant immunotoxin
bl22 in chemotherapy-resistant
hairy-cell leukemia. New Engl J Med
2001; 345: 241-7.
Actualización de radioterapia en L infoma de
Hodgkin ¿Cómo y cuando?
Rosales-Pérez S,1 Félix-Leyva JA1,
Flores-Balcázar CH, 2 PoitevinChacón A3
1 Departamento de Radioterapia,
Centro Medico Nacional Siglo XXI
(IMSS), Mexico, D.F., México
2 Departamento de Radioterapia,
Instituto Nacional de Ciencias Médicas y Nutrición Salvador Zubirán,
México, D.F, México
3 Departamento de Radioterapia,
Hospital Medica Sur, Mexico, D.F.,
Mexico
Autor de correspondencia:
Samuel Rosales-Pérez
Departamento de Radioterapia.
Centro Médico Nacional Siglo XXI,
UMAE Hospital de Oncología, Av.
Cuauhtémoc #330 Col. Doctores,
06725 México, D.F., México
samuel.rosales@me.com
Resumen. La radioterapia (RT) es
la modalidad única de tratamiento más efectiva en el control del
linfoma de Hodgkin (LH) y de
importancia en el control de la
enfermedad en combinación con
quimioterapia (QT). La tendencia
actual del tratamiento con RT es
la de usar campos más pequeños
y menos dosis totales con excelentes resultados en control local
minimizando los efectos tóxicos
radio-inducidos. En esta revisión
se describen los conceptos de
radioterapia a sitio involucrado (involved site radiation therapy, ISRT)
y radioterapia altamente conformal
a región ganglionar involucrada
(involved node radiation therapy,
INRT) que deben de regir la práctica
clínica actual según los recursos e
infraestructura con los que cuente
el radio-oncólogo.
También se definen los conceptos básicos de planeación
del GTV (gross tumor volume),
CTV (clinical target volume), ITV
(internal target volume) y PTV
(planning target volume) y las dosis actuales recomendadas para las
diferentes presentaciones clínicas
en el LH.
Abstract. Radiation therapy (RT)
is the most effective single modality for local control of Hodgkin
lymphoma (HL) and an important
component of theraphy in combination with chemotherapy (CT) .
The current trend in RT treatment is
to use smaller fields and less total
doses with excellent results in local
control minimizing radio-induced
toxic effects.
We described the concepts of
Involved Site Radiation Therapy
(ISRT) and highly conformal Involved Node Radiation Therapy (INRT)
that must be standard in current
clinical practice where resources
and infrastructure are available.
The basics of planning GTV
(gross tumor volume), CTV (clinical
target volume) , ITV (internal target
volume ) and PTV ( planning target
volume ) and recommended doses
for the different clinical presentations in the LH are also defined.
Introducción. La RT es efectiva
en el tratamiento del LH como
monoterapia o en combinación con
quimioterapia (QT). El pronóstico
y supervivencia de los pacientes
con LH ha mejorado por lo que
minimizar la toxicidad y efectos
secudanrios de los tratamientos a
largo plazo es esencial.
La radioterapia en LH ha evolucionado en las últimas decádas.
La tendencia actual es usar campos
localizados y menores dosis de radiación con el fin de maximizar el
control loco-regional con la minima
toxicidad.
En este resumen se presentará la
información y recomendaciones actuales de tratamiento con RT en LH.
Principios del tratamiento con
RT en LH. La planeación de RT moderna en LH incorpora los conceptos
de delimitación de volumenes publicados en el ICRU 50 y 83. El
radio-oncologo delimita un GTV
(gross tumor volume), CTV (clinical
target volume) y PTV (planning target
volume). La prescripción de la dosis
se hace al PTV. El contorneo de estos
volúmenes se realiza usando una
tomografía simple (TC). También se
pueden usar otras modalidades de
imágenes para delimitar con mayor
exactitud los blancos terapeúticos;
en la planeación de RT destaca por
su utilidad la tomografía por emisión
de positrones (PET). Siempre que
este disponible el uso del PET/CT es
recomendado (1).
La RT puede usarse como modalidad única de tratamiento,
tratamiento de consolidación y en
pacientes con enfermedad refractaria a la QT que sean candidatos
a trasplante.
RT como tratamiento primario.
La RT como modalidad única de
tratamiento es relevante y eficaz
en algunos tipos de LH. Aunque
poco común, el LH con predominio
linfocitario ganglionar EC IA y IIA
(NLPHL, por sus siglas en inglés)
puede ser tratado con RT sin QT. Las
S73
Volumen 15, Suplemento 1, 2014
Revista de Hematología
series publicadas (2 , 3) demuestran
un periodo libre de progresión (PLP)
a 15 años de 84-95% en EC I y 7385% en ECII con dosis de 20-40 Gy.
Las dosis de RT recomendadas para
estos casos no deben ser mayores a
30-35 Gy (4 ).
En NLPHL EC IB-IIB el tratamiento recomendado ( 5) es ciclos
cortos de QT con esquemas del tipo
ABVD (doxorrubicina, bleomicina,
vinblastina, dacarbacina) +/- rituximab y RT con dosis de 30-40 Gy;
el tipo y duración de QT no está
bien definido debido a la falta de
estudios aleatorizados.
Recientemente se publicó una
revisión del tema útil para la práctica clínica diaria (6).
RT en combinación con otras
modalidades terapéuticas. Los pacientes con LH clásico se dividen en
tres grupos principales: temprano
favorable, temprano no favorable y
alto riesgo. Para el grupo temprano
favorable el tratamiento recomendado es dos ciclos de QT con ABVD
y RT con dosis de 20 Gy (7). Los
pacientes del grupo temprano no
favorable reciben cuatro ciclos de
QT con ABVD y RT con dosis de 30
Gy (8, 9). El tratamiento combinado
en LH ha demostrado mejorar el
control local y supervivencia global en meta-análisis recientemente
publicados (10).
El tratamiento de los pacientes
de alto riesgo es controversial;
durante muchos años se ha considerado estándar usar de 6-8 ciclos
de QT con ABVD (11,12) aunque algunos recientemente apoyan el uso
del esquema BEACOPP intensivo
con mejores resultados oncológicos
a corto plazo pero a expensas de
mayor toxicidad (13).
El uso de RT en los estadios
clínicos avanzados es controversial
pero se recomienda en residuales
tumorales posterior a dosis plenas
de QT o en protocolos que incorporan la QT-RT secuencial (14). En estos
casos el volúmen del GTV post-QT
S74
será muy diferente al pre-QT, por
lo que el radio-oncólogo deberá
delimitar el GTV basandose en el
volumen tumoral inicial. Las dosis
en estos casos van de los 36-40 Gy.
Definición de volúmenes de RT
en LH . Recientemente el International Lymphoma Radiation Oncology
Group (ILROG) publicó (15 ) la guía
para la RT moderna en LH introduciendo la definición y diferencia de
la radioterapia altamente conformal
a región ganglionar involucrada
(involved node radiation therapy,
INRT) y la radioterapia sitio involucrado (involved site radiation
therapy, ISRT).
1. Adquisición de imágenes para
la planeación de RT. La planeación
de RT moderna requiere del uso de
la simulación 3D con tomografía
computada. Siempre que este
disponible debe usarse la información proporcionada por el PET o la
resonancia magnética (IRM) para el
contorneo del GTV y CTV.
2. Determinación del GTV y
CTV. El GTV de tratamiento debe
incluir el volumen tumoral macroscópico en todos los casos. En pacientes
donde se usó primero QT o cirugía, el
volumen del GTV deberá delimitarse
según el volumen tumoral inicial y
siempre ser parte del CTV. Por lo tanto, el volumen tumoral inicial debe
incluirse en el CTV. Los órganos de
riesgo (OAR) y estructuras normales
“claramente” no infiltradas deben de
excluirse del CTV.
El CTV debe de delimitarse
considerando los siguientes factores: calidad de la simulación,
cambios en el volumen tumoral
desde la simulación, patrones de
diseminación, enfermedad subclínica, límites y dosis a los OARs
adyacentes. Si dos o más regiones
ganglionares están afectadas a
menos de 5 cm de distancia deben
incluirse en el mismo CTV-PTV; en
el caso contrario se deberá realizar
un CTV-PTV por separado para cada
una de las regiones.
3. Determinación del ITV. El
concepto de internal target volume
(ITV) se describió en el ICRU 62 (16)
y se refiere a un márgen adyacente
al CTV que compensa el movimiento del tumor en el cuerpo. El ITV se
determina usando simulación con
tomografía 4D, por fluoroscopía o
en algunos casos basado en la experiencia y datos publicados (17). En
los tumores localizados en el tórax
inferior y/o el abdomen superior se
deben agregar márgenes de 1.5-2
cm en el eje craneo-caudal para
compensar los movimientos respiratorios; en cambio en tumores de
la cabeza y el cuello no es necesario
agregar un ITV.
4. Determinación del PTV. El
PTV es un margen que incluye el
CTV-ITV y toma en consideración
los “errores” de posicionamiento
del paciente y de la alineación de
los haces de radiación intra e interfracción. El PTV debe de considerar
el método de fijación del paciente
y verificación del tratamiento; así
entonces, podemos usar un PTV de
3-5mm en tumores de la cabeza y
el cuello si la simulación y tratamiento se realiza usando máscara
termoplástica y la verificación se
realiza con CBCT (cone beam CT).
Se puede concluír entonces que
no existe un PTV “estandar” en la
práctica de la RT.
Existen publicaciones que guían
al clínico en la determinación del
PTV según sea el caso (18).
5. Determinación de los órganos de riesgo (OARs). Los OARs son
estructuras normales adyacentes al
PTV que deben de delimitarse. Se
usan histogramas dosis-volúmen
(DVH) y se comparan con datos publicados de probable complicación,
asociado a RT, de los tejidos normales en cuestión (NTCP; normal
tissue complication probability). El
límite de dosis para cada OAR debe
de tomar en cuenta la dosis por
fracción y el volúmen parcial o total
irradiado. El Radiation Therapy On-
Libro Educativo 55 Congreso Nacional de la Agrupación Mexicana para el Estudio de la Hematología, A.C.
cology Group (RTOG) ha definido
estos parámetros para la mayoría de
los OARs (http://en.wikibooks.org/
wiki/Radiation_Oncology/Toxicity/
RTOG).
Técnica de tratamiento de RT.
El radio-oncólogo determinará la
mejor técnica de tratamiento según
el caso. No existe una técnica estandar en LH. En algunos pacientes
un arreglo “sencillo” de dos campos
antero-posterior/postero-anterior
puede ser la mejor opción para
evitar irradiar un gran volumen
de tejido sano, mientras que en
otros se requieren de técnicas mas
complejas como la radioterapia de
intensidad modulada (IMRT). Se
compara un plan tratamiento con
una técnica conformada vs IMRT
(ver fig 1).
RT sitio involucrado (ISRT)
en LH clásico estadios clínicos
tempranos. El concepto de ISRT se
Figura 1. Distribución de dosis en un
plan de tratamiento conformado-3D (izquierda) vs un plan de IMRT (derecha).
Observese la mayor dosis a pulmón
bilateral con la técnica de IMRT; en este
caso la técnica más adecuada es la 3-D.
(Tomado de: Specht L, Yahalom J, Illidge
T, et al. Modern Radiation Therapy for
Hodgkin Lymphoma: Field and Dose
Guidelines From the International
Lymphoma Radiation Oncology Group
(ILROG). Int J Radiation Oncol Biol Phys
2013 Jun 18; [Epub ahead of print]).
desarrolló según los lineamientos
de la EORTC (Association for Research and Treatment of Cancer) y
está relacionado con el concepto de
INRT. En la ISRT el CTV se determina por el GTV pre-QT y el volúmen
de irradiación es significativamente
menor a la técnica de IFRT (involved
field radiation therapy).
La ISRT se usa cuando el clínico
no puede determinar con exactitud
el volúmen tumoral pre-QT; sea por
falta de información suficiente para
hacerlo o por que los estudios de
imagen pre-QT son de mala calidad
o no compatibles con los sistemas
de planeación radioterapica. Por
lo tanto, la ISRT tendrá volúmenes
mayores de tratamiento a los de la
INRT pero menores a los de la IFRT.
RT altamente conformal a región ganglionar involucrada (INRT)
en LH clásico estadios clínicos
tempranos. La INRT se describió
en el tratamiento de LH clásico.
Está técnica reduce al máximo, pero
seguro, el GTV tomando en consideración el volúmen del tumor pre
y post-QT. La INRT debe reservarse
para casos donde se tiene toda la información disponible para delimitar
el GTV pre-QT. La INRT demanda
ciertas características:
1. La RT debe de comenzar 3-4 semanas posterior al fin de la QT.
2. En todos los pacientes es mandatorio tener disponible un
PET/CT pre y post-QT para la
planeación de RT (19).
3. La posición del paciente debe
ser la misma en el CT de simulación y en los estudios de
imagen pre y post-QT; incluyendo el PET.
4. Se debe de seguir la guía de
delimitación del CTV según la
guía publicada del ILROG (XV)
La técnica de radiación altamente conformada a región ganglionar
involucrada ha demostrado ser
segura y efectiva (20,21 ) siempre y
cuando se mantengan en estricto los
lineamientos antes mencionados.
RT en enfermedad residual
posterior a QT. Estadios clínicos
avanzados. En estadios clínicos
avanzados (LH clásico y LPHL)
muchos centro basan el tratamiento
solamente en la QT. La RT se reserva
para residuales post-QT o en casos
de enfermedad voluminosa inicial.
El GTV en estos casos será la enfermedad macroscópica residual y se
agregará un margén de 1 cm para
formar el PTV de prescripción. En lesiones de tórax inferior y/o abdomen
superior se deberan de considerar
margénes más amplios en la dirección craneo-caudal (1.5-2.0 cm).
RT en LPHL estadio clinico
temprano. Como modalidad única
de tratamiento, la RT es efectiva
en LPHL temprano. En estos casos
la RT de campo extendido (EFRT)
no ha demostrado diferencias en
comparación con campos más
reducidos (22). El CTV debe incluir
al GTV y al menos los relevos ganglionares adyacentes más margenes
más o menos generosos según la
situación clínica particular.
RT en campos más que extendidos. Estos campos cada vez se
deben de usar menos y no son
recomendados en la práctica clínica cotidiana. Se deben limitar a
pacientes en donde no hay respuesta a QT o en casos de paliación.
Siempre debe de tomarse en cuenta
la toxicidad radio-inducida.
RT en recaída y LH refractario.
La RT juega un papel importante en
el control local de la enfermedad
refractatria, sobre todo cuando la
presentación clínica de la enfermedad es localizada. La RT también es
útil en paceintes con recaída como
parte del manejo combinado con
QT de salvamento y QT a altas dosis y trasplante autólogo de células
madre (ASCT, autologous stem cell
transplantation).
Hay otros escenarios clínicos
donde la RT ha demostrado beneficio: en pacientes con recaída local
que no tienen síntomas sistémicos
S75
Volumen 15, Suplemento 1, 2014
Revista de Hematología
(23) y en pacientes con recaída local
después del ASCT, o con recaída/
progresión local después de QT;
estos pacientes pueden alcanzar
PLE de más de 5 años (24,25). En
todos estos casos el radio-oncólogo
decidirá la posibilidad de tratamiento considerando sitio y tamaño de
la lesión y en su caso la dosis de
tolerancia de los tejidos normales
si fueron previamente irradiados.
Conclusión. La RT moderna
en LH ofrece excelentes tasas de
control con campos más pequeños
y menos dosis totales. El concepto
de ISRT con su variante de INRT
debe regir la práctica clínica actual. El volúmen tumoral pre-QT
debe de ser medido, registrado y
guardado de manera electrónica
para la planeación de RT; por lo que
el radio-oncólogo debe de formar
parte del equipo multidisciplinario
y decidir el manejo inicial de estos
pacientes.
1.
2.
3.
4.
5.
S76
6.
7.
8.
9.
10.
Referencias
Rossier C, Dunet V, Matzinger O, et al.
PET/CT and radiotherapy: indications
and potential applications. Cancer
Radiother 2012;16:152-63.
Wirth A, Yuen K, Barton M, et
al. Long-term outcome after radiotherapy alone for lymphocytepredominant Hodgkin lymphoma:
a retrospective multicenter study
of the Australasian Radiation Oncology Lymphoma Group. Cancer
2005;104:1221–1229
Schlembach P, Wilder R, Jones D, et
al. Radiotherapy alone for lymphocyte-predominant Hodgkin’s disease.
Cancer J 2002;8:377–383.
Wirth A, Yuen K, Barton M, et
al. Long-term outcome after radiotherapy alone for lymphocytepredominant Hodgkin lymphoma:
A retrospective multicenter study
of the Australasian Radiation Oncology Lymphoma Group. Cancer
2005;104:1221-1229
Savage KJ, Skinnider B, Al-Mansour
M, et al. Treating limited-stage
nodular lymphocyte predominant
Hodgkin lymphoma similarly to
classical Hodgkin lymphoma with
11.
12.
13.
14.
15.
ABVD may improve outcome. Blood
2011;118:4585–4590.
Fanale M. Lymphocyte-predominant
Hodgkin lymphoma: what is the optimal treatment. Hematology Am Soc
Hematol Educ Program 2013:406-13.
Engert A, Plutschow A, Eich HT,
et al. Reduced treatment intensity in patients with early-stage
Hodgkin’s lymphoma. N Engl J Med
2010;363:640–652.
Eich HT, Muller RP, Engenhart-Cabillic, et al. Involved-node radiotherapy
in early-stage Hodgkin’s lymphoma.
Definition and guidelines of the German Hodgkin Study Group (GHSG).
Strahlenther Onkol 2008;184:406–
410.
Fermé C, Eghbali H, Meerwaldt JH, et
al. Chemotherapy plus involved-field
radiation in early-stage Hodgkin’s disease. N Engl J Med. 2007 357:1916–
1927.
Herbst C, Rehan FA, Brillant C, et
al. Combined modality treatment
improves tumour control and overall
survival in patients with early stage
Hodgkin lymphoma: a systematic
review. Haematologica 2010; 95:494500.
Engert A, Franklin J, Brillant C, et al.
Two cycles of doxorubicin, bleomycin, vinblastine, and dacarbazine
plus extended- field radiotherapy
is superior to radiotherapy alone in
early favorable Hodgkin’s lymphoma:
final results of the GHSG HD7 trial. J
Clin Oncol 2007;25:3495–3502.
Raemaekers J, Kluin-Nelemans H,
Teodorovic I, et al. The achievements
of the EORTC Lymphoma Group.
European Organisation for Research
and Treatment of Cancer. Eur J Cancer 2002;38:S107–S113.
Engert A, et al. Reduced treatment
intensity in patients with early-stage
Hodgkin’s lymphoma. N Engl J Med.
2010;363(7):640–652.
Bartlett NL, Rosenberg SA, Hoppe RT,
et al. Brief chemotherapy, StanfordV,
and adjuvant radiotherapy for bulky
or advanced-stage Hodgkin’s disease:
A preliminary report. J Clin Oncol
1995;13:1080-1088.
Specht L, Yahalom J, Illidge T, et
al. Modern Radiation Therapy for
Hodgkin Lymphoma: Field and Dose
Guidelines From the International
16. 17.
18.
19.
20.
21.
22.
23. 24.
25.
Lymphoma Radiation Oncology
Group (ILROG). Int J Radiation Oncol
Biol Phys 2013 Jun 18; [Epub ahead
of print].
ICRU. International Commission on
Radiation Units and Measurements.
Prescribing, recording, and reporting
photon therapy. (Supplement to
ICRU Report 50). ICRU Report 62.
1999.
Cai J, McLawhorn R, Read PW, et al.
Effects of breathing variation on gating window internal target volume
in respiratory gated radiation therapy.. Med Phys 2010;37:3927-34.
van Herk M. Errors and margins in
radiotherapy. Semin Radiat Oncol
2004;14:52-64.
Hutchings M, Loft A, Hansen M, et al.
Positron emission tomography with or
without computed tomography in the
primary staging of Hodgkin’s lymphoma. Haematologica 2006;91:482-489.
Paumier A, Ghalibafian M, Beaudre
A, et al. Involved-node radiotherapy
and modern radiation treatment
techniques in patients with Hodgkin
lymphoma. Int J Radiat Oncol Biol
Phys 2011;80:199-205.
Maraldo MV, Aznar MC, Vogelius IR,
et al. Involved node radiotherapy:
An effective alternative in early stage Hodgkin lymphoma. Int J Radiat
Oncol Biol Phys 2013;85:1057-1065.
Nogova L, Reineke T, Eich HT, et al.
Extended field radiotherapy, combined modality treatment or involved
field radiotherapy for patients with
stage IA lymphocyte-predominant
Hodgkin’s lymphoma: A retrospective analysis from the German Hodgkin
Study Group (GHSG). Ann Oncol
2005;16:1683-1687.
Josting A, Nogova L, Franklin J, et al.
Salvage radiotherapy in patients with
relapsed and refractory Hodgkin’s
lymphoma: A retrospective analysis
from the German Hodgkin Lymphoma Study Group. J Clin Oncol
2005;23:1522-1529.
Goda JS, Massey C, Kuruvilla J, et al.
Role of salvage radiation therapy for
patients with relapsed or refractory
Hodgkin lymphoma who failed autologous stem cell transplant. Int J Radiat
Oncol Biol Phys 2012;84:e329-e335.
Vose JM, Bierman PJ, Anderson JR,
et al. Progressive disease after high-
Libro Educativo 55 Congreso Nacional de la Agrupación Mexicana para el Estudio de la Hematología, A.C.
dose therapy and autologous transplantation for lymphoid malignancy:
Clinical course and patient follow-up.
Blood 1992;80: 2142-2148.
Estudios de laboratorio
para el diagnóstico y seguimiento de pacientes con
amiloidosis primaria generalizada
Alejandro Ruiz- Argüelles.
Clínica Ruiz Laboratorios.
aruiz@clinicaruiz.com
El término amiloidosis incluye un
grupo de entidades caracterizadas
por el depósito en los tejidos de
unas proteínas de estructura fibrilar
insoluble denominado amiloide, en
una cantidad suficiente como para
poder deteriorar la función normal
del tejido afecto. Es un trastorno
que depende de un plegamiento
determinado de la secuencia de
aminoácidos, no importando cuál
sea esta. Cualquier proteína que
adquiera ese plegamiento y esas
características físico-químicas, independientemente de la secuencia
de aminoácidos, es amiloide. De
esta manera, no existe una única
proteína del amiloide, sino que se
conocen al menos 23 proteínas humanas y 8 animales capaces de ser
precursoras del material amiloide.
El laboratorio juega un papel
importante en el diagnóstico y
seguimiento de esta alteración, y
son dos las categorías de pruebas
que pueden ser útiles. Por una
parte, pruebas generales que miden
la magnitud del daño a órganos
afectados, principalmente el riñón,
y por otro lado pruebas especiales
consideradas como biomarcadores
de la proteína anormal que se involucra en la formación del amiloide.
Proteinuria, usualmente sin
hematuria; pueden detectarse otros
hallazgos del síndrome nefrótico.
Pruebas de función renal alteradas
en hasta la mitad de pacientes.
Complemento sérico normal. La
electroforesis de proteínas demostrará pico monoclonal en la mayoría
de casos de mieloma, sin embargo,
no se detecta en casi la mitad de
pacientes con amiloidosis AL. En
muchos de estos casos se detectará
una proteína monoclonal por inmunoelectroforesis o inmunofijación.
En 2/3 de pacientes hay una proteína monoclonal en orina. No suele
detectarse proteína de Bence Jones.
En proliferaciones neoplásicas
de células productoras de Igs o
sus fracciones, las características
físico-químicas de la proteína
monoclonal son muy importantes
para el tipo de enfermedad que se
produce: si hay cadenas ligeras que
atraviesan la barrera de filtración
glomerular se produce riñón de
mieloma: nefropatía por cilíndros
(“cast nephropathy”), pero si éstas
son lo suficientemente grandes para
no atravesarla, o tienen propiedades
químicas que se lo impiden, será
más probable que se depositen en
tejidos produciendo amiloidosis
o enfermedad por de pósitos de
cadenas ligeras. Es excepcional
que se presenten en un mismo
paciente enfermedad por depósitos
de paraproteínas (amiloidosis o
enfermedad de cadenas ligeras - o
pesadas-) y nefropatía por cilindros.
Los métodos disponibles para
la detección sensible de cadenas
ligeras en suero arrojan datos
interesantes. Al parecer, la detección de cadenas ligeras libres –no
totales- en suero, parece ser el
biomarcador más confiable, aunque
la inmunofijación y la electroforesis
del suero en matrices de alta resolución, podrían tener desempeños
nosográficos semejantes.
Amiloidosis primaria generalizada de cadenas ligeras
(APG)
Dr. Guillermo J. Ruiz-Argüelles
Dr. Guillermo J. Ruiz-Delgado
Centro de Hematología y Medicina
Interna de Puebla
gruiz1@clinicaruiz.com
Las amiloidosis generalizadas
son un grupo de enfermedades
complejas causadas por el depósito tisular de proteínas autólogas
“dobladas” incorrectamente que
conducen a daño orgánico progresivo. El tipo más común es la
amiloidosis primaria generalizada
de cadenas ligeras (APG) en la que
células plasmáticas neoplásicas
clonales producen cadenas ligeras
mal dobladas amiloidogénicas
que se vuelven insolubles en agua,
se precipitan y se depositan en el
espacio extracelular, conduciendo
a disfunción orgánica. La APG es
una neoplasia maligna que puede
o no asociarse a otras enfermedades clonales de las células B
y es la más agresiva de todas las
amiloidosis porque afecta al corazón. El diagnóstico de la APG
suele ser difícil y precisa de una
biopsia tisular y de estudios especiales para confirmar el subtipo de
enfermedad sistémica. Por razones
probablemente genéticas, la APG,
al igual que otras gamopatías monoclonales, es menos frecuente
en mestizos mexicanos que en
otras poblaciones; sin embargo,
las características clínicas de la
enfermedad son similares.
Tratamiento inicial de la APG.
El tratamiento de la APG debe
seleccionarse de acuerdo al riesgo
de la enfermedad, que se define
de acuerdo con marcadores tanto
clínicos como de laboratorio: Edad,
grado de desempeño personal
(performance status), fracción de
eyección del ventrículo izquierdo,
presión sistólica, capacidad de
difusión de monóxido de carbono,
troponina T, péptido natriurético
tipo pro-B con amino-terminal
(NT-proBNP). Parece que los marcadores de función cardíaca son los
más útiles para definir el grado de
riesgo, el tratamiento y el pronóstico
de los pacientes con APG:1
S77
Volumen 15, Suplemento 1, 2014
Revista de Hematología
1. Riesgo bajo: Grado de desempeño personal, involucro de
órganos limitado, función renal
normal, troponina T menor
de 0.06 ng/ml y NT-proBNP
menor de 5000 ng/L.
2. Riesgo intermedio: Grado de
desempeño personal adecuado
y NT-proBNP menor de 8500
ng/L.
3. Riesgo alto: NT-proBNP mayor
de 8500 ng/L.
a) Tratamiento de pacientes con
APG de riesgo bajo: Lo ideal es
hacerles trasplante de células hematopoyéticas autólogas empleando
melfalán a 200 mg/m2.4 También es
adecuado trasplantarlos con dosis
menores de melfalán (140 a 200
mg/m2), seguido de consolidación
con bortezomib. En este subgrupo
de pacientes con APG la mortalidad
relacionada al trasplante es menor
de 5%
b) Tratamiento de pacientes con
APG de riesgo intermedio: Este es el
grupo en el que caben la mayoría de
los pacientes con APG. En ellos se
recomiendan esquemas de quimioterapia combinada con melfálán /
dexametasona, CTD (ciclofosfamida, talidomida y dexametasona),
CyBorD (ciclofosfamida, bortezomib y dexametasona) o BMDex
(bortezomib, melfalán y dexametasona). Parece que el bortezomib es
el mejor fármaco para tratar a estos
pacientes, quienes también pueden
ser sometidos a trasplante de células
hematopoyéticas autólogas si sus
condiciones lo permitenc) Tratamiento de pacientes con
APG de riesgo alto: Este grupo incluye pacientes sumamente frágiles y
sensibles a los agentes quimioterápicos y a la dexametasona. Se pueden
emplear esquemas de quimioterapia
a dosis atenuadas o vigilancia estrecha. Parece que el bortezomib es el
fármaco de elección por la vulnerabilidad de las células plasmáticas
productoras de proteína amiloidogénica a esta droga.
S78
d) Tratamiento de pacientes con
APG refractaria o en recaída: Si el
período de remisión ha sido largo
después del tratamiento inicial, es
posible emplear nuevamente el
esquema inicial. El uso de bortezomib, lenalidomida y pomalidomida
puede ser util en pacientes quienes
han sido tratados con talidomida y
agentes alquilantes. Se están llevando a cabo estudios para evaluar
nuevos agentes como carfilzomib,
ixazomib y bendamustina.
e) Tratamiento de apoyo para
pacientes con APG: En algunos
casos se requieren transfusiones de
albúmina libre de sal, diuréticos e
inhibidores de la enzima convertasa de angiotensina. En pacientes
jóvenes es posible llevar a cabo
trasplante de riñón o de corazón
antes de hacer trasplante de células
hematopoyéticas autólogas.
Referencias
1.
2.
3.
4.
Merlini G, Wechlekar AD, Palladini G.:
Systemic light chain amyloidosis: An
update for treating physicians. Blood
2013; 121:5124-5130.
Hernández-Reyes J, Galo-Hooker E,
Ruiz-Delgado GJ, Ruiz-Argüelles GJ.:
Systemic immunoglobulin light-chain
amyloidosis (AL) in México: A single
institution, 30-year experience. Rev
Invest Clín Méx 2012; 64:604-608.
Ruiz-Argüelles GJ, Ruiz-Delgado GJ.:
AL amyloidosis; An epidemiological
and clinical challenge. Rev Invest Clin
Méx 2013; 65; 359-360.
López-Otero A, Ruiz-Delgado GJ, RuizArgüelles GJ.: A simplified method
for stem cell autografting in multiple
myeloma: A single institution experience. Bone Marrow Transplant
2009; 44:715-9
El futuro de la medicina
transfusional
Nidia Paulina Zapata Canto1 y Sergio Arturo Sánchez Guerrero2
1
Departamento de Hematología
2
Banco de sangre del Instituto Nacional de Cancerología.
México, D.F., MÉXICO
Correspondencia: Dr. Sergio Arturo
Sánchez Guerrero.
Jefe del banco de sangre del Instituto Nacional de Cancerología.
Correo electrónico: sasanche@
prodigy.net.mx
RESUMEN. La medicina transfusional es una rama de la medicina
de recién aparición pero con una
historia tan antigua como lo fue el
intento de la primera transfusión
sanguínea por el Profesor Jean
Denis en el siglo XVII . Con el
descubrimiento de los grupos sanguíneos por el Dr. Karl Landsteiner
comenzando el siglo XX se hizo patente su carácter científico y, con el
advenimiento de nuevas y mejores
técnicas para la conservación de la
sangre y sus componentes, ha jugado un rol importante para apoyar a
los médicos en la atención de sus
pacientes quienes ahora pueden ser
sometidos a cirugías y tratamientos
cada vez más complejos y demandantes como son los esquemas
quimioterapéuticos y los trasplantes
de órganos y tejidos. El descubrimiento de la biología molecular y
del genoma humano ha permitido
abrir nuevos horizontes para ir en
pos de productos sanguíneos cada
vez más seguros. Por otro lado, la
posibilidad de colectar y manipular
la célula progenitora hematopoyética ha sido determinante en el
desarrollo de la terapia celular y la
ingeniería de los tejidos. El reto, de
aquí en adelante, será la aplicación
universal de estos descubrimientos
para el beneficio de toda la humanidad y no solo de los habitantes de
los países industrializados.
PALABRAS CLAVE: Medicina
transfusional. Transfusión sanguínea. Sangre segura. Terapia celular.
ABSTRACT. Transfusion medicine is a medical discipline which
appeared recently but has a long
history as evidenced by the first
attempt of blood transfusion by
Professor Jean Denis back in the
XVII century, and when Dr. Karl
Landstainer discovered the ABO
Libro Educativo 55 Congreso Nacional de la Agrupación Mexicana para el Estudio de la Hematología, A.C.
blood groups its scientific basis was
established and since the implantation of better techniques for blood
components’ conservation it was
possible to support clinicians to deal
with the modern medical complexities such as organ and stem cell
transplantation as well as extensive
surgeries and high-dose chemotherapies. Furthermore, the discovery
of molecular biology and human
genome permitted to move forward
to get safer blood products. Finally,
the possibility of isolating and manipulating the stem cells resulted in the
development of cellular therapy and
tissue engineering. Therefore, the
challenge from now on is to make
possible that all these discoveries
could reach the whole world for
the humankind benefit and not just
for the support of those individuals
living in developed countries.
KEY WORDS: Transfusion medicine. Blood transfusion. Safe blood.
Cellular therapy.
El concepto de medicina transfusional aparece publicado por
primera vez en 1987 cuando el Dr.
Harvey G. Klein1 denomina así a
una especialidad cuyos orígenes
se remontan a los primeros intentos
de la transfusión en humanos de
sangre proveniente de animales por
el Profesor Jean Denis con el sabido
fracaso y su posterior prohibición
por parte del gobierno francés 2
. Iniciando el siglo XX el Dr. Karl
Landsteiner, con su descubrimiento
de los grupos ABO, le dio el respaldo de los principios científicos con
el desarrollo de la inmunohematología que es, hoy en día, uno de
los pilares en los cuales descansa la
medicina transfusional.2
En la actualidad, quienes nos
dedicamos a esta apasionante y cada
vez más vasta área de la medicina
debemos reconocer los avances que
se han logrado a través del tiempo
pero también los retos que nos
depara el futuro y es que, durante
su evolución histórica, la medicina
transfusional ha pasado por diversas
etapas cronológicas que incluyen la
aparición de los agentes infecciosos
que pueden transmitirse a través de
la transfusión sanguínea, desde la
sífilis hasta el virus del Nilo Occidental, pasando por las hepatitis B
y C y el VIH, los cuales marcaron
un parteaguas en las décadas de
los 70, 80 y 90 del siglo pasado
que nos han obligado a ir en pos
del denominado riesgo cero lo que,
para muchos, pareciera una quimera. Esta búsqueda ha implicado la
aplicación de nuevas tecnologías
que incluyen la biología molecular
pero que han abierto la brecha entre
los países industrializados y en vías
de desarrollo desde el punto de vista
epidemiológico del riesgo residual.3
Esta brecha que, a todas luces, parece injusta se amplía aún más cuando
se incorporan los más recientes
avances como lo son: la inactivación viral y la genotipificación. Por
tal motivo, el reto principal tendrá
que ser la equidad en la seguridad
de la medicina transfusional que se
practica en todo el mundo. He aquí
algunos conceptos que pudieran
ayudar a lograrlo.
Lo primero que debemos aceptar es que, en la actualidad, los
bancos de sangre ya no deben ser
observados como meros depósitos
de componentes sanguíneos ni
su actividad debe encasillarse en
el aspecto puramente asistencial.
Los bancos de sangre o centros de
medicina transfusional deberán incorporar actividades académicas y
de investigación tanto clínica como
básica en la materia. Solamente así
será posible lograr el avance y la
calidad de la práctica transfusional
en nuestros países.
Otra de las limitantes a vencer
será alcanzar la suficiencia de sangre
y para esto tenemos que propender
por lograr el índice de 20 donantes
de sangre por cada 1,000 habitantes
a nivel nacional. Para llegar a él
debemos anticipar que las carac-
terísticas demográficas de nuestra
población están cambiando pues,
con el control de la natalidad por
un lado y la mayor expectativa de
vida por el otro, dicha población
está envejeciendo lo que, por una
parte hace que la demanda de sangre se incremente pero que el nicho
de población susceptible de donar
tenga un menor crecimiento lo que
podría desencadenar una carencia
de productos sanguíneos en el futuro
tal y como se anticipa que ocurra en
algunos países industrializados 4.
Afortunadamente, cada vez se tiende
a manejar una política transfusional
más bien restrictiva que liberal y a
aplicar a nuestra práctica la medicina basada en las evidencias.5
Otro pilar que se ha recomendado por diversos organismos
internacionales es la donación altruista de sangre que, si bien, ha sido
cuestionada por algunos autores6,7
diversos países de Latinoamérica ya
se han sumado a este esfuerzo con
excelentes logros, tales como Nicaragua 8 y Argentina. En otros países
del mundo también se ha replicado
este esfuerzo como en Sudáfrica y SriLanka. Sin embargo, para alcanzar
estos logros, se requiere de diversas
medidas como: una adecuada planificación, contar con los recursos
humanos capacitados y recursos
económicos suficientes, establecer
alianzas con las organizaciones de la
sociedad civil, mejorar la calidad en
la atención de los donantes, el involucro de las autoridades sanitarias y
evaluar periódicamente los avances
de los programas para realizar las
adecuaciones a los mismos.
Por otro lado, será necesario
incorporar, paulatinamente, los
avances tecnológicos entre los que
deseamos destacar: un expediente
electrónico, la tecnología de la plataforma múltiple para las pruebas de
serología infecciosa, las pruebas de
ácidos nucleicos (o bien, las técnicas combo para la identificación no
solamente de los anticuerpos sino
S79
Volumen 15, Suplemento 1, 2014
Revista de Hematología
de los antígenos de los agentes infecciosos) y, de esta manera, reducir
los diversos periodos de ventana,
así como la genotipificación de los
grupos sanguíneos.
Dado que, en buena medida
la manufactura de los productos
sanguíneos y la confiabilidad de los
resultados de las pruebas realizadas
en los bancos de sangre (infecciosas
e inmunohematológicas) así como
los procedimientos de aféresis, dependen del actuar del personal de
dichos bancos, será necesaria la implantación de alguno de los diversos
sistemas de gestión de la calidad
que incluyen: ISO, AABB, College
of American Pathology (CAP) y Joint
Comission of Accreditation of Health
Organizations (JCAHO), de los cuales
ya hay varios ejemplos en los países
Latinoamericanos, destacando: Brasil, Argentina, Colombia y México.
Resulta incuestionable que la
operación de un banco de sangre y
de un servicio de medicina transfusional resultan costos para cualquier
sistema de salud. Por lo tanto, será
imprescindible incrementar la
competitividad de los mismos a
través de una gestión profesional
de sus programas y servicios, la
centralización de los mismos para
lo cual se necesitará la elaboración
de convenios interinstitucionales y
mejorar la productividad de su personal. Para conseguir todos estos
logros, deberá contarse con líderes
que establezcan la misión, la visión,
los objetivos y metas de la organización pero que, también, planeen
las estrategias para lograrlo, favorezcan el clima laboral y el trabajo
en equipo, impulsen los programas
académicos en medicina transfusional para el personal del banco de
sangre y el resto del personal de salud, así como también, estimulen la
investigación clínica y básica en la
materia. Finalmente, será necesario
analizar los resultados y reconocer
que, si se ha fallado, habrá que
corregir el rumbo.9-11
S80
En cuanto a la educación se
refiere, cada vez resulta más necesaria la figura de los especialistas
en medicina transfusional quienes
manejarán el destino de los bancos
de sangre, sobretodo, de aquellos
que se encuentren o le den servicio
a los hospitales de alta especialidad. Felizmente, estos programas
ya se encuentran activos en países
como Brasil, Argentina y México y
cuentan con el aval universitario.
Sin embargo, será necesario que
se incremente el número de instituciones en las cuales se brinde
esta enseñanza. Adicionalmente,
resulta menester capacitar al personal del banco de sangre, al resto
del personal de salud e incluso a
la población general en materia
transfusional. Los programas de
posgrado incluirán las maestrías
y doctorados en ciencias transfusionales como ya lo han hecho en
algunos países industrializados y
es que, con el advenimiento de la
terapia celular y la ingeniería de
los tejidos la relevancia que han
adquirido los bancos de sangre en
estas tareas resulta incuestionable.
Más de una década se ha requerido para el estudios de las
células madre hematopoyéticas y la
mayoría de los estudios tienen sus
cimientos en los modelos murinos.
Adicionalmente, se ha iniciado ya
la carrera del estudio de células
madre embrionarias, aprendiendo
acerca de su diferenciación y desarrollo. Otros estudios recientes
versan sobre la inducción de las
células madre, reprogramándolas,
utilizando diferentes genes como
Oct4, Sox2, Klf4, y c-Myc. Encontrando, incluso, que con estos genes
se podrían inducir a estas células.
Este es el inicio de los múltiples
usos de estas células y la inducción,
sin tener que requerir un genoma
completo, encontrando que es
posible convertir diferentes linajes
de células maduras (incluyendo células hematopoyéticas), en células
madre inducidas y que pueden ser
una fuente óptima y específica para
trasplante, sin tener la limitación de
las barreras inmunológicas. 12
En la última década, las células
madre han tenido mucho auge en
el tratamiento del infarto agudo
al miocardio. Sin embargo aún
quedan muchas preguntas por
contestar tales como la dosis de
células utilizadas y su fuente. No
obstante que muchos tipos celulares
se han estudiado para reparar el
infarto agudo al miocardio, desde
el hallazgo que las células madre
se pueden diferenciar en cardiomiocitos, su elección ha tenido un
cambio dramático a favor de los
pacientes que lo requieren. 13
Adicionalmente, un número
importante de líneas celulares pluripotenciales se han generado en
pacientes con trastornos hematológicos, dentro de los que cabe
mencionar: la anemia de Fanconi,
anemia de células falciformes,
leucemia mieloide crónica, y otros
síndromes mieloproliferativos. Estas
líneas celulares tienen el potencial
de ser modelos de las bases moleculares de las diferentes patologías
previamente mencionadas y son
una plataforma no solo para el
estudio de nuevas drogas sino que,
también, para la búsqueda de otras
alternativas en su tratamiento. Por
otro lado, se ha logrado silenciar las
globinas fetales mediante el hallazgo
que en los eritrocitos trasplantados
ocurre un silenciamiento de la globina embriónica y se induce la del
adulto, respaldando el concepto
de que el microambiente juega un
papel muy importante promoviendo
este cambio con lo que nace la posibilidad de que este cambio se inicie
por señalamientos específicos en las
vías de activación y otros factores
que regulan estas células. 14
Otro hallazgo interesante y
promisorio es que la modulación
del receptor del hidrocarbono aryl
(AhR), podría facilitar la expansión
Libro Educativo 55 Congreso Nacional de la Agrupación Mexicana para el Estudio de la Hematología, A.C.
de los progenitores y la diferenciación de los megacariocitos y la serie
eritroide. Éste se ha encontrando
en las células hematopoyéticas y
su activación deriva en una expansión de la series previamente
mencionadas. Estos resultados parecen conllevar a una producción
ilimitada de células diferenciadas. 15
Desafortunadamente, la falta
de una normatividad en muchos
de nuestros países ha provocado
que pululen centros de dudosa
reputación que le dan un sentido
mágico y esotérico a estos avances
y que los están aplicando como
herramienta terapéutica en los seres
humanos cuando muchas de estas
aplicaciones no han pasado aún
el rigor experimental en modelos
animales. Adicionalmente a la
normatividad, será imprescindible
el registro de los bancos de sangre
y centros de terapia celular ante
los organismos rectores nacionales
e internacionales, implantar los
comités de medicina transfusional,
de trasplante y bioética, así como
regirse siempre por los principios
científicos (estado del arte).
Finalmente, consideramos que
los bancos de sangre deberán ser un
ejemplo de organizaciones socialmente responsables y se involucren,
cada vez más, en programas que
cuiden el medio ambiente incluyendo el manejo adecuado de los
residuos peligrosos biológico-infecciosos, que reduzcan el desperdicio
y fomenten el reciclaje.
CONCLUSIÓN. Los nuevos hallazgos en el control y manipulación
de genes, así como la innovación
tecnológica ha permitido la diferenciación en líneas celulares
que pudieran emplearse para el
tratamiento de diferentes enfermedades hematológicas y en cuyo
procesamiento los bancos de sangre
podremos participar activamente.
El futuro nos reta a afrontar y
vencer las limitantes actuales y las
adversidades a las que nos enfrenta-
remos en el tratamiento de nuestros
pacientes.Para lograrlo será obligado el establecimiento de alianzas
entre autoridades sanitarias, el
personal del propio banco de sangre (comenzando con sus líderes),
fabricantes y proveedores. Solo
así será posible alcanzar el sueño
de la universalidad y equidad en
materia transfusional en un futuro,
idealmenente, no muy lejano.
REFERENCIAS
1.
2.
3.
4.
5.
6.
7.
8.
9.
Klein HG. Transfusion Medicine: the
evolution of a new discipline. JAMA
1987;16:2108-9.
Greenwalt TJ. A short history of
transfusion medicine. Transfusion
1997;37:550-63.
Vázquez-Flores JA, Valliente-Banuet
L, Marín y López RA et al. La seguridad de las reservas sanguíneas en
México de 1999 a 2003. Rev Invest
Clín 2006;58:101-8.
Drackley A, Bruce Newbold K, Paez
A et al. Forecasting Ontario’s blood
supply and demand. Transfusion
2012;52:366-74.
Josephson CD, Glynn SA, Kleinman
SH et al. A multidisciplinary “think
tank”: the top 10 clinical trial opportunities in transfusion medicine from
the National Heart, Lung, and Blood
Institute-sponsored 2009 state-ofthe-science symposium. Transfusion
2011;51:828-41.
Sabino EC, Gonçalez TT, CarneiroProietti AB et al. Human immunodeficiency virus prevalence,
incidence, and residual risk of
transmission by transfusions at Retrovirus Epidemilogy Donor Study-II
blood centers in Brazil. Transfusion
2012;52:870-9.
Allain JP. Moving on from voluntary
non-remunerated donors: who is the
best blood donor? Br J Haematol
2011;154:763-9.
Berrios R. González A y Cruz JR. Achieving self-sufficiency of red blood cells
based on universal voluntary blood
donation in Latin America. The case
of Nicaragua. Transf Apheres Sci
2013; http://dx.doi.org/10.1016/j.
transci.2013.06.013
Porter ME. Estrategia competitiva.
25a. reimpresión. Compañía Editorial Contintental, S.A. México. 1998.
10. Steiner GA. Planeación estratégica.
23ª. Reimpresión. Compañía Editorial Continental, S.A. México. 1998.
11. Bennis W. Cómo llegar a ser líder.
2ª. Reimpresión. Grupo Editorial
Norma. Colombia. 1998.
12. Kaufman DS. Toward clinical therapies using hematopoietic cells derived from human pluripotent stem
cells. Blood 2009;114:3513-23.
13. Jonathan H.and Dinsmore. Stem Cell
Therapy for the Treatment of Acute
Myocardial Infarction. Cardiol Clin
2010;28:127–38
14. Doulatov S, Vo LT, Chou, Kim PG, Arora N et al. Induction of multipotential
hematopoietic progenitors from
human pluripotent stem cells via respecification of lineage-restricted precursors. Stem Cells 2013,13:459–470
15. Smith BW, Rozelle SS, Leung A et
al. The aryl hydrocarbon receptor
directs hematopoietic progenitor
cell expansion and differentiation.
republished online May 30, 2013;
doi:10.1182/blood-2012-11-466722
Tratamiento de la leucemia
promielocítica aguda ¿Es la
combinación trióxido de
arsénico y ATRA el nuevo
tratamiento estándar?
Miguel A. Sanz
Hospital Universitario La Fe. Departamento de Medicina de la
Universidad de Valencia, Valencia,
España
msanz@uv.es
La introducción de trans-retinoico
(ATRA) en el tratamiento de la leucemia promielocítica aguda (LPA)
ha sido uno de los paradigmas de
las últimas décadas en el tratamiento del cáncer. El uso de este agente
diferenciador en combinación con
quimioterapia basada en el uso de
antraciclinas, que es considerado el
actual estándar de tratamiento de la
LPA, ha cambiado completamente
el pronóstico de esta enfermedad,
convirtiéndose es la más curable
de las leucemias mieloides agudas. También el uso de protocolos
terapéuticos adaptados al riesgo ha
S81
Volumen 15, Suplemento 1, 2014
Revista de Hematología
contribuido a optimizar la combinación de fármacos y la intensidad
de dosis más adecuada para cada
subgrupo de pacientes clasificados
según el riesgo de recaída y la
vulnerabilidad a la toxicidad de
los fármacos. Más recientemente,
el trióxido de arsénico (ATO) se ha
incorporado al arsenal de fármacos
eficaces en esta enfermedad, siendo
probablemente el agente único
más activo en el LPA. Este agente
fue utilizado primeramente en los
pacientes con LPA en recaída y,
tras su éxito, recientemente se ha
investigado el papel de ATO como
tratamiento de primera línea, para
minimizar o incluso omitir el uso
de agentes citotóxicos y mejorar
los resultados de la quimioterapia
convencional. En esta revisión,
discutimos el enfoque actual del
tratamiento de la LPA en pacientes
de nuevo diagnostico, especialmente teniendo en cuenta los últimos
avances con el uso de regímenes
alternativos a la quimioterapia convencional basados en ATO como
tratamiento de primera línea sin
quimioterapia.
Enfoque terapéutico convencional. El tratamiento convencional de
la LPA consiste en un tratamiento
de inducción, consolidación y
mantenimiento. Una vez que el
diagnóstico genético es confirmado, todo debe comenzar con un
tratamiento de inducción con ATRA
(45 mg/m2/d hasta la RC; 25 mg/
m2/d para niños y adolescentes) y
quimioterapia con antraciclinas,
administrado simultáneamente.
Con respecto a la quimioterapia
más adecuada para la inducción,
no hay ningún ensayo aleatorizado para comparar los regímenes
más comúnmente usados. Esquemáticamente, dos regímenes de
quimioterapia son los de uso más
frecuente, los basados en una
antraciclina sola, principalmente
con idarubicina, aunque también
con daunorubicina, y los que
S82
combinan daunorubicina con
citarabina. Aparentemente, no se
observan diferencias significativas
en los resultado con cualquiera de
estas estrategias. De hecho, con
cualquiera de estos regímenes se
esperaría una virtual ausencia de
resistencia leucémica durante la
inducción a la remisión.
Una vez que el paciente alcanza
RC, el tratamiento de consolidación
suele basarse en dos a tres ciclos de
quimioterapia con antraciclinas en
combinación con ATRA. Aunque no
se han realizado estudios aleatorizados para demostrar el beneficio
del uso de ATRA en consolidación,
estudios comparativos de grandes
series sucesivas de los grupos GIMEMA y PETHEMA ofrecen unos
resultados que dejan lugar a pocas
dudas sobre una mayor eficacia
antileucémica cuando ATRA se
combina con quimioterapia de consolidación. Diversos estudios han
tratado de demostrar la mayor eficacia de la quimioterapia cuando se
añade citarabina a las antraciclinas
en consolidación, con resultados no
concluyentes. De conjunto todos
los indicios sugieren una mayor
eficacia usando citarabina en los
pacientes con recuentos leucocitarios superiores a 10 x 109/L.
Respecto al papel del ATO para
reforzar el tratamiento convencional
con ATRA y quimioterapia, también
hay diversos estudios recientes que
sugieren un papel efectivo de este
agente añadido tanto en inducción
como en consolidación
A pesar de los beneficios proporcionados por el tratamiento de
mantenimiento en algunos estudios
aleatorizados, su papel actual ha
sido recientemente cuestionado.
En general, los datos disponibles
sobre el beneficio de la terapia
de mantenimiento en el contexto
de los tratamientos modernos con
ATRA y quimioterapia no permiten
un posicionamiento de unívoco,
y probablemente se debe evaluar
teniendo en cuenta el potencial
curativo de la terapia de inducción
y consolidación previa.
Enfoque terapéutico alternativo
Tratamientos principalmente
basados en la administración de
ATO minimizando el uso de la
quimioterapia han demostrado ser
altamente eficaces en varios estudios piloto en pacientes con LPA
de nuevo diagnóstico.
Un recientemente estudio del
grupo italiano GIMEMA y el German–
Austrian Study Group ha comparado
por primera vez la combinación de
ATRA y quimioterapia convencional
con la de ATRA y ATO en pacientes
con el LPA, pero esta comparación
fue restringido a pacientes riesgo
bajo a intermedio, es decir, con
recuentos leucocitarios ≤10 x 109/L.
La supervivencia libre de eventos y la
supervivencia global fueron mejores
con la combinación de ATRA y ATO
comparado con la combinación de
ATRA y quimioterapia. Tras de este
excelente estudio, se puede afirmar
sin duda que la combinación de
ATRA y ATO, sin quimioterapia, es
al menos no inferior y podría ser ser
superior al tratamiento convencional con ATRA y quimioterapia en
pacientes con LPA de riesgo bajo o
intermedio. Sin embargo, teniendo
en cuenta que la experiencia a largo
plazo con tratamiento con ATRA y
ATO sin quimioterapia es aún escasa,
un seguimiento más largo sería de
ayuda para evaluar definitivamente la
eficacia y seguridad de este enfoque.
Además, dado que el tratamiento
ATO es mucho más caro que la
quimioterapia en los países occidentales, sería conveniente disponer de
estudios solventes de costo-beneficio.
Algoritmos de tratamiento
para linfoma difuso de células grandes B
Luis Villela*, Sean Scott-Sartini*,
Oscar Fajardo-Ramirez*, Carmen López-Sánchez*, Jessica
Giselle Herrera-Gamboa*, Martín
Libro Educativo 55 Congreso Nacional de la Agrupación Mexicana para el Estudio de la Hematología, A.C.
Wah-Suárez* y José Ascención
Hernández-Hernández*.
*Tecnológico de Monterrey. Cátedra de hematología y cáncer de la
Escuela de Medicina y Ciencias de
la Salud, Tec Salud.
Autor correspondiente:
Luis Villela, MD, MSc
Av. Morones Prieto No. 3000 pte.
Edificio CITES
Col. Los Doctores, C.P. 64960,
Monterrey, NL
e-mail: villela@itesm.mx
Introducción. Los linfomas noHodgkin (LNH) son las neoplasias
hematológicas más frecuente en el
adulto, Siendo descritos en 1998 30
subtipos de LNH.1 En la más reciente
clasificación de la Organización
Mundial de Salud (OMS), esta cifra
se ha incrementado a 55 subtipos de
neoplasias de células B maduras.2
En el presente escrito se discutirá
el algoritmo de tratamiento del LNH
más frecuente y que por sus características clínico-biológicas pueden
considerarse agresivo: el linfoma difuso de células grandes B (LDCGB).
Daremos una breve descripción
de la enfermedad y como se abordan
actualmente en las guías mexicanas
de diagnóstico y tratamiento recientemente publicadas,3 diferentes
esquemas propuestos por grupos
internacionales, así como el uso de
nuevas drogas (anticuerpos monoclonales y moléculas pequeñas) desde
un punto de vista personal y que
pronto, con seguridad, se incluirán
en las guías de manejo no solo mexicanas, si no en forma internacional.
GENERALIDADES DE LINFOMA DIFUSO DE CÉLULAS
GRANDES B (LDCGB). Es importante señalar que el tratamiento
en los LDCGB ha mejorado notablemente durante los últimos 40
años. Dicha mejoría ha sido posible
por definiciones de la entidad o
entidades más claras, por mejores
métodos diagnósticos, mejoría en
la definición de estadios y rees-
tadificiación clínica, así como el
surgimiento de biomarcadores que
nos permiten definir mejor grupos
de riesgo y predecir sobrevida.4
En base a estos conocimientos, el
LDCGB se considera aun una enfermedad heterogénea y que cada
una de estas caras deberá recibir un
tratamiento “personalizado”.
Es la entidad nosológica más
frecuente dentro de las neoplasias
linfoproliferativas en el mundo, con
una incidencia del 30%-35% de
los casos en Estados Unidos.1 En
México, las cifras no son del todo
seguras pero se calcula entre 40%
y 45% de todos los casos de LNH,
muy similar a otros países en Latino
América (Centro y Sudamérica).5 Se
considera como el prototipo de LNH
agresivo. Es importante recordar que
hasta un 40% puede presentarse
como enfermedad extranodal. Las
características inmunofenotípicas
de este subtipo de linfoma consiste
en expresión de CD19 y CD20 sin
expresión de CD23 y en el 95% negativo para CD5%, la expresión de
BCL-2, BCL-6 y CD10 se expresa en
muchos pero no en todos (2). En un
5% de los casos de LDCGB pueden
presentar una doble mutación que
involucra al gen MYC y al gen bcl-2.
Esta doble mutación genera que el
linfoma tenga una resistencia innata
a la quimioterapia de inducción y
su comportamiento sea muy agresivo, originando que el resultado
sea de muy mal pronóstico para el
paciente.6
TRATAMIENTO A LA INDUCCIÓN DEL LDCGB. Las guías
mexicanas recientemente publicadas a mediados del año pasado,
contienen el siguiente texto: “Dado
que en México muchos hospitales carecen de infraestructura
óptima para fines de diagnóstico,
se proponen las presentes guías
de diagnóstico, estadificación y
tratamiento de LNH, basadas en
evidencia. En ellas se incluyen tanto
las opciones terapéuticas más inno-
vadoras como propuestas específicas
para los centros hospitalarios con
menor infraestructura o tratamientos
con recursos limitados”.3 Es cierto
que uno de los pilares importantes
para ofrecer un correcto tratamiento
es el diagnóstico histopatológico
apoyado en inmunohistoquímica
como mínimo, así como la obtención de grupos de riesgo basados en
el índice pronóstico internacional
(IPI),2,7 donde la mayoría de los
centros hospitalarios en México
si cuentan con este mínimo para
realizar un diagnóstico correcto y
colocación de los pacientes en un
grupo de riesgo ya que en su mayoría
son datos clínicos o de laboratorio y
gabinete “sencillos” [edad >60 años,
Estado funcional (ECOG ≥2), Deshidrogenasa láctica elevada, ≥2 sitios
extranodales, Estadio clínico avanzado (III/IV de Ann Arbor)] , donde
cada factor presente es un punto
de riesgo que se le asigna y dependiendo de este número se colocará
en un grupo de riesgo (0-1 bajo , 2
intermedio bajo, 3 intermedio alto,
4-5 alto riesgo). El IPI ajustado es la
utilización de tres factores solamente: estado funcional, deshidrogenasa
láctica y estadio avanzado (0 bajo, 1
intermedio bajo, 2 intermedio alto y
3 alto riesgo).
El tratamiento “estándar” sugerido por las guías mexicanas,3 no
difiere por lo que se realiza en otros
países, donde a un seguimiento
prospectivo de más de 10 años ha
mostrado que R-CHOP (rituximab,
ciclofosfamida, doxorrubicina,
vincristina y prednisona) es mejor
que CHOP (mismas drogas sin
rituximab) en el tratamiento de los
LDCGB.8,9 Así también, se ha definido que R-CHOP “estándar” (cada
21 días) es mejor que el tratamiento
a dosis densas (cada 14 días) y esta
duda se despejó con dos trabajos
independientes (británico y francés)
que compararon ambos esquemas
diferentes solamente en el tiempo
de aplicación (21 días vs. 14 días
S83
Volumen 15, Suplemento 1, 2014
Revista de Hematología
apoyado con factores estimulantes
de colonias).10,11
Ya definido el tratamiento convencional o estándar (R-CHOP-21).
El siguiente paso es buscar un
esquema que ofrezca el mayor porcentaje de curación, con la menor
toxicidad. Sin lugar a duda los factores que más influyen en los clínicos
para decidir el tipo de tratamiento
son la edad (“tolerancia” a las quimioterapias) y por grupos de riesgo
para ofrecer terapias menos tóxicas
o más cortas en tiempo pero con la
misma efectividad, y así esto influya
en costos menores de atención en
la seguridad pública.
Cuando tomamos en cuenta
los dos factores comentados con
anterioridad (edad e IPI) nos damos
cuenta que el tratamiento en el
caso de jóvenes con IPI de 0 o sin
factores de riesgo y sin enfermedad
voluminosa se benefician del RCHOP-21 con sobrevidas arriba de
80% (9). Así también, entendemos
que aquellos que no tienen ningún
factor de riesgo (IPI=0) pero tienen
enfermedad voluminosa definida
como ≥ 7 cm en su eje mayor o
presentan un factor de riesgo o más
según el IPI, el tratamiento con RCHOP no cumple las expectativas
(8, 9) y esto probablemente tenga
que ver con el origen biológico del
linfocito neoplásico, como ha sido
sugerido recientemente.12 Sin embargo, se requiere corroborar dicho
dato con estudios moleculares sólidos (se usó solamente IHQ), y desde
un punto de vista prospectivo, ya
que fue un estudio retrospectivo.
El consenso mexicano para
las guías nacionales de tratamiento sugiere que en pacientes con
enfermedad localizada (estadio I/
II de Ann Arbor) con o sin factores de riesgo como elevación de
DHL, estado funcional (ECOG ≥2),
voluminoso (>10cm, factor que
no se toma en cuenta en el IPI) y
>60 años, se sugiere se aplique
“R-CHOPX3 más radioterapia (RT)
S84
o R-CHOPX6 más RT” sin especificar cuándo usar una u otra.3 Sin
embargo, no hay ningún estudio
que haya evaluado R-CHOPX3 +
RT vs. R-CHOPX8 o X6 sin RT y
solamente se traspola los resultados
obtenidos en las años ‘90 cuando se
comparó CHOPX3 + RT vs. CHOPX8, favoreciendo al “esquema
corto” de CHOP + RT en pacientes
que en su mayoría presentaron un
IPI de 0 o 1.13 El grupo ECOG (Eastern Cooperative Oncology Group)
reportó un estudio en pacientes con
LDCGB y enfermedad localizada,
donde comparó RT vs. Observación después de recibir CHOPX8.14
Los autores mencionan una mejoría
en la sobrevida libre de enfermedad
(SLEn) (75% para RT vs. 56% para
observación; p=0.05). Confirmando
que la RT posterior a la quimioterapia es fundamental en pacientes
de bajo riesgo. Es importante mencionar que en nuestra opinión
personal tal vez los pacientes con
enfermedad localizada sin factores
de riesgo si podrían beneficiarse de
R-CHOPX3 ± RT siempre y cuando
se use un método de imagen que
permita valorar con mayor detalle
la enfermedad mínima residual,
como sería el PET/CT que ha mostrado ser una buena herramienta de
evaluación de enfermedad mínima
residual.15 Pero lo ideal sería contestar dicha pregunta en un trabajo
de investigación clínica en forma
prospectiva y aleatorizada.
Por tanto, solamente se tiene la
certeza que R-CHOP cumple las expectativas en un grupo de pacientes
de muy buen pronóstico (menores
de 60 años y con un IPI=0), como
se puede observar en las curvas de
sobrevida mostradas por el grupo
de Vancouver cuando propuso
su IPI revisado o R-IPI, donde los
pacientes fueron evaluados con los
mismos 5 factores de riesgo del IPI
original para sobrevida global (SG)
y solamente se “reacomodaron”, es
decir IPI=0 (muy buen pronóstico)
proyectó 94% de SG, IPI con 1 o 2
factores (buen pronóstico) proyectó 80% de SG y ≥ 3 factores (mal
pronóstico) proyectó 55% de SG.16
Por tanto creemos que hay subgrupos en los que hay que buscar una
terapia mejor que R-CHOP.
PA P E L D E L T R A S P L A N T E
AUTÓLOGO DE CÉLULAS PROGENITORAS (TACP) COMO PARTE
DE LA INDUCCIÓN EN LDCGB.
El papel del TACP en LDCGB como
parte del tratamiento de inducción
(primera línea) ha sido controversial. En un meta-análisis donde se
analizaron 15 estudios y donde
se incluyeron 2728 pacientes, se
observó que no hay evidencia que
soporte una mejoría en la SG y en
la SLE en aquellos con bajo riesgo,
mientras que en los de alto riesgo
los resultados fueron inconclusos.17
Los autores sugirieron realizar nuevos estudios en el grupo de alto
riesgo prospectivos y aleatorizados
para intentar responder la pregunta. A partir de la publicación del
meta-análisis han surgido algunos
trabajos que soportan el uso de TACP
en primera remisión en los grupos
de alto riesgo calculado por el IPI
ajustado en primera remisión completa,18-21 mientras que otros trabajos
no soportan dicha afirmación.22,23
Sin embargo, si uno analiza con
detenimiento a los subgrupos que
fueron tratados con y sin rituximab,
podemos observar que los que recibieron rituximab en la quimioterapia
de inducción y se consolidaron en
remisión completa con TACP tuvieron una mejor SG y SLP.
FUTUROS ESQUEMAS DE
TRATAMIENTO QUE PODRÍAN
SER MEJOR QUE R-CHOP COMO
INDUCCIÓN EN LDCGB. El grupo GELA desarrolló un esquema
llamado ACBVP-R (doxorrubicina,
ciclofosfamida, bleomicina, vindesina, prednisona y rituximab)
que comparó con R-CHOP en
pacientes con LDCGB de novo,
jóvenes (<60 años) y con un IPI
Libro Educativo 55 Congreso Nacional de la Agrupación Mexicana para el Estudio de la Hematología, A.C.
de 1 (riesgo bajo intermedio).24
Donde se observó que los resultados en sobrevida libre de
evento (SLE), sobrevivencia libre
de progresión (SLP) y SG favorecen a ACVBP-R comparado con
R-CHOP (81%vs.67%, 87%vs.73%
y 92%vs.84%; respectivamente).24 Sin embargo, vindesina no
existe en México y así también la
toxicidad observada fue elevada,
manifestada en fiebre y neutropenia (38% vs. 9%, respectivamente).
El grupo GELA posteriormente reportó la toxicidad tardía y segundas
neoplasias en tres estudios donde
se utilizó ACBVP y observó una
incidencia del 8.1% de toxicidad
global y segundas neoplasias a 7
años de seguimiento.25. Con un incremento dela incidencia de riesgo
(IR) notable en 2.45 (p<0.001) para
cáncer de pulmón y una incidencia
de 5.65 (p<0.001) para síndrome
mielodisplásico/leucemia mieloide
aguda (SMD/LMA) en los hombres;
mientras que en las mujeres se
observó una IR de SMD/LMA en
19.9 (p<0.001).25 La conclusión
de este grupo fue que el ACBVP es
altamente efectivo contra LDCGB
pero con una incidencia elevada
de segundas neoplasias tanto de
tumor sólido como hematológicos.
Se debe recordar que los pacientes
incluidos en el régimen de ACVBP
fueron menores de 60 años y que
se “curarían” de un tipo de neoplasia a cambio de otra. Así también,
el uso de ACBVP no ha sido evaluado en cada uno de los subtipos
moleculares de LDCGB. Recordemos que los subtipos moleculares
juegan un papel importante incluso
para los de IPI de bajo riesgo como
se ha descrito anteriormente.26
El grupo Nórdico desarrolló un esquema complicado de quimioterapia
de dosis densa, donde al R-CHOP-14
le agregó etopósido (R-CHOEP-14)
con profilaxis al sistema nervioso
central en base a dosis altas sistémicas de citarabina y posteriormente
dosis altas de metotrexate para pacientes jóvenes (<65años) con un IPI
ajustado intermedio (75%) y elevado
(25%), con estado funcional de 0 a 3,
donde solo un 10% tuvieron ECOG
> 2 (27). El estudio tuvo una mediana
de seguimiento de 4.3 años y una
SG proyectada a 3 años de 81% y
SLE de 65%.27 Desafortunadamente,
no hubo una rama comparativa con
R-CHOP-21 y es difícil obtener un
juicio más concreto entre ambas
terapias donde la toxicidad temprana y tardía puede jugar un papel
importante.
Desde hace algunos años se
propuso un nuevo esquema que
adiciona una topoisomerasa II (etopósido) y modifica la aplicación de
algunos componentes del esquema
(infusión continua de etopósido,
vincristina y doxorrubicina), ya
con datos un poco más maduros
a seguimiento. Dicho esquema se
denomina dosis ajustadas (DA)
de EPOCH-R; dicho ajuste es en
base al número de neutrófilos absolutos previo a cada ciclo con un
incremento de la doxorrubicina y
etopósido. Se evaluó la respuesta de
este esquema dependiendo el origen
“molecular” del LDCGB (germinal
vs. No-germinal) por inmunohistoquímica.28 Cuando se analizó los
resultados, de nuevo traspolando
dichos resultados, según los grupos
de riesgo por IPI y edad, estos fueron
mejor a los publicados con R-CHOP.
Cuando se analizó los resultados
en el subtipo “molecular por IHQ”
como centro germinal fueron muy
buenos en el contexto de SLP y SG
(100% y 94%, respectivamente),
sin embargo los no-germinales no
tuvieron la misma respuesta (67%
y 58%, respectivamente), aunque
los resultados son mejores que los
reportados con R-CHOP; todo esto
con una mediana de seguimiento de
64 meses.28 En forma independiente, otros grupos que han reportado
buenos resultados con el uso de
DA-R-EPOCH cada 21 días, así
como en dosis densas.29,30 Desafortunadamente, en ninguno de ellos fue
comparado contra R-CHOP. Actualmente se encuentra en desarrollo un
estudio clínico fase III que compara
DA-EPOCH-R vs. R-CHOP por el
grupo Cancer and Leukemia Group
B (NCT0 0118209) para responder
la pregunta si DA-EPOCH-R es mejor
o igual que R-CHOP en diferentes
subtipos “moleculares”, por lo que
debemos estar pendientes de dichos
resultados.
Actualmente, las nuevas terapias
están enfocadas a mejorar los resultados según el subtipo molecular
de los linfomas: célula B activada
(ABC) o centro germinales (CG).
La vía constitutiva del factor de
transcripción NFkappaB que está
en relación a proliferación y sobrevivencia está involucrado en el
subtipo ABC como se demostró en
líneas celulares y que su bloqueo a
través de un inhibidor de IkappaB
cinasa produjo muerte celular.31
Dunleyve, basado en estos hallazgos realizó un estudio fase II donde
adicionó a DA-EPOCH un medicamento denominado bortezomib
(capaz de inhibir NFkappaB) para
probar que la adición de dicha
droga tendría un efecto benéfico
en la respuesta de LDCGB recaídos/
refractarios que mostraran un perfil
genético tipo ABC y no así en los
CG, dicho perfil de genes expresados lo realizó en forma molecular
y no por IHQ (32). Los resultados
observados fueron alentadores en el
subtipo ABC que en los CG como
se había hipotetizado (83% vs.
13%, p<0.001; respectivamente) y
una mejor sobrevida (10.8 vs. 3.4
meses, p<0.003; respectivamente).32 Actualmente, hay diferentes
protocolos probando R-CHOP y
DA-EPOCH-R más bortezomib para
corroborar los hallazgos anteriores.
N U E VO S M O N O C L O NA LES COMO TRATAMIENTO DEL
LDCGB. Actualmente han surgido
nuevas terapias biológicas dirigidas
S85
Volumen 15, Suplemento 1, 2014
Revista de Hematología
contra el receptor CD20, ejemplo el
ofatumumab que es humanizado,
ocrelizumab, veltuzumab así como
obinutuzumab que son quiméricos;
todos ellos probados en linfoma
folicular.33 Sin embargo, solamente
ofatumumab y obinutuzimab han
sido utilizados ya en LDCGB de
estudios fase II como monoterapia
o combinado a quimioterapia de
rescate.34-36 Las respuestas observadas en los estudios con ofatumumab
no son mejores que las reportadas
en otros estudios donde se utilizó
rituximab con quimioterapias de
rescate como R-DHAP (rituximab, dexametasona, altas dosis
de citarabina y platino) o R-ICE
(rituximab, ifosfamida, carboplatino, etoposido).34,35,37 Mientras que
obinutuzumab como monodroga ha
mostrado ser efectivo en LDCGB a
dosis altas (1600/800mg) con tasas
de respuesta completa de 32%.36
Sin embargo es apenas una cohorte
pequeña (n=40) y requiere estudios
comparativos contra rituximab en
quimioterapias clásicas de rescate
(DHAP o ICE); y sin lugar a duda,
su uso en estudios clínicos como
primera línea está garantizado.
MODIFICADORES DEL MICROAMBIENTE Y MOLECULAS
PEQUEÑAS. Tal vez esta sea el área
donde más se desarrollará como blanco terapéutico en linfomas. Donde la
modificación del microambiente en el
LDCGB y las vías intracelulares juegan
un papel importante.
LENALIDOMIDA. La lenalidomida es un medicamento
inmunomodulador que es de
origen sintético y de la familia de
la talidomida, que se desarrolló
en los años ’90 para mejorar la
potencia con menos efectos secundarios como tratamiento del
mieloma múltiple.38 Los efectos
antineoplásicos de la lenalidomida se dan en el contexto de
sobreregular los inhibidores de
cinasas del ciclo celular (CDKN1A,
CDKN1B, CDKN2A, CDKN2B) que
S86
promueven un robusto arresto del
ciclo celular como monodroga o
combinado con dexametasona.39,40
Así también, antagoniza las vías
de señalización de sobrevida celular controlado por NFkappaB,
produciendo una reducción en
la regulación de factores antiapoptóticos como CASP8 y el
regulador FADD-like (CFLAR) y
el gen BIRC3.41 Así también suprime la vía del Factor de necrosis
tumoral alfa (FNT-α) y por tanto
tiene la habilidad de bloquear la
vía NFKappaB también.42 Pero no
solo tiene acción sobre la célula
neoplásica directamente, también
tiene una acción importante en
el microambiente y es capaz de
inhibir Interleucina 6 (IL-6), FNT-α
y activación de la vía NFkappaB.43
En el contexto de los LDCGB, se
publicó recientemente el efecto de
la lenalidomida como monodroga
en pacientes con LDCGB refractario/
recaído (R/R).44 Hernández-Ilizaliturri y cols. Reportaron una respuesta
global (RG) de 27.5%; cuando se
analizó por subtipos “moleculares”
(germinal vs. No germinal por IHQ)
se observó que los no germinales
tuvieron una tasa de respuesta
mayor que los germinales (53%
vs. 9% respectivamente, p<0.001).
Ivanov y cols. Reportaron el uso
de lenalidomida y rituximab como
rescate en LDCGB R/R una tasa de
respuesta completa de 35.3% con
una mediana de duración de la respuesta de más de 26 meses lo que
confirma su actividad en LDCGB
R/R.45 También se ha probado en
primera línea en pacientes con
LDCGB mayores de 60 años, de
novo como fase I en combinación
con CHOP.46 La RG observada fue
de 90% y de respuestas completas
81%; la dosis máxima tolerada de
lenalidomida fue 15mg y la principal toxicidad fue la neutropenia
grado ¾ en un 28%.46
RECEPTOR DE CÉLULA B (BCELL RECEPTOR, BCR). Hay
evidencia que la estimulación
crónica del receptor BCR, provoca
la activación de la vía constitutiva
de NFkappaB. En los LDCGB se
ha observado que la mutación de
CARD11 y de MYD88 promueve
también la activación de NFkappaB,
sugiriendo así algunos blancos
moleculares terapéuticos. Uno
de estos blancos es la Tirocincinasa de Bruton (BTR) y por tanto
se ha desarrollado una molécula
pequeña llamada ibrutinib que es
selectivamente tóxico en aquellos
con activación crónica del BCR
(47). En base a estos estudios se
desarrolló un estudio fase II donde
se evaluó la efectividad del ibrutinib en LDCGB dependiendo de
su subtipo molecular (CG vs. ABC
por microarreglos) y el papel que
jugaban las mutaciones a nivel de
CD79, MYD88 y CARD11 en la RG
de los pacientes (n=70, ABC=29,
GC=20 y desconocido=21).47 Se
corroboró que los LDCGB del subtipo ABC respondieron mejor que
los CG (41% vs. 5%, p=0.007), apoyando la hipótesis de la activación
crónica del BCR en LDCGB subtipo
ABC. Cuando las respuestas se
evaluaron dependiendo de la presencia de mutación o no mutación
en CD79, MYD88 y CARD11, se
pudo observar que el ibrutinib tiene
su mayor actividad inhibiendo proliferación y produciendo apoptosis
en LDCGB con mutaciones del BCR
en su parte de CD79b y a nivel de
MYD88, mientras que en aquellos
con mutación a nivel de CARD11
no se observó ninguna actividad de
la molécula.47
VÍA FOSFATIDIL 3 INOSITOL,
PROTEINCINASA B (AKT) Y MAMMALIAN TARGET OF RAPAMYCIN
(PI3K/AKT/mTOR). Dicha vía está
relacionada con el incremento en la
proliferación y crecimiento celular
de los LDCGB y juega un papel
importante en la activación de la vía
NFkappaB en forma aberrante y no
constitutiva.48,49 Se activa a través de
Libro Educativo 55 Congreso Nacional de la Agrupación Mexicana para el Estudio de la Hematología, A.C.
citoquinas y factores de crecimiento
que estimulan al receptor de tirocinkinasa o TKR. Pero no es la única
vía de activación; en los LDCGB
la activación de PI3KàmTOR es a
través del estímulo crónico del BCR
(B-cell receptor).49
Actualmente, existen varias moléculas en vía de investigación
clínica que se encargan de inhibir
la vía de PI3KmTOR. Hay reportes
donde el ibrutinib interactúa favorablemente con inhibidores de PI3K y
que su combinación incrementar la
apoptosis de células de LDCGB (50).
Xu y cols. observaron que en un
poco más del 50% de pacientes con
LDCGB tuvieron activación de la vía
y se asociaron a mala respuesta al
usar CHOP pero no al combinar RCHOP, la conclusión de los autores
fue que se requieren estudios donde
se evalúe la sinergia o aditividad de
rituximab más un inhibidor de la vía
PI3KàmTOR.51 El mismo grupo chino
describió la sinergia de rituximab +
everolimus en líneas celulares con
un efecto de tipo aditivo.52 Barnes
y cols. Reportan en pacientes con
LDCGB R/R el efecto aditivo de
rituximab + everolimus.53 Actualmente corre un protocolo clínico
denominado THE STORM TRIAL
en fase I/II para evaluar la seguridad
y tolerancia a la combinación de
R-DHAP + temsirolimus; aún no se
tiene datos preliminares.
TERAPIAS DE RESCATE (INCLUIDO EL TACP) EN LDCGB. Sin
lugar a duda, uno de los retos del
especialista que atiende LDCGB
es la recaída (Re) o la enfermedad con refractariedad primaria
(Rp). Sin lugar a duda hay varios
factores que influyen en el “rescate” de este grupo de pacientes
y se deben subdividir en Re, que
ya mostraron en algún momento
quimiosensibilidad y los Rp que
desde un principio son refractarios a la quimioterapia de primera
línea. Creemos que en este rubro es
importante la búsqueda de biomar-
cadores que nos ayuden a predecir
que pacientes no responderán.
Nuestro grupo está trabajando en
un biomarcador sérico que podría
predecir hasta en un 60% de los
casos Rp y respuesta parcial antes
de la quimioterapia de inducción
(datos publicados en abstract en
ASH anual meeting Villela L et al.
2012: 120: abstract 5102).
Poseemos una gran variedad de
combinaciones de quimioterapia de
rescate como DHAP (dexametasona,
dosis altas de citarabina y platino),
ESHAP (etopósido, esteroide, dosis altas de citarabina y platino),
ICE (ifosfamida, carboplatino y
etopósido), GIFOX (Gemcitabina,
ifosfamida, oxaliplatino), GEMOX
( Gemcitabina, oxaliplatino). Todos
con diferentes porcentajes de respuesta (dependiendo si se usó con
rituximab o no), algunos mejores
que otros, por lo menos desde el
punto de vista “comparativo”. Desafortunadamente, ninguno de los
esquemas anteriormente mencionados se comparan en una forma
prospectiva entre sí y solamente se
hacen referencia unos a otros. Sin
embargo, el grupo colaborativo para
el estudio de los linfomas agresivos
recaídos (CORAL Trial) comparó dos
de los esquemas más usados a nivel
mundial R-ICE vs. R-DHAP.37,54 Este
estudio contestó varias preguntas en
pacientes R/R: Toxicidad y respuesta
en dos de los tratamientos más usados; y si la SG y SLP está influida
por la consolidación con TACP y el
mantenimiento con rituximab posterior al TACP. Los resultados finales
fueron los siguientes: la respuesta
global (respuesta completa + respuesta parcial) antes del trasplante
(efecto de la quimioterapia) fue de
85% (65%+20%, respectivamente);
Si evaluamos por el tipo de quimioterapia observamos que 63% de
respuestas completas fue obtenido
en el grupo de R-ICE y 64% en
el R-DHAP; para un subgrupo de
pacientes con tratamiento previo
con rituximab y progresión dentro
de los 12 meses del diagnóstico la
respuesta global fue de 46%. Tres
meses después del trasplante se
elevó la tasa de respuesta completa
de 65% a 73%, es decir, el trasplante
adicionó un 8% más, es decir, de respuesta parcial a respuesta completa.
Cuando se analiza la curva de SLP
(pacientes que obtuvieron respuesta
completa y se mantienen en ese
estatus) observamos que a 4 años el
53% continua en remisión completa,
y si se evalúa a los que se dio mantenimiento vs. No mantenimiento,
no hay diferencia entre los grupos
(p=0.8) y las recaídas/progresiones
fueron iguales entre los brazos.
Cuando se analizaron los factores
que influían en la SLP, finalmente
fueron el IPI ajustado al momento
de recaída o progresión previo al
salvamento (≥2 o más factores,
p<0.001) y de forma interesante el
género (masculino, p<0.01).54
Aunque en este reporte final del
grupo CORAL mencionan que el
uso previo de rituximab no influye
en la SLP, en su primer reporte posterior al trasplante y analizado a 3
años de seguimiento, si se observó
este fenómeno (37), que ya otros
grupos lo han objetivado.55
CONCLUSION. R-CHOP 21 es
tratamiento estándar para LDCGB.
Sin embargo, al intentar personalizar las quimioterapias observamos
que solamente los jóvenes con
factores de riesgo de 0/1 son los
únicos que se benefician de dicho
tratamiento y que los que se encuentran en un riesgo intermedio
o alto se requiere encontrar aún un
tratamiento estándar. Posiblemente
en los jóvenes de intermedio y alto
riesgo el TACP como consolidación
en la inducción produzca mayores
“curaciones”, pero se requieren de
estudios prospectivos y controlados
para definir esta percepción. Así
también, los nuevos anticuerpos
monoclonales y moléculas pequeñas jugarán un papel importante en
S87
Volumen 15, Suplemento 1, 2014
Revista de Hematología
la sinergia o adición antitumoral a
la quimioterapia estándar.
Con respecto a los pacientes
recaídos/refractarios parece que
la mejor terapia para ellos es la
prevención de la recaída e identificar previa a las terapias a los
potenciales refractarios a través de
biomarcadores.
Referencias
1.
2.
3.
4.
5.
6.
7.
S88
Armitage JO, Weisenburger DD. New
approach to classifying non-Hodgkin’s
lymphomas: clinical features of the major histologic subtypes. Non-Hodgkin’s
Lymphoma Classification Project. J Clin
Oncol. 1998;16(8):2780-95.
Campo E, Swerdlow SH, Harris NL,
Pileri S, Stein H, Jaffe ES. The 2008
WHO classification of lymphoid
neoplasms and beyond: evolving
concepts and practical applications.
Blood. 2011;117(19):5019-32.
Candelaria M, Cervera-Ceballos E,
Meneses-Garcia A, Aviles-Salas A,
Lome-Maldonado C, Zarate-Osorno
A, et al. [National guidelines of
diagnosis and treatment of the nonHodgkin lymphoma]. Rev Invest Clin.
2013;65 Suppl 2:s5-27.
Zinzani PL, Broccoli A, Stefoni V,
Musuraca G, Abruzzese E, De Renzo
A, et al. Immunophenotype and
intermediate-high international
prognostic index score are prognostic
factors for therapy in diffuse large
B-cell lymphoma patients. Cancer.
2010;116(24):5667-75.
Laurini JA, Perry AM, Boilesen E,
Diebold J, Maclennan KA, MullerHermelink HK, et al. Classification of
non-Hodgkin lymphoma in Central
and South America: a review of 1028
cases. Blood. 2012;120(24):4795-801.
Green TM, Young KH, Visco C, XuMonette ZY, Orazi A, Go RS, et al. Immunohistochemical double-hit score
is a strong predictor of outcome in
patients with diffuse large B-cell
lymphoma treated with rituximab
plus cyclophosphamide, doxorubicin,
vincristine, and prednisone. J Clin
Oncol. 2012;30(28):3460-7.
A predictive model for aggressive
non-Hodgkin’s lymphoma. The International Non-Hodgkin’s Lymphoma
Prognostic Factors Project. N Engl J
Med. 1993;329(14):987-94.
8.
9.
10.
11.
12.
13.
14.
Coiffier B, Thieblemont C, Van Den
Neste E, Lepeu G, Plantier I, Castaigne S, et al. Long-term outcome of
patients in the LNH-98.5 trial, the
first randomized study comparing
rituximab-CHOP to standard CHOP
chemotherapy in DLBCL patients:
a study by the Groupe d’Etudes
des Lymphomes de l’Adulte. Blood.
2010;116(12):2040-5.
Pfreundschuh M, Trumper L, Osterborg A, Pettengell R, Trneny M,
Imrie K, et al. CHOP-like chemotherapy plus rituximab versus CHOPlike chemotherapy alone in young
patients with good-prognosis diffuse
large-B-cell lymphoma: a randomised
controlled trial by the MabThera
International Trial (MInT) Group.
Lancet Oncol. 2006;7(5):379-91.
Cunningham D, Hawkes EA, Jack A,
Qian W, Smith P, Mouncey P, et al.
Rituximab plus cyclophosphamide,
doxorubicin, vincristine, and prednisolone in patients with newly
diagnosed diffuse large B-cell nonHodgkin lymphoma: a phase 3 comparison of dose intensification with
14-day versus 21-day cycles. Lancet.
2013;381(9880):1817-26.
Delarue R, Tilly H, Mounier N, Petrella T, Salles G, Thieblemont C, et al.
Dose-dense rituximab-CHOP compared with standard rituximab-CHOP
in elderly patients with diffuse large
B-cell lymphoma (the LNH03-6B
study): a randomised phase 3 trial.
Lancet Oncol. 2013;14(6):525-33.
Ozbalak M, Ar MC, Tuzuner N, Salihoglu A, Eskazan AE, Ongoren Aydin
S, et al. Detailed analysis of diffuse
large B cell lymphoma patients: a
single-center, retrospective study.
ISRN Hematol. 2013;2013:908191.
Miller TP, Dahlberg S, Cassady JR,
Adelstein DJ, Spier CM, Grogan
TM, et al. Chemotherapy alone
compared with chemotherapy
plus radiotherapy for localized
intermediate- and high-grade nonHodgkin’s lymphoma. N Engl J Med.
1998;339(1):21-6.
Horning SJ, Weller E, Kim K, Earle JD,
O’Connell MJ, Habermann TM, et
al. Chemotherapy with or without
radiotherapy in limited-stage diffuse
aggressive non-Hodgkin’s lymphoma: Eastern Cooperative Oncology
15.
16.
17.
18.
19.
20.
21.
22.
Group study 1484. J Clin Oncol.
2004;22(15):3032-8.
Cronin CG, Swords R, Truong MT,
Viswanathan C, Rohren E, Giles FJ,
et al. Clinical utility of PET/CT in
lymphoma. AJR Am J Roentgenol.
2010;194(1):W91-w103.
Sehn LH, Berry B, Chhanabhai M,
Fitzgerald C, Gill K, Hoskins P, et al.
The revised International Prognostic
Index (R-IPI) is a better predictor of
outcome than the standard IPI for
patients with diffuse large B-cell lymphoma treated with R-CHOP. Blood.
2007;109(5):1857-61.
Greb A, Bohlius J, Trelle S, Schiefer
D, De Souza CA, Gisselbrecht C, et al.
High-dose chemotherapy with autologous stem cell support in first-line
treatment of aggressive non-Hodgkin
lymphoma - results of a comprehensive meta-analysis. Cancer Treat Rev.
2007;33(4):338-46.
Dilhuydy MS, Lamy T, Foussard C,
Gressin R, Casassus P, Deconninck E,
et al. Front-line high-dose chemotherapy with rituximab showed excellent
long-term survival in adults with
aggressive large b-cell lymphoma:
final results of a Phase II GOELAMS
Study. Biol Blood Marrow Transplant.
2010;16(5):672-7.
Takasaki H, Hashimoto C, Fujita A,
Matsumoto K, Taguchi J, Kuwabara
H, et al. Upfront autologous stem
cell transplantation for untreated
high-risk diffuse large B-cell lymphoma in patients up to 60 years of
age. Clin Lymphoma Myeloma Leuk.
2013;13(4):404-9.
Stiff PJ, Unger JM, Cook JR, Constine LS, Couban S, Stewart DA, et
al. Autologous transplantation as
consolidation for aggressive nonHodgkin’s lymphoma. N Engl J Med.
2013;369(18):1681-90.
Fitoussi O, Belhadj K, Mounier
N, Parrens M, Tilly H, Salles G, et
al. Survival impact of rituximab
combined with ACVBP and upfront
consolidation autotransplantation
in high-risk diffuse large B-cell lymphoma for GELA. Haematologica.
2011;96(8):1136-43.
Inano S, Iwasaki M, Iwamoto Y, Sueki
Y, Fukunaga A, Yanagita S, et al. Impact
of high-dose chemotherapy and autologous transplantation as first-line
Libro Educativo 55 Congreso Nacional de la Agrupación Mexicana para el Estudio de la Hematología, A.C.
23.
24.
25.
26.
27.
28.
29.
therapy on the survival of high-risk
diffuse large B cell lymphoma patients: a single-center study in Japan.
Int J Hematol. 2014;99(2):162-8.
Tomita N, Kodama F, Motomura S,
Koharazawa H, Fujita H, Harano H,
et al. Prognostic factors in diffuse
large B-cell lymphoma treated by
risk-adopted therapy. Intern Med.
2006;45(5):247-52.
Recher C, Coiffier B, Haioun C, Molina TJ, Ferme C, Casasnovas O, et
al. Intensified chemotherapy with
ACVBP plus rituximab versus standard CHOP plus rituximab for the
treatment of diffuse large B-cell lymphoma (LNH03-2B): an open-label
randomised phase 3 trial. Lancet.
2011;378(9806):1858-67.
Andre M, Mounier N, Leleu X, Sonet
A, Brice P, Henry-Amar M, et al. Second cancers and late toxicities after
treatment of aggressive non-Hodgkin
lymphoma with the ACVBP regimen:
a GELA cohort study on 2837 patients. Blood. 2004;103(4):1222-8.
Rosenwald A, Wright G, Chan WC,
Connors JM, Campo E, Fisher RI, et
al. The use of molecular profiling to
predict survival after chemotherapy
for diffuse large-B-cell lymphoma. N
Engl J Med. 2002;346(25):1937-47.
Holte H, Leppa S, Bjorkholm M,
Fluge O, Jyrkkio S, Delabie J, et al.
Dose-densified chemoimmunotherapy followed by systemic central
nervous system prophylaxis for
younger high-risk diffuse large Bcell/follicular grade 3 lymphoma
patients: results of a phase II Nordic
Lymphoma Group study. Ann Oncol.
2013;24(5):1385-92.
Wilson WH, Jung SH, Porcu P, Hurd D,
Johnson J, Martin SE, et al. A Cancer
and Leukemia Group B multi-center
study of DA-EPOCH-rituximab in
untreated diffuse large B-cell lymphoma with analysis of outcome by
molecular subtype. Haematologica.
2012;97(5):758-65.
Garcia-Suarez J, Banas H, Arribas I, De
Miguel D, Pascual T, Burgaleta C. Dose-adjusted EPOCH plus rituximab is
an effective regimen in patients with
poor-prognostic untreated diffuse
large B-cell lymphoma: results from
a prospective observational study. Br
J Haematol. 2007;136(2):276-85.
30. Garcia-Suarez J, Flores E, Callejas M,
Arribas I, Gil-Fernandez JJ, Olmedilla
G, et al. Two-weekly dose-adjusted
(DA)-EPOCH-like chemotherapy
with high-dose dexamethasone plus
rituximab (DA-EDOCH14-R) in poorprognostic untreated diffuse large
B-cell lymphoma. Br J Haematol.
2013;160(4):510-4.
31. Davis RE, Brown KD, Siebenlist U,
Staudt LM. Constitutive nuclear
factor kappaB activity is required
for survival of activated B cell-like
diffuse large B cell lymphoma cells. J
Exp Med. 2001;194(12):1861-74.
32. Dunleavy K, Pittaluga S, Czuczman
MS, Dave SS, Wright G, Grant N, et
al. Differential efficacy of bortezomib
plus chemotherapy within molecular
subtypes of diffuse large B-cell lymphoma. Blood. 2009;113(24):606976.
33. Cang S, Mukhi N, Wang K, Liu D. Novel CD20 monoclonal antibodies for
lymphoma therapy. J Hematol Oncol.
2012;5:64.
34. Coiffier B, Radford J, Bosly A, Martinelli G, Barca G, Davies A, et al. A multicentre, phase II trial of ofatumumab
monotherapy in relapsed/progressive diffuse large B-cell lymphoma. Br
J Haematol. 2013;163(3):334-42.
35. Matasar MJ, Czuczman MS, Rodriguez MA, Fennessy M, Shea TC,
Spitzer G, et al. Ofatumumab in
combination with ICE or DHAP chemotherapy in relapsed or refractory
intermediate grade B-cell lymphoma.
Blood. 2013;122(4):499-506.
36. Morschhauser FA, Cartron G, Thieblemont C, Solal-Celigny P, Haioun C,
Bouabdallah R, et al. Obinutuzumab
(GA101) monotherapy in relapsed/
refractory diffuse large b-cell lymphoma or mantle-cell lymphoma: results from the phase II GAUGUIN study. J Clin Oncol. 2013;31(23):2912-9.
37. Gisselbrecht C, Glass B, Mounier N,
Singh Gill D, Linch DC, Trneny M, et
al. Salvage regimens with autologous
transplantation for relapsed large Bcell lymphoma in the rituximab era.
J Clin Oncol. 2010;28(27):4184-90.
38. Muller GW, Corral LG, Shire MG,
Wang H, Moreira A, Kaplan G, et
al. Structural modifications of thalidomide produce analogs with
enhanced tumor necrosis factor
39.
40.
41.
42.
43.
44.
45.
46.
inhibitory activity. J Med Chem.
1996;39(17):3238-40.
Verhelle D, Corral LG, Wong K,
Mueller JH, Moutouh-de Parseval L,
Jensen-Pergakes K, et al. Lenalidomide and CC-4047 inhibit the proliferation of malignant B cells while
expanding normal CD34+ progenitor
cells. Cancer Res. 2007;67(2):746-55.
Gandhi AK, Kang J, Capone L, Parton
A, Wu L, Zhang LH, et al. Dexamethasone synergizes with lenalidomide
to inhibit multiple myeloma tumor
growth, but reduces lenalidomideinduced immunomodulation of T and
NK cell function. Curr Cancer Drug
Targets. 2010;10(2):155-67.
Mitsiades N, Mitsiades CS, Poulaki
V, Chauhan D, Richardson PG, Hideshima T, et al. Apoptotic signaling
induced by immunomodulatory thalidomide analogs in human multiple
myeloma cells: therapeutic implications. Blood. 2002;99(12):4525-30.
Keifer JA, Guttridge DC, Ashburner BP,
Baldwin AS, Jr. Inhibition of NF-kappa
B activity by thalidomide through
suppression of IkappaB kinase activity.
J Biol Chem. 2001;276(25):22382-7.
Anderson KC. The role of immunomodulatory drugs in multiple myeloma.
Semin Hematol. 2003;40(4 Suppl
4):23-32.
Hernandez-Ilizaliturri FJ, Deeb G,
Zinzani PL, Pileri SA, Malik F, Macon WR, et al. Higher response to
lenalidomide in relapsed/refractory
diffuse large B-cell lymphoma in
nongerminal center B-cell-like than
in germinal center B-cell-like phenotype. Cancer. 2011;117(22):5058-66.
Ivanov V, Coso D, Chetaille B, Esterni
B, Olive D, Aurran-Schleinitz T, et al.
Efficacy and safety of Lenalinomide
combined to Rituximab in patients
with relapsed/refractory diffuse large
B cell lymphoma. Leuk Lymphoma.
2014.
Chiappella A, Tucci A, Castellino A, Pavone V, Baldi I, Carella AM, et al. Lenalidomide plus cyclophosphamide,
doxorubicin, vincristine, prednisone
and rituximab is safe and effective
in untreated, elderly patients with
diffuse large B-cell lymphoma: a
phase I study by the Fondazione
Italiana Linfomi. Haematologica.
2013;98(11):1732-8.
S89
Volumen 15, Suplemento 1, 2014
Revista de Hematología
47. Davis RE, Ngo VN, Lenz G, Tolar P,
Young RM, Romesser PB, et al. Chronic active B-cell-receptor signalling
in diffuse large B-cell lymphoma.
Nature. 2010;463(7277):88-92.
48. Uddin S, Hussain AR, Siraj AK, Manogaran PS, Al-Jomah NA, Moorji A,
et al. Role of phosphatidylinositol
3’-kinase/AKT pathway in diffuse large B-cell lymphoma survival. Blood.
2006;108(13):4178-86.
49. Kloo B, Nagel D, Pfeifer M, Grau
M, Duwel M, Vincendeau M, et al.
Critical role of PI3K signaling for
NF-kappaB-dependent survival in a
subset of activated B-cell-like diffuse
large B-cell lymphoma cells. Proc Natl
Acad Sci U S A. 2011;108(1):272-7.
50. Mathews Griner LA, Guha R, Shinn
P, Young RM, Keller JM, Liu D, et
al. High-throughput combinatorial
screening identifies drugs that coo-
S90
perate with ibrutinib to kill activated
B-cell-like diffuse large B-cell lymphoma cells. Proc Natl Acad Sci U S
A. 2014;111(6):2349-54.
51. Xu ZZ, Xia ZG, Wang AH, Wang WF,
Liu ZY, Chen LY, et al. Activation
of the PI3K/AKT/mTOR pathway
in diffuse large B cell lymphoma:
clinical significance and inhibitory
effect of rituximab. Ann Hematol.
2013;92(10):1351-8.
52. Xu ZZ, Wang WF, Fu WB, Wang AH,
Liu ZY, Chen LY, et al. Combination
of rituximab and mammalian target
of rapamycin inhibitor everolimus
(RAD001) in diffuse large B-cell lymphoma. Leuk Lymphoma. 2013.
53. Barnes JA, Jacobsen E, Feng Y, Freedman A, Hochberg EP, LaCasce AS, et
al. Everolimus in combination with
rituximab induces complete responses in heavily pretreated diffuse large
B-cell lymphoma. Haematologica.
2013;98(4):615-9.
54. Gisselbrecht C, Schmitz N, Mounier
N, Singh Gill D, Linch DC, Trneny
M, et al. Rituximab maintenance
therapy after autologous stem-cell
transplantation in patients with
relapsed CD20(+) diffuse large Bcell lymphoma: final analysis of
the collaborative trial in relapsed
aggressive lymphoma. J Clin Oncol.
2012;30(36):4462-9.
55. Redondo AM, Pomares H, Vidal MJ,
Pascual MJ, Quereda B, Sancho JM,
et al. Impact of prior rituximab on
outcomes of autologous stem-cell
transplantation in patients with relapsed or refractory aggressive B-cell
lymphoma: a multicentre retrospective Spanish group of lymphoma/autologous bone marrow transplant study.
Br J Haematol. 2014;164(5):668-74.
Trabajos libres
Rev Hematol Mex 2014;15 (Supl. 1):S91-S202.
CASOS CLÍNICOS
PRESENTACIÓN ORAL
A1090
BORTEZOMIB EN PACIENTES
CON SINDROME DE UPSHAWSCHULMAN
Vásquez Díaz JE*, Barrera Chairez E**, Zuno Reyes EE***, Pérez
Becerra E****, Ron Magaña AL**,
De La Mora López PA**, Pineda
Palma JI**, Ruíz Morales TC**,
Padilla Ortega JA**, Chamorro
Morales NH***, Villalobos De La
Mora LO***, Martínez Ayón C***.
* Hospital Civil De Guadalajara Fray
Antonio Alcalde. ** Universidad de
Guadalajara (UDG). *** Servicio
de Hematología-Hospital Civil de
Guadalajara . **** Unidad de Patología Clínica.
jestuardo61@yahoo.com
ANTECEDENTES. El síndrome de
Upshaw-Schulman es la forma
congénita de la purpura trombocitopénica trombotica (PTT), una
complicación fatal en el embarazo;
tiene una incidencia anual de 4 a
10 casos por millón/año. La plasmaferesis es el tratamiento de primera
línea, con rituximab en recaídas
tempranas y bortezomib en casos
refractarios.
OBJETIVO. Se presenta el caso
de una paciente con síndrome de
“Upshaw-Schulman” refractario a
tratamiento.
CASO CLÍNICO. Femenina de
33 años, referida de hospital regional dos semanas posteriores a parto
complicado por PTT, donde recibe 3
bolos de metilprednisolona. Acude
al servicio de urgencia desorientada, con disminución de la agudeza
visual e hipertensión maligna. Antecedentes: 6 embarazos, 4 abortos y
2 partos; durante su primer embarazo presento pre-clampsia. Historia
familiar: madre con 5 embarazos
sin complicaciones, hermana mayor
falleció posterior a parto presentando cuadro de PTT y hermana menor
falleció en hospital regional horas
después del parto sin diagnóstico
establecido. Ingresa consciente con
habla incoherente, fundoscopia
sin papiledema, extremidades con
equimosis y hematomas, hiperreflexia bicipital y rotuliana derecha.
Se documentó anemia hemolítica
microangiopática (Hb: 6.98 g/
dL, BT: 3.4 mg/dL, BI: 2.6 mg/dL,
DHL: 2,507 UI/L, esquizocitos
+++), trombocitopenia (plaquetas:
46,300/uL) y coagulopatia (Dímero
D: 2 020 ng/mL, fibrinógeno: 329
mg/dL). Medula ósea: hiperplasia
de la serie eritrocítica con maduración megaloblástica, esquizocitos
y trombocitopenia. Las causas secundarias virales (citomegalovirus,
epstein-barr, HIV, hepatitis B y
C) e inmunes investigadas fueron
negativas. TAC torácica-abdominal
normal. Niveles de ADAMTS13:
38% (normal >66%), anticuerpos
para ADAMTS13: 10 u/mL (negativos <12 u/mL). Recibió 6 sesiones
de plasmaferesis con buena respuesta (DHL: 150 000/uL plaquetas:
385 000/uL, Hb: 11.2 g/dL, Dímero
D: 329 y frotis: 5-6 esquizocitos por
campo); en segunda sesión presenta
reacción transfusional menor por
anticuerpos (Anti-E) y 48 hrs posterior a sexta sesión presenta crisis
convulsiva. Angio-resonancia con
zona de gliosis frontal derecha y
parietal izquierda e infarto subagudo occipital izquierdo. Iniciamos
Rituximab semanal por tres dosis
sin respuesta (plaquetas: 70 000/uL,
Hb: 10.5 g/dL, DHL: 386, Dímero
D: 1,029, frotis: 6-7 esquizocitos
por campo). Se confirma supresión
de células B por inmunofenotipo
CD19: 0.05% y actividad de células plasmáticas CD138: 2.36%.
Reiniciamos plasmaferesis por 4
sesiones y bortezomib (días 1, 4,
8, 11 y 21) con adecuada respuesta
(DHL:146 UI/L, plaquetas:325,000,
Hg:11.6, Dímero D:229 y frotis: 1
esquizocitos por campo).
CONCLUSIONES. La plasmaferesis continúa siendo el tratamiento
de elección en pacientes con PTT;
en la variante congénita el Rituximab no mostro efectividad. La
terapia con bortezomib más plasmaferesis es eficaz en pacientes con
síndrome de Upshaw-Schulman
refractario a tratamiento.
A1172
H E M O F I L I A A D Q U I R I DA
TRATADA CON RITUXIMAB/
MICOFENOLATO DE MOFETILO.
REPORTE DE UN CASO
Pérez Lozano U*, Audelo Guzman
M*, Ruiz Ovalle JL**, Limón Flores
JA*, Lobato Tolama R*, Audelo
Guzman M*.
* IMSS Hospital De Especialidades
De Puebla UMAE. ** Unidad de
Oncología SSA.
dra_uendy@yahoo.com.mx
INTRODUCCIÓN. La Hemofilia
Adquirida (HA) es una enfermedad
grave causada por autoanticuerpos
contra cualquier factor de la coagulación, tiene una incidencia de 0.2
a 1 caso por millón de habitantes y
una mortalidad cercana al 90% por
hemorragias masivas.
OBJETIVO. Describir el comportamiento clínico de un hombre
con HA ante un esquema de inmunosupresión.
M AT E R I A L Y M É TO D O S .
Hombre de 61 años, diabético,
alcoholismo positivo intenso antiguo. Asintomático, enviado por
esplenomegalia masiva, hasta cresta
iliaca, sobrepasando línea media.
S91
Volumen 15, Suplemento 1, 2014
Revista de Hematología
Sin historia de sangrados. TAC
con esplenomegalia de 26 cm
de longitud con zonas de infarto
esplénico, ectasia del sistema venoso esplenoportal sin evidencia de
obstrucción vascular. Ultrasonido
Doppler con dilatación vena porta.
Hb 11.8 g/dL, Hto 37%, Plaquetas
133 000/uL, Leucocitos 6 000/uL,
Neutrofilos 2,820/uL. TP: 15 s, TTPa
29Ls. Glucosa 99 mg/dl, Creatinina
0.5 , BT: 0.72, BD: 0.23, BI : 0.49,
ALT: 29 U/L, AST: 37 U/L, DHL: 200
U/L. HIV, VHB, VHC CMV , VEB negativos -. PCR BCR/ABL : Negativo.
Mutación JAK2/ V617F Negativo.
Chagas: Negativo. Beta 2 microglobulina elevada, Biopsia Osea :
Celularidad del 50%, presencia de
las tres líneas celulares, sin fibrosis.
Prequirúrgicos: TTPa en 53,9 s, TP
15 s. Factor VIII : 11%. Inhibidor
Factor VIII 5.12 UB/mL por lo que
se suspende cirugía. Factor Reumatoide <10.4 UI/mL,, VDRL: Positivo
1:16. Anticardiolipinas IgM 273.7
UMPL/mL, Anticoagulante Lúpico
1.58, Anti- Ro y Anti- La Negativos,
Anti- Sm Negativo, Ac Antinucleares Positivo . Recibió Prednisona
75 mg/día por 30 días. El Inhibidor
contra Factor VIII: 30 UB/ml en la
primera semana, por lo que agrega
Micofenolato de Mofetilo. A los 6
meses reduce esplenomegalia a 9
cm debajo reborde costal e Inhibidor contra Factor VIII (-) por lo que
ingresa a esplenectomía, la cual
se difiere por anticuerpos irregulares: Anti- Kell y Coombs Directo
Positivo. Inicia Rituximab 750 mg/
semana, por 8 dosis.
RESULTADOS. F VIII 57%,
Inhibidor contra F VIII: 0 %, anticardiolipinas positivo, TP 15”,
TTPa 28“. El producto de esplenectomía reporta: infartos recientes
y antiguos, dilatación sinusoidal
y depleción de pulpa blanca sin
evidencia de neoplasia. Biopsia
hepática: cirrosis hepática. Sin
eventualidad alguna después de
un año.
CONCLUSIONES. La HA es
una enfermedad autoinmune
rara, que se puede asociar con
síndrome antifosfolípido primario
y modificar el comportamiento
clínico. Los esquemas de inmunosupresión propuestos para
éstos casos se apoyan en series
de casos con escaso número de
pacientes.
PRESENTACIÓN CARTEL
A1002
MANIFESTACIONES HEMORRÁGICAS EN PACIENTE CON LA
PRESENCIA ANTICOAGULANTE
LÚPICO
Ayala-Haro N*, Amador-Medina
LF*.
* Hospital Regional De Alta Especialidad Bajio.
noe_aharo17@hotmail.com
ANTECEDENTES. El anticoagulante
lúpico es un anticuerpo IgM y/o
IgG que reacciona de forma cruzada con fosfolípidos aniónicos y
beta 2-glicoproteína I. Se asocia
típicamente con trombosis arterial
o venosa, abortos recurrentes o
trombocitopenia. En un número pequeño de pacientes puede asociarse
con manifestaciones hemorrágicas.
OBJETIVO. Presentar un caso clínico de un síndrome hemorragíparo
asociado a anticoagulante lúpico.
CASO CLÍNICO. Femenino de
20 años de edad referida de hospital
S92
de segundo nivel por historia de 2
semanas previas a su ingreso con
manifestaciones hemorrágicas. Refiere hace 5 años fue hospitalizada
por gingivorragia y epistaxis. Fue
trasfundida en su unidad de referencia por síndrome anémico, a su
ingreso con Hb 9.4 g/dL, Hct 28.4,
VGM 82.8, HCM 27.4, leucocitos
4930/uL, neutrófilos 70%, linfocitos
22%, plaquetas de 31,000/uL, TP
42.7 s, INR 3.55, TTPa 187 s. Fue
ingresada para abordaje diagnóstico de bicitopenia y coagulopatía
en estudio. Al aspirado de médula
ósea hipercelularidad con displasia leve de la serie roja; índice de
Rosner sin corrección de tiempos
de coagulación (TP y TTPa). Hubo
prolongación de tiempos de coagulación posterior a la administración
de 2 PFC, con TP 40.3, TTPa 155,
INR 3.33, lo que nos hizo sospechar
en un inhibidor de factores de la vía
común (Factor X, V, II, I), se solicita
determinación de los mismos; el
anticoagulante lúpico se reportó
positivo, se documentó hipocomplementemia (C4 <8 mg/dL, C3
<40 mg/dL); el panel inmunológico
que incluía anti-DNA, Factor reumatoide, c-ANCA y p-ANCA, anti
Nucleares resultaron negativos al
igual que serologías contra VHB,
VHC y VIH. Ante dichos hallazgos
se decidió inicio de pulsos de metilprednisolona 1gr IV cada 24 horas.
Fue enviada a la UCI ante hemorragia pulmonar y gastrointestinal con
inestabilidad hemodinámica que
requirió intubación orotraqueal observándose TP 19.3, TTPa 38.9, INR
1.11, atribuyéndose dicha mejora a
los pulsos de esteroide. Los factores
de coagulación se reportaron con
Factor II 20% (normal 50-120%),
Factor X 46% (80-120%), no se
pudo determinar Factor V, y los
anticuerpos anti-protrombina que
se tomaron posterior a los pulsos
de metilprednisolona, no fueron
detectados.
Libro Educativo 55 Congreso Nacional de la Agrupación Mexicana para el Estudio de la Hematología, A.C.
CONCLUSIONES. Cuando un
paciente presenta sangrado, en
ausencia de coagulopatía preexistente o defectos de la coagulación
la posibilidad de anticuerpos contra factores de coagulación debe
ser considerada. La deficiencia
adquirida de Factor VIII es la más
común. Anticuerpos contra otros
factores de coagulación son más
raros, atribuyéndose principalmente a enfermedades autoinmunes,
fármacos, neoplasias. El papel del
anticoagulante lúpico puede ser
determinante.
A1006
ÉXITO DEL USO DE MESILATO
DE IMATINIB E INFUSIÓN DE
LINFOCITOS DEL DONADOR EN
LEUCEMIA MIELOIDE CRÓNICA
EN FASE BLÁSTICA EN RECAIDA
POST-ALOTRASPLANTE
Tuna-Aguilar E*, Barrera-Lumbreras
G*, Galván-López I*, CouaryAguilera P*, Barrales-Benítez O*,
Aguayo-González A*.
*Instituto Nacional De Ciencias Médicas Y Nutrición Salvador Zubirán.
INTRODUCCIÓN. En Leucemia Mieloide Crónica (LMC), el
alotrasplante de progenitores hematopoyéticos (aloTCPH) produce
excelentes resultados (SG 40-80%
a 5 años), pero la frecuencia de
mortalidad relacionada a TCPH
es elevada (5-50%). La fase de la
enfermedad afecta el resultado;
en fase crónica (FC) la frecuencia
de recaída es de 5-20% y en fases
acelerada (FA) y blástica (FB) de
30%-60%. La infusión de linfocitos
del donador (ILD) ha sido el tratamiento de elección en pacientes en
recaída post-alo TCPH. Las complicaciones se reducen con dosis
escaladas pero persiste el riesgo
de recurrencia. Desde la aprobación del Imatinib (MI) se considera
posible la erradicación de la enfermedad residual al disminuir los
transcritos (BCR-ABL) que tiene un
efecto sinérgico con la ILD (injerto
contra enfermedad) reduciendo la
necesidad de altas dosis de ILD y
sus complicaciones. El efecto de
esta combinación continúa siendo
menos favorable en la FB.
OBJETIVO. Ilustrar el beneficio
de la combinación de la ILD/MI en
pacientes en recaída post-alo TCPH
en fases avanzadas de la LMC.
MATERIAL Y MÉTODOS. Revisión expediente clínico.
RESULTADOS. Mujer de 65
años con diagnóstico de LMC en
FC en 1998 (tratada con Interferón
alfa e hidroxiurea. Enero/2000:
transformación a FB linfoide B,
se aplicó quimioterapia (QT) de
inducción con HOP, se logró segunda FC. 24/8/2000: alo TCPH de
donador masculino relacionado .
No presentó datos de Enfermedad
Injerto Contra Huésped (EICH).
Marzo 2001: recaída citogenética;
ILD en dos ocasiones, logró quimerismo completo sin EICH. Desde
entonces sin datos de actividad.
19/09/12: recaída hematológica
en FC y quimerismo 51% donador,
5/10/12: ILD: 12/10/2012 inició MI
600mg, sin embargo evolucionó
a FB mieloide: 15/11/2012: QT
de inducción con 7+3, NO logró
remisión completa(RC). Reinducción con dosis altas de citarabina,
alcanzando RC. Por edad mayor
a 60 años no fue candidata a segundo aloTCPH y considerando
que nunca había recibido MI, se
decidió no aplicar más QT y continuar con MI 400mg (por toxicidad
medular con 600mg). A 15 meses
de la intervención se encuentra
en RCgC, RMM4.5 y quimerismo
100% donador.
CONCLUSIONES. 1.Hubo pérdida de quimerismo y cromosoma
Ph positivo, por lo que: ILD fue útil
para restablecer quimerismo, la
QT para citorreducción y el MI en
el control de los transcritos BCRABL, con lo que se logró un efecto
sinérgico positivo. 2. La primera FB
linfoide y la segunda mieloide podría explicarse por la inestabilidad
crómosómica existente en LMC.
3. Es un caso poco frecuente de
FB en RC prolongada sin segundo
aloTCPH que sobrepasa la expectativa de vida(3 -7 meses) en FB
tratada sólo con MI.
A1017
MUCOPOLISACARIDOSIS TIPO 1
HURLER SCHEIE, EXPERIENCIA EN
HGZ/UMAA #48 AZCAPOTZALCO DF. IMSS
Castellanos Sinco HB*, Mendiola R
Berenice G**, Badillo De La Peña
S**, Álvarez Cruz R**, Morales Tardos G**, Cartagena Sandoval JA**,
Cabrera Rayo A**. * Hospital General De México. **
HGZ/UMAA No. 48 San Pedro
Xalpa. IMSS.
humbertosinco@hotmail.com
ANTECEDENTES. La mucopolisacaridosis es un trastorno genético
que se caracteriza por la deficiencia
de la enzima alfa-L-iduronidasa
que produce la acumulación de
glucosaminoglucanos en órganos y
tejidos que conlleva a un deterioro
progresivo. Las manifestaciones
más comunes son disostosis, hernias recurrentes, opacidad corneal,
engrosamiento de rasgos faciales,
enfermedad en vías respiratorias
recurrente. El diagnóstico tiene
tres bases principales: la clínica,
la determinación bioquímica y la
definición molecular, la cuantificación de la actividad disminuida
o ausente de la alfa-L-iduronidasa
confirma el diagnóstico de mucopolisacaridosis tipo 1 y el tratamiento
de elección es la terapia de reemplazo enzimático, disponible en
México a partir 2005.
OBJETIVO. El objetivo de este
trabajo es presentar el protocolo de
estudio para llegar al diagnóstico y
la evolución física, bioquímica y
funcional de un paciente con MPS1
tipo Hurler Scheie, que recibe tra-
S93
Volumen 15, Suplemento 1, 2014
Revista de Hematología
tamiento de reemplazo enzimático
con laronidasa desde hace 7 años
y a partir de este estudio la evaluación de los cambios que presenta
la paciente.
CASO CLÍNICO. Se realizó
investigación documental en el
expediente clínico para conocer
los antecedentes y evolución del
paciente, se dio seguimiento continuo con base en las guías de
manejo del consenso mexicano de
enfermedades lisosomales. El protocolo de estudio que se realizó al
paciente fue el que marcan las guías
clínicas para llegar al diagnóstico.
Los resultados encontrados a partir
de uso de la terapia enzimática fueron: aumento en la movilidad de las
articulaciones, reducción de dolor
articular, disminución de la hepatoesplenomegalia, aumento en la
capacidad funcional pulmonar que
se reflejó en el paciente al presentar
diminución de disnea, reducción de
la frecuencia de enfermedad de vías
respiratorias.
CONCLUSIONES. La importancia de seguir el protocolo de
estudio tras la sospecha clínica
como lo marcan las guías clínicas
es realizar diagnóstico oportuno
como se presentó en este caso, para
evitar el rezago en el tratamiento
ya que no se diagnostica o detecta
a tiempo la enfermedad, debido a
la baja incidencia. Es de crucial
importancia que la comunidad
médica cuente con un mayor conocimiento del padecimiento para
hacer un diagnóstico diferencial
que permita al paciente iniciar un
tratamiento lo antes posible para
obtener un resultado óptimo. El manejo multidisciplinario y la terapia
de reemplazo enzimática lograron
una mejoría notable de manera
global, ya que se logró aumento en
movimiento articular, disminución
de organomegalia y aumento de
capacidad funcional pulmonar
que en conjunto mejoraron significativamente la calidad de vida del
S94
paciente y se detuvo el deterioro
progresivo de la enfermedad.
A1021
LEUCEMIA DE CÉLULAS PELUDAS
VARIANTE, UNA ENTIDAD POCO
FRECUENTE, REPORTE DE UN
CASO DE DIFICIL DIAGNÓSTICO
Galván-López I*, Couary-Aguilera
P*, Barrera-Lumbreras G*, Guadarrama-Beltrán E*, Tuna-Aguilar E*,
Lome-Maldonado C*.
*Instituto Nacional De Ciencias Médicas Y Nutrición Salvador Zubirán.
histio53@hotmail.com
INTRODUCCIÓN. La leucemia de
células peludas (LCP) es un síndrome linfoproliferativo infrecuente
( 2-4 % de todas las leucemias).
Inmunofenotípicamente, las células
peludas tienen inmunoglobulina
de superficie, marcadores pan-B
(CD19, CD20, CD22); los marcadores característicos son CD11c,
CD103 y CD25. Las anomalías
citogenéticas identificadas son: +5,
+12 y deleción o mutación de p53.
Se ha descrito una variante prolinfocítica de LCP (LCP-V) en 10% de los
pacientes. LCP-V típicamente presenta leucocitosis (>50.000/uL) sin
leucopenia. Son de fenotipo B pero
suelen ser CD25- y CD103- y puede
ser negativa para fosfatasa ácida tartrato resistente (TRAP) y expresión
baja o nula de CD25, ésta puede explicar la resistencia al tratamiento.
Es más probable la transformación
en enfermedad de alto grado (5%).
Tratamiento: Se acepta la vigilancia, aunque se recomienda iniciar
tratamiento cuando hay enfermedad
sintomática o aparecen citopenias.
Los pacientes con LCP-V responden poco a cladribina (2CDA), si
hay respuesta, la duración es más
breve y, por lo general no vuelven
a responder ante los análogos de
purina después de una remisión.
Las combinaciones de rituximab y
análogos de la purina se encuentran
bajo evaluación y se requieren
estudios adicionales para definir la
terapia óptima.
OBJETIVO. Establecer las
diferencias inmunofenotípicas, laboratoriales, clínicas y tratamiento
de la LCP-V con respecto a la LCPclásica mediante la presentación de
un caso clínico.
RESULTADOS. Mujer de 53
años en quien se documentó leucocitos 20,020/uL (linfocitos: 76%)
en septiembre/2010. Se realizó
aspirado de medula ósea (MO)
(diciembre/2010) que fue compatible con LCP inmunofenotipo
B(CD20+, CD5-, con coexpresión
de TRAP y Anexina A1). Cariotipo
46XX. A su ingreso al INCMNSZ
(abril/2011): el hallazgo relevante
fue esplenomegalia (3cm debajo de
reborde costal). La revisión de biopsia de MO evidenció infiltración
por LCP (CD20+ CD25+ y CD3-),
inmunofenotipo en sangre reportó
padecimiento linfoproliferativo de
células B clonal, no LCP (CD19+,C
D20+,CD22+,CD23+,FMC7+,CD7
9b+,CD 103-), sin un diagnóstico
preciso, se realizó esplenectomía el
26/junio/2012 que fue compatible
con infiltración difusa por LCP-V
(anexinaF+/-,antiTRAP+,CD25
-/+,IGM++,IGD+,CD3-,CD10,CD5-). Se propuso tratamiento
con Rituximab, que nunca pudo
costear, por lo que se mantiene
en vigilancia, sin datos de transformación.
CONCLUSIONES. 1. LCP-V es
un padecimiento de baja frecuencia. En la experiencia de 20 años
del INCMNSZ publicada en 2012
no se diagnosticó ningún caso de
LCP-V. 2. La leucocitosis más que
las citopenias es un dato que lleva
a buscar diagnósticos diferenciales
ante el hallazgo de células peludas
en frotis. 3. Los marcadores por
inmunofenotipo que diferencian
LCP-clásica de LCP-V son CD103 y
CD25. 4. Aún no existe tratamiento
óptimo para lograr remisión sostenida en LCP-V.
Libro Educativo 55 Congreso Nacional de la Agrupación Mexicana para el Estudio de la Hematología, A.C.
A1023
ANEMIA PERNICIOSA. REPORTE
DE CASO CLÍNICO PEDIÁTRICO.
Cruz Blanquel A*.
*Hospital Infantil De México Federico Gomez.
anel_blanquel@hotmail.com
ANTECEDENTES. La anemia perniciosa tiene una incidencia poco
frecuente de aproximadamente 2-5%
a nivel mundial; caracterizada por
cambios megaloblásticos y es debida
a la malabsorción por la ausencia de
síntesis de factor intrínseco secundaria a la atrofia de la mucosa gástrica.
La fisiopatogenia no está plenamente
aceptada, siendo la teoría autoinmune mediada por mecanismos
celulares dirigidos contra las células
parietales del fundus y cardias gástrico productoras de factor intrínseco.
OBJETIVO. La anemia perniciosa es un padecimiento que no se
presenta comúnmente en pacientes
pediátricos, por lo cual se presenta
caso clínico.
CASO CLÍNICO. Paciente femenino de 9 meses de edad, padres
sanos sin antecedentes heredofamiliares de importancia, producto
de gesta II, embarazo normo evolutivo, resuelto por vía vaginal,
apgar 8/9, peso de 3.110 kg, egresa
al binomio, vacunas completas,
alimentación seno materno exclusivamente ablactación a los 6 meses
de edad, con poca aceptación,
desarrollo psicomotor normal para
la edad, con padecimiento de 3
semanas de evolución con palidez
de tegumentos progresiva, hiperoxia
y anemia que requirió transfusión
de concentrado eritrocitario, con
laboratorios a su ingreso con Hb
6.6 g/dL, Hto 20.1% VCM: 100
fL, HCM pg: 33.10 CHCM: 33.00
% ADE: 29.00 reticulocitos 1.7 %
(corregidos: 0.97) leucocitos 7400/
uL, neutrófilos: 400/uL linfocitos:
6900/uL plaquetas: 205.000/uL,
Coombs directo negativo, BT: 2.11
BD: 0.69 BI: 1.42 DHL: 3011.0, se
realiza aspirado de médula ósea,
el cual reporta celularidad aumentada +++, megacariocitos 5-6 por
campo, mielocitos 22 % juveniles 8 % bandas 12 % eosinófilos
29% basófilos 1% monocitos 1%
blastos 1% pronormoblastos 5 %
normoblastos 90 %. Medula ósea
con hiperplasia de serie eritroide
detención en la maduración con
megaloblastosis, serie mieloide
con cambios megaloblásticos,
neutrófilos polisegmentados. Se
sospecha en anemia megaloblástica, se toman niveles de vitamina
B12 96 pg/mL (211-900 pg/mL)
ácido fólico 23.5 ng/mL (5-38 ng/
mL), los cuales se reportan bajos, se
solicitan anticuerpos antifactor intrínseco positivos, se inicia manejo
con hidroxicobalamina a 1000ug
intramuscular mensual, posterior a
la administración con la siguiente
Biometría Hemática: Hb: 12.00
g/dL Hto: 34.7 % VCM: 77.30 fL
HCM: 26.80 pg CHCM: 34.70 %
ADE: 13.70. reticulocitos: 1.8 %
plaquetas: 211 000/uL, leucocitos:
5 800/uL N: 28% neutrófilos: 1 970/
uL linfocitos: 3 480/uL.
CONCLUSIONES. La anemia
perniciosa es una enfermedad poco
común en la edad pediátrica, sin
embargo es de suma importancia
tener presente la sintomatología y la
posibilidad diagnóstica ante un cuadro clínico de anemia acompañada
con cambios megaloblásticos, ya
que las complicaciones de la deficiencia de vitamina B12 podrían ser
graves e incluso riesgo de presentar
cáncer gástrico en 0.14% a 6.5años.
A1038
MOVILIZACIÓN DE CÉLULAS
PROGENITORAS HEMATOPOYÉTICAS CD34+ CON PLERIXAFOR
Y FACTOR ESTIMULANTE DE
GRANULOCITOS EN PACIENTES
PEDIÁTRICOS CON CÁNCER
Reyes Morales DM*, Loeza Oliva
JDJ*, Jaimes Reyes EZ*, Silva Martínez JF**, Vázquez Meraz JE***. * Centro Estatal De Cancerología
“Dr. Miguel Dorantes Mesa”. **
Banco de Cordón Umbilical BCU,
Huixquilucan, Estado de México.
*** Banco de Sangre del Hospital
General de Ecatepec “Las Américas”, Instituto de Salud del Estado
de México.
dianamagnolia@yahoo.com.mx
ANTECEDENTES.Los trasplantes
autólogos de células progenitoras
hematopoyéticas de sangre periférica en pacientes con antecedente
de quimioterapia intensa, pueden
verse limitados por el bajo número
de células CD34+ obtenidos en las
aféresis. El plerixafor es un inhibidor
del enlace de CXCR4-SDF1alfa, que
libera a las células progenitoras
hematopoyéticas de su anclaje a la
médula ósea.
OBJETIVO. Presentar tres casos de pacientes pediátricos con
cáncer que recibieron plerixafor
y factor estimulante de colonias
de granulocitos (FEC-G) durante la
movilización de sangre periférica.
CA S O C L Í N I C O . P R I M E R
CASO: Masculino de 12 años con
diagnóstico de Linfoma no Hodgkin de células grandes B, etapa
III, refractario al tratamiento y baja
tolerancia a la quimioterapia. La
movilización incluyó FEC-G. Se
realizaron dos aféresis, la primera
con celularidad insuficiente. La
segunda aféresis obtuvo 0.5 x 10
(6) CD34+/kg de peso. Por la baja
cosecha se realizó una segunda
movilización con FEC-G y plerixafor. Se realizaron tres aféresis
obteniendo una celularidad total
de 3 x 10 (6) CD34+/kg de peso.
No se reportaron efectos adversos
durante la movilización. El acondicionamiento consistió en rituximab,
busulfán IV y ciclofosfamida. Se
logró injerto de neutrófilos el día
+11. SEGUNDO CASO: Masculino de 6 años, con neuroblastoma
suprarrenal izquierdo etapa IV por
infiltración a sistema nervioso cen-
S95
Volumen 15, Suplemento 1, 2014
Revista de Hematología
tral, de alto riesgo por edad mayor
a 1 año y amplificación de N-myc.
Recibió 4 ciclos de quimioterapia
neo-adyuvante con ICE, nefrectomía, adrenalectomía izquierda
completa y radioterapia a tumor
primario, con remisión completa.
Se realizó movilización con FECG por cuatro días y plerixafor al
quinto y sexto día. Se realizaron
dos aféresis con celularidad de
6.7 x 10 (6) CD34+/kg de peso.
No se reportaron efectos adversos
durante la movilización. El acondicionamiento consistió en melfalán,
carboplatino y etopósido. Se logró
injerto de neutrófilos el día +11.
TERCER CASO: Femenino de 15
años con Linfoma de Hodgkin variedad celularidad mixta en primera
recaída tardía, etapa IIIB. Recibió
seis ciclos de quimioterapia MECC,
radioterapia supradiafragmática y
subdiafragmática. Se realizó movilización con FEC-G y plerixafor. Se
realizaron dos aféresis con celularidad total de 4 x 10 (6) CD34+/kg
de peso. Se reportó ardor leve en
sitio de aplicación de FEC-G. Se
administró quimioterapia BEAM
como acondicionamiento. Se logró
injerto de neutrófilos el día +9.
CONCLUSIONES. La movilización de células progenitoras
hematopoyéticas en niños con
cáncer, con antecedente de quimioterapia y/o radioterapia intensa,
puede beneficiarse con la aplicación de FEC-G y plerixafor sin
efectos colaterales importantes.
A1039
AUTOTRASPLANTE EN EL TRATA M I E N T O D E L E U C E M I A
PROMIELOCITICA DESPUES
DE RECAIDA MOLECULAR Y A
SISTEMA NERVIOSO CENTRAL.
REPORTE DE CASO
Pérez Lozano U*, Reyes Perez EN*,
Ruiz Ovalle JL**, Limón Flores JA*,
Lobato Tolama RD*.
* IMSS Hospital de Especialidades
de Puebla UMAE. ** Unidad On-
S96
cológica SSA.
dra_uendy@yahoo.com.mx
INTRODUCCIÓN. La posibilidad
de recaída de una leucemia promielocítica (LPA) actualmente es
menor al 20%. El tratamiento de
una segunda remisión (2ª RC) no
está aún establecido. Los ensayos
PETHEMA LPA99 y el APL 2000
demostraron el beneficio de citarabina a dosis altas al consolidar a
pacientes con riesgo alto. Recientemente algunos estudios exploran
autotrasplante hematopoyético
acondicionado con dosis altas de
citarabina en pacientes en 2ª RC
con resultados comparables a los
pacientes alotrasplantados
OBJETIVO. Describir un caso
clínico de LPA en 2ª RC tratado con
autotrasplante de sangre periférica.
MATERIAL Y MÉTODOS. Masculino de 30 años con bicitopenia y
leucocitos de 5 450. AMO infiltrado
por promielocitos y PLM RAR alfa,
inmunofenotipo CD33+, CD13+,
CD117+, logró RC con esquema
AIDA, como riesgo intermedio manteniendo la respuesta molecular, a
los siete meses de mantenimiento
se documentó recaída a sistema
nervioso central, con 1,029/dl
promielocitos en LCR, recibió 8
quimioterapias intratecales con
triple droga hasta negativización y
reinducción (citarabina 2000 mg/
m2 SC por 4 dosis + mitoxantrona
10 mg/m2 SC por 2 dosis y ATRA),
consolidación con radioterapia
creaneoespinal. Ante la falta de
donador HLA emparentado y manteniendo la respuesta molecular
inició movilización con FEC-G a
20 ug/kg por 6 días, se procesaron
6 volemias, se realizó cosecha periférica que se almacenó durante
5 días a 4°C. Se acondicionó con
(BEA) busulfán vo 12 mg/kg, VP16
a 20 mg/kg por 4 dosis, citarabina
2.5 gr/m2 por 4 dosis en infusión de
4 horas. Se infundieron 4.5 millones
CD34+/kg
RESULTADOS. Presentó mucositis grado II desde el +1. Neutropenia
febril desde +7 a +10 tratado con
antibióticos de amplio espectro
escalonado a pesar de profilaxis
con voriconazol, trimetroprim y
aciclovir habitual. Presentó injerto neutrofílico al día +24, injerto
plaquetario y eritroide en + 36.
Manteniendo PLM RAR alfa negativa. El trasplante alogénico ha
sido el tratamiento estándar de las
leucemias agudas en segunda remisión. En la actualidad el tratamiento
de elección en recaída en LPA es el
trióxido de arsénico (no disponible
en México) En LPA se ha descrito de
forma comparativa el autotrasplante
hematopoyético con EMR indetectable, observándose sobrevida
global a largo plazo similar a los
pacientes trasplantados alogénicamente sin el riesgo de EICH pero
con la posibilidad incrementada de
recaída neoplásica.
CONCLUSIONES. El autotrasplante es una opción terapéutica
descrita para pacientes en 2ª RC aún
teniendo donador HLA compatible
debido a que el riesgo de mortalidad relacionada al procedimiento
es mínimo
A1061
SÍNDROME DE EVANS. PRESENTACIÓN DE UN CASO
Gonzalez Rodríguez K*, Romero
Tecua S*, Mejía San Martín R*.
* Pemex.
aniraktgr78@hotmail.com
ANTECEDENTES. El síndrome
de Evans (SE) es un desorden autoinmune caracterizado por el
desarrollo simultáneo o secuencial
de anemia hemolítica autoinmune, trombocitopenia inmune y/o
neutropenia en ausencia de una
causa subyacente. Ahora se sabe
que puede asociarse a enfermedades autoinmunes, linfomas e
inmunodeficiencias primarias, entre
otras. Es una entidad clínica poco
Libro Educativo 55 Congreso Nacional de la Agrupación Mexicana para el Estudio de la Hematología, A.C.
común, no tiene predilección de
género y se ha descrito en todos
los grupos etarios y étnicos. Su
fisiopatología exacta se desconoce.
Los pacientes pueden presentar
anemia hemolítica autoinmune o
trombocitopenia inmune de forma
separada o concomitante, la neutropenia ocurre en un 55% de los
pacientes al inicio o pancitopenia
en 14%. El desarrollo de la segunda
citopenia puede ocurrir meses o
años después de la primera y esto
retarda el diagnóstico.
OBJETIVO. Describir un caso
de Síndrome de Evans asociado a
adenocarcinoma prostático
CASO CLÍNICO. Masculino de
73 años de edad con adenocarcinoma bien diferenciado invasor de
próstata Gleason 4 desde 2009 con
enfermedad estable. El 16/02/13
ingresa a urgencias por con síndrome anémico (Ver Tabla 1)
secundario a anemia hemolítica
autoinmune por anticuerpos calientes con prueba de Coombs
directa positiva a IgG. Se hospitalizó recibiendo esteroide IV, se
transfundió un concentrado eritrocitario sin complicaciones y egresó
con prednisona oral. Desarrolló
trombocitopenia y neutropenia a
los 15 días del inicio de la anemia
hemolítica. Reingresó a urgencias
el 30/3/13 con herpes zoster glúteo
bilateral y neumonía, se continuó prednisona oral. Se extendió
abordaje diagnóstico: 1. aspirado
de médula ósea: con celularidad
normal, megacariocitos 2/campo.
Diferencial: normal para edad,
sin blastos ó células ajenas a la
médula ósea; 2. biopsia de hueso
sin infiltración neoplásica. 3. tomografía toraco-abdomino-pélvica: sin
alteraciones. El paciente persistió
con trombocitopenia severa por
lo que se agregó romiplostim y
se observó mejoría de la cuenta
plaquetaria. Para junio el paciente quedó postrado en cama, en
malas condiciones generales y se
solicitó gammagrama óseo el cual
fue positivo para metástasis óseas,
con antígeno prostático específico
normal. Recibió ácido zoledrónico
y bicalutamida, recobró la marcha
y ha mejorado su calidad de vida.
Con respuesta completa de las citopenias autoinmunes hasta su último
seguimiento el 23/12/13.
CONCLUSIONES. Se describe
la asociación de síndrome de Evans
y adenocarcinoma prostático en
un hombre de 73 años que inició
con cuadro de anemia hemolítica
autoinmune y a los 15 días presentó segundas citopenias, recibió
esteroide IV como primera línea
de tratamiento y romiplostim para
trombocitopenia, con respuesta
completa hasta el último seguimiento.
A1062
LEUCEMIA DE CELULAS PLASMATICAS IgG LAMBDA PRIMARIA:
REPORTE DE CASO Y REVISION
DE LA LITERATURA
Ramos Blas GJ*, Martínez Pozos
DGE**, Neme Yunes DY****.
* Hospital Angeles Metropolitano.
** Hospital de Especialidades Centro Médico Nacional Siglo XXI, IMSS
*** Centro Médico ABC.
dr.ramosblas@gmail.com
INTRODUCCIÓN. La leucemia de
células plasmáticas primaria (LCPp)
es la forma más agresiva de las neoplasias de células plasmáticas, con
una frecuencia de 1 a 4%. En comparación con el mieloma múltiple,
tiene un comportamiento clínicobiológico diferente y más agresivo,
dándole un pronóstico muy pobre
con una supervivencia global de sólo
7 meses con quimioterapia estándar.
OBJETIVO. Exponer la respuesta
al tratamiento con esquema basado
en inhibidor de proteosoma, asociado a inmunomodulador y dosis altas
de esteroide, en un paciente con
leucemia de células plasmáticas
primaria.
MATERIAL Y MÉTODOS. Hombre de 40 años de edad quien
ingresó en mayo de 2013 por dolor
abdominal. Con carga genética para
diabetes mellitus e hipertensión
arterial sistémica. Sin antecedente
de enfermedades crónico-degenerativas. Sin exposición a mielotóxicos,
quirúrgicos, ni transfusionales. Inició en Marzo de 2013 con malestar
general, dolor abdominal, debilidad, diaforesis y pérdida ponderal
no cuantificada. En la exploración
física solo con palidez generalizada y hepatoesplenomegalia. Se
documentó hemoglobina de 8.5 g/
dL, plaquetas de 92 000/uL, hiperglobulinemia (globulinas de 8.5 g/
dL), hipercalcemia, hiperuricemia
y creatinina de 1.6 mg/dL. Frotis de
sangre periférica (SP) con linfocitos
de aspecto plasmocitoide en 40%
del diferencial de leucocitos y fenómeno de Rouleaux. Electroforesis
de proteínas en suero y orina de 24
h con pico monoclonal en región
gamma (5.74 g/dL) a expensas de
IgG, con clonalidad para cadena
ligera lambda por inmunofijación.
El inmunofenotipo SP reportó
clonalidad de células plasmáticas
CD38+ y CD138+. Se estableció
el diagnóstico de leucemia de
células plasmáticas, IgG lambda.
Los estudios de citogenética /
FISH reportaron hiperdiploidías.
Inició tratamiento con esquema
RVD (lenalidomida + bortezomib
+ dexametasona), con respuesta
parcial al tercer ciclo. Actualmente
el paciente ha recibido 6 ciclos,
último en Diciembre del 2013 y se
encuentra en protocolo de trasplante autólogo de células progenitoras
hematopoyéticas.
RESULTADOS. El paciente logró
respuesta parcial con reducción del
componente monoclonal en 86.5%.
Por ello se decidió completar 6
ciclos de tratamiento con esquema RVD y posteriormente llevar
a trasplante autólogo de células
progenitoras hematopoyéticas, una
S97
Volumen 15, Suplemento 1, 2014
Revista de Hematología
vez alcanzada por lo menos muy
buena respuesta parcial. El paciente
completó el ciclo 6 de tratamiento
en diciembre de 2013.
CONCLUSIONES. En este caso
se observa mejoría en la supervivencia global, respecto a lo reportada
en la literatura, con un esquema
basado en inhibidor de proteosoma,
inmunomodulador y esteroide.
A1065
RESULTADOS DEL TRATAMIENTO
DE ANEMIA APLASICA SEVERA
Y MUY SEVERA A 10 AÑOS EN
UN HOSPITAL INSTITUCIONAL
Ortiz Zepeda SM*, Lopez Hernandez MA*, Briones Cerecero R*.
* ISSSTE Centro Médico Nacional
20 De Noviembre.
kikamar2@hotmail.com
ANTECEDENTES. La Anemia Aplástica Severa (AAS) y Muy Severa
(AAMS), son condiciones graves,
con elevada mortalidad y tratadas
con inmunosupresión ó trasplante
de células progenitoras. La supervivencia, con inmunosupresión, se
informa en 55 a 60% a 7 años.
OBJETIVO. Dar a conocer los
resultados con tratamiento inmunosupresor, de AAS y AAMS, con
seguimiento a 10 años.
M AT E R I A L Y M E TO D O S .
Retrospectivo. Se revisaron los
expedientes y hojas de seguimiento
del Servicio de Hematología de
2003 a 2012. Fueron incluidos mayores de 15 años con AAS y AAMS.
Criterios: Neutrófilos 200 a 500/uL;
plaquetas <20 000/uL; Reticulocitos <1%. Para AAMS: neutrófilos
<200/uL. Los criterios de respuesta:
Completa: hematocrito (Ht) >38%,
sin transfusiones; Neutrófilos >1
800/uL; plaquetas >140 000/uL
con recuperación de la celularidad
mieloide a >60%. Parcial: desaparición de alteraciones clínicas, sin
necesidad de transfusiones u otra
terapéutica y sin que las cifras
S98
hematológicas alcancen los límites
anteriores. El tratamiento consistió
en Globulina Antitimocito de conejo (GAT), 1.5 mg/kg (días 1 a 4)
ó ciclofosfamida 45 mg/kg, (días 1
a 4). Fue seguido con ciclosporina,
tacrolimus o micofenolato según
disponibilidad y tolerancia.
RESULTADOS. Se estudiaron
26 pacientes. Del sexo femenino
fueron 58%. (15), una media de
edad 39 años ( 16-76), Los datos
hemáticos iniciales (medias) Ht 21
% , leucocitos 1’800/uL; plaquetas
21 000. AAS/AAMS: 18/8. La comorbilidad estuvo ausente en una
84% (n 22) y el resto 16% (n 4) presentaron DM, LES, Cancer Ovario
y Epilepsia. Recibieron GAT 24 y
ciclofosfamida. Fallecieron 46% (n
12). Respuesta completas 26% (n 7)
/parciales 23% (n 6) a 4 meses. El
tiempo promedio de respuesta fue
2.5 meses. El tratamiento de sostén
mas empleado fue la ciclosporina
65%, (n 17). Destino: con respuesta
(n 14) de estos 5 fueron dados de
alta por remisión completa, defunciones (n 12).La probabilidad
de supervivencia es de 0.54% a
10 años.
CONCLUSIONES. La AAS y
AAMS continúan siendo afecciones muy graves. El manejo con
inmunosupresores es una buena
opción comparada con los resultados informados con TCPH con una
sobrevida de 75-83% a 10 años.
A1068
POLICITEMIA VERA, PRESENTACIÓN DE UN CASO CLÍNICO
CON UN NÚMERO INUSUAL DE
ERITROCITOS
Saldaña López RV*, Vargas Ruiz
DAG*, Terrazas Marin DRA*, Espinoza Macias DGA*, Valencia
Martínez QAA*, Rojas Maya QS*,
Torres Jiménez B MD*, León Moreno QE*, Barrales Benitez EOV*,
Jaimes Hernández LVM**.
* Instituto Nacional De Ciencias
Médicas Y Nutrición Salvador Zu-
birán. ** Hospital Juárez de México.
reynasaldana31@yahoo.com.mx
ANTECEDENTES. La Policitemia
Vera (PV) es una neoplasia mieloproliferativa crónica, caracterizada
por un aumento en la masa eritrocitaria, acompañada frecuentemente
de leucocitosis, trombocitosis y esplenomegalia, con manifestaciones
clínicas secundarias a hiperviscocidad y episodios de trombosis o
hemorragia. La edad media de los
pacientes al diagnóstico es de 60
años, con un ligero predominio en
los hombres. Para el diagnóstico,
los criterios de la OMS tienen como
criterios mayores el incremento en
la hemoglobina (> 18.5 g/dL en
hombres y >16.5 g/dL en mujeres,
o bien, >25 % sobre el valor normal
en un estudio de masa eritrocitaria)
y la presencia de la mutación en
JAK-2 V617F. En las distintas series
de pacientes con PV se reporta un
rango de hemoglobina que va entre
14.4 y 20.2 g/dL, siendo el valor
máximo de 20.2 g/dL para los hombres y de 19.3 g/dL para las mujeres.
OBJETIVO. Presentar el caso
clínico de una paciente con
diagnóstico de PV con valores inusualmente altos de hemoglobina
y hematocrito.
CASO CLÍNICO. Mujer de 56
años con antecedentes de síndrome
de Sjogren y Esclerodermia. Enviada
a hematología por hallazgos en la
BH y clínica de enrojecimiento
generalizado, cianosis y prurito. Por
USG con esplenomegalia (volumen
408 mL). La BH con eritrocitos de
10 millones/µL; Hto 81.1%; Hb
24.5 g/dL, VGM 73.6 fL.; HCM
24.5 pg, plaquetas 258 000/uL;
leucocitos 8 600/µL y reticulocitos
1.4%. Saturación de O2 93.5 %, eritropoyetina de 0.0 mU/mL, perfil de
hierro con deficiencia, médula ósea
y biopsia de hueso hipercelulares,
con marcada hiperplasia eritroide,
sin mielofibrosis y cariotipo normal.
Sin hiperuricemia ni alteraciones
Libro Educativo 55 Congreso Nacional de la Agrupación Mexicana para el Estudio de la Hematología, A.C.
de la coagulación. No se realizó
estudio de masa eritrocitaria ni se
buscó la mutación en JAK-2, cumplió con los criterios de la OMS para
el diagnóstico de PV (incremento
en la cantidad de Hb como criterio
mayor y como criterios menores
una médula ósea compatible y EPO
suprimida).
CONCLUSIONES. En nuestro
hospital, este paciente representa
el caso con los valores más altos
en la cifra de eritrocitos durante
los últimos 13 años. Aunque ya se
ha descrito que el valor de la Hb y
del Hto no son un fiel indicador del
aumento en la masa eritrocitaria, el
hematocrito >60% en hombres y
>55% en mujeres se han encontrado asociados a incrementos reales
de la masa eritrocitaria.
A1071
HEMOTRANSFUSIÓN MASIVA EN
PEDIATRÍA
Tapia Castro G*, Guevara Reyes
DR**, Vázquez Meráz DJE***, Domínguez Pérez DST*.
* Hospital Pediátrico Moctezuma
Secretaría De Salud Del Distrito
Federal. ** Hospital Regional de
Alta Especialidad de Zumpango.
*** Hospital General de Ecatepec
las Américas ISEM.
gaviota1515@hotmail.com
ANTECEDENTES. La protocolización de transfusión masiva está
diseñada para pacientes adultos
politraumatizados por heridas de
guerra. Es indispensable apoyarse
en guías clínicas en población
pediátrica, que desarrolla una
hemorragia catastrófica, y poder
evitar , alteraciones de la coagulación, hemodilución. y finalmente
parada cardíaca. Presentamos tres
casos, manejados exitosamente
de hemorragia masiva con reposición intensiva de hemosustitutos
basados en el volumen circulante
concordante al peso y edad de los
pacientes.
OBJETIVO. Dar a conocer la
experiencia en la hemorragia catastrófica, enfocar el manejo correcto
de hemotransfusión masiva en pediatría.
CASO CLÍNICO. CASO 1
Masculino 4 años, peso 13 kg ,
diagnóstico de linfangioma gigante
de tórax , MT izquierdo de 30 cm
de diámetro. En la cirugía, tuvo una
pérdida sanguínea mayor a 1.5 ml/
kg/min durante 20 minutos, iniciando de hemotransfusión masiva con
reposición de CE, PFC y CP 1:1:1 de
acuerdo al volumen circulante. La
evolución transoperatoria y postoperatoria fue satisfactoria, a pesar
de un déficit hemático de 2500 ml.
CASO 2 Masculino 5 años de edad,
peso 20 kg. Diagnóstico trauma
abdominal cerrado, encontrando
lesión parenquimatosa del 25% del
hígado. Iniciamos hemotransfusión
masiva preoperatoria en sala de
urgencias, por inestabilidad hemodinámica del paciente. Durante la
exploración quirúrgica, cuantificamos pérdidas hemáticas de 2 200
mL. La evolución posoperatoria fue
satisfactoria. CASO 3 Masculino
11 años, peso 32 kg. Trauma renal
por contusión abdominal, ingresó
a urgencias con choque hipovolémico. Iniciando hemotransfusión
masiva por pérdida hemática total
1 900 ml, secundaria a lesión renal
Grado IV. El paciente evolucionó
satisfactoriamente.
CONCLUSIONES. Los trastornos en la hemostasia establecen
referencias exactas de pérdidareposición de hemocomponentes
durante el pre, trans y postoperatorio. En Pediatría realizamos la
reposición de acuerdo al volumen
circulante dependiendo de la edad
del niño: Prematuros 90-100 mL/kg,
RN de término 80-90 mL/kg, <de 1
año 75-80 mL/kg, De 1 a 6 años 7075 mL/kg, >de 6 años 65-70 mL/kg.
Los tres pacientes presentados aquí
enfatizan la necesidad de establecer
protocolos de transfusión masiva en
las salas de urgencias y de cirugía
en la población infantil.
A1077
TRATAMIENTO DEL LINFOMA T/
NK TIPO NASAL EN EL HOSPITAL
CARLOS MAC GREGOR SANCHEZ
NAVARRO EN 2013
Ledesma De La Cruz C*, Silva Ruacho R*, Garcia Barboza E*.
*Hospital Carlos MacGregor Sánchez Navarro, IMSS.
clcruzita@hotmail.com
ANTECEDENTES. Los linfomas T/
NK ocurren a nivel mundial, predominio en asiáticos. La OMS los
clasifica dentro de malignidades
de células NK. El inmunofenotipo
típico es CD2+, CD3€+, CD56+,
(perforina granzima B, y TIA-1,
positivo), las células neoplásicas
expresan Epstein Barr, es extranodal, infiltra nariz, nasofaringe,
ocasionalmente senos paranasales,
destruye cavidad nasal y perforan
paladar. El manejo con CHOP tiene
pobres resultados, nuevos esquemas con L-asparaginasa han sido
creados, con mejores resultados.
Por lo cual presentamos 2 casos.
OBJETIVO. Mostrar el tratamiento de pacientes con linfoma
T/NK tipo nasal aplicado en 2013.
CASO CLÍNICO. Caso 1. Hombre 21 años, inicia dos años previos,
con infecciones respiratorias repetitivas, recibiendo manejo en privado
con antibióticos sin mejoría, acude
a CMN la Raza, reportando biopsia
con LINFOMA T/NK TIPO NASAL
CD3, CD4, CD8 positivos, CD20
negativo, CD68 positivo en macrófagos, CD56 positivo, LMPI
negativo, Ki67 20% y BCL-2 negativo. Envían e inicia CHOP, a los
3 ciclos sin respuesta. Inicia 2da
línea con SMILE, con pancitopenia,
choque séptico y muerte. Caso 2.
Mujer 42 años, padecimiento de un
año previo, con cuadros infecciosos
sin mejoría, acude a este hospital,
presentando cefalea, destrucción de
S99
Volumen 15, Suplemento 1, 2014
Revista de Hematología
tabique nasal con necrosis, biopsia
diagnostica de LINFOMA T/NK tipo
nasal, con infiltración a sistema
nervioso central, inicia esquema AspaMetDex, actualmente en manejo.
CONCLUSIONES. Los dos casos
recibieron esquemas recomendados actualmente en linfoma T/NK
tipo nasal. Caso 1, SMILE (Dexametasona 40mg días 2-4, metotrexate
2000mg/m2 día 1, ifosfamida 1
500mg/m2 días 2-4, L-asparaginasa
6 000 U/m2 IV días 8, 10, 12, 14,
16, 18 y 20 y etopósido 100 mg/m2
días 2-4. Diseñado para estadios
IV, recaída o refractarios, se utilizó
por falla a CHOP, confirmando su
pobre respuesta, probablemente la
alta expresión de glicoproteína-P,
con drogo-resistencia. La RC es
66% con RG de 86%, la mortalidad
relacionada 5%, no pudimos evaluar la respuesta debido a muerte
por sepsis, posterior a un ciclo (no
acudió a sus citas oportunamente).
Caso 2, recibe AspaMetDex por
estadio IV infiltración a SNC, (Lasparaginasa 6000UI/m2 IM días
2, 4, 6 y 8, metotrexate 3000mg/
m2 día 1, dexametasona 40 mg
días 1-4). Reportando respuestas
(RC hasta 61% y RG 78%, mortalidad cercana al 0%). Ha recibido
4 ciclos presentando respuesta
parcial, por completarse radioterapia, por la alta radiosensibilidad en
células NK. Siendo poco frecuente
y agresivo, nuevos esquemas con
L-asparaginasa deben tomarse en
cuenta en las instituciones de salud
del país, nosotros mostramos nuestra experiencia.
A1080
LEUCEMIA DE CÉLULAS PLASMÁTICAS TRATADA CON CYBOR-D Y
LENALIDOMIDA. PRESENTACIÓN
DE UN CASO
Padilla Ortega JA*, Barrera Chairez
E****, Martínez Ayón C****, Chamorro Morales N****, Villalobos
De La Mora LO****, Zuno Reyes
EE****, Ron Magaña AL****, De La
S100
Mora López PA****, Pineda Palma
JI****, Ruiz Morales TC****, Vásquez Díaz JE****, Pérez Becerra E**.
* Hospital Civil De Guadalajara Fray
Antonio Alcalde. ** Unidad de Patología Clínica. *** Universidad de
Guadalajara. **** Hospital Civil de
Guadalajara Fray Antonio Alcalde,
Universidad de Guadalajara.
dropadilla@yahoo.com.mx
ANTECEDENTES. El espectro de las
discrasias de células plasmáticas es
muy amplio y puede evolucionar
en forma rápida y agresiva. La leucemia de células plasmáticas (LCP)
es una neoplasia rara, con un curso
clínico agresivo y corta supervivencia. Se define por la presencia de
células plasmáticas en un 20% de
la totalidad de leucocitos o más de
2 000/uL en sangre periférica (SP).
OBJETIVO. Aportar la experiencia en nuestro centro de la
respuesta al tratamiento con el
esquema CyBorD + lenalidomida,
administrado a una paciente con
diagnóstico de mieloma múltiple
que evolucionó a LCP.
CASO CLÍNICO. Paciente femenino de 58 años de edad, que
inicia su padecimiento con dolor a
nivel dorsolumbar y limitación en
la movilidad. En la TAC de columna
se encuentran tumoraciones a nivel
de T4-T5 y S1 compatibles con
plasmocitomas por biopsia. En el
abordaje sistémico se diagnosticó
mieloma múltiple plasmablasticoproplasmocitico de IgA/Lambda
estadio III ISS. Recibió 5 ciclos
de tratamiento con talidomida/
dexametasona/Ac. zoledrónico
y radioterapia complementaria a
plasmocitomas torácico y sacro.
Previo al sexto ciclo acude por
presentar fiebre, pancitopenia,
B2-microglobulina de 5.75 mg/
dL y 40% de células plasmáticas
en SP, por lo que se realizó inmunofenotipo con 68.1% de células
malignas CD 38+, diagnosticando
leucemia de células plasmáticas.
Cariotipo no valorable por ausencia
de metafases. Desarrolla parestesias
en extremidades inferiores con
evolución rápida a paraplejía por
recurrencia de plasmocitoma en
C5-T4, diagnosticado por RMN.
Debido a la rápida progresión
de la enfermedad se inició tratamiento con esquema CyBorD
+ lenalidomida bajo el siguiente
esquema: ciclofosfamida 650 mg/
m2 y bortezomib 1.3 mg/m2 los
días 1, 8, 15, 22. Dexametasona 20
mg los días 1-2, 8-9, 15-16, 22-23
y lenalidomida 25 mg por 21 días
del ciclo, además de laminectomia
descompresiva en columna dorsal y
radioterapia paliativa subsecuente.
Al finalizar el primer ciclo se documentó mejoría evidente, tanto
clínica como de la pancitopenia,
con disminución a un 8% de células plasmáticas en SP. Sin embargo,
al inicio del cuarto ciclo presenta
pancitopenia, deterioro clínico y
recurrencia de 35% de células plasmáticas en SP; con sepsis severa
asociada a infección pulmonar y
del tracto urinario que evoluciona
a choque séptico y fallece 72 horas
despúes de su ingreso hospitalario;
a los 10 meses del diagnóstico.
CONCLUSIONES. Este caso
ilustra la progresión y el curso
variable y agresivo que pueden
presentar las neoplasias de células
plasmáticas (LCP) aun administrando tratamiento intensivo con la
combinación de quimioterapia e
inmunomoduladores.
A1083
ANEMIA APLÁSICA SECUNDARIA
A INFECCIÓN POR INFLUENZA
H1N1, REPORTE DE UN CASO
PEDIÁTRICO Y REVISIÓN EN LA
BIBLIOGRAFÍA
Mejía Martínez JC*, Castillo Martínez ID*, Velázquez Marmolejo L*,
Moreno González M*.
* Hospital Infantil De México Federico Gomez.
dr_juancarlosmejia@yahoo.com
Libro Educativo 55 Congreso Nacional de la Agrupación Mexicana para el Estudio de la Hematología, A.C.
ANTECEDENTES.La anemia aplásica adquirida o secundaria es
caracterizada por pancitopenia con
una médula ósea hipocelular en la
ausencia de un síndrome constitucional. El Estudio Internacional
para la Agranulocitosis y Anemia
Aplásica la define como una hemoglobina por debajo de 10 g/dl,
una cuenta plaquetaria menor a 50
x 109 /L, granulocitos menor a 1.5
x 109/L y una biopsia de médula
ósea demostrando la disminución
de la celularidad y la ausencia de
fibrosis significativa o infiltración
neoplásica.
OBJETIVO. Presentar caso de
un paciente con Anemia Aplásica
secundaria a infección por Influenza H1N1.
CASO CLÍNICO. -Material y
métodos: Paciente lactante de 1 año
5 meses de edad previamente sano
el cual acudió a nuestra institución
el día 18.11.2013 por presentar
fiebre de 1 semana de evolución
y petequias de 24 h de evolución
previo ingreso a urgencias, se
observó citometría hemática del
18.11.2013 reportando lo siguiente:
Hemoglobina 7.2 g/dL Hematocrito 21% plaquetas 4,000 x 103 /
µL, leucocitos de 2 400 x 103 µL,
linfocitos 91.3% neutrófilos 2.9%,
neutrófilos totales de 40/µL con
antecedente de 11 de noviembre
vacunación contra virus de influenza, sin otro antecedente de
importancia. Se realizó aspirado
de médula ósea reportando medula
ósea hipocelular negativa a infiltración neoplásica, médula ósea
con grumos de células reticulares.
Se realizó biopsia de médula ósea
reportando las celdillas con celularidad total aproximada del 40%
con escasos elementos mieloides y
eritroides, sin células neoplásicas
o mielofibrosis, se observa además
plasmocitosis reactiva. El paciente
ingresó a terapia intensiva por
neumonía complicada asociada a
infección por virus de influenza
requiriendo apoyo aminérgico e
intubación mecánica. Se realizó
determinación de causas secundarias para anemia aplásica, los
cuales fueron negativas. Se reportó
el día 22.11.2013 prueba positiva
para virus Influenza AH1N1/2009
y Virus Sincitial Respiratorio B
(hRSVB) positivo
CONCLUSIONES. La anemia
aplásica secundaria por etiología
viral es poco común en la edad
pediátrica, existen reportes (Grupo
Cooperativo Francés) de un estudio
con 147 casos de anemia aplásica
y sólo el 5% fue secundario a infecciones virales. En la literatura
hay escasos casos reportados de
pancitopenia transitoria posterior a
infección por virus de influenza, y
menos en pacientes pediátricos. Se
sugiere considerar la asociación de
anemia aplásica con infección de
virus de Influenza H1N1
A1086
LEISHMANIASIS VISCERAL EN UN
PACIENTE INMUNOCOMPROMETIDO. REPORTE DE UN CASO
Alvarez Vera JL*, Donis Hernandez
J**, Renteria Diaz F***, Serrano
Ortiz H***.
* ISSSTE/Hospital Español. ** Unidad de Enfermedades Infecciosas
Hospital Español. *** Servicio Hematologia, Hospital Español.
draselo@hotmail.com
INTRODUCCIÓN. La Leishmaniasis se refiere a un diverso espectro de
síndromes clínicos causados por la
infección de un protozoario perteneciente a la familia de Leishmania.
Los síndromes y las manifestaciones
clínicas causadas por Leishmania
varían ampliamente, pero generalmente se han dividido en tres
síndromes clínicos: Leishmaniasis
visceral, cutánea y mucosa.
ANTECEDENTES. La Leishmaniasis se refiere a un diverso
espectro de síndromes clínicos
causados por la infección de un
protozoario perteneciente a la familia de Leishmania. Los síndromes
y las manifestaciones clínicas
causadas por Leishmania varían
ampliamente, pero generalmente
se han dividido en tres síndromes
clínicos: Leishmaniasis visceral,
cutánea y mucosa.
OBJETIVO. La leishmaniasis
visceral no es una enfermedad
frecuente en la ciudad de México,
al presentarse en cualquier paciente obliga a buscar estados de
inmunosupresión no sólo por VIH
sino también por tratamiento de
inmunosupresores o en enfermedad
crónica.
CASO CLÍNICO. Masculino
de 39 años de edad, quien ingresa
por fiebre durante las últimas 72
horas, posterior a 4 semanas de
tratamiento antiretroviral. Se realizó el diagnóstico de Síndrome de
Inmunodeficiencia Adquirida, posterior a cuadro de Neumonía por
Acinetobacter baumanni, recuento
de linfocitos T CD4 en 39/ul y carga
viral HIV-1 RNA > 500 000 copias/
mL. Se documenta pancitopenia en
estudio (LT 0.3/uL, RBC 3.1x10(9)/L,
PLT 11 000/uL Neu 0.08/uL). Se realiza aspirado de médula ósea con
reporte de presencia de macrófagos
con imágenes compatibles con
Leshmania, resultado corroborado
por el servicio de patología y microbiología, se inicia administración de
Anfotericina B, al tiempo se decide
la suspensión de los antirretrovirales
y se inicia tratamiento por síndrome
de reconstitución inmune a base
de metilprednisolona. Presenta
evolución tórpida, persistencia de
fiebre y pobre recuperación, progresa a falla orgánica múltiple, sin
respuesta al tratamiento. Fallece 18
días posteriores al diagnóstico de
Leishmaniasis visceral.
CONCLUSIONES. En un reporte
2006 a 2008 se notificaron 289
casos de Leishmaniasis visceral,
68.9% pacientes con VIH. El análisis muestra distribución geográfica
S101
Volumen 15, Suplemento 1, 2014
Revista de Hematología
ha cambiado y tiene mayor frecuencia en inmunosuprimidos. En otro
estudio, se observaron 27 pacientes
con VIH y Leishmaniasis, se comparó la evolución con tratamiento
antiretroviral altamente efectivo,
encontrándose disminución en
las recaídas por Leishmaniasis. Se
presentó síndrome de reconstitución inmunológica al recuperarse
la función medular. La transmisión
de Leishmaniasis en imunosuprimidos probablemente ha cambiado,
no sólo se presenta por el vector
también probablemente entre humanos, por mascotas como lo
explica el estudio en 2003. En nuestro caso, se observa cambio en el
patrón geográfico de presentación
de esta enfermedad y se desconoce
la forma de transmisión.
A1089
LEUCEMIA MIELOCITICA AGUDA
DE PRESENTACION ATIPICA
Vásquez Díaz JE*, Barrera Chairez
E**, Zuno Reyes EE**, Juárez López
GE***, Pérez Becerra E****, De La
Mora López PA**, Pineda Palma
JI**, Ruíz Morales TC**, Padilla
Ortega JA**, Chamorro Morales
NH*****, Villalobos De La Mora
LO*****, Martínez Ayón C*****.
* Hospital Civil De Guadalajara
Fray Antonio Alcalde. ** Universidad de Guadalajara (UDG). ***
Laboratorio de Histopatología e Inmunohistoquímica. **** Laboratorio
de Patología Clínica. ***** Servicio
de Hematología-Hospital Civil de
Guadalajara.
jestuardo61@yahoo.com
ANTECEDENTES. La LMA tiene
una incidencia anual de 2.4/100
000 habitantes/año. El subtipo M2
t(8;21)(q22;22) es predominante
en jóvenes y representa el 10%
de los casos; se caracteriza por
mieloblastos con bastones de Auer,
granulaciones azurófilas, vacuolas
citoplasmáticas, eosinofilia y en
algunos casos se observa un enga-
S102
ñoso porcentaje de blastos (<20%).
El inmunofenotipo suele expresar
CD13, CD15, CD34, CD56, CD45,
CD19 y ausencia de CD2, CD7.
OBJETIVO. Se presenta el
caso clínico de una paciente con
LMA-M2 t(8;21), inicialmente diagnosticada como LMA-M3.
CASO CLÍNICO. Femenina de
30 años, que acude al servicio de
urgencias con cefalea holocraneana
de 48 horas de evolución, nauseas,
vómitos en proyectil con tumoración retroauricular derecha de 5 cm
de diámetro, dolorosa, no móvil con
edema facial y salida de material
purulento por conducto auditivo derecho. Se diagnóstico LMA-M3 en
Centro Estatal de Cancerología 15
meses previos, donde recibe inducción con esquema “7+3” asociado
a ATRA y 12 ciclos con ARA-C/
doxorrubicina/ 6-mercaptopurina/
methotrexate, desconociendo respuesta a tratamiento. Ingresa pálida,
sin evidencia de purpura, fundoscopia sin papiledema, soplo
sistólico multifocal grado III/VI y
sangrado vaginal. Tomografía de
cráneo: con edema perilesional
parietal y occipital derecho, masa
ubicada en región petrosa del
hueso temporal sin datos de infiltración a tejido cerebral. Medula
ósea: con 42% de promielocitos
y 16% de mieloblastos, bastones
de auer y translocación 15;17
negativa; inmunofenotipo: positivo
para CD13, CD15, CD117, CD34,
CD19, consistente con LMA-M2
con expresión aberrante de CD19,
citogenética: cariotipo 45X t(8;21)
(q22;22) en 20/20 mitosis analizadas. Reporte histopatológico de
tumoración: sarcoma mieloide.
Debido a los hallazgos morfológicos iniciales en médula ósea
se inicia esquema de inducción
PETHEMA durante tres semanas,
el cual fue suspendido posterior a
obtener reporte de inmunofenotipo
y ausencia de translocación (15;17).
Recibe segunda inducción con
“7+3” modificado por dosis tope
de antraciclinas con etoposido y
radioterpia en tumoración retroauricular. La medula ósea al día 10
no se observo evidencia de LMAM2 y enfermedad mínima residual
negativa para malignidad.
CONCLUSIONES. La LMA-M2
t(8;21), representa un reto diagnóstico en pacientes con porcentaje de
blastos <20% debiéndose apoyar en
métodos como el inmunofenotipo
y citogenética; una característica
notable de esta variante es la presencia de eosinofilia en medula
ósea y sarcomas mieloides de novo
diagnóstico o como parte de la
evolución final de la enfermedad.
Son sensibles a medicamentos
antraciclicos y se consideran de
buen pronóstico por su respuesta a
largo plazo.
A1091
LINFOMA INTRAVASCULAR: REPORTE DE UN CASO
De La Mora Lopez López PA*, Barrera Chairez E*, Lome Maldonado C**,
Zuno Reyes EE*, Chamorro Morales
NH*, Villalobos De La Mora LO*,
Ron Magaña AL*, Vásquez Díaz JE*,
Pineda Palma JI*, Ruiz Morales T*,
Padilla Ortega JA*, Martinez Ayon
C*, Juarez Lopez GE***.
* Hospital Civil De Guadalajara,
Universidad De Guadalajara. ** Instituto Nacional de Ciencias Médicas
y de Nutrición Salvador Zubirán,
Universidad Autónoma de México.
*** Laboratorio de histopatología e
inmunohistoquímica, Universidad
de Guadalajara.
morita_10@hotmail.com
ANTECEDENTES. El Linfoma intravascular es un subtipo raro de
linfoma de células B difuso extranodal, con proliferación de células
neoplásicas en el lumen de los
pequeños vasos, particularmente en
capilares. Debido a su presentación
clínica variable es frecuentemente
subdiagnosticado.
Libro Educativo 55 Congreso Nacional de la Agrupación Mexicana para el Estudio de la Hematología, A.C.
OBJETIVO. Presentamos el caso
de un paciente con pancitopenia,
hepatoesplenomegalia y fiebre
persistente, con diagnostico de
Linfoma Intravascular de curso fatal.
CASO CLÍNICO. Masculino
de 55 años previamente sano, con
evolución de tres semanas con
fiebre de hasta 40°C vespertina,
diaforesis y pérdida de peso de 15
kg, Ingresa pálido, sin adenopatías
con hígado 2 cm y bazo 3 cm por
debajo del borde costal; pancitopenia con Hg 7.1 g/dL, leucocitos 2
090/uL, neutrófilos 620/uL, plaquetas 81 000/uL, AST 186, ALT 230,
FA 1,790, DHL 316/UI y Beta2
microglobulina 10.1. Los estudios
realizados para identificación de
la etiología febril fueron negativos
para: Micobacterias, Hepatitis
A, B, C, D, VIH, Citomeglovirus,
Epstein Barr, Herpes simple tipos
1 y 2, Brucella Abortus, reacciones
febriles, Dengue, hemocultivos,
CA 125, CA 19.9 y AFP. Rx de
tórax normal, TAC de abdomen sin
adenopatía, solo hepatoesplenomegalia (17 cm) con hipertensión
portal y endoscopia sin evidencia
de varices esofágicas. Se observó
presencia de linfoblastos grandes
atípicos en el frote de sangre
periférica, aspirado y biopsia de
hueso con cambios displasicos,
hemofagocitosis y 6 a 8% de linfocitos de aspecto neoplásico sin ser
concluyente. Ante la persistencia
de la fiebre, el deterioro de las
condiciones del paciente y la falta
de diagnóstico, se realizó biopsia
hepática reportando: infiltración
portal y sinusoidal por linfoma
no Hodgkin de células grandes B
intravascular. Se inició quimioterapia con ciclofosfamida/vincristina/
dexametasona; sin embargo el
paciente presenta deterioro progresivo, cursando con falla hepática,
insuficiencia renal y acidosis metabólica severa, sin respuesta al
tratamiento médico y fallece a los
14 días del ingreso.
CONCLUSIONES. Se conoce
muy poco sobre la etiología y la
fisiopatología del linfoma intravascular. El mal pronóstico en esta
patología se debe en parte a la dificultad en el diagnóstico y el retardo
en el inicio del manejo. No existen
estudios prospectivos controlados
que establezcan la mejor opción
de tratamiento, en su mayoría son
experiencias anecdóticas o datos
retrospectivos, de ahí la importancia
del reporte de estos casos. Considerar en el diagnostico diferencial de
pacientes con fiebre, pancitopenia
y visceromegalia, a el linfoma intravascular puede permitir realizar
un diagnóstico oportuno, inicio de
tratamiento de forma temprana,
y quizás mejorar la expectativas
de vida y el pronóstico de estos
pacientes.
A1097
LEUCEMIA DE CÉLULAS DENDRÍTICAS SECUNDARIA A LINFOMA
NK. REPORTE DE UN CASO
Ruiz Morales TC*, Barrera Chairez
E**, Chamorro Morales NH**, Zuno
Reyes EE**, Villalobos De La Mora
LO**, Martínez Ayón C**, Juárez
López G**, Pérez Becerra E***, Pineda Palma JI**, De La Mora López
PA**, Vásquez Díaz JE**, Padilla
Ortega JA**.
* Hospital Civil Fray Antonio Alcalde. ** Hospital Civil Fray Antonio
Alcalde, Universidad de Guadalajara. *** Unidad de Patología Clínica.
taniaruizmorales@hotmail.com
ANTECEDENTES. Las neoplasias
de células dendríticas son un subtipo poco frecuente de leucemias
mielocíticas agudas. Se caracterizan por proliferación clonal de
precursores de células dendríticas
con expresión de CD4+ y CD56+.
Las manifestaciones más comunes
son lesiones cutáneas y afectación
ocasional a la médula ósea, con
la consecuente diseminación leucémica.
OBJETIVO. Reportamos el caso
de una paciente femenina de 57
años de edad, con diagnóstico de
linfoma NK y desarrollo posterior
de leucemia de células dendríticas
(LCD).
CASO CLÍNICO. Paciente referida por sospecha de linfoma cutáneo,
con antecedente de hipertensión
arterial de 5 años y tabaquismo
crónico. Acudió con dermatosis generalizada de 6 meses de evolución,
tipo pápulas edematosas, eritematovioláceas de aproximadamente 1
cm de diámetro y nódulos necróticos en tórax posterior de 8 cm.
Negó síntomas B. El estudio histopatológico de las lesiones reportó
linfoma cutáneo no Hodgkin de
células “cerebriformes” de alta malignidad histológica. La biometría
hemática no mostró alteraciones;
medula ósea con infiltración del
40% por linfocitos inmaduros y
atípicos, correspondiendo por
inmunofenotipo a leucemia/linfoma de células NK, perforinas(-) y
CD49(-). La TAC tóraco-abdominal
no evidenció infiltración a otros
órganos. Se concluyó diagnóstico
de linfoma/leucemia NK estadio
IVA de la clasificación de Ann
Arbor. Recibió 6 ciclos de quimioterapia con esquema CHOP,
observándose remisión completa,
sin evidencia de infiltración en
medula ósea; enfermedad mínima
residual negativa y resolución de
las lesiones cutáneas. A los 5 meses post-remisión, se documentó
primera recaída manifestada por:
neutropenia, reactivación de las
lesiones cutáneas, hepatoesplenomegalia con 2 nódulos esplénicos
por TAC tóraco-abdominal; infiltración a medula ósea del 100%
por células inmaduras de aspecto
linfomonocitoide, clasificada por
inmunofenotipo como leucemia de
células dendríticas CD4+, CD56+,
CD123+. Fue tratada con esquema
“7+3”, con médula sumamente
hipocelular al día 10; desarrolló
S103
Volumen 15, Suplemento 1, 2014
Revista de Hematología
mucositis grado III/IV y falla cardiaca asociada al uso de antraciclinas.
Al día 12 postquimioterapia fue
egresada por alta voluntaria.
CONCLUSIONES. Los reportes
de incidencia de LCD son muy
escasos, corresponden al 0.44%
de todas las malignidades hematológicas y menos del 1% de las
leucemias agudas, lo cual dificulta
definir su comportamiento biológico y características clínicas. Los
tratamientos de inducción, se basan en esquemas para LMA o LLA,
sin que alguno de ellos haya sido
aprobado como terapia de elección.
Una vez alcanzada la remisión,
debe someterse al paciente a trasplante de células hematopoyéticas.
Aunque responden favorablemente
a la quimioterapia inicial, la recaída
es la regla y su pronóstico es muy
pobre, con sobrevida global de 8.7
meses.
A1099
LINFOMA LINFOPLASMOCITICO ESPLENICO PRIMARIO CON
EXPRESION DE PARAPROTEÍNA
IgG LAMBDA; UN CASO REPORTE
Best Aguilera CR*, Robles Rodríguez A*, García Balderrama JA*,
Fernández Figueroa YM*, Rojas
Sotelo R M*, Lomelí Guerrero A*,
Pérez Banuet Saucedo D*, Pérez
Escamilla G*.
* Hospital General De Occidente/
universidad De Guadalajara.
carlosbest@gmail.com
ANTECEDENTES. Entre los Linfomas Linfoplasmocíticos (LL), la
Macroglobulinemia de Waldenstrom (MW) es la entidad mejor
definida y reconocida, la presencia
de un componente monoclonal IgM
e infiltración linfoplasmocitoide
a la médula ósea son elementos
diagnósticos que la caracterizan.
Su incidencia es de 1 500 casos
por año en los Estados Unidos.
Contrariamente, respecto a los LL
no MW no se conocen datos con-
S104
cretos ya que son entidades menos
frecuentes, y con una presentación
clínico patológica pobremente
caracterizada. Aquí se informa un
caso de un LL no MW con un pico
monoclonal de IgG lambda.
OBJETIVO.Presentar un caso
raro de Linfoma Linfoplasmocítico
esplénico primario con expresión
de paraproteína IgG.
CASO CLÍNICO. Varón de 77
años, con antecedentes de HAS,
que inicia 2 meses con fatiga,
saciedad temprana y molestias
en hipocondrio izquierdo, en su
lugar de origen le fue detectada
esplenomegalia de 17 cm y lo
sometieron a esplenectomía. A
su ingreso a nuestro hospital no
encontramos adenopatía periférica ni retroperitoneal y/o hacia
el hilio esplénico. Se documentó
Hb 10.6 gr/dl, GB 12,280 (87%
segmentados), plaquetas 87,000. El
aspirado de la medula ósea mostró
infiltración linfoplasmocitoide y la
inmunofijación sérica identificó
un componente monoclonal IgG
lambda de 5.5 gr/dl. El estudio
histopatológico del bazo demostró
infiltración por células linfoplasmocitoides con la siguiente expresión
antigénica (inmunohistoquímica):
CD20+, CD79+, EMA+,BCL-2+,
CD5+, Ki67+ (5%), ANEXINA1-,
CD10-,CD22-,FOXP3-.
CONCLUSIONES. La similitud
clínico patológica entre este caso y
la Macroglobulinemia de Waldenstrom es amplia, pero el componente
monoclonal y el perfil antigénico
descarta a la MW. Las dos condiciones son la expresión diferenciada
de un continuo desregulado en diferentes etapas de la diferenciación
linfoplasmocítica. Y desde un punto
de vista práctico la clase de inmunoglobulina involucrada es clave en la
identificación de estas condiciones.
A1107
LEUCEMIA LINFOMA LINFOBLÁSTICO B: RECAÍDA A MAMA.
REPORTE DE 1 CASO Y REVISIÓN
DE LA LITERATURA
Grimaldo Gomez FA*, Terrazas Hoyos A*, López Navarro OG*, Zapata
Canto NP*, Pavón Hernández CM*,
Labardini Méndez JR*.
* Instituto Nacional De Cancerología/UNAM.
dr.grimaldo@yahoo.com
INTRODUCCIÓN. La infiltración
leucémica de mama es rara y puede
presentarse como un tumor o como
una manifestación extra-medular
en la enfermedad sistémica. Sólo
en muy raras ocasiones se presenta
infiltración de la mama en recaída
extra-medular. Las pacientes con
infiltración leucémica de mama
pueden presentar una lesión palpable que es generalmente bien
circunscrita y de rápido crecimiento, la lesión puede ser uni o
bilateral. A la exploración clínica
puede simular un fibroadenoma
y los estudios de extensión, como
mastografía y ecografía, la mayoría
de las veces no son concluyentes.
Un estudio de BAAF puede establecer el diagnóstico y en algunos
casos es imprescindible la biopsia
con estudios de inmunohistoquímica para llegar al diagnóstico
definitivo.
OBJETIVO. Describir las características clínicas, mastográficas,
ecográficas, citopatológicas e
histopatológicas de la infiltración
leucémica de la mama.
CASO CLÍNICO. Femenino de
22 años de edad. Se diagnostica
LAL IF B en septiembre del 2009,
recibió esquema pediátrico con
prednisona, vincristina y daunorrubicina del 2009 al 2012, logrando
RC. En marzo 2013 se documenta
recaída. Cursaba con embarazo de
16 SDG. Recibió esquema alternativo de LARSON. A las 26 SDG
recibe tratamiento con 2 ciclos de
citarabina 75mg/m2/día por 4 días
como reinducción en el Instituto
Nacional de Perinatología (INPER).
Libro Educativo 55 Congreso Nacional de la Agrupación Mexicana para el Estudio de la Hematología, A.C.
Se interrumpe embarazo a las
36 SDG; obteniéndose producto
masculino de 2985g APGAR 8/9,
sin complicaciones. Es enviada a
Instituto Nacional de Cancerología
en agosto 2013. Se realiza AMO
con 28% de blastos linfoides (L2,
FAB) IF B común. Evolución y tratamiento: Recibe QT R-HiperCVAD
IA el 24.08.13. Aspirado de recuperación sin infiltración. Recibe la
fase IB el 20.11.13, con retraso de
88 días por motivos económicos.
El 20.11.13 se documenta recaída
con AMO infiltrada por LAL 10%
blastos, IF CD34 55.6%, CD10
63.9%. Presenta lesiones nodulares
en mama izquierda de dos días de
evolución. USG reporta dos lesiones heterogéneas de predominio
ecogénico localizadas en la unión
de zona glandular con grasa pre
glandular, una lesión localizada en
R3/4 a 5 cm del pezón. Mastografía
reporta lesiones de ecogenicidad
heterogénea, bilaterales. Se realiza
biopsia por aspiración. Reporte
histopatológico leucemia/linfoma
linfoblástico.
CONCLUSIONES. La infiltración de mama en LAL es rara. Debe
tenerse en cuenta en el diagnóstico
diferencial de las masas de la mama
de aparición súbita y crecimiento
rápido, sobre todo cuando hay ya
antecedente de LAL. El diagnóstico
definitivo se puede hacer por BAAF,
evitando una biopsia por escisión
y permitir la iniciación de un tratamiento precoz.
A1112
LEUCEMIA MIELOIDE CRÓNICA
EN FASE BLÁSTICA DE FENOTIPO
HÍBRIDO CON INFILTRACIÓN
EXYTRAMEDULAR Y CROMOSOMA PH VARIANTE
Bourlon De Los Rios C*, Tuna
Aguilar E*.
* Instituto Nacional De Ciencias
Médicas Y Nutrición Salvador Zubirán.
chrisbourlon@hotmail.com
ANTECEDENTES. La Leucemia mieloide crónica (LMC) se caracteriza
por la presencia de cromosoma
Filadelfia (Ph+) t(9;22)(q34;q11),
que codifica para una proteína de
fusión con actividad tirosin cinasa.
Comprende tres fases: crónica (FC),
acelerada (FA) y blástica (FB). La
LMC-FB se presenta al diagnóstico
en 5% de los casos, el 14% son de
tipo bifenotípico y <10% se presenta con enfermedad extramedular.
El 60-80% presenta alteraciones
citogenéticas adicionales (ACA),
representando las translocaciones
variantes solo el 6%.
OBJETIVO. Presentar un caso
infrecuente de LMC-FB fenotipo híbrido con infiltración extramedular
y cromosoma Ph variante
CASO CLÍNICO. Hombre de
45 años. ANTECEDENTES: fiebre
reumática(1971) con valvulopatía
aórtica, recambio valvular biológica
y mecánica(1987 y 1989 respectivamente). PADECIMIENTO ACTUAL:
Acudió a urgencias por cuadro de 1
mes de lumbalgia progresiva (10/10)
irradiada a miembros pélvicos, sin
mejoría con analgésicos. EXPLORACIÓN FÍSICA: Esplenomegalia(4cm
debajo de reborde costal), dolor
a la digitopresión en columna
lumbar, sacro y crestas iliacas. LABORATORIOS: anemia (Hb:8.8g/
dl), trombocitosis (475x103uL),
leucocitos: 61.6x103uL (Neutróf
ilos:79%,Linfocitos:5%,Monocit
os:1%,Eosinófilos:0%,Basófilos:0
%,Bandas:2%,Metamielocitos:10
%,Mielocitos:3%), DHL 623U/L,
resto normal. GABINETE: Rx columna lumbar y pelvis normal. TC
abdomen hepato-esplenomegalia.
RM múltiples lesiones infiltrativas en columna, sacro, iliacos y
cabezas femorales. Aspirado de
médula ósea(AMO) hipercelular
infiltrada por LMC-FB, Biopsia MO,
inmunofenotipo y biopsia vertebral
compatibles con infiltración por
LMC-FB fenotipo híbrido(PAX5,
CD79a+,CD34+,CD117+,TDT+
,MPO+,CD10+,CD20+,CD61-).
cariotipo: 2 0 = 46XY, t(1;9;22)
(q21;q34;q11.2), der(9),del(9)
(q34.1q34.3). FISH:200NI 182=(+)
t(9;22)(q34;q11.2),-1F y 18=(+)
t(9;22)(q34;q11.2). Punción lumbar sin infiltración. EVOLUCIÓN:
Se indujo a la remisión con HCVAD+Imatinib (IM) 600mg.
Presentó toxicidad GIV posterior a
segunda Fase B y al no contar con
donador HLA compatible, continuó
monoterapia con IM. A 3 meses del
tratamiento, el AMO sin evidencia
de infiltración; Cariotipo 20=46XY,
FISH 0%, PCR indetectable (Respuesta Molecular Mayor4.5).
CONCLUSIONES. La LMC-FB
semeja una leucemia aguda de
novo pero es una entidad distinta,
resistente a tratamiento y pobre
pronóstico con SG de 3 a 6 meses.
Según factores pronósticos las
peores tasas de SG se asocian a:
FB no linfoide, evolución clonal
(ACA de ruta mayor) y enfermedad
extramedular. Por otro lado, las
anormalidades cromosómicas variantes de ruta menor(cromosomas
1,3,etc) son infrecuentes(6%) y no
se asocian a evolución clonal ni a
pobre pronóstico, por lo que en este
caso el Ph variante t(1;9;22), no predispuso a la FB como presentación
de LMC. El tratamiento continúa
siendo un reto en este grupo, ya
que a pesar del tratamiento con
inhibidores de tirosin cinasa, QT
citotóxica y altotrasplante, la SG no
se ha modificado.
A1115
DERRRAME PLEURAL MALIGNO
BILATERAL Y POLINEUROPATÍA
COMO PRESENTACIÓN CLÍNICA
INICIAL DE MIELOMA MÚLTIPLE.
Lacayo Leñero D*, Aguayo Gonzalez A*, García Vera JA*, Lome
Maldonado C*, Martínez Baños D*,
* Instituto Nacional De Ciencias
Médicas Y Nutrición Salvador Zubirán.
dennis_ll@yahoo.com
S105
Volumen 15, Suplemento 1, 2014
Revista de Hematología
ANTECEDENTES. La afección extramedular en el mieloma múltiple
(MM) se ha reportado en 13%. El
derrame pleural maligno (DPM)
como manifestación inicial de
mieloma múltiple es muy poco
frecuente (0.8%-2.6%), y en estos
casos se asocia más frecuentemente
al isotipo IgA y una alta frecuencia
de deleción del cromosoma 13 en el
cariotipo. Los métodos de diagnóstico de DPM son: demostración de la
proteína monoclonal en electroforesis en líquido pleural o detección
de células plasmáticas atípicas en
derrame pleural o confirmación
histológica en biopsia de pleura.
La mediana de supervivencia a
partir del desarrollo de DPM es de
4 meses. La neuropatía periférica
es una presentación poco común al
diagnóstico del MM y cuando está
presente deberá elevar la sospecha
de otros diagnósticos.
OBJETIVO. Presentación de un
caso clínico atípico de mieloma
múltiple: DPM y polineuropatía.
CASO CLÍNICO. Masculino de
40 años que inició hace un año
con pérdida de peso de 70 kg,
edema en extremidades inferiores
y disnea progresiva. A su ingreso el
paciente refirió paresia proximal de
extremidades inferiores; se encontró dermatosis en tórax constituida
por 2 neoformaciones vasculares,
derrame pleural bilateral, edema de
pared y ascitis. Destacó Hb 9.0 g/dL
VGM 78 fL, HCM 24 pg, leucocitos
6.9 x 109/L (Ne 71.3%), plaquetas
197 000/uL, creatinina 0.5 mg/dL,
albúmina 1.8 g/dL, globulinas 6.1
g/dL, calcio corregido 9.5 mg/dL.
La toracocentesis reportó exudado
sin desarrollo microbiológico. La
tomografía reportó derrame pleural
bilateral, adenopatía mediastinal
de 1.3 cm, hepatomegalia, esplenomegalia, ascitis. El estudio
neurofisiológico fue compatible
con polineuropatía axonal/desmielinizante sensitivo-motora de las 4
extremidades. Ecocardiograma sin
S106
alteraciones. _2-microglobulina 5.5
mg/L, DHL 123 UI/L, VEGF 71 pg/
ml. Electroforesis de proteínas séricas y urinarias sin pico monoclonal.
Inmunofijación sérica sin patrón
monoclonal. Inmunofijación urinaria banda monoclonal kappa-kappa
libre. Testosterona libre 0.55 ng/
mL. Serie ósea con lesiones líticas
diseminadas. Los reportes histopatológicos reportaron hemangioma
capilar en piel, grasa periumbilical
y biopsia de hueso sin infiltración
por amiloide, aspirado de médula
ósea demostró un incremento en
células plasmáticas atípicas y la
biopsia de hueso confirmó neoplasia maligna de células plasmáticas
con restricción kappa; la biopsia
pleural pleura reportó infiltración
por neoplasia de células plasmáticas clonales kappa. Las cadenas
ligeras libres en suero kappa 380
con relación 1.8.
CONCLUSIONES. Este caso
clínico se caracteriza por la combinación de dos manifestaciones
clínicas muy raras. El derrame
pleural maligno como presentación
inicial del mieloma múltiple es muy
poco frecuente y se asocia a mal
pronóstico.
A1118
EXPRESIÓN INTENSA Y GENERALIZADA DE CD20 EN CÉLULAS
PLASMÁTICAS DE MIELOMA
MÚLTIPLE: REPORTE DE UN CASO
Espinoza Macias GA*, Aguayo
A*, Viramontes Aguilar L*, Lome
Maldonado C*, Martínez Baños D*,
* Instituto Nacional De Ciencias
Médicas Y Nutrición Salvador Zubirán.
gaem_7@hotmail.es
ANTECEDENTES. La expresión
de CD20 en células de mieloma
múltiple (MM) es heterogénea, y
puede ser detectada en 13-22%
de los pacientes. Generalmente,
ésta expresión se limita a <30% de
las células plasmáticas. Un estudio
inicial que abordó el pronóstico de
los pacientes con MM y expresión
de CD20, ésta resultó deletérea
para la supervivencia global. Un
estudio reciente que investigó el
papel pronóstico de la t(11;14)
(q13;q32) en MM y leucemia de
células plasmáticas, encontró que
los pacientes con MM con ésta
translocación tenían diferente supervivencia global y supervivencia
libre de enfermedad de acuerdo
a la expresión de CD20: ambos
desenlaces resultaron favorables
para el grupo que fue tratado con
bortezomib y que expresaba CD20.
OBJETIVO. Describir un caso
de Mieloma Múltiple con expresión
intensa y generalizada de CD20.
CASO CLÍNICO. Paciente femenino de 82 años de edad con
antecedentes de cáncer de mama,
HAS, DM, e hipotiroidismo. Inició
su padecimiento actual en mayo
del 2013, con síndrome anémico.
A su ingreso se encontró Hb de 6 g/
dL, VGM; 119 fL HCM; 38 pg, reticulocitos 5.7%; plaquetas 120000/
uL, creatinina 1.6 mg/dL. En el aspirado de médula ósea se observó
infiltración masiva por células plasmáticas maduras y plasmablastos.
La biopsia de hueso reportó médula
ósea hipercelular con infiltración
por neoplasia maligna de células
plasmáticas con morfología linfoplasmocítica (CD20+, CD38+,
CD3-, Lambda+, Kappa-, CD5-,
CD23-, CD56-, ciclina D1+ focal,
IgG+, IgM-). La electroforesis de
proteínas demostró una proteína
monoclonal de 374 mg en orina
de 24 horas y las inmunofijaciones
en suero y orina fueron positivas
para una banda monoclonal IgG
lambda y lambda-lambda libre,
respectivamente. IgA, IgG e IgM en
suero se encontraron bajas, Beta2
microglobulina de 25 mg/L. En la
serie ósea metastásica se encontraron lesiones líticas diseminadas.
La morfología linfoplasmocítica
observada en la biopsia, y la fuerte
Libro Educativo 55 Congreso Nacional de la Agrupación Mexicana para el Estudio de la Hematología, A.C.
expresión de CD20 en prácticamente la totalidad de las células orientó
hacia el diagnóstico de linfoma
linfoplasmocítico, sin embargo éste
se descartó debido a la ausencia de
banda monoclonal IgM y el comportamiento clínico sugerente de
mieloma. Se concluyó el diagnóstico de mieloma múltiple de cadenas
ligeras lambda, ISS 3, Durie-Salmon
IIIA y se inició tratamiento con MPT
(melfalán, prednisona y talidomida).
CONCLUSIONES. El caso clínico corresponde a una presentación
extremadamente infrecuente de
mieloma múltiple con expresión
intensa de CD20 en el total de las
células plasmáticas neoplásicas.
A1119
HEMARTROSIS COMO PRESENTACIÓN CLÍNICA DE LA
DEFICIENCIA DE PROTROMBINA
Corolla Salinas MM*, López Miranda A*, Ramírez Cázares AC*,
Santacruz Esparza E*, Ríos Solís
JE*, Villarreal Martínez L*, Mancías
Guerra C*, Gómez Almaguer D*,
González Llano O*.
* Hospital Universitario “Dr. José
Eleuterio González” / Facultad De
Medicina Universidad Autónoma
De Nuevo León / Servicio De Hematología.
madiacorolla@hotmail.com
ANTECEDENTES. Las hemorragias
en sitios no habituales como el
sangrado articular, debe hacer
sospechar la posibilidad de algún
trastorno de la coagulación. La
deficiencia de protrombina (Factor
II) es un trastorno hereditario muy
poco común de la coagulación
sanguínea, se transmite con un
carácter autosómico recesivo,
razón por la cual la mayor parte
de los casos reportados son en
grupos étnicos con altas tasas de
consanguinidad.
OBJETIVO. Se presenta el caso
de un paciente con deficiencia
congénita de protrombina.
CASO CLÍNICO. Se presenta el
caso de un paciente masculino de
5 años de edad, sin antecedentes
personales o heredofamiliares de
importancia, el cual sufre caída
de su propia altura que ocasiona
aumento de volumen de la rodilla
izquierda, la cual se encuentra
hiperémica, con aumento de calor
local y limitación funcional Se manejó inicialmente con analgésicos
sin presentar mejoría, es valorado
por Ortopedia que solicita radiografías del área afectada, se descarta
fractura y se realiza artrocentesis
extrayéndose material hemático no
cuantificado y se refiere a nuestro
hospital.
CONCLUSIONES. La deficiencia de protrombina es un trastorno
genético que se transmite con un
carácter autosómico recesivo y se
presenta con una frecuencia de 1:12 000 000 personas. Su presentación
clínica depende de la deficiencia
del factor e incluso, puede ocurrir sangrado anormal de manera
espontánea. Los sitios más frecuentemente afectados son: hemorragia
mucocutánea (60%) y hemartrosis/
hematomas musculares (36%). Los
hallazgos de laboratorio incluyen
prolongación del TP y del TTP, que
corrigen con plasma normal, el
tiempo de trombina es normal y actividad de protrombina disminuida.
El tratamiento es con plasma fresco
congelado o con complejo de concentrado de protrombina.
A1122
TRASPLANTE HAPLOIDENTICO
EN HEMOPATIAS BENIGNAS EN
NIÑOS: REPORTE DE DOS CASOS
Reynolds Ocampo L*, Ovilla Martínez R*, Calles Payán DI*, Miranda
Madrazo MR*, Ruiz Reyes G*.
* Unidad Medica Hematología Hospital Angeles Lomas.
lucia.reynolds@gmail.com
ANTECEDENTES. El trasplante de
médula ósea es la única opción
curativa en enfermedades genéticas o de falla medular que acortan
la vida del paciente pediátrico, la
ausencia de un donante histocompatible representa más del 70% de
los casos, lo que imposibilita esta
opción terapéutica.
OBJETIVO. Evaluar la eficacia
del Trasplante Haploidéntico en
hemopatías benignas.
CASO CLÍNICO. Caso1: Masculino de 8 años de edad con Síndrome
de Wiskott-Aldrich (Clasificación)
con mutación WAS:c.37C>T en
hemicigosis en el exón 1 del gen
WAS lo que codifica un codón
stop prematuro y la subsecuente
disminución en la expresión de la
proteína, inmunofenotipo y subclases de linfocitos con disminución
de los linfocitos B, Cariotipo 46XY.
Sin donador histocompatible. Compatibilidad 6/10 Padre, se decide
TMO Haploidéntico. Acondicionamiento de intensidad reducida
con Busulfan, Ciclofosfamida, Fludarabina, globulina antitimocito
mas irradiación corporal 200cGy.
Día de Trasplante 2 de Noviembre
2012, injerto día +17, profilaxis
para enfermedad injerto contra
huésped: ciclofosfamida días +3
y +4, Micofenolato + tracolimus,
terapia de soporte transfusional
convencional, profilaxis antibacteriana y fúngica convencional.
Complicaciones: 1.Microangiopatia
trombótica secundaria a tracolimus,
2. Reactivación de Citomegalovirus 3. Sepsis asociado a cuadro
intestinal por E. Coli 4. Enfermedad injerto contra huésped grado
I cutánea. Presenta quimerismos
de día +26,+70+180 positivos al
100%. Caso 2.- Femenina de 2
años y 4 meses de edad con Anemia
Aplásica Severa sin respuesta a Globulina antitimocito + Ciclosporina.
Aspirado de medula ósea Hipocelular ++++, histiocitosis, basófilia
importante y linfocitos de aspecto
maduro, Inmunofenotipo linfocitos
B atípicos, con expresión parcial de
S107
Volumen 15, Suplemento 1, 2014
Revista de Hematología
CD5 y CD23. Expresión de cadenas
ligeras policlonal, Cariotipo en
medula ósea :46XX, PCR para Parvovirus B19 Negativo. Sin donador
histocompatible. Compatibilidad
6/10 Madre. Acondicionamiento de
intensidad reducida con Busulfan,
Ciclofosfamida, Fludarabina. Día de
Trasplante 3 de Junio 2013, injerto
día 27, profilaxis para enfermedad
injerto contra huésped: ciclofosfamida días +3 y +4, Micofenolato
+ tracolimus, terapia de soporte
transfusional convencional, profilaxis antibacteriana y fúngica
convencional. Complicaciones Hipersensibilidad al Peg-filgastrim, 2.
Gastroenteritis infecciosa. Presenta
quimerismos positivos al 100%.
Actualmente pacientes sin manifestaciones clínicas ni hematológicas
de enfermedad con una Supervivencia Libre de enfermedad (SLE): 15 y
8 meses respectivamente.
CONCLUSIONES. El trasplante Haploidéntico representa una
excelente oportunidad para niños
que requieren trasplante de medula
ósea y carecen de donante histocompatible.
A1123
ESTENOSIS VALVULAR AÓRTICA;
MANEJO DE UN PACIENTE CON
HEMOFILIA EN EL INSTITUTO
NACIONAL DE CARDIOLOGÍA
IGNACIO CHÀVEZ
Coronel Ayala OF*, Núñez Toscano
M*, Cortina De La Rosa E*, Ramírez
Hernandez A*, Izaguirre Ávila R*.
* Instituto Nacional De Cardiología
Ignacio Chávez.
omar.coronel@ymail.com
ANTECEDENTES. La prevalencia
de la hemofilia es de 1 en 10 000
personas. En la hemofilia leve, hay
menos complicaciones en comparación con casos de hemofilia grave
y, por lo tanto, la esperanza de vida
es similar a la población normal. La
Federación Mundial de Hemofilia
menciona que la sobrevida es de 72
S108
años para pacientes con hemofilia
leve, en comparación con 75.5
años para la población normal. Las
principales causas de muerte en pacientes con hemofilia leve han sido
infecciones por hepatitis C y por el
virus de la inmunodeficiencia humana (VIH). Se informa una mejor
calidad de vida relacionada con la
salud en los pacientes con hemofilia
leve, permitiendo observar complicaciones propias de la edad.
OBJETIVO. Describir el manejo
hematológico del cambio valvular
aórtico en un paciente hemofílico.
CASO CLÍNICO. Masculino de
73 años Peso 90 kg. Hemofilia A
leve sin requerimientos transfusionales, no historia de Inhibidores.
Diabetes Mellitus tipo 2. Doble
lesión aórtica con insuficiencia
moderada y estenosis severa. Para
el estudio por parte de nuestro
servicio se le solicitò: TP: 10.9/11.5
s TTPa 46.2/31.5 s, mezcla con
plasma: 31.8 s mezcla 1:1; FIX
97%, FVIII : 5.2%; FvW Ag 96%;
CoRi 85%. Desde el 2010 refiere
disnea progresiva y 2 episodios de
síncope. En julio 2013 se realizó
coronariografía e intervencionismo,
angioplastía a la descendente posterior y coronaria derecha.
Se aplicó para el procedimiento
FVIII 3000 U c/12 h por 3 días.
El paciente desarrolló fibrilación
auricular por lo que se decidió
mantener sin anticoagulación y
usar amiodarona como antiarrítmico. Se decidió la colocación vía
percutánea (TAVI) válvula aórtica
Edwards Sapiens 26mm, se corroboró adecuada posición, en la
aortografía se observó exitoso sin
fuga paravalvular. Se administró
FVIII 3500U (100%) cada 12 h por
tres días. Se midió la actividad del
factor VIII 48 hrs posteriores a la
intervención, se encontró en 92%,
por lo que se administro por 24
hrs al 50% (2000U) el paciente no
presento datos hemorrágicos, se
egresó 72 hrs posteriores a la inter-
vención con doble antiagregación
plaquetaria con ASA/clopidogrel,
enalapril. Control por consulta externa dos meses posteriores donde
se encuentra asintomático.
CONCLUSIONES. Dado el
incremento de sobrevida en pacientes hemofílicos, se observan
con mayor frecuencia las complicaciones crónicas de la población
general. Se describe el manejo en
un paciente con hemofilia leve que
requirió cambio valvular aórtico
exitosamente. Aún falta experiencia
en el manejo de las complicaciones
crónicas en este tipo de pacientes.
A1126
DIAGNÓSTICO DIFERENCIAL DE
LINFOMA Y TUBERCULOSIS, UN
RETO CLÍNICO
Maldonado López CDJ*, Rentería
Castillo E*, Rivas Vera MS*, Labardini Méndez JR*.
* Instituto Nacional De Cancerología.
mlcarlos@hotmail.com
ANTECEDENTES. Cada año se reportan 8.7 millones de nuevos casos
de tuberculosis. La presentación
más frecuente es pulmonar, siendo
Mycobacterium tuberculosis el
agente. Las manifestaciones clínicas
van desde una infección latente
asintomática hasta afección sistémica. En pacientes con VIH, CD4
menor a 200/uL la presentación es
atípica. En pacientes con diabetes
o terapia inmunosupresora se debe
buscar la presencia de tuberculosis
OBJETIVO. Presentar tres casos
de pacientes con infección activa
por tuberculosis, antecedente de
linfoma, que se sospechó persistencia o recaída del linfoma
CASO CLÍNICO. Primer caso.Masculino de 52 años, inició en
2011 con síntomas B, tomografía con múltiples adenopatías en
ambos lados del diafragma y hepatoesplenomegalia. Leucocitos 4
600/uL, linfocitos 700/uL. Diag-
Libro Educativo 55 Congreso Nacional de la Agrupación Mexicana para el Estudio de la Hematología, A.C.
nóstico de Linfoma de Hodgkin
clásico variedad esclerosis nodular.
Tratado con 6 ciclos de ABVD. En
estudio de PET-CT posterior con
masa hipodensa en próstata, biopsia
reportó prostatitis granulomatosa.
En punción lumbar el citoquímico
reportó hipoglucorraquia, hiperproteinorraquia y 99% mononucleares.
La RMN de cráneo con 6 lesiones
supratentoriales cortico-subcortical
y 2 cerebelosas. Cultivo de LCR
positivo para tuberculosis.
Segundo caso.- Masculino de
62 años, empezó en 2012 con
adenopatía en cuello, dolor óseo y
síntomas B. En PET-CT conglomerados en cuello de 10 cm e inguinales
bilaterales. Diagnóstico de linfoma
difuso de células grandes B, leucocitos iniciales 9 000/uL, linfocitos
700/uL. Tratado con 8 ciclos de
R-CHOP y consolidación con radioterapia, se documentó progresión y
se cambió esquema a RICE. Nuevamente con adenopatías cervicales,
en tomografía se halló derrame
pleural izquierdo, infiltrados basales nodulares y conglomerados
ganglionares cervicales, ADA y
cultivo para micobacterias positivo
en líquido pleural.
Tercer caso.- Masculino de 64
años, con pérdida de 3 kg en 3
meses, vómito, evacuaciones melénicas. En TAC lesión ocupativa
sólida en mesenterio. Leucocitos
iniciales 9 800/uL, linfocitos 1000/
uL, reporte de linfoma difuso de
células grandes B. Tratado con 2 ciclos de R-CHOP, se hospitalizó por
fiebre y neutropenia. En tomografía
con cavitación pulmonar. Se realizó
broncoscopía, reporte de cultivo
positivo para tuberculosis.
CONCLUSIONES. Existe aumento de casos de reactivación de
tuberculosis. Las características de
los tres pacientes es media de 59
años, linfocitos < 1 000/uL. Dos
casos con linfoma difuso de células grandes B y otro con linfoma
de Hodgkin. Se estima recuento
inicial de CD4 menor a 500 células/uL. Es importante valorar si
ha presentado infección por TB,
mediante una prueba cutánea de
tuberculina, determinación de
linfocitos CD4 iniciales y hacer
diagnóstico diferencial de reactivación de TB con persistencia o
recaída de linfoma.
A1128
LINFOMA COMPUESTO. REPORTE DE CASO EN EL INSTITUTO
NACIONAL DE CANCEROLOGÍA
–MÉXICO
Renteria Castillo E*, Maldonado
López CDJ*, De La Torre Luján
AHF*, Avilés Salas A*, Labardini
Méndez JR*.
* Instituto Nacional De Cancerología.
eliza.renteria@hotmail.com
ANTECEDENTES. El linfoma compuesto es una neoplasia linfoide
con dos (o más) subtipos distintos de
linfoma que infiltran el mismo sitio
anatómico. Es relativamente raro y
ha sido reportado principalmente
entre linfomas de Hodgkin (LH) y
linfomas no Hodgkin (LNH).
OBJETIVO. Reportar un caso
de un paciente con linfoma compuesto en el Instituto Nacional
de Cancerología (INCan) y descripción de las características
clínico-patológicas
CASO CLÍNICO. Masculino
de 38 años de edad. Inició en
diciembre del 2012 con fiebre y
adenomegalia en cuello nivel III
B del lado derecho de 2x2 cm.
Se realizó biopsia que reportó
hiperplasia linfoide. En mayo del
2013 presentó dolor abdominal,
se realizó laparotomía exploratoria
documentándose una tumoración
retroperitoneal, se tomó biopsia con
reporte histopatológico de linfoma
compuesto. La inmunohistoquímica
resultó positiva para CD10, CD20,
BCL-2, BCL-6 en el área con linfoma folicular grado 3a con patrón
predominantemente folicular; en el
componente de linfoma de Hodgkin
clásico, variante celularidad mixta
fue positiva para CD15, CD30 y
EBV (LMP-1). El estudio de FISH
se reportó positivo para la translocación t(14;18). Se realizó PET/CT
con actividad metabólica tumoral
en adenopatías supra e infra diafragmáticas, pulmón, intestino, riñón y
peritoneo. El aspirado de médula
ósea: sin infiltración. A su ingreso
al instituto el paciente se encontraba con ECOG de 0 y Karnosfky de
100%. Se concluye etapa clínica
IV B. El paciente se encuentra
actualmente en tratamiento con
el segundo ciclo de R-CHOP de 8
planeados.
CONCLUSIONES. El linfoma
compuesto fue reportado por primera vez por Custer. Su incidencia
va de 1 a 4.7% dependiendo de
la serie que se revise. Pueden ser
combinaciones de LH con LNH de
células B o T, o dos tipos distintos
de LNH. Lo más frecuente es la
incidencia de LNH de células B
con LH. Se debe distinguir entre
linfoma discordante en el cual hay
dos tipos diferentes de linfoma en
sitios diferentes y el secuencial, en
el cual se presentan uno posterior al
otro en relación al tiempo.
A1133
TROMBOCITOPENIA REF R AC TA R I A Y P E R S I S T E N T E
ENMASCARANDO UNA INMUNODEFICIENCIA PRIMARIA:
REPORTE DE CASO
Scheffler Mendoza SC*, Montero
Ponce DI**, González Serrano
DE***, Espinosa Padilla DSE***,
Hernández Moreno DAL**.
* Instituto Nacional De Pediatría. **
Hospital General “Dr. Gaudencio
González Garza”, Centro Médico
Nacional La Raza, I.M.S.S. ***
Unidad de Investigación en Inmunodeficiencias Primarias, Instituto
Nacional de Pediatría.
drascheffler@hotmail.com
S109
Volumen 15, Suplemento 1, 2014
Revista de Hematología
ANTECEDENTES. La trombocitopenia es un hallazgo que se presenta
de manera idiopática o asociada a
otros síndromes, que requiere de
un abordaje para diagnosticar su
etiología. Ante la persistencia de
cifras plaquetarias disminuidas,
con curso persistente y refractario al
tratamiento, en un paciente masculino se debe descartar Síndrome de
Wiskott-Aldrich (WAS); que es una
inmunodeficiencia primaria caracterizada por microtrombocitopenia,
infecciones, eccema, y sangrado. El
defecto molecular se encuentra en
WASP (Wiskott-Aldrich Syndrome
protein), el tipo de herencia es
ligado a X y de acuerdo al tipo de
mutación puede ser el espectro
de manifestaciones. El tratamiento depende de fenotipo clínico,
deben administrarse antibióticos
profilácticos, inmunoglobulina
humana sustitutiva y puede requerir
de inmunosupresores en caso de
manifestaciones de autoinmunidad
y en los fenotipos mas graves está
indicado el Trasplante de células
pluripotenciales hematopoyéticas
(TCPH) el cual es un tratamiento
curativo.
OBJETIVO. Describimos el
caso de un paciente con trombocitopenia refractaria y persistente
con WAS.
CASO CLÍNICO. Masculino
de 2 años 8 meses, sin antecedentes familiares de importancia.
Al nacimiento presentó eccema y
biometría hemática con trombocitopenia (15 000/uL). Es hospitalizado
a los 6 meses por presencia de petequias y trombocitopenia (15 000/
uL), se realizó abordaje diagnóstico
con frotis de sangre periférica con
plaquetas disminuidas en tamaño
y en cantidad, aspirado de médula ósea reportó presencia de
megacariocitos hipolobulados con
poca producción de plaquetas. Se
inició tratamiento con prednisona
2.5mg/ día e inmunoglobulina intravenosa, incrementado los niveles
S110
plaquetarios, pero aún en rangos
bajos de 13000/mm3 a 73000/
mm3. Además el paciente ha presentado infecciones de vías aéreas
superiores leves. Por tratarse de un
paciente masculino, con antecedente de eccema, trombocitopenia
e infecciones se sospechó en WAS,
por lo que se realizaron niveles de
inmunoglobulinas encontrándolas normales: IgA 63 mg/dL , IgG
977 mg/dL, IgM 52.20 mg/dL , IgE
820 UL/ml, y se realizó citometría
de flujo para búsqueda de la expresión de la proteína WASp, la
cual no fue detectada, con lo que
concluimos que el paciente cursa
con este síndrome. Se valorará la
respuesta de anticuerpos específica
a polisacáridos de Neumococo para
implementar tratamiento con Inmunoglobulina humana sustitutiva e
iniciar protocolo de TCPH.
CONCLUSIONES. Ante el escenario de un paciente masculino
con trombocitopenia persistente
refractaria a tratamiento se debe
descartar WAS. Un método de
diagnóstico rápido es mediante la
expresión de la proteína WASp por
citometría de flujo. El pronóstico y
sobrevida de estos pacientes mejora
con un diagnóstico y tratamiento
oportuno y adecuado.
A1142
ABORDAJE DIAGNÓSTICO DE
HIPOPLASIA MEDULAR SEVERA CON CITOPENIAS LEVES
EN SÍNDROME MIELODISPLÁSICO. REPORTE DE UN CASO
Padilla Ortega JA*, Zuno Reyes
EE**, Barrera Chairez E**, Chamorro Morales NH**, Villalobos
De La Mora LO**, Martínez Ayón
C**, Pineda Palma JI**, De La Mora
López PA**, Ruiz Morales TC**,
Vásquez Díaz JE**, Juárez López
GE***, Pérez Becerra E****.
* Hospital Civil De Guadalajara
Fray Antonio Alcalde. ** Hospital
Civil de Guadalajara, Universidad
de Guadalajara. *** Laboratorio de
Histopatología e Inminohistoquímica, Universidad de Guadalajara.
**** Unidad de Patología Clínica.
dropadilla@yahoo.com.mx
ANTECEDENTES. Los síndromes
mielodisplasicos (SMD) comprenden un grupo heterogéneo de
malignidades hematológicas que se
caracterizan por grados variables de
citopenias en sangre periférica, hematopoyesis ineficaz con displasia
y riesgo aumentado de transformación a leucemia aguda. Los SMD
hipoplásicos corresponden al 10%
de los casos, siendo la monosomía
7 una de las alteraciones citogenéticas más frecuentes.
OBJETIVO. Aportar la evidencia
en el abordaje diagnóstico de un
caso de SMD hipocelular, y citopenias leves.
CASO CLÍNICO. Paciente femenino de 24 años de edad, con
antecedentes familiares de enfermedad autoinmune. Por hallazgos
de exámenes de laboratorio se
documenta leucopenia (2,100),
trombocitopenia (114 000/uL) con
hemoglobina normal (13.5 g/dL),
es referida a hematología, donde
se corroboran las citopenias, la
paciente se mostraba asintomática.
Como parte del abordaje inicial se
realizo aspirado de médula ósea y
biopsia de hueso en 2 ocasiones
diferentes, con sitios de punción
distintos, reportando hipoplasia
medular severa con reserva medular
del 15% sin mielofibrosis. Se inicia
abordaje de causas secundarias de
hipoplasia medular considerando
como posibilidades diagnósticas
causas infecciosas, nutricionales, inmunológicas, congénitas y
malignidades hematológicas. Se
realizaron estudio serológico viral
resultando negativo para hepatitis
B y C, VIH, Citomegalovirus, y
Epstein-Barr. Así mismo por el
antecedente familiar se realizo búsqueda de anticuerpos antinucleares,
anticardiolipinas, anticoagulante
Libro Educativo 55 Congreso Nacional de la Agrupación Mexicana para el Estudio de la Hematología, A.C.
lúpico y reactantes de fase aguda
siendo negativos. Las causas nutricionales se descartan por niveles
normales de vitamina B12, ácido
fólico, ácido metilmalónico y
homocisteina. Se realizó abordaje
de HPN con marcadores CD55,
CD56 resultando negativo. En
cuanto al abordaje de causas congénitas se considero la posibilidad
diagnostica de anemia de Fanconi,
se realizó cariotipo de fragilidad
cromosómica con resultados dentro
de parámetros normales. Dentro de
la evolución de la paciente persistió
con citopenias periféricas leves
(Leucocitos 3 100/uL, Plaquetas 120
000/uL y Hemoglobina de 12.5 g/
dL) , índice reticulocitario menor
de 0.5%, sin requerimientos transfusionales, procesos infecciosos o
hemorrágicos. Ante la evolución
se decide realizar una nueva biopsia de hueso encontrando medula
hipocelular con 12% de reserva
medular, cambios displásicos en las
3 series hematopoyéticas. El estudio
citogenético reporta un cariotipo
46XX y en FISH sin evidencia de
deleción 5q, 20q o monosomía
7. Por estos hallazgos se realiza
diagnostico de Síndrome mielodisplásico hipoplásico.
CONCLUSIONES. Los síndromes mielodisplásicos, generalmente
cursan con citopenias severas en
sangre periférica, cuando la presentación inicial es con médulas
hipocelulares, se requiere un abordaje más extenso para concluir el
diagnóstico. La ausencia de citopenias severas en este caso, son
una variante atípica de síndromes
mielodisplasicos hipoplásicos.
A1145
SÍNDROME DE UPSHAW SCHULMAN: PRESENTACIÓN DE 3
CASOS EN EL INSTITUTO NACIONAL DE PEDIATRÍA
Nemi Cueto J*, Paredes Aguilera
RA*, González Pedroza MDL*,
Tavera Rodríguez MG*.
* Instituto Nacional De Pediatría.
jorgenemi3@hotmail.com
ANTECEDENTES. En 1960 Schulman reportó el caso de un escolar
de 8 años que presentó episodios
de trombocitopenia y anemia que
respondían a la administración de
plasma; en 1978 Upshaw reportó
un caso similar agregando anemia
hemolítica, propuso que presentaba
un trastorno congénito parecido a
la PTT y que la eficacia del tratamiento con plasma podía explicarse
por el reemplazo de un factor que
estaba ausente. La Púrpura trombocitopénica trombótica (PTT) se
caracteriza por trombocitopenia,
anemia hemolítica microangiopática, fiebre y grado variable de
afección neurológica y renal; resulta de la inhibición de la enzima
metaloproteasa fragmentadora de
los multímeros de Von Willebrand
(VW), el ADAMTS13, que condiciona microtrombos que forman una
red donde se atrapan y fragmentan
los eritrocitos; mayor incidencia en
adultos, rara en niños.
OBJETIVO. Describir las características clínicas, evolución y
tratamiento de tres pacientes con
Síndrome de Upshaw Schulman
atendidos en el Instituto Nacional
de Pediatría.
CASO CLÍNICO. Caso 1. Femenino; inició a los 5 meses con
palidez, ictericia y anemia regenerativa; fragilidad osmótica
aparentemente compatible con
Esferocitosis; seis hospitalizaciones
por síndrome anémico y trombocitopenia; ingresa al INP con
anemia y trombocitopenia, frotis
con esferocitos y esquistocitos;
determinación de ADAMTS13 en
0%. Inicia plasma fresco (PFC)
mensual. Caso 2. Femenino; a los
4 años presenta petequias, tratada
con Prednisona sin mejoría; 7
meses después presenta EVC isquémico, al mes recurre; referida
al INP, ingresa con anemia regene-
rativa y trombocitopenia, frotis con
microesferocitos y esquistocitos;
presenta daño renal, ameritó hemodiálisis, se transfunde PFC, buena
respuesta; cuantificación de ADAMTS13 menor de 1%, inicia PFC
mensual; suspende el tratamiento,
presenta nuevo EVC isquémico
con anemia y trombocitopenia,
reinicia PFC cada 15 días. Caso
3. Femenino; inicia a los 5 meses
con anemia y trombocitopenia
refractarias, médula ósea reportada
con mielodisplasia, sin tratamiento;
hospitalizada dos ocasiones por hemorragia, anemia, trombocitopenia
y daño renal, se transfunde con
mejoría; nueva hospitalización por
hemorragia; se valora en INP, frotis
con esferocitos y esquistocitos;
ADAMTS13 en 2%; inicia PFC,
corrige daño renal y citopenias;
actualmente PFC cada 15 días.
CONCLUSIONES. El Síndrome
de Upshaw-Schulman es la forma
congénita de PTT causada por la
deficiencia de ADAMTS13. La plasmaféresis induce remisión en 80%
de los pacientes y la transfusión periódica de PFC revierte la hemólisis
y daño renal, con lo que disminuyen los eventos trombóticos.
A1149
SERIE DE CASOS DE SÍNDROME
DE PEARSON EN EL SERVICIO DE
HEMATOLOGÍA DEL INSTITUTO
NACIONAL DE PEDIATRÍA
Goldbard Rochman D*, Gonzalez
Pedroza MDL*, Paredes Aguilera
RA*.
* Instituto Nacional De Pediatría.
danielagoldbard@gmail.com
ANTECEDENTES. El síndrome
de Pearson fue descrito por primera vez en 1979, como una
enfermedad de la infancia prácticamente mortal, con altas necesidades
transfusionales, vacuolización de
precursores hematopoyéticos con
anemia sideroblástica, e insuficiencia pancreática exocrina.
S111
Volumen 15, Suplemento 1, 2014
Revista de Hematología
Ahora se sabe que es una citopatía
mitocondrial, rara, con afección
multiorgánica, presentándose con
anemia, neutropenia y trombocitopenia, así como falla hepática, renal
y pancreática variable. La muerte
generalmente ocurre a edades tempranas, habitualmente en presencia
de crisis metabólicas con acidosis
láctica severa de forma intercurrente de enfermedades infecciosas. Se
han reportado menos de 100 casos
en la literatura médica. En general
no existe una terapia efectiva, fuera
del tratamiento sintomático.
OBJETIVO. Revisar la experiencia del servicio de hematología para
Síndrome de Pearson.
CASO CLÍNICO. Caso 1. Masculino quien inicia a los 4 meses
de vida con diarrea, la cual en 3
ocasiones requirió hospitalización
por cuadros de deshidratación.
Tratado de forma inicial como
alergia a las proteínas de la leche
de vaca y acidosis tubular renal,
sin embargo un año después de
dicho manejo, se interconsulta al
servicio de hematología por la presencia de leucopenia. Se observa
pancitopenia por lo que se realiza
AMO donde se encuentran con
cambios megaloblásticos en serie
roja y blanca, así como la presencia
de vacuolas en ambos. CASO 2.
Lactante menor quien por falla de
medro se realiza biometría hemática donde se observa anemia, por
lo que es referida a este INP, a los 9
meses de edad. Se observa paciente
con talla baja, se encuentra en la
biometría hemática con anemia macrocítica.se agrega neutropenia por
lo que se toma AMO encontrando
vacuolas en serie roja y mieloide.
Meses posteriores se agrega diarrea, diagnosticando insuficiencia
pancreática exócrina. CASO 3.
Masculino de 11 meses de edad,
quien cuenta con el diagnóstico
de infección por CMV, sin embargo
con la presencia de pancitopenia
desde los 6 meses de vida. Se toma
S112
AMO donde se observa vacuolización de precursores eritroides, con
cambios displásicos.
CONCLUSIONES. Al establecer
el diagnóstico diferencial, ante
la presencia de un paciente con
síntomas como los descritos, pocas
veces se piensa en el síndrome de
Pearson, la pretensión es que este
padecimiento sea tomado en cuenta, sobre todo ante la expectativa de
que alguna intervención se pueda
considerar, no sólo en beneficio del
paciente sino también de la familiar.
A1152
LINFOMA INTRAOCULAR, REPORTE DE UN CASO
García Castillo JA*, Tenorio Guajardo G*, Moreno D*, Rivas Vera S*.
* Hospital General De México.
betoegroj@hotmail.com
ANTECEDENTES. Los linfomas
intraoculares representan menos
del 1% de todos los linfomas no
Hodgkin. El Linfoma intraocular
primario o vitreoretiniano (LVR), es
un subtipo raro de linfoma primario
de sistema nervioso central. 6080% de los pacientes en quienes
se diagnostica inicialmente LVR se
extenderá a otras áreas del SNC. Los
linfomas intraoculares secundarios
generalmente infiltran coroides;
la infiltración vítreo-retiniana es
extremadamente rara. La biopsia
por aspiración del vítreo es el procedimiento de elección. Se pueden
realizar: Inmunohistoquímica /
citometría de flujo; Marcadores de
superficie celular; Cuantificación
intraocular de citosinas (IL-10 e
IL-6 ); Punción lumbar; Imagenología: RM/TAC. El tratamiento es
multidisciplinario. Opciones: Local:
metrotexate o rituximab intraocular;
Regional: irradiación cerebral/ocular y/o Sistémico: Quimioterapia
CASO CLÍNICO. Masculino 52
años con historia de Linfoma Difuso
de Células Grandes (LDCGB), EC:
IIIb, IPI bajo. 1ª. Línea QT: CHOPx8,
respuesta parcial; 2ª línea: CEPx4:
RC, julio 2010 (PET-CT). Agosto
2011: visión borrosa, se instituyó
tratamiento antimicrobiano sin
mejoría. Seis meses después por disminución progresiva de la agudeza
visual (AV) sin otra sintomatología
clínica ni bioquímica se realizó
angiografía con fluoresceína: puntos hiperfluorescentes y zonas de
isquemia. Dos semanas después:
disminución notoria de la agudeza
visual: OD 20/400 y OI 20/200,
mal estado general; fundoscopía:
celularidad 2+ bilateral, infiltración retiniana y coroides, inicia
prednisolona tópica sin respuesta.
RM: infiltración parenquimatosa
y meníngea, supra e infratentorial
y nervio óptico izquierdo. LCR:
infiltración. Recibió altas dosis
de metotrexate, 5 ciclos: 8 gr/m2,
ajuste de dosis por nefrotoxicidad,
siguientes 3 ciclos: 5 g/m2. Al término del tratamiento (diciembre
2012) la AV: OD: 20/40 y OI: 20/25
. Ambos ojos: Papila pálida, mácula:
disminución de brillo foveolar y
cambios pigmentarios. LCR, RM y
PET-CT: sin actividad tumoral. Consolidación: RT holocraneal (30 Gy).
Asintomático, después de un año,
crisis convulsivas, LCR: infiltración
linfomatosa. Recibió QT intratecal
con negativización del LCR y sin
evidencia de actividad tumoral
sistémica hasta enero 2014.
CONCLUSIONES.El LVR se
presenta como uveítis crónica
enmascarada que no responde a
corticoides. Debe alertar al clínico
la posibilidad de infiltración del
SNC por LDCGB. La supervivencia
es corta, independientemente del
tratamiento, 15%-25% de pacientes
con linfoma del SNC tendrán afección vítreo-retiniana en el curso de
su enfermedad: la exploración oftalmológica completa es obligada.
La erradicación de la enfermedad
intraocular es importante para
eliminar del ojo un reservorio que
podría aumentar el riesgo de recu-
Libro Educativo 55 Congreso Nacional de la Agrupación Mexicana para el Estudio de la Hematología, A.C.
rrencia. El tratamiento del linfoma
intraocular por sí solo no mejora la
supervivencia, debe ser multidisciplinario.
A1157
LINFOHISTOCITOSIS HEMOFAGOCÍTICA EN UN PACIENTE CON
SÍNDROME DE GRISCELLI TIPO 2
DE PRESENTACIÓN ATÍPICA
Cabrera Garcia A*, Balderas Delgado C*, Aldape Mora A**, Alvarez
Avila F**, Ladines WJ*, Zazueta
Pozos JF*, Trejo R*, Barragan Ibañez
G*, Martinez JL*, Barranco Lampon
GI*, Aveces G*, Reyes Atrisco S*,
Cabrera Osuna S*, Cabrera Osuna
S*, Ventura Y*, Garcia A*, Ramos
Peñafiel CO*.
* Hospital General De México. **
Universidad Autónoma de Aguascalientes.
alvarohematohgm@gmail.com
ANTECEDENTES. El síndrome de
Griscelli es un enfermedad autosómica recesiva muy rara, que
fue descrita por primera vez en
1978, se caracteriza por albinismo
parcial, inmunodeficiencias, infecciones frecuentes y predisposición a
procesos neoplásicos, que comúnmente desencadena eventos fatales
durante la infancia. Se han descrito
tres tipos, el segundo es causado
por mutación en el gen RAB27A,
se manifiesta con hipomelanosis,
deterioro inmunológico y síndrome
hemofagocítico. La linfohistiocitosis hemofagocítica es caracterizada
por una abrumadora activación
de células T y macrófagos que
conduce a fiebre, esplenomegalia,
citopenias, hipofibrinogenemia y/o
hipertrigliceridemia e hiperferritinemia. La combinación de estos
dos síndromes es casi siempre
fatal, alcanzando una sobrevida
menor a 2 meses sin tratamiento, y
con esquemas de manejo actuales
se logra una sobrevida de 55% a
3.1 años de seguimiento. El tratamiento incluye medicamentos
quimio-inmunosupresores como
dexametasona, ciclosporina, rituximab y etopósido durante 8 semanas
y posteriormente administrando
dosis semanales de Etoposido
hasta la semana 40 (Terapia de
Continuación) con el objetivo de
mejorar el estado clínico, limitar
el daño y llevar al paciente a
trasplante de células progenitoras
hematopoyéticas.
O B J E T I VO . D e s c r i b i r l a
presentación atípica (edad de
presentación, sin antecedentes
familiares, sin infecciones de repetición) de un síndrome genético de
raro (Síndrome de Griscelli tipo 2)
complicado con manifestaciones
hematológicas casi siempre fatales
(Linfohistiocitosis hemofagocítica)
con adecuada respuesta al tratamiento (HLH2004 modificado).
CASO CLÍNICO. Femenino
de 19 años de edad. Inicia padecimiento con astenia, adinamia,
fatiga, y fiebre forma intermitente,
tinte ictérico, dolor abdominal y
vomito. Exploración física: Cabello
y cejas plateados, palidez de tegumentos, ictericia generalizada,
hepatoesplenomegalia. Exámenes
de laboratorio con Leucocitos
0.7x103/uL, Hemoglobina 9.3 g/dl,
Neutrófilos 0.24x103/uL, plaquetas
10x103/uL, Glucosa 87 mg/dL, Urea
19.3 mg/dL, creatinina 0.5 mg/dL,
Trigliceridos 430 mg/dL, Bilirrubina
total 10.1 mg/dL, Bilirrubina directa
6.4 mg/dL, Bilirrubina indirecta 3.7
mg/dL, AST 238 mg/dL, FA 1138
mg/dL, DHL 38 mg/dL, ferritina
333. Aspirado de Médula Ósea con
hemofagocitosis. Se descartaron
infecciones como citomegaluvirus,
virus de inmunodeficiencia humana, toxoplasmosis, parvovirus B19,
Epstein Barr, virus de Hepatitis B y
C, así como fúngicas, y procesos
neoplásicos concomitantes. Se inició tratamiento con esquema HLH
2004 modificado (sin ciclosporina)
con reducción en los niveles de
enzimas hepáticas y corrección
de citopenias. Tras 7 semanas de
tratamiento las cifras celulares descendieron nuevamente, por lo que
se inició protocolo para trasplante
de células progenitoras hematopoyéticas.
CONCLUSIONES. Este caso
representa el primer reporte de
Linfohistiocitosis hemofagocítica en
Síndrome de Griscelli tipo 2 de más
de 18 años de edad con respuesta
temporal al tratamiento.
A1159
TERAPIA DE COMBINACIÓN DE
ALEMTUZUMAB CON DOSIS
BAJAS DE RITUXIMAB EN UNA
PACIENTE CON HEMOFILIA A
ADQUIRIDA
González López EE*, Herrera Reyes
MÁ*, Vazquez Mellado De Larracoechea A*, González Leal XJ*,
Gómez Almaguer D*.
* Universidad Autónoma De Nuevo
León, Hospital Universitario Dr. José
Eleuterio González.
eliasgzzl@hotmail.com
ANTECEDENTES. La hemofilia A
adquirida es una enfermedad autoinmune causada por anticuerpos
que inhiben la función del factor
VIII. Afecta a personas de edad
avanzada, con una media de 77
y secundaria o idiopática. Existe
evidencia que la combinación de
rituximab a dosis bajas y alemtuzumab puede inducir respuesta en
pacientes con citopenias autoinmunes refractarias a esteroides. La
justificación para el uso de terapia
de combinación con alemtuzumab
y rituximab es que los linfocitos T
están involucrados en el control
y expansión de los linfocitos B
autorreactivos, lo cual genera una
depleción más profunda y sostenida
de los mismos
OBJETIVO. Valorar la respuesta
clínica y de laboratorio de una paciente con hemofilia A adquirida al
uso de terapia de combinación con
alemtuzumab y rituximab
S113
Volumen 15, Suplemento 1, 2014
Revista de Hematología
CASO CLÍNICO. Femenina
de 75 años con antecedente de
cáncer de mama diagnosticada y
tratada hace 2 años. Se ingresa en
hospital particular por cuadro de
sangrado de tubo digestivo además
de múltiples equimosis en brazos y
piernas, TTP prolongado >100 s y
TP normal, se administran plasmas
frescos congelados y desmopresina,
sin respuesta. En nuestro hospital se
encuentra actividad del factor VIII en
0.6% y un inhibidor del factor VIII
con 224 UB. Se trata con metilprednisolona 2.5g IV, ciclofosfamida 1g
IV, dosis única y rituximab 100mg
semanal por 4, con dosis de mantenimiento de prednisona 1mg/kg;
cuantificándose 102.4 UB de inhibidor. Asintomática durante 3 meses;
tras una caída de su propia altura
presenta múltiples equimosis y se
encuentran 512 UB de inhibidor; se
administra otro ciclo de rituximab.
Durante 2 meses disminuye la cantidad y frecuencia de las equimosis
con 256 UB de inhibidor de factor
VIII, sin embargo 3 meses después se
exacerba, con aumento del inhibidor a 819UB. Se administra terapia
de combinación con alemtuzumab
10mg subcutáneos cada 24 horas
por 3 días y un ciclo de rituximab;
después de dos meses disminuye el
inhibidor a 256UB y al tercer mes
se demuestra una disminución aún
mayor con 153.6 UB y un aumento
en la actividad del factor VIII a
4.7%. A 5 meses de seguimiento,
se encuentra asintomática.
CONCLUSIONES. La paciente
está en la remisión sintomática
más prolongada de su enfermedad, con los niveles más bajos de
inhibidor, sin uso de agentes alquilantes o dosis altas de esteroides. La
terapia de combinación de alemtuzumab/rituximab parece inducir
respuesta clínica en enfermedades
autoinmunes refractarias a terapia
convencional. Es necesario realizar
estudios comparativos y prospectivos para establecer su eficacia.
S114
A1181
PERFIL DE ALTERACIONES MOLECULARES DIAGNOSTICADAS POR
RT-PCR EN PACIENTES PEDIÁTRICOS CON LEUCEMIA AGUDA.
Parra Ortega I*, Lopez Martinez B*.
* Hospital Infantil De México Federico Gómez.
i_parra29@hotmail.com
ANTECEDENTES. Las leucemias
agudas representan la neoplasia maligna más frecuente en la población
pediátrica. El valor pronóstico del
análisis molecular de los pacientes
pediátricos es actualmente de suma
importancia e indispensable para el
diagnóstico, clasificación y sobre
todo definición del tratamiento.
OBJETIVO. Realizar un estudio
que relacioné las translaciones así
como demás alteraciones cromosómicas y moleculares en pacientes
con leucemia aguda. Se realizó un
estudio descriptivo, transversal y
prospectivo.
CASO CLÍNICO. Se analizaron
muestras de médula ósea y sangre
periférica de 56 pacientes pediátricos menores de 18 años con
diagnóstico de leucemia aguda.
Se realizó un análisis de RT-PCR
múltiple (Hemavision HV01-28N)
para búsqueda de 28 translocaciones Las alteraciones cromosómicas
buscadas fueron: t(1;11)(p32;q23),
t(1;11)(q21;q23), t(1;19), t(3;5),
t(3;21), t(4;11), t(5;12), t(5;17),
t(6;9), t(6;11), t(8;21), t(9;9), t(9;11),
t(9;12), t(9;22), t(10;11), t(11;17),
t(11;19)(q23;p13.1), t(11;19)
(q23;p13.3), t(12;21), t(12;22),
t(15;17), t(16;21), t(17;19), t(X;11)
; la inv(16), y en la secuencia del
gen TAL1.
CONCLUSIONES. Se estudiaron
56 pacientes con leucemia aguda,
los intervalos de edad fueron de 2
meses a los 18 años de edad con
una media de 6.5 años. 33 fueron
negativos para alguna de las translocaciones buscadas (59%) mientras
que 23 fueron positivos para alguna
de ellas (41%). De estos últimos dos
pacientes presentaron dos alteraciones cada uno: t(3;21)(q26;q22)
con t(6;9)(p23;q34) para el primer
caso y TAL1d 40kpb del(1p32) con
t(9;22)(q34;q11) para el segundo. La
translocación más frecuentemente
encontrada fue t(12;21)(p13;q22)
con el 36% de los casos positivos,
seguidas por t(9;22)(q34;q11) y
t(16;21)(p11;q22) con el 12%
cada una. t(1;19)(q23;p13), t(4;11)
(q21;q23) y TAL1d 40kpb del( 1p32)
con el 8% cada una y finalmente
t(10;11)(p12;q23), t(8;21)(q22;q22),
t(3;21)(q26;q22) y t(6;9)(p23;q34)
con el 4% en cada uno de los casos. En nuestro estudio, la t(12;21)
(p13;q22) fue la más frecuente. Lo
que concuerda con los datos reportados en otros estudios similares
alrededor del mundo. Sin embargo,
no concuerda con la alta presencia
de translocaciones relacionadas
con el gen MLL (11q23), el cual no
aparece de forma importante en
nuestro estudio. Lo que podría interpretar diferencias genéticas en los
pacientes mexicanos comparados
con otras poblaciones mundiales.
A1193
T R ATA M I E N TO D E L A H P N
CON ECULIZUMAB. LECCIONES
APRENDIDAS A PROPOSITO DE
UN CASO
Gonzalez Martinez P*, Góngora
Biachi RA**, Alonzo Salomón G*,
Quintal Ortiz I*, Rosado Paredes
P*, Moguel Rodríguez W*, Rivero
Cárdenas NA*, Lara Perera DM**.
* Universidad Autónoma De Yucatán. ** Centro Médico de las
Américas.
gmartin@uady.mx
OBJETIVO. Reportar un caso de
HPN tratado con Eculizumab.
CASO CLÍNICO. JAS. Masculino
de 59 años, originario de Mérida,
Yucatán, México. Ingeniero civil,
empleado universitario. Un hermano menor murió por LAM y una
Libro Educativo 55 Congreso Nacional de la Agrupación Mexicana para el Estudio de la Hematología, A.C.
hermana padece CUCI. Inicia su
padecimiento en VI-93, en Nueva
Orleans, al presentar mareo. En VIII93 en Mérida, México es evaluado
y por síndromes anémico (Hb 6.6
g/dL, reticulocitos 5%) e ictérico
(B.Indirecta: 1.3 g/dL, DHL: 1804
UI) y hemoglobinuria+, se investiga
anemia hemolítica. La prueba de
coombs directa fue negativa y la
Hb libre en suero: 41 mg/dL. Otros
valores de la CH: 1 000 leucocitos/uL, 52% linfocitos. Plaquetas
264 000. Las pruebas de Ham+,
Sucrosa+, Inulina+. La MO celularidad disminuida, megacariocitos
normales, hiperplasia eritroide.
Basófilos tisulares+. El cariotipo: 46
XY. Desde Agosto/93, se establece
el diagnóstico de HPN. Durante 20
años, recibió diversos tratamientos:
esteroides, anabólicos, danazol,
ácido fólico, manteniéndose compensado, con hemólisis crónica y
exacerbaciones. A partir de 2011
ha habido deterioro de la calidad
de vida con crisis de afectación
psico-emocional, ansiedad recurrente y DE. Sólo ha recibido 2
PGs (2001). El 11-02-13, el panel
de Fenotipo HPN corroboró el
diagnóstico de HPN. La diferencia
entre el tamaño de la clona en leucocitos y eritrocitos se consideró
debida a hemólisis reciente. Para
el 31-V-13, se refería bien pero
con crisis psico-emocional; además
tomaba 15 mg de deflazacort, 50
mg de mesterolona, 5 mg de ácido
fólico, 1 gr de omega 3 y 2 mg de
loflazepato de etilo y estaba en
programa de psicoterapia. Aceptó
iniciar eculizumab, ya habiéndose
vacunado contra N. Meningitidis
desde enero de 2013. Evolución 6
meses después de haber iniciado
eculizumab el 9-VI-13: Desde la
primera semana mostró respuesta
al normalizar la DHL y la Hb libre
en suero, así como desaparición de
la hemoglobinuria. Los niveles de
hemoglobina se han incrementado
hasta 12.9 gr/dL en diciembre de
2013, manteniéndose en promedio
en 11.5 gr/dL. La mejoría en la calidad de vida es evidente, incluso en
el aspecto psicoemocional. Se han
logrado suspender los esteroides,
anabólicos y se mantiene sólo con
ácido fólico; incluso ya no recibe
psicoterapia. No ha presentado
reacciones adversas ni complicaciones ya que las enzimas hepáticas
y la depuración de creatinina son
normales. Las plaquetas han estado normales y los leucocitos casi
normales.
CONCLUSIONES. En conclusión, el eculizumab en este paciente
ha sido eficaz, seguro y ha mejorado su calidad de vida.
A1197
SÍNDROME MIELODISPLÁSICO
EN PACIENTES PEDIÁTRICOS.
REPORTE DE CASOS
Reyes Zepeda NC*, De Diego
Flores-chapa J*, Flores Villegas V*,
Mar Aldana R*.
* Centro Médico Nacional 20 De
Noviembre, ISSSTE.
ncreyesz@yahoo.com
ANTECEDENTES. El Síndrome Mielodisplásico es una entidad rara en
pediatría. En la literatura se reporta
una incidencia de alrededor de
1.8 a 4 casos por cada 1´000,000
niños. Debido a esto los reportes
son escasos. Los conocimientos han
avanzado en cuanto a las anormalidades genéticas y el tratamiento. La
mayoría de los artículos se enfocan
al manejo por medio del trasplante
de células progenitoras hematopoyéticas (TCPH), sin embargo pocos
son los pacientes que cuentan con
donador compatible, es necesario
tomar en cuenta otros tratamientos
que permitan mejorar la calidad de
vida de los pacientes.
OBJETIVO. En este trabajo
describimos las características demográficas, clínicas, tratamiento y
evolución de los pacientes atendidos en nuestro Servicio.
CASO CLÍNICO. De 2008 a la
fecha se diagnosticaron 9 pacientes,
edad promedio de 6.6 (1 a 12 años).
El 44% debutó con pancitopenia.
El 100% de los pacientes recibió
un diagnóstico diferente al inicio
(anemia aplásica, púrpura trombocitopénica inmune), dos pacientes
recibieron esteroide previo a su
envío. En el 100% de los casos el
aspirado de médula ósea presentó
celularidad normal con cambios
displásicos, principalmente en la
serie eritroide. Una paciente con
síndrome de Down, progresó a leucemia mieloide aguda, un paciente
con Síndrome de Noonan, progresó
al cabo de siete años a leucemia
linfoblástica aguda ambos continuaron a paliación. Siete pacientes
recibieron inicialmente globulina
antitimocito (GAT) asociada a
micofenolato o ciclosporina, una
paciente con respuesta completa y
actualmente en remisión, el resto
presentó respuestas parciales, dos
pacientes recibieron un segundo
curso por pérdida de la respuesta.
Un paciente no toleró la segunda
aplicación, continuando manejo
con ciclosporina + talidomida,
actualmente se encuentra en remisión, con biometría normal. El
100% de los pacientes recibieron
talidomida, con una dosis inicial de
10 mg y posterior incremento, con
mejoría de la biometría hemática y
disminución de los requerimientos
transfusionales. La respuesta a
talidomida se perdió a los 10 a 12
meses, por lo que tres pacientes
recibieron TCPH, falleciendo por
complicaciones. Una paciente
recibió lenalidomida, (dosis 12.5
mg) a los dos meses de iniciada,
sin requerimientos transfusionales.
CONCLUSIONES. Aquí describimos tratamientos como GAT,
talidomida, ciclosporina y lenalidomida como alternativas,
mostrando respuestas completas
y/o parciales y pocos efectos adversos. La talidomida con disminución
S115
Volumen 15, Suplemento 1, 2014
Revista de Hematología
importante de los requerimientos
transfusionales, la lenalidomida,
de la cual hay poca experiencia
en pediatría, con una excelente
respuesta, ambas con pocos efectos adversos, aunque se requiere
mayor experiencia para establecer
su papel en estos pacientes.
A1198
LEUCEMIA MIELOIDE CRÓNICA
EN PEDIATRÍA. REPORTE DE
CASOS
Reyes Zepeda NC*, De Diego
Flores-chapa J*, Flores Villegas V*,
Mar Aldana R*.
* Centro Médico Nacional 20 De
Noviembre, ISSSTE.
ncreyesz@yahoo.com
ANTECEDENTES. La leucemia
mieloide crónica es poco frecuente
en pediatría, comprende el 3% de
las leucemias en este grupo. Con
una incidencia de 1/1’000,000 de
niños y adolescentes menores 20
años, siendo más rara en menores
de 4 años. La presentación clínica
y de laboratorio es similar a la de
los adultos. El trasplante de médula ósea se consideraba el manejo
estándar hasta la llegada de los
inhibidores de tirocinasa, actualmente este tipo de medicamentos
se considera de primera línea, sin
embargo el papel del trasplante aún
está en controversia.
OBJETIVO. Presentamos los
casos de LMC en nuestro servicio,
su manejo y evolución.
CASO CLÍNICO. Desde 2000 a
la fecha se han diagnosticado cinco
pacientes, 4 sexo masculino. Edad
6.2 (2-12 años). Cuenta leucocitaria
al diagnóstico promedio 280,000/
mm3. La principal manifestación
al inicio del padecimiento fue la
distensión abdominal, seguida de
astenia, adinamia y dolor óseo. El
100% de los pacientes se presentó
en fase crónica. El paciente diagnosticado en el año 2000 (GMA) a
la edad de tres años inició quimioterapia (citarabina y epirrubicina),
posteriormente interferón y citarabina, presentando fase acelerada
en 2002 manejado con busulfan,
en 2004 inicia imatinib, en 2008
nuevamente con fase acelerada
cambiando a dasatinib 50 mg/día.
Durante este tiempo sin alcanzar
respuesta molecular. Se incrementa
dosis a 100 mg/día, julio 2013 se reporta respuesta molecular. Paciente
NAL de 4 años, inició manejo con
imatinib, sin lograr respuesta molecular al año, se realizó trasplante de
células progenitoras de cordón um-
bilical en septiembre 2010 logrando
remisión molecular, posteriormente
con pérdida de la misma, iniciando
manejo con nilotinib 200 mg/día
en abril de 2011, recuperando la
respuesta molecular, actualmente
en manejo por endocrinología por
pubertad precoz, sin otros efectos
adversos. GRS paciente de 2 años,
inició manejo con dasatinib por
seis meses, presentando efectos
adversos importantes como dolor
muscular, calambres y diarrea de
difícil control, por lo que se cambió
a nilotinib, actualmente en remisión
molecular, presentando como efecto adverso rash. MMCN de 10 años,
inició manejo de primera línea
con nilotinib, logrando respuesta
molecular a los tres meses, también
reportó rash como efecto adverso.
CARAA de 12 años, paciente recién
diagnosticado, en manejo con dasatinib, actualmente con respuesta
hematológica.
CONCLUSIONES. Presentamos el manejo con inhibidores de
tirocincinasa de primera y segunda
generación, logrando respuestas
similares a la población adulta y
con pocos efectos adversos. También iniciamos el uso de nilotinib
en pacientes pediátricos con buena
respuesta y tolerancia.
FISIOLOGÍA Y FISIOPATOLOGÍA DE LOS ERITROCITOS
PRESENTACIÓN ORAL
A1143
INCIDENCIA DE DEFICIENCIA
DE GLUCOSA 6 FOSFATO DESHIDROGENASA EN UN PROGRAMA
DE TAMIZ NEONATAL EN MÉXICO
Villarreal Martinez L*, Martínez
Garza LE*, González Llano O*,
Mancías Guerra C*, Garza Osoria CA*, Torres Sepúlveda R*,
Ruiz Herrera C*, Peña Cabrera
A*, Arredondo Vázquez P**,
S116
Gómez Almaguer D*, Villarreal
Pérez JZ*.
* Universidad Autónoma De Nuevo
León. ** Secretaría de Salud del
Estado de Nuevo León.
dr_lauravillarreal@hotmail.com
INTRODUCCIÓN. La deficiencia
de glucosa 6 fosfato deshidrogenasa (G6PD), es una enfermedad
hereditaria ligada al X, que pre-
dispone a hemólisis, su gen G6PD,
está localizado en el locus Xq28.
Es la enzimopatía más frecuentemente reportada en el mundo.
Cerca del 7.5% de la población
mundial es portador de uno o dos
mutaciones para dicha deficiencia, y la proporción de portadores
oscila entre un máximo de 35%
en algunas partes de África, hasta
un 0.1% en Japón y otras partes
Libro Educativo 55 Congreso Nacional de la Agrupación Mexicana para el Estudio de la Hematología, A.C.
de Europa. Se estima que cerca
del 2.9% de la población mundial
(aproximadamente 400 millones
de personas) tienen deficiencia de
G6PD, por lo que se ha incluido en
los programas de tamiz neonatal
en muchos países. En México esta
enfermedad no es considerada
dentro del programa de tamiz metabólico neonatal, por lo que sería
importante conocer su incidencia
para evaluar el costo-beneficio de
incluirla.
OBJETIVO. Detectar la incidencia de deficiencia de G6PD en una
población del noreste de México
para justificar su inclusión en el
tamiz metabólico neonatal.
M AT E R I A L Y M É TO D O S .
Cuantificación de G6PD mediante
fluorescencia (Delfia, Perkin Elmer),
en sangre de papel filtro colectada
de talón del recién nacido a las
24 horas de vida, como parte del
programa de tamiz metabólico
neonatal ampliado en el estado de
Nuevo León, México, de noviembre
2011 a Diciembre 2013.
RESULTADOS. Se realizó el
tamiz metabólico ampliado con
cuantificación de G6PD en 74,000
recién nacidos de los cuales 79
fueron positivos para deficiencia
de G6PD (incidencia de 1:1000)
de los cuales 7 (8.9%) fueron
del sexo femenino. Los pacientes
fueron evaluados por el servicio
de hematología y el departamento
de genética para su asesoramiento
respectivo.
CONCLUSIONES. Si bien la
incidencia no es de las más altas
reportadas en la literatura, se podrían
estar presentando más de 2000 casos
anuales además de considerar que
nuestro país es heterogéneo genéticamente por lo que la incidencia
pudiera ser diferente de acuerdo a la
región. Las complicaciones asociadas a la deficiencia de G6PD pueden
ser prevenidas y por su frecuencia
resulta costo-beneficio su inclusión
en el tamiz metabólico neonatal en
nuestro país.
PRESENTACIÓN CARTEL
A1049
EVOLUCIÓN Y COMPLICACIONES POST ESPLENECTOMÍA EN
PACIENTES CON ESFEROCITOSIS
HEREDITARIA EN EL HOSPITAL
INFANTIL DE MÉXICO FEDERICO
GÓMEZ
Luna Silva NC*, Castillo Martínez
ID*.
* Hospital Infantil De México Federico Gómez.
lunamedica@hotmail.com
INTRODUCCIÓN. La Esferocitosis
hereditaria (EH) es la anemia hemolítica más frecuente en nuestro
país (31.3%). La esplenectomía es
un recurso terapéutico utilizado en
nuestra institución.
OBJETIVO. Describir la evolución y complicaciones de pacientes
pediátricos con diagnóstico de EH
sometidos a esplenectomía.
M AT E R I A L Y M É TO D O S .
Cohorte. Prospectivo, longitudinal, descriptivo. Se revisaron 74
expedientes de pacientes con
diagnóstico de EH del 2007 a 2012,
encontrando 28 pacientes con esplenectomía terapéutica.
RESULTADOS. Las indicaciones
de esplenectomía fueron esplenomegalia en 20 pacientes (71.5%),
litiasis vesicular en 8 pacientes
(28.5%), alto requerimiento transfusional en 6 pacientes (21.5%).
93% de pacientes contaba con
vacunación completa para neumococo y H. Influenza B. Ningún
paciente tenía vacunación para
meningococo. La edad de realización de la esplenectomía tuvo
una media de 90.3 meses, siendo
17% menores de 5 años, de éstos
7% tenían menos de 36 meses. El
procedimiento en el 100% de los
pacientes fue esplenectomía total,
en 1 caso fue abierta por presencia
de bazos accesorios y en el resto
laparoscópica. En 8 casos (28.5%)
se realizó esplenectomía y colecistectomía conjunta. Todas fueron
cirugías programadas. Se presentó
lesión vascular en 1 paciente (3.5%)
y fue reparada. Las complicaciones
infecciosas post esplenectomía se
presentaron en 4 pacientes: 2 (7%)
tuvieron sepsis nosocomial en el
post quirúrgico inmediato, sin germen aislado. Dos pacientes (7%)
presentaron procesos infecciosos
mediatos leves. Del 93% de los
pacientes que recibieron profilaxis
antibiótica, se utilizó penicilina V
potásica, penicilina benzatínica o
amoxicilina. No hubo mortalidad
asociada a sepsis en ningún caso.
En el aspecto hematológico posterior a la esplenectomía, 6 pacientes
(21.5%) mantuvieron cifra normal
de plaquetas, 20 pacientes (71.5%)
con cifra plaquetaria mayor de 450
000 y 2 pacientes (7%) con cifra mayor de 1000000 de plaquetas. Tres
pacientes recibieron ácido acetilsalicílico. Sin eventos de trombosis.
El incremento de hemoglobina,
por encima de 2g/dl se observó en
24 pacientes (86%). En el 100%
de los pacientes hubo un descenso
de más del 50% de reticulocitos
respecto al basal y en 11 pacientes
(39%) la cifra de reticulocitos llegó
a ser normal.
S117
Volumen 15, Suplemento 1, 2014
Revista de Hematología
CONCLUSIONES. La esplenectomía es una opción terapéutica
eficaz y segura para los pacientes
con EH, mejora el requerimiento
transfusional, cifra de hemoglobina
y reticulocitos. No existió mortalidad asociada. Requiere una
valoración estricta de las indicaciones, edad y condiciones de
los candidatos a esplenectomía.
Es necesario el seguimiento de
las inmunizaciones y la profilaxis
antibiótica.
A1076
EXÁMENES DE LABORATORIO Y
SU IMPACTO EN EL DESARROLLO
DE ANEMIA NOSOCOMIAL. ESTUDIO RETROSPECTIVO EN UN
HOSPITAL UNIVERSITARIO
Cantú Rodríguez OG*, Hawing
Zarate JA*, De La Cruz Cruz R*,
Gutiérrez Aguirre CH*, González
Llano O*, Mancias Guerra MDC*,
Herrera Rojas MA*, Vázquez-Mellado De Larracoechea A*, Gómez
Almaguer D*.
* Servicio de Hematología, Hospital
Universitario, Universidad Autónoma de Nuevo León.
ogcantur@yahoo.com.mx
INTRODUCCIÓN. El poder contar
con una amplia diversidad de estudios diagnósticos ayudan a hacer
de la medicina una ciencia cada
vez más objetiva y práctica; sin
embargo el abuso de estos estudios
podría causar paradójicamente
efectos adversos no deseados para
nuestros pacientes, tal como es el
desarrollo de anemia nosocomial.
OBJETIVO. Conocer la prevalencia de anemia nosocomial en
un hospital universitario.
MATERIAL Y MÉTODOS. Revisamos los expedientes de sujetos
adultos internados en el Hospital
Universitario de marzo-octubre
2012 que a su ingreso no presentaron anemia (masculinos Hb >13g/
dL y femeninos Hb >12g/dL). Se
excluyeron además los que presen-
S118
taran: hemorragias, traumatismos,
discrasias sanguíneas, neoplasias malignas, enfermedad renal
crónica, transfusión sanguínea,
suplementación con hierro, administración de eritropoyetina, ingreso
por eventos de sangrado o durante
el internamiento y los sometidos a
procedimientos quirúrgicos. Con información del laboratorio se recabo
el número y tipo de muestras para
determinar el volumen sanguíneo
extraído durante cada internamiento. El período de internamiento lo
definimos como el tiempo comprendido entre el primer y último
registro de hemoglobina o el último
registro previo a transfusión si así
fuera el caso.
RESULTADOS. De 1782 internamientos revisados fueron
incluidos 123 casos. La mediana
de edad al ingreso fue de 47 años
(16-92), con un promedio de 8.6
días de internamiento (+ 6.56).
Cuantificamos 2049 muestras, de
las cuales el 42.31% fueron para
realización de pruebas metabólicas
(química sanguínea, electrolitos
séricos, PFH), 24.93% fueron
pruebas hematológicas (biometría
hemática, hematocrito), 17.52%
para pruebas de coagulación y
14.34% para medición de gases
arteriales/venosos. A los pacientes estudiados se les tomaron en
promedio 2.5 muestras por día (+
1.52) obteniendo una mediana en
el volumen de extracción sanguínea al término del internamiento
de 43 mL (12-208). El 26% de los
pacientes desarrollaron anemia
durante el internamiento con un
rango de valores de hemoglobina
al término del mismo de 9.16-11.9
g/dL en mujeres y de 9.7-12.9g/dL
en varones. En la regresión logística
los pacientes femeninos tuvieron
un OR de 2.98 para el desarrollo
de anemia (p=0.034), y un OR de
2.62 en aquellos sujetos con una
estancia intrahospitalaria superior
a los 7 días (0.049).
CONCLUSIONES. En nuestro
estudio, la extracción de sangre
con fines diagnósticos se asocia a
la disminución en los niveles de
hemoglobina a rangos de anemia
en pacientes con hospitalizaciones
superiores a 7 días, particularmente
en pacientes del sexo femenino.
Este grupo presentó valores limítrofes normales de Hb al ingreso,
esto podría justificar este hallazgo.
A1081
PLASMAFÉRESIS Y RITUXIMAB
EN DOSIS BAJAS COMO TRATAMIENTO DE PRIMERA LÍNEA
EN PACIENTES CON PÚRPURA
TROMBOCITOPÉNICA TROMBÓTICA Y SÍNDROME URÉMICO
HEMOLÍTICO TÍPICO
Vazquez Mellado De Larracoechea
A*, Pequeño Luévano M*, Gómez
Almaguer D*, Gómez De León A*,
González López E*, González Leal
XJ*, Herrera Rojas M*, Jaime Pérez JC*.
* Universidad Autónoma De Nuevo
León Hospital Universitario “Dr José
Eleuterio González”.
vmelladol@hotmail.com
INTRODUCCIÓN. La púrpura
trombocitopenia trombótica (PTT)
se presenta por la reducción de la
actividad de la proteasa del factor
de Von Willebrand ADAMTS-13 que
se debe, en la mayoría de las veces,
a la presencia de autoanticuerpos
contra esta proteasa. Con plasmaféresis, la supervivencia es del
77-83% pero las tasas de recaída
son elevadas y van desde 34 -41%.
El síndrome urémico hemolítico
típico (SUHt) tiene una presentación clínica similar a la PTT y en
ocasiones requiere solo tratamiento
de sostén. Es imposible diferenciar
entre PTT/SUH en base a la presentación clínica y es mandatorio
iniciar plasmaféresis hasta vigilar
la evolución del paciente y en algunos casos, apoyar o descartar el
diagnóstico mediante la actividad
del ADAMTS-13.
Libro Educativo 55 Congreso Nacional de la Agrupación Mexicana para el Estudio de la Hematología, A.C.
OBJETIVO. Describir la evolución clínica de 8 pacientes con
sospecha diagnóstica de TTP/HUSt
que recibieron tratamiento con
plasmaféresis y rituximab a dosis
bajas como primera línea.
MATERIAL Y MÉTODOS. El diagnóstico se hizo en base a criterios
clínicos, trombocitopenia, esquistocitos en sangre periférica y prueba
de Coombs negativa. A todos los
pacientes se les inició plasmaféresis
con 1-1.5 recambios diarios hasta
alcanzar la remisión y se administró
rituximab 100 mg/dosis por 4 semanas, iniciando la primera dosis en el
cuadro agudo después del recambio plasmático. Algunos pacientes
recibieron prednisona a 1mg/kg a
discreción del médico tratante. Si
existía disponibilidad, se cuantificó
ADAMTS-13, anticuerpos contra la
proteasa y toxina Shiga.
RESULTADOS. Se incluyeron 8
pacientes; se diagnosticó TTP en 7
pacientes y en 1 SUHt; 3 hombres
(38%) y 5 mujeres (62%). El promedio de edad fue de 32 años (rango
15-46). En todos los pacientes se
documentó anemia hemolítica
microangiopática no inmune y
trombocitopenia. La cifra media de
plaquetas fue de 13.89X109/L (rango
7-35). En 5 pacientes se cuantificó
actividad del ADAMTS-13 y en 4
se encontró <10%. Se buscaron
anticuerpos contra el ADAMTS-13
en 3 pacientes y se documentaron
en 2 de ellos. Todos los pacientes
con TTP tuvieron desorientación,
convulsiones o cefalea como manifestaciones neurológicas. El número
promedio de plasmaféresis hasta
alcanzar la remisión fue de 7.7
(rango 5-12), se utilizó prednisona
a 1 mg/kg en 5 pacientes. No hubo
complicaciones serias relacionadas
al tratamiento. Todos los pacientes
permanecen en remisión completa
después una media de 14.5 meses
de seguimiento. (rango 2-33)
CONCLUSIONES. El Rituximab
a dosis bajas es efectivo como
tratamiento de primera línea en
pacientes con PTT/HUS. En nuestra cohorte de pacientes no se han
documentado recaídas.
A1158
FERUMOXYTOL (HIERRO IONIZADO) INTRAVENOSO COMO
TRATAMIENTO DE LA DEFICIENCIA
DE HIERRO CON Y SIN ANEMIA
Ovilla Martínez R*, Calles Payán
DI**, Reynolds Ocampo L**, Miranda Madrazo MR**, Ruiz Reyes
G**, Montesinos Ovilla A**.
* Hospital Angeles Lomas/departamento De Hematología Y Trasplante
De Médula Ósea. ** Hospital Angeles Lomas / Departamento de
Hematología y Trasplante de Médula Ósea.hematologica@gmail.com
INTRODUCCIÓN. El hierro es un
ion vital para el ser humano, su déficit produce síntomas como fatiga,
caída de cabello, uñas adelgazadas,
piel seca, mialgias, memoria lábil,
irritabilidad, geofagia, incluso síndrome anémico. El tratamiento en
ambos casos es restaurar los valores fisiológicos de hierro tanto en
sangre como en depósito. El Ferumoxytol es una nanopartícula de
óxido de hierro superparamagnética
que permite su uso intravenoso y
utiliza al macrófago como vehículo.
OBJETIVO. Demostrar la eficacia de Ferumoxytol en el tratamiento
de la deficiencia de hierro en pacientes anémicos y no anémicos.
MATERIAL Y MÉTODOS. Estudio
analítico, observacional, retrospectivo con 34 pacientes con deficiencia
de hierro con y sin anemia, con uso
Ferumoxytol 510 mg por dosis, intravenosa en bolo por 1 a 3 dosis. Se
emplearon como criterio de anemia
hemoglobina <12 g/dL en mujeres
y <14g/dL en hombres y en ambos
grupos se midió la deficiencia de
hierro. La respuesta al tratamiento
se valoró de acuerdo a los gramos
de hemoglobina recuperados en 4
semanas. Se utilizó premedicación
vía oral de 120 mg de clorhidrato
de fexofenadina dosis única.
RESULTADOS. Tabla 1
Tabla 1. Relación de pacientes con deficiencias de hierro con y sin anemia
tratados con Ferumoxytol
Edad (media)
Relación Mujer:Hombre
Deficiencia de hierro
Leve (>60 ug/dL)
Moderada (40-60 ug/dL)
Severa (<40 ug/dL)
Clasificación anemia
Leve (9-10 g/dL)
Moderada (7.1-8.9 g/dL)
Severa (6-7 g/dL)
Recuperación
Hb 1-2 g/dL
a) Anemia Leve
Hb 2-3 g/dL
a) Anemia Leve
b) A. Moderada
Hb >3 g/dL
a) Anemia Leve
b) A. Moderada
Remisión de los síntomas
Pacientes con anemia
n(23)
Pacientes sin anemia
n(11)
46 años
17:06
42 años
10:01
17.39%(4)
8.69%(2)
73.91%(17)
17.17%(2)
27.27%(3)
54.54%(6)
89.60%(19)
21.73%(5)
0.00%(0)
26.08%(6)
100%(6)
30.43%(7)
85.71%(6)
14.28%(1)
43.47%(10)
60%(6)
40%(4)
100%
100%
S119
Volumen 15, Suplemento 1, 2014
Revista de Hematología
CONCLUSIONES. En nuestra
muestra 73% de los pacientes con/sin
anemia fueron del género femenino.
El 100% de los pacientes remitió la
sintomatología tras la aplicación de
hierro. La dosis de Ferumoxytol osciló
entre 500 mg y 1 500 mg con una
tasa de recuperación del 100% a las
4 semanas. Se comprueba el uso de
Ferumoxytol como una molécula segura ya que en este grupo de pacientes
no se presentó ningún efecto adverso.
GAMAPATÍAS MONOCLONALES
PRESENTACIÓN ORAL
A1040
FRECUENCIA DE ALTERACIONES
CROMOSÓMICAS EN UNA SERIE
DE 160 PACIENTES CON MIELOMA MÚLTIPLE (MM) DE NOVO;
ALTA INCIDENCIA DE ALTERACIONES DEL CROMOSOMA 1.
Arana Trejo RM*, Aguilar E**, Del
Castillo Moreno A**, Madrid Cedillo V**, Pahlmayer Garduño H***,
Saldivar Saldaña I***, Castellanos
Galan J****, Hernandez MP****,
Solis Anaya L****, Ignacio Ibarra
G*****.
* Hospital General De México SS Y
Laboratorio De Análisis De Oncohematología SC.. ** Hospital General
de México ss. *** Laboratorio de
Análisis de Oncohematología, S.C..
**** Hospital Regional #1 Carlos
Mc Gregor; IMSS. ***** Hospital
Oncología, CMN SXXI; IMSS y
Laboratorio de Análisis de Oncohematología, S.C.
aranat@prodigy.net.mx
INTRODUCCIÓN. El Mieloma
Múltiple tiene una incidencia de
alteraciones cromosómicas de 3050% en casos de novo por técnicas
de citogenética convencional en
metafases. Esta incidencia está limitada por el bajo índice mitótico de
las células plasmáticas que dificulta
la caracterización citogenética; sin
embargo, con técnica de FISH se
identifican alteraciones cromosó-
S120
micas hasta en 90-95% de los casos
de novo.
OBJETIVO. Determinar la
incidencia del alteraciones cromosómicas en 160 pacientes con
mieloma múltiple de novo por
citogenética convencional.
M AT E R I A L Y M É TO D O S .
Pacientes. Se estudiaron 190 pacientes con MM de novo recibidos
entre 2009-2013 procedentes de
diferentes instituciones de salud.
160 pacientes con cariotipos evaluables fueron incluidos para su
análisis. Cariotipo. Se realizó en
muestras de médula ósea procesadas por técnica directa, cultivos de
24-72 horas y análisis con bandeo
GTG. Se revisaron al menos 20
metafases y el cariotipo se reporta
de acuerdo a la nomenclatura citogenética ISCN.
RESULTADOS. La edad promedio fue 59 años (rango 34-89); sexo
masculino 83 (52%) y femenino
77 (48%). La frecuencia de alteraciones cromosómicas observadas
fue 52.5% (84/160); predominan las alteraciones estructurales
55/84 (65.5%) sobre las numéricas
29/84 (34.5%). Estas últimas las
agrupamos en tres categorías: hipodiploidia (8.3%); hiperdiploidia
con 47 a 50 cromosomas (14%)
y con >50 cromosomas (12%).
Las alteraciones estructurales fueron rearreglos del cromosoma 1,
deleciones 13q, 12q, 14q, 18q,
isocromosoma 17q, inversión (9q)
y translocaciones variadas [t(7;7),
t(3;5)]. Predominaron las alteraciones del cromosoma 1, [24/84 casos
(29%)]; con duplicación parcial de
1p en 16 y ocho casos con del(1q).
La deleción 13q se observo en 10
casos (11.9%) siete con bandas
GTG y tres con FISH que habían
tenido cariotipo normal con bandas GTG.
CONCLUSIONES. Se observo
una alta incidencia de rearreglos
del cromosoma 1 (29%) comparado con la literatura que reporta 16
a 24%; que están asociados con
mal pronóstico, particularmente
la duplicación (1p). Y observamos
baja frecuencia de hiperdiploidia
26%, ya que la literatura reporta
hasta 50%, asociada con buen
pronóstico. La incidencia de alteraciones cromosómicas observadas
de 52.5% coincide con los reportes
previos y se incrementa cuando se
buscan por FISH. En esta serie, a
tres casos con cariotipo normal, se
realizó FISH y los tres presentaron
del(13q). Como el costo se incrementa recomendamos que además
del cariotipo convencional se realice FISH para buscar alteraciones
de mal pronóstico idealmente en
todos los casos o seleccionar a los
de mal pronóstico y en ausencia de
metafases.
Libro Educativo 55 Congreso Nacional de la Agrupación Mexicana para el Estudio de la Hematología, A.C.
PRESENTACIÓN CARTEL
A1035
¿ES LA CUANTIFICACIÓN DE CADENAS LIGERAS EN SUERO MÁS
SENSIBLE QUE LA INMUNOFIJACIÓN PARA EL DIAGNÓSTICO Y
EL SEGUIMIENTO DE LOS PACIENTES CON MIELOMA MÚLTIPLE?
Gonzalez Ramirez MP*, Martagon
Herrera NA*, Hernandez Reyes J*,
Velázques De Cima S*, Zamora
Ortiz G*, Ruiz Delgado GJ*, Ruiz
Argüelles A*, Ruiz Argüelles GJ*
* Centro De Hematología Y Medicina Interna, Clínica Ruiz Puebla. **
Universidad Popular Autónoma del
Estado del Puebla.
glez_monica2@hotmail.com
INTRODUCCIÓN. El estándar
de oro para la detección de la
paraproteinemia de las neoplasias
en las células plasmáticas es la
electroforesis de proteínas séricas
y la inmunofijación de las cadenas
pesadas y ligeras de las inmunoglobulinas en suero y orina. Se ha
propuesto que la cuantificación de
cadenas ligeras en suero hace innecesario el análisis en orina.
OBJETIVO. Definir el papel
de la electroforesis de proteínas
séricas, inmunofijación y cuantificación de cadenas ligeras en suero
en pacientes con mieloma múltiple
(MM), al diagnóstico y durante el
seguimiento del mismo.
MATERIAL Y MÉTODOS. Se
llevaron a cabo electroforesis de
proteínas séricas, inmunofijación de
las cadenas pesadas y ligeras de las
inmunoglobulinas y cuantificación
de cadenas ligeras en un grupo de
63 pacientes con MM al diagnóstico y en 29 de estos individuos a lo
largo del tratamiento, como parte
de su seguimiento
RESULTADOS. En los 63 pacientes analizados al momento
del diagnóstico encontramos
anormalidades del corrimiento
electroforético de proteínas séricas
en el 58% de los pacientes. El 92%
de los pacientes presentaron banda
monoclonal en la inmunofijación
del suero y el 45% de los pacientes
presentaron anormalidades en la
cuantificación de cadenas ligeras
en suero. El 64% de los pacientes
tuvo resultados anormales en los
tres estudios realizados. A lo largo
del tratamiento, todos los casos
con inmunofijaciones normales y
cuantificación de cadenas ligeras
normales presentaron corrimientos
electroforéticos normales, en tanto
que se encontraron 12 casos con
inmunofijaciones anormales a pesar de electroforesis de proteínas
normal.
CONCLUSIONES. Lo ideal es
que se hagan los tres estudios en
pacientes con MM, tanto al momento del diagnóstico como a lo largo
del tratamiento. En esta serie, no
encontramos mayor sensibilidad de
la cuantificación de cadenas ligeras
en comparación con la inmunofijación, ni al momento del diagnóstico
ni en el seguimiento. La cuantificación de las cadenas ligeras libres
en suero es aparentemente más
sensible que la cuantificación de
cadenas ligeras totales, pero actualmente éste método no se encuentra
disponible en México.
A1064
ESTUDIO PILOTO PARA EVALUAR
LA ADICIÓN DE METFORMIN
A UN RÉGIMEN DE CICLOS
SEMANALES DE BORTEZOMIB
SUBCUTÁNEO EN PACIENTES
PORTADORES DE MIELOMA MÚLTIPLE DE NOVO
Ramos Peñafiel CO*, Olarte Carrillo I*, Martínez Tovar A*, Aguilar
Mateos AM*, Fajardo Jiménez A*,
Collazo Jaloma J*.
* Hospital General De México.
leukemiachop@hotmail.com
INTRODUCCIÓN. La administración subcutánea de Bortezomib
es bien tolerada y reduce significativamente los eventos adversos.
Metformin ha demostrado efectos
antitumorales in vitro ejerciendo
influencia sobre la vía mTOR y
disminuyendo los niveles del factor
Nkß.
OBJETIVO. Establecer la eficacia y seguridad de la adición de
Metformin a un régimen de Bortezomib semanal.
MATERIAL Y MÉTODOS. Estudio prospectivo, longitudinal
experimental en pacientes portadores de MM de novo. La dosis de
bortezomib fue de 1.3mg/m2/SC los
días 1, 8, 15, 22 de cada ciclo por
un total de 4 ciclos planeados. La
dosis de Metformin fue de 850 mg
PO x 3, durante todo el régimen de
tratamiento. De manera profiláctica
se adicionó pregalabalina 75 mg
PO cada 24 h para la prevención
de la neuropatía. La dexametasona
se administró PO los días 1-4 y
8-11, plus talidomida 100 mg PO
de manera continua. Análisis estadístico. Se realizó estadística no
paramétrica con test ji-cuadrado.
Se realizó un análisis multivariado
supervivencia mediante curvas de
Kaplan Meier.
RESULTADOS. Se analizaron
5 pacientes. La mediana de seguimiento fue de 63 días (17-264 días).
La mediana de edad fue 53 años. El
60% correspondieron a ISSIII (n=3). El
60% debutó con fracaso renal (n=3),
siendo la anemia la manifestación
más constante (n=4). El tipo IgA fue
el mieloma más frecuente (80%)
seguido de IgG (20%). Un 60 %
(n=3) integró algún tipo de respuesta
favorable (2; VGPR y 1 RC). Hasta el
S121
Volumen 15, Suplemento 1, 2014
Revista de Hematología
momento no hay ninguna progresión
de la enfermedad. Un 20% (n=2) presentaron neuropatía grado I, ningún
evento de grado III/IV, 20% presentó
un solo episodio de neutropenia
y 20% síntomas gastrointestinales
(diarrea) asociados a Metformin. La
supervivencia global general fue del
78% a 250 días. Dos pacientes adquirieron influenza, falleciendo uno
de ellos. Tanto el puntaje ISS como la
falla renal al diagnóstico no impactaron sobre el pronóstico (p= 0.366,
p=0.317 respectivamente). Solo se
apreciaron cambios de coloración
en el sitio de la aplicación.
CONCLUSIONES. Metformin
es bien tolerado y no incrementa la
toxicidad asociada a bortezomib. El
régimen semanal muestra respuesta
favorable y baja toxicidad. El uso de
terapias biológicas incrementa el
riesgo de infecciones virales respiratorias, incrementando la morbilidad
y mortalidad.
A1174
PRINCIPALES CARACTERISTICAS
CLINICAS AL MOMENTO DEL
DIAGNÓSTICO EN PACIENTES
PORTADORES DE MIELOMA MULTIPLE DE NOVO Y SU IMPACTO
EN LA MORTALIDAD TEMPRANA.
EXPERIENCIAS DEL HOSPITAL
GENERAL DE MEXICO
Atrisco Ma Del Socorro R*, Ramos
Peñafiel C*, Guitiérrez M*, Ramos
Peñafiel C*.
* Hospital General De México.
socmary@live.com.mx
INTRODUCCIÓN. El MM es una
gamapatía monoclonal con un espectro clínico amplio, actualmente
la terapia con bortezomib es el
tratamiento de elección la cual incrementa la respuesta al tratamiento
e impacta con el riesgo de muerte.
Diversos factores como la hipoalbuminemia o la falla renal se han
establecido como parámetros que
incrementan el riesgo de muerte y
la morbilidad asociada.
S122
Objetivo. Establecer las principales características al diagnóstico
en pacientes con MM y establecer
el impacto de diversas variables con
el riesgo de muerte.
MATERIAL Y MÉTODOS. Estudio retrospectivo, observacional,
descriptivo y analítico en base de
registros médicos de pacientes portadores de MM. Análisis estadístico.
Test chi cuadrado considerándose
significativo un valor de p =0.05,
95% IC. Diferencia de medias por
prueba T-student y cálculo de Odds
Ratio
Resultados. Se estudiaron
un total de 102 pacientes, la mediana de edad fue de 59 años
(35-103años). En un 51% (n=52)
correspondió al género femenino.
No se encontró diferencia de media
de edad entre géneros (p=0.867),
tampoco se encontró diferencia en
el número de células plasmáticas
(p=0.618), ni calcio (p=0.814) o
DHL (p=0.542). El principal tipo de
MM es de IgG (63.7%), IgA (28.4%)
seguido de cadenas ligeras (5.9%) e
IgM (2%). Acorde al ISS el más frecuente fue el ISS III (58.8%) seguido
del ISSII (26.5%) e ISSI (14.7%). La
principal manifestación clínica fue
anemia (27.5%) seguida de fractura
aislada (13.7%) y fracturas múltiples
(14.7%). En cuanto a los tratamientos el principal régimen terapéutico
es talidomida-dex (74.9%) seguido
de la adición de melfalan (4.9%),
4.9% (n=5) con bortezomib y 2.9%
los pacientes requirieron radioterapia como coadyuvante terapéutico.
El contar con estadios avanzados
(ISSII o ISIII) no impactó con el
riesgo de muerte (p=0.461). La
elevación de creatinina se reportó
en un 34.6% de los casos (n=36).
La falla renal no impactó con el
riesgo de muerte (p=0.539) con un
Odds de 0.9. La hipoalbuminemia
tampoco mostró impacto sobre la
muerte (p=0.297, Odds 2.02).
Conclusiones. Al diagnóstico la mayoría de pacientes con MM
muestran factores de pronóstico
adverso pero que no influyen directamente con el riesgo de muerte.
Esto probablemente debido al pobre
acceso de la terapia de primera
línea con bortezomib. El fracaso
renal es frecuente pero solo generando secuela crónica en un 3.6%
de los casos.
A1195
PREVALENCIA DE DISCRASIAS DE
CELULAS PLASMATICAS EN PACIENTES MENORES DE 45 AÑOS.
EXPERIENCIA DE UN CENTRO
DEL NORESTE DE MEXICO
Cuervo Sierra J*, Gomez Almaguer
D*, Tarin Arzaga LDC*, Martinez
Hernandez RA*, Jaime Perez JC*,
Pequeño Luevano MP*.
* Universidad Autónoma De Nuevo
León. Servicio De Hematología.
Hospital “Dr José E Gonzalez”.
plus1996@gmail.com
INTRODUCCIÓN. Las discrasias
de células plasmáticas ocurren
generalmente en la sexta década
de la vida. Se han descrito prevalencias de mieloma múltiple del
8% en menores de 50 años y en
México reportamos prevalencias
del 23.6% en dicha población. Es
importante conocer las características de estos pacientes jóvenes
que constituyen una población
altamente productiva e identificarlos tempranamente para iniciar un
tratamiento adecuado.
OBJETIVO. Determinar la prevalencia de discrasias de células
plasmáticas en pacientes menores
de 45 años
Describir las características clínicas y de laboratorio en este grupo
de pacientes
MATERIAL Y MÉTODOS. Estudio descriptivo, retrospectivo. Se
incluyeron pacientes que asistieron
a la consulta de hematología del
Hospital Universitario “ Dr. José E
González “ UANL de Monterrey en
los años 2005 a 2012. Se registraron
Libro Educativo 55 Congreso Nacional de la Agrupación Mexicana para el Estudio de la Hematología, A.C.
datos clínicos y de laboratorio. Se
utilizó estadística descriptiva.
RESULTADOS. En total 15 de
123 pacientes tenían menos de
45 años (prevalencia: 12.2%). Se
clasificaron así: 9 mielomas, 4
plasmocitomas, 2 amiloidosis. El
AMO inicial tenía una media de
células plasmáticas de 19.3%. Solo
3 mielomas se subclasificaron (IgG
2 e IgE 1). La hemoglobina media
fue de 11 g/Dl, leucocitos de 8
272/uL y plaquetas de 394 750/
uL. La creatinina media fue de 0.8
mg/dL, calcio sérico de 12.56 mg/
dL, B2 microglobulina de 2.4 ng/
dL , proteínas totales de 6.84 g/
dL y albúmina de 3.88 g/dL. Se
pudieron clasificaron según DurieSalmon a 5 mielomas (3 IIIA y 2
IIIB). Como tratamiento inicial 10
recibieron tratamientos basados
en Talidomida/dexametasona y 5
otros tratamientos. Seis pacientes
alcanzaron RC (40%), 6 recibieron
mantenimiento con talidomida.
Cuatro pacientes se sometieron a
trasplante de médula ósea ( 3 auto,
1 allo). La supervivencia media fue
de 34.1 meses (2-92 meses)
CONCLUSIONES. Se observó
un porcentaje significativamente
alto de pacientes con discrasias
de células plasmáticas en este
grupo etareo comparado con
lo reportado en otros centros
(12.2% vs <5%). Esta población
se caracterizó por una hemoglobina similar a la del grupo mayor
de 45 años (11 vs 11.02 gr/dL),
menor compromiso renal (creatinina media de 0.8 vs 1.94 g/dL) ,
menos paraproteinemia (proteínas
de 6.84 vs 8.51 g/dL). La mayoría
se clasificaron como estadios
III(A y B). La supervivencia mediana fue ligeramente superior a
la de la población mayor de 45
años (31.25 vs 26.86 meses). La
mayoría recibieron tratamiento a
base de esteroides, talidomida y
dexametasona , demostrando que
es un tratamiento eficaz y seguro
en todos los grupos de edad.
HEMATOPOYESIS
PRESENTACIÓN ORAL
A1044
EFICACIA DE LA ADICIÓN DE
ANDRÓGENOS AL RÉGIMEN
INMUNOSUPRESOR EN PACIENTES PORTADORES DE ANEMIA
APLÁSTICA. ACTUALIZACIÓN
DE LA COHORTE DEL HOSPITAL
GENERAL DE MÉXICO.
Ramos Peñafiel CO*, Ferrer Argote
V*, León González G*, Trejo Antonio R*, Collazo Jaloma J*.
* Hospital General De México.
leukemiachop@hotmail.com
INTRODUCCIÓN. Actualmente el
tratamiento de la Anemia Aplástica
consiste en regímenes intensivos de
inmunosupresores al igual que el
trasplante de progenitores hematopoyéticos. Los andrógenos han
sido utilizados para el tratamiento
de los síndromes de falla medular
desde los años sesenta, pero en
la última década se describió su
efecto sobre el acortamiento de
los telómeros.
OBJETIVO. Establecer la eficacia y tiempo promedio de respuesta
del tratamiento con andrógenos
para el síndrome de falla medular.
MATERIAL Y MÉTODOS. Tipo
de estudio. Estudio retrospectivo, observacional analítico en la
cohorte de pacientes portadores
de Anemia Aplástica del Hospital
General de México. Análisis estadístico. Prueba no paramétrica chi
cuadrada (valor de p = 0.05, 95%
IC), la supervivencia se estableció
por las curvas de Kaplan-Meier.
RESULTADOS. Se estudiaron
63 pacientes con diagnóstico de
AA, la media de edad fue 47 años
(rango 18-83 años). Un total de
36.5% (n=23) eran de tipo moderado, 25.4% severa (n=16) y 38.1%
muy severa (n=24). La media de
leucocitos fue 2.3 x 103/uL (rango
0.5-4.6 x 103/uL) con una media
de neutrófilos de 0.601 x 103/uL
(rango 0 – 1.1 x 103/uL) y 20 x 103/
uL para plaquetas. En 57.2% (n= 35)
el cariotipo era normal, solo 3 casos
reportaron alteraciones citogenéticas (del 7q, poliploidias, trisomía
19, 16, 18). En 3 casos coexistía
una clona de HPN en conjunto
con la enfermedad. Respuesta al
tratamiento. De 27 pacientes que
integraron una RC (42.9%), 62%
contaba con algún inmunosupresor
en conjunto con los andrógenos
(ciclosporina, micofenolato de
mofetilo, prednisona). La media de
respuesta fue de 725 días (rango
331 – 1119 días), siendo menor en
aquellos con 3 inmunosupresores.
Solo un caso recibió tratamiento
con GAT presentando respuesta parcial a 8 meses. La RC se presentó en
39.1% de las AA moderadas (n=9),
43. 8% de las severas (n=7) y 45.8%
de muy severas (n=11). La media de
concentrados eritrocitarios previo a
la RC fue 11 (rango 9 -13 unidades).
Cuanto se utilizó más de 2 inmunosupresores se apreció 50% de
respuestas en comparación con solo
S123
Volumen 15, Suplemento 1, 2014
Revista de Hematología
un inmunosupresor (42.9%) pero
sin ser estadísticamente significativo
(p= 0.311, 95% IC). Supervivencia.
La supervivencia a 4 años de seguimiento fue del 86%, sin diferencias
significativas en cuanto a la severidad de la falla medular.
CONCLUSIONES. La adición
de andrógenos mejoró la tasa de
respuesta a los inmunosupresores
principalmente con AA muy severa. El tiempo general de respuesta
es largo requiriendo durante un
tiempo prolongado soporte transfusional.
PRESENTACIÓN CARTEL
A1019
CORRELACIÓN ENTRE EL NIVEL
DE FERRITINA SÉRICA Y EL RIESGO DE PREECLAMPSIA
Gutiérrez Aguirre CH*, García
Lozano JA*, Treviño Montemayor
OR**, Iglesias Benavides JL**, Cantú Rodríguez OG*, González Llano
O*, Gómez De León A*, Mancías
Guerra C*, Jaime Pérez JC*, Gómez
Almaguer D*.
*Servicio De Hematología Del
Hospital Universitario “Dr. José
Eleuterio González” U.A.N.L. **
Servicio de Obstetricia del Hospital
Universitario “Dr. José Eleuterio
González” U.A.N.L.
hematohu@yahoo.com
INTRODUCCIÓN. La Organización Mundial de la Salud
recomienda administrar hierro a
las mujeres embarazadas. En Latinoamérica, 30% de las mujeres
embarazadas desarrollan anemia
o deficiencia de hierro asociada al
embarazo. En el embarazo normal
los productos de peroxidación lipídica se encuentran elevados por
la gran actividad mitocondrial y
síntesis hormonal. Estos productos
se encuentran aun más elevados
en pacientes con preeclampsia o
diabetes gestacional. El hierro en
forma ferrosa, es uno de los principales factores en las reacciones de
iniciación y propagación de los fenómenos de peroxidación lipídica.
OBJETIVO. El objetivo del estudio fue demostrar la relación entre
los niveles de ferritina sérica y el
S124
riesgo de desarrollar preeclampsia
en mujeres que reciben hierro profiláctico durante el embarazo.
MATERIAL Y MÉTODOS. Estudio prospectivo, comparativo
y transversal. Se incluyeron pacientes embarazadas con más de
20 semanas de gestación (SDG) y
preeclampsia y un grupo control
de embarazadas sanas con más de
20 SDG. Se excluyeron pacientes
con procesos infecciosos o recientemente trasfundidas. Se midieron
los niveles de ferritina, transferrina,
hierro, glucosa, se realizó una citometría hemática y se compararon
los resultados entre ambos grupos.
RESULTADOS. Se incluyeron 16
pacientes con preeclampsia y 18 en
el grupo control. Todas tomaban
hierro profiláctico. La mediana de
edad, peso y SDG fue de 27 años
(rango 18-41), 87 kg (61.50-127)
y 36.2 SDG (22.3-40.5) para las
pacientes con preeclampsia y 25
años (19-39), 78 kg (56-98) y 39.2
SDG (37.3-42.6) en el grupo control, respectivamente. La mediana
de hemoglobina para las pacientes
con preeclampsia fue de 12.2 g/
dL (10.10-13.60) y para el grupo
control 11.55 g/dL (8.90-13.90).
La mediana de ferritina fue de
47.65 ng/mL en las pacientes con
preeclampsia y 11.80 ng/mL en el
grupo control (p=0.002). El 52.9%
de las pacientes con preeclampsia
presentaron una ferritina sérica
mayor de 40 ng/mL vs. 16.7%
en el grupo control (p=0.03). La
mediana de transferrina, hierro
y glucosa para las pacientes con
preeclampsia fue de 421.02 mg/dL
(324.64-580.72), 86 ug/dL (36-364)
y 76 mg/dL (62-98) mientras que
en el grupo control fue de 432.26
mg/dL (303.83-499.49), 71.50 ug/
dL (37-178) y 73 mg/dL (57-86)
respectivamente (p>0.05).
CONCLUSIONES. En el presente estudio encontramos correlación
entre niveles de ferritina sérica
mayores de 40 ng/ml y el desarrollo
de preeclampsia en mujeres que
reciben hierro profiláctico.
A1060
USO DE FACTORES DE CRECIMIENTO EN ENFERMEDAD DE
ALZHEIMER Y DEMENCIAS VASCULARES
Hernández Ayala LG*, Gutiérrez
Vázquez DFJ**, Hanon Esqueda
DJT**, Bermúdez Borja LC***,
Reyes Maldonado DE****, Vela
Ojeda DJ****.
* Patronato Banco De Ojos Y Tejidos
De Aguascalientes, A.C. ** Hospital
General ISSSTE Aguascalientes. ***
Consultoría Psicológica Privada.
**** Escuela Nacional de Ciencias
Biológicas IPN.
guicho_hernandez@yahoo.com
INTRODUCCIÓN. La enfermedad
de Alzheimer (EA) es un trastorno
neurodegenerativo progresivo. Durante los últimos cinco años se han
publicado trabajos donde se plantea el uso de células progenitoras
hematopoyéticas (CPH), así como
la aplicación de diferentes factores
Libro Educativo 55 Congreso Nacional de la Agrupación Mexicana para el Estudio de la Hematología, A.C.
de crecimiento como terapia regenerativa en esta enfermedad.
OBJETIVO. Determinar si la
aplicación de factores de crecimiento favorece el incremento de
CPH y se asocia con la mejora
cognitiva en pacientes con EA y
demencia vascular (DV).
MATERIAL Y MÉTODOS. Se
realizó un estudio piloto, clínico y
terapéutico, de fase II, longitudinal,
prospectivo, comparativo, participaron 10 pacientes que recibieron
su tratamiento farmacológico convencional y movilizaron con G-CSF,
eritropoyetina y atorvastatina. Al
sexto día, se les administró por vía
intravenosa sobrenadante de gel
plaquetario. Se realizaron valoraciones cognitivas, aplicando las
escalas MMSE de Folstein y ADAS
basal y a los 30, 60 y 120 días post
movilización. Se cuantificaron
las CPH (CD34+, CD133+) en
muestra basal y post movilización
por citometría de flujo. El análisis
estadístico realizado a este estudio
fue hecho utilizando el programa
SPSS versión 19, Chicago IL, USA.
Las comparaciones antes y después
de la aplicación del G-CSF, respecto a los valores totales de CPH, y
las escalas de ADAS y MMSE se
realizaron utilizando la prueba de
T pareada y U Mann Whitney que
dieron resultados semejantes.
RESULTADOS. De los 10 pacientes, 7 fueron mujeres y 3
hombres, 8 pacientes tuvieron EA
y 2 DV. La mediana de edad fue de
74 años (rango de 60 - 82). El grado
de daño demencial fue leve en un
enfermo, moderado en 7 y grave en
dos. Respecto a la cuantificación
de las CPH CD34+, CD133+ basal
y post movilización se obtuvo un
incremento significativo, así como
al comparar los resultados de las
escalas de MMSE y ADAS basales
con las realizadas a los 30, 60 y
120 días post aplicación del G-CSF.
CONCLUSIONES. El uso
de factores de crecimiento he-
matopoyético como G-CSF y el
sobrenadante de gel plaquetario,
indujeron incremento y movilización significativa de las CPH en
pacientes con EA y DV. Esto es relevante debido a que se ha reportado
que las CPH pluripotentes pueden
diferenciarse hacia tejido neural y
de esta forma promover la neoformación de tejido, lo que pudiera
explicar los resultados obtenidos.
De manera paralela se observó
mejoría en las funciones cognitivas
de dichos pacientes, evidenciada
por los resultados obtenidos en las
pruebas de valoración utilizadas,
MMSE de Folstein y ADAS COG.
A1151
EFICACIA DE LA GLOBULINA
ANTIMOCITO DE CONEJO MAS
CICLOSPORINA Y FACTOR EST IM UL ANTE DE C OLONIA S
GRANULOCITO EN NIÑOS CON
ANEMIA APLASICA ADQUIRIDA
Jiménez Hernández E*, Martínez
Villegas O*, Dueñas González M*,
Marín Palomares T*, Ortiz Fernández
A*, Berges García A*, Pérez Casillas
R*, Tiznado García H*, Jaimes Reyes
E*, Sánchez Jara B*, Ortiz Torres G*,
Martínez Villegas O*,
* Instituto Mexicano Del Seguro
Social.
elvajimenez@yahoo.com
INTRODUCCIÓN. La Anemia
Aplásica Adquirida (AAA) es un
padecimiento de baja incidencia,
aunque cobra importancia por su
elevada mortalidad. El tratamiento
de primera línea en niños que no
tienen donador familiar idéntico la
terapia inmunosupresora combinada (TIC) es la mejor opción
OBJETIVO. Conocer la eficacia
de la globulina de conejo (GATr)+ciclosporina (CsA) y Factor
estimulante de colonia granulocito (FEC-G), en niños con AAA y
compararlo con un grupo control
histórico que recibió TIC con GAL
de caballo (GAL-h)
MATERIAL Y MÉTODOS. Pacientes menores de 16 años con
diagnóstico de AAA tratados con
TIC con GAT-r entre Enero 2008 y
Octubre 2012 y un grupo control
histórico tratados previo a 2008
CON TIC con GAL-h, se evaluó respuesta completa (RC), parcial (RP) y
sin respuesta (SR), a 3, 6 y 12 meses en el Servicio de Hematología
Pediátrica UMAE CMN “La Raza”.
Se utilizó prueba Chi-cuadrada o
exacta de Fisher, La supervivencia
mediante curva de Kaplan-Meier,
comparación entre los grupos prueba de Long-rank
RESULTADOS. Total 76 pacientes, hombres 63%, más frecuente
entre 8.1 y 12 años (34%). Más
común la AAA muy grave (AAAMG)
59.2%. Del total de pacientes
11(14.5%) recibieron GAT-r y
65(85%) GAL-h. De los 11 con
GAT-r alcanzaron RC 3(27%), RP
5(46%) y SR 3(27%). Recibieron
un segundo ciclo 5 (29.5%) 2 que
recayeron y 3 con RP. Comparado
con los que recibieron GAL-h alcanzaron RC 13(20%), RP 23(35%)
y SR 29 (45%). Recibieron un
segundo ciclo 14 (2 por recaída y
el resto por RP). Los efectos secundarios más comunes fueron fiebre
y enfermedad del suero (94%),
más frecuente con la GAL-h y solo
un paciente se transformó a SMD
y finalizó con LMA. Las causas
de muerte mas comunes fueron
hemorragia (43%) y sepsis (36%).
La SG por grupos de gravedad en
la AAAG de 49.6% comparada con
52.6% para la AAAMG a 6.2 años
de seguimiento con una p=0.886,
y de acuerdo al tipo de GAL para
GAL-r viven 72.7% con una mediana de seguimiento de 1792 días
y para GAL-h viven el 53.8% con
mediana de seguimiento de 2309
días (p=0.799)
CONCLUSIONES. Aunque la
supervivencia global está a favor
de la GAL-r, los resultados se deben
tomar con reserva, por el número
S125
Volumen 15, Suplemento 1, 2014
Revista de Hematología
de pacientes y el tiempo de seguimiento entre ambos grupos. Se
requiere de un ensayo clínico aleatorizado e incrementar el tiempo de
seguimiento. Al comparar nuestros
resultados con otros grupos internacionales nuestra supervivencia
es más baja.
A1165
BAD BUGS: ALTERACIONES MORFOLÓGICAS EN MÉDULA ÓSEA
EN PACIENTES PORTADORES DE
INFECCIÓN POR VIRUS DE INMUNODEFICIENCIA ADQUIRIDA
Y NEUMONÍA ATÍPICA DURANTE
LA PANDEMIA DE INFLUENZA
DEL 2013
Ramos Peñafiel CO*, García Arroyo
A**, Salcedo Roldán M**, Galvan
Flores F**, Cabrera García Á*, Balderas Delgado C*, Collazo Jaloma
J*, Rozen Fuller E*.
* Hospital General De México. **
Hospital General de Cuautitlán.
leukemiachop@hotmail.com
INTRODUCCIÓN. Durante infecciones de tipo viral, las citopenias
aisladas o múltiples se presentan
hasta en un 30% de los casos, una
práctica frecuente es la toma de
médula ósea por aspiración principalmente por médicos infectólogos
y médicos internistas sin una justificación específica. Hallazgos de
dishemopoyesis se han descrito
hasta en un 69% de infecciones
virales (VIH) asociándose con progresión de la enfermedad. Hasta el
momento no hay descripción en
la literatura de los cambios hematológicos en pacientes portadores
de infección por virus de influenza
H1N1.
OBJETIVO. Describir los principales hallazgos en frotis de médula
ósea tanto en pacientes portadores
de infección por virus de inmunodeficiencia humana como infección
por virus influenza tipo A H1N1
MATERIAL Y MÉTODOS. Estudio ambilectivo, observacional
descriptivo en pacientes portadores
de infección por virus de inmunodeficiencia humana y neumonía
atípica asociada a virus tipo influenza. Análisis estadístico. Se
utilizó solamente estadística descriptiva para el establecimiento de
frecuencias
RESULTADOS. Pacientes con
VIH: Se estudiaron 155 frotis, siendo la principal indicación de toma
citopenias aisladas o múltiples, del
total de las muestras tomadas, solo
un tercio fue valorable, el 80% de
los pacientes correspondieron al
género masculino y 20% al género
femenino. La celularidad se encontró disminuida en un 66% de los
casos, 37% mostraron disminución
en megacariocitos. Solo se reportó
un caso de leucemia mieloide
aguda. En un 76% se mostró un
incremento en el porcentaje de
células plasmáticas, granulación
tóxica en un 37% y solo en un 24%
hallazgos morfológicos de displasia.
Solo en 2 casos se demostró hemofagocitosis y en otros dos casos
blastos de aspecto linforreticular.
Pacientes portadores de neumonía
atípica: Se estudiaron 5 frotis de
pacientes portadores de neumonía atípica asociada a influenza
H1N1, en un 25% (n=1) se mostró
disminución en la celularidad, 50%
demostró granulación tóxico infecciosa. La cifra de megacariocitos se
encontró normal en un 80% (n=4)
encontrándose disminuidos en un
caso, un hallazgo constante fue los
grumos plaquetarios al igual que
anormalidades displásicas en los
eritroblastos (100%). En los 5 casos
se mostró disminución significativa
en la cifra de linfocitos
CONCLUSIONES. Los cambios
dishemopoyéticos son constantes
en pacientes con infecciones virales tanto por VIH como influenza
H1N1, principalmente en la última
en el linaje eritroide, otros hallazgos
con linfopenias severas y en algunos
casos con HIV la presencia de hemofagocitosis. El estudio de médula
ósea es útil cuando es realizado
por personal capacitado para la
toma y es de utilidad en el abordaje
diagnóstico.
HEMOSTASIA Y TROMBOSIS
PRESENTACIÓN ORAL
A1022
NUEVOS FACTORES DE RIEGO PARA
EL DESARROLLO DE PÚRPURA
TROMBÓTICA TROMBOCITOPÉNICA EN PACIENTES CON LUPUS
ERITEMATOSO GENERALIZADO
Merayo Chalico J*, Demichelis Gómez R*, Gómez Martín D*, Aparcio
L*, Rajme S*, Alcocer Varela J*.
S126
*Instituto Nacional De Ciencias Médicas Y Nutrición Salvador Zubirán.
robertademichelis@gmail.com
INTRODUCCIÓN. La asociación
de PTT y LEG es poco común, y es
compleja en la mayoría de las ocasiones diferenciar ambos cuadros ya
que comparten características clíni-
cas semejantes. Se realizó estudio
retrospectivo de casos y controles.
Los pacientes con PTT fueron
diagnosticados con al menos la
presencia de anemia hemolítica microangiopática y trombocitopenia.
Los pacientes con LEG presentaron
al menos 4 criterios según los criterios del ACR.
Libro Educativo 55 Congreso Nacional de la Agrupación Mexicana para el Estudio de la Hematología, A.C.
OBJETIVO. El objetivo de este
estudio es determinar los factores
de riesgo para el desarrollo de púrpura trombocitopénica trombótica
en pacientes con lupus eritematoso
generalizado.
MATERIAL Y MÉTODOS. Se reclutaron 92 pacientes, definiéndose
tres grupos de estudio diferentes:
pacientes con asociación de PTT
y LEG (casos, n= 22); y dos grupos
controles: 1) pacientes con PTT de
origen no autoinmune (n=22) y 2)
pacientes con LEG sin presencia de
PTTP (n=42).
RESULTADOS. En el análisis
multivariado, presencia de Hb
<7g/dL [OR 6.81 (1.72 – 26.9)],
linfopenia <1 000/uL [OR 5.76
(1.23 – 26.8)] y cifras bajas de bilirrubina indirecta fueron variables
asociadas a la presencia de PTT y
LEG. El análisis de supervivencia
demostró que los pacientes con LEG
y PTT presentaron mayor sobrevida
que el grupo de PTT no autoinmune
(p=0.033). Los pacientes con PTT y
LEG presentaron mayores puntajes
de SLEDAI tres meses previos al
evento, al ser comparados con LEG
sin PTT que hubieran sido hospitalizados por otra causa (p=0.002);
así mismo la linfopenia menor de
1,000 [OR 19.84, (IC 95% 1.19
- 32.89)] y las cifras plaquetarias
bajas al momento del evento,
resultaron factores de riesgo indepedientes para el desarrollo de PTT
en pacientes con LEG. Los pacientes
hospitalizados por PTT y LEG presentaron mayor riesgo de muerte
que aquellos hospitalizados por
alguna otra causa diferente a PTT
[OR 10.01 (IC 95% 1.23 – 20.39)]
CONCLUSIONES. La linfopenia
es un factor de riesgo independiente
para el desarrollo de PTT y LEG.
Aunado a lo anterior, es probable
que los pacientes con LEG y que
presentan PTT, tengan cuadros
con características clínicas menos
evidentes, por lo que el nivel de
sospecha de PTT en estos pacientes
debe de ser alto para evitar retraso
en el tratamiento. El presente estudio es el primero realizado en
población hispana.
A1058
TROMBOFILIA PRIMARIA EN
MÉXICO X: ESTUDIO PROSPECTIVO DEL TRATAMIENTO DEL
SÍNDROME DE LAS PLAQUETAS
PEGAJOSAS
Gonzalez Ramírez MP*, Martagón
Herrera NA*, Hernández Reyes J*,
Labastida Mercado N*, Galindo
Becerra LS*, Ruiz Delgado GJ*, Ruiz
Argüelles GJ*,
* Centro De Hematología Y Medicina Interna, Clínica Ruiz Puebla.
glez_monica2@hotmail.com
INTRODUCCIÓN. El síndrome
de las plaquetas pegajosas (SPP)
es una causa común de trombosis
y actualmente no existen estudios
prospectivos sobre su tratamiento.
OBJETIVO. Analizar los cambios presentes en las plaquetas
hiperagregables de pacientes con
síndrome de plaquetas pegajosas,
quienes recibieron tratamiento
con fármacos antiplaquetarios para
evaluar su asociación con eventos
trombóticos post – tratamiento.
MATERIAL Y MÉTODOS. Se
estudiaron de manera prospectiva
55 pacientes con al menos un
marcador clínico de trombofilia
primaria asociado a la presencia
del fenotipo de SPP: 17 hombres y
38 mujeres. De los 55 pacientes, 53
recibieron inicialmente tratamiento
con aspirina y 2 con clopidogrel.
RESULTADOS. La mediana
de edad fue de 49 años. Todos
los pacientes cumplían con los
criterios de un estado de hipercoagulabilidad primaria. De los 55
pacientes, 35 resultaron tener SPP
tipo I, 3 tuvieron SPP tipo II y 17
SPP tipo III. 48 de los 55 pacientes
mostraron hiperagregabilidad a la
mayor dilución de ADP, mientras
que 30 de los 55 mostraron hipe-
ragregabilidad a la mayor dilución
de epinefrina. A 13 pacientes
se les cambió el tratamiento de
aspirina a clopidogrel + aspirina,
ya que la hiperagregabilidad no
revirtió después de 4 semanas de
haber iniciado el tratamiento. Los
pacientes fueron seguidos durante
1 a 129 meses, con mediana de
13 meses. 40 pacientes recibieron
tratamiento únicamente con aspirina, 13 aspirina + clopidogrel y
2 solamente clopidogrel. Las respuestas plaquetarias a los agentes
agregantes disminuyeron de manera
significativa con el tratamiento antiplaquetario y sólo dos pacientes
tuvieron re-trombosis a los 52 y
259 meses de haber iniciado el
tratamiento; la supervivencia libre
de re-trombosis de todo el grupo estudiado fue de 96.4% a 129 meses.
CONCLUSIONES. Usando
antiagregantes plaquetarios se
puede revertir la hiperagregabilidad plaquetaria de pacientes con
el fenotipo de SPP; esto se traduce
en una reducción significativa de
los eventos trombóticos posteriores.
A1124
NIVELES DE FvW Y SU ASOCIACIÓN CON ENFERMEDAD
VASCULAR CEREBRAL EN ADULTOS MAYORES DE 50 AÑOS.
Gomez Avila VM*, Zavala Hernández C**, Rosales Cruz E*,
Hernandez Zamora E*, Nieto Gomez C**, Gutierrez Mendoza C**,
Ramirez Flores C**, Saldaña Garcia
M**, Cervera Bustamante M**, Reyes Maldonado E**.
* Instituto Politécnico Nacional/
ENCB. ** Instituto Nacional de
Rehabilitación.
victorqbp@hotmail.com
INTRODUCCIÓN. El Factor de von
Willebrand (FvW) es una glicoproteína que se encuentra de manera
constitutiva en el endotelio y participa en la adhesión y agregación
plaquetaria y transporta al FVIII. El
S127
Volumen 15, Suplemento 1, 2014
Revista de Hematología
FvW se ha utilizado como indicador
de daño endotelial, debido a que
a pesar de que se puede encontrar
en el torrente sanguíneo unido al
FVIII o dentro de los gránulos alfa
de las plaquetas, la mayor cantidad
se encuentra almacenada dentro
de los cuerpos de Weibel-Palade
localizados en el citoplasma de
las células endoteliales. Cuando hay daño en estas células, se
compromete la integridad de la
membrana liberando su contenido
citoplasmático (entre este, elFvW)
al torrente sanguíneo. Por lo tanto,
a mayor daño, mayores niveles de
FvW en el torrente sanguíneo. El
daño endotelial favorece las complicaciones cardiovasculares de la
hipertensión, acelera la progresión
de la aterosclerosis, así como otras
patologías como falla renal, desarrollo de isquemia cardíaca aguda
y enfermedad vascular cerebral.
OBJETIVO. Determinar los niveles de FvW en voluntarios mayores
de 50 años y su asociación con factores de riesgo propios de la edad.
M AT E R I A L Y M É TO D O S .
Los sujetos estudiados fueron
seleccionados por muestreo no
probabilístico. Se incluyeron adultos de 50 años o mayores de ambos
géneros. A cada uno se les realizó
historia clínica y se obtuvo muestra
sanguínea en tubos con citrato de
sodio al 3.8%, se separó el plasma
donde es determinaron los niveles
plasmáticos del FvW por métodos
inmunoturbidimétricos. Así mismo,
se determinó el grupo sanguíneo.
El análisis estadístico se realizó
utilizando el programa GraphPadPrism 5.
RESULTADOS. Se captaron 149
sujetos (72 mujeres y 77 hombres)
con un intervalo de edad de 50 a
98 años. Las medianas de FvW para
sujetos sin patologías fue de 125%,
mientras que en sujetos con alguna
o varias patologías fue de 132% sin
diferencia significativa. Los niveles
de FvW se incrementaron con la
S128
edad y fueron significativamente
más elevados en sujetos del grupo sanguíneo O. El incremento
en niveles de FvW se asocio con
enfermedad vascular cerebral con
riesgo relativo de 3.7 veces. No se
encontró relación con algún otro
factor de riesgo.
CONCLUSIONES. Los niveles
elevados de FvW se asociaron con
enfermedad vascular cerebral con
un riesgo relativo de 3.7 veces.
A1135
SINOVIORTESIS QUÍMICA CON
OXITETRACICLINA EN PACIENTES
CON ARTROPATÍA HEMOFÍLICA
Y/O SINOVITIS CRÓNICA, EXPERIENCIA EN UMAE PEDIATRÍA
CMNO
Hurtado Llamas RM*, Soto Padilla
JM*, Toro Castro JL*, Jaloma Cruz
AR*, Ortega R*, Troyo R**.
* IMSS/UNAM. ** U de G.
reyman_hu@hotmail.com
INTRODUCCIÓN. Las hemartrosis recurrentes son un problema
común en pacientes hemofílicos
con sinovitis crónica y artropatía, y si no se da un tratamiento
eficiente se producirá más daño
articular y evolución a artropatía
terminal. El tratamiento de estas
complicaciones incluye terapia
de reemplazo de factor (profilaxis
secundaria), cuidados de la articulación, y anti-inflamatorios.
Cuando estas medidas fallan,
una excelente alternativa es la
sinoviortesis química con oxitetraciclina o rifampicina, de acuerdo
con excelentes resultados que se
han reportado previamente (Bernal-Lagunas, Fernández-Palazzi).
Contradictoriamente este tratamiento no se realiza en muchos centros
hospitalarios, a pesar de que existe
una cantidad importante de niños
y adolescentes con hemorragias
recurrentes en articulación diana.
OBJETIVO.Valorar la efectividad y seguridad de la sinoviortesis
química con oxitetraciclina en niños hemofílicos con hemartrosis
recurrentes en UMAE Pediatría del
CMNO.
MATERIAL Y MÉTODOS. Mediante un diseño prospectivo, se
dio seguimiento de niños hemofílicos con hemartrosis recurrente
tratados con sinoviortesis química
con oxitetraciclina en la UMAE
Pediatría del CMNO en el período
abril-septiembre 2013. Criterios de
inclusión: hemofílicos menores de
16 años, sin inhibidor, con hemorragia recurrente en articulación diana,
firma de consentimiento informado
por padres o tutor. El tratamiento
consistió en aplicación de oxitetraciclina intra-articular (100-250 mg)
por 3 a 5 dosis (rodillas:5, codos/
tobillos:3). La seguridad se evaluó
mediante la frecuencia de efectos
adversos (dolor, infección, hemorragia, etc.). La efectividad se evaluó
en términos de disminución en la
frecuencia mensual de hemartrosis
y en mejoría de la función articular,
medida por el instrumento clínico
de la FMH, para el análisis estadístico de estas variables se realizó
prueba Wilcoxon.
RESULTADOS. Fueron tratadas
23 articulaciones, de 13 pacientes
(edades 6-15 años). Seguimiento de
3-8 meses (desde el término del tratamiento hasta el cierre del estudio).
Seguridad: 79.5% de los pacientes
presentó dolor leve a moderado y
19.5% refirió dolor intenso, no se
presentaron otros efectos adversos.
Efectividad: Se observó disminución
significativa del número de hemorragias mensual post-tratamiento
(p<0.001), asimismo, el puntaje medido por el instrumento clínico de la
FMH disminuyó significativamente
(p<0.00001), reflejando mejoría en
la función articular.
CONCLUSIONES. Los resultados fueron favorables en el 100%
de los pacientes tratados, con
significancia estadística, y sugieren
que la oxitetraciclina es una exce-
Libro Educativo 55 Congreso Nacional de la Agrupación Mexicana para el Estudio de la Hematología, A.C.
lente opción para el tratamiento
de las hemartrosis recurrentes en
la sinovitis y artropatía hemofílica,
y debería de considerarse siempre
que no respondan con tratamiento
conservador y no haya contraindicación,, teniendo especial atención
en el manejo del dolor.
A1168
DETERMINACIÓN DE JAK2V617F
EN UNA MUESTRA ANIDADA EN
UNA COHORTE DE PACIENTES
ALTAMENTE TROMBOGÉNICOS
Ignacio Ibarra G*, Arana Trejo R**.
* Instituto Mexicano Del Seguro
Social. ** Laboratorio de Análisis de
Oncohematología.
gregignacio@telmexmail.com
INTRODUCCIÓN. La trombosis
es la causa más frecuentes de
morbi-mortalidad en el grupo
de neoplasias mieloproliferativas
(NMPs) y se ha atribuido a la presencia de JAK2V617F. La mutación
genera alteraciones en la función
de los megacariocitos y las plaquetas asociada a la expresión de
JAK2V617F. Se ha identificado la
mutación de JAK2V617F en células
endoteliales de hígado de pacientes
con síndrome de Budd-Chiari, lo
que sugiere que la expresión de
JAK2V617F contribuye de manera
directa a incrementar el riesgo de
trombosis. Existe una proporción
alta de pacientes con trombofilia
que no tienen una causa demostrada.
OBJETIVO. Determinar la incidencia de JAK2V617F como
determinante o contribuyente de
trombosis en una muestra de pacientes altamente trombogénicos.
MATERIAL Y MÉTODOS. Estudio de corte transversal de una
muestra anidada en una cohorte.
Pacientes altamente trombogénicos
de largo seguimiento en una clínica
de trombosis y hemostasia, con más
de un evento trombótico grave de
un hospital de concentración. Pa-
cientes estudiados para deficiencia
de proteína C, S antitrombina III,
resistencia a la proteína C, hiperomocistinemia y mutación del
factor V de Leiden. Todos con datos
clínicos corroborados de trombosis
venosa y arterial, en tratamiento con
anticoagulación formal. Se realizó
extracción de DNA en sangre periférica utilizando trizol y un kit
comercial de Quiagen® y identifica
la mutación de JAK2V617F por
dos técnicas específico de alelo y
restricción enzimática utilizando
enzima BsaXI con sitio de restricción presente en el exón 14 de JAK2
nativo. Se realizan mediciones de
dispersión y frecuencias.
RESULTADOS. Se analizaron
108 pacientes, 64 femeninos y 44
masculinos, edad promedio 56
años. Una media de seguimiento de
5 años un rango de 2-15 años. No
se encontró en ningún caso la presencia de la mutación JAK2V617F.
CONCLUSIONES. En esta
muestra de pacientes altamente
trombogénicos no se encontró la
mutación JAK2V617F. Tenemos
una muestra representativa de una
población altamente trombogénica;
el no tener la mutación JAK2V617F,
hace suponer que la frecuencia en
la población abierta es muy baja.
Por otro lado, en pacientes con
NMPs la frecuencia de la mutación
JAK2V617F es alta y se asocia a un
incremento del riesgo de trombosis.
También hay una doble expresión
BCR-ABL/JAK2 V617F. Estas diferencias plantean la pregunta ¿la
mutación JAK2V617F es pre existente o adquirida, como parte de la
evolución clonal de las NMPs. Se
requiere ampliar la muestra y el monitoreo de la mutación JAK2V617F
en las NMPs, que además será
determinante en la profilaxis de la
trombosis.
A1170
GENERACIÓN DE TROMBINA Y
CINÉTICA DE INHIBICIÓN COMO
PARÁMETROS DE RESPUESTA AL
TRATAMIENTO Y ASOCIACIÓN
DE MARCADORES GENÉTICOS
CON EL DESARROLLO DE INHIBIDORES EN PACIENTES CON
HEMOFILIA A GRAVE
Luna Záizar H*, Jaloma Cruz
AR********, Esparza Flores MA****,
Bergés García A*****, Soto Padilla
JM****, Aguilar López LB**********,
Rodríguez Zepeda MDC******,
Pompa Garza MT*******, González
Ramos IA**, Beltrán Miranda CP***.
* CUCEI/Universidad De Guadalajara. ** Doctorado en Genética
Humana, CUCS, U de G. *** CUSUR, U de G. **** UMAE, H Ped,
CMNO, IMSS, Guadalajara. *****
CMN La Raza, IMSS, DF. ******
CMN Siglo XXI, IMSS, DF. *******
UMAE 25 IMSS, Monterrey, NL.
******** División de Genética,
CIBO, Guadalajara, Jalisco, México.
********* UMAE, H. Espec. CMNO,
Guadalajara. ********** UMAE
145, H. Espec. CMNO, IMSS,
Guadalajara.
hiluna90@yahoo.com.mx
INTRODUCCIÓN. El tratamiento de elección en pacientes con
hemofilia e inhibidores es la terapia con agentes de bypass tales
como concentrados de complejo
protrombínico (CCPA) o factor VII
recombinante activados (rFVIIa),
no ampliamente disponibles en
México.
OBJETIVO. Utilizar el ensayo de
generación de trombina (TGA) y la
cinética del inhibidor para evaluar
la respuesta al tratamiento con FVIII
o CCPA así como marcadores genéticos en pacientes con HA grave e
inhibidores.
MATERIAL Y MÉTODOS. Se
estudiaron 207 pacientes con HA
de 164 familias procedentes de
20 estados de la República. Los
inhibidores al FVIII se investigaron
por el método Nijmegen-Bethesda
y la cinética de inhibición por
diluciones seriadas en plasma. La
S129
Volumen 15, Suplemento 1, 2014
Revista de Hematología
generación de trombina (GT) se
midió por Trombografía Calibrada
Automatizada (CAT) en plasmas positivos a inhibidor incubados con el
producto terapéutico: FVIII y CCPA:
Feiba™. La evaluación clínica de
la respuesta fue realizada por 30
hematólogos de 29 instituciones. La
identificación de los polimorfismos
se realizó de acuerdo a Kogan et al.
y Lalloz et al. Los datos se analizaron por ANOVA, Student o Fisher.
RESULTADOS. A partir de 189
pacientes con HA grave, 70% de
presentación familiar y 30% esporádicos, se detectaron 47 pacientes
(24.9%) con inhibidores de altarespuesta (5-1,700 U-NB/mL) y 25
(13.2%) con anticuerpos de baja-
respuesta (0.6-4.7 U-NB/mL). De
acuerdo a su patrón de inhibición
se clasificaron los inhibidores como
tipo I en 34, tipo II en nueve y tipo
III en 7 pacientes (68%, 18% y 14%
respectivamente). Los valores promedio de potencial endógeno de
trombina (ETP) mostraron diferencia
significativa entre inhibidores tipo
I y II/III (P=0.0001). Se encontró
asociación entre el tipo de inhibidor y la respuesta clínica al FVIII
(P=0.0049) o frente a la respuesta
in vitro al FVIII (P=0.0007). Todos
los plasmas con inhibidores mostraron respuesta dosis-dependiente
a CCPA La concordancia entre hermanos que desarrollaron o no
inhibidores fue de 82.1%. Los casos
familiares mostraron seis haplotipos
con distribución diferencial.
CONCLUSIONES. La evaluación de la capacidad de formación
de trombina en plasma predijo la
respuesta a la terapia con FVIII
o APCC. El patrón de inhibición
de los anticuerpos al FVIII:C correlacionó con los parámetros
de GT y mostró asociación con
la respuesta clínica al FVIII. TGA
permite la optimización individual
de recursos en pacientes con HA
grave e inhibidores de alto título.
Se evidenció el factor genético al
desarrollo de inhibidores por la
alta concordancia entre hermanos
y la distribución diferencial de
haplotipos del gen F8.
PRESENTACIÓN CARTEL
A1003
EXPERIENCIA EN EL TRATAMIENTO DE LA PÚRPURA
TROMBOCITOPÉNICA INMUNE
EN EL CMN “20 DE NOVIEMBRE”.
Lopez Hernandez MA*, Medina
Guzman L*, Alvarado Ibarra M*,
Álvarez Vera JL*.
*Centro Médico Nacional 20 de
Noviembre, ISSSTE.
lopema@prodigy.net.mx
INTRODUCCIÓN. La púrpura
trombocitopénica inmune (PTI)
es un padecimiento relativamente
frecuente. Es objeto de múltiples
tratamientos, novedosos o no. Suele manejarse con corticoides, en
primera línea, y otros varios si no
hay respuesta.
OBJETIVO. Evaluar la seguridad
y eficacia de tratamientos de primera y segunda línea para la PTI en
mayores de 15 años.
MATERIAL Y MÉTODOS. Estudio retrospectivo. Se incluyeron
pacientes con PTI de enero 2001
a diciembre del 2011. Las variables estudiadas: edad, sexo; sitio y
S130
magnitud de las hemorragias; comorbilidades iniciales o asociadas
al tratamiento; defunciones y sus
causas. Se registraron y clasificaron
todas las respuestas a los distintos
tratamientos. Se consideró respuesta
completa a una cuenta plaquetaria
superior a 100 000/Ul; respuesta
parcial si la cuenta de plaquetas
fue de 30 000/Ul a 100 000/Ul y
falta de respuesta si la cuenta fue
<30 000/Ul. Se cuantificó el tiempo
de respuesta. Manejo de primera
línea: corticoides (Prednisona ó
Hidrocortisona) ó inmunoglobulina
G (IgG). Segunda línea: se usaron
esplenectomía, rituximab, danazol,
inmunosupresores (ciclofosfamida,
azatioprina ó micofenolato) y danazol. Se indagaron complicaciones
al tratamiento
RESULTADOS. Se incluyeron
116 pacientes. Mujeres 74%. Edad
media 45 años (15-90). La media
inicial de plaquetas fue 28 X 1
000/Ul (0/Ul-90/Ul). En los sobrevivientes la media de seguimiento
fue 19 meses (12-120). En el tratamiento de primera línea se usaron
corticoides (n=108) ó IgG (n=8).
Fueron curados 59 (51%). La mediana de respuesta sucedió en 26
días; existieron tres defunciones
(3%) por hemorragia intracraneana.
Hipertensión e hiperglucemia (10 y
9), fueron las complicaciones encontradas. Recibieron tratamiento
de segunda línea 54 pacientes. La
mayoría cursó con púrpura remitente; el número máximo de recaídas
fue 4. El tratamiento más frecuente
fue la esplenectomía. Ninguno
mostró tener más eficacia (p= 0.55);
la mediana en la presentación de
la respuesta fue de 3 meses. Resultados finales globales: curación
82%, remisión parcial 3%, púrpura
remitente 10%, púrpura refractaria
2%. Complicaciones asociadas:
infecciones, citopenias, elevación
de transaminasas y pancreatitis 7,
4, 2, 1, respectivamente.; todas se
relacionaron al empleo de inmunosupresores.
CONCLUSIONES. El tratamiento de primera línea es suficiente para
curar a la mitad de los enfermos. Los
de segunda línea, frecuentemente
Libro Educativo 55 Congreso Nacional de la Agrupación Mexicana para el Estudio de la Hematología, A.C.
más de uno, fueron efectivos en
31% de los casos. La púrpura remitente fue la modalidad más usual en
los no curados.
A1028
DABIGATRÁN VERSUS ACENOCUMARINA EN EL TRATAMIENTO
DE LA TROMBOFILIA PRIMARIA
Morales Maravilla A*, Herrera Olivares W**, Perez Figueroa C**, Juan
Lien Chang LE***.
* ISSSTEP - SSEP. ** Centro Médico
de los SSEP*** Unidad de Oncología, SSEP.
maramorad@gmail.com
INTRODUCCIÓN. Los eventos
trombóticos son la primera causa
de muerte en la población a nivel
mundial, a temprana edad, son
generalmente causados por una
trombofilia primaria. En nuestra institución, la frecuencia de
trombofilias se ha incrementado,
posiblemente debido a la existencia
de mejores métodos de diagnóstico.
La existencia de nuevos anticoagulantes orales evita la necesidad de
restricciones dietéticas y vigilancia
por medio de laboratorio, estudios
preliminares muestran que no hay
riesgo aumentado de sangrados
iatrogénicos.
OBJETIVO. Compara la eficacia
y seguridad de dabigatrán versus
acenocumarina en el tratamiento
de los pacientes diagnosticados
con trombofilia primaria en nuestras
instituciones.
MATERIAL Y MÉTODOS. Criterios de inclusión: Pacientes con
diagnóstico de trombofilia primaria, que iniciaron tratamiento
con dabigatran 110mg c/12h, con
consentimiento informado firmado.
Pacientes con trombofilia primaria
manejados con acenocumarina
después de tratamiento inicial con
enoxaparina 1mg/kg/día hasta resolución del cuadro clínico agudo, la
dosis de acenocumarina se ajustó
de acuerdo a vigilancia mensual
con TP e INR. Criterios de exclusión: pacientes con trombofilia
secundaria agregada, o con factores
de riesgo cardiovascular, intolerantes al dabigatrán, insuficiencia
cardiaca o hepática. Criterios de
eliminación: pacientes que se negaran a continuar con el estudio.
Se realizó seguimiento clínico
durante un periodo de 24 meses a
los pacientes con diagnóstico de
novo que recibieron dabigatrán, se
analizó el expediente clínico del
grupo con acenocumarina durante
los primeros 24 meses desde el
inicio del tratamiento.
RESULTADOS. Se incluyeron
42 pacientes con diagnóstico de
trombofilia primaria, 28 mujeres y
14 hombres, edad promedio de 39
años (rango 15-57), 20 pacientes
recibieron dabigatrán, 22 pacientes
recibieron acenocumarina, un paciente de éste último grupo falleció
por accidente de tránsito. Los sitios
más frecuentes de trombosis fueron:
Miembros pélvicos 30(73%), SNC:
4 (9%), suprahepáticas: 3 (7%) Subclavias 2(4.8%) Pulmonar 2 (4.8%).
Ningún paciente del grupo dabigatrán presentó evento trombótico o
hemorrágico. De los pacientes del
grupo acenocumarina: 6 (28%)
presentaron eventos hemorrágicos
a nivel del tubo digestivo, 2 (10%)
presentaron nuevos eventos trombóticos en miembros pélvicos.
CONCLUSIONES. El uso de
dabigatrán en el manejo de la trombofilia primaria, parece ser seguro y
no se observó aumento de los eventos hemorrágicos o de re-trombosis e
el grupo utilizado, además su uso no
requiere de estudios de laboratorio
frecuentes ni requiere restricciones
dietéticas. Se requiere de estudios
con un número significativamente
más grande de pacientes para validar
dicha tendencia.
A1032
NIVELES DE HOMOCISTEÍNA Y
SU ASOCIACIÓN CON HIPER-
TENSION ARTERIAL EN ADULTOS
MAYORES
Gomez Ávila VM*, Rosales Cruz
E*, Gonzales Espinosa L*, Zavala
Hernandez C**, Hernandez Zamora
E**, Reyes Maldonado E*.
* Instituto Politécnico Nacional/
ENCB. ** Instituto Nacional de
Rehabilitación.
victorqbp@hotmail.com
INTRODUCCIÓN. La homocisteína (Hcy) se considera un agente
oxidante que altera las proteínas del
sistema de la coagulación. Concentraciones altas de Hcy en plasma
producen hiperhomocisteinemia
(HHcy), que en la población general
pueden predisponer al desarrollo de
enfermedades cardiovasculares. En
adultos mayores se sabe que existe
mayor incidencia de HHcy por
alteraciones en el metabolismo u
hormonales así como por disfunción renal. La hipertensión arterial
(HTA) es una condición en la que la
pared arterial aumenta su rigidez y
resistencia al flujo sanguíneo, esto
ocasiona que el corazón lata con
más fuerza y aumente la presión
de la sangre que sale del corazón.
La hipótesis de que la HHcy puede
desempeñar un papel en la patogénesis de la hipertensión arterial se
basa en el hecho de que la Hcy induce: vasoconstricción, disfunción
renal y aumento de reabsorción
de sodio, genera radicales libres
que ocasionan lesión endotelial,
estimula la proliferación de células
musculares lisas y altera las propiedades elásticas de la pared vascular.
OBJETIVO. Determinar los niveles de Hcy en voluntarios mayores
de 50 años y la asociación con factores de riesgo propios de la edad.
MATERIAL Y MÉTODOS. Los
sujetos fueron seleccionados por
muestreo no probabilístico. Se
incluyeron adultos de 50 años o
mayores de ambos géneros. A cada
uno se les realizó historia clínica y
obtuvo muestra sanguínea en tubos
S131
Volumen 15, Suplemento 1, 2014
Revista de Hematología
con EDTA. Se separó el plasma y determinaron los niveles plasmáticos
de Hcy por métodos inmunoturbidimétricos. El análisis estadístico
se realizó utilizando el programa
GraphPad Prism 5.
RESULTADOS. Se captaron 149
sujetos (72 mujeres y 77 hombres)
con un intervalo de edad de 50 a
98 años. Las medianas de Hcy para
sujetos sin patologías asociadas
fueron de 7.48 µmol/L, mientras
que en sujetos con alguna patología fueron 9.97 µmol/L, con
diferencia significativa. Los niveles
de Hcy se incrementaron con la
edad y fueron significativamente
más elevados en varones. Se presentó mayor frecuencia de HHcy
moderada en hipertensos con un
riesgo relativo de 1.7 veces. No se
encontró relación con algún otro
factor de riesgo.
CONCLUSIONES. Se asoció
la presencia HHcy moderada con
hipertensión con un riesgo relativo
de 1.7 veces.
A1055
HEMOGLOBINURIA PAROXÍSTICA NOCTURNA EN MÉXICO:
EXPERIENCIA DE 30 AÑOS EN
UNA SOLA INSTITUCIÓN.
Gonzalez Ramirez MP*, Martagón
Herrera NA*, Hernández Reyes J*,
Rosales Durón AD*, Ruiz Delgado
GJ*, Labastida Mercado N*, Galindo Becerra LS*, Ruiz Argüelles GJ*.
* Centro De Hematología Y Medicina Interna, Clínica Ruiz Puebla.
glez_monica2@hotmail.com
INTRODUCCIÓN. La hemoglobinuria paroxística nocturna
(HPN) es una enfermedad crónica
mediada por el complemento que
causa hemólisis intravascular y se
manifiesta con anemia, hemoglobinuria y fatiga. Se ha señalado
que la distribución de las distintas
formas clínicas de la enfermedad es
diferente en México que en otros
lugares.
S132
OBJETIVO. Analizar las características de un grupo de pacientes
con HPN identificado en un período
de 30 años en una sola institución
privada en México.
MATERIAL Y MÉTODOS. Se
revisaron los expedientes de 31
pacientes con HPN identificados
entre 1983 y 2013. 20 fueron mujeres y la mediana de edad fue de
39 años, rango de 5 a 88 años. Los
pacientes fueron seguidos durante
períodos de 0.5 a 221 meses, con
una mediana de 46 meses.
RESULTADOS. La mayoría de
los pacientes (97%) se presentaron
con citopenias en sangre periférica,
35% se presentó con un episodio
trombótico y 13% se presentó
como anemia hemolítica. Ningún
evento trombótico fue fatal. En el
grupo de pacientes con citopenias
se incluyeron los 4 con hemólisis y
en ellos la destrucción de hematíes
fue continua y no paroxística. La
anemia se registró en 30 individuos, los niveles de hemoglobina
promedio fueron de 8.5 g/dL (rango
3,7 a 12,8 g/dL). La leucopenia se
encontró en 18 pacientes con una
mediana del conteo de glóbulos
blancos 3.3 x 109/L (rango 1.6 a
10.89 x 109/L), la trombocitopenia
se presentó en 18 sujetos con una
mediana en el conteo de plaquetas
de 67 x 109/L, (rango de 6 a 546
x109/L) y la pancitopenia se reportó
en 15 pacientes. En 12 pacientes
con hemoglobinuria se encontraron
valores disminuidos de haptoglobina libre y aumento de los niveles
de deshidrogenasa láctica en 4
pacientes.
CONCLUSIONES. La variante
citopénica de la HPN en México
es considerablemente más común
que las variantes trombótica ó
hemolítica de la enfermedad, lo
que es particularmente relevante
actualmente, dado que sólo las
variantes hemolíticas son las que
muestran una buena respuesta a la
terapia inhibidora de la activación
del complemento empleada hoy en
día como tratamiento de elección
para esta enfermedad.
A1056
LA TROMBOCITOPENIA DE LOS
PACIENTES CON ESTEATOHEPATITIS NO ALCOHÓLICA
Gonzalez Ramírez MP*, Martagón
Herrera NA*, Hernández Reyes J*,
Velazquez Sanches De Cima S*,
Zamora Ortiz G*, Labastida Mercado N*, Galindo Becerra LS*, Ruiz
Delgado GJ*, Ruiz Argüelles GJ*.
* Centro De Hematología Y Medicina Interna, Clínica Ruiz Puebla.
glez_monica2@hotmail.com
INTRODUCCIÓN. La esteatohepatitis no alcohólica es mundialmente,
la causa más común de daño hepático. La trombocitopenia se ha
descrito en algunos casos de esteatohepatitis no alcohólica, pero
hasta ahora no se ha descrito su
prevalencia y ni sus características
sobresalientes.
OBJETIVO. Analizar la prevalencia y las características de la
trombocitopenia en los pacientes
con esteatohepatitis no alcohólica.
MATERIAL Y MÉTODOS. Se
estudiaron 119 pacientes (26 con
pruebas de función hepática anormales y 93 con trombocitopenia:
cifras inferiores a 100 x 109 / L plaquetas), buscando la coexistencia
de esteatohepatitis no alcohólica y
trombocitopenia. El diagnóstico de
esteatohepatitis no alcohólica fue
realizado en base a estrategias de
diagnóstico no invasivo que emplea
combinaciones de marcadores
bioquímicos séricos simples (Fibromax ®). No se hicieron biopsias
de hígado.
RESULTADOS. En 93 pacientes
consecutivos con trombocitopenia,
se identificaron cinco esteatohepatitis no alcohólica. Todos presentaban
sobrepeso. La mediana del recuento
de plaquetas fue de 72 x 109 / L, la
mediana del volumen plaquetario
Libro Educativo 55 Congreso Nacional de la Agrupación Mexicana para el Estudio de la Hematología, A.C.
medio fue de 9 fL. Dos pacientes
presentaron niveles anormalmente
elevados de aminotransferasas
mientras que tres tenían aumento
de gamma glutamil transpeptidasa.
Dos pacientes presentaban tanto
disminución de los niveles de
haptoglobina como aumento de
bilirrubina, lo que sugiere un grado
leve de hemolisis, siendo los niveles
de hemoglobina normales en ambos casos. Se realizó seguimiento
de los pacientes por períodos de 1
a 27 meses (mediana 9 meses), sin
tratamiento específico y las plaquetas se mantuvieron relativamente
estables: ningún paciente tuvo menos de 40 x 109 / L plaquetas a lo
largo del estudio.
CONCLUSIONES. La trombocitopenia se presenta en menos
de la mitad de los pacientes con
esteatohepatitis no alcohólica,
todos ellos con sobrepeso, y cifras plaquetarias por lo general
por encima de 40 x 109 / L, sin
asociarse a hemorragias mucocutáneas; habitualmente no requiere
tratamiento. Se concluye que la
esteatohepatitis no alcohólica debe
ser considerada como una causa de
trombocitopenia.
A1078
COMPORTAMIENTO DE PRUEBAS
DE HEMOSTASIA EN EL PACIENTE
CON SEPSIS (SP) Y SU PROBABLE
VALOR PREDICTIVO DE MORTALIDAD
Mariscal Ibarra I*,
* Hospital Regional “Dr. Valentín
Gomez Farias” I.S.S.S.T.E.
i_mariscal@hotmail.com
INTRODUCCIÓN. La sepsis, síndrome resultante de una respuesta
inflamatoria excesiva a la infección, es frecuente y de elevada
mortalidad que se relaciona con
su gravedad y la edad del paciente.
Las alteraciones en la hemostasia
han sido manejadas con antitrombina III y dotrecogin alfa entre
otros, con escaso impacto en el
pronóstico.
OBJETIVO. Observar el comportamiento de pruebas de hemostasia
en pacientes con Sp practicadas al
ingreso, 48h, 96 h y al egreso para
correlacionarlas con mortalidad.
MATERIAL Y MÉTODOS. Se
estudiaron 59 pacientes con Sp que
ingresaron a la UCI en el segundo
semestre del 2012. Los resultados se
correlacionaron con el pronóstico.
Se emplearon medidas de dispersión, medias, DS, Xi cuadrada y
exacta de Fisher.
RESULTADOS. El grupo incluyó 32 hombres, edad promedio
73 años; con Sp 27, Sp grave 26
y choque séptico 6. La causa más
común fue neumonía. La mortalidad: grupal 40.7% y en Sp 33%, Sp
grave 38% y choque séptico 83%.
Al ingreso el 25% mostró trombocitopenia, 66% TP alargado y 15%
TTP alargado. Estos valores aumentaron al egreso a 39% (P 0.039),
78% (P0.006) y 37% (P0.015) respectivamente. Hubo correlaciones
entre mortalidad y trombocitopenia:
inicial (P0.026), 48 h (P0.033) y 96
h (P0.041); entre TP prolongado y
mortalidad al inicio (P0.02), 96h (P
0.008) y egreso (P0.006); en TTP al
egreso (P0.015). Todos los casos con
hipofibrinogenemia, (5%), fallecieron. Los cambios en las pruebas de
hemostasia traducen una activación
temprana de la misma, y se asociaron significativamente a mortalidad.
Hiperfibrinogenemia, presente
hasta en el 76% no tuvo significado
pronóstico, probablemente solo es
manifestación de inflamación.
CONCLUSIONES. El grupo
estuvo integrado por pacientes
longevos, la mortalidad grupal fue
41% y también estuvo relacionada
con la gravedad de la Sp. Cambios comunes y tempranos de la
hemostasia con valor pronóstico
fueron alargamiento del TP (70%)
y trombocitopenia (34%). Entre
los fallecidos, trombocitopenia
moderada se presentó desde el
ingreso, tuvo un descenso progresivo y además cuando se asoció
a alargamiento de TP, TTP y descenso de fibrinógeno, se apoyó el
diagnóstico de CID. El manejo aún
no es óptimo. El deterioro inicial
o progresivo de la coagulación se
asoció a mayores porcentajes de
defunción.
A1088
BUSQUEDA DE TROMBOFILIA
EN UN GRUPO DE PACIENTES
DE LA CLÍINICA DE HEMOSTASIA
Y TROMBOSIS DE UN HOSPITAL
DE REFERENCIA DE TERCER NIVEL
Lacayo Leñero D*, Vargas Ruiz
DAG*, Hernández Hernández QD*,
Martínez Valencia QA*, Barrales
Benítez EOV*.
* Instituto Nacional de Ciencias Médicas y Nutrición Salvador Zubirán.
dennis_ll@yahoo.com
INTRODUCCIÓN. Actualmente
se recomienda buscar trombofilia
en pacientes “seleccionados” con
trombosis. Esto para incrementar
el éxito de búsqueda y para que
el resultado sea de utilidad clínica. Las causas de trombofilia son
distintas de acuerdo a la población
estudiada.
OBJETIVO. Conocer los resultados de la búsqueda de trombofilia
en los pacientes que son referidos
para este fin.
MATERIAL Y MÉTODOS. Revisión de expedientes, recabando
características de la trombosis, indicación para estudiar trombofilia,
determinación de PC, PS, AT, FVL,
mutación G20210A del factor II y
MTHFR C677T, homocisteína, serología para SAF y ACL. Se excluyeron
pacientes con datos incompletos.
RESULTADOS. Fueron estudiados 123 pacientes entre 2011 y
2013. Aquí se incluyó a 56 pacientes, con edad media 36 años, 38
mujeres (67%) y 18 hombres (33%).
Dos pacientes (3.5%) tuvieron trom-
S133
Volumen 15, Suplemento 1, 2014
Revista de Hematología
bosis en relación a cirugía. 5.2%
de las mujeres tuvieron trombosis
relacionada a hormonales transdérmicos y 21% con antecedentes de
morbilidad obstétrica. La mediana
de eventos trombóticos fue de 1
(rango 1-4), con 41 eventos venosos (73.2%), 13 arteriales (23.2%)
y un paciente con ambos tipos.
23 pacientes (41%) con trombosis
en sitios inusuales, la mayoría en
territorio venoso esplácnico (43%)
o del SNC (17.3%). La indicación
más frecuente para estudio de trombofilia fue la trombosis en <45 años
(82.1%), seguido de la trombosis
en sitios inusuales (41%), la trombosis recurrente (37.5%), el tener
familia con trombosis (12.5%) y la
morbilidad obstétrica (14.2%). En
50 pacientes (89.2%) se identificó
trombofilia. Lo más frecuente fue
la mutación C677T de la MTHFR
en 48 pacientes (85.7%), 17 de los
cuales fueron homocigotos (30.3%),
de estos, solo 24 pacientes (50%)
cursaron con hiperhomocistinemia.
El FVL se encontró en 2 pacientes
(3.5%), al igual que la mutación
del factor II (3.5%), 1 caso de deficiencia de PS (1.7%) y un caso de
SAF (1.7%). No se encontraron deficiencias de AT o PC. En 5 pacientes
se encontró trombofilia combinada
(8.9%).
CONCLUSIONES. La alteración
más frecuente fue la mutación
C677T de la MTHFR, una trombofilia de bajo riesgo que es altamente
prevalente en población sana, por
lo que su importancia en ausencia
de hiperhomocistinemia es actualmente cuestionada. Las mutaciones
comunes en población caucásica como el FVL y la mutación
G20210A del gen de la protrombina resultaron poco frecuentes y
la deficiencia de anticoagulantes
naturales lo fue aún más.
A1106
CORRELACIÓN CLÍNICO-LABORATORIAL EN EL DIAGNÓSTICO
S134
DE PACIENTES CON SOSPECHA
DE ENFERMEDAD DE VON WILLEBRAND DEL OCCIDENTE DE
MÉXICO
Ibarra Hernandez A*, Aguilar López LB*, Jaloma Cruz AR**, Padilla
Romo MGZ**.
* Instituto Mexicano del Seguro
Social. ** Centro de Investigación
Biomédica de Occidente, IMSS.
arman2mil@hotmail.com
INTRODUCCIÓN. La enfermedad
de von Willebrand (EvW) es el trastorno hemorrágico hereditario más
frecuente, con incidencia de hasta
1% de la población. Es causado por
una deficiencia o anormalidad del
factor de von Willebrand (FvW).En
México se desconoce la incidencia
y prevalencia real.
OBJETIVO. Realizar la correlación clínico-laboratorial para
el diagnóstico de pacientes con
sospecha de EvW en población del
Occidente. Hipótesis: los niveles
del FvW antigénico (FvW:Ag) se
modifican por el grupo sanguíneo
y adicionalmente en las mujeres por
efecto estrogénico durante la fase
del ciclo menstrual.
MATERIAL Y MÉTODOS. Estudio transversal, prospectivo,
analítico. Se realizó muestreo de
forma censal en pacientes que
cumplieron con los criterios de
inclusión en un período de 12
meses. Se aplicó un cuestionario
estandarizado para evaluar la
tendencia hemorrágica y se tomó
muestra de sangre para las pruebas
de escrutinio y confirmatorias. En
el caso de las mujeres se registró
el periodo del ciclo menstrual en
la primera toma y se citó para una
segunda toma que evaluara la fase
complementaria. Se realizó estadística descriptiva, contrastación
de variables cuantitativas mediante
análisis de varianza y de la prueba
de homogeneidad de varianzas de
Levene. Para evaluar la variación de
los niveles del FvW:Ag en el grupo
de mujeres respecto al periodo
menstrual, se realizó análisis de
tablas de contingencia.
RESULTADOS. Se analizaron 35
pacientes, 7 hombres y 28 mujeres.
Se encontró una sospecha diagnóstica de EvW en 16 (53.3%) de las
familias estudiadas. La principal
manifestación hemorrágica fue la
aparición de equimosis o petequias en 23(65.7%).Con base en
la relación calculada de FvW:CoR/
FvW:Ag se diagnosticó a 30 familias
con EvW, mientras que en 7 familias
se descartó. El subtipo predominante fue la EvW tipo 2(40%), seguido
por el tipo 1(30%) y el tipo 3(6.7%).
Se observó una media de FvW:Ag
30% menor en el grupo de pacientes con hemotipo “O” respecto a los
pacientes del grupo sanguíneo “no
O”. En el grupo femenino, no se
encontró una variación importante
en los valores de los parámetros de
función y nivel de antígeno, ni en
la relación FvW:CoR/FvW:Ag en las
distintas fases del ciclo en que se
realizó la toma.
CONCLUSIONES. El uso de un
cuestionario estandarizado y ajustado a población mexicana permitirá
una mejor selección de pacientes
con sospecha clínica. Los grupos
sanguíneos influyen en la cantidad
de FvW:Ag, sin embargo, no deben
considerarse como un criterio que
influya en el diagnóstico definitivo.
La variabilidad que se presenta en la
cuantificación del FvW por efecto
estrogénico muestra significancia
estadística, sin embargo no limita a
realizar el diagnóstico en cualquier
fase del ciclo menstrual.
A1109
EXPERIENCIA EN EL CURSO CLÍNICO EN TROMBOCITOPENIA
INMUNE PRIMARIA EN EL CENTRO ONCOLOGICO ESTATAL
ISSEMyM EN EL PERIODO 2008
– 2012
Lugo Alferez LA*, Hardy Pérez
AE*, Díaz Vargas G*, Armenta San
Libro Educativo 55 Congreso Nacional de la Agrupación Mexicana para el Estudio de la Hematología, A.C.
Sebastian JA*, Gutiérrez Serdán R*.
* Centro Oncológico Estatal ISSEMYM.
ruth_gtz21@hotmail.com
INTRODUCCIÓN. La Trombocitopenia Inmune Primaria, es un
desorden autoinmune caracterizado
por la destrucción inmunológica de
las plaquetas, por una disminución
en la producción de las mismas, o
una combinación de las mismas. La
incidencia estimada para adultos es
de 3.3 casos por 100 000 personas
año. La edad de presentación es a
los 18 años y su mortalidad de 1.6.
El diagnóstico se realiza mediante
exclusión. Los corticoesteroides son
el tratamiento estándar en primera
línea, con lo cuales se logra una tasa
de respuesta completas del 63% y
una recaída de 30%. En segunda
línea se utiliza esplenectomía con
tasas de respuesta del 65%, los que
recaen a estos tratamientos se han
utilizado diversos inmunosupresores, anticuerpos monoclonales y
actualmente los análogos de trombopoyetina.
OBJETIVO. Evaluar el curso
clínico de los pacientes con Trombocitopenia Inmune Primaria en el
Centro Oncológico Estatal durante
el periodo del 2008 al 2012
MATERIAL Y MÉTODOS. Estudio observacional, transversal y
retrospectivo en pacientes de el
servicio de Hematología del Centro
Oncológico Estatal ISSEMyM de
Trombocitopenia Inmune Primaria
durante el periodo del 2008-2012.
Criterios de inclusión pacientes con
diagnóstico de novo y mayores de
15 años, Criterios de exclusión menores de 15 años y que se perdieran
en el seguimiento se utilizó para el
análisis estadístico SPSS vs17.
RESULTADOS. Durante el período de estudio se analizó una
muestra de 149, de los cuales se
excluyeron 57 pacientes, debido a
ser causas secundarias En total se
revisaron 92 expedientes clínicos
que contaban con el diagnóstico de
Trombocitopenia Inmune Primaria,
de los cuales se excluyeron 22
pacientes que no recibieron tratamiento. El 80% fueron mujeres, con
promedio de edad de 44.6 años.
La principal característica clínica
fue el sangrado grado 1 según la
OMS en el 42.9%, en cuanto a la
respuesta en el tratamiento de primera línea que fueron los esteroides
la respuesta en general para dexametasona 84%, prednisona 62% y
metil 63%. Evaluando la eficacia
de la segunda línea de tratamiento,
respecto a la Respuesta Completa
que presentaron los pacientes, el
75% de los 16 pacientes a los que
se les hizo esplenectomía presentó
Respuesta Completa, comparado
contra el 42.8%, 50%, 33.3%, que
recibieron Danazol, Rituximab y
Micofenolato respectivamente, con
una P de (0.569)
CONCLUSIONES. En el Centro
Oncológico Estatal ISSEMyM, el
tratamiento de elección de primera
línea son los corticoesteroides ya
que presentan adecuada eficacia,
y una baja incidencia de eventos
adversos, y como tratamiento de
segunda elección la esplenectomía.
A1127
CARACTERISTICAS DE PACIENTES CON ANTICOAGULANTE
LUPICO COMO ALTERACION DE
LABORATORIO, SIN EVENTOS DE
TROMBOSIS
Martínez Ramírez MA*, Ocejo Rodríguez A*, Muñoz Leal MDLPN**.
* Instituto Mexicano Del Seguro Social. ** Facultad de Medicina Región
Veracruz, Universidad Veracruzana.
mmartinezrmz@live.com
INTRODUCCIÓN. En la práctica
clínica, la trombocitopenia o el
alargamiento de los tiempos de
coagulación, constituyen una de
las principales causas de consulta
hematológica. En el proceso de
estudio de este tipo de alteraciones,
en algunos casos, se llega a determinar que existe Anticoagulante
Lúpico, cuya única manifestación
es la trombocitopenia o el alargamiento del TTP, sin que el enfermo
tenga manifestaciones clínicas de
trombosis.
OBJETIVO. Determinar cuáles
son las características de los pacientes con Anticoagulante Lúpico, sin
trombosis.
MATERIAL Y MÉTODOS. Se
revisaron todos los expedientes
clínicos de pacientes con diagnóstico de trombofilia del Centro
Médico Adolfo Ruiz Cortines. Se
identificaron a los pacientes con
Anticoagulante Lúpico, se separaron a los pacientes que no tenían
trombosis detectada y se recabaron
datos como género, edad, anticuerpos anticardiolipinas, anticuerpos
antifosfolípidos.
RESULTADOS. Se identificaron en total 95 expedientes, de
los cuales hubo 14 (14.7%) con
anticoagulante lúpico, sin haberse documentado trombosis.
Tres (21.5%) fueron varones y 11
(78.5%) mujeres, la mediana de
edad fue de 35 años, con un rango
de 16 a 64 años, 3 de 11 (27.2%)
pacientes a quienes se investigó
anticuerpos anticardiolipinas fueron positivos, a 5 de 11 (45%) a
quienes se investigó anticuerpos
antifosfolípidos fueron positivos.
Sólo en uno de los 14 pacientes
se le detectó otra trombofilia, una
mutación heterocigota C677T
del Gen de la MTHFR. El motivo
de envío a hematología fue TTP
prolongado en 9 (64%) pacientes,
Trombocitopenia en 2 pacientes
y TTP con trombocitopenia en 2
pacientes, en un paciente sin datos.
Se encontró Lupus Eritematoso Sistémico en 5 pacientes, de los cuales
en 3 estuvo asociado a Síndrome
de Anticuerpos Antifosfolípidos. En
3 pacientes fueron detectados por
estudios preoperatorios. 2 pacientes
tenían neoplasias activas.
S135
Volumen 15, Suplemento 1, 2014
Revista de Hematología
CONCLUSIONES. Como
alteración de laboratorio el Anticoagulante Lúpico sin trombosis
es más frecuente en mujeres, en
adultos jóvenes, como manifestación de Síndrome de Anticuerpos
Antifosfolípidos y Lupus Eritematoso Sistémico. El principal motivo
de envío es TTP prolongado. Se
considera necesario realizar estudios prospectivos que permitan
analizar más parámetros en un
grupo más amplio de pacientes para
determinar de manera más precisa
las características de esta población
de pacientes.
A1137
PURPURA TROMBOCITOPENICA
TROMBOTICA: EXPERIENCIA DE
DOS AÑOS EN EL HOSPITAL DE
ESPECIALIDADES DE CENTRO
MEDICO NACIONAL DE OCCIDENTE IMSS
Palacios Ramos A*, Aguilar Lopez
L*, Borjas Gutiérrez C*, Rubio
Jurado B*, Vega Ruiz A*, Garces
Ruiz OM*.
* Centro Médico Nacional De Occidente IMSS.
jabacuc@hotmail.com
INTRODUCCIÓN. La púrpura trombocitopénica trombótica (PTT) es un
trastorno hematológico caracterizado por trombocitopenia y anemia
hemolítica microangiopática; con
o sin anormalidades neurológicas
o renales, sin otra etiología como
infección sistémica u otra causa
de microangiopatía trombótica. Es
importante un diagnóstico oportuno, sin embargo, ante la sospecha
de esta patología, se debe iniciar
tratamiento con plasmaféresis.
OBJETIVO. Describir las características clínicas y evolución de
los casos de PTT en el Hospital de
Especialidades de Centro Médico
Nacional de Occidente durante los
años 2012-2013
MATERIAL Y MÉTODOS. Se
incluyeron los pacientes con diag-
S136
nóstico clínico y paraclínico de PTT
de marzo 2012 a diciembre 2013,
en el Servicio de Hematología
del Hospital de Especialidades de
CMNO IMSS.
RESULTADOS. Se estudiaron 5
pacientes con diagnóstico de PTT
durante 2012-2013, cuyas características se muestran en la tabla 1.
Son 3 mujeres y 2 hombres. Media
de edad de 30 años. Una paciente
con antecedente de uso de anticonceptivos orales, otro con ingestión
de proteínas para ganado y otro
con anorexígenos y cocaína. Todos
los pacientes presentaron hemorragia mucocutánea, alteraciones
neurológicas (cefalea, parestesias,
somnolencia, confusión), anemia
hemolítica microangiopática y
trombocitopenia al diagnóstico. La
falla renal se presentó en 3 pacientes sin requerir diálisis, y la pentada
clásica en 2 casos. El diagnóstico
se realizó en menos de 24 horas.
Todos los pacientes fueron tratados
con esteroides y plasmaféresis,
además; en los pacientes 2, 3 y 5
se administró rituximab. La paciente
2 presentó deterioro neurológico
debido a isquemia en territorio de
la arteria cerebral media, y requirió
ventilación mecánica durante 6
días. El paciente 4, presentó rash
e hipotensión durante la primera
sesión de plasmaféresis con plasma fresco congelado, la siguiente
sesión de plasmaféresis se realizó
con albúmina, y posterior a esta,
desarrolló deterioro neurológico y
murió al quinto día del diagnóstico. La paciente 5, presentó retraso
en el inicio de plasmaféresis por
disfunción del catéter, además de
deterioro neurológico el cual remitió con plasmaféresis. Actualmente
los 4 pacientes se encuentran en
remisión hematológica completa.
CONCLUSIONES. La PTT en
una urgencia hematológica, que
requiere manejo inmediato con
plasmaféresis con plasma fresco
congelado. En nuestro seguimiento,
4 pacientes se encuentran en remisión completa, y 1 murió. El 40%
de nuestros pacientes presentaron
todos los síntomas de la pentada
de Moschowitz. La mortalidad está
relacionada con lo anterior y la falta
de uso de plasma fresco congelado
para las plasmaféresis.
A1140
DETECCION DE ENFERMEDADES
HEMORRAGICAS EN UNA POBLACION PEDIATRICA
Ramirez Cazares AC*, Rios Solis
JE*, Lopez Miranda A*, Gonzalez
Llano O*, Marfil Rivera L*, Villarreal
Martinez L*, Corola Rivera MM*,
Gomez Almaguer D*.
* Universidad Autónoma De Nuevo
León.
dracarormz@hotmail.com
INTRODUCCIÓN. El diagnóstico
de enfermedades hemorrágicas es
dependiente de la presencia de
síntomas de sangrado en el paciente
pero la realización de una historia
de sangrado y su interpretación
aún permanece siendo subjetiva.
La recolección de los síntomas de
sangrado requiere una investigación
sistemática de todos los posibles
síntomas que han ocurrido durante
toda la vida, siendo en pediatría
difícil ya que no han sido expuestos a ciertos retos como cirugías,
procedimientos dentales o la menstruación. Por esta razón se han
propuesto cuestionarios, algunos
de los cuales ya han sido validados
como herramientas diagnósticas
para comparar datos obtenidos con
controles sanos. Para ampliar la
cantidad de casos diagnosticados
de enfermedades hemorrágicas
en nuestra unidad, iniciamos este
protocolo.
OBJETIVO. Determinar la
prevalencia de enfermedades hemorrágicas detectadas mediante
la aplicación de un cuestionario
a pacientes que acuden a nuestra
consulta.
Libro Educativo 55 Congreso Nacional de la Agrupación Mexicana para el Estudio de la Hematología, A.C.
MATERIAL Y MÉTODOS. Pacientes pediátricos referidos con
datos de sangrado los cuales primero son valorados mediante el
Pediatric Bleeding Questionarie
el cual consta de diversos ítems
con un puntaje dependiendo de la
gravedad de la presentación siendo
la prueba positiva para sangrado
cuando es >2. Al descartar alguna
otra patología que condicione a
sangrados o diagnóstico directo
o familiar se realizó tiempos de
coagulación corregidos, factor VIII,
factor Von Willebrand, agregometría con ristocetina, multímeros de
factor Von Willebrand, cofactor de
ristocetina y grupo y RH.
RESULTADOS. Se incluyeron a
26 pacientes (17 hombres y 9 mujeres) con edades desde los 9 meses
hasta los 15 años en un período
de 8 meses. El motivo de consulta
más frecuente fue epistaxis seguido
de metrorragia y sangrado dental.
Con este protocolo se pudieron
realizar los siguientes diagnósticos:
6 pacientes con hemofilia A, un
paciente con deficiencia de factor
XI, 2 pacientes con alteración en
tiempos de protrombina (aún en
valoración), y un paciente con posterior diagnóstico de lupus.
CONCLUSIONES. La realización del cuestionario en nuestros
pacientes aumentó la probabilidad
de detección de enfermedades
hemorrágicas en nuestra unidad y
el número de casos diagnosticados
por ejemplo de hemofilia que en
años anteriores solo era de 2 casos
por año. Es fácil su aplicación al
paciente además de ser orientado
a población pediátrica. Con la realización de la encuesta es posible
orientar hacia el tipo de pruebas
que se requieren en específico y al
poder dar más difusión para referencia al especialista.
A1150
EFICACIA DEL USO DE ESTEROIDES COMO TRATAMIENTO DE
PRIMERA LÍNEA EN PACIENTES
PORTADORES DE TROMBOCITOPENIA INMUNE PRIMARIA.
EXPERIENCIA DEL DEPARTAMENTO DE PEDIATRIA DEL HOSPITAL
GENERAL DE MEXICO
Barranco Lampon GI*, Ramos
Peñafiel CO*, Bolea Murga V*, Espinosa Elizondo RM*, Ramirez Garcia
MA**, González Hernández AY*.
* Hospital General de México.
** Instituto Mexicano del Seguro
Social.
drgibalampon@gmail.com
INTRODUCCIÓN. La púrpura
trombocitopénica autoinmune
(PTA) es un padecimiento hemorragíparo en el que se encuentra
alterada la hemostasia primaria por
déficit cuantitativo de la cifra de
plaquetas. En niños estima una incidencia de 4 a 5.3 casos por 100 000
personas. El objetivo de tratamiento
se encamina a 1) respuesta clínica
2) de laboratorio y 3) duración de
esta respuesta.
OBJETIVO. Evaluar la eficacia
(remisión completa, tasa de remisión completa, recaídas y tiempo de
duración de la primera remisión.) de
los esteroides como primera línea
de tratamiento. Establecer la tasa de
remisiones completas y la mediana
de tiempo en el que se alcanza.
MATERIAL Y MÉTODOS. Se
realizó una cohorte retrospectiva
basada en los registros de los pacientes potadores de TIP atendidos
en el departamento de pediatría
del Hospital General de México de
Enero del 2008 a Enero del 2013.
Se utilizó estadística no paramétrica en base a la prueba de U de
Mann-Whitney para establecer la
diferencia de medias de plaquetas
entre géneros, peso y edad. Se
realizarán curvas de Kaplan Meier
para establecer el tiempo libre de
enfermedad.
RESULTADOS. Se estudiaron un
total de 16 pacientes, 62.5% correspondieron al género femenino.
37.5% al masculino. La media de
peso al diagnóstico fue de 33 kg,
(2 a 58 kg) la media de edad fue
de 8.6 años (8 meses a 17 años).
El 56.3% (n=9) tenían aspirado de
medula ósea con cifra normal de
megacariocitos, 43.7% presentaban megacariocitos aumentados.
El 100% de los pacientes iniciaron
tratamiento con esteroide con una
media de plaquetas de 12.6 x 10e 3/
uL (1-37 x 10e 3/uL). La tasa de remisión completa fue de 56.3 (n=9),
de remisión parcial fue 43.8%
(n=7). La mediana de respuesta
completa al tratamiento de primera
línea fue de 10.5 días (1 a 363 días).
El 37.5% (n=6) presentaron recaída,
manteniendo una supervivencia
libre de recaída de 56% a 400
días. Una cifra plaquetaria menor
a 10x10e3/ul no impacto con el
desarrollo de remisión completa o
recaída (0.633, 0.358, 95% IC), al
igual que la edad menor a 10 años
(p=0.299) ni el peso menor a 30 kg
(p=0.68). No se encontraron diferencias de medias entre el género,
el peso menor a 30 kg o la edad
menor a 10 años.
CONCLUSIONES. Los esteroides continúan siendo la terapia
de primera línea, sin embargo en
nuestra población encontramos
tasa alta de recaídas, por lo que
debe evaluarse la necesidad de
combinarlos con algunos otros
medicamentos que han demostrado
beneficio terapéutico.
A1178
VARIACIONES EN LOS ALELOS
677 C>T Y 1298 A>C EN GEN QUE
CODIFICA PARA LA ENZIMA 5,10
METILENTETRAHIDROFOLATO
REDUCTASA (MTHFR) EN NIÑOS
CON TROMBOSIS
López Martínez B*, Barrera Dávila
L*, Castillo González I*, Martínez
Arias M*, Sánchez Huerta JL*, Vilchis Ordoñez A*, Juárez Barreto V*,
Parra Ortega I*.
S137
Volumen 15, Suplemento 1, 2014
Revista de Hematología
* Hospital Infantil De México Federico Gómez.
i_parra29@hotmail.com
INTRODUCCIÓN. En 9 pacientes se
encontró coexistencia en forma heterocigota de las mutaciones C677T
y A1298C en el gen que para la enzima MTHFR, considerando que dicha
alteración juega un papel importante
en la patogenia de la predisposición
a trombosis, es importante investigar
la frecuencia de dichas mutaciones
en un grupo de niños con trombosis.
Material y métodos. Se incluyeron
152 niños con trombosis y 207
controles, a través de RT-PCR, se
evaluaron las mutaciones C677T y
A1298C en el gen que codifica para
la enzima MTHFR para obtener la
frecuencia de las variaciones alélicas y compararlas con una base de
datos de mexicanos con un estado
de trombofilia. Resultados. De los
152 niños estudiados 138 (90.8%)
presento una o ambas mutaciones
estudiadas, 207 personas sanas estudiadas, se identificaron 118 (77.6%)
mutados para C677T, 43(28.3%)
para A1298C y coexistencia de
C677T y A1298C en 12 (7.9%),
en los sujetos normales se identificaron 165 (79.7%) mutados para
C677T, 39(18.9%) para A1298C y
coexistencia de C677T y A1298C
en 12 (11.1%). Conclusiones. Las
frecuencias identificada en pacientes
con trombosis y controles suponen
la no existe de asociación entre
alteraciones genéticas y el riesgo a
trombosis.
OBJETIVO. Evaluar, en pacientes con trombosis del Hospital
Infantil Federico Gomez en el periodo de 2008-2013, la frecuencia de
los polimorfismos c y 77t y a 1298c.
MATERIAL Y MÉTODOS. Se
incluyeron 152 niños con trombosis
y 207 voluntarios aparentemente
sanos (disponentes sanguíneos) a
los cuales se les realizó mediante la
reacción en cadena de la polimerasa en tiempo real, la investigación
S138
de las mutaciones C677T y A1298C
en el gen que codifica para la
enzima MTHFR para obtener la
frecuencia de las variaciones alélicas y compararlas con una base de
datos de mexicanos con un estado
de trombofilia
RESULTADOS. Se incluyeron
152 niños con trombosis y 207
voluntarios aparentemente sanos
(disponentes sanguíneos) a los cuales
se les realizo mediante la reacción en
cadena de la polimerasa en tiempo
real, la investigación de las mutaciones C677T y A1298C en el gen que
codifica para la enzima MTHFR para
obtener la frecuencia de las variaciones alélicas y compararlas con una
base de datos de mexicanos con un
estado de trombofilia
CONCLUSIONES. Las frecuencias identificadas en los pacientes
con trombosis suponen una poca
asociación directa entre las alteraciones genéticas y el riesgo a
trombosis, sin embargo es necesario
generar estudios relacionados a la
interacción de variantes genéticas
y predisposición a trombosis en
población mexicana.
A1180
CARACTERISTICAS GENERALES Y
TIEMPO DE RESPUESTA CLINICA
EN PACIENTES CON TROMBOCITOPENIA INMUNE PRIMARIA
Aceves Castillo G*, Martínez Murillo C*, Serrano Ostoa B*, León
González G*,
* Hospital General De México.
elroi_serrost@yahoo.com.mx
INTRODUCCIÓN. La Trombocitopenia Inmune Primaria (TIP) es un
desorden autoinmune caracterizado
por la destrucción de plaquetas
mediada por anticuerpos, el tratamiento de primera línea consiste
en la administración de esteroides, actualmente los criterios de
respuesta al tratamiento incluyen;
respuesta y respuesta completa. Se
han realizado estudios previos en
el Hospital General de México con
la intención de definir tiempo de
respuesta clínica (TRCli); la cual se
asumido como el tiempo (días) en
que el paciente presenta cese de
las manifestaciones hemorrágicas
a partir del inicio del tratamiento
de primera línea, sin embargo
aun no se tiene caracterizada esta
población.
OBJETIVO. Describir las características generales de los pacientes
con TIP; conocer la frecuencia con
la que se presentan los criterios de
respuesta al tratamiento y observar
el tiempo en que se presenta el
primer episodio de pérdida de la
respuesta en base al TRCli.
M AT E R I A L Y M É TO D O S .
Estudio de cohorte, ambispectivo, observacional, descriptivo.
Estadística descriptiva para las características demográficas, análisis
de supervivencia (curvas de Kaplan
Meier)
RESULTADOS. Se analizaron
104 pacientes con diagnóstico de
TIP, 80% mujeres y 20% hombres,
la edad promedio al diagnóstico fue
36 (SD+ 19 años), la manifestación
hemorrágica más común fue la
purpura húmeda (50 %), el conteo
plaquetario al diagnóstico fue 12
x10e3/ul, con un VPM 7.7 + 3.2 fl.
El tipo de esteroide utilizado inicialmente fue la metilprednisolona
(46%) seguido por la prednisona
(38%). El tiempo de RCli se logró
a los 4.8 días (SD + 3.7 días), con
una dosis acumulada de esteroide
de 1712 mg (SD + 1743 días) y un
conteo plaquetario de 23 x10e3/l. El
tiempo de R se logró a los 13.7 (SD
+12 días), con una dosis acumulada
de esteroide de 2750 (DS+ 2282
mg) y un conteo plaquetario de 86.1
x10e3/ul. El tiempo de RC se logró
a los 231 días (SD +1091 días), con
una dosis acumulada de esteroide
de 3800 mg (DS+ 2880 mg) y un
conteo plaquetario de 191 x10e3/
ul. En el análisis de supervivencia
los pacientes con TRCli entre 1-3
Libro Educativo 55 Congreso Nacional de la Agrupación Mexicana para el Estudio de la Hematología, A.C.
días tuvieron una mas días libres de
pérdida de la respuesta (p= 0.019).
CONCLUSIONES. El TRCli
podría ser un parámetro útil para
la evaluación de la respuesta en
pacientes con TIP.
A1183
EVALUACIÓN DEL DESEMPEÑO
ANALÍTICO DEL EQUIPO ACL
TOP 500 EN UN HOSPITAL PEDIÁTRICO DE TERCER NIVEL
Parra Ortega I*, López Valladares
K*, Reyna Pérez F*, Medina Sánchez D*, Hernández Reyes H*,
Martínez Arias M** Vilchis Ordoñez
A*, López Martínez B*.
* Hospital Infantil de México Federico Gómez. ** Instituto Mexicano
del Seguro Social.
i_parra29@hotmail.com
INTRODUCCIÓN. El sistema ACL
TOP 500 CTS de Instrumentation
Laboratory® es un analizador de
coagulación que presenta algunas ventajas respecto a sistemas
anteriores tales como la lectura espectrofotométrica a 671 nm donde
no interfiere la presencia de hemoglobina, lípidos y bilirrubina, lo que
favorece el proceso de muestras en
pacientes con padecimientos crónicos como hepatopatías, neoplasias
y enfermedades complejas en pacientes pediátricos en un hospital
de tercer nivel.
OBJETIVO. Determinar el desempeño analítico de pruebas de
coagulación para pacientes pediátricos a través de un equipo
automatizado en un hospital de
tercer nivel.
MATERIAL Y MÉTODOS. Para la
evaluación se incluyeron las pruebas
de Precisión intra-corridas, Precisión
inter-corridas y linealidad, utilizando
materia de control de la marca y
siguiendo las recomendaciones de
trabajo descritas por el fabricante, las
pruebas incluidas fueron: TP, TTPa,
Fibrinógeno, Dimero D, Factores
II, V, VII, VIII, IX, X, anticoagulantes
naturales: proteínas S y C de la
coagulación y la antitrombina. Las
especificaciones de calidad fueron
establecidas con los valores de cartilla, variabilidad biológica.
RESULTADOS. Los resultados
obtenidos en la evaluación de la
precisión (CV) de las pruebas de
TP, TTPa, Fibrinógeno, Dímero D a
concentraciones normales fueron:
1.2%, 1.1%, 3.3% y 5.5% para
los factores II, V, VII, VIII, IX, X a
concentraciones normales fueron:
4.1%, 4.0%, 3.6%, 2.9% y 2.9%
para proteínas S y C de la coagulación y la antitrombina se obtuvieron
los siguientes valores: 4.2%, 2.2% y
2.1%. En la evaluación a niveles patológicos los resultados fueron: para
TP (1.4%), TTPa (2.4%), Fibrinógeno
(5.8%), Dímero D (8.2%), para los
factores II, V, VII, VIII, IX, X fueron:
6.2%, 4.1%, 2.9%, 3.8%, 3.1% y
1.9%, para para proteínas S y C de
la coagulación y la antitrombina se
obtuvieron: 5.8%, 1.9% y 1.6%.
C O NCLUSIONES. Los resultados de la evaluación son
significativos para ofrecer resultados medicamente útiles,
adicionalmente las necesidades
asistenciales en los pacientes
trasplantados de órganos sólidos
y pacientes onco-hematológicos
hacen imperativo considerar todas
las herramientas de control de calidad para beneficial al máximo al
clínico en apoyo a las decisiones
terapéuticas.
A1184
BÚSQUEDA DE LAS MUTACIONES
LEIDEN DEL FACTOR V Y G20210A
DE LA PROTROMBINA EN PACIENTES PEDIÁTRICOS CON
HEMOFILIA A GRAVE
Parra Ortega I*, Lopez Martinez B*,
Barrera Dávila L, Sánchez Huerta
JL*, Martínez Arías M*, Reina Pérez F*.
* Hospital Infantil de México Federico Gómez.
i_parra29@hotmail.com
INTRODUCCIÓN. Se ha descrito
que las características clínicas de la
hemofilia A grave se ven modificadas
favorablemente por el efecto de factores protrombóticos, específicamente
las mutaciones Leiden del factor V y
la G20210A de la protrombina, Se ha
descrito desde hace mucho tiempo
que entre 10 y 15% de las personas
clasificadas fenotípicamente con
hemofilia A grave tienen manifestaciones leves de la enfermedad, se ha
descrito que los pacientes con alguna
de las mutaciones tuvieron menor
frecuencia de sangrados anuales que
los no portadores de las mutaciones
(p=0.012); el daño articular y la artropatía también fueron menores en
los pacientes portadores de alguna de
las mutaciones.
OBJETIVO. Evaluar aquellos
cambios que se producen en los
pacientes con hemofilia A grave,
relacionados a los factores protrombóticos.
MATERIAL Y MÉTODOS. Estudio prospectivo, descriptivo con 20
pacientes pediátricos con diagnóstico de hemofilia A grave en quienes
se investigó la presencia de las
mutaciones: Leiden del factor V y
la G20210A de la protrombina por
medio de reacción en cadena de la
polimerasa en tiempo real.
RESULTADOS. Al investigar la
presencia de las mutaciones todos
los pacientes presentaron el genotipo homocigoto normal para las
mutaciones Leiden del factor V y la
G20210A de la protrombina.
CONCLUSIONES. Estos 20 pacientes forman parte de una línea
de investigación que tiene como
finalidad conocer los cambios que
se producen en los pacientes con
hemofilia A grave que son también
portadores de factores protrombóticos, es necesario continuar con el
aumento del número de pacientes
para obtener la frecuencia de dichas
mutaciones en los pacientes con
hemofilia grave y conocer las el
comportamiento de dichos pacientes.
S139
Volumen 15, Suplemento 1, 2014
Revista de Hematología
A1187
VARIACIONES EN LOS ALELOS
677 C>T Y 1298 A>C EN GEN QUE
CODIFICA PARA 5,10 METILENTETRAHIDROFOLATO REDUCTASA
(MTHFR) Y EL AUMENTO DE HOMOCISTEINA
Parra Ortega I*, Martinez Arias M**,
Lopez Valladares K*, Barrera Dávila
L*, Sanchez Huerta JL*, Sanchez
Huerta JL*, Vilchis Ordoñez A*,
Castillo Martinez ID*, Juárez Barreto V*, Lopez Martinez B*.
* Hospital Infantil De México Federico Gómez. ** UMAE Hospital de
Cardiología, CMN Siglo XXI, IMSS.
i_29@hotmail.com
INTRODUCCIÓN. Se ha descrito
en algunos estudios que la coexistencia en forma heterocigota de las
mutaciones C677T y A1298C en
el gen que codifica para la enzima
MTHFR juega un papel importante
en patogenia de algunas enfermedades como la predisposición a
trombosis. Por lo que el objetivo
de este trabajo fue investigar la
frecuencia de dichas mutaciones
en un grupo de mestizos mexicanos
OBJETIVO. Comparar los niveles de Homocisteina en los
diferentes genotipos identificados
en sujetos sanos
MATERIAL Y MÉTODOS. Se
incluyeron 207 voluntarios (disponentes sanguíneos) a los cuales se
les realizo mediante la reacción en
cadena de la polimerasa en tiempo
real, la investigación de las mutaciones C677T y A1298C en el gen que
codifica para la enzima MTHFR para
obtener la frecuencia de las variaciones alélicas y comparar los valores
de homocisteina sérica (HCT).
RESULTADOS. De las 207
personas sanas estudiadas, se identificaron: 1) 28 (13.52%) con un
genotipo normal y HCT 14.92
µmol/L promedio, 2) 14 (6.76%)
con 677 Normal/1298 Heterocigotos y HCT 13.25 µmol/L promedio,
3) 74 (35.74%) 677 Heterocigo-
S140
to/1298 Normal y HCT 14.44
µmol/L promedio, 4) 67 (32.36%)
677 Homocigoto Mutado/1298
Normal y HCT 16.82 µmol/L
promedio, 23 (11.11%) 677 Heterocigoto/1298 Heterocigoto y HCT
21.20 µmol/L1 (0.48%) 677 Homocigoto Mutado /1298 Heterocigotos
y HCT 13.22 µmol/L promedio. El
análisis multivariado demuestra que
las diferencias entre las medias de
homocisteina para todos los grupos
es significativa p < 0.05.
CONCLUSIONES. La alta frecuencia de las variaciones alélicas
en MTHFR hace imperativo el
análisis de los mecanismos bioquímicos en las diversas patologías
en las cuales dichas variaciones
tiene una implicación directa en los
pacientes mexicanos. La diferencia
en la concentración homocisteina
para todos los grupos de mutaciones sugiere realizar un estudio con
una muestra mayor y un análisis
epidemiológico más detallado, para
poder considerar como significativos estos hallazgos.
A1194
TROMBOCITOPENIA INMUNE
PRIMARIA: EXPERIENCIA DE UNA
INSTITUCIÓN
Flores Jimenez JA*, Zambrano Velarde MA*, Olivares Guzman LO*,
Madrigal Gómez AM*, Navarro
Pérez KA*, Preciado Figueroa FM*.
* Hospital Civil “Dr. Juan I. Menchaca” Universidad De Guadalajara.
jafloresmd@gmail.com
INTRODUCCIÓN. La trombocitopenia inmune primaria (TIP),
es definida como un conteo plaquetario menor a 100x109/L. La
fisiopatogenia de dicha enfermedad
esta mediada inmunológicamente.
La incidencia es similar en mujeres
y hombres excepto en el rango de
edad de 30-60 años, en donde es
mas frecuente en mujeres. La TIP se
clasifica de acuerdo a su evolución
clínica, en de reciente diagnóstico
(<3 meses), persistente (3-12 meses)
y crónica (>12 meses). El tratamiento de primera línea consiste en
corticoesteroides como prednisona,
dexametasona y metilprednisolona
y/o inmunoglobulina. En segunda
línea se ha utilizado rituximab,
esplenectomía y otros agentes inmunosupresores.
OBJETIVO. Describir a los pacientes con TIP
MATERIAL Y MÉTODOS. Mediante un estudio retrospectivo, se
revisaron los registros internos del
servicio de Hematología en búsqueda de pacientes con Dx TIP, durante
el periodo de tiempo comprendido
de febrero 2002 a enero 2014. Los
datos se presentan como estadística
descriptiva.
RESULTADOS. Durante el período de estudio, 70 pacientes fueron
incluidos. La mediana de edad
al diagnóstico fue de 36 años, en
relación al género 75% del sexo femenino y 25% del sexo masculino.
Todos los pacientes fueron tratados
con corticoide como tratamiento
de primera línea (prednisona vía
oral, dexametasona,y/o bolos de
metilprednisolona ) del grupo de
pacientes que no respondieron a
corticoides, 13 fueron esplenectomizados, de los cuales uno recibió
rituximab y uno más inmunoglobulina y ciclofosfamida. Dos pacientes
más, recibieron dosis bajas de rituximab como segunda línea.
CONCLUSIONES. En nuestros
pacientes la mediana de edad
fue un poco menor a la reportada por otros grupos, en relación
a los tratamientos se utilizaron
corticoesteroides como primera
línea y fue necesario implementar
combinación de medicamentos
inmunosupresores. Los pacientes
con TIP son pacientes que requieren un seguimiento estrecho y en
varias ocasiones combinación de
medicamentos para lograr una respuesta duradera que permita a los
pacientes estar libres de esteroides.
Libro Educativo 55 Congreso Nacional de la Agrupación Mexicana para el Estudio de la Hematología, A.C.
LEUCEMIAS AGUDAS
PRESENTACIÓN ORAL
A1004
SUPERVIVENCIA LIBRE DE RECAÍDA EN PACIENTES CON LEUCEMIA
AGUDA LINFOBLÁSTICA CON
RETRASO EN EL CUMPLIMIENTO
DEL PROGRAMA DE QUIMIOTERAPIA
Lopez Hernandez MA*, Guajardo
Leal ML*, Alvarado Ibarra M*, Álvarez Vera JL*.
*Centro Médico Nacional 20 de
Noviembre, ISSSTE.
lopema@prodigy.net.mx
INTRODUCCIÓN. En la Leucemia
Aguda Linfoblástica (LAL), varios
factores contribuyen al fracaso
de un programa de quimioterapia
(QT): particularidades biológicas, comorbilidades y tipo de QT
(drogas, combinaciones y dosis).
Un requisito indispensable es la
puntualidad con qué se aplican los
antineoplásicos planeados.
OBJETIVO. Comparar la supervivencia libre de recaída (SLR) y la
supervivencia libre de evento (SLE),
entre pacientes con LAL (>15 años)
que cumplieron puntualmente, o
no, un programa de QT.
MATERIAL Y MÉTODOS. Estudio retrospectivo. Con edad
superior a 15 años y diagnóstico
de LAL, según criterios convencionales. El seguimiento mínimo, sin
evento, fue de un año; el máximo
de doce. Se analizaron: edad,
sexo, comorbilidades, infiltración
extramieloide inicial, biometría
hemática inicial, clasificación
citomorfológica (FAB), cariotipo
e inmunofenotipo. Se consideró
puntualidad en el programa de QT,
medida en días, al apego con una
tolerancia no mayor de 20% del
tiempo proyectado (grupo control).
El restante fue el grupo con retraso.
RESULTADOS. Se estudiaron
121 pacientes (56% hombres), la
edad media fue de 31 años (1268), incluidos en dos programas
secuenciales y rotativos: LAL-6 y
LAL-10 (para menores de 35 años y
mayores). Los grupos control y con
retraso fueron 60 y 61. El retraso
varió de 30% a 151% del tiempo
programado. En el grupo control y
con retraso las recaídas fueron de 8
y 50 (p= 0.0001). La probabilidad
de SLR a 150 meses fue de 0.82 y
0.08 (p=0.0001). La probabilidad
de SLE fue de 0.62 y 0.05 a 150
meses (p=0.0001). La SLR fue paralelamente influenciada por edad
superior a 38 años (p=0.03). En la
SLE influyeron la edad superior a 39
años y la existencia de comorbilidades (p= 0.004).
CONCLUSIONES. En LAL, el
retraso en las aplicaciones de quimioterapia, en programas de tipo
secuencial y rotativo, tiene efectos
desfavorables en la SLR y SLE. Como
factor aislado tiene mayor impacto
negativo en la SLR que las otras
variables analizadas, salvo la edad.
A1007
FACTORES PRONOSTICOS QUE
INFLUYEN EN LA SOBREVIDA
LIBRE DE RECAIDA Y SOBREVIDA
GLOBAL DE LOS ENFERMOS CON
LEUCEMIA MIELOIDE AGUDA
Alvarado-Ibarra M*, Lopez-Hernandez M*, Álvarez-Vera JL*,
Ortiz-Zepeda SM*.
*Centro Médico Nacional “20 de
Noviembre”. ISSSTE.
normoblasto@gmail.com
INTRODUCCIÓN. A lo largo de
tres décadas la quimioterapia estándar de inducción para el tratamiento
de la leucemia mieloide aguda ha
sido el clásico esquema de 7 días
de citarabina y tres de antraciclina
logrando alcanzar remisión en 70
a 75%.
Los resultados del Cancer and
Leukemia Group B demostraron
que dos consolidaciones con dosis
altas de citarabina aumentaron la
sobrevida libre de enfermedad y
sobrevida global, sin embargo los
mejores resultados se han alcanzado con trasplante alogénico. Los
factores pronósticos que se han
asociado al resultado terapéutico
son edad, cuenta leucocitaria, enfermedad secundaria y mutaciones
como FLT3, CEBPA y NPM1.
OBJETIVO. Conocer cuáles son
los factores pronósticos que influyen en la sobrevida libre de recaída
y sobrevida global de los enfermos
con leucemia mieloide aguda de
novo que reciben quimioterapia
intensiva.
MATERIAL Y MÉTODOS. Fueron incluidos todos los enfermos
mayores de 15 años y menores de
65, con diagnóstico de leucemia
mieloide aguda excepto la M3,
fueron excluidos para este análisis
los de trasplante en cualquiera de
sus variedades. Todos recibieron
inducción a la remisión con 7 días
de citarabina y 3 días de idarubicina, en caso de falla terapéutica
recibían una segunda inducción,
posteriormente dos consolidaciones
con dosis altas de citarabina. Se
analizaron las características clínicas y de laboratorio basales para
conocer los factores que afectaron
la supervivencia.
RESULTADOS. Del 2000 al 2013
fueron incluidos 103 enfermos, 44
hombres y 59 mujeres, la media de
edad fue de 39 años, el diagnóstico
morfológico predominante fue de
S141
Volumen 15, Suplemento 1, 2014
Revista de Hematología
M2 seguida de M4, la media de leucocitos fue de 58.4/uL y la DHL de
646. La remisión se alcanzó en 75%,
la defunción en la primera y segunda
inducción fue de 23%, 25 pacientes
recayeron, en el análisis multivariado se encontró impacto pronóstico
para la sobrevida libre de recaída
la ausencia del marcador CD117 (
p= 0.02) y para la sobrevida global
la cuenta de leucocitos superiores
a 30.0/uL (p=0.03) y la ausencia
del marcador CD117 (p=0.04). La
sobrevida libre de recaída a 150
meses fue de 58% y la mediana de
la sobrevida global fue de 11 meses.
CONCLUSIONES. Debido a
que en el Servicio no se cuenta
con análisis mutacional y ocasionalmente se cuenta con análisis
citogenético es de utilidad conocer
que la cuenta alta de leucocitos y
la ausencia del marcador CD117
impactan negativamente la supervivencia libre de enfermedad y
supervivencia global en los enfermos con leucemia mieloide aguda.
A1027
EFICACIA DE LA ADMINIST R A C I Ó N P A R A C E TA M O L
ENDOVENOSO (TEMPRA©) PARA
LA DISMINUCIÓN DEL DOLOR
DURANTE LA TOMA DE MÉDULA
ÓSEA POR ASPIRACIÓN. ESTUDIO
RANDOMIZADO NO CEGADO
Trejo Ayala RA*, Bañuelos JorgeArmando L*, Jaloma Juan C*.
* Hospital General de México Dr.
Eduardo Liceaga.
rafaeltrejoayala@gmail.com
INTRODUCCIÓN. La toma de
médula ósea por aspiración es
fundamental para el diagnóstico
y seguimiento de gran variedad
de enfermedades hematológicas.
Desafortunadamente pocos ensayos
han evaluado el manejo del dolor
asociado al procedimiento
OBJETIVO. Evaluar el efecto de
Paracetamol endovenoso sobre el
dolor asociado al procedimiento
S142
M AT E R I A L Y M É TO D O S .
Diseño del estudio. Ensayo clínico aleatorizado no cegado 2:1
favoreciendo el brazo de la no
administración de paracetamol
endovenoso. Para la evaluación del
dolor se utilizó la escala análoga
visual de dolor (EAV). Análisis estadístico. Se utilizó el software SPSS
versión 20.0. Para la diferencia de
medias entre las variaciones de la
frecuencia cardiaca y la escala de
dolor se utilizó la prueba de t student. Para las pruebas de contraste
de hipótesis se utilizó la prueba ji
cuadrado, considerándose como
significativo a un valor de p = o
igual a 0.05, 95% IC.
RESULTADOS. Se analizaron
109 pacientes, 36 recibieron paracetamol previo al procedimiento. El
principal diagnóstico fue Leucemias
Agudas (73%) seguido de Mieloma
Múltiple (7.3%). La mediana de
edad general fue de 38 años (rango
de 15- 81), a pesar de que la edad
fue menor en el grupo sin paracetamol, esta no fue estadísticamente
significativa (p=0.493, 95 % IC).
La mediana de edad fue 38 años
(rango de 15- 81). Como una medición indirecta del incremento del
dolor se evaluó las modificaciones
en la frecuencia cardiaca, pero sin
registrarse diferencias significativas
en los dos brazos. Tampoco no existió una diferencia en el tiempo de
la duración del procedimiento con
las dos estrategias (15.3 min versus
13.5 min, valor de p = 0.099,95%
IC). Evaluación del dolor. Se registró una diferencia significativa
entre las medias del dolor a favor
de los pacientes tratados con paracetamol (1.8 versus 2.5, valor de
p = 0.005, 95% IC). Se estudiaron
diversos factores para la percepción
de una mayor intensidad de dolor
(puntaje estimado mayor de 3 pts).
De aquellos pacientes los cuales se
les realizó un aspirado de médula
ósea previo al estudio, solo el 3%
de los casos en el brazo de parace-
tamol consideraron que el dolor fue
mayor con el procedimiento previo
en comparación con un 36% de
aquellos pacientes que no se les
administró paracetamol ( valor de
p=0.000*, 95% IC
CONCLUSIONES. Paracetamol endovenoso es eficaz para
la reducción del dolor asociado
al procedimiento e incrementa la
adherencia al mismo.
A1043
E F I CAC I A D E L A A D I C I Ó N
DE CLORHIDRATO DE METFORMIN A UN RÉGIMEN DE
QUIMIOTERAPIA ESTÁNDAR SOBRE LAS RECAÍDAS TEMPRANAS
EN PACIENTES PORTADORES DE
LEUCEMIA LINFOBLÁSTICA AGUDA (LLA) DEL ADULTO
Ramos Peñafiel CO*, Martínez Tovar A*, Olarte Carrillo I*, Zamora
Domínguez J*, León González G*,
Kassack Ipiña J*, Collazo Jaloma J*.
* Hospital General de México. **
Universidad Nacional Autónoma
de México.
leukemiachop@hotmail.com
INTRODUCCIÓN. Los efectos antitumorales de Metformin han sido
establecidos en diversas líneas celulares. Su efecto es principalmente
inhibiendo la vía mTOR e incrementando los niveles de AMPK. No
se cuentan hasta el momento con
ensayos sobre su eficacia en conjunto a quimioterapia en neoplasias
hematológicas.
O B J E T I VO . E s t a b l e c e r l a
eficacia de Metformin sobre el
porcentaje de recaídas tempranas
en pacientes con LLA.
MATERIAL Y MÉTODOS. Estudio prospectivo, longitudinal
experimental 3:1 en pacientes portadores de LLA de novo. La dosis de
Metformin fue de 850 mg tres veces
al día, durante todo el régimen de
tratamiento. Análisis estadístico. Se
realizó estadística no paramétrica
con test ji-cuadrado, se estimó el
Libro Educativo 55 Congreso Nacional de la Agrupación Mexicana para el Estudio de la Hematología, A.C.
RR y la supervivencia se estimó
mediante el análisis de regresión
de Cox y curvas de Kaplan-Meier.
RESULTADOS. Se estudiaron
93 pacientes, 73 sin Metformin y
20 con Metformin. La mediana de
seguimiento fue de 303 días (250365 días). La mediana de edad fue
31 años. El 55.9% correspondieron
a tipo de riesgo alto y en su mayoría
leucemias B (87.1%). Un 81.3%
(n=61) de los pacientes del grupo
sin Metformin integraron RC versus
70% (n=14) del grupo sin Metformin, en ambos grupos se registraron
4 casos de leucemias refractarias. El
grupo de tratamiento sin Metformin
registró un mayor porcentaje de
recaídas (47.9% versus 25%). La supervivencia global general a un año
fue del 68%. Mediante el test de Log
Rank, no se encontró una diferencia
significativa en acorde al tipo de tratamiento (p=0.123, 293.73- 306.26,
IC 95%). La supervivencia libre de
enfermedad general fue del 64% a
un año de seguimiento. En cuanto
al tipo de tratamiento no se logró
establecer diferencias significativas
mediante el test de Log –Rank (p=
0.735, 284.93-315.06, 95% IC)
o el test de Wilcoxon (p=0.928,
284.93-315.06, 95% IC).La adición
de Metformin impactó significativamente sobre las recaídas tempranas
(p=0.055*, 95% IC). Para el análisis
de regresión de Cox la adición de
Metformin al tratamiento, brindó
una protección en cuanto a la recaída, con una reducción del riesgo
del 56%. Otras variables de riesgo
clásicas (edad, cifra de leucocitos,
tipo de riesgo) no mostraron ser un
factor protector sobre la recaída
CONCLUSIONES. Metformin
mostró ser un factor protector de recaída a médula ósea, pero su adición
durante la inducción incrementa los
eventos adversos asociados.
A1073
¿CUAL ES EL ROL DE LAS
DOSIS BAJAS DE ATRA EN EL
TRATAMIENTO DE LA LEUCEMIA PROMIELOCÍTICA AGUDA?
EXPERIENCIA EN UN CENTRO
UNIVERSITARIO
Jaime Pérez JC*, Pinzón Uresti MA*,
Gómez De León A*, González Leal
XJ*, Gutiérrez Aguirre H*, Cantú
Rodríguez OG*, Herrera Garza JL*,
Gómez Almaguer D*.
* Servicio de Hematología, Medicina Interna, Hospital Universitario
“Dr. José Eleuterio González”. Facultad de Medicina Universidad
Autónoma de Nuevo León, Monterrey, México.
carjaime@hotmail.com
INTRODUCCIÓN. El esquema
usual de tratamiento en la leucemia
promielocítica aguda (LPA) consiste
en la combinación de antraciclinas
con ácido trans-retinóico (ATRA) 45
mg/m2 al día hasta alcanzar una
respuesta completa, sin embargo el
costo del ATRA es muy alto, lo que
limita su uso. En estudios de farmacocinética las concentraciones en
plasma y los efectos terapéuticos
son similares con dosis de 25 mg/
m2 y 45 mg/m2 de ATRA.
OBJETIVO. Determinar si la
administración de ATRA a dosis
bajas (25 mg/m2) en pacientes con
LPA es igual de eficaz que la administración a las dosis habituales
(45 mg/m2).
MATERIAL Y MÉTODOS. Estudio observacional, longitudinal,
retrospectivo en el que se incluyeron los pacientes que cumplieran
con los criterios clínicos y de laboratorio de LPA de Enero de 2002
a Mayo de 2012, tratados en el
Hospital Universitario “Dr. José
Eleuterio González” de la Universidad Autónoma de Nuevo León. La
terapia de inducción consistió en
ATRA 25 mg/m2/día hasta alcanzar
remisión completa y doxorubicina
45 mg/m2/día o mitoxantrona 10
mg/m2/día por tres días consecutivos empezando el día 3. En la
consolidación se administraron 2
ciclos de doxorubicina 45 mg/m2/
día o mitoxantrona 10 mg/m2/día
del día 1 al 3, en combinación con
ATRA 25 mg/m2/día por 15 días.
Al final de la consolidación se evaluó remisión con FISH o PCR. Los
pacientes que alcanzaron remisión
completa recibieron terapia de
mantenimiento con ATRA 25 mg/
m2/día por 15 días cada 3 meses,
seguido de 6-mercaptopurina 50
mg/m2/día de lunes a sábado y metotrexate 15 mg/m2 los domingos,
durante 2 años.
RESULTADOS. Se trataron 26
pacientes con una mediana de edad
de 27 años, 72% continuaban vivos
al final del seguimiento, 2 pacientes
tuvieron falla al tratamiento; 92.3%
alcanzaron remisión completa y en
19.2% se documento recaída. A los
2 años la sobrevida global fue de
84%, sobrevida libre de evento de
71.4% y sobrevida libre de enfermedad del 85.4%, a los 5 años estos
valores fueron de 68.3%, 53.5% y
74.7%, respectivamente.
CONCLUSIONES. El uso de
dosis bajas de ATRA combinado
con doxorubicina o mitoxantrona,
resultó en una tasa alta de respuestas y se asoció a un menor costo.
A1075
T R ATA M I E N TO H C VA D E N
PACIENTES ADULTOS CON LEUCEMIA LINFOBLASTICA AGUDA
Zagoya Martinez P*, Limón Flores
JA*, Lobato Tolama RD*, Vidal Vidal
JA**, Zagoya Martinez J***, Rodriguez Castillo P*, Solis Poblano JC*,
Perez Lozano U*.
* UMAE CMN Manuel Ávila Camacho IMSS Puebla. ** Hospital para
el Niño Poblano. *** Universidad
del Desarrollo del Estado de Puebla.
p_zagoya@hotmail.com
INTRODUCCIÓN. La Leucemia
linfoblástica aguda (LLA), no cuenta
en la actualidad con un tratamiento
concreto y eficaz para la mejora de
supervivencia global en pacientes
S143
Volumen 15, Suplemento 1, 2014
Revista de Hematología
adultos. El esquema HCVAD, es
ampliamente utilizado, ya que representa una opción en la mejora
de la remisión completa (RC).
OBJETIVO. Determinar la eficacia del esquema HCVAD sobre
RC en pacientes adultos con LLA.
MATERIAL Y MÉTODOS. El estudio se realizó durante 2013 en la
UMAE del Centro Médico Nacional
Manuel Ávila Camacho, perteneciente al Instituto Mexicano del Seguro
Social. Los criterios de inclusión
fueron: edad mayor a 15 años y diagnóstico confirmado por morfología e
inmunofenotipo a LLA. Se excluyeron
a pacientes con infecciones graves,
cardiopatías, hepatopatías y nefropatías. El total de pacientes evaluados
fue de 33, con características de
acuerdo a la Tabla 1. El tratamiento
fue HCVAD con dosis modificada de
Citarabina (2 g/m2). Con la finalidad
de evaluar el tratamiento se estimó
el porcentaje de blastos, 28 días
después de iniciado; mediante aspirado de medula ósea con tinción de
Wright (AMO), y enfermedad mínima
residual por citometría de flujo (EMR).
Al finalizar la medición, se procedió
a la ordenación y estudio de datos
mediante correlación de Pearson y
herramientas de estadística descriptiva, utilizando el programa estadístico
Statistical Analysis System (SAS).
RESULTADOS. Se observó que
a mayor concentración de Hb al
diagnostico, menor porcentaje de
blastos en AMO y EMR. La presencia de adenopatías e infiltración
al sistema nervioso central, está
relacionado directamente (P=0.05),
al porcentaje de blastos en AMO,
EMR y la severidad de la trombocitopenia. Se encontró que niveles
elevados de DHL provoca un incremento en el riesgo de recaída, así
como una EMR positiva (P=0.01). La
supervivencia global estuvo relacionada significativamente con el nivel
de Hb al diagnostico (P=0.01). Del
total de pacientes, diez fallecieron,
de los cuales cuatro fueron por
complicaciones durante mielosupresión en inducción a la RC; tres
en reinducción por recaída temprana, dos en consolidación y uno por
refractariedad.
CONCLUSIONES. Las resultados reflejan mayor influencia de
las condiciones del paciente al
diagnóstico sobre la RC. Así mismo
poco efecto del esquema HCVAD,
probablemente a la falta de terapia
blanco, por lo que habría de continuar con el estudio del genoma y
práctica clínica para brindar más y
mejores opciones en el tratamiento
de la LLA.
A1082
¿REALMENTE TIENE IMPACTO
NEGATIVO EN LOS RESULTADOS
TERAPEUTICOS LA PRESENCIA DE
GLICOPROTEINA P EN ENFERMOS
CON LEUCEMIA LINFOBLASTICA
AGUDA?
Alvarado Ibarra M*, Salazar Ramírez O*, Lopez Hernandez M*, Vera
Jose Luis A*.
* Centro Médico Nacional “20 de
Noviembre”. ISSSTE.
normoblasto@gmail.com
INTRODUCCIÓN. La presencia del
gen MDR induce la sobreproducción de glicoproteína P que se ha
relacionado primordialmente con
la Leucemia Linfoblástica Aguda
(LLA). A la glicoproteína P se le
considera responsable del descenso
de los niveles de fármacos antineoplásicos al interior de las células
tumorales.
OBJETIVO. Conocer si la expresión por inmunofenotipo de la
glicoproteína P aumenta la incidencia de recaídas y disminuye la
sobrevida libre de enfermedad en
pacientes adultos con leucemia
linfoblástica aguda de novo.
MATERIAL Y MÉTODOS. Estudio de cohorte, comparativo,
unicéntrico de pronóstico, fueron
incluidos todos los enfermos con
diagnóstico de leucemia linfoblástica aguda de novo atendidos en el
Servicio en los últimos 5 años, que
hayan recibido quimioterapia intensiva de acuerdo a los protocolos
vigentes del Servicio, los enfermos
menores de 35 años recibieron un
protocolo pediátrico. Se estudiaron la edad, valores bioquímicos,
tratamiento empleado, frecuencia
de remisión y recaída así como la
sobrevida global y libre de enfermedad. Se consideró positiva la
expresión de glicoproteína P con
más de 20%. Se analizaron los datos
Tabla 1. Características de pacientes con LLA al iniciar esquema de HCVAD
Característica
Frecuencia
Porcentaje
Valor mínimo
Valor máximo
Promedio
Desviación estándar
Sexo
Masculino
Femenino
Edad (años)
Hemoglobinaa
Leucocitosb
Neutrofilosc
Plaquetasd
*DHLe
22
11
33
33
33
33
33
33
66.70
33.30
100.00
100.00
100.00
100.00
100.00
100.00
--16
3.80
300.00
0.00
3000.00
158.00
--52
14.50
167000.00
19400
379000
6652.00
--32.76
7.94
36889.73
2516.03
83181.82
721.03
--11.11
2.77
51402.50
4185.92
82364.83
1135.32
Enzima Deshidrogenasa Láctica; a g/dl; bcd 10 3 /ml; eUI/L
*
S144
Libro Educativo 55 Congreso Nacional de la Agrupación Mexicana para el Estudio de la Hematología, A.C.
con estadística descriptiva para las
variables demográficas y ANOVA
para valorar el impacto de la glicoproteína P como factor pronóstico,
considerando significativa un valor
de p =0.05. Para la sobrevida se
utilizó Kaplan Meier
RESULTADOS. De junio de
2008 a junio de 2013 se incluyeron
54 enfermos la edad media fue de
33 años, la media de leucocitos fue
de 65 000/uL, y de deshidrogenasa
láctica de 907, la glicoproteína P
fue positiva en 29 pacientes. La
remisión fue de 96%, hubo una
falla en cada grupo. No se encontró
diferencia estadísticamente significativa por grupo al evaluar sexo,
edad, leucocitos y deshidrogenasa
láctica (p>0.7), hubo 8 recaídas en
los enfermos con glicoproteína P
positiva y 7 en el otro grupo (p=0.6),
la defunción se encontró en 16
enfermos en el grupo de glicoproteína P positiva y 6 en el otro grupo
(p=0.07). La mediana de sobrevida
libre de recaída fue de 28 meses en
el grupo con glicoproteína P positiva vs 30 meses (p=0.5) y la mediana
de sobrevida global en los pacientes
con glicoproteína P positiva fue de 9
meses vs 30 meses (p= 0.05).
CONCLUSIONES. De acuerdo a
los resultados obtenidos en nuestro
centro no se observa relación entre
la presencia de glicoproteína P y
las tasas de remisión o recaída.
Hubo mayor número de defunciones en el grupo de Glicoproteína
P positiva sin ser estadísticamente
significativo y disminución de la
sobrevida global.
A1093
LEUCEMIA MIELOBLASTICA
AGUDA NO M3, SOBREVIDA
GLOBAL Y SOBREVIDA LIBRE
DE LEUCEMIA TRATADAS CON
EL PROTOCOLO AMED EN EL
HOSPITAL GENERAL DE OCCIDENTE SSJ
Best Aguilera CR*, García Balderrama JA*, Fernández Figueroa
YM*, Rojas Sotelo R M*, Robles
Rodríguez A*, Lomelí Guerrero A*,
Pérez Banuet Saucedo D*, Pérez
Escamilla GA*.
* Hospital General de Occidente/
Universidad de Guadalajara.
carlosbest@gmail.com
INTRODUCCIÓN. El tratamiento
convencional de la LMA concluye
con la consolidación basado en
DAAC ± TMO. Con este estándar de
tratamiento para LMA existen altos
porcentajes de fracaso. La supervivencia global en adultos menores
de 60 años es de 40-50% a 5 años
y la supervivencia libre de leucemia
es aún menor. El mantenimiento
postremisión similar al utilizado en
LLA no ha sido útil. Por lo que se
diseño un esquema de tratamiento
que explora el valor de una terapia
post-remisión intensiva, extendida
y secuencial basada en dosis altas
e intermedias de Ara C en combinación con drogas con probada
utilidad en el tratamiento de la
LMA con el objetivo de mejorar la
sobrevida en esta enfermedad.
OBJETIVO. Sobrevida global y
sobrevida libre de leucemia de las
variantes no M3 tratadas con el protocolo AMED en Hospital General
de Occidente SSJ.
MATERIAL Y MÉTODOS. Estudio retrospectivo, descriptivo;
para evaluar la sobrevida global
y sobrevida libre de leucemia de
la variante no M3, tratada con el
protocolo AMED: ARAC 500 mg/
m2/3d alternado con doxorrubicina
45mg/m2/2d, etopósido 100mg/
m2/3d y 6 MP 1000 mg/m2/1d/VO.
La inducción se realizó con doble
7+3 convencional y se consolido
con 1.5 g/m2/3d de ARAC.
RESULTADOS. De Enero 1997
a Abril del 2013, 34 pacientes con
LMA no M3 recibieron terapia postremisión con esquema AMED. Se
observó un ligero predominio del
género femenino con 19 pacientes,
con una relación H:M 1.2:1. La
mediana de edad al diagnóstico fue
de 32 años (4-85). El tiempo para
alcanzar RC tuvo una mediana de
35 días (24-60). El promedio de ciclos de AMED recibidos fue 8.3 por
paciente (5-12) y de 1.5 gr/m2/3d
de ARAC de 2.4 (0-3). El esquema
AMED en LMA no M3 mostró una
SG de 59% con media de 57 meses
(6-182) y una SLE de 65% con mediana de 47.5 meses (5-172).
CONCLUSIONES. A pesar de
que aun no existen esquemas óptimos, dosis adecuadas ni número
de ciclos, el protocolo de manejo
AMED aquí presentado tiene una
experiencia de 19 años y se encontraron resultados superiores de SG y
SLE para LMA no M3 comparados
con la literatura mundial. De tal
suerte que una muestra mayor está
justificada.
A1100
M I C R OA M B I E N T E P R O - I N FLAMATORIO MEDIADO POR
CITOCINAS EN LA MÉDULA ÓSEA
DE LEUCEMIA LINFOBLÁSTICA
AGUDA
Vilchis Ordóñez A*, Contreras
Quiroz A**, Dorantes Acosta
E***, Mayani Viveros H*****, Ortiz Navarrete V******, López
Martínez B*******, Pelayo Camacho
R********.
* Hospital Infantil De México Federico Gómez, SSA/Unidad De
Investigación Médica En Enfermedades Oncológicas, IMSS/Universidad
Nacional Autónoma De México/
Biomedicina Molecular, Cinvestav.
** Unidad De Investigación Médica En Enfermedades Oncológicas,
IMSS/Biomedicina Molecular, Cinvestav. *** Hospital Infantil De
México Federico Gómez, SSA. ****
Unidad De Investigación Médica en
Enfermedades Oncológicas, IMSS.
***** Unidad De Investigación
Médica En Enfermedades Oncológicas, IMSS. ****** Biomedicina
Molecular, Cinvestav. ******* Hospital Infantil De México Federico
S145
Volumen 15, Suplemento 1, 2014
Revista de Hematología
Gómez, SSA. ******** Unidad De
Investigación Médica En Enfermedades Oncológicas, IMSS.
vilchisarmando82@hotmail.com
INTRODUCCIÓN. La LLA es un
problema serio de salud pública en
la población pediátrica de nuestro
país y en el mundo, contribuyendo
al 85% de las muertes por neoplasias infantiles. La enfermedad
resulta de la proliferación oligoclonal de células precursoras de estirpe
linfoide y su forma más grave es
caracterizada por falla funcional de
la médula ósea e infiltrado celular.
El entendimiento de los factores de
riesgo biológicos para el establecimiento y mantenimiento de las
células leucémicas es de crucial
importancia para el manejo clínico
de esta patología y el desarrollo
de medidas terapéuticas. Estudios
recientes han resaltado la importancia de la inflamación crónica en
carcinogénesis.
OBJETIVO. Determinar el repertorio de citocinas y quimiocinas
producidas por las células hematopoyéticas de la médula ósea
leucémica, y su contribución al
mantenimiento de la enfermedad.
MATERIAL Y MÉTODOS. Estudio prospectivo de pacientes
pediátricos con diagnóstico de
LLA, con muestras de aspirados de
médula ósea. Evaluación de la producción de citocinas, quimiocinas
y factores de crecimiento por los
precursores linfoides de la médula
ósea leucémica: ensayo Milliplex
de 28 determinaciones simultáneas
de: FGF-2, IFNg, 1L-10, 1L-1b, IL6, IL-8, TNFa, VEGF, FLT3L, GCSF,
GMCSF, IFNa, IL-12p40, IL-12p70,
IL-13, IL-1Ra, IL-2, IL-2Ra, IL-4,
IL-5, IL-7, etc. Evaluación de la activación de las vías de señalización
de NFkB y STAT3 en los precursores
linfoides de la médula ósea leucémica por inmunofluorescencia.
RESULTADOS. Nuestros hallazgos sugieren la prevalencia
S146
de factores microambientales inflamatorios en la médula ósea de
un grupo de pacientes pediátricos
con leucemia linfoblástica aguda,
en los que se distingue la alta producción de IL-1a, IL-1b y TNF por
células mononucleares. Así mismo,
algunas citocinas que promueven
eventos pro-inflamatorios como
INFa, IL-12p40 e IL-4, y de factores
de crecimiento que participan en la
biología normal del microambiente
hematopoyético como G-CSF, GMCSF e IL7, mostraron incrementos
sustanciales con respecto a sus contrapartes normales. Al investigar las
vías de señalización de los factores
de transcripción pNFkB y pSTAT 3
por inmunofluorescencia indirecta,
fue evidente una clara activación de
dichos mediadores.
CONCLUSIONES. El perfil de
citocinas y quimiocinas producidos por células de médula ósea,
permite distinguir dos grupos de
pacientes con LLA al diagnóstico y
clasificar al microambiente medular de acuerdo a un posible estado
pro-inflamatorio. En concordancia,
las vías de señalización de pNFkB y
pSTAT3 se encuentran encendidas,
lo que potencialmente participaría
en el mantenimiento de la enfermedad. Su papel en la regulación
de la hematopoyesis está siendo
actualmente investigado.
A1188
PERFIL DE ALTERACIONES MOLECULARES DIAGNOSTICADAS POR
RT-PCR EN PACIENTES PEDIÁTRICOS CON LEUCEMIA AGUDA
López Martínez B*, Dorantes Acosta
EM**, Grajeda Galaviz A*, Sánchez
Huerta JL*, Zapata Tarres M***,
Ramos León D*, Parra Ortega I*.
* Hospital Infantil De México Federico Gómez.
i_parra29@hotmail.com
INTRODUCCIÓN. Las leucemias
agudas representan la neoplasia maligna más frecuente en la
población pediátrica. El valor pronóstico del análisis molecular de
los pacientes pediátricos es actualmente de suma importancia e
indispensable para el diagnóstico,
clasificación y sobre todo definición del tratamiento
OBJETIVO. Realizar un estudio
que relacioné las translaciones así
como demás alteraciones cromosómicas y moleculares en pacientes
con leucemia aguda.
MATERIAL Y MÉTODOS. Se
trata de un estudio descriptivo,
transversal y prospectivo. Se realizó
análisis molecular de muestras de
médula ósea y sangre periférica de
56 pacientes pediátricos menores
de 18 años con diagnóstico de
leucemia aguda. Las traslocaciones
se investigaron por RT-PCR múltiple (Hemavision HV01-28N) para
búsqueda de 28 translocaciones
Las alteraciones cromosómicas
buscadas fueron: t(1;11)(p32;q23),
t(1;11)(q21;q23), t(1;19), t(3;5),
t(3;21), t(4;11), t(5;12), t(5;17),
t(6;9), t(6;11), t(8;21), t(9;9), t(9;11),
t(9;12), t(9;22), t(10;11), t(11;17),
t(11;19)(q23;p13.1), t(11;19)
(q23;p13.3), t(12;21), t(12;22),
t(15;17), t(16;21), t(17;19), t(X;11)
; la inv(16), y en la secuencia del
gen TAL1.
RESULTADOS. Se estudiaron
56 pacientes con leucemia aguda,
los intervalos de edad fueron de 2
meses a los 18 años de edad con
una media de 6.5 años. 33 fueron negativos para alguna de las
translocaciones buscadas (59%)
mientras que 23 fueron positivos
para alguna de ellas (41%). De
estos últimos dos pacientes presentaron dos alteraciones cada
uno: t(3;21)(q26;q22) con t(6;9)
(p23;q34) para el primer caso y
TAL1d 40kpb del(1p32) con t(9;22)
(q34;q11) para el segundo. La
translocación más frecuentemente
encontrada fue t(12;21)(p13;q22)
con el 36% de los casos positivos,
seguidas por t(9;22)(q34;q11) y
Libro Educativo 55 Congreso Nacional de la Agrupación Mexicana para el Estudio de la Hematología, A.C.
t(16;21)(p11;q22) con el 12%
cada una. t(1;19)(q23;p13), t(4;11)
(q21;q23) y TAL1d 40kpb del(
1p32) con el 8% cada una y finalmente t(10;11)(p12;q23), t(8;21)
(q22;q22), t(3;21)(q26;q22) y t(6;9)
(p23;q34) con el 4% en cada uno
de los casos.
CONCLUSIONES. En nuestro
estudio, la t(12;21)(p13;q22) fue la
más frecuente. Lo que concuerda
con los datos reportados en otros
estudios similares alrededor del
mundo. Sin embargo, no concuerda con la alta presencia de
translocaciones relacionadas con
el gen MLL (11q23), el cual no
aparece de forma importante en
nuestro estudio. Lo que podría
interpretar diferencias genéticas
en los pacientes mexicanos comparados con otras poblaciones
mundiales.
PRESENTACIÓN CARTEL
A1000
FACTORES PRONÓSTICOS DE LA
LEUCEMIA LINFOBLÁSTICA AGUDA EN PEDIATRÍA. SEIS AÑOS DE
EXPERIENCIA DE UN HOSPITAL
PEDIÁTRICO
Romero CA*, Castillo M*, Martin
L*, Arbesu G*.
*Hospital Pediátrico Humberto
Notti.
Carolromero81@yahoo.com.ar
INTRODUCCIÓN. La LLA es la
neoplasia más común en pediatría.
EFS mayores de 80% gracias a la
identificación de factores pronósticos.
OBJETIVO. 1) Conocer las
características epidemiológicas,
clínicas y respuesta al tratamiento
de pacientes menores de 15 años
con diagnóstico de LLA diagnosticados en una Institución pública y
su evolución en los últimos 6 años.
2) Investigar la asociación entre las
variables estudiadas y sobrevida.
MATERIAL Y MÉTODOS. Número: 72. Período: 1/7/06 – 1/7/12.
El seguimiento: 3 años. Se evaluaron variables epidemiológicas,
clínicas y biológicas de la enfermedad y respuesta al tratamiento.
RESULTADOS. La relación hombre/mujer fue 1.27. Edad media al
diagnóstico 6.3 años. El número
de casos/año fue entre 8 y 16.
Presentaban: adenomegalias 58%,
hepatomegalia 53% y esplenomegalia 42%. El 76% presentó anemia,
57% trombocitopenia y 29% >20
000 leucocitos al debut. El 50%
tuvo síndrome de lisis tumoral.
Ningún paciente presentó compromiso del SNC. El 54% tenían
entre 1 y 6 años. El 90% presentó
fenotipo B. El estudio citogenético
fue: normal 36 %, hiperdiploidía en
25 %, e hipodiploidía en 5.5 %. El
estudio molecular fue positivo en
9 y negativo en el 74 %. La buena
respuesta al día 8, 15 y 33 fue: 92%,
84% y 96%, respectivamente. Presentaron una remisión completa el
96% y una sobrevida global de 75
%. La recaída medular aislada fue
más frecuente en el riesgo estándar.
Factores pronósticos: 18 fallecidos,
50% del grupo de 1-6 años, el 67%
hombres. Pacientes con recuento
de GB inicial < 20.000/Ul tuvieron una sobrevida 82% (p 0.08).
Aquellos BRP y los MRP tuvieron
una sobrevida de 77 % vs 50 %
respectivamente (p 0.14). Analizando la respuesta al día 15, <25 % vs
>25 % de blastos, la sobrevida fue
de 89 % vs 9 %. (p=0.013). El 4%
no obtuvieron remisión el día 33 y
ninguno sobrevivió. El 33.3% de los
fallecidos tenían falta de molecular
y/o citogenético.
CONCLUSIONES. Neoplasia
frecuente, con una tasa anual
constante. Sobrevida del 75%. El
recuento de GB >20 000/Ul y mala
respuesta en MO al día 15 tiene
valor pronóstico adverso estadísticamente significativa. La evaluación
morfológica de la médula ósea y
el recuento inicial de GB son de
extrema importancia pronóstica
pero no reemplazan estudios más
complejos. La recaída medular fue
la evolución adversa más frecuente.
Se deben sumar todos los esfuerzos
para el mejor estudio de la enfermedad y optimizar las medidas de
soporte clínico.
A1009
LEUCEMIA LINFOBLÁSTICA AGUDA E HIPERLEUCOCITOSIS EN
NIÑOS. EXPERIENCIA EN UN
HOSPITAL UNIVERSITARIO
Lopez Miranda A*, Rios Solis J*,
Ramírez Cazarez C*, Villarreal
Martinez L*, Mancias Guerra C*,
Gonzalez Llano O*, Gomez Almaguer D*, Santacruz Esparza E*,
Corolla Salinas MM*.
*Centro Universitario Contra el
Cáncer. Universidad Autónoma de
Nuevo Leon.
dra.adela.lopez@gmail.com
INTRODUCCIÓN. Aproximadamente del 5% al 10% de los
pacientes con leucemia aguda
linfoblástica (LLA) se presentan
con hiperleucocitosis (HL) 1, esta
se define como una cuenta de
leucocitos superior a 100,000
cel/uL y puede complicarse con
condiciones médicas graves, por
ejemplo, síndrome de lisis tumoral
(SLT) y hemorragia intracraneal. La
prevención y manejo de las com-
S147
Volumen 15, Suplemento 1, 2014
Revista de Hematología
plicaciones asociadas a HL siempre
son un reto y es imprescindible
el manejo multidisciplinario para
obtener mejores resultados.
OBJETIVO. Determinar la incidencia de HL en LLA en niños,
describir el abordaje inicial, complicaciones observadas y seguimiento
a largo plazo.
MATERIAL Y MÉTODOS. Se
revisaron los expedientes de niños
con LLA y HL al momento del
diagnóstico entre febrero del 2008
y diciembre del 2013 atendidos en
el servicio de Hematología del Hospital Universitario Dr. José Eleuterio
González, se analizaron las características clínicas y de laboratorio,
el manejo inicial y su evolución.
RESULTADOS. Se diagnosticaron 163 nuevos casos de leucemias
agudas, de ellos 22 (15%) correspondieron a LLA e HL. Todos los
pacientes recibieron como parte de
nuestro protocolo para prevención
y/o manejo del SLT: hiper-hidratación
con líquidos intravenosos a 3000 mL/
m2/día, con bicarbonato de sodio a
90-120 mEq/m2/día para mantener
PH urinario mayor de 7, sin potasio
en las soluciones y alopurinol a 300
mg/m2/día por vía oral. Se inició
dexametasona intravenosa con una
media de 12 horas después de haber
iniciado las medidas anteriormente
mencionadas. Adicionalmente, se
realizó leucorreducción mediante
exanguinotransfusión en dos pacientes, ambos de 2 meses de edad
y con cuentas de leucocitos de más
de 900 mil células/uL. La mortalidad
durante la inducción ocurrió en 4
pacientes (18.8%), 2 por complicaciones derivadas del SLT que se
presentó incluso antes del inicio
de la dexametasona y los otros dos
casos por causas infecciosas. De
los 18 pacientes que terminaron su
inducción a la remisión, 15 lograron remisión morfológica y cinco
de ellos tuvieron una detección de
enfermedad mínima residual (EMR)
negativa. Doce de los dieciocho
pacientes se encuentran vivos, solo
dos de ellos se trasplantaron, los
otros seis fallecieron por recaída a
médula ósea antes de un año del
diagnóstico (Tabla 1).
CONCLUSIONES. La incidencia
en nuestro hospital es mayor que
la descrita en la literatura. En dos
de los cuatro casos que fallecieron
por complicaciones del SLT, estas
ocurrieron antes del inicio de la
dexametasona. Llevar a cabo al
menos las medidas descritas debe
ser obligado antes del inicio de la
quimioterapia en estos niños.
Tabla 1. Características de los pacientes
Parámetro
Sexo
Hombres
Mujeres
Edad (años)
Media
Rango
SNC
1
2
3
Recaídas
MO
SNC
ambas
Defunciones
S148
Numero
100-199
200-299
300-399
>400
10
12
5
6
0
4
1
0
4
2
6-1
1-14
4-7
1-14
6-1
3-13
9
9
0.2-13
2
20
1
1
11
3
1
1
5
7
3
2
10
4
1
1
2
1
4
A1026
ANALISIS DE LA EXPRESION
DE LOS TRANSPORTADORES
DE DROGAS (ABC-B1, ABC-C1
Y ABC-G2) EN PACIENTES CON
LEUCEMIA AGUDA
Martinez Tovar A*, Olarte Carrillo
I*, Téllez Sánchez G**, Mendoza
Salas I***, Ramos Peñafiel CO*, Collazo Jaloma J*, Gutiérrez Romero
M*, Kassack Ipiña JJ*, Rozen Fuller
E*, Miranda Peralta E*, Zamora
Domínguez JA*, Esquivel Alemán
B*, Nacho Vargas K****.
* Hospital General De México. **
FES-Zaragoza UNAM. *** Escuela
Nacional de Ciencias BiológicasIPN. **** Novartis Oncológica
México.
mtadolfo73@hotmail.com
INTRODUCCIÓN. El genoma humano tiene 48 genes ABC los cuales
están distribuidos en siete subfamilias designados de la A a la G.
Esta subfamilias de transportadores
desempeña un papel fundamental
en muchos procesos celulares;
por ejemplo, transportan una serie
de sustratos incluyendo los iones
metálicos, péptidos, aminoácidos,
azúcares y un gran número de compuestos hidrofóbico, sin embargo
también son responsables de la
resistencia a múltiples fármacos de
las células cancerosas. En Leucemia
Aguda el tratamiento principal se
basa principalmente en el uso de
quimioterapia y a pesar de nuevos
medicamentos un porcentaje alto
de los pacientes no alcanza una
sobrevida libre de enfermedad a
5 años. Un mecanismo implicado
podría ser la presencia de los transportadores de drogas.
OBJETIVO. Analizar la frecuencia de expresión de los
transportadores de drogas ABCB1, ABC-C1 Y ABC-G2 a nivel
de mensajero en pacientes con
Leucemia Aguda del Servicio de
Hematología del Hospital General
de México.
Libro Educativo 55 Congreso Nacional de la Agrupación Mexicana para el Estudio de la Hematología, A.C.
MATERIAL Y MÉTODOS. Se
analizaron 45 muestras de pacientes con Leucemia Aguda de
novo diagnosticado de acuerdo a
los criterios de la FAB. Se aisló el
RNAm y se transformo en cDNA por
medio de la transcriptasa reversa,
posteriormente se realizó PCR de
punto final para los genes ABCB1,C1 y G2.
RESULTADOS. La frecuencia
de expresión para los pacientes
con LLA fue de 57.1% (20/35) para
ABC-B1, 62.8% (22/35) para ABCC1 y una frecuencia de expresión
de 77% (27/35) para ABC-G2. En
el caso de la Leucemia Aguda Mieloblástica la expresión de los genes
ABC-B1, ABC-C1 y ABC-G2 fue del
100% (10/10).
CONCLUSIONES. Existe expresión de los genes ABC-B1, ABC-C1
y ABC-G2 en los pacientes con
Leucemia Aguda. Por lo que podría
explicar los casos de quimioresistencia y falla al del tratamiento.
Este proyecto está apoyado por Fondos Sectoriales
CONACYT 162269 y por la Industria Farmacéutica, División
Oncológica (NOVARTIS), avalado
y registrado por la Dirección de
investigación del HGM No. de
registro DIC/09/204/03/131A1033
A1031
ASOCIACIÓN ENTRE LA PUNCIÓN LUMBAR TRAUMÁTICA
DURANTE EL TRATAMIENTO DE
LOS PACIENTES CON LEUCEMIA
LINFOBLÁSTICA AGUDA Y SU
RELACIÓN CON INFILTRACIÓN
A SISTEMA NERVIOSO CENTRAL
Barranco Lampon GI*, Ramos Peñafiel CO*, Collazo Jaloma J*, Rozen
Fuller E*, Gutiérrez Romero M*,
Zazueta Pozos JF*.
* Hospital General De México.
drgibalampon@gmail.com
INTRODUCCIÓN. Pocos estudios
han valorado la asociación de una
punción lumbar traumática (PLT) y
el riesgo de infiltración a sistema
nervioso central (SNC) en adultos
con Leucemia Linfoblástica Aguda
(LLA). En el 2000, Gajjar A., Harrison P. , et al publicaron que en el
grupo infantil, existía una relación
entre la punción lumbar traumática
al momento del diagnóstico y un
pronóstico adverso.
OBJETIVO. Establecer la asociación entre la punción lumbar
traumática durante el tratamiento
de los pacientes con LLA y el riesgo
de infiltración a SNC.
M AT E R I A L Y M É TO D O S .
DISEÑO. Se realizó un estudio
retrospectivo, observacional, analítico, en la cohorte de pacientes
del Hospital General de México,
portadores de LLA de novo desde
enero del 2011 a diciembre del
2013. Análisis estadístico. Se utilizó el software SPSS versión 20,
estadística descriptiva y prueba no
paramétrica de tipo X2 de Pearson
a un 95% de IC. Se calculó el
Odds ratio de la punción lumbar
traumática en relación al riesgo de
infiltración a SNC.
RESULTADOS. Se estudió un
total de 79 pacientes; la media de
edad fue de 31 años (rango de 16 a
65 años). El 55.7% correspondieron
al sexo masculino. La mediana de
líquidos cefalorraquídeos registrados por paciente fue de 5 (rango
de 1 a 32). La frecuencia registrada
de infiltración a SNC fue de 10.7%
(N=8). Punciones lumbares traumáticas. El 74.6% de los casos (N=51)
contaba con una punción lumbar
traumática. Seis de los casos en los
que se documento infiltración a
SNC, contaban con al menos una
punción lumbar traumática previo
a la recaída al SNC; 3 casos con 2
punciones traumáticas, y 2 casos
con 3 punciones traumáticas o más.
Once casos se reportaron con un
líquido cerfalorraquídeo traumático
previo a la recaída de médula ósea.
Se realizó un test de X2 cuadrada de
Pearson para evaluar la asociación
de al menos una punción traumática y la infiltración a SNC, siendo
estadísticamente significativo con
un valor de p de 0.024, a 95% de
IC. Al asociar la punción lumbar
contra cualquier tipo de recaída
(SNC, médula ósea, o extramedular) la punción lumbar traumática,
no demostró ser estadísticamente
significativa (p=0.414, 95% IC). Se
estableció el Odds ratio para recaída a SNC relacionada con Punción
lumbar traumática, siendo de 11.13
(rango de 0.618 a 200.62).
CONCLUSIONES. La punción
traumática es un factor de riesgo
importante para recaída a SNC en
pacientes con Leucemia Linfoblástica Aguda. Este procedimiento
debe ser realizado por personal
altamente capacitado.
A1033
NIVELES DE EXPRESION DEL
TRANSPORTADOR DE DROGAS
ABCB1 EN PACIENTES CON LEUCEMIA AGUDA Y SU IMPACTO
CLINICO
Olarte Carrillo I*, Balderas Delgado C*, Mendoza Salas I**, Ramos
Peñafiel CO*, Zamora Domínguez
JA*, Rozen Fuller E*, Esquivel Alemán B*, Collazo Jaloma J*, Kassack
Ipiña JJ*, Miranda Peralta E*, Gutiérrez Romero M*, Nacho Vargas
K***, Martínez Tovar A*.
*Hospital General De México.
** Escuela Nacional de Ciencias
Biológicas-IPN. *** Novartis Oncológica México.
irmaolartec@yahoo.com
INTRODUCCIÓN. La leucemia
linfoblástica aguda es una neoplasia
de células precursoras linfoides que
se caracteriza por una proliferación
descontrolada, invasión de la médula
ósea y bloqueo de la hematopoyesis
normal. La resistencia múltiple a drogas contribuye al fracaso terapéutico
en este tipo de enfermedad sobre
todo al ser tratada con regímenes
que contienen antracíclicos, alca-
S149
Volumen 15, Suplemento 1, 2014
Revista de Hematología
loides de la vinca o epipodofilinas
los cuales son modulados en su
concentración intracelular por la
glucoproteína p-170 producto del
gen de multidrogo-resistencia-1. Se
desconocen los niveles de expresión
de los genes ABC-B1 y si pudieran
presentar impacto clínico en los
pacientes adultos con leucemia
linfoblástica aguda.
OBJETIVO. Conocer los niveles
de expresión del gen ABC-B1 y su
impacto clínico en pacientes con
Leucemia Linfoblástica Aguda del
Servicio de Hematología del Hospital General de México.
MATERIAL Y MÉTODOS. Se
analizaron 35 muestras de pacientes
con Leucemia Linfoblástica Aguda
sin tratamiento de quimioterapia,
así como células mononucleares
de sangre periférica normales. Se
aisló el RNA total para la síntesis
de cDNA, posteriormente se realizó
la cuantificación de los transcritos
del gen ABC-B1 normalizando con
GADPH. Cada muestra se amplificó
por triplicado y los resultados se
expresaron como expresión relativa.
La correlación entre la expresión
de ABCB1 y las variables clínicas
se realizó con la prueba de Chicuadrada y la prueba exacta de
Fisher, considerándose significativo
un valor de p= 0,05. Se utilizó el
programa estadístico S.P.S.S. versión
20 (Statistical Package for Social
Sciences, SPSS Inc., Chicago, USA).
RESULTADOS. Los niveles de
expresión del gen ABC-B1 fueron
significativamente más altos que en
células mononucleares de sangre
periférica normales (p<0.001). Se
realizó una correlación entre los
parámetros clínicos y los niveles de
expresión y observamos una asociación estadísticamente significativa
entre los niveles de expresión del
gen ABCB1 y los pacientes con alto
riesgo (p=0.007).
CONCLUSIONES. Los datos
obtenidos sugieren que los niveles
de expresión más altos del gen de
S150
resistencia múltiple a drogas ABCB1
contribuyen al peor desenlace de
pacientes adultos con Leucemia
Linfoblástica Aguda viéndose reflejado en el impacto generado en
la mortalidad. La detección y cuantificación al diagnóstico de éste
gen puede ser útil como marcador
pronóstico inicial.
Este proyecto está apoyado
por Fondos Sectoriales CONACYT
162269, SEP-CONACYT 80085
y por la Industria Farmacéutica,
División Oncológica (NOVARTIS),
avalados y registrados por la Dirección de investigación del HGM
No. de registro DIC/09/204/03/131,
DIC/08/204/04/017 y
DIC/12/204/05/01.
A1037
EFECTO DE LA METFORMINA EN
LINEAS CELULARES HEMATOLÓGICAS MALIGNAS
Zamora Domínguez J*, Olarte Carrillo I*, Zamora Domínguez JA*,
Ramos Peñafiel C*, Ruiz Ramos
R**, Collazo Jaloma J*, Gutiérrez
Romero M*, Miranda Peralta EI*,
Martinez Tovar A*.
* Hospital General De México. **
Universidad Veracruzana.
anzamor@hotmail.com
INTRODUCCIÓN. La metformina
(Diamida N,N Dimetilimidodicarbonimídico), es un droga oral
semi-sintética con dos grupos metilos unidos al nitrógeno del núcleo
de la biguanida, y cuya fórmula
es: C4H11N5. Este compuesto ha
sido utilizado ampliamente en el
tratamiento de la diabetes mellitus
tipo 2 y fue aprobado por la FDA
(Food and Drug Administration)
en 1994. El potencial del uso del
clorhidrato de metformina en oncología fue reconocido en estudios
epidemiológicos retrospectivos de
pacientes con cáncer. Numerosos
estudios observacionales reportaron
una disminución de la incidencia y
mortalidad del cáncer.
OBJETIVO. Evaluar el efecto
de la metformina en la viabilidad,
ciclo celular y apoptosis en las
líneas celulares Molt-4 (LAL-T) y
K562 (LGC).
MATERIAL Y MÉTODOS. Las
líneas celulares Molt-4 (LAL-T) y
K562 (LGC) fueron obtenidas de
American Type Culture Collection
(ATCC, Manassas, VA) y mantenidas
en medio de cultivo RPMI 1640
(Gibco BRL, Grand Island, NY), suplementadas con 10% de suero fetal
bovino (SFB) (Gibco BRL, Grand
Island, NY), penicilina (100 U/mL),
estreptomicina (100 ug/mL) y L-glutamina (2 mM). Las células fueron
cultivadas en atmósfera húmeda de
37ºC con 5% de CO2. La viabilidad
celular fue determinada usando el
método de exclusión del colorante
azul tripano. Mediante el conteo
en la cámara de Neubauer. Para
determinar el perfil del ciclo celular
las células se tiñeron con ioduro de
propidio (50 ug/mL) y se analizaron
con un equipo FACSCalibur (Bekton
Dickinson Immunocytometry Systems, San José CA.USA) (BDIS) y
por medio del software Modfit (Verity Software House Topsham, NE.
USA). Finalmente la apoptosis fue
medida mediante el kit de anexina.
RESULTADOS. La metformina
disminuye la viabilidad de las células Molt-4 y K562. Así mismo,
bloquea la progresión del ciclo celular incrementando el porcentaje de
las células en la fase G0/G1 y G2/M
y reduce la fracción de las células
en la fase S. Aunado a esto existe
un incremento de apoptosis en las
células tratadas con dicho fármaco.
CONCLUSIONES. La metformina disminuye la viabilidad,
incrementa la apoptosis y altera
la progresión del ciclo celular de
las líneas celulares hematológicas
malignas Molt-4 (LLA-T) y K562
(LGC) in vitro; sugiriendo que esta
droga podría tener gran utilidad
terapéutica en los pacientes adultos
con leucemia.
Libro Educativo 55 Congreso Nacional de la Agrupación Mexicana para el Estudio de la Hematología, A.C.
A1045
EFICACIA DEL USO DE HYPERCVAD COMO RÉGIMEN DE
PRIMERA LÍNEA PARA EL TRATAMIENTO DE LA LEUCEMIA
LINFOBLÁSTICA AGUDA DEL
ADULTO. COMPARACIÓN CON
EL PROTOCOLO INSTITUCIONAL
HGMLAL07
Ramos Peñafiel CO*, Cabrera
García Á*, Balderas Delgado C*,
Rozen Fuller E*, León González G*,
Kassack Ipiña JJ*, Martínez Murillo
C*, Gutiérrez Romero M*, Martínez
Tovar A*, Olarte Carrillo I*, Collazo
Jaloma J*.
* Hospital General De México.
leukemiachop@hotmail.com
INTRODUCCIÓN. Desde su publicación original diversos ensayos han
empleado el régimen Hyper-CVAD
como primera opción terapéutica
en leucemias linfoblástica agudas
con resultados controvertidos. En
nuestra institución este régimen
estaba reservado solamente para
recaídas.
OBJETIVO. Establecer la no inferioridad del régimen Hyper-CVAD
como primera línea de tratamiento
de LLA de novo
M AT E R I A L Y M É TO D O S .
Análisis estadístico. Se utilizó el
Software SPSS versión 20.0. Para
el contraste de hipótesis se utilizó
el test exacto de Fisher para la
prueba ji-cuadrada considerándose
significativa menor a p = 0.05 a un
95% de intervalo de confianza.
Para el análisis de supervivencia
se utilizaron curvas de KaplanMeier y el análisis de regresión
de Cox. Pacientes y métodos: Se
incluyeron solamente pacientes
jóvenes (18-40 años) portadores
con buen estado funcional y sin
comorbilidades de marzo a septiembre de 2011. Los resultados
se compararon con los resultados
del protocolo institucional HGMLAL07 desde enero de 2010 a
diciembre de 2012.
RESULTADOS. Se estudiaron
18 pacientes bajo el esquema
Hyper-CVAD previo a demostrar
la inferioridad sobre el protocolo
institucional (n= 72). La tasa de
RC del esquema Hyper-CVAD fue
del 67.7% (n=12) en comparación
con 81.9% (n=59) del protocolo
institucional. Se registraron un
11.1% de leucemias refractarias en
ambos protocolos. La mortalidad en
inducción fue mayor en el brazo
de Hyper-CVAD (n= 4, 22.2%) en
su mayoría asociada a neutropenia
febril. Alrededor de 7 casos (38.9%)
presentaron recaída a médula ósea
durante el primer año de seguimiento en comparación con un 47.2%
del registro histórico. Alrededor de
5 de los 7 casos que se mantenían
en remisión fallecieron por neutropenia febril durante los bloques
secuenciales de tratamiento. Dentro
del grupo experimental 2 pacientes
solicitaron cambio de régimen
terapéutico; Supervivencia. En comparación con el registro histórico,
Hyper-CVAD presentó una menor
supervivencia tanto al año (40%
versus 62%) como a 2 años (18%
versus 34%) (p=0.110, 95% IC). Al
ejecutar un sub-análisis únicamente con menores de 35 años para
ambos grupos, se obtuvieron datos
semejantes. No existieron factores
pronósticos asociados con relevancia significativa. La supervivencia
libre de enfermedad a un año fue
de 40% y a 5 años de seguimiento
del 34%. Los variables pronosticas
clásicas no mostraron impacto en el
análisis de regresión de Cox
CONCLUSIONES. La eficacia de
Hyper-CVAD se limita a pacientes
con leucemia en recaída y capaces
de soportar la alta toxicidad. Su
elevado costo y requerimientos
adicionales restringen su uso a instituciones de presupuesto elevado.
A1046
RELACIÓN ENTRE LOS PARÁMETROS HEMÁTICOS AL MOMENTO
DEL DIAGNÓSTICO Y DURANTE LA RECAÍDA EN PACIENTES
PORTADORES DE LEUCEMIA LINFOBLÁSTICA AGUDA DE NOVO Y
SU IMPACTO SOBRE LA SUPERVIVENCIA
Ramos Peñafiel CO*, Cabrera Osuna
S**, Rozen Fuller E*, León González
G*, Gutiérrez Romero M*.
* Hospital General De México. **
Hospital Naval Militar.
leukemiachop@hotmail.com
INTRODUCCIÓN. El porcentaje
de recaídas a médula ósea es en
promedio del 31.3% con una alta
tasa de mortalidad. En una gran
mayoría de los pacientes esta es
asintomática y debutan con valores de leucocitos menores que al
momento del diagnóstico.
OBJETIVO. Establecer la correlación entre los valores de
hematimetría al momento del
diagnóstico versus recaída y su
correlación con la supervivencia.
M AT E R I A L Y M É TO D O S .
Diseño. Estudio retrospectivo,
observacional analítico. Análisis
estadístico. Estudio de correlación
y regresión lineal, diferencia de medias por prueba T de student y curva
de supervivencia de Kaplan-Meier
RESULTADOS. Se estudiaron
69 pacientes con recaída a médula
ósea, 37.7% (n=26) correspondieron al género femenino. La mediana
de leucocitos fue 25.1 x 103/uL
(rango 0.4 – 388 x 103/uL), acorde
al riesgo (habitual versus alto) la
mediana de leucocitos fue 3. 9 x
103/uL para riesgo habitual y 59 .15
x 103/uL para riesgo alto. La mediana de supervivencia global fue 395
días (rango 54 días a 9 años). Al
realizar correlación y regresión lineal entre las cifras de leucocitos al
diagnóstico (transformada en log10)
y cifra de leucocitos al momento de
la recaída (log10) no se estableció
asociación entre estas dos variables
(p= 0.872,95% IC). Al realizar el
análisis de regresión lineal la R2
S151
Volumen 15, Suplemento 1, 2014
Revista de Hematología
fue de 0.000 (sin relación) con un
valor de p = 0.872 y estadístico
F de 0.26. La correlación entre el
número de blastos al diagnóstico
y durante la recaída tampoco demostró significancia estadística (p=
0.31, 95% IC), pero si existió una
diferencia significativa en todos
los parámetros de la hematimetría,
siendo menor los valores de leucocitos, mayor cifra de hemoglobina
y de plaquetas (p= 0.000*, 95% IC).
Resultados del protocolo de recaída. Los principales esquemas para
recaída fueron HyperCVAD (49.3%
[n=34]) seguido de esquema institucional “235” (4.3% [n=3]). El
40.6% decidieron no iniciar algún
tipo de tratamiento y mantenerse
bajo soporte transfusional plus dosis
bajas de quimioterapia. La tasa de
2da RC fue de 41.2% (n=14) con
Hyper-CVAD y 33.3% con el protocolo institucional. La supervivencia
global posterior a recaída fue 27%
a un año (rango 0.2 a 365 días) No
se encontró una diferencia acorde a
edad, el riesgo, leucocitos o estrategia terapéutica (p=0.856 ,95% IC).
CONCLUSIONES. Durante la
recaída, las cifras de leucocitos son
significativamente menores que al
momento del diagnóstico, pero
no impactan con la supervivencia
global. La tasa de una segunda RC
es aun baja posterior a recaída.
A1047
PRINCIPALES ALTERACIONES
E L E C T R O L Í T I CA S A L D I AG NÓSTICO EN PACIENTES CON
DIAGNÓSTICO DE LEUCEMIA
LINFOBLÁSTICA AGUDA DE
NOVO Y SU RELACIÓN CON LA
CIFRA DE LEUCOCITOS
Ladines Castro WJ*, Zazueta Pozos
JF*, Ramos Peñafiel C*, Castellanos
Sinco B*,
* Hospital General De México.
javi__1411@hotmail.com
INTRODUCCIÓN. Al diagnóstico,
las leucemias presentan una diver-
S152
sidad de alteraciones electrolíticas.
La principal alteración es la hipokalemia, seguida de hiponatremia y
pocos casos de hipocalcemia.
OBJETIVO. Establecer las principales alteraciones electrolíticas
tanto por edad como por cifra de
leucocitos y buscar asociación con
el perfil hemático y bioquímico.
MATERIAL Y MÉTODOS. Se utilizó el software SPSS versión 20. Se
utilizó prueba en T para diferencia
de medias, ANOVA de una vía y un
Análisis factorial
RESULTADOS. Se estudiaron
271 pacientes. La mediana de edad
fue 31 años (rango de 1-90 años).
Se estratificaron a los pacientes
acorde a edad (7 grupos) y la cifra
de leucocitos siendo el grupo más
frecuente entre los 11-21 años
(26.2 %, n=71). Las principales
alteraciones fueron hiponatremia
(40.2%) e hipocalcemia (67.9%),
pero la forma severa solo en 2.6%
(n=7). Un caso (0.4%) registró
hiponatremia severa sintomática
(rango menor de 120mEq/L) y 3
(1.1%) hipernatremia sintomática.
Los trastornos de potasio fueron
principalmente leves (rango 2.513.49 meq/dL) (n= 66, 24.4). Edad:
Los adultos mayores fueron el
principal grupo con alteraciones,
principalmente en sodio (hiponatremia e hipernatremia) y fosforo
(hipofosfatemia, 65.8%). Los trastornos de calcio (hipocalcemia)
fueron constantes en adultos. El
test de ANOVA de una vía fue
significativo para fosforo y calcio
(p= 0.000, 95% IC). Los valores
medios de fosforo, calcio y magnesio fueron menores en mayores de
edad en comparación con jóvenes.
Al realizar la prueba T de student
se encontró una diferencia entre
fosforo y calcio entre pacientes
jóvenes y adultos mayores. Leucocitos. La media de leucocitos
fue 60.8 x 103/uL (0.3- 728 x 103/
uL), el test de ANOVA de una vía
presentó diferencias en niveles de
potasio (p= 0.027, 95% IC) fosforo
(p= 0.000, 95% IC). La media de
potasio fue mayor con cifras de leucocitos > 451 x 103/uL a diferencia
de fosforo cuyo valor fue variable.
Los niveles más bajos fueron en valores de 201- 450 x 103/uL (media
de 2.6 mg/dl) y los más altos entre
6 -15 x 103/uL (media de 4.57mg/
dL). Análisis factorial. Se extrajeron
7 componentes. No se estableció
asociación de electrolitos con
alguna variable hemática o bioquímica. Si se encontró un patrón
se asociación entre las enzimas
hepáticas y los niveles de lactatodeshidrogenasa (Componente 1).
CONCLUSIONES. Las alteraciones electrolíticas son constantes en
pacientes con leucemia, la edad es
el principal factor de riesgo para
alteraciones principalmente en
sodio y fosforo.
A1048
EXPERIENCIA EN EL USO DE
UNA PLATAFORMA COMERCIAL
DE RT-PCR MÚLTIPLE PARA EL
DIAGNÓSTICO DE 28 TRANSLOCACIONES CROMOSÓMICAS
ASOCIADAS CON LEUCEMIA
AGUDA EN PACIENTES ADULTOS
MEXICANOS
Crespo Solís E*, Segura Kato Y*,
Tussie Luna I***, Cerrillo Hinojosa
M****, Rosas López A*, Uribe Patricia G*, Tussie Luna MT*.
* Instituto Nacional De Ciencias Médicas Y Nutrición Salvador Zubirán.
** Genika. *** Genika Diagnóstico.
**** Servicio de Genética, Proyectos
Especiales AGN.
INTRODUCCIÓN. La detección
de reordenamientos cromosómicos
en médula ósea de pacientes con
leucemia aguda utilizando pruebas
moleculares de alta sensibilidad
es importante para el diagnóstico
preciso, el pronóstico y la selección
del tratamiento en esta población.
La plataforma comercial de RT-PCR
múltiple HEMAVISION facilita el
Libro Educativo 55 Congreso Nacional de la Agrupación Mexicana para el Estudio de la Hematología, A.C.
tamizaje de 28 translocaciones
asociadas a leucemia.
OBJETIVO. Evaluar prospectivamente la utilidad de aplicar la
plataforma HEMAVISION para el
diagnóstico molecular de translocaciones asociadas a leucemia aguda
en pacientes adultos mexicanos.
MATERIAL Y MÉTODOS. Con el
ensayo HEMAVISION se analizaron
prospectivamente 20 muestras de
médula ósea de pacientes adultos
con leucemia aguda: 3 casos con
leucemia promielocítica aguda
(LPA), 6 con leucemia mieloide
aguda (LMA) y 9 con leucemia linfoide aguda (LLA) y 2 casos en los
que en ese momento no quedaba
claro el diagnóstico. Los resultados
del ensayo se interpretaron según
las indicaciones del kit. En algunos
casos ambiguos, las muestras se
analizaron por qPCR usando sondas
Taqman específicas para ciertos
rearreglos.
RESULTADOS. Con la plataforma Hemavisión, 4 pacientes
fueron claramente positivos: 2 para
BCR-ABL (LLA) y 2 para PML-RARA
(LPA). En otros casos no se obtuvo
un resultado claro. El resultado
positivo usando sondas Taqman
para los transcritos BCR-ABL (bcr1,
bcr2 y bcr3) o PML-RARA (M-bcr y
m-bcr) en muestras aparentemente
negativas para HEMAVISION, demostró que esta plataforma tiene
una sensibiilidad limitada.
CONCLUSIONES. El porcentaje
de casos positivos con HEMAVISION (20%) y las translocaciones
identificadas: BCR-ABL y PMLRARA, es similar a lo reportado
anteriormente. Esta prueba es útil
para un tamizaje inicial, pero dada
su acotada sensibilidad, es útil
complementarla con un sistema
más sensible, como es qPCR que
utiliza sondas Taqman.
A1057
ESTUDIO PROSPECTIVO DE LA
IDENTIFICACIÓN Y DEL TRA-
TAMIENTO DE LAS LEUCEMIAS
EN CÉLULAS DEL DONADOR:
EXPERIENCIA EN UNA SOLA INSTITUCIÓN
Gonzalez Ramírez MP*, Martagón
Herrera NA*, Hernández Reyes J*,
Garces Eisele J*, Ruiz Argüelles A*,
González Cortes A*, Labastida Mercado N*, Galindo Becerra LS*, Ruiz
Delgado GJ*, Ruiz Argüelles GJ*.
* Centro De Hematología Y Medicina Interna, Clínica Ruiz Puebla.
glez_monica2@hotmail.com
INTRODUCCIÓN. Las neoplasias
derivadas de las células del donador
posteriores al trasplante de un órgano sólido o al trasplante de células
hematopoyéticas son consideradas
como entidades poco frecuentes.
OBJETIVO. Analizar la incidencia y prevalencia de los pacientes
quienes desarrollaron leucemia de
células del donador (LCD), después
del trasplante de células hematopoyéticas alogénicas.
MATERIAL Y MÉTODOS. De
manera prospectiva se estudió
un grupo de 106 pacientes con
leucemia trasplantados en la Clínica Ruiz de Puebla con células
hematopoyéticas alogénicas entre
septiembre de 2002 y diciembre de
2013. A todos los pacientes quienes
tuvieron actividad leucémica posttrasplante se les hicieron estudios
para definir el origen de las células
leucémicas (receptor o donador)
en médula ósea, sangre periférica o
líquido cefalorraquídeo por medio
de microsatélites, citometría de
flujo y separación celular activada
por fluoresceína.
RESULTADOS. En 106 pacientes
trasplantados se identificaron de
manera prospectiva siete con LCD
en un periodo de 12 años en una
sola institución. Dentro del grupo
de pacientes con LCD, seis fueron
trasplantados por leucemia aguda
linfoblástica en segunda remisión y
uno por hemoglobinuria paroxística
/ hipoplasia medular. La mediana
de edad fue de 16 años, habiendo
identificado 7 pacientes con LCD;
seis fueron leucemias linfoblásticas
y uno leucemia de células peludas.
Las seis LCD linfoblásticas fueron
tratadas como leucemias “de novo”
y tres pacientes se encuentran vivos
libres de leucemia 11, 12 y 98
meses después del inicio del tratamiento, siendo quimeras completas.
CONCLUSIONES. La incidencia
de LCD es mayor que la informada
en la literatura mundial. Teniendo
en cuenta que se trata de neoplasias distintas a las que motivaron
los TCH los pacientes se trataron como leucemias “de novo” y
los resultados son halagüeños,
pudiendo lograrse respuestas favorables y supervivencias prolongadas
empleando esquemas de quimioterapia combinada.
A1059
GENERACIÓN DE UN SISTEMA DE
CO-CULTIVO TRIDIMENSIONAL
PARA EL ESTUDIO DE LA HEMATOPOYESIS LEUCÉMICA
Balandrán Juárez JC*, Enciso García
J*, Espinoza Sánchez NA*, Piña
Sánchez P*, Vadillo Rosado E*,
Purizaca Bazán J*, Jiménez Hernández E**, Mayani Viveros H*, Ortiz
Navarrete V***, Guzman ML****,
Pelayo Camacho R*.
* Centro Médico Nacional Siglo XXI
IMSS. ** Hospital Pediátrico Moctezuma, SSA. *** CINVESTAV, IPN.
**** Weill Cornell Medical College.
jcbalandran@gmail.com
INTRODUCCIÓN. Observaciones
previas de nuestro laboratorio
indican que el contenido de progenitores linfoides en la médula
ósea (MO) de pacientes pediátricos
con leucemia linfoblástica aguda
(LLA) está crucialmente reducido
exhibiendo limitada capacidad
proliferativa y de diferenciación en
sistemas de cultivo convencionales. Dichos hallazgos sugieren la
existencia de factores microambien-
S153
Volumen 15, Suplemento 1, 2014
Revista de Hematología
tales que regulan críticamente la
diferenciación y el mantenimiento
de las células primitivas en leucemia. Al ser la LLA una enfermedad
que inicia y progresa en la MO,
y considerando que la estructura
tridimensional de este tejido es
importante para la organización
de nichos especializados, en este
proyecto exploramos la posibilidad
de mejorar los sistemas de cultivo
y diferenciación leucémica a través de la generación de esferoides
estromales que provean de una
geometría más natural que simule
su microambiente y conexiones que
impacten su destino.
OBJETIVO. Investigar si las
estructuras tridimensionales de
células estromales mesenquimales
(CEM) favorecen el mantenimiento
y diferenciación in vitro de precursores leucémicos CD34+.
MATERIAL Y MÉTODOS. Las
CEM de aspirados de MO de
individuos pediátricos con LLA y
de individuos hematológicamente
sanos fueron inducidas a la formación de esferoides estromales
en placas no adherentes. Una
vez formados los esferoides, se
co-cultivaron con células de LLA
enriquecidas en la fracción CD34+
en presencia de citocinas y factores
de crecimiento necesarios para el
desarrollo linfoide. La capacidad
de mantenimiento de precursores
CD34+ al interior y al exterior del
esferoide se evaluó por ensayos de
dilución de carboxifluoresceína.
La generación y/o mantenimiento
de células al interior y al exterior
de los esferoides después de 3-6
semanas fue evaluada por citometría de flujo multiparamétrica.
El potencial de diferenciación se
reportó como el rendimiento (#
de células de cada categoría) por
cada unidad de progenitor inicial
del cultivo tridimensional (3-D)
comparándolo con el obtenido
en cultivos convencionales tipo
Dexter (2-D).
S154
RESULTADOS. El mantenimiento de precursores linfoides
tempranos (CD34+) de LLA, así
como sus potenciales de diferenciación para los linajes B y NK,
se incrementan cuando se utilizan
andamios tridimensionales de
CEM. Los precursores dentro del
esferoide mostraron un fenotipo
primitivo sin aparente proliferación,
mientras que las células que rodean
al esferoide proliferan e inician un
programa de diferenciación hematopoyética.
CONCLUSIONES. El cultivo
tridimensional es un acercamiento al microambiente de la MO, y
constituye una alternativa innovadora para mantener e incrementar
el potencial de diferenciación de
células precursoras leucémicas
in vitro. De especial interés es
la posible utilización de estas
plataformas para la evaluación
farmacobiológica con nuevas
estrategias terapéuticas.
A1063
PRINCIPALES CARACTERÍSTICAS
DE LAS LEUCEMIAS AGUDAS Y SU
RELACIÓN CON LA TEMPORADA
DEL AÑO
Santoyo Sánchez A*, Ramos Peñafiel C**, Palmeros Morgado G**,
Mendoza García E**, Olarte Carrillo I**, Martínez Tovar A**, Collazo
Jaloma J**.
* Universidad Nacional Autónoma
De México. ** Hospital General de
México.
tenshi.ramiel@gmail.com
INTRODUCCIÓN. En 2009,
17.9% de morbilidad hospitalaria
por tumores malignos en México
correspondió a neoplasias hemato-oncológicas, principalmente
leucemias agudas (LA), siendo
la Ciudad de México de las más
afectadas mundialmente. Estudios
sugieren un patrón de temporalidad
al existir más afectados durante el
verano.
OBJETIVO. Estimar la relación
entre los diferentes subtipos de LA
con la edad de presentación y establecer patrones de comportamiento
acorde a las temporadas del año.
MATERIAL Y MÉTODOS. Estudio retrospectivo, observacional,
basado en los registros del servicio
de Hematología durante enero del
2006 a abril del 2012, incluyendo únicamente diagnósticos de
novo de LA bajo la clasificación
Franco-Américo-Británica. Análisis
de temporalidad realizado con el
modelo periódico de Edward.
RESULTADOS. De los 833 casos
de LA, 48% fueron mujeres y 52%
hombres, predominó LA linfoblástica (LLA) sobre LA mieloblástica
(LMA) subtipo M4 (p<0.05). La
edad media fue 36.2 (±19.8 años),
encontrándose diferencias (p<0.01)
entre LLA y LMA, 32.3 y 41.8 respectivamente. A pesar de existir
picos pronunciados en la serie
temporal, nunca se repitieron de
forma periódica.
CONCLUSIONES. L2 es la
variedad más frecuente, seguida
por M4, afectando principalmente
a mayores de 40 años. No existe
patrón de presentación acorde a la
temporada del año.
A1067
EXPERIENCIA DEL TRATAMIENTO
DE LA LEUCEMIA PROMIELOCÍTICA AGUDA EN EL HOSPITAL
GENERAL DE MÉXICO. ACTUALIZACIÓN DE LA COHORTE
HGMLAP01
Zazueta Pozos JF*, Montaño Figueroa E*, Collazo Jaloma J*, Olarte
Carrillo I*, Leon González G*, Kassack Ipiña JJ*, Ramos Peñafiel C*.
* Hospital General De México.
juanfranciscozazueta@gmail.com
INTRODUCCIÓN. La LPA es una
de las principales neoplasias mieloides en Latinoamérica, el uso
de terapias basadas en ATRA son
eficaces con una alta tasa de RC.
Libro Educativo 55 Congreso Nacional de la Agrupación Mexicana para el Estudio de la Hematología, A.C.
A diferencia de Europa, en países
en desarrollo cuentan con una
mayor tasa de mortalidad asociado
principalmente a inicio tardío del
tratamiento o las complicaciones
hemorrágicas
OBJETIVO. Establecer la eficacia y mortalidad del esquema
HGMLAP01 para el tratamiento de
la LPA de novo
MATERIAL Y MÉTODOS. Estudio prospectivo, longitudinal
experimental en base del esquema
HGMLAP01 fundamentado en
terapia de riesgo desde octubre
del 2008 a junio del 2013. Análisis
estadístico. Se realizó estadística
no paramétrica con test ji-cuadrado
(95% IC), se realizó un análisis de
regresión de Cox y curvas de supervivencia de Kaplan-Meier.
RESULTADOS. Se estudiaron
38 pacientes. La mediana de seguimiento fue de 953 días (3-4 923
días). La mediana de edad fue 29
años. El 47.4% correspondieron a
riesgo intermedio, 31.6% (n=12) a
bajo y 21.1% (n=8) a riesgo alto.
La mediana de leucocitos fue de
2.3 x 103/uL y 51.3 x 103/uL para
plaquetas. El 78.9% (n=30) de los
pacientes integraron RC, 21.1%
(n=8) integraron falla terapéutica
por muerte. El 65.8% (n=21) de los
casos desarrolló neutropenia febril
y solo un caso presentó Síndrome
de diferenciación (2.6%). La supervivencia global fue del 76% a 5
años de seguimiento con una SLE
del 86% a 5 años de seguimiento.
En cuanto al tipo de riesgo mediante
el test de Mantel Cox no se mostró
diferencia en supervivencia entre
los tres estratos de riesgo de Sanz
(p= 0.223, 95% IC), pero sí cuanto
se combinaron el grupo de riesgo
bajo e intermedio versus el grupo
de riesgo alto (p=0.000, 95% IC).
Para el análisis de regresión de Cox
la presencia de un test de PCR para
PML RAR post-inducción fue estadísticamente significativo para el
riesgo de recaída (p=0.012,95% IC),
no así el tipo de riesgo (p=0.194)
género (p=0.611).
CONCLUSIONES. En nuestra
serie la neutropenia febril fue
la principal causa de muerte en
inducción seguido de los episodios hemorrágicos. La mortalidad
temprana aun es alta semejante a
otras series latinoamericanas. La
estratificación de riesgo es útil para
predecir la falla terapéutica al igual
que la positividad de PML-RARa
es predictiva de recaída temprana.
A1069
DESARROLLO DE UN MODELO
DINÁMICO DE REGULACIÓN
INTERCELULAR EN LA MÉDULA
ÓSEA DE LA LEUCEMIA LINFOBLÁSTICA AGUDA
Enciso Garcia J*, Mendoza Sierra
LA**, Pelayo Camacho R*.
* Unidad De Investigación Médica
En Enfermedades Oncológicas,
Centro Médico Nacional Siglo
XXI, IMSS / Programa De Maestría
En Ciencias Bioquímicas, UNAM.
** Instituto de Investigaciones
Biomédicas, Universidad Nacional
Autónoma de México.
jenny_gr8@msn.com
INTRODUCCIÓN. Las decisiones
de destino durante la diferenciación
de las células troncales y progenitores hematopoyéticos (HSPC)
son dependientes de factores intrínsecos y señales extrínsecas
liberadas por el microambiente de
la médula ósea en el que residen.
En la leucemia linfoblástica aguda
(LLA), la alteración de los nichos
hematopoyéticos ha sido propuesta como un factor que contribuye
a su progresión. Observaciones
de nuestro laboratorio sugieren la
existencia de factores microambientales pro-inflamatorios que regulan
críticamente la diferenciación y el
mantenimiento de células primitivas
en LLA. Los modelos computacionales, particularmente los modelos
Booleanos (MB), han sido aplicados
exitosamente en el modelado de
redes de regulación genética y redes
de señalización celular, y son actualmente herramientas poderosas
para el entendimiento de la biología
celular de estas enfermedades, para
la predicción de su comportamiento
ante perturbaciones del sistema y
para el futuro diseño de estrategias
terapéuticas basadas en la modelación del microambiente tumoral.
OBJETIVO. Proponer un MB
que represente las vías de comunicación entre células estromales
mesenquimales y HSPC en la MO
leucémica, y valide las teorías
formuladas a partir de nuestros
hallazgos experimentales, para
predecir estados que favorezcan la
progresión y mantenimiento de la
LLA, o por el contrario, el reemplazo de la hematopoyesis leucémica
por normal.
MATERIAL Y MÉTODOS. Construcción de la red de interacciones
y señalización MSC-HSPC, incluyendo moléculas detonadoras
pro-inflamatorias, factores de represión transcripcional, moléculas
de adhesión, moléculas de uniones
tipo gap y el eje de comunicación
intercelular CXCR4/CXCL12. Desarrollo de las reglas lógicas que
describan las condiciones necesarias para que cada nodo esté
encendido. Simulación matemática
de comportamientos dinámicos.
RESULTADOS. Los elementos
propuestos como factores esenciales en el mantenimiento de la
comunicación intercelular en la LLA
(CXCL12/CXCR4, Cx43, VCAM1/
VLA4) se encuentran aparentemente
inter-conectados y regulados por
vías que participan en diferenciación
(let-7e) y proliferación celulares (Gfi1, YY1, b-catenina). Es de especial
interés la posible activación de la
vía NF-kB a través de ligandos de
TLR, que conduce a la producción
de citocinas pro-inflamatorias. Se
propone la activación de PI3K/Akt
como vía alterna.
S155
Volumen 15, Suplemento 1, 2014
Revista de Hematología
CONCLUSIONES. El siguiente
punto a investigar en este modelo,
es predecir si la perturbación de
la red de comunicación propuesta
conduce a la inhibición de los ejes
de comunicación intercelular y deriva en la migración y proliferación
de precursores leucémicos.
A1087
POLIMORFISMO EN PROTEÍNAS
ACTIVADORAS DE SEÑALES INTRACELULARES EN LEUCEMIA
AGUDA
Filio Briseño LA*, Martínez Álvarez
JC**, Vázquez González WG****,
Contreras Serratos MM*****, Martínez Gutierrez CR****, Arrazola
García A**, Fuentes Landa RÁ**,
Martínez Murillo C***, Pérez Rodríguez M****.
* UIM En Inmunología, UMAE Hp,
CMN SXXI, IMSS. ** Laboratorio de
Histocompatibilidad y HLA, Banco
Central de Sangre, CMN SXXI, IMSS.
*** Banco Central de Sangre, CMN
SXXI, IMSS. **** UIM en Inmunología, UMAE HP, CMN SXXI, IMSS.
***** Servicio de Trasplante de Médula ósea, UMAE Especialidades,
CMN SXXI, IMSS.
figolink@hotmail.com
INTRODUCCIÓN. La leucemia en
México ocupa el séptimo lugar de
mortalidad por neoplasias malignas. Su etiología es multifactorial y
alteraciones en la inmunovigilancia pueden ser factores de riesgo
para su desarrollo. Las células NK
y TCD8+ reconocen y eliminan
células tumorales a través de receptores activadores como NKG2D
y NKG2C que se unen a DAP10 y
DAP12 respectivamente. Ambas
moléculas presentan polimorfismo
de un solo nucleótido en su secuencia genómica, lo que podría alterar
su función y existir una asociación
entre variantes de estas moléculas y
la predisposición a leucemia.
OBJETIVO. Determinar si el
polimorfismo de un solo nucleótido
S156
(SNP) de las moléculas adaptadoras DAP10 y DAP12 se asocia en
leucemia.
MATERIAL Y MÉTODOS. La genotipificación se realizó en C38A,
C891T y G938A de DAP10, así
como G798T, A3730G y G3766T
de DAP12 por discriminación
alélica por PCR en tiempo real,
utilizando sondas Taqman, en
pacientes con diagnóstico de leucemia linfoide aguda (LLA) (n=94)
y leucemia mieloide aguda (LMA)
(n=66) comparados contra un grupo
control (n=400). Los resultados fueron analizados para el equilibrio de
Hardy-Weinberg, el desequilibrio
de ligamiento (LD) y la asociación
calculando el OR.
RESULTADOS. En DAP10 el
resultado de los alelos C (C38A) y
G (G938A) fue del 100%, en poblaciones como la asiática y la negra
los alelos A de ambas variantes se
encuentran en el 5%. De la misma
forma los alelos G (G798T) y A
(A3730G) de DAP12 se presentaron en el 100% y como en el caso
anterior la frecuencia de los alelos
T y G es del 5% en orientales y
africanos. Con respecto a C891T
de DAP10 el alelo C y T fue del
2% y 98% en LLA, 1% y 99% en
LMA, y 5% y 95% en controles,
respectivamente. Del mismo modo,
para G3766T de DAP12 el alelo
G y T fue del 1% y 99% en LLA,
0% y 100% en LMA y 2% y 98%
en controles, respectivamente. En
estos polimorfismos también observamos que las frecuencias varían
con respecto a otros grupos. Los
SNPs analizados cumplen con el
equilibrio Hardy-Weinberg. No se
presentan diferencias significativas
de en alelos, genotipos ni en el LD.
CONCLUSIONES. Las frecuencias de DAP10 y DAP12 reportadas
en nuestro estudio son diferentes
de la población asiática o negra.
Las variantes alélicas, genotípicas
y haplotípicas de estas moléculas
adaptadoras no representan un
factor de riesgo o protección para
el desarrollo de leucemia aguda en
el grupo estudiado.
A1094
LEUCEMIA PROMIELOCITICA
AGUDA: SOBREVIDA GLOBAL Y
SOBREVIDA LIBRE DE LEUCEMIA.
TRATADA CON EL PROTOCOLO
AMED EN EL HOSPITAL GENERAL
DE OCCIDENTE SSJ
Best Aguilera CR*, García Balderrama JA*, Fernández Figueroa
YM*, Rojas Sotelo R M*. Robles
Rodríguez A*, Lomelí Guerrero A*,
Pérez Banuet Saucedo D*, Pérez
Escamilla G*,
* Hospital General De Occidente/
Universidad de Guadalajara.
carlosbest@gmail.com
INTRODUCCIÓN. La eficacia del
tratamiento de la Leucemia Promielocítica Aguda (LPA) constituye
un parteaguas en la historia de las
leucemias. La combinación de
ATRA/ATO/QT recientemente ha
resultado en supervivencia global y
libre de leucemia superior al 90%.
No obstante su alto costo, la hace
inaccesible para muchos centros
hospitalarios. Por otra parte el rol
del ARA-C, una droga barata y
accesible, ha sido controvertido en
este contexto. Se le ha dado mayor
valor en el subgrupo de alto riesgo.
El esquema AMED es una terapia
postremisión intensiva, extendida y
secuencial basada en dosis altas e
intermedias de Ara C en combinación con doxorrubicina, etoposido
y 6 MP.
OBJETIVO. Determinar sobrevida global y la sobrevida libre de
leucemia de la LPA con el protocolo
AMED en Hospital General de Occidente SSJ.
MATERIAL Y MÉTODOS. Estudio retrospectivo, descriptivo, de
todos los pacientes tratados con el
protocolo AMED: ARAC 500 mg/
m2/3d alternado con doxorrubicina
45mg/m2/2d, etoposido 100mg/
Libro Educativo 55 Congreso Nacional de la Agrupación Mexicana para el Estudio de la Hematología, A.C.
m2/3d y 6 MP 1000 mg/m2/1d/VO.
Se determinó el riesgo en base al
número de leucocitos y plaquetas al
diagnóstico. La inducción se realizó
con ATRA exclusivamente a dosis
convencionales y la consolidación
con ARAC 1.5 gr/m2/3d.
RESULTADOS. De enero 1997
a abril del 2013, 20 pacientes
con LPA recibieron terapia postremisión con esquema AMED. Se
observó un predominio del género
femenino con 13 pacientes, con
una relación M: H 1.8:1. La mediana de edad al diagnóstico fue de 30
años (17-51). El tiempo para alcanzar remisión completa (RC) tuvo
una mediana de 45 días (32-75). El
100% alcanzó RC. El promedio de
ciclos de AMED recibidos fue 9.3
por paciente (5-12). Los pacientes
que recibieron esquema AMED
presentaron una SG del 80% con
una mediana de 72.5 meses (30182) y una SLE de 80% con una
mediana de 71 meses (21-182). Se
observaron 35% de recaídas. Corresponden 66% de riesgo habitual
y 33% riesgo alto.
CONCLUSIONES. A pesar de
que aun no existen esquemas óptimos, dosis adecuadas ni número de
ciclos, el protocolo de tratamiento
AMED aquí presentado tiene una
experiencia de 19 años y se encontraron resultados equiparables
de SG y SLE para LPA en regímenes
basados en ATRA.
A1102
SIGNIFICADO CLÍNICO DE LA
EXPRESIÓN DE MIR-24 EN LEUCEMIA AGUDA MIELOBLÁSTICA
Gómez Gómez Y*, Organista Nava
J***, Illades Aguiar B****, Alarcón
Romero LDC*****, Saavedra Herrera MV*, Rivera Ramírez AB*,
Garzón Barrientos VH*, Leyva
Vázquez MA****.
* Departamento De Investigación
Del Instituto Estatal De Cancerología Arturo Beltran Ortega,
Acapulco, Guerrero, México. **
Instituto de Fisiología Celular, Universidad Nacional Autónoma de
México (UNAM), Ciudad Universitaria, 04510, D.F., México.
*** Instituto de Fisiología Celular,
Universidad Nacional Autónoma
de México (UNAM), D.F., México.
**** Laboratorio de Biomedicina
Molecular de la Unidad Académica Ciencias Químico Biológicas
de la Universidad Autónoma de
Guerrero, Chilpancingo, Guerrero,
México . ***** Laboratorio de Citopatología de la Unidad Académica
Ciencias Químico Biológicas de la
Universidad Autónoma de Guerrero, Chilpancingo, Guerrero, México.
ygomez_gomez@yahoo.com.mx
INTRODUCCIÓN. Los MicroRNAs
(miRNAs) juegan un papel importante en el desarrollo y progresión
de la leucemia Aguda (LA). Los
miR-24 promueve la sobrevida de
líneas celulares de Leucemia Aguda
Mieloblástica (LAM).
OBJETIVO. El objetivo principal
de este estudio fue investigar el
significado clínico de la expresión
de miR-24 en muestras de Leucemia
Aguda Mieloblástica.
MATERIAL Y MÉTODOS. Se
analizó la expresión de miR-24
en 38 muestras sanguíneas de pacientes con LAM, provenientes del
Instituto Estatal de Cancerología
de Acapulco, Guerrero y en 50
muestras sanguíneas de individuos
sanos de edad entre 1-18 años. Se
realizó la extracción de RNA total
por la técnica de fenol-cloroformo.
La medición de miR-24 fue hecha
por RT-PCR en tiempo real. La
cuantificación relativa se realizó
por el método comparativo de Ct.
Un análisis de regresión logística
fue realizado para medir la asociación entre la expresión de miR-24
y riesgo de recaída. Las curvas de
log-rank test y Kaplan-Meier fueron
usadas para analizar el efecto de
la expresión de miR-24 sobre la
sobrevida (OS). Un valor de p<0.05
fue considerado estadísticamente
significativo.
RESULTADOS. Se observó que
la expresión de miR-24 fue significativamente alta en pacientes con
LAM comparado con los individuos
sanos (p<0.001), la cual disminuye
significativamente después de que
los pacientes alcanzan la remisión
completa. Se encontró una asociación entre la expresión de miR-24
y el riesgo de recaída (p<0.005);
pacientes con altos niveles de miR24 tuvieron 3.22 (CI95% 1.34-7.77,
p= 0.009) veces más el riesgo de
tener una recaída. Otras variables
tales como la edad y numero de
leucocitos también fueron asociados (p<0.005) con el riesgo de
recaída. Por otro lado se observó
que los individuos con altos niveles
de miR-24 tuvieron una sobrevida
más baja que los individuos con niveles bajos de miR-24 (log-rank test;
p<0.05). Aunque preliminarmente,
estos datos sugieren un papel muy
importante de la expresión de
miR-24 sobre el riesgo de recaída
y la sobrevida de los pacientes
con LAM.
CONCLUSIONES. Los datos
indican que los niveles elevados
de miR-24 fueron asociados con
pobre pronóstico de los pacientes
con LAM. La expresión de miR-24
fue identificado como un posible
marcador para predecir la respuesta
clínica de los pacientes con LMA.
A1104
ASOCIACIÓN DEL POLIMORFISMO A22G EN EL GEN DE LA
FOLILPOLIGLUTAMATO SINTETASA CON LA SOBREVIDA DE
LOS PACIENTES CON LEUCEMIA
LINFOBLÁSTICA AGUDA
Organista Nava J*, Gómez Gómez
Y**, Rangel Rodríguez CA***, Illades Aguiar B***, Alarcón Romero
LDC****, Leyva Vázquez MA***.
* Instituto De Fisiología Celular,
Universidad Nacional Autónoma
De México (UNAM), México, D.F.,
S157
Volumen 15, Suplemento 1, 2014
Revista de Hematología
México. ** Departamento de Investigación del Instituto Estatal de
Cancerología Dr. Arturo Beltrán
Ortega, Acapulco, Guerrero, México. *** Laboratorio de Biomedicina
Molecular de la Unidad Académica
Ciencias Químico Biológicas de la
Universidad Autónoma de Guerrero, Chilpancingo, Guerrero, México.
**** Laboratorio de Citopatología de
la Unidad Académica Ciencias Químico Biológicas de la Universidad
Autónoma de Guerrero, Chilpancingo, Guerrero, México.
joorna@gmail.com
INTRODUCCIÓN. La enzima
folilpoliglutamato sintetasa (FPGS)
es una enzima muy importante en
la vía del folato y en la poliglutamación del metotrexato (MTX), una
vez que éste entra a la célula debe
retenerse en el citoplasma el mayor
tiempo posible para inhibir las enzimas blanco de la vía del folato. Leil
et. al., (2007) determinaron que el
polimorfismo A22G presente en el
gen de la FPGS confiriere resistencia al MTX, fármaco esencial para
el tratamiento de la LLA
OBJETIVO. En este estudio se
evaluó el efecto del polimorfismo
A22G del gen de la FPGS sobre
la sobrevida y el riesgo de recaída
en LLA.
MATERIAL Y MÉTODOS. Se
analizaron 70 muestras sanguíneas
de individuos con LLA, entre 1-18
años de edad provenientes del
Instituto Estatal de Cancerología de
Acapulco, Guerrero. La PCR-RFLP,
se utilizó para la genotipificación
del polimorfismo A22G de la FPGS.
Un análisis de regresión logística
fue realizado para medir la asociación del riesgo de recaída con el
polimorfismo A22G. Las curvas de
log-rank test y Kaplan-Meier fueron
usadas para analizar el efecto del
polimorfismo A22G sobre la sobrevida (OS). Un valor de p<0.05
fue considerado estadísticamente
significativo.
S158
RESULTADOS. Se encontró
una asociación entre el polimorfismo A22G y el riesgo de recaída
(p<0.005); pacientes con el genotipo GA tuvieron 1.2 (95% CI
1.47-3.53) veces más el riesgo de
tener recaída, mientras los individuos portadores del genotipo GG
tuvieron un riesgo de 1.9 (95% CI
2.41-6.77). Otras variables tales
como la edad y número de leucocitos también fueron asociados
(p<0.005) con el riesgo de recaída.
Por otro lado se observó que los
individuos con los genotipos GA
y GG tuvieron una sobrevida más
baja que los individuos con el genotipo AA (log-rank test; p<0.05).
CONCLUSIONES. Los datos
sugieren un papel muy importante del polimorfismo A22G de la
FPGS sobre el riesgo de recaída y
la sobrevida de los pacientes con
LLA. Nuestro estudio, es el primer
reporte acerca de la determinación
del polimorfismo A22G de la FPGS
en población mexicana y el primer
estudio donde se evalúa la asociación entre el polimorfismo A22G y
la sobrevida en pacientes con LLA.
A1114
EL RETRASO EN EL DIAGNÓSTICO
COMO FACTOR PRONÓSTICO EN
LEUCEMIA LINFOBLÁSTICA AGUDA EN NIÑOS
Lopez Miranda A*, Ramirez Cazares
C*, Rios Solis J*, Corolla Salinas
MM*, Santacruz Esparza E*, Villarreal Martinez L*, Mancias Guerra
C*, Gonzalez Llano O*, Gomez
Almaguer D*.
* Centro Universitario Contra El
Cáncer. Universidad Autónoma De
Nuevo Leon.
dra.adela.lopez@gmail.com
INTRODUCCIÓN. La leucemia
linfoblástica aguda (LLA) representa
el cáncer más común en la infancia. Se reportan actualmente por
diferentes grupos supervivencias
libres de enfermedad superiores al
80 %. Han sido publicados reportes
donde el retraso en el tiempo de
diagnóstico (intervalo entre el inicio
de los síntomas y el diagnóstico) 1-2
es un factor pronóstico adverso en
diversas enfermedades neoplásicas,
incluyendo LLA. Se considera en
LLA que ocurre un retraso en el
diagnóstico cuando transcurren
más de 30 días en el tiempo de
diagnóstico3.
OBJETIVO. Determinar el tiempo transcurrido entre la aparición de
los primeros síntomas y la llegada a
nuestro hospital de los niños diagnosticados con LLA.
MATERIAL Y MÉTODOS. Se
practicaron prospectivamente encuestas a los padres de los niños
diagnosticados con LLA en el Hospital Universitario “José Eleuterio
González” entre marzo del 2013 y
enero del 2014.
RESULTADOS. Los padres de los
24 pacientes diagnosticados en este
período contestaron la encuesta.
El 45 % de los pacientes presentó
retraso en el diagnóstico. El tiempo
transcurrido desde el inicio de los
síntomas hasta la llegada al hospital
fue menos de 7 días en el 29.2%,
entre 7 y 15 días en el 16.7% , más
de dos semanas en el 12.5%, más
de un mes en el 33.3% y más de 3
meses en el 8.3%, con una mediana
de 24 días (Tabla 1). Catorce de los
24 pacientes fueron consultados por
2 o más médicos. El médico de primer contacto fue un médico general
en el 58.8% de los casos, seguido
de un pediatra en el 29.2% .Aunque
el 75% de los médicos de primer
contacto hicieron una referencia
hacia un nivel superior de atención,
sólo en 2 casos se realizó el diagnóstico de manera adecuada por el
primer médico que les proporcionó
la atención (Tabla 2).
CONCLUSIONES. El 45 % de
nuestros pacientes tuvieron un
retraso en el diagnóstico y más de
la mitad de los enfermos fueron
consultados por dos o más médicos.
Libro Educativo 55 Congreso Nacional de la Agrupación Mexicana para el Estudio de la Hematología, A.C.
Es importante determinar si estos
hallazgos tienen valor pronóstico
en los niños con LLA.
A1120
RELACIÓN ENTRE LA CONCENTRACIÓN DE INTERLEUCINAS
EN EL LÍQUIDO CEFALORRAQUÍDEO Y RECAÍDA AL SISTEMA
NERVIOSO CENTRAL EN NIÑOS
CON LEUCEMIA LINFOBLÁSTICA AGUDA SOMETIDOS A UNA
PUNCIÓN LUMBAR
Jaime Pérez JC*, Gamboa Alonso
CM*, Gómez De León A*, López
Silva LJ*, González Llano O*, Gómez Almaguer D*.
* Servicio De Hematología, Medicina Interna, Hospital Universitario
“dr. José Eleuterio González”. Facultad De Medicina Universidad
Autónoma De Nuevo León, Monterrey, México.
carjaime@hotmail.com
INTRODUCCIÓN. Se ha estudiado
la concentración de interleucinas
(IL) en el líquido cefalorraquídeo
(LCR) de niños con LLA con resultados no concluyentes y sin
saberse con certeza si su presencia
o un aumento en su concentración
predicen o acompaña la recaída de
la LLA al SNC.
OBJETIVO. Establecer cuál es
el patrón de interleucinas (ILs) en
el niño con LLA en ausencia o presencia de infiltración del SNC, así
como la relación entre las diferentes
ILs con el curso clínico de la enfermedad al diagnóstico y al recibir
quimioterapia intratecal.
MATERIAL Y MÉTODOS. Se
realizó un estudio prospectivo, descriptivo, de 22 pacientes menores
de 18 años con el diagnóstico de
LLA a los que se les practicó una
punción lumbar diagnóstica y/o
terapéutica. Se determinaron secuencialmente la concentración de
ILs MCP-1, IL-6, TNFa, IL-10, IL-2,
IL-4 en el LCR al momento del diagnóstico y al finalizar la inducción a
la remisión (IR). Se realizó el análisis
descriptivo y se emplearon pruebas
de muestras repetidas y pruebas no
paramétricas como la chi-cuadrada
y prueba exacta de Fisher para
determinar la asociación entre las
variables así como las regresiones
logísticas binarias para el análisis
univariado y multivariado de ambas
determinaciones.
RESULTADOS. Se estudiaron
22 pacientes pediátricos con diagnóstico de LLA, 14 niñas y 8 niños,
relación de 1.75:1, con una mediana
de edad de 7.5 años (2-15 años). Todos presentaron un Inmunofenotipo
B CALLA +. Nueve presentaron organomegalia y 8 adenomegalias (Tabla
1). Se compararon las mediciones de
las Ils al momento del diagnóstico y
al terminar la IR sin encontrar una
diferencia significativa en las ILs-10,
IL-2, IL-4 y TNFa. En las IL-6, IL-8,
MCP-1 se encontró una diferencia
estadísticamente significativa al
comparar las determinaciones en
dos tiempos distintos (Tabla 2).
CONCLUSIONES. Existieron
diferencias significativas en las IL6, IL-8, MCP-1 entre el momento
del diagnóstico y al terminar la IR
en todos los pacientes con LLA.
Es probable que esta diferencia
sea debida a la introducción de la
quimioterapia en el SNC causando
inflamación a nivel local. Los valores de algunas ILs aumentan en
pacientes con infiltración del SNC,
en nuestro grupo no se documentó
una elevación estadísticamente
significativa.
A1121
ASOCIACIÓN DE LOS POLIMORFISMOS CT60 A/G Y CTLA-4 49
A/G DEL GEN CTLA-4 CON EL DESARROLLO DE LEUCEMIA AGUDA
EN PACIENTES PEDIÁTRICOS DEL
ESTADO DE ZACATECAS
Sotelo Ham EI*, Jasso Jasso CA**,
Torres Orozco R**, Ayala Luján JL**,
Barrales Baranda M**, Zapata Sosa
I***, Godina González S**.
* Servicios De Salud De Zacatecas.
** Universidad Autónoma de Zacatecas. *** Hospital General de los
Servicios de Salud de Zacatecas.
sotham@hotmail.com
INTRODUCCIÓN. El gen CTLA-r,
el cual codifica para una proteína
que se expresa en la membrana de
linfocitos T activados, su función
es disminuir la actividad de estos,
al competir con una molécula activadora (CD28) por la unión con
su ligando CD80/87, mecanismo
por el cual célula T se regula. Se ha
identificado que en algunos tumores sólidos hay una sobreexpresión
de esta molécula, lo que conduce
a un estado de tolerancia inmunológica hacia el desarrollo tumoral.;
también la actividad o expresión
ineficiente de CTLA-4 con diversos
polimorfismos genéticos, como lo
son CT60 G/A y CTLA-4 49 A/G,
en donde la presencia al menos
de un alelo A tiene un factor de
susceptibilidad.
OBJETIVO. Determinar los
polimorfismos CT60A/G y CTLA-4
49 A/G por PCR en pacientes pediátricos con leucemia linfoblástica.
MATERIAL Y MÉTODOS
Se realizó un estudio de CasosControles 1:1 con sangre periférica
en pacientes pediátricos con leucemia linfoblástica aguda (LLA)
del Hospital General de Zacatecas
(HGZ) para la detección de los polimorfismos CT60A/G y CTLA-4 49
A/G por PCR en tiempo real, utilizando sondas Taqman prediseñadas
por Applied Biosystems.
RESULTADOS. Se analizaron 62
individuos (27 casos diagnosticados
con LLA (15 hombres y 12 mujeres
entre 3 y 16 años de edad) y 35
controles (17 mujeres y 18 hombres, entre 6 y 15 años de edad)
los cuales cumplieron con las condiciones óptimas para la evaluación
de los polimorfismos CT60 G/A y
CT49 A/G. Para el SNP CT 60 A/G
la presencia al menos de 1 alelo G
S159
Volumen 15, Suplemento 1, 2014
Revista de Hematología
juega un papel protector en cambio
para el SNP CTLA-4 49 A/G el alelo
A puede ejercer un efecto sobre el
riesgo posterior de LLA.
CONCLUSIONES. Estos resultados contrastan con lo reportado
en tumores sólidos e indican una
diferencia entre los mecanismos
de la regulación de la respuesta
inmune ante neoplasias de tumores
sólidos con respecto a la respuesta a
tumores derivados de médula ósea.
A1125
EFICACIA DEL PROTOCOLO TÉCNICO DEL SEGURO POPULAR
VERSIÓN 2005 PARA EL TRATAMIENTO DE LA LEUCEMIA
LINFOIDE AGUDA DEL NIÑO DE
RIESGO ALTO Y HABITUAL, EN
PACIENTES DEL HOSPITAL GENERAL DE MEXICO “DR. EDUARDO
LICEAGA” EN EL PERIODO DE
2007 A 2012
Ventura Enroquez J*, Bolea Murga
V*, Ramos Peñafiel C*, Espinoza Elizondo RM*, Gutiérrez Romero M*.
* Hospital General De México.
yanereb@gmail.com
INTRODUCCIÓN. La leucemia
linfoide aguda es la neoplasia más
frecuente en menores de 15 años.
Se han identificado factores pronósticos como la edad al diagnóstico,
el sexo, alteraciones genéticas,
tipo de estirpe linfoide y el estado
nutricional, entre otros. Los nuevos
regímenes de quimioterapia han
aumentado los índices de supervivencia, sin embargo los porcentajes
de respuesta difieren entre países
desarrollados y no desarrollados
OBJETIVO. El objetivo de este
trabajo fue analizar los resultados
obtenidos tras cinco años de experiencia en el tratamiento con
el Protocolo técnico del Seguro
Popular para el tratamiento de la
Leucemia Linfoide Aguda del niño,
en el servicio de Pediatria del Hospital General de México, a fin de
evaluar la eficacia de este protocolo
S160
mediante indicadores como la supervivencia global y supervivencia
libre de enfermedad, recaídas y
mortalidad.
MATERIAL Y MÉTODOS. Se
realizó una cohorte retrospectiva, basado en la revisión de 52
expedientes clínicos de pacientes
pediátricos con diagnóstico de Leucemia linfoide aguda inscritos en el
Programa del Seguro Popular y que
hubieran recibido tratamiento con
el protocolo técnico de dicho Seguro. Se realizó estadística descriptiva
para la estimación de frecuencias
y porcentajes de las características
sociodemográficas, clínicas y de
clasificación de riesgo para obtener
medidas de tendencia central. El
análisis estadístico se realizó con
el software SPSS versión 20.0, a un
95% de IC.
RESULTADOS. La incidencia
de leucemia linfoide aguda en este
estudio fue del 81%. El género
masculino fue el más frecuente en
el 69% de los casos. La frecuencia
de la presencia del transcrito BCR/
ABL fue similar a lo reportado en
la literatura (1%). El Inmunofenotipo pre B Común CALLA + fue el
más frecuente en el 58.6% de los
casos. La sobrevida global a 5 años
de seguimiento fue del 81%. La
supervivencia libre de enfermedad
a 2.7 años de seguimiento fue de
32%, presentando una disminución
progresiva hasta alcanzar el 18% a
3.8 años de seguimiento. La tasa de
recaída fue del 34%, en contraste
con el 10% reportado por países
desarrollados.
CONCLUSIONES. En México
la Leucemia linfoide aguda infantil
ha observado un aumento en la supervivencia global y supervivencia
libre de enfermedad, a partir del uso
del protocolo técnico del Seguro
Popular, que permite que un número mayor de niños cuente con la
posibilidad financiera para enfrentar esta enfermedad, sin embargo
los resultados obtenidos aun no
muestran la misma magnitud que la
reportada por países desarrollados.
A1136
ASOCIACIÓN ENTRE LOS PORCENTAJES DE EXPRESIÓN CD
MEDIANTE INMUNOFENOTIPO Y
LA PRESENCIA DE VACUOLAS EN
PACIENTE CON LEUCEMIA LINFOBLÁSTICA AGUDA DE NOVO
Barragan Ibañez G*, Barragan
Ibañez G*, Palmeros Morgado G*,
Morales Hernandez M*, Roman
Nuñez C*, Ramos Peñafiel C*,
Rozen Fuller E*, Collazo Jalomo J*,
Garcia Emma M*.
* Hospital General De México.
zakys10@hotmail.com
INTRODUCCIÓN. La leucemia
linfoblástica aguda es una neoplasia
de células inmaduras, caracterizado
por síndrome anémico, hemorrágico, neutropenia. El diagnóstico
es por aspirado de medula ósea,
inmunofenotipo. Se clasifica según
la morfología, inmunofenotipo.
OBJETIVO. Establecer los
diferentes inmunofenotipos en
leucemia linfoblástica aguda y
correlacionar con las alteraciones
morfológicas mediante el puntaje
Avenger (número de vacuolas 0:0.5,
1:1, 2-3: 1.5, +4:2).
MATERIAL Y MÉTODOS. Estudio retrospectivo, observacional,
analítico, basado en los registros
de inmunofenotipos y hallazgos
morfológicos en pacientes portadores de LLA.
RESULTADOS. Se estudiaron un
total de 69 leucemias, la media de
edad fue 32.7 años (4 a 68 años), el
principal inmunofenotipo fue B común 84.1 (n 58), B madura 8.7 % (n
6), Precursores T 4.3% (n 3), Pre B
2.9% (n 2). La expresión media de
CD10 fue 78.7% (0.2 a 99), CD20
11.5% (0.3 a 63.5), CD19 72.2%(0
a 99), CD22 64.1% (0.09 a 99%).
La diferencia de medias entre los
valores de CD10, entre el subtipo
B común y B madura no fueron
Libro Educativo 55 Congreso Nacional de la Agrupación Mexicana para el Estudio de la Hematología, A.C.
significativas (p 0.369) IC (95%),
no fue significativo para CD19,
CD22 (p 0.528, p 0.119), pero si
para CD20 (p 0.000). La expresión
de CD117 si mostro una diferencia
significativa (p 0.045) siendo en
su mayoría B madura. Al realizar
el test de correlación de Pearson
no se logró una correlación significativa entre CD20 y CD117 (p
0.280). Tampoco se encontró una
correlación entre la expresión de
CD117 y marcadores mieloide
(CD13 y CD33) (p 0.436, p 0.267),
ni la correlación para CD10 (p
0.703). A pesar de no encontrar
una correlación al realizar el análisis factorial de los CDs, se aislaron
8 componentes principales en el
cual CD117, se encontró compartiendo varianza con CD13. Acorde
al puntaje de vacuolas el valor
medio para el estirpe B común fue
53.7% (50 a 97), B madura 53.3%
(50 a 66), pre B 66% (54 a 67). Al
realizar comparación de medias
entre los puntajes no se encontró
una diferencia entre B madura y
B común (p 0.924), tampoco para
pre B (p 0.74), B común contra pre
B (p 0.587).
CONCLUSIONES. La expresión
de vacuolas no se asocia a ningún
inmunofenotipo específico de LLA,
la expresión de CD117 se asocia
a la expresión de CD13, la cual
pudiese impactar con el pronóstico
de la enfermedad.
A1139
CORRELACIÓN PRONÓSTICA
ENTRE LA CUENTA ABSOLUTA DE
LINFOCITOS Y LA ENFERMEDAD
MÍNIMA RESIDUAL EN NIÑOS
CON LEUCEMIA LINFOBLÁSTICA
AGUDA
Santacruz Esparza E*, Gonzalez
Llano O*, Corolla Salinas MM*, Ramirez Cazares AC*, Lopez Miranda
A*, Gomez Almaguer D*.
* Universidad Autónoma De Nuevo
Leon.
esantacruz1983@gmail.com
INTRODUCCIÓN. La leucemia
linfoblástica aguda (LLA) es la
neoplasia más común en Pediatría.
Existen diversos factores pronósticos en la LLA del niño. Se sabe
que el tiempo de recuperación de
la hematopoyesis normal posterior
a la quimioterapia de inducción
a la remisión se refleja en la cifra
de los linfocitos. Varios reportes
sugieren como factor pronóstico
de la cuenta absoluta de linfocitos
en diversas entidades, donde una
cuenta baja de linfocitos se asocia
a un pronóstico adverso. Además,
el factor pronóstico más importante
en niños con LLA es tener positiva
la determinación de la enfermedad
mínima residual (EMR) después de
la inducción.
OBJETIVO. Determinar la correlación pronóstica de la cuenta
absoluta de linfocitos (CAL) y la detección de EMR en niños con LLA.
MATERIAL Y MÉTODOS. Se
revisaron retrospectivamente los
expedientes de los niños con LLA en
nuestro hospital de enero del 2010
a diciembre del 2013, para conocer
la CAL de la biometría hemática y
la EMR en médula ósea del día 29
del tratamiento. De 107 pacientes,
74 contaban tanto con la EMR
como con la CAL del mismo día.
Se contrastó la CAL con la EMR al
final de la inducción con la prueba
de x2/exacta de Fisher. Asimismo
se correlacionó con el resultado
de la EMR mediante la correlación
de Spearman. Por último se realizó
un análisis de regresión logística
binaria univariada para observar la
influencia de algunos factores con
la positividad de la EMR.
RESULTADOS. Cuarenta de los
74 pacientes tuvieron EMR negativa
y en 34 se detectó EMR positiva. La
mediana de la CAL fue de 2.4 x 10 9
/L. De los 74 pacientes, 56 enfermos
presentaron una CAL > 1.5x109/L y
18 tuvieron una CAL < 1.5x109/L.
No hubo significancia estadística
al contrastar la CAL al final de la
inducción con la EMR positiva
(p=0.41); tampoco se encontró
una diferencia al compararlos con
las variables categóricas cuando se
realizó una división entre aquellos
con una CAL mayor o menor de 1.5
x 10 9/L(p=0.42). No existió una
correlación entre el CAL de 1.5 x
109/L y el resultado de la EMR (r de
Spearman -0.16, p=0.17).
CONCLUSIONES. Aunque la
asociación de los factores documentados en otros estudios con
influencia al resultado de la EMR,
en este trabajo la cuenta de linfocitos al final de la inducción no tuvo
tal relación. Se requiere un seguimiento a largo plazo para establecer
la sobrevida en estos pacientes.
A1141
MANTENIMIENTO INTERMITENTE EN PACIENTES PEDIATRICOS
CON LEUCEMIA LINFOBLASTICA
AGUDA
Ramírez Cazares AC*, Rios Solis
J*, Lopez Miranda A*, Villarreal
Martinez L*, Gonzalez Llano O*,
Mancias Guerra C*, Gomez Almaguer D*,
* Universidad Autónoma De Nuevo
Leon.
dracarormz@hotmail.com
INTRODUCCIÓN. La Leucemia
Linfoblástica Aguda (LLA) representa 30% de todas las malignidades
en la edad pediátrica. La etapa de
mantenimiento es muy importante
para lograr prolongar la remisión
obtenida. La 6-mercaptopurina
(6-MP) y el metotrexato (MTX) son
las drogas más utilizadas en esta
fase y sus efectos adversos son
principalmente hematológicos y
hepáticos. Un componente importante del éxito del tratamiento
depende del adecuado manejo de
la toxicidad, que permitirá menores
interrupciones en la administración
de quimioterapia y por lo tanto una
disminución de recaídas. Durante
esta fase se ha reportado que hasta
S161
Volumen 15, Suplemento 1, 2014
Revista de Hematología
el 85% de los pacientes pueden
presentar datos de hepatotoxicidad
y el 76% de ellos algún episodio
infeccioso. En pacientes con datos
repetitivos de toxicidad durante
la fase de mantenimiento se ha
sugerido modificar la estrategia de
tratamiento con respecto a la 6-MP
y metotrexato con la intención
de obtener efecto terapéutico con
disminución de toxicidad y de suspensiones de los esquemas.
OBJETIVO. Determinar la efectividad del uso de mantenimiento
intermitente en pacientes con LLA
que con el mantenimiento convencional presentaron toxicidad.
MATERIAL Y MÉTODOS. Serán
incluidos los pacientes que hayan
presentado 3 o más episodios de
toxicidad hematológica grado 3 o
que requirieron suspender el tratamiento por más del 25% en 90 días
del primer año del mantenimiento;
o que hayan desarrollado toxicidad
hepática grado 2 en base al CTCAE
versión 4.0. En el protocolo de
mantenimiento intermitente cada
3 semanas el metotrexato es administrado a una dosis de 200 mg/m2
en infusión intravenosa para 6 horas
con rescate de folinato cálcico. A
las 24 horas de iniciada la infusión
de metotrexato se iniciara 6MP a
100 mg/m2 por 10 días. Cada 8
semanas se realizará intensificación con vincristina a 1.5 mg/m2,
quimioterapia intratecal y dexametasona por 3 días.
RESULTADOS. Actualmente
se encuentran 6 pacientes en este
esquema, cinco pacientes fueron incluidas por toxicidad hematológica
y una debido a hepatitis y pancreatitis. Los pacientes han respondido
adecuadamente, dos de ellos ya se
encuentran en etapa de vigilancia
y solo una paciente presentó un
episodio de neutropenia posterior.
CONCLUSIONES. Este es un
estudio piloto y es necesario incluir
más pacientes para determinar
la efectividad de este protocolo,
S162
sin embargo creemos que debe
ser considerado en pacientes con
suspensiones frecuentes con el
mantenimiento convencional.
A1146
CARACTERÍSTICAS CLÍNICAS,
BIOLÓGICAS Y RESPUESTA AL
TRATAMIENTO CON PROTOCOLO AIDA MODIFICADO EN
PACIENTES PEDIÁTRICOS CON
LEUCEMIA PROMIELOCÍTICA
AGUDA
Jiménez Hernández E*, Perla Posada R*, Sánchez Jara B*, Ortiz Torres
G*, Núñez Villegas N*, Balam
Canul A*, Martínez Villegas O*,
López Hernández M*, Martínez
Martell A*, Herver Olivares A*, Arellano Galindo J**, Bekker Méndez
C***, Mejía Aranguré J****.
* Instituto Mexicano Del Seguro
Social. ** Unidad de Investigación
Hospital Infantil de México “Federico Gómez”. *** Unidad de
Investigación Hospital de Infectología UMAE CMN “La Raza”. ****
Coordinación de Investigación
CMN Siglo XXI.
elvajimenez@yahoo.com
INTRODUCCIÓN. La Leucemia
Promielocítica Aguda (LPA) tiene
manifestaciones clínicas, biológicas
y citogenéticas muy particulares al
resto de las LMA, a partir del uso
del ácido holo-trans-retinoico para
su tratamiento, los resultados han
mejorado, al disminuir las muertes
tempranas por hemorragias
OBJETIVO. Conocer las características clínicas, biológicas y
respuesta al tratamiento con protocolo AIDA modificado en pacientes
pediátricos con LPA
MATERIAL Y MÉTODOS. Cohorte retrospectiva observacional
descriptiva, se incluyeron pacientes menores de 16 años de edad,
con diagnóstico de LPA de novo
que fueron tratados con el protocolo de quimioterapia AIDA
modificado entre Enero del 2003 a
Agosto del 2012. Se utilizó prueba
de Chi-cuadrada y prueba exacta
de Fisher, valor de p<0.05 se consideró estadísticamente significativa,
análisis de supervivencia mediante
Kaplan-Meier
RESULTADOS. Total 42 pacientes, mediana de edad 11 años,
predominó en masculino (54.8%).
La manifestación clínica más común fue hemorragia mucocutánea
(73.8%) seguido de hemorragia
intracraneana y pulmonar como
casusas de muerte temprana, la presencia de infiltración extramedular,
fue común principalmente adenomegalias (50%) y hepatomegalia
(47.6%). Presentaron CID 61.9%,
con predominio de fibrinólisis en
7.1%. La mediana de leucocitos de
6950/µL y plaquetas 17,200/µL. El
subtipo morfológico hipergranular
fue de 76% e hipogranular 24%.
Para el análisis de la respuesta
al tratamiento se excluyeron 17
pacientes (40%) por diferentes
causas; 10 (23.8%) por muerte
temprana sin tratamiento y 16.6%
por cambio de protocolo. De los 25
pacientes que recibieron el protocolo completo, el 100% alcanzaron
remisión hematológica completa,
con una mediana de 28 días. De
las complicaciones del tratamiento,
predominó fiebre y neutropenia.
Permanecen vivos 22/25 pacientes
(88%), la supervivencia libre de
enfermedad fue de 84% con una
mediana de seguimiento de 1037
días. La supervivencia global de
88% con mediana de 1207 días,
con seguimiento total de 9.8 años.
No encontramos diferencia estadísticamente significativa entre el
riesgo bajo o alto y recaída (p=
0.377), tampoco entre riesgo bajo o
alto y mortalidad (p= 0.645)
CONCLUSIONES. Las características clínicas y biológicas
son similares a lo reportado en la
literatura excepto la infiltración
extramedular que fue mayor en
nuestra población. La variante
Libro Educativo 55 Congreso Nacional de la Agrupación Mexicana para el Estudio de la Hematología, A.C.
hipogranular se presenta en un
porcentaje bastante alto similar a
lo reportado en otros estudios. El
ser riesgo bajo o alto no influyó
significativamente para la recaída
o mortalidad, probablemente porque ambos recibieron la misma
intensidad de tratamiento. Con
nuestros resultados de RC, SLE, SG,
se demuestra la eficacia del protocolo AIDA modificado en población
pediátrica, al ser comparados con
otros grupos internacionales.
A1156
ESTUDIO COMPARATIVO DE 30
PACIENTES ANALIZADOS CON
LOS CRITERIOS DE LA EGIL PARA
LEUCEMIA BIFENOTÍPICA CONTRA LOS CRITERIOS DE LA OMS
2008 DE LEUCEMIA DE FENOTIPO
MIXTO
Solis Solis JC*, Limón Flores A*, Lobato Tolama RD*, Pérez Lozano U*,
Alarcón Rodriguez M*, Espinoza
Vazquez CF*, Huerta Moreno A*,
Pavón Vargas A*.
* Hospital De Especialidades CMN
Gral De Div Manuel Avila Camacho
IMSS Puebla/ Universidad Popular
Autónoma Del Estado De Puebla.
jchemato@yahoo.com
INTRODUCCIÓN. Los pacientes
con datos clínicos de Leucemia
son sometidos a pruebas diagnósticas que incluyen morfología
celular, cariotipo e inmunofenotipo, con el objetivo de clasificar
el tipo de leucemia. Sin embargo
existen pacientes que presentan
una diversidad de marcadores en
su membrana citoplasmática o
intracitoplasmáticos de diferentes
linajes, estas leucemias se han clasificado como bifenotípicas (LAB)
según los criterios EGIL, a nivel
mundial estas leucemias ocupan un
porcentaje del 2 al 5%. En el 2008
la OMS publica una clasificación
de tumores hematopoyéticos y
linfoides modificando los criterios
diagnósticos e introduce un nuevo
término llamado leucemia aguda de
fenotipo mixto (LAFM). Por lo que
es importante revisar estos nuevos
criterios y analizar los resultados
de los pacientes clasificados como
LAB para así poder reclasificarlos si
fuera necesario.
OBJETIVO. Comparar los resultados por citometría de flujo de
los pacientes diagnosticados con
LAB por EGIL, con los criterios de
la OMS 2008.
MATERIAL Y MÉTODOS. Material y Métodos: Un total de 30
pacientes del CMN MAC IMSS Puebla se diagnosticaron como LAB de
1993 al 2013. A partir del año 2000
para realizar el inmunofenotipo se
utilizó un citómetro de flujo BD,
con un panel de anticuerpos que
incluyen marcadores linfoides T, B
y mieloide.
RESULTADOS. De un total de
1222 pacientes 30 cumplieron con
los criterios del EGIL para ser clasificados como LAB, resultando 13
pediátricos, 10 hombres adultos y 7
mujeres adultas, arrojando un 2.4%
de LAB. Al reanalizar sus resultados
siguiendo los criterios de la OMS
2008 el número total de leucemias
ahora llamadas de fenotipo mixto se
redujo a 21, siendo 11 pediátricos, 6
hombres adultos, 4 mujeres adultas.
CONCLUSIONES. De un total
de 1222 pacientes 30 cumplieron
con los criterios del EGIL para ser
clasificados como LAB, resultando
13 pediátricos, 10 hombres adultos
y 7 mujeres adultas, arrojando un
2.4% de LAB. Al reanalizar sus resultados siguiendo los criterios de
la OMS 2008 el número total de
leucemias ahora llamadas de fenotipo mixto se redujo a 21, siendo
11 pediátricos, 6 hombres adultos,
4 mujeres adultas.
A1166
INCIDENCIA DE LEUCEMIAS EN
PACIENTES PEDIÁTRICOS DEL
HOSPITAL GENERAL CENTRO
MÉDICO LA RAZA
Reyes Huesca S*, Escamilla González JR*, Aguilera Caldera JW*,
Carpio Mireles N*, Herver Olivares
AN*, Nuñez Villegas NN*, Robles
Espinosa LA*.
* Instituto Mexicano Del Seguro
Social Hospital General Centro
Medico La Raza.
sofia_reyesh@yahoo.com.mx
INTRODUCCIÓN. Las leucemias
son enfermedades de etiología
desconocida; se caracterizan por
la proliferación incontrolada de
células hematopoyéticas inmaduras
o maduras que invaden la médula
ósea (MO), sangre periférica y otros
órganos. Lo que define a las leucemias no es únicamente el aumento
de células que evaden los mecanismos normales de regulación de la
hematopoyesis, sino también el mal
funcionamiento de la MO normal
.La mayoría (75-80%) corresponden
a Leucemias Linfoblásticas Agudas
(LLA) y el resto a Leucemias Mieloblásticas Agudas (LMA), ya que
las leucemias crónicas son muy
raras (2%).
OBJETIVO. Determinar la incidencia de las leucemias de novo en
el Hospital General Centro Médico
Nacional La Raza en pacientes
pediátricos, correspondientes al
periodo 2009 al 2013.
MATERIAL Y MÉTODOS. Aspirado de MO con EDTA al 10%
obtenido de pacientes menores de
16 años con diagnóstico clínico,
morfológico (tinción de Wrigth),
citoquímico (mieloperoxidasa, esterasa inespecífica, fosfatasa ácida
y PAS) y fenotípico de leucemia de
novo. Las determinaciones de los
diferentes marcadores de superficie e intracelulares en las células
blasticas y linfoides se realizaron
por citometría de flujo utilizando un
equipo FACSCalibur de 4 colores.
Es un estudio retrospectivo, observacional, longitudinal y descriptivo.
RESULTADOS. En nuestro centro
de trabajo en el periodo comprendi-
S163
Volumen 15, Suplemento 1, 2014
Revista de Hematología
do del 2009 al 2013 se presentaron
403 nuevos casos de leucemia, de
los cuales la mayoría corresponde
a leucemias linfoblásticas, con
predominio el de las células Pre-B.
Menos del 20% corresponden a la
estirpe mieloide, dentro de las que
destacan la M3 y M4. El linaje T
correspondió solo al 3%, mientras
que las Leucemias Granulocíticas
Crónicas al 1%.
CONCLUSIONES. Los resultados obtenidos en nuestro estudio
coinciden con la incidencia reportada en la literatura a nivel
mundial, encontrando que el tipo
de leucemia predominante es el de
las células Pre-B. Asimismo, podemos concluir que la citometría de
flujo sigue siendo una herramienta
útil para el diagnóstico de las leucemias.
A1169
EFICACIA DE LAS ESTRATEGIAS TERAPÉUTICAS ESTABLECIDAS PARA
EL TRATAMIENTO DE LAS LEUCEMIAS AGUDAS DEL ADULTO
MAYOR EN EL DEPARTAMENTO
DE HEMATOLOGIA DEL HOSPITAL GENERAL DE MEXICO
Galindo Lopez MP*, Ramos Peñafiel C*, Del Olmo Gil E*,
* Hospital General De México.
palitaglbe@hotmail.com
INTRODUCCIÓN. A pesar que la
media de edad de presentación de
Leucemias Agudas en los adultos
es por encima de los 60 años,
existen en general pocas estrategias
eficaces para su manejo. Diversos
ensayos han utilizado regímenes
intensivos o fraccionados de quimioterapia, desafortunadamente
sin éxito, ya que las diversas comorbilidades asociadas a la edad
muestran una influencia significativa en el mal pronóstico de estos
pacientes.
OBJETIVO. Determinar si existe
diferencia en cuanto a la eficacia
terapéutica, ésta establecida por la
S164
supervivencia global y supervivencia
libre de enfermedad, acorde con las
diferentes estrategias terapéuticas
utilizadas en pacientes portadores
de leucemias agudas mayores de 55
años atendidos en el Departamento
de Hematología desde Enero del
1998 hasta Octubre del 2013.
MATERIAL Y MÉTODOS. Estudio retrospectivo, observacional,
prolectivo realizando la revisión
de registros médicos desde Enero
de 1998 hasta Octubre del 2013
Período. 1998- 2013 de pacientes
mayores de 50 años que hayan sido
ingresados al servicio de Hematología y que se les haya considerado
candidatos a algún tipo de terapia.
Se excluirán a aquellos que hayan
solicitado su egreso voluntario o
que contaran con una expectativa
de vida menor de 72h.
RESULTADOS. Se analizaron un
total de 67 expedientes, teniendo
una distribución homogénea en
cuanto al tipo de leucemia, 34
linfoide y 33 mieloide. Las comorbilidades mas prevalentes la Diabetes
Mellitus 46% y la Hipertensión
Arterial Sistémica 36% Al analizar
los factores de mal pronostico al
momento del diagnóstico, se encontró hipoalbuminemia en 41.8%,
mas de 30.000 leucocitos 40.3%,
edad mayor a 60 años en 53.7%,
en inmunofenotipo la presencia de
CD 117 en 10 (14.9%), CD 20 en 5
(7,5%), y hallazgo en el cariotipo de
cromosoma Filadelfia en 3 (4.5%).
Así mismo se valoro el tipo de
tratamiento dado a estos pacientes
discriminándolo de acuerdo a intensidad en conservador, intensivo,
baja y de soporte, encontrándose
6% en el primero, 47,8% en el
segundo, 16,4% en el tercero y 20
(29,9%) en el último, además de la
respuesta al mismo con remisión
completa 40,3%, muerte en 4,5%,
refractario 55,2%. La supervivencia
a dos años de estos pacientes fue
menor al 1% sin importar que tipo
de tratamiento o tipo de leucemia.
CONCLUSIONES. Sin importar
el tratamiento dado en nuestros
pacientes, la expectativa de vida
a dos años es la misma. A pesar
que aquellos sometidos a regímenes intensivos integran remisión
luego de la inducción, fallecen
de complicaciones propias de la
inmnosupresión.
A1182
EFICACIA DE DIVERSAS ESTRATEGIAS TERAPÉUTICAS PARA EL
TRATAMIENTO DE LEUCEMIAS
DEL ADULTO MAYOR: EXPERIENCIA DEL DEPARTAMENTO DE
HEMATOLOGIA DEL HOSPITAL
GENERAL DE MEXICO
Ramos Peñafiel CO*, Galindo
López MP*, Montaño Figueroa
E*, León González G*, González
Chávez A*.
* Hospital General De México.
leukemiachop@hotmail.com
INTRODUCCIÓN. Diversos tipos
de cáncer son frecuentes en el adulto mayor, siendo las comorbilidades
la principal limitante terapéutica.
Son pocos los ensayos en leucemias
en adultos mayores que brinden
recomendaciones específicas sobre
las estrategias terapéuticas
OBJETIVO. Establecer la eficacia de las diferentes estrategias
terapéuticas en pacientes adultos
mayores portadores de leucemia
aguda
MATERIAL Y MÉTODOS. Diseño: Estudio de cohorte ambilectivo
en pacientes portadores de leucemia entre 1998 - 2014. Estadística:
Para la prueba de contraste de hipótesis se utilizara ji cuadrada . Para
la función de supervivencia curvas
de Kapplan Meyer. Análisis de regresión de Cox para variables que
impacten sobre la supervivencia de
los pacientes a una significancia
prefijada en p <0.05 con un intervalo de confianza del 95%.
RESULTADOS. Se estudiaron 67
pacientes, en su mayoría del género
Libro Educativo 55 Congreso Nacional de la Agrupación Mexicana para el Estudio de la Hematología, A.C.
femenino (59.7%), 33 (n=49.3) correspondieron a leucemia mieloide
y 50.7% (n=34) linfoide. Un 13.4%
(n=9) eran diabéticos, contaban con
> 2 comorbilidades (EPOC, ICC,
IHC). La media de edad para LLA
fue 62 años y LMA 67 años estadísticamente significativa (p=0.04). No
se encontró en leucocitos (0.291),
hemoglobina (0.600) o plaquetas
(0.696). La tasa de RC general
fue 40.3% (n=27) siendo mayor
para LLA (50% versus 30.3%). La
mortalidad en inducción fue equivalente (3 versus 5.9%). La tasa de
leucemias refractarias fue mayor
en LMA (66.7%). El tratamiento
más frecuente fue terapia de alta
intensidad (47.8%) seguido de baja
intensidad (16.4%), soporte transfusional (29.9%) y conservador (6%).
La supervivencia a 12 meses fue del
100% para la LMA con tratamiento
de soporte en comparación con la
LLA la cal fue del 100% a 12 meses
con tratamiento intensivo. El tratamiento intensivo con Dosis altas de
AraC o 7+3 impacto en la supervivencia de la LMA (48% a 12 meses),
a diferencia de la LLA en donde el
tratamiento de baja intensidad se
asoció con un pronóstico adverso.
Al realizar el análisis de Cox solo el
riesgo fue significativo (p=0.022).
Las comorbilidades si impactaron
con el pronóstico (más de 2; 60%
de supervivencia) a diferencia de
sin morbilidades (100% de supervivencia a 12 meses )
CONCLUSIONES. La eficacia
del tratamiento en adultos mayores
aun es pobre, terapias de baja intensidad son la elección para LMA
pero en aquellos con un adecuado
estado funcional las terapias estándar son eficaces en LLA.
A1186
TIMIDINA KINASA MARCADOR
DE PROLIFERACION TUMORAL
EN LEUCEMIAS AGUDAS
Parra Ortega I*, Lopez Martinez
B*, Dorantes Acosta E*, Morales
Balcazar I*, Herrera Muciño I*,
Parra Ortega I*.
* Hospital Infantil De México Federico Gómez. ** Clinica Ruiz.
i_parra29@hotmail.com
INTRODUCCIÓN. Las leucemias
agudas (LA) son un grupo heterogéneo de padecimientos que suponen
proliferación desordenada de una
clona de células hematopoyéticas.
En México, el cáncer es la segunda
causa de muerte en la población de
1 a 15 años de edad y la leucemia
aguda es el cáncer más frecuente
en niños menores de 15 años. La
timidina quinasa (TK) es una enzima
celular que está involucrada en la
síntesis de DNA y se ha considerado
como marcador de proliferación
celular en algunos tumores sólidos,
sin embargo en leucemias agudas
no existe evidencia de que pueda
ser utilizado como marcador de
proliferación tumoral motivo por el
que en esta investigación se planteó
el siguiente objetivo. Determinar la
utilidad de la TK en sangre como
marcador de proliferación tumoral
en pacientes con leucemia aguda
OBJETIVO. Medir la timidina
quinasa en pacientes con leucemia
MATERIAL Y MÉTODOS. Se
cuantificó la timidina quinasa en
sangre periférica de 125 niños con
leucemia aguda al diagnóstico y en
138 niños sin leucemia aguda utilizando un inmunoensayo indirecto
modificado por quimioluminiscencia. Del grupo de niños con LA;
90 fueron con Leucemia aguda
linfoblástica tipo B (LAL-B), 13 con
Leucemia aguda linfoblástica tipo T
(LAL-T) y 22 pacientes con leucemia Aguda Mieloide (LAM)
R E S U LTA D O S . D e l g r u p o
control la media de los valores
obtenidos de la TK para este grupo
fue de 26.5 U/L con un desviación
estándar de 13.1 con los intervalos
de confianza al 95% inferior de
24.3 U/L y superior del 28.7. En el
grupo de enfermos se cuantificó la
timidina quinasa encontrando intervalos de 6.8 UI hasta 3520 UI con
una media de 351 para el grupo de
leucemia y para el grupo control intervalos de 5 UI a 53 UI una media
de 30.6 UI. La diferencia de medias
fue estadísticamente significativa
(P< 0.0001). En la LAL-B la media
fue de 199 UI con intervalos de 6UI
a 3216 UI, en la LAL-T se encontró
una media de 1387UI y en LAM
se encontró una media de 602 UI.
CONCLUSIONES. La timidina
quinasa es una enzima que en la
LAL tipo B sus niveles se encuentran
distribuidos de forma heterogénea,
sin embargo en el 90% de los pacientes con LAL-T y en la LAM se
incrementa de forma importante.
Estos resultados son la base de una
investigación en el que se propone realizar diferentes estudios de
asociación y de pronóstico en las
leucemias agudas.
A1192
FRECUENCIA DE OBESIDAD Y
SINDROME METABOLICO EN
PACIENTES PEDIATRICOS CON
LEUCEMIA LINFOBLASTICA AGUDA EN EL HOSPITAL DEL IMSS
GINECOPEDIATRIA No.48
Alatoma Medina NE AM*, Peralta
Cortázar C*, Sosa Bustamante GP*,
Rojas Rodriguez YA*,
* Instituto Mexicano Del Seguro
Social Ginecopediatria No. 48.
exitosmile@yahoo.com.mx
INTRODUCCIÓN. La Leucemia
Linfoblástica Aguda (LLA) representa el cáncer más común en la
infancia, constituyendo el 25-30%
de los casos registrados de cáncer
en niños entre los 0 a 14 años de
edad. La supervivencia actual es del
80% a los 5 años de tratamiento y,
de 90 % a los 8 años de tratamiento.
Una proporción pequeña de estos
pacientes morirá por recaída de la
enfermedad, de un segundo cáncer
o de alguna complicación tardía
del tratamiento. Varios estudios han
S165
Volumen 15, Suplemento 1, 2014
Revista de Hematología
mostrado incremento en la prevalencia de sobrepeso y obesidad en
niños sobrevivientes de cáncer que
va del 16% al 50%.
OBJETIVO. Conocer la frecuencia de obesidad y síndrome
metabólico en niños con Leucemia
linfoblástica aguda.
MATERIAL Y MÉTODOS. En
cada paciente se realizó evaluación
antropométrica, medición de la
presión arterial, medición de la circunferencia de la cintura, medición
de talla y peso en forma controlada
y los siguientes exámenes de laboratorio: glucosa sérica y perfil de
lípidos. Se calculó el índice de masa
corporal (IMC). Todos los resultados
antropométricos y bioquímicos se
compararon en tablas de percentiles
para edad y sexo. Para clasificación
de síndrome metabólico se utilizaron los criterios de la Federación
Internacional de Diabetes.
RESULTADOS. Incluimos 41 pacientes en el estudio, la frecuencia
de obesidad al diagnóstico fue de
9% y 12% al final del estudio y la
frecuencia de síndrome metabólico
fue de 12% al final del estudio. No
hubo diferencias significativas en
los grupos de obesos y no obesos
en ninguna de las variables. En el
grupo con y sin síndrome metabólico, se encontró mayor IMC (p
0.02), elevación de triglicéridos (p
0.02) y de VLDL (p 0.03) de forma
significativa, para tensión arterial y
niveles de glucosa no se encontró
significancia estadística en este
grupo.
CONCLUSIONES. La frecuencia de síndrome metabólico en
los pacientes con LLA, aumenta
desde los primeros meses de
tratamiento significativamente,
mostrando mayor relación con las
de alto riesgo y con los pacientes
que inician el tratamiento con
peso normal. La recomendación
de políticas para la institución es
realizar un programa de vigilancia
desde el diagnóstico y continuar
el seguimiento hasta terminar el
tratamiento de LLA para prevenir
el desarrollo de estas dos enfermedades.
LEUCEMIAS CRÓNICAS
PRESENTACIÓN ORAL
A1074
TERAPIA CON INHIBIDORES DE
TIROSIN CINASA EN PACIENTES CON LEUCEMIA MIELOIDE
CRÓNICA
Urrutia Alvarado JF*, García Salas
JJ*, Esquivel Molina CG*, García
Marín AY*.
* Instituto Mexicano Del Seguro
Social UMAE HE No. 71 Torreón
Coah.
jf_urrutia@hotmail.com
INTRODUCCIÓN. La Leucemia
Mieloide Crónica (LMC), es una
neoplasia mieloproliferativa, cuya
patogénesis central es la Translocación cromosómica t:(9;22)
(q34;q11), o cromosoma Philadelphia, el cual resulta en una
expresión de una oncoproteína
llamada BCR-ABL. Con la aparición
de los Inhibidores de Tirosin-Cinasa
(ITK) la sobrevida de estos pacientes
ha cambiado dramáticamente que
con una supervivencia que en muchos casos promete ser comparable
S166
a la de las personas normales de
edad similar.
OBJETIVO. Determinar el índice de Respuesta molecular y
hematológica a Inhibidores de
Tirosin-Cinasa.
MATERIAL Y MÉTODOS. Se
trata de un estudio Descriptivo,
pacientes mayores de 16 años, con
diagnóstico de LMC en control
en la consulta de Hematología
de la UMAE 134 HE 71, que se
encuentren actualmente con tratamiento con ITK y que cuenten
con expediente clínico completo,
se registraran datos demográficos,
clínicos, bioquímicos y moleculares en hoja elaborada para este fin.
Para el análisis se utilizó el paquete
estadístico SPSS v21 y epidat 3.1
RESULTADOS. Se incluyeron
74 pacientes con LMC tratados
con ITK, el 97% tuvo Respuesta
Hematológica Completa (RHC) en
un promedio de 1.65 meses, se encontró Respuesta Molecular Mayor
(RMM) hasta en 71% de los casos,
con sobrevida general de hasta 85%
a 5 años. Se calculó un OR de 4.2,
5.7 y 13.4 para no obtener RMM en
los grupos de riesgo alto de Sokal,
Hasford y EUTOS respectivamente.
Los efectos adversos hematológicos
y no hematológicos se presentaron
hasta en 37.8% y 54% de los pacientes respectivamente.
CONCLUSIONES. Los índices
de RHC y RMM son similares a los
reportados en la literatura internacional, Las escalas Sokal, Hasford
y EUTOS correlacionaron de forma
significativa con el riesgo de presentar o no respuesta a tratamiento. Los
eventos adversos se registraron en
una menor proporción de pacientes
probablemente debido a un subregistro en el expediente clínico.
A1098
PREDICCIÓN DE LA RESPUESTA
CITOGENÉTICA MEDIANTE LA
ESCALA EUTOS EN PACIENTES
CON LMC EN FASE CRÓNICA
TRATADOS CON IMATINIB EN
Libro Educativo 55 Congreso Nacional de la Agrupación Mexicana para el Estudio de la Hematología, A.C.
EL HOSPITAL GENERAL DE OCCIDENTE
Best Aguilera CR*, Fernández Figueroa YM*, García Balderrama
JA*, Robles Rodríguez A*, Rojas
Sotelo RM*, Lomelí Guerrero A*,
Pérez Banuet Saucedo D*, Pérez
Escamilla G*, Lozano Valdivia J*,
* Hospital General De Occidente/
universidad De Guadalajara.
carlosbest@gmail.com
INTRODUCCIÓN. Las escalas de
riesgo para LMC fueron originalmente diseñadas para tratamientos
con bajas posibilidades de inducir
respuesta citogenética y son previos
al Imatinib. Ha quedado clara la eficacia de este agente en la inducción
de respuestas citogenéticas en una
mayor proporción de pacientes y la
importancia de esto en la supervivencia libre de progresión. La escala
EUTOS fue diseñada con esto en
mente, establece dos grupos de riesgo en función del tamaño del bazo
y la cuenta de basófilos en sangre
periférica. Validada con muestras
grandes en pacientes con evaluación citogenética al mes 18. Aquí
exploramos el valor predictivo de
esta escala en 63 pacientes evaluados para respuesta citogenética en
cualquier momento del tratamiento
con Imatinib.
OBJETIVO. Evaluar el valor
predictivo de la escala EUTOS en la
inducción de respuesta citogenética
de la LMC tratada con Imatinib
400 mg/día, evaluada en cualquier
momento del tratamiento.
MATERIAL Y MÉTODOS. Sesenta y tres pacientes con fase
crónica de LMC y tratamiento con
Imatinib 400 mg, evaluados para
respuesta citogenética en cualquier
momento del tratamiento, fueron
estratificados de acuerdo a la escala EUTOS y a la categoría de la
respuesta citogenética (completa,
parcial y nula). Se aplicó una prueba de X2 para el valor predictivo de
la clasificación de EUTOS (riesgo
alto o bajo) y la respuesta citogenética obtenida. Se estimaron
también: valor predictivo positivo
(VPP), valor predictivo negativo
(VPN), sensibilidad y especificidad
para la muestra.
RESULTADOS. Se identificaron
51 pacientes (81%) con riesgo bajo
y 12 (19%) de alto riesgo. La mediana de evaluación citogenética fue
de 48 meses (3-72), se obtuvieron
83% de RCC, 15.5% de RCP, 1.5%
no alcanzó RC. La distribución de
las respuestas citogenéticas por
grupo de riesgo es como se ilustra
en la siguiente tabla: EUTOS RCC
RCP NO RC. BAJO RIESGO 67%
14% 0%. ALTO RIESGO 16% 1.5%
1.5%. TOTALES 83% 15.5% 1.5%.
La prueba de X2 correlacionó positivamente al grupo de riesgo bajo
con la obtención de una respuesta
citogenética otorgándole valor predictivo. El VPP fue 18%, VPN 84%,
sensibilidad 16% y la especificidad
se calculó en 82%.
CONCLUSIONES. La proporción de pacientes con RCC
(mediana de evaluación 48 meses)
tiene una tendencia acumulativa
similar a la informada en el seguimiento a 60 meses en el estudio
IRIS. De la misma forma la escala
EUTOS tuvo un valor predictivo en
la respuesta citogenética que no
fue restringido por el momento de
la evaluación de la misma.
A1148
VALIDEZ Y SEGURIDAD DE LA
CITOMETRÍA DE FLUJO COMO
PRUEBA DIAGNÓSTICA PARA LA
DETECCIÓN DE LA PROTEÍNA
BCR-ABL EN PACIENTES CON
LEUCEMIA AGUDA Y MIELOIDE
CRÓNICA EN EL HOSPITAL JUÁREZ DE MÉXICO (HJM). ESTUDIO
PILOTO
Cruz Rico J*, Verdejo Hernández
B*, Hernández Caballero ME**.
* Hospital Juárez De México. **
Escuela Superior de Medicina IPN.
jcruzrico@gmail.com
INTRODUCCIÓN. El diagnóstico
de la leucemia mieloide crónica
(LMC) se basa en la detección
del cromosoma Filadelfia (Ph+),
translocación t(9;22), presente en
casi todos los pacientes y en un
subgrupo de mal pronóstico de pacientes con leucemia linfoblástica
de tipo B (LLA). Las aberraciones
de la fusión genética son detectadas
por cariotipo, hibridación in situ
con fluorescencia (FISH) o reacción
en cadena de la polimerasa (PCR).
Estas técnicas requieren de laboratorios especializados no siempre
disponibles o con resultados después de varios días.
OBJETIVO. Determinar la validez y seguridad como prueba
diagnóstica de la CMF comparada
con PCR en pacientes con LMC y
LLA positivas al transcrito BCR-ABL.
MATERIAL Y MÉTODOS. La
proteína de fusión BCR-ABL se
detecto por CMF y comparamos
el resultado con PCR por medio
de un estudio piloto de prueba
diagnóstica. Estudiamos pacientes
de los Servicios de Hematología y
Oncología pediátrica del HJM de
mayo a octubre de 2013. Criterios
de inclusión: hombres o mujeres,
mayores de dos años edad, diagnóstico de LMC o LLA de reciente
diagnóstico o en recaída, así como
otras enfermedades con las que hicimos diagnóstico diferencial, todos
los pacientes tuvieron un control
negativo de la prueba. La muestra
se obtuvo de sangre en la mayoría
de los pacientes y se procesó en el
laboratorio de CMF del HJM. EL
análisis estadístico incluyo sensibilidad, especificidad, valor predictivo
positivo (VPP), valor predictivo
negativo (VPN) y exactitud.
RESULTADOS. En 52 pacientes
estudiados, 15 fueron positivos
para BCR-ABL por CMF, 12 con
LMC y 3 con LLA, todos positivos por PCR. Un paciente con
LMC negativo con CMF, resulto
positivo con PCR. Los positivos
S167
Volumen 15, Suplemento 1, 2014
Revista de Hematología
por medio de CMF tuvieron una
intensidad media de fluorescencia (IMF) de 951.87 (rango
46.43 a 5095), muy por encima
de la IMF de 25.49 de controles
negativos o de 25.58 de quienes,
teniendo algún padecimiento
hematológico no presentaron la
fusión BCR-ABL por ninguno de
los dos métodos. Al comparar los
resultados de la prueba por CMF
y el diagnóstico de referencia,
encontramos una sensibilidad de
93.7%, especificidad de 100%,
VPP de 100% y VPN de 97.3%,
la exactitud o concordancia entre
la prueba diagnóstica propuesta y
PCR es de 98% y la prevalencia
en nuestro grupo de pacientes fue
del 30 por ciento.
CONCLUSIONES. La CMF es
una prueba diagnóstica accesible
para establecer diagnóstico de certeza, válida, confiable, no depende
del sitio de rompimiento BCR-ABL y
sobretodo es rápida, obteniendo resultados el mismo día que se solicita.
PRESENTACIÓN CARTEL
A1001
EL TRASPLANTE DE CÉLULAS
PROGENITORAS HEMATOPOYÉTICAS EN LEUCEMIA MIELOIDE
CRÓNICA CONTINÚA SIENDO
ÚTIL EN LA ERA POST-IMATINIB.
EXPERIENCIA EN EL INSTITUTO
NACIONAL DE CIENCIAS MÉDICAS Y NUTRICIÓN SALVADOR
ZUBIRÁN (INCMNSZ)
Tuna-Aguilar E*, Galván-López
I*, Couary-Aguilera P*, BarralesBenítez OV*, Guadarrama-Beltrán
E*, León-Rodríguez E*, AguayoGonzález A*.
*Instituto Nacional De Ciencias Médicas Y Nutrición Salvador Zubirán.
elenatuna@yahoo.fr
INTRODUCCIÓN. El alotrasplante
de células progenitoras hematopoyéticas (aloTCPH) tuvo su auge
como tratamiento potencialmente
curativo de la leucemia mieloide
crónica (LMC) pero posterior a la
aprobación de imatinib (IM) por la
FDA (2001), éste fue reemplazado
por los inhibidores de tirosin cinasa
(ITKS) que logran respuestas citogenéticas completas (RCgC) cercanas
al 80% con supervivencia prolongada y menos complicaciones. Sin
embargo, hay pacientes que no
logran RCgC o la pierden evolucionando a fases más agresivas y
considerando que en los países subdesarrollados existe poco acceso
a los ITKs de 2da generación, el
trasplante continúa siendo un pro-
S168
cedimiento crucial para tratar esta
enfermedad. Se presenta la experiencia en el INCMNSZ de los casos
de pacientes con LMC trasplantados
en la era pre y post-imatinib.
OBJETIVO. Inferir la importancia del alotrasplante de progenitores
hematopoyéticos en LMC en la era
pre-IM y post-IM
MATERIAL Y MÉTODOS. Análisis retrospectivo descriptivo, basado
en la revisión del expediente clínico
de los pacientes trasplantados por
LMC en el INCMNSZ durante el
período 1 de enero de 1990-30 de
junio de 2013.
RESULTADOS. Entre 1 enero
1990 y 30 junio 2013 se han tratado
179 pacientes con LMC; 9 (5%) de
estos alotrasplantados; 5 (55.6%)
era pre-IM y 4 (44.4%) era post-IM.
Edad media: 32 años (rango14-51).
FASE AL ALOTCPH: 77.7% (7) fase
crónica1 (FC1), 11.1% (1) FC2
y 11.1% (1) fase acelerada (FA).
MESES ENTRE DIAGNÓSTICO Y
ALOTCPH: 40 (6-89): era pre-IM
14 (6-24), era post-IM 72 (48-89).
INDICACIÓN DE ALOTCPH EN
ERA POST-IM: Pérdida de RCg
(100%), USO ITKs de 2da generación: (100%) al menos tres meses
pre-aloTCPH, todos lograron RCgC,
excepto uno con mutación T315I.
FUENTE DE CT: 66.7% (6) médula
ósea (MO), 22.2% (2) sangre periférica (SP). ENFERMEDAD INJERTO
CONTRA HUÉSPED (EICH). Era
pre-IM 0 , era post-IM 100% (4);
aguda(2) crónica (2), GRADOS
EICH AGUDA (EICHa): II: 1 (Piel)
IV: 1 (piel-hígado-intestino). EICH
crónica (EICHc) 2 (hígado-piel).
RECAÍDAS POST-ALOTCPH: 22.2%
(2) pacientes en era pre-IM 1 fase
blástica y 1 FC , ambos en RCgC
después de infusión de linfocitos
del donador (ILD) e IM. 0% de era
post-IM ha recaído ni requerido
ILD. MUERTES POST-ALOTCPH,
2(22.2%) 1 de era pre-IM por rechazo y fibrilación aurirular y 1 de era
post-IM por EICHa GIV y choque
séptico. 7 vivos, todos en RCgC.
CONCLUSIONES. 1) El
aloTCPH continúa siendo un tratamiento con potencial curativo en
pacientes con LMC en recaída post
ITKs. 2) Podría existir relación entre
EICH y uso de ITKs pre-TCPH. 3)
Hubo reducción de ILD al usar ITKs
pre-aloTCPH. 4) Se requiere estudio
con mayor número de pacientes.
A1005
MESILATO DE IMATIIB COMO
TERAPIA DE PRIMERA LINEA EN
PACIENTES CON DIAGNOSTICO DE LEUCEMIA MIELOIDE
CRONICA. EXPERIENCIA EN EL
INSTITUTO NACIONAL DE CIENCIAS MEDICAS Y NUTRICIÓN SZ
Tuna-Aguilar E*, Pérez-Jacobo F*,
García-Álvarez E*, Cazarez-Ordoñez Y*, Guadarrama-Beltrán E*,
Couary-Aguilera P*, Galván-López
I*, Saldaña-López*, Terrazas-Marin
R, Aguayo-González A*.
Libro Educativo 55 Congreso Nacional de la Agrupación Mexicana para el Estudio de la Hematología, A.C.
*Instituto Nacional De Ciencias Médicas Y Nutrición Salvador Zubirán.
INTRODUCCIÓN. El Mesilato de
imatinib (MI), un inhibidor de la Tirosín Cinasa (ITK) BCR-ABL, mejoró
dramáticamente el resultado de los
pacientes con LMC comparado con
las primeras líneas previas (IFN- alfa
y alotrasplante). Presenta frecuencias
de respuesta citogenética completa
(RCgC) de 82%, probabilidad libre
de transformación de 93% y supervivencia global de 89% a 5 años.
En México, existen pocos estudios
que evalúan la respuesta a MI como
primera línea; la mayoría se enfocan
en análisis epidemiológicos y de tratamiento en general, mecanismos de
resistencia, seguimiento citogenético
y molecular, opciones terapéuticas
con ITKs de segunda generación
ante falla a MI; por lo que se presenta
la experiencia de diez años con MI
como primera línea en LMC que
puede ser útil como base para la actualización de guías de tratamiento
de la LMC en México.
OBJETIVO. Evaluar la respuesta
al mesilato de imatinib como tratamiento primera línea en LMC.
MATERIAL Y MÉTODOS. Análisis retrospectivo, descriptivo,
basado en revisión de expediente
clínico de pacientes con diagnóstico de LMC tratados con MI como
primera línea en el período: 1 enero
2003- 31 diciembre 2012.
RESULTADOS. Total: 85 pacientes con MI primera línea, SEXO:
masculino (52%), mediana de
edad al diagnóstico: 39 años (1080). motivo de consulta: 1. pérdida
ponderal 2. dolor abdominal 3.
síndrome anémico. riesgo eutos:
alto (44%) bajo (27%), falta de
datos (29%). Fase al diagnóstico:
crónica 86%. Otras anormalidades
citogenéticas al diagnóstico: 19%
(t(3;9;22), 45xx, -7 hiperdiploidías,
monosomías, cariotipo complejo).
Evaluación de la respuesta: RHC
a los 3 meses (93%). RCGC: 62%
(3meses (12%), 6meses (37%),
12meses (19%), no RCGC: 32%,
ND 6%. Pérdida de RCG: 15%.
Falla primaria: 2%. en 67% la pérdida de respuesta ocurrió en los
dos primeros años del diagnóstico.
Respuesta molecular: evaluada con
PCR-RT en 18 pacientes en RCGC
por un período mayor a dos años:
RMM 4.5 (39%), RMM (33%) y alguna RM en 22%, 6% sin ninguna
respuesta o progresión. supervivencia al corte: 77% vivos, 14%
perdidos y 9% muertos. mediana
sg: 80% (5 años) .
CONCLUSIONES. 1. En los
países en desarrollo el MI sigue
siendo el tratamiento de elección
como primera línea en LMC. 2. La
mediana de SG es comparable a la
de la literatura (80% a 5 años) 3. Los
resultados de RCgC son ligeramente
inferiores a los encontrados en la literatura internacional(65% vs 83%).
4. Se observa efecto acumulativo en
RCg en los pacientes tratados con
MI. 5. Se logra un porcentaje considerable de RMM4.5 en pacientes
tratados con MI que han sostenido
la RCgC por más de dos años.
A1008
LEUCEMIA CRÓNICA MIELOIDE
Ph NEGATIVO. EXPERIENCIA EN
UN HOSPITAL INSTITUCIONAL
Lopez Hernandez MA*, Ramos
Leon EM*, Alvarado Ibarra M*,
Ortiz Zepeda M*, Alvarez Vera JL*.
*Centro Médico Nacional 20 de
Noviembre, ISSSTE.
lopema@prodigy.net.mx
INTRODUCCIÓN. El 95% de los
casos de Leucemia Crónica Mieloide (LCM), son Ph+, identificados
mediante cariotipo. Los restantes se
consideran del tipo Ph neg (LCMn).
Según la clasificación de la OMS
(2008), los últimos se catalogan
como mieloproliferativos, leucemia
neutrofílica crónica (LNC) ó con
displasia, leucemia crónica mieloide atípica (LCMa).
OBJETIVO. Describir características y destino de pacientes con
LCMn, clasificados como LNC ó
LCMa.
MATERIAL Y MÉTODOS. Retrospectivo. Se examinó la base
de datos del Servicio de Hematología de 1990 a 2013. Fueron
seleccionados pacientes con diagnóstico de LCMn y se estudiaron
sus expedientes. Se analizaron
las siguientes variables: cariotipo,
tiempo de evolución, pérdida de
peso, existencia de fiebre ó hemorragias, visceromegalias, biometría
hemática, aspirado y biopsia de médula ósea, tratamiento y destino. Se
clasificaron en LNC ó LCMa, según
los criterios de la OMS del 2008.
RESULTADOS. Se encontraron
diez pacientes con LCMn que
representa 4.5% de los casos con
LCM. Su evolución previa fue de 10
semanas (1-16); dos tuvieron fiebre
y tres pérdida de peso. Se encontraron 5 con LNC y 5 con LCMa.
Las características de las variables
para LNC y LCMa: hepatomegalia
y esplenomegalia n= (cm) 1 (2) y 2
(7, 16). Variables hemáticas, media
(oscilación): leucocitos en miles/
uL 41 (15-60) y 57 (22-160); granulocitos adultos 81% (75%-90%)
y 59% (23%-75%); granulocitos
intermedios 2% (0%-6%) y 27%
(12%-61%); monocitos 5% (2%8%) y 2% (0%-4%); basófilos 0.8%
(0%-2%) y 1% (0%-3%). Blastos en
sangre 0% y 0.4% (0%-1%). Blastos
en médula ósea 1% (0%-6%) y 5%
(1%-10%). Sólo en los pacientes
con LCMa se encontraron cambios
displásicos por lo menos en la serie
granulopoyética. No se informó
mielofibrosis en ningún caso. En
todos se realizaron, al menos, tres
cariotipos. La determinación de
BCR-ABL se efectuó en cinco. Han
fallecido 6 enfermos en 9 a 56 meses (media=26) y 2 abandonaron.
Hay 2 vivos con (LNC y LCMa) 52
y 152 meses; el primero manejado
con quimioterapia oral (en remisión
S169
Volumen 15, Suplemento 1, 2014
Revista de Hematología
parcial) y el segundo con trasplante
alogénico (en remisión completa).
CONCLUSIONES. El número
de LCMn puede ser menor si se
aplican técnicas de análisis molecular para variantes de BCR-ABL1.
Los criterios de la OMS vigentes
son sensibles pero imprecisos para
distinguir LNC y LCMa. Se hace
necesario un marcador molecular
detectable que indique clonalidad
y especificidad para ambas.
A1029
IMPLICACIÓN DE LAS VÍAS PI3K,
RAF-1 Y MEK 1/2 EN LA EXPRESIÓN DE LOS GENES BCR-ABL,
MDR-1 Y ABC-G2 EN LA LÍNEA
CELULAR K562
Esquivel Alemán BT*, Olarte Carrillo I**, Salas Iveth M**, Sanchez
Guadalupe T**, Peralta Enrique
M**, Domínguez Jorge Z**, Vargas
N***, Tovar Adolfo M**.
* Tecnológico De Estudios Superiores De Huixquilucan. ** Hospital
General de México. *** Novartis
Oncología, México.
brenda.esal@gmail.com
INTRODUCCIÓN. La Leucemia
Mieloide Crónica (LMC) se caracteriza por presentar una alteración
molecular conocida como cromosoma Philadelphia que involucra
la presencia de la translocación
recíproca entre los brazos largos
de los cromosomas 9 y 22 [t(9;22)],
en el 99% de los pacientes. Dicha
translocación involucra al oncogén BCR-ABL, activando vías de
señalización como PI3k, Raf-1 y
MEk 1/2 que inducen al aumento
de la proliferación e inhibición de
la apoptosis. El Mesilato de Imatinib (Gleevec, STI571, Novartis
Pharma AG) es el tratamiento para
esta enfermedad y está dirigido
al bloqueo de la función del oncogén BCR-ABL. Sin embargo un
porcentaje de los pacientes tienen
quimioresistencia al medicamento,
siendo la principal causa el aumen-
S170
to de la expresión de los genes de
resistencia MDR de la familia ABC
(ATP- Binding Cassette). Actualmente se desconoce cuáles son las
vías implicadas en la activación de
los genes MDR-1 (ABC-B1), BCRP
(ABC-G2) en LMC, por lo tanto, la
finalidad de este proyecto fue evaluar si las vías de señalización PI3k,
Raf-1 y MEk 1/2 están involucradas
en la expresión de dichos genes en
la línea celular k562 del banco de
líneas celulares del Laboratorio de
Biología Molecular de Hematología
en el Hospital General de México.
OBJETIVO. Analizar si el oncogén BCR-ABL regula las vías PI3K,
MEK ½ y RAF-1 en la expresión de
los genes BCR-ABL, MDR-1 (ABCB1) y BCRP (ABC-G2) en la línea
celular K562.
MATERIAL Y MÉTODOS. Se
realizó el cultivo celular de K562
con medio RPMI suplementado con
10% de SFB, 5% CO2 a 37°C, las
células fueron sometidas independientemente a Imatinib (STI57) 0.3
µM, Nilotinib (AMN 107) 25nM,
PI3K (Ly294002) 10µM, MEk ½
(U0126) 5 µM, RAF-1 (8-BROMOcAMP) 400 µM, se realizó el conteo
celular a 24, 48 y 72 horas respectivamente, finalmente se analizó la
expresión de los genes BCR-ABL,
ABC-B1 y ABC-G2 por qRT-PCR
para cada tratamiento.
RESULTADOS. La cinética de
crecimiento celular de la línea K562
se ve disminuida al estar sometida
a cada inhibidor independientemente y con respecto al control, al
bloquear las vías de señalización
BCR-ABL, PI3K, RAF-1 y MEK ½
disminuyen los niveles de expresión
de los genes BCR-ABL, ABC-B1
y ABC-G2, implicados en la quimioresistencia a los tratamientos
de la LMC.
CONCLUSIONES. La disminución en los niveles de expresión
de BCR-ABL, ABC-B1 y ABC-G2
demuestra que las vías de señalización bloqueadas podrían estar
implicadas en la ruta de encendido
de dichos genes.
A1041
ANÁLISIS DE LA EXPRESIÓN
DE GENES ASOCIADOS A PROGRESIÓN (SSX-1, PRAME) Y
RESPUESTA AL TRATAMIENTO
(ABC-B1, ABC-G2) EN LEUCEMIA
MIELOIDE CRÓNICA
Mendoza Salas I*, Olarte Carrillo I*,
Esquivel Alemán B*, Rozen Fuller
E*, Kassack Ipiña JJ*, Collazo Jaloma
J*, Gutiérrez Romero M*, Miranda
Peralta E*, Martinez Tovar A*.
* Hospital General De MÉxico Dr.
Eduardo Liceaga.
iveth_ms@hotmail.com
INTRODUCCIÓN. La leucemia
mieloide crónica se caracteriza
por un descontrol en los mecanismos normales de proliferación,
diferenciación y apoptosis en las
líneas hematopoyéticas. Entre las
alteraciones que se producen se
encuentran las moleculares que dan
como resultado expresión de genes
que normalmente están silenciados
(antígenos testiculares de cáncer,
ATC) como SSX-1 y PRAME, que en
condiciones normales se expresan
en células germinales testiculares
y de placenta únicamente, y su
presencia en otro tejido indica alteración neoplásica. Los genes de
la familia ABC, principalmente
ABC-B1 y ABC-G2, son proteínas
de superficie involucradas en la
resistencia al tratamiento en diversos tipos de cáncer. El estudio de
ambas familias en conjunto ofrece
una perspectiva de la situación de
la LMC.
OBJETIVO. Establecer una correlación clínica entre los ABC,
los ATC y los datos clínicos del
paciente con LMC, así como una
correlación entre la presencia de
estos y la influencia del tratamiento,
utilizando como comparativo la
respuesta de los pacientes a los 12
meses de tratamiento con Imatinib.
Libro Educativo 55 Congreso Nacional de la Agrupación Mexicana para el Estudio de la Hematología, A.C.
MATERIAL Y MÉTODOS. El
tamaño de la muestra fue de 11
pacientes, considerando el promedio de pacientes que ingresaron al
HGM según el censo 2000 a 2010,
el número final de pacientes fue
14. Se recolectaron 2 muestras de
sangre periférica por paciente (al
diagnóstico y a los 12 meses de tratamiento). Se realizó RT-PCR, para
identificar los genes y posteriormente se realizó la correlación clínica.
RESULTADOS. Frecuencia al
diagnóstico: ABC-B1 (57,1%), ABCG2 (50,0%), PRAME (0,0), SSX-1
(0,0). Frecuencia a los 12 meses de
tratamiento: ABC-B1 (21,4%), ABCG2 (21,4%), PRAME (0,0), SSX-1
(21,4%). Correlación clínica: ABCG2, significativo al diagnóstico para
valores de hemoglobina (p=0.004);
a los 12 meses de tratamiento para
edad (p=0.028) y dosis de imatinib
(p=0.031). El resto de los genes no
tiene significancia estadística.
CONCLUSIONES. Hay expresión de los genes ABC y ATC en
LMC. La frecuencia de ABC-B1 y
ABC-G2 disminuye con el tratamiento. ABC-G2 disminuye con
el tratamiento pero sigue expresándose en aquellos pacientes que
son resistentes a Imatinib. ABC-G2
presenta significancia estadística
en relación a las dosis de Imatinib.
ABC-G2 podría ser tomado en
cuenta como marcador de resistencia al tratamiento en pacientes
con LMC. SSX-1 se expresa una vez
iniciado el tratamiento pero no al
diagnóstico, lo cual es un indicativo
del pronóstico de la enfermedad
ya que los ATC están regulados
por factores epigenéticos. No hay
expresión de PRAME. Proyecto CONACyT: 80085 y 162269. Novartis
y registro HGM DIC/09/204/03/131
y DIC/12/204/05/01
A1085
I M P A C T O
D E L
RITUXIMAB ASOCIADO A CICLOFOSFAMIDA-FLUDARABINA
VS CICLOFOSFAMIDA-FLUDARABINA EN EL TRATAMIENTO
DE LEUCEMIA LINFOCÍTICA
CRÓNICA
Alvarez Vera JL*, Alvarado Ibarra
M**, Ortiz Zepeda SM**, Lopez
Hernandez MA**.
* ISSSTE/Hospital Español. **
Centro Médico Nacional “20 de
Noviembre” ISSSTE.
draselo@hotmail.com
INTRODUCCIÓN. La leucemia
linfocítica crónica es un desorden
linfoproliferativo clonal caracterizados por la acumulación de
linfocitos funcionalmente incompetentes, muchos pacientes son
diagnósticos en estadios tempranos,
incluso antes de tener manifestaciones clínicas. El tratamiento de
quimioinmunoterapia combinando
análogos de purina con anticuerpos
monoclonales anti- CD20, es considerado el tratamiento de primera
línea ha mejorado, la sobrevida
libre de evento y sobrevida global.
OBJETIVO. En la actualidad
con el surgimiento de nuevas terapias como los inhibidores de la
Bruton Tirosin kinasa, nos obligan
a conocer las tasas de respuesta en
nuestra población antes de incluir
estas nuevas opciones terapéuticas.
MATERIAL Y MÉTODOS. Por
tal motivo se incluyeron todos los
pacientes ingresados en el Servicio
de hematología del CMN “20 de
noviembre”, del 2008 al 2013, tratados con ciclofosfamida-fludarabina,
CF, y cliclofosfamida-fludarabinarituximab, CFR, se excluyeron los
pacientes con clasificación RAI
0 y 1.
RESULTADOS. 57 pacientes
fueron incluidos, 17 mujeres y 22
hombres, la edad promedio fe de
66 años, rango de 45 a 84 años,
21 tratados a base de CF y 18 CFR,
clasificados según la INTERNATIONAL WORSKOP EN A2: 12, B1:
12, B2 7, C3 4, C4 4. Los linfocitos
totales a su ingreso por grupo fueron
119,000/uL para CF con rango de
2,700 a 558,000, y 90,000 para el
grupo de CFR no encontrando diferencia significativa con p=0.5. La
mortalidad asociada a tratamiento
fue 4 y 1 para cada grupo respectivamente con (p=0.4), siendo la
causa más frecuente sepsis en 3
casos, 1 caso con insuficiencia hepática y 1 por hemorragia a sistema
nervioso central. la progresión de la
enfermedad se observo en el grupo
tratado con CF 6 y en el grupo de
RCF 1, con p=0.07, con sobrevida
libre de progresión de 60% con CF
contra 90% con CFR, con p= 0.5. La
sobrevida global fue de 80% contra
85% con p= 0.7.
CONCLUSIONES. En conclusión pese a que la muestra en
estudio es pequeña, la sobrevida
global obtenida es comparable
con la reportada en la literatura
internacional, al agregar rituximab,
pese a que las curvas se separan
claramente, no se obtuvo diferencia
estadística significativa en la sobrevida libre de progresión, de igual
forma no encontramos diferencia en
la mortalidad al agregar rituximab
en los últimos años, con base en
nuestra sobrevida y los resultados
mostrados en ASH 2013 por el
grupo alemán de estudio de CLL,
aún es temprano para considerar
un cambio en la primera línea de
tratamiento.
A1095
PROFUNDIDAD DE LA RESPUESTA MOLECULAR EN LA LEUCEMIA
MIELOIDE CRONICA TRATADA
CON IMATINIB, MEDIDA EN
CUALQUIER MOMENTO DEL TRATAMIENTO Y SU CORRELACION
CON LA SUPERVIVENCIA LIBRE
DE PROGRESION Y GLOBAL
Best Aguilera CR*, Fernández Figueroa YM*, García Balderrama
JA*, Robles Rodríguez A*, Rojas
Sotelo RM*, Lomelí Guerrero A*,
Pérez Banuet Saucedo D*, Pérez
Escamilla G*,
S171
Volumen 15, Suplemento 1, 2014
Revista de Hematología
* Hospital General De Occidente/
universidad De Guadalajara.
carlosbest@gmail.com
INTRODUCCIÓN. La respuesta
molecular mayor obtenida en el
mes 18 del tratamiento con Imatinib de la LMC es un marcador de
respuesta óptima y bajo riesgo de
progresión. En la práctica cotidiana
el seguimiento de la respuesta molecular según European Leukemia
Net, frecuentemente no es posible.
Aquí informamos la respuesta
molecular medida en cualquier momento del tratamiento en un grupo
de pacientes con LMC tratados en
una institución, correlacionamos
la respuesta con su estatus de progresión y la supervivencia global.
OBJETIVO. Evaluar la profundidad de la respuesta molecular en
cualquier momento del tratamiento
en LMC y su correlación con la
supervivencia libre de progresión
y global.
MATERIAL Y MÉTODOS. Se evaluaron 76 pacientes mediante PCR
cuantitativa para el transcrito BCR/
ABL, en un laboratorio de referencia
estandarizado internacionalmente.
La medición se hizo en cualquier
momento del tratamiento (Imatinib
400 mg/día) y se correlacionó mediante la prueba de X2 la respuesta
molecular con la supervivencia libre
de progresión y global.
RESULTADOS. La evaluación
se realizó en un rango de 4 a
120 meses (mediana 48 meses).
31.57% (24/76) alcanzaron RMC,
39.47% (31/76) lograron RMM y
28.9% (21/76) no alcanzó respuesta molecular significativa (7 de 21
evaluados antes del mes 18). La
supervivencia libre de progresión se
observó en 100% en RMC, 100% en
RMM y 95.24% sin RM (progresión
a FA 1/21), p: 2.53 (no significativa).
La supervivencia global en los 3
grupos fue del 100% a una mediana
de 48 meses (4-120 meses) hasta el
término del estudio.
S172
CONCLUSIONES. La proporción de la respuesta molecular
en este estudio (71%) es similar a
la informada en las grandes serie,
denotando la importancia de la
exposición prolongada al Imatinib
para obtener respuestas moleculares útiles (la mediana de tiempo
para la evaluación fue de 4 años).
No se encontró una diferencia significativa en la progresión en los
pacientes sin respuesta molecular
respecto a sus contrapartes. Esto
puede explicarse por la historia
natural de la enfermedad que puede
implicar fases crónicas prolongadas, adicionada por una respuesta
limitada al Imatinib. La supervivencia global no fue afectada en
función de la respuesta molecular
y es superior a la informada en el
estudio IRIS. Finalmente la evaluación de la respuesta molecular en
cualquier momento del tratamiento
sigue un patrón similar en cuanto a
la acumulación de respuestas moleculares a través del tiempo, según
ha sido descrito antes para Imatinib.
A1110
EXPERIENCIA EN PACIENTE CON
LEUCEMIA MIELOIDE CRÓNICA
(LMC) TRATADOS CON INHIBIDORES DE TIROSINA-QUINASA
EN UN HOSPITAL DE REFERENCIA
Aguilar Luna JC*
* ISSSTE “Valentín Gomez Farías”.
jcaguilarl@yahoo.com.mx
INTRODUCCIÓN. La LMC se
caracteriza por la translocación
t(9:22) conocida como cromosoma
Filadelfia, la terapia actual es a base
de inhibidores de tirosina-quinasa,
que inhiben el oncogen BCR-ABL
presente en la LMC.
OBJETIVO. Evaluar la respuesta
con inhibidores de tirosina-quinasa
en un grupo de pacientes con
LMC atendidos en un hospital de
referencia
MATERIAL Y MÉTODOS. Se
trataron 26 pacientes durante el pe-
riodo 2007-2013, con predominio
femenino 18 pacientes (69%), edad
promedio 45.6 años, procedentes la
mayoría del occidente del país. Su
presentación fue en fase crónica 24
(92%), acelerada 2 (8%) y ninguno
en fase blástica. La mayoría cursó
con esplenomegalia (80%), con
clasificación riesgo de Sokal alto
en 9 pacientes (35%) y bajo en 17
(65%). El tratamiento de primera
línea fue a base de Imatinib en 16
pacientes (61%), Nilotinib en 9
(35%) y Desatinib en 1 paciente
(4%), como tratamiento de segunda
línea se utilizó Nilotinib en 3 (11%)
y Dasatinib en 2 (8%).
RESULTADOS. El promedio de
seguimiento del grupo es de 32
meses (1-83 meses). Durante el
tratamiento inicial con Imatinib se
presentaron dos defunciones (8%),
ambos pacientes en fase acelerada y
riesgo alto de Sokal. Once pacientes
(42%) se encuentran con respuesta
molecular principal. Ante la pérdida de la respuesta molecular en 5
pacientes (19%), estos pasaron a
tratamiento de segunda línea con
Nilotinib (11%) y Dasatinib (8%),
obteniéndose a la fecha respuesta
molecular.
En 9 pacientes (35%) tratados
con Nilotinib como tratamiento
de primera línea, en la mayoría
(89%) se obtuvo respuesta molecular principal, en un paciente se
consideró falla al tratamiento por
mutación T3151. Solo un paciente
recibió Dasatinib como tratamiento
de primera línea, con respuesta
molecular.
CONCLUSIONES. El uso de
inhibidores de tirosina-quinasa
induce una mayor respuesta molecular y remisión con una mejor
sobrevida, retardando la transformación a fase acelerada o fase
blástica.
A1154
EFECTIVIDAD Y SEGURIDAD DE
IMATINIB COMO TRATAMIEN-
Libro Educativo 55 Congreso Nacional de la Agrupación Mexicana para el Estudio de la Hematología, A.C.
TO DE PRIMERA LINEA EN 145
PACIENTES CON LEUCEMIA MIELOIDE CRONICA DEL HOSPITAL
GENERAL DE MEXICO
Cabrera Garcia A*, Balderas Delgado C*, Ramos Peñafiel CO*,
Collazo Jaloma J*, Martinez Murillo
C*, Castellanos Sinco H*, Leon
Gonzalez G*, Montaño Figueroa E*,
Gallardo Trillanes E*, Rivas Vera S*,
Gutiérrez Romero M*, Rozen Fuller
E*, Aguilar E*, Martinez Tovar A*,
Kassack Ipiña JJ*.
* Hospital General de México.
Email de autor contacto
INTRODUCCIÓN. La terapia
blanco en contra de la Leucemia
Mieloide Crónica comenzó con el
desarrollo de pequeñas moléculas
inhibidoras de cinasa de tirosina.
Imatinib, es el primero de este tipo
de fármacos que ha mostrado un
adecuado perfil de seguridad y eficacia en comparación con la terapia
previa estándar, logrando altas respuestas y mejorando radicalmente
el pronóstico de los pacientes. Sin
embargo, los excelentes resultados
de los grandes estudios clínicos, no
son del todo reproducibles en el
“mundo real”. Queremos compartir
nuestra experiencia de una década
en el uso de Imatinib como terapia
de primera línea
OBJETIVO. Conocer la Respuesta Citogenética Completa (RCC) y la
Sobrevida Libre de Progresión (SLP)
como medidas de efectividad, así
como suspensión o modificación
del tratamiento por efectos adversos, como medida de seguridad de
Imatinib, en pacientes con Leucemia Mieloide Crónica.
MATERIAL Y MÉTODOS. Se
incluyeron 145 pacientes tratados
con Imatinib en el Hospital General
de México del 1ro de enero de 2003
al 31 de mayo del 2013. Se utilizó
estadística descriptiva para evaluar
la distribución de frecuencias de
las variables. Se aplicó análisis de
sobrevida con método de KaplanMeier y Long-Rank.
RESULTADOS. Con un seguimiento promedio de 74 meses, se
obtuvieron las siguientes respuestas: Respuesta hematológica en
84% (117); Respuesta Citogenética
Completa en 41% (57); Respuesta
Citogenética Mayor en 72% (100);
Sobrevida Global 85% (119); Sobrevida libre de progresión 80.8%
(113); Desarrollo de Crisis Blástica
y/o Fase Acelerada en 27 pacientes.
La escala Pronóstica de sobre-
vida Hasford diseñada en 1998,
representa adecuadamente el comportamiento de los pacientes según
la categoría de riesgo atribuida, el
Índice pronóstico Sokal también se
ajusta a los resultados obtenidos, sin
embargo, la escala EUTOS diseñada en la era de los Inhibidores de
Tirocin-cinasa, no predice sobrevida ni respuesta al tratamiento con
imatinib a los 18 meses de seguimiento en nuestros pacientes. En el
subgrupo de pacientes con 60 años
y más (34 pacientes), que representa
el 23.4%, se lograron las siguientes
respuestas: Respuesta Citogenética
Completa en 20.5% (7); Respuesta
Citogenética Parcial en 11.6%
(4); Sobrevida Global en 55.8%;
Sobrevida Libre de Progresión en
44.1%. En cuanto a la seguridad
del fármaco, 71% de los pacientes
no suspendieron o abandonaron el
tratamiento, mientras que en 23.4%
se registró Toxicidad Hematológica
grados III y IV.
CONCLUSIONES. Este estudio
mostró que imatinib es efectivo y
bien tolerado por nuestros pacientes
y permanece como una muy buena
estrategia de primera elección para
pacientes con Leucemia Mieloide
Crónica.
LINFOMAS
PRESENTACIÓN ORAL
A1092
AUSENCIA DE EXPRESIÓN DEL
GEN DE FACTOR TISULAR (F3) EN
CÉLULAS DE REED STERNBERG
PURIFICADAS DE PACIENTES
CON LINFOMA DE HODGKIN
Cesarman Maus G*, Reichel J*,
Roshal M, Cesarman-Raisbaum E*.
* Instituto Nacional De Cancerología/ New York Hospital Weill-cornell
Medical Center.
gcesarman@gmail.com
INTRODUCCIÓN. La expresión
de factor tisular (FT) por células
neoplásicas de tumores sólidos es
uno de los mecanismos claves que
relacionan trombosis con un comportamiento tumoral agresivo y con
supervivencia corta [1]. De hecho,
el FT, una glicoproteína de superficie celular transmembrana de 47
kDa que desencadena la activación
de la coagulación por la unión al
factor VIIa (4), está implicado en
señalización celular, angiogénesis
y metástasis [5,6]. Recientemente
utilizando la base de datos pública
del Broad Institute (http://www.
broadinstitute.org/ccle/home) que
comprende 163 lineas celulares de
neoplasias linfoides y mieloides,
reportamos que las neoplasias
hematológicas no expresan el gen
de FT (F3) ni por ende la proteína
(confirmado por inmunohistoquimica). Una excepción es linfoma
S173
Volumen 15, Suplemento 1, 2014
Revista de Hematología
de Hodgkin (LH) en el cual se observa expresión moderada a alta en
aproximadamente una tercera parte
de las líneas celulares.
OBJETIVO. En éste estudio investigamos si el origen celular de
FT en LH es o no la célula de Reed
Sternberg (HRS).
MATERIAL Y MÉTODOS. Utilizamos citometría de flujo para aislar
células de HRS con un método que
nos permite obtener rápidamente
miles de células de HRS viables
(Fromm, et al., Am J Clin Pathol 126,
2006), usando anticuerpos contra
CD64, CD95, CD30, CD5, CD20,
CD15, CD40, and CD45. Una vez
purificadas logramos por primera
vez realizar secuenciación profunda del exoma de células de HRS y el
perfil de expresión génica en éstas
células, al igual que en linfocitos
tumorales utilizados como control
somático.
RESULTADOS. Al igual que en
otras neoplasias de origen linfoide,
encontramos que las células de
HRS no expresan el gen del factor
tisular (F3). El FT también está ausente en linfocitos que se encuentra
infiltrando el tumor. Los resultados
del estudio de expresión génica de
las diferentes proteínas y receptores
que forman parte del sistema de
coagulación, inflamación y complemento están en proceso.
CONCLUSIONES. El LH está
compuesto por 99% de células noneoplásicas y 1% de células HRS.
Este estudio confirma la ausencia
de FT en todas las neoplasias de
origen linfoide, por lo que el FT
circulante en pacientes con linfoma
de Hodgkin, se origina en células no
tumorales. En efecto, las micropartículas circulantes en LH derivan de
monocitos. La observación reciente
de que la presencia de trombosis
no impacta la supervivencia de
pacientes con linfomas (a diferencia
de individuos con tumores sólidos),
sugiere que el FT que proviene de
células no tumorales puede inducir
S174
trombosis, sin embargo, no tiene
efecto sobre la agresividad tumoral.
A1108
IMPACTO EN LA SOBREVIDA DE
PACIENTES AFECTOS DE LDCGB
TRATADOS CON R-CHOP Y QUE
PRESENTARON UNA MUTACIÓN PUNTUAL EN LOS GENES
DEL RITMO CIRCADIANO. ¿UN
NUEVO BIOMARCADOR MOLECULAR?
Villela Martínez LM*, Gutiérrez
Monrreal MA*, Baltazar S**, Cardinó G***, Hernández Hernández
JA*, López Sánchez RDC*, Scott
Sartini SP*.
* Tecnológico De Monterrey. Tec
Salud. Cátedra De Hematología Y
Cáncer. ** UMAE #25. IMSS. Monterrey Nuevo León. *** Tecnológico
de Monterrey. Departamento de
Biotecnología.
villela@itesm.mx
INTRODUCCIÓN. Los LDCGB son
el subtipo más frecuente en México.
Biológicamente son heterogéneos
y su respuesta a la quimioterapia
estándar es igualmente heterogénea. Muchos continuamos usando
el índice pronóstico internacional
que de igual forma a su biología
es heterogénea. Por tanto se requiere de nuevos biomarcadores
sencillos que nos puedan ayudar a
predecir sobrevida. En el contexto
de LDCGB no hay ningún trabajo
que haya reportado genes del ritmo
circadiano mutados en mexicanos y
si estos pueden predecir una mejor
o peor sobrevida.
OBJETIVO. Evaluar la proporción de mutaciones en 16
polimorfismos de 10 genes relacionados al ritmo circadiano (pacientes
vs. controles sanos) y si alguno
de ellos es capaz de predecir una
mejor o peor sobrevida posterior
al tratamiento quimioterápico con
R-CHOP
MATERIAL Y MÉTODOS. El
trabajo de investigación fue presen-
tado a los comités de investigación
y ética. Los pacientes previos a ser
incluidos en el estudio firmaron un
consentimiento informado. Material.
Se utilizó kit de extracción de DNA
promega y se diseñaron los primers
con las secuencias de los fragmentos
específicos a analizar de 10 genes
del ritmo circadiano. La corrida de
los geles se leyó con bromuro de etidio. Método. Se realizó la extracción
de DNA siguiendo las indicaciones
del kit. Se obtuvieron los datos clínicos de los pacientes. Estadística.
Las variables cuantitativas se obtuvo
mediana con rangos intercuartiles
y en el caso de las cualitativas se
analizó con prueba exacta de Fisher.
La sobrevida se calculó con curvas
Kaplan Meier y las diferencias con
prueba de log rank. La diferencia
entre uno o más grupos fue definida
cuando la p < o igual a 0.05.
RESULTADOS. La proporción
de mutaciones puntuales de los
genes del ritmo circadiano fueron
más frecuentes en los LDCGB que
en los controles, pero sin diferencia
estadística (p=0.16). Solo 4 mutaciones puntuales se observaron
en LDCGB y controles, afectando
solo a NPAS2, PER3. Cuando
analizamos las variables clínicas
y los 4 polimorfismos mutados
presentes observamos que solo la
deshidrogenasa láctica sérica elevada (p=0.021), el ipi (p<0.001) y
el polimorfismo en per3 (p=0.047)
fueron predictoras de sobrevida. el
resto de variables clínicas y polimorfismos mutados analizados no
mostraron diferencia estadística.
CONCLUSIONES. La proporción de mutaciones en el ritmo
circadiano son mayores en LDCGB
que en los controles pero sin diferencia estadística. IPI alto y no
mutación en PER3 se asociaron con
peor sobrevida.
A1117
ALTA ASOCIACIÓN ENTRE ENFERMEDAD VOLUMINOSA CERCANA
Libro Educativo 55 Congreso Nacional de la Agrupación Mexicana para el Estudio de la Hematología, A.C.
A CRÁNEO Y NEUROEJE CON
INFILTRACIÓN A SISTEMA NERVIOSO CENTRAL EN PACIENTES
CON LINFOMA DIFUSO DE CÉLULAS GRANDES-B
Ignacio Ibarra G*, Huerta Guzmán
J*, Sierra Ramírez JA**.
* Instituto Mexicano Del Seguro
Social. ** Instituto Politécnico
Nacional.
gregignacio@telmexmail.com
INTRODUCCIÓN. El linfoma
difuso de células grandes-B (LDCGB) es el subtipo más frecuente y
agresivo. La infiltración a sistema
nervioso central (iSNC) está sub
diagnosticada. El diagnóstico tardío
empeora. Su pronóstico. Identificar
al paciente con alto riesgo de iSNC
ayudara a dar tratamiento oportuno.
OBJETIVO. Cuantificar la
asociación entre enfermedad
voluminosa (EV) y enfermedad
voluminosa cercana a cráneo y
neuroeje (EVCCN) e infiltración a
sistema nervioso central (iSNC) en
pacientes con LDCG-B.
MATERIAL Y MÉTODOS. Cohorte retrospectiva, en un Hospital
de alta especialidad. Diagnóstico de
LDCG-B de novo por inmunohistoquímica, >16 años. Se excluyeron
HIV+, linfoma primario de SNC y
sin expediente. La iSNC se confirmo por citología de líquido
cefalorraquídeo (LCR), tomografía
axial computada (TAC) y/o imagen
de resonancia magnética (IRM). Se
analizaron las variables conocidas
de riesgo para iSNC. Análisis con
medidas de dispersión y asociación,
análisis univariado y bivariado, análisis proporcional de COX y riesgo
atribuible (HR).
RESULTADOS. 873 pacientes
captados de enero 2010 a junio
2013 con LNH. 344 pacientes
cumplieron criterios de selección.
197 femeninos, 147 masculinos,
estadios I-II 135 (39%), III-IV 209
(60.8%), ECOG >2 216 (62.8%),
DHL alta 258 (75%), IPI 0-2 95
(27.6%) y 3-5 249 (72.4%), EV 155
(45%), EVCCN 71 (20.63%). Se
identifico a 40 pacientes (11.62%)
con iSNC, 21 al diagnóstico, 5 refractarios, 6 durante la inducción y
8 en recaída. La iSNC se diagnostico por LCR 19 (47.5%), TAC y/o
IRM (14 35%), LCR/TACy/oIRM 7
(17.5%). Localización leptomeningea 32 (80%), parenquimatosa 3
(7.5%) y ambas 5 (12.5%). Alteraciones neurológicas presentes en
74% de los pacientes.
La iSNC sin EV 11.1% y con EV
12.25%,el HR 1.6 (IC95% 0.843.2). La iSNC sin EVCCN 8.5% y
con EVCCN 33.3%; el HR 3.4 (IC
95%, 1.7-6.8, p=0.00). las otras
variables analizadas sin asociación. En el análisis proporcional
de COX hay mayor frecuencia de
iSNC cuando existe EVCCN en el
seguimiento.
CONCLUSIONES. El LDCG-B
de esta cohorte tiene enfermedad
avanzada (60%), IPI alto (72.4%),
alta frecuencia de EV (46.5%). La
frecuencia de iSNC se incrementa
de 11.62% a 33.3% en EVCCN con
HR de 3.4.
La iSNC leptomeningea (92.5%)
se identifico por LCR en el 65%, se
requiere determinar la sensibilidad
de la PL en un estudio prospectivo
en pacientes considerados como
alto riesgo.
A1167
VALOR PRONÓSTICO DEL ÍNDICE LINFOCITOS/MONOCITOS
ABSOLUTOS EN LINFOMA DE
HODGKIN CLÁSICO. EXPERIENCIA EN EL INSTITUTO NACIONAL
DE CANCEROLOGÍA
Acosta Maldonado BL*, Grimaldo
Gómez FA*, De La Torre Lujan
AHF*, Gómez Perdomo G*, Hernández Redondo HM*, Urbalejo
Ceniceros VI*, Maldonado López
CDJ*, Rentería Castillo E*, Terrazas
Hoyos A*, Cruz Escamilla KA*,
Escamilla Illescas D*, Martínez
Cardona JA*, Ramírez Ibarguen A*,
Oñate Ocaña LF*, Lozano Zavaleta
V*, Labardini Méndez JR*, Rivas
Vera S*.
* Instituto Nacional De Cancerología.
Email de autor contacto
INTRODUCCIÓN En el linfoma
de Hodgkin las células malignas
constituyen solo el 1% del tejido
tumoral, el resto está formado por
un microambiente compuesto de
células inflamatorias; es por ello
que se ha buscado establecer la
relación del microambiente con la
respuesta y supervivencia de los pacientes. La cuenta baja de linfocitos
absolutos ha sido estudiada como
parte del índice pronóstico (IPS),
siendo un factor deletéreo asociado
a la secreción de citocinas proinflamatorias y al escape inmunológico
de la células de Reed-Sternberg. Por
otra parte, los macrófagos dentro
del microambiente se han asociado
con mayor frecuencia a síntomas
constitucionales y recaída. Algunos
estudios revisaron la correlación
del índice de linfocitos absolutos/
monocitos absolutos (LA/MA-Dx)
en sangre periférica en LHc al diagnóstico, encontrando que un índice
=1.1 se asocia a mayor supervivencia. Al momento, no hay estudios
que valoren la utilidad del índice
respecto a la respuesta global.
OBJETIVO. Determinar el valor
pronóstico del LA/MA-Dx en pacientes con LH clásico y su impacto
en la respuesta al tratamiento y la
supervivencia.
MATERIAL Y MÉTODOS. Estudio retrospectivo de pacientes con
LH al momento del diagnóstico.
Se realizó un análisis multivariado
y curvas de ROC para establecer
la relación del LA/MA-Dx con la
respuesta al tratamiento y la supervivencia.
RESULTADOS. Se revisaron
162 expedientes de pacientes con
diagnóstico de LH establecido de
enero 2006 a junio 2009 y de octu-
S175
Volumen 15, Suplemento 1, 2014
Revista de Hematología
bre 2011 a julio 2013. La mediana
de seguimiento fue de 25.6 meses
(0.4- 91.7). La SG fue de 93% a 3
años. La respuesta global (RC+RP)
se obtuvo en 132 pacientes (81%) y
falla (EE+P) en 30 pacientes (19%).
En el índice LA/MA-Dx se determinó un nuevo punto de corte de 1.75
con una área bajo la curva de 0.83.
Se establecieron 3 categorías, los
pacientes con un índice LA/MA-Dx
bajo (0-0.95) obtuvieron respuestas
de 46.7%; en el índice LA/MA-Dx
intermedio (0.96- 1.75) de 73.9%
(OR 5.6, IC95%1.3-23.5,p<0.05)
e índice LA/MA-Dx alto (? 1.75)
con 90.1% de respuestas (OR 8.9,
IC95%2.2-35.3,p<0.01). El análisis
multivariado mostró que el índice
LA/MA-Dx fue un factor pronóstico
independiente para la respuesta al
tratamiento, sin embargo no se encontró impacto en la supervivencia.
CONCLUSIONES. En nuestra
población el índice LA/MA-dx se
estableció con un punto de corte
de 1.75, estableciendo 3 categorías (índice bajo, medio y alto) que
actúan como factor pronóstico
independiente de respuesta en
pacientes con LH clásico pero no
muestra relación con la supervivencia global.
A1171
PREVALENCIA DE ANEMIA EN
PACIENTES CON LINFOMA Y SU
VALOR PRONÓSTICO AL DIAGNÓSTICO, ESTUDIO PILOTO.
EXPERIENCIA EN EL INSTITUTO
NACIONAL DE CANCEROLOGÍA,
MÉXICO
Acosta Maldonado BL*, Fernández
Salazar F*, Ramírez Ibargüen A*,
Rivas Vera S*.
* Instituto Nacional De Cancerología.
brenda_ao@hotmail.com
INTRODUCCIÓN. La Organización
Mundial de la Salud (OMS) considera
a la anemia como una hemoglobina
(Hb) <13g/dL en hombres y <12g/
dL en mujeres. Es una complicación
frecuente en pacientes con cáncer
y causa frecuente de fatiga que se
traduce en deterioro de la calidad de
vida. Estudios previos reportan una
prevalencia de anemia de 28-47% en
Linfoma No Hodgkin (LNH). La anemia se ha reconocido e incorporado
en varios índices pronósticos de las
neoplasias linfoides como un factor
adverso, asociado a menor supervivencia global (SG) y supervivencia
libre de progresión (SLP). Se ha descrito además que los valores de Hb
postratamiento son un fuerte predictor independiente de supervivencia
en los ancianos con LNH agresivo,
sin embargo, son pocos los estudios
que valoran el nivel de hemoglobina
al diagnóstico y ninguno lo evalúa en
nuestra población.
OBJETIVO. Determinar la prevalencia de anemia en los pacientes
con linfoma al momento del diagnóstico y evaluarla como factor
pronóstico en la respuesta al tratamiento y SG.
MATERIAL Y MÉTODOS. Se evaluaron las características clínicas y
de laboratorio de forma retrospectiva
de 453 pacientes con diagnóstico
de Linfoma Hodgkin (n=69) y LNH
(n=383) que ingresaron en el Instituto Nacional de Cancerología de
Octubre del 2011 a Junio del 2013.
RESULTADOS. En LNH se encontró anemia en el 31% de los
pacientes. Estos paciente tuvieron
una respuesta (RC+RP) de 65% a
diferencia del 83% de los casos sin
anemia (p<0.05). A 22.6 meses de
seguimiento no se alcanzó la mediana, pero se observó una SG de
68% en los pacientes con anemia
vs 86% en aquellos sin anemia
(p<0.05). Se analizó de forma específica la SG en LDCGB y Linfoma
Folicular (LF) por ser los subtipos
más frecuentes en la población
estudiada. En el caso de LDCGB se
encontró SG a 21.8 meses de 67%
en presencia de anemia vs 84% sin
anemia (p<0.05). En LF con seguimiento a 23.6 meses se encontró SG
de 83% en pacientes con anemia vs
97% sin anemia (p=0.1).
La anemia estuvo presente en
48% de los pacientes con LH y la
SG a 21.3 meses fue de 95%; sin
embargo, no se encontró relación
significativa de la anemia con la
respuesta ni con la SG.
CONCLUSIONES. La anemia
al diagnóstico en LNH es un factor
pronóstico adverso para la respuesta
y SG, no así en LH donde no mostró
relación con la respuesta ni con SG.
PRESENTACIÓN CARTEL
A1011
LINFOMA NO HODGKIN E
INFECCIÓN POR VIH/SIDA. VARIEDADES HISTOLÓGICAS Y
SITIOS DE INFILTRACIÓN. EXPERIENCIA DEL HOSPITAL GENERAL
DE MÉXICO
S176
Castellanos-Sinco H*, RamosPeñafiel Ch*, Rivas-Vera S*,
Kassack-Ipiña JJ*, Martinez-Murillo
C*, Collazo-Jaloma J*, Rozen-Fuller
E*, León-González MG*, GallardoTrillanes E*, Gutiérrez-Romero M*,
Montaño-Figueroa E*.
*Hospital General de México.
humbertosinco@hotmail.com
INTRODUCCIÓN. El riesgo de
presentar linfoma cuando se está
infectado por VIH es de 60 a 200
veces mayor que en la población
Libro Educativo 55 Congreso Nacional de la Agrupación Mexicana para el Estudio de la Hematología, A.C.
general. El LNH tiene mayor frecuencia en inmunosuprimidos
graves y es poco frecuente cuando
el defecto inmune es moderado,
como en los casos en los que el
enfermo recibe tratamiento antirretroviral.
OBJETIVO. Determinar las
variedades histológicas y localizaciones del LNH en enfermos
infectados por VIH/SIDA en pacientes del HGM.
MATERIAL Y MÉTODOS. Estudio observacional, descriptivo,
retrospectivo, basado en la revisión
de los expedientes de pacientes con
diagnóstico de LNH del archivo
clínico del servicio de Hematología
del Hospital General de México,
diagnosticados entre 1992 y 2009.
RESULTADOS. Veintiún pacientes con VIH/SIDA presentaron LNH,
de ellos 17 ya se conocían infectados. En cuanto a la localización
el 33% se ubicaron en cuello, el
12% en ano/recto. En axila, nariz
y cavidad oral el 10% en cada uno
de estos sitios; y en región inguinofemoral, encía, estómago, íleon y
retroperitoneo 5% en cada una de
estas estructuras.
VARIEDADES HISTOLÓGICAS
DE LNH ASOCIADOS A VIH.
N=21. B= 81%, T=19%
61%
Difuso de células grandes
De células T periféricas
14%
Linfoplasmacítico
10%
Folicular grado III
5%
De células grandes anaplásico
ALK negativo
5%
Plasmablástico
5%
CONCLUSIONES. En nuestra
población se presentó predominio
de linfomas B, al igual que lo documentado internacionalmente. No
hubo casos de linfoma Burkitt. Cabe
destacar que la segunda variedad
más frecuente fue la de células T
periféricas. En concordancia con
lo establecido en la literatura, en
donde el LNH en VIH tiene alto
componente extranodal y tropismo
por el aparato digestivo, en nuestros
pacientes el comportamiento extranodal fue de 47%, con infiltración
digestiva en 32% del total de casos.
A1012
VARIEDADES HISTOLÓGICAS DE
LINFOMA NO HODGKIN (LNH)
EN EL HOSPITAL GENERAL DE
MÉXICO
Castellanos-Sinco H*, RamosPeñafiel Ch*, Rivas-Vera S*,
Martínez-Murillo C*, Kassack-Ipiña
JJ*, Collazo-Jaloma J*, Rozen-Fuller
E*, León-González MG*, MontañoFigueroa E*, Gallardo-Trillanes E*.
*Hospital General de México.
humbertosinco@hotmail.com
INTRODUCCIÓN. Hay un claro
predominio de los LNH de linaje B
sobre los de células T. De los primeros, los más frecuentes son el difuso
de células grandes, el folicular y el
de linfocitos pequeños. De los de
linaje T, los de células T periféricas y
el angioinmunoblástico son los que
se presentan con mayor frecuencia.
OBJETIVO. Determinar las variedades histológicas de los LNH
diagnosticados en el HGM.
MATERIAL Y MÉTODOS. Estudio observacional, descriptivo,
retrospectivo, basado en la revisión
de los expedientes de pacientes con
diagnóstico de LNH del archivo
clínico del servicio de Hematología
del Hospital General de México,
diagnosticados entre 1992 y 2009.
RESULTADOS. Se analizaron
632 enfermos.
TIPOS DE LINFOMA NO HODGKIN. N=632.
LINFOMAS DE CÉLULAS B
Difuso de células grandes B53.1%
Linfocitos pequeños/LLC 10.8%
Folicular
9.3%
Grado I
1,4%
Grado II
2.5%
Grado III 15.4%
MALT
4.3%
Linfoplasmacítico
1.9%
Burkitt 0.8%
Células del manto 0.5%
DCGB, rico en linfocitos T e
histiocitos
0.3%
0.2%
Células B inclasificable Plasmablástico
0.2%
Linfoblástico
0.2%
LINFOMAS DE CÉLULAS T
Células T periféricas
8.2%
Células NK/T extranodal,
tipo nasal
5.1%
Células grandes anaplásico
ALK negativo
2.4%
Células grandes anaplásico
ALK positivo
1.1%
Micosis fungoides
0.5%
Células T, tipo paniculitis
0.2%
subcutánea
0.2%
Linfoblástico T
Primario cutáneo células
0.2%
grandes anaplásico T
CONCLUSIONES. Se confirmó
el predominio de LNH B sobre los
T en nuestro servicio. A diferencia
de la literatura los foliculares y los
MALT son menos frecuentes, y los
de linfocitos pequeños, células T
periféricas, extranodal de células
NK-T tipo nasal, de células grandes
anaplásico ALK positivo y negativo
y el linfoplasmacítico se encuentran
con mayor frecuencia.
A1013
LINFOMA NK-T, TIPO NASAL:
EXPERIENCIA TERAPÉUTICA EN EL
HOSPITAL GENERAL DE MÉXICO
(HGM)
Castellanos-Sinco H*, RamosPeñafiel Ch*, Rivas-Vera S*,
Martínez-Murillo C*, Kassack-Ipiña
JJ*, Collazo-Jaloma J*, Rozen-Fuller
E*, León-González MG*, MontañoFigueroa E*, Gutiérrez-Romero M*,
Gallardo-Trillanes E*.
*Hospital General de México.
humbertosinco@hotmail.com
INTRODUCCIÓN. El linfoma
de células NK/T extranodal, tipo
nasal es de difícil diagnóstico. Se
caracteriza por daño y destrucción
vascular, necrosis, fenotipo citotóxico y asociación a virus Epstein Barr.
Se presenta con mayor frecuencia
S177
Volumen 15, Suplemento 1, 2014
Revista de Hematología
en Asia, México, Centroamérica
y Sudamérica, con predominio en
hombres.
OBJETIVO. Determinar características clínicas, terapéutica, tipo de
respuesta y supervivencia general
de los pacientes con LNH NK-T,
tipo nasal del HGM.
MATERIAL Y MÉTODOS. Estudio observacional, descriptivo,
retrospectivo, basado en la revisión
de los expedientes de pacientes con
diagnóstico de linfoma de células
NK/T extranodal, tipo nasal del
HGM de 1992 a 2009.
RESULTADOS. De un total de
632 linfomas, se identificaron 113
linfomas de células T y de éstos,
32 casos (28.3%) correspondieron a linfomas de células NK-T.
La edad media de presentación
fue de 42 años (rango 19 a 56).
La relación hombre:mujer fue de
2.2:1. Las manifestaciones clínicas
más frecuentes fueron: sensación
de obstrucción nasal, tumefacción
facial y dolor. Sólo dos enfermos
presentaron infiltración a sistema
nervioso central al inicio y uno a
médula ósea. Setenta y ocho por
ciento de los individuos tuvieron
estadios clínicos I ó II. 56% presentaron síntomas B. En 7 de 10
pacientes se confirmó su asociación
con el virus Epstein Barr (VEB) por
histopatología. 31/32 pacientes
recibieron tratamiento, 54.8% presentaron algún tipo de respuesta
independientemente de la terapia
utilizada. El tratamiento inicial en
el 80.6% de los casos fue CHOP
y 13% radioterapia. El 60% de los
pacientes tratados con CHOP tuvo
algún tipo de respuesta (RC, RCnc,
RP) mientras que el 100% de los
que recibieron radioterapia logró
respuesta completa, aunque en este
grupo la mayoría de los pacientes
se encontraba en EC I. La supervivencia general a 36 meses fue de
63%. El seguimiento promedio fue
de 40 meses. No hubo diferencia
estadísticamente significativa en
S178
la supervivencia general entre los
2 grupos de tratamiento debido al
tamaño de la muestra, sin embargo
parece haber una tendencia a mejor
RC y SG con radioterapia.
CONCLUSIONES. Este estudio
documenta que las características
de nuestra población son similares a
las publicadas internacionalmente.
A pesar de que la frecuencia de este
tipo de linfoma es baja, es indispensable estandarizar el tratamiento
de los pacientes, utilizando como
terapéutica inicial a la radioterapia
y dejando para estadios avanzados
el uso de quimioterapia.
A1014
INFILTRACIÓN DE LA MÉDULA
ÓSEA POR LINFOMAS NO HODGKIN (LNH) AL DIAGNÓSTICO
EN EL HOSPITAL GENERAL DE
MÉXICO (HGM)
Castellanos-Sinco H*, RamosPeñafiel Ch*, Rivas-Vera S*,
Kassack-Ipiña JJ*, Martínez-Murillo
C*, Collazo-Jaloma J*, Rozen-Fuller
E*, Léon-González MG*, MontañoFigueroa E*, Gallardo-Trillanes E*,
Gutiérrez-Romero M*.
*Hospital General de México.
humbertosinco@hotmail.com
INTRODUCCIÓN. La infiltración a médula ósea por LNH es
alrededor de 30%. Los linfomas
indolentes, como el de linfocitos
pequeños y el folicular son las que
infiltran con mayor frecuencia la
médula ósea.
OBJETIVO. Determinar las
variedades histológicas de LNH
asociadas a infiltración medular.
MATERIAL Y MÉTODOS. Estudio observacional, descriptivo,
retrospectivo, basado en la revisión
de los expedientes de pacientes con
diagnóstico de LNH del archivo
clínico del servicio de Hematología
del Hospital General de México,
diagnosticados entre 1992 y 2009.
RESULTADOS. De 632 pacientes solo el 91% tuvieron biopsia de
hueso. De ellos el 22% resultaron
infiltrados (124 enfermos).
VARIEDADES HISTOLÓGICAS
DE LNH ASOCIADOS A INFILTRACIÓN DE MÉDULA ÓSEA. N=124.
48%
Difuso de células grandes
Linfocitos pequeños/leucemia
linfocítica crónica
24%
11%
Folicular
De células T periféricas
7%
3%
Linfoplasmacítico
De células del manto
2%
De células NK/T, extranodal,
tipo nasal
1%
De células grandes anaplásico
1%
ALK positivo
De células grandes anaplásico
1%
ALK negativo
MALT
1%
De la zona marginal nodal
1%
CONCLUSIONES. La infiltración resultó menor a lo publicado.
En el presente estudio los tres primeros lugares correspondieron en
ese orden a las variedades histológicas de linfomas más frecuentes.
Lo anterior se atribuye más, a la
incidencia que a las características
de cada linfoma.
A1015
ESQUEMA DEP DE SEGUNDA
LÍNEA PARA EL TRATAMIENTO DE
LINFOMA NO HODGKIN (LNH)
REFRACTARIO O EN RECAÍDA
EN EL HOSPITAL GENERAL DE
MÉXICO (HGM)
Castellanos-Sinco H*, RamosPeñafiel Ch*, Collazo-Jaloma J*,
Rozen-Fuller E*, Zazueta-Pozos*,
Trejo-Ayala*, Martínez-Flores*,
Ladines-Castro*, Barragán-Ibañez*,
Barranco-Lampón*, Reyes-Atrisco*,
García*, Aceves*.
*Hospital General de México.
humbertosinco@hotmail.com
INTRODUCCIÓN. Los LNH corresponden a un grupo heterogéneo de
neoplasias derivadas de linfocitos,
que a nivel mundial y en México
presentan un impacto importante
sobre las tasas de morbilidad y
Libro Educativo 55 Congreso Nacional de la Agrupación Mexicana para el Estudio de la Hematología, A.C.
mortalidad. En el HGM, son la neoplasia hematológica más frecuente
y presentan frecuentemente refractariedad o recaída tras la primera
línea de tratamiento.
OBJETIVO. Determinar la respuesta, la supervivencia general y
la supervivencia libre de evento
(progresión, recaída, muerte o última visita) asociadas a la aplicación
de 4 ciclos trisemanales con DEP,
régimen de segunda línea, (dexametasona 40 mg IV diarios días 1 a
4, etopósido 300 mg/m2 IV diarios,
días 1 y 2 y cisplatino 100 mg/m2
IV dia 1) para enfermos con LNH refractario a una línea de tratamiento
o en primera recaída.
MATERIAL Y MÉTODOS. Estudio observacional, descriptivo,
retrospectivo, basado en la revisión
de los expedientes de pacientes con
diagnóstico de LNH del archivo
clínico del servicio de Hematología
del Hospital General de México,
diagnosticados entre 1992 y 2009.
RESULTADOS. Cuarenta y tres
pacientes de 632 fueron sometidos
a DEP como segunda línea de
tratamiento. La edad promedio de
presentación del LNH fue de 52
años, con relación H:M 1:1.1. El
34% de la población fue mayor de
60 años.
43
Número de pacientes 47%
Remisión completa
Supervivencia general 3 años 56%
Supervivencia general 5 años 24%
Supervivencia libre de
27%
evento 3 años
Supervivencia libre de
evento 5 años
7%
CONCLUSIONES. Los parámetros terapéuticos evaluados para DEP
fueron equiparables a los reportados
con otros esquemas más tóxicos
y costosos (ESHAP, DHAP) lo que
puede representar una alternativa de
tratamiento en países en desarrollo.
A1016
CARACTERÍSTICAS CLÍNICOE P I D E M I O L Ó G I CA S Y D E
LABORATORIO DE LOS LINFOMAS NO HODGKIN EN EL
HOSPITAL GENERAL DE MÉXICO
(HGM)
Castellanos-Sinco H*, RamosPeñafiel Ch*, Rivas-Vera S*,
Kassack-Ipiña JJ*, Martínez-Murillo
C*, Collazo-Jaloma J*, Rozen-Fuller
E*, Léon-González MG*, MontañoFigueroa E*, Gallardo-Trillanes E*,
Gutiérrez-Romero M*.
*Hospital General de México.
humbertosinco@hotmail.com
INTRODUCCIÓN. La incidencia
del LNH varía entre diez y doce veces de país a país. Hay tasas de 1.6
a 17.1 por cada 100 000 personas/
año entre hombres y de 0.7 a 11.7
casos por 100 000 habitantes/año
entre mujeres. En el HGM (20002005), los LNH ocuparon el primer
sitio de las neoplasias en el servicio
(616), 32.5% del total. Fueron
102.6 casos nuevos promedio por
año, con mediana de presentación
de 48 años.
OBJETIVO. Determinar las
principales características clínicoepidemiológicas y de laboratorio
de los pacientes con LNH del HGM.
MATERIAL Y MÉTODOS. Estudio observacional, descriptivo,
retrospectivo, basado en revisión de
expedientes de pacientes con LNH
del HGM (1992-2009).
RESULTADOS. De un total de
632 linfomas, la mediana de presentación fue de 52 años, con rango
de 16 a 95. La relación H:M 1:1.1.
El 17% de los pacientes fueron analfabetas, y más la mitad (68%) solo
poseían educación básica. El 71%
vivían en la zona metropolitana de
la Ciudad de México. El 10% de los
pacientes presentó historia familiar
de neoplasias. La exposición a
mielotóxicos se dio en 7% de los
enfermos. El 17% tuvo alguna patología concomitante (exceptuando
VIH). El 56% refirió tener alguna
adenomegalia. El 51% presentó
manifestaciones B. La diaforesis
profusa se documentó en 71%, la
fiebre en 52% y la pérdida de peso
en 24%. 60% de los individuos
presentaron ECOG < 1. Sesenta y
ocho por ciento tuvieron <1 región
ganglionar afectada. La ubicación
predominante de ellas fue cuello
(77%), axila (12%) e ingles (8%).
Hubo hepatomegalia en 12% y
esplenomegalia en 9%. Estadios
clínicos I y II en 45% de los casos,
estadio IV en 37% de los enfermos.
La tercera parte presentó hemoglobina menor de 12 g/dL. La mitad
de enfermos tuvieron elevaciones
una a dos veces las cifras normales
de DHL.
CONCLUSIONES. La mediana
de edad y la edad promedio al diagnóstico fueron similares a lo que se
describe en la literatura. El analfabetismo superó la media nacional
y la instrucción básica predominó.
Casi tres cuartas partes residían
cerca del Hospital. Casi la quinta
parte tuvo alguna comorbilidad.
Los resultados son equiparables en
cuanto a localizaciones ganglionares y ECOG. Para los individuos con
linfoma folicular, la hemoglobina
solo en 12% de los casos representó
un factor de riesgo para el FLIPI. La
DHL como factor de riesgo para el
IPI y FLIPI fue el segundo parámetro
más frecuente.
A1018
IMPACTO DEL CICLO FARMACOLÓGICO INICIAL SOBRE
BIOMARCADORES DE COAGULACIÓN, INFLAMACIÓN y LISIS
TUMORAL EN PACIENTES CON
LINFOMA NO HODGKIN
Rubio Jurado B*, González Sánchez
AG*, Cardona Muñoz EG**, Guerra
Soto A*, Nava Zavala AH*.
* Instituto Mexicano Del Seguro
Social. ** CUCS. Universidad de
Guadalajara.
rubiojb@yahoo.com.mx
INTRODUCCIÓN. En Linfoma no
Hodgkin (LNH) la expresión de al-
S179
Volumen 15, Suplemento 1, 2014
Revista de Hematología
teraciones genéticas y moleculares
manifiesta un complejo perfil con
distintivos panoramas clínicos,
bioquímicos y morfológicos. Los
pacientes con (LNH) puede tener un
estado protrombótico e inflamatorio, y adicionalmente la lisis celular
puede condicionar hiperuricemia y
cambios electrolíticos
OBJETIVO. Evaluar en pacientes con LNH el efecto del ciclo
farmacológico sobre biomarcadores, como son: niveles séricos de
electrolitos, ácido úrico, PCR y
dimero-d (D-D).
MATERIAL Y MÉTODOS. Se
incluyeron pacientes del Servicio
de Hematología del Hospital Especialidades, UMAE, CMNO, IMSS.
Con Linfoma No Hodgkin, de novo,
confirmado; mayor o igual a 18
años edad, firma consentimiento
bajo información. La información
clínica se recabó del expediente.
Se realizaron pruebas de ac. úrico,
electrolitos séricos, PCR y Dimero
–d (DD). TAMAÑO DE MUESTRA
Utilizando la fórmula para comparación de dos medias. n = 2(Za+
ZB)2 (S)2 / d 2; alfa = 0.05. beta =
0.20; S=1000 ng/ml, delta = 1500
ng/ml. Riesgo de 0.05 (1.960); Poder estadístico de 80% (0.842); n =
2(1.960 + 0.842)2 (1000)2 /(1500)2
; Obtenemos n = 8.1sujetos.
RESULTADOS. Se incluyeron en
el estudio 11 pacientes; 8 hombres
y 3 mujeres. Los valores (Mediana;
valor mínimo a valor máximo) fueron: edad 56 años; (25-89 a). Los
niveles pre y post R-CHOP fueron
(comparados con prueba de Wilcoxon): Ácido úrico 3.8 mg/L (1.1
a 8.5 mg/L) vs 3.6 mg/L (1.6 a 10.9
mg/L), Creatinina 0.65 mg/dL (0.5
a 1.0 mg/dL) vs 0.65 mg/dL (0.4 a
1.1 mg/dL) Calcio 8.75 mEq/L (6.8
-9.6 mEq/L) vs. 8.5mEq/L (2.1-11.7
mEq/L) Fósforo 4 mEq/L (1.9 – 5.4
mEq/L) vs. 4.0 mEq/L (1.2 – 6.9
mEq/L) PCR: 25.8 mg/L (8.5 – 58
mg/L) vs 27.6 mg/L (16-62 mg/L)
Leucocitos 8,9 cel/uL (3800 a
S180
15100 cel/uL) vs 9,8 cel/uL (3700 a
15,400 cel/uL), todos sin diferencia
estadística significancia; Potasio
4.6 mEq/L(3.5-5.4 mEq/L) vs. 4.1
mEq/L (2.7 – 4.4 mEq/L) (p<0.05)
D-D 1469 ng/mL (950 a 3248 ng/
ml) vs 1159 ng/mL (445- 4,060 ng/
mL) con p< 0.05.
CONCLUSIONES. Los niveles
de ácido úrico se incrementan en un
subgrupo sin alcanzar significancia
estadística. Los niveles de electrolitos séricos, creatinina y PCR no
muestran diferencia estadística. Se
encontró una disminución en el
nivel sérico de potasio (p<0.05).
Los niveles basales de D-D están
incrementados y muestran una
disminución una vez expuestos a
R-CHOP (p<0.05).
A1034
PRESENTACIÓN CLÍNICA, TRATAMIENTO Y EVOLUCIÓN DE
LINFOMA NO HODGKIN EN EL
NORESTE DE MÉXICO: EXPERIENCIA EN UN SOLO CENTRO
Gamboa Alonso CM*, Jaime Pérez
DJC*, Gutiérrez Aguirre DCH*,
Cantú Rodríguez DOG*, Marfil Rivera DLJ*, Gómez Almaguer DD*.
* Servicio De Hematología, Medicina Interna, Hospital Universitario
“dr. José Eleuterio González” Facultad De Medicina Universidad
Autónoma De Nuevo León, Monterrey, México.
magdis_gam@hotmail.com
INTRODUCCIÓN. El Linfoma no
Hodgkin es un desorden linfoproliferativo con una amplia variedad
de subtipos histológicos y características clínicas que influyen en su
pronóstico y evolución. No se cuenta con información epidemiológica
que estudie al LNH en México. La
incidencia ha aumentado con los
años, en EUA es de 4.6 por cada
100,000 habitantes y en México
de 3.4 %.
OBJETIVO. Conocer a la población con diagnóstico de LNH e
identificar las intervenciones que
podrían realizarse para un mejor
manejo clínico.
MATERIAL Y MÉTODOS. Se
analizaron retrospectivamente
las características clínicas y de
laboratorio de los pacientes con
diagnóstico de LNH confirmado por
biopsia y tratado en un centro de referencia del noreste de México del
2006 al 2013. El análisis estadístico
se realizó con el programa SPSS. Se
utilizó el método de Kaplan-Meier
para obtener el análisis de supervivencia.
RESULTADOS. Se incluyeron un
total de 453 pacientes diagnosticados con Linfoma no Hodgkin. La
mediana de edad fue de 54 años
(rango 1-95), con una relación
hombre/mujer de 1.6:1. La mayoría
de los pacientes fueron diagnosticados en etapas clínicas avanzadas
III y IV. El inmunofenotipo estuvo
disponible en 395 pacientes correspondiendo a la línea celular
B 89.9% (355 casos), 8.6% (34
casos) a la T , 0.7% (3 casos) B/T y
0.7% (3 casos) a las células NK. En
98 pacientes (21.6 %) no se pudo
realizar la clasificación del subtipo,
los subtipos que predominaron fue
el difuso de células grandes en 141
pacientes (39.7%) y el folicular en
86 pacientes (24.2%). La presencia
de síntomas B al momento del diagnóstico fue referido en un 62.2%
de los pacientes (207 casos). La
sobrevida global en los pacientes
con diagnóstico de LNH a 5 años
fue de 71%. Utilizando la regresión de Cox se encontró un riesgo
significativo asociado al rango de
hemoglobina (p=0.011), e infecciones tales como CMV (p=0.001),
HIV (p=0.046), HsAg (p= 0.046). Se
encontró también que utilizar Rituximab mejoraba significativamente
(p=0.030) la sobrevida global. El
resto de las variables no resultaron
ser estadísticamente significativas.
CONCLUSIONES. La edad de
presentación del LNH es menor en
Libro Educativo 55 Congreso Nacional de la Agrupación Mexicana para el Estudio de la Hematología, A.C.
México que en países desarrollados.
Se diagnostica en etapas clínicas
más avanzadas, sin embargo la
sobrevida global es igual a la que
encontramos en países desarrollados. Esto podría explicarse debido
a la implementación de nuevos
tratamientos como el anti-CD20
Rituximab que muestra un aumento en la sobrevida global de
los pacientes y una mejoría en su
evolución clínica.
A1053
IMPACTO DEL IMC EN LA RESPUESTA AL TRATAMIENTO DE
PACIENTES CON LINFOMA
Cantú Rodríguez OG*, Hawing
Zarate JA*, De La Cruz Cruz RA*,
Gutiérrez Aguirre CH*, Herrera
Rojas MA*, González Llano O*,
Mancias Guerra MDC*, De La Torre
Salinas A*, Gómez Almaguer D*.
* Servicio De Hematología, Hospital Universitario, Universidad
Autónoma De Nuevo León.
ogcantur@yahoo.com.mx
INTRODUCCIÓN. Actualmente
está bien documentada la estrecha relación entre el cáncer y la
obesidad, al igual que su potencial
predictivo sin embargo, actualmente no encontramos de estudios
prospectivos evaluando el IMC
como factor pronóstico en los Linfomas de Hodgkin y no Hodgkin.
O B J E T I VO . L a p o b l a c i ó n
mexicana presenta altos índices
sobrepeso, resultaría relevante contar con estos datos, con la finalidad
de dirigir una terapéutica integral
del paciente con linfoma.
MATERIAL Y MÉTODOS. Estudio observacional, prospectivo y
descriptivo realizado en el Servicio de Hematología del Hospital
Universitario “Dr. José Eleuterio
González”, en pacientes que acudieron a consultar en el período de
diciembre 2011 – diciembre 2013
y que fueron diagnosticados con
Linfoma Hodgkin (LH) y no Hod-
gkin LNH) bajo tratamiento con el
esquema convencional del centro
según su diagnóstico. Se realizaron
mediciones seriadas de peso, talla,
IMC, % grasa corporal, teniendo
como referencias importantes el
peso inicial, y el peso al término del
esquema de tratamiento; además
de edad, género, estadio, presencia
de síntomas B, enfermedad bulky,
ubicación en la escala de ECOG
al momento del diagnóstico, presencia de comorbilidades como
hipertensión arterial (HTA) y diabetes mellitus (DM).
RESULTADOS. De 71 pacientes estudiados (39 masculinos, 32
femeninos), 18 pacientes (25.4%)
sufrían de LH y 53 LNH (74.6%). La
mediana de edad global fue de 53
años (17-84). Con una mediana de
seguimiento de 5.46 meses (0.4217.26), la sobrevida global fue de
79.6% a 12 meses. Al comparar
la supervivencia teniendo como
factor la presencia o ausencia de
sobrepeso, encontramos una mayor
sobrevida en el grupo con sobrepeso
(sobrepeso u obesidad) en relación
al grupo sin sobrepeso (peso normal
o bajo), alcanzando un valor marginalmente significativo (p=0.069).
Al análisis 36 pacientes concluyeron tratamiento, encontrando que
aquellos que perdieron más del 5%
en relación a su peso inicial antes
del tratamiento tienen una menor
sobrevida (p=0.002). En el análisis
multivariado no existió asociación
entre el estadio de la enfermedad,
síntomas B, comorbilidades o ECOG
con la sobrevida y/o respuesta en los
grupos con y sin sobrepeso.
CONCLUSIONES. Los pacientes
con linfoma que presentan IMC alto
al tiempo del diagnóstico parecen
tener una mayor mortalidad asociada. Sin embargo, notamos que
la pérdida de más del 5% del peso
corporal al término de la primera
línea de tratamiento supone un
factor más importante que la simple
categorización inicial del IMC.
A1101
BUENA INDUCCIÓN DE RESPUESTA CON EL ESQUEMA ABOD
EN PACIENTES CON LINFOMA DE
HODGKIN CLÁSICO: EXPERIENCIA EN 5 CASOS
González López EE*, Herrera Rojas MÁ*, Vazquez Mellado De
Larracoechea A*, González Leal
XJ*, Jaime Pérez JC*, Gómez Almaguer D*.
* Universidad Autónoma de Nuevo
León, Hospital Universitario Dr. José
Eleuterio González.
eliasgzzl@hotmail.com
INTRODUCCIÓN. El esquema
ABVD ha sido el estándar de tratamiento para linfoma de Hodgkin
(LH) clásico por 4 décadas, sin
embargo la escasez de vinblastina
desde enero del 2012 en México ha
comprometido la administración de
este esquema. La vincristina, otro
alcaloide de la vinca, posee un
mecanismo de acción similar y ha
sido utilizado en otros esquemas
terapéuticos para el LH.
OBJETIVO. Valorar la tasa y tipo
de respuesta con el esquema ABOD
en pacientes con LH clásico.
MATERIAL Y MÉTODOS. Se
incluyeron pacientes con LH de
enero del 2013 a enero del 2014
que recibieron ABOD y se valoró
la respuesta por TAC y/o PET. Se
excluyeron pacientes con 2 o más
ciclos de ABVD.
RESULTADOS. Se encontraron
5 pacientes, 3 hombres y 2 mujeres, la edad promedio fue de 38.8
años. Paciente 1: Etapa clínica IIIBX
con masa mediastinal, IPS 4, 6
ciclos de ABOD. PET-CT posterior
a dos ciclos con respuesta parcial
(adenopatía 2cm mediastinal con
14.1 SUV). Se realiza autotrasplante de células hematopoyéticas,
tras 2 meses de seguimiento, sin
datos de actividad. Paciente 2:
Etapa clínica IIIA, IPS 3, 4 ciclos
de ABOD. PET-CT después de dos
ciclos, con respuesta completa. El
S181
Volumen 15, Suplemento 1, 2014
Revista de Hematología
paciente falleció sin evidencia de
actividad, debido a neumonitis,
complicada con un neumotótax.
Paciente 3: Etapa clínica IVBM,
IPS 5, 6 ciclos de ABOD. TAC al
final del tratamiento con respuesta
parcial, sin más tratamiento. A 6
meses de seguimiento se observa en
TAC de control enfermedad estable.
Paciente 4: Etapa clínica IVBM,
IPS 3, 6 ciclos de ABOD. TAC al
final del tratamiento con respuesta
parcial, sin más tratamiento. A 6
meses de seguimiento se observa en
TAC de control enfermedad estable.
Paciente 5: Etapa clínica IIB con
masa mediastinal, IPS 2, 2ciclos de
ABVD, 4 ciclos de ABOD. PET-CT
después del 2º ciclo, con respuesta
completa. Presenta progresión de la
enfermedad al 2º mes de vigilancia.
CONCLUSIONES. El esquema
ABOD indujo respuesta en el 100%
de los pacientes con LH, completa
en 2 casos (40%). La Sociedad Americana de Farmacéuticos (ASHP)
emitió un comunicado el 10 de
diciembre del 2013 donde se menciona que continuará la escasez
de vinblastina. La sustitución de
vinblastina por vincristina en el
esquema ABOD es una alternativa
para la inducción de respuesta en
LH clásico.
A1103
SEGUNDAS NEOPLASIAS EN
LINFOMA NO HODGKIN (LNH)
EN EL INSTITUTO NACIONAL DE
CANCEROLOGIA –MEXICODe La Torre Lujan AH*, Candelaria
Hernandez MG*, Labardini Mendez JR*.
* Instituto Nacional de Cancerología.
alfredo_de_la_torre@yahoo.com
INTRODUCCIÓN.Segunda neoplasia (SN) es aquella que ocurre
posterior a un diagnostico de
cáncer, y pudiera caer en dos
categorías, sincrónica es aquella
de otro extirpe histológico, que
S182
se presenta al mismo tiempo que
la primera o en las primeros dos
meses de acuerdo a criterios de
SEER. El LNH es la 7ª causa de
cáncer en hombres y la 6ª causa
en mujeres en EU, se estiman 15 a
20 casos/100 000, afecta a Adultos
entre los 50 a 70 años se presenta
más en hombres y en caucásicos,
90% son de extirpe B. Los más
comunes son el difuso de células
grandes B (LDCGB) y el folicular
(LF) representando el 30% y 22.6%
de los casos respectivamente
OBJETIVO. Describir las segundas neoplasias asociadas a los
linfomas más comunes, factores
de riesgo asociados, incidencia y
características demográficas
MATERIAL Y MÉTODOS. Estudio retrospectivo, de pacientes
con LDCGB, y LF en el INCan,
de enero 2007 a Diciembre de
2012 incluyendo tumores sincrónicos y metacrónicos, evaluando
incidencia, factores de riesgo y
características demográficas, excluyendo tumores benignos
RESULTADOS. Se incluyeron
630 pacientes encontrando 19
casos con segunda neoplasia, una
incidencia de 3.01% de segunda
neoplasia, edades entre 40 a 82
años, 8 con LF y 11 con LDCGB,
3 neoplasias fueron sincrónicas
y 16 metacrónicas. Las segundas
neoplasias fueron 6 cáncer papilar
de tiroides, 2 adenocarcinoma de
recto, 3 cáncer de mama, 1 adenocarcinoma de colon, 1 cáncer
cervicouterino, 4 cáncer de piel
no melanoma, 1 paciente con melanoma, 1 cáncer epidermoide de
vulva, 1 adenocarcinoma gástrico.
El cáncer papilar de tiroides, tuvo
represento 30%. 11 Pacientes recibieron alquilantes previamente,
aquellos que no habían tenido
exposición previa habían sido
neoplasias sincrónicas y 5 casos
solo tenían cirugía previo a SN.
1 paciente fue expuesto a radioterapia previo a SN. Un paciente
tuvo diagnostico de síndrome de
Li-Fraumeni.
CONCLUSIONES. Nuestros resultados son algo diferentes a los de
estudios previos ya que de acuerdo
a la incidencia de SEER casi un 10%
de los sobrevivientes llegan a tener
SN, estudios en población de LNH
hay pocos y en ellos la incidencia
va de 3.45 a 7.23 %, Este estudio
muestra una cosa que ningún otro
estudio había mostrado ya que presenta 6 casos de cáncer papilar de
tiroides como SN principal en LNH
siendo el 30% de las neoplasias en
nuestra población. La mayoría de
los estudios anteriores mencionan
que las neoplasias hematológicas
son las principales SN seguido de
pulmón, próstata
A1162
TERAPIA DE MANTENIMIENTO
EN LINFOMAS NO FOLICULARES EN ETAPA AVANZADA CD20
POSITIVOS. INFORME DE CASOS
Gonzalez Acosta JC*.
* Instituto Mexicano Del Seguro
Social.
jcga74@hotmail.com
INTRODUCCIÓN. La terapia de
mantenimiento con rituximab en
Linfomas de alto grado de malignidad u otros neoplasmas linfoides
CD20 positivos incluyendo en
linfoma de Hodgkin. En este estudio de informa los resultados de
pacientes tratados con mantenimiento con rituximab con estos
tipos de linfoma.
OBJETIVO. Informar los resultados de la terapia de mantenimiento
en linfomas no foliculares en un
grupo de pacientes con tumor en
etapa avanzada y/o extranodal mediante una revisión retrospectiva de
expedientes clínicos.
MATERIAL Y MÉTODOS. Se
evaluaron retrospectivamente los
resultados de tratamiento de 9 pacientes con linfomas No Foliculares
en etapa avanzada en quienes se
Libro Educativo 55 Congreso Nacional de la Agrupación Mexicana para el Estudio de la Hematología, A.C.
administró terapia de mantenimiento cada 3 meses con Rituximab 375
mg/m2 IV durante el lapso de 2 años
una vez que recibieron terapia de
inducción a remisión con esquemas
de quimioterapia estándar combinados con Rituximab. Todos los
pacientes fueron positivos a CD20
en los estudios de inmunohistoquímica.
RESULTADOS. En este informe
se evaluaron 9 expedientes de
pacientes del HGZ No 1 del IMSS
en la ciudad de Durango tratados
entre los años de 2007 a 2012. De
estos 6 tenían diagnóstico de LNH
de células grandes (LNHCG), 1 Linfoma de células del Manto (LCM),
1 LNH de linfocitos pequeños y 1
Linfoma de Hodgkin predominio
linfocitico nodular (LHPLN), 6
corresponden al sexo femenino y
3 al masculino. Todos los pacientes
tenían una etapa IIIB (n=2) a IVB
(n=7) al diagnóstico, con score
pronostico de riesgo alto , 6 de
ellos tuvieron infiltración extranodal (testículo, intestino grueso,
vía urinaria baja, pleura). Cuatro
pacientes con LNHCG recibieron
6 ciclos de R-CHOP y dos de ellos
con LNH de bajo grado no folicular
6 ciclos de R-CNOP (mitoxantrone). La paciente con LHPLN recibió
8 ciclos de R-ABVD. Ninguno
de ellos recibió radioterapia de
consolidación. Todos recibieron
inmediatamente después de concluir quimioterapia combinada
mantenimiento con Rituximab. La
mediana de SVLE fue de 38 meses
(rango 12-62 meses). Solamente
uno de estos pacientes falleció
por progresión tumoral al año del
diagnóstico de LNHCG.
CONCLUSIONES. En este grupo
de pacientes es posible que la terapia de mantenimiento haya influido
en una mayor supervivencia libre de
progresión ya que todos ellos tenían
tumores con pronóstico adverso y
score de riesgo alto, sin embargo
se ameritan ensayos clínicos comparativos para un lograr mayor nivel
de evidencia.
A1164
CARACTERÍSTICAS CLÍNICO-BIOLÓGICAS DE LA ENFERMEDAD DE
CASTLEMAN: EXPERIENCIA EN
CENTRO MÉDICO NACIONAL DE
OCCIDENTE
Jiménez Ochoa MA*, Borjas Gutiérrez C*, Garcés Ruiz OM*, Aguilar
López L*, Vega Ruiz A*, Rubio
Jurado B*, Miranda Ruvalcaba C*,
Palacios Ramos A*, Pérez Mar NP*.
* Instituto Mexicano Del Seguro
Social UMAE CMNO.
markj8a@gmail.com
INTRODUCCIÓN. La Enfermedad
de Castleman (EC) es un trastorno
linfoproliferativo no clonal, descrito
inicialmente en 1954. Se han demostrado 3 variantes histológicas,
las cuales son: Hialino-Vascular, de
células plasmáticas y mixta. También se categoriza en unicéntrica,
si afecta 1 porción ganglionar, o
multicéntrica si lo hace en más de
una. Cada una con diferente tratamiento y pronóstico.
OBJETIVO. Describir las características clínico-biológicas, así
como el tratamiento y estado actual
de los pacientes con diagnóstico de
EC en Hospital de Especialidades
Centro Médico Nacional de Occidente IMSS
MATERIAL Y MÉTODOS. Se
realizó un estudio descriptivo,
observacional, trasversal, a través
de revisión de expedientes de los
pacientes con diagnóstico histopatológico de EC, diagnosticados en
un periodo de 4 años desde enero
de 2009 a diciembre de 2013, en el
servicio de hematología del Hospital de Especialidades Centro Médico
Nacional de Occidente IMSS. Se
registraron las características demográficas, clínico-biológicas, el
tratamiento y el estado actual de
los mismos.
RESULTADOS. Se encontraron
5 pacientes con el diagnóstico de
EC, en el periodo de tiempo comprendido, siendo el sexo masculino
más frecuente y una edad promedio
de 47.8 años La variedad predominante fue la Hialino Vascular,
unicéntrica en 60% porcentaje de
casos.
El cuadro clínico se caracterizó
por dolor abdominal persistente
lo que obligó a realizar estudios
de imagen, donde se descubrió la
masa tumoral, la cual fue biopsiada
de manera excisional en todos los
casos. Un paciente presentó síntomas B y pénfigo paraneoplásico,
los cuales disminuyeron de manera
importante con la quimioterapia. El
tratamiento inicial fue quirúrgico y
solo a 2 casos se indicó quimioterapia, uno por multicéntrico y otro
por variedad de células plasmáticas.
Actualmente todos los pacientes
se encuentran en vigilancia. Los
resultados se muestran en Tabla 1
CONCLUSIONES. La EC tiene
una presentación poco común
y debido a su baja incidencia se
cataloga como una enfermedad
huérfana; por lo que la mayoría
de la información se obtiene a
través de pequeños reportes como
el presente. Se presentan 5 casos
los cuales todos fueron tratados de
manera inicial quirúrgicamente y
según necesidad, se dio quimioterapia adyuvante. El 100% de los
pacientes se encuentra vivo y sin
evidencia de enfermedad. El tratamiento específico de la EC aún está
por definirse.
S183
Volumen 15, Suplemento 1, 2014
Revista de Hematología
Tabla 1. Características Demográficas, clínico-biológicas, tratamiento y respuesta de los pacientes con EC
Pac Edad Sexo Histología
Centricidad
1
2
3
4
5
Multicéntrico
Unicéntrico
Unicéntrico
Unicéntrico
Unicéntrico
40
52
51
55
41
M
M
F
F
M
HV
CP
HV
HV
HV
Síntomas
B, Penfigo
Dolor
Dolor
Dolor
Estreñimiento
Sitio
Trat
Retroperitoneo
Retroperitoneo
Apendice
Retropertitoneo
Retroperitoneo
Edo Actual
QX+ CHOP X4 RC (2ª)
Qx +CFA-Vin X4 RC(3ª)
Qx
RC 3meses)
Qx
RC 5meses)
Qx
RC(4 años)
MEDICINA TRANSFUSIONAL
PRESENTACIÓN ORAL
A1096
PREVALENCIA DE SÍNDROME
METABÓLICO EN UNA MUESTRA
DE PREDONANTES Y DONANTES
DE SANGRE EN ZACATECAS
Sotelo Ham EI*, Rodríguez Monreal
ME*, Chávez Amaya R*, Dávila
Mota M*, Rojo Medina J**.
* Servicios De Salud De Zacatecas.
** Centro Nacional de Transfusión
Sanguínea.
sotham@hotmail.com
INTRODUCCIÓN. En México
Aguilar-Salinas informó prevalencia
ajustada por edad de 13.6%, con
criterio de la Organización Mundial
de la Salud y 26.6% con el criterio
NCEP-ATPIII en personas de 20 a
69 años de edad, provenientes de la
Encuesta ENSA-2000 y ENSANUT
2012 fue del 45 %. Munguía.
Miranda reporto 35.2 % de dislipidemia mixta en 2008. González
Villalpando en el estudio de Diabetes en la ciudad de México informó
prevalencias e 39.9% y 59.9%, con
base al criterio de la NCEP-ATP III.
OBJETIVO. Conocer la prevalencia de síndrome metabólico
en una muestra de predonantes y
donantes de sangre en Zacatecas.
M AT E R I A L Y M É TO D O S .
Estudio transversal de casos consecutivos, de abril a agosto de 2013,
S184
previo consentimiento de informados, incluyó 182 predonantes
y donadores de 18 a 60 años. Se
efectúo historia clínica, examen
físico y determinaciones de glicemia y perfil de lípidos. Se analizó
con estadística descriptiva, con una
p < 0.05.
RESULTADOS. La edad promedio fue de 31.1± 0.4, predominó
el sexo masculino 153 (84.1%),
ocupación; campesinos 51 (28
%) y empleados de oficina y sin
empleo (18%); escolaridad secundaria 65 (35.7%) y primaria
55 (30.2%). Con antecedentes
heredofamiliares de sobrepeso u
obesidad 36 (19.8%), Diabetes 86
(47.3%), Hipertensión 49 (26.9%),
Hipercolesterolemia 10 (5.5%),
trigliceridemia 4 (2.2%), Cáncer 22
(12.1%), Embolia cerebral 7(3.8%)
e infarto cardíaco 11(6.6%). La prevalencia de sobrepeso 78 (42.95%)
y obesidad 46 (25.2%). La media
de glucosa 85.4, colesterol 85.4,
C.HDL 49.1, C- LDL 118.8 mg/
dl, Triglicéridos 201.2 mg/dl. La
prevalencia de hipertrigliceridemia
70 (37.9%), hipercolesterolemia
11 (6%), incremento de HDL 8
(4.4%) y LDL 26 (14.2%). De los
sujetos con obesidad por índice de
cintura/cadera: hombres 6 (3.3%) y
mujeres 17 (9.3%). La prevalencia
de síndrome metabólico de acuerdo
a los criterios de la NCEP ATP III >
3 componentes 26 (14.2%) de los
cuáles 16 (8.7%) presentaron sueros
lipémicos.
CONCLUSIONES. Es importante
la proporción de sujetos que acuden
como potenciales donadores a
bancos de sangre de concentración
que se consideran individuos sanos.
Dado que enfermedades del corazón han sido la principal causa de
muerte en México desde 1990, el
tamizaje del perfil de lípidos es útil
para identificar a individuos con
riesgo de enfermedad coronaria,
que justifiquen la aplicación de intervenciones intensivas en el estilo
de vida y la institución de terapia
farmacológica. Es necesario diseñar
y aplicar programas que reduzcan el
efecto de este l problema de salud
pública.
A1179
INCIDENCIA DE EFECTOS ADVERSOS EN EL DONADOR DE
AFERESIS PLAQUETARIA CON
LA MODALIDAD DOBLE COSECHA, EN EL BANCO DE SANGRE
CENTRAL DEL CENTRO MÉDICO
NACIONAL DE OCCIDENTE
Jiménez Ochoa MA*, Torres Torres
O**, Carrasco Martinez IL**, Garcés
Ruiz OM*, Aguilar López L**, Bor-
Libro Educativo 55 Congreso Nacional de la Agrupación Mexicana para el Estudio de la Hematología, A.C.
jas Gutiérrez C*, Rubio Jurado B*,
Vega Ruiz A*, Miranda Ruvalcaba
C*, Palacios Ramos A*, Pérez Mar
NP*, Sandoval Evaris MDR**.
* Instituto Mexicano Del Seguro
Social UMAE CMNO. ** Banco De
Sangre Central IMSS UMAE CMNO.
markj8a@gmail.com
INTRODUCCIÓN. Las innovaciones en la aféresis plaquetaria
(AP), han permitido progreso con
respecto a la eficiencia en la recolección, se han generado diversas
estrategias para obtener el máximo
beneficio, sin exponer la seguridad
de los donadores. La modalidad de
recolección doble permite obtener
mayor cantidad de hemocomponentes, disminuyendo los recursos
requeridos, sin embargo no se han
establecido los criterios de selección del donador ni se conocen
con exactitud los efectos adversos
relacionados a la AP en dicha modalidad en pacientes mexicanos.
OBJETIVO. Establecer la seguridad de la aféresis plaquetaria,
en modalidad doble cosecha en
el Banco de Sangre Central (BSC)
de Centro Médico Nacional de
Occidente (CMNO), utilizando
esta modalidad de rutina, como
estrategia para disminuir costos y
aumentar el número de hemocomponentes disponibles.
MATERIAL Y MÉTODOS. Se
realizó un estudio observacional
transversal, en donadores de AP
BSC de CMNO, de septiembre
2013 a enero de 2014, los cuales
fueron asignados dependiendo de
cuenta plaquetaria, para realizar AP
modalidad doble cosecha.
Se registraron los valores de
citometría hemática de los donadores, previos y posteriores al
procedimiento de extracción, del
mismo modo los efectos adversos
asociados a la plaquetoaféresis
(accesos venosos, circulatorios y
relacionados al citrato). Evaluando
el control de calidad de los productos, con citometría hemática de
los mismos, calculando número de
plaquetas procesadas, rendimiento
plaquetario y eficiencia de la recolección.
RESULTADOS. Se realizaron 70
AP, se obtuvieron 140 productos
disponibles. Se encontraron 40
varones, 30 mujeres, una edad
promedio de 31.6 años. La cuenta
plaquetaria promedio previa fue
312, el hematocrito 45.5, asi como
la cuenta plaquetaria posterior fue
de 173.4 y el hematocrito 43.75. El
tiempo promedio del procedimiento fue 89 minutos. En los productos
se evidenció una eficiencia de recolección de 66%. 8 de los donadores
presentaron algún evento adverso,
más comúnmente dependientes
de citrato, 6 de éstos con parestesias periorales, que remitieron de
carbonato de calcio, sin otros incidentes. 1 donador presentó tetania
se manejó gluconato de calcio IV. 1
donador con hipotensión manejado
con solución salina.
CONCLUSIONES. La técnica de
AP en modalidad de doble cosecha,
es conveniente, debido a que se
utilizan los mismos recursos con
el fin de obtener doble producto,
lo cual aparte de disminuir costos,
aumentaría la disponibilidad de
hemocomponentes. Los efectos adversos encontrados en esta población
de 70 donadores, fueron del 11%,
todos ellos inocuos, Por lo cual el
procedimiento de extracción doble
rutinario podría considerarse seguro.
PRESENTACIÓN CARTEL
A1111
DETERMINACIÓN DE LOS NIVELES
SÉRICOS DE FERRITINA COMO UN
MARCADOR DE SOBRECARGA DE
HIERRO POSTRANSFUSIONAL EN
PACIENTES CON INSUFICIENCIA
RENAL CRÓNICA (IRC) SOMETIDOS A MULTITRANSFUSIÓN DE
HEMOCOMPONENTES, EN EL
SERVICIO DE NEFROLOGÍA DEL
HOSPITAL GENERAL DE ZONA
NO. 1 DEL IMSS EN LA CIUDAD
DE DURANGO DGO
Gonzalez Acosta JC*, Mercado
Suarez MF*.
* Instituto Mexicano Del Seguro
Social.
jcga74@hotmail.com
INTRODUCCIÓN. La sobrecarga de hierro se produce cuando
aumenta el ingreso de hierro por
transfusión de glóbulos rojos o por
un incremento de su absorción
intestinal. El alto requerimiento de
transfusiones está sujeto a sobrecarga de hierro. En nefrópatas es
necesario un programa de transfusión sanguínea al mismo tiempo de
la terapia dialítica pero la ferritine-
mia causa efectos potencialmente
letales.
OBJETIVO. Determinar la presencia de sobrecarga de hierro en
pacientes con insuficiencia renal
crónica sometidos a multitransfusión de concentrados de eritrocitos
como parte del tratamiento de la
anemia por enfermedad crónica.
MATERIAL Y MÉTODOS. Se
realizó un estudio observacional,
trasversal. Los pacientes fueron
elegibles para el estudio si tenían
18 años o más y un diagnóstico de
insuficiencia renal crónica de por
S185
Volumen 15, Suplemento 1, 2014
Revista de Hematología
lo menos 6 meses antes de ingresar
al estudio tratados con hemodiálisis
y que hayan recibido por lo menos
10 transfusiones de paquete globular desde el inicio de su nefropatía.
En todos los pacientes se realizaron
niveles de ferritina sérica, hierro sérico, citometría hemática, proteína
C reactiva y VSG. Se excluyeron
del estudio a los pacientes con
VSG y PCR elevada, neoplasias,
infección activa, inflamación aguda o crónica, hemólisis, IAM, EVC,
trombosis, rabdomiólisis, hipertiroidismo, enfermedad de Gaucher,
hepatopatía , etilismo crónico o
conectivopatía al momento de la
toma de la muestra.
RESULTADOS. Se analizaron
un total de 20 pacientes con diagnóstico de IRC en el periodo de
septiembre a diciembre 2011 la
mediana de transfusiones fue de
22.5 eventos en la población analizada (rango 10-35 transfusiones).
Todos los pacientes estaban en
hemodiálisis. Todos los pacientes
se administraban de 6000- 12,000
U de EPO semanal. La prevalencia
puntual de sobrecarga de hierro
fue 0.7 (70%) (n=14 ) que tuvo al
momento del análisis nivel alto de
ferritina. Para los pacientes del sexo
masculino la mediana del nivel
sérico de ferritina fue de 1248 ng/
ml (rango 237-2260) y para mujeres 186 (rango 101-272). El 35.7
% de los pacientes (n= 5) curso
con hierro sérico bajo y el 64.3%
con hierro sérico normal (n=9). La
mediana de nivel Hb sérica fue
8.85 gr/dL (6.3-11.4 gr/dL)entre los
hombres y de 10.6 gr/dL (7.3-13.9
gr/dL) en mujeres. Ninguno de los
pacientes curso con elevación PCR
y/o VSG.
CONCLUSIONES. La sobrecarga de hierro postransfusional tuvo
una elevada prevalencia entre la
población nefrópata en hemodiálisis, sin embargo se encontró en
rango no tributario de terapia de
quelación en los pacientes.
S186
A1132
PRODUCTIVIDAD DEL BANCO
DE CÉLULAS HEMATOPROGENITORAS Y LABORATORIO DE
CRIOPRESERVACIÓN DE UN
HOSPITAL UNIVERSITARIO DEL
NORTE DEL PAIS
Mancias Guerra MDC*, González
Llano Ó*, Villarreal Martínez L*,
Cantú Rodríguez OG*, Gutiérrez
Aguirre CH*, Osorno Rodríguez
KL*, Aguirre Fernández GC*, Garza
Bedolla A*, Méndez Ramírez N*,
Cepeda Cepeda MG*, Mayagoitia
Fragoso MT*, Salazar Riojas R*,
Gómez Almaguer D*.
* Hospital Universitario “Dr. José
Eleuterio González”, Facultad De
Medicina, Universidad Autónoma
De Nuevo León.
consuelomanciasg@gmail.com
INTRODUCCIÓN
El Banco de Sangre con permiso
de manejo de CPH (células hematoprogenitoras) y laboratorio de
criopreservación inició actividades
en el 2001. Este fue el primer banco público de cordón umbilical
(CU) en operar en México. Sus
servicios incluyen la criopreservación, recolección, procesamiento
y criopreservación de unidades de
sangre de CU y de sangre periférica
y médula ósea, ambas para trasplante autólogo o alogénico de CPH.
OBJETIVO. Describir la experiencia generada del Banco de
Sangre y laboratorio de criopreservación del Servicio de Hematología
de un Hospital Universitario del
norte del país.
MATERIAL Y MÉTODOS. Se
utilizaron procedimientos operativos estándar internacionales para
la selección y criopreservación
de unidades de sangre de cordón
umbilical (USCU). Su búsqueda
para trasplante de CPH se realiza
no solo con las unidades de CU
inventariadas en este banco, sino
también en el Centro Nacional de la
Transfusión Sanguínea y en algunos
bancos y registros de los EU. Las
USCU seleccionadas para trasplante fueron liberadas y descongeladas,
basados en su HLA y su contenido
de células CD34+. Por otro lado,
la recolección y criopreservación
de CPH de sangre periférica (SP) es
utilizado en trasplantes autólogos
y alogénicos, en enfermedades
hematológicas malignas y benignas.
RESULTADOS. Un total de 1004
USCU (30.2% alogénicas, 69.8%
autólogas) se han criopreservado
durante este tiempo. Se han realizado 285 búsquedas de USCU en
nuestro Banco. Se han liberado para
trasplante de CPH 10 unidades de
nuestro Banco (3.1% de las unidades criopreservadas). El 85.2% de
las USCU criopreservadas provienen de otros centros hospitalarios.
Solo el 61.8% del total de unidades
recibidas son criopreservadas. El
resto se desecha por defectos en
la recolección principalmente. Se
han criopreservado 323 unidades
(35.6% alogénicas, 64.4% autólogas) de SP representando el 66.5%
del total recolectado.
CONCLUSIONES. El Servicio
de Hematología no sólo evalúa,
diagnostica y trata pacientes con
enfermedades hematológicas que
no cuenten con ningún tipo de
seguridad social, sino que también
realiza un gran número de trasplantes de CPH. Además, por medio de
su laboratorio de criopreservación
y Banco de Sangre con Manejo de
Células Hematoprogenitoras criopreserva, resguarda, descongela y
transporta CPH de SCU y SP hacia
otros hospitales públicos y privados,
especialmente en el norte del país.
Hemos avanzado mucho en lo relacionado a trasplante de CPH, pero
como país en vías de desarrollo,
aún tenemos un largo camino por
recorrer.
A1155
COMPARACIÓN DE LA CITOMETRÍA HEMÁTICA OBTENIDA
Libro Educativo 55 Congreso Nacional de la Agrupación Mexicana para el Estudio de la Hematología, A.C.
MEDIANTE TOMA CAPILAR VS.
VENOSA EN PACIENTES CON ENFERMEDADES HEMATOLÓGICAS
Herrera Rojas MA*, Gómez De
León A*, Tarín Arzaga LDC*, Valdés
Galván MJ*, Salazar Riojas R*.
* Hospital Universitario “dr. José
Eleuterio Gonzalez”, UANL.
miguel.herrera.rojas@gmail.com
INTRODUCCIÓN. Los pacientes
con enfermedades hematológicas
requieren de seguimiento de los
valores de la citometría hemática
(CHv), provocando deterioro de
los sitios de punción venosa. Por tal
motivo la citometría capilar (CHc)
es una opción en estos pacientes.
En adultos existen 3 estudios realizados con lancetas estandarizadas,
en ellos los valores obtenidos en
la CHc son mayores y estadísticamente significativos, pero sin
repercusión clínica.
OBJETIVO. Comparar la CHc
tomada con una lanceta no estandarizada con la CHv de los pacientes
con enfermedades hematológicas.
MATERIAL Y MÉTODOS. Estudio prospectivo, comparativo, en
adultos con alguna enfermedad
hematológica, previa aceptación
y firma del consentimiento informado. La toma de CHc ocurrió en
la parte lateral externa del tercer o
cuarto dedo utilizando una lanceta
mediLance® de 3mm, descartando
la primera gota y recogiendo 250500 µL en un tubo BD microtainer
con EDTA. La muestra de CHv
se obtuvo de la vena cubital por
punción directa en tubo de 5 mL
BD Vacutainer con EDTA. Ambas
muestras se recolectaron al mismo
tiempo en cada paciente por el
mismo operador. La medición de la
CH se realizó utilizando el equipo
Sysmex XT-2000i.
RESULTADOS. Se incluyeron 92
CH en el análisis, cuyas muestras
fueron tomadas de de 51 mujeres
y 41 hombres, con una mediana
de edad de 46.6 años (rango 18-
91). El diagnóstico más común fue
linfoma no Hodgkin en el 18.5%
de los casos, seguido de leucemia
linfoblástica aguda y leucemia
granulocítica crónica, ambos en el
14.1%. La media de todas las variables incluidas en la CH se encontró
dentro de los rangos normales. Se
encontró un aumento significativo
(p<0.001), aunque pequeño, en el
diferencial de leucocitos capilar,
siendo más pronunciado en los
monocitos (+0.46x106/L). Asimismo se encontró un aumento en el
hematocrito y concentración de
hemoglobina (+0.5% y +0.29 g/dL,
respectivamente) en la CHc. En contraste, la concentración plaquetaria
fue menor en la CHc (-4.94x109/L).
El coeficiente de correlación (r)
para todas las variables fue bueno,
de 0.82-0.99 (p<0.001 en todos
los casos). De manera similar la
concordancia para diagnosticar
niveles elevados o disminuidos de
leucocitos, hemoglobina y plaquetas fue buena, con un valor de ? de
0.87, 0.76 y 0.96 (p<0.001 en todos
los casos).
CONCLUSIONES. En conclusión, aunque la CHc presenta
resultados distintos, estos no son
clínicamente relevantes al utilizar
una lanceta no estandarizada de
menor costo. La toma de sangre
capilar es aceptable y no influye en
la decisión clínica.
A1163
CORRELACION ENTRE RECUENTO PLAQUETARIO Y VALOR DE
CD 34+/KG DE PESO, COMO
PREDICTORES DE ÉXITO EN
COSECHAS DE CELULAS PROGENITORAS HEMATOPOYETICAS EN
MIELOMA MULTIPLE Y LINFOMAS
Alexander Alfaro M*, Acosta Maldonado BL*, Sanchez Guerrero SA*.
* Instituto Nacional de Cancerologia.melvinalfaro2006@yahoo.com
INTRODUCCIÓN. Los pacientes
con diagnóstico de linfoma o
mieloma múltiple sometidos a movilización de células progenitoras
hematopoyéticas (CPH) presentan
un alto porcentaje de falla en la
obtención de una cosecha celular
adecuada. Se han utilizado múltiples parámetros de laboratorio con
el objetivo de predecir el resultado;
el conteo de CD34 en sangre periférica es el más estudiado; pero sin
un valor estándar para su uso. Otros
parámetros menos estudiados son
el recuento plaquetas y la cosecha
de CD 34/kg de peso el primer día
de la cosecha.
OBJETIVO. Determinar el valor
pronóstico del recuento plaquetario
previo a la movilización y del recuento de CD34/Kg/peso el primer
día de la cosecha y el éxito de la
obtención.
MATERIAL Y MÉTODOS. Se
realizó un estudio retrospectivo
de enero de 2011 a septiembre de
2013).Se analizó a 82 pacientes: 16
con Linfoma Hodgkin (LH), 37 con
Linfoma No Hodgkin (LNH) y 29
Mieloma Múltiple sometidos a esquemas de movilización y cosecha
de CPH. El objetivo fue determinar
el valor pronóstico del recuento
plaquetario previo a la movilización
y del recuento de CD34/Kg/peso el
primer día de la cosecha y el éxito
de la obtención.
RESULTADOS. De los 82 pacientes sometidos 55 (67.1%)
movilizaron exitosamente y 27
(32.9%) fallaron. No se encontró
asociación entre el recuento plaquetario y el éxito de cosecha (P
= 0.21). Se encontró una relación
significativa de éxito en la cosecha
en pacientes con recuento > 1.00
millones de CD34+/kg/peso el primer día de la cosecha (p = <0.000)
y > 15.1 cel./ µL de células CD34+
en sangre periférica el primer día de
inicio de la cosecha (P = <0.000).
CONCLUSIONES. No se encontró asociación entre el recuento
plaquetario y el éxito de cosecha,
sin embargo si hay una fuerte aso-
S187
Volumen 15, Suplemento 1, 2014
Revista de Hematología
ciación entre recuentos de CD34 en
sangre periférica previo y el primer
día de la cosecha. Es necesario
realizar más estudios para determinar si hay otros parámetros y/o su
combinación puedan predecir el
éxito en la cosecha de CPH.
A1177
EFECTO DE LAS TRANSFUSIONES
EN LA SOBREVIDA DE PACIENTES CON LEUCEMIA AGUDA
INFANTIL
Saavedra Herrera MV*, Rivera Ramirez AB*, Rodriguez Ramirez AP*,
Morales Flores EM*, Gomez Gomez
Y*, Organista Nava J**, Hernandez
Morales JR*, Estrada Brito JS***,
Villanueva Flores F***, Ibarra Sierra
E*, Diaz Gonzalez SDM*, Jimenez
Lopez MA*, Reyes Navarrete S*,
Garzon Barrientos VH*.
* Instituto Estatal De Cancerología
Dr Arturo Beltrán Ortega. ** Doctorado en Ciencias Biomédicas,
UNAM. *** Facultad de Ingeniería
Bioquímica, Instituto Tecnológico
de Acapulco.
monisaav2003@yahoo.com.mx
INTRODUCCIÓN. El banco de
sangre del Instituto Estatal de
Cancerología “Dr Arturo Beltrán
Ortega” (IECAN) se mantuvo bajo
condiciones adversas hasta el año
2012 cuando la contratación de
más personal permitió la captación
y el fraccionamiento de un mayor
número de unidades. La disponibilidad de hemocomponentes de
manera oportuna favorece y da un
mejor soporte a la quimioterapia,
por lo que quisimos evaluar si estos
cambios en la obtención y accesibilidad a hemocomponentes tuvieron
un impacto sobre la sobrevida de
los pacientes con LA infantil.
OBJETIVO. Determinar si el
número de transfusiones tienen
impacto en la sobrevida de los
pacientes con LA infantil.
M AT E R I A L Y M É TO D O S .
Estudio de tipo observacional, des-
S188
criptivo y longitudinal, realizado
de Enero de 2010 a Diciembre de
2012 en el IECAN de Acapulco,
Guerrero, México. Se consultaron
los expedientes clínicos de 69
pacientes con diagnóstico de LA.
El tipo de LA se determinó por criterios morfológicos y de Citometría
de flujo . La clasificación del riesgo
por edad fue en riesgo estándar (RE)
1 a 10 años y riesgo alto (RA) <1 y
>10. La recaída se definió como
la presencia de >20% de blastos
en la médula ósea o presencia de
infiltrados leucémicos en cualquier
sitio después de la quimioterapia de
inducción. Se utilizó el programa
SPSS v.16 para realizar un análisis
descriptivo y la sobrevivencia total
por diferentes variables mediante el
método de Kaplan Meier
RESULTADOS. Se revisaron los
expedientes clínicos de los pacientes
que ingresaron en el 2010, 2011 y
2012, siendo un total de 69 , de
ellos 60 (85.7%) presentaron LLA y 9
(12.9%) presentaron LAM, los leucocitos al diagnóstico fueron de 8,050
(3,850-42,975) para la LLA y de
10,200 (5,000- 63,600) para la LAM
, 28 fueron niñas y 41 fueron niños
, la edad promedio fue de 5 años
(2.8-11.2) para LLA y de 8(4.0-11.0)
para LAM, 56.7% de los pacientes
con LLA fueron de riesgo estándar y
el 26% fue de riesgo alto. El análisis
de Kaplan-Meier mostró mayor sobrevida en aquellos pacientes con
LLA (Log-Rank p=0.035), edad entre
1-10 años (Log-Rank p=0.049), sin
recaida durante su tratamiento (LogRank p=0.034), que recibieron más
de 19 transfusiones (percentil 80)
(Log-Rank p=0.019). No encontramos asociación significativa entre
sexo y sobrevida de los pacientes
(Log-Rank p=0.89) . Observamos
mayor sobrevida en el año 2012
que en el 2011 (Log-Rank p=0.157)
CONCLUSIONES. Estos datos
sugieren un papel muy importante
de la edad, la recaída y las transfusiones recibidas.
A1196
CLASIFICACIÓN SANGUÍNEA EN
PREDONANTES Y DONANTES EN
LA UNIDAD MÉDICA DE ALTA
ESPECIALIDAD UMAE CLÍNICA 21
DEL IMSS: ¿QUÉ TAN FRECUENTES SON LOS DONADORES RH
NEGATIVO?
Cuervo Sierra J*, Cobos Ayala C**,
Domínguez Aguirre A**.
* Universidad Autónoma De Nuevo
Leon. Servicio De Hematología.
Hospital “Dr Jose E Gonzalez”.
** Laboratorio y Banco de Sangre,
Unidad Médica de Alta Especialidad UMAE Clínica 21 del Instituto
Mexicano del Seguro Social, Monterrey-México.
plus1996@gmail.com
INTRODUCCIÓN. Los grupos sanguíneos Rh negativo representan
un porcentaje bajo en la población
(<5-10%) y adquieren relevancia
en embarazadas Rh negativo que
requieren trasfusiones o en pacientes Rh negativo sensibilizados.
Obtener donadores Rh negativo
constituye un problema importante. En Latinoamérica existen pocos
datos de la prevalencia de dichos
donadores.
OBJETIVO. Describir los grupos sanguíneos ABO y Rh entre
predonantes y donantes en un
banco de sangre del Instituto
Mexicano del Seguro Social (IMSS)
Monterrey. Determinar la frecuencia de grupos sanguíneos Rh
negativos entre predonantes y donantes. Determinar cómo se afecta
la disponibilidad de donadores
Rh negativos entre predonantes y
donantes efectivos
MATERIAL Y MÉTODOS. Estudio descriptivo, retrospectivo. Se
incluyeron pacientes entre 18-65
años que asistieron a donar entre
el 2008 y 2013. Se realizó una
evaluación médica y la encuesta
para donantes del Centro Nacional
de la Trasfusión Sanguínea. Se recolectaron datos demográficos, grupo
Libro Educativo 55 Congreso Nacional de la Agrupación Mexicana para el Estudio de la Hematología, A.C.
sanguíneo ABO y Rh. Se utilizó
estadística descriptiva.
RESULTADOS. Total de predonantes evaluados: 50423. Total
donantes: 48047, edad mediana
43.48 años. Los grupos sanguíneos
ABO y Rh de la población total se
ilustran en la tabla 1. La prevalencia de donadores Rh negativo fue
del 5.37%. Del total de donantes
Rh negativo el 83% eran hombres
y 17% mujeres, 62.9% pertenecían al grupo O, 27.3% grupo A,
8.8% grupo B y el 1% grupo AB.
La edad mediana de los donantes
Rh negativo fue de 38.52 años. Los
grupos sanguíneos ABO entre predonantes y donantes Rh negativos
no se afectaron por el proceso de
selecció : 25.6 %, 7.8%, 1.1% y
65.5% en predonantes vs 26.3 %,
5.1%, 1.2% y 67.4 % en donantes para los grupos A, B , AB y O
respectivamente . La mediana de
edad entre predonantes/donadores fue de 35.6, 37.1 , 35 y 46.4
años para los grupos O, A, B y AB
negativo respectivamente. Las principales causas de rechazo de los
predonantes fueron: hemoglobina/
hematocrito bajo (8.2%) , leucocitos elevados (11.4%), Hipertensión
arterial no controlada (5%) y leucocitos bajos (3.4%). De los donantes
se excluyeron a 203: autoexclusión
(58.6 %), nerviosismo (7%), venas
difíciles (6%).
CONCLUSIONES. Los porcentajes de donantes Rh negativo
conservan el patrón de distribución
normal observado en el mundo. El
proceso de selección de predonantes
no altera la cantidad de donantes
efectivos del grupo Rh negativo. Es
fundamental crear conciencia de la
práctica de donación, especialmente
en aquellos con grupos sanguíneos
poco frecuentes y Rh negativo.
SINDROMES MIELODISPLÁSICOS Y NEOPLASIAS MIELOPROLIFERATIVAS
PRESENTACIÓN ORAL
A1084
REGISTRO MEXICANO DE ENFERMEDADES HEMATOLÓGICAS
(REMEDEH): UN ESTUDIO MULTICÉNTRICO DE CASOS CON
SÍNDROMES MIELODISPLÁSICOS
(SMD) EN ADULTOS
Rodriguez González MG*, Montaño Figueroa E**, Hernández Perez
CR***, Martínez Ibarra Y*, Zamora
Pérez E****, Ramos Peñafiel CO**,
Meillón García LA***, Xolotl Castillo M*, Neme Yunes Y*****, Crespo
Solis E****, López Karpovitch X****.
* CMN La Raza, IMSS. ** Hospital
General de México. *** CMN Siglo
XXI, IMSS. **** Instituto Nacional
de Ciencias Médicas y Nutrición SZ.
***** Centro Médico ABC.
INTRODUCCIÓN. En México
se carece de información amplia
de los SMD. El REMEDEH es una
plataforma desarrollada por socios
de la AMEH AC que se creó para
el registro en línea de enfermedades hematológicas iniciando
con SMD.
OBJETIVO. Registrar variables
demográficas, de laboratorio y
taxonómicas de pacientes adultos
con SMD.
MATERIAL Y MÉTODOS. En
2012 se inició el proyecto REMEDEH para SMD que incluyó casos
confirmados según los criterios
OMS-2008 y se convino usar las
clasificaciones de riesgo IPSSR y
WPSS.
R E S U LTA D O S . E n t r e e l
25/10/2012 y el 17/12/2013 cuatro hospitales de tercer nivel de la
Ciudad de México registraron 329
casos, de los cuales 40 % fueron
hombres y 60% mujeres (relación
H/M 1:1.5). La información mostrada en la tabla se recopiló al
diagnóstico. Sólo el 36% presentó macrocitosis. Se identificaron
comorbilidades en el 63% de los
pacientes y de éstos, el 32% tuvo
2 o más.
CONCLUSIONES. En el presente registro se encontraron
diferencias importantes comparado
con lo publicado en series extranjeras en las siguientes variables:
mayor: proporción de mujeres, de
individuos menores de 60 años,
de trombocitopenia grave, SMD
hipoplásicos, CRDM, y riesgo bajo
según WPSS. Este es el primer estudio multicéntrico mexicano de
SMD y el tercero más grande en
Latinoamérica.
S189
Volumen 15, Suplemento 1, 2014
Revista de Hematología
Variable
N
%
Variable
N
%
Variable
N
%
Edad años
<40
41 a 60
61 a 80
>80
Tipo
Primario
Secundario
Hb g/L
<8
Neu Abs mL
<800
Plaq 109/L
<50
Ferritina
>1000ng/mL
Cariotipo
Muy bajo
Bajo
Intermedio
Alto
Muy alto
329
40
98
160
31
326
316
10
325
92
324
65
325
130
115
33
319
7
241
44
12
15
100
12.1
29.8
48.6
9.4
99.1
96.9
3.1
98.8
28.3
98.5
20.1
98.8
40
34.9
28.7
97
2.2
75.5
13.8
3.8
4.7
Celularidad
<20 %
Mielofibrosis
Grado 0
Grado 1
Grado 2
Grado 3
ECOG
0
1
2
3-4
Comorbilidad
Ninguna
Una
Dos
Tres
Cuatro
HAS
DM
Dislipidemia
Cardiopatía
267
83
186
128
38
17
3
326
166
104
53
3
329
121
140
48
15
5
62
53
28
15
81.1
31.1
56.5
68.8
20.4
9.1
1.6
99.1
50.9
31.9
16.3
0.9
100
36.8
42.5
14.6
4.6
1.5
15
13
7
4
OMS
CRDU
ARSA
CRDM
AREB-1
AREB-2
5q del
Inclasificable
IPSS-R
Muy bajo
Bajo
Intermedio
Alto
Muy alto
WPSS
Muy bajo
Bajo
Intermedio
Alto
Muy alto
307
37
3
195
36
16
5
15
307
64
109
84
34
16
307
24
154
75
45
9
93.3
12
1
63.5
11.7
5.2
1.6
4.9
93.3
20.8
35.3
27.4
11.1
5.2
93.3
7.8
50.2
24.4
14.7
2.9
PRESENTACIÓN CARTEL
A1129
PRINCIPALES CARACTERÍSTICAS
CLÍNICAS Y MOLECULARES AL
MOMENTO DEL DIAGNÓSTICO
EN PACIENTES PORTADORES DE
MIELOFIBROSIS PRIMARIA (MFP).
EXPERIENCIA EN EL HOSPITAL
GENERAL DE MÉXICO
García Castillo JA*, Ramos Peñafiel
C*, Gallardo Trillanes E*, Olarte
Carrillo I*, Mendoza Garcia E**,
Kassack Ipiña JJ*.
* Hospital General De México. **
Laboratorio de Estudios Especiales,
Hospital General de México.
betoegroj@hotmail.com
INTRODUCCIÓN. La MFP es una
neoplasia mieloproliferativa crónica poco frecuente. A pesar de
la baja expresión de JAK2V617F
la eficacia del uso de inhibidores
ha sido eficaz impactando con la
calidad de vida y la supervivencia.
De forma clásica la descripción
S190
clínica es con esplenomegalia
e imagen leucoeritroblástica en
sangre periférica, desafortunadamente la presentación clínica
clásica es de alrededor del 60%
comprometiendo la sospecha
diagnóstica y retrasando el inicio
del tratamiento.
OBJETIVO. Establecer las principales características clínicas y
moleculares al momento de diagnóstico en pacientes portadores
de MFP y MF secundaria a PV y TE
MATERIAL Y MÉTODOS. Estudio retrospectivo, observacional,
analítico basándose en los registros
médicos de pacientes con diagnóstico de MFP diagnosticados
durante el 2013. Para las pruebas
de contraste de hipótesis se utilizó
test ji-cuadrada., Regresión lineal
para establecer la R2 entre tamaño
de bazo y cifra de leucocitos. La
diferencia de medias se estableció
por U-Mann Whitney.
RESULTADOS. Se estudiaron 12
pacientes, el 58.3% (n=7) correspondieron al género masculino,
la media de leucocitos fue 20.9 x
103/mcL (rango 1.68-71.45 x 103/
uL), la media de edad fue 53 años
(rango 24-74 años) y de bazo 9.9cm
(0-20 cm). El 75% correspondieron
a riesgo alto (n=9), intermedio 1 en
un 16.7% (n=2) y 8.3% riesgo bajo
(n=1). El un 25% (n=3) los pacientes fueron esplenectomizados, en
cuanto al tratamiento de soporte
la hydrea (n=4) fue el tratamiento
más utilizado (33%), andrógenos en
un 25% y talidomida en un 16.7%
(n=2). En un 25% (n=3) requerían
soporte transfusional de manera
continua. En un 41.7% (n=5) se
detectó la mutación JAK2V617F.
No se encontraron diferencias significativas en cuanto a la cifra de
leucocitos y tamaño de bazo acorde p=0.343, p=0.202,95% IC. Al
realizar el análisis de correlación,
Libro Educativo 55 Congreso Nacional de la Agrupación Mexicana para el Estudio de la Hematología, A.C.
la R2 de la cifra de leucocitos y
tamaño de bazo fue de 0.086, sin
ser significativa la correlación de
Pearson (p=0.355,95% IC) Tampoco
se apreciaron diferencias en cuanto
a la cifra de leucocitos (p=0.202),
tamaño de bazo (p=0.343) o edad
(p=0.343) acorde al status de la
mutación JAKV617F. En cuanto a
la presentación los datos clínicos
clásicos solo se registraron en un
50% de los casos, en 25% contaban
con hematopoyesis extramedular
en hígado, pleura y mediastino
generando principalmente la sintomatología.
CONCLUSIONES. La MFP
cuenta con un amplio espectro
clínico. La mutación JAKV617F se
encontró presente en 50%. Tanto la
edad como el status de la mutación
no son significativos para el crecimiento esplénico como la cifra de
leucocitos.
A1191
ESTUDIO CITOGENÉTICO COMO
FACTOR PRONÓSTICO EN LA
SUPERVIVENCIA GLOBAL EN
UNA POBLACIÓN DE PACIENTES MEXICANOS ADULTOS CON
SÍNDROMES MIELODISPLÁSICOS
(SMD)
Rodriguez González MG*, Martínez Ibarra Y*, Xolotl Castillo M*,
Robledo Pascual J**, Vela Ojeda J*.
* CMN La Raza, IMSS. ** Dr. Juan
Graham Casasús SSA3.
lurodis10@hotmail.com
INTRODUCCIÓN. Los SMD son
un grupo heterogéneo de enfer-
medades clonales, con riesgo de
evolucionar a leucemia mieloide
aguda (LMA). Actualmente no existe
registro o epidemiología de SMD en
México, por lo que en este estudio
se evalúa clínica, alteraciones citogenéticas y supervivencia.
OBJETIVO. Evaluar las características epidemiológicas y hallazgos
citogenéticos de los SMD en una
población mexicana estableciendo
su asociación con la supervivencia
global (SG).
MATERIAL Y MÉTODOS. Estudio realizado en Hematología del
Hospital de Especialidades Centro
Médico Nacional La Raza del 2005
a 2013. Criterios de inclusión:
casos confirmados de SMD en pacientes > 16 años, ambos géneros,
diagnóstico de novo con estudio
citogenético. Estadística descriptiva,
análisis multivariado con regresión
logística; curvas de Kaplan-Meier
para supervivencia.
RESULTADOS. Se incluyeron
92 pacientes con SMD, 44 (47.8%)
hombres y 48 (52.2%) mujeres. La
mediana de edad fue 56 ± 18 años.
Con base a la clasificación OMS:
66% CRDM, 9 .8% hipoplásico,
7.6% AREB-2, 7.6% AREB-1, 3.3%
AR, 3.3% ARSA y 1% Del 5q. El
estudio citogenético fue normal en
72 (78.3%) pacientes y 20 (21.7%)
estudio anormal. Alteraciones: 5
(25%) cariotipo complejo, 3 (15%)
tuvieron –Y, 2 (10%) hipodiploidias, 2 (10%) del9, 1 (5%) del7, 1
(5%) +9, 1 (5%) t1:5, 1 (5%) 17p-,
1 (5%) del 21, 1 (5%) +19, 1 (5%)
del 5q y 1(5%) +8. El riesgo citoge-
nético según IPSS fue: 77 (83.7%)
bueno, 8 (8.7%) intermedio y 7
(7.6%) riesgo pobre. Estratificación
IPSS: riesgo bajo 33(35.9%), intermedio-1 39(53.3%), intermedio-2
5(5.4%), alto 5(5.4%). Mediana
de SG: 85 meses, mediana de seguimiento 35 meses (2–96 meses).
La mediana de supervivencia por
riesgo citogenético fue: bueno 82.7
meses (IC 95%) (75 - 90), intermedio 73.6 meses (IC 95%) (49 - 98)
y riesgo pobre 46.8 meses (IC 95%)
(18 -11). La progresión a LMA se
presento en 10 pacientes (10%), 5
tenían cariotipo de riesgo bueno
y 5 riesgo pobre. La mediana de
supervivencia libre de progresión
a LMA fue de 18.7 meses (IC 95%)
(4.1-33.2). El estudio citogenético
está estadísticamente asociado
con mortalidad (P 0.006). Existe
una asociación independiente
de citogenética de riesgo bueno
contra mortalidad (OR 0.141, IC
95%) (0.042-0.47) esto le confiere
un factor de protección 86% para
supervivencia.
Regresión logística: el estudio
citogenético está asociado con
mortalidad (OR 2.61, IC 95%)
(1.42-4.79) es decir 161% de riesgo
de mortalidad si se estadifica riesgo
citogenético en bueno y pobre.
CONCLUSIONES. En población mexicana, las alteraciones
citogenéticas difieren en relación
a la literatura, solo un 21.7% tuvo
estudio citogenético anormal. Es
vital realizar la citogenética ya que
confirma su importancia pronostica
en la supervivencia global.
TRASPLANTE DE CÉLULAS PROGENITORAS HEMATOPOYÉTICAS
PRESENTACIÓN ORAL
A1010
TRASPLANTE AUTOLOGO EN
L E U C E M I A L I N F O B L A S T I CA
AGUDA CON RECAIDA AISLADA A SISTEMA NERVIOSO
CENTRAL
Pérez Lozano U*, Juárez Lara J*,
Ruiz Ovalle JL**, Limón Flores JA*,
Lobato Tolama RD*.
S191
Volumen 15, Suplemento 1, 2014
Revista de Hematología
*IMSS Hospital De Especialidades
De Puebla UMAE. **Unidad de
Oncología SSA Puebla.
dra_uendy@yahoo.com.mx
INTRODUCCIÓN. Los pacientes
con leucemia linfoblástica aguda
con recaída aislada a sistema nervioso central tienen indicación de
recibir tratamiento con trasplante de
médula ósea alogénico, sin embargo, menos del 30% de los pacientes
tienen un donador compatible.
La quimioterapia con dosis altas
seguidas de trasplante autólogo
no ha sido considerada como una
opción terapéutica en la literatura
internacional.
OBJETIVO. Determinar la sobrevida global de los pacientes
con leucemia linfoblástica aguda
y recaída aislada a sistema nervioso central en segunda remisión
completa consolidados con autotrasplante hematopoyético
MATERIAL Y MÉTODOS. De
370 sometidos a trasplante hematopoyético de 1995 a 2013
se seleccionaron a los pacientes
con leucemia linfoblástica aguda
en segunda remisión de sistema
nervioso central (SNC) y primera
remisión medular consolidados
con quimioterapia con potencial
de penetración a SNC y rescate
celular con células tallo periféricas
autólogas almacenadas por cinco
días sin criopreservación. Que
hubieran recibido irradiación a neuroeje y cráneo previa al trasplante,
con enfermedad mínima residual
indetectable por citometría de flujo.
Recibiendo el mismo esquema de
acondicionamiento: Citarabina 10
gr/m2 dividido en 4 dosis, Etopósido 800 mg/m2 diarios x 3 días,
Ciclofosfamida 120 mg/kg dividido
en dos días.
RESULTADOS. Diez pacientes
cumplieron los criterios de selección, con edades de 3 a 18 años
con una media de 10 años. El
rango de leucocitos al diagnóstico
S192
fue de 200 a 130 000/µl, con una
media de 24,670/µl. El tiempo del
diagnóstico al trasplante fue de 9 a
81 meses, con una media de 29.7
meses. El rango de recuperación
neutrofílica fue de 11 a 48 días con
una media de 17.5 meses, tuvieron
41 días de hospitalización (20 a 93
días). La tasa de recaída medular
fue de 30%, la causa de muerte fue
recaída medular en 3 casos e infección pulmonar 1 caso. La sobrevida
global fue de 60%, con una media
de sobrevida 17 meses, la media de
seguimiento 31 meses.
CONCLUSIONES. El trasplante
autólogo mieloablativo puede ser
una opción terapéutica, después
de una segunda remisión a SNC,
siempre que se conserve la primera
remisión medular ante carencia de
donador HLA compatible.
A1054
MEDICIÓN DE LOS NIVELES
SÉRICOS DE CICLOSPORINA A
EN NIÑOS SOMETIDOS A UN
TRASPLANTE DE CÉLULAS HEMATOPOYÉTICAS DONDE LAS
MUESTRAS SE OBTIENEN DE TRES
DIFERENTES SITIOS DE MANERA
SIMULTÁNEA
Gamboa Alonso CM*, González
Llano O*, Mancías Guerra C*, Ríos
Solís JE*, Gutiérrez Aguirre CH*,
Cantú Rodríguez OG*, Villarreal
Martínez L*, Gómez De León A*,
Gómez Almaguer D*.
* Servicio De Hematología, Medicina Interna, Hospital Universitario
“Dr. José Eleuterio González” Facultad De Medicina Universidad
Autónoma De Nuevo León, Monterrey, México.
magdis_gam@hotmail.com
INTRODUCCIÓN. La ciclosporina
A (CA) es un agente inmunosupresor
ampliamente utilizado en el área de
los trasplantes para la prevención
de la enfermedad de injerto contra
huésped (EICH). La medición de
los niveles séricos de CA se realiza
utilizando sangre venosa periférica,
sin embargo se ha considerado la
posibilidad de obtener la muestra
mediante punciones capilares y
catéteres venosos.
OBJETIVO. Comparar los resultados de los niveles séricos de CA,
obteniendo las muestras sanguíneas
de tres diferentes sitios.
MATERIAL Y MÉTODOS. Las
muestras se obtuvieron de manera
simultánea por punción venosa,
punción capilar y por medio de
aspiración de catéter en un grupo
de doce pacientes menores de 18
años de edad en quienes se llevó
a cabo un trasplante de células
hematopoyéticas (TCH) que incluía
CA como prevención para la EICH.
Todos los pacientes recibieron desde el día previo a la infusión de las
células hematopoyéticas CA entre
3 y 5 mg /Kg cada 12 horas por vía
oral. La medición de la CA se llevó a
cabo por medio de inmunoanálisis
quimioluminiscente de micropartículas (CMIA), utilizando el método
ARCHITECT. El análisis estadístico
se realizó con el programa SPSS,
utilizando la prueba T de student y
la correlación de Pearson.
RESULTADOS. Se recolectaron
78 muestras sanguíneas, 26 de
catéter, 26 de punción capilar y
26 de punción venosa en los 12
pacientes. La mediana de edad fue
de 9 años (rango 2- 14). Diez de
los doce pacientes tenían como
diagnóstico LLA. Nueve de los TCH
fueron haploidénticos y tres de donador familiar idéntico. La primera
medición del nivel de CA se realizó
en el días +1 del TCH, donde se
obtuvieron las muestras de los tres
sitios de recolección, la segunda y
tercera determinación se tomaron
en diferentes días de acuerdo a
las características del paciente. En
la segunda muestra se incluyeron
9 pacientes y en la tercera cinco;
ya que para ese día del trasplante
algunos pacientes ya no contaban
con el catéter o no aceptaron ser
Libro Educativo 55 Congreso Nacional de la Agrupación Mexicana para el Estudio de la Hematología, A.C.
puncionados nuevamente. No se
encontró en nuestros pacientes
diferencias estadísticamente significativas cuando se compararon los
tres diferentes sitios de obtención de
la muestras.
CONCLUSIONES. En nuestro
grupo de pacientes no se encontró
diferencia en los niveles de CA independientemente del sitio de donde
se obtuvo la muestra, parecería
razonable entonces que la muestra
pudiera ser elegida de acuerdo a
las circunstancias de cada enfermo. Son necesarios más estudios
similares para corroborar nuestros
resultados.
A1116
¿ES LA IRRADIACIÓN DE HEMOCOMPONENTES INDISPENSABLE
EN UN TRASPLANTE DE PROGENITORES HEMATOPOYÉTICOS
DESPUÉS DE UN RÉGIMEN DE
INTENSIDAD REDUCIDA?
Jaime Pérez JC*, Villarreal Villarreal
CD*, Salazar Riojas R*, Méndez
Ramírez N*, Garza Vázquez E*,
Gómez Almaguer D*.
* Servicio De Hematología, Medicina Interna, Hospital Universitario
“Dr. José Eleuterio González”. Facultad De Medicina Universidad
Autónoma De Nuevo León, Monterrey, México..
carjaime@hotmail.com
INTRODUCCIÓN. El uso de hemocomponentes irradiados para
la prevención de la enfermedad
injerto contra huésped asociada a la
transfusión (EICH-AT) es un estándar
en pacientes trasplantados con progenitores hematopoyéticos (TPH).
OBJETIVO. Comparar los resultados después de condicionamiento
de intensidad reducida (RIC) en
pacientes con TPH que recibieron
hemocomponentes irradiados contra los que recibieron productos
sanguíneos no irradiados.
MATERIAL Y MÉTODOS. Se
realizó un estudio retrospectivo
incluyendo 173 pacientes a quienes
se les realizo un TPH después de un
RIC y que recibieron transfusiones
del 2005 al 2013. Los pacientes
fueron divididos en 2 grupos, 73
que recibieron hemocomponentes
irradiados y 100 que recibieron productos no irradiados. Se evaluaron
las diferencias en el curso de su
enfermedad, incidencia de EICH y
comorbilidades.
RESULTADOS. No se documentó ningún caso de EICH-AT. Setenta
y cuatro pacientes en todo el grupo
(42.4%) presentaron EICH, de los
cuales 37 (50%) recibieron productos irradiados contra 37 (50%)
que recibieron hemocomponentes
no irradiados, p=0.089. Sesenta y
uno (35.2%) desarrollaron EICH
aguda, 28 (45.9%) recibieron productos irradiados y 33 (54.1%) no
irradiados, p=0.549. Treinta y siete
pacientes en todo el grupo (21.4%)
desarrollaron EICH crónica, 19
(51.4%) fueron transfundidos con
hemocomponentes irradiados,
y 18 (48.6%) con productos no
irradiados, p= 0.322 En cuanto a comorbilidades, 44 pacientes (25.4%)
presentaron fiebre y neutropenia,
de los cuales 14 (31.8%) recibieron
hemocomponentes irradiados y 30
(68.2%) no irradiados, p =0.115.
Cuarenta y ocho pacientes (27.7%)
presentaron infección, 16 (33.3%)
fueron irradiados y 32 (66.7%) en el
grupo de no irradiados, p = 0.170.
Cuarenta y seis pacientes (26.6%)
tuvieron mucositis, 18 (39.1%)
recibieron productos irradiados, y
28(60.9%) productos no irradiados,
p= 0728. La sobrevida libre de
evento para EICH a un año fue de
43.1% (95% IC;55.7-30.3) para los
que recibieron hemocomponentes
irradiados contra 51.7% (95%
IC;64-39.4) en los transfundidos
con productos sanguíneos no irradiados, p= 0.324.
CONCLUSIONES. No se presentó ningún caso de EICH-AT. Se
deben irradiar los productos san-
guíneos en receptores de un TPH
condicionados con un RIC, pero la
falta de un irradiador no debe evitar
dicho procedimiento en países en
desarrollo.
A1190
MÉDULA ÓSEA ESTIMULADA
(MOE) COMO FUENTE DE PROGENITORES HEMATOPOYÉTICOS
(PH) EN TRASPLANTE ALOGÉNICO
PARA ENFERMEDADES HEMATOLÓGICAS MALIGNAS Y NO
MALIGNAS
León Rodríguez E*, Guzmán Uribe
P*, Deffis Court M*, Pérez Álvarez
SI*, Rivera Franco M*.
* Instituto Nacional De Ciencias
Médicas Y Nutrición Salvador Zubirán.
eucarios@hotmail.com
INTRODUCCIÓN. La principal
fuente de PH en todo el mundo es la
sangre periférica (SP). Sin embargo,
su uso se ha asociado a una mayor
incidencia de enfermedad injerto
contra huésped (EICH) cuando se
compara con el uso de médula
ósea (MO). El uso de médula ósea
estimulada como fuente de progenitores hematopoyéticos (PH) ha
mostrado eliminar la ventaja de
los PH obtenidos de SP en relación
al tiempo para injertar, además de
asociarse con una reducción en la
incidencia de EICH.
OBJETIVO. Describir los resultados de los trasplantes alogénicos
realizados con MOE en el INCMNSZ de Noviembre de 1998 a Marzo
de 2013.
MATERIAL Y MÉTODOS. Se
realizó un análisis prospectivo de
los pacientes sometidos a TPH en
el INCMNSZ, usando MOE como
fuente de PH. Se describen las características clínicas, frecuencia de
EICH y la supervivencia, utilizando
el paquete estadístico SPSS v21.0.
RESULTADOS. Se incluyeron
49 pacientes trasplantados usando
MOE como fuente de PH, de No-
S193
Volumen 15, Suplemento 1, 2014
Revista de Hematología
viembre de 1998 a Marzo de 2013.
Mediana de edad: 29 años (16-59),
31 (63%) eran hombres. Las indicaciones más frecuentes del TPH:
Anemia aplásica grave (AAG) en 15
pacientes (30.6%), Síndromes Mielodisplásicos (SMD) en 12 pacientes
(24.5%), Leucemia Mieloide Crónica (LMC) en 9 pacientes (18.4%),
Leucemia Linfoblástica Aguda (LLA)
en 7 pacientes (14.3%), Leucemia
Mieloide Aguda (LMA) en 3 pacientes (6.1%) y otros diagnósticos
en 3 pacientes (6.1%). La mediana
de días para lograr injerto de neu-
trófilos fue de 20 días (11-40), para
injerto de plaquetas fue de 15 días
(5-45). Se presentó EICH agudo en
4 pacientes (8.2%) de grado I y II
y EICH crónico en 14 pacientes
(28.6%). Se presentó recaída de la
enfermedad en 9 pacientes (18.4%),
todos con diagnóstico de LMC,
los cuales fueron rescatados con
infusión de linfocitos del donador.
Con un seguimiento de 43 meses (0149), la mediana de supervivencia
global aún no se alcanza; sin embargo, la supervivencia proyectada
a 10 años es de 69%.
CONCLUSIONES. El uso de
MOE es la mejor fuente de PH en
trasplante alogénico para enfermedades hematológicas malignas y no
malignas, ya que permite un tiempo
de injerto similar al obtenido con
PH de sangre periférica pero con
menor frecuencia y grado de la
EICH tanto aguda como crónica.
Sin embargo, esta estrategia parecería no ser una buena opción
para patologías en las que el injerto
contra enfermedad es esencial para
la erradicación de la neoplasia maligna, como es el caso de la LMC.
PRESENTACIÓN cartel
A1020
RECOLECCIÓN DE CÉLULAS
HEMATOPOYÉTICAS DE SANGRE
PERIFÉRICA EN PACIENTES PEDIÁTRICOS DE 20 KG O MENOS
PARA TRASPLANTE AUTÓLOGO
O ALOGÉNICO
Gutiérrez Aguirre CH*, García Lozano JA*, Salazar Riojas R*, Valdés
Galván M*, Cantú Rodríguez OG*,
González Llano O*, Gómez De
León A*, Gómez Almaguer D*.
* Servicio De Hematología Del
Hospital Universitario “Dr. José
Eleuterio González” U.A.N.L.
hematohu@yahoo.com
INTRODUCCIÓN. La recolección
por aféresis de células hematopoyéticas de sangre periférica (PBSC)
para trasplante autólogo o alogénico ha remplazando paulatinamente
al aspirado de médula ósea para la
obtención de las mismas. Un grupo
especial de donadores son aquellos con menos de 20 kg de peso
ya que por su pequeño volumen
sanguíneo tienen mayor riesgo de
complicaciones.
OBJETIVO. El objetivo de nuestro estudio fue evaluar la seguridad
y eficacia de la recolección por
S194
aféresis de PBSC en donadores con
menos de 20 kg de peso.
MATERIAL Y MÉTODOS. Se
revisaron retrospectivamente los
expedientes de donadores pediátricos de PBSC de 20 kg o menos.
La aféresis se realizó a través de
un catéter venoso central (CVC)
tipo Mahurkar colocado en sala de
fluoroscopía. Para evitar descompensación hemodinámica, se llenó
la máquina de aféresis con 285 ml
de concentrado eritrocitario del
mismo grupo ABO-RH, radiado y
depletado de leucocitos. Se utilizó
ACD-A y heparina de 1000 U como
anticoagulante en una relación
22:1. De forma profiláctica se
utilizó gluconato de calcio para
disminuir los efectos de la anticoagulación.
RESULTADOS. Se analizaron 22
recolecciones de PBSC en pacientes
pediátricos de 20 kg o menos; 14
para trasplante alogénico y 8 para
autólogo. Se requirió más de un procedimiento de aféresis para obtener
las células CD34+ deseadas en 3
(21.43%) recolecciones para alogénico y en 2 (25%) para autólogo.
La mediana de edad y peso fue de
3 años (rango 1-7) y 16 kg (12-20)
para el grupo de donadores alogénicos y de 3 años (2-7) y 15.5 kg
(8-20) para el grupo de autólogos.
La mediana del volumen sanguíneo
del donador, duración de la aféresis
y células CD34+ recolectadas por
kilo de peso del receptor en el grupo de donadores alogénicos fue de
1,073.50 ml (595.70-1,453), 194
min (135-305) y 5.79 x 106 (1.8129.56 x 106), mientras que en el
grupo de autólogos fue de 1412
ml (856-1670), 211 min (151-279)
y 11.84 x 106 (0.6 - 25.50 x 106)
respectivamente. No se observaron
eventos adversos serios. El efecto
adverso más común fue parestesia
relacionada al anticoagulante utilizado que desapareció al administrar
calcio. No se observaron complicaciones relacionadas con el CVC.
CONCLUSIONES. La recolección de PBSC por aféresis utilizando
un CVC es efectiva y segura en
donadores pediátricos de 20 kg o
menos para trasplante autólogo o
alogénico.
A1030
INMUNOFENOTIPO DE CÉLULAS
MESENQUIMALES DERIVADAS DE
TEJIDO DE CORDÓN Y PULPA
Libro Educativo 55 Congreso Nacional de la Agrupación Mexicana para el Estudio de la Hematología, A.C.
DENTAL, COMO CONTROL DE
CALIDAD DEL PROCESAMIENTO
EN BANCO DE CÓRDÓN UMBILICAL
Martínez De La Cruz B*, Sosa
Hernández A*, Silva Martinez J*,
Hernández Nevárez A*, Flores
Mejía P*, Rodríguez Vargas W*,
Kleiman Keller I*, Pier Gary D*,
Vázquez Meraz E**.
* Banco De Cordón Umbilical.
** Servicio de Banco de Sangre,
Hospital General de Ecatepec las
Americas.
drakbezt@hotmail.com
INTRODUCCIÓN. En la investigación sobre la caracterización de
células troncales mesenquimales,
se ha encontrado que hay cierta
discrepancia dependiendo del tipo
de tejido de donde se obtienen.
OBJETIVO. En este contexto, el
presente trabajo se pretende determinar si estas diferencias existen
entre células derivadas tejido de
cordón umbilical y pulpa dental.
MATERIAL Y MÉTODOS. Para
corroborar lo anterior, células
procesadas, cultivadas y criopreservadas en Banco de Cordón, de
muestras de tejido de cordón (n=10)
obtenidos de recién nacidos y pulpa
dental (n=10) de dientes temporales
de niños de entre 7 y 8 años, fueron
evaluadas bajo los siguientes parámetros: viabilidad por exclusión al
azul tripano, índice de proliferación
e inmunofenotipo por citometría
de flujo.
RESULTADOS. Nuestros resultados indican que las células
de los diferentes tejidos muestran
un patrón morfológico de células adherentes fusiformes tipo
fibroblasto. En cuanto al índice de
proliferación, existe un porcentaje
mayor para células aisladas de tejido de cordón umbilical, seguidas
de las obtenidas de pulpa dental.
Por otro lado, la viabilidad postdescongelación mostró una media
de 96.7% +/- 1% en las dos fuentes.
Interesantemente, las células de las
muestras evaluadas muestran una
mayor expresión a los marcadores
CD90 y CD73 seguidas del marcador CD105, y no expresan CD45
y CD34 marcadores para el linaje
hematopoyético, lo cual concuerda
con lo reportado en la literatura.
Todas las muestras resultaron negativas en estudios de seguridad
biológica tanto en microbiológica
y serología.
CONCLUSIONES. En conjunto,
los datos anteriores nos indican que
las células aisladas bajo nuestras
condiciones cumplen con 2 de las
3 características establecidas por
la Sociedad Internacional de Terapia Celular (ISCT), invitándonos a
continuar con un estudio posterior
que nos permita comprobar los
potenciales de diferenciación y sus
posibles similitudes o diferencias, lo
cual cumpliría con los controles de
calidad necesarios para un posible
uso terapéutico.
A1050
FLUDARABINA ORAL VERSUS
INTRAVENOSA COMO PARTE
DEL ACONDICIONAMIENTO DE
INTENSIDAD REDUCIDA PARA
TRASPLANTE DE CÉLULAS HEMATOPOYÉTICAS ALOGÉNICAS
Gonzalez Ramírez MP*, Martagón
Herrera NA*, Hernández Reyes J*,
Velázquez Sánchez De Cima S*,
Zamora Ortiz G*, Rosales Durón
AD*, Ruiz Delgado GJ*, Ruiz Argüelles GJ*.
* Centro De Hematología Y Medicina Interna, Clínica Ruiz Puebla.
glez_monica2@hotmail.com
INTRODUCCIÓN. En el 2003,
la fludarabina oral se introdujo
en Estados Unidos para pacientes
con enfermedades malignas hematológicas como alternativa de su
formula intravenosa (i.v.); en el año
2008, fue introducida a México, y
el medicamento en forma i.v. fue
retirado del mercado. La fludara-
bina i.v. tuvo que ser reemplazada
por la fludarabina oral como parte
del régimen de acondicionamiento
de intensidad reducida en trasplante
alogénico de células hematopoyéticas en México.
OBJETIVO. Comparar a los pacientes quienes fueron preparados
con fludarabina oral y los pacientes
preparados con fludarabina i.v.
MATERIAL Y MÉTODOS. Estudio
no aleatorio, retrospectivo donde se
incluyeron 55 pacientes quienes
recibieron acondicionamiento
oral con fludarabina comparado
con otro grupo de 113 pacientes
quienes recibieron acondicionamiento con fludarabina i.v. También
se incluyeron en el régimen de
acondicionamiento, busulfán oral
y ciclofosfamida i.v. Los donadores
fueron hermanos HLA idénticos en
todos los casos.
RESULTADOS. Se compararon
ambos grupos. No hubo diferencias
estadistas en tiempo de recuperación de neutrófilos, tiempo de
recuperación de plaquetas, ocurrencia de enfermedad de injerto contra
huésped aguda, recaída o mortalidad al día 100. La supervivencia de
los pacientes acondicionados con
fludarabina oral fue mejor que la de
los pacientes acondicionados con
fludarabina i.v.; 62% y 33% a los 67
meses respectivamente (p=0.0006).
CONCLUSIONES. La fludarabina oral puede reemplazar la fórmula
i.v. como parte del régimen del
acondicionamiento de intensidad
reducida sin repercusiones tempranas en los pacientes trasplantados.
A1051
LOS PACIENTES SOMETIDOS A
TRASPLANTES DE CÉLULAS HEMATOPOYÉTICAS ALOGÉNICAS
CON ESQUEMA DE INTENSIDAD
REDUCIDA TIENEN UN MEJOR
COMPONENTE MENTAL EN CALIDAD DE VIDA RELACIONADA
CON LA SALUD QUE UN GRUPO
CONTROL
S195
Volumen 15, Suplemento 1, 2014
Revista de Hematología
Gonzalez Ramírez MP*, Martagón
Herrera NA*, Hernández Reyes J*,
Gómez De León A**, Lagunes Miravete K*, Tenorio Rojo AP*, Gomez
Almaguer D**, Ruiz Delgado GJ*,
Ruiz Argüelles GJ*.
* Centro De Hematología Y Medicina Interna, Clínica Ruiz Puebla.
** Hospital Universitario de Nuevo
León.
glez_monica2@hotmail.com
INTRODUCCIÓN. Actualmente
no se conoce con detalle la calidad
de vida relacionada con la salud
(CVRS) en pacientes sometidos a
trasplantes de células hematopoyéticas (TCH).
OBJETIVO. Estudiar la CVRS
de los pacientes con leucemia
quienes fueron tratados con TCH
empleando un esquema de acondicionamiento de intensidad reducida
en dos instituciones de salud.
MATERIAL Y MÉTODOS. Se
analizaron 35 pacientes entre 18 y
62 años de edad con diagnóstico de
leucemia aguda y crónica quienes
fueron sometidos a TCH alogénicas.
Al mismo tiempo, se estudió un
grupo control de 35 sujetos sanos
apareados por sexo y edad. A los 70
individuos se les aplicó la encuesta
SF 36 V.2 que está integrada por
ocho módulos. Se compararon las
puntuaciones obtenidas en los dos
grupos de personas.
RESULTADOS. Se encontró
que el grupo control tuvo mejor
calidad de vida en los siguientes
módulos: Función física con una
calidad de 93 (p=0.259), rol físico
de 91 (p=0.441), función social
80 (p=0.144) y dolor corporal
82 (p=0.338). Los pacientes leucémicos trasplantados tuvieron
mejor CVRS en los módulos correspondientes a salud general 71
(p=0.473), vitalidad 73 (p=0.469),
y salud mental 82 (p=0.458). Ambos grupos tuvieron los mismos
resultados para rol emocional 86
(p=1.00). Los pacientes sometidos
S196
a TCH obtuvieron una mejor CVRS
resumida en el componente mental
(que incluye salud mental, rol emocional, función social y vitalidad)
que el grupo control.
CONCLUSIONES. Los pacientes leucémicos trasplantados con
esquemas de intensidad reducida
tienen algunos aspectos de CVRS
mejores que los del grupo control.
Es posible que esto se deba a que
existen grandes cambios en la vida
de una persona cuando es diagnosticada con un padecimiento que
sin tratamiento puede ser mortal.
Se requieren más estudios para
corroborar estos datos.
A1052
EL GÉNERO COMO FACTOR PRONÓSTICO DE LA SUPERVIVENCIA
POSTRASPLANTE DE CÉLULAS
HEMATOPOYÉTICAS TOTIPOTENCIALES: EXPERIENCIA EN UNA
SOLA INSTITUCIÓN
Gonzalez Ramírez MP*, Martagón
Herrera NA*, Hernández Reyes J*,
Zamora Ortiz G*, Morales Floranes
R*, Velázquez Sánchez De Cima S*,
García Villaseñor A**, Ruiz Delgado
GJ*, Ruiz Argüelles GJ*,
* Centro De Hematología Y Medicina Interna, Clínica Ruiz Puebla. **
Universidad de las Américas Puebla.
glez_monica2@hotmail.com
INTRODUCCIÓN. Se han estudiado diversas variables que
influyen en el pronóstico de los
pacientes portadores de trasplante
de células hematopoyéticas (TCH),
entre ellos padecimiento de base,
cantidad de células CD34, edad y
sexo; respecto al último, existen
discrepancias en los resultados de
diversos estudios.
OBJETIVO. Determinar el papel
del género como factor pronóstico
en la supervivencia post TCH.
MATERIAL Y MÉTODOS. En este
estudio, que incluyó trasplantes autólogos y alogénicos, sin diferencia
de edad ni padecimiento de base,
no hubo diferencia estadísticamente
significativa en cuanto a la SV post
TCH respecto al género.
RESULTADOS. En el periodo
señalado se llevaron a cabo 285
TCH, de los cuales fueron 155
alogénicos, 40% mujeres y 60%
hombres, con diagnóstico de LAM
en 25%, LAL en 23%, LGC en 19%,
mediana de supervivencia de 11
meses en el grupo de mujeres y
10.5 en el de los hombres, con seguimiento a 131 meses el 38% de
las mujeres y a 155 meses el 35%
de los hombres alotrasplantados.
Se realizaron 130 autotrasplantes,
48% mujeres y 52% hombres,
diagnóstico de mieloma múltiple
en 38%, LAL 17%, LAM 15%. Se
calculó supervivencia según el
método de Kaplan Meier, se realizó
regresión lineal comparando SV
con género, edad, IMC y padecimiento de base, obteniendo R2
de 0.0335. Se realizó prueba de
medias para la supervivencia por
género, sin encontrar significancia estadística. Por la similitud de
resultados encontrados no fueron
realizadas otras pruebas de inferencia estadística.
CONCLUSIONES. En este estudio, que incluyó trasplantes
autólogos y alogénicos, sin diferencia de edad ni padecimiento de
base, no hubo diferencia estadísticamente significativa en cuanto a
la SV post TCH respecto al género.
A1105
RESULTADOS DEL PROGRAMA DE
TRASPLANTE DE PROGENITORES
HEMATOPOYÉTICOS: 15 AÑOS
DE EXPERIENCIA EN EL INCMNSZ
León Rodríguez E*, Guzmán Uribe
P*, Deffis Court M*, Pérez Álvarez
SI*, Castro Sánchez A*, Rivera
Franco M*, Espinosa Poblano I*,
Velázquez González A*.
* Instituto Nacional De Ciencias
Médicas Y Nutrición Salvador Zubirán.
eucarios@hotmail.com
Libro Educativo 55 Congreso Nacional de la Agrupación Mexicana para el Estudio de la Hematología, A.C.
INTRODUCCIÓN. El trasplante
de progenitores hematopoyéticos
(TPH) es actualmente el tratamiento
de elección y en muchos casos la
única opción curativa para diversas
enfermedades hematológicas malignas. En nuestro país, son pocos los
centros especializados en esta estrategia de tratamiento, por lo cual es
importante reportar los resultados
de un programa de trasplante sistematizado y consolidado en nuestra
institución.
OBJETIVO. Describir los resultados a largo plazo del programa de
TPH del INCMNSZ de Noviembre
de 1998 a Marzo de 2013
MATERIAL Y MÉTODOS. Se
realizó un análisis prospectivo de
los pacientes sometidos a TPH en
el INCMNSZ entre 1998 y 2013.
Se describen las características
clínicas, las tasas de respuesta y la
supervivencia utilizando el paquete
estadístico SPSS v17.0.
RESULTADOS. Se incluyeron
173 pacientes sometidos a TPH en
nuestra institución de Noviembre
de 1998 a Marzo de 2013. La mediana de edad fue de 31 años (rango
15-65), de los cuales 117 (67.6%)
eran hombres. Las indicaciones
más frecuentes del TPH fueron las
siguientes: Tumores germinales
en 33 pacientes (19.1%), Linfoma
No Hodgkin (LNH) y Leucemia
Mieloide Aguda (LAM) con 24 pacientes respectivamente (13.8%),
Anemia Aplásica Grave (AAG) en 20
pacientes (11.5%), Linfoma de Hodgkin (LH) en 16 pacientes (9.2%),
Síndrome Mielodisplásico (SMD)
en 15 pacientes (8.6%), Mieloma
Múltiple (MM) en 12 pacientes
(6.9%), Leucemia Linfoblástica
Aguda (LAL) y Leucemia Mieloide
Crónica (LMC) en 10 pacientes
respectivamente (5.7%), y otros en
9 pacientes (5.2%). De acuerdo al
tipo de trasplante, 109 pacientes
(62.6%) recibieron un trasplante
autólogo y 64 pacientes (36.8%)
recibieron trasplante alogénico. Las
fuentes de obtención de PH más
utilizadas fueron: Sangre periférica
en 94 pacientes (53.4%), Médula
ósea estimulada con factor de crecimiento de colonias de granulocitos
en 55 pacientes (31%), Médula
ósea no estimulada en 15 pacientes
(8.6%) y médula ósea más sangre
periférica en 9 pacientes (4.6%).
Con un seguimiento de 28.5 (0-157)
meses, la mediana de supervivencia
no se ha alcanzado; sin embargo la
supervivencia proyectada a 5 años
es de 67% y a 10 años de 64%; la
mortalidad relacionada a tratamiento es de 6.2%.
CONCLUSIONES. El desarrollo de programas de TPH en
nuestro país es indispensable para
ofrecer a los pacientes la mejor
opción terapéutica, optimizando
los recursos limitados disponibles
y estableciendo lineamientos propios de tratamiento, que permitan
tener resultados de supervivencia
y mortalidad similares a centros
extranjeros con mayores recursos.
A1130
COMPARACIÓN DE PEGFILGRASTIM VS FILGRASTIM EN LA
RECUPERACIÓN HEMATOLÓGICA DESPUÉS DE DOSIS ALTAS DE
QUIMIOTERAPIA Y TRASPLANTE
AUTÓLOGO DE CÉLULAS PROGENITORAS HEMATOPOYÉTICAS
Martínez Miranda M*, Rivera Fong
L**, Valero Saldaña LM*.
* Institituto Nacional De Cancerología México. ** Universidad
Nacional Autónoma de México.
maritzamm@gmail.com
INTRODUCCIÓN. Los protocolos
de acondicionamiento seguidas de
trasplante de células progenitoras
hematopoyéticas (TauCPH) producen pancitopenia severa y los
pacientes quedan expuestos durante
ese tiempo a diversas complicaciones derivadas de la misma como
fiebre, y desarrollo de infecciones
bacterianas, virales y fúngicas que
aumentan la morbimortalidad de
pacientes trasplantados, el uso de
factores estimulantes de colonia de
Granulocitos(CSF-G) favorecen una
recuperación hematológica temprana y actualmente es un estándar su
utilización.
OBJETIVO. Comparar la eficacia
de Pegfilgrastim versus Filgrastim en
la disminución del tiempo de la
recuperación de neutrófilos después
de quimioterapia a dosis altas con
acondicionamientos BEAM, RBEAM ,R-PEAM ,PEAM ,MELFALÁN
200 Y ICE seguido de TauCPH en
pacientes con Linfomas , Mieloma
Múltiple y Cáncer testicular.
MATERIAL Y MÉTODOS. Es un
estudio comparativo de una cohorte
retrospectiva de 82 pacientes que
recibieron tratamiento con dosis
altas de quimioterapia seguidos
de un TauCPH, el periodo comprendido para ambas cohortes fue
Enero 2009 hasta Diciembre 2011
para 41 pacientes en el grupo de
Filgrastim y Diciembre 2011 hasta
Octubre 2013 para 41 pacientes en
el grupo de Pegfilgrastim. Las dosis
aplicadas de Filgrastim fué de 10 ug/
kg/día cada 12 horas hasta lograr la
recuperación hematológica y Pegfilgrastim dosis única de 6 mg, en
el día + 5 posterior a ASCT. Se revisaron las siguientes variables: datos
demográficos, diagnóstico, estadio
de la enfermedad al momento del
trasplante, Dosis CD34+ infundidas, recuperación hematológica,
duración de la fiebre, presencia
de infecciones, efectos adversos y
estancia intrahospitalaria.
RESULTADOS. La recuperación de neutrófilos (injerto) con
Pegfilgrastim se presento con una
mediana en el día +11 mientras y
con Filgrastim la mediana fue el día
+ 15, algunos pacientes con Pegfilgrastim presentaron recuperaciones
muy tempranas en el día +6, mientras que con Filgrastim las primeras
recuperaciones se dieron el día +9;
en la evaluación de probabilidad de
S197
Volumen 15, Suplemento 1, 2014
Revista de Hematología
recuperación; nuestros pacientes
con Pegfilgrastim, tiene 61% de
probabilidades de recuperarse para
el día +10, mientras que con Filgrastim tiene el 30% de probabilidades
de recuperarse en el mismo tiempo
(día +10), los resultados de injerto
de neutrófilos son estadísticamente
significativos no hubo diferencias
en la recuperación de plaquetas.
CONCLUSIONES. Los resultados en nuestro estudio la
administración única de 6 mg de
Pegfilgrastim es eficaz en disminuir el tiempo de recuperación de
Neutrófilos sin efectos adversos
en su aplicación, a pesar que el
costo es mayor que Filgrastim, la
disminución de estancia hospitalaria, disminución de infecciones
y requerimientos transfusionales,
compensan en forma muy importante el mismo.
A1134
BAJA INCIDENCIA DE EFECTOS
ADVERSOS AGUDOS DEL FILGRASTIM EN PACIENTES NO
HEMATOLOGICOS
Mancias Guerra MDC*, Villarreal
Martínez L*, Cantú Rodríguez OG*,
Osorno Rodríguez KL*, Morales
Mancillas NR*, Aguirre Fernández
GC*, De La Cruz Cruz RA*, Garza
Bedolla A*, Gutiérrez Aguirre CH*,
González Llano O*, Gómez Almaguer D*.
* Hospital Universitario “Dr. José
Eleuterio González”, Facultad De
Medicina, Universidad Autónoma
De Nuevo León.
consuelomanciasg@gmail.com
INTRODUCCIÓN. La sangre periférica movilizada con filgrastim
(G-CSF) es un recurso utilizado
frecuentemente para trasplante
autólogo o alogénico de células hematoprogenitoras. En la actualidad,
se ha echado mano de esta fuente
progenitores para su uso en terapia
celular. No existen estudios que
demuestren evidencia concluyente
S198
acerca de la seguridad a largo plazo
del filgrastim en donadores sanos,
ya que el número de donadores aún
no es suficiente para comprobar la
ausencia de eventos adversos poco
comunes. En el Servicio de Hematología del Hospital Universitario
“Dr. José Eleuterio González” se
realizó un análisis retrospectivo
de pacientes con enfermedades
no hematológicas en quienes se
realizó un procedimiento de terapia celular para enfermedades no
hematológicas.
OBJETIVO. Valorar la seguridad
a corto plazo del filgrastim en pacientes que se sometieron a terapia
celular ajenos a algún padecimiento
hematológico.
MATERIAL Y MÉTODOS. Se
revisaron las bases de datos de
95 pacientes con diferentes padecimientos del 2009 a la fecha,
los cuales se sometieron a la estimulación de médula ósea con
filgrastim durante 3 días previos a su
tratamiento. Se obtuvieron variables
demográficas, las manifestaciones
clínicas y resultados de laboratorio.
RESULTADOS. Se evaluaron 95
pacientes (49 femeninos y 46 masculinos), la mediana de edad fue de
12 años (1-72), 61.1% pediátricos
vs 38.9 % adultos. La mediana de
células CD34+ x 106 fue de 18,
siendo de 14.26 para los pacientes
pediátricos y de 18.8 para adultos.
Los efectos adversos se muestran
en la tabla 1, siendo los de mayor
frecuencia cefalea (11.8%) y dolor
óseo (34.4%).
CONCLUSIONES. Existen ya
algunos estudios que hablan de la
seguridad del uso del filgrastim en
donadores sanos de trasplante de
médula ósea, siendo incluso un
fármaco aprobado por la FDA en
donadores sanos no relacionados.
El uso del filgrastim en este tipo de
pacientes causó una baja incidencia de efectos adversos no serios a
corto plazo y no se presentó ningún
efecto adverso serio. Los efectos ad-
versos no serios encontrados fueron
fiebre, irritabilidad, vómito, cefalea
y dolor óseo siendo estos últimos
dos los de mayor incidencia. Cabe
destacar que todos los síntomas
fueron controlados mediante la
administración de acetaminofén
(paracetamol). Existen estudios que
no reportan eventos adversos severos a largo plazo (5 años).
A1144
CA R AC T E R I Z AC I O N D E U N
PAT R O N D E R E C O N S T I T U C I O N I N M U N O L O G I CA E N
PACIENTES PEDIATRICOS POSTTRASPLANTADOS CON CELULAS
PROGENITORAS HEMATOPOYETICAS OBTENIDAS DE FUENTE DE
SANGRE PERIFERICA Y SANGRE
DE CORDON UMBILICAL
Mujica Guzman F*, Pérez García
M*, Romero Guzmán LT*, Medina
Torres EA*, Mendoza González F*,
Romero López V*, Monsivais Orozco AC*, Olaya Vargas A*.
* Instituto Nacional De Pediatría.
anti_ybaf@yahoo.com.mx
INTRODUCCIÓN. La finalidad
del trasplante de Células Progenitoras Hematopoyéticas (TCPH) es
implantar un sistema sano hematopoyético en sustitución de uno
enfermo. La recuperación total
inmunológica es un proceso lento
y a menudo incompleto después del
trasplante. La inmunidad innata se
reconstituye rápidamente, mientras
que la inmunidad adaptativa se ve
comprometida por varios meses.
Las células NK alcanzan niveles
normales desde las primeras semanas post-trasplante, seguida de los
linfocitos B. La reconstitución de
los linfocitos T es lenta puede tardar
hasta dos años.
OBJETIVO. Describir el patrón
de reconstitución inmunológica de
los pacientes pediátricos del INP,
post trasplantados alogénicamente
con CPH de fuente de sangre de
cordón umbilical o de sangre peri-
Libro Educativo 55 Congreso Nacional de la Agrupación Mexicana para el Estudio de la Hematología, A.C.
férica, durante el periodo de Enero
de 2008 a Diciembre de 2013.
MATERIAL Y MÉTODOS. Se incluyeron 115 pacientes pediátricos
sometidos a TCPH: 41 del género
femenino y 74 del género masculino. A 9 se les realizó trasplante
autólogo, y a 106 se les realizó
trasplante alogénico. Se tomaron
muestras de sangre periférica anticoagulada con EDTA durante los 1,
3, 6, 9 y 12 meses de seguimiento
post-trasplante. Se determinaron
las subpoblaciones linfocitarias
por Citometría de flujo (Citómetro
Cytomics FC500 Beckman Coulter).
Se utilizaron los anticuerpos monoclonales de superficie: CD4-FITC/
CD8-PE/CD3-PC5; CD19-FITC;
CD56-PE. Se elaboro base de datos
y se realizo análisis estadístico.
RESULTADOS. SP: primero reconstituyó la población de CD56+
al mes de seguimiento, la subpoblación de CD19+, CD3+ y CD8+
a los 3 meses, y finalmente la
subpoblación de CD4+ al año de
seguimiento. SCU: primero reconstituyó la población de CD56+ a los
3 meses de seguimiento, la población de CD19+ a los 6 meses, la
reconstitución de la subpoblación
CD3+ y CD8+ a los 9 meses, y
posteriormente la subpoblación de
CD4+ al año de seguimiento.
CONCLUSIONES. Se sugiere
el siguiente patrón de reconstitución inmunológica para: trasplante
alogénico empleando como fuente
sangre periférica: 1º. Linfocitos NK
(respuesta inmune innata) a 1 mes
de seguimiento. 2º. Linfocitos B
(respuesta inmune humoral) a los 3
meses de seguimiento. 3º. Linfocitos
T citotóxicos (respuesta inmune
celular) a los 3 meses de seguimiento. 4º. Linfocitos T cooperadores
(respuesta inmune celular) a los 12
meses de seguimiento. Trasplante
alogénico empleando como fuente
sangre de cordón umbilical: 1º.
Linfocitos NK (respuesta inmune innata) a los 3 meses de seguimiento.
2º. Linfocitos B (respuesta inmune
humoral) a los 6 meses de seguimiento. 3º. Linfocitos T citotóxicos
(respuesta inmune celular) a los
9 meses de seguimiento. 4º. Linfocitos T cooperadores (respuesta
inmune celular) a los 12 meses de
seguimiento.
A1176
PAPEL REGULADOR Y CITOTÓXICO DE LAS CÉLULAS T CD8+
EN EL DESARROLLO DE EICH
EN PACIENTES SOMETIDOS A
TRASPLANTE ALOGÉNICO DE
CÉLULAS HEMATOPOYÉTICAS
Gutiérrez Hoya A*, Vela Ojeda J**,
López Santiago R*, Montiel Cervantes L**, Montiel Cervantes L**,
Rodríguez Cortes O***, Moreno
Lafont M*.
* Escuela Nacional De Ciencias
Biológicas – Instituto Politécnico
Nacional. ** Unidad Médica de Alta
Especialidad, Centro Médico Nacional La Raza, Instituto Mexicano del
Seguro Social. *** Escuela Superior
de Medicina - Instituto Politécnico
Nacional.
adrianagh85@hotmail.com
INTRODUCCIÓN. El trasplante
alogénico de células hematopoyéticas (TACH) surge como opción
terapéutica para el tratamiento de
enfermedades hematológicas, uno
de sus principales inconvenientes es
el desarrollo de enfermedad injerto
contra huésped (EICH), esta es una
reacción de las células inmunes
del donador contra los tejidos del
hospedero. Aproximadamente del
35-50% de los receptores de TACH
desarrollan EICH y se sabe que este
proceso puede ser regulado por las
células Treg CD4+; sin embargo resiente reportes en modelos murinos
indican que existen subpoblaciones
de células CD8+ que pueden llevar
acabo mecanismos de regulación
y que pueden ser suficientes para
prevenir el incremento en la mortalidad debida al desarrollo de EICH,
esto hace necesario su estudio en
humanos.
OBJETIVO. Analizar el fenotipo inflamatorio y regulador de
las células CD8+ en los pacientes
sometidos a TACH y correlacionarlo
con el desarrollo de EICH
MATERIAL Y MÉTODOS. Se
analizaron a 18 pacientes sometidos a TACH; se obtuvieron muestras
de sangre periférica y se analizaron marcadores de regulación e
inflamación en células CD8+ de
manera basal y en respuesta al estímulo policlonal. Se dividieron a los
pacientes en tres grupos: paciente
sin EICHa, pacientes con EICHa y
pacientes con EICHa controlado.
RESULTADOS. Observamos un
aumento en el porcentaje de células
CD8+IFNg en pacientes con EICHa
(p<0.05) y este aumento correlacionó con la severidad del EICHa, sin
embargo, el papel de las células
CD8+IL-17+ en el desarrollo de
EICHa parece no ser relevante. Con
respecto a la importancia del papel
regulador de las células T CD8+,
se encontró un aumento en el porcentaje de las células CD8+CD39+
(p<0.05) en pacientes sin desarrollo
de EICH al igual que en los pacientes con EICHa controlado; también
se observo el aumento en el porcentaje de las células CD8+TGFß+
(p<0.05) y CD8+IL-10+ (p<0.05)
en los pacientes con EICHa controlado.
CONCLUSIONES. Las células
CD8+IFNg+ son importantes en
el desarrollo de la EICH, mientras
que el papel de las células Tc17
se mantiene controversial. El perfil
Tc1 puede ser utilizado como un
marcado pronóstico para regular
la cantidad de fármacos inmunosupresores administrados y de esta
manera llevar un mejor control
de la EICH. Por otra parte, queda
claro que existe regulación por
parte de las células CD8+ ya que
pueden llevar a cabo procesos de
regulación mediante la secreción
S199
Volumen 15, Suplemento 1, 2014
Revista de Hematología
de citocinas como TGFß e IL10, al
igual que la regulación por medio
de la expresión de moléculas de
superficie como CD39, que actúan
agotando el ATP del medio.
A1185
ALOTRASPLANTE HEMATOPOYETICO MIELOABLATIVO CON
IRRADIACION CORPORAL TOTAL
Y CICLOFOSFAMIDA EN LEUCEMIA LINFOBLASTICA AGUDA DE
RIESGO ALTO
Pérez Lozano U*, Ruiz Ovalle JL**,
Limón Flores JA*, Lobato Tolama R*.
* IMSS Hospital De Especialidades
De Puebla UMAE. ** Unidad de
Oncología SSA Puebla.
dra_uendy@yahoo.com.mx
INTRODUCCIÓN. La Leucemia
Linfoblástica Aguda (LLA) es una
neoplasia con pobre pronóstico
aún con trasplante alogénico hematopoyético. La intensidad del
acondicionamiento se ha considerado una variable importante para
la erradicación permanente de la
enfermedad debido al reducido
papel del fenómeno injerto contra
leucemia.
OBJETIVO. Reportar los resultados de toxicidad y eficacia a largo
plazo en una serie de casos.
MATERIAL Y MÉTODOS. Doce
pacientes trasplantados desde
mayo 2008 a mayo 2012, con
LLA de riesgo alto, con hermano
HLA compatible al que se le realizó leucoaféresis de progenitores
hematopoyéticos procesando 6
volemias en dos días consecutivos
infundiéndose de 2 a 48 horas
después de su obtención. Todos
los pacientes recibieron irradiación
corporal total con bomba de cobalto de 12 a 16cGy divididos en 6 a 9
fracciones durante 3 días, seguidos
de ciclofosfamida IV 60 mg/kg durante dos días. Todos los pacientes
eran positivos para CMV IgG. Todos
recibieron profilaxis con aciclovir,
trimetroprim/sulfametoxazol, y an-
S200
fotericina B desde el dia +1; factor
estimulante de colonias desde el
día +5, gammaglobulina semanal
durante la fase aplásica. Todos recibieron ciclosporina A intravenosa y
curso corto de metrotexate.
RESULTADOS. Ingresaron 8
pacientes en 2ª RC y 4 en primera remisión Ph+. 7 mujeres, 5
hombres. Promedio de edad 19.1
años (5-36). Promedio de células
CD34+/kg infundidas: 3.4millones
(0.1-7.8). 3 pacientes con una
incompatibilidad HLA-1. Toxicidad: alopecia 100%, neutropenia
G: IV- trombocitopenia G: IV y
anemia severa 100%; neutropenia
febril 100% , mucositis I-II: 83%
Mucositis G: III 16% , Neumonía
nosocomial 4/12; colitis neutropénica 2/12; sepsis 4/12, infección
de catéter 33.3% . Promedio de
neutropenia 13.2 días (9-18). Promedio de estancia en aislamiento
37 días (12-55), EICH agudo 3/12,
EICH crónico 2/12. Mortalidad: por
infección 2/12; Recaída 3/12; EICH
agudo 1/12; EICH crónico 1/12. Sobrevida libre de enfermedad 41.6%.
Media de seguimiento 29.5 meses.
De los 5 sobrevivientes ninguno
tiene secuelas crónicas.
CONCLUSIONES. El trasplante
alogénico mieloablativo con ICT/CFA
es un procedimiento indicado para
enfermedad de alto riesgo de mortalidad por recaída; tiene muy alta
toxicidad, requiere de soporte vital
intensivo y ofrece una posibilidad de
curación real para algunos pacientes
sin otra opción terapéutica.
A1199
PROGENITORES DETECTADOS
EN CULTIVO DE UNIDADES
TRASPLANTADAS DE SANGRE
DE CORDÓN UMBILICAL, SU
CORRELACIÓN CON EL INJERTO
Y POSIBLE INFLUENCIA EN LA
SOBREVIVENCIA DE PACIENTES.
BANCO DE CÉLULAS DE SANGRE
DE CORDÓN UMBILICAL. CMN
LA RAZA
Luna-Bautista F, Romero-Juárez Y,
Juárez-Cortés E, Franco-Gutiérrez
E, Arellano-Ocampo S, GuerraMárquez A, Gasca-Leyva.
Instituto Mexicano Del Seguro
Social.
leila.vera@imss.gob.mx
INTRODUCCIÓN. Desde hace
ya varios años se sabe que el
contenido de progenitores en
unidades colectadas de Sangre
de Cordón Umbilical (SCU) es de
vital importancia para su elección
en el trasplante. Aunque aún se
debate la importancia funcional
de cada fracción celular que en
este recurso existe para la cura
de pacientes, nadie niega ---en
el caso de pacientes hematológicos--- la importancia de elegir
unidades con alto contenido de
progenitores hematopoyéticos.
Por otro lado el sistema de cultivo
de colonias hematopoyéticas en
medio semisólido (Colony Assay)
sigue siendo la herramienta más
útil para detectar y conocer la
funcionalidad de esta fracción
celular.
OBJETIVO. Conocer la correlación existente entre dicho
contenido de progenitores en
unidades trasplantadas proporcionadas por el Banco de Células
de Sangre de Cordón Umbilcal y
sus datos de injerto en pacientes
receptores.
MATERIAL y MÉTODO. Se
tuvo a bien cultivar en Colony
Assay muestras post congelación
provenientes de dichas unidades,
cuantificar los diferentes linajes
desarrollados y observar su posible
correlación con el desarrollo del
injerto. Se estudiaron 120 datos de
unidades trasplantados.
RESULTADOS Nuestros resultados indican una correlación
positiva entre el número de progenitores detectados y la ocurrencia
de injerto (p<005), así como en
menor grado --pero siempre signi-
Libro Educativo 55 Congreso Nacional de la Agrupación Mexicana para el Estudio de la Hematología, A.C.
ficativo (P<0.05)-- la correlación
positiva entre la cantidad de progenitores y la permanencia con
vida del paciente. De acuerdo a
lo antes reportado nuestra mayor
significancia fue obtenida con las
fracciones de progenitores y células
mononucleares (p<0.005) y con
el linaje de células primitivas del
tipo HPP-CFC (P<0.05). El cual por
anteriores trabajos parece ser uno
de los más afectados durante la
criopreservación.
CONCLUSIONES Nuestros
resultados avalan la importancia
de elegir unidades de SCU con
alto contenido de progenitores
hematopoyéticos principalmente
de tipo primitivo y otras células
mononucleares accesorias, que
faciliten y aceleren el injerto y por
otro lado se infiere la influencia de
otros factores en la sobrevivencia
de los pacientes además de que
coinciden con la importancia de
realizar criopreservaciones cuidadosas a fin de mantener lo más
intacto posible a progenitores y
demás células útiles en la cura por
trasplante.
VARIOS
PRESENTACIÓN CARTEL
A1079
P R I N C I PA L E S M OT I VO S D E
I N T E R C O N S U LTA A H E M A TO L O G I A E N L A S A L A D E
MEDICINA INTERNA EN UN
HOSPITAL DE CONCENTRACIÓN
Flores Jimenez JA*, López Hernández JC*, Zambrano Velarde MÁ*,
Preciado Figueroa FM*, Madrigal
Gómez AM*, Navarro Pérez CA*,
Bedolla Barajas M*.
* Hospital Civil “Dr. Juan I. Menchaca” Universidad De Guadalajara.
** Hospital Civil “Dr. Juan I. Menchaca”. *** Hospital Civil “Dr.
Juan I. Menchaca” Universidad de
Guadalajara.
jafloresmd@gmail.com
INTRODUCCIÓN. En los centros
hospitalarios, el médico internista
es frecuentemente el primer contacto para una gran cantidad de
pacientes; como consecuencia, su
papel es de suma relevancia en la
detección de diversas alteraciones
en la salud, facilitando así el inicio
de un tratamiento. Derivado de esta
dinámica, se hace necesario la intervención de otras especialidades.
La Hematología es el área médica
que se encarga del estudio de las
enfermedades y trastornos de la
sangre y comúnmente es necesaria su colaboración en el manejo
interdisciplinario de los pacientes
adultos.
OBJETIVO. Describir los principales motivos de interconsulta al
servicio de Hematología adultos.
MATERIAL Y MÉTODOS. Mediante un estudio retrospectivo,
se revisaron los registros internos
del servicio de Hematología en
búsqueda de los motivos de interconsultas, durante el período
de tiempo comprendido de enero
a julio de 2013. Los motivos de
consulta se categorizaron de la
siguiente manera: alteraciones en la
biometría hemática, trastornos de la
coagulación, neoplasias hematológicas y otras causas (enfermedades
hematológicas no neoplásicas,
enfermedades inmunológicas). Los
datos se presentan como estadística
descriptiva.
RESULTADOS. Durante el periodo de estudio se revisaron 257
interconsultas; 133 (52%) correspondieron a mujeres; la media
de edad fue de 43 años (±20). De
acuerdo a las categorías, los más
frecuentes fueron: alteraciones en
la biometría hemática (57%), neoplasias hematológicas (23%), otros
(18%) y trastornos en la coagulación
(2%). Los principales motivos de
interconsultas fueron: anemia no
especificada (18%), trombocito-
penia (14%), pancitopenia (13%),
leucemias (9%) y linfomas (8%).
La trombocitopenia fue el motivo
más frecuentemente en el sexo
femenino con p=0.001, mientras
que los trastornos de la coagulación se presentaron más en el sexo
masculino p=0.005. En relación
a las interconsultas de neoplasias
hematológicas los linfomas fueron
más frecuentes en el sexo masculino p=0.021
CONCLUSIONES. Las alteraciones en la biometría hemática fue el
principal motivo de interconsulta al
servicio de Hematología, mientras
que la anemia no especificada fue
el trastorno más frecuente. La labor
conjunta entre el médico internista
y el hematólogo son fundamentales
en la atención médica integral.
A1147
EVALUACION DEL VOLUMEN
CORPUSCULAR MEDIO NEUTROFILICO COMO UN INDICADOR
DE SEPSIS EN PACIENTES PEDIATRICOS DEL INP
Mujica Guzman F*, Padilla Valdez
JM*, Mendoza Gonzalez F*, Medina Torres EA*, Farfan Becerril C*,
Rodriguez Hernandez R*, Jaloma
Avendaño RE*, Navarro Alegria IA*,
Romero Lopez V*, Paredes Aguilera
R*, Romero Guzman LT*.
S201
Volumen 15, Suplemento 1, 2014
Revista de Hematología
* Instituto Nacional de Pediatría.
anti_ybaf@yahoo.com.mx
INTRODUCCIÓN. La Sepsis se define como una respuesta sistémica
inflamatoria del huésped contra
un agente infeccioso. El correcto
diagnóstico es crítico para el tratamiento y cuidado del paciente.
En la práctica clínica los estudios
más utilizados para su diagnóstico son: la proteína C-Reactiva,
hemocultivo, biometría hemática
completa y la identificación de
características morfológicas (neutrófilos en banda, granulocitos
inmaduros, cuerpos de Döhle,
granulación tóxica, y la expresión
de CD64 en leucocitos de sangre
periférica. En la actualidad los analizadores hematológicos cuentan
con nuevos parámetros que han
proporcionado grandes ventajas al
alertar la existencia de anomalías
presentes en la muestra analizada.
El analizador COULTER LH 750 es
capaz de evaluar: el tamaño de la
célula (volumen), la composición
interna de cada célula, la granula-
S202
ridad citoplasmática y el tamaño
del núcleo celular. Con base en
la medición de estas propiedades
celulares es posible determinar distintos parámetros como el Volumen
Corpuscular Medio Neutrofílico
(VCMN); la determinación de
este parámetro puede emplearse
para detectar la variabilidad de
los cambios morfológicos en los
neutrófilos y relacionarlos con la
presencia de un proceso infeccioso, por lo que puede ser utilizado
como una herramienta en el diagnóstico oportuno de una infección
sistémica como es el caso de la
Sepsis.
OBJETIVO. Evaluar la utilidad y
funcionalidad del parámetro VCMN
como un indicador primario en la
detección de Sepsis.
MATERIAL Y MÉTODOS. Se
estudiaron muestras de sangre
periférica anticoaguladas con
EDTA de una población pediátrica
de entre 0 y 18 años de edad del
INP, 282 muestras, de las cuales
158 corresponden a niños y 124 a
niñas. Las muestras de sangre pe-
riférica anticoaguladas con EDTA
fueron analizadas por medio del
equipo COULTER LH 750 para
obtener los valores de la biometría
hemática y los valores del volumen
corpuscular medio Neutrofílico
(VCMN). Se realizaron frotis de
sangre periférica con la tinción de
Wright para realizar la evaluación
morfológica de los leucocitos y
buscar alteraciones en la morfología de los neutrófilos.
RESULTADOS. Los valores obtenidos del VCMN en la población
estudiada tienen una distribución
normal y este parámetro no se ve
afectado por la edad y el género.
Se obtuvo un valor de corte para
VCMN de 148.26±15.20 fL con
una especificidad del 90.0%, sensibilidad del 93%, valor predictivo
positivo de 93.7% y un valor predictivo negativo del 96.7%.
CONCLUSIONES. Proponemos
un valor de corte para el VCMN
de 148.26±15.20 fL para detectar
a los pacientes pediátricos que se
encuentran en la fase sub-clínica
de un proceso infeccioso.
Libro Educativo 55 Congreso Nacional de la Agrupación Mexicana para el Estudio de la Hematología, A.C.
RESULTADOS DE RESPUESTA A
TRATAMIENTO Y SUPERVIVENCIA
EN PACIENTES ADULTOS CON
LPA TRATADOS CON EL PROTOCOLO DEL INTERNATIONAL
CONSORTIUM ON APL (IC-APL)
MODIFICADO
Crespo-Solis E.
Clínica de Leucemia Aguda del
Departamento de Hematología y
Oncología del Instituto Nacional
de Ciencias Médicas y Nutrición
Salvador Zubirán. México, D.F.
La leucemia promielocítica aguda
t(15;17) con rearreglo de PML/
RARA actualmente está clasificada
por la OMS como parte del grupo
de leucemia mieloide aguda con
anormalidades genéticas recurrentes. (1) Los avances terapéuticos
con esquemas combinados de
quimioterapia y ácido trans-retinoico (ATRA) han logrado tasas
de respuesta completa cercanas
a 90% y curvas de supervivencia
libre de enfermedad a largo plazo
de 85%. (2-5)
En 2006 se puso en marcha
el protocolo de tratamiento del
International Consortium on Acute
Promyelocytic Leukemia (IC-APL)
que pretendía mejorar las tasas
de remisión completa y de supervivencia para países en desarrollo
mediante un esquema ajustado
con base en el riesgo y la aplicación de daunorrubicina en lugar
de idarrubicina. Recientemente se
publicaron los resultados de este
estudio multicéntrico. (6)
En 2006 participamos con la
inclusión de dos pacientes en
el protocolo del IC-APL quienes
quedaron incluidos en el reporte
original (6). Debido a los buenos
resultados reportados inicialmente,
decidimos implementar el protocolo de tratamiento con mínimas
modificaciones en los pacientes
adultos con LPA de nuevo diagnóstico o en aquellos pacientes
en recaída previamente tratados
con ATRA con más de un año de
duración de la remisión.
A 8 años de haber iniciado el
protocolo de tratamiento del IC-APL
modificado reportamos los datos
de respuesta a tratamiento y supervivencia de la primera serie de 18
pacientes adultos con LPA tratados
en la Clínica de Leucemia Aguda
del INCMNSZ.
Se reclutaron todos los pacientes
con LPA a partir del año 2006 hasta
el año 2013. El diagnóstico de LPA
se estableció con base en las recomendaciones de la OMS 2008 (1)
con biometría hemática, aspirado
de médula ósea y comprobación
de la t(15;17) mediante citogenética
convencional, FISH, o bien, al demostrar el rearreglo de PML/RARA
por PCR cualitativa o cuantitativa.
Se hicieron algunas modificaciones menores al protocolo original:
no realizamos seguimiento de enfermedad residual mínima (ERM),
no identificamos las isoformas de
PML/RARA al momento del diagnóstico y se aplicó quimioterapia
intratecal profiláctica en pacientes
de alto riesgo, de 4 a 6 dosis de
citarabina 60 mg y metotrexate
12.5 mg, mensualmente, una vez
concluida la terapia de consolidación. A los pacientes que recayeron
posterior a la aplicación del esquema IC-APL se les dio tratamiento de
rescate y TCH autólogo en segunda
remisión completa (RC) o TCH
alogénico en quienes recayeron
posterior a TCH autólogo y lograron
tercera RC con algún esquema de
rescate. Los esquemas de rescate
fueron variables; sin embargo, se
podía implementar el mismo protocolo si la remisión se sostuvo al
menos por un año o combinaciones
de ATRA más trióxido de arsénico
o regímenes convencionales para
leucemia mieloide aguda en los
estados avanzados. Los pacientes
firmaron consentimiento informado
para aplicación de quimioterapia
de primera línea con base en los
procedimientos de tratamiento de
la Clínica de Leucemia Aguda del
Departamento de Hematología y
Oncología del INCMNSZ. El presente estudio fue aprobado por el
Comité de Ética Local.
De los 18 pacientes evaluados
(61.1%) fueron mujeres y 7 (38.9%)
hombres, dando una relación 1.6:1.
La mediana de edad al diagnóstico
fue de 40 años con un intervalo de
21 a 74 años. Cabe destacar que el
16.6% (3 pacientes) tenían más de
65 años al diagnóstico. En 27.8%
(n=5) de los casos se clasificaron
como riesgo bajo, 55.6% (n=10)
intermedio y 16.7% (n=3) alto.
Al momento del diagnóstico
22.2% de los pacientes cumplían
Cuadro 1. Características de los pacientes al diagnóstico
Parámetro
Edad (años)
Hemoglobina (g/dl)
Leucocitos (x109/L)
Neutrófilos totales (x109/L)
Promielocitos (%)
Plaquetas (x109/L)
Tiempo de Protrombina (seg)
Tiempo de Tromboplastina Parcial (seg)
Tiempo de Trombina (seg)
Fibrinógeno (mg/dL)
Dímero-D (μg/L)
Promielocitos en médula ósea (%)
Mediana (intervalo)
Intervalo
40
8.25
1.75
0.079
17.5
43.5
11.9
27.1
16.9
263
3,4672.8
81.5
21-74
3.2-13.1
0.2-15.90
0-13,880
0-96
9-108
9.2-14.7
22-38.4
13.8-23.1
88-901
682-6,570
3-96
S203
Volumen 15, Suplemento 1, 2014
Revista de Hematología
con los criterios de coagulación
intravascular diseminada. Ningún
paciente se presentó con alteración
en las pruebas de funcionamiento
renal o hepático.
De los 18 pacientes analizados
50% no tenía comorbilidades al
momento del diagnóstico.
Las características morfológicas del aspirado de médula
ósea fueron analizadas en 17 pacientes de los cuales 94.1% (16)
fueron catalogadas como clásica
y en un paciente (5.9%) fue considerado como variante, en dicho
paciente inicialmente se hizo el
diagnóstico morfológico de LMA
sin maduración (M1) debido a que
los promielocitos variantes fueron
calificados como blastos.
De los 18 pacientes incluidos
a 16 se les realizó inmunofenotipo
al momento del diagnóstico, 100%
de los cuales presentó un patrón de
inmunofenotípico clásico CD34(-),
HLADR(-), CD13 (+), CD33 (+),
Mieloperoxidasa (+) .
L a tra n s lo c a c ió n t(1 5 ;1 7 )
(q22;q21) fue demostrada ya sea por
cariotipo o FISH en 94.4% (17) de
los pacientes, solamente en uno de
ellos fue necesario la demostración
del re-arreglo PML/RARA por PCR.
De los 18 pacientes tratados
con el esquema IC-APL 2006, 17
alcanzaron remisión completa
hematológica (94.4%) en una mediana de 42 días (intervalo, 34-158
días). Solamente un paciente (5.5%)
falleció durante inducción a la remisión y este paciente presentaba
múltiples comorbilidades (EPOC,
TB, fibrosis pulmonar, DM2, hipotiroidismo, antecedente de CA mama
y basocelular).
Durante la inducción a la remisión el 22.2% de los pacientes no
experimentaron complicaciones
graves (3-4 de la CTCAE versión ),
66.7% presentaron complicaciones
infecciosas grado 3-4 y 11.1% complicaciones no hematológicas grado
3-4 (hemorragia subaracnoidea y
S204
vasculitis leucocitoclásica).
La tasa de neutropenia grave
febril durante la inducción fue de
61.1%.
El síndrome de diferenciación
(síndrome de ATRA) fue identificado
en el 22.2% de los pacientes.
De los 17 pacientes en remisión
completa hematológica solamente
se pudo analizar la remisión citogenética mediante FISH en 15
de ellos; de los cuales el 100%
se encontraban en remisión completa citogenética al término de la
inducción. No analizamos remisión molecular (limitante de este
estudio)*
De los 17 pacientes que lograron la remisión completa, 14
recibieron las 3 consolidaciones
en los tiempos programados, solamente 3 pacientes recibieron
una consolidación con un mes de
retraso. Uno de ellos por dificultades económicas y dos ellos por
complicaciones graves atribuidas al
tratamiento, NGF en uno y otro por
toxicidad hepática; ambos eventos
se documentaron durante la segunda consolidación.
La tasa de NGF durante las consolidaciones fue de 29.4% (5/17).
Lo que contrasta con 61.1% de
incidencia de NGF en inducción;
sin embargo sólo fue una tendencia
(p=0.06). No se registraron muertes
durante consolidación.
De los 18 pacientes incluidos
para tratamiento uno se perdió del
seguimiento posterior a su tercera
consolidación y corroboramos posteriormente que se encontraba vivo
y en remisión; sin embargo después
ya no fue posible establecer contacto con el paciente. El cese electivo
de tratamiento para el momento
del corte se documentó en 10 de
16 pacientes (62.5%) .
Durante el seguimiento solamente se documentó una recaída
(5.9%) la cual fue en médula ósea.
La paciente fue sometida a trasplante de células hematopoyéticas
autólogo y posterior al mismo
se documentó progresión de la
enfermedad lo que condicionó su
muerte.
Del total de pacientes, sólo
2 fallecieron (11.1%), uno en
aplasia postquimioterapia durante
Figura 1. Curva de supervivencia global en meses de los pacientes adultos con LPA
tratados con el protocolo IC-APL modificado.
Libro Educativo 55 Congreso Nacional de la Agrupación Mexicana para el Estudio de la Hematología, A.C.
inducción (5.5%) y el otro en progresión de la enfermedad post-TCH
autólogo (5.5%). La mediana de
supervivencia no ha sido alcanzada.
Este es la primera serie de pacientes tratada con el protocolo del
IC-APL después de su publicación
en 2013 (6). Aunque la serie es
pequeña y las modificaciones son
mínimas, se corrobora la eficacia
y seguridad de este esquema de
tratamiento.
BIBLIOGRAFÍA
1. Arber D.A, Brunning R.D, Le Beau
M.M, Falini B, in Chapter 6: Acute
myeloid leukemia with recurrent
genetic abnormalities. WHO Classification of Tumours of Haematopoietic
and Lymphoid Tissues. Swerdlow S,
Campo E, Harris NL, Jaffe ES, Pileri
SA, Stein H, Thiele J, Vardiman JW,
Editors. International Agency for
Research on Cancer, Lyon 2008; 4th
Edition: p 110-123.
2. Sanz MA, Montesinos P, Rayón C, et
al. Risk adapted treatment of acute
promyelocytic leukemia base don alltransretinoic acid and anthracyclyne
with addition of cytarabine in consolidation therapy for high risk patients:
further improvements in treament
outcome. Blood 2010;110(25):51375146.
3. Ade`s L, Guerci A, Raffoux E, et al;
European APL Group. Very longterm outcome of acute promyelocytic leukemia after treatment
with all- trans retinoic acid and
chemotherapy: the European APL
Group experience. Blood. 2010;
115(9):1690-1696.
4. Ade`s L, Sanz MA, Chevret S, et
al. Treatment of newly diagnosed
acute promyelocytic leukemia (APL):
a comparison of French- BelgianSwiss and PETHEMA results. Blood.
2008;111(3):1078-1084.
5. Avvisati G, Lo-Coco F, Paoloni FP,
et al; GIMEMA, AIEOP, and EORTC
Cooperative Groups. AIDA 0493
protocol for newly diagnosed
acute promyelocytic leukemia:
very long-term results and role
of maintenance. Blood. 2011;
117(18):4716-4725.
6. Eduardo M. Rego, Haesook T. Kim,
Guillermo J. Ruiz-Argüelles, Maria
Soledad Undurraga, Maria del
Rosario Uriarte, Rafael H. Jacomo,
Homero Gutiérrez-Aguirre, Raul A.
M. Melo, Rosane Bittencourt, Ricardo Pasquini, Katia Pagnano, Evandro
M. Fagundes, Maria de Lourdes
Chauffaille, Carlos S. Chiattone,
Lem Martinez, Luis A. Meillón,
David Gómez-Almaguer, Hau C.
Kwaan, Javier Garcés-Eisele, Robert
Gallagher, Charlotte M. Niemeyer,
Stanley L. Schrier, Martin Tallman,
David Grimwade, Arnold Ganser,
Nancy Berliner, Raul C. Ribeiro,
Francesco Lo-Coco, Bob Löwenberg
and Miguel A. Sanz. Improving
acute promyelocytic leukemia (APL)
outcome in developing countries
through networking, results of the
International Consortium on APL.
Blood 2013;121:1935-1943.
S205