Segunda parte taller - Accidente-cerebro-vascular-2014-2-FN
Anuncio
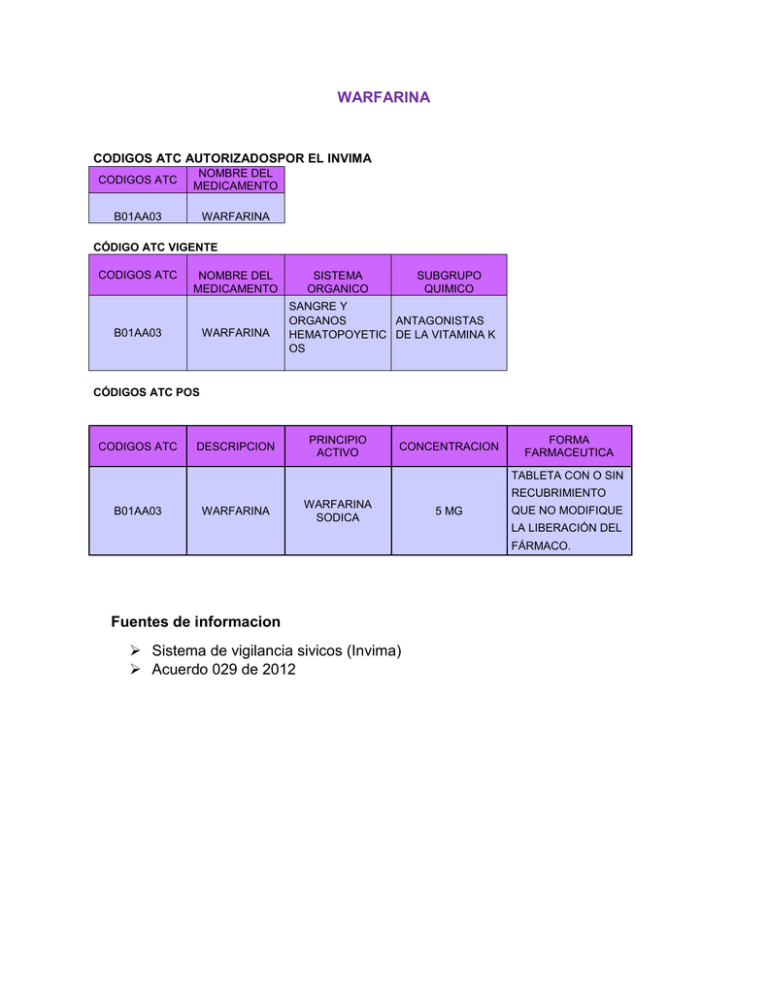
WARFARINA CODIGOS ATC AUTORIZADOSPOR EL INVIMA CODIGOS ATC NOMBRE DEL MEDICAMENTO B01AA03 WARFARINA CÓDIGO ATC VIGENTE CODIGOS ATC NOMBRE DEL MEDICAMENTO B01AA03 WARFARINA SISTEMA ORGANICO SUBGRUPO QUIMICO SANGRE Y ORGANOS ANTAGONISTAS HEMATOPOYETIC DE LA VITAMINA K OS CÓDIGOS ATC POS CODIGOS ATC DESCRIPCION PRINCIPIO ACTIVO CONCENTRACION FORMA FARMACEUTICA TABLETA CON O SIN RECUBRIMIENTO B01AA03 WARFARINA WARFARINA SODICA 5 MG QUE NO MODIFIQUE LA LIBERACIÓN DEL FÁRMACO. Fuentes de informacion Sistema de vigilancia sivicos (Invima) Acuerdo 029 de 2012 COUMADIN TABLETAS 2,5 MG Pricipio Activo Forma Farmaceutico Concentracion Lote Fecha de Vencimiento Presentacion Comercial Unidad de Medida Registro Sanitario Vigente expedido por el INVIMA NIMODIPINO Tabletas 5 MG 4B79541C MAR 2016 Caja por 30 tabletas MG/U 2004 M-014870-R1 CONTRAINDICACIONES DE NIMODIPINO TABLETA POR 30MG Desordenes hemorrágicos, úlcera péptica, heridas severas incluyendo las producidas por cirugías, endocarditis bacterial, insuficiencia hepática o renal severas o hipertensión, embarazo, lactancia. adminístrese con precaución en pacientes ancianos con deficiencia de vitamina k, en pacientes con hipertiroidismo y cuando se administran otros medicamentos que afectan la coagulación. EFECTOS SECUNDARIOS INCIDENCIA EN LA ADHERENCIA DEL TRATAMIENTO Las reacciones adversas potenciales de WARFARINA pueden incluir: hemorragia desde un tejido u órgano. Esto es una consecuencia del efecto anticoagulante. Los signos y síntomas variarán de acuerdo con la ubicación y grado de extensión del sangramiento. Las complicaciones producto de la hemorragia pueden presentarse en la forma de parálisis, cefalea, dolor en el pecho, abdomen, coyunturas o en otras partes del cuerpo; respiración entrecortada, dificultad para respirar o tragar; hinchazón sin causa aparente. Por lo tanto, se debe considerar la posibilidad de una hemorragia al evaluar la condición de cualquier paciente anti coagulado que presenta malestares que no indican un diagnóstico evidente. Fuentes Consultadas : Página INVIMA Coumadin. Ministerio de salud disponible en: http://www.ministeriodesalud.go.cr/empresas/bioequivalencia/prescripcion_product os/COUMADIN/DRS_MOINS_COUMADIN_5MG_TAB_VersionOCT12.pdf Adherencia al tratamiento prolongado Consiste en el grado de cumplimiento terapéutico por parte del paciente en cuanto a la administración de determinado medicamento, el cambio de un hábito de vida promoviendo modos de vida saludable. FUENTE CONSULTADA: Artículo: adherencia a largo plazo CLIPS ANEURISMA DESCRIPCION Clips de aneurismas YASARGIL MARCA DEL DISPOSITIVO B. BRAUN MEDICAL S.A. PRESENTACION COMERCIAL EMPAQUE INDIVIDUAL REGISTRO SANITARIO 2007DM-0000504-R1 CLASIFICACION DEL RIESGO II RIESGO VIDA UTIL 5 AÑOS LA ANTERIOR INFORMACIÓN SE EXIGE EN LA NORMA decreto 4725 de 2005 por el cual se reglamenta el régimen de registros sanitarios, permiso de comercialización y vigilancia sanitaria de los dispositivos médicos para uso humano Del Sistema Obligatorio de Garantía de Calidad de la Institución donde realiza las prácticas profesionales. ASAMBLEA GRAL DE SOCIOS REVISOR FISCAL ORGANIGRAMA JUNTA DIRECTIVA GERENTE DIRECTOR ADMINISTRATIVO Y FINANCIERO COORDINADOR MEDICO SECRETARIA DIRECCION ADM Y FINANCIERA FACILITADOR DE CALIDAD ESPECIALISTA AUX DE SERVICIOS GENERALES EL ORGANIGRAMA DE LA CLINICA PIEDECUESTA S.A JEFE DE ENFERMERIA COORDINADOR DE LABORATORIO SECRETARIA IMAGENOLOGIA NUTRICIONISTA QUIMICO FARMACEUTICO COORDINADOR DE ADMISIONES INSTRUMENTADOR CONTADOR COORDINADORA DE FACTURACION Y CARTERA AUDITOR TECNICO ADMINISTRATIVO AUXILIAR ADMINISTRATIVO Esta articulado dentro de la institución en: Director administrativo y financiero AUX DE ARCHIVO Y ESTADISTICA TERAPEUTA LA DEPENDECIA SEREGENTE LLAMA: Facilitador de calidad DE TECNOLOGO BACTERIOLOGO FARMACIA DE RAYOS X AUX. DE CONTABILIDAD MEDICO AUX ENFERMERIA AUX DE LABORATORIO AUX DE NUTRICION AUX DE FARMACIA AUX ENFERMERIACIRUGIA ORIENTADOR AUXILIAR DE RECEPCION DE URGENCIAS AUXILIAR DE FACTURACION INDICADORES DE CALIDAD DE LA ATENCIÓN EN SALUD AUXILIAR DE TRAMITE DE GLOSAS La institución registra el indicador: OPORTUNIDAD DE ENTREGA DE MEDICAMENTOS POS La institución si registra indicadores de Oportunidad en la entrega de medicamentos POS en promedio se hace una oportunidad de entrega en un 90% de las formulas recibidas. MENSAJERO RESOLUCIÓN 001446 DE 2006 Por la cual se define el Sistema de Información para la Calidad y se adoptan los indicadores de monitoria del Sistema Obligatorio de Garantía de Calidad de la Atención en Salud. Artículo 1º. Objeto. La presente resolución tiene por objeto definir y establecer las condiciones y procedimientos para disponer de la información que permita: 1. Realizar el seguimiento y evaluación de la gestión de la calidad de la atención en salud en el Sistema Obligatorio de Garantía de Calidad de la Atención en Salud. 2. Brindar información a los usuarios para elegir libremente con base a la calidad de los servicios, de manera que puedan tomar decisiones informadas en el momento de ejercer los derechos que para ellos contempla el Sistema General de Seguridad Social en Salud. 3. Ofrecer insumos para la referenciación por calidad que permita materializar los incentivos de prestigio del Sistema. Artículo 2º. Niveles de operación del sistema de información para la calidad. Opera en los siguientes niveles: 1. Nivel de Monitoría del Sistema. Los indicadores trazadores definidos para este nivel y las fichas técnicas de los mismos están contenidos en el Anexo Técnico que forma parte integral de la presente resolución, los cuales son de obligatoria implementación y reporte por parte de las instituciones a que hace referencia el artículo 1º del Decreto 101 1 de 2006 y servirán para la monitoría de la calidad de la atención en salud en todo el territorio Nacional y el desempeño de los diferentes actores en la implementación del Sistema Obligatorio de Garantía de Calidad de la Atención en Salud. En cumplimiento del artículo 3º del Decreto 2193 de 2004 o la norma que lo modifique, adicione o sustituya, la información solicitada para las variables de calidad corresponderá a los indicadores definidos para el nivel de monitoría de la presente resolución. Para las instituciones que hayan sido acreditadas, la entidad acreditadora conjuntamente con el Ministerio de la Protección Social deberá implementar indicadores de seguimiento, los cuales le servirán como trazadores del grado de permanencia de las condiciones evaluadas durante el proceso de otorgamiento de la acreditación y constituirán una herramienta técnica para orientar las visitas de seguimiento y la información a los usuarios. 2. Nivel de Monitoría Externa. Entre los diversos actores del Sistema Obligatorio de Garantía de Calidad de la Atención en Salud, se pueden proponer y utilizar en el marco de sus competencias indicadores de calidad adicionales a los que hace referencia la presente resolución, con el objeto de evaluar la calidad y promover acciones de mejoramiento en áreas específicas de responsabilidad, atendiendo al principio de eficiencia del Sistema de Información para la calidad contemplado en el artículo 47 del Decreto 1011 del 2006. 3. Nivel de Monitoría Interna. Está constituido por los indicadores que se evalúan y los eventos adversos que se vigilan al interior de los actores en la implementación del Sistema Obligatorio de Garantía de Calidad de la Atención en Salud. Es obligatorio hacer la monitoría de indicadores de calidad y vigilar el comportamiento de los eventos adversos los cuales serán definidos voluntariamente por la institución. Se encuentran comprendidos en este nivel, como de obligatorio cumplimiento e implementación los indicadores de seguimiento a riesgo establecidos en el Sistema Unico de Habilitación. Parágrafo. Para que sirva de referente en el Anexo Técnico que forma parte integral de la presente resolución se incluye un listado de eventos adversos. Artículo 3º. Indicadores de monitoría del sistema obligatorio de garantía de la calidad. Adóptense los indicadores de monitoría del Sistema Obligatorio de Garantía de la Calidad, los cuales están contenidos en la circular que para el efecto expida la Superintendencia Nacional de Salud y las fichas técnicas establecidas en el Anexo Técnico que forma parte integral de la presente resolución. Artículo 4º. Reporte de la información. Las entidades responsables de reportar información deberán hacerlo a la Superintendencia Nacional de Salud, quien realizará la recepción, validación y cargue de la información y la pondrá a disposición del Ministerio de la Protección Social. Parágrafo. La Superintendencia Nacional de Salud establecerá mediante circular los plazos, mecanismos y procedimientos mediante los cuales se realizará el reporte de información mencionado. Artículo 5º. Información a usuarios. El Ministerio de la Protección Social incluirá en la página web y en los mecanismos de difusión que considere convenientes, los datos del Sistema de Información para la Calidad con el propósito de facilitar el acceso en línea sobre la siguiente información: 1. Indicadores del nivel de monitoría del sistema. 2. Análisis del comportamiento de los indicadores del nivel de monitoría del Sistema. 3. Informe Nacional de Calidad. 4. Ordenamiento de IPS y EAPB basados en criterios de calidad. 5. Observatorio de calidad. Artículo 6º. Vigilancia y control. Corresponde a la Superintendencia Nacional de Salud y a las entidades territoriales, en desarrollo de sus competencias, cumplir y hacer cumplir las disposiciones establecidas en la presente resolución y en caso de incumplimiento, adelantar las acciones a que hubiere lugar. Artículo 7º. Implementación. Las instituciones obligadas a implementar el Sistema de Información para la Calidad deberán hacerlo en un plazo máximo de seis meses, contados a partir de la vigencia de la presente resolución. INDICADORES DEL NIVEL DE MONITORÍA DEL SISTEMA Oportunidad de la asignación de cita en la Consulta Médica General Oportunidad de la asignación de cita en la Consulta Médica Especializada Proporción de cancelación de cirugía programada Oportunidad en la atención en consulta de Urgencias Oportunidad en la atención en servicios de Imagenología Oportunidad en la atención en consulta de Odontología General Oportunidad en la realización de cirugía programada Tasa de Reingreso de pacientes hospitalizados Proporción de pacientes con Hipertensión Arterial Controlada Tasa de Mortalidad intrahospitalaria después de 48 horas Tasa de Infección intrahospitalaria Proporción de vigilancia de Eventos adversos Tasa de Satisfacción Global Número de Tutelas por no prestación de servicios POS o POS-S Oportunidad de entrega de medicamentos POS Oportunidad de la Referencia en la EAPB Proproción de quejas resueltas antes de 15 días POLÍTICA DE SEGURIDAD DEL PACIENTE Tiene la institución instaurada una Política de Seguridad del Paciente/Usuario? La CLINICA PIEDECUESTA tiene instaurada una POLITICA DE SEGURIDAD DEL PACIENTE, quienes los conforman es una enfermera que es la jefe del departamento se encargan de hacer la revison en un tiempo promediado y realizar un plan de accion y mejora en caso de necesitarlo. RESOLUCIÓN NÚMERO 2003 DE 2014 La Resolución 2003 de 2014 tiene como objeto ajustar el Sistema Único de Habilitación del Sistema Obligatorio de Garantía de Calidad de la Atención de Salud implementado anteriormente en la resolucion 1441 de 2013 y definirn los procedimientos y condiciones de inscripción de los Prestadores de Servicios de Salud y de habilitación de servicios de salud, así como adoptar el Manual de Inscripción de Prestadores y Habilitación de Servicios de Salud. Campo de aplicación La presente resolución aplica a: Las Instituciones Prestadoras de Servicios de Salud. Los Profesionales Independientes de Salud. Los Servicios de Transporte Especial de Pacientes. Las entidades con objeto social diferente a la prestación de servicios de salud, que por requerimientos propios de su actividad, brinden de manera exclusiva servicios de baja complejidad y consulta especializada, que no incluyan servicios de hospitalización ni quirúrgicos. Farmacovigilancia y la Tecnovigilancia con las Políticas de Seguridad del Paciente/Usuario Farmacovigilancia: Es la ciencia y actividades relacionadas con la detección, evaluación, entendimiento y prevención de los eventos adversos o cualquier otro Problema Relacionado con Medicamentos. Tecnovigilancia: es el conjunto de actividades que tiene por objeto la identificación y cualificación de los efectos adversos serios e indeseados producidos por los dispositivos médicos, así como la identificación de los factores de riesgos asociados a estos efectos o característicos, con base en la notificación, registro y evaluación sistemática de los efectos adversos de los dispositivos, con el fin de determinar su frecuencia, gravedad e incidencia de los mismos para prevenir su aparición. La Farmacovigilancia y Tecnovigilancia es una actividad que se debe implementar en todas las instituciones prestadoras de servicios de salud a nivel nacional como requisito de calidad y de habilitación, para poder tener prevención, detección, investigación, análisis y difusión de información sobre incidentes y eventos adversos con Medicamentos y Dispositivos Médicos durante su uso. El Programa de Farmacovigilancia y Tecnovigilancia contribuye a mejorar el cuidado presente y futuro del paciente. Se ha demostrado que la monitorización de eventos adversos, disminuye su incidencia y gravedad, así como el tiempo de estancia hospitalaria, lo que se traduce en un mejor cuidado individual del paciente. Así mismo, los programas de Farmacovigilancia y Tecnovigilancia a nivel hospitalario, apoyan al uso racional de medicamentos y el maneo seguro de dispositivos. Otros objetivos que se persiguen con este programa institucional son: Detección temprana de las reacciones adversas e interacciones desconocidas. Detección de aumentos de las frecuencias de reacciones adversas (conocidas). Identificación de factores de riesgo y de los posibles mecanismos subyacentes de las reacciones adversas e incidentes por dispositivos. Estimación de los efectos cuantitativos de la relación beneficio/riesgo y difusión de la información necesaria para mejorar la regulación, uso y prescripción de Medicamentos y/o Dispositivos Médicos. Educación e información a los pacientes y personal asistencial. Política Farmacéutica Norma le da el marco legal a la Política Farmacéutica La ley 1438 del 19 enero 2011, por medio de la cual se reforma es Sistema General de Seguridad social en salud y se dictan otras dispocisiones CONPES por medio del cuál se publica la Política Farmacéutica El CONPES mediante el cual se establece la Politica farmaceutica es el 155, del 30 de Agosto de 2012, formulada en el marco de los principios constitucionales asociados al derecho de la salud y de aquellos elementos de desarrollo del sector industrial farmaceutico que faciliten el cumplimiento de este derecho, acorde a los objetivos planteados en el Plan de Desarrollo Prosperidad Para Todos 2010 - 2014.



