ATOMO ejercicios PRACTICOSpopular!
Anuncio
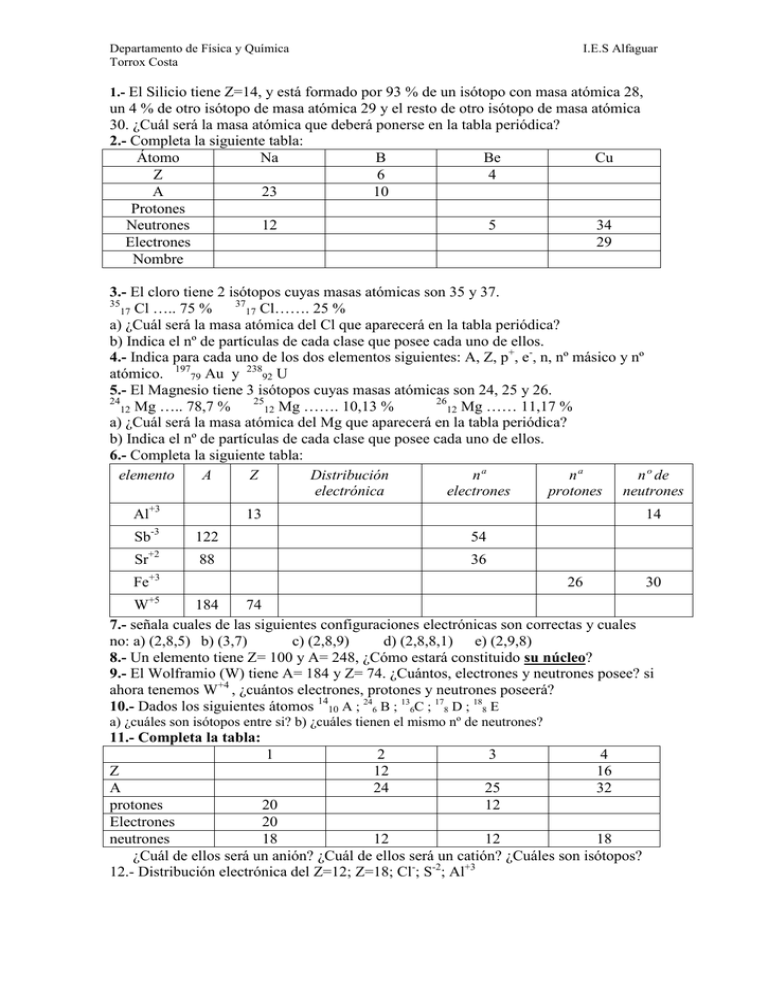
Departamento de Física y Química Torrox Costa I.E.S Alfaguar 1.- El Silicio tiene Z=14, y está formado por 93 % de un isótopo con masa atómica 28, un 4 % de otro isótopo de masa atómica 29 y el resto de otro isótopo de masa atómica 30. ¿Cuál será la masa atómica que deberá ponerse en la tabla periódica? 2.- Completa la siguiente tabla: Átomo Na B Be Cu Z 6 4 A 23 10 Protones Neutrones 12 5 34 Electrones 29 Nombre 3.- El cloro tiene 2 isótopos cuyas masas atómicas son 35 y 37. 35 37 17 Cl ….. 75 % 17 Cl……. 25 % a) ¿Cuál será la masa atómica del Cl que aparecerá en la tabla periódica? b) Indica el nº de partículas de cada clase que posee cada uno de ellos. 4.- Indica para cada uno de los dos elementos siguientes: A, Z, p+, e-, n, nº másico y nº atómico. 19779 Au y 23892 U 5.- El Magnesio tiene 3 isótopos cuyas masas atómicas son 24, 25 y 26. 24 25 26 12 Mg ….. 78,7 % 12 Mg ……. 10,13 % 12 Mg …… 11,17 % a) ¿Cuál será la masa atómica del Mg que aparecerá en la tabla periódica? b) Indica el nº de partículas de cada clase que posee cada uno de ellos. 6.- Completa la siguiente tabla: elemento A Z Distribución nª nª nº de electrónica electrones protones neutrones Al+3 13 14 Sb-3 122 54 Sr+2 88 36 +3 Fe 26 30 +5 W 184 74 7.- señala cuales de las siguientes configuraciones electrónicas son correctas y cuales no: a) (2,8,5) b) (3,7) c) (2,8,9) d) (2,8,8,1) e) (2,9,8) 8.- Un elemento tiene Z= 100 y A= 248, ¿Cómo estará constituido su núcleo? 9.- El Wolframio (W) tiene A= 184 y Z= 74. ¿Cuántos, electrones y neutrones posee? si ahora tenemos W+4 , ¿cuántos electrones, protones y neutrones poseerá? 10.- Dados los siguientes átomos 1410 A ; 246 B ; 136C ; 178 D ; 188 E a) ¿cuáles son isótopos entre si? b) ¿cuáles tienen el mismo nº de neutrones? 11.- Completa la tabla: 1 2 12 24 3 4 16 32 Z A 25 protones 20 12 Electrones 20 neutrones 18 12 12 18 ¿Cuál de ellos será un anión? ¿Cuál de ellos será un catión? ¿Cuáles son isótopos? 12.- Distribución electrónica del Z=12; Z=18; Cl-; S-2; Al+3








