Unidad II - Escuela Bernardino Rivadavia
Anuncio

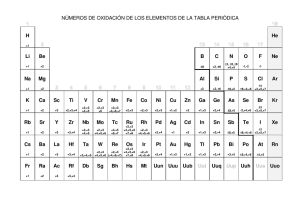
Unidad II: Eje : Electroquímica y almacenamiento de energía En tu netbook, en Escritorio del Alumno – Actividades – Física y Química – Clases de reacciones químicas. Realiza una lectura comprensiva. Y luego, nos introducimos en estas reacciones: LOS PROCESOS REDOX ESTE MATERIAL FUE EXTRAÍDO DEL LIBRO: QUÍMICA 4 – AULA TALLER – JOSÉ MARÍA MAUTINO – EDITORIAL STELLA Actividades de aplicación, recordando el número de oxidación: 1.- Calcular el número de oxidación de los siguientes átomos, iones y moléculas: a) Potasio b) Catión Ca2+ c) Cloro d) Anión Cl5- e) sodio Na 2.- Expresar el número de oxidación en los siguientes compuestos químicos y grupos: a) Ácido sulfúrico b) HNO3 c) CuO d) H2S e) SO4-2 f) CO3- CÓMO AJUSTAR ECUACIONES QUÍMICAS EN LAS QUE OCURREN PROCESOS REDOX: Por ejemplo: FeCl3 + SnCl2 → FeCl2 + Sn Cl4 a) Se escribe la ecuación totalmente ionizada (el agua, los óxidos y las sustancias simples no se ionizan) Fe3+ + 3 Cl- + Sn2+ + 2Cl - → Fe2+ + 2Cl - + Sn4+ + 4Cl- b) Se escriben las hemirreacciones de oxidación y de reducción: Sn2+ → Sn4+ + 2e- (oxidación) Fe3+ + 1e- → Fe2+ (reducción) c) Como el número de electrones cedidos en la oxidación debe ser igual al número de electrones adquiridos en la reducción, se igual el número de electrones en ambas hemirreacciones multiplicándolas por coeficientes apropiados. Sn2+ → Sn4+ + 2e- (oxidación) 2 Fe3+ + 2e- → 2 Fe2+ (reducción) d) Se suman miembro a miembro las hemirreacciones de oxidación y reducción y luego se simplifican los electrones: Sn2+ → Sn4+ + 2e- (oxidación) 2 Fe3+ + 2e- → 2 Fe2+ (reducción) ------------------------------------------------------------2Fe3+ + 2e + Sn2+ → 2 Fe2+ + Sn 4+ + 2e e) Los coeficientes así obtenidos, se llevan a la ecuación original: 2 FeCl3 + SnCl2 → 2 FeCl2 + SnCl4 Ejercicios: 1) Dada la siguiente reacción, escribe las hemireacciones de oxido-reducción Ca + O2 → CaO 2) Escribe las ecuaciones de oxido-reducción e iguala la ecuación Zn + HCl → ZnCl2 + H2 3) Realiza lo mismo para esta reacción química: HNO3 + Na OH → NaNO3 + H2O 4) Otra más: CuSO4 + Fe → Cu + FeSO4 5) Esta la resolvemos juntos: AgNO3 + Cu → Cu (NO3)2 + Ag a) Escribimos la ecuación disociada con los números de oxidación Ag+1 + N+5 + 3 O-2 + Cu0 → Cu+2 + 2N+5 + 6 O-2 + Ag0 b) Ecuaciones de oxido-reducción: 2 ( Ag +1 + 1e- → Ag0 ) reducción (La Ag se reduce, es un agente oxidante) Cu0 → Cu2+ + 2e- oxidación (El Cu se oxida, es el agente reductor) ---------------------------------------------2 Ag+1 + 2e- + Cu0 → 2Ag0 + Cu2+ + 2e(multiplicamos por 2 para igualar cantidad de electrones transferidos) c) Trasladamos los coeficientes a la ecuación original 2AgNO3 + Cu → Cu(NO3)2 + 2 Ag 6) Iguala la ecuación mediante el método de oxido-reducción K2CrO4 + AgNO3 → Ag2CrO4 + KNO3 7) Lo mismo que en el punto anterior: FeI2 + I2 → FeI3 ¿Cuándo un elemento oxida a otro? Un elemento puede oxidar a otro según la mayor o menor tendencia que tenga a ceder electrones. Este comportamiento puede predecirse conociendo los potenciales de oxidación de los elementos químicos (medidos en Volt). En la siguiente tabla de Potenciales de oxidación (también llamada serie electroquímica), se expresan los potenciales (comparados con el potencial de oxidación del Hidrógeno, que es cero). hemirreacciones + - Li ↔ Li + e K ↔ K+ + e Ca ↔ Ca2+ + 2eNa ↔ Na+ + eMg ↔ Mg 2+ + 2eAl ↔ Al3+ + 3eZn ↔ Zn2+ +2eFe ↔ Fe2+ + 2eCr ↔ Cr2+ + 2eNi ↔ Ni2+ + 2eSn ↔ Sn2+ + 2ePb ↔ Pb2+ + 2eH2 ↔ 2H+ + 2eCu ↔ Cu2+ + 2e2I- ↔ I2 + 2eAg ↔ Ag+ + e2Br- ↔ Br2 + 2e2Cl- ↔ Cl2 + 2eAu ↔ Au3+ + 3e2F- ↔ F2 + 2e- Volt +3,05 +2,93 +2,87 +2,71 +2,37 +1,66 +0,76 +0,44 +0,41 +0,25 +0,14 +0,13 0,00 -0,34 -0,54 -0,79 -1,09 -1,36 -1,51 -2,87 Un elemento desplazará a otro elemento en una reacción química, si tiene mayor potencial de oxidación que él, es decir, si está por arriba de él en la tabla. 1) Por ejemplo, el Mg desplazará al Fe en la siguiente reacción: Mg + FeSO4 → MgSO4 + Fe El Mg se oxida Mg0 → Mg2+ + 2eEl Mg tiene potencial de oxidación +2,37 mientras que el Fe tiene potencial de oxidación +0,44. La diferencia de potenciales es de 1,93: esto significa que el Mg tiene más facilidad para ceder sus electrones externos (y oxidarse) . Esos electrones serán captados por el catión Fe2+ 2) Pero la reacción “contraria”, no ocurrirá Fe + MgSO4 → No hay reacción 3) En el caso de la reacción Mg + CuSO4 → MgSO4 + Cu Ocurre con facilidad, ya que la diferencia de potenciales entre el Mg y el Cu es 3,11 (+2,37 – (-0,34)) = +2,37 + 0,34 = 3,11 ALGUNAS CUESTIONES PARA PENSAR……. a) ¿Cuál de estas reacciones sucederán?. Justifique 1) AgNO3 + Cu → 2) CuSO4 + Ag → ¿? ¿? Respuesta: La primera sucederá, pues el Cu tiene mayor potencial de oxidación. Por eso no deben guardarse sales de Ag en recipientes de Cobre. El Cu se oxida La Ag se reduce Ag+1 Cu0 → Cu2+ + 2e+ 1e- → Ag0 b) La plata, el oro y el platino son resistentes a la oxidación…..Por eso se utilizan en orfebrería. Explique este hecho usando los potenciales de oxidación. c) Se desea preparar un recipiente para guardar una solución de sulfato de cobre (II). ¿Cuáles de los siguientes metales puedes emplear: cinc, plomo, hierro o plata? d) En la reacción entre nitrato de plomo y cinc, ¿cuál es el elemento que cede electrones?. ¿Cuál los gana?. Plantee e iguale la ecuación e) Explique por qué se indica no dejar los alimentos preparados en ollas de aluminio. f) Investigue qué proceso químico es una corrosión. g) Complete en la línea punteada la palabra que corresponda: Transformación química en la cual los átomos o iones ganan electrones…………………… Sustancia que realiza la oxidación de otra…………………………………….. Reacción química en la cual los átomos o iones ceden electrones …………………………… Sustancia que produce la reducción de otra………………………………… Número que indica la carga eléctrica que tiene un átomo en un compuesto…………………