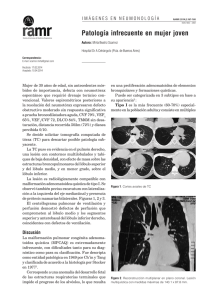
revista colombiana de revista colombiana de
Anuncio

REVISTA COLOMBIANA DE NEUMOLOGÍA ISSN - 0121 - 5426 VOLUMEN 24 No. 2 TARIFA POSTAL REDUCIDA No. 962 EN ESTA EDICIÓN: Editorial Historia de la Cirugía de Tórax en el Hospital Universitario San Ignacio. Página 51 Artículos de revisión Avances en la selección de donantes para el trasplante pulmonar. Página 54 Artículos originales Proyecto de un registro institucional de cirugía de tórax. Página 70 Presentación de casos Página 95 Osteomielitis costal por Cryptococcus neoformans en pacientes inmunocompetentes en el Hospital Universitario Fundación Santa Fe de Bogotá, Colombia. Reporte de 2 casos y revisión de la literatura. Página 92 PUBLICACIÓN OFICIAL DE VOLUMEN 24 No 2 revista colombiana de neumología VOLUMEN 24 No 2 CONTENIDO EDITORIAL • Historia de la Cirugía de Tórax en el Hospital Universitario San Ignacio.........................................................................51 Hernando Russi Campos, MD. REVISIÓN DE TEMAS • Avances en la selección de donantes para el trasplante pulmonar.................................................................................54 Ricardo Zapata González, Iker López Sánz, Cristina Berástegui García, Juan Sole Montserrat, Nuria Masnou Burrallo, María Deu Martín, Laura Romero Vielva, Alberto Jáuregui Aburalach, Antonio Román Broto, Mercedes Canela Cardona. • Nódulos pulmonares subsólidos: presentación de casos y estado actual.......................................................................63 Juan Carlos Varón Cotes, MD.; Luis Gerardo García-Herreros, MD. ARTÍCULOS ORIGINALES • Proyecto de un registro institucional de cirugía de tórax..................................................................................................70 Mauricio Velásquez Galvis, MD.; Jhon Harry Loaiza Guendica • Anestesia peridural con paciente despierto para cirugía de tórax....................................................................................76 Indira Fabiana Cujiño, MD.; Mauricio Velásquez, MD. • Cirugía toracoscópica unipuerto: experiencia en la Fundación Valle del Lili....................................................................80 Mauricio Velásquez Galvis; Andrés Fernando Domínguez Calero • Experiencia diagnóstica de diez años del tumor neuroendocrino de pulmón en la Fundación Santa Fe........................84 de Bogotá: 2001 – 2010 Lucía Beatriz Taboada Barrios, MD.; Rocío del Pilar López Panqueva, MD.; Luis Gerardo García-Herreros Hellal, MD.; Deyanira González Devia, MD. PRESENTACIÓN DE CASOS • • Osteomielitis costal por Cryptococcus neoformans en pacientes inmunocompetentes en el Hospital............................92 Universitario Fundación Santa Fe de Bogotá, Colombia. Reporte de dos casos y revisión de la literatura Beatriz Espinosa; Luis Gerardo García-Herreros; Andrés Jimenez; Oscar Rivero Toxicidad pulmonar secundaria a bleomicina: reporte de caso y actualización clínica....................................................97 Javier Leonardo Galindo Pedraza, MD.; Plutarco García-Herreros Ochoa, MD., FCCP; Alfredo Saavedra Rodríguez, MD.; Edgar Alberto Sánchez Morales, MD. GLOSARIO RADIOLÓGICO • Signo de halo..................................................................................................................................................................102 Ana Manzano, MD.; Carlos Celis Preciado, MD. IMÁGENES EN BRONCOSCOPIA • Tumor carcinoide............................................................................................................................................................104 Alejandra Cañas, MD. revista colombiana de neumología VOLUMEN 24 No 2 CONTENTS EDITORIAL • History of thoracic surgery at San Ignacio University Hospital.........................................................................................51 Hernando Russi Campos, MD. TOPICS REVIEW • Advances in donor selection for lung transplantation.......................................................................................................54 Ricardo Zapata González, Iker López Sánz, Cristina Berástegui García, Juan Sole Montserrat, Nuria Masnou Burrallo, María Deu Martín, Laura Romero Vielva, Alberto Jáuregui Aburalach, Antonio Román Broto, Mercedes Canela Cardona. • Subsolid pulmonary nodules: presentation of cases and current state of the matter.......................................................63 Juan Carlos Varón Cotes, MD.; Luis Gerardo García-Herreros, MD. ORIGINAL ARTICLES • Project for an institutional registry of thoracic surgery......................................................................................................70 Mauricio Velásquez Galvis, MD.; Jhon Harry Loaiza Guendica • Epidural anesthesia in awake thoracic surgery................................................................................................................76 Indira Fabiana Cujiño, MD.; Mauricio Velásquez, MD. • Uniport thoracoscopic surgery: experience at the Fundación Valle del Lili......................................................................80 Mauricio Velásquez Galvis; Andrés Fernando Domínguez Calero • Ten years of experience in diagnosing neuroendocrine neoplasms of the lung at the Fundación Santa Fe de..............84 Bogotá: 2001 – 2010 Lucía Beatriz Taboada Barrios, MD.; Rocío del Pilar López Panqueva, MD.; Luis Gerardo García-Herreros Hellal, MD.; Deyanira González Devia, MD. CASE REPORTS • Cryptococcal rib osteomyelitis in immunocompetent patients at the Hospital Universitario Fundación Santa Fe de.......92 Bogotá, Colombia. Report of 2 cases and review of the literature Beatriz Espinosa; Luis Gerardo García-Herreros; Andrés Jimenez; Oscar Rivero • Pulmonary toxicity secondary to bleomycin: report of a case and clinical update............................................................97 Javier Leonardo Galindo Pedraza, MD.; Plutarco García-Herreros Ochoa, MD., FCCP; Alfredo Saavedra Rodríguez, MD.; Edgar Alberto Sánchez Morales, MD. RADIOLOGIC GLOSSARY • Halo sign.........................................................................................................................................................................102 Ana Manzano, MD.; Carlos Celis Preciado, MD. IMAGES IN BRONCHOSCOPY • Carcinoid tumor..............................................................................................................................................................104 Alejandra Cañas, MD. EDITORIAL Historia de la Cirugía de Tórax en el Hospital Universitario San Ignacio Palabras pronunciadas durante la celebración de los 35 años de la Unidad de Neumología del Hospital Universitario San Ignacio, noviembre 10 de 2012, Bogotá. Debo expresar mi gratitud a los directivos de la Sociedad Colombiana de Neumología y a los organizadores del presente congreso por la oportunidad de presentar ante este auditorio una reseña de la evolución histórica del Servicio de Cirugía de Tórax del Hospital Universitario San Ignacio (HUSI). A manera de coincidencia, el HUSI y el Hospital Santa Clara fueron fundados en 1942, por lo cual ambas instituciones cumplen setenta años de ejemplar funcionamiento. El HUSI, de carácter privado y a la vez privado de asistencia gubernamental, fue concebido por iniciativa del Padre Félix Restrepo SJ., en asocio con padres de familia y médicos, con el fin de dotar a la Facultad de Medicina de la Universidad Javeriana de un centro médico para la práctica de sus estudiantes de pregrado. El Hospital Santa Clara nació por iniciativa de la gran sensibilidad humana y social de doña Lorencita Villegas de Santos, entonces esposa del Presidente de la República Eduardo Santos, impresionada por la difícil situación médica y humana de los pacientes afectados por tuberculosis en Bogotá y en el resto del país. El HUSI ha mantenido una creciente y a la vez estable evolución hacia la expansión física, apertura a las necesidades de la ciudad de Bogotá y del país, y un desarrollo tecnológico de los más avanzados disponibles en Colombia. El Hospital Santa Clara mantuvo un perfil inicial de sanatorio antituberculoso con una infraestructura pintoresca de pequeña casa villadiega, donde parecía imposible que en “una casita de campo” el Doctor Pearson, Jefe de Cirugía de Tórax del Hospital General de Toronto, encontrara tres pacientes operados de resección de tráquea. El hospital cambió su naturaleza de sanatorio antituberculoso a hospital general, ampliando las especialidades médicas y quirúrgicas para poder brindar atención a las comunidades del sur de la ciudad de Bogotá. Desde su fundación el Hospital Santa Clara ha mantenido un Departamento de Cirugía de Tórax de gran calidad científica y técnica. Los cirujanos pioneros practicaron intervenciones a nivel pleural como parte del manejo de la tuberculosis a través de la colapsoterapia. En 1948 se practicó la primera neumonectomía con la asesoría técnica y científica de cirujanos extranjeros. Estas inquietudes por la cirugía de tórax fueron acogidas por varios cirujanos como el Doctor José Pablo Leyva, quien recibió entrenamiento en las técnicas modernas de resección pulmonar. El Doctor Leyva fue vinculado como profesor de cirugía de la Universidad Javeriana a comienzos de los años 50. Dos brillantes cirujanos regresaron al país en los años 1953 y 1954, los Doctores Gilberto Rueda Pérez y Camilo Schrader Fajardo, después de recibir su entrenamiento en cirugía de tórax en prestigiosas universidades de los Estados Unidos de América. De inmediato asumieron su liderazgo en la orientación y práctica de la cirugía de tórax en el Hospital Santa Clara. Su especial emulación en los ateneos quirúrgicos del hospital, creó un ejemplar espíritu de controversia, con altura científica y alusiones personales recíprocas con gran simpatía y sentido humano como obstinados contradictores. 51 Revista Colombiana de Neumología Volumen 24 Número 2 El Doctor Camilo Schrader fue médico egresado de la Universidad Javeriana, formando parte de sus primeras generaciones. Desde su regreso del exterior permaneció en el Hospital Santa Clara con una dedicación y compromisos inigualables hacia la institución y su especialidad quirúrgica. Fue un profesor incondicional y ejemplar y no puedo menos que reconocer lo abrumador e incondicional de sus cualidades científicas y personales. Su inmenso orgullo por ser egresado de la Universidad Javeriana, le permitió ser vinculado en 1962 como profesor de cirugía de tórax de su alma máter. Simultáneamente, desde su consultorio privado en el HUSI derivaba pacientes para ser operados con gran celo y maestría quirúrgica, cualidades que hoy todavía recordamos con gran vigencia. Gracias a su generosidad, quien habla para ustedes fue nombrado Profesor de Cirugía de la Universidad Javeriana en 1976 por el Doctor Alberto Escallón, quien ejercía como Decano de la Facultad de Medicina. De manera casi simultánea emergió en la escena quirúrgica del hospital otro gran profesor y estudioso inigualable, el Doctor Assaad Matuk, quien con su bagaje intelectual y su formación moderna en uno de los centros quirúrgicos más prestigiosos de Nueva York, practicó las más complejas cirugías del tórax, como resecciones y reconstrucciones de tráquea. Recuerdan sus alumnos y contemporáneos que en su rigor disciplinario y académico, les exigía pasar revista del servicio los días domingos a la seis de la mañana. Podríamos suponer que existiera por parte del Doctor Matuk una compensación por su descanso sabatino. Es evidente que desde su comienzo la cirugía de tórax se implantó en el HUSI con los más altos estándares de calidad científica y complejidad técnica, gracias al aporte simultáneo, aunque no siempre coordinado, de estos dos pioneros. La creación de la especialidad de Cirugía de Tórax en el Hospital Santa Clara por iniciativa y tesón del Doctor Fidel Camacho con el respaldo académico y legal de la Universidad El Bosque en 1988, permitió la formación de una generación de brillantes cirujanos de tórax, de quienes universidades y hospitales de alto nivel del país dan fe de su solvencia profesional. Esta iniciativa hizo que nuevos líderes de la cirugía de tórax le dieran aliento y perpetuidad a nuestro oficio. Al retirarse el Doctor Schrader del Hospital Santa Clara en 1991, continuó formando cirujanos de tórax en el Instituto Nacional de Cancerología. Uno de ellos, la Doctora Stella Isabel Martínez, dirige en la actualidad el Servicio de Cirugía del Hospital Santa Clara y es la responsable de la orientación de las nuevas generaciones de cirujanos de tórax. El Doctor Schrader se retiró del HUSI en 1997. El supremo designio lo invitó a ejercer su oficio y a compartir con los elegidos en el más allá el 18 de marzo de 1998. En 1995 se vinculó al Servicio de Cirugía de Tórax el Doctor Mauricio Peláez Arango, trayendo consigo una revitalización de la cirugía de tórax en el HUSI. El Doctor Peláez es médico egresado de la Universidad del Rosario, especialista en Cirugía General de la misma universidad con sede en el Hospital San José, y Cirujano de Tórax de la Universidad El Bosque con sede en el Hospital Santa Clara. Complementó su formación con especializaciones en cirugía de la vía aérea y técnicas de resección toracoscópica con láser en Filadelfia, con el Doctor Larry Kaiser. El Doctor Peláez fue Jefe del Departamento de Cirugía del HUSI, siendo el primer cirujano egresado de otra universidad y a la vez cirujano de tórax, que ocupara tal cargo. Logró el Doctor Peláez rehabilitar un equipo láser destinado a otro servicio quirúrgico y emplearlo en procedimientos endoscópicos de resección en la vía aérea. Hizo un receso en su vinculación al HUSI, mientras adelantó una especialización más en cirugía vascular, circunstancia que satisface una de sus aficiones quirúrgicas. Confió que se constituya en una afortunada consonancia para con la cirugía de tórax. En 1997 se unió al Departamento de Cirugía del HUSI el Doctor Gerardo García Herreros, egresado de la Universidad Javeriana, especialista en Cirugía General del HUSI y cirujano de tórax del Hospital Santa Clara. Junto con el Doctor Peláez cimentaron el relevo generacional que la ausencia de los Doctores Schrader y Matuk propiciaron. En la actualidad el Doctor García Herreros ejerce como Jefe del Departamento de Cirugía de la Fundación Santa Fe de Bogotá. La más reciente vinculación la constituyó el Doctor Andrés Eduardo Jiménez, médico egresado de la Universidad Militar Nueva Granada, cirujano general del Hospital Militar Central, y cirujano de tórax del Hospital Santa 52 Historia de la Cirugía de Tórax en el Hospital Universitario San Ignacio. Russi Clara. Recibió entrenamiento adicional en vía aérea en Barcelona y en trasplante de pulmón. Demostró gran solvencia técnica, en especial en la cirugía toracoscópica y en la instrumentación endoscópica de la vía aérea. Durante su permanencia en el hospital implantó un marcapaso diafragmático para tratar una paciente con apnea de origen central. El Doctor Diego Pardo, médico, cirujano general de la Universidad Javeriana y de tórax del Hospital Santa Clara, y residente en Barranquilla, prestó su valiosa asesoría en la implantación del dispositivo. Quien se dirige a Ustedes se vinculó al Servicio de Cirugía de Tórax del HUSI en 2001, después de laborar en el Hospital Santa Clara durante 26 años. La generosidad del Doctor Saúl Rugeles como Jefe del Departamento de Cirugía y del Doctor Peláez, me han permitido continuar ejerciendo la cirugía de tórax con más de 35 años de oficio ininterrumpido. Esta apertura de la Universidad Javeriana y del Hospital San Ignacio representada en la vinculación de los cirujanos mencionados, complementada con una incesante dotación de tecnología moderna, han permitido mantener al Servicio de Cirugía de Tórax dentro de un gran nivel técnico y científico. Se ha incrementado el número de procedimientos y su complejidad. Los cirujanos generales en formación tienen una experiencia creciente en cirugía de tórax. Se creó la unidad de vía aérea como grupo multidisciplinario liderada por la Doctora Alejandra Cañas Arboleda como neumóloga y especialista en vía aérea con formación en Pensilvania, el Doctor Camilo Ospina como otorrinolaringólogo pediatra y especialista en vía aérea en niños, el Doctor Luis Humberto Jiménez como otorrinolaringólogo y especialista en vía aérea de adultos y el Doctor Mauricio Peláez como cirujano de vía aérea y especialista en procedimientos intervencionistas. En la actualidad el Servicio de Cirugía de Tórax mantiene contacto permanente con la mayoría de los servicios médicos y quirúrgicos del hospital, en especial con el Servicio de Neumología con quienes existe retroalimentación y apoyo diarios. Está a punto de ver la luz un trabajo compartido que recoge la experiencia del hospital en la práctica de biopsias de pulmón. Se colabora con el Servicio de Ortopedia y Neurocirugía en el abordaje de la cirugía de columna torácica dentro de un protocolo rotulado como “corpectomía mínimamente invasiva videoasistida”, técnica pionera en nuestro medio. Este trabajo científico ha recibido reconocimiento internacional en las presentaciones sostenidas por los neurocirujanos, doctores Díaz y Berbeo. El Departamento de Cirugía, en cabeza del Doctor Saúl Rugeles, se ha hecho presente en los últimos congresos nacionales de cirugía, con trabajos originados en la Unidad de Cirugía de Tórax. Con el Departamento de Pediatría se coopera en el área de oncología y lesiones congénitas. Existe una creciente solicitud de valoraciones y procedimientos de la Unidad de Cuidados Intensivos, de donde se origina un número importante de procedimientos diagnósticos y terapéuticos. En asocio con el Doctor Peláez y quien se dirige a ustedes, mantenemos la disposición y responsabilidad en la conducción de la Unidad de Cirugía de Tórax; al mismo tiempo aspiramos a corresponder a la confianza de nuestros pacientes y de las directivas del Hospital. Debo finalizar la presente reseña con una felicitación y reconocimiento fraternal a los colegas neumólogos del Hospital San Ignacio, a los médicos residentes titulares y en pasantía, al personal de enfermería, a los terapistas y personal administrativo con motivo del aniversario número 35 de la creación de la Unidad de Neumología. Continuamos deseosos y expectantes por el progreso de la Unidad. Sin su presencia e invitación incesante a compartir las patologías comunes con nuestra especialidad, el progreso de la Unidad de Cirugía de Tórax sería espectral. Gracias Hernando Russi Campos, MD. Cirujano de Tórax. Departamento de Cirugía. Hospital Universitario San Ignacio, Bogotá. 53 Revista Colombiana de Neumología Volumen 24 Número 2 REVISIÓN DE TEMAS Avances en la selección de donantes para el trasplante pulmonar Advances in donor selection for lung transplantation Ricardo Zapata González(1), Iker López Sanz(1), Cristina Berastegui Garcia(2), Juan Sole Montserrat(1), Nuria Masnou Burrallo(3), María Deu Martín(1), Laura Romero Vielva(1), Alberto Jauregui Aburalach(1), Antonio Román Broto(2), Mercedes Canela Cardona(1). RESUMEN La obtención de donantes pulmonares válidos continúa siendo un reto en el trasplante pulmonar. En los centros trasplantadores con larga trayectoria, una de las opciones que ha permitido aumentar el número de trasplantes pulmonares por año, ha sido la extensión de los criterios de aceptabilidad para los donantes. En este artículo se hace un repaso minucioso de cada criterio por separado y de la posible influencia en los resultados del trasplante a corto y largo plazo; igualmente, se revisan los datos actuales de donación y trasplante en España. Palabras clave: trasplante, donante, selección. ABSTRACT Getting valid lung donors continues to be a challenge in lung transplantation. At experienced transplantation centers, an option that has increased the number of pulmonary transplantations per year has been the extension of the criteria for donor acceptability. In this review, we carefully examine each criterion and its possible influence on the short- and long-term results of transplantation. We also review current data on donation and transplantation in Spain. Keywords: lung trasplant, donor, selection. Rev Colomb Neumol 2013; 24 (2):54-62 INTRODUCCIÓN En 1963, el grupo de Hardy de la Universidad de Missisipi, en Estados Unidos, fue el primero en reportar un trasplante pulmonar en humanos, si bien el paciente falleció a los 18 días por insuficiencia renal aguda. Posteriormente, en 1983, en el Hospital de Toronto, debido a la introducción de la ciclosporina como inmunosupresor, junto a las mejoras de la técnica quirúrgica, las medidas de preservación de los órganos y el refinamiento de los criterios de selección de los donantes, se realizó el primer trasplante pulmonar en humanos con supervivencia a largo plazo. En España la actividad trasplantadora comenzó en la década de los 90, realizándose el primer trasplante con éxito en 1990 en el Hospital Vall d’Hebron de Barcelona (1-3). A partir de este momento el trasplante pulmonar ha ganado terreno en el tratamiento de estas enfermedades pulmonares en fase terminal (4, 5), incrementando de forma progresiva, a partir del año 2000, el número de trasplantes anuales realizados y mejorando progresivamente las tasas de morbilidad y mortalidad (6-8). Según los datos de la ISHLT (International Society for Heart and Lung Transplantation), en 2009 se realizaron 3.272 trasplantes pulmonares en el mundo, siendo éste el mayor número de trasplantes reportados hasta la fecha, con predominio de los bipulmonares respecto a los unipulmonares (8). La obtención de donantes pulmonares para mantener listas de espera aceptables es todo un reto para Servicio de Cirugía Torácica, Hospital Vall d’Hebron, Barcelona. Servicio de Neumología, Hospital Vall d´Hebron, Barcelona. (3) Dirección y coordinación de Trasplante, Hospital Vall d’Hebron. (1) (2) Correspondencia: Dr. Ricardo Zapata González. Correo electrónico: rzapata@vhebron.net Recibido: octubre 12 de 2012. Aceptado: noviembre 12 de 2012. 54 Avances en la selección de donantes para el trasplante pulmonar. los programas de trasplante pulmonar debido a que el número de donantes multiorgánicos se ha mantenido estable, sumado a que el pulmón es el órgano más lábil a los cambios asociados a la muerte encefálica por sí misma, al hecho de que es un órgano que está en contacto con el exterior y a que es el de más difícil conservación (de los potenciales donantes multiorgánicos, sólo 15% – 20% son donantes reales de pulmón) (9). Los donantes provienen de tres posibles fuentes: 1. Donantes vivos para trasplantes lobares (10-12), técnica con poca aceptación global y que prácticamente se utiliza sólo en Japón. 2. Donantes a corazón parado, técnica que ha ido ganando aceptación, pero cuyo aporte global al número de donantes es limitado, siendo entre los años 2002 a 2009, responsable de aproximadamente 6,7% de los trasplantes pulmonares en España (13, 14). 3. Donantes en muerte encefálica, técnica de donde proviene la mayoría de injertos pulmonares; hoy se observa un incremento progresivo del número de donantes que llegan a muerte encefálica por enfermedad cerebrovascular, lo que genera que tanto la edad como otros factores asociados al propio donante varíen. Este hecho se conoce como cambio en el perfil de donante: más añoso, más comorbilidades y más patología cerebrovascular como causa de muerte encefálica (15, 16). Es en este último grupo de donantes donde los grandes centros trasplantadores han extendido los criterios de donación para incrementar de forma significativa el número de trasplantes (17-20). DEL DONANTE IDEAL AL DONANTE CON CRITERIOS EXPANDIDOS Los criterios tradicionales para la aceptación de los donantes de pulmón se basan en datos de pequeñas series y reportes de casos de centros específicos realizados en los inicios del trasplante pulmonar, pero no existen estudios prospectivos, aleatorizados que sustenten los criterios tradicionales para la elección de donantes. Los criterios clásicos adoptados para la validez de los donantes son: • • • • Edad menor a 55 años. Compatibilidad ABO. Radiografía de tórax normal. Intercambio gaseoso correcto (PaFiO2 > 300). Zapata y cols. • • • • • No traumatismo torácico. No evidencia de aspiración. Tinción de gram en esputo negativa. Broncoscopia normal. Tabaquismo menor a 20 paquetes/año. Otros factores a tener en cuenta a la hora de aceptar o rechazar un donante son la causa de muerte, el tiempo de ventilación mecánica previo a la donación, el tiempo de isquemia previsible, la historia de cáncer y las comorbilidades (21, 22). De otra parte, el concepto de donante pulmonar óptimo ha ido evolucionando a lo largo de los últimos veinte años de historia del trasplante pulmonar. En Inglaterra, sólo 41% de los pacientes en lista de espera son trasplantados en un año (23); en España, 90% de los pacientes que entra en lista de espera, recibirá un trasplante en los primeros dos años (24); en Estados Unidos la situación es más crítica, con más de 4.000 pacientes en lista de espera, sólo uno de cada cuatro recibirá un pulmón en el próximo año, otro morirá en lista y dos más permanecerán en lista al finalizar el año (25). Visto así el problema, es una preocupación de las autoridades sanitarias y de la comunidad científica internacional ver cómo se puede aumentar el número de donantes. Cabe preguntarse entonces si los llamados criterios “ideales” son adecuados para una actividad trasplantadora eficiente. En otras palabras, es posible que donantes no considerados “óptimos”, deberían re-evaluarse y considerarse como donantes adecuados. Es así como en los últimos diez años, se ha mejorado en la selección de donantes, en el tratamiento del potencial donante, extendiendo los criterios de aceptación, lo que se ha traducido en un aumento marcado de la actividad trasplantadora a pesar de un número relativamente estable de donantes (26). Edad del donante Tradicionalmente, el donante ideal era aquel menor de 55 años (9, 17, 21), sin embargo, en los últimos años este concepto se ha revaluado, observando que los pulmones de donantes mayores pueden ser trasplantados de forma exitosa (27, 28). Los pulmones de los donantes mayores tienen mayor susceptibilidad teórica a las neoplasias, las infecciones y los cambios enfisematosos por tabaco. Así mismo, su sistema inmune es menos reactivo, por lo que en teoría generarían menor estímulo inmunógeno. Se han realizado varias revisiones retrospectivas con el fin de valorar el uso de donantes mayores, encontrándose tanto en los análisis univariantes como multivariantes, 55 Revista Colombiana de Neumología que la edad no es un factor predictor de supervivencia a corto y largo plazo cuando se analiza de forma independiente (29-31). No obstante, al asociar edad mayor a 55 años con tiempo de isquemia prolongado (más de seis horas), existe mayor incidencia de morbilidad temprana y menor supervivencia. Esto también se ha reflejado en los resultados globales cuando se asocia edad mayor a 55 años y volumen bajo de trasplante en el centro (32, 33). Según el registro internacional, la edad media de los donantes en 2010 fue de 37 años, encontrándose un incremento de los donantes mayores de 50 años; los donantes mayores de 60 años representaron aproximadamente 10% del total de los donantes actuales (15). En Cataluña la edad media de los donantes en 2010 fue de 44 años, con un rango de 13 a 70 años. Se realizó un análisis retrospectivo observacional de 116 trasplantes consecutivos, entre enero de 2007 y mayo de 2009, en el Hospital Vall d’Hebron, donde se dividieron dos grupos de pacientes, uno con donantes mayores de 60 años (n: 19 receptores, media 63 años; r: 60-70) y otro con donantes menores de 60 años en receptores mayores de 50 años para tener una muestra homogénea en cuanto a la edad de los receptores. La morbilidad en ambos grupos fue similar, sin encontrarse diferencia estadísticamente significativa en cuanto a la tasa de reintervención por sangrado, disfunción primaria del injerto, rechazo agudo e infección respiratoria. En lo concerniente a la estancia en la unidad de cuidad intensivo (30 días vs. 21 días, respectivamente) y la estancia hospitalaria (52 días vs. 37 días, respectivamente) la diferencia no fue estadísticamente significativa. Igualmente, no se encontró diferencia significativa entre la mortalidad a 30 días (10,9% vs. 0%) y la mortalidad durante la estancia hospitalaria (15% vs. 10%). Los donantes mayores deben considerarse adecuados siempre y cuando su valoración se haga de forma individualizada, siendo excluidos para receptores de alto riesgo, cuando se prevé un tiempo de isquemia prolongado o cuando el centro tiene un bajo volumen de trasplante. Una buena alternativa es considerar el emparejamiento conocido con el término inglés “old for old”. Gases arteriales El valor del cociente PaO2/FiO2 (PaFi) de 300, es un valor teórico que se asignó de forma arbitraria como margen de seguridad, sin estar basado en ningún hallazgo científico. 56 Volumen 24 Número 2 Si se revisa la experiencia de los grupos trasplantadores y los diferentes registros internacionales, se verá que rara vez se encuentra un donante con una PaFi > 600. Por lo tanto, el valor medio de 300 mm Hg podría considerarse como una cifra orientadora. A lo largo de los años se han observado diferentes resultados contradictorios en la literatura. Shumway y colaboradores, describen 25 receptores de donantes con PaFi de 250 sin efectos adversos a los 18 meses (34). Sundaresan describe seis donantes marginales con PaFi menor a 300, sin encontrar diferencias en cuanto a la estancia en la unidad de cuidado intensivo, ventilación mecánica y supervivencia global (35). Thabut y colaboradores encuentran en su estudio multicéntrico, que una PaFi por debajo de 300 se relaciona con peor intercambio gaseoso en las primeras seis horas postrasplante, mayor tiempo de ventilación mecánica y peor supervivencia a largo plazo (36). La PaFi puede verse afectada por diversos factores como el gradiente A-a de oxígeno, el edema pulmonar neurogénico, el embolismo graso o el tromboembolismo pulmonar, de los cuales los dos primeros son potencialmente manejables y recuperables. En la serie de Gabbay y colaboradores, el manejo activo del donante permitió que 20 de 59 donantes con PaFi < 300 se pudieran recuperar para el trasplante, sin afectar la estancia en la unidad de cuidados intensivos ni la supervivencia a corto y medio plazo (37). Finalmente, la medición de la PO2 directamente de las venas pulmonares es adecuada y válida para verificar el intercambio gaseoso de un donante con una PaFi límite (38). En conclusión, puede decirse que aunque la literatura es contradictoria y no hay acuerdo, un mal intercambio gaseoso en el donante, traducido en mala gasometría a la hora de la extracción, no atribuible a causas reversibles, se convierte en un aumento de la mortalidad del receptor. Radiografía de tórax La radiografía de tórax da una idea del estado de hidratación del pulmón del paciente, grado de contusión o de infección, grado de insuflación (dependiente de parámetros del ventilador), simetría de ventilación en función de la colocación del tubo orotraqueal y micro-macro atelectasias. Nuevamente, en este aspecto hay poca evidencia o guías sobre los hallazgos tolerables en la radiografía para elegir un potencial donante. Avances en la selección de donantes para el trasplante pulmonar. Otro aspecto muy importante a considerar es la variabilidad interobservador que se puede evidenciar en la lectura de una radiografía de tórax que, en opinión de algunos autores, hace que desempeñe un papel poco relevante a la hora de elegir un donante concreto (39). En resumen, la radiografía de tórax es una herramienta útil para ayudar a la adecuada conservación de los pulmones, ya que permite guiar el manejo activo y valorar la respuesta al tratamiento de las atelectasias y del edema pulmonar (34, 40). Colonización bacteriana e infecciones El tiempo de ventilación mecánica está directamente relacionado con la colonización bacteriana del árbol traqueobronquial y el riesgo de neumonía asociada al ventilador (41). Las circunstancias de la intubación, más o menos electiva, y la sospecha de broncoaspiración, se deben tener en cuenta a la hora de valorar un injerto pulmonar. Eso obliga a iniciar profilaxis antibiótica precoz (incluso antes de la muerte encefálica) para evitar las neumonías, aunque no siempre se pueden evitar las traqueítis. Algunos equipos trasplantadores abogan por la realización sistemática de broncoscopia para la evaluación de las secreciones traqueobronquiales y la toma de muestras. El hallazgo de una mucosa inflamada - eritematosa y secreciones purulentas es un factor de exclusión para muchos equipos (42, 43). En diferentes series de trasplantes, tanto cardiacos, cardiopulmonares como pulmonares, se ha observado una prevalencia de bacterias en el aspirado traqueal hasta en 80% de los donantes. Los microorganismos más aislados son: Staphylococcus, Candida y Haemophylus (44-47). De acuerdo con los reportes de la ISHLT, la neumonía bacteriana es una las principales causas de morbi – mortalidad temprana e intermedia en el trasplante pulmonar. Sin embargo la presencia de una tinción de gram positiva en el donante, no necesariamente predice la infección del receptor; de hecho, la neumonía de un lado, no contraindica la donación del pulmón contralateral. Con la introducción de la antibioticoterapia profiláctica de amplio espectro tanto en los donantes como en los receptores, hoy en día es poco frecuente que se rechacen pulmones por la presencia de bacterias en el aspirado traqueal (15, 48). Una excepción es la presencia de bacterias particularmente virulentas y resistentes como Burkholderia, Mycobacterias o Pseudomonas abscesus, las cuales se relacionan con alta morbi – mortalidad postoperatoria (25, 36, 49). Zapata y cols. El uso de donantes infectados con el virus de la hepatitis B y C sigue siendo un tema controversial, con poco soporte en la literatura y opiniones encontradas. Una opción razonable es utilizar donantes positivos para el virus C en receptores igualmente positivos (50, 51). Previo a la terapia antirretroviral, los pacientes infectados por el virus de la inmunodeficiencia adquirida humana (VIH), no se consideraban candidatos a trasplante de órganos sólidos, dado su pobre pronóstico y el efecto negativo de la inmunosupresión en la replicación del virus. Sin embargo con la introducción y mejora progresiva de dicha terapia, los resultados a corto y largo plazo en el trasplante de hígado y riñón son muy alentadores. Aunque hoy en día la infección por el VIH es una contraindicación formal para el trasplante pulmonar, ya se han empezado a publicar trasplantes de otros órganos con resultados alentadores a corto y mediano plazo. Tabaquismo En la literatura actual no se demuestra una influencia negativa en la supervivencia a corto y mediano plazo en cuanto a los donantes con historia de tabaquismo y la evolución a largo plazo del receptor (22, 52-54). Está claramente identificado que un factor de exposición mayor a 20 paquetes/año se considera como tabaquismo importante y es un factor de riesgo claro para EPOC, cáncer de pulmón y patología cardiovascular (55, 56). Con base en estos datos se ha puesto este límite para definir un tabaquismo tolerable en el donante, haciendo que los donantes con factores mayores a 20 paquetes/año, se consideren como donantes con criterios extendidos. Uno de los potenciales riesgos de aceptar donantes con una historia importante de tabaquismo, es el desarrollo de cáncer de pulmón en el receptor, sin embargo, en la literatura, suele ser más frecuente encontrar casos de carcinoma broncogénico en el pulmón nativo de los trasplantes unilaterales, que en el pulmón injertado (57, 58). Historia de cáncer El cáncer del donante más trasmitido es el carcinoma renal, seguido por el carcinoma pulmonar, el melanoma, el coriocarcinoma y el cáncer de mama. Lo ideal es tener un donante sin historia previa de cáncer; sin embargo, en caso de existir dicho antecedente, se puede considerar válido en caso que exista un periodo libre de enfermedad de diez años. Un antecedente de melanoma es una contraindicación absoluta para la donación. 57 Revista Colombiana de Neumología Algunas excepciones a esta indicación las constituyen el carcinoma in situ de cérvix, el feocromocitoma, la neoplasia de próstata estadios I y II y el cáncer de colon estadio I correctamente tratado, en cuyo caso se pueden considerar periodos menores libres de enfermedad. Las neoplasias de bajo grado de piel y el carcinoma renal menor a 4 cm no requieren periodos libres de enfermedad (59, 60). En el registro de la ONT la frecuencia de donantes con tumor no detectado en los últimos quince años ha sido del 6,1 por mil donantes. De estos donantes con tumor, sólo 5 (2,9 por 10.000 donantes) transmitieron el tumor al receptor. Sólo 10 receptores de los 155 que recibieron un injerto de un donante con tumor desarrolló transmisión tumoral (6,4%) (61, 62). Los tumores del sistema nervioso central son un caso especial, dada su baja frecuencia de metástasis extracraneales, pudiéndose utilizar como donantes excepto en los casos de radioterapia previa, craneotomía previa, derivación ventrículo peritoneal (que aumentan exponencialmente el riesgo de trasmisión) o alto grado histológico de la neoplasia, como los glioblastomas y los meduloblastomas. Cuando los donantes no están manipulados y están dentro de los tipos histológicos aceptados, pueden utilizarse siempre y cuando el receptor lo conozca y el equipo trasplantador lo acepte. (63, 64). Asma Hay poca literatura acerca de los donantes con historia de asma y la evolución postrasplante. Los resultados encontrados en la literatura son contradictorios; sin embargo, la historia de asma no severa, en pacientes estrictamente seleccionados no parece contraindicar la donación (22, 65). Ventilación mecánica El tiempo de ventilación mecánica en el donante en un factor de riesgo para desarrollar complicaciones postrasplante, como infecciones y/o colonizaciones por gérmenes resistentes, habiéndose descrito también en algunas series la relación entre la duración de la ventilación mecánica y la aparición de complicaciones de la vía aérea. Pese a ello, no existe suficiente evidencia para afirmar que el tiempo de ventilación mecánica del donante, como factor aislado, sea bastante para rechazar un donante (23, 66, 67). En el Hospital Vall d’Hebron, se realizó un estudio retrospectivo observacional de 164 trasplantes conse- 58 Volumen 24 Número 2 cutivos entre enero de 2007 y junio de 2010, donde se definieron como criterios marginales o extendidos: edad mayor a 60 años, tabaquismo mayor a 20 paquetes/año, intubación orotraqueal por más de cinco días, hallazgos anormales en la radiografía, secreciones purulentas y PaFi menor a 300. Según estas variables, se definieron tres grupos de pacientes: cero y un criterio marginal, dos y tres criterios marginales y más de tres criterios marginales. Se realizó un análisis comparativo, para evaluar los días de ventilación mecánica, los días de ingreso en la UCI, la mortalidad perioperatoria, la mortalidad durante el ingreso y la supervivencia a medio plazo. De 164 pacientes, 69% de los donantes tenía al menos uno de los criterios extendidos. No hubo diferencias estadísticamente significativas en cuanto a los días de ventilación mecánica, ni a los días de ingreso en la UCI entre los tres grupos. En cuanto a la mortalidad perioperatoria y durante el ingreso, tampoco se encontraron diferencias estadísticamente significativas. La mortalidad perioperatoria (30 días) fue de 12%, 4,5% y 0%, respectivamente. La supervivencia a mediano plazo (2 años), no fue significativamente diferente entre los tres grupos, siendo de 72%, 89% y 67%, respectivamente. Estrategias en la donación: tiempo de isquemia previsible El límite superior del tiempo de isquemia es un tema discutido, estableciéndose entre 6 y 8 horas, como tiempo máximo, según la mayoría de autores (68). Diferentes revisiones no han demostrado un incremento de la mortalidad cuando se analiza el tiempo de isquemia mayor a 6 horas como factor independiente (69, 70). Sin embargo, en publicaciones recientes, se toma hasta 8 horas como tiempo, sin cambios significativos en la supervivencia a corto plazo ni aumento de la disfunción primaria del injerto (18, 32, 66, 68). Un factor que posiblemente ha permitido dicho aumento en la isquemia previsible es la mejoría en los métodos de preservación en los últimos años (71, 72). Uno de los avances quizá más importantes en la actualidad en cuanto a la mejora en la preservación de órganos, es la introducción de la perfusión ex vivo, el concepto de reparación pulmonar y la posibilidad de máquinas portátiles para el transporte, acondicionamiento y preservación de los órganos donados. De acuerdo con la literatura, la perfusión ex vivo ha demostrado ser una herramienta útil para aumentar el número de donantes válidos si afectar la morbimortalidad de Avances en la selección de donantes para el trasplante pulmonar. Zapata y cols. los receptores (73-75). Estudios han demostrado que los pulmones tanto de animales como de humanos, pueden perfundirse por tiempos hasta de 12 horas, sin evidenciar aumento del edema, lo que abriría una nueva puerta, el acondicionamiento pulmonar pre trasplante y el concepto de reparación pulmonar, permitiendo aumentar los tiempos de isquemia previsibles, modificar las estrategias de ventilación/perfusión, el soporte metabólico y la remoción de toxinas (76-79). Experiencia del trasplante pulmonar en España Estrategias de emparejamiento: tamaño del injerto La historia del trasplante pulmonar en el Hospital Vall d’Hebron inicia en 1990; desde entonces se han realizado 606 trasplantes pulmonares hasta el año 2011, lo que representa 22,5% de todos los trasplantes en España, con resultados en cuanto a supervivencia a corto y largo plazo muy similares a los de las estadísticas del registro internacional. Es así como a la fecha el Hospital Vall d’Hebron es el principal centro trasplantador de España (84). El uso de injertos muy pequeños para la cavidad torácica se traduce en problemas a nivel del espacio pleural, con cámaras persistentes, drenaje pleural prolongado, mayor riesgo de infección y empiema. Por otro lado, un pulmón pequeño se traduce también en una menor red vascular pulmonar con la consecuente hipertensión pulmonar secundaria. Igualmente, la hiperexpansión del injerto genera una disminución de la “compliance” y un incremento del trabajo respiratorio. El uso de injertos demasiado grandes para la caja torácica, también genera problemas en el receptor, pues producen inestabilidad hemodinámica y taponamiento cardiaco al momento de cerrar la pared torácica. Por otro lado, también genera atelectasias persistentes, disfunción diafragmática y distorsión de la vía aérea por compresión del parénquima, que conlleva retención de secreciones e infecciones pulmonares (43, 80). Existen varias formas para asegurar una adecuada correspondencia entre los pulmones del donante y la caja torácica del receptor, entre los cuales destacan la TLC predicha (sigla en ingles de la capacidad pulmonar total) y la medida del pulmón en la radiografía de tórax (longitud cúpula diafragmática – ápice pulmonar y de seno a seno) (81). En nuestra institución, esta última es la de elección, con adecuados resultados en cuanto a la concordancia entre donante – receptor, con bajas tasas de resecciones pulmonares en el injerto (13% de resecciones). Es importante valorar en conjunto, teniendo en cuenta si es un trasplante pulmonar unilateral o bilateral, y si el receptor tiene EPOC o fibrosis, ya que estos datos influirán en la selección del donante con el fin de que su tamaño se ajuste al receptor. Si a pesar de una rigurosa selección, el injerto es demasiado grande para la caja torácica, se puede recurrir a la reducción de tamaño del injerto, realizándose una lobectomía o una resección menor según el grado de desproporción (82, 83). Según los datos de la ONT (Organización Nacional de Trasplante), en España se realizaron 219 trasplantes pulmonares en 2009, 235 en 2010 y 230 en 2011, lo que supone que desde 1990, se han practicado un total de 2.702 trasplantes de pulmón en España. La supervivencia global a cinco años del trasplante pulmonar en España es actualmente del 50%. De los 1.667 donantes generados en España durante 2011, 343 fueron aceptados como donantes pulmonares, extrayéndose finalmente los pulmones de 246. La edad media de los donantes pulmonares fue de 47,5 años, continuando la tendencia creciente de la edad de los últimos años. En las causas de muerte se observa el continuado descenso de los traumas craneoencefálicos por tráfico y el aumento del accidente cerebrovascular superando ya el 60% de las causas de muerte en los donantes pulmonares. El número de donantes cadavéricos en Cataluña sigue siendo una de las más elevadas del mundo, con 238 donantes válidos en 2011 (80% multiorgánicos) (Figura 1). La edad media de los donantes de cadáver válidos mayores de 14 años ha pasado de 51,7 años en el año 2000 a 56,8 años en 2011. En los donantes de pulmón, la edad media fue de 49,1 años durante 2011; el grupo de edad predominante en los donantes de pulmón por tercer año consecutivo fue el de 46-60 años. El porcentaje de obtención con relación al total de órganos ofrecidos en Cataluña varía según el tipo de órgano, siendo para pulmón de 17,1% del total de donantes válidos en muerte encefálica como donantes de pulmón (85). La tendencia a extender los criterios de los donantes se debe a la necesidad de obtener un mayor número de éstos para una lista de espera que cada día aumenta. Dicha tendencia comienza en el Hospital Vall d’Hebron hacia 2007, siendo la edad de los donantes, el tiempo de intubación, las infecciones y la historia de tabaquismo, los primeros criterios ampliados. 59 Revista Colombiana de Neumología Volumen 24 Número 2 Tasa (pmp) Cataluña 8,1 5,2 España 3,6 Alemania 13,6 Austria 10,6 Bélgica Finlandia Francia 4,1 4,0 Irlanda 2. Roman A, Morell F, Astudillo J, Margarit C, Bravo C, Tenorio L et al. Unilateral lung transplantation: the first 2 cases. Group of Lung Transplantation of the University General Hospital of the Vall d’Hebron. Med Clin (Barc). 1993; 100 (10): 380-383. 0,9 Italia 1,8 Noruega 6,5 Portugal 0,9 Reino Unido 3. Morell F, Astudillo J, Roman A. The lung transplant. Med Clin (Barc). 1993; 100 (14): 545-546. 2,6 4. Trulock EP. Lung transplantation. Am J Respir Crit Care Med. 1997; 155 (3): 789-818. 5,4 Suecia Suiza 6,3 Canadá 5. Arcasoy SM, Kotloff RM. Lung transplantation. N Engl J Med. 1999; 340 (14): 1081-1091. 5,3 EE.UU. 6. Garrido-Cantarero G, Matesanz-Acedos R. Epidemiology of transplantation in Spain. Enferm Infecc Microbiol Clin. 2007; 25 (1): 54-62. 5,6 0,0 Argentina 1,0 Brasil 7. Coll E, Santos F, Ussetti P, Canela M, Borro JM, De La Torre M et al. The Spanish Lung Transplant Registry: First Report of Results (2006-2010). Arch Bronconeumol. 2012. 0,3 5,5 Australia 2,8 Nueva Zelanda 0,0 3,0 BIBLIOGRAFÍA 1. Morell F, Roman A, Bravo C, Nicolau F, Marti S. The results of the evaluation of 208 patients referred in the first 4 years to a lung transplantation program. The Lung Transplantation Group of Hospital Vall d’Hebron. Arch Bronconeumol. 1996; 32 (6): 280-284. 2,8 Holanda México han permitido aceptar el reto. De este modo, se tiene la oportunidad de ofrecer una opción terapéutica a un mayor número de pacientes con enfermedades respiratorias terminales. 6,0 9,0 12,0 15,0 Fuente: registro catalán de trasplante. Figura 1. Comparación internacional de la tasa (pmp) de trasplante pulmonar, 2010. 8. Christie JD, Edwards LB, Kucheryavaya AY, Benden C, Dobbels F, Kirk R et al. The Registry of the International Society for Heart and Lung Transplantation: Twenty-eighth Adult Lung and HeartLung Transplant Report--2011. J Heart Lung Transplant. 2011; 30 (10): 1104-1122. 9. Weill D. Donor criteria in lung transplantation: an issue revisited. Chest. 2002; 121 (6): 2029-2031. 10. Date H, Aoe M, Nagahiro I, Sano Y, Andou A, Matsubara H et al. Living-donor lobar lung transplantation for various lung diseases. J Thorac Cardiovasc Surg. 2003; 126 (2): 476-481. A partir de 2007, la extensión de los criterios de los donantes es una de las causas que ha permitido aumentar el número de trasplantes por año de forma significativa, sin afectar la evolución a corto y largo plazo. En los en los últimos cinco años (2007 al 2011) se han realizado 255 trasplantes (media de 51 trasplantes por año), frente a 151 trasplantes (media de 30 trasplantes por año) de los cinco años previos (2002 a 2006). 11. Date H, Shiraishi T, Sugimoto S, Shoji T, Chen F, Hiratsuka M et al. Outcome of living-donor lobar lung transplantation using a single donor. J Thorac Cardiovasc Surg. 2012; 144 (3): 710-715. CONCLUSIONES 14. Gomez-de-Antonio D, Campo-Canaveral JL, Crowley S, Valdivia D, Cordoba M, Moradiellos J et al. Clinical lung transplantation from uncontrolled non-heart-beating donors revisited. J Heart Lung Transplant. 2012; 31 (4): 349-353. Dado el escaso número de donantes pulmonares, insuficiente para compensar el aumento de pacientes en lista de espera, los grandes centros trasplantadores con larga experiencia se han visto obligados a ampliar los criterios de aceptación de los donantes, como resultado de una adaptación al envejecimiento progresivo de los potenciales donantes y a unos resultados más que aceptables a corto y largo plazo que 60 12. Bando T, Date H, Minami M, Kondo T, Shiraishi T, Miyoshi S et al. First registry report: lung transplantation in Japan: The Japanese Society of Lung and Heart-Lung Transplantation. Gen Thorac Cardiovasc Surg. 2008; 56 (1): 17-21. 13. de Antonio DG, Marcos R, Laporta R, Mora G, García-Gallo C, Gamez P et al. Results of clinical lung transplant from uncontrolled non-heart-beating donors. J Heart Lung Transplant. 2007; 26 (5): 529-534. 15. Christie JD, Edwards LB, Kucheryavaya AY, Benden C, Dobbels F, Kirk R et al. The Registry of the International Society for Heart and Lung Transplantation: Twenty-eighth Adult Lung and HeartLung Transplant Report-2011. J Heart Lung Transplant. 2011; 30 (10): 1104-1122. 16. Coll E, Miranda B, Domínguez-Gil B, Martín E, Valentín M, Garrido G, et al. Organ donors in Spain: evolution of donation rates Avances en la selección de donantes para el trasplante pulmonar. Zapata y cols. per regions and determinant factors. Med Clin (Barc). 2008; 131 (2): 52-59. is not compromised by the use of marginal donor lungs. J Thorac Cardiovasc Surg. 1995; 109: 1075-1079. 17. Orens JB, Boehler A, de Perrot M, Estenne M, Glanville AR, Keshavjee S et al. A review of lung transplant donor acceptability criteria. J Heart Lung Transplant. 2003; 22: 1183-1200. 36. Thabut G, Mal H, Cerrina J, Dartevelle P, Dromer C, Velly JF et al. Influence of donor characteristics on outcome after lung transplantation: a multicenter study. J Heart Lung Transplant 2005; 24 (9 ): 1347-1353. 18. Snell GI, Westall GP. Selection and management of the lung donor. Clin Chest Med. 2011; 32 (2): 223-232. 19. Snell GI, Westall GP. Donor selection and management. Curr Opin Organ Transplant. 2009; 14 (5): 471-476. 20. Minambres E, Zurbano F, Naranjo S, González-Castro A, Mons R, González-Fernández C et al. Lung transplantation using donors 55 years and older. Med Intensiva. 2011; 35 (7): 403-409. 21. Filosso PL, Turello D, Cavallo A, Ruffini E, Mancuso M, Oliaro A. Lung donors selection criteria: a review. J Cardiovasc Surg (Torino). 2006; 47 (3): 361-366. 22. Aigner C, Winkler G, Jaksch P, Seebacher G, Lang G, Taghavi S et al. Extended donor criteria for lung transplantation - a clinical reality. Eur J Cardiothorac Surg. 2005; 27 (5): 757-761. 23. Botha P, Fisher AJ, Dark JH. Marginal lung donors: A diminishing margin of safety? Transplantation. 2006; 82 (10): 1273-1279. 24. Garrido-Cantarero G, Matesanz-Acedos R. Epidemiology of transplantation in Spain. Enferm Infecc Microbiol Clin. 2007; 25 (1): 54-62. 25. Wilkes DS, Egan TM, Reynolds HY. Lung transplantation: opportunities for research and clinical advancement. Am J Respir Crit Care Med. 2005; 172: 944-955. 26. Minambres E, Ballesteros MA, Rodrigo E, García-Miguelez A, Llorca J, Ruiz JC, et al. Aggressive lung donor management increases graft procurement without increasing renal graft loss after transplantation. Clin Transplant. 2012. 27. Fischer S, Gohrbandt B, Struckmeier P, Niedermeyer J, Simon A, Hagl C et al. Lung transplantation with lungs from donors fifty years of age and older. J Thorac Cardiovasc Surg. 2005; 129 (4): 919-925. 28. Schiavon M, Falcoz PE, Santelmo N, Massard G. Does the use of extended criteria donors influence early and long-term results of lung transplantation? Interact Cardiovasc Thorac Surg. 2012; 14 (2): 183-187. 29. Kawut SM, Reyentovich A, Wilt JS, Anzeck R, Lederer DJ, O’Shea MK, et al. Outcomes of extended donor lung recipients after lung transplantation. Transplantation. 2005; 79: 310-316. 30. Lardinois D, Banysch M, Korom S, Hillinger S, Rousson V, Boehler A et al. Extended donor lungs: eleven years experience in a consecutive series. Eur J Cardiothorac Surg. 2005; 27: 762767. 31. Thabut G, Mal H, Cerrina J, Dartevelle P, Dromer C, Velly JF, et al. Influence of donor characteristics on outcome after lung transplantation: a multicenter study. J Heart Lung Transplant. 2005; 24 (9): 1347-1353. 32. Freitas MC. Trend in lung transplantation in the U.S.: an analysis of the UNOS registry. Clin Transpl. 2010; 17-33. 33. Novick RJ, Bennett LE, Meyer DM, Hosenpud JD. Influence of graft ischemic time and donor age on survival after lung transplantation. J Heart Lung Transplant. 1999; 18 (5): 425-431. 37. Gabbay E, Williams TJ, Griffiths AP, Macfarlane LM, Kotsimbos TC, Esmore DS, et al. Maximizing the utilization of donor organs offered for lung transplantation. Am J Respir Crit Care Med. 1999; 160: 265-271. 38. Aziz TM, El Gamel A, Saad RA, Migliore M, Campbell CS, Yonan NA. Pulmonary vein gas analysis for assessing donor lung function. Ann Thorac Surg. 2002; 73: 1599-1604. 39. Bolton JS, Padia SA, Borja MC, Becker P, Orens JB, Wiener C et al. The predictive value and inter-observer variability of donor chest radiograph interpretation in lung transplantation. Eur J Cardiothorac Surg. 2003; 23: 484-487. 40. Straznicka M, Follette DM, Eisner MD, Roberts PF, Menza RL, Babcock WD. Aggressive management of lung donors classified as unacceptable: excellent recipient survival one year after transplantation. J Thorac Cardiovasc Surg. 2002; 124: 250-258. 41. Egan TM, Boychuk JE, Rosato K, Cooper JD. Whence the lungs? A study to assess suitability of donor lungs for transplantation. Transplantation. 1992; 53 (2): 420-422. 42. Riou B, Guesde R, Jacquens Y, Duranteau R, Viars P. Fiberoptic bronchoscopy in brain-dead organ donors. Am J Respir Crit Care Med. 1994; 150: 558-560. 43. Orens JB, Boehler A, de PM, Estenne M, Glanville AR, Keshavjee S et al. A review of lung transplant donor acceptability criteria. J Heart Lung Transplant. 2003; 22 (11): 1183-1200. 44. Harjula A, Baldwin JC, Starnes VA, Stinson EB, Oyer PE, Jamieson SW et al. Proper donor selection for heart-lung transplantation. The Stanford experience. J Thorac Cardiovasc Surg. 1987; 94 (6): 874-880. 45. Griffith BP, Zenati M. The pulmonary donor. Clin Chest Med. 1990; 11 (2): 217-226. 46. Stewart S, Ciulli F, Wells FC, Wallwork J. Pathology of unused donor lungs. Transplant Proc. 1993; 25 (1 Pt 2): 1167-1168. 47. Gavalda J, Roman A. Infection in lung transplantation. Enferm Infecc Microbiol Clin. 2007; 25 (10): 639-649. 48. Maurer JR, Tullis DE, Grossman RF, Vellend H, Winton TL, Patterson GA. Infectious complications following isolated lung transplantation. Chest. 1992; 101 (4): 1056-1059. 49. Chaparro C, Maurer J, Gutiérrez C, Krajden M, Chan C, Winton T, et al. Infection with Burkholderia cepacia in cystic fibrosis: outcome following lung transplantation. Am J Respir Crit Care Med. 2001; 163 (1): 43-48. 50. Chamorro C, Aparicio M. Influence of anti-hbc positive organ donor in lung donor selection. Arch Bronconeumol. 2012; 48 (9): 320-324. 51. Chamorro C, Aparicio M. Influence of HBcAb positivity in the organ donor in heart transplantation. Med Intensiva. 2012. 34. Shumway SJ, Hertz MI, Petty MG, Bolman RM, III. Liberalization of donor criteria in lung and heart-lung transplantation. Ann Thorac Surg. 1994; 57 (1): 92-95. 52. Bonser RS, Taylor R, Collett D, Thomas HL, Dark JH, Neuberger J. Effect of donor smoking on survival after lung transplantation: a cohort study of a prospective registry. Lancet. 2012; 380 (9843): 747-755. 35. Sundaresan S, Semenkovich J, Ochoa L, Richardson G, Trulock EP, Cooper JD et al. Successful outcome of lung transplantation 53. Berman M, Goldsmith K, Jenkins D, Sudarshan C, Catarino P, Sukumaran N et al. Comparison of outcomes from smoking and 61 Revista Colombiana de Neumología nonsmoking donors: thirteen-year experience. Ann Thorac Surg. 2010; 90 (6): 1786-1792. 54. Oto T, Griffiths AP, Levvey B, Pilcher DV, Whitford H, Kotsimbos TC et al. A donor history of smoking affects early but not late outcome in lung transplantation. Transplantation. 2004; 78: 599606. 55. Boyle P. Cancer, cigarette smoking and premature death in Europe: a review including the Recommendations of European Cancer Experts Consensus Meeting, Helsinki, October 1996. Lung Cancer. 1997; 17 (1): 1-60. 56. Boyle P, Maisonneuve P. Lung cancer and tobacco smoking. Lung Cancer. 1995; 12 (3): 167-181. 57. De Soyza AG, Dark JH, Parums DV, Curtis A, Corris PA. Donoracquired small cell lung cancer following pulmonary transplantation. Chest. 2001; 120 (3): 1030-1031. 58. Arcasoy SM, Hersh C, Christie JD, Zisman D, Pochettino A, Rosengard BR et al. Bronchogenic carcinoma complicating lung transplantation. J Heart Lung Transplant. 2001; 20 (10): 10441053. 59. Buell JF, Trofe J, Hanaway MJ, Lo A, Rosengard B, Rilo H et al. Transmission of donor cancer into cardiothoracic transplant recipients. Surgery. 2001; 130 (4): 660-666. 60. Penn I. Transmission of cancer from organ donors. Ann Transplant. 1997; 2 (4): 7-12. 61. García RA. Spain is to lead on EU policy on organ donation and transplantation. BMJ. 2011; 343: d4413. 62. Matesanz R, Miranda B. The Spanish model of organ donation: the National Organization of Transplants (ONT) Registry report 1994. Clin Transpl. 1995; 111-115. 63. Matesanz R, Marazuela R, Dominguez-Gil B, Coll E, Mahillo B, de la Rosa G. The 40 donors per million population plan: an action plan for improvement of organ donation and transplantation in Spain. Transplant Proc. 2009; 41 (8): 3453-3456. 64. Chui AK, Herbertt K, Wang LS, Kyd G, Hodgeman G, Verran DJ et al. Risk of tumor transmission in transplantation from donors with primary brain tumors: an Australian and New Zealand registry report. Transplant Proc. 1999; 31 (1-2): 1266-1267. 65. Oto T, Griffiths A, Levvey B, Whitford H, Kotsimbos TC, Rabinov M et al. Donor history of asthma is not a contraindication to lung transplantation: 12-year single-center experience. J Heart Lung Transplant. 2004; 23: 309-316. 66. Oto T, Rowland M, Griffiths AP, Levvey BJ, Esmore DS, Williams TJ et al. Third-time lung transplant using extended criteria lungs. Ann Thorac Surg. 2007; 84 (2): 642-644. 67. Aigner C, Winkler G, Jaksch P, Seebacher G, Lang G, Taghavi S et al. Extended donor criteria for lung transplantation -a clinical reality. Eur J Cardiothorac Surg. 2005; 27: 757-761. 68. Thabut G, Mal H, Cerrina J, Dartevelle P, Dromer C, Velly JF et al. Graft ischemic time and outcome of lung transplantation: a multicenter analysis. Am J Respir Crit Care Med. 2005; 171: 786-791. 69. Fiser SM, Kron IL, Long SM, Kaza AK, Kern JA, Cassada DC et al. Influence of graft ischemic time on outcomes following lung trans- 62 Volumen 24 Número 2 plantation. J Heart Lung Transplant 2001; 20 (12): 1291-1296. 70. Gammie JS, Stukus DR, Pham SM, Hattler BG, McGrath MF, McCurry KR et al. Effect of ischemic time on survival in clinical lung transplantation. Ann Thorac Surg. 1999; 68 (6): 2015-2019. 71. Chamorro C, Falcon JA, Michelena JC. Controversial points in organ donor management. Transplant Proc. 2009; 41 (8): 34733475. 72. Hicks M, Hing A, Gao L, Ryan J, Macdonald PS. Organ preservation. Methods Mol Biol. 2006; 333: 331-374. 73. Sánchez PG, Bittle GJ, Burdorf L, Pierson RN, III, Griffith BP. State of art: clinical ex vivo lung perfusion: rationale, current status, and future directions. J Heart Lung Transplant. 2012; 31 (4): 339-348. 74. Zych B, Popov AF, Stavri G, Bashford A, Bahrami T, Amrani M et al. Early outcomes of bilateral sequential single lung transplantation after ex-vivo lung evaluation and reconditioning. J Heart Lung Transplant. 2012; 31 (3): 274-281. 75. Wierup P, Haraldsson A, Nilsson F, Pierre L, Schersten H, Silverborn M et al. Ex vivo evaluation of nonacceptable donor lungs. Ann Thorac Surg 2006; 81 (2): 460-466. 76. Cypel M, Yeung JC, Machuca T, Chen M, Singer LG, Yasufuku K et al. Experience with the first 50 ex vivo lung perfusions in clinical transplantation. J Thorac Cardiovasc Surg. 2012. 77. Cypel M, Keshavjee S. The clinical potential of ex vivo lung perfusion. Expert Rev Respir Med. 2012; 6 (1): 27-35. 78. Cypel M, Rubacha M, Yeung J, Hirayama S, Torbicki K, Madonik M et al. Normothermic ex vivo perfusion prevents lung injury compared to extended cold preservation for transplantation. Am J Transplant. 2009; 9 (10): 2262-2269. 79. Cypel M, Keshavjee S. The clinical potential of ex vivo lung perfusion. Expert Rev Respir Med. 2012; 6 (1): 27-35. 80. Eberlein M, Reed RM, Permutt S, Chahla MF, Bolukbas S, Nathan SD et al. Parameters of donor-recipient size mismatch and survival after bilateral lung transplantation. J Heart Lung Transplant. 2011. 81. Massard G, Badier M, Guillot C, Reynaud M, Thomas P, Giudicelli R, et al. Lung size matching for double lung transplantation based on the submammary thoracic perimeter. Accuracy and functional results. The Joint Marseille-Montreal Lung Transplant Program. J Thorac Cardiovasc Surg. 1993; 105 (1): 9-14. 82. Eberlein M, Arnaoutakis GJ, Yarmus L, Feller-Kopman D, Dezube R, Chahla MF et al. The effect of lung size mismatch on complications and resource utilization after bilateral lung transplantation. J Heart Lung Transplant. 2012; 31 (5): 492-500. 83. Eberlein M, Permutt S, Chahla MF, Bolukbas S, Nathan SD, Shlobin OA et al. Lung size mismatch in bilateral lung transplantation is associated with allograft function and bronchiolitis obliterans syndrome. Chest. 2012; 141 (2): 451-460. 84. Disponible en Internet: www.ont.es/infesp/Memorias/MemPulmón2011.pdf. Último acceso enero 2013. 85.Disponible en Internet: www.gencat.cat/docs/canalsalut/Minisite/Trasplantament/Informe%20donació% 202011.pdf. Último acceso enero de 2013. Nódulos pulmonares subsólidos: presentación de casos y estado actual. Varón y cols. REVISIÓN DE TEMAS Nódulos pulmonares subsólidos: presentación de casos y estado actual Subsolid pulmonary nodules: presentation of cases and current state of the matter Juan Carlos Varón Cotes, MD.(1); Luis Gerardo García-Herreros, MD.(2) RESUMEN El avance reciente en la tecnología escanográfica con la introducción de tomografía axial con multidetectores, ha permitido diferenciar, cada vez con mayor asiduidad, la presencia de lesiones pulmonares denominadas nódulos pulmonares subsólidos u opacidades nodulares en vidrio esmerilado, las cuales pueden asociarse con diferentes etiologías, incluso con cáncer pulmonar. Aún no hay consenso acerca de cómo abordar, dar seguimiento, diagnosticar o tratar dichas lesiones, y por ello con este artículo se pretende revisar su estado actual a propósito de cuatro casos clínicos tratados en la Fundación Santa Fe de Bogotá. Palabras clave: nódulo subsólido, vidrio esmerilado, adenocarcinoma, adenocarcinoma in situ, hiperplasia adenomatoide atípica. ABSTRACT Recent advances in scanning technology, with the introduction of axial tomography with multidetectors, has made it possible to differentiate more often the presence of pulmonary injuries known as subsolid pulmonary nodules (SN) or nodular ground-glass opacities (GGN). These injuries can be associated with different etiologies, including lung cancer. There is still no consensus about the workup, follow-up, diagnosis, or treatment of these injuries. Therefore this article intends to carry out a general review of the current state of SNs and GGNs, with regard to 4 cases managed at the Fundación Santa Fe de Bogotá. Keywords: subsolid nodule, ground glass, adenocarcinoma, adenocarcinoma in situ, atypical adenomatoid hyperplasia. Rev Colomb Neumol 2013; 24 (2):63-69 El avance reciente en la tecnología escanográfica con la introducción de tomografía axial con multidetectores, ha permitido diferenciar, cada vez con mayor frecuencia, la presencia de lesiones pulmonares denominadas nódulos pulmonares subsólidos u opacidades nodulares en vidrio esmerilado, las cuales pueden estar asociadas con diferentes etiologías, incluso con cáncer pulmonar. Aún no hay consenso acerca de cómo abordar, dar seguimiento, diagnosticar o tratar esas lesiones, y por ello, con este artículo se pretende hacer una revisión general de su estado (1) actual a propósito de cuatro casos clínicos tratados en la Fundación Santa Fe de Bogotá. CASO 1 Mujer de 57 años de edad, con antecedente de cáncer de seno estado I A y timoma estado A1, en quien se descubrió nódulo subsólido en seguimiento de su patología de mama, localizado en lóbulo superior derecho (Figura 1); fue llevada a resección del nódulo mediante Fellow de Cirugía de Tórax, Universidad El Bosque, Bogotá, Colombia. Cirujano de Tórax, Fundación Santa Fe de Bogotá, Docente Facultad de Medicina, Universidad El Bosque, Bogotá, Colombia. (2) Correspondencia: Dr. Juan Carlos Varón Cotes. Correo electrónico: jcvaronc@gmail.com Recibido: septiembre 5 de 2012. Aceptado: noviembre 2 de 2012. 63 Revista Colombiana de Neumología cuña pulmonar y análisis por congelación. El reporte de la congelación mostró adenocarcinoma, por lo cual se practicó lobectomía superior derecha más muestreo ganglionar. El estudio patológico de la pieza resecada mostró adenocarcinoma invasivo de crecimiento lepídico. CASO 2 Mujer de 62 años con antecedente de cáncer de mama estado IB, melanoma nivel II de Clark y displasia en nódulo tiroideo, en quien se halló nódulo subsólido en lóbulo inferior derecho en seguimiento de su patología de mama. Fue llevada a resección del nódulo mediante cuña pulmonar y análisis por congelación. El reporte de la congelación mostró adenocarcinoma, por lo cual se practicó lobectomía inferior derecha más muestreo ganglionar mediastinal. Los estudios de coloración de la pieza resecada mostraron adenocarcinoma in situ (Figura 2). Volumen 24 Número 2 CASO 3 Hombre de 55 años con antecedente de seminoma testicular y carcinoma gástrico temprano, quien consultó al cirujano de tórax por tos y hemoptisis. Se encontró nódulo subsólido en tomografía computarizada de tórax, de localización central en lóbulo superior derecho, por lo cual se practicó lobectomía superior derecha más muestreo ganglionar mediastinal sin realizar previamente resección pulmonar en cuña; además, no fue posible tomar biopsia del nódulo previo a la cirugía debido a su localización. El estudio patológico mostró adenocarcinoma in situ (Figura 3). CASO 4 Hombre de 57 años quien consultó por tos crónica e incoercible. Se encontró nódulo subsólido del lóbulo superior izquierdo en tomografía computarizada de tórax para estudio de la tos crónica. Se administró tratamiento antibiótico con quinolona por 15 días y se evidenció persistencia de la lesión en tomografía de control. Fue llevado a resección del nódulo mediante cuña pulmonar y análisis por congelación. El reporte de la congelación mostró adenocarcinoma in situ por lo cual se decidió no realizar lobectomía (Figura 4). REVISIÓN DEL TEMA A PROPÓSITO DE LOS CASOS Figura 1. Nódulo subsólido en lóbulo superior derecho: adenocarcinoma in situ. Figura 2. Nódulo subsólido en lóbulo inferior derecho: adenocarcinoma in situ. 64 A diferencia de los nódulos pulmonares sólidos, no hay mucho conocimiento aún acerca del comportamiento de los nódulos subsólidos en muchos aspectos y así mismo, no hay recomendaciones de manejo con suficiente poder estadístico que permitan hacer guías basadas en la evidencia. Por lo tanto, a continuación Figura 3. Nódulo subsólido en lóbulo superior derecho, de localización central: adenocarcinoma in situ. Nódulos pulmonares subsólidos: presentación de casos y estado actual. Varón y cols. premalignos o malignos. Por eso, el primer paso es establecer una impresión diagnóstica, la cual se logra, mediante la evaluación de un conjunto de aspectos que se obtienen en la anamnesis del paciente, además de otras características radiológicas. Esto permite sospechar si esas opacidades nodulares en vidrio esmerilado corresponden a una enfermedad benigna o maligna. Figura 4. Nódulo subsólido en lóbulo superior izquierdo. Congelación adenocarcinoma in situ. Se decidió no realizar lobectomía. se presenta una revisión de tema y se sugieren algunas recomendaciones de manejo basadas en la experiencia de algunos grupos de especialistas con series de pacientes similares. DEFINICIONES • Nódulo: opacidad de cualquier contorno, relativamente esférica, de 3 cm o menos, rodeada, por lo menos en 2/3 de su circunferencia, por aire (1). • Opacidad en vidrio esmerilado: aumento en la opacidad pulmonar, con preservación de los bordes bronquiales y vasculares (1). Llamamos nódulo en vidrio esmerilado (NVE) a aquellas lesiones nodulares que en la tomografía computarizada miden menos de 3 cm de diámetro, cuyo patrón radiológico es una opacidad que permite visualizar la trama vascular subyacente. Estos nódulos pueden ser: 1. Puros (opacidades nodulares en vidrio esmerilado puro): si el 100% del nódulo es vidrio esmerilado. 2. Mixtos o subsólidos (nódulos subsólidos): si tienen un componente sólido en su interior (Clasificación de Suzuki) (2). APROXIMACIÓN DIAGNÓSTICA Y DE MANEJO Los opacidades nodulares en vidrio esmerilado pueden aparecer como hallazgos incidentales o en el contexto de pacientes con cuadros clínicos diversos y como manifestaciones de cuadros clínicos benignos, Las opacidades nodulares en vidrio esmerilado benignas, tienden a desaparecer en un lapso de dos a tres meses (3); generalmente están asociadas a procesos inflamatorios y son de bordes irregulares, mal definidos y poco focalizadas (3). Libby y colaboradores, en un estudio en el cual analizan una serie de opacidades nodulares en vidrio esmerilado puras, sugestivas de inflamación, que fueron sometidas a manejo antibiótico y controladas en dos meses, observaron que 75% de estos nódulos desaparecieron total o parcialmente (4). Aproximadamente un tercio de las opacidades nodulares en vidrio esmerilado puras tienen este comportamiento, así como la mitad de las opacidades nodulares en vidrio esmerilado puras que aparecen de novo en los estudios de tomografía computarizada que se hacen como seguimiento para diversas entidades (3). Muchas patologías de tipo benigno se asocian con presencia de opacidades nodulares en vidrio esmerilado, entre estas aspergilosis, fibrosis intersticial focal, neumonía eosinofílica (que a su vez pueden asociarse con parásitos, fibrosis idiopática, sarcoidosis, medicamentos, enfermedades del colágeno), bronquiolitis obliterante con neumonía de organización (BOOP), endometriosis torácica, entre otras (5). Si una opacidad nodular en vidrio esmerilado o los nódulos pulmonares subsólidos no son benignos, lo más probable es que su patología corresponda a una parte del espectro del adenocarcinoma, llámese lesión premaligna [hiperplasia adenomatosa atípica (AAH) o adenocarcinoma in situ (AIS) o lesión maligna (adenocarcinoma moderadamente invasivo (AMI) o adenocarcinoma invasivo del tipo de crecimiento lepídico (ACL) anteriormente llamado carcinoma bronquioloalveolar (CBA)] (6). El tamaño del nódulo, es quizás el factor de riesgo más importante que determina la posibilidad de malignidad de las opacidades nodulares en vidrio esmerilado o los nódulos pulmonares subsólidos. Kim y colaboradores (7), dividieron 40 nódulos resecados en dos grupos (malignos y no malignos) según lo reportado en la patología, y analizaron ciertas características de manera retrospectiva, con el objetivo de determinar 65 Revista Colombiana de Neumología la posibilidad de malignidad en términos de porcentaje; encontraron que las opacidades nodulares en vidrio esmerilado mayores o iguales a 10 mm tuvieron 67% de probabilidad de malignidad. Por otra parte, Detterbeck y colaboradores (6), en una revisión de estudios retrospectivos japoneses, de nódulos resecados, determinaron que las opacidades nodulares en vidrio esmerilado puras, menores o iguales a 1 cm, tienen 25% de posibilidades de ser premalignas (AAH o AIS) y menos de 5% de ser malignas (ACL), mientras que aquellas mayores a 1 cm tienen 40% de posibilidades de ser premalignas y 20% de posibilidades de ser malignas; así mismo, los nódulos pulmonares subsólidos menores o iguales a 1 cm tienen 50% de posibilidades de ser premalignos y 25% de ser malignos, mientras que los nódulos pulmonares subsólidos mayores a 1 cm, tienen 50% de posibilidades de ser premalignos y 50% de ser malignos; es decir, no tienen chance de ser benignos, por lo tanto urge resecarlos. SEGUIMIENTO Tal vez este sea uno de los temas de mayor discusión ya que no existe aún consenso al respecto e intervienen muchos factores que están en estudio. El 95% de las opacidades nodulares en vidrio esmerilado que desaparecen, lo hacen dentro de los tres primeros meses. Es poco probable que una lesión que permanece sin cambios durante tres meses, desaparezca; por lo tanto, debería ser resecada. Además, 10% a 20% de los nódulos que no desaparecen en ese lapso de tiempo, aumentan de tamaño (6). Ni el crecimiento de las lesiones nodulares ni la velocidad de crecimiento de las mismas, tienen relación directa con el tipo de lesión ni con su histología; de hecho, existe gran variabilidad en los patrones de crecimiento, lo cual no permite predecir su comportamiento. Lindell y colaboradores (8), midieron los patrones de crecimiento en centímetros a lo largo del tiempo de seguimiento en meses de nódulos malignos, y evidenciaron gran diferencia de patrones entre distintos tipos de cáncer y entre los nódulos del mismo tipo de cáncer. Hasegawa y colaboradores (9) midieron el tiempo de doblaje tumoral (TDT), de una serie de opacidades nodulares en vidrio esmerilado y nódulos pulmonares subsólidos, con el objetivo de relacionar las características que hacen que estos nódulos crezcan con mayor o menor velocidad, y encontraron que no hay factores predictores de la velocidad de crecimiento de éstos. 66 Volumen 24 Número 2 Sin embargo, Hiramatsu y colegas (10), hicieron un análisis multivariado de diversas características de opacidades nodulares en vidrio esmerilado que pudieran afectar la velocidad de crecimiento de los mismos y encontraron que el tamaño inicial al ser descubierta la lesión, era estadísticamente significativo y podía servir de predictor de crecimiento de la misma. Así entonces, una lesión mayor o igual a 10 mm, representaría una probabilidad estimada de crecimiento del 66%, respecto a la lesión menor de 1 cm, cuya probabilidad de crecimiento fue de 14%. Varios autores reportan nódulos malignos que disminuyen de tamaño durante el seguimiento con tomografía axial computarizada. Se piensa que esta disminución puede ser relativa, ya que por lo general se da a expensas del componente de vidrio esmerilado periférico en los nódulos pulmonares subsólidos (11), lo cual, en efecto, demuestra una disminución en el diámetro de la lesión completa así el componente sólido del nódulo haya crecido. Por lo tanto, ante estos hallazgos se puede concluir que la disminución en el tamaño de las opacidades nodulares en vidrio esmerilado no excluye la necesidad de continuar con el seguimiento de dichas lesiones y mucho menos descarta la posibilidad de malignidad (12). Además de todo, hay diferencias grandes entre observadores y entre los métodos radiológicos de medición disponibles al momento de determinar el tamaño de estos nódulos y, por supuesto, al momento de determinar qué tanto ha variado su tamaño en cada seguimiento. Jennings y su equipo (13) comparan diferentes métodos de medición tanto manuales como automáticos, con un estándar dorado y describen altas tasas de falsos positivos y falsos negativos al momento de comparar los métodos. Oda y colaboradores (14), miden el porcentaje de error relativo a la medición del volumen entre observadores y programas de medición computarizada y encuentran diferencias hasta del 40% entre programas y medidores cuando las lesiones son menores de 8 mm. ESTUDIO DE LAS OPACIDADES NODULARES EN VIDRIO ESMERILADO Y LOS NÓDULOS PULMONARES SUBSÓLIDOS El objetivo de estudiar las opacidades nodulares en vidrio esmerilado y los nódulos pulmonares subsólidos, es determinar su malignidad antes de decidir su resección. Para tal fin, hay varios métodos disponibles. La tomografía con emisión de positrones, o PET, su sigla en inglés, no es un buen método de estudio Nódulos pulmonares subsólidos: presentación de casos y estado actual. para esos casos debido a la gran cantidad de falsos positivos y falsos negativos que presenta. Nomori y colaboradores (15), hicieron un estudio retrospectivo de PET tomadas a una serie de opacidades nodulares en vidrio esmerilado y nódulos pulmonares subsólidos, los cuales fueron divididos en malignos, benignos y discriminados entre opacidades nodulares en vidrio esmerilado puras y nódulos pulmonares subsólidos. Encontraron una alta tasa de falsos negativos en nódulos malignos, predominantemente en nódulos menores de 1,5 cm, así como una alta tasa de falsos positivos en nódulos inflamatorios y un rendimiento diagnóstico de 13% para opacidades nodulares en vidrio esmerilado puras. La biopsia transtorácica con aguja fina (TTAF) guiada por TAC, es un método muy usado y aceptable para el estudio de las opacidades nodulares en vidrio esmerilado y los nódulos pulmonares subsólidos. Shimizu y colaboradores (16), reportan rendimientos diagnósticos de entre 48% y 83%, dependiendo del tamaño del nódulo. El rendimiento diagnóstico es similar entre opacidades nodulares en vidrio esmerilado y nódulos pulmonares subsólidos cuando son mayores de 1,5 cm y es menor en opacidades nodulares en vidrio esmerilado puras si son menores de 1 cm. Hur y colegas (17), muestran rendimientos diagnósticos entre 70% y 90% dependiendo de la distancia de la lesión respecto a la pared del tórax, con una concordancia de 70% entre el resultado de la biopsia y el hallazgo de patología con la pieza resecada completa. Sin embargo, debido a la naturaleza difusa de las opacidades nodulares en vidrio esmerilado y de los nódulos pulmonares subsólidos en su periferia, hay 20% a 30% de posibilidades de no obtener muestras significativas (6, 17). Sin duda, la toracoscopia video asistida (VATS, su sigla en inglés), es el método que ofrece mejores posibilidades diagnósticas, porque el dictamen se obtiene a partir de la totalidad del nódulo, siempre y cuando éste pueda ser detectado. El gran problema con las opacidades nodulares en vidrio esmerilado y los nódulos pulmonares subsólidos, es que con frecuencia no pueden ser palpados ni vistos, por lo cual se requiere de un método de marcación en el preoperatorio y en el transoperatorio (18, 19). TRATAMIENTO La probabilidad de que un nódulo pulmonar subsólido mayor de 1 cm sea benigno es casi nula, y las opacidades nodulares en vidrio esmerilado o los nódu- Varón y cols. los pulmonares subsólidos que no desaparecen luego de tres meses, igualmente tienen más posibilidades de ser malignos que benignos; por lo tanto, como se indicó antes, estas lesiones deben ser resecadas. Si el resultado de patología corresponde a una lesión premaligna (adenocarcinoma in situ o AAH), la resección en cuña ofrece sobrevida a cinco años del 100% (20), y por ende es suficiente (21). Si el resultado de patología es una lesión maligna, existe chance de invasión concomitante a ganglios linfáticos; sin embargo, hasta que no se demuestre lo contrario, la lesión estaría clasificada como cT1 N0 M0. La controversia está en si es suficiente o no una resección sublobar en este tipo de lesiones. Gran cantidad de estudios japoneses reportan tasas de sobrevida a cinco años del 100% en grupos grandes de pacientes con nódulos cT1 N0 M0, que fueron sometidos a resecciones sublobares (resección en cuña). Estos resultados hacen pensar que sería razonable manejar estos pacientes con resecciones sublobares y tener éxito; sin embargo, es preciso analizar tales resultados de manera cuidadosa, porque muchos de los estudios utilizan protocolos de acción que no se reproducen en otras partes del mundo. Por ejemplo, Yoshida y colaboradores (22), al resecar el nódulo mediante cuña pulmonar, envían a congelación el espécimen para verificar bordes de resección mayores a 1 cm y determinar si el nódulo encaja en la clasificación de Noguchi A o B para decidir terminar el procedimiento, de lo contrario, aumentan el margen de resección o realizan lobectomía y disección ganglionar. En caso de múltiples opacidades nodulares en vidrio esmerilado o nódulos pulmonares subsólidos, se deben aplicar los mismos principios que se aplican para manejar los pacientes con opacidades nodulares en vidrio esmerilado o nódulos pulmonares subsólidos únicos (23). CONCLUSIONES No todas las opacidades nodulares en vidrio esmerilado son malignas; sin embargo, según la literatura, sí corresponden a la mayoría y esa incidencia aumenta considerablemente con el incremento del tamaño del nódulo. Claramente, no todas las opacidades nodulares en vidrio esmerilado deben ser resecadas y por lo tanto siempre deben relacionarse con la clínica del paciente. Se justifica, entonces, instaurar manejo antibiótico a las opacidades nodulares en vidrio esmerilado de apariencia inflamatoria 67 Revista Colombiana de Neumología (bordes mal definidos, irregulares, poco focalizados) y hacer seguimiento de tres a seis meses. El riesgo de malignidad aumenta con relación a su tamaño; así mismo, una opacidad nodular en vidrio esmerilado menor o igual a 1 cm, tiene riesgo de ser adenocarcinoma in situ en 25% y menos del 5% de ser AC; entre tanto una opacidad nodular en vidrio esmerilado mayor a 1 cm tiene riesgo de ser adenocarcinoma in situ en 40% y 20% de ser AC. Un nódulo pulmonar subsólido (>50% de GGO) menor o igual a 1 cm, tiene riesgo de ser adenocarcinoma in situ de 50% y de 25% para AC; mientras que un nódulo pulmonar subsólido mayor a 1 cm tiene riesgo de ser adenocarcinoma in situ de 50% y de 50% para ser AC. Por eso, opacidades nodulares en vidrio esmerilado o nódulos pulmonares subsólidos mayores de 1 cm deben ser resecadas. El 30% de las opacidades nodulares en vidrio esmerilado desaparecen en ese tiempo; sin embargo, el hecho de aumentar de tamaño, disminuir o permanecer sin cambios, no sugiere ni descarta malignidad. El 10% a 20% de estas lesiones aumentan de tamaño. Si una lesión persiste por más de tres meses, es muy poco probable que desparezca, y por tanto debe plantearse un manejo definitivo. Debido a la gran variabilidad de crecimiento que existe entre opacidades nodulares en vidrio esmerilado y nódulos pulmonares subsólidos, no hay forma de predecir el resultado de una lesión respecto a su patrón de crecimiento o tiempo de doblaje tumoral, y menos, si existen grandes diferencias entre los métodos de medición existentes al momento de evaluar con exactitud lesiones pequeñas (menores de 8 mm). Esto ha generado confusión y dificultades a la hora de determinar una estrategia de seguimiento para estas lesiones. La PET, no ofrece exactitud adecuada para el estudio de estas lesiones. La biopsia percutánea con aguja fina tiene un rendimiento diagnóstico aceptable y se correlaciona hasta en 70% con el resultado final de la pieza en patología; si el resultado es positivo para malignidad, es indicación para resecar el nódulo; si es negativo, justifica repetir el estudio o realizar la biopsia por otro método. La VATS, tiene el mejor rendimiento diagnóstico, pero se requiere disponer de alguna forma de marcación preoperatoria o transoperatoria. Se pueden resecar opacidades nodulares en vidrio esmerilado o nódulos pulmonares subsólidos clasificados como ct1 N0 M0 mediante sólo resección sublobar, siempre y cuando ésta se haga bajo un protocolo 68 Volumen 24 Número 2 estricto de estudio y manejo del nódulo; pese a ello, no en todas las instituciones se dispone de tales condiciones. Por eso, se recomienda realizar muestreo ganglionar hasta que no exista evidencia suficiente que soporte lo contrario. Los pacientes con varias opacidades nodulares en vidrio esmerilado o nódulos pulmonares subsólidos, deben manejarse igual a los pacientes con opacidades nodulares en vidrio esmerilado o nódulos pulmonares subsólidos únicos. Los avances tecnológicos en imágenes diagnósticas, han permitido en los últimos años detectar una serie de lesiones que anteriormente no se descubrían fácilmente y por lo tanto no eran estudiadas. Cada vez, hay más hallazgos que sorprenden al cuerpo médico, sobre todo las opacidades nodulares en vidrio esmerilado, que resultan ser lesiones premalignas. Eso significa que si se logra aprender un poco más acerca de la naturaleza de este tipo de lesiones, podrían hallarse y estudiarse más oportunamente y cambiar las estadísticas en términos de detección temprana de cáncer pulmonar e incidir así en la sobrevida de los pacientes. BIBLIOGRAFÍA 1. Hansell DM, Bankier AA, MacMahon H, et al. Fleischner society: glossary of terms for thoracic imaging. Radiology. 2008; 246: 697-722. 2. Suzuki K, Kusumoto M, Watanabe S, et al. Radiologic classification of small adenocarcinoma of the lung: radiologic-pathologic correlation and its prognostic impact. Ann Thorac Surg. 2006; 81: 413-9. 3. Kaneda H, Sakaida N, Saito T, et al. Appearance of bronchioloalveolar carcinoma and the rapid progression into invasive papillary adenocarcinoma. Gen Thorac Cardiovasc Surg. 2009; 57: 224-7. 4. Libby DM, Wu N, Lee IJ, et al. CT screening for lung cancer: the value of short-term CT follow-up. Chest. 2006; 129: 103942. 5. Park CM, Goo JM, Lee HJ, Lee CH, Chun EJ, Im JG. Nodular ground-glass opacity at thin-section CT: histologic correlation and evaluation of change at follow-up. Radiographics. 2007; 27: 391-408. 6. Detterbeck F, Homer R. Approach to the ground-glass nodule. Clin Chest Med. 2011; 32: 799–810. 7. Kim H, Choi Y, Kim K, et al. Management of ground glass opacity lesions detected in patients with other wise operable nonsmall cell lung cancer. J Thorac Oncol. 2009; 4: 1242-6. 8. Lindell RM, Hartman TE, Swensen SJ, et al. 5-year lung cancer screening experience. Chest. 2009; 136: 1586-95. 9. Hasegawa M, Sone S, Takashima S, et al. Growthrate of small lung cancers detected on mass CT screening. Br J Radiol. 2000; 73: 1252-9. Nódulos pulmonares subsólidos: presentación de casos y estado actual. 10. Hiramatsu M, Inagaki T, Inagaki T, et al. Pulmonary ground-glass opacity (GGO) lesions-large size and a history of lung cancer are risk factors for growth. J Thorac Oncol. 2008; 3: 1245-50. 11. Kakinuma R, Ohmatsu H, Kaneko M, et al. Progression of focal pure ground-glass opacity detected by low dose helical computed tomography screening for lung cancer. J Comput Assist Tomogr. 2004; 28: 17-23. 12. Min JH, Lee HY, Lee KS, et al. Stepwise evolution from a focal pure pulmonary ground-glass opacity nodule into an invasive lung adenocarcinoma: an observation for more than 10 years. Lung Cancer. 2010; 69: 123-6. Varón y cols. 17. Hur J, Lee HJ, Nam JE, et al. Diagnostic accuracy of CT fluoroscopy-guided needle aspiration biopsy of ground-glass opacity pulmonary lesions. AJR Am J Roentgenol. 2009; 192: 629-34. 18. Sortini D, Feo C, Maravegias K, et al. Intrathoracoscopic localization techniques. Surg Endosc. 2006; 20: 1341-7. 19. Daniel T, Altes T, Rehm P, et al. A novel technique for localization and excisional biopsy of small or illdefined pulmonary lesions. Ann Thorac Surg. 2004; 77: 1756–62 [discussion: 1762]. 13. Jennings SG, Winer-Muram HT, Tarver RD, et al. Lung tumor growth: assessment with CT–comparison of diameter and crosssectional area with volume measurements. Radiology. 2004; 231: 866-71. 20. Travis WD, Brambilla E, Noguchi M, et al. International Association for the Study of Lung Cancer/ American Thoracic Society/ European Respiratory Society International Multidisciplinary Classification. of Lung Adenocarcinoma. J Thorac Oncol. 2011; 6. 14. Oda S, Awai K, Murao K, et al. Computer-aided volumetry of pulmonary nodules exhibiting ground-glass opacity at MDCT. AJR Am J Roentgenol. 2010; 194: 398-406. 21. NCCN Clinical Practice Guidelines in Oncology (NCCN guidelines) Non Small cell Lung cancer. Version 2. 2012. Dsiponible en: www.nccn.org. 15. Nomori H, Watanabe K, Ohtsuka T, et al. Evaluation of F-18 fluorodeoxyglucose (FDG) PET scanning for pulmonary nodules less than 3 cm in diameter, with special reference to the CT images. Lung Cancer. 2004; 45: 19-27. 22. Yoshida J, Ishii G, Yokose T, et al. Possible delayed cut-end recurrence after limited resection for ground-glass opacity adenocarcinoma, intraoperatively diagnosed as Noguchi type B, in three patients. J Thorac Oncol. 2010; 5: 546-50. 16. Shimizu K, Ikeda N, Tsuboi M, et al. Percutaneous CT-guided fine needle aspiration for lung cancer smaller than 2 cm and revealed by ground-glass opacity at CT. Lung Cancer. 2006; 51: 173-9. 23. Kim TJ, Goo JM, Lee KW, et al. Clinical, pathological and thinsection CT features of persistent multiple ground-glass opacity nodules: comparison with solitary ground-glass opacity nodule. Lung Cancer. 2009; 64: 171-8. 69 Revista Colombiana de Neumología Volumen 24 Número 2 ARTÍCULOS ORIGINALES Proyecto de un registro institucional de cirugía de tórax Project for an institutional registry of thoracic surgery Mauricio Velásquez Galvis, MD.(1); Jhon Harry Loaiza Guendica(2) RESUMEN En Colombia existe un gran déficit de información sobre las patologías que aquejan a la población y el manejo que se les da, especialmente en áreas como la cirugía de tórax, lo cual, sumado a la complejidad de los pacientes con patologías pulmonares, hace necesario fundar un registro institucional de cirugía torácica que permita conocer los desenlaces de los pacientes y compararlos con otras instituciones y registros mundiales. Se estableció un registro institucional de cirugía de tórax para recoger todos los pacientes mayores de 18 años que fueran llevados a una resección pulmonar y evaluar datos demográficos, comorbilidades, diagnóstico, tipo de intervención y desenlaces. Se registraron 43 pacientes, con un promedio de edad de 56 (± 17) años, de los cuales 90% presentaba alguna comorbilidad, 42% tuvo diagnóstico de cáncer de pulmón y a 51,2% se le realizó una lobectomía pulmonar. La mediana de estancia hospitalaria fue de 9 días; 41,8% tuvo alguna complicación postoperatoria y la mortalidad fue de 9,4%. Este trabajo presenta los primeros datos de un registro institucional de cirugía de tórax que permite compararlos con datos de otros países y mejorar la atención que se les brinda a los pacientes. Con el tiempo se espera aumentar el número de pacientes para mejorar los análisis que se puedan llevar a cabo. Palabras clave: cirugía de tórax, registro, estadística. ABSTRACT In Colombia there is a substantial lack of information about the diseases affecting the population and the way they are managed, especially in fields such as thoracic surgery. When added to the complexity of patients with lung diseases, this calls for the foundation of an institutional registry of thoracic surgery capable of providing information concerning the outcomes of patients and comparing them with other institutions and registries at the world level. An institutional registry of thoracic surgery was established in order to gather all patients older than 18 years who underwent lung resection, and to evaluate demographic data, comorbidities, diagnoses, types of intervention, and outcomes. A total number of 43 patients were registered, with a mean age of 56 (± 17) years; 90% had some comorbidity, 42% were diagnosed with lung cancer, 51,2% underwent pulmonary lobectomy, the median hospital stay was 9 days, 41,8% had some postoperative complication, and the mortality was 9,4%. This article presents the first data of an institutional registry of thoracic surgery, in order that they may be compared with data from other countries for the improvement of patient care. The number of patients will hopefully increase as time goes by, so that better analyses can be done. Keywords: thoracic surgery, registry, statistics. Rev Colomb Neumol 2013; 24 (2):70-75 (1) Cirujano de Tórax. Unidad de Investigaciones Clínicas, Fundación Valle del Lili, Cali, Colombia. Estadístico. Unidad de Investigaciones Clínicas, Fundación Valle del Lili, Cali, Colombia. (2) Correspondencia: Doctor Mauricio Velásquez Galvis, Correo electrónico: mauriciovelasq@yahoo.com Recibido: agosto 11 de 2012. Aceptado: octubre 2 de 2012. 70 Proyecto de un registro institucional de cirugía de tórax. INTRODUCCIÓN La base de datos de la Sociedad de Cirujanos del Tórax de los Estados Unidos funciona desde enero de 1999 y en ella participan hospitales, grupos de investigación y cirujanos. Ha llegado a formar parte de la práctica diaria de todos y cada uno de ellos, comprometiéndose estos, de manera voluntaria, a enviar los datos de los pacientes a fin de conformar la base de datos de cirugía de tórax más grande del mundo (1-3). Esta base de datos ha permitido no sólo el crecimiento científico de la organización, visto en el gran número de publicaciones originadas allí, sino que ha sentado los fundamentos de la práctica de la cirugía de tórax en ese país. Además, ha mostrado la ruta para la evolución de la cirugía torácica al permitir evaluar los desenlaces de los pacientes y la comparación entre los diferentes hospitales, grupos de investigación y cirujanos, dando la oportunidad de ofrecer una cirugía de tórax de mejor calidad. En nuestro medio cuando, por un lado la práctica de la cirugía se ha vuelto tan compleja debido a la legislación colombiana y por otro la falta de organización del gobierno en cuanto a tener unas cifras o estadísticas actualizadas y veraces que permitan saber lo que ocurre con las patologías propias de cada especialidad médica, se hace más necesario que nunca fundar un registro de los pacientes de cirugía torácica, que permita una retroalimentación sobre los resultados de la práctica diaria de la cirugía de tórax en nuestra institución ofreciendo una mejor atención a los pacientes y una cirugía torácica de mejor calidad. MATERIALES Y MÉTODOS Luego del estudio y la aprobación del proyecto por parte del comité de ética institucional de la Fundación Valle del Lili se decidió establecer el Registro Institucional de Cirugía de Tórax, con el objetivo de recoger de manera prospectiva todos los pacientes que sean llevados a una cirugía de resección pulmonar para evaluar los desenlaces y registrar el seguimiento de la evolución postoperatoria. A partir de enero de 2011, se incluirán todos los pacientes mayores de 18 años que sean programados para una cirugía de resección pulmonar por cualquier método quirúrgico, los cuales se ingresarán al registro para continuar posteriormente con la introducción de los desenlaces y los seguimientos clínicos de acuerdo con cada caso. Velásquez y cols. No se requiere firmar un consentimiento informado para ingresar los pacientes al registro en vista de que a través de todo el proceso de la recolección y análisis de los datos se mantendrá la confidencialidad de los mismos al evitar cualquier dato que permita identificarlos. La introducción de los datos será realizada por el cirujano de tórax, en un instrumento diseñado en conjunto con la Unidad de Investigaciones Clínicas, y el análisis de los datos estará a cargo de la Unidad de Investigaciones Clínicas de la institución. Las variables a estudiar incluyen datos demográficos, variables de diagnóstico, evaluación fisiológica preoperatoria, tipo de procedimiento, datos del procedimiento y desenlaces así como complicaciones. El análisis estadístico de los datos recolectados se llevará a cabo con el paquete estadístico Stata 8 TM. Las variables categóricas o de tipo nominal se presentarán como frecuencias relativas y frecuencias absolutas. Las variables de tipo cuantitativas se mostrarán en medidas de tendencia central y en medidas de dispersión (media y desviación estándar en caso de cumplir con los criterios de normalidad para su análisis; en caso contrario, se presentarán medianas y rangos intercuartílicos). Se realizarán pruebas chi-cuadrado para las variables categóricas para comparación de grupos de interés entre los pacientes operados. De igual forma, se usarán pruebas de hipótesis para medidas de tendencia central en el caso de variables cuantitativas, ya sean paramétricas, como la t student, sólo si se cumplen los criterios de normalidad en la variable analizada, de lo contrario se usará la prueba U Mann-Whitney para grupos independientes o prueba de Wilcoxon para datos pareados. Se realizarán análisis de sobrevida para los eventos post-quirúrgicos y de egreso mediante metodología de Kaplan-Meier; se analizarán modelos de riesgos proporcionales con las variables que presenten asociación/correlación en el análisis bivariado con el(los) evento(s) de interés (complicaciones y mortalidad, entre otros). Se realizarán los respectivos gráficos para las curvas de sobrevida y de las variables que sean de interés y relevancia para el subanálisis requerido. Así mismo, se harán reportes intermedios o de desenlaces que sean de interés para el estudio y/o con el objetivo de ser presentados en congresos o publicaciones que se puedan llevar a cabo durante el proceso de recolección de información en el registro. 71 Revista Colombiana de Neumología RESULTADOS A la fecha se registraron en total 43 pacientes, 21 (48,8%) mujeres y 22 (51,2%) hombres con un promedio de edad de 56 (DE±17) años. Los datos demográficos se pueden observar en la tabla 1. Se encontró que el 90% (39) de los pacientes Volumen 24 Número 2 presentaba al menos una comorbilidad, 74% (32) tenía un antecedente de cáncer en otro órgano, 44,2% (24) fumaba o había fumado y de éstos 44,7% (9) había fumado más de 20 paquetes/años y la mayoría fueron ASA 2 ó 3. Se encontró que 25 (58%) pacientes tuvieron uno o más diagnósticos quirúrgicos benignos (tabla 2), mientras que en los 18 (42%) restantes el Tabla 1. Datos demográficos. Comorbilidades Hipertensión Uso de esteroides Falla cardiaca Enfermedad coronaria Enfermedad vascular periférica Cirugía cardio-torácica previa Diabetes Falla renal Anemia Fibrosis pulmonar Cáncer Quimioterapia Radioterapia Otros Cáncer No Si Cérvix Estómago Mama Próstata Pulmón Sarcoma de tejidos blancos Riñón Otro Tabaquismo Nunca Actual Previamente Grado de tabaquismo Menos de 10 paq/año Entre 10 y 20 paq/año Más de 20 paq/año Tiempo transcurrido desde el abandono de fumar (meses) 1 10 12 80 120 NA ASA 1 2 3 4 U 72 n=43 Porcentaje 39 11 1 1 4 2 5 5 1 6 1 10 1 4 16 32 11 1 1 0 1 1 1 1 5 24 4 15 7 3 9 90 28,2 2,6 2,6 10,3 5,1 12,8 12,8 2,6 15,4 2,6 25,6 2,6 10,3 41,0 74,4 25,6 2,3 2,3 0,0 2,3 2,3 2,3 2,3 11,6 55.8 9.3 34.8 36,8 15,8 47,4 1 1 1 1 9 1 1 16 19 3 4 6,66 6,66 6,66 6,66 60,0 6,6 2,3 37,2 44,2 7,0 9,3 Proyecto de un registro institucional de cirugía de tórax. Velásquez y cols. diagnóstico fue cáncer pulmonar, siendo el adenocarcinoma la histología más frecuente con 41,2% (7) (tabla 3). La distribución de las pruebas de función pulmonar se puede observar en la tabla 4; la prueba más Tabla 2. Diagnósticos diferentes de cáncer. Diagnóstico n=25 Metástasis 58,1% 1 4 13 52 Absceso 1 7,7 Histoplasmosis 1 7,7 Influenza AH1N1 1 7,7 Neumonía 1 7,7 TBC 6 46,2 SD* 3 23,1 Bronquiectasias 6 24,0 Enfisema 1 4,0 Fibrosis pulmonar 1 4,0 Trauma pulmonar 2 8,0 Otro 6 24,0 Secuestro pulmonar 2 33,3 Malformaciones vasculares 2 33,3 Inflamación granulomatosa crónica 1 16,7 Infarto pulmonar 1 16,7 Infección pulmonar utilizada fue la espirometría, realizada en 44,2% (19) de los pacientes. La tabla 5 muestra los procedimientos realizados; los más frecuentes fueron las lobectomías pulmonares, 22 (51,2%), seguidas de las resecciones pulmonares en cuña, que fueron 17 (39,5%). En 7 (16,2%) pacientes se trasfundieron glóbulos rojos con un promedio de 3 (± 2,7) unidades por paciente. La mediana de duración de las cirugías fue de 120 (RIQ 60-200) minutos y la mediana de estancia fue de 9 (RIQ 5-18) días (tabla 6). El destino postoperatorio de los pacientes fue el siguiente: 31 pacientes (72,1%) se trasladaron a la UCI, 12 (12,9%) al piso y sólo 6 (13,9%) tuvieron que reingresar a la UCI por alguna complicación. Tabla 4. Pruebas de función pulmonar. n=43 Porcentaje Espirometría 19 44,2 Difusión de CO 18 41,9 Pletismografía 0 0,0 Prueba de consumo de oxígeno 1 2,3 Gammagrafía de perfusión pulmonar 4 9,3 22 51,2 No aplica Tabla 5. Procedimientos realizados. * SD: sin dato. n=43 Tabla 3. Pacientes con cáncer de pulmón. Porcentaje Cirugías abiertas 24 55,8 Diagnóstico histológico n=18 42% Cirugías video-asistidas 19 44,2 Adenocarcinoma 7 41,2 Resecciones en cuña 17 39,5 Carcinoma escamocelular 5 29,4 Resecciones segmentarias 0 0,0 Carcinoma bronquioloalveolar 2 11,7 Lobectomías 22 51,2 Pulmón derecho Tumor neuroendocrino 2 11,7 Tumor benigno 1 5,9 Neumonectomía 3 7,0 SD* 1 5,9 Lóbulo superior 6 14,0 Lóbulo medio 0 0,0 Lóbulo inferior 1 2,3 Bilobectomía 2 4,7 TNM Ia 2 11,8 Ib 1 5,9 Pulmón izquierdo IIa 1 5,9 IIb 7 41,2 Neumonectomía 1 2,3 IIIa 3 17,7 Lóbulo superior 3 7,0 IV 3 17,7 Lóbulo inferior 10 23,3 * SD: sin dato. 73 Revista Colombiana de Neumología Volumen 24 Número 2 DISCUSIÓN Tabla 6. Resultados quirúrgicos. Mediana RIQ* 120 60-200 UCI 2 1-6 Piso 5,5 3-10 Total 9 5-18 Duración de la cirugía (minutos) Estancia hospitalaria (días) * RIQ: rango intercuartílico. 18 (41,86%) presentaron alguna complicación postoperatoria, de los cuales 2 (4,65%) tuvieron dos o más complicaciones y 16 (37,21%) presentaron sólo una complicación (tabla 7). En el seguimiento a 30 días se encontró que 3 (6,9%) pacientes requirieron alguna reintervención, uno por sangrado, otro por neumotórax luego del retiro del tubo y otro por cirugía de control de daños, en la que se hizo una ligadura temporal del hilio pulmonar. Además, se encontró que 4 (9,4%) pacientes murieron durante la hospitalización por tromboembolismo pulmonar y por ruptura de la arteria pulmonar como secuela de radioterapia, dos por falla respiratoria severa secundaria a un enfisema severo postoperatorio de una cirugía de reducción de volumen y uno por un desgarro de la carina en un trauma cerrado de tórax. La fundación de un registro institucional de cirugía de tórax es una labor compleja, que comprende la coordinación y el trabajo en equipo de diferentes personas con formaciones académicas disímiles. El reporte que se presenta en este momento muestra cómo la constancia y disciplina de un grupo de trabajo puede llegar a mostrar unos resultados que en el futuro permitirán comparar nuestra institución no sólo con otras instituciones en Colombia sino con los resultados consolidados de otros países. El cáncer de pulmón es la principal causa de mortalidad por cáncer en el mundo (4) y en el trabajo de Bernard y colaboradores (5) se muestra como a partir de la base de datos nacional de Francia se logran recolectar 18.049 resecciones pulmonares por cáncer de pulmón, y así calcular modelos de riesgo de mortalidad intra-hospitalaria en pacientes de cirugías de resección pulmonar. En nuestro reporte se muestran 18 pacientes con cáncer de pulmón y 25 con diagnóstico de una condición benigna a quienes se les realizó una cirugía de resección pulmonar, dentro de las que se incluyen 17 resecciones en cuña, 22 lobectomías y 4 neumonectomías. Las patologías susceptibles de manejo por cirugía de tórax son entidades bastante complejas y representan un reto no sólo para los cirujanos en Colombia Tabla 7. Complicaciones. Complicaciones Pulmonares Cardíacas Otras 74 n=18 41,9% Fuga de aire 0 0 Atelectasia que requirió fibrobroncoscopia 2 4,7 Neumonía 1 2,3 SDRA 3 7,0 Fístula bronco-pleural 1 2,3 Neumotórax 2 4,7 Traqueostomía 1 2,3 Otra complicación pulmonar Ruptura de arteria pulmonar 1 2,3 Arritmia auricular 2 4,7 Arritmia ventricular 1 2,3 Otra complicación cardíaca Elevación ST 1 2,3 Sangrado digestivo 1 2,3 Infección del tracto urinario 2 4,7 Anemia 2 4,7 Otra 2 4,7 Proyecto de un registro institucional de cirugía de tórax. sino en el mundo; en su trabajo Thomas (6) demuestra la necesidad de crear un registro mundial para el manejo de los timomas. En Colombia, donde no se cuenta con estadísticas veraces, el reporte que se presenta aquí muestra los datos de 43 pacientes operados en una institución permitiendo comparar las comorbilidades (90%), los desenlaces (ej: estancia hospitalaria de 9 días), las complicaciones (41,8%) y la mortalidad (9,4%) de varios procedimientos. En el trabajo de Wright y colaboradores (7) se buscaron los factores de riesgo para estancia hospitalaria prolongada, que se consideró a partir del día 14 postquirúrgico, lo cual sólo ocurrió en 7% de los 4.979 pacientes operados, con una mediana de estancia hospitalaria de 6 días (RIQ 3-8). En nuestro trabajo se encontró una mediana de estancia hospitalaria de 9 días (RIQ 5-18), lo cual es comparable si se tiene en cuenta que en este registro se combinan diagnósticos de enfermedad maligna y de enfermedades benignas inflamatorias, hecho que, bien se sabe, aumenta un poco la estancia hospitalaria; sin embargo, este análisis permite afirmar que la estancia hospitalaria nuestra es ligeramente superior a la estancia postoperatoria en los procedimientos de cirugía torácica en los Estados Unidos (que se registran en la base de datos de la STS) y a futuro permitirá tomar decisiones para mejorar este aspecto. En el trabajo de Onaitis y colaboradores (8) se buscan factores de riesgo para fibrilación auricular en pacientes operados por cáncer de pulmón, encontrando esta patología en 12,6% de 13.906 pacientes incluidos. En nuestro reporte hubo 2 (4,7%) pacientes que presentaron fibrilación auricular y aunque el número de pacientes es menor, es una muestra clara del potencial de comparación y estudio que este registro tiene para el futuro. Velásquez y cols. CONCLUSIONES En este trabajo se presentan los primeros datos de un registro institucional de cirugía de tórax, lo cual es un gran esfuerzo que se ve recompensado al poder comparar los resultados con los datos de otros países y con ello tomar decisiones para ofrecer un mejor tratamiento a los pacientes de nuestra institución. Este trabajo es sólo el inicio y con el paso del tiempo se espera incrementar el número de pacientes de modo que puedan realizarse análisis más profundos y comparar datos con los de otras instituciones en el mundo. BIBLIOGRAFÍA 1. Orringer M. STS database activities and you: “What´s in it for me?” Ann Thorac Surg. 2001; 72: 1-2. 2. Cáceres M, Braud R, Garrett H. A short history of The Society of Thoracic Surgeons National Cardiac Database: Perceptions of a practicing surgeon. Ann Thorac Surg. 2010; 89: 332-339. 3. Edwards F. The STS database at 20 years: A tribute to Dr. Richard E. Clark. Ann Thorac Surg. 2010; 89: 9-10. 4. Parkin D. Global cancer statistics in the year 2000. Lancet Oncology. 2001; 2: 533-543. 5. Bernard A, Rivera C, Pages P, Falcoz P, Vicaut E, Dahan M. Risk model of in-hospital mortality after pulmonary resection for cancer: A national database of the French Society of Thoracic and Cardiovascular Surgery (Epithor). J Thorac Cardiovasc Surg. 2011; 141: 449-458. 6. Thomas P. The need for organization and collaboration: Establishing a Thymoma registry. Thorac Surg Clin. 2011; 21: 131-134. 7. Wright C, Gaissert H, Grab J, O´Brien S, Paterson E, Allen M. Predictors of prolonged length of stay after lobectomy for lung cancer: A Society of Thoracic Surgeons General Thoracic Surgery Database risk-adjustment model. Ann Thorac Surg. 2008; 85: 1857-1865. 8. Onaitis M, D´Amico T, Zhao Y, O´Brien S, Harpole D. Risk factors for atrial fibrillation after lung cancer surgery: Analysis of The Society of Thoracic Surgeons General Thoracic Surgery Database. Ann Thorac Surg. 2010; 90: 368-374. 75 Revista Colombiana de Neumología Volumen 24 Número 2 ARTÍCULOS ORIGINALES Anestesia peridural con paciente despierto para cirugía de tórax Epidural anesthesia in awake thoracic surgery Indira Fabiana Cujiño, MD.(1); Mauricio Velásquez, MD.(2) RESUMEN La anestesia general complementada con la peridural, es en la actualidad la técnica de elección en los pacientes de cirugía de tórax; sin embargo, nuevos estudios sugieren que la anestesia peridural sola puede tener algunos beneficios. Se realizó un estudio prospectivo que incluyó todos los pacientes sometidos a toracoscopia para cualquier procedimiento torácico y que se hicieran con una técnica de anestesia peridural con el paciente despierto. Se incluyeron veinte pacientes que fueron seguidos durante toda su hospitalización en búsqueda de eventos adversos cardiacos, pulmonares, renales o hidroelectrolíticos, muerte y los relacionados con el manejo del dolor postoperatorio. Se hicieron pleurodesis con talco, decorticaciones y cuñas pulmonares. Cuatro pacientes presentaron alguna complicación y tres fallecieron debido a su enfermedad de base. Este estudio sugiere que la anestesia peridural con el paciente despierto es una técnica segura para los procedimientos por toracoscopia y que se asocia con una incidencia baja de complicaciones respiratorias y dolor postquirúrgico. Se requieren más estudios clínicos que corroboren esta observación. Palabras clave: anestesia peridural, cirugía torácica, toracoscopia. ABSTRACT General anesthesia combined with epidural anesthesia is currently the technique of choice in patients undergoing thoracic surgery. However, new studies suggest that epidural anesthesia alone could have some benefits. A prospective study was done which included all patients who underwent thoracoscopy for any thoracic procedure performed with epidural anesthesia with the patient awake. Twenty (20) patients were included and followed up during their whole hospital stay in search for adverse cardiac, pulmonary, renal, or hydroelectrolytic adverse effects, death, or events related with postoperative pain management. Talc pleurodesis, decortications, and wedge resections were performed. Four patients had any complication and 3 patients died due to their basal illness. This study suggests that awake epidural anesthesia is a safe technique for thoracoscopic procedures. It is associated with low rates of respiratory complications and postoperative pain. Further clinical studies are needed in order to confirm this observation. Keywords: epidural anesthesia, thoracic surgery, thoracoscopy. Rev Colomb Neumol 2013; 24 (2):76-79 INTRODUCCIÓN Los progresos en ventilación pulmonar y el desarrollo de las técnicas anestésicas, han permitido el desarrollo concomitante de la cirugía de tórax (1-3). (1) La necesidad de colapso pulmonar en cirugía, estimuló el desarrollo de dispositivos que permitieran aislar un pulmón de forma ventilatoria. Estudios posteriores permitieron conocer la fisiología de la ventilación unipulmonar, las indicaciones de la separación pulmonar Médica Anestesióloga, Fundación Valle del Lili, Cali, Colombia. Médico Cirujano de Tórax, Fundación Valle del Lili, Cali, Colombia. (2) Correspondencia: Doctora Indira Fabiana Cujiño. Correo electrónico: indirafcuji@yahoo.com Recibido: septiembre 8 de 2012. Aceptado: noviembre 5 de 2012. 76 Anestesia peridural con paciente despierto para cirugía de tórax. y las técnicas para lograr este propósito (2). Hasta el momento, la anestesia general sola o en combinación con anestesia peridural se considera la mejor opción en el manejo anestésico de los pacientes de cirugía torácica (2, 3). Las ventajas de la anestesia peridural torácica son ampliamente conocidas en cirugía de tórax. Existe evidencia a favor de la técnica neuroaxial peridural y su relación con menor sangrado intraoperatorio, mejor manejo del dolor postoperatorio, inicio temprano de la deambulación y de la vía oral, atenuación de la respuesta al estrés quirúrgico, disminución de la frecuencia cardiaca y las arritmias relacionadas con la manipulación intraoperatoria, mejoría en los determinantes del flujo sanguíneo miocárdico y la función ventricular izquierda, extubación temprana, disminución de las complicaciones trombóticas postoperatorias, disminución del riesgo de infecciones postoperatorias y mejoría en la función pulmonar postoperatoria (4-11). En la búsqueda por evitar malos desenlaces relacionados con la anestesia general, como las complicaciones de la vía aérea por manipulación de la misma, mayor riesgo de neumonía, posibilidad de injuria pulmonar por la ventilación mecánica y aparición de atelectasias en el pulmón dependiente, se han publicado estudios en los que se ha utilizado la anestesia peridural para procedimientos como cirugía de bypass coronario, timectomía transesternal y cirugía de mama, con resultados benéficos a favor de esta técnica anestésica. (5, 9, 12-14). En cirugía de tórax, específicamente, sólo dos grupos en el mundo han mostrado la utilización de anestesia peridural con el paciente despierto para procedimientos quirúrgicos en tórax (5, 15, 16). Dado lo anterior, se realizó un estudio que analizará diferentes desenlaces postoperatorios en pacientes con distintas patologías y procedimientos hechos con técnica peridural con el paciente despierto (APPD). MATERIALES Y MÉTODOS Se llevó a cabo un estudio descriptivo prospectivo, desde el 1o. de enero de 2010 al 31 de diciembre de 2010, en el que se incluyeron todos los pacientes mayores de 18 años, programados para cirugía de tórax, que fuera realizada con APPD durante el período de estudio. Para el registro prospectivo de los datos se diseñó un instrumento para tal fin, en el que se registraban los datos del perioperatorio temprano así como aquellos Cujiño y cols. relacionados con los desenlaces de interés hasta los primeros treinta días del postoperatorio. Todos los procedimientos estuvieron a cargo de un grupo de anestesiólogos entrenados en anestesia para cirugía de tórax, quienes estandarizaron previamente el manejo intraoperatorio de la técnica anestésica utilizada. Ninguno de los anestesiólogos participó en el manejo postoperatorio o en la toma de decisiones durante la estancia en la unidad de cuidado intensivo o pisos, así como en la valoración de los desenlaces postoperatorios tempranos, los cuales fueron registrados por una persona previamente entrenada para tal fin. Para la técnica APPD, se administró 1 mg de midazolam por vía intravenosa y luego se insertó un catéter peridural #18 en el espacio de T3-T4 por técnica de pérdida de resistencia. Una vez pasado el catéter y previa verificación de su adecuada posición, se pasaron 8 mL de bupivacaína al 0,5%, con epinefrina. Se ubicó al paciente en decúbito lateral, se utilizó un sistema de Ventury al 50% para la administración de oxígeno y se vigiló el procedimiento con monitoría básica (incluida capnografía a través de una de las fosas nasales del paciente). El nivel de bloqueo se evaluó de manera constante para mantener niveles de bloqueo sensitivo entre T1 y T7 aplicando bolos adicionales de 2-4 mL más de bupivacaína al 0,5% si se consideraba necesario. Luego de cirugía todos los pacientes permanecieron con el catéter peridural por 24 horas más en espera de la decisión del uso o no de analgesia peridural continua por el grupo de clínica del dolor. Todos los procedimientos fueron realizados por el mismo cirujano, quien utilizó un solo puerto de toracoscopia en el quinto espacio intercostal con línea axilar anterior, de 20 a 30 milímetros de longitud, por el que se introdujo simultáneamente la cámara y los instrumentos de trabajo de acuerdo con cada caso. Al final de la cirugía se dejó un tubo de toracostomía 28 Fr. Al terminar el procedimiento todos los pacientes se trasladaron a la unidad de cuidados postanestésicos, en donde eran evaluados por el grupo de cuidado intensivo quienes decidían la mejor ubicación de éstos para su cuidado postoperatorio. El análisis estadístico se realizó con el software estadístico STATA 10 (StataCorp 4905 Lakeway Dr. USA). Las variables categóricas se muestran como frecuencias absolutas y frecuencias relativas y las variables cuantitativas se presentan como medidas de tendencia central y dispersión (promedio, DS, si se cumplían los criterios de normalidad) y como medianas y rangos intercuartílicos para los datos dispersos. Dado que este estudio era de tipo observacional, se decidió, desde el inicio del diseño, no realizar un 77 Revista Colombiana de Neumología Volumen 24 Número 2 consentimiento informado específico para la investigación adicional a los consentimientos de anestesiología y cirugía que por ley se exigen. de pacientes que requieren algún tipo de cirugía torácica. En este estudio se muestra una serie de pacientes con diferentes diagnósticos y procedimientos realizados bajo APPD. RESULTADOS Este estudio muestra que la APPD es una técnica segura incluso en pacientes ASA 3-4, con tiempos quirúrgicos y anestésicos aceptables si se compara con la duración de una cirugía bajo anestesia general. Los tiempos de hospitalización pudieran considerarse un poco prolongados para el tipo de procedimientos realizados; sin embargo están justificados por la clase funcional de estos pacientes. En cuanto a los tiempos totales de hospitalización prolongados, tienen soporte en el hecho de que en nuestra institución es frecuente que los pacientes con cáncer de cualquier tipo queden a cargo del Servicio de Oncología, donde inician estudios y tratamientos oncológicos mientras permanecen hospitalizados. También se demostró que el EVA (escala visual análoga de dolor) inmediato y a las 24 horas postoperatorias, fue menor de 5 y que no hubo necesidad de utilizar analgésicos opioides, lo cual permite, como lo menciona Waurick, (17) que el paciente pueda deambular y realizar actividades como comer y levantarse al baño más pronto, y disminuir así los riesgos de trombosis venosa profunda, tromboembolismo pulmonar, atelectasias pulmonares, neumonía, estreñimiento e infección urinaria. Se incluyeron 20 pacientes, 14 mujeres y 6 hombres, con una edad promedio de 72 (41-95) años. En la tabla 1 se muestran los datos descriptivos de las cirugías y los diagnósticos de los pacientes intervenidos. Los procedimientos realizados fueron pleurodesis con talco, resecciones pulmonares en cuña y decorticaciones. Los datos de los resultados y el manejo postoperatorio (tabla 2) muestran los días de necesidad de cuidado intensivo, de ventilación mecánica, los pacientes que necesitaron el catéter peridural en el postoperatorio inmediato, los días de su uso, y finalmente los días de hospitalización. Tres pacientes fallecieron, los tres tenían diagnóstico de cáncer y el procedimiento que se les realizó fue una pleurodesis con talco; sin embargo la muerte no se relacionó con el procedimiento y, en dos casos se debió a enfermedad avanzada y en el otro a tromboembolismo pulmonar. Las demás complicaciones se registran en la tabla 3. DISCUSIÓN La anestesia general sola o combinada con anestesia peridural es hoy la técnica de elección en la mayoría La mitad de los pacientes del estudio fueron a la unidad de cuidado intensivo y sólo cinco requirieron algún tipo de asistencia ventilatoria. Esto se puede explicar porque al implementar una técnica anestésica Tabla 1. Datos descriptivos de las cirugías. ASA Diagnóstico (n) Procedimiento (n) 2-4 Derrame pleural (15) Pleurodesis (15) Duración de la cirugía (min) Duración de la anestesia (min) 35 (15-60) 86 (50-225) Nódulo pulmonar (3) Cuña pulmonar (3) Empiema (2) Decorticación pulmonar (2) (n)= número de pacientes. min= minutos. Tabla 2. Datos del manejo postoperatorio. Pacientes en UCI Promedio días en UCI Pacientes en VM (duración en días) Pacientes en VMNI (duración en días) Pacientes con peridural (duración en días) Hospitalización cirugía de tórax (promedio) Hospitalización total (promedio) Tabla 3. Complicaciones postoperatorias. 10 2 (0-15) 2 (1-6) 3 (2-5) 8 (1-3) 4 (1-6) 10 (1-30) UCI= unidad de cuidado intensivo. VM= ventilación mecánica. VMNI= ventilación mecánica no invasiva. 78 EVA inmediato 1 (1-5) EVA 24 horas 1 (1-4) Pacientes con necesidad de opioides 0 Complicaciones Falla respiratoria 3 Falla renal 1 Muerte 3 EVA= escala visual análoga de dolor. Anestesia peridural con paciente despierto para cirugía de tórax. nueva los primeros casos realizados con APPD fueron enviados a las unidades de cuidado intensivo para vigilancia respiratoria, situación que fue cambiando y los últimos se trasladaban con tranquilidad a una habitación. Un hallazgo importante fue el número bajo de complicaciones respiratorias. Similares resultados fueron encontrados por Tacconi y colaboradores (18) en 66 pacientes a quienes les realizaron cirugía de reducción de volumen unilateral con APPD y los compararon con un grupo control con AG. Estos hallazgos van de la mano con el mejor control del dolor postoperatorio y con el hecho de evitar la manipulación de la vía aérea y el uso de ventilación mecánica invasiva. En cuanto a los resultados obtenidos en relación con la estancia hospitalaria, Pompeo y colaboradores reportaron, en varios estudios para diferentes tipos de procedimientos que incluían resección pulmonar segmentaria (19) metastasectomías (20) y manejo de neumotórax espontáneo (21), que los pacientes manejados con APPD presentaron menor estancia hospitalaria y mayor satisfacción con la técnica anestésica. De la misma manera, Al-Abdullatief y colaboradores (15) demostraron, en un estudio con 79 pacientes, que la APPD disminuye la estancia hospitalaria y la necesidad de UCI al evitar la AG. Se requieren estudios con una población más grande que permita comparar aspectos como la estancia en la unidad de cuidado intensivo, el tiempo de ventilación mecánica y en otro tipo de cirugías. CONCLUSIONES La anestesia peridural con el paciente despierto para la realización de cirugías de tórax, es una técnica anestésica segura, que se asocia con baja incidencia de complicaciones respiratorias en el postoperatorio y con disminución del dolor con base en la Escala Visual Análoga evaluada en el posoperatorio inmediato y a las 24 horas postoperatorias. Son precisos más estudios que incluyan mayor número de pacientes y metodologías diferentes para evaluar otras variables. BIBLIOGRAFÍA 1. Brodsky J, Lemmens H. The history of anesthesia for thoracic surgery. Minerva Anestesiol. 2007; 73: 513-524. 2. Wilson W., Benumof J. Anestesia en cirugía torácica. En: Miller R.: Miller Anestesia.. Sexta edición. Madrid: Elsevier; 2005. p. 1847. 3. Galbis J. Anesthesia for thoracic surgery: a challenge for the twenty-first century. Rev Esp Anestesiol Reanim. 2010; 57: 545. 4. Slinger P. Pro: every posthoracotomy patient deserves thoracic Cujiño y cols. epidural analgesia. J Cardiothorac Vasc Anesth. 1999; 13: 350354. 5. Mineo T. Epidural anesthesia in awake thoracic surgery. Eur J Cardio-Thorac Surg. 2007; 32: 13-19. 6. Lagunilla J, García J, Fernández A, Álvarez J, Rubio J, Rodríguez J. High thoracic epidural blockade increases myocardial oxygen in coronary surgery patients. Acta Anesthesiol Scand. 2006; 50: 780-786. 7. Loick H, Schmidt C, Van Aken H, Junker R, Erren M, Berendes E, et al. High thoracic epidural anesthesia, but not clonidine, attenuates the perioperative stress response via sympatholysis and reduces the release of troponin T in patients undergoing coronary artery bypass grafting. Anesth Analg. 1999; 88: 701-709. 8. Groeben H. Epidural anesthesia and pulmonary function. J Anesth. 2006; 20: 290-299. 9. Vanni G, Tacconi F, Sellitri F, Ambrogi V, Mineo T, Pompeo E. Impact of awake videothoracoscopic surgery on postoperative lymphocyte responses. Ann Thorac Surg. 2010; 90: 973-978. 10.Clemente A, Carli F. The physiological effects of thoracic epidural anesthesia and analgesia on the cardiovascular, respiratory and gastrointestinal systems. Minerva Anestesiológica. 2008; 74: 549-563. 11. Mutz C, Vagts D. Thoracic epidural anesthesia in sepsis – is it harmful or protective. Critical Care. 2009; 13: 182. 12. Yen C, Tsou M, Lin S, Chan K, Chu Y. Thoracic epidural anesthesia for a polymyositis patient undergoing awake mini-thoracotomy and unroofing of a huge pulmonary bulla. Acta Anaesthesiol Taiwan. 2008; 46: 42-45. 13. Groeben H, Schäfer B, Pavlakovic G, Silvanus M, Peters J. Lung function under high thoracic segmental epidural anesthesia with ropivacaine or bupivacaine in patients with severe obstructive pulmonary disease undergoing breast surgery. Anesthesiology. 2002; 96: 536-541. 14.Anderson M, Kwong K, Furst A, Salerno T. Thoracic epidural anesthesia for coronary bypass via left anterior thoracotmy in the conscious patient. Eur J Cardio-Thorac Surg. 2001; 20: 415417. 15. Al-Abdullatief M, Wahood A, Al-Shirawi N, Arabi Y, Wahba M, AlJumah M, et al. Awake anaesthesia for major thoracic surgical procedures: An observational study. Eur J Cardio-Thorac Surg. 2007; 32: 346-350. 16.Mukaida T, Andou A, Date H, Aoe M, Shimizu N. Thoracoscopic operation for secondary pneumothorax under local and epidural anesthesia in high-risk patients. Ann Thorac Surg. 1998; 65: 924-926. 17.Waurick R, Van Aken H. Update in thoracic epidural anaesthesia. Best Practice and Research Clinical Anaesthesiology. 2005; 19: 201-213. 18.Tacconi F, Pompeo W, Mineo T. Duration of air leak is reduced after awake nonresectional lung volume reduction surgery. Eur J Cardio-Thorac Surg. 2009: 35: 822-828. 19.Pompeo E, Mineo D, Rogliani P, Sabato A, Mineo T. Feasibility and results of awake thoracoscopic resection of solitary pulmonary nodules. Ann Thorac Surg. 2004; 78: 1761-1768. 20.Pompeo E, Mineo T. Awake pulmonary metastasectomy. J Thorac Cardiovasc Surg. 2007; 133: 960-966. 21.Pompeo E, Tacconi F, Mineo D, Mineo T. The role of awake video-assisted thoracoscopic surgery in spontaneous pneumothorax. J Thorac Cardiovasc Surg. 2007; 133: 786-790. 79 Revista Colombiana de Neumología Volumen 24 Número 2 ARTÍCULOS ORIGINALES Cirugía toracoscópica unipuerto: experiencia en la Fundación Valle del Lili Uniport thoracoscopic surgery: experience at the Fundación Valle del Lili Mauricio Velásquez Galvis(1); Andrés Fernando Domínguez Calero(2) RESUMEN La forma de realizar la cirugía toracoscópica ha venido presentando cambios y ha evolucionado en la medida en que el desarrollo tecnológico ha desarrollado nuevos instrumentos que permiten tener mayor precisión y seguridad. En la actualidad se pueden encontrar algunas experiencias con diferentes procedimientos torácicos realizados por un solo puerto. Se diseñó un trabajo con el objetivo de evaluar los desenlaces de los pacientes llevados a cirugía torácica vídeo-asistida a través de un solo puerto. Se realizó un trabajo descriptivo, prospectivo, en el que se incluyeron todos los pacientes que fueran llevados a algún procedimiento de cirugía de tórax planeado para realizarse por toracoscopia y que hubiera sido hecho por un solo puerto, estudiando variables demográficas, tiempo operatorio, estancia hospitalaria, duración del tubo de tórax y complicaciones relacionadas con el procedimiento. Se operaron 38 pacientes; la mayoría de los procedimientos efectuados fueron pleurodesis con talco para derrames malignos y decorticaciones pulmonares por empiemas pleurales. La mediana de tiempo quirúrgico fue de 42 minutos y la estancia hospitalaria fue de ocho días. Las complicaciones más frecuentes fueron respiratorias, como la necesidad de uso de ventilación mecánica no invasiva. Falleció un paciente debido a su enfermedad avanzada. La cirugía torácica video-asistida a través de un sólo puerto representa una evolución de la cirugía toracoscópica tradicional. Es un procedimiento simple, efectivo y beneficioso para los pacientes, con una morbilidad mínima. Palabras clave: toracoscopia, unipuerto. ABSTRACT Thoracoscopic surgical techniques have changed and evolved as technological development has produced instruments capable of greater precision and safety. Today it is possible to find some experiences with different thoracic procedures performed through a single incision. A study was designed with the aim of assessing the outcomes of patients undergoing video-assisted thoracic surgery performed through a single incision. A descriptive, prospective study was carried out. The study included all patients who underwent surgery performed by thoracoscopy through a single port. The study assessed demographic variables, duration of surgery, length of hospital stay, time with chest tube, and complications related with the procedure. Thirty eight (38) patients were operated. The most common procedures were talc pleurodesis for malignant pleural effusions and pulmonary decortication for empyema. The median surgical time was 42 minutes, and the median hospital stay was 8 days. The most common complications were of respiratory origin, such as the need for non-invasive mechanical ventilation. Only one patient died, due to advanced illness. Video-assisted thoracic surgery performed through a single incision is an evolution of traditional thoracoscopic surgery. It is a simple, effective, and beneficial procedure, whose morbidity is minimal. Keywords: thoracoscopy, uniportal surgery. Rev Colomb Neumol 2013; 24 (2):80-83 (1) Cirujano de Tórax, Fundación Valle del Lili, Cali, Colombia. Residente II año, Universidad CES, Fundación Valle del Lili, Cali, Colombia. (2) Correspondencia: Doctor Mauricio Velásquez Galvis, Correo electrónico: mauriciovelasq@yahoo.com Recibido: septiembre 13 de 2012. Aceptado: noviembre 22 de 2012. 80 Cirugía toracoscópica unipuerto: experiencia en la Fundación Valle del Lili. INTRODUCCIÓN La cirugía torácica video-asistida ha cambiado definitivamente el manejo quirúrgico y la evolución postoperatoria de los pacientes con diferentes patologías pulmonares y mediastinales. La forma de realizar la cirugía toracoscópica también ha sufrido cambios y ha evolucionado en la medida en que el desarrollo tecnológico ha creado nuevos instrumentos que permiten tener mayor precisión y seguridad, de tal manera que la forma en que tradicionalmente se enseñaba a ubicar los puertos para acceder a la cavidad torácica ha venido adaptándose a las necesidades de cada paciente y a la experiencia de cada cirujano. En la actualidad se pueden encontrar algunas experiencias con diferentes procedimientos torácicos realizados por un solo puerto (1, 2). En este trabajo se presenta la experiencia de un centro en la realización de cirugía toracoscópica por un solo puerto. MATERIALES Y MÉTODOS Durante el período de tiempo comprendido entre enero de 2010 y diciembre de 2010 se diseñó un estudio descriptivo, prospectivo, con el objetivo de evaluar los desenlaces de los pacientes llevados a cirugía torácica video-asistida a través de un solo puerto, en el que se incluyeron todos los pacientes mayores de 18 años que fueran llevados a algún procedimiento de cirugía de tórax planeado para realizarse por toracoscopia y que hubiera sido hecho por un solo puerto. Se excluyeron los pacientes en quienes, por cualquier razón durante la cirugía, se hubiera tenido que fabricar otro puerto, así como los pacientes que se hubieran tenido que convertir a cirugía abierta. Velásquez y cols. puerto para la cámara, que además permitía la introducción del instrumental necesario para cada tipo de cirugía. Una vez finalizado el procedimiento se dejaba un tubo de tórax #28 que era fijado con un material de sutura no absorbible; posteriormente se cerraban un plano muscular y otro subcutáneo con un material absorbible y finalmente la piel. Para la recolección de los datos se diseñó un instrumento en el que se mantenía la confidencialidad de los pacientes, por lo que no se consideró necesario firmar un consentimiento informado. Los datos se procesaban en Excel de Microsoft, con el cual se hizo el análisis estadístico utilizando las medidas de normalidad expresadas en medianas y rangos intercuartílicos. RESULTADOS Se operaron 38 pacientes, 19 mujeres (50%) y 19 hombres (50%). Los datos demográficos se observan en la tabla 1. La mayoría de los procedimientos realizados fueron pleurodesis con talco para derrames malignos y decorticaciones pulmonares por empiemas pleurales. En la tabla 2 se muestran los resultados de las variables operatorias. Las complicaciones encontradas se registran en la tabla 3; de éstas las más frecuentes fueron respiratorias, como requerimiento de ventilación mecánica, Tabla 1. Datos demográficos. Edad (años) 60 (46-74)* Diagnóstico n (%) Derrame pleural maligno Derrame pleural Empiema Se estudiaron variables demográficas y otras de interés como tiempo operatorio, estancia hospitalaria, duración del tubo de tórax y complicaciones relacionadas con el procedimiento o con la enfermedad de base. Nódulo pulmonar La técnica empleada es similar a la descrita por Rocco (3) y comprende una intubación selectiva con tubo bilumen o una técnica con anestesia peridural y con el paciente despierto, lo cual fue libremente escogido por el grupo de anestesia; luego se ubicaba al paciente en decúbito lateral y se realizaba una única incisión, estandarizada en el quinto espacio intercostal entre las líneas axilar anterior y media, de unos 2 a 4 centímetros y a través de la cual se introducía un 13 (34%) 2 (5%) 10 (26%) 7 (18%) Neumotórax 3 (8%) Malformación arteriovenosa pulmonar 1 (3%) Cáncer de pulmón 1 (3%) Tumor fibroso de pleura 1 (3%) Procedimientos Pleurodesis con talco 12 (33%) Resección pulmonar en cuña 10 (26%) Decorticación pulmonar 13 (34%) Lobectomía pulmonar 3 (8%) * Valores en mediana y rango intercuartílico. 81 Revista Colombiana de Neumología Volumen 24 Número 2 Tabla 2. Resultados postoperatorios. Variable Mediana (riq) Tiempo quirúrgico (minutos) Tubo de tórax (días) Estancia hospitalaria (días) 43 (30-60) 4 (3-6) 8 (6-60) Tabla 3. Complicaciones postoperatorias. Complicación n VM 8 VMNI 9 Traqueostomía 2 Complicaciones respiratorias 3 Hipotensión 4 Uso de vasoactivos 3 Complicaciones cardiacas 1 VM: ventilación mecánica. VMNI: ventilación mecánica no invasiva. ventilación mecánica no invasiva y presencia de neumonía (dos pacientes) y de atelectasia (un paciente). Sólo se registró una complicación cardíaca en un paciente que tuvo fibrilación auricular y que cedió con manejo médico. Sólo un paciente falleció debido a un cáncer de esófago avanzado que presentó complicaciones sépticas por perforación de la masa tumoral. DISCUSIÓN La cirugía toracoscópica ha cambiado la forma en que se manejan los pacientes de cirugía de tórax; de igual manera, este tipo de cirugía ha venido evolucionando y cada vez se disminuyen los puertos de abordaje para la realización de los procedimientos pulmonares y mediastinales. Desde 2004 aparece la primera descripción de resecciones pulmonares en cuña para el diagnóstico de enfermedades intersticiales realizadas a través de un solo puerto con excelentes resultados en cuanto a estancia hospitalaria, duración del tubo de tórax y dolor postoperatorio (4, 5). En este trabajo se encontró que el abordaje unipuerto para los procedimientos de cirugía torácica es factible y permite efectuar diferentes cirugías, algunas simples, como la pleurodesis con talco, hasta procedimientos tan complejos como la lobectomía pulmonar total con vaciamiento ganglionar por cáncer de pulmón. Rocco y colaboradores habían mostrado una duración del tubo de tórax y una estancia hospitalaria de 82 1 (1-6) y 2,5 (1-6) días respectivamente (6), lo cual es menor si se compara con nuestros resultados. Sin embargo, en el trabajo de Rocco sólo se hicieron cuñas pulmonares para enfermedades intersticiales o neumotórax, mientras que en este reporte se incluyen otros tipos de diagnósticos y cirugías que pueden aumentar un poco más la estancia hospitalaria y la duración del tubo de tórax. Lo anterior se puede observar mejor en el trabajo de Migliore (7), en el que la estancia hospitalaria fue de 6 a 8 días según la patología (benigna o maligna), y la duración del tubo de tórax fue de 5 días, resultados comparables con los nuestros. Los tiempos quirúrgicos son similares en todos los trabajos (4, 6, 7) y oscilan en los 65 minutos; no obstante, encontramos que la mediana del tiempo operatorio fue de 42 minutos. Las complicaciones reportadas más frecuentes son las respiratorias debido más a las enfermedades de base que a los procedimientos realizados. Migliore (7) reporta una morbilidad en 19 pacientes, mas no especifica en qué consistió, mientras que en nuestro trabajo se reporta como la principal complicación el uso de ventilación mecánica invasiva y no invasiva en ocho y nueve pacientes, respectivamente (Tabla 3). En cuanto a las tres lobectomías, que merecen comentario aparte, sólo podrían compararse con el reporte de González y colaboradores (8) en el que se hizo igualmente una lobectomía pulmonar inferior izquierda con un tiempo quirúrgico de 110 minutos y una estancia hospitalaria de tres días, hecho comparable con nuestros datos. De igual forma, se encuentran resultados muy similares en los tres pacientes, excepto en uno que tuvo una estancia de ocho días debido a neumotórax residual luego del retiro del tubo de tórax y que finalmente tuvo desenlace sin otros contratiempos. CONCLUSIONES La cirugía torácica video-asistida a través de un solo puerto, representa una evolución de la cirugía toracoscópica tradicional con unos resultados comparables. Es un procedimiento simple, efectivo y beneficioso para los pacientes, cuya morbilidad es mínima. Se requieren más estudios que permitan comparar los desenlaces de los procedimientos realizados por un solo puerto frente a los que utilicen más incisiones. BIBLIOGRAFÍA 1. Salati M, Brunelli A, Rocco G. Uniportal video-assisted thoracic surgery for diagnosis and treatment of intrathoracic conditions. Thorac Surg Clin. 2008; 18: 305-310. Cirugía toracoscópica unipuerto: experiencia en la Fundación Valle del Lili. 2. Rocco G, Romano V, Accardo R, Tempesta A, La Manna C, La Rocca A, e al. Awake single-access (Uniportal) video-assisted thoracoscopic surgery for peripheral pulmonary nodules in a complete ambulatory setting. Ann Thorac Surg. 2010; 89: 16251627. 3. Rocco G. Single-port video-assisted thoracic surgery (uniportal) in the routine general thoracic surgical practice. Op Tech Thorac Cardiovasc Surg. 2009; 14: 326-335. 4. Rocco G, Martin-Ucar A, Passera E. Uniportal VATS wedge pulmonary resections. Ann Thorac Surg. 2004; 77: 726-728. 5. Jutley R, Khalil M, Rocco G. Uniportal versus standar three-port VATS technique for espontaneous pneumothorax: Comparison Velásquez y cols. of post-operative pain and residual paraesthesia. Eur J Cardiothorac Surg. 2005; 28: 43-46. 6. Rocco G, Khalil M, Jutley R. Uniportal video-assisted thoracoscopic surgery wedge lung biopsy in the diagnosis of interstitial lung diseases. J Thorac Cardiovasc Surg. 2005; 129: 947-948. 7. Migliore M. Efficacy and safety of single-trocar technique for minimally invasive surgery of the chest in the treatment of noncomplex pleural disease. J Thorac Cardiovasc Surg. 2003; 126: 1618-1623. 8. González D, Delgado M, Paradela M, Fernández R. Uni-incisional video-assisted thoracoscopic left lower lobectomy in a patient with an incomplete fissure. Innovations 2011; 6: 45-47. 83 Revista Colombiana de Neumología Volumen 24 Número 2 ARTÍCULOS ORIGINALES Experiencia diagnóstica de diez años del tumor neuroendocrino de pulmón en la Fundación Santa Fe de Bogotá: 2001 – 2010 Ten years of experience in diagnosing neuroendocrine neoplasms of the lung at the Fundación Santa Fe de Bogotá: 2001 – 2010 Lucía Beatriz Taboada Barrios, MD.(1); Rocío del Pilar López Panqueva, MD.(2); Luis Gerardo García-Herreros Hellal, MD.(3); Deyanira González Devia, MD.(4) RESUMEN Introducción: los tumores neuroendocrinos de pulmón surgen a partir de las células de Kulchitsky dispersas en todo el árbol bronquial; éstos tienen un amplio espectro de diferenciación histológica y son capaces de producir aminas bioactivas. Objetivos: describir las características clinicopatológicas de la población con diagnóstico de tumores neuroendocrinos de pulmón en el Hospital Universitario Fundación Santa Fe de Bogotá (HUFSFB) de 2001 a 2010. Diseño: estudio descriptivo tipo corte transversal. Materiales y métodos: se incluyó toda la población con tumores neuroendocrinos de pulmón confirmados por patología en el HUFSFB durante el periodo 2001 a 2010. Se revisaron los reportes de patologías y los registros médicos para la obtención de datos. Resultados: se incluyeron 132 casos. El tipo de tumor más frecuente fue el carcinoma de célula pequeña. El carcinoide típico fue cinco veces más frecuente que el atípico. Los tumores bien diferenciados fueron más frecuentes en mujeres y los de alto grado en hombres, presentándose a mayor edad y asociados al antecedente de tabaquismo. La principal forma de llegar al diagnóstico fue la aparición de síntomas secundarios al tumor. De todos los sujetos, 50% tenía metástasis al momento del diagnóstico, la mayoría en las formas mal diferenciadas. Conclusiones: el pulmón presenta un espectro histológico, clínico y bioquímico muy heterogéneo de tumores neuroendocrinos. Aun no hay datos nacionales de incidencia y supervivencia de este tipo de tumor. Se busca motivar la investigación en este campo y alertar sobre el seguimiento necesario, incluso en los tumores bien diferenciados. Palabras clave: cáncer de pulmón, tumores neuroendocrinos, carcinoma neuroendocrino, tumor carcinoide, carcinoma de células pequeñas del pulmón. ABSTRACT Introduction: neuroendocrine tumors (NET) of the lung arise from Kulchitsky cells, which are found throughout the bronchial tree. These tumors have a broad range of histologic differentiation, and are capable of producing bioactive amines. Departamento de Medicina Interna, Sección Endocrinología, Hospital Universitario Fundación Santa Fe de Bogotá. Bogotá. Colombia. Servicio Social Obligatorio, Medicina Interna, Fundación Santa Fe de Bogotá. Departamento de Patología y Laboratorios, Hospital Universitario Fundación Santa Fe de Bogotá. Profesor Facultad de Medicina, Universidad de los Andes. Bogotá, Colombia. (3) Cirugía de Tórax, Hospital Universitario Fundación Santa Fe de Bogotá. Profesor Facultad de Medicina, Universidad de los Andes. Bogotá, Colombia. (4) Medicina Interna, Endocrinología Oncológica, Hospital Universitario Fundación Santa Fe de Bogotá. Profesor Facultad de Medicina, Universidad de los Andes. Bogotá, Colombia. (1) (2) Correspondencia: Dra. Deyanira González Devia. Calle 119 No. 7 – 75. 2º Piso. Clínicas especializadas. Hospital Universitario Fundación Santa Fe de Bogotá. Teléfono: (571) 6030303 Ext. 5069. Correo electrónico: deyaniragonzalezdevia@yahoo.com, luciataboadab@gmail.com Recibido: agosto 5 de 2012. Aceptado: noviembre 12 de 2012. 84 Experiencia diagnóstica de diez años del tumor neuroendocrino de pulmón en la Fundación Santa Fe de Bogotá. Taboada y cols. Objectives: to describe the clinical and pathological characteristics of the population diagnosed with NET of the lung at the Hospital Universitario Fundación Santa Fe de Bogotá (HUFSFB) between the years 2001 and 2010. Design: descriptive cross-cut study. Materials and methods: the entire population with confirmed NET of the lung at the HUFSB over the period 2001-2010 was included. Pathology reports and medical charts were reviewed for obtaining data. Results: one hundred and thirty two (132) cases were included. The most common type of tumor was small-cell lung carcinoma. Typical carcinoid was five-fold more frequent than the atypical. Well-differentiated tumors were more common in women, and high-grade tumors were more common in men. High-grade tumors presented at more advanced ages and were associated with smoking. The main path for reaching diagnosis was the appearance of symptoms due to the tumor. Of all subjects, 50% had metastatic disease at the moment of diagnosis, mostly in poorly-differentiated types. Conclusions: the lung has a very heterogeneous spectrum of histological, clinical, and biochemical types of NETs. There are still no national data with regard to incidence and survival of this type of tumor. We seek to motivate research in this field and to call attention to the need of follow-up in these cases, including well-differentiated tumors. Keywords: lung cancer, neuroendocrine tumors, neuroendocrine carcinoma, carcinoid tumor, small-cell carcinoma of the lung. Rev Colomb Neumol 2013; 24 (2):84-91 INTRODUCCIÓN Los tumores neuroendocrinos son un grupo de neoplasias complejas originadas en el tejido endocrino, cuyas células pueden estar organizadas en glándulas o existir como parte de un sistema difuso compuesto por las células argentafines localizadas principalmente en el epitelio intestinal y respiratorio (1). En el pulmón estos tumores surgen a partir de células neuroendocrinas llamadas células de Kulchitsky dispersas de manera difusa en todo el árbol bronquial y capaces de producir aminas bioactivas como hormona adrenocorticotropa (ACTH), hormona antidiurética (ADH), hormona de crecimiento (GH) y serotonina, entre otras (2). Estos tumores, al igual que otros tumores neuroendocrinos, tienen un amplio espectro de diferenciación, tanto desde el punto de vista molecular como morfológico, que varía desde las formas bien diferenciadas, incluyendo el carcinoide típico (CT) de bajo grado y el carcinoide atípico (CA) de grado intermedio (grados I y II respectivamente), hasta las formas pobremente diferenciadas constituidas por el carcinoma de células pequeñas (CCP) y el carcinoma neuroendocrino de células grandes (CNECG), considerados de alto grado (grado III) (3, 4). De acuerdo con la última clasificación de la Organización Mundial de la Salud (OMS) de 2004 (5), los tumores neuroendocrinos de pulmón se diagnostican y se clasifican según se observa en la tabla 1. Dentro del espectro de proliferación de las células neuroendocrinas de pulmón se destacan otras variantes histológicas como la hiperplasia de células neuroendocrinas, que no sobrepasa la membrana basal, los tumorlets que son proliferaciones nodulares de células neuroendocrinas con morfología similar a la de un tumor neuroendocrino carcinoide típico, pero con un diámetro máximo de 5 mm y que pueden sobrepasar la membrana basal, y la hiperplasia difusa idiopática de células neuroendocrinas pulmonares, la Tabla 1. Clasificación de los tumores neuroendocrinos de pulmón de la OMS 2004. Clasificación histológica de los tumores neuroendocrinos de pulmón Criterios de la OMS CT CA CNECG CCP Diferenciación Bien diferenciado Bien diferenciado Mal diferenciado Mal diferenciado Mitosis (x10 CAP) <2 2-10 > 10 (Promedio 70) >10 (Promedio 80) Necrosis Ausente Usualmente focal Extensa Extensa Adaptada de: Rekhtman N. Neuroendocrine tumors of the lung: an update. Arch Pathol Lab Med. 2010; 134 (11): 1628-38. 85 Revista Colombiana de Neumología cual es una condición muy rara que representa una lesión preneoplásica de un TC dada su asociación con fibrosis e inflamación en sujetos que tienen diez o más lesiones neuroendocrinas de pulmón (6, 7). Por último, están los tumores mixtos en los que el componente neuroendocrino se encuentra en diferentes proporciones, con alguno de los carcinomas del tipo célula no pequeña (8). Los tumores neuroendocrinos de pulmón corresponden aproximadamente al 25% (22-27%) de los tumores neuroendocrinos del sistema endocrino difuso (9, 10), con una incidencia anual estimada de 1,35 por 100.000 personas al año (11); en Colombia no se tienen datos publicados para esta patología. En este estudio se describen las características clinicopatológicas de la población con diagnóstico de tumores neuroendocrinos de pulmón del Hospital Universitario Fundación Santa Fe de Bogotá (HUFSFB) en el período de 2001 a 2010. METODOLOGÍA Se realizó un estudio descriptivo de tipo corte transversal en el momento del diagnóstico, que incluyó toda la población con tumores neuroendocrinos de pulmón confirmados por patología en el HUFSFB durante el periodo 2001 a 2010. Se hizo una búsqueda electrónica en los archivos de patología y una revisión del registro médico correspondiente con el fin de obtener los datos clínicos de los sujetos. Se analizaron las siguientes variables: edad y género, grado histológico, presencia y sitio de metástasis al momento del diagnóstico, forma de llegar al diagnóstico y manifestaciones clínicas asociadas. Para las variables que requerían acceso a la historia clínica se incluyeron únicamente los sujetos con registro dentro de los archivos del HUFSFB. Este trabajo fue aprobado por el comité de Ética Institucional. El análisis estadístico se realizó con Stata 12 y Excel 2010. Se calcularon medidas de tendencia central, frecuencia simple, rangos y porcentajes. RESULTADOS Se encontraron en total 139 sujetos con reportes de patologías confirmatorias de neoplasia neuroendocrina de pulmón; para el análisis se excluyeron siete casos con diagnóstico de tumorlet, debido a que no hacen parte de la clasificación de tumores neuroen- 86 Volumen 24 Número 2 docrinos propuesta por la OMS en la actualidad, y en su mayoría son hallazgos quirúrgicos incidentales. Al final, se incluyeron en total 132 casos. Frecuencia por año La frecuencia anual tuvo un aumento notorio desde el año 2003 con 16 casos, sin haber grandes variaciones en años posteriores. En 2001 se notó una frecuencia mucho menor a la encontrada en los demás años, con únicamente dos casos diagnosticados. El comportamiento fue similar para ambos grupos de tumores, siendo los mal diferenciados más frecuentes en la mayoría de los años, excepto en 2003 (Figura 1). Presentación histológica El tipo de tumor más frecuente fue el CCP correspondiendo a más del 50% de los casos. Seis casos fueron no clasificados: un caso por material insuficiente para diferenciar entre típico y atípico, y el resto clasificados como mal diferenciados sin especificar el tamaño celular (Tabla 2). 20 15 6 10 9 6 11 10 10 7 7 5 0 10 10 1 1 3 7 6 8 4 6 5 5 2001 2002 2003 2004 2005 2006 2007 2008 2009 2010 Mal diferenciados Bien diferenciados Figura 1. Frecuencia anual de tumores neuroendocrinos de pulmón. Tabla 2. Frecuencia de tumores de acuerdo con la clasificación histológica. Clasificación histológica Carcinoide típico Carcinoide atípico CCP CNECG No clasificado Total (n) 46 9 69 2 6 132 Porcentaje 34,9 6,8 52,3 1,5 4,5 100 Experiencia diagnóstica de diez años del tumor neuroendocrino de pulmón en la Fundación Santa Fe de Bogotá. De las formas bien diferenciadas hay 55 casos de tumores carcinoides; 83,6% fueron CT y 16,4% CA. Taboada y cols. Entre los pacientes que debutaron con sintomatología la principal manifestación fueron síntomas respiratorios que incluyeron tos, hemoptisis, neumonía obstructiva, disnea y dolor pleurítico. Otros síntomas menos frecuentes fueron dolor crónico relacionado con el tumor, síndrome de vena cava superior, SIADH, acromegalia y alteraciones neurológicas o síndrome medular como sintomatología de metástasis al sistema nervioso. Cabe aclarar que varios pacientes debutaron con más de un síntoma (Tabla 4). Perfil demográfico de acuerdo con el tipo de tumor En general los tumores neuroendocrinos de pulmón fueron más frecuentes en mujeres (53%; 66 de 126 casos) con una edad promedio de presentación de 61,3 años (rango 11 – 82) y mediana de 65 años. De acuerdo con el grado histológico, los tumores bien diferenciados fueron más frecuentes en mujeres, con 80,4% y 66,7% respectivamente para el CT y CA; mientras que los tumores neuroendocrinos de alto grado fueron más frecuentes en hombres y con una edad de presentación más tardía. El antecedente de tabaquismo fue analizado en 40 sujetos; 87,5% de los CCP fueron fumadores en comparación con 35% de los CT, si se tienen en cuenta únicamente los sujetos con datos (Tabla 3). Presencia de metástasis Se analizaron 90 casos para metástasis; de todos los sujetos con datos 71% tenía metástasis al momento del diagnóstico. En los tumores bien diferenciados, el CT presenta en 11% invasión a nivel de ganglios regionales, mientras que el CA lo hace en 62,5% de los casos tanto a nivel ganglionar regional como a distancia. Para el CCP, 98% tenía metástasis a distancia. El principal sitio de metástasis a distancia fue el hígado (Tabla 5, figura 2). Síntomas y forma de llegar al diagnóstico Para el diagnóstico se cuenta con 45 registros completos, se excluye uno correspondiente a un tumor no clasificado. La principal forma de llegar al diagnóstico fue por la aparición de síntomas relacionados con el tumor y en segundo lugar por los hallazgos radiológicos incidentales. DISCUSIÓN La incidencia y prevalencia del tumor neuroendocrino de pulmón se considera subestimada debido a la pobre correlación con la mortalidad, al comportamiento indolente del tumor neuroendocrino bien Tabla 3. Resumen de las características demográficas de acuerdo con el tipo de tumor. Características demográficas de acuerdo con el tipo de tumor CT n= 46 CA n=9 CCP n=69 CNECG n=2 Género Masculino n, (%) 9 (19,6) 3 (33,3) 46 (66,7) 2 (100) Femenino n, (%) 37 (80,4) 6 (66,7) 23 (33,3) 0 (0) 1:4 1:2 2:1 N/A 56,6 62,9 64,5 66,5 11-81 46-75 38-82 65-68 Si N (%) 7 (15,2) 3 (33,3) 14 (20,3) 0 No N (%) 13 (28,3) 1 (11,1) 2 (2,9) 0 No dato n (%) 26 (56,5) 5 (55,6) 53 (76,8) 2 (100) Razón M:F Edad (años) Promedio Rango Antecedente de tabaquismo 87 Revista Colombiana de Neumología Volumen 24 Número 2 Tabla 4. Forma de llegar al diagnóstico y síntomas asociados a cada tipo de tumor. Forma de diagnóstico y síntomas de acuerdo con el tipo de tumor Total CT CA CCP CNCG Forma de llegar al diagnóstico n=44 Manifestaciones clínicas 29 (65,9) 13 3 13 0 Hallazgo radiológico 15 (34,1) 12 2 1 0 Clínica predominante Síntomas respiratorios 23 12 2 9 0 Alteraciones neurológicas/paraplejía 2 0 1 1 0 Dolor crónico relacionado con el tumor 3 0 0 3 0 Pérdida de peso 2 0 0 2 0 Síndrome de vena cava 2 0 0 2 0 Acromegalia 1 1 0 0 0 SIADH 1 0 0 1 0 Tabla 5. Presencia de metástasis de acuerdo con el tipo de tumor. CT n= 46 CA n=9 CPP n=69 CNCG n=2 3 (6,5) 5 (55,6) 53 (76,8) 1 (50) Ganglios regionales 3 2 17 0 A distancia 0 3 35 1 No dato 0 0 1 0 No n (%) 24 (52,2) 3 (33,3) 1 (1,5) 0 No dato n (%) 19 (41,3) 1 (11,1) 15 (21,7) 1 (50) Metástasis al diagnóstico Si n (%) Sitio de metástasis 12 10 11 8 6 11 8 7 4 4 2 0 1 Hígado Gánglios Hueso a distancia 1 Cerebro Tejidos Suprarrenal Pleura blandos 1 1 Médula espinal Colon Figura 2. Frecuencia de sitios de metástasis a distancia. 88 diferenciado y a la falta de asociación entre los signos clínicos y la gravedad de la enfermedad; por tanto, algunos tumores neuroendocrinos bien diferenciados nunca se detectarán (12). A pesar de esto, en los últimos años se ha documentado incremento en la incidencia. La base de datos publicada por Modlin y colaboradores (9), incluye el análisis de 13.715 sujetos con tumores carcinoides de 1950 a 1999, de los cuales 3.365 (24,5%) casos correspondían a tumores neuroendocrinos bien diferenciados típicos y atípicos traqueobronquiales. Desde 1950 a 1999 la incidencia de estos tumores aumentó de 0,22 a 0,52 x 100.000 habitantes en hombres blancos y de 0,24 a 0,89 x 100.000 habitantes en mujeres blancas, al igual que el porcentaje de tumores neuroendocrinos correspondientes al pulmón, que ha pasado de 10,2% a 27,9%. Es preciso tener en cuenta que esta incidencia Experiencia diagnóstica de diez años del tumor neuroendocrino de pulmón en la Fundación Santa Fe de Bogotá. incluye únicamente a las formas bien diferenciadas. De igual forma, un estudio realizado en Dinamarca mostró un aumento en los tumores neuroendocrinos de pulmón diferente a carcinoma de célula pequeña de 0,24 a 0,53 por 100.000 habitantes-año en hombres y de 0,14 a 0,41 por 100.000 habitantes-año en mujeres desde 1978 a 1997 (13). El estudio que aquí se publica no busca estimar la incidencia de los tumores neuroendocrinos de pulmón, dada la naturaleza del mismo; sin embargo, se puede ver un leve aumento en la frecuencia de tumores neuroendocrinos de pulmón con el paso de los años. El aumento en la frecuencia en el HUFSF, como en el mundo, probablemente se relaciona con la evolución de las técnicas diagnósticas, el incremento de la utilización de imágenes radiológicas y el acceso a los servicio médicos, factores que pueden influir en su epidemiología (6, 12). El aumento notorio de la frecuencia después del año 2001, probablemente sea el resultado de la creación de un grupo multidisciplinario y la difusión del conocimiento de la enfermedad, que han permitido ser reconocidos como un centro de referencia para el estudio de este tipo de lesiones. Las formas histológicas bien diferenciadas son infrecuentes; el CT corresponde al 1%-2% de las malignidades de pulmón y al 85 a 90% de los bien diferenciados y el CA a sólo el 0,1%-0,2% de las malignidades de pulmón y a menos del 10% de los carcinoides de pulmón (3, 14, 15). En nuestra serie los carcinoides presentan una distribución similar, siendo los CT cinco veces más frecuentes que el CA. Las formas mal diferenciadas son más frecuentes; el CCP corresponde al 15% a 20% de las malignidades invasivas de pulmón, y el CNECG al 3% del total de cánceres de pulmón (16). En nuestra serie el CCP corresponde a más de la mitad de los tumores neuroendocrinos de pulmón y fue mucho más frecuente que el CNECG, similar a lo reportado en otras series (13). Una posible explicación de la mayor frecuencia de las formas mal diferenciadas es su curso más agresivo y la presencia de síntomas que motivan el diagnóstico diferencial, contrario de los bien diferenciados que pueden ser asintomáticos, diagnosticándose algunos como hallazgos incidentales y algunos incluso nunca diagnosticarse. Los tumores carcinoides de pulmón (CT y CA) tienen una edad promedio de presentación de 45 a 55 años; no hay una predilección clara por algún género, aunque en sujetos menores de 50 años hay predilección por el femenino, y no hay relación con el antecedente de tabaquismo (16, 17). Por su parte, Taboada y cols. los carcinomas mal diferenciados tienden a ocurrir en edades mayores, con una media de presentación de 60 a 70 años para el CCP y 62 años para el CNECG, con predominio por el género masculino, reportado en series hasta 8 a 9 veces más frecuente en hombres y en donde el antecedente de tabaquismo está presente en la mayoría de los pacientes (12, 16, 18, 19). En nuestra serie los hallazgos se correlacionan con lo reportado en la literatura, con un promedio de edad creciente a lo largo del espectro de diferenciación, que va de 56,4 y 62,9 años respectivamente para las formas bien diferenciadas, carcinoide típico y atípico, hasta 64,5 y 66,5 años para las formas mal diferenciadas. La diferencia de género es evidente, presentándose las formas bien diferenciadas con mayor frecuencia en el género femenino contrario de lo reportado en la literatura donde se aprecia una distribución similar de acuerdo con el género, y las formas mal diferenciadas con mayor frecuencia en el género masculino, lo que esté probablemente relacionado con la mayor exposición al tabaquismo en este género. La presentación clínica de los tumores neuroendocrinos depende del grado histológico tumoral, del sitio de la lesión, de la producción hormonal, del compromiso o extensión tumoral y de la presencia de un síndrome heredofamiliar. Aproximadamente la mitad de los sujetos con tumores neuroendocrinos bien diferenciados son asintomáticos al momento del diagnóstico y los que debutan con síntomas son clásicamente respiratorios (disnea, tos, hemoptisis o neumonía); 40% puede localizarse en la periferia y diagnosticarse como hallazgo radiológico incidental (3). Aunque los síntomas por producción hormonal son raros, el síndrome de Cushing se presenta en 2% de los carcinoides y son la causa más frecuente de producción ectópica de hormona de crecimiento (20). El síndrome carcinoide está presente en menos de 5% de los casos (21). Los hallazgos radiológicos incidentales son una forma importante de diagnóstico, en especial para las formas bien diferenciadas, por su curso indolente inicial con ausencia de síntomas o limitados a síntomas respiratorios. Estos tumores bien diferenciados tienen el potencial de hacer metástasis, las cuales, en ciertos casos, son las que motivan el diagnóstico. La presencia de metástasis al diagnóstico variará de acuerdo con el espectro, encontrando tasas bajas en los pacientes con CT y más altas en los CA. En una serie de 142 casos en Israel con 128 casos de CT, 17 sujetos (13%) cursaban con metástasis ganglionares y 2 (1,6%) sujetos a distancia en hígado, a la vez que de los 14 sujetos con CA 6 tenían metástasis ganglionares (43%) y 3 (21%) a distancia en hígado, bazo y cerebro (14). 89 Revista Colombiana de Neumología Por su parte, una serie española reúne 361 casos de tumores neuroendocrinos de pulmón de 1980 a 1997 con 261 CT y 43 CA con porcentaje de metástasis ganglionares de 4% y 23% respectivamente y a distancia de 1,5% y 20,9% (15). En nuestra serie de los 26 CT con datos clínicos, la mitad de los casos fueron diagnosticados como un hallazgo radiológico incidental mientras que la otra mitad presentó alguna sintomatología que motivó el diagnóstico. En este caso la clínica se limitaba a síntomas respiratorios como tos, disnea, neumonía obstructiva, entre otros. En cuanto a las metástasis, 11% de los casos con datos presentaba metástasis, todos a nivel de ganglios regionales. Para los CA se halló algo muy similar en la distribución de la presentación clínica con 50% de los casos asintomáticos y 50% con alguna manifestación clínica que en la mayoría fue respiratoria a excepción de un paciente con síndrome medular a causa de metástasis. El 62,5% de los pacientes con datos cursaba con diseminación de la enfermedad, de los cuales 40% la presentaba a nivel de ganglios regionales y 60% a distancia. Consideramos que los aspectos clínicos y la presencia de metástasis es congruente con lo reportado en la literatura y se debe tener presente en todo momento ante este diagnóstico, ya que a pesar de ser tumores bien diferenciados, no son completamente indolentes, y la agresividad y el potencial de metástasis aumenta a medida que avanza el espectro tumoral. De los tumores mal diferenciados, el CCP puede debutar con diferentes tipos de manifestaciones, ya sean constitucionales, pulmonares, síntomas por diseminación o desórdenes paraneoplásicos, siendo los más frecuentes fatiga, tos, disnea, disminución del apetito, pérdida de peso, dolor o hemoptisis o síntomas secundarios a metástasis extratorácicas; se puede encontrar el síndrome de vena cava hasta en el 10% de los sujetos (3). Estos tumores tienen gran potencial de producción hormonal, y de esta manera generan diferentes endocrinopatías. El síndrome de secreción inadecuada de ADH se presenta en 5,5% de los pacientes al momento del diagnóstico (18). El carcinoma neuroendocrino de célula grande usualmente es de localización periférica en 67% a 84% de los casos, llevando principalmente a síntomas torácicos no pulmonares por compromiso a estructuras vecinas o a sintomatología dada por metástasis (3, 15). Estos carcinomas de alto grado tienen un gran potencial metastásico desde el inicio. Hay presencia de 90 Volumen 24 Número 2 metástasis extratorácicas a lugares como hueso, cerebro, hígado y adrenales en la mayoría de los pacientes al momento de la presentación (3). La serie española muestra que de 35 sujetos con CCP 20% tenía metástasis ganglionares y 37,1% a distancia, y de los 22 CNECG 41% cursaba con metástasis ganglionares y 63% con metástasis a distancia (15). Por su parte, una serie danesa con 11.998 pacientes con CCP mostró que 50% de los pacientes tenía enfermedad a distancia y 25% regional en ganglios, con 11% de pacientes sin datos reportados, mientras que de los 50 CNECG 40% tenía metástasis a distancia y 26% enfermedad en ganglios regionales, con 14% de pacientes sin información (13). En nuestra serie, de los 14 sujetos con CCP de los que se contaba con información con respecto a la forma del diagnóstico, en la mayoría de los casos éste fue motivado por las manifestaciones clínicas secundarias al tumor, siendo las más frecuentes los síntomas respiratorios, pero otros como el síndrome de vena cava, la pérdida de peso, las alteraciones neurológicas y el dolor crónico y un caso de SIADH también figuraban como parte de la clínica. La mayoría de los pacientes cursaba con metástasis al momento del diagnóstico (98% de los sujetos con datos), principalmente a distancia. Sólo hay 2 casos de CNECG, por lo que no consideramos suficiente para hacer un análisis. La principal debilidad de este trabajo es la pérdida de algunos datos debido a su condición de estudio retrospectivo, de los cuales muchos son diagnosticados en la Institución pero continúan seguimiento externo. Igualmente, no se pudo obtener la incidencia por no contar con las estadísticas globales de los tumores de pulmón y otros tumores en el HUFSFB. Aun no hay datos nacionales de incidencia y supervivencia de este tipo de tumor. Con este estudio se busca motivar la investigación en este campo y alertar sobre el seguimiento necesario aun en los tumores bien diferenciados, que no son indolentes. BIBLIOGRAFÍA 1. Clark OH, Benson AB 3rd, Berlin JD, Choti MA, Doherty GM, Engstrom PF, et al. NCCN Clinical Practice Guidelines in Oncology: neuroendocrine tumors. J Natl Compr Canc Netw. 2009; 7 (7): 712-47. 2. Chong S, Lee KS, Chung MJ, Han J, Kwon OJ, Kim TS. Neuroendocrine tumors of the lung: clinical, pathologic, and imaging findings. Radiographics. 2006; 26 (1): 41-57. 3. Travis WD. Advances in neuroendocrine lung tumors. Ann Oncol. 2010; 21 (Suppl 7): VII65-71. Experiencia diagnóstica de diez años del tumor neuroendocrino de pulmón en la Fundación Santa Fe de Bogotá. 4. Bertino EM, Confer PD, Colonna JE, Ross P, Otterson GA. Pulmonary neuroendocrine/carcinoid tumors: a review article. Cancer. 2009; 115 (19): 4434-41. 5. Travis WD, Brambilla E, Muller-Hermelink HK, Harris CC. World Health Organization classification of tumours, pathology & genetics, tumours of the lung, pleura, thymus and heart. Lyon, France, IARC Press, 2004. 6. Rekhtman N. Neuroendocrine tumors of the lung: an update. Arch Pathol Lab Med. 2010; 134 (11): 1628-38. 7. Ferolla P, Daddi N, Urbani M, Semeraro A, Ribacchi R, Giovenali P, et al. Tumorlets, multicentric carcinoids, lymph-nodal metastases, and long-term behavior in bronchial carcinoids. J Thorac Oncol. 2009; 4 (3): 383-7. Taboada y cols. gical subtypes. A population-based study in Denmark. Lung Cancer. 2002; 37 (2): 127-35. 14.Fink G, Krelbaum T, Yellin A, Bendayan D, Saute M, Glazer M, et al. Pulmonary carcinoid: presentation, diagnosis, and outcome in 142 cases in Israel and review of 640 cases from the literature. Chest. 2001; 119 (6): 1647-51. 15.García-Yuste M, Matilla JM, Alvarez-Gago T, Duque JL, Heras F, Cerezal LJ, et al. Prognostic factors in neuroendocrine lung tumors: a Spanish Multicenter Study. Ann Thorac Surg. 2000; 70 (1): 258-63. 16.Travis WD. Lung tumours with neuroendocrine differentiation. Eur J Cancer. 2009; 45 (Suppl 1): 251-66. 8. Righi L, Volante M, Rapa I, Scagliotti GV, Papotti M. Neuro-endocrine tumours of the lung. A review of relevant pathological and molecular data. Virchows Arch. 2007; 451 (Suppl 1): S51-9. 17.Hage R, de la Rivière AB, Seldenrijk CA, van den Bosch JM. Update in pulmonary carcinoid tumors: a review article. Ann Surg Oncol. 2003; 10 (6): 697-704. 9. Modlin IM, Lye KD, Kidd M. A 5-decade analysis of 13,715 carcinoid tumors. Cancer. 2003; 97 (4): 934-59. 18.Gustafsson BI, Kidd M, Chan A, Malfertheiner MV, Modlin IM. Bronchopulmonary neuroendocrine tumors. Cancer. 2008; 113 (1): 5-21. 10.Taal BG, Visser O. Epidemiology of neuroendocrine tumours. Neuroendocrinology. 2004; 80 (Suppl 1): 3-7. 11. Oberg K, Hellman P, Kwekkeboom D, Jelic S. ESMO Guidelines Working Group. Neuroendocrine bronchial and thymic tumours: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2010; 21 (Suppl 5): v220-2. 12.Ferolla P, Faggiano A, Avenia N, Milone F, Masone S, Giampaglia F, et al. Epidemiology of non-gastroenteropancreatic (neuro) endocrine tumours. Clin Endocrinol (Oxf). 2007; 66 (1): 1-6. 13.Skuladottir H, Hirsch FR, Hansen HH, Olsen JH. Pulmonary neuroendocrine tumors: incidence and prognosis of histolo- 19.Asamura H, Kameya T, Matsuno Y, Noguchi M, Tada H, Ishikawa Y, et al. Neuroendocrine neoplasms of the lung: a prognostic spectrum. J Clin Oncol. 2006; 24 (1): 70-6. 20.Pinzón B, Palacios D, García-Herreros LG, Acero R, Pavía J, Roa J, et al. Tumor carcinoide broncopulmonar. Rev Colomb Radio. 2006; 17 (2): 1942-1948. 21.Barreto J, Mejía B, Plata R, Lizacno J, González H, Serrano R. Broncoscopia: imagen y discusión. Tumor carcinoide endobronquial: resección endoscópica por electrocirugía. Rev Colomb Neumol. 2008; 20 (3): 107-110. 91 Revista Colombiana de Neumología Volumen 24 Número 2 PRESENTACIÓN DE CASOS Osteomielitis costal por Cryptococcus neoformans en pacientes inmunocompetentes en el Hospital Universitario Fundación Santa Fe de Bogotá, Colombia. Reporte de dos casos y revisión de la literatura Cryptococcal rib osteomyelitis in immunocompetent patients at the Hospital Universitario Fundación Santa Fe de Bogotá, Colombia. Report of 2 cases and review of the literature Beatriz Espinosa(1); Luis Gerardo García-Herreros, MD.(2); Andrés Jimenez, MD.(3); Oscar Rivero, MD.(4) RESUMEN En el mundo son pocos los casos descritos de osteomielitis costal por Cryptococcus neoformans en pacientes inmunocompetentes. Se presentaron dos casos en pacientes de género femenino, de 35 y 68 años respectivamente, previamente sanas, quienes fueron tratadas de forma quirúrgica en la Fundación Santa Fe de Bogotá y tuvieron una evolución posoperatoria adecuada. Palabras clave: osteomielitis, Cryptococcus neoformans, inmunocompetente, Colombia. ABSTRACT Very few cases of rib osteomyelitis caused by Cryptococcus neoformans have been described in the international literature. Two cases were found in previously healthy, female patients, aged 35 and 68 years respectively. Both received surgical management at the Fundación Santa Fe de Bogotá, and their postoperative evolution was satisfactory. Keywords: osteomyelitis, Cryptococcus neoformans, immunocompetent, Colombia. Rev Colomb Neumol 2013; 24 (2):92-96 INTRODUCCIÓN La criptococosis es una infección que se adquiere por la inhalación de los propágulos de cualesquiera de las especies infectantes de las dos variedades del complejo de especie Cryptococcus neoformans (1). No constituye una enfermedad de notificación obligatoria en Colombia, lo que explica porqué existe tan poca información sobre su incidencia en los grupos de mayor riesgo. Sin embargo, en la literatura nacional se encuentran una serie de artículos que revelan su importancia en nuestro medio (2-4). La incidencia de la criptococosis en Colombia es baja en comparación con la de otros países. En Colombia, las regiones con incidencias más altas fueron los Santanderes, la región Central, incluida Bogotá, y Interna, Fundación Santa Fe de Bogotá, Estudiante de Medicina último año, Universidad de Los Andes, Bogotá, Colombia. Cirujano de tórax, Jefe de Cirugía, Fundación Santa Fe de Bogotá, Bogotá, Colombia. (3) Cirujano de tórax, Fundación Santa Fe de Bogotá, Bogotá, Colombia. (4) Médico radiólogo. Departamento de Imágenes Diagnósticas, Fundación Santa Fe de Bogotá, Bogotá, Colombia. (1) (2) Correspondencia: Doctor Luis Gerardo García-Herreros, Correo electrónico: lggarciaherreros@gmail.com Recibido: agosto 15 de 2012. Aceptado: noviembre 2 de 2012. 92 Osteomielitis costal por Cryptococcus neoformans en pacientes inmunocompetentes en el Hospital Universitario... la región de Antioquia y el Eje Cafetero. El equipo de investigación cree que estas cifras revelan solamente una mayor notificación de casos, y que las incidencias bajas de otras regiones, como la de la Costa Atlántica, se deben a una baja notificación y a dificultades en el diagnóstico micológico. Las regiones señaladas al principio han sido las que más reportan casos de infección por VIH en Colombia (5). La infección por Cryptococcus en Colombia ocurre principalmente en hombres jóvenes, lo que refleja la epidemiología de la infección por el VIH. En la población general el predominio del género masculino es marcado, relación que aumenta en los pacientes VIH positivos; no obstante, en los pacientes sin SIDA se mantiene el predominio de los hombres, aunque en una proporción menor. Este último hecho ya se reconocía desde antes de la aparición del VIH. El promedio de edad es mayor en los pacientes sin SIDA, en quienes se da una distribución por edades más amplia de la enfermedad. La información de otros países coincide con estas observaciones (6-8). La infección se presenta comúnmente en pacientes inmunocomprometidos, como aquellos VIH positivos y/o trasplantados. Anatómicamente se ven en predominio pulmonar y en el sistema nervioso central, pero cualquier órgano puede verse comprometido (9). En la literatura se ha descrito entre 5% a 10% de compromiso óseo, en donde la columna vertebral es la más afectada. A continuación se describen dos casos de osteomielitis costal, en dos mujeres previamente sanas que tuvieron adecuada respuesta al manejo quirúrgico. La infección por Cryptococcus neoformans ocurre generalmente en pacientes inmunocomprometidos, pero puede darse también en inmunocompetentes. A nuestro entender, sólo 47 casos de osteomielitis aislada criptococócica han sido reportados en pacientes VIH negativos desde 1974 hasta 2005. El rango de edad fue de 1,3-84 años con una media de 38,2. Estos pacientes a menudo tenían una enfermedad crónica debilitante, encabezando la lista la sarcoidosis, que es la patología más común subyacente, seguida por la tuberculosis, el tratamiento con esteroides y otras enfermedades tales como linfoma, leucemia, enfermedad de Hodgkin y diabetes (10). Nuestra experiencia fue excepcional, ya que ninguna de las pacientes presentaba ninguna otra enfermedad acompañante indicativa de disfunción inmune. Los pacientes con osteomielitis por criptococo presentan como cuadro clínico inicial edema y dolor de los tejidos blandos que rodean el hueso, el cual puede Espinosa y cols. verse o no comprometido. Usualmente no hay eritema, pero sí se percibe una leve elevación de la temperatura local (11). En la mayoría de los pacientes, se evidencia aumento de la velocidad de sedimentación globular y el recuento de glóbulos blancos. El examen radiológico muestra una lesión lítica con reacción perióstica leve o ausente. La reacción perióstica variable puede ser engañosa, tanto así que se ha llegado a confundir con osteosarcoma (12). En un caso reportado por Witte y colaborador, se pensó inicialmente en una neoplasia maligna debido a la presencia de una lesión lítica con una reacción perióstica extensa. El diagnóstico de la osteomielitis criptococócica se realizó más tarde en la biopsia con aguja fina (12). La infección criptococócica debe diferenciarse de otras infecciones como las micosis sistémicas (histoplasmosis, blastomicosis, esporotricosis, actinomicosis y coccidioidomicosis), las infecciones por micobacterias y la brucelosis, ya que estas también pueden presentar similares características radiográficas. Las pacientes de los casos no tenían ninguna reacción perióstica visible en la radiografía de tórax. La gammagrafía ósea por lo general evidencia un aumento de la captación local del trazador. El diagnóstico definitivo de la infección por Cryptococcus neoformans sólo puede ser establecido por cultivos del hongo a partir de material infectado y la identificación del microorganismo en el material obtenido por la biopsia (12). El agar de canavanina-glicina azul de bromotimol (CGB) es el medio de elección para identificar cepas de Cryptococcus. Cryptococcus gattii puede crecer en presencia de L-canavanina y asimilar la glicina como única fuente de carbono convirtiendo el agar CGB azul, mientras que Cryptococcus neoformans no crece en este medio. Para la diferenciación de Cryptococcus neoformans variedad neoformans y Cryptococcus neoformans variedad grubii, se emplea el agar de creatinina dextrosa azul de bromotimol timina (CDBT). Cryptococcus neoformans variedad neoformans crece en colonias de color rojo brillante, mientras que no se observa ningún cambio de coloración para Cryptococcus neoformans variedad grubii (13). Existen varias tinciones útiles para identificar Cryptococcus en muestras clínicas, incluyendo tinción de Wright, plata Gomori metenamina (GMS) mancha, blanco Calcofluor, H y E, azul Alcian, mucicarmín, y la tinta china. Al microscopio, aparece como una forma esférica, de base estrecha, célula de levadura en ciernes en el tejido. La cápsula de Cryptococcus neoformans está representada por los espacios vacíos 93 Revista Colombiana de Neumología alrededor del organismo (13). El diagnóstico en los dos casos reportados se basó en el análisis bioquímico, histológico y microbiano de la muestra obtenida. No hay un protocolo estandarizado para el tratamiento de la infección criptococócica en ninguna localización anatómica específica, a excepción del pulmón y del sistema nervioso central. La Sociedad de Enfermedades Infecciosas de América (IDSA) 2010, en sus directrices recomienda que aquellos pacientes que no tienen compromiso meníngeo ni pulmonar y presentan una infección limitada a un solo sitio, pueden ser tratados con fluconazol (400 mg [6 mg/kg] por día por vía oral) durante seis a doce meses (recomendación B-III nivel) (14). La selección del agente antimicótico y la duración del tratamiento dependen de factores como la severidad de la enfermedad, el estado inmune del huésped y la respuesta terapéutica. Murphy y Figura 1. Resonancia magnética del tórax. Imagen coronal eco de espín con información T2 (A) e imagen axial con información T2, obtenida de una secuencia eco de espín con pulso de inversión recuperación/STIR (B). Se demuestra la presencia de una masa extrapulmonar marcadamente hiperintensa en el aspecto posterior del hemitórax derecho, compatible con una colección pleural loculada, con extensión asociada a los tejidos blandos subyacentes de la pared torácica. 94 Volumen 24 Número 2 colaboradores publicaron la resolución completa de la osteomielitis en un solo sitio por infección criptococócica después de diez semanas de fluconazol en una dosis de 200 mg/día (15). REPORTE DE CASOS Caso 1 Paciente de género femenino, de 68 años, quien presentó cuadro clínico de cuatro meses de evolución conformado por dolor progresivo localizado en la pared posterior del tórax derecho, no asociado a trauma, el cual incrementaba con la movilización de la extremidad superior derecha y estaba acompañado de pérdida de 6 kg de peso. Al examen físico se encontró masa dolorosa a la palpación de 10 x 9 cm de diámetro (Figuras 1 y 2). Figura 2. Resonancia magnética del tórax. Imágenes axiales eco de gradiente con información T1 post contraste (A, B). Las imágenes confirman la presencia de una colección pleural loculada en el aspecto posterior del hemitórax derecho, la cual presenta una extensión a los tejidos blandos subyacentes de la pared torácica. Se nota un engrosamiento asociado de la pleura parietal y visceral. Osteomielitis costal por Cryptococcus neoformans en pacientes inmunocompetentes en el Hospital Universitario... Espinosa y cols. Caso 2 Paciente femenina de 35 años con cuadro clínico de dos meses de evolución, consistente en masa dolorosa de 6 cm de diámetro, de crecimiento progresivo en la pared anterior del tórax derecho con erosión costal. Se realizó biopsia que reportó material fibrinopurulento. Ingresó a la institución donde realizaron resección local de la lesión de la pared torácica con reconstrucción con colgajo muscular (Figuras 3 a 5). Figura 3. Radiografía de tórax. La proyección anterior oblicua derecha demuestra un aumento en la densidad de los tejidos blandos de la pared torácica, lo cual sugiere la presencia de una masa en esta localización. Figura 4. Escanografía simple del tórax (A, B). Las imágenes obtenidas en el plano axial demuestran la presencia de una masa bien definida, de apariencia sólida y de localización extrapulmonar en el aspecto lateral derecho de la pared torácica. Existe compromiso osteolítico costal subyacente. Figura 5. Resonancia magnética del tórax. Imagen axial con información T1 de una secuencia eco de gradiente (A) e imágenes con información T2 obtenidas de secuencias eco de espín en los planos coronal y axial (B, C). Se demuestra la presencia de una masa extrapulmonar sólida y bien definida en el aspecto lateral derecho de la pared torácica, con compromiso infiltrativo costal asociado (ver flecha). La lesión es de señal homogénea e isointensa con los músculos adyacentes en la imagen con información T1 (A) y presenta una señal heterogénea en las imágenes con información T2 (B, C). 95 Revista Colombiana de Neumología BIBLIOGRAFÍA 1. Lizarazo J, Linares M, De Bedout C, Restrepo A. Estudio clínico y epidemiológico de la criptococosis en Colombia: resultados de nueve años de la encuesta nacional, 1997-2005. Biomédica. 2007; 27: 94-109. 2. Uribe P, Restrepo A, Díaz G. Estudio prospectivo clínico y microbiológico de las meningitis subagudas y crónicas. Antioquia Médica. 1973; 23: 153-64. 3. Lizarazo J, Mendoza M, Palacios D, Vallejo A, Bustamante A, Ojeda E et al. Criptococosis ocasionada por Cryptococcus neoformans variedad gattii. Acta Med Colomb. 2000; 25: 1718. 4. Castañeda E, Torrado E, Arango M, de Bedout C, Tobón AM, Restrepo A et al. Criptococosis en Colombia: estudio interinstitucional. Inf Quinc Epidemiol Nac. 2000; 5: 115-9. 5. Góngora LR. Informe evento VIH/SIDA Semana epidemiológica 1 a 14, primer semestre julio 2005. Julio 13 de 2005. (Agosto 4 de 2006). Disponible en: http:// www.ins.gov.co/pdf/vcsp/ informe_evento _ vih_ junio_1sem2005.pdf. 6. Dromer F, Mathoulin S, Dupont B, Laporte A. Epidemiology of cryptococcosis in France: a 9-year survey (1985-1993). French Cryptococcosis Study Group. Clin Infect Dis. 1996; 23: 82-90. 7. Hakim JG, Gangaidzo IT, Heyderman RS, Mielke J, Mushangi E, Taziwa A, et al. Impact of HIV infection on meningitis in 96 Volumen 24 Número 2 Harare, Zimbabwe: a prospective study of 406 predominantly adult patients. AIDS 2000; 14: 1401-7. 8. Rozenbaum R, Goncalvez AJ. Clinical epidemiological study of 171 cases of cryptococcosis. Clin Infect Dis. 1994; 18: 369-80. 9. Zhang Y et al. Cryptococcal osteomyelitis of the scapula and rib in an immunocompetent patient. Medical Mycology Month. 2012, Early Online: 1–5. 10. Al-Tawfiq JA, Ghandour J. Cryptococcus neoformans abscess and osteomyelitis in an immunocompetent patient with tuberculous lymphadenitis. Infection. 2007; 35: 377-382. 11. Behrman RE, Masci JR, Nicholas P. Cryptococcal skeletal infections: Case report and review. Rev Infect Dis. 1990; 12: 181-90. 12. Zach TL, Penn RG. Localized cryptococcal osteomyelitis in an immunocompetent host. Pediatr Infect Dis. 1986; 5: 601-603. 13. Perfect JR. Cryptococcus neoformans. In: Mandell GL, Bennett, Dolin R, editors. Mandell, Douglas, and Qadir et al. – Isolated cryptococcal osteomyelitis. J Infect Dev Ctries. 2011; 5 (9): 669-673. 14. Perfect JR, Dismukes WE, Dromer F, Goldman DL, Graybill JR, Hamill RJ, et al. Clinical practice guidelines for the management of cryptococcal disease: 2010 update by the Infectious Diseases Society of America. Clin Infect Dis. 2010; 50: 291-322. 15. Murphy SN, Parnell N. Fluconazole treatment of cryptococcal rib osteomyelitis in an HIV-negative man. A case report and review of the literature. J Infect. 2005; 51: e309-311. Toxicidad pulmonar secundaria a bleomicina: reporte de caso y actualización clínica. Galindo y cols. PRESENTACIÓN DE CASOS Toxicidad pulmonar secundaria a bleomicina: reporte de caso y actualización clínica Pulmonary toxicity secondary to bleomycin: report of a case and clinical update Javier Leonardo Galindo Pedraza, MD.(1); Plutarco García-Herreros Ochoa, MD., FCCP(2); Alfredo Saavedra Rodríguez, MD.(2); Edgar Alberto Sánchez Morales, MD.(3) RESUMEN Algunos antineoplásicos pueden producir toxicidad pulmonar de acuerdo con su perfil de acción; en tal sentido, la bleomicina es uno de los medicamentos en los que se ha reportado este evento. Este citostático puede lesionar el endotelio pulmonar y el epitelio alveolar para llevar a un proceso inflamatorio y fibrótico del intersticio con repercusiones potencialmente fatales. La fisiopatología de la lesión pulmonar no se conoce del todo, de ahí que los virtuales blancos moleculares para la prevención y el tratamiento no se hayan definido. En la actualidad el único tratamiento con una posible efectividad clínica es el uso temprano de corticoides para prevenir la falla respiratoria aguda y el desarrollo de fibrosis pulmonar. Palabras clave: bleomicina, toxicidad pulmonar, fibrosis pulmonar. ABSTRACT Some antineoplastic agents can cause pulmonary toxicity, according to their action profile. Bleomycin is one of the drugs with which this event has been reported. This cytostatic can injure the pulmonary endothelium and the alveolar epithelium, which can lead to an inflammatory and fibrotic process of the interstice with potentially fatal repercussions. The pathophysiology of the pulmonary injury is not fully understood, and therefore the potential molecular targets for prevention and treatment have not been defined. The only available treatment with possible clinical efficacy is early administration of corticoids, in order to prevent acute respiratory failure and pulmonary fibrosis. Keywords: bleomycin, pulmonary toxicity, pulmonary fibrosis. Rev Colomb Neumol 2013; 24 (2):97-101 INTRODUCCIÓN Las bleomicinas son glicopéptidos con acción antibiótica aislados a partir del Streptomyces verticillos, Su actividad antineoplásica se centra en la inducción directa de la muerte celular y la inhibición de la angiogénesis (1), efectos que han permitido incluirla en es- quemas de manejo para linfomas, tumores de células germinales y sarcoma de Kaposi, entre otros (2). La bleomicina sintetizada con uso clínico se compone de dos isoformas, la bleomicina A y la bleomicina B (1). Su acción requiere de la unión transitoria a un metal reducido (Fe+2) que al oxidarse (Fe+3) forma la Medicina Interna, Universidad Nacional de Colombia. Neumología. Profesor Unidad de apoyo en Neumología, Universidad Nacional de Colombia. (3) Neumología. Coordinador Unidad de apoyo en Neumología, Universidad Nacional de Colombia. (1) (2) Correspondencia: Doctor Plutarco García-Herreros Ochoa. Correo electrónico: plugarciherreros@gmail.com Recibido: octubre 12 de 2012. Aceptado: noviembre 12 de 2012. 97 Revista Colombiana de Neumología bleomicina activa (bleomicina-Fe+3-OOH), la cual tiene la capacidad de unirse a su blanco en el ADN donde produce el clivaje de la estructura (1). Los mecanismos de toxicidad de la bleomicina están en relación con la acción directa del medicamento así como la inducción de inflamación tisular. Los datos que subyacen a la fisiopatología de la toxicidad no son del todo conocidos y los disponibles en la actualidad son extraídos de modelos animales. DESCRIPCIÓN DEL CASO Paciente de género masculino, de 21 años, con historia de un año de evolución de fiebre de origen desconocido y esplenomegalia, estudios inicialmente negativos incluyendo esplenectomía diagnóstica. Posteriormente, al desarrollar adenopatías retroperitoneales, se complementó el estudio con biopsia de las mismas que documentaron la existencia de linfoma Hodgkin variedad clásica con extensión a la médula ósea, para el cual se inició tratamiento con protocolo de quimioterapia ABVD. Ingresó a urgencias, diez días después del cuarto ciclo de quimioterapia, por fiebre cuantificada de 40°C asociada a rinorrea hialina, sin tos, disnea u otra sintomatología en relación. El hemograma de ingreso reportaba leucocitos de 2.250/μL con neutrófilos de 20/μL en su recuento absoluto, hemoglobina de 10,1 g/dL y plaquetas de 509.000/μL. La radiografía de tórax mostraba infiltrados reticulares difusos escasos (Figura 1). Figura 1. Radiografía de tórax al ingreso. 98 Volumen 24 Número 2 Considerando sus factores de riesgo, se inició manejo antibiótico dentro del protocolo de una neutropenia febril. Al segundo día de estancia presentó deterioro del patrón respiratorio con hipoxemia severa en la gasimetría arterial. Las imágenes de tórax mostraron progresión de los infiltrados intersticiales y alveolares respecto a la imagen del ingreso, con tendencia a la coalescencia, particularmente en el lóbulo medio. Con los resultados de una nueva radiografía y tomografía de tórax, se inició cubrimiento antibiótico empírico contra P. jirovecii con TMP/SMX y se adjuntó prednisolona 70 mg/día, según esquema Filadelfia (Figuras 2 y 3). Se realizó una fibrobroncoscopia y en el lavado broncoalveolar se hallaron células epiteliales bronquiales con cambios reactivos, recuento celular normal (macrófagos 50%, linfocitos 40%, neutrófilos 10%), coloraciones negativas (gram, ZN, PAS, Gomory y KOH) y citología negativa para malignidad. Se continuó el corticoide sistémico con la sospecha de toxicidad por bleomicina sin completar manejo contra P. jirovecii. Se observó remisión clínica e imaginológica y se dio de alta con corticoide sistémico oral (Figura 4). DISCUSIÓN Las reacciones secundarias al uso de bleomicina incluyen rash cutáneo, mucositis e hipersensibilidad. De todos los efectos adversos, la toxicidad pulmonar es el más grave, pues alcanza una incidencia de 2% a 46% y una mortalidad hasta de 3% (3). Quienes sufren falla respiratoria aguda representan la mayor Figura 2. Radiografía de tórax control. Toxicidad pulmonar secundaria a bleomicina: reporte de caso y actualización clínica. Galindo y cols. Figura 3. Cortes de tomografía de tórax contrastada control. Figura 4. Cortes de tomografía de tórax contrastada posterior al inicio de corticoide. mortalidad atribuible a la toxicidad, mientras aquellos que superan el episodio agudo no afectan su sobrevida a largo plazo (4). La susceptibilidad del tejido pulmonar a la acción de la bleomicina se debe en parte a la carencia en este órgano de la hidrolasa inducida por bleomicina, enzima que permite el metabolismo del fármaco a nivel hepático, esplénico, intestinal y medular (2). Uno de los mecanismos de lesión descritos corresponde a la reacción química de activación de la bleomicina por medio del Fe+2, que reduce el oxígeno y forma radicales libres que alteran la membrana alvéolo-capilar al oxidar lípidos, clivar ARN y ADN e hidrolizar proteínas (2). Así mismo, al descomponerse la bleomicina genera radicales hidroxilo que forman especies reactivas lesivas (1). La bleomicina también produce lesión endotelial directa y síntesis de citoquinas. El proceso tiene inicio al activarse el macrófago alveolar, el cual dirige la respuesta inflamatoria hacia Th1 por medio del factor de necrosis tumoral α y las interleucinas 1β, 6 y 18 que generan apoptosis del epitelio alveolar y del endotelio vía Fas/Fas-ligando (2, 5). Existe también un aumento en la expresión de moléculas de adhesión endotelial que favorece el paso de neutrófilos, macrófagos y linfocitos al intersticio (2). Paradójicamente, se ha encontrado que la expresión de E-selectinas, P-selectinas y V-CAM puede tener efecto protector posiblemente por linfocitos NK que podrían regular la inflamación (6). Las citoquinas proinflamatorias inducen a la síntesis del factor de crecimiento transformante β, el 99 Revista Colombiana de Neumología principal factor profibrótico del intersticio, que promueve la proliferación de fibroblastos y miofibroblastos a partir de células pluripotenciales de la médula ósea y/o del mesénquima (2, 7, 8). Junto al papel que cumple el macrófago alveolar, existe actividad inducida por el epitelio alveolar para la activación del fibroblasto y la diferenciación del epitelio en fibroblasto, constituyendo la transición epitelial-mesenquimal (7, 8). Otras citoquinas que también promueven la fibrosis son la endotelina 1, el factor de crecimiento similar a la insulina-1, el factor de crecimiento derivado de plaquetas (FCDP) y la angiotensina II a través del receptor AT1, entre otras (7, 9, 10). La COX-2 y la prostaciclina inhiben la migración del fibroblasto y durante la toxicidad se expresan menos (11, 12). También se ha determinado en la fisiopatología un aumento de la actividad procoagulante del endotelio por la expresión de factor tisular, la síntesis del activador del inhibidor del plaminógeno-1 y la disminución de la actividad del plasminógeno activador de la urokinasa (13). Este fenómeno podría facilitar la proliferación de fibroblastos en el intersticio a partir de coágulos de fibrina (13). Los patrones histológicos que se han descrito por la exposición a la bleomicina corresponden a la bronquiolitis obliterante con neumonía de organización (BONO), la neumonía eosinofílica por hipersensibilidad y la neumonitis intersticial con lesión alveolar difusa, siendo esta última la que se encuentra relacionada con la progresión a fibrosis pulmonar (2). En aquellos pacientes con lesión alveolar difusa durante la etapa aguda, o fase exudativa, se aprecia infiltración de células inflamatorias en el intersticio, edema y disminución de la población de neumocitos tipo I; en la fase proliferativa se establece progresivamente un aumento de las fibras de colágeno, en una evolución descrita entre la primera a la segunda semana (3, 14). La correlación clínica con los cambios patológicos puede ser de algunos días hasta de seis meses después de su uso, aunque hay reportes de toxicidad tardía de hasta dos años (2, 15). En la literatura se han documentado varios factores de riesgo para el desarrollo de la toxicidad; uno de ellos corresponde a la ruta de administración de la bleomicina en la que parece existir menor riesgo cuando se usa la vía intramuscular respecto a la vía intravenosa, así como si se administra el medicamento en bolo respecto a la aplicación en infusión (2). La dosis acumulada aumenta el riesgo de forma proporcional, siendo así que 3% a 5% de los pacientes desarrollan toxicidad a dosis acumuladas menores a 100 Volumen 24 Número 2 450 mg, 13% a dosis entre 450 a 549 mg y 17% a dosis mayores a 550 mg, con una fatalidad de 1% a dosis menores a 450 mg y de 10% a dosis mayores a 550 mg (16). Algunos autores recomiendan definir el factor de riesgo de dosis alta acumulada a partir de 400 mg (2). Otros factores de riesgo son la insuficiencia renal, al prolongar la exposición a la bleomicina, y los factores con acción sinérgica sobre el daño alveolar como la radioterapia en tórax, el uso de factor estimulante de colonias y las altas fracciones inspiradas de oxígeno (2, 17). En un estudio realizado en pacientes con cáncer de células germinales con la base de datos del Royal Marsden NHS Trust en Gran Bretaña se encontró asociación estadística significativa entre la exposición a bleomicina y la toxicidad pulmonar para las variables TFG menor a 80 mL/min antes del inicio de la quimioterapia (HR: 3,3; IC 95% 1,4-8,0), estadio IV de la neoplasia (HR: 2,6; IC 95% 1,5-4,4), edad mayor a 40 años (HR: 2,3; IC 95% 1,2-4,1) y dosis acumulativa mayor a 300 mg (HR: 3,5; IC 95% 2-6) (3). Las manifestaciones clínicas son escasas y se componen de síntomas generales como tos, disnea y fiebre (2). El examen físico no aporta datos mayores, pudiéndose encontrar ocasionalmente crépitos basales, roncus o frote pleural (2). El hallazgo más frecuente en las imágenes diagnósticas es la aparición de infiltrados difusos alveolares o intersticiales de predominio basal, con tendencia a la disminución de los volúmenes pulmonares y compromiso del ángulo costofrénico (18). Pueden encontrarse presentaciones inusuales con infiltrados focales o nódulos de predominio basal subpleurales secundarios a ocupación alveolar en pacientes con BONO y compromiso pleural dado por derrame pleural tipo exudado o neumotórax (2, 19). Algunos reportes de caso han documentado neumomediastino, que generalmente no tiene repercusión clínica (20, 21). En algunos estudios se ha establecido el uso de pruebas para el monitoreo de la exposición y el diagnóstico temprano de la toxicidad, como el conteo celular en el lavado bronquioalveolar, el scanning con galio-67 y las pruebas de función pulmonar, sin que ninguna sea lo suficientemente específica para definir su uso rutinario (19). Debido a que no es fácil determinar la toxicidad por los datos clínicos y paraclínicos se requiere de una alta sospecha clínica para el diagnóstico. La suspensión de bleomicina en quienes se sospecha toxicidad, es la primera aproximación al tratamiento (22). La prevención está igualmente relacionada con la disminución de las dosis acumuladas de bleomicina para limitar el riesgo. Toxicidad pulmonar secundaria a bleomicina: reporte de caso y actualización clínica. En la actualidad, el grupo de medicamentos con mayor evidencia en el tratamiento son los corticoides sistémicos a altas dosis (prednisolona 1 mg/kg/día o su equivalente), teniendo al parecer efectividad limitada al evento inflamatorio inicial (23). Parte del beneficio de esta terapia podría deberse al tratamiento de pacientes con BONO o neumonía eosinofílica por hipersensibilidad (2). Ante la ausencia de evidencia, se recomienda evitar la suspensión temprana para disminuir el riesgo de recaída y la progresión a fibrosis. En 1984 White y Strover publicaron el único estudio clínico en el cual se puso a prueba la corticoterapia en este tipo de toxicidad (21). En este estudio no aleatorizado de diez pacientes con neumonitis secundaria a bleomicina, tres de ellos no recibieron tratamiento y todos murieron de forma temprana, mientras en los otros siete pacientes se suspendió la bleomicina, se iniciaron corticoides y se observó mejoría clínica en todos ellos y muerte tardía sólo en tres de estos casos. Los esquemas de manejo utilizados en ese estudio correspondían a prednisolona 60 a 100 mg/día o metilprednisolona 60 mg/día. En la literatura se encuentran reportes escasos de uso de otros agentes inmunosupresores como colchicina, ciclofosfamida y azatioprina (24). De forma experimental se han usado terapias dirigidas contra algunos mediadores fisiopatológicos como el losartán (inhibiendo la acción de la angiotensina II sobre receptores AT1), el imatinib (inhibiendo el FCDP), la talidomida (reduciendo la producción de IL-6), la pentoxifilina (como antiinflamatoria y antifibrogénica), el iloprost (favoreciendo la actividad antifibrótica de la prostaciclina), entre otros (7, 10, 25, 26, 27). BIBLIOGRAFÍA 1. Chen J, Stubbe J. Bleomycins. Nat Rev Cancer. 2005; 5: 102-112. 2. Sleijfer S. Bleomycin-induced pneumonitis. Chest. 2001; 120: 617-624. 3. Azambuja E. Bleomycin lung toxicity: who are the patients with increased risk? Pulm Pharmacol Ther. 2005; 18: 363-366. 4. Martin W, Ristow K, Habermann T, Colgan JP, Witzig TE, Ansell SM. Bleomycin pulmonary toxicity has a negative impact on the outcome of patients with Hodgkin’s lymphoma. J Clin Oncol. 2005; 23: 7614-7620. 5. Hoshino T, Okamoto M, Sakazaki Y. Role of proinflammatory cytokines IL-18 and IL-1b in bleomycin-induced lung injury in humans and mice. Am J Respir Cell Mol Biol. 2009; 41: 661-670. 6. Horikawa M, Fujimoto M, Hasegawa M, Matsushita T, Hamaguchi Y, Kawasuji A, et al. E- and P- selectins synergistically inhibit bleomycin-induced pulmonary fibrosis. Am J Pathol. 2006; 169: 740-749. 7. Chaudhary N, Schnapp A, Park J. Pharmacologic differentiation of inflammation and fibrosis in the rat bleomycin model. Am J Respir Crit Care Med. 2006; 173: 769-776. 8. Mouratis MA, Aidinis V. Modeling pulmonary fibrosis with bleomycin. Curr Opin Pulm Med. 2011; 17: 355-361. Galindo y cols. 9. Lasky J, Ortiz L, Tonthat B, Hoyle GW, Corti M, Athas G, et al. Connective tissue growth factor mRNA expression is upregulated in bleomycin-induced lung fibrosis. Am J Physiol Lung Cell Mol Physiol. 1998; 275: L365-L371. 10. Yao H, Zhu J, Zhao M, Lu Y. Losartan attenuates bleomycin-induced pulmonary fibrosis in rats. Respiration. 2006; 73: 236-242. 11. Lovgren A, Jania L, Hartney J, Parsons KK, Audoly LP, Fitzgerald GA, et al. COX-2-derived prostacyclin protects against bleomycininduced pulmonary fibrosis. Am J Physiol Lung Cell Mol Physiol. 2006; 291: L144-L156. 12. Card J, Voltz J, Carey M, Bradbury JA, DeGraff LM, Lih FB, et al. Cyclooxygenase-2 deficiency exacerbates bleomycin-induced lung dysfunction but not fibrosis. Am J Respir Cell Mol Biol. 2007; 37: 300-308. 13. Wygrecka M, Markar P, Ruppert C, Petri K, Preissner KT, Seeger W, et al. Cellular origin of pro-coagulant and (anti)-fibrinolytic factors in bleomycin-injured lungs. Eur Respir J. 2007; 29: 11051114. 14. Adamson I. Pulmonary toxicity of bleomycin. Environ Health Perspect. 1976; 16: 119-126. 15. Uzel I, Ozguroglu M, Uzel B, Kaynak K, Demirhan O, Akman C, et al. Delayed onset bleomycin-induced pneumonitis. Urology. 2005; 66: 195. 16. Simpson AB, Paul J, Graham J, Kaye SB. Fatal bleomycin pulmonary toxicity in the west of Scotland 1991-95: a review of patients with germ cell tumours. Br J Cancer. 1998; 78: 1061-1066. 17. Kawai K, Hinotsu S, Tomobe M, Akaza H. Serum creatinine level during chemotherapy for testicular cancer as a possible predictor of bleomycin-induced pulmonary toxicity. Jpn J Clin Oncol. 1998; 28: 546-550. 18. Balikian J, Jochelson M, Bauer K. Pulmonary complications of chemotherapy regimens containing bleomycin. Am J Roentgenol. 1982; 139: 455-461. 19. Camus P, Costabel U. Drug-induced respiratory disease in patients with hematological diseases. Semin Respir Crit Care Med. 2005; 26: 458-481. 20. Keijzer A, Kuenen B. Fatal pulmonary toxicity in testis cancer with bleomycin-containing chemotherapy. J Clin Oncol. 2007; 25: 3543-3544. 21. White D, Stover D. Severe bleomycin-induced pneumonitis. Clinical features and response to corticosteroids. Chest. 1984; 86: 723-728. 22. Carver J, Shapiro C, Ng A. American Society of Clinical Oncology clinical evidence review on the ongoing care of adult cancer survivors: cardiac and pulmonary late effects. J Clin Oncol. 2007; 25: 3991-4008. 23. Koenig W, Cross C, Hesterberg T, Last J. The smoking gun: Mechanism of methylprednisolone prevention of bleomycin-induced pulmonary fibrosis. Chest. 1983; 83: 5S-7S. 24. Maher J, Daly P A. Severe bleomycin lung toxicity. Thorax. 1993; 48: 92-94. 25. Tabata C, Tabata R, Kadokawa Y. Thalidomide prevents bleomycin-induced pulmonary fibrosis in mice. J. Immunol. 2007; 179: 708-714. 26. Goffin J, Kreisman H, Sandor V. Bleomycin-induced lung toxicity and pentoxifylline. J Clin Oncol. 2001; 19: 597-598. 27. Aytemura ZA, Hacievliyagilb SS, Irazc M, Samdancid E, Ozerole E, Kukuf I, et al. Effects of iloprost on bleomycin-induced pulmonary fibrosis in rats compared with methyl-prednisolone. Rev Port Pneumol. 2012; 18: 272-277. 101 Revista Colombiana de Neumología Volumen 24 Número 2 GLOSARIO RADIOLÓGICO Signo del halo Halo sign Ana Manzano, MD.(1), Carlos Celis Preciado, MD.(2) Rev Colomb Neumol 2013; 24 (2):102-103 SIGNO DEL HALO Es un hallazgo escanográfico consistente en un halo de vidrio esmerilado rodeando un nódulo o masa pulmonar (1) (Figura 1). Fue originalmente descrito en aspergilosis angioinvasiva (2), pero pronto se comprobó que se encuentra presente en múltiples patologías, por lo que es un signo inespecífico. El halo de vidrio esmerilado usualmente es debido a hemorragia en los alvéolos vecinos al nódulo. En el caso de la aspergilosis angioinvasiva, esta hemorragia es secundaria a la necrosis isquémica que ocasiona la obstrucción de arterias de mediano y pequeño calibre por el hongo (3, 4). Se ha demostrado que el signo del halo está presente en etapas tempranas de la infección en casi todos los pacientes, pero su frecuencia va disminuyendo en etapas más tardías (3). El grupo más grande, de 235 pacientes, con Aspergilosis angioinvasiva Figura 1. Signo del halo. Paciente en quimioterapia por recadida de leucemia linfoide aguda con cuadro febril. TACAR demuestra un nódulo sólido con un halo de vidrio esmerilado. Se confirmó aspergillosis angioinvasiva. (1) (2) estudiado con escanografía (5) demostró que la mayoría de los pacientes se presenta con nódulos (94%) y de éstos, el 61% tenía el signo del halo presente. Los pacientes con signo del halo respondieron mejor al tratamiento que los que no tenían este hallazgo. Aunque el signo del halo no es patognomónico de aspergilosis angioinvasiva, su presencia en el contexto clínico de un paciente inmunosuprimido con fiebre es muy sugestivo de esta micosis. El signo del halo se ha visto asociado con otras micosis (mucor, cándida, criptococo) (Figura 2). Así Figura 2. Paciente masculino en quimioterapia por leucemia linfoide aguda con cuadro febril. TACAR demuestra un nódulo de tejido blando rodeado de un grueso halo de vidrio esmerilado. Se confirmó mucormicosis. Radióloga, Departamento de Radiología, Hospital Universitario San Ignacio, Pontificia Universidad Javeriana. Bogotá, Colombia. Internista, Neumóloga, Unidad de Neumología, Hospital Universitario San Ignacio, Pontificia Universidad Javeriana. Bogotá, Colombia. Correspondencia: Doctora Ana Manzano. Correo electrónico: crispetamanzano@gmail.com Recibido: noviembre 5 de 2012. Aceptado: noviembre 25 de 2012. 102 Signo del halo. Tabla. Causas descritas del signo del halo. 1- Infecciosas - Hongos: aspergilosis angioinvasiva, Candida, Mucor, criptococo, Coccidioides - Bacterias: neumonía bacteriana de resolución lenta, fiebre Q, Actinomyces - Virus: herpes simple, cytomegalovirus, varicela zoster, mixovirus - Micobacterias: tuberculosis, Mycobacterium avium intracellulare - Parásitos: Paragonimus, Schistosoma - Embolismos sépticos 2- Neoplasias - Primarias: adenocarcinoma, linfoma, sarcoma de Kaposi, angiosarcoma - Metástasicas: angiosarcoma, coriocarcinoma, melanoma, osteosarcoma, carcinoma de células renales, adenocarcionomas del tubo digestivo 3- Enfermedades inflamatorias no infecciosas -Neumonía en organización -Granulomatosis de Wegener -Sarcoidosis -Enfermedades eosinofílicas pulmonares 4- Otras -Iatrogénicas: biopsias transbronquiales -Endometriosis pulmonar -Amiloidosis Manzano y cols. mismo, otras patologías que cursan con hemorragia se pueden presentar con el signo del halo como metástasis hipervascularizadas (angiosarcoma, melanoma, osteosarcoma y coriocarcinoma, sarcoma de Kaposi) y la granulomatosis de Wegener (3,4). Entidades que se acompañan con edema o infiltración del pulmón vecino pueden ocasionar el signo del halo. El adenocarcinoma infiltrante (anteriormente llamado bronquioloalveolar) por su crecimiento lepídico puede presentarlo y es la causa neoplásica más frecuente de este signo (4). Se ha descrito también en neumonía criptogénica organizada, patologías eosinofílicas del pulmón (infecciones parasitarias, Sindrome de Loeffler), tuberculomas y sarcoidosis (3,4,6) (Tabla). BIBLIOGRAFÍA 1- Fleishner Society: Glossary of Terms For Thoracic Imaging. Radiology 2008; 46: 697-722. 2- Kuhlman JE, Fishman EK, Siegalman SS. Invasive Aspergillosis in Acute Leukemia: characteristic findings in CT, the halo CT sign and the role of CT in early diagnosis. Radiology 1985: 157; 862-865. 3- Pinto P. CT Halo Sign. Radiology 2004; 230: 109-110. 4- Lee,Y.R. et al. CT Halo Sign: The Spectrum Of Pulmonary Diseases. Br J Radiol. 2005: 78; 862-865. 5- Greene, R. et al. Imaging Findings in Acute Invasive Pulmonary Aspergillosis: Clinical Significance of the Halo Sign. Clin Infect Dis. 2007; 44: 373-9. 6- Parrón M, Torres I, Pardo M, Morales C, Navarro M, MartínezSchmizcraft M. [The halo sign in computed tomography images: differential diagnosis and correlation with pathology findings]. Arch Bronconeumol. 2008; 44: 386-92. 103 Revista Colombiana de Neumología Volumen 24 Número 2 IMÁGENES EN BRONCOSCOPIA Tumor carcinoide Carcinoid tumor Alejandra Cañas, MD.(1) Rev Colomb Neumol 2013; 24 (2):104-105 Paciente de 23 años, con embarazo de 25 semanas, quien consultó por cuadro de 3 días de tos con expectoración hemoptoica con posterior hemoptisis de aproximadamente 100 cc. Antecedente de dos episodios de neumonía adquirida en comunidad hace 2 años (figura 1) y 1 mes, respectivamente. Figura 2. TAC de tórax del ingreso con masa en bronquio fuente derecho. Figura 1. Radiografía de tórax tomada 2 años previos al ingreso con atelectasia de lóbulos medio e inferior derecho. Figura 3. Broncoscopia con masa pediculada nacarada a 0,5 cm de la carina que obstruye el 90% de la luz de bronquio intermediario, se logra paso del equipo a bronquio para lóbulo superior que se observa con bronquios segmentarios normales. La masa sangra muy fácilmente al contacto con el equipo; se realiza coagulación con láser NdYag pulsos simples, con control del sangrado. (1) Internista, Neumóloga, Unidad de Neumología, Hospital Universitario San Ignacio, Pontificia Universidad Javeriana. Bogotá, Colombia. Correspondencia: Doctora Alejandra Cañas. Correo electrónico: alejandra. canas@javeriana.edu.co Recibido: octubre 12 de 2012.Aceptado: noviembre 12 de 2012. 104 Tumor carcinoide. Cañas a. a. b. Figura 4. Tumor carcinoide típico con necrosis tumoral, actividad mitótica e invasión linfovascular ausentes. Índice de proliferación Ki67 menor al 3%. a. Hematoxilina y eosina. b. Positividad con cromogranina y sinaptofisina. 105