procesos redox utilizados en metalurgia y obtención de elementos
Anuncio

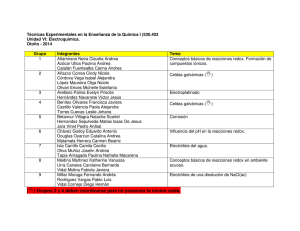
1 PROCESOS REDOX UTILIZADOS EN METALURGIA Y OBTENCIÓN DE ELEMENTOS Existe una minoría de elementos que se encuentran libres en la naturaleza. Así Ar, Kr y Xe se obtienen de la destilación del aire líquido, proceso necesario para obtener aire sintético (aire sin CO2 y otras impurezas corrientes), oxígeno líquido y comprimido y nitrógeno líquido y comprimido. Estos tres gases son muy utilizados tanto en la industria, como en medicina y en laboratorios. El He se obtiene como impureza del gas natural que queda en estado gas al licuar éste. Los elementos del grupo del platino (Ru, Rh, Pd, Os, Ir, Pt) y también el Au, y en menor proporción Ag, Cu…., se encuentran nativos y algunas veces se obtienen sin la intervención de ningún proceso redox. La mayoría de los elementos, tanto metálicos como no metálicos, se encuentran como combinaciones en la naturaleza, y pueden obtenerse por diferentes métodos que implican procesos redox. Entre ellos el más drástico es la electrolisis – en general de sales, pero otras veces de óxidos, etc.- pero sólo se suele hacer una electrólisis cuando es imprescindible, bien porque no sea posible obtener el elemento de otra forma más económica, o bien porque es imposible obtenerlo a partir de otro proceso químico redox. A continuación se dan las reacciones redox de algunos procesos de obtención de los elementos más comunes. En la mayoría de los casos, además de estas reacciones hay otras adicionales, previas y/o posteriores a las aquí dadas, que sirven para concentrar y/o purificar el elemento de sus menas originales o para purificar el elemento bruto obtenido. La finalidad de este listado es tratar de acercar al alumno a la fuente de TODO lo que somos y tenemos: LA NATURALEZA. Toda nuestra civilización se sustenta en las sustancias que salen de la Tierra: sustancias minerales y orgánicas. Tratar de recordar que TODO procede de la TIERRA, y aunque en último término es gratuito, hay que aplicar cierto esfuerzo en buscarlo, concentrarlo, obtenerlo y purificarlo. En ningún caso pretende ser un estudio o listado exhaustivo, ni completo, ni libre de errores, ni totalmente actualizado. Tampoco pretende ser algo que se tenga que aprender de memoria, sino un recordatorio, sólo eso. También pretende ser un apoyo a las enseñanzas básicas de la Escuela de Minas, en las que, por falta de tiempo, se suele abundar en principios generales y escasear en concretizaciones y aplicaciones. 1. H2: electrólisis de agua, a la que se ha aumentado la conductividad añadiéndole sales, ácidos o bases inertes. 2H2O → 2H2 + O2 2. H2: desplazamiento del agua, con metales muy activos 2Na + 2H2O → H2 + 2NaOH(aq) Zn + H2O → H2 + ZnO (hay que calentar a unos 3000 ºC) Alberto Navarro Izquierdo. Catedrático de E.U. DIQYC. ETSI de Minas. UPM 2009-05-20 PROCESOS REDOX UTILIZADOS EN METALURGIA Y OBTENCIÓN DE ELEMENTOS 2 3Fe + 4H2O → 4H2 + Fe3O4 (hay que calentar) 3. H2: desplazamiento de los ácidos con metales menos nobles que el H+/H2 Fe + 2H+ → H2 + Fe2+ Cd + 2H+ → H2 + Cd2+ 4. H2: desplazamiento de las bases por metales anfóteros menos nobles que el H+/H2 Zn + 2OH-(aq) → H2 + ZnO22-(aq) 2Al + 2OH-(aq) + 2H2O → 3H2 + 2AlO2-(aq) 5. H2: desplazamiento del agua por el carbón incandescente C + 2H2O → H2 + CO (“gas de agua” hay que calentar a unos 1000 ºC) 6. Li: electrólisis del LiCl fundido (preparado a partir de la ambligonita (Li(AlF)PO4)) 2LiCl → Cl2 + 2Li 7. Na: electrólisis de la halita (NaCl) fundida (802 ºC) o del NaOH fundido (323 ºC) 2NaCl → Cl2 + 2Na 4NaOH → O2 + 4Na + 2H2O 8. K: electrólisis de la silvina (KCl) fundida (771 ºC) 2KCl(l) → Cl2(g) + 2K(l) 9. Mg: electrólisis del cloruro fundido (se añade NaCl o KCl para rebajar la Tfus) MgCl2(l) → Cl2(g) + Mg(l) 10. Mg: reducción del óxido 2MgO2(s) + Si(s) → 3Mg(g) + SiO2(g) MgO2(s) + C(s) → Mg(g) + CO(g) 11. Ca: electrólisis del cloruro fundido (775 ºC) CaCl2(l) → Cl2(g) + Ca(l) 12. Sr: electrólisis del cloruro fundido (874 ºC) SrCl2(l) → Cl2(g) + Sr(l) 13. Ba: electrólisis del cloruro fundido (960 ºC) BaCl2(l) → Cl2(g) + Ba(l) 14. La: reducción del cloruro con Na LaCl3(s) + 3Na(s) → La(s) + 3NaCl(s) 15. La: electrólisis del cloruro disuelto en KCl(l) + CaF2(l) 2LaCl3(l) → 2La(s) + 3Cl2(g) Alberto Navarro Izquierdo. Catedrático de E.U. DIQYC. ETSI de Minas. UPM 2009-05-20 PROCESOS REDOX UTILIZADOS EN METALURGIA Y OBTENCIÓN DE ELEMENTOS 3 16. U: reducción de los haluros – procedentes del tratamiento de la pechblenda (UO2), carnotita (KUO2VO4·3H2O), autunita (Ca(UO2)2(PO4)2·10-12H2O), torbernita (Cu(UO2)2(PO4)2 ·8-12H2O).............Minerales → UO3(s) UO3(s) + H2(g) → UO2(s) + H2O(g) UO2(s) + 4HF(g) → UF4(s) + 4H2O(g) UF4(s) + 2Ca(s) → U(s) + 4CaF2(s) 17. Ti: reducción del rutilo (TiO2) -que en su caso se ha obtenido a partir de la ilmenita (FeTiO3)- o del tetracloruro 2FeTiO3(s) + 4HCl + Cl2 → 2FeCl3(g) + 2TiO2(s) + 2H2O 3TiO2(s) + 4Al(s) → Al2O3(s) + 3Ti(s) TiCl4(l) + 4Na(s) → 4NaCl(s) + Ti(s) 18. Zr: reducción del K2ZrF6 –procedente del circón (ZrSiO4) o de la badeleyita (ZrO2)con Na, K o Al K2ZrF6(s) + 4Na(s) → 2KF(s) + 4NaF(s) + Zr(s) 19. Va: reducción del pentóxido procedente de la vanadinita (Pb3(VO4)2·PbCl2), carnotita K2(UO2)2(VO4)2·3H2O, o de cenizas de carbón, con carbón o por aluminotermia 2V2O5(s) + 5C(s) → 4V(s) + 5CO2(g) 3V2O5(s) + 10Al(s) → 5Al2O3(s) + 6V(l) 20. Cr: aluminotermia del trióxido procedente de la cromita (FeCr2O4) CrO3(s) + 2Al(s) → Al2O3(s) + Cr(l) 21. Mo: aluminotermia del trióxido procedente de la molibdenita (MoS2) o de la wulfenita (PbMoO4) MoO3(s) + 2Al(s) → Al2O3(s) + Mo(l) 22. W: reducción del ácido wolfrámico -procedente de la wolframita ((Fe,Mn)WO4), o de la scheelita (CaWO4)- en horno eléctrico H2WO4(s) + 3H2(g) → W(s) + 4H2O(g) 23. Mn: aluminotermia de los óxidos: pirolusita (MnO2), braunita (Mn2O3), manganita (Mn2O3·H2O), o hausmanita (Mn3O4) Mn2O3(s) + 2Al(s) → Al2O3(s) + 2Mn(l) 24. Fe: reducción de los óxidos –oligisto o hematites roja (Fe2O3), limonita o hematites parda (Fe2O3·nH2O), magnetita (Fe3O4)- que en su caso proceden de la calcinación de la siderita (FeCO3), con carbón Fe2O3(s) + CO(g) → CO2 + 2FeO(s) FeO(s) + CO(g) → CO2 + Fe(s) 2C(s) + O2 → 2CO(g) Alberto Navarro Izquierdo. Catedrático de E.U. DIQYC. ETSI de Minas. UPM 2009-05-20 PROCESOS REDOX UTILIZADOS EN METALURGIA Y OBTENCIÓN DE ELEMENTOS 4 25. Co: reducción del óxido –procedente de la tostación de la esmaltina (CoAs2) y de la cobaltina (CoSAs)- por aluminotermia o con hidrógeno Co2O3(s) + 2Al(s) → Al2O3(s) + 2Co(s) Co2O3(s) + 3H2 (s) → 3H2O(s) + 2Co(s) 26. Ni: reducción del óxido –procedente de la tostación de la niquelina (NiAs), milllerita (NiS) y de la pentlandita (NiS·2FeS)- con carbón Co2O3(s) + 2Al(s) → Al2O3(s) + 2Co(s) Co2O3(s) + 3H2(s) → 3H2O(s) + 2Co(s) 27. Cu: electrólisis o bien reducción con Fe, del CuSO4(aq) procedente de la lixiviación de la cuprita (Cu2O), azurita (2CO3Cu·Cu(OH)2), o malaquita (CO3Cu·Cu(OH)2)), 2Cu2+(aq) + 2H2O → Cu(s) + O2 + 4H+(aq) Cu2+(aq) + Fe(s) → Cu(s) + Fe2+(aq) 28. Cu: reducción de la cuprita (Cu2O), o de la calcosina (Cu2S), covelita (CuS), bornita (Cu5FeS4), enargita (Cu3AsS) y tetraedrita (3Cu2S·Sb2S3) Cu2O(s) + C(g) → 2Cu(s) + CO(g) Cu2S(s) + O2 → SO2 + 2Cu 29. Ag: amalgamación de menas de cerargirita (AgCl) y de Ag, y posterior destilación de la amalgama 2AgCl + 2Hg → Hg2Cl2 + 2Ag(Hg) Ag(Hg) (l) → Hg(g) + Ag(s) 30. Ag: cianuración de menas seguido de reducción química o electrolítica del ión argentocianuro 4Ag + 8CN-(aq) + O2 + 2H2O → 4[Ag(CN)2] -(aq) + 4OH-(aq) AgCl + 2CN-(aq) → [Ag(CN)2]- (aq) + Cl-(aq) Ag2S + 4CN-(aq) → 2[Ag(CN)2] -(aq) + S=(aq) 2[Ag(CN)2] -(aq) + Zn → 2Ag + [Zn(CN)4] =(aq) 4[Ag(CN)2] -(aq) + 4OH-(aq) → 4Ag + O2 + 8CN-(aq) + 2H2O 31. Au: cianuración de menas conteniendo oro disperso, y posterior reducción química o electrolítica del ión aurocianuro 4Au + 8CN-(aq) + O2 + 2H2O → 4[Au(CN)2] -(aq) + 4OH-(aq) 2[Au(CN)2] -(aq) + Zn → 2Au + [Zn(CN)4] =(aq) 4[Au(CN)2] -(aq) + 4OH-(aq) → 4Au + O2 + 8CN-(aq) + 2H2O 32. Zn: reducción del óxido que procede de la tostación de la esfalerita o blenda de cinc (ZnS) o de la calcinación de la smithsonita (ZnCO3) 2ZnS(s) + 2O2 → 2ZnO(s) + 2SO2(g) ZnCO3(s) → ZnO(s) + CO2(g) 2ZnO(s) + C(s) → 2Zn(g) + CO2(g) Alberto Navarro Izquierdo. Catedrático de E.U. DIQYC. ETSI de Minas. UPM 2009-05-20 PROCESOS REDOX UTILIZADOS EN METALURGIA Y OBTENCIÓN DE ELEMENTOS 5 33. Zn: electrólisis del ZnSO4(aq) procedente de la lixiviación de la cincita (ZnO) ZnO(s) + H2SO4(aq) → ZnSO4(aq) + H2O(l) 2Zn2+ + 2H2O → Zn + O2 + 4H+ 34. Cd: reducción del óxido procedente de la tostación de la greenockita (CdS) 2CdS(s) + 2O2 → 2CdO(s) + 2SO2(g) 2CdO(s) + C(s) → 2Cd(g) + CO2(g) 35. Hg: tostación del cinabrio (HgS) HgS(s) + O2 → Hg(g) + 2SO2(g) 36. B: reducción del cloruro con hidrógeno 2BCl3(g) + 3H2 → 2B(s) + 6HCl(g) 37. B: reducción del óxido con magnesio B2O3(s) + 3Mg(s) → 2B(s) + 3MgO(s) 38. Al: electrolisis de la alúmina (Al2O3) -obtenida a partir de la bauxita (Al2O3·2H2O)disuelta en criolita fundida (Na3AlF6(l)) a T = (900-1000) ºC 2Al2O3(l) → 3O2 + 4Al(l) 39. Si: reducción de la sílice SiO2 + 2C → Si + 2CO SiO2 + 2Mg → Si + 2MgO 40. Ge: reducción del dióxido procedente de la argirodita (GeS2·4Ag2S), o como subproducto de la obtención del Zn 3GeO2(s) + 4Al(s) → 3Ge(s) + 2Al2O3(s) GeO2(s) + 2H2 → Ge(s) + 2H2O ; T = 760 ºC 41. Sn: reducción de la casiterita SnO2(s) + 2C → Sn(l) + 2CO 42. Pb: tostación de la galena (PbS), en su caso mezclada con anglesita (PbSO4) 2PbS(s) + 3O2 → 2PbO(s) +2SO2(g) PbS(s) + 2O2 → PbSO4(s) Posteriormente: 2PbO(s) + PbS(s) → 3Pb(l) +SO2(g) PbSO4(s) + PbS(s) → 2Pb(l) + 2SO2(g) 43. Pb: reducción del óxido procedente de la calcinación de la cerusita (PbCO3) PbCO3(s) → PbO (s) + CO2 2PbO(s) + C → Pb(l) + CO2 44. P: reducción de la fosforita en horno eléctrico: Ca3(PO4)2 + 3SiO2 + 5 C → 2P + 3CaSiO3 + 5CO Alberto Navarro Izquierdo. Catedrático de E.U. DIQYC. ETSI de Minas. UPM 2009-05-20 PROCESOS REDOX UTILIZADOS EN METALURGIA Y OBTENCIÓN DE ELEMENTOS 6 45. As: reducción del trióxido producido por tostación de arseniuros: S3As2 (rejalgar y oropimente), SAsFe (mispiquel), SAsCo (cobaltina).... S3As2(s) + 4,5O2 → 3SO2(g) + As2O3(s) As2O3(s) + 3 C(g) → 2As(g) + 3 CO(g) 46. Sb: reducción del óxido producido por tostación de la estibina S3Sb2(s) + 5O2 → 3SO2(g) + Sb2O4(s) Sb2O4(s) + 4C(g) → 2Sb(g) + 4CO(g) 47. Sb: reducción de la estibina S3Sb2 + 3Fe → 3SFe + 2Sb 48. F2: electrólisis del HF anhidro (40%) y KHF2 (60%) fundidos a 72 ºC 2HF → F2 + H2 49. Cl2: electrólisis del NaCl fundido (802 ºC) 2NaCl(l) → Cl2 + 2Na(l) 50. Cl2: oxidación de los cloruros o del HCl MnO2(s) +4HCl(aq) → MnCl2(aq) + Cl2 + 2H2O O2 +4HCl(g) → Cl2 + 2H2O (400 ºC, catalizado) NaCl(aq) + MnO2(s) + 3H2SO4(aq) → Cl2 + 2NaHSO4(aq) + MnSO4(aq) + 2H2O 51. Br2: electrólisis de los bromuros fundidos 2NaBr(l) → Br2(g) + 2Na(l) ; T = 1020 K 52. Br2: oxidación de los bromuros y del HBr MnO2(s) +4HBr(aq) → MnBr2(aq) + Br2 + 2H2O Cl2 +2Br-(aq) → Br2 + 2Cl-(aq) 2KBr(aq) + MnO2(s) + 3H2SO4(aq) → Br2 + 2KHSO4(aq) + MnSO4(aq) + 2H2O 53. I2: oxidación de los yoduros y del HI Cl2 + 2I-(aq) → I2 + 2Cl-(aq) MnO2(s) + 4HI(aq) → MnI2(aq) + I2 + 2H2O 54. I2: reducción del iodato sódico (contenido como impureza en el NaNO3 de Chile) 2NaIO3(aq) + 5NaHSO3(aq) → I2 + 3NaHSO4(aq) + 2Na2SO4(aq) + H2O Actualmente una gran cantidad de elementos que se utilizan en pequeñas cantidades, pero que son de alto interés tecnológico, y que se suelen obtener como subproductos de otros procesos industriales. Estos elementos se encuentran como impurezas en forma de disolución sólida en los minerales, o como microinclusiones de minerales diferenciados en los minerales portadores. Estas microinclusiones son difíciles de separar de los minerales matriz o portadores. Por ejemplo los metales Ga, In y Tl se obtienen como subproducto de la metalurgia del cinc a partir de la esfalerita (ZnS). Estos elementos tienen interés en microelectrónica para fabricar semiconductores (como (In,Ga)N, InN, GaN, (Ga,In)P, GaP, InP, GaAs, InAs, (Ga,In)As….) de propiedades optoelectrónicas de las que carecen el semiconductor más ampliamente empleado, el Si. Alberto Navarro Izquierdo. Catedrático de E.U. DIQYC. ETSI de Minas. UPM 2009-05-20