durogesic
Anuncio

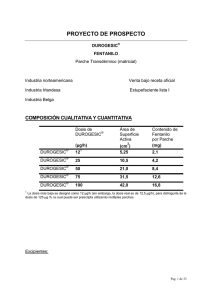
DUROGESIC® FENTANILO Parches transdérmicos Industria belga Cómo administrar DUROGESIC® Comenzar con DUROGESIC® En la parte superior del torso o del brazo, localice un sector de la piel que esté intacto y sin vello. En esa área no debe haber heridas pequeñas ni la piel debe estar roja, quemada o irritada. Con un par de tijeras, corte cualquier vello restante (no lo afeite, eso afectará la piel). Si es necesario lavar la piel antes, use agua limpia (sin jabón) y luego asegúrese de que la piel vuelva a estar completamente seca. Se debe inspeccionar el parche antes de usarlo. No se deben usar parches que estén cortados, divididos o dañados en cualquier forma. 1. Abra el empaque justo antes de aplicar DUROGESIC ®. Corte el envoltorio a la altura de la flecha del costado hasta la ranura. Suavemente, abra el envoltorio por el costado. Siga abriendo el envoltorio de ambos lados, doblando su apertura como un libro. 2. Retire el parche. 3. Afloje la cobertura de plástico más grande por uno de los extremos y quítela completamente. Evite tocar el lado adhesivo del parche. 4. Aplique el parche sobre la piel y presiónelo firmemente con la mano unos 30 segundos. Asegúrese de que todo el parche esté en contacto con la piel y, en especial, que los bordes estén bien adheridos. 5. Luego lávese las manos con agua limpia (sin jabón). Se puede dejar el parche durante 3 días (72 horas). Puede bañarse, ducharse o nadar. Siempre anote el día en que se colocó el parche. En la caja hay un lugar para eso. Lo ayudará a usar correctamente DUROGESIC ® y a recordar cuándo transcurrieron los 3 días. Cambiar un parche DUROGESIC® - Después de 3 días, tire del parche para quitarlo. - Inmediatamente, dóblelo con la cara adhesiva hacia adentro y arrójelo. - A continuación, coloque un parche nuevo, pero nunca en el mismo lugar que el anterior. Seleccione una nueva área de piel intacta. - Siga las instrucciones de aplicación que aparecen debajo de “Comenzar con DUROGESIC ®”. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA DUROGESIC® DUROGESIC® DUROGESIC® Administración (mcg/h) 25 50 Tamaño del parche (cm2) 10,5 21,0 Contenido de fentanilo en el parche (mg) 4,2 8,4 Para los excipientes, consulte Información farmacéutica, Lista de excipientes. 1 FORMA FARMACÉUTICA Parche transdérmico que administra continua y sistemáticamente fentanilo, un potente analgésico opiáceo, durante 72 horas. RELEASE LINER DRUG CONTAINING LAYER BACKING LAYER REVESTIMIENTO LIBERACIÓN CAPA CONTENEDORA MEDICAMENTO CAPA DE REFUERZO DE DEL INFORMACIÓN CLÍNICA Indicaciones terapéuticas DUROGESIC® se indica para el dolor crónico y para el dolor no tratable que requiere de la administración continua de opiáceos por un período de tiempo prolongado. Posología y forma de administración Las dosis de DUROGESIC ® deben ser individuales, según el estado del paciente y deben ser evaluadas en intervalos periódicos después de la primera aplicación. Los parches están diseñados para proporcionar 25 y 50 mcg/h de fentanilo a la circulación sistémica, lo que representa unos 0,6 y 1,2mg por día (consulte Composición cualitativa y cuantitativa), respectivamente. Selección de la posología inicial La dosis inicial apropiada de DUROGESIC ® debe estar basada en el consumo de opiáceos actual del paciente. Se recomienda administrar DUROGESIC ® en pacientes que tengan tolerancia demostrada a los opiáceos. Otros factores a considerar son el estado general y médico del paciente, como por ejemplo, el tamaño corporal, la edad y el grado de debilitación y de tolerancia a los opiáceos. Adultos Pacientes con tolerancia a los opiáceos Para pasar a los pacientes con-tolerancia a opiáceos desde los opiáceos orales o parenterales hasta DUROGESIC®, consulte Conversión de potencia equianalgésica. Subsecuentemente, se ajustará una dosis mayor o menor, si fuera necesario, en incrementos de 12 o 25 mcg/h para conseguir la dosis más baja apropiada de DUROGESIC® según la respuesta y la necesidad de analgésicos complementarios. Pacientes que nunca recibieron-opiáceos La experiencia clínica con DUROGESIC ® es limitada en los pacientes que nunca recibieron opiáceos. En circunstancias en que se considere apropiado un tratamiento con DUROGESIC® en pacientes que nunca recibieron opiáceos, se recomienda que dichos pacientes reciban dosis bajas de opiáceos de liberación prolongada (es decir, 2 morfina, hidromorfona, oxicodona, tramadol y codeína) para obtener una dosis equianalgésica relativa a DUROGESIC® con un índice de liberación de 25 mcg/h. Luego se puede pasar al paciente a DUROGESIC ® 25 mcg/h. Subsecuentemente, se ajustará una dosis mayor o menor, si fuera necesario, en incrementos de 12 o 25 mcg/h para conseguir la dosis más baja apropiada de DUROGESIC ® según la respuesta y la necesidad de analgésicos complementarios (consulte Conversión de potencia equianalgésica abajo). (Consulte Advertencias y precauciones especiales de empleo: estados de sin consumo previo de opiáceos e intolerancia a los opiáceos). Conversión de potencia equianalgésica 1. Calcule la necesidad de analgésicos en las 24 horas previas. 2. Convierta esa cantidad a la dosis de morfina oral equianalgésica con la Tabla 1. Todas las dosis intramusculares y orales en esta tabla se consideran equivalentes a 10 mg de morfina intramuscular en efecto analgésico. 3. Para derivar la dosis de DUROGESIC® correspondiente a la dosis de 24 horas de morfina equianalgésica calculada, use la conversión de dosis de la Tabla 2. La Tabla 2 es para pacientes adultos que necesitan rotar o cambiar el régimen de opiáceos (índice de conversión de morfina oral a fentanilo transdérmico aproximadamente igual a 150:1). Tabla 1: Conversión de potencia equianalgésica Dosis equianalgésica (mg) Nombre del medicamento IM* Oral morfina 10 30 (asumiendo la repetición de la dosis)** hidromorfona 1,5 7,5 metadona 10 20 oxicodona 15 30 levorfanol 2 4 oximorfona 1 10 (rectal) diamorfina 5 60 petidina 75 – codeína 130 200 buprenomorfina 0,4 0,8 (sublingual) *Con base en los estudios de dosis única en que la dosis intramuscular (IM) de cada medicamento nombrado se comparó con la morfina para establecer la potencia relativa. Se recomiendan las dosis orales cuando se cambia de una vía parenteral a una oral. **La potencia oral/IM para la morfina tiene base en la experiencia clínica en pacientes con dolor crónico. Referencia: Adapted from Foley KM. The treatment of cancer pain. NEJM 1985; 313 (2): 84–95. Tabla 2:1 Posología inicial recomendada de DUROGESIC® con base en la dosis diaria de morfina Posología de Morfina oral de 24 DUROGESIC® horas (mcg/h) (mg/día) 3 <135 (para adultos) 25 135–224 50 225–314 75 315–404 100 405–494 125 495–584 150 585–674 175 675–764 200 765–854 225 855–944 250 945–1034 275 1035–1124 300 1 En ensayos clínicos, se utilizaron estos rangos de dosis de morfina oral diaria como base de conversión a DUROGESIC®. La evaluación inicial del efecto analgésico máximo de DUROGESIC ® puede realizarse una vez transcurridas las 24 horas de uso del parche. Ese retraso se debe al incremento gradual de las concentraciones de fentanilo en suero en las 24 horas que siguen a la aplicación inicial del parche. Por lo tanto, los tratamientos analgésicos previos se deben eliminar en forma gradual después de la aplicación de la dosis inicial hasta que se obtenga la eficacia analgésica con DUROGESIC®. Titulación de la dosis y terapia de mantenimiento Existe una concentración de 12 mcg/h para la titulación de la dosis. El parche de DUROGESIC® se debe remplazar cada 72 horas. La dosis se debe titular en forma individual hasta que se obtenga un equilibrio entre la eficacia analgésica y la tolerabilidad. Si el efecto analgésico es insuficiente después de la aplicación inicial, la dosis se puede incrementar pasados 3 días. Desde ese momento, la dosis se puede ajustar cada 3 días. Al principio del tratamiento, algunos pacientes no obtienen el efecto analgésico adecuado al tercer día de uso con este intervalo posológico y puede que sea necesario colocar el nuevo parche DUROGESIC ® a las 48 horas y no a las 72 horas. Al reducir el tiempo de aplicación y remplazarlo antes de las 72 horas, se pueden conseguir mayores concentraciones de fentanilo en suero (consulte Propiedades farmacocinéticas). La titulación posológica se debe realizar normalmente en incrementos de 12 mcg/h o 25 mcg/h, aunque se deben tener en cuenta las necesidades analgésicas complementarias (morfina oral 45/90 mg/día | DUROGESIC® 12/25 mcg/h) y el estado de dolor del paciente. Se puede utilizar más de un parche DUROGESIC ® para dosis mayores a 100 mcg/h. Los pacientes pueden necesitar dosis complementarias periódicas de un analgésico de corta duración para los “episodios” de dolor. Algunos pacientes pueden necesitar métodos adicionales o alternativos de administración de opiáceos cuando la dosis de DUROGESIC® excede los 300 mcg/h. Interrupción de DUROGESIC® Si fuera necesaria la interrupción de DUROGESIC®, el remplazo con otros opiáceos debe ser gradual, iniciando con dosis bajas y aumentando lentamente. Esto se debe a que las concentraciones de fentanilo se reducen en forma gradual cuando se interrumpe el uso de DUROGESIC®, las concentraciones de fentanilo en suero tardan 17 horas o más para disminuir a la mitad. En general, la interrupción de analgésicos 4 opiáceos deber ser gradual para evitar los síntomas de abstinencia. Los síntomas de abstinencia a opiáceos (consulte Reacciones adversas) pueden ocurrir en algunos pacientes después de la conversión o ajuste de dosis. La Tabla 2 no debe utilizarse para cambiar el tratamiento con DUROGESIC ® por otros tratamientos, a fin de evitar sobrestimar la nueva dosis analgésica y causar una sobredosis. Contraindicaciones DUROGESIC® está contraindicado en pacientes con hipersensibilidad conocida al fentanilo o a los adhesivos presentes en el parche. DUROGESIC® está contraindicado para el tratamiento del dolor agudo o postoperatorio, ya que no se puede ajustar la dosis a corto plazo y, además, puede producir una hipoventilación grave o comprometer la vida del paciente. Advertencias y precauciones especiales de empleo LOS PACIENTES QUE PRESENTARON EVENTOS ADVERSOS GRAVES DEBEN PERMANECER BAJO OBSERVACIÓN DURANTE AL MENOS 24 HORAS DESPUÉS DE LA INTERRUPCIÓN DE DUROGESIC ®, SEGÚN LO DICTAMINEN LOS SÍNTOMAS CLÍNICOS, YA QUE LAS CONCENTRACIONES DE FENTANILO EN SUERO DISMINUYEN GRADUALMENTE A UN 50% AL CABO DE 17 (RANGO 13–22) HORAS. DUROGESIC® se debe mantener fuera del alcance de los niños antes y después de su uso. No corte los parches DUROGESIC ®. No se deben usar parches que fueron divididos, cortados o dañados. Estados sin consumo previo de opiáceos e intolerancia a los opiáceos El uso del sistema transdérmico DUROGESIC ® en pacientes que no hayan recibido tratamientos con opiáceos se asoció con casos muy raros de una importante depresión respiratoria o muerte cuando se utilizó como tratamiento inicial con opiáceos. La hipoventilación potencialmente mortal existe aun cuando se utilizan las dosis más bajas del sistema transdérmico DUROGESIC ® como tratamiento inicial en pacientes que nunca recibieron opiáceos. Se recomienda que DUROGESIC ® se administre a pacientes con tolerancia demostrada a los opiáceos (consulte Posología y método de administración: Selección de la posología inicial). Depresión respiratoria Como ocurre con todos los opiáceos, algunos pacientes pueden experimentar depresiones respiratorias importantes con DUROGESIC ®; se debe observar a los pacientes por si eso ocurre. La depresión respiratoria puede persistir después de extraer el parche DUROGESIC ®. La incidencia de depresión respiratoria aumenta cuando la dosis de DUROGESIC ® es mayor (consulte Sobredosis, sobre la depresión respiratoria). Los medicamentos activos para el SNC pueden aumentar la depresión respiratoria (consulte Interacción con otros medicamentos y otras formas de interacción). Enfermedad pulmonar crónica DUROGESIC® puede presentar más efectos adversos graves en pacientes con 5 enfermedad obstructiva crónica u otras enfermedades pulmonares. En dichos pacientes, los opiáceos pueden disminuir la frecuencia respiratoria e incrementar la resistencia de las vías respiratorias. Dependencia farmacológica y posible abuso La administración repetida de opiáceos puede desarrollar tolerancia, y dependencia física y psicológica. La adicción iatrogénica por la administración de opiáceos es rara. Se puede abusar del fentanilo en forma similar a otros agonistas de los opiáceos. El abuso o mal uso intencional de DUROGESIC® puede resultar en una sobredosis o la muerte. Los pacientes con mayor riesgo de abuso a los opiáceos pueden ser tratados con formulaciones de opiáceos de liberación modificada; sin embargo, esos pacientes deberán estar bajo observación para controlar que no haya un mal uso, abuso o adicción. Aumento de la presión intracraneal DUROGESIC® se debe utilizar con cuidado en los pacientes que puedan ser particularmente susceptibles a los efectos intracraneales de la retención de CO2 como aquellos con indicios de presión intracraneal, pérdida del conocimiento o coma. DUROGESIC® se debe usar con precaución en pacientes con tumores cerebrales. Insuficiencia cardíaca El fentanilo puede producir bradicardia y, por ende, se debe administrar con precaución a los pacientes con bradiarritmias. Insuficiencia hepática Como el fentanilo se metaboliza a metabolitos inactivos en el hígado, la insuficiencia hepática puede retrasar su eliminación. Si los pacientes con insuficiencia hepática reciben DUROGESIC®, deben ser cuidadosamente observados por si aparecen indicios de toxicidad por fentanilo y, de ser necesario, se deberá reducir la dosis de DUROGESIC® (consulte Propiedades farmacocinéticas). Insuficiencia renal Menos del 10% de fentanilo se excreta sin modificación por el riñón y, a diferencia de la morfina, no se eliminan metabolitos activos por dicho órgano. Si los pacientes con insuficiencia renal reciben DUROGESIC®, deben ser cuidadosamente observados por si aparecen indicios de toxicidad por fentanilo y, de ser necesario, se deberá reducir la dosis (consulte Propiedades farmacocinéticas). Fiebre/aplicación externa de calor Un modelo farmacocinético indica que las concentraciones de fentanilo en suero pueden aumentar en un tercio si la temperatura de la piel aumenta a 40 °C. Por ende, los pacientes con fiebre deben permanecer bajo observación en caso de que aparezcan efectos secundarios producidos por opiáceos y, de ser necesario, se debe ajustar la dosis de DUROGESIC ®. En el caso de los incrementos de liberación de fentanilo del sistema debido a la temperatura, existe una posibilidad de que dicho incremento produzca sobredosis y la muerte. Un ensayo clínico farmacológico realizado en sujetos adultos sanos mostró que la aplicación de calor sobre el sistema DUROGESIC® incrementa los valores medios de AUC de fentanilo en un 120% y los valores medios de Cmáx en un 61%. Se debe aconsejar a 6los pacientes que eviten la exposición del sitio de aplicación de DUROGESIC® a las fuentes de calor externas directas como compresas de calor, mantas eléctricas, camas de agua caliente, lámparas bronceadoras o de calor, exposición intensa a la luz solar, botellas de agua caliente, baños calientes prolongados, saunas y baños de hidromasaje calientes. Síndrome de la serotonina Se aconseja tener precaución cuando se coadministra DUROGESIC ®“ con medicamentos que afectan los sistemas de neurotransmisión serotogénica. El desarrollo de un síndrome de la serotonina potencialmente mortal puede ocurrir con el uso concomitante de medicamentos serotoninérgicos como Inhibidores Selectivos de Recaptación de Serotonina (ISRS) e Inhibidores Selectivos de Recaptación de Norepinefrina-Serotonina (ISRNS) y con medicamentos que afectan al metabolismo de la serotonina (como por ejemplo, Inhibidores de la Monoaminooxidasa [IMAO]). Eso puede ocurrir con la dosis recomendada. El síndrome de la serotonina puede incluir modificaciones del estado mental (por ej., agitación, alucinaciones, coma), inestabilidad autónoma (por ej., taquicardia, presión sanguínea lábil, hipertermia), anormalidades neuromusculares (por ej., hiperreflexia, incoordinación, rigidez) o síntomas gastrointestinales (por ej., náuseas, vómitos, diarrea). Si se sospecha de la existencia del síndrome de la serotonina, se debe interrumpir el tratamiento con DUROGESIC®. Interacciones con otros medicamentos Interacciones con Inhibidores del CYP3A4 El uso concomitante de DUROGESIC ® con inhibidores del citocromo P450 3A4 (CYP3A4) (por ej., ritnovair, ketoconazol, itraconazol, troleandomicina, claritromicina, nelfinavir, nefazodona, verapamilo, diltiazem y amiodarona) puede resultar en un aumento de las concentraciones de fentanilo en plasma, lo que puede incrementar o prolongar los efectos terapéuticos y los efectos secundarios, y causar una depresión respiratoria grave. En esta situación, son apropiados el cuidado especial y la observación del paciente. Por ende, no se recomienda el uso concomitante de fentanilo transdérmico e inhibidores del CYP3A4, a menos que se monitorice cuidadosamente al paciente. Los pacientes, en especial, los que reciben DUROGESIC® e inhibidores del CYP3A4, deben permanecer bajo observación para verificar que no haya indicios de depresión respiratoria y, si esos indicios existen, se debe ajustar la dosis. Exposición accidental por contacto con el parche La transferencia accidental del parche de fentanilo a la piel de una persona que no utilice el parche (en particular un niño) al compartir una cama o al estar en contacto físico cercano con un usuario del parche puede causar una sobredosis por opiáceos en la persona que no utilice el parche. Se debe advertir a los pacientes que, en caso de contacto accidental con el parche, dicho parche debe retirarse inmediatamente de la piel de la persona no usuaria del parche. (Consulte Sobredosis). Administración en pacientes de edad avanzada 7 Los datos de un estudio intravenoso con fentanilo indican que los pacientes de edad avanzada pueden tener una eliminación reducida, una semivida prolongada y pueden ser más sensibles al medicamento que los pacientes más jóvenes. Si los pacientes de edad avanzada reciben DUROGESIC ®, deben ser cuidadosamente observados por si aparecen indicios de toxicidad por fentanilo y, de ser necesario, se deberá reducir la dosis (consulte Propiedades farmacocinéticas). Tracto gastrointestinal Los opiáceos aumentan el tono y disminuyen las contracciones propulsivas de los músculos lisos del tracto gastrointestinal. La duración prolongada del tránsito gastrointestinal resultante puede ser la responsable del estreñimiento causado por el fentanilo. Se deberá advertir a los pacientes que tomen medidas para prevenir el estreñimiento y se valorará el consumo profiláctico de laxantes. Se debe tener especial precaución en los pacientes con estreñimiento crónico. Si se manifiesta o se sospecha de la presencia de íleo paralítico, se debe suspender el tratamiento con DUROGESIC®. Uso en niños No se ha probado la eficacia ni la seguridad de DUROGESIC® en niños. Interacciones con otros medicamentos y otras formas de interacción El uso concomitante de otros medicamentos depresores del sistema nervioso central, por ejemplo los opiáceos, los sedantes, los hipnóticos, la anestesia general, la fenotiazina, los tranquilizantes, los relajantes musculoesqueléticos, los antihistamínicos sedantes y las bebidas alcohólicas, pueden producir más efectos depresivos: pueden ocurrir hipoventilación, hipotensión y sedación profunda, coma o muerte. Por ello, el uso concomitante de cualquiera de esos medicamentos con DUROGESIC® requiere de un cuidado y observación especial del paciente. El fentanilo, un medicamento de alta eliminación, se metaboliza principalmente de forma rápida y extensiva por CYP3A4. El uso concomitante de inhibidores del CYP3A4 con fentanilo transdérmico puede resultar en un incremento en las concentraciones de fentanilo en plasma, que puede aumentar o prolongar los efectos terapéuticos y secundarios y puede causar depresiones respiratorias graves. En esa situación, son apropiados el cuidado especial y la observación del paciente. No se recomienda el uso concomitante de inhibidores del CYP3A4 y fentanilo transdérmico, a menos que el paciente permanezca bajo estricta observación (consulte Advertencias y precauciones especiales de empleo). El uso concomitante de DUROGESIC® con los inductores del CYP3A4 (por ej., rifampicina, carbamazepina, fenobarbital, fenitoína) puede provocar una disminución de las concentraciones plasmáticas de fentanilo y disminuir el efecto terapéutico. Esto puede requerir un ajuste de la dosis de fentanilo transdérmico. Después de interrumpir el tratamiento de un inductor del CYP3A4, los efectos del inductor se reducen gradualmente y pueden provocar un aumento de la concentración plasmática de fentanilo, que a su vez puede aumentar o prolongar tanto los efectos adversos como los terapéuticos y causar una depresión respiratoria grave. En ese caso, se debe vigilar cuidadosamente al paciente y ajustar la dosis si se justifica. Inhibidores de la monoamina oxidasa (IMAO) No se recomienda el uso de DUROGESIC ® en pacientes que necesitan la 8 administración concomitante de un IMAO. Se han informado interacciones graves e impredecibles con IMAO, entre ellas, la potenciación de los efectos opiáceos o la potenciación de los efectos serotoninérgicos. Por ende, DUROGESIC ® no se debe usar dentro de las 14 horas posteriores a la interrupción del tratamiento con IMAO. Medicamentos serotoninérgicos La coadministración de fentanilo con agentes serotoninérgicos, como un Inhibidor Selectivo de Recaptación de Serotonina (ISRS) o un Inhibidor Selectivo de la Recaptación de Serotonina-Norepinefrina (ISRSN) o un Inhibidor de Monoamina Oxidasa (IMAO), puede aumentar el riesgo de sufrir síndrome de la serotonina, una afección potencialmente mortal. Embarazo y amamantamiento Embarazo No existen datos adecuados sobre el uso de DUROGESIC ® en mujeres embarazadas. Los estudios en animales mostraron cierta toxicidad reproductiva (consulte Información de seguridad preclínica). El posible riesgo en humanos es desconocido, aunque se descubrió que el fentanilo como anestésico intravenoso atraviesa la placenta en embarazos humanos de temprana edad. Se informó el síndrome de abstinencia neonatal en infantes recién nacidos con uso maternal crónico de DUROGESIC ® durante el embarazo. No se debe administrar DUROGESIC® durante el embarazo a menos que sea totalmente necesario. No se recomienda el uso de DUROGESIC ® durante el parto porque no debe administrarse en el control de dolor agudo o postoperatorio (consulte Contraindicaciones). Además, como el fentanilo atraviesa la placenta, el uso de DUROGESIC® durante el parto puede resultar en la depresión respiratoria del infante recién nacido. Amamantamiento El fentanilo se excreta en la leche humana y puede causar sedación/depresión respiratoria en un infante. Por ende, no se recomienda el uso de DUROGESIC ® en mujeres en período de lactancia. Efectos sobre la capacidad para conducir y utilizar máquinas DUROGESIC® puede afectar la capacidad mental o física necesaria para realizar tareas potencialmente peligrosas como conducir un vehículo u operar máquinas. Reacciones adversas Datos de ensayos clínicos La seguridad de DUROGESIC ® se evaluó en 216 sujetos que participaron en un ensayo clínico multicéntrico, doble ciego, aleatorizado, controlado con placebo (FEN-EMA-1) de DUROGESIC ®. Estos sujetos recibieron al menos una dosis de DUROGESIC® y proporcionaron datos de seguridad. Con ese ensayo, se examinaron participantes de más de 40 años de edad con dolores intensos inducidos por osteoartritis de cadera o rodilla y que necesitaban y esperaban un reemplazo de la articulación. Los participantes fueron tratados durante 6 semanas con DUROGESIC® mediante la titulación adecuada de control de dolor comenzando por 25 mcg/h hasta 9 una dosis máxima de 100 mcg/h en incrementos de 25 mcg/h. En la Tabla 3, se muestran las reacciones adversas al medicamento (RAM) informadas por ≥1% de los sujetos tratados con DUROGESIC® y con una incidencia mayor en comparación con los pacientes tratados con placebo. Tabla 3: Reacciones adversas al medicamento informadas por ≥1% de los sujetos tratados con DUROGESIC® y con una incidencia mayor en comparación con los sujetos tratados con placebo en® un ensayo clínico, doble ciego, controlado con placebo de DUROGESIC DUROGESIC®® Placebo Clase de órgano o sistema % % Reacción adversa (n=216) (n=200) Trastornos metabólicos y nutricionales Anorexia 4,6 0 Trastornos psiquiátricos Depresión 1,4 0 Insomnio 10,2 6,5 Trastornos del sistema nervioso Somnolencia 19,0 2,5 Mareos 10,2 4,0 Trastornos del oído y del laberinto Vértigo Trastornos cardíacos Palpitaciones Trastornos gastrointestinales Náuseas Vómitos Estreñimiento Dolor abdominal superior Boca seca Trastornos de la piel y del tejido subcutáneo Hiperhidrosis Prurito Erupción cutánea Trastornos musculoesqueléticos y del tejido conjuntivo Espasmos musculares Trastornos generales y alteraciones en el lugar de administración Fatiga Frío 2,3 0,5 3,7 1,0 40,7 25,9 8,8 2,8 2,3 16, 52,5 1,0 1,5 0 6,5 3,2 1,9 1,0 2,0 1,0 4,2 1,5 6,5 6,5 3,0 2,0 10 Reacciones adversas al medicamento informadas por ≥1% de los sujetos tratados con DUROGESIC® y con una incidencia mayor en comparación con los sujetos tratados con placebo en un ensayo clínico, doble ciego, controlado con placebo de DUROGESIC® DUROGESIC ® Placebo Clase de órgano o sistema % % Reacción adversa (n=216) (n=200) Malestar 3,7 0,5 Astenia 2,3 0 Edema periférico 1,4 1,0 Tabla 3: Las reacciones adversas al medicamento que no se informan en la Tabla 3 y que fueron informadas por un ≥1% de los sujetos tratados con DUROGESIC ® (n=1854) en 11 ensayos clínicos de DUROGESIC ® para el tratamiento de dolor crónico maligno o no maligno (que incluye ensayos FEN-EMA-1) se muestran en la Tabla 4. Todos los sujetos recibieron al menos una dosis de DUROGESIC ® y proporcionaron datos de seguridad. Tabla 4: Reacciones adversas al medicamento informadas por un ≥1% de los pacientes tratados en 11 ensayos clínicos de DUROGESIC® DUROGESIC® Clase de órgano o sistema Reacción adversa % (n=1854) Trastornos del sistema inmunológico Hipersensibilidad 1,0 Trastornos psiquiátricos Ansiedad 2,5 Estado de confusión 1,7 Alucinaciones 1,2 Trastornos del sistema nervioso Cefalea 11,8 Temblores 2,6 Parestesias 1,8 Trastornos gastrointestinales Diarrea 9,6 Dolor abdominal 2,9 Trastornos de la piel y del tejido subcutáneo Eritema 1,2 Trastornos renales y urinarios Retención urinaria 1,4 En la Tabla 5, se muestran las reacciones adversas informadas por <1% de los sujetos tratados con DUROGESIC® (n=1854) en la serie de datos del ensayo clínico a continuación. Tabla 5: Reacciones adversas informadas por <1% de los sujetos tratados 11 en 11 ensayos clínicos de DUROGESIC® Clase de órgano o sistema Reacción adversa Trastornos psiquiátricos Desorientación Estado de ánimo eufórico Trastornos del sistema nervioso Hipostesia Trastornos oculares Miosis Trastornos cardíacos Cianosis Trastornos respiratorios, torácicos y mediastínicos Depresión respiratoria Trastornos gastrointestinales Obstrucción intestinal leve Trastornos de la piel y del tejido subcutáneo Dermatitis Dermatitis alérgica Dermatitis de contacto Eczema Trastornos de la piel Trastornos musculoesqueléticos y del tejido conjuntivo Contracciones musculares Trastornos del sistema reproductor y de las mamas Disfunción eréctil Disfunción sexual Trastornos generales y alteraciones en el lugar de administración Dermatitis en el lugar de la aplicación Eccema en el lugar de la aplicación Hipersensibilidad en el lugar de la aplicación Reacción cutánea en el lugar de la aplicación Síndrome de abstinencia Síndrome gripal 12 Datos posteriores a la comercialización En la Tabla 6, se incluyen las reacciones adversas al medicamento informadas en forma espontánea durante la experiencia mundial posterior a la comercialización en todas las indicaciones de DUROGESIC ® que cumplieron con los criterios de límite. Las RAM se clasifican por frecuencia, según la siguiente convención: Muy común ≥1/10 Común ≥1/100 y <1/10 Poco común ≥1/1000 y <1/100 Raro ≥1/10.000 y <1/1000 Muy raro <1/10.000, incluso informes aislados Las frecuencias proporcionadas abajo reflejan los índices de informes para los RAM de comunicaciones espontáneas y no representan estimaciones más precisas de los que se puedan obtener en estudios clínicos o epidemiológicos. Tabla 6: Reacciones adversas al medicamento que se identificaron durante la experiencia de DUROGESIC® posterior a la comercialización, clasificadas por frecuencia y calculadas de acuerdo con los índices de comunicación espontánea Trastornos del sistema inmunológico Muy raros Shock anafiláctico, reacción reacciones anafilactoides Trastornos psiquiátricos Muy raros anafiláctica, Agitación Trastornos del sistema nervioso Muy raros Convulsiones (por ejemplo, convulsiones clónicas y convulsiones generalizadas), amnesia, depresión de los niveles de conciencia, pérdida de conciencia Trastornos oculares Muy raros Visión borrosa Trastornos cardíacos Muy raros Taquicardia, bradicardia 13 Trastornos vasculares Muy raros Hipotensión, hipertensión Trastornos respiratorios, torácicos y mediastínicos Muy raros Dificultad respiratoria, apnea, bradipnea, hipoventilación, disnea (consulte Sobredosis para obtener más información sobre eventos relativos a la depresión respiratoria) Trastornos gastrointestinales Muy raros Obstrucción intestinal, dispepsia Trastornos generales y alteraciones en el lugar de administración Muy raros Sensación de cambios de temperatura, Pirexia Como ocurre con otros analgésicos opiáceos, se puede desarrollar tolerancia, dependencia física y dependencia psicológica por el uso repetido de DUROGESIC ® (consulte Advertencias y precauciones especiales de empleo). Los síntomas de abstinencia a opiáceos (como náuseas, vómitos, diarrea, ansiedad y temblor) pueden ocurrir en algunos pacientes después de la conversión de sus analgésicos opiáceos previos a DUROGESIC ® y si el tratamiento se interrumpe de repente (consulte Posología y método de administración). Hubo algunas notificaciones de síndrome de abstinencia neonatal en infantes recién nacidos en que las madres usaron DUROGESIC ® en forma crónica durante el embarazo (consulte Embarazo y lactancia). Sobredosis Síntomas y signos Las manifestaciones de sobredosis de fentanilo son una extensión de sus acciones farmacológicas, siendo la depresión respiratoria el efecto más grave. Tratamiento Entre las contramedidas inmediatas para controlar la depresión respiratoria, se enumeran: quitar el parche DUROGESIC® y estimular al paciente física o verbalmente. A esas acciones le pueden seguir la administración de un antagonista opiáceo específico, como naloxona. Una depresión respiratoria por sobredosis puede superar la duración de la acción del antagonista opiáceo. El intervalo entre las dosis antagonistas intravenosas se debe elegir con cuidado debido a la posibilidad de renarcotización una vez que se haya eliminado el parche; puede ser necesaria la administración repetida o una infusión continua de naloxona. La inversión del efecto narcótico puede resultar en la aparición de corta duración de dolor y liberación de catecolaminas. Si la situación clínica lo requiere, se debe establecer y mantener una vía respiratoria patente, posiblemente con una vía orofaríngea o un tubo endotraqueal y se debe administrar el oxígeno y asistir o controlar la respiración, según sea necesario. Se debe mantener una temperatura corporal e ingesta de líquidos adecuados. Si ocurre una hipotensión grave o persistente, se debe considerar la hipocalemia y se debe controlar la afección con una terapia de fluidos parenterales apropiada. 14 PROPIEDADES FARMACOLÓGICAS Propiedades farmacodinámicas Grupo farmacoterapéutico: Analgésicos, opiáceos; fenilpiridina derivados de Código ATC: N02AB03 El fentanilo es un analgésico opiáceo, que interactúa predominantemente con el receptor opiáceo μ. Las acciones terapéuticas principales son la analgesia y sedación. Las concentraciones analgésicas en suero mínimas efectivas de fentanilo en pacientes sin uso previo de opiáceos oscilan entre 0,3 a 1,5 ng/ml; la frecuencia de los efectos secundarios aumentan en concentraciones en suero mayores a 2 ng/ml. Tanto las concentraciones mínimas efectivas y la concentración en que ocurre la toxicidad aumentan con el incremento de la tolerancia. El índice de desarrollo de tolerancia varía ampliamente entre los individuos. Propiedades farmacocinéticas Absorción DUROGESIC® proporciona una administración sistémica continua de fentanilo durante el período de aplicación de 72 horas. El fentanilo se libera en un índice relativamente constante. La gradiente de concentración que existe entre el sistema y la menor concentración en la piel dirige la liberación del medicamento. Tras la aplicación inicial de DUROGESIC ®, la concentración de fentanilo en suero aumenta en forma gradual y, generalmente, se estabiliza entre las 12 y las 24 horas y se mantiene relativamente constante por el resto del período de aplicación de 72 horas. La concentración de fentanilo en suero obtenida es proporcional al tamaño del parche DUROGESIC ®. Al final de la segunda aplicación de 72 horas, se logra una concentración en suero constante y se mantiene durante las aplicaciones subsecuentes de un parche del mismo tamaño. Un modelo farmacocinético indicó que la concentración en suero puede crecer un 14% (rango 0–26%) si se aplica un parche nuevo después de 24 horas en lugar de las 72 horas recomendadas. Distribución La unión a proteínas plasmáticas del fentanilo es de 84%. Metabolismo El fentanilo es un medicamento de alta eliminación, se metaboliza principalmente de forma rápida y extensiva por CYP3A4 en el hígado. El metabolito principal, norfentanilo, está inactivo. La piel no parece metabolizar el fentanilo administrado en forma transdérmica. Eso se determinó en un ensayo celular del queratinocito humano y en estudios clínicos en que el 92% de la dosis entregada por el sistema fue responsable por el fentanilo sin modificaciones que apareció en la circulación sistémica. Eliminación 15 Una vez retirado el DUROGESIC ®, la concentración de fentanilo en suero disminuyó en forma gradual a un 50% tras las 17 (rango de 13-22) horas posteriores a una aplicación de 24 horas. Tras una aplicación de 72 horas, la semivida media oscila entre 20–27 horas. La absorción continua de fentanilo por la piel es responsable de una desaparición más lenta del medicamento en suero, en comparación con la observada después de una infusión intravenosa, en que la semivida aparente es de aproximadamente 7 (rango 3–12) horas. Dentro de las 72 horas de administración de fentanilo intravenoso, aproximadamente el 75% de la dosis de fentanilo se excreta por la orina, principalmente como metabolitos, con menos del 10% como medicamento no modificado. Cerca del 9% de la dosis se recupera en las heces, principalmente como metabolitos. Poblaciones especiales Pacientes de edad avanzada: Los datos de un estudio intravenoso con fentanilo indican que los pacientes de edad avanzada pueden tener una eliminación reducida, una semivida prolongada y pueden ser más sensibles al medicamento que los pacientes más jóvenes. En un estudio realizado con DUROGESIC ®, sujetos sanos de edad avanzada recibieron farmacocinéticos de fentanilo que no difirieron considerablemente de sujetos sanos jóvenes, aunque el pico de concentración en suero tendió a ser menor y los valores de semivida se prolongaron a aproximadamente 34 horas. Los pacientes de edad avanzada deben ser observados cuidadosamente en caso de que aparezcan indicios de toxicidad por el fentanilo y, de ser necesario, se debe reducir la dosis (consulte Advertencias y precauciones especiales de empleo). Insuficiencia hepática: En un estudio realizado entre pacientes con cirrosis hepática, se evaluó la farmacocinética de una única aplicación de 50 mcg/h de DUROGESIC®. Aunque no se alteraron la tmáx y la t1/2, los valores medios de Cmáx en plasma y AUC aumentaron un 35% y 73%, respectivamente, en esos pacientes. Los pacientes con insuficiencia hepática deben ser observados cuidadosamente en caso de que aparezcan indicios de toxicidad por el fentanilo y, de ser necesario, se debe reducir la dosis de DUROGESIC® (consulte Advertencias y precauciones especiales de empleo). Insuficiencia renal: La información obtenida de un estudio en que se administró fentanilo intravenoso en pacientes que se sometían a un trasplante de riñón indicó que la eliminación de fentanilo se puede reducir en esa población. Si los pacientes con insuficiencia renal reciben DUROGESIC®, deben ser cuidadosamente observados por si aparecen indicios de toxicidad por fentanilo y, de ser necesario, se deberá reducir la dosis (consulte Advertencias y precauciones especiales para el uso). Datos preclínicos sobre seguridad Carcinogénesis y mutagenicidad El fentanilo in vitro mostró, como otros analgésicos opiáceos, efectos mutagénicos en un ensayo de cultivos celulares de mamíferos, solo en concentraciones citotóxicas y junto con activación metabólica. El fentanilo no mostró indicios de mutagenicidad 16 cuando se evaluó en estudios in vivo en roedores y en ensayos bacterianos. En un estudio de carcinogénesis realizado en ratas de dos años de duración, el fentanilo no se asoció con un aumento en la incidencia de tumores en dosis subcutáneas de hasta 33 μg/kg/día en machos o 100 μg/kg/día en hembras (0,16 y 0,39 veces la exposición diaria obtenida mediante parches de 100 mcg/h con base a una comparación de AUC0-24h). Fertilidad Algunas pruebas en ratas hembras mostraron una reducción de la fertilidad y mortalidad de embriones. Esos descubrimientos estuvieron relacionados con la toxicidad materna y no con un efecto directo del fármaco sobre el embrión en desarrollo. No hubo indicios de efectos teratogénicos. INFORMACIÓN FARMACÉUTICA Lista de excipientes Capa de refuerzo: Poliéster*/EVA** Capa de medicamento: Adhesivo de poliacrilato Revestimiento protector: Poliéster siliconado Tintas (en la capa de refuerzo): Tinta de impresión anaranjada/roja/verde/azul/gris * Poliéster = tereftalato de polietileno ** EVA = Etil vinil acetato Incompatibilidades Se desconocen. Período de validez Observe la fecha de caducidad en el embalaje exterior. Precauciones especiales de conservación Almacenar en el envoltorio original sin abrir y a menos de 30° C. Mantener fuera de la vista y del alcance de los niños. Naturaleza y contenido del envase Cada parche de DUROGESIC ® está empaquetado en un envase termosellado y se proporciona en envases de 5 parches. Instrucciones de uso, manipulación y desecho DUROGESIC® se debe aplicar sobre piel no irritada y no irradiada, en una superficie plana del torso o de la parte superior del brazo. Se debe cortar (no afeitar) el pelo existente en la zona de aplicación (preferentemente un área sin vello) antes de la aplicación. Si el sitio de aplicación de DUROGESIC ® debe ser limpiado antes de aplicar el parche, se debe hacer con agua limpia. No se deben usar jabón, aceite, lociones ni cualquier otro agente que pueda irritar la piel o alterar sus características. La piel debe estar completamente seca antes de aplicar el parche. Se debe inspeccionar el parche antes de usarlo. No se deben usar parches que estén cortados, divididos o dañados en cualquier forma. DUROGESIC® se debe aplicar inmediatamente después de extraerlo del envase cerrado. Para remover la capa protectora, coloque el corte protector (que se indica con 17 una flecha en la etiqueta del parche) sobre el borde del sello. Doble el parche sobre el corte, luego rompa con cuidado el material del envase. Siga abriendo el envoltorio de ambos lados, doblando su apertura como un libro. El revestimiento de liberación del parche está cortado. Doble el parche por la mitad y quite cada mitad del revestimiento por separado. Evite tocar el lado adhesivo del parche. Aplique el parche a la piel presionando suavemente con la palma de la mano durante unos 30 segundos. Asegúrese que los bordes del parche se adhieran apropiadamente. Luego lávese las manos con agua limpia. DUROGESIC ® se puede usar continuamente durante 72 horas. Se debe aplicar un nuevo parche en un área diferente de la piel después de remover el parche transdérmico previo. Deberán pasar varios días antes de que se aplique un nuevo parche en la misma área. Los parches utilizados se deben doblar de manera tal que el lado adhesivo se adhiera a sí mismo y luego se deben descartar. Los parches sin usar deben devolverse a la farmacia (del hospital). Lávese las manos, solo con agua, después de aplicar o remover el parche. Ante la eventualidad de una sobredosificación, concurrir al hospital más cercano o comunicarse con los Centros de Toxicología: Ante la eventualidad de una sobredosificación recurrir al Centro Nacional de Toxicología del Centro de Emergencias Médicas del M.S.P. y B.S. – Av. Gral. Máximo Santos entre Herminio Giménez y Teodoro S. Mongelós – Teléfonos: (021)220-418; (021)204-800(interno 1011). Importado y Distribuido por VICENTE SCAVONE & CIA., Pastora Céspedes y Don Vicente Scavone, San Lorenzo, Paraguay. Director Técnico: María Belén Vega M. Química Farmacéutica. Reg. Nº 5051. Venta bajo receta cuadruplicada Registro Sanitario Nº: 17062-01-EF (25 mg), 17468-01-EF (50 mg) Centro de Atención al Cliente: Por correo electrónico: infojanssen@janar.jnj.com Por teléfono: Paraguay: 00980 0521 0040 FABRICADO POR Consulte el embalaje exterior. FECHA DE REVISIÓN: 27 de mayo de 2016 18