Archivos Médicos de Actualización en
Anuncio
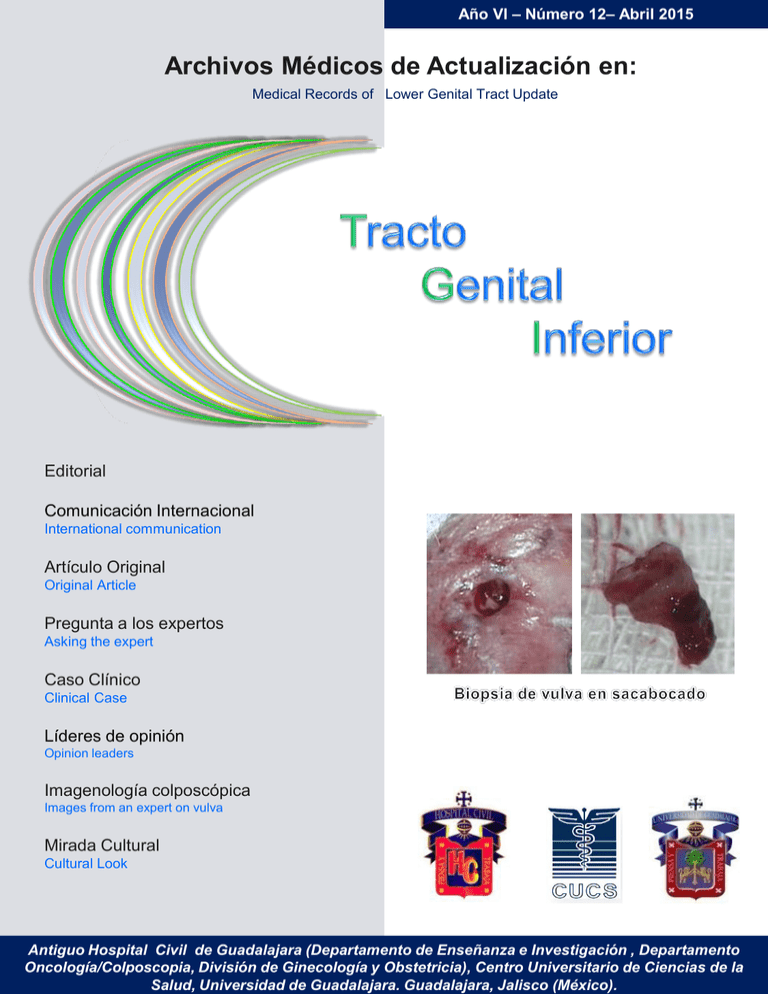
Año VI – Número 12– Abril 2015 Archivos Médicos de Actualización en: Medical Records of Lower Genital Tract Update Editorial Comunicación Internacional International communication Artículo Original Original Article Pregunta a los expertos Asking the expert Caso Clínico Clinical Case Líderes de opinión Opinion leaders Imagenología colposcópica Images from an expert on vulva Mirada Cultural Cultural Look Antiguo Hospital Civil de Guadalajara (Departamento de Enseñanza e Investigación , Departamento Oncología/Colposcopia, División de Ginecología y Obstetricia), Centro Universitario de Ciencias de la Salud, Universidad de Guadalajara. Guadalajara, Jalisco (México). Definición La Revista “Archivos Médicos de Actualización en Tracto Genital Inferior, es una publicación médica científica en formato electrónico, que difunde información actualizada y consistente mediante la interconexión globalizada con instituciones, profesores expertos e investigaciones analizadas y de vanguardia, cuya dinámica profesional gira en torno al Tracto Genital Inferior (TGI) Objetivos: Difundir conocimiento médico especializado, sólido y de actualidad oportuna. Generar y vincular redes que filtren ideas e hipótesis científicas, favoreciendo una fluida gama en líneas de análisis e investigación en torno al TGI. Interacción entre los lectores y profesores participantes. Ofrecer un foro abierto a los colegas interesados en publicar sus investigaciones en TGI. Cobertura temática: Ciencias de la Salud en Ginecología relacionadas con el estudio del Tracto Genital Inferior e interdisciplinas. Cobertura pública: Revista de difusión local, nacional y mundial a través de las siguientes páginas web: Hospital Civil de Guadalajara: Fray Antonio Alcalde (HCGFAA) (http://www.hcg.udg.mx/) http://www.hcg.udg.mx/PAGs/seccionMenu_4.php?opcSubM4=3 * Centro Universitario de Ciencias de la Salud de la Universidad de Guadalajara (http://www.cucs.udg.mx/) http://www.hcg.udg.mx/PAGs/seccionMenu_4.php?opcSubM4=3 Servicio de Ginecología del HCGFAA (http://frayantonioalcalde.blogspot.com) Universidad Nacional Autónoma de México: Latindex (http//www.latindex.unam.mx) Revistas Biomédicas Latinoamericanas: Imbiomed http//www.imbiomed.com.mx Medigraphic www.medigraphic.com La revista se dirige a: Profesionales de la salud con enseñanza superior: de pregrado y posgrado. Archivos Médicos de Atualización en Tracto Genital Inferior, Año VI, No. 12 Abril 2015, es una publicación semestral editada en formato electrónico en el Antiguo Hospital Civil de Guadalajara, Fray Antonio Alcalde a través del Departamento de Enseñanza e Investigación, y del Centro Universitario de Ciencias de la Salud (CUCS), de la Universidad de Guadalajara. Calle Hospital # 278, Col. El Retiro, Sector Hidalgo, C.P. 44280,Tel. (33) 39-42-44-00, directo (33) 36 42 49 77 y (33) 36 40 14 82, http://www.hcg.udg.mx, Link revista: http://www.hcg.udg.mx/Sec_Inicio/Rev_Oncologia/RevOncologia; http://frayantonioalcalde.blogspot.com/. Correspondencia: amatgi@hcg.gob.mx y mlaguilar@hcg.gob.mx Editor responsable: Hospital Civil de Guadalajara. Solicitud de la reserva de derechos al uso exclusivo (derechos de autor) (SEP) núm. 04-2009062514572200-01 ID 14599 Número de certificado de licitud de título, aprobado: No. 04-2009-062514572200-0. ISSSN en proceso. La revista: “Archivos Médicos de Actualización en Tracto Genital Inferior”, es una publicación semestral en la especie de difusión vía computo, de distribución gratuita. The journal "Medical Records Update in Lower Genital Tract", is published twice a year in the kind of computing via diffusion of free distribution. Archivos Médicos de Actualización en Tracto Genital Inferior Año VI, No. 12, Abril 2015 Hospital Civil de Guadalajara, Centro Universitario de Ciencias de la Salud (CUCS), Universidad de Guadalajara, Guadalajara, Jal. México CONTENIDO SECCIÓN 1. DIRECTORIO 2. EDITORIAL José Rogelio González Ramírez Benfield 3. COMUNICACIÓN INTERNACIONAL La detección de NIC 3 y el cáncer del cuello uterino: pruebas primarias VPH Diane M Harper. Luz Fernandez 4. PREGUNTANDO A LOS EXPERTOS Qué hacer primero?: la prueba citológica o la de VPH Patricia Alonso de Ruiz, José Antonio Ruiz Moreno 5. ARTÍCULO ORIGINAL Resultados de un programa de detección de cáncer cervico uterino con la prueba de PCR, para identificar a los virus de papiloma humano de alto riesgo más frecuentes y su correlación con la citología tradicional y la colposcopia. Oscar Augusto Trejo Solórzano, José Luis López Velásquez, María del Carmen García Martínez, José Adrian Tolentino López, Silvia Priscila Vásquez Castellanos, José Manuel Solórzano Camacho, Gabriela Cabrera Lopez, Brenda Valeria Gabilondo Acevedo, Fernando de La Torre Rendón 6. LÍDERES DE OPINIÓN La Colposcopia en la Actualidad Santiago Dexeus, Damián Dexeus 7. CASO CLÍNICO Liquen escleroso vulvar y atrofia genital comunicación de un caso y revisión de la literatura. Hugo Briseño Hanon, Martha Leticia Gómez Martínez, Guillermo Solís Ledesma, Susana Elizabeth de la Torre Flores 8. IMAGENOLOGÍA COLPOSCÓPICA DE UN EXPERTO Hallazgos colposcópicos de microinvasión e Invasión en el cuello uterino Alexander Mortakis 9. BIBLIOGRAFIA NACIONAL 2014 - 2015 10. MIRADA CULTURAL. Aparición histórica del Virus de Papiloma Humano María de Lourdes Aguilar 11. NORMAS PARA AUTORES 12. NUEVA PUBLICACIÓN EN COLPOSCOPIA y PATOLOGÍA DEL TRACTO ANOGENITAL. COLPOSCOPIA, cómo y cuándo realizarla. Editorial Cuéllar Ayala 13. EVENTOS ACADÉMICOS EN GUADALAJARA-2015 La revista: “Archivos Médicos de Actualización en Tracto Genital Inferior”, es una publicación semestral en la especie de difusión vía computo, de distribución gratuita.The journal "Medical Records Update in Lower Genital Tract", is published twice a year in the kind of computing via diffusion of free distribution. Archivos Médicos de Actualización en Tracto Genital Inferior Año VI, No. 12, Abril 2015 SECCIÓN 1 Hospital Civil de Guadalajara, Fray Antonio Alcalde, Centro Universitario de Ciencias de la Salud CUCS), Universidad de Guadalajara, Jal. México. DIRECTORIO PROFESORES PARTICIPANTES Y CONSULTADOS Dra Diane M. Harper……………………….……..Louiseville, EUA Dr. Alexander Mortakis (USA)……………………Atenas, Grecia UNIVERSIDAD DE GUADALAJARA Mtro. Itzcóatl Tonatiuh Bravo Padilla Rector General, Universidad de Guadalajara (U de G) Dr. Dr. Jaime Federico Andrade Villanueva Rector del Centro Universitario de Ciencias de la Salud Dr. Santiago Dexeus………………………….Barcelona (España) Dr. Damián Dexeus………………………...…Barcelona (España) Dra. Patricia Alonso de Ruiz…….....................México, DF (Méx) Dr. José Antonio Ruiz Moreno…………..........México, DF (Méx) Dr. Oscar Augusto Trejo Solorzano……….…México, DF (Méx) Dr. Hugo Briseño Hanon.. …………...…Zapopan, Jalisco (Méx) HOSPITAL CIVIL de GUADALAJARA, Fray Antonio Alcalde (HCGFAA) Dr. José Rogelio González Ramírez...…Guadalajara, Jal. (Méx) Dr. Héctor Raul Pérez Gómez Director General: OPD Hospitales Civiles de GDL Dr. Benjamín Becerra Rodríguez Director Médico Hospital Civil de Guadalajara, Fray Antonio Alcalde (HCGFAA) M.S.P. Víctor Manuel Ramírez Anguiano Subdirector General de Enseñanza e Investigación, Hospitales Civiles Dra. Claudia Margarita Asencio Tene Subdirector: Enseñanza e Investigación, HCGFAA Dr. José Enrique Cabrales Vázquez Jefe de Servicio: Oncología, HCGFAA Dr. Francisco Alfaro Baeza Jefe de División: Ginecología y Obstetricia: HCGFAA Dr. Roberto Larios Casillas Responsable: Sección Pelvis: Servicio Oncología, HCGFAA Dra. María de Lourdes Aguilar Garay Responsable: Clínica de Colposcopia en el Servicio de Oncología, HCGFAA Dr. José Pedro Chávez Chávez Responsable: Clínica de Colposcopia: del Instituto Jalisciense de Cancerología, Secretaria de Salud en Jalisco (IJC) Mtra. Verónica A Barrios Villalobos Jefe de departamento de vinculación y extensión, adscrita a la subdirección general de enseñanza e investigación. HCFAA CONSEJO EDITORIAL Dra. Maria de Lourdes Aguilar Garay....Guadalajara, Jal. (Méx) Dr. José Enrique Cabrales Vázquez Jefe: Servicio Oncología, HCGFAA Dr. Francisco Alfaro Baeza Jefe de División: Ginecología y Obstetricia, HCGFAA Dr. Gabino de Jesús Vaca Carbajal Jefe, Servicio Ginecología HCGFAA Dr. Arnoldo Guzmán Martínez Jefe, Servicio Obstetricia, HCGFAA Dra. Ma. de la Merced Ayala Castellanos Responsable de la Unidad de Colposcopia, Servicio de Ginecología, HCGFAA Dr. Roberto Larios Casillas Responsable: Sección Pelvis/Oncología/HCGFAA Dr. José Pedro Chávez Chávez Responsable de La Unidad de Colposcopia en el Instituto Jalisciense de Cancerologia de La Secretaria de Salud em Jalisco. Profesor Titular em el diplomado de colposcopia de La U de G Dra. Maria de Lourdes Aguilar Garay Responsable Sección Colposcopia, Servicio de Oncologia HCGFAA y colaborador adjunto en el diplomado de colposcopia de la U de G. EDITOR FUNDADOR Dra. Ma. de Lourdes Aguilar Garay COORDINACIÓN CIENTÍFICA Dra. Ma. De Lourdes Aguilar Garay Dr. José Pedro Chávez Chávez REVISIÓN, TRADUCCION, ACABADO, DIFUSION Dra. Ma. De Lourdes Aguilar Garay (HCGFAA) Dr. José Pedro Chávez Chávez (IJC) Dr. Alejandro Acosta Aguilar (Hospital Juan I. Menchaca). Mtro. Alfredo Cedano Rodríguez Jefe de Unidad de Tecnología para la Enseñanza e Investigación. Subdirección general de Enseñanza e Investigación: HCGFAA Ma. Elena Calzada Torres Asistente de difusión La revista: “Archivos Médicos de Actualización en Tracto Genital Inferior”, es una publicación semestral en la especie de difusión vía computo, de distribución gratuita. The journal "Medical Records Update in Lower Genital Tract", is published twice a year in the kind of computing via diffusion of free distribution. Archivos Médicos de Actualización en Tracto Genital Inferior Año VI, No. 12, Abril 2015 SECCIÓN 2 Hospital Civil de Guadalajara, Fray Antonio Alcalde, Centro Universitario de Ciencias de la Salud CUCS), Universidad de Guadalajara, Jal. México. Gonzalez Ramirez Benfield Editorial CÁNCER CERVICO-UTERINO, VIRUS DEL PAPILOMA HUMANO Y LA EPIGENÉTICA Se conoce ampliamente la relación del VPH con la carcinogénesis cervicouterina, esto por medio de las proteínas virales E5, E6 y E7, las cuales condicionan una disfunción de las proteínas p53 y Rb, confiriendo una evasión de la muerte celular y permitiendo la proliferación de células displásicas a neoplásicas en el cuello uterino. Estos descubrimientos han permitido conocer ampliamente la biología de la carcinogénesis de esta neoplasia, pero no han implicado formalmente un avance en el desarrollo de estrategias de prevención o tratamiento del cáncer. Pero paralelamente las proteínas E5, E6 y E7, llevan a una sobre expresión inflamatoria en el sitio de la infección mediando por prostaglandinas, COX-1 y COX2, lo cual es sabido que COX-2 es un inductor de factores de crecimiento y proliferación celular, atribuyéndole un factor importante en el desarrollo del cáncer. Lo anterior en estudios fase II con Rofecoxib y Celecoxib, han demostrado ser una prometedora medida quimiopreventiva en pacientes con neoplasia intraepitelial 2 y3, sin ser considerados aún una terapéutica estándar. Lo cual orienta al desarrollo de futuras estrategias de prevención de la neoplasia por medio del conocimiento de su epigenética. 1 Dr. José Rogelio González Ramírez Benfield Médico Internista y Oncólogo Médico Certificado por el Consejo Mexicano de Oncología Adscrito al Servicio de Oncología del Hospital Civil Fray Antonio Alcalde Profesor Titular de la Especialidad en Oncología Médica. rogelio.glez_md@hotmail.com La revista: “Archivos Médicos de Actualización en Tracto Genital Inferior”, es una publicación semestral en la especie de difusión vía computo, de distribución gratuita. The journal "Medical Records Update in Lower Genital Tract", is published twice a year in the kind of computing via diffusion of free distribution. Archivos Médicos de Actualización en Tracto Genital Inferior Año VI, No. 12, Abril 2015 SECCIÓN 3 Hospital Civil de Guadalajara, Centro Universitario de Ciencias de la Salud (CUCS), Universidad de Guadalajara, Guadalajara, Jal. México Harper, Fernández Comunicación Internacional LA DETECCIÓN DE NIC 3 Y EL CÁNCER DEL CUELLO UTERINO: PRUEBAS PRIMARIAS VPH Diane M Harper MD MPH MS*. Luz Fernández, MD** *Profesor en la Facultad de Medicina de la Universidad de Louisville, EUA. 1 ** Asistente de Profesor en la Facultad de Medicina de la Universidad de Louisville, EUA. Correspondencia: Diane M Harper MD MPH MS, University of Louisville. Louisville, KY 40202 EUA. 502-852-3320 office. diane.m.harper@Gmail.com Con el tiempo, el tamizaje de Papanicolaou ha reducido la incidencia de cáncer de cuello uterino 50-100 / 100.000 [1, 2] en áreas sin programas de diagnóstico, hasta un mínimo de 3 / 100.000 en Finlandia [3] donde el cribado organizado se inició por primera vez en 1953. Entre 1990 y 2003, Finlandia vio aumentada su incidencia de cáncer de cuello uterino a 4,4 / 100.000 [4] debido a la disminución de la participación de cribado entre las jóvenes de 25 a 35 años; haciendo hincapié en la importancia de la participación continua para el tamizaje. La menor incidencia de cáncer que la citología ha podido lograr ha sido de 2-3 / 100 000 [5], sin una estrategia de detección capaz de detectar todos los casos de neoplasia intraepitelial cervical de grado 3 (NIC 3) o cánceres de cuello uterino. Aquellos países en los que se aplica un programa de detección de cáncer de cuello de útero oportuno u organizado han revisado los objetivos de su población para detectar al precursor del cáncer, NIC 3, y el adenocarcinoma in situ (AIS), además de cáncer de cuello uterino [6]. Actualmente, los estudios de detección declaran NIC 3 como el punto final de detección primaria, ya que es poco ético permitir que las mujeres continúen en un estudio hasta que desarrollen cáncer de cuello uterino. La baja incidencia de AIS requiere muy grandes poblaciones para evaluar las estrategias específicas de detección para su detección, lo que no siempre es posible; por lo tanto, la detección de AIS se observa como parte de NIC 3 o peor (NIC 3+). El Virus de papiloma humano (VPH) es una causa necesaria, pero no suficiente, del cáncer cervical [7]. 70% de las infecciones por VPH se resuelven dentro de un año; 90% se resuelven Archivos Médicos de Actualización en Tracto Genital Inferior Año VI, No. 12, Abril 2015 SECCIÓN 3 Hospital Civil de Guadalajara, Centro Universitario de Ciencias de la Salud (CUCS), Universidad de Guadalajara, Guadalajara, Jal. México Harper, Fernández en alrededor tres años, dejando 5% como infecciones persistentes, y el 5% que el progreso a una lesión intraepitelial cervical de grado 2/3 (NIC 2/3) [8]. Las infecciones persistentes por VPH 16 y 18 progresan más rápidamente a NIC 3 que otros tipos de VPH de alto riesgo, alcanzando una tasa de incidencia acumulada (TIA) de entre 15-20% a diez años, en comparación con el menos del 1% de de todos los otros tipos de VPH de alto riesgo [ 9]. De esas verdaderas lesiones NIC 3, sólo el 20% progresarán a cáncer cervical invasivo en 5 años, y sólo el 40% avanzan a cáncer invasivo en los siguientes 30 años [10]. Existen tres vacunas profilácticas contra el VPH aprobadas: Cervarix®, Gardasil® y Gardasil9®. Cervarix tiene el índice más alto de protección frente a NIC 3+ causada por cualquier tipo de VPH en el 93% [11], Gardasil y Gardasil9 son equivalentes en su 43% de protección contra un CIN 3 similar en su línea final [12, 13]. Suponiendo una cobertura del 100% y la eficacia de por vida, las mujeres jóvenes vacunadas decidirìan no participar en la detección del cáncer de cuello de útero, la incidencia de cáncer de cuello uterino se incrementaría, con el mayor aumento entre los que reciban la vacuna Gardasil. Si las mujeres vacunadas deciden participar en el cribado, la incidencia de cáncer de cuello uterino disminuirá un poco más allá de lo que el cribado puede alcanzar, pero nunca llegará a cero [14]. La eficacia de la detección del cáncer de cuello uterino comienza a los 25 años de edad, y es más eficaz entre los 30 y los 64 años [15]. El cribado reduce las posibilidades de cáncer en fase 1A o mayor en una mujer de 30 a 37 años de edad en un 43-60%; y para una mujer de 40-65 años de edad en un 64-82%. El cribado en mujeres menores de 25 años no funciona como protección ni eficaz. Menos del 2% de los cánceres de cuello uterino se desarrolla en mujeres de 20-25 años de edad, y múltiples cribados son incapaces de detectar el 75% de estos de cánceres [15]. Si bien se recomienda la vacunación contra el VPH a los 11-12 años de edad para una protección limitada en tiempo hasta que se inicie el cribado, no hay evidencia de la eficacia en la detección antes de los 25 años, a pesar de que muchos países, incluidos los EE.UU., continúan realizando tamizaje demasiado temprano. La interrupción de cribado en las mujeres de 65 a 70 años que han participado en los programas de cribado y han tenido 10 años sin anormalidades citológicas es una recomendación sin evidencia [16]. Las mujeres con una NIC previa siguen teniendo un mayor riesgo de cáncer anogenital que va de 3 a 12 veces mayor sobre la población en general, ocurriendo 10 a 20 años después de su diagnóstico de NIC inicial [17]. Aquellas mujeres cuya NIC fue diagnosticada a la edad de 40 años o más deben continuar con la detección de al menos otros 40 años, ya que su riesgo de cáncer cervical o vaginal seguirá aumentando con el tiempo [18]. El intervalo de la prueba depende de la tecnología de detección utilizada. El intervalo de cribado se define como el periodo de tiempo durante el cual la incidencia acumulada de CIN 2/3 no aumenta por encima de 5/1000 mujeres examinadas [19]. Uno de los ensayos de detección de VPH más tempranos mostró que las mujeres que dieron negativo para la Captura de Híbridos II para VPH de alto riesgo (VPHAR) no tuvieron un aumento en la incidencia acumulada de NIC 2/3 hasta la marca límite de cribado de seis años: mientras que aquellas que fueron sometidas a de detección con citología convencional cuyo resultado fue negativo, duplicaron la incidencia acumulada de NIC 2/3 a los 3 años [19]. Al considerar al cáncer cervical invasivo como el punto de resultado final, las mujeres con citología negativa mantuvieron una incidencia acumulada de cáncer de menos de 0,5 / 100.000 mujeres hasta los 3 años; y las mujeres con pruebas VPHAR negativa mantuvieron su incidencia acumulada de cáncer de 0,5 / 100.000 para 5 años [20]. Estos resultados le dieron forma a las guías de manejo para el cribado con citología de rutina cada 3 años si los resultados son normales, y cada 5 años para las pruebas VPHAR negativo. Existen varios ensayos controlados aleatorios longitudinales utilizando detección del VPH que se complementan entre sí mostrando resultados similares de Canadá, los Países Bajos, Reino Unido, Finlandia, Suecia, Italia, España, Alemania, Dinamarca y Francia [21,22, 23, 24, 25, 26 , 27,28,29,30,31], y ahora los EE.UU. [32]. El estudio de Estados Unidos fue el único completamente patrocinado por la industria, resultando en la aprobación de la FDA para la prueba del VPH primaria utilizando la plataforma de pruebas de Roche Cobas para VPH. Esta prueba utiliza células cervicales recogidas en solución PreservCyt® de la que se extrae el VPH y el ADN celular. Se realiza la amplificación por PCR de secuencias de ADN diana para HPV 16, HPV 18 y una prueba agregada para el VPH 31, 33, 35, 39, 2 Archivos Médicos de Actualización en Tracto Genital Inferior Año VI, No. 12, Abril 2015 SECCIÓN 3 Hospital Civil de Guadalajara, Centro Universitario de Ciencias de la Salud (CUCS), Universidad de Guadalajara, Guadalajara, Jal. México Harper, Fernández 45, 51, 52, 56, 58, 66 y 68, así como una betaglobina de control. El estudio ATHENA con sede en EE.UU. eligiò al azar mujeres para cuatro diferentes brazos del estudio: la prueba del VPH primaria, la citología sola, y dos estrategias de co-detección de VPH y citología diferentes. Para las mujeres mayores de 25 años, la estrategia de la detección del VPH primario resultó en tres acciones posibles: si VPHAR fue negativo, se repitió una prueba VPHAR rutina en 5 años; si resultaba VPH 16/18 positiva, se realizaba una colposcopia; si el ensayo de 12 VPHAR era positivo, una prueba citológica de clasificación se produjo en la que si era negativo a células malignas (NILM), la citología se repetiría en un año, y si se detectó células escamosas atípicas de significado indeterminado (ASCUS) o peor, se realizo una colposcopia. La estrategia de cribado de citología resultó en dos acciones: si no había células sugestivas de malignidad, la citología se repitió en 3 años y si ASCUS +, se realizo una colposcopia. La primera estrategia de co-detecciòn fue estratificada por edad. Para las mujeres de 25-29 años, el tamizaje de la citología resultó en una de las tres acciones: si no había células sugestivas de malignidad, la citología se repitió en 3 años; si había lesión intraepitelial escamosa de bajo grado (LEIBG) o peor, se realizó una colposcopia; si habìa ASCUS, la clasificación de VPHAR dio lugar a una de dos acciones: si era negativo para VPHAR, la citología se repitió en 3 años; si era positivo, se realizaba la colposcopia. Para las mujeres de 30 años o más, la detecciòn inicial con citología resultó en una de tres acciones. Si no había células sugestivas de malignidad, la citología fue clasificada con genotipado del VPH 16/18 que dio lugar a una de dos acciones posibles: si era negativo, la citología se repitió en 3 años, y si es positivo, se realizó una colposcopia. Si la citología resultaba con LEIBG +, se realizó una colposcopia. Si la citología reportaba ASCUS, se realizaban pruebas de VPHAR lo que dio lugar a dos posibles acciones: si es negativo, la citología se repitió en 3 años, y si es positivo se realiza una colposcopia. La segunda estrategia de co-prueba fue idéntica a la primera estrategia de la prueba anterior para las mujeres de 30 años, excepto que esta estrategia también se aplicó a las mujeres mayores de 25 años y mayores, sin la estrategia independiente de los 25-29 años de edad. Las 40.944 mujeres en el ensayo ATHENA padecieron NIC 3+ durante los 3 años de seguimiento a una incidencia acumulada de casi el 25% de los VPH 16 positivo, de casi el 10% de los VPH 18 positivo, de casi el 5% para aquellos positivo para los agregados de los 12 VPHar tipos, y menos del 1% de los negativos para VPHar [Wright 2015], proporcionando evidencia primaria de la importancia del genotipado para VPH 16/18. Después de una ronda de cribado, la prueba negativa para VPHar empató con el resultado de la co-detecciòn de células negativas a malignidad en la citología y la prueba VPHar negativa para ser las pruebas más tranquilizadoras para asegurar que NIC 3+ no estaba presente (CIR 0,3; IC del 95%: 0,1, 0,7, 0,3 CIR, IC del 95%: 0,1, 0,6, respectivamente), seguido de un resultado de citología negativo a malignidad (CIR IC: 0,8 (95%: 0,5, 1,1). Todos tenían una incidencia acumulada incidencias en menos del 1% para NIC 3+. El resultado de cribado que detecta la más alta incidencia acumulada de NIC 3+ fue una prueba de genotipado VPHar 16/18 positivo (CIR 21,1, IC del 95%: 18,4, 24,0), seguido por una prueba de co-detección que resulta en ASCUS + y VPHar positivo (CIR 19.9, IC del 95%: 17,1, 22,7), y en un distante tercer lugar fue el resultado de la co-detección de una citología negativa y una prueba de genotipado del VPH 16/18 positivo (CIR 13,6; IC del 95%: 10,8, 16,9). La sensibilidad de la estrategia de detección primaria de VPH fue del 76%, la citología sola fue del 48%, co-detecciòn partir de los 30 años fue del 69%, y la co-detecciòn para los 25 años y mayores fue de 62%. Las especificidades respectivas eran 94%, 97%, 95% y 95%. La Tabla 1 muestra que la estrategia detecciòn primaria de VPH resultó en menor número de referencias a colposcopia, con muy alta detección de CIN 3, y en menor número de resultados falsos positivos. La Figura 1 muestra los beneficios de la detección de la enfermedad verdadera y los daños de los procedimientos adicionales o identificación errónea de la enfermedad, así como los costos de la cantidad de pruebas de detección. La figura 2 muestra la relación beneficio / daño por cada 10,000 mujeres con la resutante mejor estrategia de cribado que resulta ser la prueba del VPH primario. 3 Archivos Médicos de Actualización en Tracto Genital Inferior Año VI, No. 12, Abril 2015 SECCIÓN 3 Hospital Civil de Guadalajara, Centro Universitario de Ciencias de la Salud (CUCS), Universidad de Guadalajara, Guadalajara, Jal. México Harper, Fernández Tabla 1. La prueba del VPH obtuvo el menor número de referencias para colposcopia, con muy alta detección de N IC 3, y el menor número de resultados falsos positivos. Figura 1. Los beneficios de la detección de la enfermedad ocurren con los daños de los procedimientos adicionales o identificación errónea de la enfermedad, así como los costos de la cantidad de pruebas de detección. 4 Archivos Médicos de Actualización en Tracto Genital Inferior Año VI, No. 12, Abril 2015 SECCIÓN 3 Hospital Civil de Guadalajara, Centro Universitario de Ciencias de la Salud (CUCS), Universidad de Guadalajara, Guadalajara, Jal. México Harper, Fernández Figura 2. Relación beneficio / daño por cada 10.000 mujeres con la mejor estrategia de cribado que resulta ser la prueba del VPH primaria. Figura 3. En mujeres positivas para VPH 16/18 el riesgo de NIC 3+, mostró un patrón similar de declive. 5 Archivos Médicos de Actualización en Tracto Genital Inferior Año VI, No. 12, Abril 2015 SECCIÓN 3 Hospital Civil de Guadalajara, Centro Universitario de Ciencias de la Salud (CUCS), Universidad de Guadalajara, Guadalajara, Jal. México Harper, Fernández El estudio de la prueba de VPH primario de Reino Unido continuó durante tres rondas de cribado después de seis años y claramente mostró que el NIC 3 prevalente se detectó en la primera vuelta de selección; en la ronda 2, el doble de nuevas infecciones 16/18 fueron los responsables de las NIC 3 como infecciones persistentes; y en la ronda 3, más de cuatro veces el número de nuevas infecciones 16/18 fueron los causantes de NIC 3 como restantes infecciones persistentes indetectadas [23]. La detección inicial de la enfermedad prevalente seguido por la detección de proporciones cada vez mayores de la incidencia de la enfermedad son las maneras más óptimas en las que una prueba de detección podría funcionar. SWEDESCAN continuó durante 14 años a través de cuatro rondas de cribado [24]. El riesgo de NIC 3+ para mujeres positivas de VPH 16/18 mostró un patrón similar de declive. La mayor prevalencia de NIC 3+ se detectó en la primera ronda de cribado, con una disminución del riesgo similar de NIC 3+ en la segunda y tercera rondas de cribado y una reducción a la mitad del riesgo de NIC 3+ a por la cuarta ronda de cribado [Figura 3] El riesgo de NIC 3+ entre las mujeres VPH 16/18 positivas nunca desaparece, pero disminuye considerablemente con el tiempo, lo que indica la detección de nuevas infecciones persistentes 16/18 que se convierten en lesiones NIC 3+. En resumen, la prueba del VPH primario es la prueba de detección más adecuada biológicamente para el cáncer de cuello uterino en mujeres de 25 años y más. Conduce a la mayor detección de enfermedades prevalentes en la prueba inicial y la enfermedad incidente en las pruebas posteriores de cualquier modalidad de detección hasta la fecha. Comunicación original Screening for CIN 3 and Cervical Cancer: Primary HPV Testing Over time, the Papanicolaou screen has reduced the incidence of cervical cancer from 50100/100,000 [1, 2] in areas with no screening, to as low as 3/100,000 in Finland [3] where organized screening was first started in 1953. Between 1990 and 2003, Finland saw its incidence of cervical cancer increase to 4.4/100,000 [4] due to the decrease in screening participation among the 25-35 year olds; emphasizing the importance of continued screening participation. The lowest incidence of cancer that cytology screening can accomplish has been 2-3/100,000 [5], with no screening strategy able to detect all cervical intraepithelial neoplasia grade 3 (CIN 3) or cervical cancers. Countries in which an opportunistic or organized cervical cancer screening program exists have revised their population goals to screen for the cancer precursor, CIN 3, and adenocarcinoma in situ (AIS), in addition to cervical cancer [6]. Currently, screening studies declare CIN 3 as the primary detection endpoint as it is unethical to allow women to continue in a study until they develop cervical cancer. The low incidence of AIS requires very large populations to evaluate specific screening strategies for its detection which is not always possible; hence AIS detection is noted as a part of CIN 3 or worse (CIN 3+). Human papillomavirus (HPV) is a necessary, but not sufficient, cause of cervical cancer [7]. 70% of HPV infections clear within one year; 90% clear within three years, leaving 5% as persistent infections, and 5% that progress to a cervical intraepithelial grade 2/3 (CIN 2/3) change [8]. Persistent HPV 16 and 18 infections progress more quickly to CIN 3 than other high risk HPV types, reaching a cumulative incidence rate (CIR) between 15-20% at ten years, compared to less than 1% for all other high risk HPV types [9]. Of those true CIN 3 lesions, only 20% progress to invasive cervical cancer in 5 years, and only 40% progress to invasive cancer within 30 years [10]. There are three prophylactic HPV vaccines approved: Cervarix®, Gardasil® and Gardasil9®. Cervarix has the highest rate of protection against CIN 3+ caused by any HPV type at 93% [11], Gardasil and Gardasil9 are equivalent at 43% protection against a similar CIN 3 endpoint [12, 13]. Assuming 100% coverage and lifetime efficacy, should young vaccinated women choose not to participate in cervical cancer screening, the incidence of cervical cancer will increase, with the highest increase occurring among those receiving a Gardasil product. Should vaccinated women choose to participate in screening, the incidence of cervical cancer will decrease a small amount beyond 6 Archivos Médicos de Actualización en Tracto Genital Inferior Año VI, No. 12, Abril 2015 SECCIÓN 3 Hospital Civil de Guadalajara, Centro Universitario de Ciencias de la Salud (CUCS), Universidad de Guadalajara, Guadalajara, Jal. México Harper, Fernández that which screening can attain, but never reach zero [14]. The effectiveness of cervical cancer screening starts at 25 years of age, and is most effective between 30 and 64 years [15]. Screening reduces the chances of stage 1A or greater cervical cancer in a woman 30-37 years old by 43-60%; and for a woman 40-65 years old by 64-82%. Screening women younger than 25 years is neither protective, nor effective. Less than 2% of cervical cancers develop in women 20-25 years old, and multiple screenings are unable to detect 75% of these cancers [15]. While HPV vaccination is recommended at 11-12 years of age for time limited protection until screening starts, there is no evidence for screening efficacy before 25 years, despite many countries, including the US, who continue to screen too early. Discontinuing screening in those 65-70 years among those who have participated in screening and have had 10 years of no cytological abnormalities is recommended without evidence [16]. Women with a past CIN abnormality continue to have an increased risk of anogenital cancers ranging from 3 to 12 fold increased risk over the general population occurring 1020 years after their initial CIN diagnosis [17]. Those women whose CIN was diagnosed at the age of 40 years or older must continue with screening for at least another 40 years, as their risk of cervical or vaginal cancer continues to increase with time [18]. The screening interval depends on the screening technology used. The screening interval is defined as that period of time for which the cumulative incidence of CIN 2/3 does not increase above 5/1000 screened women [19]. One of the earliest HPV screening trials showed that women who tested negative for the Hybrid Capture II High Risk HPV (HRHPV) test did not have an increase in cumulative incidence of CIN 2/3 until the six year screen mark, whereas those screened with conventional cytology whose result was negative had a doubling of the cumulative CIN 2/3 incidence at 3 years [19]. When using invasive cervical cancer as the outcome endpoint, women with negative cytology maintained a cumulative cancer incidence of less than 0.5/100,000 women through 3 years; and women with negative HRHPV testing maintained their cumulative cancer incidence of 0.5/100,000 for 5 years [20]. These results shaped the screening guidelines for routine cytology screening every 3 years if results are normal, and every 5 years for negative HRHPV testing. There are several longitudinal randomized controlled trials using HPV screening that complement each other showing similar results from Canada, the Netherlands, UK, Finland, Sweden, Italy, Spain, Germany, Denmark and France [21,22, 23, 24, 25, 26,27,28,29,30,31], and now the US [32]. The US trial was the only study completely sponsored by industry resulting in FDA approval for primary HPV testing using the Roche Cobas HPV testing platform. This uses cervical cells collected in Preservcyt® solution from which to extract the HPV and cellular DNA. There is PCR amplification of target DNA sequences for HPV 16, HPV 18 and an aggregate test for HPV 31, 33, 35, 39, 45, 51, 52, 56, 58, 66 and 68, as well as a control beta-globin primer. The US based ATHENA study randomized women to four different study arms: primary HPV testing, cytology alone, and two different HPV and cytology co-testing strategies. For women 25 years and older, primary HPV testing strategy resulted in three possible actions: if HRHPV was negative, a routine HRHPV test in 5 years was repeated; if HPV 16/18 positive, a colposcopy occurred; if the 12 HRHPV assay was positive, a cytology triage test occurred where if NILM, the cytology would be repeated in one year, and if atypical squamous cells of undetermined significance (ASCUS) or worse was detected, a colposcopy occurred. The cytology screening strategy resulted in two actions: if NILM, the cytology was repeated in 3 years and if ASCUS+, a colposcopy occurred. The first co-testing strategy was age stratified. For women 25-29 years, the cytology screen resulted in one of three actions: if NILM, cytology was repeated in 3 years; if low grade squamous intraepithelial lesion (LSIL) or worse, a colposcopy was performed; if ASCUS, HRHPV triage resulted in one of two actions: if negative for HRHPV, cytology was repeated in 3 years; if positive, colposcopy was performed. For women 30 years or older, the initial cytology screen resulted in one of three actions. If NILM, the cytology was triaged with HPV 16/18 genotyping which resulted in one of two possible actions: if negative, cytology was repeated in 3 years, and if positive, a colposcopy was performed. If the cytology was LSIL+, a colposcopy was performed. If the cytology was ASCUS, HRHPV testing resulted in two possible actions: if negative, cytology was repeated in 3 years, and if positive a colposcopy was performed. The second co-testing strategy was identical to the first co-testing strategy above for women 30 years and older, except this strategy applied to women 25 years and older, without the separate 25-29 year old strategy. 7 Archivos Médicos de Actualización en Tracto Genital Inferior Año VI, No. 12, Abril 2015 SECCIÓN 3 Hospital Civil de Guadalajara, Centro Universitario de Ciencias de la Salud (CUCS), Universidad de Guadalajara, Guadalajara, Jal. México Harper, Fernández The 40,944 women in the ATHENA trial accrued CIN 3+ over the 3 years of follow up at a cumulative incidence of nearly 25% for those HPV 16 positive, of nearly 10% for those HPV 18 positive, of nearly 5% for those positive for the aggregate 12HRHPV types, and less than 1% for those negative for HRHPV [Wright 2015], providing primary evidence for the importance of HPV 16/18 genotyping. After one screening round, the negative HRHPV test tied with the co-test result of NILM cytology and negative HRHPV to be the most reassuring tests that CIN 3+ was not present (CIR 0.3, 95% CI: 0.1, 0.7; CIR 0.3, 95% CI: 0.1, 0.6, respectively), followed by a NILM cytology result (CIR 0.8 (95% CI: 0.5, 1.1). All had cumulative CIN 3+ incidences at less than 1%. The screening result that detected the highest cumulative incidence of CIN 3+ was a positive HRHPV 16/18 genotyping test (CIR 21.1, 95% CI: 18.4, 24.0), followed by co-testing resulting in ASCUS+ and HRHPV positive (CIR 19.9, 95% CI: 17.1, 22.7), and a distant third was the co-testing result of a NILM cytology and positive HPV 16/18 genotyping test (CIR 13.6, 95% CI: 10.8, 16.9). The sensitivity of the primary HPV screening strategy was 76%, cytology alone was 48%, co-testing starting at 30 years was 69%, and the co-testing for the 25 years and older strategy was 62%. Respective specificities were 94%, 97%, 95% and 95%. Table 1 shows that the primary HPV testing strategy resulted in the fewest colposcopy referrals, with very high detection of CIN 3, and the least number of false positive test results. Figure 1 demonstrates the benefits of true disease detection with the harms of further procedures or misidentification of disease as well as the costs of the number of screening tests. Figure 2 demonstrates the benefit/harm ratio per 10,000 women with the resulting best screening strategy being primary HPV testing. The UK primary HPV testing study continued for three rounds of screening past six years and clearly showed that prevalent CIN 3 was detected in the first screening round; at round 2, twice as many new 16/18 infections were responsible for the CIN 3 as persistent infections; and at round 3, over four times as many new 16/18 infections were responsible for CIN3 as remaining undetected persistent infections [23]. The initial detection of prevalent disease followed by detection of increasingly higher proportions of incident disease is the most optimal manner a screening test could function. SWEDESCAN continued for 14 years through four screens [24]. The risk of CNI 3+ for HPV 16/18 positive women showed a similar pattern of decline. The most prevalent CIN 3+ was detected in the first screening round, with a similar decreased risk of CIN 3+ at the second and third screening rounds and a halving of the CIN 3+ risk by the fourth screening round [Figure 3] The risk of CIN 3+ among HPV 16/18 positive women never goes away, but substantially decreases over time, indicating detection of new persistent 16/18 infections that become CIN 3+ lesions. In summary, primary HPV testing is the most biologically appropriate test for cervical cancer in women 25 years and older. It leads to the greatest detection of prevalent disease at initial screen and incident disease at subsequent screens of any screening modality to date. REFERENCIAS BIBLIOGRÁFICAS 1. http://www.wcrf.org/int/cancer-facts-figures/data-specific-cancers/cervical-cancer-statistics 2. Arrossi S, Sankaranarayanan R, Parkin DM. Incidence and mortality of cervical cancer in Latin America. Salud Publica Mex 2003;45 suppl 3: S306-S314. March 16, 2015, Accessed at: http://www.scielosp.org/pdf/spm/v45s3/v45s3a04.pdf 3. www.cancerregistry.fi/tilastot 4. http://stats.cancerregistry.fi/stats/eng/veng0021i0.html 5. Sawaya GF, Grimes DA. New technologies in cervical cytology screening: a word of caution. Obstet Gynecol. 1999 Aug;94(2):307-10 6. Saslow D, Solomon D, Lawson HW, Killackey M, Kulasingam SL, Cain J, et al. American Cancer Society, American Society for Colposcopy and Cervical Pathology, and American Society for Clinical Pathology screening guidelines for the prevention and early detection of cervical cancer. CA Cancer J Clin 2012;62(3):147–72. 7. Walboomers JM, Jacobs MV, Manos MM, Bosch FX, Kummer JA, Shah KV, et al. Human papillomavirus is a necessary cause of invasive cervical cancer worldwide. J Pathol 1999;189(1):12–9 8 Archivos Médicos de Actualización en Tracto Genital Inferior Año VI, No. 12, Abril 2015 SECCIÓN 3 Hospital Civil de Guadalajara, Centro Universitario de Ciencias de la Salud (CUCS), Universidad de Guadalajara, Guadalajara, Jal. México Harper, Fernández 8. Schiffman M, Rodríguez AC. Heterogeneity in CIN3 diagnosis. Lancet Oncol. 2008 May;9(5):404-6. 9. Khan MJ, Castle PE, Lorincz AT, Wacholder S, Sherman M, Scott DR, Rush BB, Glass AG, Schiffman M. The elevated 10-year risk of cervical precancer and cancer in women with human papillomavirus (HPV) type 16 or 18 and the possible utility of type-specific HPV testing in clinical practice. J Natl Cancer Inst. 2005 Jul 20;97(14):1072-9. 10. McCredieMR, Sharples KJ, Paul C, Baranyai J, Medley G, Jones RW, Skegg DC. Natural history of cervical neoplasia and risk of invasive cancer in women with cervical intraepithelial neoplasia 3: a retrospective cohort study. Lancet Oncol. 2008 May;9(5):425-34. 11. Lehtinen M, Paavonen J, Wheeler CM, et al. Overall efficacy of HPV-16/18 AS04-adjuvanted vaccine against grade 3 or greater cervical intraepithelial neoplasia: 4-year end-of-study analysis of the randomised, double-blind PATRICIA trial. Lancet Oncol. 2012 Jan;13(1):89-99. doi: 10.1016/S1470-2045(11)70286-8. 12. Joura EA, Giuliano AR, Iversen O-E, et al. A 9-Valent HPV vaccine against infection and intraepithelial neoplasia in women. N Eng J Med 2015; 372:711-723. 13. Munoz N, Kjaer SK, SigurdssonK, et al. Impact of human papillomavirus (HPV)-6/11/16/18 vaccine on all HPV-associated genital diseases in young women. J Natl Cancer Inst. 2010 Mar 3;102(5):325-39. 14. Castle PE, Solomon D, Saslow D, Schiffman M. Predicting the effect of successful human papillomavirus vaccination on existing cervical cancer prevention programs in the United States. Cancer. 2008 Nov 15;113(10 Suppl):3031-5 15. Sasieni P, Castanon A, Cuzick J. Effectiveness of cervical screening with age: population based case-control study of prospectively recorded data. BMJ 2009;339:b2968 16. American Geriatrics Society. Screening for cervical cancer in older women. J Am Geriatr Soc. 2001;49:655– 657. 17. Kalliala I, Anttila A, Pukkala E, Nieminen P. Risk of cervical and other cancers after treatment of cervical intraepithelial neoplasia: retrospective cohort study. BMJ. 2005 Nov 19;331(7526):1183-5. 18. Strander B, Hällgren J, Sparén P. Effect of ageing on cervical or vaginal cancer in Swedish women previously treated for cervical intraepithelial neoplasia grade 3: population based cohort study of long term incidence and mortality. BMJ. 2014 Jan 14;348:f7361. 19. Cuzick J, Szarewski A, Mesher D, Cadman L, Austin J, Perryman K, Ho L, Terry G, Sasieni P, Dina R, Soutter WP. L ongterm follow-up of cervical abnormalities among women screened by HPV testing and cytology-Results from the Hammersmith study. Int J Cancer. 2008 May 15;122(10):2294-300. 20. ] Ronco G, Dillner J, Elfström KM, Tunesi S, Snijders PJ, Arbyn M, et al. Efficacy of HPV based screening for prevention of invasive cervical cancer: follow-up of four European randomised controlled trials. Lancet 2014;383(9916):524–32. 21. Mayrand MH, Duarte-Franco E, Rodrigues I, Walter SD, Hanley J, Ferenczy A, Ratnam S, Coutlée F, Franco EL; Canadian Cervical Cancer Screening Trial Study Group. Human papillomavirus DNA versus Papanicolaou screening tests for cervical cancer. N Engl J Med. 2007 Oct 18;357(16):1579-88. 22. Anttila A, Kotaniemi-Talonen L, Leinonen M, Hakama M, Laurila P, Tarkkanen J, Malila N, Nieminen P. Rate of cervical cancer, severe intraepithelial neoplasia, and adenocarcinoma in situ in primary HPV DNA screening with cytology triage: randomised study within organised screening programme. BMJ. 2010 Apr 27;340:c1804. 23. Kitchener HC, Gilham C, Sargent A, Bailey A, Albrow R, Roberts C, Desai M, Mather J, Turner A, Moss S, Peto J. A comparison of HPV DNA testing and liquid based cytology over three rounds of primary cervical screening: extended follow up in the ARTISTIC trial. Eur J Cancer. 2011 Apr;47(6):864-71. 24. Smelov V, Elfström KM, Johansson AL, Eklund C, Naucler P, Arnheim-Dahlström L, Dillner J. Long-term HPV typespecific risks of high-grade cervical intraepithelial lesions: a 14-year follow-up of a randomized primary HPV screening trial. Int J Cancer. 2015 Mar 1;136(5):1171-80. 25. Elfström KM, Smelov V, Johansson AL, Eklund C, Nauclér P, Arnheim-Dahlström L, Dillner J. Long term duration of protective effect for HPV negative women: follow-up of primary HPV screening randomised controlled trial. BMJ. 2014 Jan 16;348:g130. 26. Rijkaart DC, Berkhof J, Rozendaal L, van Kemenade FJ, Bulkmans NW, Heideman DA, Kenter GG, Cuzick J, Snijders PJ, Meijer CJ. Human papillomavirus testing for the detection of high-grade cervical intraepithelial neoplasia andcancer: final results of the POBASCAM randomised controlled trial. Lancet Oncol. 2012 Jan;13(1):78-88. 27. Ronco G1, Giorgi-Rossi P, Carozzi F, Confortini M, Dalla Palma P, Del Mistro A, Ghiringhello B, Girlando S, Gillio-Tos A, De Marco L, Naldoni C, Pierotti P, Rizzolo R, Schincaglia P, Zorzi M, Zappa M, Segnan N, Cuzick J; New Technologies for Cervical Cancer screening (NTCC) Working Group. Efficacy of human papillomavirus testing for the detection of 9 Archivos Médicos de Actualización en Tracto Genital Inferior Año VI, No. 12, Abril 2015 SECCIÓN 3 Hospital Civil de Guadalajara, Centro Universitario de Ciencias de la Salud (CUCS), Universidad de Guadalajara, Guadalajara, Jal. México Harper, Fernández 28. 29. 30. 31. invasive cervical cancers and cervical intraepithelial neoplasia: a randomised controlled trial. Lancet Oncol. 2010 Mar;11(3):249-57. doi: 10.1016/S1470-2045(09)70360-2. Bulkmans NW, Berkhof J, Rozendaal L, van Kemenade FJ, Boeke AJ, Bulk S, Voorhorst FJ, Verheijen RH, van Groningen K, Boon ME, Ruitinga W, van Ballegooijen M, Snijders PJ, Meijer CJ. Human papillomavirus DNA testing for the detection of cervical intraepithelial neoplasia grade 3 and cancer: 5-year follow-up of a randomised controlled implementation trial. Lancet. 2007 Nov 24;370(9601):1764-72. Roura E, Iftner T, Vidart JA, Kjaer SK, Bosch FX, Muñoz N, Palacios S, Rodriguez MS, Morillo C, Serradell L, TorcelPagnon L, Cortes J, Castellsagué X; CLEOPATRE Spain Study Group. Predictors of human papillomavirus infection in women undergoing routine cervical cancer screening in Spain: the CLEOPATRE study. BMC Infect Dis. 2012 Jun 26;12:145. Petry KU, Menton S, Menton M, van Loenen-Frosch F, de Carvalho Gomes H, Holz B, Schopp B, Garbrecht-Buettner S, Davies P, Boehmer G, van den Akker E, Iftner T. Inclusion of HPV testing in routine cervical cancer screening for women above 29 years in Germany: results for 8466 patients. Br J Cancer. 2003 May 19;88(10):1570-7. Clavel C, Masure M, Bory JP, Putaud I, Mangeonjean C, Lorenzato M, Nazeyrollas P, Gabriel R, Quereux C, Birembaut P. Human papillomavirus testing in primary screening for the detection of high-grade cervical lesions: a study of 7932 women. Br J Cancer. 2001 Jun 15;84(12):1616-23 32. Wright TC, Stoler MH, Behrens CM, Sharma A, Zhang G, Wright TL. Primary cervical cancer screening with human papillomavirus: End of study results from the ATHENA study using HPV as the first-line screening test. Gynecol Oncol. 2015 Feb;136(2):189-97. 10 Archivos Médicos de Actualización en Tracto Genital Inferior Año VI, No. 12, Abril 2015 SECCIÓN 4 Hospital Civil de Guadalajara, Centro Universitario de Ciencias de la Salud (CUCS), Universidad de Guadalajara, Guadalajara, Jal. México Alonso-Ruiz Preguntando a los expertos ¿QUÉ HACER PRIMERO?: LA PRUEBA CITOLÓGICA O LA DEL VPH Patricia Alonso de Ruiz*, José Antonio Ruiz Moreno** 1 *Centro de Investigación en Salud Poblacional. Instituto Nacional de Salud Pública. Cuernavaca, Mor. **Departamento de Ginecología y Obstetricia. Centro Médico ABC. México, DF. E mail: ruizalonso01@aol.com RESÚMEN El cáncer cérvicouterino (CaCu) es un problema mundial de salud, más grave en los países en vías de desarrollo entre los que se encuentra México. Es una enfermedad altamente previsible ya que se cuenta con métodos de detección que la descubren en su etapa preinvasora, cuando es curable. Los métodos de detección útiles son dos: la citología cervical de Papanicolaopu y las pruebas de Biología molecular para demostrar la presencia de virus del papiloma humano de alto riesgo oncogénico (VPH-AR) en la región cérvico-vaginal. Ambas pruebas se complementan y no compiten entre sí como equivocadamente se supone. La citología cervical debe realizarse por vez primera a los 24 años, repetirse en un año y si ambos resultados son negativos entonces realizarla cada tres años hasta los 35. A esta edad debe iniciarse la detección con pruebas para demostrar la presencia de un VPH-AR en la región cervical (toma por experto) o cérvico-vaginal (autotoma). Si el resultado es negativo (alrededor del 90% de las mujeres) la prueba se repetirá cada cinco años.Si resulta positiva entonces se practicará una citología cervical para conocer la gravedad del efecto citopático que el virus ha causado. Si la citología es negativa se repetiran ambas pruebas anualmente. Si la citología es positiva (ASCUS o más grave y AGC o más grave) la mujer será referida a una Clínica de Colposcopía para evaluacion, diagnóstico y tratamiento si lo amerita. En programas de detección de CaCu o de su lesión precursora la prueba de VPH-AR no tiene ninguna aplicación antes de los 35 años y esto es así en razón de la historia natural de la infección genital por VPH y la del CaCu. ABSTRACT Cervical cancer (CC) is a worldwide health problem, more frequent in developing countries, Mexico included. CC has many opportunities for detection and healing when discovered in his preinvasive phase. Detection methods are the cervical cytology and the high-risk Human-Papilloma-Virus (HR-HPV) demostration in the cervix or the cervico-vaginal area by any specific Biomolecular test. Both, cervical cytology and Bio-molecular Archivos Médicos de Actualización en Tracto Genital Inferior Año VI, No. 12, Abril 2015 SECCIÓN 4 Hospital Civil de Guadalajara, Centro Universitario de Ciencias de la Salud (CUCS), Universidad de Guadalajara, Guadalajara, Jal. México Alonso-Ruiz tests are complementaries. Cervical cytology is indicated in women less of 35 years. According with the Official Mexican Norm (NOM-014) detection starts at the age of 24 years; if negative, one more test should be taken a year later and if both negatives then the test should be repeated in a 3-years interval. The HR-HPV tests should start at 35 years-old and if negative, repeated in five year. If the test is positive to any high-risk Human papilloma Virus (HR-HPV) a cervical cytology should be taken. If the Pap is negative, both tests should be repeated in one year. If cytologic results are abnormal (ASC-US or more or AGC or more) women should be refered to a Colposcopi Clinic for evaluation, diagnosis and treatment if indicated, according with the final diagnosis. INTRODUCCIÓN El cáncer cérvicouterino (CaCu) es una enfermedad de muy altas morbilidad y mortalidad en el mundo, ya que en 2012 hubo 527,624 casos nuevos y 265,672 defunciones.1 Lo peor de estas cifras tan elevadas es que alrededor del 85% de los casos nuevos y del 87% de las muertes ocurrieron en las regiones menos desarrolladas del planeta, entre las que se encuentra México.2 Aquí, en ese mismo año, se registraron 13,960 casos nuevos (tasa estandarizada de incidencia 23.3 x 100,000) y murieron 4,769 mujeres (tasa estandarizada de mortalidad 8.1 x 100,000).2 Las mujeres que enfermaron o murieron se encontraban aún en etapas de alto compromiso familiar y social, lo que aumentó el impacto de su pérdida (total o parcial) y generó profundas repercusiones en sus núcleos de acción.3 Más dolorosas resultan las cifras anteriores si se tiene en cuenta que el CaCu es una enfermedad altamente previsible mediante programas para su detección oportuna, los que aplican muchos países desde hace muchos años y con muy buenos resultados. El CaCu es una enfermedad ideal para su prevención ya que: 1) se genera en un órgano clínicamente accesible; 2) se conoce su historia natural; 3) tiene una etapa temprana (la fase preinvasora) susceptible de diagnosticar y de tratar; 4) el tratamiento en esa fase preinvasora es menos complicado y ofrece mejores resultados que el de la enfermedad avanzada y 5) existen varias pruebas útiles para detectar la enfermedad preinvasora. El concepto CaCu comprende, en la realidad, a dos enfermedades: el carcinoma escamoso y el adenocarcinoma, según el epitelio del cérvix en donde se genera la neoplasia. Mientras el primero representa alrededor del 90% de los casos, el impacto del adenocarcinoma no es despreciable. Los programas de combate al CaCu tienen como objetivo diagnosticar y tratar las lesiones precursoras de cada uno de estos dos tipos de cáncer: la lesión escamosa intraepitelial de alto grado (LEIAG) para el carcinoma escamoso y el adenocarcinoma in situ para el adenocarcinoma, seguidas tales acciones por la adecuada vigilancia epidemiológica de los casos tratados. Estas intervenciones llevan a una disminución de la mortalidad por CaCu. Los programas de combate contra el CaCu tienen a su favor que la historia natural de ambas neoplasias tiene muchas semejanzas por lo que la detección y la evaluación de los casos positivos son semejantes y el tratamiento de las lesiones precursoras de cada estirpe está determinado más por su situación topográficas y que por el diagnóstico histopatológico. MÉTODOS DE DETECCIÓN DEL CaCu Los métodos actuales para la detección del CaCu son: 1) la citología cervical; 2) la demostración, por pruebas de Biología molecular, de que se encuentra un virus del papiloma humano (VPH) de alto riesgo oncogénico (VPH-AR) en el cérvix o en la región cérvico-vaginal; 3) la combinación de las dos anteriores y 4) la visualización del cérvix con ácido acético o ácido acético/solución de Lugol.4 Esta última prueba tiene aplicación, prácticamente exclusiva, en zonas altamente marginadas en donde es imposible implementar una o ambas de las dos primeras señaladas, por lo que no se utiliza en México. Métodos de Detección del Ca Cu 1. Citología cervical 2. Prueba molecular para VPH 3. Combinación de las dos anteriores Citología cervical La citología vaginal, ideada por George N. Papanicolaou, fue presentada al mundo médico en 1928 y en 1941 sin que tuviera impacto, lo que sí logró el Atlas que escribió junto con Herbert F. Traut en 1943.5 A partir de la publicación de este pequeño libro,6 la citología vaginal se convirtió en el método de detección de cánceres invasores incipientes y de sus lesiones precursoras y la demostración de que el tratamiento de tales casos 2 Archivos Médicos de Actualización en Tracto Genital Inferior Año VI, No. 12, Abril 2015 SECCIÓN 4 Hospital Civil de Guadalajara, Centro Universitario de Ciencias de la Salud (CUCS), Universidad de Guadalajara, Guadalajara, Jal. México Alonso-Ruiz hacía disminuir la mortalidad por la enfermedad se reflejó en las estadísticas rápidamente. J. Ernst Ayre, patólogo canadiense, propuso que ya que se trataba de encontrar neoplasias del cérvix, la citología debía tomarse precisamente de ese órgano e ideó una espátula para tal fin logrando que los resultados de la detección mejoraran.7 La propuesta inicial, por la sencillez de la prueba y la posibilidad de resultados falsos negativos, fue que la citología cervical se realizara anualmente para un combate efectivo contra el CaCu. Sin embargo, los grandes programas poblacionales demostraron que no era necesaria tal periodicidad, ya que si se realizaba trianualmente la prueba no perdía eficiencia y reducía en forma importante los costos del programa, permitiendo extender su cobertura. En lo que difieren los programas de diversos países es en la edad para iniciar la prueba citológica, la que debe adoptarse a la epidemiología del CaCu en cada país, región o grupo. Mientras en los Estados Unidos se aconseja8 iniciar la detección con citología cervical a los 21 años y repetirla cada tres, la NOM-014, aún vigente9 señala los 24 años para la primera prueba, dado que antes de esa edad los casos de CaCu son excepcionales, y que después de dos resultados anuales negativos la prueba debe espaciarse a cada tres años. Los programas que utilizan exclusivamente la citología cervical como método de detección pueden suspender el tamizaje a la edad de 64 años, si los resultados siempre han sido negativos. Una mujer en esas condiciones difícilmente se infectará por VPH-AR y en caso de que ocurriera no habría tiempo para desarrollar la enfermedad invasora. encarecido el procedimiento sin mejorar resultados.10 los Genotipificación del VPH La demostración ineludible de que el CaCu es una enfermedad que tiene como agente causal indispensable, aunque no único11 un VPH-AR12 estimuló el desarrollo y la comercialización de pruebas para identificar y tipificar a estos virus13 y a aplicar esta tecnología en los programas de detección del CaCu.14 Detección de Ca Cu con citología cervical en México (NOM-014) Primera citología A los 24 años Después de 2 resultados Cada tres años anuales negativos Si los resultados anuales son Suspender a los negativos siempre 64 años La utilización correcta de estas pruebas implica conocer la historia natural de la infección genital por VPH, la que se adquiere, habitualmente, por transmisión sexual y constituye la más frecuente de las enfermedades de este grupo.15 Se sabe que hasta el 80% de las mujeres que han iniciado su vida sexual adquieren y desarrollan la infección genital por VPH dentro de los siguientes doce meses16 y que esta primoinfección o infección transitoria o infección incidental desaparece espontáneamente en un tiempo variable, entre 4 a 9 meses si es producida por un VPH de bajo riesgo oncogénico (VPH-BR) o de 12 a 18 meses si se trata de una VPH-AR.17,18 La desaparición es consecuencia de la actividad de la inmunidad celular de la hospedera.16 Por alguna razón, ya que se trata de mujeres sanas, alrededor del 10 al 20% de ellas no eliminan la infección y ésta entra en la fase de infección persistente, definida como aquella que persiste a los 24 meses del contagio inicial.18,19 Como no es posible demostrar el momento preciso de la adquisición y la desaparición de esa infección, en la práctica, siguiendo la guía de las tasas de prevalencia a diferentes edades, cuando la infección está presente en las mujeres a los 30 o los 35 años, dependiendo de la población, tal infección debe calificarse como persistente, la que es, precisamente, y no la incidental, la que constituye un factor de riesgo para desarrollar lesiones precursoras e invasoras. En México, la curva de prevalencia señala que la edad de corte debe ser a los 35 años20 mientras en otras poblaciones se considera a los 30 años. La citología cervical como único método de detección, en programas poblacionales organizados, ha logrado reducciones en la incidencia y mortalidad del CaCu hasta del 80%.8 Su utilidad está fuera de toda duda. Los intentos de mejorar los resultados de la citología tradicional, la de Papanicolaou, con nuevas tecnologías, sólo han Por tales razones, la prueba para demostrar una infección cervical o cervicovaginal por VPH-AR no está indicada, en las mujeres mexicanas menores de 35 años, ya que su positividad estaría señalando, en muchísimos casos, una infección incidental, intrascendente para el desarrollo de una lesión precursora o invasora. Otro hecho importante para no realizar la prueba antes de la 3 Archivos Médicos de Actualización en Tracto Genital Inferior Año VI, No. 12, Abril 2015 SECCIÓN 4 Hospital Civil de Guadalajara, Centro Universitario de Ciencias de la Salud (CUCS), Universidad de Guadalajara, Guadalajara, Jal. México Alonso-Ruiz edad señalada es que la positividad genera, solamente, angustia y problemas familiares y que si no se tiene claro su significado biológico, llevará a las mujeres a nuevas pruebas diagnósticas o terapéuticas innecesarias, costosas y capaces de generar problemas personales o familiares y dejar secuelas.21 Como método de detección para lesiones precursoras, una prueba de VPH-AR positiva separa a las mujeres en riesgo, las que deben valorarse de inmediato, de aquellas que tienen la prueba negativa la que se repetirá hasta cinco años después.22 En las mujeres en riesgo por ser VPH-AR positivas es necesario conocer el grado de alteración citopática que el virus ha causado y para eso, la citología cervical es el método único e ideal (sensibilidad aceptable y especificidad muy alta). Por supuesto que debe tratarse de una citología tomada y preparada en condiciones óptimas y diagnosticadas en un laboratorio de excelencia.22 Una citología negativa (que será el grupo mayoritario, alrededor del 90%) identifica a una “portadora sana” a la que el VPH-AR no ha causado alteración en las células epiteliales del cérvix. Son casos que deben revalorarse, con ambas pruebas, en un año. Por el contrario, las mujeres con citología anormal, de ASC-US (atypical squamous cells of undetermined significance) y de AGC (atypical glandular cells) en adelante, las mujeres deben ser referidas de inmediato a una Clínica de Colposcopía para su evaluación y diagnóstico, y en caso necesario, tratamiento.23 Las pruebas de búsqueda del VPH-AR deben suspenderse a los 65 años si han resultado permanentemente negativas.8 Una ventaja de las pruebas de VPH-AR, evidente sobretodo en países con grupos étnicos donde privan usos y costumbres especiales que dificultan la toma de especímenes para estudio de laboratorio, es la posibilidad de que el estudio se realice en muestras autotomadas.24 Su utilidad clínica se mantiene al tiempo que se respeta la idiosincrasia socio-cultural de estos grupos. ¿CUÁL PRUEBA DE ADN-VPH ES LA QUE DEBE REALIZARSE? 1. Como la intención es detectar mujeres con lesiones precursoras o invasoras asintomáticas y a aquellas que están en riesgo de desarrollarlas la prueba debe encontrar un VPHAR. 2. No es necesario que la prueba indique el tipo de VPH que infecta a la mujer, ser portadora de cualquiera de los VPH-AR es el factor de riesgo. 3. Por tanto, las pruebas que son positivas ante los VPH-AR encontrados más frecuentemente en casos de CaCu son las indicadas. La prueba más utilizada ha sido la Captura de Híbridos 2™ (Digene Corp. USA) que señala positividad si existe uno o varios de los 13 VPH-AR siguientes: VPH-16, -18, -31, -33, -35, -39, -45, 51, -52, -56, -58, -59 y -68, que son los más frecuentes encontrados como causa del CaCu.12,25,26 Esta prueba, comunmente llamada Captura Híbrida 2, utiliza la metodología de la amplificación de señales.13 4. El otro grupo de pruebas que se ha utilizado se basa en la amplificación de los ácidos nucleicos de los VPH-AR mediante la reacción en cadena de la polimerasa.13 De entre ellas, la prueba COBAS 4800 HPV test™ (Roche Molecular Systems, USA) ha sido la más utilizada. Cuando resulta positiva revela por separado la presencia de VPH-16, de VPH-18 y del grupo formado por otros VPH-AR:como son: VPH-31, -33, -35, -39, -45, -51, -52, -56, -58, -59, -66, y -68.27 Esta separación de genotipos, a pesar de que se conoce que el VPH-16 y VPH-18 son mucho más frecuentes que los otros, no tiene aplicación en la práctica.13,16,19 Pruebas moleculares más utilizadas Captura de Híbridos 2™ (Digene Corp. USA). Detecta VPH-AR: 16, -18, -31, -33, -35, -39, -45, -51, -52, -56, -58, -59 y -68. PCR (COBAS 4800, ROCHE Molecular System). Detecta: VPH-AR: 16, -18, -31, -33, 35, -39, -45, -51, -52, -56, -58, -59, -66, y -68 ¿QUÉ HACER PRIMERO? Genotipificación del VPH en México Primera prueba A los 35 años Ultima Prueba A los 65 años Ciertos grupos Autotoma Por lo señalado debe quedar claro que no hay controversia científica ni lugar a preferencias personales. La citología cervical es el único método de detección que debe aplicarse en mujeres menores de 35 años. Para que los resultados sean óptimos y confiables, debe recordarse que el Pap 4 Archivos Médicos de Actualización en Tracto Genital Inferior Año VI, No. 12, Abril 2015 SECCIÓN 4 Hospital Civil de Guadalajara, Centro Universitario de Ciencias de la Salud (CUCS), Universidad de Guadalajara, Guadalajara, Jal. México Alonso-Ruiz es “intolerante a las falla del proceso”29 por lo que la muestra debe tomarse, enviarse, procesarse, diagnosticarse y comunicar sus resultados en condiciones ideales. La toma ideal es aquella que proviene de una mujer que está en la parte media de su ciclo menstrual y que no tiene infecciones agregadas y que no se ha colocado en la vagina algún medicamento, ni ha tenido relaciones sexuales, ni se ha realizado lavados vaginales en las 48 horas previas. La muestra citológica debe tomarse gentilmente, sin provocar sangrado y utilizando los instrumentos adecuados: si la unión escamocolumnar es visible a simple vista, una sola toma circular, que abarque los 360° de la circunferencia, utilizando una espátula de madera, es suficiente. El material debe extenderse de inmediato, linealmente, a lo largo de la superficie libre de la laminilla. Si la unión escamocolumnar no es visible o lo es parcialmente o si se tiene duda, entonces la toma debe ser mixta: la muestra ectocervical tomada con espátula de madera como se indicó, en primer lugar, seguida de la muestra endocervical tomada con cepillo que se rota gentilmente 360°. La preparación de la laminilla en estos casos, se hará utilizando una mitad de la laminilla, a lo largo, para cada muestra. Para la muestra endocervical el cepillo debe rotarse suavemente mientras se hace el extendido. La toma y la preparación del frotis con una o dos muestras no debe pasar de 30 segundos y la fijación debe ser inmediata, sea con aerosol rociado a una distancia de alrededor de 30 cm o con la introducción de la laminilla en un frasco con alcohol de 96°. El tiempo de fijación mínimo es de 15 minutos y entonces la laminilla puede sacarse y dejar secar al aire ambiente y así enviarse al laboratorio o mandarla dentro en el frasco fijador. El estudio citológico es una consulta médica por lo que la hoja de requisición debe llenarse con todos los datos pertinentes. El laboratorio de Citología por su parte debe realizar su función de teñir, diagnosticar y reportar el resultado de la muestra con profesionalismo y en un tiempo razonable, que la NOM-014 vigente señala como menor de 28 días (inciso 8.4).9 El resultado del estudio citológico dará la pauta para el manejo de cada mujer. A partir de los 35 años, la detección se realiza con alguna prueba para detectar VPH-AR, seguida de citología cervical si el resultado es positivo. La sola positividad de una prueba molecular no indica enfermedad y no está justificado que con este sólo resultado positivo, la mujer sea referida a una Clínica de Colposcopía y, mucho menos, realizar algún procedimiento con intenciones terapéuticas que no están exentas de complicaciones.30,31 Que hacer primero? Citología cervical (en condiciones ideales): único método antes de los 35 años. Prueba molecular para detectar VPH-AR, a partir de los 35 años, seguida de citología cervical si el resultado es positivo. CONCLUSIÓN La combinación racional de las dos pruebas para la detección del CaCu o su lesión preinvasora, la citología cervical y la de búsqueda de VPH-AR en la región cérvicovaginal, cuando son bien aplicadas, mejoran discretamente los resultados de la detección únicamente con citología cervical. Son técnicas que deben, por tanto, utilizarse en condiciones óptimas. BIBLIOGRAFIA 1. Globocan.2012. http://globocan.iarc.fr/Pages/fact_sheets.population.aspx. Consultada el 06/02/2015 2. Globocan 2012. http://globocan.iarc.fr/Pages/fact_sheets_cancer.aspx. Consultada el 06/02/2015 3. Ekwueme DU, Chesson HW, Zhang KB, Balamurugan A. Years of potential life lost and productivity costs because of cancer mortality and for specific cancer sites where human papillomavirus may be a risk factor for carcinogenesis - United States, 2003. Cancer 2008;113 (suppl 10):2936–2345 4. Sankaranarayanan R, Nene BM, Shastri SS, Kasturi Jayant K y cols. HPV screening for cervical cancer in rural India. N Engl J Med 2009; 360:1385-1394 5. Alonso de Ruiz P, Ruiz Moreno JA. Papanicolaou y la serendipia. Algunas notas acerca del surgimiento de la prueba de Papanicolaou. Rev Enf Tracto Genital Inf 2014:8:21-29 6. Papanicolaou G, Traut HF: Diagnosis of uterine cancer by the vaginal smear. The Commonwealth Fund. Nueva York. 1943. 7. Ayre E: Cervical cytology in diagnosis of early cancer. JAMA 1948;136:513-517 5 Archivos Médicos de Actualización en Tracto Genital Inferior Año VI, No. 12, Abril 2015 SECCIÓN 4 Hospital Civil de Guadalajara, Centro Universitario de Ciencias de la Salud (CUCS), Universidad de Guadalajara, Guadalajara, Jal. México Alonso-Ruiz 8. Smith RA, Manassaram-Baptiste D, Brooks D, Doroshenk M y cols. Cancer scrrening in the United States, 2015: A review of current American Cancer Society Guidliness and current issues in cancer screening. CA Cancer J Clin 2015;65:30-54 9. NOM-014-SSA2-1994, Para la prevención, detección, diagnóstico, tratamiento, control y vigilancia epidemiológica del cáncer cérvicouterino. Diario Oficial de la Federación 31 de mayo de 2007. En: http://www.spps.gob.mx/marco-juridico/normas-oficiales.html. (Consultada 03/03/2015) 10. Arbyn M, Bergeron C, Kinkhamer P y cols. Liquid compared with conventional cervical cytology. A systematic review and meta-analysis. Obsyte Gynecol 2008;111:167-177 11. Walboomers JM, Jacobs MV, Manos MM, Bosch FX y cols. Human papillomavirus is a necessary cause of invasive cervical cancer worldwide. J Pathol 1999;189:12-19 12. Muñoz N, Bosch FX, de Sanjosé S, Herrero R y cols. Epidemiologic classification of human papillomavirus types associated with cervical cacner. New Engl J Med 2003;348:518-527 13. Abreu ALP, Souza RP, Gimenes F, Consolaro MEL. A review of methods for detects human Papillomavirus infection. Virology J 2012;9:262 (htpp://www. virologyj.com/content/9/1/262) 14. Kaufman RH. Is there a role for human papillomavirus testing in clinical practice? Obstet Gynecol 2001;98:724-725 15. Burchell AN, Coutlée F, Tellier P-P, Henley J y cols. Genital transmission of human papillomavirus in recently formed heterosexual couples. J Infect Diseases 2001;204:1723-1729 16. Stanley M. Pathology and epidemiology of HPV infection in females. Gynecol Oncol 2010;117(Suppl 2):S5S10 17. Franco EL, Villa LL, Ruiz A y Costa MC. Transmission of cervical human papillomavirus infection by sexual activity: Difference between low and high risk types. J Infect Dis 1995;172:756-763 18. Trotter H, Mahmud S, Prado JCM, Sobrinho JS y cols. Type specific duration of human papillomavirus infection: Implication for human papillomavirus screening and vaccination. J Inect Dis 2008;197:1436-1447. 19. Koustky L. Epidemiology of genital human papillomavirus infection. Am J Med 1997;102:3-8 20. Lazcano-Ponce E, Herrero R, Muñoz N, Cruz A y cols. Epidemiology of HPV infection among Mexican women with normal cervical cytology. Int J Cancer 2001;91:412-420 21. Drolet M, Brisson M, Maunsell E, Franco EL y cols. The psycosocial impact of an abnormal cervical smear result. Psyco-Oncology 2012;21:1071-1081 22. Phelan DF, Boitnott J, Clark DP, Dubay L y cols. Trends of human papillomavirus testing in cervical cancer screening at a large academic cytology laboratory Obstet Gynecol 2011;118:289-295 23. Wright TC Jr, Massad LS, Dunton CJ, Spitzer M y cols. 2006 consensus guidelines for the management of women with abnormal cervical cancer screening tests. Am J Obstet Gynecol 2007;19:346–355. 24. Lazcano-Ponce E, Lorincz AT, Cruz-Valdez A, Salmerón J y cols. Self-collection of vaginal specimens for human papillomavirus testing in cervical prevention (MARCH): a community-based randomised controlled trial. Lancet 2011;378:1868-1873. 25. Clifford GM, Galluys S, Herrero R, Muñoz N y cols. Worldwide distribution of human papilloma virus types in cytologically normal women in the International Agency for Research on Cancer HPV prevalence survey: a pooled analysis. Lancet 3005;366:991-998 26. de Sanjosé S, Diaz M, Castellsagué X, Clifford G y cols. Worldwide prevalence and genotype distribution of cervical human papillomavirus DNA in women with normal cytology: a meta-analysis. Lancet Inf Dis 2007;7:453-459 27. Wright TC, Schiffman M. Adding a test for human papillomavirus DNA to cervical-cancer screening. N Engl J Med 2003;348:489-490 28. Heideman DA, Hesselink AT, Berkhof J, van Kemenade F y cols. Clinical validation of the Cobas 488 HPV test for cervical screening purposes. J Clin Microbiol 2011;49:3983-3985 29. Franco EL. Comunicación personal. 2012 30. Weed JC, Curry SL, Duncan ID, Parker RT y cols.Fertility after cryosurgery of the cervix. Obstet Gynecol 1978;52:245-246 31. Miller ES, Grobman WA. The association between cervical excisional procedure, midtrimester cervical length, and preterm birth. Am J Obstey Gynecol 2014;211:242e1-4 6 Archivos Médicos de Actualización en Tracto Genital Inferior Año VI, No. 12, Abril 2015 SECCIÓN 5 Hospital Civil de Guadalajara, Fray Antonio Alcalde, Centro Universitario de Ciencias de la Salud (CUCS), Universidad de Guadalajara, Jal. México. Trejo Solorzano Articulo original Resultados de un programa de detección de cáncer cervico uterino con la prueba de PCR, para identificar a los virus de papiloma humano de alto riesgo mas frecuentes y su correlación con la citología tradicional y la colposcopia Oscar Augusto Trejo Solórzano,* José Luis López Velásquez,** María del Carmen García Martínez,** José Adrian Tolentino López,** Silvia Priscila Vásquez Castellanos, *** José Manuel Solórzano Camacho, *** Gabriela Cabrera Lopez, *** Brenda Valeria Gabilondo Acevedo,*** Fernando de la Torre Rendón.**** *Ginecólogo, Obstetra y Colposcopista. Profesor Titular del Curso de Ginecología y Obstetricia. Profesor Titular Curso de Alta Especialidad de Patología del Tracto Genital Inferior y Colposcopia. “Hospital Regional Lic. Adolfo López Mateos” ISSSTE. **Ginecólogo y Obstetra. Servicio de Colposcopia. *** Residente de Ginecología y Obstetricia. ****Jefe Del Servicio de Patología quirurgica. Correspondencia: Av. Universidad 1321, Florida, Álvaro Obregón, 01030 Ciudad de México, Distrito Federal. oscarcolpotre@hotmail.com RESUMEN Introducción. El cáncer de cuello uterino es una de las principales causas de muerte en mujeres a nivel mundial.El agente etiológico asociado a este cáncer es el virus de papiloma humano (VPH), esencialmente los tipos oncogénicos o de alto riesgo. Hoy en día, se considera que la infección por VPH es una causa necesaria, pero no suficiente, para el desarrollo de esta neoplasia. Las pruebas de detección del ADN de los genotipos de alto riesgo (VPH-AR) 16, 18 y doce más en un panel o “pool”, tiene una sensibilidad hasta del 96,6% para detectar lesiones precancerosas. Método y Material.El estudio se llevó en 10 976 mujeres con edad entre los 35 y 64 años. Se tomó una citología cervico vaginal con una brocha de polietileno, el material que se obtuvo se colocó en un vial para ser procesado con el sistema robotizado Roche-Cobas 4800. Resultados. Obtuvimos que la frecuencia máxima esperada de los resultados positivos (1120), se encontró en la categoría “pool” con 965 pacientes (86,16%), siguiéndole VPH genotipo 16 conteniendo a 80 pacientes (7,14%), mientras que la prueba VPH 18 resultó positiva en 30 pacientes (2,67%). Al cálculo de la contingencia para las variables genotipo 16 y genotipo 18 hallamos que la contingencia más elevada se encuentra en el resultado citológico negativo para malignidad encasillando a 58 pacientes (72,5%) pero la contingencia con el resultado citológico NIC 3 se derivó positiva en 12 pacientes (48%) ocurriendo de manera casi similar con el genotipo 18. La colposcopia fue positiva para NIC 3 en18 pacientes (1.62%) de los resultados positivos de PCR para VPH 16 y18. Conclusiones. Nuestra población nos permitió asumir que 12 pacientes (48%) y 10 mas (42%), resultaron positivas en la citología con NIC 3, fueron también positivas al genotipo 16 y 18 respectivamente. Palabras clave: Cáncer cervico uterino, mortalidad, citología. SUMMARY Introduction. Cervical cancer is a leading cause of death in women worldwide. The etiologic agent associated with this cancer is the human papilloma virus (HPV), essentially oncogenic or high-risk types. Today, the presence of an HPV infection is considered to be necessary, although not sufficient for the development of this neoplasm. The DNA testing of high-risk genotypes (HR-HPV) 16, 18 and twelve more in a panel or "pool" has a sensitivity up to 96.6% for detecting precancerous lesions. 1 Archivos Médicos de Actualización en Tracto Genital Inferior Año VI, No. 12, Abril 2015 SECCIÓN 5 Hospital Civil de Guadalajara, Fray Antonio Alcalde, Centro Universitario de Ciencias de la Salud (CUCS), Universidad de Guadalajara, Jal. México. Trejo Solorzano Method and Material. The study took place in 10 976 women aged between 35 and 64 years of age. A cervical Pap smear was taken with a brush of flexible polyethylene and the material was placed in a vial to be processed with the Cobas 4800 (Roche Diagnostics, Mannheim, Germany) robotic system. Results. It was found that the maximum frequency of expected positive results, was in deed found in the "pool" with 965 (86, 16%) patients, followed in number by HPV genotype 16 positives containing 80 of the patients (7.14%), while the HPV 18 test was positive in 30 of the patients (2,67%). When calculating the contingency variables for genotype 16 and genotype 18, it was found that the highest contingency is in the negative cytology result for malignancy encasing 58 of the patients (72,5%), while the contingency result for CIN 3 cytological test was derived positive in 12 of the patients (48%) occurring in an almost similar way with genotype 18. Conclusions. Our population allowed us to assume that 12 patients (48%) and 10 more (42%) were positive on cytology CIN 3 were also positive genotype 16 and 18 respectively. Keywords: uterine cervical cancer, mortality, cytology. INTRODUCCIÓN El cáncer de cuello uterino es una de las principales causas de muerte en mujeres a nivel mundial, principalmente en países en vías de desarrollo [1]. El agente etiológico asociado al cáncer cervical es el virus de papiloma humano (VPH), esencialmente los tipos oncogénicos o de alto riesgo. Esta infección es una de las más prevalentes en cuanto a infecciones de transmisión sexual (ITS) en el mundo [2-3]. No obstante, se trata de una patología altamente curable si se detecta a tiempo [3-4]. El cáncer cervico uterino está precedido por una serie de lesiones precursoras que generalmente se desarrollan de modo lento precediendo al cáncer invasivo típicamente durante un período mayor a 10 años[5]. Estas lesiones precursoras son las anteriormente llamadas displasias o neoplasias intraepiteliales cervicales (NIC) y la actualmente denominada lesión escamosa intraepitelial (LEI)[6]. Una de las características de la historia natural del cáncer cervical es que en más del 50% de pacientes con lesiones de bajo grado regresan, mientras que pacientes con lesiones intraepiteliales de alto grado y cáncer tienen una baja probabilidad de regresión; sin embargo, no es del todo claro por qué unas pacientes regresan y otras progresan[10].Por esta razón, es importante desarrollar estrategias que lleven al conocimiento de factores virales moleculares con valor predictivo y con capacidad para indicar qué personas muestran alto riesgo de desarrollar este tipo de patologías, esto con el fin de implementar medidas de prevención, intervención y seguimiento. El VPH es un virus ADN que desempeña un papel importante en el desarrollo del cáncer cervical [8-9]. Hoy en día, se considera que la infección por VPH es una causa necesaria, pero no suficiente, para el desarrollo de esta neoplasia[10]. Alrededor del 99% de mujeres con cáncer cervical presentan esta infección [11]. Igualmente, se ha descrito su presencia en las lesiones precancerosas antes descritas. El virus actuaría conjuntamente con otros factores, no totalmente conocidos para el desarrollo final de la lesión invasora [4-12]. El VPH pertenece a la familia Papovaviridae, que está formada por virus que tienen una cápside con 72 capsómeros con el genoma del virus. Los capsómeros están compuestos por dosproteínas estructurales: L1, que forma el 80% de la partícula viral y L2, que es la proteína menor de las cápsides. El genoma es una molécula de doble cadena de ADN organizada con 8 a 10 marcos de lectura abierta (ORFs) la cual es semejante para todos los VPH. El genoma está dividido en tres regiones: la región larga de control (LCR) que no tiene potencial para codificar, la región de las proteínas tempranas (E1-E8) y la región de las proteínas tardías (L1 y L2). Las proteínas E1 y L2 son necesarias para la replicación extracromosómica del virus y existen para poder completar el ciclo vital del virus[20-22]. Una de las características del cáncer cervical es la pérdida de la expresión de la proteína viral E2. Se cree que en las células basales del epitelio neoplásico, proteína E2, pierde su expresión y esto produce una pequeña cantidad de E2-ORF el cualy como producto de fusión, es capaz de represar la replicación del ADN y su expresión, por lo tanto mantendría el virus en fase latente en las células 2 Archivos Médicos de Actualización en Tracto Genital Inferior Año VI, No. 12, Abril 2015 SECCIÓN 5 Hospital Civil de Guadalajara, Fray Antonio Alcalde, Centro Universitario de Ciencias de la Salud (CUCS), Universidad de Guadalajara, Jal. México. Trejo Solorzano basales [20.21]. Las proteínas E1 y E2 se van a unir a secuencias específicas del ADN, de tal modo que E1 es la proteína iniciadora de la replicación, para lo cual las secuencias únicas de E1 en adenina/timina van a estar flanqueadas por dos o tres sitios de unión con la proteína E2, con alta afinidad para las secuencias de adenina/timina, la E2también regula la trascripción y es capaz de reprimir algunos promotores que controla la expresión de los genes E6 y E7 siendo un regulador de la proliferación celular y de la capacidad de transformación de las células infectadas. La proteína E4 se expresa en estadios tardíos de la infección cuando se están ensamblando los viriones, en tanto que la proteína E5 en un marco de lectura abierta está demorada en las células neoplásicas y ella no es necesaria para mantener la transformación maligna de las células huésped [20,21,22] . En la etapa no productiva episomal, las células basales del epitelio llegan a formar hasta 200 copias con gran amplificación del genoma. Posteriormente, se transcribirá el ARNm y se van a codificar las proteínas L1 y L2 de la cápside, cosa que se produce únicamente en las capas superficiales del epitelio, allí se pueden comenzar a ver con el microscopio electrónico las partículas virales. La infección persiste en las células basales porque ellas no sufren cambios, no hay coilocitosis, no hay lisis celular, no son productivas.Las proteínas E6 y E7 son, sin duda alguna, las más importantes en sus propiedades oncogénicas. Ellas mantendrán el ambiente celular para que el genoma viral pueda mantenerse extracromosómico. Hoy en día se conoce bien la capacidad de E6 y E7 para inmortalizar y transformar las células del cuello uterino. Los modelos de E6-P53 y de E7-Rb han servido para demostrar como el VPH provoca los cambios premalignos [11-12]. El blanco de E6 es la proteína supresora de tumores conocida como p53, pues E6 promueve su degradación a través de la ubiquitina. De manera que las células que expresan E6 tienen bajos niveles de p53, lo cual favorece la acumulación de mutaciones en los cromosomas.Hasta el momento se han aislado más de 200 tipos diferentes de HPV que incluyen aquellos de bajo y alto riesgo oncogénico, mencionándose también un riesgo intermedio. Al grupo de bajo riesgo pertenecen el 6, 11, 40, 42, 43, 44, 54, 61, 70, 72, 81; los de alto riesgo son el 16,18, 35, 39,45,51,52,56,58,59,68,73,82 y los de riesgo intermedio el 31 y 33. Los denominados de bajo riesgo se relacionan con lesiones benignas y condilomas, en cambio los de alto riesgo están relacionados y se les encuentra en lesiones intraepiteliales y cáncer de cuello siendo el tipo 16 el de mayor frecuencia en el tipo escamoso [13,14]. Para el cribado de cáncer cervical, se ha utilizado tradicionalmente la citología cervico vaginal o prueba de Papanicolaou. Aunque la citología cervical ha contribuido enormemente a la reducción de la morbimortalidad del cáncer cervical, su sensibilidad para detectar lesiones precursoras de cáncer es muy baja, aproximadamente del 55,4%. En comparación, la prueba de detección del ADN de los genotipos VPH-AR en muestras cervicales, tiene una sensibilidad hasta del 96,6% para detectar lesiones precancerosas, aunque es menos específica que la citología [5]. Sin embargo, el verdadero valor de la prueba de detección del ADN de los VPH-AR es su altísimo valor predictivo negativo cercano al 100% que permite espaciar los cribados con la seguridad de no desarrollar NIC III en por lo menos 3 años aunque algunos autores aseguran que hasta 5 años [7-8]. También hay que considerar que no todos los tipos de VPH son igual de oncogénicos. Los genotipos 16 y 18 se encuentran en el 70% de lesiones NIC 3 [9] y en el 75% de los casos de cáncer cervical [10]. Está comprobado que el riesgo de desarrollar NIC III en las mujeres infectadas por estos genotipos es bastante mayor que en las infectadas por otros genotipos distintos. Recientemente se ha propuesto un seguimiento distinto de las pacientes mayores de 30 años infectadas con estos genotipos aunque la citología sea normal o con células atípicas de significado incierto (ASCUS) [611-12] . Por lo tanto, es muy importante que las pruebas de detección del ADN de VPH-AR detecten separadamente los genotipos 16 y 18 para hacer un seguimiento exhaustivo a estas pacientes. La detección temprana del virus podría revelar pacientes con lesiones precursoras. En este sentido, la PCR (Reacción en Cadena de la Polimerasa) es el método más sensible para la detección de secuencias del ADN del VPH en muestras clínicas [13-14-15-16]. El sistema cobas 4800 (Roche Diagnostics, Mannheim, Germany) está compuesto por el automático Cobas X, el termociclador Cobas Z y el software necesario para la realización de una PCR a tiempo real con primers de la región L1 del VPH. Los resultados aparecen en pantalla diferenciados en cuatro canales: genotipo 16, genotipo 18, otros ARVPH (31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 68, 66) y beta-globina que se usa como control interno en cada muestra [14-15-16]. 3 Archivos Médicos de Actualización en Tracto Genital Inferior Año VI, No. 12, Abril 2015 SECCIÓN 5 Hospital Civil de Guadalajara, Fray Antonio Alcalde, Centro Universitario de Ciencias de la Salud (CUCS), Universidad de Guadalajara, Jal. México. Trejo Solorzano La investigación que proponemos está dirigida a evaluar la correlación de los resultados de estudio de la genotipificación del ADN de los VPH-AR en muestras cervicales, ya que tiene una sensibilidad de hasta el 96,6% para detectar lesiones precancerosas, con la citología cervico vaginal y la colposcopia. La detección temprana del virus podría revelar pacientes con alto riesgo de lesiones precursoras cáncer cervico uterino, y así dar un seguimiento y control adecuados, ya que el cáncer de cuello uterino es el segundo tipo de cáncer más frecuente[15-16-17].Además de que es una enfermedad que puede ser prevenida cuando se detecta en sus estados iníciales. La citología únicamente permite sugerir la presencia de una infección por VPH, gracias a la colposcopia se realiza una exploración complementaria básica para el estudio de lesiones escamosas a nivel cervical, junto con la biopsia constituye el eje central para el manejo de las mismas. La combinación de métodos de detección viral con citología cervical incrementa la sensibilidad de los programas de tamizaje y prevención de cáncer cervico uterino. [16-17]. Recientemente se ha utilizado las pruebas de biología molecular para la detección del ADN del virus del papiloma humano (VPH) en la prevención del cáncer cervical especialmente si se identifican los genotipos 16 y 18 [17]. MATERIAL Y MÉTODO Se llevó a cabo esta investigación en 10 976 mujeres, que acudieron a las clínicas de medicina familiar del primer nivel de atención del ISSSTE de la Delegación Sur y Oriente de la ciudad de México.El estudio se llevó a cabo durante el periodo comprendido entre Enero del 2012 a Junio del 2014. Se exhortaron a todas las derechohabientes con edad entre los 35 y 64 años, al aceptar; se les aplicó un formulario-encuesta, con el propósito de integrar el expediente clínico como parte integral de la valoración. Se les explico a las pacientes el procedimiento y se les solicitó firmar un consentimiento informado, siguiendo de manera estricta los lineamientos contemplados en el protocolo de Helsinki. Se procedió a la toma dela citología cervico vaginal con una brocha de polietileno flexible, desechable y atraumatica, dándole tres rotaciones sobre la zona de transformacion del cérvix y aplicando el material celular obtenido con un fino extendiendo sobre el portaobjetos previamente marcado, el residuo de la misma brocha se colocó en el vial de alcohol, el cual se agito ligeramente para desprender el material de las hebras desechando finalmente brocha. Etiquetadas ambas muestras, se enviaron al laboratorio de citología y biología molecular regional para su procesamiento, este procedimiento se llevó a cabo con el sistema robotizado Cobas 4800 (Roche Diagnostics, Mannheim, Germany) amplificación en tiempo real.Posteriormente se citó a las pacientes a la consulta externa 4 semanas despuéspara entregalos resultados. A las pacientes positivas en la citología o la prueba de PCR, se les envió al servicio de colposcopia de su unidad. RESULTADOS De las 10976 muestras recolectadas para la prueba PCR VPH-AR resultaron positivas 1120 (9.8%) convirtiéndose en nuestra muestra a analizar. La frecuencia máxima esperada, de los resultados positivos, se encuentra en la categoría “pool” con 965 pacientes que equivalen al 86,16% del total de la población, le sigue la categoría positiva a VPH 16 conteniendo a 80 pacientes (7,14%) mientras que la prueba VPH 18 resultó positiva en 30 de las 1120 pacientes representando el 2,67%, 20 pacientes (1,78%) resultaron positivas en la categoría “pool” más VPH 16 y 10 a la categoría Pool más VPH 18 (0,89%) y otro tanto a la prueba VPH 16 y 18; las 5 pacientes restantes se encuentran dentro de la categoría “pool” más VPH 16 y 18 y equivalen al (0,44%). Al cálculo de la contingencia para las variables genotipo 16 y genotipo 18 (por ser los genotipos de alto riesgo) con el resultado citológico, hallamos que la contingencia más elevada se encuentra en el resultado citológico negativo para malignidad encasillando a 58 pacientes correspondientes al 72,5% de las 80 pacientes positivas al genotipo 16, pero la contingencia con el resultado citológico NIC 3 (lesión con mayor frecuencia) deriva positiva en 12 pacientes, cabe mencionar que la población en este resultado citológico es de 25 pacientes positivas y por lo tanto nuestro porcentaje es de 48% del total; entendiéndose que casi la mitad de las pacientes con resultado citológico en NIC 3 resultan también positivas al genotipo 16 ocurriendo de manera casi similar con el genotipo 18 ya que albergan a 10 pacientes que, en porcentaje, equivalen al 40%. Seguido, y dentro del genotipo 16, la lesión NIC 1 concentra a 8 pacientes de los 22 pacientes positivos en la prueba citológica, estos representan el 36,36% del total positivo al genotipo (Tabla 1 y 2). 4 Archivos Médicos de Actualización en Tracto Genital Inferior Año VI, No. 12, Abril 2015 SECCIÓN 5 Hospital Civil de Guadalajara, Fray Antonio Alcalde, Centro Universitario de Ciencias de la Salud (CUCS), Universidad de Guadalajara, Jal. México. Trejo Solorzano Tabla 1. Total de pacientes positivas a la prueba de PCR. Pacientes VPH “Pool” 16 18 “Pool”+16 “Pool”+18 16/18 “Pool”+ 16/18 965 80 30 20 10 10 5 TOTAL 1120 Porcentaje 86,16 7,14 2,67 1,78 0,89 0,89 0,44 100% Tabla 2. Total de pacientes positivas a PCR vs Resultado de citología. VPH + 16 18 16/18 “Pool” “Pool”+16 “Pool”+18 “Pool”+16/18 Total Pacientes 80 30 10 965 20 10 5 1120 NEG 58 18 9 907 12 9 2 1015 NIC 1 8 0 0 43 2 0 0 53 NIC 2 1 0 0 4 4 0 0 9 NIC 3 12 10 1 2 0 0 0 25 ASCUS 0 2 0 9 0 0 0 11 ADENO 1 0 0 0 0 0 0 1 5 Dentro de nuestro análisis y de las muestras con resultado citológico, sometimos a colposcopia 1120 muestrasdonde hallamos que el 94,01% (1053) arrojaron resultados negativos a la prueba de PCR. La carga con resultado negativo a la colposcopia con mayor frecuencia se encuentra en la categoría “pool” con 936 muestras que equivalen al 83,57% del total, seguida encontramos la categoría VPH 16 con 59 colposcopias negativas equivalentes al 5,26%. La prueba de colposcopia positiva NIC1 agrupó 44 muestras de la cuales 35 se sitúan, de nuevo, en “pool” y estas equivalen al 79,54% de la categoría analizada (NIC1). La prueba de colposcopia positiva a NIC-2/3 mantiene la mayor carga en VPH 16 y 18 con 8 y 9 pacientes, respectivamente, de 21 muestras; es decir, entre ambas ocupan el 80,95% del total para dicha categoría. Para las colposcopias positivas para invasor y adenocarcinoma la muestra positiva fue de uno para cada uno y equivalen al 0,17% del total de la muestra recolectada y sometida a colposcopia (1120) Tabla 3. Tabla 3. Total de pacientes positivas a PCR vs Resultado de colposcopia VPH+ 16 18 16/18 “Pool” “Pool”+16 “Pool”+18 “Pool”+16+18 Total Colposcopia Negativa 59 22 9 936 14 9 4 1053 Colposcopia NIC - 1 2 1 3 35 2 0 1 44 Colposcopia NIC -2/3 8 9 2 1 1 0 0 21 Colposcopia Invasor 1 0 0 0 0 0 0 1 Colposcopia Adenocarcinoma 1 0 0 0 0 0 0 1 Total 71 32 14 972 17 9 5 1120 Archivos Médicos de Actualización en Tracto Genital Inferior Año VI, No. 12, Abril 2015 SECCIÓN 5 Hospital Civil de Guadalajara, Fray Antonio Alcalde, Centro Universitario de Ciencias de la Salud (CUCS), Universidad de Guadalajara, Jal. México. Trejo Solorzano DISCUSIÓN Actualmente las pruebas moleculares son un instrumento útil para la detección del VPH. Esta herramienta se esta fortaleciendo como una prueba fundamental en el cribado primario del cáncer cervical. Estas pruebas seconfirman con una alta sensibilidad y especificidad. Los métodos de PCR basados en la amplificación de ADN de VPH poseen una alta sensibilidad para la detección del virus en muestras cervico-vaginales[11]. Las técnicas basadas en PCR permiten conocer el tipo específico y las infecciones múltiples, lo que posibilita el seguimiento particular de la persistencia de la infección. El cáncer cervico uterino se encuentra dentro de las primeras causas de muerte por patología maligna entre las mujeres. Es la segunda causa de neoplasia maligna más frecuente en mujeres en países en vías de desarrollo. La mayoría de las pacientes nunca se realiza citología cervico vaginal. Sin embargo, es una contradicción que siendo una patología factible de ser detectada en etapas tempranas y tratada de manera oportuna, debido al largo período de tiempo que transcurre entre la aparición de una lesión intraepitelial y su evolución a cáncer. Esto continúa ocurriendo en un número importante de fallecimientos.Las lesiones precursoras frecuentemente regresan hasta en 50% de los casos en un tiempo promedio de 18 meses; el conocimiento de los eventos moleculares y tipificación viral además de la búsqueda por inmunohistoquimica de ciertos marcadores se relaciona con la progresión de las lesión, lo cual es de interés debido a la necesidad de identificar tendencias que permitan definir con mayor certidumbre si la lesión va a progresar y, por lo tanto, darle un tratamiento más adecuado y oportuno a la paciente En todas las estrategias de prevención para el cáncer cervico uterino la detección y genotipificación del VPH es un paso determinante y critico. Con esto se identifican pacientes de riesgo, pacientes que necesiten seguimiento o tratamiento y en ciertas circunstancias evitar tratamientos excesivos no justificados. Aunque la citología cervical ha contribuido a la reducción de la morbimortalidad del cáncer cervico uterino, su sensibilidad para detectar lesiones precursoras de cáncer es del 55,4% en comparación la genotipificación de VPH-AR que tiene una sensibilidad de hasta el 96,6% para detectar lesiones precancerosas y existen muy pocos estudios que evalúen la relación entre la genotipificación positiva de VPH y la citología y la colposcopia. La citología tradicional, tomada con los instrumentos adecuados seguirá siendo el estudio de elección como detección en los países con alta prevalencia para cáncer cervico uterino. CONCLUSIONES Debido a que nuestro objetivo era encontrar el VPH de alto riesgo más frecuente y su correlación con la citología tradicional y la colposcopia, podemos concluir quecasi la mitad de las pacientes con resultado citológico en NIC III resultan también positivas al genotipo 16 ocurriendo de manera casi similar con el genotipo 18, donde también la frecuencia máxima esperada, de los resultados positivos, se encuentra en la categoría “pool” con 965 pacientes equivalentes al 86,16% del total de la población, le sigue la categoría positiva a VPH 16 conteniendo a 80 pacientes mientras que la prueba VPH 18 resultó positiva en 30 de las 1120 pacientes. Por lo tanto, concluimos que la detección temprana del virus podría revelar pacientes con alto riesgo de lesiones precursoras cáncer cervico uterino, y así dar un seguimiento y control adecuados, ya que el cáncer de cuello uterino es el segundo tipo de cáncer más frecuente. Además de que es una enfermedad que puede ser prevenida cuando se detecta en sus estados iníciales. La citología únicamente permite sugerir la presencia de una infección por VPH, gracias a la colposcopia se realiza una exploración complementaria básica para el estudio de lesiones escamosas a nivel cervical, junto con la biopsia constituye el eje central para el manejo de las mismas. La combinación de métodos de detección viral con citología cervical incrementa la sensibilidad de los programas de tamizaje y prevención de cáncer cervico uterino. Es importante mencionar, que a partir del uso de la brocha de polietileno para tomar la muestra celular del estudio citológico, en un gran porcentaje hemos obtenido un reporte de la calidad de las laminillas, las cuales siempre tiene material celular necesario y suficiente para un estudio citológico de calidad. Desapareciendo en su totalidad las pruebas sin reporte por falta de material celular. 6 Archivos Médicos de Actualización en Tracto Genital Inferior Año VI, No. 12, Abril 2015 SECCIÓN 5 Hospital Civil de Guadalajara, Fray Antonio Alcalde, Centro Universitario de Ciencias de la Salud (CUCS), Universidad de Guadalajara, Jal. México. Trejo Solorzano BIBLIOGRAFÍA 1. Bosch, F.X.; Rohan T.; Schneider A.; Frazer I.; Pfister H et all. Papillomavirus research update: Highlights of the Barcelona HPV 2000 international papillomavirus conference. EnJ.Clin.Pathol.National Cancer Institute Workshop. 2001; 54: pag.0-12. 2. Brown D.; Shew, M.; Qadadri, B.; Neptune, N.; Vargas, M.; A longitudinal study of genital human papillomavirus infection in a cohort of closely followed adolescent women. En J. INFECT DIS. 2005; 15, 191 (2), pag. 182 - 192. 3. Gravitt, P.; y cols; “A Comparison between Real-Time Polymerase Chain Reaction and Hybrid Capture 2 for Human Papillomavirus DNA Quantitation”. En Cancer Epidemiology Biomarkers Prevention; 200312: pag. 477-484, 4. Muñoz, N.; Castellsague, X.; Berrington,; De González, A.; Gissman, L.; HPV in the etiology of human cancer. Review En VACCINE; 2006; 24 Suppl 3:S3 pag. 1-10. 5. Ryan, D.P.; Compton, C.C.; Mayer, R.J.; Carcinoma of the anal canal. En N Engl J Med. Pubmed; 2000; 342; pag.792800 6. CDC Fact Sheet; Genital HPV Infection. U.S. Department of Health and Human Services, Centers for Disease Control and Prevention, Atlanta, Ga. Disponible en http://www.cdc.gov/std/HPV/STDF act HPV.htm/cancer; Agosto 2007. 7. Maynard, M.H.; Duarte; Franco, E.; Rodríguez, I.; Stephen, D.W.; Hanley, J.; Ferenczy, A. et-al, Human papillomavirus DNA versus Papanicolaou screening tests for cervical cancer for the Canadian Cervical Cancer Screening Trial Study Group. En N ENGL J MED. 2007; 357: pag. 1579-88. 8. Sotlar, D.; Diemer, A.; Detheleffs, Y.; Hack, A.; Detection and Typing of Human Papilomavirus by E6 Nested Multiplex PCR, En J CLINICAL MICROBIOL; 2004; 42 (7): pag. 3176-3184. 9. Cortés, J.; Martinón-Torres, F.; Ramón y Cajal, J.M.; Gil, A.; Velasco, J.; Abizanda, M.; et-al. Prevención primaria y secundaria de los cánceres de cuello de útero y vulva: recomendaciones para la práctica clínica. En PROG OBSTET GINECOL. 2010; 53(Suppl 1): pag. 1-19. 10. Clavel, C.; Coucherousset, J.; Lorenzato, M.; Caudroy, S.; Nou, J.M.; Nazeyrollas, P.; et-al. Negative human papillomavirus testing in normal smears selects a population at low risk for developing high grade cervical lesions. En BR J CANCER. 2004; 90: pag. 1803-8. 11. Muñoz M.; Xavier, B.; Epidemiological Classification of Human Papillomavirus Types associated with cervical cancer. En N Engl J Med; 2005. 12. Wrigth, T.C.; Schiffman, M.; Solomon, D.; Cox, T.; García, F.; Goldie, S.; et-al. Interim guidance for the use of human papillomavirus DNA testing as an adjunct to cervical cytology for screening. Obstet Gynecol. 2004; 103: pag. 304-9. 13. Brown, D.; Legge, D.Qadadri, B.; Distribution of human papillomavirus types in cervicovaginal washings from women evaluated in a sexually transmitted diseases clinic. EnSexTransm Dis; 2002; 29 (12): pag. 763-768. 14. Mateos, L.; Sánchez, C. J.M.; Chacón de Antonio, S.I.; Díaz, E.; Rubio, M.D.; De la Morena, M.L.; Prevalence and distribution of high-risk genotypes of HPV in women with severe cervical lesionnsin Madrid, Spain: importance of detecting genotype 16 and other high-risk genotypes. En advances in preventive medicine. 2011; 269468: 4: pag. 15687. 15. De Francesco, M. Gargiulo, F. Schreiber, C.; Ciravolo, G.; etal.Detection and genotyping of human papillomavirus in cervical simples from Italian patients. EnJ.Med.Virl, 2005; 75, (4), pag. 588-592. 16. Franceschi, S.; the IARC commitment to cancer prevention: the example of papillomavirus and cervicalcancer.Recent Results Cancer Res, 2005; 166, pag. 277-297. 17. Thomas, C.; Wright, J.R.; M.D.; Schiffman, M.D. adding a test for human Papillomavirus DNA to Cervical-Cancer Screening. N Engl J Med; 2005. 7 Archivos Médicos de Actualización en Tracto Genital Inferior Año VI, No. 12 Abril 2015 Sección 6 Hospital Civil de Guadalajara, Fray Antonio Alcalde, Centro Universitario de Ciencias de la Salud, Universidad de Guadalajara. Guadalajara, Jalisco. México. Dexeus S-Dexeus D Líderes de opinión “LA COLPOSCOPIA EN LA ACTUALIDAD” *Dr. Santiago Dexeus, **Dr. Damián Dexeus * Director científico de SOMDEX Ginecología, Barcelona, España. **Director médico de SOMDEX Ginecología, Barcelona, España. La historia de la colposcopia, como cualquier técnica diagnóstica, ha experimentado períodos de máxima difusión. Esta no se produjo, como era de esperar en los años siguientes a su introducción por Hinselmann en 1925, probablemente por el aislamiento internacional que padeció Alemania tras la primera guerra mundial que afectó también a la difusión científica germánica. No obstante el área de su influencia se mantuvo, destacando los trabajos de Mestwerdt (Alemania, 1939), Wespi (1940, Suiza) Cattaneo (1940, Italia). En España, pionero de la colposcopia fue Martínez de la Riva en 1944 y posteriormente en 1960 se publicaron simultáneamente los textos de Mateu Aragonés y el nuestro Dexeus y Carrera. En la última década, la técnica esta siendo relegada, en ciertos ámbitos asistenciales, a convertirse en una simple guía de la biopsia, ante citología sospechosa, ASCUS, lesiones de bajo o alto grado, que además suele realizar aquella, especialista ajeno al de “cabecera”, quien envió la biopsia. El propósito de este escrito, es el de revindicar la utilidad de la colposcopia en la consulta ginecológica diaria. La técnica adquiere una nueva dimensión, gracias a los trabajos de Richard (1967) y De Brux (1971) que describen el potencial evolutivo de las “imágenes” colposcópicas, lo cual obligó a los colposcopistas a no limitarse a una descripción “pictórica” de los signos colposcópicos sino a conferir un potencial evolutivo a las imágenes observadas. Es lo que nosotros, denominamos como colposcópia dinámica (Dexeus, Coupez, Carrera, 1977). Esta nueva filosofía, no fue tenida en cuenta por la International Federation of Cervical Pathology and Colposcopy en su 1ª clasificación oficial, en 1990 y hubo que esperar al congreso internacional del 2002, en Barcelona para que se aceptara la importancia de la colposcopia dinámica, posibilitando el diagnóstico histológico de las lesiones subyacentes, a la simple IMAGEN descrita en la colposcopia clásica. 1 1 1 Archivos Médicos de Actualización en Tracto Genital Inferior Año VI, No. 12 Abril 2015 Sección 6 Hospital Civil de Guadalajara, Fray Antonio Alcalde, Centro Universitario de Ciencias de la Salud, Universidad de Guadalajara. Guadalajara, Jalisco. Dexeus S-Dexeus D España, siguiendo el ejemplo de su vecina Francia y de la más lejana Suiza inició campañas de cribado regional, oportunista, mediante la citología. Uno de nosotros, tenía la experiencia del relativo fracaso de estas, tan voluntaristas pero ineficaces iniciativas, sino iban precedidas de una correcta información, en cuanto a la inocuidad y sencillez de la toma citológica. Concretamente en Suiza cuando se desplazaba una unidad móvil pertrechada con todo lo necesario para realizar la toma citológica, en los pueblos de los cantones suizos, apenas acudían las mujeres más obligadas a dar ejemplo: la del alcalde, la del medico y pocas más. En los núcleos urbanos suizos, la participación fue mucho mayor, gracias a que la información previa a la campaña, motivó a muchas mujeres. En España, la primera campaña tuvo lugar en 1964, se cursaron unas 200.000 invitaciones, repartidas en las mesas petitorias del “Día del Cáncer”; solo 30 mujeres acudieron a los hospitales, de referencia. En el mundo anglosajón, la colposcopia fue considerada como un instrumento en manos de los patólogos y empleada por pocos ginecólogos. Probablemente esta “exclusión” ginecológica, obedecía al concepto, tan anatomista propio de la medicina alemana, cuyo pilar fundamental era el estudio de los tejidos. En la actualidad surgen dos diferentes orientaciones, aquella que se realiza en centros especializados y la practican por lo tanto, especialistas en patología del tracto genital inferior, y la otra la que la considera al alcance de cualquier especialista en Ginecología, como parte integrante de la consulta ginecológica. La elección se halla supedita a dos principales aspectos: la política sanitaria de cada país, y la infraestructura sanitaria que se ofrece la ginecólogo para desarrollar su labor cotidiana. Esta dualidad de opciones se refleja claramente en los programas nacionales para la enseñanza de la colposcopia. En Gran Bretaña con una amplia implantación del Sistema Nacional de Salud, se prioriza la dicotomización de los servicios médicos y no se contempla prácticamente la colposcopia rutinaria. La acreditación colposcópica se concede a las unidades especializadas tras comprobar su excelencia. En España, los aspirantes pasan un examen que les acredita como experto en colposcopia. Titulo que no es para siempre, sino que debe renovarse ya sea con un nuevo examen o por un currículo que demuestre su dedicación activa a la colposcopia. Se comprende perfectamente que en una consulta ginecológica, con plétora de enfermas-no es este el espacio para analizar aquella situación- el gesto colposcópico sea materialmente imposible., sin embargo es obvio que la colposcopia enriquece el simple tacto vaginal o la ecografía, que esta adquiriendo gran difusión entre ginecólogos de “cabecera”, aunque en España para considerarse ecografista ginecólogo deben superarse unos establecidos niveles de aptitud. La colposcopia permite diagnosticar lesiones vulvares que la paciente no suele explicitar, tróficas, inflamatorias. Es útil en el diagnostico diferencial de la dispareunia, la obligada introducción del espéculo para su realización, favorece el diagnóstico de los trastornos menores del suelo pélvico y si se completa con la aplicación del lugol, pueden descubrirse signos de colpitis asintomáticas, cuyo tratamiento etiológico redundará en el confort de la paciente. Podríamos seguir con otras muchas ventajas, pero en síntesis creemos que la colposcopia aporta a la consulta ginecológica, un mejor conocimiento de la paciente, y sería deseable que la plétora asistencial no interfiriera en su implantación. 2 2 2 Archivos Médicos de Actualización en Tracto Genital Inferior Año VI, No. 12, Abril 2015 SECCIÓN 7 Hospital Civil de Guadalajara, Centro Universitario de Ciencias de la Salud (CUCS), Universidad de Guadalajara, Guadalajara, Jal. México Briseño Hanon Caso clínico Liquen escleroso vulvar y atrofia genital comunicación de un caso y revisión de la literatura Hugo Briseño Hanon*, Martha Leticia Gómez Martínez**, Guillermo Solís Ledesma***, Susana Elizabeth de la Torre Flores**** *Ginecólogo Colposcopista, Jefe de Ginecología y obstetricia y responsable de la unidad de Colposcopia del Hospital General de Zapopan; Jalisco México **Dermatóloga del Hospital General de Zapopan ***Dermatólogo y Dermatopatólogo, práctica privada ****Pasante de la Carrera de Medicina de la Universidad de Guadalajara Correspondencia: Dr. Hugo Briseño Hanon, Hospital Hospital General de Zapopan. Ramón Corona No. 500, Colonia Centro; Cabecera Municipal Zapopan, Jal. México; Tels: 0133-362313. E mail: hugobh57@gmail.com RESUMEN Antecedentes: El liquen escleroso es una enfermedad mucocutánea inflamatoria crónica, de etiología desconocida y afecta principalmente área genital, aunque puede aparecer afección extragenital en un 15-20%, suele presentarse como placas esclerosas. Caso clínico: mujer de 77 años de edad atendida por dermatosis de trece años de evolución, localizada en región vulvar desde el clítoris hasta región perianal de predominio en labios mayores constituida por vesículas que se agrupan formando dos placas escleroatroficas, zonas escoriadas con costra serohemática y atrofia genital avanzada, se toma biopsia para descartar malignidad, el estudio histopatológico revelo Neoplasia intraepitelial vulvar, no satisfechos con los resultados solicitamos interconsulta a dermatología realizándose dos biopsias en sacabocado reportando el estudio anatomopatologico Liquen escleroso y dermatitis crónica. La paciente recibe tratamiento dermatológico con levocetirizina, itraconazol, betametasona tópica, tacrolimus al 0.1%, estrógenos conjugados locales, y seguimiento colposcopico con remisión del 100% de las lesiones. Las variantes de las lesiones mucocutaneas del liquen escleroso en ocasiones son confusas, la participación conjunta de dermatología y colposcopia enriquecen el conocimiento y el manejo de las enfermedades de la vulva. Palabras clave: Liquen escleroso, lesiones, colposcopia, dermatología. ABSTRACT Background: Lichen sclerosus is a chronic inflammatory mucocutaneous disease of unknown etiology and mostly affects the genital area, but may appear extragenital disease by 15-20%, usually presented as sclerotic plaques. Case report: A woman 77 years old attended by dermatosis thirteen years of evolution, located in vulvar region from the clitoris to perianal region dominance labia consists of vesicles that cluster forming two escleroatrofics plates, areas excoriated with serohematic crust and advanced genital atrophy, biopsy to rule out malignancy is taken, the histopathological study revealed vulvar intraepithelial neoplasia, not satisfied with the results interconsultation request to dermatology performed two punch biopsies pathological study reporting Lichen sclerosus and chronic dermatitis. The patient receives dermatological treatment with levocetirizine, itraconazole, topical betamethasone, tacrolimus 0.1%, local conjugated estrogens and colposcopic follow up with 100% remission of the lesions. Variants of the mucocutaneous lesions of lichen sclerosus are sometimes confusing, joint participation of dermatology and colposcopy enrich the knowledge and management of diseases of the vulva. Keywords: Lichen sclerosus, lesions, colposcopy, and dermatology. 1 Archivos Médicos de Actualización en Tracto Genital Inferior Año VI, No. 12, Abril 2015 SECCIÓN 7 Hospital Civil de Guadalajara, Centro Universitario de Ciencias de la Salud (CUCS), Universidad de Guadalajara, Guadalajara, Jal. México Briseño Hanon INTRODUCIÓN El liquen escleroso (LE) Es una enfermedad mucocutánea inflamatoria crónica, descrita por primera vez por Hallopeau en 1887, sin embargo en 1892 Darier describió su histopatología y la denominó liquen plano escleroso, es conocido también como craurosis vulvar o balanitis xerótica obliterante cuando se presenta en el hombre [1]. Predomina en el género femenino, con una incidencia reportada de 5:1 [2]. Breisky hace referencia a la craurosis vulvar en 1885. Shelley y Crissey en 1953 hacen descripciones como: Los labios que al parecer se pierden, están enyesados en la superficie mucosa de los labios mayores, dando el efecto general de desaparecer con lo cual puede ofrecer una resistencia anormal al coito, la piel aparece blanquecina y seca con partes adyacentes de gris rojizo pálido y ramificación vascular ectásica. Ahora se acepta que la craurosis, la vulvitis leucoplásica y la atrofia primaria son esencialmente casos de liquen escleroso [3]. El liquen escleroso es de etiología desconocida. Se le han atribuido procesos autoinmunes [4], genéticos [5], endocrinológicos e infecciosos principalmente por Borrelia y otras espiroquetas. Gubertini (2011) reporta un caso de LES asociado a Borrelia burdogferri diagnosticado por PCR. También se atribuye etiología viral, por VPH. En casos reportados por Zhou Jing en un artículo de revisión de casos asociados a patología vulvar y VPH encontró una asociación del 35% con VPH 16 y LE. [6 Afecta principalmente área genital, aunque puede aparecer afección extragenital en un 15-20%. Presentándose como placas esclerosas bien delimitadas y rara vez una forma ampollosa, su sintomatología es variable siendo el prurito el más importante, tiene evolución incierta. Se presenta una incidencia bimodal, el primer grupo y menos frecuente en prepúberes, y el segundo y más importante en mujeres posmenopáusicas, aunque puede afectar a cualquier edad. 2 CASO CLINICO Femenino de 77 años de edad la cual se presenta al servicio de Colposcopia con dermatosis de 13 años de evolución localizada en región vulvar desde el clítoris hasta región perianal de predominio en labios mayores constituida por vesículas que se agrupan formando 2 placas escleroatroficas, zonas escoriadas con costra serohemática que miden 5 cm. cada una. Figuras 1 y 2 Dentro de sus antecedentes de importancia diabética e hipertensa ambas en control. Casada, escolaridad primaria, ama de casa, su primera relación sexual fue a los 14 años de edad, una pareja sexual, Gesta 13, Para 12, Abortos 1, no uso métodos anticonceptivos, su última regla fue a los 52 años de edad, último Papanicolaou 2013 clase II con atrofia avanzada. Se toma biopsia para descartar cáncer in situ de vulva, reportando Neoplasia intraepitelial de la vulva displasia leve asociada a virus papiloma humano (VPH), estudio negativo para malignidad. Se Solicita interconsulta a dermatología donde se realizan dos biopsias, estas en sacabocado y se envía el espécimen con dermatólogo patólogo. Fig. 3, 4. Resultado histopatológico: Epidermis con hiperqueratosis laminar y compacta, cúmulos de exudado, acantosis irregular y marcada, además degeneración vacuolar de la capa basal en forma focal. La dermis papilar es homogénea, pálida, con vasos dilatados e infiltrado inflamatorio difuso, compuesto por linfocitos, histiocitos y eosinófilos. Compatibles con Liquen Escleroso más dermatitis crónica. Figuras 5 y 6. La paciente es tratada con antihistamínico a base de levocetirizina 5 mg por día, itraconazol 100 mgs por día, betametasona tópica por 3 meses crema a base de estrógenos conjugados, con remisión del 100%. Figuras 7 y 8. El tratamiento actual continua con tacrolimus al 0.1% en crema, estrógenos conjugados tópicos 2 veces por semana además de Oxiester de glicerol. A 2 años de seguimiento la paciente se encuentra asintomática y solo con manchas hipocrómicas residuales. Archivos Médicos de Actualización en Tracto Genital Inferior Año VI, No. 12, Abril 2015 SECCIÓN 7 Hospital Civil de Guadalajara, Centro Universitario de Ciencias de la Salud (CUCS), Universidad de Guadalajara, Guadalajara, Jal. México Briseño Hanon A 3 B Figura 1. Placas escleroatroficas Figura 3. Biopsia en sacabocado Figura 2. A y B Acercamiento Figura 4. Espécimen de 5 mm Archivos Médicos de Actualización en Tracto Genital Inferior Año VI, No. 12, Abril 2015 SECCIÓN 7 Hospital Civil de Guadalajara, Centro Universitario de Ciencias de la Salud (CUCS), Universidad de Guadalajara, Guadalajara, Jal. México Briseño Hanon Figura 5. Epidermis con Hiperqueratosis laminar y compacta. Figura 6. Infiltrado inflamatorio Difuso. Linfocitos e histiocitos. 4 Figura 7. Antes de tratamiento Figura 8. Después de tratamiento DISCUSIÓN El liquen escleroso (LS) se puede presentar en diversas especialidades clínicas y los médicos no siempre la reconocen. Goldstein encontró una prevalencia de LS vulvar en la práctica de ginecología de 1. 7%. Powell [7] y Wojnarowska encontró una prevalencia de LS en niñas premenarcas de 0.1% [8]. Kizer et al. En una población de 153.432 pacientes de sexo masculino lo encontró en el 0. 07% [9]. Cooper y colaboradores estudiaron un total de 253 mujeres y 74 niñas con las características clínicas típicas de Liquen escleroso vulvar. 23% de los pacientes eran pre menarquicas, el 17% en sus años reproductivos, y el 60% en la posmenopausia. La edad media de inicio de los síntomas fue de 5.4 años para las niñas y 55.1 años para las mujeres. La edad media al diagnóstico fue de 7.6 años para las niñas y 60 Archivos Médicos de Actualización en Tracto Genital Inferior Año VI, No. 12, Abril 2015 SECCIÓN 7 Hospital Civil de Guadalajara, Centro Universitario de Ciencias de la Salud (CUCS), Universidad de Guadalajara, Guadalajara, Jal. México Briseño Hanon años para las mujeres [10]. El diagnóstico de LS es generalmente clínico. Cuando las características clínicas son típicas, el examen histológico no siempre es esencial. Sin embargo, en las primeras etapas de la enfermedad el diagnóstico puede ser difícil. Los principales diagnósticos diferenciales son el liquen plano (LP), liquen simple crónico, vitíligo, El diagnóstico diferencial se debe hacer con otras dermatosis que afectan en área vulvar como el liquen plano erosivo, penfigoide cicatrizal, dermatitis por contacto por irritante primario por el uso de toallas sanitarias, morfea y eczema vulvar. Los pacientes de seguimiento de rutina en la consulta médica tendrán una biopsia si: 1) hay una sospecha de cambio neoplásico, es decir, una área persistente de hiperqueratosis, erosión persistente o eritema, enfermedades ampollosas como pénfigo y penfigoide vulvar o neoplasia intraepitelial del pene [11] [12]. En los casos clínicamente no concluyentes, es recomendable la toma de biopsia y estudio histopatológico con expertos en piel como los dermatólogos patólogos. una nueva lesión verrugosa o lesiones papulares. 2) Área resistente al tratamiento adecuado. 3) LE extra genital, con características que sugieren morfea o ampollas. 4) Presencia de áreas pigmentadas, con el fin de excluir una proliferación melanocítica anormal. 5) Sí la terapia de segunda línea será utilizada [3]. En la tabla 1 se presenta el tratamiento del LS. Tabla 1. Tratamiento del liquen escleroso ano genital Minimizar los irritantes, sustituir jabón y evitar contacto urinario Hidratación con emolientes Tratamiento de infecciones Corticoide ultra potente o potente tópico diario por la noche por 4 semanas, después continuar la terapia de supresión de acuerdo con la actividad inflamatoria. En los casos de resistencia a corticoide considere la aplicación de inhibidores tópicos de la calcineurina, retinoides tópicos en las lesiones hiperqueratósicas, retinoides sistémicos, o la terapia fotodinámica. Cirugía para la neoplasia intraepitelial o carcinoma si esta se presenta Vigilancia a largo plazo El síntoma principal es un prurito intratable [1] La lesión primaria consiste en pápulas acrómicas de bordes irregulares que tienden a coalescer, formando placas atróficas de bordes regulares y disposición simétrica [13]. Tiende a presentar fenómeno de koëbner. Entre los síntomas principales se encuentran el prurito, ardor, dispareunía, defecación dolorosa, fusión de labios menores, hipopigmentación de labios mayores y menores y fisuras en introito. En varones puede aparecer fimosis de la uretra pudiendo ocasionar balanitis xerótica obliterante. El liquen escleroso extra genital afecta principalmente región submamaria, hombros, cuello, muñecas. Se ha demostrado una asociación con el desarrollo de carcinoma espinocelular en pacientes con liquen escleroso [14], encontrándose en estos casos mutaciones del gen P53, [15], se realizó un estudio por (KJ Rolfe, 2003), en el cual por medio de métodos de inmunohistoquimica y PCR, se demostró que en un total de 27 pacientes, 21 presentaron mutación del gen P53. 5 Archivos Médicos de Actualización en Tracto Genital Inferior Año VI, No. 12, Abril 2015 SECCIÓN 7 Hospital Civil de Guadalajara, Centro Universitario de Ciencias de la Salud (CUCS), Universidad de Guadalajara, Guadalajara, Jal. México Briseño Hanon HISTOPATOLOGIA Hiperqueratosis, taponeamiento folicular, adelgazamiento de la epidermis y alteraciones vacuolares de la capa basal, edema subepidermico con homogenización del colágeno, zonas escleróticas, dilatación de los vasos sanguíneos. Infiltrado perivascular difuso, en tercio medio de la dermis puede haber células plasmáticas e histiocitos. En estadios iniciales las fibras de colágeno se ven por debajo del edema además de infiltrado inflamatorio en banda. [16] En cuanto al tratamiento se basa en medidas generales como evitar irritantes locales así como el uso de sustitutos de jabón y emolientes tópicos. El tratamiento recomendado de elección en estos pacientes es el uso de corticosteroides de alta potencia durante cuatro a ocho semanas. En caso de resistencia a corticosteroides se puede optar por el uso tópico de inhibidores de calcineurina tacrolimus o pimecrolimus, retinoides en caso de lesiones hiperqueratósicas. Se ha encontrado mejoría con el uso de retinoides orales y terapia fotodinámica. En pacientes tratados con tacrolimus se ha observado remisión de las lesiones [5]. CONCLUSIONES El presente caso es una evidencia más de la variedad de lesiones que pueden presentarse en el liquen escleroso y que los clínicos y patólogos generales debemos estar más avezados en dicha patología, la interconsulta al servicio de dermatología propicio la sospecha de liquen escleroso y la participación de un dermatólogo patólogo en el estudio de las biopsias subsecuentes, lo que confirmo el diagnóstico de liquen escleroso y por ende la propuesta terapéutica implementada por dermatología, avalan los resultados satisfactorios de la evolución clínica del caso en cuestión. 6 Referencias [1] Bolognia J, Jorizzo J, Rapini R. Dermatología. Madrid, España: Elsevier. 2004. [2] Meffert JJ, Davis BM, Grimwood RE. Lichen Sclerosus. J Am Acad Dermatol, 1995. 32: 393-416. [3] Neill SM, Lewis FM, Tatnall FM. British Association of Dermatologists’ guidelines for the management of lichen sclerosus 2010. Br J Dermatol., 2010 163:672–682. [4] Meyrick Thomas RH, Ridley CM, Mcgibbon DH. Lichen sclerosus at atrophicus and autoimmunity: a study of 350 women. Br J Dermatol., 1998. 118: 41-6. [5] Fistarol S, Itin P. Diagnosis and Treatment of Lichen Sclerosus. Am J Clin Dermatol, 2013. 14: 27-47. [6] Zhou J, Xiao S, Deng X, Cui C. Expression of HPV16 E6 protein in nonneoplastic epithelial disorder of the vulva and squamous cell carcinoma of the vulva. Zhong Nan Da Xue Xue Bao Yi Xue Ban. 2013. 38 (3): 225-30. [7] Goldstein AT, Marinoff SC, Christopher K. Prevalence of vulvar lichen sclerosus in a general gynecology practice. J Reprod Med. 2005. 50:477–480. [8] Powell J, Wojnarowska F. Childhood vulvar lichen sclerosus: an increasingly common problem. J Am Acad Dermatol. 2001. 44:803–806. [9] Kizer WS, Prarie T, Morey AF. Balanitis xerotica obliterans: epidemiologic distribution in an equal access health care system. South Med J., 2003. 96:9–11. [10] Cooper SM, Gao XH, Powell JJ. Does treatment of vulvar lichen sclerosus influence its prognosis? . Arch Dermatol., 2004. 140:702–706. [11] R Murphy. Lichen sclerosus. Dermatol Clin, 2010. 28:707–715. [12] D Funaro. Lichen sclerosus: a review and practical approach. Dermatol Ther., 2004. 17:28–37. [13] J Zeiguer, K. de Zeiguer. Vulva, vagina y cuello. Argentina: Panamericana. 1996. [14] V. Garcia llaver, V Parra, F Flores, C Sanchez, L Tenneri. Liquen escleroso vulvar y carcinoma espinocelular. Trabajos Originales, 2011. 365-369. [15] KJ Rolfe, AB Maclean, JC Crow, E Benjamin, CW Perret. TP53 mutations in vulvar lichen sclerosus adjacent to squamous cell carcinoma of the vulva. British Journal of Cancer, 2003. 2249-2253. [16] Weedon, D. Piel, Patologia. España: Marbán. 2002. Archivos Médicos de Actualización en Tracto Genital Inferior Año VI, No. 12, Abril 2015 SECCIÓN 8 Hospital Civil de Guadalajara, Fray Antonio Alcalde, Centro Universitario de Ciencias de la Salud CUCS), Universidad de Guadalajara, Jal. México. Mortakis Imagenología Colposcópica de un Experto HALLAZGOS COLPOSCÓPICOS DE MICROINVASIÓN E INVASIÓN EN EL CUELLO UTERINO 1 Dr. Alexander Mortakis* *Gineco-obstetra, graduado en Atenas Grecia, con estudios de postgrado en San Francisco, California (USA). Experto profesor en educación médica continua y en adiestramientos en patología del tracto genital inferior. En 1990, aplicó por primera vez en Grecia la técnica LEEP. Reconocido y galardonado colposcopista a nivel nacional e internacional. INTRODUCCIÓN La colposcopia es simplemente un medio de examinar el cuello uterino y la vagina superior con magnificación de baja potencia (6-40 x). Su uso principal es en la evaluación de mujeres con citología cervical anormal, lo que permite al colposcopista identificar y confirmar la magnitud y características del epitelio anormal o atípico. La gestión eficaz de las neoplasias del tracto genital inferior depende de la colposcopia de calidad. Aunque el diagnóstico final se basa en última instancia en la histología, el diagnóstico clínico presuntivo de la colposcopia es una parte imprescindible de la correcta evaluación y manejo de la enfermedad. Todos los derechos reservados: mortakis.gr Archivos Médicos de Actualización en Tracto Genital Inferior Año VI, No. 12, Abril 2015 SECCIÓN 8 Hospital Civil de Guadalajara, Fray Antonio Alcalde, Centro Universitario de Ciencias de la Salud CUCS), Universidad de Guadalajara, Jal. México. Mortakis La colposcopia no es un método de diagnóstico muy preciso. La gran variabilidad que muestra en cambios precancerosos y cancerosos es tal, que ningún aspecto solo puede ser llamado característica. La mezcla de los patrones de los vasos sanguíneos variables con diferentes grados de madurez del epitelio asociados con alteraciones en el contorno de la superficie, color, y la demarcación, todo en conjunto determinan la gran variabilidad en la imagen colposcópica resultante. Es sumamente importante que el colposcopista sea capaz de diferenciar entre los patrones colposcópicos normales, anormales y mínimamente anormales. ………………………… FIABILIDAD DE LA COLPOSCOPIA Y CIRCUNSTANCIAS QUE JUSTIFICAN LA PREOCUPACIÓN. (Figuras 1 – 9) Tanto el carcinoma de células escamosas microinvasor y francamente invasivo, consisten en tejido que ha proliferado y transformado, alterando la configuración de la superficie del cuello uterino y causando la formación de vasos sanguíneos exagerados, retorcidos, e inusuales para apoyar el crecimiento del tumor. Patrones de contorno de la superficie y de los vasos sanguíneos son indicadores fiables de la evolución de la enfermedad, pero no siempre son típicos. Aunque muchos autores informan que la colposcopia es de valor en la detección temprana de la enfermedad invasiva, los mismos autores reportan un problema significativo con inexactitud del diagnóstico colposcópico. 2 Figura 1. Caso con microinvasión. Mujer de 40 años con lesión extensa, con características de alto grado, que entra en el canal. Se requiere escisión de toda la Z de T, cuando las biopsias colposcópicas no confirman el cáncer. Es esencial que todas las personas que practican la colposcopia en pacientes con citología anormal aprendan a reconocer los signos de la enfermedad colposcópicas microinvasivas y más avanzada. Aproximadamente 70% a 75% de las mujeres con un Pap mostrando HSIL habrá CIN 2 o 3, y aproximadamente 1% a 4% subyacente tendrá cáncer invasivo. Lamentablemente, muchas de estas mujeres tienen una colposcopia insatisfactoria, y el cáncer por lo general no se puede excluir sin conización. . El tamaño de una lesión CIN3 con invasión asociada: en promedio, es siete veces mayor que sin invasión. Lesiones CIN3 lineales largas (> 10 mm), sobre todo cuando hay afectación endocervical, son siempre sospechosas de cáncer. Figura 2. Extensa lesión HSIL que ocupa más de la mitad de la superficie cervical con afectación endocervical. Nota erosiones superficiales irregulares y mosaicismo grueso. Caso de cáncer invasivo. Todos los derechos reservados: mortakis.gr Archivos Médicos de Actualización en Tracto Genital Inferior Año VI, No. 12, Abril 2015 SECCIÓN 8 Hospital Civil de Guadalajara, Fray Antonio Alcalde, Centro Universitario de Ciencias de la Salud CUCS), Universidad de Guadalajara, Jal. México. Mortakis 3 Figura 3. Extensa lesión que penetra en el canal. Contorno de superficie irregular, el epitelio sangrado frágil. Caso de cáncer invasivo. Figura 4. El HSIL ocupa toda la superficie del cuello uterino y entra en el canal. Masa hemorrágica por encima del orificio cervical. Cáncer invasivo Todos los derechos reservados: mortakis.gr Archivos Médicos de Actualización en Tracto Genital Inferior Año VI, No. 12, Abril 2015 SECCIÓN 8 Hospital Civil de Guadalajara, Fray Antonio Alcalde, Centro Universitario de Ciencias de la Salud CUCS), Universidad de Guadalajara, Jal. México. Mortakis Al menos el 50% de las lesiones CIN3 implican el conducto cervical. La peor enfermedad siempre se encuentra en el centro. Ante sospecha de cáncer, el error más grave hecho en colposcopia generalmente se puede atribuir a una evaluación inadecuada del conducto cervical en casos de colposcopia insatisfactoria RESULTADOS DE LA COLPOSCOPIA Figura 5. Punteado grueso y vasos atípicos observados antes de la aplicación de la solución de ácido acético. La Figura 6. La masa de tejido queratinizado y hemorrágico amarillento necróticas. Cáncer escamoso invasivo del cuello uterino. Contorno de la superficie: cáncer microinvasor y cánceres ocultos puede producir superficies irregulares, erosiones, apariciones granulares o, en una enfermedad más avanzada, la necrosis. Un contorno nodular, papilar, papular, o exofítico observado dentro de un área de la lesión CIN3 sugiere la presencia de cáncer. Color: Acetoblanco denso, es una característica colposcópica distinta de cualquiera de SIL de alto grado o de la presencia de queratina. La queratina se asocia con malignidad y también se observa en los condilomas. El grado de blancura en la neoplasia es un reflejo de la cantidad de actividad nuclear. La visualización utilizando un filtro azul o verde a menudo revela punteado o mosaicismo y el epitelio blanco después de la aplicación de ácido acético. HSIL son generalmente blanco denso. Cánceres escamosos pueden ser color amarillento, una característica asociada con necrosis. Un color rojo refleja vascularidad marcada. Vasos atípicos: En microinvasión y con mayor frecuencia en los cánceres invasivos el puntilleo y patrones de mosaico se degradan y desorganizan observando como si los vasos están surgiendo de los arreglos típicos y transmutan en los vasos más atípicos. Estas formaciones se denominan comúnmente como sacacorchos, espaguetis, coma, zarcillo, y residuos de hilo, dependiendo de lo que se asemejan. Otras formas atípicas tienen bucles de ramificaciónes que sobresalen y constriñen, exhibiendo calibres variables. A veces aparecen dentro de un área de contorno de la superficie desigual ya que estos bucles están apoyando a tumores proliferativos activos. Figura 7. El grado de gravedad de esta lesión basado únicamente en la mera presencia de vasos aberrantes no es fiable. Las características vasculares anormales como el punteado y mosaicos son significativas solo si se ven confinados a áreas acetoblancas densas con márgenes distintos. La histología mostró una lesión CIN1. Es prioridad para el colposcopista a tener en cuenta las señales de advertencia de cáncer invasivo. (Tabla 1). Todos los derechos reservados: mortakis.gr 4 Archivos Médicos de Actualización en Tracto Genital Inferior Año VI, No. 12, Abril 2015 SECCIÓN 8 Hospital Civil de Guadalajara, Fray Antonio Alcalde, Centro Universitario de Ciencias de la Salud CUCS), Universidad de Guadalajara, Jal. México. Mortakis Tabla 1. SEÑALES COLPOSCÓPICAS DE ADVERTENCIA EN EL CÁNCER INVASIVO Vasos anormales Lesiones intraepiteliales extensas con afectación del canal Frágil, el epitelio sangrado Masa hemorrágica Lesión con formación de queratina Tejido necrótico En resumen, el diagnóstico colposcópico preciso del carcinoma invasor preclínico depende de varios factores. Tabla 2. Tabla 2. FACTORES INVOLUCRADOS EN EL DIAGNÓSTICO COLPOSCÓPICO DE CÁNCER INVASOR PRECLÍNICO El estado de alerta permanente por parte de la colposcopia. El cumplimiento estricto de la enfoque paso a paso para el examen. La utilización de un índice de calificación, La atención cercana a la superficie de los vasos sanguíneos, La evaluación honesta de cuando un examen es inadecuada, El uso apropiado de la ECC (curetaje endocervical) para descartar lesiones en el conducto, y La toma de múltiples biopsias bien dirigidos de tejido suficiente en la que basar un diagnóstico histopatológico fiable. En "casos sospechosos" (por ejemplo, la citología anterior con sospecha de invasión) los colposcopistas no deben confiar en la negatividad de las biopsias tomadas por colposcopia. Deben proceder a la conización. Figura 8. La formación de queratina. Superficie irregular y el contorno de la lesión por encima del canal cervical. Las placas de mosaico a la izquierda de la imagen, son debidas a los vasos atípicos bajo la placa de queratina. Diagnóstico: cáncer invasivo. 5 Figura 9. Mujer embarazada en el segundo trimestre. Zonas densas, exofíticas notablemente acetoblancas, con contorno de superficie irregular y márgenes afilados. Múltiples biopsias mostraron CIN BIBLIOGRAFÍA http://mortakis.hpvinfocenter.gr/ https://gr.linkedin.com/pub/δαφνη-μπουρα/6a/.../426 mortakis.hpvinfocenter.gr/index.php/atypical-transformation-zone/atypical-transformation-zone-5-colposcopic-findings-ofmicroinvasion-invasion Revisión web: Ma. de Lourdes Aguilar Garay. Todos los derechos reservados: mortakis.gr Archivos Médicos de Actualización en Tracto Genital Inferior Año VI, No. 12, Abril 2015 SECCIÓN 9 Hospital Civil de Guadalajara, Centro Universitario de Ciencias de la Salud (CUCS), Universidad de Guadalajara, Guadalajara, Jal. México Bibliografía Nacional 2014-2015 Journal of Medical Virology J. Med. Virol.# 2015 Wiley Periodicals, Inc. Infecciones por Virus Papiloma Humano en México en mujeres con citología normal, lesiones precancerosas y cáncer de cuello uterino: Prevalencia según el subtipo especìfico, y coinfecciones con VPH Adriana Aguilar-Lemarroy,1 Vero _ nica Vallejo-Ruiz,2 Elva I CorteÂs-GutieÂrrez,3 Manuel Eduardo Salgado-Bernabe ,4 Norma Patricia Ramos-Gonza lez,5 Laura Ortega-Cervantes,6 Rafael Arias-Flores,4 Irma M Medina-DõÂaz,6 Fernando Herna ndezGarza,7 Gerardo Santos-Lo _ pez,2 Patricia Pi~na-Sa nchez,4* and On behalf of the IMSS Research Network on DPB . 1Western Biomedical Research Center (CIBO)ÐIMSS, Guadalajara, Jalisco, Mexico Biomedical Research Center (CIBIOR)ÐIMSS, Metepec, Puebla, Mexico 3Northeastern Biomedical Research Center (CIBIN)ÐIMSS, Monterrey, Nuevo Leo_n, Mexico 4Molecular Oncology Laboratory, Oncology Research Unit (UIMEO)ÐIMSS, Mexico City, Mexico 5Guadalajara Civil Hospital, and University of Guadalajara, Guadalajara, Jalisco, Mexico 6Autonomous University of Nayarit, Tepic, Nayarit, Mexico 7Medical Specialties Hospital 23 (UMAE)ÐIMSS, Monterrey, Nuevo Leo_n, Mexico 2Eastern _Correspondence to: Patricia Pi~na-SaÂnchez, PhD, Molecular Oncology Laboratory, Oncology Research Unit, Oncology Hospital, Mexican Institute for Social Security (IMSS), Avenida CuauhteÂmoc 330 colonia Doctores, MeÂxico D.F C.P. 06720. E-mail: 1307patricia@gmail.com Accepted 23 September 2014 DOI 10.1002/jmv.24099 Published online in Wiley Online Library (wileyonlinelibrary.com). Resumen La prevalencia y distribución de genotipo del virus del papiloma humano (VPH) son la base para el diseño de programas de prevención del VPH. Las tasas de prevalencia de los subtipos específicos de VPH y las coinfecciones en muestras de mujeres mexicanas se investigaron en 822 mujeres de entre 18 y 87 años. La detección del VPH se realizó con la prueba Linear ArrayTM , que detecta el genotipo. La infección por VPH se encontró en 12,4% de los controles, en 46,3% de las que cursaban con neoplasia intraepitelial cervical 1, y en el 100% de las personas con neoplasia intraepitelial cervical 3 o cáncer cervical. El VPH 16 fue el subtipo más común en todos los grupos de diagnóstico. Los subtipos de VPH más frecuentemente encontrados en cáncer cervical fueron el 16, 18, 45, 52, 58, y 39; los subtipos 16, 62, 51, 84, 18, 53 y el CP6108 fueron los más frecuentes en las mujeres control. Tomando en cuenta solamente las muestras positivas para el VPH , las coinfecciones ocurrieron con mayor frecuencia en los controles (63%) y fueron menos frecuentes en las pacientes con cáncer cervical (26%). Los subtipos virales más frecuentes en coinfecciones con VPH 16 en las mujeres del grupo control fueron VPH 62, 51, y 84; y en mujeres con cánceres de cuello uterino, el VPH 18, 39, y 70 fueron los más comunes. En conclusión, además de los subtipos 16 y 18, los tipos 45, 39, 58, 52 y 71 fueron encontrados en los cánceres de cuello uterino de mujeres mexicanas (78%); entre ellos, sólo el 65% eran atribuible a los tipos de VPH 16 y 18. Por lo tanto, es necesario tener en cuenta estos subtipos virales en el diseño de nuevas vacunas, y para determinar si ciertos subtipos de VPH coinfectando con el VPH 16 en lesiones precursoras pueden determinar progresión o regresión tumoral. 1 Archivos Médicos de Actualización en Tracto Genital Inferior Año VI, No. 12, Abril 2015 SECCIÓN 9 Hospital Civil de Guadalajara, Centro Universitario de Ciencias de la Salud (CUCS), Universidad de Guadalajara, Guadalajara, Jal. México Resumen original: Human Papillomavirus Infections in Mexican Women With Normal Cytology, Precancerous Lesions, and Cervical Cancer: Type-Speci®c Prevalence and HPV Coinfections Abstract The prevalence and genotype distribution of human papillomavirus (HPV) provides the basis for designing HPV prevention programs. The prevalence rates of type-speci®c HPV and coinfections in samples of Mexican women were TM investigated in 822 women aged 18±87 years. HPV detection was performed using a Linear Array genotyping test. HPV infection was found in 12.4% of controls, 46.3% of those with cervical intraepithelial neoplasia 1, and 100% of those with cervical intraepithelial neoplasia 3 or cervical cancer. HPV 16 was the most prevalent type in all diagnosis groups. The HPV types most frequently found in cervical cancers were 16, 18, 45, 52, 58, and 39; HPV types 16, 62, 51, 84, 18, 53, and CP6108 were the most prevalent in control women. Considering HPV-positive samples only, coinfections occurred most often in controls (63%) and were less frequent in those with cervical cancer (26%). The most frequent viral types in coinfections with HPV 16 in control women were HPV 62, 51, and 84; in women with cervical cancers, HPV 18, 39, and 70 were most common. In conclusion, in addition to HPV types 16 and 18, types 45, 39, 58, 52, and 71 were found in cervical cancers in Mexican women (78%); among them, only 65% were attributable to HPV types 16 and 18. Therefore, it is necessary to consider these viral types in the design of new vaccines, and to determine whether certain HPV types coinfecting with HPV 16 in precursor lesions determine tumor progression or regression. ……………………………………………………………………………………………………………………… Asian Pacific Journal of Cancer Prevention, Vol 15, 2014 10061 / 10066 DOI:http://dx.doi.org/10.7314/APJCP.2014.15.23.10061 Human Papilloma Virus Genotypes among Females in Mexico Genotipos del Virus del Papiloma Humano entre las mujeres en México: un estudio del Instituto Mexicano del Seguro Social. Mauricio Salcedo *, Patricia Pina-Sanchez , Veronica Vallejo-Ruiz , Alberto Monroy-Garcia , Adriana Aguilar-Lemarroy , Elva I. Cortes-Gutierrez , Gerardo Santos-Lopez , Hector Montoya-Fuentes , Renan Grijalva , Vicente Madrid- Marina , Teresa ApresaGarcia , Dulce M. Hernandez , Luis F. Jave-Suarez , Pablo Romero , Albros Poot , Eduardo Salgado , Patricia Ramos-Gonzalez , Rigoberto Gonzalez-Hernandez , Juan C. Canton , Lucio Jimenez-Aranda , Miriam Parra-Melquiadez , Lucero Paniagua , Monica Mendoza , Hugo Arreola , Vanesa Villegas , Kirvis Torres-Poveda , Margarita Bahena-Roman , Beatriz Gonzalez-Yebra , Keiko Taniguchi , Carlos Rodea , Alejandra Mantilla- Morales , Maria L. Mora-Garcia , Cindy K. Velazquez-Velazquez , Candelaria Cordova-Uscanga , Raúl Peralta , Ricardo Lopez-Romero , Daniel Marrero , Cindy Bandala , Julio Reyes-Leyva , Maria E. Furuya , Eduardo Almeida , Maria E. Galvan , Israel Grijalva 1 1 4 2 1 2 1 3 7 3 3 1 1 1 10 11 15 1 8 6 1 1 2 1 6 13 1 3 1 1 6 11 15 3 5 9 12 1 1 14 2 15 15 Unidad de Investigacion Medica en Enfermedades Oncologicas, Hospital de Oncologia, Centro Medico Nacional Siglo XXI, Instituto Mexicano del Seguro Social (Mexican Institute for Social Security; IMSS), 2Centro de Investigacion Biomedica de Oriente IMSS, Metepec, Puebla, 3Centro de Investigacion Biomedica de Occidente IMSS, Guadalajara, Jalisco, 4Centro de Investigacion Biomedica del Noreste IMSS, Monterrey, Nuevo Leon, 5Centro de Prevencion del Cancer en la Mujer Rigoberta Menchú Tum, Col. Campo Nuevo, Las Choapas, Veracruz, 6Centro de Investigacion sobre Enfermedades Infecciosas, Instituto Nacional de Salud Pública, Secretaria de Salud (S.S.), Cuernavaca, Morelos, 7Division de Mejora a la Gestion de los Servicios de Salud IMSS, 8Departamento de Oncologia Ginecologica, UMAE Ginecologia del CMN de Occidente, Guadalajara, Jalisco, 9Hospital Regional de Alta Especialidad del Bajio, IMSS, Leon Guanajuato, Mexico; Departamento de Medicina y Nutricion, Division Ciencias de la Salud, Universidad de Guanajuato Campus Leon. Leon, Gto. 10Departamento de Radioterapia, Hospital de Oncologia, CMN SXXI-IMSS, 11Departamento de Patologia, Hospital de Oncologia, CMN SXXI-IMSS, 12Laboratorio Inmunobiologia-UMIEZ, FES-Zaragoza, UNAM, 13Departamento de Matematicas, Facultad de Ciencias, UNAM, 14Unidad de Apoyo a la Investigacion, Instituto Nacional de Rehabilitacion, S.S. 15Coordinacion de Investigacion en Salud, IMSS, Mexico *For correspondence: maosal89@yahoo.com 1 2 Archivos Médicos de Actualización en Tracto Genital Inferior Año VI, No. 12, Abril 2015 SECCIÓN 9 Hospital Civil de Guadalajara, Centro Universitario de Ciencias de la Salud (CUCS), Universidad de Guadalajara, Guadalajara, Jal. México Resumen Antecedentes: La relación etiológica entre la infección por el virus del papiloma humano (VPH) y el cáncer cervical (CaCu) es ampliamente aceptada. Nuestro objetivo fue determinar la prevalencia de los subtipos de VPH en mujeres mexicanas que se atienden en el Instituto Mexicano del Seguro Social de diferentes áreas de México. Materiales y métodos: Los ADN de 2.956 muestras cervicales fueron sometidos a prueba de genotipo del VPH: 1.020 muestras reportaron citología normal, 931 con lesiones escamosas intraepiteliales de bajo grado (LEIBG), 481 con alto grado (LEIAG), y 524 con cáncer cervicouterino (CaCu) . Resultados: La prevalencia total de VPH fue de 67.1%. Se encontraron un total de 40 subtipos de VPH; el VPH 16 se detectó en el 39,4% de las muestras positivas para el VPH, seguido de VPH 18 en el 7,5%, VPH 31 en el 7,1%, VPH 59 en el 4,9%, y VPH 58 en el 3,2%. El VPH 16 presentó la mayor prevalencia tanto en mujeres con citología alterada como normal, y el VPH 18 presentó una prevalencia menor, como se ha reportado en el resto del mundo. Se calculó la razón de prevalencia (RP) para los subtipos de VPH. El análisis de RP mostró que VPH 16 presenta la mayor asociación con el CaCu , y el VPH 31, 33, 45, 52 y 58 también demostraron una asociación elevada. Conclusiones: Los tipos de VPH de mayor prevalencia en muestras de cáncer de cuello uterino son 16, 18, 31, pero es importante tener en cuenta que se obtuvo una menor prevalencia de VPH 18 como se ha reportado en el resto del mundo, y que el VPH 58 y el 52 fueron genotipos con una prevalencia importante en las muestras de CaCu. La determinación de los genotipos del VPH es muy importante con el fin de evaluar el impacto de la introducción de vacunas y futuras estrategias de prevención del cáncer de cuello uterino. Resumen original: Human Papillomavirus Genotypes among Females in Mexico: a Study from the Mexican Institute for Social Security Abstract Background: The aetiological relationship between human papillomavirus (HPV) infection and cervical cancer (CC) is widely accepted. Our goal was to determine the prevalence of HPV types in Mexican women attending at the Mexican Institute for Social Security from different areas of Mexico. Materials and Methods: DNAs from 2,956 cervical samples were subjected to HPV genotyping: 1,020 samples with normal cytology, 931 with low-grade squamous intraepithelial lesions (LGSIL), 481 with high grade HGSIL and 524 CC. Results: Overall HPV prevalence was 67.1%. A total of 40 HPV types were found; HPV16 was detected in 39.4% of the HPV-positive samples followed by HPV18 at 7.5%, HPV31 at 7.1%, HPV59 at 4.9%, and HPV58 at 3.2%. HPV16 presented the highest prevalence both in women with altered or normal cytology and HPV 18 presented a minor prevalence as reported worldwide. The prevalence ratio (PR) was calculated for the HPV types. The analysis of PR showed that HPV16 presents the highest association with CC, HPV 31, 33, -45, -52 and -58 also demonstrating a high association. Conclusions: The most prevalent HPV types in cervical cancer samples were -16, -18, -31, but it is important to note that we obtained a minor prevalence of HPV18 as reported worldwide, and that HPV58 and -52 also were genotypes with an important prevalence in CC samples. Determination of HPV genotypes is very important in order to evaluate the impact of vaccine introduction and future cervical cancer prevention strategies. 3 Archivos Médicos de Actualización en Tracto Genital Inferior Año VI, No. 12 Abril 2015 Sección 10 Hospital Civil de Guadalajara, Fray Antonio Alcalde, Centro Universitario de Ciencias de la Salud, Universidad de Guadalajara. Guadalajara, Jalisco. México. Mirada Cultural APARICIÓN HISTÓRICA DE LOS CONDILOMAS GENITALES Y EL VPH Algunas investigaciones han reportado haber encontrado lesiones del Virus del Papiloma Humano en algunas momias de Egipto. (1) Las verrugas genitales eran una entidad reconocida ya en el antiguo mundo, descritos con precisión por griegos y romanos. Constituían una forma conocida de enfermedad venérea homo o heterosexual. El término condiloma acuminado, deriva del griego kondulos, que significa nudo y del latín acuminare, que significa puntiagudo. (2). Celso (siglo 1 dC) describe con precisión las verrugas del pene, que asocia claramente el desorden con el coito. (3). Los romanos llamaban "higos" a las lesiones condilomatosas perianales y las consideraban como un signo inequívoco de practicar relaciones receptivas anales. Términos alternativos fueron ficus y thymus (Butler y Stanbridge, 1984). (1) seres humanos con un filtrado Berkefeld de una suspensión de material verrugoso. (2) En 1924 Serra y col. repitieron sus experimentos usando un filtrado de las verrugas papilomatosas del cuero cabelludo y la zona suprapúbica. Seis de 18 inoculaciones en 3 voluntarios fueron positivos, todos ellos se producen en el dorso de la mano. Cuatro de estas inoculaciones positivas se observaron en el sujeto del que se tomó el material original. Las inoculaciones de la piel del pene y el cuero cabelludo fueron negativas. (1). 1 1 En los textos del siglo XV, eran considerados signos de sífilis, en el siglo XIX el condiloma se relacionó con la falta de higiene personal y de las secreciones vaginales; hacia finales del mismo siglo se describió la similitud histológica entre verrugas cutáneas y condilomas gigantes. (1) Jadassohn fue el primero en 1896 en establecer la naturaleza infecciosa de las verrugas. (2). En 1907 la etiología viral de las verrugas cutáneas fue puesta en evidencia por Ciuffo estableciéndose esta etiología de manera definitiva. (1) Sin embargo, el significado de estos hallazgos no fue apreciado ya que las verrugas son hiperplasias benignas y no tumores malignos. En 1919 Wile y Kingery consiguieron la producción de verrugas mediante la inoculación. intracutánea a Figura 1. Micrografía electrónica de un virus del papiloma humano teñido negativamente. Archivos Médicos de Actualización en Tracto Genital Inferior Año VI, No. 12 Abril 2015 Sección 10 Hospital Civil de Guadalajara, Fray Antonio Alcalde, Centro Universitario de Ciencias de la Salud, Universidad de Guadalajara. Guadalajara, Jalisco. México. Findlay (1930) comprobó que las verrugas venéreas o condilomas acuminados eran contagiosas, al parecer causado por un virus, y ocasionalmente podían volverse cancerosas. 1935 Stanley cristalizaba virus. (2) Más datos a favor de la etiología vírica fueron proporcionados por Strauss y cols. (1949), quienes documentaron la existencia de partículas cristalinas semejantes a virus que obtenían a partir de extractos acuosos de tejidos cutáneos verrugosos. Ayre (1949) fue el primero en observar los cambios citológicos celulares causados por el HPV y sugirió un nexo de unión con la neoplasia. El término “atipia koilocítica” fue introducido por Koss y Durfee (1956) quienes señalaban que estos patrones celulares se asociaban con el precáncer. (2) El virus del papiloma humano (VPH) no fue observado en el microscopio electrónico hasta 1949. (1) El posible potencial maligno de los condilomas acuminados vulvares fue establecido por Charlewood y Shippel (1953). 1954 Barret y cols. Documentaban la transmisión venérea de las verrugas genitales en varones que regresaban de la guerra de Corea que habían tenido relaciones sexuales con mujeres afectadas de condilomas. En los años 60 hubo un gran incremento de las infecciones por VPH, situación que persiste en la actualidad. (1) 1963 Dulbecco comprobaba que las células son transformadas por los virus. 1965 Von Melczer descubría acúmulos de partículas intranucleares e intracitoplasmáticas semejantes al papiloma virus humano en el material de verrugas genitales. Von Melczer (1965) descubrió partículas semejantes a papilomavirus humanos (HPV) en el material de verrugas genitales. (2) 1967 Baeferstedt asociaba las verrugas genitales con las prácticas homosexuales. Oriel y Almeida (1970) demostraron la presencia de partículas víricas en las verrugas genitales humanas. Se observó la similitud con las verrugas Figura 2. Imagen de microscopio electrónico de partículas de VPH. cutáneas corrientes pero no se encontró reactividad cruzada antigénica entre los dos tipos. 1971 Oriel hallaba una alta incidencia de contactos sexuales en las pacientes con verrugas genitales Meisels y Fortin (1976) describieron los cambios discarióticos en los frotis citológicos de cuello y vagina asociados con los condilomas acuminados. Observaron las típicas células con un halo perinuclear. Meissels y col. Y Syrjanen (1981) describieron la similitud entre las alteraciones epiteliales inducidas por el HPV y las de la neoplasia intraepitelial. (2) 2 El Center for Disease Control USA (1983) había señalado un 500% de incremento en la incidencia de verrugas genitales en los 15 años previos. (2) El virus de las verrugas se incluyo en la familia de los papovavirus. Se encontraron 4 tipos de HPV – tipo 6, 11, 16, 18- que eran responsables de casi todas las lesiones anogenitales por HPV (Gismann y cols. 1983; Ferenczy y col. 1985). Más evidencias sobre la asociación entre papilomavirus humano y cáncer cervical las proporcionaban la inmunoquímica, la hibridación del ADN y los estudios serológicos. (3). La Basílica de San Domenico Maggiore, que se remonta a principios del siglo 14, es una de las iglesias más grandes y más importantes de Nápoles, Italia. La sacristía monumental de la Basílica contiene, en una pasarela suspendida cerca de la bóveda, 2 Archivos Médicos de Actualización en Tracto Genital Inferior Año VI, No. 12 Abril 2015 Sección 10 Hospital Civil de Guadalajara, Fray Antonio Alcalde, Centro Universitario de Ciencias de la Salud, Universidad de Guadalajara. Guadalajara, Jalisco. México. 38 sarcófagos de madera con las momias de diez reyes aragoneses y otros nobles napolitanos que murieron en los siglos 15 y 16. El estudio de estas momias ha producido resultados importantes para Paleopatología, Paleovirología y Paleooncología. (3). María de Aragón (1503-1568) es un ejemplo típico de una noble renacentista, cuya belleza atrajo la admiración de los humanistas. Fue miembro del círculo literario de Ischia, fundada por el poeta renacentista Victor Colonna, amigo de Miguel Ángel. Su momia artificial (figura 3), mostrando dilatación asimétrica de las extremidades inferiores, debido a edema, reveló una goma sifilítica de la piel con treponemas típicos. Por lo tanto, decidimos evaluar la momia para otras enfermedades de transmisión sexual. (3) 3 Figura 3. A. Momia de María de Aragón (1568). (3). 3 Figura 3. B, C, D. La identificación de la infección por VPH en la momia de María de Aragón (1568). (2). (B) Tumores ramificados y pediculados de piel para vulvar derecha (aumento x 7). (C) Sección de tumor papilar, con pedúnculo y vasos dilatados (× 10). (D) Los productos de PCR a partir de ADN de VPH momia: carril 1 = producto de PCR de VPH de la muestra de la momia (141 pb); carril 2 = enriquecido PCR de HPV; carril 3 = control positivo; carril 4 = muestra en blanco. (3) Un examen más detallado reveló, en la región paravulvar derecha, una gran neoformación pediculada ramificada de la piel (alrededor de 3 × 12 mm), que se evaluaron microscópicamente después de la coloración tricrómica de Masson. La microscopia óptica indicó una lesión cutánea papilar exofítica con epidermis engrosada y tejido interno menos denso con vasos dilatados. Estas características macroscópicas e histológicas sugieren la presencia de verrugas anogenitales. Se utilizó el fragmento de ADN amplificado para hibridación directa, con oligonucleótidos de VPH 6, 11, 16, 18, 33, revelando la presencia de HPV 18, un virus con un alto potencial oncogénico. Para confirmar los resultados, los fragmentos amplificados fueron clonados y secuenciados. El diagnóstico de condiloma acuminado en paleopatología es importante porque el VPH 18 juega un papel importante en la patogenia de algunos cánceres epiteliales del tracto genital femenino y también porque este descubrimiento de VPH en una momia podría allanar el camino para una mayor investigación sobre la evolución secular de estos virus. (3). Archivos Médicos de Actualización en Tracto Genital Inferior Año VI, No. 12 Abril 2015 Sección 10 Hospital Civil de Guadalajara, Fray Antonio Alcalde, Centro Universitario de Ciencias de la Salud, Universidad de Guadalajara. Guadalajara, Jalisco. México. El descubrimiento galardonado del virus del papiloma humano que causa el cáncer de cuello de útero. En 1974 zur Hausen publicó su primer informe en el intento de encontrar ADN del VPH en el cáncer cervical y verrugas genitales biopsias por hibridación de ADN tumoral con cRNA obtenidos a partir de verruga plantar se purificó el ADN del VPH. Partículas de VPH habían sido detectados en las verrugas plantares mediante microscopia electrónica, y cRNA plantar fue utilizado como una sonda, dado que el VPH no podía ser propagado in vitro. La hibridación se logra posteriormente en biopsias de tales verrugas plantares y de verrugas vulgaris (verrugas de la piel), mientras que las biopsias de condiloma acuminado y cáncer de cuello uterino fueron consistentemente negativas. Dado que ni el tipo de tumor daba resultado positivo pese a la evidencia de las típicas partículas de VPH en las lesiones condilomas, se sospechaba heterogeneidad genética entre los virus de VPH. (4) Harald zur Hausen's y la teoría de la etiología del VPH para cáncer de cuello uterino fue apoyado por el trabajo más tarde por Meisels y Fortin, que había descrito células atípicas coilocítica como la manifestación de papiloma virus que induce un cambio citopático en la displasia cervical. La posterior identificación de partículas similares a virus del papiloma en tales las células por microscopía electrónica, dan mayor sosten a la idea. El equipo de Harald zur Hausen utilizó posteriormente el ADN purificado de partículas virales de diferentes verrugas plantares para generar sondas que permitieron la detección de distintos patrones de restricción de la enzima de escisión en HPV aislados de muchos pacientes. Esto condujo a la identificación de múltiples cepas de VPH 1-3. Otra cepa, HPV4 describió un año más tarde fue claramente diferente de los tres primeros aislamientos como la cadena hibrida ni al VPH 1-3 ni el ADN de condilomas acuminados o papiloma laringe, ejemplificando aún más la heterogeneidad entre los tipos de VPH. (4) 4 4 Ref. Red de Revistas Científicas de América Latina, el Caribe, España y Portugal, Sistema de Información Científica. (5). BIBLIOGRAFÍA 1. Baefverstedt B. Condyloma acuminate past and present. Acta dermatol Venerol 1967; 47: 376-38. 2. O’Dowd Michael J., Phillip Elliot E. The History of Obstetrics and Gynaecology. 1994:192, 193, 455. 3. Gino Fornaciari, Katia Zavaglia, Laura Giusti, Claudia Vultaggio, Rosalba Ciranni. Human papillomavirus in a 16th century mummy THE LANCET • Vol 362 • October 4, 2003 • www.thelancet.com 4. ld M. Pillsbury, M.D., Director, University of Pennsylvania School of Medicine, Philadelphia, Pennsylvania. Received for publication January 10, 1958. 5. Álvarez Aldana, Adalucy; Sepúlveda Arias, Juan Carlos; Siller López, Fernando. Carcinogénesis inducida por el virus del papiloma humano. Investigaciones Andina, vol. 14, núm. 24, abril-septiembre, 2012, pp. 438-456. Versión disponible en: www.redalyc.org Revisión: Ma. de Lourdes Aguilar Garay Archivos Médicos de Actualización en Tracto Genital Inferior Año VI, No. 12, Abril 2015 Sección 11 Hospital Civil de Guadalajara, Fray Antonio Alcalde, Centro Universitario de Ciencias de la Salud (CUCS), Universidad de Guadalajara. Guadalajara, Jal. México. NORMAS PARA AUTORES 1El texto deberá enviarse a través de internet, en Words a: amatgi@hcg.gob.mx; mlaguilar@hcg.gob.mx 2- La extensión máxima de los originales será de cuatro hojas (8 cuartillas - páginas), incluyendo figuras o cuadros. Letra Arial #11, interlineado 1.5, márgen normal. 3- Título del trabajo sin superar los 85 caracteres. Identificar los nombres de los autores, servicios o departamentos o institución (es) al que pertenece (n) y la dirección del primer autor. La identificación de los autores 1 2 3 4 deberá hacerse con números ( , , , ), o asteriscos (*, **, ***, ****) en superíndice. 4- Identificación de cada hoja de manuscrito, con número progresivo o iniciales. 5- Si desea enviar imágenes obtenidas mediante colposcopia, serán valoradas para utilización en la sección “Imagenología Colposcopica de un Experto” agregando el crédito de cada autor. a) Las imágenes deberán ser nítidas y rigurosamente: ORIGINALES. B) Cada Imagen colposcópica deberá de ir acompañada de un texto-viñeta con una breve descripción de la misma (máximo 100 palabras por imagen), c) siempre se agregara el crédito de cada autor. 6- Tipo de artículos: la revista publica información médica relacionada con el Tracto Genital Inferior, como: artículos originales, artículos de revisión, comunicación de casos, imágenes colposcopicas originales y cartas al editor. 7- Resumen: 250 palabras como máximo y deberá estar estructurado en antecedentes, material y método, resultados y conclusiones. Al final del resumen proporcionará de 3 a 10 palabras o frases clave en orden alfabético. En seguida se incluirá éste resumen (abstract) en inglés. 8- Texto: Los Artículos originales, se ordenan en secciones de la siguiente manera: página del título, resumen, abstract, introducción, material, método, resultados, discusión, referencias, cuadros, pies de figuras. a) Introducción. Exprese brevemente el propósito del artículo. Resuma el fundamento lógico del estudio u observación b) Material y Métodos. Describa claramente, de manera breve y ordenada c) Resultados. Preséntelos siguiendo una secuencia lógica. No repita en el texto los datos de los cuadros o figuras. d) Discusión. Insista en los aspectos nuevos e importantes del estudio. Establezca el nexo de las conclusiones con los objetivos del estudio. Proponga una hipótesis cuando haya justificación para ello. 9- Referencias. Numere las referencias consecutivamente siguiendo el orden de aparición en el texto (identifique las referencias en el texto clocando los números en superíndice y sin paréntesis. No debe utilizarse el término "comunicación personal. 10- Transmisión de los derechos de autor. Se incluirá un manuscrito adjunto, con la carta firmada por todos los autores conteniendo los siguientes párrafos: "El/los abajo firmante/s transfiere/n todos los derechos de autor a la revista que será propietaria de todo el material remitido para publicación". Esta cesión tendrá validez en el caso de que el trabajo sea publicado por la revista. No se podrá reproducir ningún material publicado en la revista sin autorización de los autores. 11- Utilizamos los siguientes “Niveles de Evidencia” Nivel de evidencia Tipo de estudio I Al menos un ensayo clínico controlado y aleatorizado diseñado de forma apropiada. II-1 Ensayos clínicos controlados bien diseñados, pero no aleatorizados. II-2 Estudios de cohortes o de casos y controles bien diseñados, preferentemente multicéntricos. II-3 Múltiples series comparadas en el tiempo, con o sin intervención, y resultados sorprendentes en experiencias no controladas. III Opiniones basadas en experiencias clínicas, estudios descriptivos, observaciones clínicas o informes de comités de expertos. U. S. Preventive Services Task Force (USPSTF) 12- La revista “Archivos Médicos de Actualización en Tracto Genital Inferior” se reserva el derecho de realizar cambios o introducir modificaciones en el estudio en aras de una mejor comprensión del mismo, sin que ello derive en un cambio de su contenido. 12- Toda correspondencia relacionada con trabajos que deseen ser publicados en ésta revista deberán dirigirse por vía electrónoca a: Dra. Ma. de Lourdes Aguilar Garay; amatgi@hcg.gob.mx; mlaguilar@hcg.gob.mx ; Tel, (33) 39 42 44 00 (41096), directo: (33) 36 40 14 82; (33) 36 42 49 77; La revista: “Archivos Médicos de Actualización en Tracto Genital Inferior”, es una publicación semestral en la especie de difusión vía computo, de distribución gratuita. The journal "Medical Records Update in Lower Genital Tract", is published twice a year in the kind of computing via diffusion of free distribution 1 Archivos Médicos de Actualización en Tracto Genital Inferior Año VI, No 12, Abril 2015 Hospital Civil de Guadalajara, Centro Universitario de Ciencias de la Salud (CUCS), Universidad de Guadalajara, Guadalajara, Jal. México Publicación 2014 COLPOSCOPIA, cómo y cuándo realizarla. El objetivo principal en la elaboración de ésta publicación, es la de ofrecer a los lectores una consulta ágil y consistente, acerca de la colposcopia, como el punto angular, central y general del texto. CONTENIDO PROLOGO José Antonio Ruíz Moreno CAP I. INTRODUCCIÓN AL ESTUDIO COLPOSCÓPICO Hans Hinselmann y la colposcopia, datos históricos. Aguilar Garay ML. Características de un colposcopio. Aguilar Garay ML. Indicadores y estándares de calidad en colposcopia. Aguilar, Cantón R. Cuando y a quien realizar un estudio colposcópico. Aguilar Garay ML. Nomenclatura y terminología colposcópica. Lúa Alvarado RA. Sensibilidad y especificidad en colposcopia. Vera Gaspar D. CAPÍTULO II. MORFOLOGÍA DEL TRACTO GENITAL INFERIOR Embriología del tracto genital inferior. Acosta Aguilar A. Anatomía y fisiología del cuello uterino. Aguilar Garay ML. Citología e histología del cuello uterino normal. Alonso de Ruíz P. Anatomía y fisiología de la vagina. Moreno VargasTH. Citología e histología de la vagina normal. Juárez López G. Anatomía y fisiología de la vulva. Ayala Castellanos MM. Citología e histología de la vulva normal. Cerda Camacho F. Identificación: Primera edición 2014 ISBN: 978-607-9274-8-5 220 páginas, pasta dura © 2014 Editorial Cuéllar Ayala Guadalajara, Jalisco, México Tel. 0133-31267959 Fax 0133-31265211 Contacto: francisco@cuellarayala.com.mx nuria@cuellarayala.com.mx www.cuellarayala.com Impreso en México/Printed in Mexico © Todos los derechos reservados. CAPÍTULO III. COMPRENSIÓN DEL ESTUDIO COLPOSCÓPICO Fundamentos del método colposcópico. Mello Isa M. Materiales para realizar una colposcopia. Aguilar Garay ML. Método para realizar una colposcopia. López Velázquez JL. Cómo evaluar los hallazgos colposcópicos. Aguilar Garay ML. El desarrollo de la colpofotografía y la videocolposcopía. -Cómo obtener las mejores imágenes colposcópicasSeidl Stefan. Como obtener la mejor biopsia del cuello uterino. Aguilar Garay ML. Zona de transformación normal. Chávez Chávez JP. Zona de transformación anormal. Guzmán Martínez RG. CAPÍTULO IV. HALLAZGOS COLPOSCÓPICOS Hallazgos colposcópicos en el cuello uterino Briseño Hanon H. Hallazgos colposcópicos en el endocervix. Dexeus S, Dexeus D. Hallazgos colposcópicos en la vagina. Ojeda O, Ojeda P, Anaya C. Hallazgos colposcópicos en la vulva. Guinto Balanzar JE. Hallazgos colposcópicos durante la adolescencia. Carrarach Tur M. Hallazgos colposcópicos durante el embarazo. Copolillo Páez EF. Hallazgos colposcópicos durante el climaterio. Aguilar Garay ML. Hallazgos colposcópicos después de una ataque sexual. Aguilar Garay. Hallazgos colposcópicos en el ano. Ojeda Ortíz J. Hallazgos colposcópicos en el hombre, androscopia. García Acevez SJ.









