Document
Anuncio

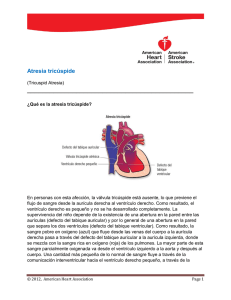
Página Inicial SCVC Area: English - Español - Português Evolución Histórica y Estado Actual del By Pass Total de Ventrículo Venoso (Operación de Fontan-Kreutzer) Dr. Christián Kreutzer, Dr. Guillermo Gallón Castrillón, Dr. Andrés Schlichter, Dr. Guillermo Kreutzer División de Cirugía Cardiovascular, Hospital de Niños Dr. Ricardo Gutiérrez, Buenos Aires, Argentina. INTRODUCCION La antigua concepción de Galeno acerca de la circulación sanguínea fue solo rectificada por el trabajo de Colombo y Harvey, quienes en pleno renacimiento y edad moderna, describieron el conocimiento actual de lo que entendemos por circulación pulmonar y sistémica (1). La característica fisiológica fundamental del corazón univentricular es que el ventrículo único se encuentra siempre sobrecargado, ya que siempre está a cargo de la circulación pulmonar y sistémica. La necesidad de tener una circulación pulmonar dependiente de un ventrículo no fue cuestionada hasta el siglo 20 cuando Rodbard (1) en 1948 realiza un by pass de ventrículo derecho en perros anastomosando la orejuela derecha a la arteria pulmonar ligada proximalmente. Este logro épico de la cirugía experimental dio el puntapié inicial a la introducción clínica de diversos procedimientos como la operación de Glenn (2), de Fontan (3) y de Kreutzer (4). A lo largo de las tres ultimas décadas se ha establecido que el objetivo final en el tratamiento de las cardiopatías univentriculares es la creación de un sistema hemodinámico en el cual el retorno venoso sistémico es derivado hacia las arterias pulmonares sin pasar por el ventrículo. De esta manera el ventrículo único funciona como una bomba aspirante y expelente y en su faz aspirante se encarga pasivamente la circulación pulmonar y en su faz expelente se dedica exclusivamente a la circulación sistémica. Sin lugar a dudas, para que este sistema hemodinámico funcione dos requisitos básicos se tiene que cumplir a rajatabla: Resistencias pulmonares bajas y presión de fin de diástole baja del Ventrículo sistémico. Cualquier causa que provoque un aumento de estas dos variables como un neumotórax o una arritmia traerá aparejada la disfunción del sistema con el aumento de la presión venosa central y la aparición de edemas periféricos. El largo camino del Fontan Kreutzer ha sido caracterizado por el desarrollo de diversas técnica para llevar el retorno venoso sistémico hacia las arterias pulmonares. El objetivo de este capítulo es repasar los últimos 30 años de historia de este procedimiento poniendo especial énfasis en los distintos abordajes quirúrgicos y en los desafíos actuales. 1968-1987. DEL CONCEPTO DE BOMBA AURICULAR O VENTRICULAR AL SISTEMA DE FLUJO VENOSO PASIVO En 1968 el Dr. Francis Fontan realiza en Burdeos, Francia una operación para "ventriculizar" la aurícula derecha en la atresia tricuspídea. (3) La operación consistía básicamente en la realización de un Glenn clásico con sección de rama derecha de la arteria pulmonar, la ligadura del tronco de la pulmonar el cierre de la comunicación interauricular, a anastomosis entre la orejuela derecha y el cabo proximal de la arteria pulmonar derecha, la implantación de un homoinjerto valvulado a nivel de esta anastomosis funcionando como válvula de salida atrial y la implantación de una válvula en la entrada de la cava inferior en la aurícula. (Fig. 1) Figura 1: Operación de Fontan. Ventricularización de la AD con válvula de entrada y de salida. Este procedimiento que ahora solo tiene un interés histórico, proponía la idea de que la aurícula derecha se incrementara la hipertrofia habitual en la atresia tricuspídea de manera tal en que se convirtiera en un ventrículo derecho. En definitiva, la idea era ventriculizar la aurícula derecha que funcionaría como la cámara de bombeo de la circulación pulmonar. En junio de 1971, (4,5) en el Hospital de Niños de Buenos Aires y sin tener conocimiento de la tarea del Dr. Fontan, se realiza por primera vez un by pass de ventriculo derecho pero con una idea fisiológica distinta. Nunca se pensó que la aurícula derecha se convertiría en ventrículo y en cambio se postulo que lo que haría circular la sangre a través de los pulmones era un adecuado gradiente entre la aurícula derecha y la izquierda. En los primeros casos, la operación consistió en realizar una conexión directa entre la orejuela derecha y la arteria pulmonar, mediante un homoinjerto o desinsertando la arteria pulmonar y llevándola hacia la orejuela derecha. En ambos casos se dejo una fenestración a nivel del septum interauricular de 6 mm de diámetro y no se coloco ninguna válvula al nivel de la vena cava inferior. (Fig. 2) Figura 2: Operación de Kreutzer. Anastomosis atriopulmonar anterior. Esta operación demostró tener un potencial problema, la posibilidad de compresión esternal de la anastomosis atriopulmonar, al quedar comrimida entre la aorta y el esternón obstruyendo de esta manera la conexión atriopulmonar. Ante esa complicación, en 1978 se decide realizar una anastomosis atriopulmonar posterior tan amplia como posible, pasando el tronco de la pulmonar por detrás de la aorta y hacia la derecha. (6,7) (Fig. 3) Figura 3: Operación de Kreutzer. Anastomosis atriopulmonar posterior. Tomado de Kreutzer GO, Vargas FJ, Schlichter AJ, Laura JP, Suarez JC, Coronel AR, Kreutzer EA. Atriopulmonary anastomosis. J Thorac Cardiovasc Surg. 1982 Mar;83(3) Pagina. 431 Fig 4. Este procedimiento conocido mundialmente como anastomosis atriopulmonar, fue adoptado mundialmente hasta mediados de la década del 80 y fue el primero en usar el concepto de flujo venoso pasivo hacia la arteria pulmonar en contraposición al concepto de la aurícula derecha o el ventrículo derecho rudimentario como cámara de bombeo pulmonar. Simultáneamente con estos avances, en 1975 el profesor Viking Bjork trabajando en el Instituto Karolinjska en Estocolmo, Suecia, describe un ingenioso procedimiento por el cual se realiza una anastomosis entre la aurícula derecha y el ventrículo derecho rudimentario en atresia tricuspídea. (8) Este procedimiento no debería llamarse by pass total de ventrículo derecho ya que en este caso el ventrículo derecho cumple alguna función de bombeo, pero se ha establecido en la literatura a lo largo del tiempo como una variante mas del by pass de ventrículo derecho. (Fig. 4). Figura 4: Operación de Bjork. Conexión avalvulada entre la AD y el VD. Tomado de Bjork VO, Olin CL, Bjarke BB, Thoren CA.Right atrial-right ventricular anastomosis for correction of tricuspid atresia. J Thorac Cardiovasc Surg. 1979 Mar;77(3) Pagina 455 figura 3 a. En 1976, Magdi Yacoub expande la indicación de estos procedimientos al ventrículo único con doble entrada persistiendo con la idea de ventriculizar la aurícula a lo Fontan colocando dos homoválvulas en la entrada y salida de la aurícula. (9) La mortalidad inicial de estos procedimientos estuvo alrededor del 10 y el 20 % en la mayoría de las series lo cual era una mortalidad muy aceptable para la década. (6,7,10) Para facilitar la selección de pacientes y mejorar la sobrevida en 1978 (11) Choussat publico sus criterios ideales para lograr una mayor sobrevida. 1. Edad entre 4 y 15 anos. 2. Ritmo sinusal. 3. Drenaje normal de venas cavas. 4. Volumen normal de AD. 5. Presión de AP menor de 15 mm de Hg. 6. Resistencia pulmonar menor a 4 u/m2. 7. Relación AP/Ao mayor de 0,75 con ramas pulmonares normales. 8. Función ventricular normal. 9. Sin Insuficiencia mitral. 10. Falta de efecto perjudicial de un shunt previo. Se desprende de estos criterios la necesidad de tener resistencias pulmonares bajas y función ventricular sistémica adecuada para el buen resultado postoperatorio. En el caso de la operación de Fontan original se observo una alta tasa de obstrucción de la conexión atriopulmonar. (40 % a los 15 años) (12) Asimismo, las tres operaciones (de Fontan, de Kreutzer y de Bjork)presentaron frecuentemente en el postoperatorio alejado dilatación severa de la aurícula derecha con posible compresión progresiva de las venas pulmonares derechas (13), trombo embolismo pulmonar, asociándose además a una alta tasa de taquiarritmias auriculares del tipo fibro aleteo por suturas y fibrosis de la pared auricular además de enteropatía perdedora de proteínas (14) por una presión portal elevada crónica. Las arritmias llevaban a los pacientes a un deterioro hemodinámico severo por la subida de la presión de fin de diástole del ventrículo sistémico y por consiguiente la de la aurícula izquierda y derecha y su tratamiento farmacológico no ofrecía grandes mejorías. (15,16,17,18). Por lo anteriormente descripto el uso de estas tres técnicas comenzó a ser cuestionado por su ineficacia hidrodinámica (19) y en ocasiones fue necesario convertir estos tipos de By pass total en versiones más modernas (13, 20, 21) o llevarlos al transplante cardiaco (22). 1987-1992 - OPTIMIZANDO EL FLUJO VENOSO PASIVO: LA ANASTOMOSIS CAVOPULMONAR TOTAL INTRACARDIACA Los estudio hidrodinámicos del grupo de Great Ormond Street Hospital en Londres a cargo del Dr. de Leval señalaron que la presencia de una cámara pre-anastomótica como la aurícula derecha producía una pérdida de energía cinética y postularon que la creación de un sistema de flujo laminar, produciría una mejoría hemodinámica en el sistema. Con este postulado como base diseñaron un nuevo procedimiento: la anastomosis cavopulmonar total. (23) (Fig. 5) Figura 5: Anastomosis cavopulmonar total. La operación consiste en la realización de dos anastomosis cavopulmonares (inferior y superior) y la creación de un túnel con un parche de poli tetra fluoro etileno expandido (PTFE) en el aspecto lateral de la aurícula derecha para derivar la sangre de la cava inferior a la arteria pulmonar. Este procedimiento prometía tener la ventaja teórica de mantener un flujo laminar y reducir la tasa de arritmias alejadas. Casi al mismo tiempo en el hospital de Niños de Boston, el Dr. Aldo Castañeda propone una anastomosis cavopulmonar total similar (24) con una fenestración utilizando el mismo concepto que nuestro grupo había utilizado en el primer paciente en 1971. Esta fenestración de 4 mm a nivel del parche logra bajar la morbi-mortalidad asociada a este procedimiento al bajar la presión en la Aurícula derecha a expensas de una leve insaturación sistémica. Esta operación se denominó entonces anastomosis cavopulmonar total fenestrada (25) Desde el primer momento esta técnica fue cuestionada por diferentes autores como el Dr. Guillermo Kreutzer, quien en el primer Congreso Mundial de Cirugía Cardíaca Pediátrica en 1988 en Bergamo, Italia, y por el Profesor Richard Van Praagh debido a que el área del orificio de la vena cava superior en su entrada a la aurícula derecha es siempre mas pequeña que el de la cava inferior por lo que la conexión quedaría estenótica. (26) A pesar del entusiasmo original y de ser adoptada por los principales centros del mundo, la técnica demostró una incidencia de taquiarritmias similar a la de los procedimientos pioneros (27) además de un 20 % de lesión del nódulo sinusal definitiva en el postoperatorio inmediato debido a la sutura circunferencial sobre el orificio de la vena cava superior en la entrada a la aurícula derecha sobre el área del nódulo sinusal. Este tipo de lesión no sorprende pues la línea de sutura es similar a la de la técnica de Mustard para la corrección atrial de la Transposición de grandes arterias. Además, cuando se la realiza una anastomosis cavopulmonar después de realizar un Glenn bidireccional, el orificio de la cava superior queda reducido a un muñón con la consecuente dificultad para preservar el nódulo sinusal y su arteria. (27,28) El uso de material protésico en un flujo venoso predispone a la trombosis por lo que la gran mayoría de estos pacientes necesitan estar anticoagulados de por vida (29) 1992-2001 DE ADENTRO HACIA FUERA: LA ANASTOMOSIS CAVOPULMONAR TOTAL EXTRACARDIACA En 1990, el Dr. Carlo Marcelletti del Ospedale Bambino Gesú de Roma propone un nuevo procedimiento con especial énfasis en la prevención de las taquiarritmias auriculares. (30,31) El fundamento de esta técnica consiste en dejar un corazón bicameral con las dos aurículas funcionado como única en un sistema de baja presión sin distensión auricular y sin suturas auriculares que según estudios de electrofisiología han demostrado ser substrato para el desarrollo de taquiarritmias auriculares. (32-38) La técnica consiste en realizar una anastomosis cavopulmonar total utilizando un conducto protésico para derivar el retorno venoso de la cava inferior hacia la cara inferior de la rama derecha de la arteria pulmonar. El flujo de la vena cava superior se deriva a la arteria pulmonar derecha a través de un Glenn Bidireccional. (Fig. 6) Figura 6: By pass total con conducto extracardíaco. Tomado de Marcelletti C, Corno A, Giannico S, Marino B. Inferior vena cavapulmonary artery extracardiac conduit: a new form of right heart bypass. J Thorac Cardiovasc Surg 1990;100. Pagina 231 Figura 2. Para evitar la trombosis del conducto protésico de debe anticoagular a estos pacientes al menos durante un ano post operación. En el hospital de Niños de Buenos Aires hemos adoptado esta técnica desde el año 1997 para la realización del By pass total de VD en todas las circunstancias. La operación se realiza sin clampeo aórtico y en nuestra experiencia con canulación de la vena femoral para permitir una anastomosis entre el tubo de PTFE de 20 mm de diámetro tan precisa como posible en el aspecto inferior. Este procedimiento ha demostrado resultados intermedios y alejados verdaderamente prometedores(31,39) con una incidencia de arritmias alejadas de solo el 10 % y es el procedimiento de elección en este momento en la mayoría de los centros del mundo. Además ha demostrado ser hemodinámicamente superior a la anastomosis cavopulmonar total intracardíaca en estudios hidrodinámicos diseñados por del Nido y colaboradores. (40) ESTADO ACTUAL La sobrevida y la calidad de vida del paciente con ventrículo único comienzan a ser determinada en el momento del nacimiento. El diagnóstico y tratamiento precoz son fundamentales para proteger a los pulmones de la hipertensión pulmonar y al ventrículo de la miocardiopatía asociada a la sobrecarga de presión y volumen. En los últimos 30 años, el abordaje tradicional del paciente con ventrículo único anatómico o funcional, ha sido la creación de un sistema de by pass del VD cuando las resistencias pulmonares y la función ventricular sean adecuadas. La comprensión de la naturaleza paliativa de los procedimientos aplicables a la patología univentricular nos ha hecho poner como objetivo final en el tratamiento de estas anomalías, la mejor tasa de sobrevida con la mejor calidad de vida. Se puede decir que hay consenso mundial en desarrollar la paliación de estas anomalías en tres etapas con la meta del by pass total: 1. Recién Nacido o lactante menor de 6 meses. Regular el flujo pulmonar y sistémico: Es inherente a la patología univentricular la sobrecarga de volumen ya que un solo ventrículo maneja la circulación pulmonar y sistémica. Por lo tanto del balance del Qp y el Qs dependerá la aparición de insuficiencia cardíaca o cianosis. Cuanto menos cianosis exista mayor sobrecarga de volumen e hipertensión pulmonar habrá, por lo tanto es necesario en esta etapa asegurar un flujo sistémico libre y regular el flujo pulmonar. Para esto se indicaran una anastomosis subclavio pulmonar o un cerclaje de arteria pulmonar o en el caso de obstrucción sistémica anatómica una operación de Norwood. (41) El objetivo es llevar al paciente a un Qp/Qs de 2 lo que es compatible con una saturación de 80 %. La sobrecarga continua y la cianosis también pero a un grado tolerable permitiendo un adecuado desarrollo. 2. Mayores de 6 meses a 2 años: Si los pacientes presentan resistencias pulmonares bajas se indica un Glenn bidireccional, comenzando de esta manera el camino del by pass de ventrículo venoso pues después del Glenn el ventrículo único no maneja mas el Qp y solo maneja el Qs. La saturación aumenta a 82-86 % y la relación Qp/Qs pasa a ser de 0,6 a 1 pues en el lactante o niño pequeño el retorno venoso de la cava superior es mayor al 50 % del retorno venoso total. Se puede dejar un flujo pulmonar accesorio como una anastomosis subclavio pulmonar o una tracto de salida pulmonar estenótico. Este flujo accesorio tiene la ventaja de disminuir la cianosis pero al costo de mayor sobrecarga de volumen. Puede estar especialmente indicado cuando al momento del Glenn se debe realizar plástica de rama. 3. A partir de los 2 años: By pass total con conducto extracardíaco o anastomosis cavopulmonar total: Siempre que existan resistencias pulmonares bajas y función ventricular adecuada. Además es el momento de revisar la función de la válvula aurículo ventricular pues es crucial en el postoperatorio del by pass total que no exista insuficiencia y en caso exista será menester realizar plástica o reemplazo valvular cuando la plástica no da resultado satisfactorio. Se desprende de lo anterior que esto representa un factor de riesgo adicional y que además requiere clampeo aórtico. Como se desprende de lo anteriormente escrito el camino del By pass del VV ha sido largo, y como todo aquello que en la medicina demuestra tener un camino tortuoso, es por que aun no ha encontrado su perfecta ubicación en el firmamento de procedimientos paliativos para el ventrículo único. Decimos paliativos, a pesar de que hace 30 años llamábamos correctores, quizá imbuidos de un optimismo pionero. Son paliativos porque a pesar de un funcionamiento ideal estos pacientes siempre van a tener que tomar medicación cardiológica y tendrán una capacidad limitada ante el ejercicio aeróbico. El camino ha sido largo y las complicaciones que han demostrado estos procedimientos nos han llevado al perfeccionamiento de la técnica del By pass Total y a descubrir en que nos habíamos equivocado. Es el momento de empezar a pensar en una técnica ideal que tendría que cumplir los siguientes requisitos. 1. Tener las cavidades cardiacas sin sobrecarga de presión o volumen. 2. No tener suturas en la aurícula derecha para evitar las arritmias. 3. Mantener un flujo laminar sin perdida de energía 4. Ser biocompatible y acompañar el crecimiento somático. 5. Mantener una distribución del flujo pulmonar homogénea a los dos pulmones. 6. Mantener las aurículas a presiones bajas para evitar la hipertrofia, agrandamiento y fibrosis auricular con el consiguiente desarrollo de taquiarritmias. 7. Mantener el retorno venoso coronario a presiones bajas. 8. Mantener una presión venosa central inferior a 12 mm de Hg. De lo anterior se desprende que el by pass total con conducto extracardíaco es la técnica que cumple con la mayor cantidad de requisitos en nuestro días. El futuro de la ingeniería tisular nos podrá proveer de conductos con posibilidad de crecimiento, o la ingeniería electrónica y mecánica de una bomba para reemplazar al VV con función acorde a las necesidades del paciente, pero el concepto hemodinámico de la separación de la circulación pulmonar y sistémica difícilmente sea abandonado, pues no hace mas que imitar a la circulación normal. También llega el momento de clarificar otras áreas en las cuales todos tenemos dudas. Los momentos de indicar un Glenn o un By pass Total. ¿Cuándo es el momento ideal? (42) La gran mayoría de los autores coincide en afirmar que es a partir de los 6 meses para el primero y de los 2/3 años para el segundo. La anastomosis de Glenn en general tiene tendencia a la desfuncionalización por la aparición de colaterales veno venosas y fístulas arteriovenosas de pulmón. Por lo tanto el by pass total debe ser indicado dos a tres anos después del Glenn. El by pass total nació como un procedimiento para corregir la Atresia tricuspídea con CIV pequeña y/o estenosis pulmonar, o sea para paliar aun paciente ideal con un ventrículo único del tipo izquierdo, con una válvula AV del tipo mitral y pulmones con resistencias bajas. El trabajo pionero de Yacoub (9) nos llevo a expandir estas indicaciones, a entidades mucho mas desfavorables. A medida en que vamos expandiendo las indicaciones a entidades mas complejas, sobre todo con ventrículo único de tipo derecho como sistémico, como la hipoplasia de corazón izquierdo, o las heterotaxias viscerales con ventrículo único, encontramos pacientes que necesitan el by pass total con anticipación. Por que sus ventrículos únicos derechos y sus válvulas AV no toleran la sobrecarga volumétrica asociada a las paliaciones sistémico pulmonares dilatando el ventrículo y desarrollando insuficiencia severa de la válvula AV. La introducción del By pass total en el campo de cirugía cardíaca revoluciono el cuidado de los pacientes con fisiología univentricular. Los resultados alejados en términos de funcionalidad demuestran la superioridad del by pass total con relación a los las paliaciones sistémico pulmonares o la operación de Glenn. La mejoría es dramática permitiéndole a la gran mayoría de los pacientes percibir su estado como bueno y estar en la categoría de insuficiencia cardiaca (NYHA) 1 o 2 e integrarse a la sociedad de la manera mas provechosa. (43) Debemos pensar también que muchas de las complicaciones postoperatorias alejadas de estos pacientes como las arritmias pueden ser disminuidas con la incorporación de las nuevas técnicas como el conducto extracardíaco. Sin embargo es de esperar que existan problemas no inherentes a la técnica sino a la naturaleza paliativa del sistema. Estos problemas deben ser comentados previamente a la realización del by pass total a los familiares o al paciente y los mas importantes a nuestro criterio son: 1. Dieta hipo sódica de por vida 2. Dificultad de llevar adelante un embarazo normal. 3. Anticoagulación de por vida. (en conductos extracardíacos y en megaaurículas de las antiguas atriopulmonares. 4. Medicación cardiológica de por vida en un alto porcentaje de sobrevivientes. Sin embargo, aun hoy nos emocionamos al ver regresar a nuestros consultorios a niños convertidos en adultos y al ver que a pesar del enorme handicap de tener un solo ventrículo han podido desarrollarse a niveles que décadas atrás hubiéramos considerado imposible. El desafío de hoy es tratar a los recién nacidos, adultos del mañana, protegiéndolos de la hipertensión pulmonar y de la miocardiopatía y llevarlos a una calidad y cantidad de vida máxima. REFERENCIAS 1. Castañeda AR. From Glenn to Fontan. A continuing evolution. Circulation 1992 Nov;86(5 Suppl):II80-4. 2. Circulatory bypass of the right side of the heart: shunt between superior vena cava and distal right pulmonaryartery-report of clinical application. N Engl J Med 1958;259:117-20. 3. Fontan F, Baudet E. Surgical repair of tricuspid atresia. Thorax. 1971 May;26(3):240-8 4. Kreutzer G, Una operación para la corrección de la atresia tricuspídea. Presentado en la Quinta reunion cientifica de la Sociedad Argentina de Cardiologia. Agosto, 1971 5. Kreutzer G, Galindez E, Bono H, De Palma C, Laura JP. An operation for the correction of tricuspid atresia. J Thorac Cardiovasc Surg. 1973 Oct;66(4):613-21 6. Kreutzer G, Schlichter A, Laura JP, Suarez JC, Vargas JF.Univentricular heart with low pulmonary vascular resistances: septation vs atriopulmonary anastomosis. Arq Bras Cardiol. 1981 Oct;37(4):301-7. 7. Kreutzer GO, Vargas FJ, Schlichter AJ, Laura JP, Suarez JC, Coronel AR, Kreutzer EA. Atriopulmonary anastomosis. J Thorac Cardiovasc Surg. 1982 Mar;83(3):427-36. 8. Bjork VO, Olin CL, Bjarke BB, Thoren CA.Right atrial-right ventricular anastomosis for correction of tricuspid atresia. J Thorac Cardiovasc Surg. 1979 Mar;77(3):452-8. 9. Yacoub M, Ahmed M, Radley-Smith R.Proceedings: Use of right atrium to pulmonary artery valved conduit for 'correction' of single ventricle of hypoplastic right heart syndrome. Br Heart J. 1975 Jul;37(7):782. 10. Fontan F, Deville C, Quaegebeur J, Ottenkamp J, Sourdille N, Choussat A, Brom GA.Repair of tricuspid atresia in 100 patients. J Thorac Cardiovasc Surg. 1983 May;85(5):647-60 11. Choussat A, Fontan F, Besse P, Vallot F, Chauve A, Bricand H. Selection crioteria for Fontan's procedure. In RH Anderson, EA Shinebourn: Pediatric Cardiology 1977. Edinburgh: Churchill Livingstone, 1978. Chap. 64. 12. Fernandez G, Costa F, Fontan F, Naftel DC, Blackstone EH, Kirklin JW. Prevalence of reoperation for pathway obstruction after Fontan operation. Ann Thorac Surg. 1989 Nov;48(5):654-9. 13. Kreutzer J, Keane JF, Lock JE, Walsh EP, Jonas RA, Castaneda AR, Mayer JE Jr.Conversion of modified Fontan procedure to lateral atrial tunnel cavopulmonary anastomosis. J Thorac Cardiovasc Surg. 1996 Jun;111(6):1169-76 14. Feldt RH, Driscoll DJ, Offord KP, et al. Protein-losing enteropathy after the Fontan operation. J Thorac Cardiovasc Surg 1996;112:672-80. 15. Knott-Craig CJ, Danielson GK, Schaff HV, Puga FJ, Weaver AL, Driscoll DD. The modified Fontan operation: an analysis of risk factors for early postoperative death or takedown in 702 consecutive patients from one institution. J Thorac Cardiovasc Surg 1995;109:1237-43. 16. Gentles TL, Gauvreau K, Mayer JE Jr, Fishberger SB, Burnett J, Colan SD, Newburger JW, Wernovsky G. Functional outcome after the Fontan operation: factors influencing late morbidity.J Thorac Cardiovasc Surg. 1997 Sep;114(3):392-403; discussion 404-5. 17. Gentles TL, Mayer JE Jr, Gauvreau K, Newburger JW, Lock JE, Kupferschmid JP, Burnett J, Jonas RA, Castaneda AR, Wernovsky G. Fontan operation in five hundred consecutive patients: factors influencing early and late outcome. J Thorac Cardiovasc Surg. 1997 Sep;114(3):376-91. 18. Fishberger SB, Wernovsky G, Gentles TL, Gauvreau K, Burnett J, Mayer JE Jr, Walsh EP. Factors that influence the development of atrial flutter after the Fontan operation. J Thorac Cardiovasc Surg. 1997 Jan;113(1):80-6. 19. Lardo A, Webber S, Iyengar A, del Nido PJ, Friehs I, Cape EG. Bidirectional superior cavopulmonary anastomosis improves mechanical efficiency in dilated atriopulmonary connections Journal of Thoracic and Cardiovascular Surgery October 1999, Volume 118, Number 4, p681 to p691 20. Marcelletti CF, Hanley FL, Mavroudis C, McElhinney DB, Abella RF, Marianeschi SM, Seddio F, Reddy VM, Petrossian E, de la Torre T, Colagrande L, Backer CL, Cipriani A, Iorio FS, Fontan F.Revision of previous Fontan connections to total extracardiac cavopulmonary anastomosis: A multicenter experience. J Thorac Cardiovasc Surg. 2000 Feb;119(2):340-6. 21. Mavroudis C, Backer CL, Deal BJ, Johnsrude CL.Fontan conversion to cavopulmonary connection and arrhythmia circuit cryoblation. J Thorac Cardiovasc Surg. 1998 Mar;115(3):547-56. 22. Carey JA, Hamilton JR, Hilton CJ, Dark JH, Forty J, Parry G, Hasan A. Orthotopic cardiac transplantation for the failing Fontan circulation. Eur J Cardiothorac Surg 1998 Jul;14(1):7-13; discussion 13-4 23. de Leval MR, Kilner P, Gewillig M, Bull C.Total cavopulmonary connection: a logical alternative to atriopulmonary connection for complex Fontan operations. Experimental studies and early clinical experience. J Thorac Cardiovasc Surg. 1988 Nov;96(5):682-95. 24. Jonas RA, Castaneda AR.Modified Fontan procedure: atrial baffle and systemic venous to pulmonary artery anastomotic techniques. J Card Surg. 1988 Jun;3(2):91-6 25. Mayer JE Jr, Bridges ND, Lock JE, Hanley FL, Jonas RA, Castaneda AR.Factors associated with marked reduction in mortality for Fontan operations in patients with single ventricle. J Thorac Cardiovasc Surg. 1992 Mar;103(3):444-51; discussion 45126. Kiaffas MG, Van Praagh R, Hanioti C, Green DW. The modified Fontan procedure: morphometry and surgical implications. Ann Thorac Surg 1999 Jun;67(6):1746-53 27. Manning PB, Mayer JE Jr, Wernovsky G, Fishberger SB, Walsh EP. Staged operation to Fontan increases the incidence of sinoatrial node dysfunction. J Thorac Cardiovasc Surg. 1996 Apr;111(4):833-9; discussion 839-40 28. Durongpisitkul K, Porter CJ, Cetta F, Offord KP, Slezak JM, Puga FJ, Schaff HV, Danielson GK, Driscoll DJ. Predictors of early- and late-onset supraventricular tachyarrhythmias after Fontan operation. Circulation. 1998 Sep 15;98(11):1099-107. 29. Jonas RA. Editorial: Intracardiac thrombosis after the Fontan procedure Journal of Thoracic and Cardiovascular Surgery. November 1995, Volume 110, Number 5, p1502 to p1503 30. Marcelletti C, Corno A, Giannico S, Marino B. Inferior vena cava-pulmonary artery extracardiac conduit: a new form of right heart bypass. J Thorac Cardiovasc Surg 1990;100:228-32 31. Amodeo A, Galletti L, Marianeschi S, Picardo S, Giannico S, Di Renzi P, Marcelletti C. Extracardiac Fontan operation for complex cardiac anomalies: seven years' experience. J Thorac Cardiovasc Surg. 1997 Dec;114(6):1020-30; discussion 10301. 32. Bromberg BI, Schuessler RB, Gandhi SK, Rodefeld MD, Boineau JP, Huddleston CB. A canine model of atrial flutter following the intra-atrial lateral tunnel Fontan operation. J Electrocardiol. 1998;30 Suppl:85-93. 33. Gandhi SK, Bromberg BI, Rodefeld MD, Schuessler RB, Boineau JP, Cox JL, Huddleston CB.Spontaneous atrial flutter in a chronic canine model of the modified Fontan operation. J Am Coll Cardiol. 1997 Oct;30(4):1095-103. 34. Rodefeld MD, Gandhi SK, Huddleston CB, Turken BJ, Schuessler RB, Boineau JP, Cox JL, Bromberg BI.Anatomically based ablation of atrial flutter in an acute canine model of the modified Fontan operation. J Thorac Cardiovasc Surg. 1996 Oct;112 (4):898-907. 35. Gandhi SK, Bromberg BI, Schuessler RB, Turken BJ, Boineau JP, Cox JL, Huddleston CB.Characterization and surgical ablation of atrial flutter after the classic Fontan repair. Ann Thorac Surg. 1996 Jun;61(6):1666-78; discussion 1678-9. 36. Gandhi SK, Bromberg BI, Huddleston CB.Surgical technique and atrial arrhythmias after total cavopulmonary connection. J Thorac Cardiovasc Surg. 1996 Jun;111(6):1291-2. 37. Gandhi SK, Bromberg BI, Rodefeld MD, Schuessler RB, Boineau JP, Cox JL, Huddleston CB. Lateral tunnel suture line variation reduces atrial flutter after the modified Fontan operation. Ann Thorac Surg. 1996 May;61(5):1299-309. 38. Rodefeld MD, Bromberg BI, Schuessler RB, Boineau JP, Cox JL, Huddleston CB.Atrial flutter after lateral tunnel construction in the modified Fontan operation: a canine model. J Thorac Cardiovasc Surg. 1996 Mar;111(3):514-26 39. Petrossian E, Reddy VM, McElhinney DB, Akkersdijk GP, Moore P, Parry AJ, Thompson LD, Hanley FL. Early results of the extracardiac conduit Fontan operation. J Thorac Cardiovasc Surg. 1999 Apr;117(4):688-96 40. Lardo AC, Webber SA, Friehs I, del Nido PJ, Cape EG. Fluid dynamic comparison of intra-atrial and extracardiac total cavopulmonary connections. J Thorac Cardiovasc Surg. 1999 Apr;117(4):697-704 41. Daebritz SH, Nollert GD, Zurakowski D, Khalil PN, Lang P, del Nido PJ, Mayer JE Jr, Jonas RA. Results of Norwood stage I operation: comparison of hypoplastic left heart syndrome with other malformations. J Thorac Cardiovasc Surg. 2000 Feb;119 (2):358-67 42. Jonas, RA. Indications and timing for the bidirectional Glenn shunt versus the fenestrated Fontan circulation. Journal of Thoracic and Cardiovascular Surgery. September 1994, Volume 108, Number 3, p522 to p524 43. Wernovsky G, Stiles KM, Gauvreau K, Gentles TL, duPlessis AJ, Bellinger DC, Walsh AZ, Burnett J, Jonas RA, Mayer JE Jr, Newburger JW. Cognitive development after the Fontan operation.Circulation. 2000 Aug 22;102(8):883-9 Arriba Preguntas, aportes y comentarios serán respondidos por el conferencista o por expertos en el tema a través de la lista Cardiología Pedíatrica. Llene los campos del formulario (en español, portugués o inglés) y oprima el botón "Enviar". Preguntas, aportes o comentarios: Nombre y apellido: País: Argentina Dirección de E-Mail: @ Enviar Borrar Arriba 2do Congreso Virtual de Cardiología Dr. Florencio Garófalo Dr. Raúl Bretal Dr. Armando Pacher Presidente Comité Organizador Presidente Comité Científico Presidente Comité Técnico - CETIFAC fgaro@fac.org.ar fgaro@satlink.com rbretal@fac.org.ar rbretal@netverk.com.ar apacher@fac.org.ar apacher@satlink.com Copyright © 1999-2001 Federación Argentina de Cardiología Todos los derechos reservados Esta empresa colaboró para la realización del Congreso