Document
Anuncio
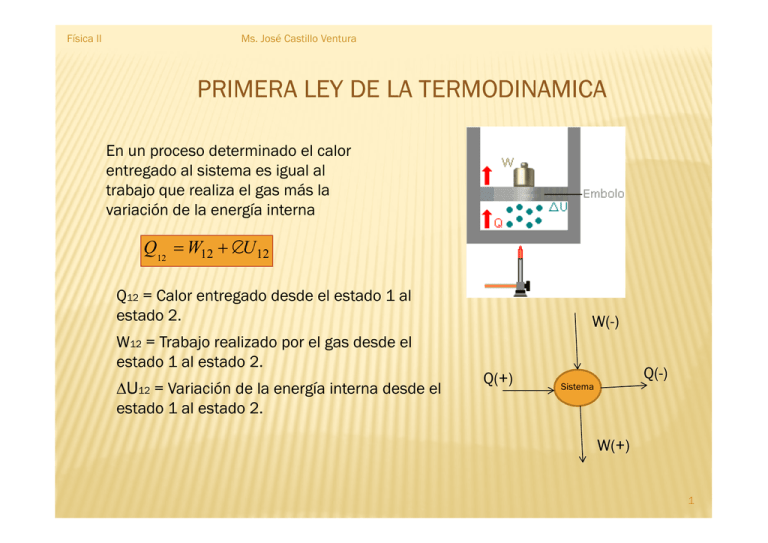
Física II Ms. José Castillo Ventura PRIMERA LEY DE LA TERMODINAMICA En un proceso determinado el calor entregado al sistema es igual al trabajo que realiza el gas más la variación de la energía interna Q12 = W12 + ∆U12 Q12 = Calor entregado desde el estado 1 al estado 2. W(-) W12 = Trabajo realizado por el gas desde el estado 1 al estado 2. ∆U12 = Variación de la energía interna desde el estado 1 al estado 2. Q(+) Q(-) Sistema W(+) 1 Física II Ms. José Castillo Ventura PROCESOS TERMODINÁMICOS I)PROCESOS ISOBÁRICO Es aquel proceso termodinámico en el cual la presión permanece constante (P= cte) . Esta situación se logra cuando se aplica al émbolo una presión externa constante. El estado del gas se modifica si se calienta Cálculo del calor Es el calor entregado para que el gas varíe de estado. Q = C p m(∆T ) Cálculo del trabajo W = F ∆X 2 Física II Ms. José Castillo Ventura W = P. A.∆x W = PA( x f − xi ) W = P(V f − V0 ) Cálculo de la variación de la energía interna Aplicando la primera ley de la termodinámica ∆U = Q − W Ley de Charles El volumen de un gas es directamente proporcional a su temperatura absoluta cuando su presión permanece constante Gráficos relacionados al trabajo 3 Física II Ms. José Castillo Ventura 4 Física II Ms. José Castillo Ventura II)PROCESO ISOTÉRMICO Es aquel proceso termodinámico en el cual la temperatura permanece constante (T= cte) . Cálculo del trabajo V2 W = p1 V1 ln ó V1 V2 W = 2,30 p1 V1 log V1 Cálculo de la variación de la energía interna Como la temperatura permanece constante, entonces ésta no varía y la energía interna tampoco. ∆U = 0 Cálculo del calor entregado ∆U = Q − W ⇒ Q = W 5 Física II Ms. José Castillo Ventura Ley de Boyle Mariotte El volumen de un gas es inversamente proporcional a su presión cuando su temperatura permanece constante 6 Física II Ms. José Castillo Ventura III)PROCESO ISOCÓRICO Es aquel proceso termodinámico en el cual al incrementarse una cantidad de calor, el volumen permanece constante . Cálculo del trabajo Como no existe desplazamiento, entonces el trabajo realizado por el gas es nulo. W =0 Cálculo de la variación de la energía interna ∆U = Q Cálculo del calor entregado Q = CV m∆T 7 Física II Ms. José Castillo Ventura Ley de Gay Lussac La presión de un gas es directamente proporcional a su temperatura absoluta, cuando el volumen permanece constante. 8 Física II Ms. José Castillo Ventura Proceso Adiabático Es un proceso termodinámico en el cual el sistema pasa de un estado inicial a otro final, sin que ingrese ni salga calor del sistema.(Q=0). Proceso en el cual se aprovecha la energía interna acumulada por el gas para lograra la expansión o compresión del mismo. Para la compresión el gas se comprime solo y aumenta la temperatura. Para la expansión la temperatura del gas disminuye. Cálculo del calor Q=0 Cálculo de la variación de la energía interna ∆U = Q − W ⇒ ∆U = −W Cálculo del trabajo P V − P1V1 W= 2 2 , 1− γ c γ = P = cte cV Para un gas monoatómico: γ= 1,67 diatómico : γ= 1,4 poliatómico : k≠ cte 9 Física II Ms. José Castillo Ventura Relación entre presión y volumen P1V1γ = P2V 2γ T1V1γ −1 = T2V 2γ −1 Para gases reales PV = n R T n = Número de moles contenidos en un gas R = Cte. universal de los gases cal mol K Joule R = 8,31 mol K lt atm R = 0,08207 mol R = 1,986 Factor de conversión : x( atm − lt ) x 24,2 cal = y cal atm lt 10 Física II Ms. José Castillo Ventura PROCESOS TERMODINÁMICOS PROCESO ∆U Q W LEY P= cte. ISOBÁRICO Charles T= cte ISOTÉRMICO Boyle-Mariotte V= Cte ISOCÓRICO 0 W Gay-Lussac Q 0 ADIABÁTICO -W 0 11 Física II Ms. José Castillo Ventura SEGUNDA LEY DE LA TERMODINÁMICA “Es imposible construir un dispositivo que pueda, sin ningún otro, transferir calor desde un objeto frío hasta otro más caliente” Esta ley implica: a) El calor fluye espontáneamente de los cuerpos calientes a los cuerpos fríos. b) Se puede lograr que el calor fluya de un cuerpo frío a otro caliente, pero para ello es necesario realizar trabajo. c) Una máquina térmica es un dispositivo que permite transformar la energía calorífica en mecánica. El rendimiento de una máquina térmica no puede ser nunca del 100%. 12 Física II Ms. José Castillo Ventura Ciclo de Carnot a) Expansión isotérmica (a→b). El gas recibe una cantidad de calor Q1 y se expande a una temperatura constante T1, la máquina realiza el trabajo W1. b) Expansión adiabática (b→c). El gas continúa expandiéndose pero sin ingreso ni salida de calor, tal que la temperatura disminuye a T2. c)Compresión isotérmica (c→d). El gas es comprimido manteniendo su temperatura constante, tal que expulsa una cantidad de calor Q2. d)Compresión adiabática (d→e). Se realiza una compresión tal que no entra ni sale calor y al final queda a la temperatura T1 . 13 Física II Ms. José Castillo Ventura 14 Física II Ms. José Castillo Ventura A los dispositivos que operan según este ciclo se denominan máquina de carnot, si el recorrido fuese en sentido contrario se tendría el refrigerador de carnot. Rendimiento o eficiencia (η). Se le define como: Q1 −Q2 η= Q1 ó T1 −T2 η= T1 T1=Temperatura de la fuente caliente (K) T2=Temperatura de la fuente fría (K) 15








