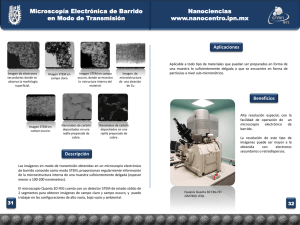
TRASPLANTE CELULAR EN LA ENFERMEDAD ARTERIAL
Anuncio

TRASPLANTE CELULAR EN LA ENFERMEDAD ARTERIAL 1. Guillermo Wilson Muñoz Ordoñez. MD, Esp, Cirujano, Vascular. 2. Jhan Sebastián Saavedra Torres 2. Luisa Fernanda Zúñiga Cerón 1. Universidad del Cauca, Facultad de Ciencias de la Salud, Departamento de Cirugía General, Grupo de Investigación CardioUniCauca, Hospital Universitario San José, Popayán, Colombia. Correo de contacto: gwmunoz@gmail.com 2. Estudiante del Programa de Medicina, Facultad de Ciencias de la Salud, Universidad del Cauca, Grupo de Investigación CardioUniCauca, Correspondencia: proyectostemcells@gmail.com Hoy día sabemos que la enfermedad cardiovascular (ECV) supera a la infección y el cáncer como primera causa de muerte en la mayor parte del mundo. Esto ha permitido e iniciado procesos de investigación más profundos acerca del uso de la terapia celular (1). Las terapias celulares son muy prometedoras para el tratamiento de numerosas enfermedades y trastornos humanos (2–4). Por ejemplo, EAP, cardiopatías, diabetes, leucemias y además en la enfermedad vascular aterosclerótica, que es causa importante de insuficiencia cardíaca y a su vez contribuye a la creciente carga de enfermedades crónicas. (3–5). El uso de células pluripotentes promueve la reparación cardíaca, o restaurar la perfusión a los tejidos, hoy día representa una estrategia importante para evitar las consecuencias perjudiciales de la enfermedad vascular oclusiva (5,6). En estudios preclínicos, la administración de células madre y progenitoras adultas se ha demostrado que mejora la función cardíaca posterior al infarto agudo (6,7). El trasplante celular, utilizando células madre mesenquimáticas o hematopoyéticas, principalmente células progenitoras endoteliales (CD 34+). Ambas han mostrado ser efectivas, mejorando el flujo sanguíneo colateral en el miocardio isquémico y en los pacientes con enfermedad arterial periférica (8). Las vías de investigación se han centrado en el tratamiento celular, para la EAP e infarto de miocardio y entre otras, que consiste en la administración de células con capacidad progenitora endotelial en los tejidos isquémicos con el fin de que se diferencien y formen nuevas estructuras vasculares. Las células madre (pluripotentes) pueden definirse como células no especializadas, con capacidad para diferenciarse hacia distintos tejidos. Hasta hace unos años se creía que el único tejido que las poseía era el embrionario, con las connotaciones éticas que suponía su uso; sin embargo, posteriormente se descubrió que en el adulto también hay células con capacidad pluripotencial (9). Aunque la verdadera plasticidad de las «células madre adultas» es desconocida y constituye la base de distintas líneas de investigación, hoy día se reconocen 4 líneas celulares adultas con capacidad pluripotencial: células madre neuronales, células madre hematopoyéticas, células madre epiteliales y células madre endoteliales. Los primeros trabajos se realizaron en pacientes con cardiopatía isquémica y en ellos se apreció un aumento de la fracción de eyección tras la administración, mediante inyecciones transendocárdicas, de células mononucleadas de médula ósea (9). En personas sanas el número de progenitores endoteliales circulantes en sangre periférica es muy bajo, menor del 0,01%. La liberación de estas células desde la médula ósea a la circulación sistémica es un proceso inducible. Varios mecanismos externos (factor estimulante de colonias granulocíticas y microcíticas, factor de crecimiento del endotelio vascular -VEGF) e internos (concentraciones de óxido nítrico y metaloproteinasas producidas por las células estromales) determinan la liberación (movilización) de estos progenitores a la sangre periférica como células inmaduras circulantes, desde donde pueden dirigirse a distintos tejidos para iniciar el proceso de vasculogenia (9). Aunque algunos autores creen que los donantes de células madre con edad avanzada generan posible disminución en la función celular, en otros estudios demuestran clínicamente que la edad no es importante para limitar la función de la terapia celular (10,11). En efecto la importancia clínica y bioquímica de la función celular se basa específicamente en la edad propia de la célula y no en la edad del paciente, no obstante la edad del destinatario o paciente que recibe las células a trasplantar, si se le debe reconocer que puede afectar la terapia por su edad y comorbilidades al proceso angiogénico o de reparación que se deseaba tener(12). Las situaciones que produzcan elevación local de factores angiógenos como lo hacen la isquemia, traumatismos, infarto, neoplasias, activan la señal necesaria para que se recluten estas células, que una vez incorporadas a los tejidos comenzarán su diferenciación in situ formando estructuras cordonales que, tras un período de maduración, constituirán una nueva red vascular, o bien integrándose en la matriz extracelular, sintetizando nuevos factores de crecimiento que regularán este proceso y favoreciendo el reclutamiento de nuevas células (9). Los estudios sobre el tratamiento celular en animales han demostrado muy buenos resultados (9,11,12). Sin embargo, los resultados en humanos están todavía en fase de estudio. Yuyama, publicó en 2002 el resultado de un estudio de 47 pacientes con isquemia crítica tratados mediante inyecciones intramusculares de Células Progenitoras Endoteliales (CPE). Éstas se obtuvieron directamente de la médula ósea y de sangre periférica y se demostró mejoría de las lesiones tróficas, del índice tobillo-brazo y del control del dolor tras el tratamiento con ambas, aunque los resultados fueron mayores con el uso de las células obtenidas directamente por punción medular (9). Otros trabajos publicados con posterioridad en los que también se utilizaban células mononucleadas han constatado estos hechos y comunicado una disminución de la tasa de amputación de extremidad en estos pacientes. Más recientemente se han publicado estudios en series más extensas de pacientes y con buenos resultados (8,9). Figura No 1: “Mecanismos relacionados con la movilización, migración, quimio-atracción y fijación célular a tejidos por celular implantadas pluripotentes”. La integridad tisular refleja un equilibrio entre lesión y reparación. Cuando se produce una lesión del tejido, se liberan quimiocinas/citocinas inflamatorias al medio tisular circundante y a la circulación que fomentan un reclutamiento de células madre y células progenitoras hacia el lugar de la lesión. Si estas células fomentan la reparación, la inflamación se reduce y, por lo tanto, se restablece la integridad tisular. Sin embargo, cuando el número de células progenitoras disminuye o estas células no son funcionales, la reparación fracasa. En ese caso, el equilibrio se decanta hacia la lesión y la inflamación aumenta y produce secuelas negativas de la respuesta inflamatoria y la lesión tisular. El suministro de células que puedan influir en la liberación de factores de crecimiento, o bien progenitores de células endoteliales capaces de actuar directamente en el mecanismo angiogénico. Además se ha señalado que en la fracción CD34 + de las células madre hematopoyéticas existen progenitores de la células endoteliales. En las células madre de la médula ósea se ha identificado un receptor específico para quimiocina el CXCR4 (CXC-chemoquine receptor 4), que mediante un sistema de "llave/cerradura" se une con la quimiocina SDF-1, factor 1 derivado del estroma (stromal derived factor 1) permitiendo mecanismos de movilización, migración, quimio-atracción y fijación de estas células a los tejidos. En los estudios preclínicos se han administrado factores de crecimiento angiogénicos como proteína recombinante que incluyen el factor de crecimiento endotelial vascular (VEGF), factor-1 de crecimiento de fibroblastos (FGF-1), FGF-2, la enzima convertidora de angiotensina (ACE) y la codificación de ADN desnudo para el factor de transcripción inducible por hipoxia factor 1 (HIF-1) con el fin de promover la neovascularización en el modelo de extremidad posterior isquémica en animales de experimentación (conejos). Realizado por los autores. Referencias: 1. Doris A. Taylor. Fundamentos de la terapia celular para el tratamiento de las enfermedades cardiovasculares: no hay una célula adecuada para todo. Rev Esp Cardiol. 2009;Vol. 62(Núm.09):1032–44. 2. Scholz D. CW. Arteriogenesis, a new concept of vascular adaptation in occlusive disease. Angiogenesis. 2001;4(4)(1):247–57. 3. Chang WY, Lavoie JR, Kwon SY, Chen Z, Manias JL, Behbahani J, et al. Feederindependent derivation of induced-pluripotent stem cells from peripheral blood endothelial progenitor cells. Stem Cell Res. Elsevier B.V.; 2013;10(2):195–202. 4. Brown ME. RE. Derivation of induced pluripotent stem cells from human peripheral blood T lymphocytes. PLoS One. 5(6)(e11373.). 5. Incze a., Fehervari L, Benendek I, Magdas a., Jeremias ZS, VBenedek I. Effects of stem cell transplantation and intravenous prostaglandin therapy in peripheral arterial disease of the elderly. Eur J Intern Med. Elsevier B.V.; 2013;24:e42. 6. Sadia Mohsin., Daniele Avitabile. MK. Stem Cells and Cardiac Repair. Stem Cells Int. Volume 201(1):2 pages. 7. UHN. Your guide to having an In-patient Autologous Stem Cell Transplant. First. Education UP, editor. Toronto: University Health Network.; 2014. 8. Yumeng Liu. Therapeutic Efficacy of Stem Cell-based Therapy in Peripheral Arterial Disease: A Meta-Analysis. PLoS One. 2015;10(4):e0125032. 9. Kawamura A, Horie T, Tsuda I, Abe Y, Yamada M EH. Clinical study of therapeutic angiogenesis by autologous peripheral blood item cell (PBSC) transplantation in 92 patients with critically ischemic limbs. J Artif Organs. 2003;206(33). 10. Perin EC., Willerson JT., Pepine CJ. et al. . Effect of transendocardial delivery of autologous bone marrow mononuclear cells on functional capacity, left ventricular function, and perfusion in chronic heart failure: the FOCUS-CCTRN trial. JAMA. 2012;307(1):1717–26. 11. David L. Regenerative Biology and Medicine (Second Edition). Second Edi. Medicine. BMARB and, editor. Londres: Elsevier Inc. All rights reserved BMA Medical Book; 12. Samuel Golpanian, MD., Jill El-Khorazaty B. Effect of Aging on Human Mesenchymal Stem Cell Therapy in Ischemic Cardiomyopathy Patients. J Am Coll Cardiol. 2015;VOL. 65(NO. 2).