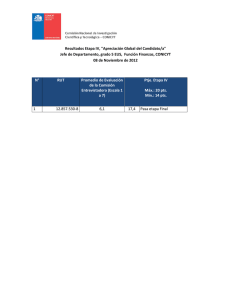
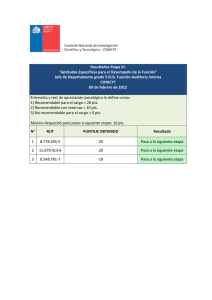
- #1/ (10 pts) / obtuve: 2,50 pts → 5 pts 1.a) CUADRO Elemento Br K Z #protones 35 #neutrones #electrones 45 19 #másico Periodo Bloque 39 → 5 pts 1.b) escriba la fórmula de puntos de LEWIS de: i) MgO ii) HF e indique justificando en base a la diferencia de electronegatividad: qué tipo de enlace químico presenta cada uno de estos compuestos y en caso de que corresponda, el tipo de fuerzas intermoleculares que presentan. - #2/ (10 pts) / obtuve: 7 pts → 5 pts 2.I.a) Calcule el descenso del punto de fusión de una solución acuosa de KCl 0,8m. 2.b) Si la solución anterior se pone en contacto a través de una membrana semipermeable con una solución acuosa de Al(NO2)3 de la misma molalidad. ¿Es o no isoosmolar con la solución de KCl 0,8m? 2.c) Indique en qué sentido se desplazará el solvente. *Datos) kf= 1,86 → 5 pts 2.II) Complete el siguiente cuadro y en (1) y (2) responda “si” o “no” (1) Sedimentación (2) Efecto Tindall Ejemplo Solución Coloide - #3/ → (10 pts) /obtuve 4 pts 5 pts I. Calcule el PH de a) Ha[OH]3 5x10-3M y b) NaO.H 5x10M: Cuál es más básica? → 5 pts II. Se dispone de una solución buffer ácido débil/sal, formado por HF (ka=7,1 x 10-4), y su sal, NaI. Complete el siguiente cuadro. En (1), (2), (3), y (4) indique solo si aumenta o disminuye, al agregar HCl a dicha solución reguladora. [sal] (1) [ácido] (2) pH (3) pOH (4) ↓ ↑ ↓ ↑ - #4/ → Capacidad Reguladora máxima 3,15 Rango útil 2,15 /4,15 (10 pts) /obtuve 4 pts 5 pts a) Se dispone de los siguientes elementos para armar una pila: un trozo de Pb, una solución de Pb2+ 1M; un trozo de Cu, una solución de Cu2+ 1M. Responda las siguientes preguntas: + 𝟎 I) ¿Cómo armaría la pila? Escriba el diagrama.(−) 𝑷𝒃𝟎 ⋅ |𝑷𝒃𝟐 ||𝑪𝟐+ 𝒖 |𝑪𝒖 (+) II) Escriba las reacciones anódicas y catódicas, y la reacción total que ocurre en la pila. III) ¿Cuál es la ∆En de la pila que armó? Datos: EPb: -0,14 / ECu: +0,34