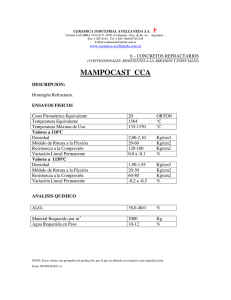
Leyes combinadas: Cuando la temperatura y la presión cambian al mismo tiempo, el volumen nuevo se debe calcular multiplicando el volumen inicial por las relaciones correctas de presión y temperatura como sigue: Volumen fina = (volumen inicial) (relación de presiones) (relaciones de temperatura) Esta ecuación combina las leyes de Boyle y de Charles, y se deben usar las mismas consideraciones para las relaciones de presión y temperatura en los cálculos. Las cuatro variaciones posibles son las siguientes: 1. 2. 3. 4. Tanto T como P originan un aumento de volumen. Tanto T como P originan una disminución de volumen. T causa un aumento de volumen y P origina una disminución de volumen. T causa una disminución de volumen y P origina un aumento de volumen De hecho, se pueden expresar las relaciones de P, V y T para una determinada masa de cualquier gas como una sola ecuación, PVIT = k. Para resolver problemas, esta ecuación se escribe usualmente: . Donde P1 V1 Y T1 son las condiciones iniciales y P2, V2 Y T2 son las condiciones finales. . De esta ecuación se puede despejar cualquiera de las seis variables y es útil para manejar las relaciones de presión-volumen-temperatura de los gases. Observa que, cuando T es constante (TI = T2), obtenemos la ley de Boyle; cuando P es constante (PI = P2), obtenemos la ley de Charles, y cuando V es constante (VI = V2), obtenemos la ley de Gay-Lussac. 1. MATERIAL: 1 vaso de precipitado de 250mL. 1 Agitador. 2 pesas de plomo. 1 mechero 1 anillo. 1 pinza universal. 1 tela de asbesto. 1 jeringa de platico graduada de 10 mL herméticamente cerrado. 1 termómetro. 1 pinzas para vaso de precipitados. 2. PROCEDIMIENTO: DATOS: PDF= 585 mmHg. m embolo= 8g. D int.=1.82 cm. 760 mmHg = 1.013 X 106dinas / cm2. P = f /A = m * g / A embolo. 1. Monte la jeringa como se indica en la figura 1. 2. presione ligeramente el embolo, este regresara a un volumen inicial Vo correspondiente a una presión inicial Po. Po = P DF + P embolo a temperatura ambiente 3. ponga arriba del embolo la pesa mas pequeña y con precaución presione ligeramente;, el embolo regresara a su volumen V1, correspondiente a una presión P1. P1 = P 0 + P pesa 1 4. quite la pesa pequeña y ponga la más grande, presione ligeramente y anote V2 para una presión P2. P2 = P 0 + P pesa 2 5. por ultimo, con precaución ponga las dos pesas y anote V3 para una presión P3. P3 = P 0 + P pesa 3 SEGUNDA PÀRTE 1. monte la jeringa como se indica en la figura 2, procurando que el nivel del agua este arriba del volumen del aire de la jeringa. Presione ligeramente y tome el volumen Vo, correspondiente a una temperatura To que será la temperatura ambiental del agua, para una presión Po constante. 2. calentar y agua constante hasta 40 oC, presione ligeramente y anote el volumen V1, correspondiente a una T1. 3. continué calentando, agitando y anotando los volúmenes a temperatura de 60 oC, 80oC y temperatura de ebullición del agua. TERCERA PARTE 1. se inicia de igual forma que la segunda parte. 2. caliente, agitando hasta 40oC y ponga la pesa chica como la figura 3., oprima ligeramente y tome el volumen V1 correspondiente a la temperatura T1 y a la presión P1. 3. continué calentando hasta 60oC y ponga la pesa grande, tome el volumen V2 a la temperatura T2 y a la presión P2. 5. CUESTIONARIO: 1. llene la tabla de datos y resultados siguientes. PRIMERA PARTE. P(dinas/cm2) V (cm3) 6 P0= 0.7817x10 P1= 782.84 x103d/cm2 P2= 783.49 x103d/cm2 P3= 784.33 x103d/cm2 5 ml = PV (erg) 3.9 x106 3.52x106 3.13x106 2.98x106 cm3 4.5 ml = cm3 4 ml = cm3 3.8 ml = cm3 SEGUNDA PARTE T (0C) po 20 p1 40 p2 60 p3 80 p4 94 T (0K) 293 313 333 353 367 V (cm3) 5 5.1 5.3 5.8 6.0 V/ T (cm3/0k) 0.017 0.016 0.015 0.016 0.016 TERCERA PARTE T (0C) T (0K) V (cm3) po 20 293 5 ml. p1 40 313 4 ml. p2 60 333 4.5 ml. P(dinas/cm2) 782.84 x103d/cm2 783.49 x103d/cm2 784.33 x103d/cm2 PV/T (erg/0k) 13.35x103 12.26x103 10.59x103 2. Con los datos obtenidos de la primera y segunda parte, construya las gráficas de: VP y P-V. 3. De la primera parte, analizando la gráfica si el gas es expandible, su presión tendrá que: disminuir 4. De la primera parte, analizando la gráfica para que un gas se expanda, su tempetarura tendrá que: Aumentar 5. Analizando las tablas de resultados, los valores de PV, V/T y PV/T, ¿Por qué no son constantes? Por que en los tres casos algo varía como es la presión, el volumen o la temperatura y por eso no puede llegar a ser constante. Y esto se comprueba por las leyes de los gases. 6. CALCULOS: Aembolo= π r2 = π (0.91)2= 2.60cm2 Pembolo = F A = mg = (8g) (980cm/s2) = 0.003015x106 d/cm2 A 2.60cm2 P0= PDF + Pembolo PDF = 585mmHg (1.013x106d/cm2) = 0.7797x106d/cm2 760mmHg P0 = 0.779x106 d/cm2 + 0.003015x106 = 0.782 x106d/cm2 Pesa 1 = 224g Pesa 2 = 396g Pesa 3 = Pesa 1 + Pesa 2 = 224 + 396 = (620g) P1= P0 + Ppesa 1 = 0.782 x106 d/cm2 + (224g) (9.81m/s2) = 782.84 x103d/cm2 2.60cm2 P2= P0 + Ppesa 2 = 0.782 x106 d/cm2 + (396g) (9.81m/s2) = 783.49 x103d/cm2 2.60cm2 P3= P0 + Ppesa 3 = 0.782 x106 d/cm2 + (620g) (9.81m/s2) = 784.33 x106d/cm2 2.60cm2 Cálculos de la tabla 1. (0.782x106d/cm2) (5cm3) = 3.9 x106 erg (782.84 x103d/cm2) (4.5 cm3) = 3.52x106 erg (783.49 x 103 d/cm2) (4 cm3) = 3.13 x 106 erg (784.33 x 103 d/cm2) (3.8 cm3 ) = 2.98x 106 erg Cálculos de la tabla 2. 5 / 293 = 0.017 cm3/ 0K 5.1 / 313 = 0.016 cm3/ 0K 5.3 / 333 = 0.015 cm3/ 0K 5.8 / 353 = 0.016 cm3/ 0K 6.0 / 367 = 0.016 cm3/ 0K Cálculos de la tabla 3. (782.84 x103d/cm2) (5 cm3) / 293K = 13.35 x103 erg/ K (782.84 x103d/cm2) (4.9 cm3) / 313K = 12.26x103 erg/ K