Pagina:
LABORATORIO
SEÑOR DE SANTIAGO
MANUAL DE PROCEDIMIENTOS
OPERATIVOS ESTANDAR – POES.
01/124
Revisión:
01
Código:
Fecha:
MC-PR-20 01-07-2012
Unidad:
SISTEMAS DE ASEGURAMIENTO DE CALIDAD
Título:
MANUAL DE PROCEDIMIENTOS OPERATIVOS
ESTÁNDAR (POES) – PROCESO ANÁLISIS
LABORATORIO DE ANÁLISIS CLÍNICO
“SEÑOR DE SANTIAGO”
Rubro:
ANÁLISIS CLÍNICO
Presentado por: Dra. Lineth G. Carpio Q.
Dra. Jimena Quiroga C.
Supervisado por: Dr. Richard M. Cancio M.
Lugar y Fecha: Quillacollo – CB. Julio de 2012
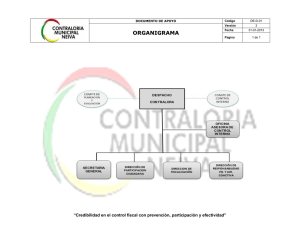
DIRECTOR TÉCNICO
BIOQUÍMICO
CONSULTOR EN SISTEMAS DE
ASEGURAMIENTO DE CALIDAD
Pagina:
LABORATORIO
SEÑOR DE SANTIAGO
MANUAL DE PROCEDIMIENTOS
OPERATIVOS ESTANDAR – POES.
02/124
Revisión:
01
Código:
Fecha:
MC-PR-20 01-07-2012
INDICE
Título
1.
2.
3.
4.
5.
Página
Introducción …………………………………………………………...…………………..03
Directrices, Responsabilidad y Aplicación ………............................................................04
Procedimientos Técnicos …………………..………...……………………………...…….05
Procedimientos de Soporte ………………………………………………………………..95
Anexos
Pagina:
LABORATORIO
SEÑOR DE SANTIAGO
MANUAL – POES – PROCESO ANÁLISIS
Título:
INTRODUCCIÓN
03/124
Revisión:
Código:
Fecha:
01 MC-PR-20 01-07-2012
1. INTRODUCCIÓN
Los procedimientos son la forma adecuada y segura de realizar las actividades establecidas por un
programa, indican también las condiciones, el método, las responsabilidades y frecuencia en el
desarrollo de estas actividades.
De acuerdo a la implementación de un Sistema de Calidad sean ISO 9000, ISO 17025, ISO 15189
los procedimientos forman parte del documento matriz de calidad y dependerá de los mismos el
cumplimiento de los requisitos implantados, aplicándolos correctamente claro esta.
En el presente documento se encuentran contemplados los Procedimientos Técnicos y
Procedimientos de Apoyo o de Soporte, los primeros están referidos a los procedimientos de
análisis propios, para el desarrollo de un análisis diagnostico; los de soporte comprenden procesos y
procedimientos auxiliares que coadyuvaran el proceso de calidad implantado.
La referencia y mención a documentos implantados en el Sistema de Aseguramiento de Calidad
para el Laboratorio Clínico “Señor de Santiago”, constituyen un trabajo elaborado de acuerdo a su
estructura organizacional y funcional, aplicándose y manteniendo los requisitos de calidad para el
proceso de habilitación del laboratorio.
NORMAS DE REFERENCIA
El presente manual toma como referencia las exigencias normativas de calidad y reguladas por la
Autoridad Sanitaria Nacional – Ministerio de Salud y Deportes; Norma ISO 15189 (Laboratorios
Clínicos Requisitos particulares para la calidad y competencia), Norma ISO/IEC 17025
(Acreditación de Laboratorios de Ensayo y Calibración), Norma ISO 9001:2000 (Manual y
Procedimientos de un Sistema de Calidad). Ver anexo 02.
Pagina:
LABORATORIO
SEÑOR DE SANTIAGO
MANUAL – POES – PROCESO ANÁLISIS
Título:
DIRECTRICES Y RESPONSABILIDAD
04/124
Revisión:
Código:
Fecha:
01 MC-PR-20 01-07-2012
2. DIRECTRICES, RESPONSABILIDAD Y APLICACIÓN
Directrices Generales
Todo los procedimientos elaborados y establecidos en función de norma, que guíen la forma de
operación en métodos analíticos, de calibración o verificación (patrones de referencia o estándar de
calibración) y procedimientos o recursos de apoyo al sistema de calidad, asegurando de esta forma
la calidad de los resultados y la gestión implantada.
Responsabilidad
Dirección Técnica, es responsable por garantizar la ejecución de los procedimientos establecidos.
Aplicación
Procedimientos Técnicos
Se aplica a los métodos o determinaciones de análisis propios, a procedimientos de calibración o
verificación del método y procedimientos de mantenimiento y calibración de equipos.
Procedimientos de Soporte
Todos los procedimientos de apoyo en el aseguramiento de calidad para el laboratorio.
Se establece el libro correspondiente a POES.
Pagina:
LABORATORIO
SEÑOR DE SANTIAGO
MANUAL – POES – PROCESO ANÁLISIS
Título:
PROCEDIMIENTOS TÉCNICOS
05/124
Revisión:
Código:
Fecha:
01 PD-TEC-00 01-07-2012
PROCEDIMIENTOS OPERATIVOS ESTÁNDAR: PROCEDIMIENTOS TÉCNICOS
Código
Versión
PD-TEC-01
01
PD-TEC-02
PD-TEC-03
PD-TEC-04
PD-TEC-05
PD-TEC-06
PD-TEC-07
PD-TEC-08
PD-TEC-09
PD-TEC-10
PD-TEC-11
PD-TEC-12
PD-TEC-13
PD-TEC-14
PD-TEC-15
PD-TEC-16
PD-TEC-17
PD-TEC-18
PD-TEC-19
PD-TEC-20
PD-TEC-21
PD-TEC-22
PD-TEC-23
PD-TEC-24
PD-TEC-25
PD-TEC-26
PD-TEC-27
PD-TEC-28
01
01
01
01
01
01
01
01
01
01
01
01
01
01
01
01
01
01
01
01
01
01
01
01
01
01
01
Descripción del Documento de Calidad
Hemograma, Hemoglobina, Hematocrito, Tiempos de
Coagulación y Sangria, VES
Grupo sanguíneo Factor RH
Determinación B-HCG cualitativo
Reacción de Widal
Determinación de V.D.R.L. ó R.P.R.
Latex R.A.
Proteína C Reactiva
Prueba Asto
Glicemia
Creatinina
Urea
Ácido Urico
Bilirrubina Total, Directa e Indirecta
Transaminasas GOT
Transaminasas GPT
Fosfatasa alcalina
Amilasa
Colesterol total
Triglicéridos
HDL Colesterol
Examen general de Orina
Heces Directo, Concentrado
Cancelado
Cancelado
Calibración Externa de Equipos
Calibración y/o Verificación de Método Analítico
Manejo y Operación de Equipos
Gráficos de Control – CHART
Pagina:
LABORATORIO
SEÑOR DE SANTIAGO
MANUAL – POES – PROCESO ANÁLISIS
Título: PROCEDIMIENTO TÉCNICOS:
HEMOGRAMA
06/124
Revisión:
Código:
Fecha:
01 PD-TEC-01 01-07-2012
HEMOGRAMA
1.-OBJETIVO:
Determinar los siguientes parámetros sanguíneos: Recuento de glóbulos rojos, de glóbulos blancos
y su diferenciación, recuento de plaquetas, determinación del hematocrito y de la velocidad de
eritrosedimentación.
2.ALCANCE:
Área de hematología
3.FUNDAMENTO:
La biometría hemática es una prueba de detección básica y constituye la técnica de laboratorio que
se pide con mas frecuencia. Los datos que proporciona constituyen información diagnóstica muy
valiosa sobre el sistema hematológico y otros aparatos del cuerpo, pronóstico respuesta al
tratamiento y recuperación.
A partir de la muestra obtenida se realizará una dilución 1/20( 190 ul de diluyente+10 ul de
sangre)para el conteo de glóbulos blancos en cámara de Neubawer, mediante la sumatoria del total
observado en los cuatro cuadrantes por 50,con un aumento de 10x;a la vez se carga un capilar para
determinar hematocrito de la misma se obtiene los valores de la hemoglobina y la cantidad
aproximada de glóbulos rojos, el capilar se centrifuga 5 min. A 12 mil rpm después del cual se
realiza la lectura con la ayuda de un ábaco. Paralelamente se realiza un frotis que se colorea con
panóptico el cual será observado con objetivo de inmersión para realizar fórmula leucocitaria,
recuento de plaquetas, y cualquier variación morfológica intra y extracelular, por último se realiza
la determinación del VSG mediante la utilización de una pipeta adecuada y medida en un lapso de
una hora los mm. que sedimenta.
4.MUESTRA REQUERIDA:
Sangre: venosa, capilar o arterial recogida con anticoagulante preferentemente EDTA, también se
puede utilizar otros como citrato.
Cantidad: 2,5 ml
5.REACTIVOS:
-Líquido de turk (glóbulos blancos )
-Solución de oxalato de amonio ( plaquetas )
-Tinción panóptica
-Anticoagulante ( EDTA o Citrato )
Instrucciones para su uso:
-Reactivos provistos: Listos para usar
-Conservación: conservar a temperatura ambiente, estables hasta la fecha de vencimiento
Página:
LABORATORIO
SEÑOR DE SANTIAGO
MANUAL – POES – PROCESO ANÁLISIS
Título: PROCEDIMIENTO TÉCNICOS:
HEMOGRAMA
07/124
Revisión:
Código:
Fecha:
01 PD-TEC-01 01-07-2012
6.MATERIALES:
-Tubos de hemólisis
-Tubos con anticuagulante
-Porta objetos
-Cámara de Neewbaver
-Micropipetas,
-tubos capilares
-Plastilina
-Cámara de Newbaver
-Pipetas de VES
-Soporte
-Cronómetro
-Guantes desechables
-Tinción panóptica
7.EQUIPOS:
-Microscopio
-Microcentrífuga
-Timer
8.PROCEDIMIENTO:
Preparación y tinción del frotis sanguíneo:En este procedimiento se obtiene un frotis sanguíneo
para el reconocimiento de los elementos celulares de la sangre.
Muestra requerida:
Una gota de sangre capilar o venosa recién extraída sin anticoagulante o sangre con anticoagulante
EDTA.
Material y reactivos:
Portaobjeto de vidrio con extremo esmerilado.
Marcador de vidrio.
Bandeja o soporte para la coloración.
Aceite de inmersión.
Reloj marcador.
Papel toalla.
Guantes descartables.
Solución Panóptico rápido
Pagina:
LABORATORIO
SEÑOR DE SANTIAGO
MANUAL – POES – PROCESO ANÁLISIS
Título: PROCEDIMIENTO TÉCNICOS:
HEMOGRAMA
08/124
Revisión:
Código:
Fecha:
01 PD-TEC-01 01-07-2012
Procedimiento:
Antes de utilizar los portaobjetos de vidrio, limpiarlos con alcohol y aclarar con agua.
Identificar la lámina adecuadamente en el extremo del portaobjeto (parte esmerilada).
Colocar en el portaobjeto una pequeña gota de sangre de 2 mm de diámetro a una distancia
de 2 a 3 mm del extremo del portaobjeto y hacer rápidamente el extendido.
Para evitar la coagulación; se puede utilizar sangre con EDTA. (Siempre conviene realizar
cuando menos dos frotis).
Poner la lámina extensora a un ángulo de 45° del portaobjeto y moverla hacia atrás para que
haga contacto con la gota, que debe extenderse rápidamente.
El extendido debe tener unos 30 mm. de largo.
Dejar secar a temperatura ambiente.
Colocar la preparación de sangre, completamente seca,dentro de los colorantes
correspondientes
(Colorante 1 : Solución de Triarilmetano a 0,1 %)
(Colorante 2 : Solución de xantenos a 0,1 %)
(Colorante 3 : Solución de Tiaminas a 0,1 % ),por un tiempo de 1 minuto a cada uno.
Lavar la lámina con agua de chorro hasta quitar el exceso de la mezcla.
Dejar secar la preparación al aire colocando la lámina en posición vertical sobre un papel
absorbente para que seque la lamina.
Fuentes de error:
Falta de mezclado de la sangre previo a la elaboración del frotis
Irregularidades en la superficie del frotis y espacios en blanco.
Que el frotis se extienda hasta el borde de la lámina.
Extendidos gruesos o muy delgados.
Tiempos de coloración inadecuados.
Mal lavado de la lámina.
Reactivo Panóptico vencido
Uso de portaobjetos con polvo, grasa o huellas dactilares.
Examen microscópico del frotis sanguíneo para fórmula diferencial
1. PROPÓSITO:
Establecer y evaluar las características morfológicas de cada tipo de células y ver la frecuencia de
las diferentes líneas leucocitarias.
2. MUESTRA REQUERIDA:
Frotis de Sangre coloreado.
Pagina:
LABORATORIO
SEÑOR DE SANTIAGO
MANUAL – POES – PROCESO ANÁLISIS
Título: PROCEDIMIENTO TÉCNICOS:
HEMOGRAMA
09/124
Revisión:
Código:
Fecha:
01 PD-TEC-01 01-07-2012
3. MATERIALES:
Frotis de sangre coloreado.
Aceite de inmersión.
Papel limpia lente.
Guantes descartables.
4. EQUIPO:
Microscopio con objetivo 40x y 100x.
Contador manual para diferencial.
5. PROCEDIMIENTO:
La observación inicia con el objetivo 40x para obtener un cuadro general del número de
células, la distribución de las mismas y la calidad de la tinción.
Seleccionar las áreas a observar con objetivo de inmersión 100x buscando una distribución
homogénea de las células.
Realizar el recuento diferencial identificando las características y grado de desarrollo de las
células; estos se reportan en porcentajes para lo cual tiene que contarse un mínimo de 100
leucocitos estos pueden convertirse en número de células por mm³ (número absoluto).
Observar en los eritrocitos: el tamaño, la forma, la reacción de coloración, las inclusiones
intracitoplasmáticas y la presencia del núcleo (eritroblastos).
6. FUENTES DE ERROR:
Observación de los leucocitos en los extremos de la lámina.
Realizar el recuento diferencial con un objetivo que no sea el de inmersión.
Hacer la fórmula diferencial en base de menos de 100 células blancas.
7. FORMA DE REPORTE:
El recuento diferencial de leucocitos se reporta en términos porcentuales según las diferentes líneas
observadas.
Valores de referencia:
LEUCOCITOS
NIÑOS (1 – 8AÑOS)
ADULTOS
NEUTROFILOS
SEGMENTADOS
NEUTROFILOS EN BANDA
LINFOCITOS
EOSINOFILOS
BASOFILOS
MONOCITOS
20 – 45 %
60 – 70 %
0–4 %
40 – 60 %
0–5 %
0–1 %
2–8 %
2– 6 %
15 – 40 %
1–4 %
0–1 %
2–8 %
Pagina:
LABORATORIO
SEÑOR DE SANTIAGO
MANUAL – POES – PROCESO ANÁLISIS
Título: PROCEDIMIENTO TÉCNICOS:
HEMOGRAMA
10/124
Revisión:
Código:
Fecha:
01 PD-TEC-01 01-07-2012
FROTIS DE SANGRE PERIFÉRICA
1. PROPÓSITO:
Observación detallada de todos los elementos de la sangre, con el fin de evaluar la condición
hematológica del paciente.
2. MUESTRA REQUERIDA:
Frotis de sangre periférica coloreado con coloración panóptica
3. MATERIALES:
- Aceite de inmersión.
- Papel limpia lente.
4. EQUIPO:
- Microscopio con objetivo 40x y 100x.
5. PROCEDIMIENTO:
Cada técnico debe aprender a observar todos los elementos del frotis mientras lleva a cabo el
recuento diferencial. Debe formar el hábito de verificar los puntos siguientes.
ERITROCITOS:
Tamaño: microcitosis, macrocitosis y normocitos. El grado de variación en tamaño se
reduce al término de anisocitosis.
Forma: esferocitos, codocitos, eliptocitos, megalocitos, drepanocitos, acantocitos,
equinocitos etc. El grado de variación en forma se reduce al término de poiquilocitosis.
Concentración de hemoglobina: Grado importante de hipocromía, e hipercromía aparente,
observar el aumento aparente o evidente de la proporción de glóbulos rojos policromáticos.
Otros hallazgos anormales: La policromatofilia (basófilia difusa), punteado basófilo, anillo
de Cabot, cuerpos de Howell-Joly, etritroblastos, las células parasitadas y la formación de
Rouleaux.
LEUCOCITOS:
Observar la madurez de los leucocitos, el número promedio, anormalidades morfológicas,
signos de malignidad, la variante de leucocitos que predominan.
Comparar el recuento de leucocitos por milímetro cúbico con lo observado en el frotis.
Pagina:
LABORATORIO
SEÑOR DE SANTIAGO
MANUAL – POES – PROCESO ANÁLISIS
Título: PROCEDIMIENTO TÉCNICOS:
HEMOGRAMA
11/124
Revisión:
Código:
Fecha:
01 PD-TEC-01 01-07-2012
PLAQUETAS:
Observar si se encuentran en cantidades aproximadamente normales (de tres a ocho
plaquetas por cien glóbulos rojos). La disminución de las plaquetas en un frotis puede
deberse a la manera de realizarlo, pero su falta o su disminución considerable, en un frotis
bien hecho pueden hacer sospechar de trombocitopenia.
Debe observarse si las plaquetas que se encuentran parecen normales o existen muchas
formas gigantes (macroplaquetas) o notablemente pequeñas.
Comparar el recuento de plaquetas por milímetro cúbico con lo observado en el frotis.
6. FUENTES DE ERROR:
Observar los elementos celulares en la parte más gruesa del frotis.
Coloración defectuosa del frotis.
Observar el extendido con un objetivo diferente al de inmersión.
Equipo en mal estado
Aceite de inmersión de mala calidad o en malas condiciones.
7. FORMA DE REPORTE:
SERIE ROJA:
Anisocitosis: leve, moderada o severa (reportar predominio).
Poiquilocitosis: leve, moderada o severa (reportar predominio).
Hipocromia: leve, moderada o severa.
Otros: reportar cualquier hallazgo anormal.
SERIE BLANCA:
Madurez de los leucocitos.
Variante de leucocitos que predomina.
Alteraciones encontradas en los leucocitos.
LÍNEA PLAQUETARIA:
Cantidad.
Tamaño: macro o micro plaquetas.
Valores de referencia:
Eritrocitos normocrómicos.
Leucocitos maduros sin presencia de anormalidades.
Plaquetas distribución y tamaño normal, comparar los observado en recuento con mm³.
Pagina:
LABORATORIO
SEÑOR DE SANTIAGO
MANUAL – POES – PROCESO ANÁLISIS
Título: PROCEDIMIENTO TÉCNICOS:
HEMOGRAMA
12/124
Revisión:
Código:
Fecha:
01 PD-TEC-01 01-07-2012
RECUENTO DE LEUCOCITOS
1. PROPÓSITO:
Evaluar la cantidad de células nucleadas que se encuentran en la muestra de sangre
2. MUESTRA REQUERIDA:
2,5 mL de sangre venosa con EDTA o sangre capilar.
3. MATERIALES Y REACTIVOS:
Tubos
Cámara de Neubauer.
Laminilla para cámara de Neubauer.
Pipeta automática de 20 µL.
Puntas plásticas.
Guantes descartables.
Gradillas para tubos.
Acido acético glacial al 3%.
4. EQUIPO:
Microscopio.
Contómetro manual.
Agitador.
5. PROCEDIMIENTO (Técnica en tubo):
Colocar 190 microlitros de ácido acético glacial al 3% en un tubo de hemólisis
Mezclar perfectamente la sangre, y tomar exactamente 10 µL con pipeta automática. Y
colocarla en el tubo que contiene el acido acético glacial al 3 % lo que hace una dilución de
la sangre 1:20.
Mezclar por un mínimo a 2 minutos.
Dispensar con pipeta automática o con capilar la dilución en el borde de la laminilla a la
cámara Neubawer.
Esperar 3 - 5 minutos Para que la célula se estabilicen.
Luego se procede a contar los glóbulos blancos en el microscopio con el objetivo 10x y con
poca luz en las dos áreas primarias opuestas de la cámara, contar las células que aparecen.
Cuando el trabajo no es excesivo se cuentan las cuatro áreas primarias para tener un dato
más exacto.
En caso de una leucopenia de menos de 1,000 leucocito/mm³, la dilución se hace 1:10.
En caso de una leucocitosis de mas de 30,000 leucocito/mm³, la dilución se hace 1:200 con
diluyente de leucocitos.
Pagina:
LABORATORIO
SEÑOR DE SANTIAGO
MANUAL – POES – PROCESO ANÁLISIS
Título: PROCEDIMIENTO TÉCNICOS:
HEMOGRAMA
13/124
Revisión:
Código:
Fecha:
01 PD-TEC-01 01-07-2012
6. FUENTES DE ERROR:
Desintegración de los leucocitos cuando se deja la muestra mucho tiempo sin procesar.
Pipeta mal calibradas.
Dilución incorrecta.
Llenado incorrecto de la cámara.
Presencia de levaduras o suciedad en el liquido de dilución.
Calculo erróneo de las células contadas.
Usar cámara y laminilla sucios y húmedos.
Usar laminillas corrientes.
Puntas defectuosas.
Cámaras de mala calidad.
7. FORMA DE REPORTE:
Reportar el número de leucocitos contados en las dos áreas opuestas de la cámara y reportar por
mm³.
Cálculos:
Cuando la dilución es 1:20 el numero de leucocitos contados en las dos áreas primarias
opuestas de la cámara se multiplica x 100 = Nº de leucocitos/mm³, y se multiplicará por 50
si se cuentan 4 área primarias.
Cuando la dilución es 1:10 el factor por el cual se multiplican los leucocitos, será 50 si se
cuentan dos áreas primarias opuestas y será 25 si se cuentan 4 áreas primarias.
Cuando la dilución es 1:200 y se cuenta toda el área central, el factor será 2,000.
Valores de referencia:
Adultos: 5,000-10,000 x mm³
Niños: 5,000-12,000 x mm³
Recién nacidos: 10,000-30,000 x mm³
Nº de células contadas en cámara x 100
= Nº leucocitos verdaderos
Pagina:
LABORATORIO
SEÑOR DE SANTIAGO
MANUAL – POES – PROCESO ANÁLISIS
Título: PROCEDIMIENTO TÉCNICOS:
HEMOGRAMA
14/124
Revisión:
Código:
Fecha:
01 PD-TEC-01 01-07-2012
RECUENTO DE PLAQUETAS ( MÉTODO DIRECTO EN CÁMARA )
1.PROPÓSITO
Evaluar la cantidad de plaquetas existentes en la sangre para lo cual se diluye una muestra de sangre
con una sustancia con un líquido diluyente que hace a las plaquetas más visibles.
2. MUESTRA REQUERIDA:
2,5 ml sangre venosa con EDTA o sangre capilar.
3. MATERIAL Y REACTIVOS:
Tubos de vidrios 12x75mm.
Cámara Neubawer.
Laminilla para cámara de Neubauer.
Papel filtro.
Caja de Petri.
Pipeta automática de 10 µL.
Puntas plásticas.
Guantes descartables.
Gradilla para tubos.
Solución para plaquetas.
4. EQUIPO:
Microscopio.
Contador manual.
Reloj marcador.
5. PROCEDIMIENTO (técnica en tubo):
Colocar 190 microlitros de reactivo para plaquetas en un tubo
Mezclar bien la muestra de sangre varias veces.
Colocar exactamente 10 µL de sangre en el tubo que contiene el diluyente.
Mezclar por un mínimo de 3 minutos.
Dispensar con pipeta automática o con capilar la dilución en el borde de la laminilla de la
cámara Neubawer.
Colocar la cámara en una caja de petri sobre un disco del papel filtro húmedo, para evitar la
evaporación, se tapa y se espera de 10 a 20 minutos para que se depositen bien las plaquetas.
Proceder al conteo de las plaquetas en el microscopio con el objetivo 40x y poca luz.
Contar toda el área central.( 4 extremos uno central ).
Observar las plaquetas como pequeñas partículas de gran refringencia.
Correlacionar el recuento de plaquetas obtenido en la cámara con las plaquetas que se
observan en el frotis.
Pagina:
LABORATORIO
SEÑOR DE SANTIAGO
MANUAL – POES – PROCESO ANÁLISIS
Título: PROCEDIMIENTO TÉCNICOS:
HEMOGRAMA
15/124
Revisión:
Código:
Fecha:
01 PD-TEC-01 01-07-2012
6. FUENTES DE ERROR:
Desintegración de las plaquetas cuando se deja mucho tiempo la muestra sin procesar, y
adherencia a las paredes del tubo de vidrio.
Tomar la muestra de sangre en área con cianosis.
Pipetas mal calibradas.
Dilución incorrecta.
Mal almacenamiento del líquido de dilución el cual debe conservarse en refrigeración.
Presencia de bacterias en el líquido de dilución.
Falta de filtración del diluyente antes de su uso.
Cámara y laminilla sucias o húmedas.
Uso de laminilla corriente.
No comparar el recuento directo con el indirecto.
7. FORMA DE REPORTE
Las plaquetas contadas en la cámara se multiplican por 1000 y se reportan por mm³ de sangre.
Cálculo:
NÚMERO DE PLAQUEtas x 1000 = Nº de plaquetas / mm3
Valores de referencia:
150,000-450,000/mm³
Pagina:
LABORATORIO
SEÑOR DE SANTIAGO
MANUAL – POES – PROCESO ANÁLISIS
Título: PROCEDIMIENTO TÉCNICOS:
HEMOGRAMA
16/124
Revisión:
Código:
Fecha:
01 PD-TEC-01 01-07-2012
ESTIMADO DEL NÚMERO DE PLAQUETAS (Método indirecto)
1. PROPÓSITO:
Evaluar el número de plaquetas presentes en la sangre, a través de la observación de un frotis
coloreado, con el fin de comparar con el conteo directo.
2. MUESTRA REQUERIDA:
Frotis de sangre coloreado con panóptico.
3. MATERIALES Y REACTIVOS:
Papel limpia lentes.
Aceite de inmersión.
4. EQUIPO:
Contador manual
Microscopio.
5. PROCEDIMIENTO:
Colocar la lámina coloreada en la platina del microscopio.
Observar con el objetivo 40x.
Colocar una gota de aceite de inmersión en la lámina coloreada.
Observar con el objetivo 100x.
Contar las plaquetas en 5 campos situados entre el cuerpo y la cola del frotis (los campos
deben contener aproximadamente 100 glóbulos rojos).
6. FUENTES DE ERROR:
Hacer el conteo en los márgenes del frotis.
Aceite de inmersión de mala calidad o contaminado.
No comparar el recuento indirecto con el directo.
7 FORMA DE REPORTE:
Calcular el número de plaquetas de la siguiente forma:
Sacar la sumatoria de los 5 campos y obtener la media ,el resultado multiplicar por 10.000
Pagina:
LABORATORIO
SEÑOR DE SANTIAGO
MANUAL – POES – PROCESO ANÁLISIS
Título: PROCEDIMIENTO TÉCNICOS:
HEMOGRAMA
17/124
Revisión:
Código:
Fecha:
01 PD-TEC-01 01-07-2012
RECUENTO DE RETICULOSITOS
1. PROPÓSITO
Evaluar el funcionamiento de la médula ósea ya que los reticulocitos son glóbulos rojos jóvenes
que constituyen un índice de la respuesta eritropoyética.
2. MUESTRA:
2,5 ml de sangre venosa con EDTA o sangre capilar.
3. MATERIALES Y REACTIVOS:
Tubos de hemólisis
Capilares.
Láminas portaobjeto en buen estado.
Gradilla para tubos.
Guantes descartables.
Azul de cresil brillante.
4. EQUIPO:
Microscopio.
Baño de María o estufa a 37° C.
Contador manual.
5. PROCEDIMIENTO:
Verter un capilar lleno de azul cresil brillante y dos capilares llenos de sangre en un tubo
Mezclar bien e incubar a 37°C o a temperatura ambiente durante 15 minutos.
Preparar frotis de la mezcla de la forma usual, dejar secar.
Leer al microscopio con objetivo de inmersión.
Contar 10 campos en donde se observen 100 eritrocitos por campo, anotar los reticulocitos
observados.
Pagina:
LABORATORIO
SEÑOR DE SANTIAGO
MANUAL – POES – PROCESO ANÁLISIS
Título: PROCEDIMIENTO TÉCNICOS:
HEMOGRAMA
18/124
Revisión:
Código:
Fecha:
01 PD-TEC-01 01-07-2012
6. FUENTES DE ERROR:
No incubar los capilares a 37°C.
Colorante con precipitados.
Observar en campos donde los eritrocitos no estén uniformemente distribuidos.
7. FORMA DE REPORTE:
Se reportan los reticulocitos por cada 100 eritrocitos observados.
Cálculo:
Valores de referencia:
Adultos: 0.5% - 1.5%
Recién nacidos: 2.5% - 6.5%
% Reticulocitos =
Total de reticulocitos observados en 10 campos
Pagina:
LABORATORIO
SEÑOR DE SANTIAGO
MANUAL – POES – PROCESO ANÁLISIS
Título: PROCEDIMIENTO TÉCNICOS:
HEMOGLOBINA
19/124
Revisión:
Código:
Fecha:
01 PD-TEC-01 01-07-2012
HEMOGLOBINA
1. PROPÓSITO:
Evaluar la presencia y la severidad de la anemia. Este método consiste en efectuar una dilución
exacta de sangre en una solución que contiene ferrocianuro de potasio, que convierte la
hemoglobina en cianometahemoglobina y se compara colorimetricamente con una solución patrón
de cianametahemoglobina de concentración exacta y estable.
2. MUESTRA REQUERIDA:
Sangre venosa con EDTA o sangre capilar.
3. MATERIAL Y REACTIVO:
Cubetas estandarizadas de lectura.
Pipeta automática de 20 µL.
Tubos de hemólisis
Gradilla para tubos.
Marcador de vidrio.
Puntas plásticas.
Papel parafilm.
Guantes descartables.
Pipeta serológica.
Reactivo de cianametahemoglobina.
Estándar de hemoglobina.
4. EQUIPO:
Espectrofotómetro.
Mezclador mecánico (opcional).
Reloj marcador.
5. PROCEDIMIENTO:
Hacer una serie de tres tubos con el estándar de hemoglobina para calcular el factor de
calibración.
Colocar al primer tubo 2,5 ml del reactivo ( como blanco )
Colocar al segundo tubo 2,5 ml del reactivo ( estándar 10 ul )
Colocar al tercer tubo 2,5 mL del reactivo ( muestra 10 ul )
Mesclar bien
Incubar por 10 minutos a temperatura ambiente
Leerlos en espectrofotómetro a 540 nm y anotar la densidad óptica de los tubos.
Obtener la concentración de cada tubo en gramos por decilitros.
La preparación de la cianametahemoglobina estará sujeto a las indicaciones del fabricante
del reactivo..
Realizar la lectura y leer en el espectrofotómetro a 540 nm.
Pagina:
LABORATORIO
SEÑOR DE SANTIAGO
MANUAL – POES – PROCESO ANÁLISIS
Título: PROCEDIMIENTO TÉCNICOS:
HEMOGLOBINA
20/124
Revisión:
Código:
Fecha:
01 PD-TEC-01 01-07-2012
6. FUENTES DE ERROR:
Toma inadecuada de muestra.
Éstasis prolongada que resulta de dejar un torniquete en el brazo.
Presencia de líquido insterticial que diluye la muestra de sangre.
Mezclar incorrectamente de la muestra.
Errores de pipeteado o dilución.
Coagulación de la muestra.
Sangre hiperlipémica (afecta el color)
Numero alto de glóbulos blancos por mm. cúbico.
Calibración incorrecta.
Reactivo expuesto a la luz.
7. FORMA DE REPORTE:
La hemoglobina se reporta en gr/dL.
Calculo:
Valores de referencia:
Hombre: 14.0-17.0 gr/dL
Mujer: 12.5-15.0 gr/dL
Niños: 11.0-13.0 gr/dL
Recién nacidos: Hasta 18 gr/dL
Lectura del estándar
Pagina:
LABORATORIO
SEÑOR DE SANTIAGO
MANUAL – POES – PROCESO ANÁLISIS
Título: PROCEDIMIENTO TÉCNICOS:
HEMATOCRITO
21/124
Revisión:
Código:
Fecha:
01 PD-TEC-01 01-07-2012
HEMATOCRITO
1. PROPÓSITO:
El hematocrito es el volumen de eritrocitos expresados en porcentaje del volumen de sangre como
una fracción del volumen de sangre, para determinar si un paciente presenta o no anemia.
2. MUESTRA REQUERIDA:
Sangre venosa con EDTA o sangre capilar tomada directamente en tubos capilares heparinizados.
3. MATERIALES:
Tubos capilares heparinizados o no heparinizados.
Plastilina.
Lector de hematocrito.
4. EQUIPO:
Micro centrífuga para hematocrito con una fuerza de 10.000 – 13.000 rpm.
5. PROCEDIMIENTO:
Llenar el tubo de micro hematocrito mediante acción capilar, ya sea por una punción que
hace que la sangre fluya libremente o por sangre venosa bien mezclada. Los tubos capilares
deben estar llenos en dos terceras partes.
El extremo opuesto y exento de sangre se llena con plastilina para sellarlo.
Colocar el capilar sellado en una centrífuga para el micro hematocrito, con el extremo
abierto hacia el centro de la microcentrífuga.
Centrifugar a velocidades de 10,000 a 13,000 rpm por 5 minutos.
Después de centrifugado leer en la tabla para hematocrito haciendo coincidir el menisco del
plasma con el final de la marca de la tabla y el fondo del empacado de eritrocitos que
coincidan con el inicio de la marca de la tabla.
Leer siempre en la dirección de la numeración ascendente cuantos mL de empacados de
eritrocitos tiene la muestra.
Pagina:
LABORATORIO
SEÑOR DE SANTIAGO
MANUAL – POES – PROCESO ANÁLISIS
Título: PROCEDIMIENTO TÉCNICOS:
HEMATOCRITO
22/124
Revisión:
Código:
Fecha:
01 PD-TEC-01 01-07-2012
6. FUENTES DE ERROR:
Presencia del líquido intersticial si se obtiene de una punción dactilar.
Éstasis prolongado en la toma de la muestra.
Exceso de anticoagulante.
Llenado incorrecto del tubo capilar.
Mezcla inadecuada de la sangre.
Incluir en la lectura la capa de leucocitos.
Lectura del hematocrito en posición paralela.
Evaporación del plasma durante la centrifugación.
Dejar transcurrir el tiempo sin hacer la lectura.
Formación de burbujas en el plasma.
Centrifugación inadecuada.
Instrumento de lectura en malas condiciones o deteriorados.
7. FORMA DE REPORTE:
Se reporta el volumen de eritrocitos empacados en porcentaje del volumen total.
Valores de referencia:
Pagina:
LABORATORIO
SEÑOR DE SANTIAGO
MANUAL – POES – PROCESO ANÁLISIS
Título: PROCEDIMIENTO TÉCNICOS:
TIEMPO DE COAGULACIÓN
23/124
Revisión:
Código:
Fecha:
01 PD-TEC-01 01-07-2012
TIEMPO DE COAGULACIÓN.
MÉTODO DE LEE Y WHITE
1. PROPÓSITO:
Evaluar en forma global el mecanismo intrínseco de la coagulación.
2. MUESTRA:
Sangre venosa.
3. MATERIALES:
Jeringas descartables.
Tubos de hemólisis.
Torundas de algodón.
Gradillas para tubos.
Alcohol etílico al 70%.
Torniquete.
Guantes descartables.
4. EQUIPO:
Baño de María a 37°C.
Reloj marcador.
Termómetro.
5. PROCEDIMIENTOS:
Lavar y secar las manos y colocarse los guantes.
Identificar el tubo de acuerdo a la solicitud.
Explicar al paciente sobre el procedimiento que se le va a realizar.
Desinfectar cuidadosamente el área de punción
Obtener sangre venosa con una jeringa descartable y estéril.
Poner en marcha el cronómetro en el momento en que la sangre penetre en la jeringa.
Verter cuidadosamente 1 CC de sangre en 3 tubos, mantenerlos en baño María a 37ºC.
Invertir cada medio minuto (sin agitar) los 3 tubos hasta que cada uno pueda invertirse sin
que se vierta su contenido.
Tomar el tiempo de coagulación de cada uno de los tubos y luego sacar un promedio de los
tres.
Pagina:
LABORATORIO
SEÑOR DE SANTIAGO
MANUAL – POES – PROCESO ANÁLISIS
Título: PROCEDIMIENTO TÉCNICOS:
TIEMPO DE COAGULACIÓN
24/124
Revisión:
Código:
Fecha:
01 PD-TEC-01 01-07-2012
6. FUENTES DE ERROR
Uso de material mal lavado.
No tomar el tiempo en el momento de la extracción.
Temperatura del Baño de María inadecuada.
No cumplir con los intervalos de tiempo indicados en el procedimiento.
Invertir bruscamente el tubo.
7. FORMA DE REPORTE:
El tiempo de coagulación se reporta en minutos.
Valores de referencia:
5-10 minutos.
Pagina:
LABORATORIO
SEÑOR DE SANTIAGO
MANUAL – POES – PROCESO ANÁLISIS
Título: PROCEDIMIENTO TÉCNICOS:
TIEMPO DE SANGRAMIENTO
25/124
Revisión:
Código:
Fecha:
01 PD-TEC-01 01-07-2012
TIEMPO DE SANGRAMIENTO
( Método de IVY )
1. PROPÓSITO:
Evaluar el funcionamiento y número de plaquetas así como la contractilidad capilar.
2 MUESTRA:
Sangre del lóbulo de la oreja.
3. MATERIALES:
Lanceta descartable estéril.
Papel filtro.
Torundas de algodón humedecidas con alcohol.
Guantes descartables.
4. EQUIPO:
Cronómetro.
5. PROCEDIMIENTO:
Lavar y secar las manos y colocarse los guantes.
Explicar al paciente sobre el procedimiento que se le va a realizar.
Desinfectar cuidadosamente el área de punción.
Puncionar el lóbulo de la oreja.
Secar con el papel filtro cada medio minuto hasta que cese el sangramiento.
Realizar el secado en forma descendente o circular sin tocar la piel.
Anotar el tiempo desde que se punciona hasta que cesa el sangramiento y reportar.
6. FUENTES DE ERROR:
Presionar el lóbulo de la oreja para que fluya la sangre.
Rozar el papel filtro al dedo.
Punción inadecuada.
No marcar el tiempo en el momento de la punción.
Puncionar el área seleccionada cuando aún está húmeda.
Pagina:
LABORATORIO
SEÑOR DE SANTIAGO
MANUAL – POES – PROCESO ANÁLISIS
Título: PROCEDIMIENTO TÉCNICOS:
TIEMPO DE SANGRAMIENTO
26/124
Revisión:
Código:
Fecha:
01 PD-TEC-01 01-07-2012
7. FORMA DE REPORTE:
Reportar el tiempo de sangrado en minutos y segundos.
Valor de referencia:
1 - 4 minutos.
8.INTERPRETACIÓN DE LOS RESULTADOS:
El tiempo de sangrado se prolonga cuando disminuyen las plaquetas o cuando éstas son
anormales,como sucede en:
-Trombocitopenia
-Síndrome de disfunción plaquetario
-Anormalidades en la pared de los vasos pequeños
-Insuficiencia renal avanzada
-Hepatopatia grave
-Anemia aplástica
Pagina:
LABORATORIO
SEÑOR DE SANTIAGO
MANUAL – POES – PROCESO ANÁLISIS
Título: PROCEDIMIENTO TÉCNICOS:
VELOCIDAD DE ERITROSEDIMENTACIÓN
27/124
Revisión:
Código:
Fecha:
01 PD-TEC-01 01-07-2012
VELOCIDAD DE ERITROSEDIMENTACIÓN
1. PROPÓSITO:
La velocidad de Eritrosedimentación mide la velocidad de sedimentación de los glóbulos rojos en el
plasma.
2. MUESTRA REQUERIDA:
3 mL de Sangre venosa con EDTA.
3. MATERIALES:
Tubos para eritrosedimentación.
Soporte para tubos de sedimentación.
Guantes descartables.
4. EQUIPO:
Reloj marcador.
5. PROCEDIMIENTO:
Mezclar la muestra de sangre.
Llenar un tubo de Wintrobe hasta la señal cero, introduciendo cuidadosamente en el
conteniendo de la sangre hasta el fondo del tubo, cuidar de que no formén burbujas.
Colocar en el soporte, en posición perfectamente vertical durante 1 hora.
A la hora exacta leer de arriba hacia abajo el valor numérico en mm, midiendo la distancia
que hay entre el punto más bajo del menisco de la superficie y el límite superior del
sedimento de glóbulos rojos; los mm, leídos corresponden a la velocidad de sedimentación
por hora.
6. FUENTES DE ERROR:
Dejar transcurrir más de 2 horas entre la toma de la muestra y el montaje de la prueba.
Efectuar la prueba en temperaturas muy altas o muy bajas.
No leer a la hora exacta.
Presencia de coágulo en la sangre.
No realizar la debida corrección cuando es necesaria.
No hacer una buena mezcla de la muestra.
Que el tubo no este en posición completamente vertical.
La presencia de burbujas al llenar el tubo.
7. FORMA DE REPORTE:
Velocidad de eritrosedimentación se expresa en milímetros por hora (mm/h).
Valores de referencia:
Pagina:
LABORATORIO
SEÑOR DE SANTIAGO
MANUAL – POES – PROCESO ANÁLISIS
Título: PROCEDIMIENTO TÉCNICOS:
GRUPO SANGUINEO FACTOR RH
28/124
Revisión:
Código:
Fecha:
01 PD-TEC-02 01-07-2012
DETERMINACIÓN DEL GRUPO SANGUÍNEO FACTOR RH
1.OBJETIVO:
Determinar y tipificar el grupo sanguíneo del paciente en sangre total o anticuagulante
2.ALCANCE:
Área de hematología
3.FUNDAMENTO DEL MÉTODO:
Los glóbulos rojos del paciente se ponen en contacto con reactivo Anti- A,Anti-B y
Anti-D.Si
existen en la superficie de los eritrocitos los antígenos correspondientes,se producirá una
aglutinación visible macroscópicamente.La ausencia de aglutinación en todos casos,implica grupo
O,en el caso de Anti-A y Anti-B y un factor Rh(-) negativo en el caso de Anti-D.
4.MUESTRA REQUERIDA:
Muestra: Sangre venosa recogida de manera usual con anticuagulante ( EDTA,Citrato)
Cantidad: 2,5 ml
5.REACTIVOS:
Suero Anti A,Suero anti B,Suero anti D.
Instrucciones para su uso: Reactivos provistos listos para usar
Conservación: Conservar refrigerados ,estables hasta le fecha de vencimiento
6.MATERIALES:
- Tubos con anticuagulante
- Tubos de hemólisis
- Láminas o placa de reacción
- Solución fisiológica
- Centrifugadora
- Baño maria
- Timer
- Pipeta automática
- Aplicadores
- Guantes desechables
Pagina:
LABORATORIO
SEÑOR DE SANTIAGO
MANUAL – POES – PROCESO ANÁLISIS
Título: PROCEDIMIENTO TÉCNICOS:
GRUPO SANGUINEO FACTOR RH
29/124
Revisión:
Código:
Fecha:
01 PD-TEC-02 01-07-2012
7.PROCEDIMENTO:
Se procede con láminas o placas de reacción de fondo claro en el cual de deposita 3 gotas de sangre
( 50 ul ) a dichas gotas se adiciona una de los reactivos Anti A, Anti B, Anti D y se mezcla bien con
la ayuda de los aplicadores individualmente, se comienza con una agitación suave balanceando la
placa con la mano durante dos minutos, después se evalúa macroscópicamente la reacción que se
produce, toda aglutinación visible se considera como de grupo A, grupo B, grupo AB, y de factor
Rh positivo, según el tipo de reacción en cada caso; en el caso de no producirse aglutinación alguna
en ninguna de las tres mesclas
( Anti A, Anti B, Anti D ) se considera del grupo “O” Cero con factor Rh ( - ) negativo. En el caso
de un grupo con factor Rh ( - ) negativo se procederá al lavado de los glóbulos rojos de la siguiente
manera: en un tubo de hemólisis se coloca 1 ml de sangre en cuestión y 3 ml de solución fisiológica
se mescla por inversión y se centrifuga a 2000 rpm por 2 minutos, se desecha el sobrenadante se
mezcla bien el centrifugado se alícuota 100 ul de la misma en un tubo de hemólisis y se le agrega
100 ul. de Anti D y se lleva a baño maria mesclando y observando la reacción por 2 minutos,
manteniendo siempre el tubo en el baño maria, con esto se confirma el factor Rh.
8.LIMITACIONES DEL PROCEDIMENTO:
-
Muestra coagulada
Pagina:
LABORATORIO
SEÑOR DE SANTIAGO
MANUAL – POES – PROCESO ANÁLISIS
Título: PROCEDIMIENTO TÉCNICOS:
DETERMINACIÓN B-HCG CUALITATIVO
30/124
Revisión:
Código:
Fecha:
01 PD-TEC-03 01-07-2012
DETERMINACIÓN B-HCG CUALITATIVO
1. OBJETIVO:
Investigar la presencia de la hormona gonadotropina coriónica (HCG) en suero, plasmau orina y
detectar el embarazo.
2.ALCANCE:
Área de inmunología
3.DEFINICIONES:
La coriogonadotrofina es una hormona peptídica producida por la placente,contituida por dos
fracciones diferentes,llamadas alfa y beta,que tiene la función de estimular la formación del cuerpo
lúteo y el crecimiento del útero.
4.FUNDAMENTO DEL MÉTODO:
Prueba de un solo paso basado en la técnica inmunocromatográfica.La muestra ( suero,plasma u
orina),migra a través de una membrana.Si la
HCG está presente,esta reacción con anticuerpos
monoclonales específicos contra la alfa HCG formando inmunocomplejos,los cuales están
marcados con un colorante rojo.
Estos complejos son capturados por anticuerpos movilizados contra la beta HCG formando una
línea roja en la zonade prueba.Los anticuerpos inmovilizados anti ratón capturan el exceso de
reactivo formando una línea roja en la zona control confirmando el correcto funcionamiento de la
prueba.
5. MUESTRA REQUERIDA:
Tipo: Suero,plasma u orina
Cantidad: 2,5 ml
Recolección: De manera usual
Conservación: De preferencia emplear muestra fresca.Se puede conservar 2 dias ( 2 a 8 º C )
6.REACTIVOS:
Tiras de pruba que contienen: colorante rojo,Anti alfa HCG ( ratón monoclonal ),Anti Beta HCG
( ratón monoclonal ) y anti ratón IgG ( cabra ).
Instrucciones para su uso: Reactivos provistos listos para usar
Conservación: Estables a temperatura ambiente ( < a 25 º C ) hasta la fecha de vencimento
Evitar la contaminación
Proteger de la luz.
7. MATERIALES
- Marcador de vidrio.
- Dispensadores plásticos.
- Pipetas para medir volúmenes indicados
-Tubos de hemólisis
-Cronómetro
- Guantes descartables.
Pagina:
LABORATORIO
SEÑOR DE SANTIAGO
MANUAL – POES – PROCESO ANÁLISIS
Título: PROCEDIMIENTO TÉCNICOS:
DETERMINACIÓN B-HCG CUALITATIVO
31/124
Revisión:
Código:
Fecha:
01 PD-TEC-03 01-07-2012
8.. EQUIPO:
- Macrocentrífuga.
- Rotador serológico.
- Reloj marcador.
9. PROCEDIMIENTO:
- Llevar a temperatura ambiente los reactivos y las muestras.
-Las muestras de sangre deben centrifugarse por 5 minutos para la obtención del suero.
- En un tubo de hemólisis colocar 1 a 2 cc de muestra
-Introducir la tira( con las flechas hacia abajo ),teniendo cuidado de no sumergir esta mas allá del
nivel marcado.
-Esperar 5 minutos para suero y 10 minutos para orina.
10.RESULTADOS:
Positivo:
presencia de dos líneas ( control y desconocido ),sin importar la intensidad.(
concentración mayor a 25 Ul/L )
Negativo: Una sola línea marcada ( control)
Inválido: Ninguna línea presente o únicamente la presencia de la línea del test
11.VALORES ESPERADOS:
- Negativo en hombres y mujeres no embarazadas
- Positivo en embarazo ( concentación mayor a 25 Ul/L )
12.LIMITACIONES DEL PROCEDIMIENTO:
-Condiciones distintas al embarazo ( enfermedad trofoblástica tales como carcinoma o quiste
hidatiforme) y ciertos neoplasmas no trofoblásticos causan elevados niveles del HCG.
-Si la orina está muy diluida ( baja densidad ) podría no detectarse la presencia de hormona.
-Altos títulos de factor Reumatoideo,anticuerpos heterofílicos,sueros hiperlipémicos o hemolíticos
pueden causar resultados falsamente positivos.
- Las concentraciones altas de hormonas folículo estimulante y luteinizante presentan reacción
cruzada con la hormona gonadotropina coriónica.
13.INTERPRETACIÓN DE LOS RESULTADOS:
Niveles aumentados:
-Embarazo
-Embarazo ectópico
-Mola hidatiforme del útero coariocarcinoma uterino,testicular u ovárico
-Tumor
Niveles disminuidos:
-Amenaza de aborto
-Aborto incompleto
-Muerte fetal
14.REFERENCIAS:
Guia de pruebas diagnósticas y de laboratorio K.D.Pagana-T.J.Pagana
Pagina:
LABORATORIO
SEÑOR DE SANTIAGO
MANUAL – POES – PROCESO ANÁLISIS
Título: PROCEDIMIENTO TÉCNICOS:
REACCIÓN DE WIDAL
32/124
Revisión:
Código:
Fecha:
01 PD-TEC-04 01-07-2012
DETERMINACION DE REACCION DE WIDAL (FIEBRE TIFOIDEA).
( REACTIVO DIALAB )
PRUEBA LATEX (AGLUTINACION)
1.DEFINICION.
La Salmonella es un Bacilos Gram (-) flagelos peritricos alrededor. Es una enfermedad
infecciosa producida por algunos serotipos de S. Typhi. Su reservorio es el cuyo mecanismo de
contagio es fecal – oral a través de H2O y alimentos contaminados con deyecciones.
El germen ingresa por vía digestiva, llega al intestino, pasando finalmente a la sangre causando una
fase de Bacteremia hacia la 1º semana de enfermedad, entra al organismo y produce fenómenos
inflamatorios y necróticos debido a la liberación de Endocartidis.
PERIODO DE INCUBACION. 10 – 15 días donde se presentan trastornos con una fase de
bacteremia con fiebre aumentada 39 – 40 ºC , cefalea, tumefacción de mucosa nasal ulceras en el
paladar la enfermedad puede evolucionar a la curación en 2 semanas o prolongarse si no se somete
a un TX adecuado puede presentarse complicaciones graves con hemorragias y peroraciones
intestinales, shock endotopico.
2.FUNDAMENTO.
La aglutinación se considera como una reacción en 2 etapas. Cuando se añade al Ag de suero se
produce una combinación Fisicoquímica en la que el Ac. Se fija a la superficie del Ag. Va seguido
de una aglutinación en presencia de solución salina. El grado de aglutinación depende de la
composición salina y la Tº.
Los títulos altos d Ag O significan una infección en la fase aguda (aparece rápidamente y
desaparece), títulos altos de Ag. H corresponda a la fase de Convalecencia (aparece lentamente y es
de larga duración) y es de Memoria.
3.MATERIALES Y REACTIVOS:
- Reactivo para REACCION DE WIDAL (Listo para Usar)
- THYPI “O”
- THYPI “H”
- PARATHYPI “A”
- PARATHYPI “B”
- Control Positivo y Negativo del Reactivo
- Placa para RX. WIDAL
- Micro pipeta
- Tips
- Rotador de Placa
- Reloj o Timer
Pagina:
LABORATORIO
SEÑOR DE SANTIAGO
MANUAL – POES – PROCESO ANÁLISIS
Título: PROCEDIMIENTO TÉCNICOS:
REACCIÓN DE WIDAL
4.MUESTRAS:
-
33/124
Revisión:
Código:
Fecha:
01 PD-TEC-04 01-07-2012
Suero
5.ENSAYO:
Método
Látex Aglutinación
Temperatura:
8…25 ºC
Sensibilidad del Reactivo 86 % (Sífilis Primaria)
100 % (Sífilis Secundaria)
Especificidad del Reactivo 98 %
Interpretación
Visual
Estándar:
Punto de corte Dil 1/80
Rango:
NEGATIVO
Estabilidad del Reactivo: Conservar a 2 – 8 º C y Protegidos de la luz.
6.PROCEDIMIENTO:
1 .- Colocar en la Placa para WIDAL 50 ul de SUERO.
2.- Sobre la Muestra colocar 50 ul de REACTIVO para Widal
3 .- Colocar al Agitador de Placa durante 2 min.
4 .- Observar la aglutinación a contra luz. En caso de ser positivo diluir hasta encontrar el punto de
corte.
5 .- El Resultado o titulo obtenido se informa como POSITIVO añadiendo la dilución en la que
esta. Pero si no hubiera aglutinación informar como NEGATIVO.
7.VALORES DE REFERENCIA:
Suero. Adultos
NEGATIVO
8.PATRONES DE REFERENCIA:
Para asegurar la exactitud de los resultados, se recomienda utilizar sueros de control POSITIVO y
NEGATIVO.
9.INTERFERENCIAS:
Hemoglobina:
Lipemia
Bilirrubinas:
Factor Reumatoide
No hay interferencia significativa hasta 10 g/l.
No hay interferencia significativa hasta 10 g/l
No hay interferencia significativa hasta 20 mg/dl.
No hay interferencia significativa hasta 300 IU/ml
Pagina:
LABORATORIO
SEÑOR DE SANTIAGO
MANUAL – POES – PROCESO ANÁLISIS
Título: PROCEDIMIENTO TÉCNICOS:
DETERMINACIÓN DE V.D.R.L. ó R.P.R.
34/124
Revisión:
Código:
Fecha:
01 PD-TEC-05 01-07-2012
DETERMINACIÓN DE V.D.R.L. ó R.P.R.
SÍFILIS (DIALAB)
1.-OBJETIVOS.Determinar la presencia de treponema pallidiumm
2.-ALCANCE.Área de inmunologia
3.-DEFINICIONES.La sífilis es producida por una espiroqueta denominada Treponema pallidum.Existen dos grupos de
anticuerpos que contituyen la base de estas pruebas.El primer grupo de pruebas detecta la presencia
de un anticuerpo no treponémico llamado reagina que reacciona con los fosfolípidos del organismo
del paciente.
Las pruebas de determinación de anticuerpos no treponémicos se conocen como STS ( Serologic
test for syphilis ) y son relativamente poco específicas.
Estos anticuerpos se detectan con mas frecuencia mediante la prueba de Wassermann o prueba del
VDRL. La reacción de reagina plasmática rápida ( RPR ) es una prueba mas moderna y
sensible.Dado que se basan en la detección de un anticuerpo no específico,las pruebas del VDRL y
la de RPR presentan una tasa elevada de falsos positivos ( o reacción cruzada ). La prueba del
VDRL es positiva aproximadamente a las dos semanas de que el paciente haya sido infectado por
Treponema y vuelve a ser normal una vez que el paciente ha recibido el tratamiento adecuado.
Si la prueba delVDRL o la de RPR son positivas,el diagnóstico puede confirmarse mediante una
prueba treponémica como la prueba de absorción de anticuerpos treponémicos fluorescentes
( fluorescent treponemal antibody test;FTA-ABS).Este segundos grupo de pruebas detecta
anticuerpos específicos contra treponema.
3.FUNDAMENTO DEL MÉTODO.La SYPHILIS RPR TEST es una prueba de aglutinación no treponémica que se usa para detectar y
cuantificar anticuerpos reagínicos.La presencia de estos anticuerpos corresponden a un diagnóstico
presuntivo de sífilis.El antígeno usado en este análisis es una modificación del antígeno VDRL el
cual contiene micropartículas de carbón para aumentar la diferencia visual entre un resultado
positivo y uno negativo.Si una muestra contiene anticuerpos anti-reagínicos,se observa una
aglutinación de las partículas antígeno - carbón.En muestras no reactivas ,la suspensión muestraantígeno tiene apariencia homogénea.
Pagina:
LABORATORIO
SEÑOR DE SANTIAGO
MANUAL – POES – PROCESO ANÁLISIS
Título: PROCEDIMIENTO TÉCNICOS:
DETERMINACIÓN DE V.D.R.L. ó R.P.R.
4.MUESTRA REQUERIDA.-Suero
-Cantidad: 50 ul
-Recolección de suero: manera usual
-Conservación: a 2 – 8 º C 8 dias
A - 20º C 3 meses
5.REACTIVOS.RPR- carbon
Las partículas de carbón contiene:
Cardiolipina,Lecitina,Colesterol
Phosfato buffer ph 7,0
Azida se sodio
20 mmol/l
0,95 g/l
Control positivo
Suero humano con reagina
Azida de sodio
_> ¼
0,95 g/l
Control negativo
Suero animal
Azida de sodio
0,95 g/l
6.INSTRUCCIONES PARA SU USO.-Reactivo listo para su uso
7.CONSERVACIÓN DE REACTIVOS.-Cerrar inmediatamente después de su uso
- Estable entre 2 – 8 º C hasta la fecha de expiración
8.MATERIAL REQUERIDO.-Tarjeta de prueba
-Micropipetas para medir volúmenes indicados
-Aplicadores
-Cronómetro
-Guantes desechables
35/124
Revisión:
Código:
Fecha:
01 PD-TEC-05 01-07-2012
Pagina:
LABORATORIO
SEÑOR DE SANTIAGO
MANUAL – POES – PROCESO ANÁLISIS
Título: PROCEDIMIENTO TÉCNICOS:
DETERMINACIÓN DE V.D.R.L. ó R.P.R.
36/124
Revisión:
Código:
Fecha:
01 PD-TEC-05 01-07-2012
9.-PROCEDIMIENTO.- Llevar Antígeno y controles a temperatura ambienta
En una placa colocar
Desconocido
Control
Desconocido
Control
Reactivo RPR
50 ul
1 gota
Mesclar y agitar en forma circular
50 ul
1 gota
por 8 minutos
10.CÁLCULO DE LOS RESULTADOS.-Positivo - Negativo
-Inmediatamente después de los 8 minutos leer los resultados microscópicamente a la luz
directa.Un resultado reactivo se indica por aglutinación gruesa en el centro y la periferia del círculo
de la prueba.Un resultado negativo ( no reactivo ) muestra una suspensión de apariencia homogénea
sin aglutinaciones visibles:
11.-MÉTODO DE CONTROL DE CALIDAD.Control positivo,Control negativo se deben analizar en cada serie de muestras y ser comparados en
las lecturas de los resultados.
El control negativo debe mostrar una suspensión homogénea sin aglutinación visible.
El control positivo debe presentar clara aglutinación macrocópica dentro de los 8 minutos.
12.-VALORES DE REFERENCIA.Reactivo
No Reactivo
13.-LIMITACIONES DEL PROCEDIMENTO.- El R.P.R. no especifica el grupo de sífilis
- Pueden dar falsos positivos en mononucleasis infecciosa,neumonía viral,toxoplasmosis
- Altas temperaturas causa en los componentes un aspecto de aglutinación dando resultados
falsos positivos.
- Hemólisis excesiva y lipemia macroscópica
14.-INTERPRETACIÓN DE LOS RESULTADOS.Resultados anormales. SÍFILIS
Pagina:
LABORATORIO
SEÑOR DE SANTIAGO
MANUAL – POES – PROCESO ANÁLISIS
Título: PROCEDIMIENTO TÉCNICOS:
LATEX R.A.
37/124
Revisión:
Código:
Fecha:
01 PD-TEC-06 01-07-2012
DETERMINACION DE FR (FACTOR REUMATOIDE)
( REACTIVO DIALAB )
PRUEBA LATEX (AGLUTINACION)
1.DEFINICION.
El Factor es un Ac. Reactivo contra en fragmento de la IgG. Este Ac. Del FR es producido
por los linfocitos B y esta compuesto por inmunoglobulinas. El Ac FR esta compuesto de 2
cadenas pesadas y 2 cadenas ligeras cada una de ellas con una región constante y una región
variable.
El FR en una prueba que mide la presencia y nivel de la IgM especifica contra las IgG
anormales producida por los linfocitos de la membrana sinovial de las articulaciones
de personas afectadas por la Artritis Reumatoidea.
La Artritis Reumatoidea es una enfermedad crónica que produce la inflamación de las
articulaciones principalmente de las manos y pies. Cuando se originas estas inmunoglobulinas IgG
y se fijan en la IgM se forman INMUNOCOMPLEJAS IgG-IgM que activan al complemento y
otros factores inflamatorios que producen secundariamente la destrucción de las articulaciones
afectadas por ello se los llama ENFERMEDAD AUTOINMUNE ya que el sistema inmunitario del
individuo es el que destruye tejidos del propio cuerpo.
Resultado Positivo en Artritis Reumatoidea , Dermatomiositis, Hepatitis crónica, Infección
Viral Crónica.
2.FUNDAMENTO.Se basa en la aglutinación entre el FR de la muestra del paciente o el suero de control y la Ig
humana G que cubre las partículas Látex Poli-estereno.
3.MATERIALES Y REACTIVOS:
- Reactivo LATEX FR (Listo para Usar)
- Control Positivo y Negativo del Reactivo
- Placa para FR
- Micro pipeta
- Tips
- Rotador de Placa
- Stat fax
- Reloj o Timer
Pagina:
LABORATORIO
SEÑOR DE SANTIAGO
MANUAL – POES – PROCESO ANÁLISIS
Título: PROCEDIMIENTO TÉCNICOS:
LATEX R.A.
4.MUESTRAS:
-
38/124
Revisión:
Código:
Fecha:
01 PD-TEC-06 01-07-2012
Suero
5.ENSAYO:
Método
Temperatura:
Sensibilidad del Análisis
Sensibilidad del Reactivo
Especificidad del Reactivo
Interpretación
Estándar:
Rango:
Estabilidad del Reactivo:
Látex Aglutinación
18…25 ºC
8 (6 - 16 ) IU/ml
100 %
98,8 %
Visual
8 UI/ml
HASTA 200 UI/ml
Conservar a 2 – 8 º C y Protegidos de la luz.
6.PROCEDIMIENTO:
1 .- Colocar en la Placa para FR 50 ul de SUERO.
2.- Sobre la Muestra colocar 50 ul de REACTIVO
3 .- Colocar al Agitador de Placa durante 2 min.
4 .- Observar la aglutinación. En caso de ser positivo diluir hasta encontrar el punto de corte.
5 .- El Resultado o titulo obtenido multiplicar por su FACTOR DE 8 UI/ml.
7.VALORES DE REFERENCIA:
Suero. Adultos
HASTA 8 UI/ml
8.PATRONES DE REFERENCIA
Para asegurar la exactitud de los resultados, se recomienda utilizar sueros de control POSITIVO y
NEGATIVO.
9.INTERFERENCIAS:
Hemoglobina:
Lipemia
Bilirrubinas:
No hay interferencia significativa hasta 5 g/l.
No hay interferencia significativa hasta 5 g/l
No hay interferencia significativa hasta 15 mg/dl.
Pagina:
LABORATORIO
SEÑOR DE SANTIAGO
MANUAL – POES – PROCESO ANÁLISIS
Título: PROCEDIMIENTO TÉCNICOS:
PROTEINA C REACTIVA
39/124
Revisión:
Código:
Fecha:
01 PD-TEC-07 01-07-2012
DETERMINACION DE PCR (PROTEINA C REACTIVA)
( REACTIVO DIALAB )
PRUEBA LATEX (AGLUTINACION)
1.DEFINICION.
La PCR es una proteína que no atraviesa la barrera placentaria. Su nombre se debe a la
capacidad para precipitar los Polisacáridos C de los Neumococos. Es una proteína de la fase
aguda y se incrementa en suero en una Gram. variedad de Enfermedades Inflamatorias o como
respuesta a Necrosis tisular.
Su determinación es importante debido a que aumenta rápidamente al comienzo de la
enfermedad 14 – 26 horas luego de la inflamación o injuria tisular y desaparece en la etapa de
recuperación, apareciendo solo durante la fase activa del proceso inflamatorio. La PCR se encuentra
comúnmente aumentada en Artritis Reumatoidea activa, infarto agudo de miocardio, también se la
pude hallar luego de una transfusión sanguinea.
La determinación de PCR no solo indica la intensidad de la enfermedad si no
también la respuesta de un paciente a un tratamiento
2.FUNDAMENTO.La PCR serica con 6 mg/L o mayor concertación provoca una aglutinación de las partículas de
Látex Recubiertas con ANTI-PCR. Cualquier proceso infeccioso es inflamatorio.
3.MATERIALES Y REACTIVOS:
- Reactivo LATEX PCR (Listo para Usar)
- Control Positivo y Negativo del Reactivo
- Placa para PCR
- Micro pipeta
- Tips
- Rotador de Placa
- Stat fax
- Reloj o Timer
4.MUESTRAS:
-
Suero
Pagina:
LABORATORIO
SEÑOR DE SANTIAGO
MANUAL – POES – PROCESO ANÁLISIS
Título: PROCEDIMIENTO TÉCNICOS:
PROTEINA C REACTIVA
40/124
Revisión:
Código:
Fecha:
01 PD-TEC-07 01-07-2012
5.ENSAYO:
Método
Temperatura:
Sensibilidad del Análisis
Sensibilidad del Reactivo
Especificidad del Reactivo
Interpretación
Estándar:
Rango:
Estabilidad del Reactivo:
Látex Aglutinación
18…25 ºC
6 (5 - 10 ) mg/L
95,6 %
96,2 %
Visual
6 mg/L
HASTA 6 mg/L
Conservar a 2 – 8 º C y Protegidos de la luz.
6.PROCEDIMIENTO:
1 .- Colocar en la Placa para PCR 50 ul de SUERO.
2.- Sobre la Muestra colocar 50 ul de REACTIVO
3 .- Colocar al Agitador de Placa durante 2 min.
4 .- Observar la aglutinación. En caso de ser positivo diluir hasta encontrar el punto de corte.
5 .- El Resultado o titulo obtenido multiplicar por su FACTOR DE 6 mg/L
7.VALORES DE REFERENCIA:
Suero. Adultos
HASTA 6 mg/L
8.PATRONES DE REFERENCIA:
Para asegurar la exactitud de los resultados, se recomienda utilizar sueros de control POSITIVO y
NEGATIVO.
9.INTERFERENCIAS:
Hemoglobina:
Lipemia
Bilirrubinas:
Factor Reumatoide
No hay interferencia significativa hasta 10 g/l.
No hay interferencia significativa hasta 10 g/l
No hay interferencia significativa hasta 20 mg/dl.
No hay Interferencia significativa hasta 100 IU/mL
Pagina:
LABORATORIO
SEÑOR DE SANTIAGO
MANUAL – POES – PROCESO ANÁLISIS
Título: PROCEDIMIENTO TÉCNICOS:
PRUEBA ASTO
41/124
Revisión:
Código:
Fecha:
01 PD-TEC-08 01-07-2012
DETERMINACION DE ASTO (ANTI-STREPTOLISINA O )
( REACTIVO HUMAN )
PRUEBA LATEX (AGLUTINACION)
1.DEFINICION.
Son Streptococcus pyogenes son anaerobios facultativos que dan positivo en fiebre reumática y
glomérulo nefritis. La mayor parte contiene Ag del grupo A son B-hemolíticos que es el principal
patógeno humano asociado con invasión local o sistémica y con transtornos inmunitarios después
de la infección..
- Hemolisinas Cocos Gram. (+) B-hemolíticos Cuando hay lisis de glóbulos rojos
con liberación de Hemoglobina.
- &-Hemolíticos Cuando hay lisis incompleta de Glóbulos Rojos con formación de
pigmento verde.
Streptococcus B – Hemolíticos del Grupo A.
Streptococcus pyogenes.- Coco Gram. (+). Contiene la ESTREPTOLISINA O que es una proteína
hemoliticamente activa en estado reducido y en presencia de O2 se inactiva.
Antiestreptolisina O .- Impide la hemólisis de los hematíes por la estreptolisina “O”.
Proteína M.- Factor importante de la virulencia para S. Pyogenes. Produce faringitis, pioderma o
impétigo, endocarditis infecciosa.
La Fiebre Reumática tiene un periodo de incubación de 1 a 4 semanas que es Post-streptocosica y
es la secuela mas grave de la infección por S. Hemolíticos daña el miocardio y válvulas cardiacas.
Pacientes con Faringitis streptocosica grave tienen mayor probabilidad de desarrollar Fiebre
Reumática.
2.FUNDAMENTO:
La streptolisina O producida por el Streptococcus del Grupo A produce hemólisis en contacto con
hematíes al colocar el suero que contiene Ac. Antiestreptolisina en presencia de dosis constante
formando una reacción Ag – Ac que neutraliza la capacidad hemolítica.
3.MATERIALES Y REACTIVOS:
- Reactivo LATEX ASTO (Listo para Usar)
- Control Positivo y Negativo del Reactivo
- Placa para ASTO
- Micro pipeta
- Tips
- Rotador de Placa
- Stat fax
- Reloj o Timer
Pagina:
LABORATORIO
SEÑOR DE SANTIAGO
MANUAL – POES – PROCESO ANÁLISIS
Título: PROCEDIMIENTO TÉCNICOS:
PRUEBA ASTO
4.MUESTRAS:
-
42/124
Revisión:
Código:
Fecha:
01 PD-TEC-08 01-07-2012
Suero
5.ENSAYO:
Método
Temperatura:
Sensibilidad del Análisis
Sensibilidad del Reactivo
Especificidad del Reactivo
Interpretación
Estándar:
Rango:
Estabilidad del Reactivo:
Látex Aglutinación
18…25 ºC
200 (+- 50 ) UI/ml
98 %
97 %
Visual
200 UI/ml
HASTA 200 UI/ml
Conservar a 2 – 8 º C y Protegidos de la luz.
6.PROCEDIMIENTO:
1 .- Colocar en la Placa para ASTO 50 ul de SUERO.
2.- Sobre la Muestra colocar 50 ul de REACTIVO
3 .- Colocar al Agitador de Placa durante 2 min.
4 .- Observar la aglutinación. En caso de ser positivo diluir hasta encontrar el punto de corte.
5 .- El Resultado o titulo obtenido multiplicar por su FACTOR DE 200 UI/L.
7.VALORES DE REFERENCIA:
Suero. Adultos
Niños menores a 5 años
HASTA 200 UI/L
HASTA 100 UI/L
8.PATRONES DE REFERENCIA
Para asegurar la exactitud de los resultados, se recomienda utilizar sueros de control POSITIVO y
NEGATIVO.
9.INTERFERENCIAS:
Hemoglobina:
Lipemia
Factor Reumatoide
Bilirrubinas:
No hay interferencia significativa hasta 5 g/l.
No hay interferencia significativa hasta 5 g/l
No hay interferencia significativa hasta 300 IU/ml.
No hay interferencia significativa hasta 15 mg/dl.
Pagina:
LABORATORIO
SEÑOR DE SANTIAGO
MANUAL – POES – PROCESO ANÁLISIS
Título: PROCEDIMIENTO TÉCNICOS:
DETERMINACIÓN DE GLICEMIA
43/124
Revisión:
Código:
Fecha:
01 PD-TEC-09 01-07-2012
DETERMINACION DE GLICEMIA
(Enzimática colorimétrica )
1.- OBJETIVO:
Determinar la concentración de glicemia en la muestra utilizada
2.- CAMPO DE APLICACIÓN:
Química sanguínea
3.- DEFINICIONES:
La concentración de la glucosa en sangre es regulada por varias hormonas, incluyendo dos
antagonistas: insulina y glucagón.
La cuantificación de glucosa en sangre es usada para el diagnóstico de desórdenes del metabolismo
de carbohidratos tales como diabetes,glicemia neonatal,hipoglicemia idiopática y enfermedad
pancreática.
La mayoria de los problemas fisiológicos estan ligados a hiperglicemia (Diabetes mellitas tipo I y
Diabetes mellitas tipo II ).
4.- FUNDAMENTO:
La glucosa se determina después de la oxidación enzimática en presencia de glucosa oxidasa.El
peróxido de hidrógeno formado reacciona bajo la catálisis de peroxidasa con fenol y 4
aminofenazona formando un complejo rojo – violeta usando la quinoneimina como indicador.
Glucosa + 02 + H20
glucosa oxidasa
2 H202 + Fenol +4-aminofenazona
Ácido glucónico + H202
Peroxidasa
Quinoneimina + 4 H202
5.- MUESTRA REQUERIDA:
Muestra: -suero libre de hemólisis
- Plasma recolectado con fluoruro o heparinizado
Cantidad: - 10 microlitros
Condición: - paciente en ayunas
Estabilidad: - suero estable por 8 hrs 2- 5 ºC y 3 dias de 2 a 8 º
- plasma preservado con fluoruro o heparinizado es estable 24 hrs. a
temperatura ambiente.
Concentraciones superiores: Si la concentración de glucosa es superior a 400 mg/dL diluir la
muestrta 1 + 2 con agua destilada y repetir la prueba.Multiplicar el resultado por 3
Pagina:
LABORATORIO
SEÑOR DE SANTIAGO
MANUAL – POES – PROCESO ANÁLISIS
Título: PROCEDIMIENTO TÉCNICOS:
DETERMINACIÓN DE GLICEMIA
7.- REACTIVOS:
- Buffer fosfato ( ph 7,5 )
- 4 aminofenazona
-Fenol
-Glucosa oxidasa
-Peroxidasa
- Mutarotasa
- Estabilizantes
-Estándar: Glucosa
44/124
Revisión:
Código:
Fecha:
01 PD-TEC-09 01-07-2012
0,1 mol/L
0,25 mmol/L
0,75 mmol/L
> 15 KU/L
> 1,5 KU/L
> 2,0 KU/L
100 mg/dL
8.- INTRUCCIONES PARA SU USO:
-Reactivos provistos: listo para su uso
-Estándar: listo para su uso
9.-CONSERVACIÓN DE REACTIVOS:
-Reactivo y estándar estable entre 2 a 8 ºC hasta la fecha de caducidad
10.-MATERIAL REQUERIDO:
-Star Fax
-Micropipetas para medir volúmenes indicados
-Tubos de hemólisis
- Vortex
-Cronómetro
-Guantes desechables
-Baño Maria
-Guantes
11.-PROCEDIMIENTO:
En 4 tubos marcados como blanco ,estándar,control ,desconocido añadir
BLANCO
STANDART
CONTROL
DESCONOCIDO
Rtvo.único
1 ml
1 ml
1 ml
1 ml
Agua destilada
10 ul
Standard
10ul
Control
10 ul
Desconocido
10 ul
Mezclar e incubar 5 min.a 37 ºC,leer la absobancia en el star fax a 500 nm contra blanco de
reactivo.
Pagina:
LABORATORIO
SEÑOR DE SANTIAGO
MANUAL – POES – PROCESO ANÁLISIS
Título: PROCEDIMIENTO TÉCNICOS:
DETERMINACIÓN DE GLICEMIA
45/124
Revisión:
Código:
Fecha:
01 PD-TEC-09 01-07-2012
12.-CALCULO DE RESULTADOS : Los calculos son automatizados,tomando en cuenta la
siguiente fórmula:
A muestra
C = 100 x
( mg/dL )
A Std
13.-MÉTODO DE CONTROL DE CALIDAD:
Para asegurar la exactitud de los resultados se recomienda utilizar sueros de origen animal
HUMATROL.
14.-VALOR DE REFERENCIA :
Suero,plasma: 75 a 115 mg/dL
15.- INTERPRETACIÓN DE LOS RESULTADOS :
Hiperglicemia
-Diabetes mellitos
-Respuesta a la agresión aguda.
-Sindrome de Cushing
-Feocromocitoma
-Insuficiencia renal cronica
-Pancreas agudo
Hipoglicemia
-Insulinoma
-HipotiroidismoInsuficiencia adenohipoficiaria
-Emfermedad de Addison
-Hepatopatía extensa
-Sobredosis de insulina
-Inanición
16.-INTERFERENCIAS :
-Muestras hemolizadas
-Farmacos que producen un aumento o disminución de la glucosa
-Sueros ictéricos
-Líquidos intravenosos(contienen dextrosa y se convierten en glucosa )
17.-PRECAUCIONES
-Revisar que los equipos esten en optimas condiciones para su uso
-Material limpio
-Verificar la temperatura del baño maria
-verificar que las pipetas esten en buen estado ( calibradas )
18.REFERENCIAS.
-K.D.Pagana T.J. Pagana
Guias de pruebas diagnósticas y de laboratorio . Octava ediccón
Pagina:
LABORATORIO
SEÑOR DE SANTIAGO
MANUAL – POES – PROCESO ANÁLISIS
Título: PROCEDIMIENTO TÉCNICOS:
DETERMINACIÓN DE CREATININA
46/124
Revisión:
Código:
Fecha:
01 PD-TEC-10 01-07-2012
DETERMINACION DE CREATININA
( Colorimétrico – Cinético )
1.- OBJETIVO:
Determinar la concentración de creatinina en sangre y orina
Brindar resultados confiables
2.- DEFINICIONES:
La Creatinina es un desecho espontáneo del metabolismo de la creatinina. Es un excelente marcador
de la función renal
Un índice alto de creatinina en suero ( asociado a un índice alto de urea ) corresponde a una
disminución en la filtración glomerular en el riñon .La prueba de creatinina en suero es más fiable
que la prueba de urea.
La prueba de Creatinina puede ser utilizada par medir la FGR.En casos de transplante de riñon,
cualquier incremento de creatinina en suero, por pequeño que sea, puede reflejar un rechazo del
transplante. Un incremento de creatinina en suero y orina puede ser un signo de necrosis muscular.
3.- FUNDAMENTO:
Es medida la cantidad de complejo coloreado formando entre la creatinina y el picrato alcalino.
El efecto de sustancias interferentes reduce el uso de procedimientos cinéticos.
4.- MUESTRA REQUERIDA:
Muestra :
Suero
Plasma heparinizado o floruro
Orina de 24 horas diluida en 9,5 ml de agua destilada +500uL de orina antes
del análisis
Cantidad :
2,5 ml de sangre venosa y orina de 24 horas
Recolección :
Conservación :
Sangre de manera usual
El suero es estable a 2-8 º C.
La orina es estable 4 días a 2-8 º C
Para un almacenamiento prolongado , las muestras deben congelarse.
Pagina:
LABORATORIO
SEÑOR DE SANTIAGO
MANUAL – POES – PROCESO ANÁLISIS
Título: PROCEDIMIENTO TÉCNICOS:
DETERMINACIÓN DE CREATININA
5.- REACTIVOS:
Reactivo 1 : R1
Ácido pícrico
Reactivo 2: R2
Hidroxido de sodio
Fosfato disódico
Estándar : Std
Creatinina
8,73
mmol/L
312,5
12,5
mmol/L
mmol/L
2
20
177
mg/dl
mg/L
umol/L
47/124
Revisión:
Código:
Fecha:
01 PD-TEC-10 01-07-2012
Reactivos listos para su uso
6.- INSTRUCCIONES: para su uso preparar reactivo de trabajo
Mesclar: 0,5 ml ( 500 ul ) de R1 con
0,5 ml ( 500 ul ) de R2
Estable 1 mes a 20 – 25 ºC
Estandart: listo para su uso
7.- MATERIALES Y EQUIPOS:
-Espectrofotómetro
-Micropipetas y pipetas para medir los volúmenes indicados
-Tubos de hemólisis
-Vortex
-Cronómetro
-Guantes desechables ( 340 a 600 nm )
8.- PROCEDIMIENTO: En los tubos de hemólisis marcar Blanco,Standard, Control y
desconocido.. ,colocar 1 ml de reactivo de trabajo y leer contra blanco de reactivo
B
Reactivo de trabajo
Estándar
Muestra (suero)
Suero control
Mezclar y leer la absorbancia a 500 nm
ST
D
C
1 ml
1 ml
1 ml
-
100ul
-
-
-
100ul
-
1 ml
-
100ul
Pagina:
LABORATORIO
SEÑOR DE SANTIAGO
MANUAL – POES – PROCESO ANÁLISIS
Título: PROCEDIMIENTO TÉCNICOS:
DETERMINACIÓN DE CREATININA
48/124
Revisión:
Código:
Fecha:
01 PD-TEC-10 01-07-2012
9.-TÉCNICA PARA ORINA :
Orina de 24 horas
Preparación del reactivo de trabajo:
Reactivo R1:
500ul
Reactivo R2:
500ul
Mezclar bien y listo para su uso:
B
ST
D
C
Reactivo de trabajo
1ml
1ml
1ml
1ml
Estándar
100ul
Muestra (orina diluida 1/20 con
Agua destilada)
100ul
Control
100ul
Mezclar y leer la absorbancia ( 500 nm ) tras añadir la muestra o estándar.
10.- CALCULO DE RESULTADOS:
(A2 – A1)Muestra x n
n= concentración del estandar
(A2 – A1)Estandar
11.-VALORES DE REFERENCIA:
Hombres
Mujeres
Hombres
Mujeres
Suero 0,8 - 1,3
0,6 – 1,2 mg/dL
Orina
0,8 – 2,0
0,6 – 1,8 g/24hrs
12.-LIMITACIONES DEL PROCEDIMENTO:
-Hiperbilirrubinemia
-Suero hiperlipemicos
-Fármacos nefrotóxicos cefalosporinas como ( Cefoxitina ),Aminoglicósidos ( Gentamicina )
pueden producir un aumento de la creatinina.
13.-INTERPRETACIÓN DE RESULTADOS:
NIVELES AUMENTADOS:
Glomerulonefritis
Pielonefritis
Necrosis tubular aguda
Obstruccón de las vias urinarias
Disminución del flujo sanguineo renal
Nefropatia diabetica
Nefritis
NIVELES DISMINUIDOS:
Debilitamiento
Disminución de la masa muscular
14.-REFERENCIAS
Manual de tecnicas basicas de laboratorio de INLASA
K.D Pagana, T.J. Pagana Guia de pruebas diagnósticas y de laboratorio octava ediccón
Manual del reactivo ELITEch
Pagina:
LABORATORIO
SEÑOR DE SANTIAGO
MANUAL – POES – PROCESO ANÁLISIS
Título: PROCEDIMIENTO TÉCNICOS:
DETERMINACIÓN DE UREA
49/124
Revisión:
Código:
Fecha:
01 PD-TEC-11 01-07-2012
DETERMINACION DE UREA
( Enzimático- Cinético)
1.-OBJETIVO:
-Determinar la concentración de úrea en suero y orina .
-Brindar un apoyo confiable en el diagnostico clinico
2.-DEFINICIONES:
La úrea es un metabolito producido por la degradación del catabolismo de las proteinas .La
biosíntesis de amonio a úrea esta a cargo de de las enzimas hepáticas. Más del 90 % de la úrea
producida se excreta por los riñones, y el remanente es eliminado a través del tracto
gastrointestinal o por la piel.
3.-FUNDAMENTO:
La úrea es hidrolizada en presencia de agua y ureasa para producir amonio y dióxido de carbono.El
amonio producido en esta reacción se combina con 2 oxoglutarato y NADH en presencia de
glutamato-deshidrogenasa (GLDH ) para formar glutamato y NAD +
Urea +2H2O------ureasa-----------2NH4 + CO3 22 - oxoglutarato + NH4+
----------GLDH----------- L-Glutamato + H20 + NAD + NADH
4.-MUESTRA REQUERIDA:
Muestra: -Suero o plasma heparinizado (excepto con heparina de amonio )
- Diluir la orina 1 + 100 con agua destilada ( resultado x 101 )
Cantidad : - 10 ul de suero
Recolección: de manera usual
Conservación: - Suero y plasma son estables por 24 horas a temperatura ambiente
y 1 semana
refrigerada a 4 grados centigrados, congelados a -15º C y -2ºC estable de 2 a 3 meses Orina es
estable por 4 dias a 4 -8ºC
Concentraciones superiores: Muestras con concentrtaciones superiores deben diluirse 1 + 1 con
agua destilada y repetir la prueba.Multiplicar los resultados por dos.
5.-REACTIVOS:
ENZ
Buffer tris ( pH 7,8 )
ADP
Ureasa
GLDH
Azida de sodio
125 mmol/l
0,88 mmol/l
_> 20 Ku/l
>_0,3 Ku/l
0,095 %
Pagina:
LABORATORIO
SEÑOR DE SANTIAGO
MANUAL – POES – PROCESO ANÁLISIS
Título: PROCEDIMIENTO TÉCNICOS:
DETERMINACIÓN DE UREA
50/124
Revisión:
Código:
Fecha:
01 PD-TEC-11 01-07-2012
SUB
2 oxoglutarato
NADH
Azida de sodio
25 mmol/l
1,25 mmol/l
0,095 %
STD
Urea
80 mg/dl
Azida de sodio
0,095 %
6.-INTRUCCIONES PARA SU USO:
ENZ y STD están listos para usar.
El Reactivo de trabajo se prepara mesclando 4 partes de ENZ con 1 parte de SUB
Ej: 800 ul de ENZ + 200 ul de SUB.
7.-CONSERVACION DE LOS REACTIVOS:
Los reactivos almacenados entre 2..8ºC se mantienen estables hasta la fecha de caducidad,aún
después de abrir.Se debe evitar la contaminación de los reactivos.
El Reactivo de Trabajo se mantiene estable por 5 dias entre 15 ….25 º C y por 4 semanas entre
2…8 º C
8.-MATERIALES Y EQUIPOS REQUERIDOS:
-Espectrofotómetro ( 340 a 600 nm )
-Micropipetas y pipetas para medir los volúmenes indicados
-Tubos de hemolisis
-Crónometro
-Vortex
-Guantes desechables
9.-PROCEDIMIENTO: (Cinético )
En cuatro tubos de hemolisis marcados B ( Blanco ) S ( Stándard ) , D ( Desconido ) y
C ( Control ) colocar 1 ml de reactivo de trabajo de trabajo y leer contra blanco de reactivo,realizar
las lecturas tubo por tubo.
Blanco
Estándar
Control
Desconocido
Rtvo de trabajo
1 ml
1ml
1ml
1ml
Mezclar, esperar 25 segundos y luego añadir
Agua destilada
10 ul
Estándar
10 ul
Control
10 ul
Desconocido
10 ul
-Mezclar y leer la variación de absorbancia a 340 nm a 37 ºC entre 30 y 90 seg.
Pagina:
LABORATORIO
SEÑOR DE SANTIAGO
MANUAL – POES – PROCESO ANÁLISIS
Título: PROCEDIMIENTO TÉCNICOS:
DETERMINACIÓN DE UREA
51/124
Revisión:
Código:
Fecha:
01 PD-TEC-11 01-07-2012
10.-CÁLCULO DE LOS RESULTADOS:
Suero,plasma
C = 80 x Amuestra / Astd ( mg/dl)
0rina
C = 80,8 x Amuestra/ Astd ( mg/dl )
11.-MÉTODO DE CONTROL DE CALIDAD:
-Suero control HUMAN de concentración conocida
12.-VALORES DE REFERENCIA:
Suero,plasma: 10 – 50 mg/dL
Orina:
20 - 35 g/24 h
13.-INTERFERENCIAS:
Bilirrubinas: No hay interferencia hasta 60 mg/dL
Hemoglobina: No hay interferencia hasta 500 mg/dL
Glucosa: No hay interferencia hasta 500 mg/dL
14.-INTERPRETACIÓN DE LOS RESULTADOS:
Causas de aumento:
-Extrarenal:
Hepatopatia
Hemorragia digestiva
Incremento en la formación de úrea ( exceso proteico en dieta )
-Nefropática:
Necrosis tubular aguda ( por isquemia,shock,insuficiencia cardíaca )
Enfermedad renal ( Glomerulonefritis aguda,vasculitis,pielonefritis aguda,nefritis
intersticial,hipersensililidad ).
Neoplasias ( por infiltración neoplásica )
Enfermedades generales ( hemólisis,rabdomiólisis,coagulación intravascular diseminada )
Obstrucción Vascular ( trombosis y embolia de la arteria renal,trombosis de la vena renal)
Obstrucción de las vias urinarias ( litiasis,neoplasia,tuberculosis )
Hipertensión arterial,diabetes,enfermedades sistémicas ( lupus,vasculitis amiloidosis )
15. REFERENCIAS
Manual de tecnicas de laboratorio INLASA
K. D .Pagana T. J. Pagana, Guias de pruebas diagnosticas y de laboratrio octava edición
Prospecto tecnica de Human.
Pagina:
LABORATORIO
SEÑOR DE SANTIAGO
MANUAL – POES – PROCESO ANÁLISIS
Título: PROCEDIMIENTO TÉCNICOS:
DETERMINACIÓN DE ACIDO URICO
52/124
Revisión:
Código:
Fecha:
01 PD-TEC-12 01-07-2012
DETERMINACIÓN DE ÁCIDO URICO
( Enzimático - Colorimétrico )
1.-OBJETIVOS:
Determinar la concentración de ácido úrico en suero, plasma
Brindar un apoyo confiable en el diagnostico clínico al médico
2.-DEFINICIÓN:
El ácido úrico es un compuesto nitrogenado procedente del catabolismo de la purina (un
componente básico del ácido desoxirribonucleico ADN. Estas pueden tener una procedencia
exógena , a través del consumo de proteínas , o endógena siendo esta ultima la más importante el
organismo elimina el ácido urico diariamente, el 60 % lo hace a través de la orina mediante el
filtrado glomerular, con absorción posterior , en los tubulos renales.
3.-FUNDAMENTO:
El ácido urico es oxidado por la enzima uricasa. El peróxido de hidrógeno formado reacciona por
la acción catalítica de la peroxidasa con ácido 3,5-dicloro-2-hidroxibenzenesulfónico (DCHBS) y 4
aminofenazona (PAP) para producir un complejo rojo-violeta de quinoneimina como indicador.
uricasa
Ácido urico + H2O + O2 ------------------ Alantoina + CO2 +H2O2
DCHBS + PAP + 2H2O2
POD
----------- quinoneimina + HCl + 4H20
La intensidad del color es proporcional a la concentración del ácido úrico de la muestra
4.-MUESTRA REQUERIDA:
Tipo:
Suero o Plasma,orina de 24 hrs. (diluida 1:10)
Cantidad:
20 ul
Conservación: Muestra estable por 30 min.
5.-REACTIVOS:
Composición:
RGT
Buffer fosfato ( pH 7,0 )
Uricasa
DCHBS
4-aminophenazona
Peroxidasa (POD )
50 mmol/l
200 U/l
4 mmol/l
0,3 mmol/l
1 kU/l
Pagina:
LABORATORIO
SEÑOR DE SANTIAGO
MANUAL – POES – PROCESO ANÁLISIS
Título: PROCEDIMIENTO TÉCNICOS:
DETERMINACIÓN DE ACIDO URICO
53/124
Revisión:
STD
Ácido urico
Azida de sodio
Código:
Fecha:
01 PD-TEC-12 01-07-2012
8mg/dl
0,095 %
6.-CONSERVACIÓN DE LOS REACTIVOS:
Reactivos estables aún abiertos ,hasta su fecha de caducidad almacenados de 2…8 ° C.Debe
evitarse la contaminación de reactivos.
Almacenado de 15…25 ° C,protegido de la luz,el RGT es estable por 2 semanas.
7.-INSTRUCCIONES PARA SU USO
Reactivos provistos listos para usar
Estandar listo para su uso
8.-MATERIAL Y EQUIPOS REQUERIDO:
-Espectofotómetro ( 340 a 600 nm)
-Micropipetas y pipetas para medir los volúmenes requeridos
-Tubos de hemolisis
-Reloj ó cronometro
-Guantes desechables
9.-PROCEDIMIENTO:
Atemperar los reactivos antes de usarlos (5 minutos)
Marcar los tubos de hemolisis:
B
STD
Reactivo de trabajo
Agua destilada
Estandar
Muestra
Suero control
1 ml
20 ul
1ml
D
1ml
C
1ml
20 ul
20 ul
20 ul
-Mezclar bien, incubar a baño maria a 37°C durante 5 minutos y leer a absorbancia a 545 nm
contra blanco de reactivo.
-Se recomienda realizar diluciones aquellos resultados mayores a 20 mg/dL,diluyendo la muestra
1:1 con NaCl ( 9 g/l ) y multiplicar los resultados por 2.
Pagina:
LABORATORIO
SEÑOR DE SANTIAGO
MANUAL – POES – PROCESO ANÁLISIS
Título: PROCEDIMIENTO TÉCNICOS:
DETERMINACIÓN DE ACIDO URICO
54/124
Revisión:
Código:
Fecha:
01 PD-TEC-12 01-07-2012
10.-METODO DE CONTROL DE CALIDAD
Suero comercial Human
11.-CÁLCULO DE LOS RESULTADOS
Acido úrico: A muestra/ Aestandar x 8 ( mg/dl)
Acido úrico en orina:Amuestra/Aestandar x 88 (mg/dl)
12.-VALORES DE REFERNCIA:
En suero: Varones: 3,6 - 8,2 mg/dL
Mujeres: 2,3 - 6,1 mg/Dl
En orina: Varones: <_ 800 mg/24hrs.
Mujeres: <_ 600 mg/24hrs.
13.-LIMITACIONES DEL PROCEDIMENTO:
-Bilirrubinas > a 20 mg/dl
-Triglicéridos > a 2000 mg/dl
-Hemoglobina > a 50 mg/dl
-Valores encima de 20 mg/dl
-Material mal lavado
14.-INTERPRETACIÓN DE LOS RESULTADOS:
Hiperuricemia
-Gota
-Aumento del aporte de purinas
-Cancer metastático
-Mieloma múltiple
-Leucemia
-Quimioterapia anticancerosa
-Hemólisis
-Acidosis
-Nefropatia crónica
Hipouricemia
-Enfermedad de Wilson
-Síndrome de Fanconi
-Intoxicaci´pn por plomo
-Atrofia amarilla del hígado
15.-REFERENCIAS:
-Técnica para ácido úrico Human
-K.D.Pagana,T.J.Pagana.Guia de pruebas diagnósticas y de laboratorio octava edición.
LABORATORIO
SEÑOR DE SANTIAGO
Pagina:
55/124
MANUAL – POES – PROCESO ANÁLISIS
Revisión:
Código:
Fecha:
01 PD-TEC-13 01-07-2012
Título: PROCEDIMIENTO TÉCNICOS:
BILIRRUBINA TOTAL, DIRECTA e INDIRECTA
BILIRRUBINAS TOTAL, DIRECTA e INDIRECTA
1.-OBJETIVO:
Determinar la concentración de la bilirrubina en suero
Reportar resultados comfiables
Dar un apoyo certero en el diagnostico clínico
2.-ALCANCE:
Área de química sanguínea
3.-FUNDAMENTO:
La bilirrubina reacciona específicamente con el ácido sulfanílico diazotado produciendo un
pigmento color rojo – violáceo ( azobilirrubina ) que se mide fotocolorimetricamente a 530 nm.
Si bien la bilirrubina conjugada ( directa ) reacciona directamente con el diazorreactivo, la
bilirrubina no conjugada ( indirecta ) requiere la presencia de un desarrollador acuoso que posibilite
su reacción.De forma tal que,para que reaccione la bilirrubina total ( conjugada y no conjugada )
presente en la muestra,debe agregarse benzoato de cafeina al medio de la reacción.
Ácido sulfanilico + NaNO2 ------------------------ Ácido sulfanilico diazotado
Bilirrubina + Ácido sulfanilico diazotado -------------- Azobilirrubina
4.-MUESTRA REQUERIDA:
Tipo:
Suero o plasma libre de hemólisis
Cantidad:
3 ml de sangre venosa
Recolección: De manera usual,proteger de la luz natural o artificial,envolviendo el tubo con papel
negro
Conservación: La muestra debe ser preferentemente fresca.En caso de no efectuarse el ensayo en
el momento,el suero debe conservarse hasta 48 hrs. en el refrigerador ( 2-10°C) y la sangre entera
no mas de 24 hrs. en refrigerador o 12 hrs. a temperatura ambiente.
5.-REACTIVOS:
-Desarrollador: solución acuosa de benzoato de cafeina 0,13 mol/l tamponada y estabilizada.
-Nitrito de sodio: solución de nitrito de sodio 0,07 mol/l
-Reactivo sulfanílico: solución de ácido sulfanílico 29mmol/l y ácido clorhídrico 0,17 mol/l
-Intrucciones para su uso
Desarrollador: listo para usar
Reactivo sulfanílico:listom para usar
Diazorreactivo: 1270 microlitros de reactivo sulfanílico + 1 gota de nitrito de sodio
LABORATORIO
SEÑOR DE SANTIAGO
Pagina:
56/124
MANUAL – POES – PROCESO ANÁLISIS
Revisión:
Código:
Fecha:
01 PD-TEC-13 01-07-2012
Título: PROCEDIMIENTO TÉCNICOS:
BILIRRUBINA TOTAL, DIRECTA e INDIRECTA
Conservación de de los reactivos: Los reactivos provistos son estables a temperatura ambiente
hasta la fecha de vencimento
Diazorreactivo en refrigerador (2-10°C) y en frasco de vidrio ambar 3 meses a partir de la
Preparación.
-Indicios de inestabilidad: La presencia de sedimento o cambio de coploración de los
reactivos,puede ser inicio de deterioro de los mismos.
6.-MATERIALES:
Micropipetas y pipetas para medir los volumen requeridos
Tubos de hemolisis
Agitador
Papel negro ó otro material para cubrir los tubos para impedir la penetración de la luz
Guantes esteriles
7.-EQUIPOS:
Espectrofotómetro
8.-PROCEDIMIENTO:
BLANCO
Muestra
200 ul
Agua destilada
2,5 ml
Desarrollador
Rtvo.Sulfanlílico
200 ul
Diazoreactivo
-
DIRECTA
200 ul
2,5 ml
200 ul
TOTAL
200 ul
2,5 ml
200 ul
Mezclar de inmediato cada tubo por inversión.Luego de 5 minutos,leer en espectrofotómetro a
530 nm,respectivamente ( B,D,T,).Las lecturas pueden efectuarse entre 4 y 15 min,excepto para la
bilirrubina directa que debe leerse a los 5 min. Exactos.Si se lee antes habrá subvaloración de los
resultados por reaación incompleta.Si se lee después habrásobrevaloración porque comienza a
reaacionar la bilirrubina libre.
Sueros Ictéricos: debe emplearse menos cantidad de muestra según la severidad de la ictericia,en
Ictericia moderada se usarán 50 ul de suero( resultado multiplicar por 3,79)
Ictericia intensa 20 ul de suero (resultado multiplicar por 9,38)
9.METODOS DE CONTTROL
Sueros comerciales
LABORATORIO
SEÑOR DE SANTIAGO
Pagina:
57/124
MANUAL – POES – PROCESO ANÁLISIS
Revisión:
Código:
Fecha:
01 PD-TEC-13 01-07-2012
Título: PROCEDIMIENTO TÉCNICOS:
BILIRRUBINA TOTAL, DIRECTA e INDIRECTA
10.VALORES DE REFERENCIA
-Adultos:
Directa: hasta 0,2 mg/dl
Total: hasta 1,0 mg/dl
-Recién nacidos
Nacidos a término
Prematuro
Sangre de cordón
2,5 mg/dl
Hasta las 24 hrs.
6 mg/dl
8 mg/dl
Hasta las 48 hrs.
7,5 mg/dl
12 mg/dl
Del 3º al 5º dia
12 mg/dl
24 mg/dl
Bilirrubina Directa
Mayor a 0,2 mg/dL
11.INTERPRETACIÓN DE LOS RESULTADOS
Niveles aumentados de bilirrubina conjugada ( directa )
Cálculos biliares
Obstrucción del conducto extrahepático ( tumor ,inflamación, cálculo biliar ,cicatriz o traumatismo
quirúrgico )
Metástasis hepática generaliza
Colestasia yatrógena
Niveles aumentados de bilirrubina no conjugada ( indirecta )
Eritroblastosis fetal
Ictericia hemolítica
Transfusión sanguínea de gran volumen
Resolución de hematoma grande
Hepatitis
Sepsis
Hiperbilirrubinemia neonatal
Anemia Hemolítica
Anemia perniciosa
Cirrosis
Anemia drepanocítica
Síndrome de Gilbert
Síndrome de Crigler-Najjar
Reacción a la transfusión
12.REFERENCIAS
K.D. Pagana. T.J Pagana . Guias de pruebas diagnósticas y de laboratorio
Manual de tecnicas de Laboratorio de INLASA
Prospecto de linea Winner
Mosby / Doyma libros .Manual clínico de pruebas de laboratorio
Pagina:
LABORATORIO
SEÑOR DE SANTIAGO
MANUAL – POES – PROCESO ANÁLISIS
Título: PROCEDIMIENTO TÉCNICOS:
TRANSAMINASAS GOT
58/124
Revisión:
Código:
Fecha:
01 PD-TEC-14 01-07-2012
DETERMINACIÓN DE GOT/AST
( Cinético UV )
1.-OBJETIVO:
Es la determinación cinética de la actividad de la GOT en sangre
Emitir valores confiables
Brindar un apoyo certero en el diagnostico clínico
2.-ALCANCE:
Química Sanguínea
3.-DEFINICIONES
El aspartato aminotransferasa ( AST ) tambien conocida como transaminasa glutamato oxalacetíca (
GOT ) es una transaminasa ampliamente distribuida en el interior de las diversas células ,
preferentemente en las hepáticas ( corazón , músculo esqueletico y riñones ) y con menor
importancia en las musculares .
4.-FUNDAMENTO:
La AST ( GOT ) cataliza la transferncia de un grupo amino del L-aspartato para el a- cetoglutarato
para formar L- glutamato.
GOT
L- Aspartato + 2-oxoglutarato --------------------Oxalacetato + L- Glutamato
MDH
Oxalocetato +NADH + H------------------- L-Malato + NAD + MDH = Malato dehidrogenasa
5.-MUESTRA REQUERIDA:
Tipo:
Suero libre de hemólisis
Cantidad:
100 ul
Recolección: de manera usual
Conservación: La GOT en suero es estable hasta 3 dias refrigerado. No congelar
6.-REACTIVO
BUF
Buffer/reactivo enzimático
Buffer TRIS (pH 7,8)
L-aspartato
LDH
MDH
100 mmol/l
300 mmol/l
> 0,9 kU/l
> 0,6 kU/l
Pagina:
LABORATORIO
SEÑOR DE SANTIAGO
MANUAL – POES – PROCESO ANÁLISIS
Título: PROCEDIMIENTO TÉCNICOS:
TRANSAMINASAS GOT
SUB Substrato
2 – oxoglutarato
NADH
59/124
Revisión:
Código:
Fecha:
01 PD-TEC-14 01-07-2012
60 mmol/l
0,9 mmol/l
7.-INSTRUCCIONES PARA SU USO: Preparar reactivo de trabajo
Mesclar
800 ul = de Buffer con
200 ul = de substrato
Standard: listo para su uso
Precauciones:
Los reactivos contienen menos de un 0,1% de ázida sódica, puede reaccionar con el cobre o platino
de las tuberías formando metales de azidas explosivas, si desecha a la tubería lave con abundante
agua.
8.-CONSERVACIÓN DE REACTIVOS:
Conservar a 2 – 8 ºC y protegidos de la luz
Los reactivos son estables hasta la fecha de caducidad que figura en la etiqueta
El reactivo de trabajo es estable 4 SEMANS DE 2…8°C y 5 dias 15…25 ° C
9.-MATERIAL Y EQUIPOS REQUERIDO:
-Espectrofotómetro (340-600 nm).
-Micropipetas y pipetas para medir volúmenes indicados.
-Tubos de hemolisis.
-Agitador de tubos ( vortex).
-Guantes desechables.
10.-PROCEDIMIENTO
Atemperar los reactivos a medio ambiente antes de usarlos.
B
Reactivo de trabajo
Muestra
Control
1ml
D
1ml
100 ul
C
1 ml
100 ul
Mezclar, leer la absorbancia con blanco de reactivo a 340 – 405 nm leer tubo por tubo.
Si la diferencia de absorbancia por minuto excede 0,160 a 334 nm/340 nm o 0,08 a 365 nm, diluir
0,1 ml de muestra con 0,9 ml de solución fisiológica y repetir el ensayo usando esta dilución.El
reultado multiplicar por 10.
Pagina:
LABORATORIO
SEÑOR DE SANTIAGO
MANUAL – POES – PROCESO ANÁLISIS
Título: PROCEDIMIENTO TÉCNICOS:
TRANSAMINASAS GOT
60/124
Revisión:
Código:
Fecha:
01 PD-TEC-14 01-07-2012
11.-METODOS DE CONTROL:
Suero control Human
12.-VALORES DE REFERENCIA:
Hombres hasta 37 U/L
Mujeres hasta 31 U/L
13.-LIMITACIONES DEL PROCEDIMIENTO:
-Sueros hemolisados
-Las muestras con concentraciones de cetoácidos endógenos particularmente elevados producen
valores falsamente elevados.
-Material mal lavado
-Sueros ictéricos
14.-INTERPRETACIÓN DE RESULTADOS
Niveles aumentados
Cardiopatias ( infarto de miocardio,intervenciones quirurgicas cardíacas,Cateterismo cardíaco )
Hepatitis
Cirrosis
Necrosis hepática
Tumor o metástasis hepática
Colestasia
Ictericia
Infarto de micardio
Pancreatitis aguda
Consumo de alcohol
Cancer de páncreas
14.2 Niveles disminuidos:
Nefropatia aguda
Beri beri
Cetoacidosis diabética
Embarazo
Diálisis renal crónica
15.-REFERENCIAS
Mosby/Doyma Libros Manual clínico de pruebas de laboratorio Madrid. España
K.D Pagana , T.J Pagana . Guías de pruebas diagnósticas y de laboratorio 0ctava edicón
Manual de Técnicas de Laboratorio INLASA
Prospecto de la linea Human
Pagina:
LABORATORIO
SEÑOR DE SANTIAGO
MANUAL – POES – PROCESO ANÁLISIS
Título: PROCEDIMIENTO TÉCNICOS:
TRANSAMINASAS GPT
61/124
Revisión:
Código:
Fecha:
01 PD-TEC-15 01-07-2012
DETERMINACIÓN DE GPT/ALT
( Cinético UV )
1.-OBJETIVO
Determinar la concentración de esta enzima en suero o plasma
Emitir resultados confiables
2.-ALCANCE:
Química sanguínea
3.-DEFINICIONES
La alamina aminotrasferasa ( ALT ) es una enzima , tambien conocida como glutamato piruvato
transaminasa ( GPT ) .
Se encuetran niveles altos de esta enzima en el higado , riñones y en pequeña cantidades el corazón
y el músculo esqueletico.
4.-FUNDAMENTO
La GPT cataliza la transferencia de un grupo amino de la L-alanina con 2 oxoglutarato para dar L –
glutamato
GPT
L- Alanina + 2 oxoglutarato ----------------------- Piruvato +L-Glutamato
LDH
Piruvato + NADH + H+ ---------------------- L-Lactato + NAD+ LDH = Lactato deshidrogenada
5.-MUESTRA REQUERIDA
Tipo:
Suero libre de hemólisis,plasma con EDTA o con heparina de litio
Cantidad:
100 ul
Recolección: de manera usual
Conservación: Es estable 24 hrs. a temperatura ambiente,disminuci{on de la actividad con 3 dias
6.-REACTIVOS:
BUF
Buffer /reactivo enzimático
Buffer TRIS ( Ph 7,5 )
L-alanina
LDH
SUB
Substrato
2 – oxoglutarato
NADH
150 mmol/l
750 mmol/l
> 1,2 kU/l
90 mmol/l
0,9 mmol/l
Pagina:
LABORATORIO
SEÑOR DE SANTIAGO
MANUAL – POES – PROCESO ANÁLISIS
Título: PROCEDIMIENTO TÉCNICOS:
TRANSAMINASAS GPT
62/124
Revisión:
Código:
Fecha:
01 PD-TEC-15 01-07-2012
7.-INSTRUCCIONES PARA SU USO: Preparar reactivo de trabajo
800 ul de BUF con
200 ul de SUB
8.- CONSERVACIÓN DE LOS REACTIVOS:
Reactivos listos para su uso,los reactivos son estables,aúin después de abiertos,hasta su fecha de
vencimiento cuando se almacenan de 2….8 ° C protegidos de la luz.
El reactivo de trabajo es estable 4 semanas de 2…8°C,5 dias de 15…25°C
9.-MATERIAL REQUERIDO:
Micropipetas y pipetas automaticas para medir los volúmenes necesarios
Tubos de hemolisis
Agitador vortex
Guantes desechables
10.EQUIPOS:
Espectrofotómetro
11.-PROCEDIMIENTO
Atemperar los reactivos antes de usarlos
Prepara el reactivo de trabajo
Reactivo BUF
800 ul
Reactivo SUB
200 ul
Reactivo de trabajo
Muestra
Suero control
B
1 ml
D
1 ml
100 ul
C
1 ml
100 ul
Llevar el equipo a cero con el reactivo de trabajo ,inmediatamente leer la absorbancia de la muestra
, luego el control.
Mezclar, leer la absorbancia ( 340nm ) después de 1 minuto y al mismo tiempo activar el
cronómetro. Leer nuevamente la absorbancia exactamente después de 1,2 y 3 minutos.
El espectrofotómetro se lo puede programar en el modo cinético con tiempo de prelectura de 60
segundos y el tiempo de lectura de 120 segundos. Con el filtro de 340 nm. Y el equipo saca la
concentración directamente
Pagina:
LABORATORIO
SEÑOR DE SANTIAGO
MANUAL – POES – PROCESO ANÁLISIS
Título: PROCEDIMIENTO TÉCNICOS:
TRANSAMINASAS GPT
63/124
Revisión:
Código:
Fecha:
01 PD-TEC-15 01-07-2012
Linealidad.-Si la diferencia de Absorvancia por min o la actividad excede 0,160 (350 U/l) diluir 0,1
ml de muestra con 0,9 ml de solución fisiológica (NaCl 0,9 %) y repetir el ensayo usando esta
dilución.Multiplicar el resultado por 10.
Precaución .- Los reactivos contienen menos del 1 % de ázida sódica , que puede reaccionar con el
cobre o plomo de las tuberías formando metales de ácida explosivos .Si descarta en tubería lavar
con abundante agua.
12.-CÁLCULO DE LOS RESULTADOS:
A partir de las lecturas calcular la media del cambio de absorbancia por min (A/min).
Calcular la actividad de la GPT en la muestra usando el siguiente factor:
U/L=(A/min)x -1745
13.-METODOS DE CONTROL:
Suero control Human
14.-VALORES DE REFERENCIA:
Mujeres: 0 – 32 U/L
Hombres: 0 – 42 U/L
15.-INTERPRETACIÓN DE RESULTADOS
Niveles aumentados
- Hepatitis
- Necrosis hepática
- Isquemia hepática
- Cirrosis
- Colestasis
- Tumor hepático
- Fármacos hepatotóxicos
- Ictericia obstructiva
- Quemaduras graves
- Traumatismo del músculo estriado
- Pancreatitis
- Infarto de miocardio
- Mononucleosis infecciosa
- Shock
16.-REFERENCIAS.- Guia de pruebas diagnósticas y de laboratorio K.D.Pagana,T.J. Pagana 8º edición
- Prospecto de la linea Human
Pagina:
LABORATORIO
SEÑOR DE SANTIAGO
MANUAL – POES – PROCESO ANÁLISIS
Título: PROCEDIMIENTO TÉCNICOS:
FOSFATASA ALCALINA
64/124
Revisión:
Código:
Fecha:
01 PD-TEC-16 01-07-2012
DETERMINACION DE FOSFATA ALCALINA
(REACTIVO WIENER)
METODO COLORIMETRICO
DETERMINACION CUANTITATIVA DE F. ALCALINA EN SUERO O PLASMA
DEFINICION:
La Fosfatasa Alcalina es una enzima ampliamente distribuida en el organismo. Hidroliza los
monoesteres del ácido ortofosforico en medio alcalino.
En el adulto proviene en parte del hígado (fracción termoestable) y en parte del hueso, sistema
reticuloendotelial y vascular (fracción termolábil), dando lugar a distintas isoenzimas.
La actividad serica de fosfatasa alcalina ósea, en condiciones normales, alcanza su mayor actividad
en los niños en edad de crecimiento (llegando a triplicar los niveles del adulto) debido a que esa
izoenzima se localiza en los osteoblastos (relacionados con la calcificación y formación de
estructuras óseas). También es fisiológico el aumento que se produce al final de primer trimestre
del embarazo, a expensas de la isoenzima placentaria que en este periodo alcanza niveles máximos
(aproximadamente el doble de los valores normales).
Entre las patologías que afectan la actividad serica de fosfatasa alcalina, se puede citar:
- Carcinomas metastáticos en hígado y hueso (productores de enzima).
- Colestasis Biliar
- Fenómenos osteoblasticos
- Trastornos de mala absorción acompañadas de lesiones ulcerosas
(donde la deficiencia de vitamina D produce osteomalacia con el
consecuente aumento de fosfatasa alcalina ósea) e incluso lesiones
en vías de reparación tales como infarto agudo de miocardio, infarto
pulmonar o renal.
PRINCIPIO DE LA REACCIÓN:
F. Alcalina
Fosfatasa nitrofenil + AMP --------------- Fosfato nitrofenol + 4-Amino antipirina
Ph 8,5 – 10
F. Nitrofenol + Ferrocianuro de K -------------- I I De color rojo
MATERIALES Y REACTIVOS:
REACTIVOS PROVISTAS
Búfer: 4 aminoantipirina 29 mmol/l en solución de aminometil propanol 3 mol/l p H 10 (a 37º C).
NaFF: Fenilfosfato de sodio, 1,4 mmoles.
Reactivo de color: Ferrocianuro de potasio, 10 mmol/l
Estándar: solución de fenol equivalente de 200 UI/L
REACTIVOS NO PROVISTOS:
Agua destilada.
Pagina:
LABORATORIO
SEÑOR DE SANTIAGO
MANUAL – POES – PROCESO ANÁLISIS
Título: PROCEDIMIENTO TÉCNICOS:
FOSFATASA ALCALINA
65/124
Revisión:
Código:
Fecha:
01 PD-TEC-16 01-07-2012
INSTRUCCIONES PARA SU USO
SUSTRATO; PREPARACION.- Transferir el contenido del frasco de NaFF volcándolo
directamente en el frasco de Buffer y mezclándolo hasta disolución completa (concentración final
14 Mm).anotar en el rotulo la fecha de preparación.
REACTIVO DE COLOR: PREPARACION: Disolver el contenido del envase en 500 ml de agua
destilada. Rotular y colocar fecha de preparación.
PRECAUCIONES:
REACTIVO DE COLOR ES TOXICO
-
Tubos de ensayo
Micro pipetas
Vórtex
Tips
Reloj o Timer.
Probeta
EQUIPOS:
-
Stat Fax
ESTABILIDAD DE:
- SUSTRATO
5 meses en refrigerador de 2 – 10 ºC.
- REACTIVO DE COLOR:
5 meses a T Ambiente y al abrigo de la luz.
MUESTRAS:
-
Suero libre de hemólisis
ENSAYO:
Longitud de onda:
Temperatura:
Paso de Luz:
Medición:
Rango :
Unidad de medida
Tiempo de Reacción:
Linealidad:
Volumen de reacción:
Volumen de muestra:
Estabilidad de Reactivo:
520 nm
37 ºC
1 cm.
Blanco de Reactivo
Adultos: 68 – 240 UI/L
Niños : 100 – 400 UI/L
UI/L
10 min.
Hasta 800 UI/L
3,0 ml
50 ul
Conservar 2 – 10 ºC. Protegido de la Luz.
Pagina:
LABORATORIO
SEÑOR DE SANTIAGO
MANUAL – POES – PROCESO ANÁLISIS
Título: PROCEDIMIENTO TÉCNICOS:
FOSFATASA ALCALINA
66/124
Revisión:
Código:
Fecha:
01 PD-TEC-16 01-07-2012
PROCEDIMIENTO:
1 .- TECNICA EN SUERO
BLANCO
0,5 ml
SUSTRATO
ESTÁNDAR
0,5 ml
DESCONOCIDO
0,5 ml
Preincubar en Baño Maria a 37 º C unos minutos. Luego agregar
SUERO
--50 ul
ESTÁNDAR
----Mezclar, incubar exactamente 10 min. agregar.
REACTIVO DE COLOR
2,5 ml
2,5 ml
ESTABILIDAD DE LA MEZCLA DE REACCION FINAL:
El color de la reacción es estable durante 30 min.
CALCULOS DE LA CONCENTRACIÓN DE FOSFATASA ALCALINA
SUERO
Fosfatasa alcalina (UI/L) = Factor * (D-B)
200 UI/L
Donde :
Factor= ------------------(S - B)
VALORES DE REFERENCIA:
SUERO:
ADULTOS: 68 – 240 UI/L
NIÑOS
: 100 – 400 UI/L
PATRONES DE REFERENCIA:
Para asegurar la calidad adecuada, se recomienda el uso de Standatrol E – S niveles.
INTERFERENCIAS:
- LOS ANTICOAGULANTES PRODUCEN INHIBICION DE LA
REACCION EN UN 50 A 90 %
--50 ul
2,5 ml
Pagina:
LABORATORIO
SEÑOR DE SANTIAGO
MANUAL – POES – PROCESO ANÁLISIS
Título: PROCEDIMIENTO TÉCNICOS:
DETERMINACIÓN DE AMILASA
67/124
Revisión:
Código:
Fecha:
01 PD-TEC-17 01-07-2012
DETERMINACION DE AMILASA
( Enzimático – Cinético )
1.-INTRODUCCIÓN:
Es una Enzima de origen principalmente pancreático o salivar que hidroliza los enlaces 1 – 4 -aglucosídicos,permitiendo así la digestión del almidon.
2.-OBJETIVO:
-Determinar la concentración de la amilasa sérica en el diagnóstico de enfermedades del páncreas
- Dar un apoyo confiable en el diagnóstico
3.-FUNDAMENTO:
El sustrato CNP-63 es hidrolizada por la accion catalitica de la a- amilasa para producir CNP.2
cloro-4
El sustrato CNP-G3 es hidrolizado por la accion catalitica de la a-amilasa para producir CNP-2
cloro-4
a-amilasa
5CNP-G3 --------------------- 3CNP + 2 CNP-G2 + 3 metotriosona + 4 glucosa
CNP-G2 = 2cloro-4nitrofenil-a-maltosida
4.MUESTRA REQUERIDA:
Muestra: Suero
Plasma heparinizado
Cantidad: 25 microlitros
Recolección: de manera usual
Conservación: De preferencia emplear muestra fresca.Se puede conservar 5 dias a temperatura
ambiente sin pérdida de actividad.
5.REACTIVOS:
Recativo :R
Tampón MES, pH 6,15
50 mmol/L
Cloruro de Sodio
70 mmol/L
Cloruro de Calcio
6 mmol/L
Tiocinato de potasio
900 mmol/L
CNP-G3
2,27 mmol/L
Nota .- El reactivo contiene menos de un 0,1 % de azíduro de sodio . La azíduro de sodio puede
reaccionar con el cobre o plomo de las tuberías formando metales de acida explosivos. Si descarta
en su tubería lavar con agua abundante
Estabilidad: El reactivo es estable hasta la fecha de caducidad
Uso: El reactivo esta listo para su uso
Pagina:
LABORATORIO
SEÑOR DE SANTIAGO
MANUAL – POES – PROCESO ANÁLISIS
Título: PROCEDIMIENTO TÉCNICOS:
DETERMINACIÓN DE AMILASA
68/124
Revisión:
Código:
Fecha:
01 PD-TEC-17 01-07-2012
6.MATERIAL Y EQUIPO REQUERIDO:
Lector de quimicas
Micropipetas y pipetas para medir los volúmenes requeridos
Tubos de hemolisis
Cronometro
Guantes desechables
7.PROCEDIMIENTO:
Marcar dos tubos
B
1ml
-
D
1ml
25 ul
C
1 ml
Reactivo
Muestra
Control
25 ul
Leer la absorbancia del blanco de reactivo e inmediatamente leer la muestra a 405 nm.
Linealidad: Hasta 1000 UI/L,si se excede el límite de la dilución,diluir 0,1 ml de muestra con 0,5
ml de solución salina fisiológica y repetir el ensayo usando esta dilución.Multiplicar el resultado
por 6
8.CÁLCULO DE LOS RESULTADOS:
Amilasa sérica( UI/L ) = Variación de Abs. x 2949
9.CONTROL DE CALIDAD:
Suero comercial de concentración conocida
10.VALORES DE REFERENCIA
Normal
menor a 90 U/L
11.LIMITACIONES DEL PROCEDIMIENTO
-Las soluciones intra venosa de dextrosa pueden producir un resultado falso negativo
-La lipemia sérica produce una falsa disminución de los valores de amilasa con los métodos
actuales de laboratorio
-Entre los fármacos que pueden producir un aumento son , ácido aminosalicílico, ácido
acetilsalicílico, dexametasona , etanol , glucocorticoides , medios de contraste que contienen yodo,
diuréticos de asa.
-Entre los fármacos que pueden producir disminución están los citratos, la glucosa y los oxalatos
Pagina:
LABORATORIO
SEÑOR DE SANTIAGO
MANUAL – POES – PROCESO ANÁLISIS
Título: PROCEDIMIENTO TÉCNICOS:
DETERMINACIÓN DE AMILASA
69/124
Revisión:
Código:
Fecha:
01 PD-TEC-17 01-07-2012
12.INTERPRETACIÓN DE RESULTADOS
Pancreatitis aguda
Úlcera péptica penetrante
Úlcera péptica perforada
Necrosis intestinal
Perforación intestinal
Colecistitis aguda
Parotiditis ( paperas )
Embarazo ectópico
Infarto pulmonar
Cetoacidosis diabética
Pancreatitis crónica recidivante
Obstrucción duodenal
13.REFERENCIAS
Prospecto Elitech
K.D.Pagana T.J.Pagana Guias de pruebas diagnósticas y de laboratorio.
Pagina:
LABORATORIO
SEÑOR DE SANTIAGO
MANUAL – POES – PROCESO ANÁLISIS
Título: PROCEDIMIENTO TÉCNICOS:
COLESTEROL TOTAL
70/124
Revisión:
Código:
Fecha:
01 PD-TEC-18 01-07-2012
DETERMINACIÓN DE COLESTEROL TOTAL
1.OBJETIVO:
Determinar la concentración de colesterol en suero
Detectar hipercolesterolemia
2.DEFINICIÓN:
El colesterol proviene de los alimentos y de su síntesis por el cuerpo , en especial de als células
hepáticas e intestinales .
El colesterol es un componente de la membrana celular y de la membrana de los organelos celulares
. Es un precursor metabólico de los ácidos biliares , vitamina D y hormonas esteroides . El
colesterol , molécula , circula asociada a lipoproteínas ( HDL , LDL y VLDL )
3.FUNDAMENTO:
El colesterol se determina después de la hidrólisis enzimática y la oxidación.El indicador es la
quinoneimina formada por el peróxido de hidrógeno y 4-aminoantipirina en presencia de fenol y
peroxidasa
Colesterol esterasa
Colesterol ester + H2O ------------------------------------ Colesterol + Ácidos grasos
Colesterol oxidasa
Colesterol + O2 --------------------------------Colestene-3-ona+ H2O2
Peroxidasa
2H2O2 + 4AAP + Fenol --------------------- Quinoneimina + 4H2O
4.MUESTRA REQUERIDA:
-Muestra: Suero
Plasma heparinizado con EDTA
-Cantidad: 10 microlitros
-Recolección del suero o plasma : de manera usual
-Conservación: estable de 5 a 7 dias a 4 grados, 3 meses a - 20 grados
5.REACTIVOS
Reactivo : RGT
Buffer fosfato ( ph 6,5 )
100 mmol/l
Fenol
5 mmol/l
4-Aminoantipirina
0,3 mmol/l
Colesterol estereasa
> 150 U/l
Colesterol oxidasa
> 100 U/l
Peroxidasa
> 5 KU/l
Estándar : STD
Colesterol
200 mg/dL
Pagina:
LABORATORIO
SEÑOR DE SANTIAGO
MANUAL – POES – PROCESO ANÁLISIS
Título: PROCEDIMIENTO TÉCNICOS:
COLESTEROL TOTAL
71/124
Revisión:
Código:
Fecha:
01 PD-TEC-18 01-07-2012
6.INSTRUCCIONES PARA SU USO:
RGT y STD están listos para su uso
7.CONSERVACIÓN DE LOS REACTIVOS:
Los reactivos son estables hasta la fecha de caducidad, aún después de abrir cuando se almacenan
de 2 a 8 º. Una vez abiertos debe evitarse la contaminación
8.MATERIALY EQUIPOS REQUERIDO:
Lector de quimicas
Pipetas y micropipetas para medir los volúmenes requeridos
Tubos de hemolisis
Cronómetro
Guantes desechables
9.PROCEDIMIENTO:
Reactivo
Estándar
Muestra
Suero control
B
1 ml
-
ST
1ml
10 ul
-
D
1ml
10 ul
-
C
1 ml
10 ul
Mezclar bien , incubar 5 minutos a 37 grados, leer la absorbancia a 500 nm frente al blanco de
reactivo antes de 60 minutos.
Linealidad: La prueba es lineal hasta concentraciones de colesterol de 750 mg/dL.Diluir las
muestras con concentraciones mas altas de colesterol 1+2 con solución salina fisiológica y repetir la
determinación.Multiplicar el resultado por 3.
10.CÁLCULO DE LOS RESULTADOS:
C = 200 x
Abs Muestra mg/dL
Abs Std
11.METODOS DE CONTROL DE CONTROL DE CALIDAD
Suero control Human
12.VALORES DE REFERENCIA
Normal
hasta 200 mg/dL
Limite alto
200-239 mg/dL
Alto
mayor a 240 mg/Dl
Pagina:
LABORATORIO
SEÑOR DE SANTIAGO
MANUAL – POES – PROCESO ANÁLISIS
Título: PROCEDIMIENTO TÉCNICOS:
COLESTEROL TOTAL
72/124
Revisión:
Código:
Fecha:
01 PD-TEC-18 01-07-2012
13.LIMITACIONES DEL PROCEDIMIENTO
-Sueros hemolisados producen valores falsamente aumentados
-Sueros hiperlipémicos
-Anticuagulantes comunes excepto heparina
-Por lo general el embarazo se asocia con niveles altos de colesterol
14.INTERPRETACIÓN DE RESULTADOS
Niveles aumentados
Hipercolesterolemia
Hiperlipidemia
Hipotiroidismo
Diabetes mellitas no controlada
Síndrome nefrótico
Embarazo
Alimentación con alto contenido en colesterol
Hipertensión
Arteroesclerosis
Cirrosis biliar
Estrés
Nefrosis
Infarto de miocardio
Niveles bajos
Hipoabsorción
Desnutrición
Hipertiroidismo
Medicación hipocolesterolemiante
Anemia perniciosa
Anemia hemolítica
Sepsis
Estrés
Hepatopatía
Infarto agudo de miocardio
15.REFERENCIAS:
Prospecto Human
K.D.Pagana T.J.Pagana .Guias de pruebas diagnósticas y de Laboratorio.
Pagina:
LABORATORIO
SEÑOR DE SANTIAGO
MANUAL – POES – PROCESO ANÁLISIS
Título: PROCEDIMIENTO TÉCNICOS:
TRIGLICERIDOS
73/124
Revisión:
Código:
Fecha:
01 PD-TEC-19 01-07-2012
DETERMINACIÓN DE TRIGLICERIDOS
( Enzimático –colorimétrico )
1.OBJETIVO:
Determinar la concentración de los triglicéridos en suero
Brindar resultados confiables
2.DEFINICIÓN:
Los triglicéridos constituyen el 95 % de la grasa que se almacena en los tejidos y su función
principal es proveer de energia a las células. Los triglicéridos se sintetizan tanto en el intestino a
partir de las grasa de la dieta como en el higado apartir de los carbohidratos de la dieta y son
transportados al torrente sanguíneo por los quilomicrones y el VLDL.
3.FUNDAMENTO:
Los triglicéridos son determinados después de hidrólisis enzimática con lipasas.El indicador es
quinoneimina formada a partir de peróxido de hidrógeno,4-aminoantipirina y 4-chlorofenol bajo la
influencia catalítica de peroxidasa.
Se produce la siguiente reacción :
Lipoproteína Lipasa
Triglicéridos ------------------------------ Glicerol + ácidos grasos
Glicerol Kinasa
Glicerol + ATP ------------------------------- Glicerol -3-fosfato+ADP
Glicerol Peroxidasa
Glicerol-3-fosfato + 02 ---------------------------- Fosfato dihidroxiacetona + H2O2
Peroxidasa
H2O2 + 4 –aminoantipirina ---------------------------- Quinoneimina + HCL + H2O +
4- Clorofenol
4.MUESTRA REQUERIDA:
-Muestra: Suero
Plasma con heparina o EDTA de pacientes en ayunas
-Cantidad : 10 microlitros
-Recolección: de manera usual
-Conservación: Las muestras son estables 3 dias entre 2 a 8 ºC, 4 meses a – 20 ºC
Pagina:
LABORATORIO
SEÑOR DE SANTIAGO
MANUAL – POES – PROCESO ANÁLISIS
Título: PROCEDIMIENTO TÉCNICOS:
TRIGLICERIDOS
5.REACTIVOS:
Reactivo: RGT
Buffer Pipes , pH 7,00
4-Chlorofenol
4-aminofenazona
Iones de magnesio
ATP
Lipasas
Peroxidasas
Glicerol Kinasa
Glicerol 3-fosfato oxidasa
STD
Triglicéridos
74/124
Revisión:
Código:
Fecha:
01 PD-TEC-19 01-07-2012
50 mmol/L
5 mmol/l
0,25 mmol/l
4,5 mml/l
2 mmo/l
_> 1300 U/l
_> 500 U/l
_> 400 U/l
_> 1500 U/l
200 mg/dl
6.INSTRUCCIONES PARA SU USO:
RGT y STD están listos para su uso
7.CONSERVACION DE LOS REACTIVOS:
Los reactivos se mantienen estables hasta la fecha de vencimiento aún después de abrir ,si se
almacenan entre 2 a 8 ª.Se debe evitar la contaminación,proteger de la luz
8.MATERIAL Y EQUIPOS REQUERIDO:
Lector de quimicas
Pipetas y micropipetas para medir los volúmenes requeridos
Tubos de hemólisis
Cronómetro
Guantes desechables
9.PROCEDIMIENTO:
Marcar cuatro tubos
B
Std
D
C
Reactivo
1 ml
1 ml
1 ml
1 ml
Estándar
10 ul
Muestra
10 ul
Suero control
10 ul
Mezclar bien, incubar 5 minutos a 37 grados y proceder a la lectura contra blanco de reactivo
antes de 60 minutos.
Linealidad. Hasta 1000 mg/dL,si es mayor,diluir la muestra 1+ 4 con solución salina y repetir la
prueba.Multiplicar los resultados por 5.
Pagina:
LABORATORIO
SEÑOR DE SANTIAGO
MANUAL – POES – PROCESO ANÁLISIS
Título: PROCEDIMIENTO TÉCNICOS:
TRIGLICERIDOS
75/124
Revisión:
Código:
Fecha:
01 PD-TEC-19 01-07-2012
10.CÁLCULO DE LOS RESULTADOS:
C= 200 x Abs.Muestra
mg/dL
Abs.Std
11.CONTROL DE CALIDAD:
Suero control Human
12.VALORES DE REFERENCIA:
Normal
hasta
Limite alto
Alto
Muy alto
mayor
150 mg/dL
150-200 mg/dL
200-500 mg/dL
500 mg/dL
13.LIMITACIONES DEL PROCEDIMIENTO:
-La ingestión de comidas con alto contenido en grasas produce un aumento de los niveles de TG.
-La ingestión de alcohol puede producir niveles altos
-El embarazo puede producir niveles altos
-Entre los fármacos que pueden producir niveles altos están ,colestiramina , estrógenos y
anticonceptivos orales, y entre los que disminuyen están ,ácido ascórbico,asparaginasa,clofibrato y
colestipol
14.INTERPRETACIÓN DE RESULTADOS:
Niveles aumentados
Glucogenosis
Hiperlipidemias
Hipotiroidismo
Diabetes poco controlada
Riesgo de arteriopatía coronaria oclusiva arteriosclerótica y vasculopatía periférica
Síndrome nefrótico
Hipertisión
Cirrosis alcohólica
Embarazo
Infarto de micardio
Niveles disminuidos
Síndrome de hipoabsorción
Desnutrición
Hipertiroidismo
15.REFERENCIAS:
Prospecto Human
K.D.Pagana T.J.Pagana Guias de pruebas diagnósticas y de laboratorio.
Pagina:
LABORATORIO
SEÑOR DE SANTIAGO
MANUAL – POES – PROCESO ANÁLISIS
Título: PROCEDIMIENTO TÉCNICOS:
DETERMINACIÓN HDL COLESTEROL
76/124
Revisión:
Código:
Fecha:
01 PD-TEC-20 01-07-2012
DETERMINACIÓN DE HDL COLESTEROL
1.OBJETIVO:
Determinar la concentración de HDL en suero
Entregar resultados confiables
2.DEFINICIÓN:
El colesterol es una molécula lipídica insoluble en medios acuosos como el plasma , en el cual
circula en forma de seudo emulsión : asociación de lípidos y proteinas que constituyen las
lipoproteínas . Estas lipoproteínas varían cuantitativamente y cualitativamente en su compasión
lipídica y proteica ,lo que da lugar a una diferencia estructural pero tambien funcionable . La
clasificación más utilizada se basa en la diferencia de densidad de las mismas . Esto explica el
nombre de Lipoproteína de alta densidad ( HDL ), Lipoproteína de baja densidad ( LDL )
,Lipoproteína de muy baja densiad ( VLDL ) y la existencia de numerosas fracciones intermedias
que corresponden a todas las etapas del metabolismo lipídico.
La HDL son proteínas de alta densidad contiene aproximadamente un 50 % de lípidos , entre los
cuales un 20 % de colesterol, su función es asegurar el flujo de colestrol de las membranas celulares
y , por consiguiente , su depuración.Numerosos estudios epidemiológicos confirman la función
antiaterogénica de esta fracción que conduce al concepto de “ buen colesterol “.El colesterol HDL
representa,por lo tanto,un elemento de evaluación del riesgo aterogénico cuando exste un
desequilibrio en la relación del colesterol total/colesterol HDL o colesterol LDL/colesterol HDL.
3.-FUNDAMENTO:
Los quilomicrones,las lipoproteínas de baja densidad (LDL) y las lipoproteínas de alta densidad
(HDL )contenidos en el suero son precipitados por adición de ácido fosfotungstico en presencia de
iones magnesio.
Las lipoproteínas de alta densidad obtenidas después de la centrifugación ( HDL ) contenidas en el
sobrenadante estan medidas por método enzimático.
4.-MUESTRA REQUERIDA:
-Muestra: Suero en ayunas 200 microlitros ,plasma con EDTA o con heparina
- Recolección de suero : de manera usual
-Conservación: estable de 1 a 3 dias a 4ºC,almacenamiento mas prolongado congelar a -50º C
5.-REACTIVOS:
Reactivo: PREC
Acido fosfotúngstico
Cloruro de magnesio
Estandar STD
Colesterol
Reactivo adicional
Kit para la determinación de colesterol
0,55 mmol/l
25 mmol/l
50 mg/dl
Pagina:
LABORATORIO
SEÑOR DE SANTIAGO
MANUAL – POES – PROCESO ANÁLISIS
Título: PROCEDIMIENTO TÉCNICOS:
DETERMINACIÓN HDL COLESTEROL
77/124
Revisión:
Código:
Fecha:
01 PD-TEC-20 01-07-2012
6.-INSTRUCCIONES PARA SU USO:
Usar precipitante sin diluir
7.-CONSERVACIÓN DE REACTIVO
PREC es estable, aún después de haberse abierto, hasta su fecha de caducidad cuando es
almacenada de 2…25º C .Debe evitarse la contaminación del reactivo.
8.-MATERIAL Y EQUIPO REQUERIDO:
-Lector de químicas
-Micropipetas y pipetas para medir volúmenes indicados
-Tubos de hemólisis
-Cronómetro
-Guantes desechables
9.-PROCEDIMIENTO:
1º Preparación del sobrenadante:
- en un tubo de hemólisis colocar 200 ul de muestra,100 ul de H20 destilada y 400 ul de
precipitante todo esto incubar por 10 minutos a temperatura ambiente
2º Centrifugar
- Después de centrifugar 10 min,separar el sobrenadante claro y determinar la concentración
del HDL colesterol usando el reactivo de HUMAN CHOLESTEROL liquicolor
3º Determinación del HDL
Bl
Rtvo de Colesterol
Agua destilada
Estándar
Sobrenadante (desconocido)
Control
1 ml
100 ul
-
St
1 ml
100 ul
-
D
1 ml
100 ul
-
C
1 ml
100 ul
Incubar por 5 minutos a 37 º C y leer la absorbancia de la muestra y el estándar respectivamente
frente al blanco de reactivo.
Pagina:
LABORATORIO
SEÑOR DE SANTIAGO
MANUAL – POES – PROCESO ANÁLISIS
Título: PROCEDIMIENTO TÉCNICOS:
DETERMINACIÓN HDL COLESTEROL
78/124
Revisión:
Código:
Fecha:
01 PD-TEC-20 01-07-2012
10.-CÁLCULO DE LOS RESULTADOS:
A muestra
C = 175 x --------------mg/dL
A std
Cálculo de la concentración de LDL colesterol:
Triglicéridos
LDLcol= Colesterol - ----------------- - HDL col.
5
11.-VALORES DE REFERENCIA:
HDL col.: 30 a 75 mg/dL
LDL COL.: 66 A 178 mg/dL
12.-INTERPRETACIÓN DE LOS RESULTADOS:
Niveles de HDL aumentados
- Lipoproteinemia familiar de HDL
- Exceso de ejercicio físico
Niveles de HDL disminuido
- Síndrome metabólico
- Hipolipoproteinemia HDL familiar
- Enfermedad hepatocelular ( ej.: hepatitis o corrosis )
- Hipoproteinemia ( ej.: síndrome nefrótico o mal nutrición )
Niveles de LDL y VLDL aumentados
-Lipoproteinemia familiar de LDL
-Síndrome nefrótico
- Enfermedades de almacenamiento del glucógeno
- Hipotiroidismo
- Consumo de alcohol
- Hepatopatia crónica ( hepatitis,cirrosis )
- Hepatoma
- Hipercolesterolemia familiar de tipo II a
- Deficiencia de apoproteina C II
Niveles de LDL y VLDL disminuidos
- Hipolipoproteinemia familiar
- Hipoproteinemia ( malabsorción, quemaduras graves, malnutrición )
- Hipertiroidismo
13.REFERENCIAS:
-Prospecto Human
-K.D Pagana T.J.Pagana Guias de pruebas diagnósticas y de laboratorio
Pagina:
79/124
LABORATORIO
SEÑOR DE SANTIAGO
MANUAL – POES – PROCESO ANÁLISIS
Título: PROCEDIMIENTO TÉCNICOS:
EXAMEN GENERAL DE ORINA
Revisión:
Código:
Fecha:
01 PD-TEC-21 01-07-2012
EXAMEN GENERAL DE ORINA
1. OBJETIVO:
Determinar las sustancias químicas presentes en una muestra de orina, así como su densidad y pH, a
través de las zonas de reacción presentes en una tira reactiva para descartar alguna anormalidad que
se pueda presentar.
2.ALCANCE:
Área de uroanálisis
3.DEFINICIONES:
La orina es un líquido muy complejo formado por 95 % de agua y 5 % de sólidos.
Constituye el producto final realizado por millones de células del sistema renal y urinario del
metabolismo y tiene un gasto promedio de 1 a 1,5 lts de orina por dia, que depende de la ingestión
de líquidos.
El riñon tiene la capacidad de diluir o concentrar la orina, de acuerdo con las necesidades de
regulación de la excreción de sodio..Algunos de los elementos mas importantes en este proceso
metabólico son la química sanguínea, presión arterial, equilibrio hídrico, ingestión de nutrimentos y
el estado general de la salud.
4.FUNDAMENTO:
En el examen general de orina se determinan propiedades de la orina:
color,olor,turbidez,densidad,pH,glucosa,cetonas,sangre,proteínas,bilirrubinas,urobilinógenonitrato,le
ucocitos,así como otros componentes anormales del sedimento urinario que se observán bajo el
microscopio.
Volumén: La cuantificación del volumen urinario forma parte de la valoración del equilibrio hídrico
y la función renal. El volumen normal de orina excretada por el adulto en periodo de 24 hrs. es de
600 a 2000 ml.
Densidad: La densidad específica urinaria constituye una medida de la capacidad que tiene el riñón
para concentrar la orina. En esta prueba se compara el peso de la orina contra el peso del agua
destilada, que tiene una densidad específica de 1.000.Debido a que la orina es una solución de
minerales, sales y compuestos disueltos en agua, su densidad específica evidentemente es mayor de
1.000.La diferencia relativa entre la densidad específica del agua destilada y la de la orina refleja el
grado de concentración de la muestra de orina.
Aspecto: La orina turbia señala posibles anormalidades como pus,eritrocitos o bacterias.La orina
alcalina suele presentar aspecto turbio debido a los fosfatos,orina ácida debido a los uratos.
Color: La muestra de orina varia en color desde amarillo hasta ambar oscuro,el tono muchas veces
está relacionado con la concentración o densidad.
Olor: La orina reciente tiene un olor característico debido a la presencia de ácidos volátiles.No suele
ser desagradable.
Pagina:
LABORATORIO
SEÑOR DE SANTIAGO
MANUAL – POES – PROCESO ANÁLISIS
Título: PROCEDIMIENTO TÉCNICOS:
EXAMEN GENERAL DE ORINA
80/124
Revisión:
Código:
Fecha:
01 PD-TEC-21 01-07-2012
pH. El símbolo pH expresa la orina como dilución ácida o solución de base y mide la
concentración de iones hidrógeno libre en la orina “ 7 “ es el punto neutro en la escala de pH.El pH
indica la capacidad de los túbulos renales para mantener una concentración normal de iones
hidrógeno en el plasma y el líquido extracelular.
Proteina: La detección de proteínas en orina combinada con un examén microscópico ,proporciona
la base para el diagnóstico diferencial de algunas nefropatías.
Glucosa: La determinacíon de glucosa en orina se utiliza para detectar diabetes.
Cetonas:Son el resultado del metabolismo de ácidos grasos y de la grasa,la presencia excesiva de
cetonas suele acompañar a la diabetes y otras alteraciones de los carbohidratos.
Nitrito: Esta prueba depende de la conversión de nitrato en nitrito mediante la acción de bacteria
Gram Negativa.
Leucocitos: Esta prueba revela la presencia de granulositos esteráseos.Los esterases se pegan a un
derivado ester principal aminoácido para liberar derivados de hidroxi pirazol.Este pirazol luego
reacciona con una sal diamónica para producir una coloración beige-rosada a púrpura.
Bilirrubina: Se basa en la reacción de azo-copulación de bilirrubina con la dicloroanilina
diazotizada en un medio ácido fuerte.
Urobilinógeno: Esta basada en la reaación de Erhlich modificada entre p-dietilaminobenzaldehido y
ácido ………. En un medio fuertemente ácido para producir un color rosado.
Sangre: Se basa en la parecida actividad-peroxidasa de hemoglobina que cataliza la reacción de
cumene……… y 3,3’,5,5’-tetrametilbenzidina.Los rangos de color van de naranja a verde a azul
oscuro
5. MUESTRA REQUERIDA:
Tipo: Orina ( la primera de la mañana 100 ml )
Recolección: En frasco de vidrio o plástico de boca ancha y tapa rosca.
Conservación: Si no se remite la muestra al laboratorio el paciente la puede refrigerar por un par
de horas hasta el momento en que lo lleve al laboratorio.
6. MATERIALES:
Frascos plásticos transparente de boca ancha con capacidad de 100 mL.
Bolsa pediátrica recolectora de orina.
Tubos cónicos con capacidad de 15 mL.
Gradilla para tubos.
Papel toalla.
Marcador de vidrio.
Guantes descartables.
Pagina:
LABORATORIO
SEÑOR DE SANTIAGO
MANUAL – POES – PROCESO ANÁLISIS
Título: PROCEDIMIENTO TÉCNICOS:
EXAMEN GENERAL DE ORINA
81/124
Revisión:
Código:
Fecha:
01 PD-TEC-21 01-07-2012
7.REACTIVOS:
Tiras reactivas para orina.
8.EQUIPOS:
Macrocentrífuga
Microscopio
9. PROCEDIMIENTO:
Identificar el tubo cónico.
Agitar la muestra de orina en forma circular sobre la mesa de trabajo.
Verter la orina en el tubo cónico.
Introducir la tira reactiva en la orina.
Eliminar el exceso de orina colocando la tira sobre un papel absorbente.
Esperar el tiempo recomendado por el fabricante para su lectura.
Anotar los resultados.
Centrifugar durante 5 minutos a 2.500 rpm
Descartar el sobrenadante
Suspender el sedimento urinario golpeando ligeramente con la mano
Colocar una gota de sedimento entre un porta y un cubreobjeto
Observar la preparación con el objetivo de 10x
Identificar los elementos formes a mayor aumento 40x
Anotar lo observado.
10. FUENTES DE ERROR:
Muestras medicamentosas.
Frascos y tubos mal lavados.
Tiras reactivas de mala calidad o vencidas.
Leer las tiras reactivas después del tiempo indicado por el fabricante.
Usar portaobjetos y cubreobjetos sucios.
Desecación del sedimento urinario.
Tiempo transcurrido desde la toma de la muestra hasta la observación microscópica.
Uso excesivo de luz.
Centrifugación inadecuada.
11. FORMA DE REPORTE:
CÉLULAS EPITELIALES, ESCAMOSAS Y REDONDAS: reportar escasas, moderadas o
abundantes.
GLÓBULOS ROJOS: Reportar el número estimado por campo.
LEUCOCITOS: Reportar el número estimado por campo.
CILINDROS: se pueden encontrar en la orina los siguientes cilindros: hialinos, granulosos finos y
gruesos, leucocitarios, hemáticos, grasos y céreos. Reportar el número de cilindros observados por
campo.
Pagina:
LABORATORIO
SEÑOR DE SANTIAGO
MANUAL – POES – PROCESO ANÁLISIS
Título: PROCEDIMIENTO TÉCNICOS:
EXAMEN GENERAL DE ORINA
82/124
Revisión:
Código:
Fecha:
01 PD-TEC-21 01-07-2012
FILAMENTOS MUCOIDES: reportar escasos, moderados o abundantes.
CRISTALES: se pueden encontrar en la orina los siguientes cristales: oxalatos de calcio, acido
úrico, uratos amorfos, fosfatos amorfos, fosfatos triples, urato de amonio, leucina, cistina y tirosina.
Reportar en la forma siguiente: escasos, moderados o abundantes.
LEVADURAS: Reportar escasos, moderada y abundantes.
PARÁSITOS: Se pueden encontrar en orina Trichomonas vaginalis, huevos y quistes de parásitos
por contaminación con heces.
BACTERIAS: Reportar la presencia de bacterias moderadas o abundantes, solamente cuando se
observen más de 10 leucocitos por campo.
Valores de referencia
CÉLULAS EPITELIALES, ESCAMOSAS: Escasas a moderadas.
CÉLULAS EPITELIALES REDONDAS: No deben observarse.
GLÓBULOS ROJOS: No deben observarse.
LEUCOCITOS: .0-5 por campo.
CILINDROS: No deben observarse.
FILAMENTOS MUCOIDES: No deben observarse.
CRISTALES: Podrían observarse oxalatos, uratos y fosfatos amorfos de escasa a moderada
cantidad.
LEVADURAS: No deben observarse.
PARÁSITOS: No deben observarse.
BACTERIAS: Escasas o no presentes.
12.INTERPRETACIÓN DE LOS RESULTADOS:
Cuando algún compuesto está elevado en orina el color varia de acuerdo a la concentración del
mismo.
Glucosa: Se detecta en pacientes diabéticos cuyo nivel de glucosa en sangre está por ea del umbral
y por eso pasa el excedente a la orina:
Bilirrubina: Se llega a detectar en orina cuando el paciente tiene alguna afección en el hígado por
ejemplo Hepatitis, cirrosis.
Cuerpos cetónicos: Se llega a detectar en especial en pacientes que tienen fiebre, que no comen, en
diabéticos cuando su glucosa está muy elevada.
Sangre: Detecta hematíes y hemoglobina. En mujeres con periodo mentrual. Si el paciente sufre una
infección de la vejiga con hematuria, con una afección renal, insuficiencia renal.
Proteinas: Si se detecta puede ser por presencia de abundantes células como ser: leucocitos, células
epiteliales, bacterias, por filamento mucoide, también por la presencia de cilindros.
Urobilinógeno: Afección hepática
Nitritos: Cuando hay bacterias en orina
Leucocitos: Puede ser principalmente por alguna infección.
Pagina:
LABORATORIO
SEÑOR DE SANTIAGO
MANUAL – POES – PROCESO ANÁLISIS
Título: PROCEDIMIENTO TÉCNICOS:
EXAMEN COPROPARASITOLOGICO
83/124
Revisión:
Código:
Fecha:
01 PD-TEC-22 01-07-2012
EXAMEN COPROPARASITOLOGICO
HECES DIRECTO, CONCENTRADO
1. OBJETIVO:
Analizar microscópicamente una muestra de heces en busca de la presencia de leucocitos,
Amebas, huevos, larvas de parásitos en sus diferentes estadios.
2.ALCANCE:
Área de parasitología
3.DEFINICIONES:
La producción de heces fecales depende de una serie muy compleja de procesos de absorción,
secreción y fermentación. La función normal del colón incluye tres procesos fisiológicos(1)
Absorción de líquidos y electrolitos,(2).Contracciones que revuelven y ponen al contenido en
contacto con la mucosa del aparato gastrointestinal, transportándolo hasta el recto, y ( 3
).Defecación.
4.MUESTRA REQUERIDA:
Tipo: heces fecales
Cantidad: Representativa para realizar la prueba (cantidad equivalente a la pepa de durazno)
Recolección: Obtener en un recipiente seco libre de agua y orina. Luego colocar en un frasco de
vidrio o plástico de boca ancha y tapa de rosca.
Conservación: La muestra debe ser preferentemente fresca y ser remitida al laboratorio en un lapso
no mayor a una hora. En caso de no efectuarse el ensayo en el momento, puede conservarse hasta 3
horas en el refrigerador.
5. REACTIVOS:
- Solución salina 0.85%
- Solución de Lugol al 2 %
6.-MATERIAL:
- Frascos plásticos de boca ancha y tapón de rosca
- Aplicadores de madera
- Marcador de vidrio
- Porta y cubre objetos
- Guantes desechables
7. EQUIPOS:
- Microscopio
Pagina:
LABORATORIO
SEÑOR DE SANTIAGO
MANUAL – POES – PROCESO ANÁLISIS
Título: PROCEDIMIENTO TÉCNICOS:
EXAMEN COPROPARASITOLOGICO
84/124
Revisión:
Código:
Fecha:
01 PD-TEC-22 01-07-2012
8. PROCEDIMIENTO:
Identificar la lámina porta objeto
Colocar en un extremo de la lámina portaobjeto una gota de solución salina al 0.85%.
Seleccionar la parte más representativa de la muestra (mucus o sangre, si hay presencia de
estos).
Agregar con un aplicador 1 a 2 mg de material fecal seleccionada y mesclar.
Cubrir la preparación con una laminilla cubreobjeto, colocándola en ángulo de 45° sobre el
borde de la preparación y bajándolo con cuidado a fin de que no queden burbujas entre el
cubre y el porta objeto.
Colocar en el otro extremo del portaobjeto, una gota de lugol para heces y repetir el
procedimiento anterior.
Observar en forma sistemática al microscopio, con el objetivo 10x y luego con el 40x.
Reportar todo lo observado.
Con solución salina 0.85%, los trofozoitos y quistes de los protozoarios se observan en
forma natural y con lugol se visualizan las estructuras internas, núcleos y vacuolas.
Coproparasitológico seriado:
Se procede de la misma manera pero por tres días consecutivos
9. FUENTES DE ERROR:
Desecación de la preparación.
Preparación muy gruesa o delgada.
Intensidad de luz inadecuada.
Contaminación de la muestra con orina.
Dejar transcurrir más de 3 horas después de la recolección para observar formas activas en
la muestra.
Omitir la preparación y observación con lugol.
No examinar en forma sistemática.
Muestra de heces escasa o seca en el frasco.
10. FORMA DE REPORTE:
PARÁSITOS: Anotar el nombre del género y especie, así como su estado evolutivo.
LEUCOCITOS: Reportar el número de leucocitos por campo.
ERITROCITOS: Reportar el número de eritrocitos por campo.
LEVADURAS: Escasas, moderadas o abundantes.
RESTOS DE GRASA: Reportar de moderado a abundante.
Valores de referencia:
PARÁSITOS: No se deben observar.
LEUCOCITOS: No se deben observar.
ERITROCITOS: No se deben observar.
LEVADURAS: No se deben observar.
RESTOS DE GRASA: Reportar de moderado a abundante.
Pagina:
LABORATORIO
SEÑOR DE SANTIAGO
MANUAL – POES – PROCESO ANÁLISIS
Título: PROCEDIMIENTO TÉCNICOS:
EXAMEN COPROPARASITOLOGICO
85/124
Revisión:
Código:
Fecha:
01 PD-TEC-22 01-07-2012
TINCIÓN PARA MOCO FECAL
1. OBJETIVO:
Es la búsqueda de leucocitos polimorfonucleares y mononucleares en una muestra coloreada con la
tinción panóptica lo que permite identificar si se trata de un proceso viral o bacteriano.
2.ALCANCE:
Área de coproparasitologia
3.DEFINICIONES:
La mucosa del colón secreta moco como respuesta al estímulo parasimpático. La presencia de moco
en una muestra fecal es anormal y se debe reportar de inmediato.
4. MUESTRA REQUERIDA:
Heces fecales frescas y líquidas, instruir al paciente sobre la forma de colectar la muestra.
5. MATERIALES Y REACTIVOS
Lámina portaobjeto.
Aplicadores de madera.
Aceite de inmersión.
Bandeja o soporte de coloración.
Colorante Panóptico
Guantes descartables.
Marcador de vidrio.
Papel toalla.
6. EQUIPOS:
Contador diferencial de células
Microscopio.
7. PROCEDIMIENTO:
Tener listo el colorante a utilizar
Identificar el portaobjeto a utilizar.
Realizar el extendido de muestra en las dos terceras partes de la lámina.
Dejar secar a temperatura ambiente.
Realizar la tinción con el panóptico
Dejar secar a temperatura ambiente.
Observar al microscopio con objetivo de inmersión 100x.
Contar 100 células blancas o leucocitos diferenciando los polimorfonucleares de los
mononucleares.
Pagina:
LABORATORIO
SEÑOR DE SANTIAGO
MANUAL – POES – PROCESO ANÁLISIS
Título: PROCEDIMIENTO TÉCNICOS:
EXAMEN COPROPARASITOLOGICO
86/124
Revisión:
Código:
Fecha:
01 PD-TEC-22 01-07-2012
8.RESULTADOS:
FORMA DE REPORTE:
Reportar el porcentaje de leucocitos encontrados con el predominio del que tenga mayor porcentaje.
Polimorfonucleares ……………………...... % ( por ciento).
Mononucleares ……………..…………….. % (por ciento).
Interpretación:
Predominio de polimorfonucleares se asume que existe un proceso infeccioso de origen bacteriano.
Predominio de Mononucleares se asume que el proceso infeccioso es de origen viral.
9.FUENTES DE ERROR:
o Extendidos gruesos
o Láminas sucias y grasosas
o Arrastrar la preparación con un lavado brusco.
10.INTERPRETACIÓN DE LOS RESULTADOS:
Las situaciones siguientes se acompañan de moco transparente y gelatinoso en la superficie de
heces formadas:
- Estreñimiento espástico
- Colitis mucosa
- Pacientes con alteraciones emocionales
- Esfuerzo excesivo al defecar.
El moco hemático en las heces sugiere.
- Neoplasia
- Inflamación del conducto anal
Puede haber moco con pus y sangre en:
- Colitis ulcerativa
- Disenteria bacilar
- Cáncer ulceratico de colón
- Tuberculosis intestinal
11.REFERENCIAS:
Manual de PRUEBAS DIAGNÓSTICAS Frances Talaska Fischbach.
Pagina:
LABORATORIO
SEÑOR DE SANTIAGO
MANUAL – POES – PROCESO ANÁLISIS
Título: PROCEDIMIENTO TÉCNICOS:
CALIBRACIÓN EXTERNA DE EQUIPOS
87/124
Revisión:
Código:
Fecha:
01 PD-TEC-25 01-07-2012
CALIBRACIÓN EXTERNA DE EQUIPOS
Objetivo
Establecer en función de norma la descripción de actividades de calibración y de mantenimiento
externo de los equipos de medida y precisión.
Alcance
La calibración de todos los equipos de precisión del laboratorio son realizados y ejecutados (cuando
sea necesario externamente) por asistencia de mantenimiento y calibración de equipos.
Responsabilidad
La responsabilidad de todas las operaciones de calibración es por Asistencia de Mantenimiento y
Calibración de Equipos y se desarrollan de acuerdo con lo establecido en el presente procedimiento.
Procedimientos de Calibración
Cada equipo de precisión inventariado dispone de un plan de calibración (competencia de asistencia
de mantenimiento y calibración de equipos) en el que se detallan las siguientes circunstancias:
o Código y definición del equipo
o Procedimiento de calibración y calculo de la incertidumbre del equipo
o Instrucciones para eliminar los desajustes detectados.
Los resultados de calibración de los equipos se conservan en registros específicos, con el fin de
aplicar la trazabilidad en equipos en los que se haya detectado algún desajuste.
Certificados de Calibración
Los sucesivos resultados de las calibraciones, quedan reflejados en certificados de calibración que
permiten seguir su evolución, declarando la garantía metrológica del procedimiento.
Pagina:
LABORATORIO
SEÑOR DE SANTIAGO
MANUAL – POES – PROCESO ANÁLISIS
Título: PROCEDIMIENTO TÉCNICOS:
CALIBRACIÓN EXTERNA DE EQUIPOS
88/124
Revisión:
Código:
Fecha:
01 PD-TEC-25 01-07-2012
Condiciones para la Realización de Medidas
Toda medida de una magnitud esta afectada de un error debido, entre otras causas, a la variación de
las condiciones ambientales de humedad, presión y temperatura.
Para disminuir este problema las salas de medición disponen de un ambiente controlado, al menos
en lo que se refiere a los parámetros más importantes, manteniendo la temperatura en 20 ± 2º C, la
humedad relativa por debajo del 65%, ausencia de polvo y de corrientes de aire, eliminación de
vibraciones, ruidos por encima de los 60 dB y cuentan con una iluminación fluorescente con difusor
y una intensidad de 800 a 1000 lux sobre el puesto de trabajo.
Dado que en las medidas realizadas a la intemperie no se pueden lógicamente mantener estas
condiciones, se procura sin embargo realizar las mediciones en el momento en que las condiciones
ambientales menos se alejen de las descritas como más adecuadas.
Pagina:
LABORATORIO
SEÑOR DE SANTIAGO
MANUAL – POES – PROCESO ANÁLISIS
Título: PROCEDIMIENTO TÉCNICOS:
CALIBRACIÓN – MÉTODO ANALÍTICO
89/124
Revisión:
Código:
Fecha:
01 PD-TEC-26 01-07-2012
CALIBRACIÓN Y/O VERIFICACIÓN DE MÉTODO ANALÍTICO
Objetivo
Establecer y describir en función de norma el procedimiento(s) para validar la trazabilidad e
incertidumbre de medición de los equipos de precisión.
Alcance
La ejecución de actividades de calibración del método analítico previo a la realización del proceso
de análisis, es de responsabilidad y administración por Dirección Técnica.
Procedimiento de Calibración y/o Verificación del Método Analítico
Los métodos analíticos poseen un procedimiento estándar de verificación (Patrón Calibrado), que
deben ser ejecutados de la forma siguiente:
01. Método Enzimático (Glucosa)
o 1 ml de Reactivo más 10 μl de muestra (suero)
o Incubación por 10 minutos a 37º C
o Lectura de resultados de verificación.
02. Método Enzimático (Ac. Urico)
o 1 ml de Reactivo más 20 μl de muestra
o Incubación a 37º C por 5 minutos
o Lectura de resultados de verificación.
03. Método Enzimático (Colesterol, Triglicéridos)
o 1 ml de Reactivo más 10 μl de muestra
o Incubación a 37º C por 5 minutos
o Lectura de resultados de calibración.
04. Método Cinético (Urea)
o 1 ml de Reactivo (blanco), 10 μl de muestra
o Lectura de resultados de calibración.
05. Método Cinético (Creatinina, GOT, GPT)
o 1 ml de Reactivo (blanco), 100 μl de muestra
o Lectura de resultados de calibración.
Pagina:
LABORATORIO
SEÑOR DE SANTIAGO
MANUAL – POES – PROCESO ANÁLISIS
Título: PROCEDIMIENTO TÉCNICOS:
CALIBRACIÓN – MÉTODO ANALÍTICO
90/124
Revisión:
Código:
Fecha:
01 PD-TEC-26 01-07-2012
Fichas o Planillas de Calibración y/o Verificación
Para validar un procedimiento de calibración del método analítico (Validación Técnica Rutinaria),
se debe realizar el registro de los resultados de medición y realizar el seguimiento de la trazabilidad,
para lo cual se establecen fichas o planillas de control de calibración del método, de acuerdo a los
siguientes:
o
o
o
o
Método o Estándar de Calibración utilizado
Resultados de la medición
Responsable de calibración
Fecha de realización de calibración.
Pagina:
LABORATORIO
SEÑOR DE SANTIAGO
MANUAL – POES – PROCESO ANÁLISIS
Título: PROCEDIMIENTO TÉCNICOS:
MANEJO Y OPERACIÓN DE EQUIPOS
91/124
Revisión:
Código:
Fecha:
01 PD-TEC-27 01-07-2012
MANEJO Y OPERACIÓN DE EQUIPOS
Objetivo
Los equipos del laboratorio deben tener establecido un manual y/o procedimiento de operación, con
las instrucciones en su manejo adecuado.
Alcance
La elaboración y establecimiento del manual de operación de equipos, compete a Asistencia de
Mantenimiento y Calibración de Equipos cuya administración y aplicación será realizado por
Dirección Técnica.
Asignación y Responsabilidades
La Dirección Técnica asignara la difusión del documento de operación de equipos para su
aplicación y cumplimiento a personal auxiliar Técnico.
Descripción
El proceso de operación debe ser sistemático de forma de prever desajustes o averiado de equipos,
las instrucciones de uso describen:
o
o
o
o
o
Nombre del equipo y código
Descripción de datos técnicos
Procedimiento de operación (encendido, proceso y apagado)
Precauciones de operación (fuente de energía, voltaje, localización del equipo, otros)
Mantenimiento y limpieza.
Pagina:
LABORATORIO
SEÑOR DE SANTIAGO
MANUAL – POES – PROCESO ANÁLISIS
Título: PROCEDIMIENTOS TÉCNICOS:
GRÁFICOS DE CONTROL CHART
92/124
Revisión:
Código:
Fecha:
01 PD-TEC-28 01-07-2012
GRÁFICOS DE CONTROL CHART
Objetivo
Implantar en función de norma el establecimiento de gráficos de control por verificación de método
(Patrón calibrado o Estándar) y análisis de los resultados del proceso, para la toma de acciones.
Alcance
La presente norma es administrada por Dirección Técnica Responsable del laboratorio, y es fuente
de aplicación y consulta en la misma área.
Determinación de los Límites del Gráfico
Realizar el control de forma permanente y frecuencia de n análisis / mes (por ejemplo
determinación de creatinina) con la previa verificación de método (Patrón calibrado) al inicio de
cada determinación / día, obteniendo los resultados de verificación se procede a establecer los
límites inferior y superior de control, de acuerdo a las fórmulas (Control para variables – S.P.C.):
El promedio del proceso y la variabilidad, en la práctica, son desconocidos.
Promedio de los datos
n
xi
x
i 1
n
Desviación estándar
n
xi
S
i 1
n 1
x
2
Siendo: X : Promedio
xi : datos o valor del Patrón calibrado
n : número de datos
Siendo:
S : Desviación estándar
xi : valores del Patrón calibrado (estándar)
X : Promedio
n : número de determinaciones
Pagina:
LABORATORIO
SEÑOR DE SANTIAGO
MANUAL – POES – PROCESO ANÁLISIS
Título: PROCEDIMIENTOS TÉCNICOS:
GRÁFICOS DE CONTROL CHART
93/124
Revisión:
Código:
Fecha:
01 PD-TEC-28 01-07-2012
Límites de Control para la X CHART
_
UCL
x
AS
3
_
Center Line x
Siendo: UCL ó LCS: Límite de Control Superior
LCL ó LCI : Límite de Control Inferior
A3 : Constante para n
_
LCL
x
AS
3
El responsable debe trazar en el gráfico la línea correspondiente a los límites, con los resultados de
verificación posterior a su determinación (No utilizar los mismos valores). Se debe seguir
controlando la operación, salvo en el caso en que alguna de las líneas de tolerancia se encuentren en
el intervalo entre límites, en cuyo caso se interrumpe el proceso y se investiga la causa para su
corrección.
Control Posterior del Proceso
El responsable debe monitorear el trazado de los puntos que representan las medidas sobre el
gráfico de forma que:
o Ningún punto se encuentra por fuera de los límites de control
o No se producen mas de seis anotaciones seguidas en secuencia ascendente o descendente
Por otra parte también se pueden aplicar las Reglas de Westgard [7], en el control del proceso.
Registro de los Gráficos
Es responsabilidad de Dirección Técnica mantener el registro específico de los gráficos de control
en RR-TE-08, de forma de implantar la trazabilidad de la medición, y promover la mejora continua
del sistema de calidad.
[7] Documentos de Referencia.
Página:
LABORATORIO
SEÑOR DE SANTIAGO
MANUAL – POES – PROCESO ANÁLISIS
Título: PROCEDIMIENTOS TÉCNICOS:
GRÁFICOS DE CONTROL CHART
Tabla de Constantes para Gráficos de Control
94/124
Revisión:
Código:
Fecha:
01
PD-TEC-28 01-07-2012
Pagina:
LABORATORIO
SEÑOR DE SANTIAGO
MANUAL – POES – PROCESO ANÁLISIS
Título:
PROCEDIMIENTOS DE SOPORTE
95/124
Revisión:
Código:
Fecha:
01 PD-SOP-00 01-07-2012
PROCEDIMIENTOS OPERATIVOS ESTÁNDAR: PROCEDIMIENTOS DE SOPORTE
Código
PD-SOP-01
PD-SOP-02
PD-SOP-03
PD-SOP-04
PD-SOP-05
PD-SOP-06
PD-SOP-07
PD-SOP-08
Versión
Descripción del Documento de Calidad
01
01
01
01
01
01
01
01
Toma, Manejo y Transporte de Muestras
Sugerencias y Reclamos por los Clientes
Procedimiento de Registros de Calidad
Gestión y Control de Auditorias Internas
Evaluación y Aseguramiento de Calidad del Proveedor (SQA)
Acción Correctiva y Preventiva
Control de Acceso a las Áreas de Análisis
Entrega de Informe de Resultados
Pagina:
LABORATORIO
SEÑOR DE SANTIAGO
MANUAL – POES – PROCESO ANÁLISIS
Título: PROCEDIMIENTOS DE SOPORTE:
TOMA, M. Y TRANS. DE MUESTRAS
96/124
Revisión:
Código:
Fecha:
01 PD-SOP-01 01-07-2012
TOMA, MANEJO Y TRANSPORTE DE MUESTRAS
Objetivo
El presente procedimiento en función de norma establece los lineamientos y acciones a seguir para
asegurar una buena toma, manejo y/o transporte de muestras.
Alcance
La presente norma es administrada por Dirección Técnica, y es fuente de aplicación y consulta en la
misma área.
Definición
Para los propósitos de esta norma se aplican las siguientes definiciones:
Toma: Acción de extraer sangre al paciente por punción venosa, y el proceso de Recepción de
muestras de orina y/o heces fecales con fines analíticos.
Manejo: Destreza de manipulación y ubicación específica de la muestra en el área de análisis.
Transporte: Proceso de envío adecuado y seguro de muestras.
Pagina:
LABORATORIO
SEÑOR DE SANTIAGO
MANUAL – POES – PROCESO ANÁLISIS
Título: PROCEDIMIENTOS DE SOPORTE:
TOMA, M. Y TRANS. DE MUESTRAS
97/124
Revisión:
Código:
Fecha:
01 PD-SOP-01 01-07-2012
Diagrama de proceso
1. Recepción
orden análisis
2. Información al
paciente.
1.
2.
3.
4.
B.P.L.
Uso material de protección personal
Compresión – torniquete
Desinfección
Desecho material infecto-contagioso.
Tratamiento Pre-analítico
Separación de suero
Tiempo aprox. de
almacenamiento 1 hrs.
Ubicación en
Sala de muestras
TOMA
DE
MUESTRA
(Sangre)
Identificación
de la muestra
1. Recepción
orden análisis
2. Información al
paciente.
RECEPCIÓN
DE
MUESTRA
(Orina, Heces)
Identificación
de la muestra
Proceso Analítico
Ubicación en
Área de análisis
ACP
Evitar accidentes
B.P.L.
Uso material de
protección personal
Servicio de Análisis
Externo
MANEJO
DE
MUESTRAS
TRANSPORTE
DE
MUESTRAS
Registro
Certificado de Análisis
Ocurrencias ACP.
ACP
Porta muestras Esp.
Evitar accidentes
ACP – Desinfección
Pagina:
LABORATORIO
SEÑOR DE SANTIAGO
MANUAL – POES – PROCESO ANÁLISIS
Título: PROCEDIMIENTOS DE SOPORTE:
TOMA, M. Y TRANS. DE MUESTRAS
98/124
Revisión:
Código:
Fecha:
01 PD-SOP-01 01-07-2012
Descripción del Procedimiento
Nro.
ACCIÓN
1
Recepción de la orden de análisis, e información previa al paciente
de las condiciones:
En ayunas para extracción de sangre
Recolección de la primera muestra de orina y/o heces.
RESPONSABLE
Director
Técnico
2
Ubicación del paciente en la sala de toma de muestras
“
3
Aplicar las B.P.Ls.:
Uso de material de protección personal
Compresión del brazo (torniquete) en caso de extracción
Desinfección efectiva del área de punción, con alcohol al
70 %
Desecho de materiales e insumos (Jeringas, algodón) en
contenedores para residuos infecto-contagiosos.
“
4
Toma o extracción de sangre (Volumen optimo requerido):
Química sanguínea de 2.5 a 5 ml
Hemograma 2.5 ml, y TP 2.5 ml
Inmunologia de 2.5 a 5 ml.
Recepción de muestras de orina y/o heces
Orina de 80 a 100 ml
Heces de 5 a 10 g.
“
5
Identificación de la muestra, con numeración correlativa.
“
6
Tratamiento Pre-analítico de la muestra para determinaciones
específicas, los siguientes:
Separación de suero sanguíneo por centrifugación a 3000
rpm por 5 minutos
Centrifugación para Tiempo de Protrombina a 1500 rpm por
10 minutos
Centrifugación de orina a 2000 rpm por 5 minutos
Almacenamiento de stock de muestras a ser procesados, por
un tiempo aproximado de 1 hora a temperatura ambiente.
“
Pagina:
LABORATORIO
SEÑOR DE SANTIAGO
MANUAL – POES – PROCESO ANÁLISIS
Título: PROCEDIMIENTOS DE SOPORTE:
TOMA, M. Y TRANS. DE MUESTRAS
99/124
Revisión:
Código:
Fecha:
01 PD-SOP-01 01-07-2012
Nro.
ACCIÓN
7
Ubicación adecuada y segura de las muestras, en el área de análisis
correspondiente.
8
Evitar las ocurrencias de accidentes por caídas y/o derrames de la
muestra; aplicar la acción correctiva y preventiva ACP ante una no
conformidad, realizando el seguimiento y ejecución correctiva
mediante el formulario ACP.
RESPONSABLE
Director
Técnico
“
Cuando el laboratorio requiere derivar análisis, a servicio de laboratorio externo, se aplica el
siguiente procedimiento.
9
Asegurar que toda muestra transportada cumpla lo siguiente:
Uso de porta muestras especial, e independiente para el tipo
de muestra (suero, plasma, orina, heces); el no cumplimiento
causara la ocurrencia no conforme de contaminación cruzada
El laboratorio debe tener asegurado la existencia de 4 porta
muestras, uno adicional en caso de no conformidad (derrame
interno de la muestra)
Aplicar (ocurrencia de no conformidad) la acción correctiva
de desinfección por contacto con Hipo Clorito de Calcio a
0.7 % (7 g x 1000 ml) por 30 minutos, y registrar en
formulario ACP.
10
El laboratorio externo debe emitir el certificado de análisis
correspondiente, al ensayo solicitado.
11
Registrar toda la documentación:
Paciente y tipo de muestra (contacto telefónico de
referencia)
Formularios ACP (aplicación condicional)
Certificados de análisis (servicio externo).
Director
Técnico
Servicio Externo
Director
Técnico
Frecuencia
Será aplicado de acuerdo al requerimiento de servicio del paciente y/o cliente, y toda ocasión de
solicitud de análisis.
Pagina:
100/124
LABORATORIO
SEÑOR DE SANTIAGO
MANUAL – POES – PROCESO ANÁLISIS
Título: PROCEDIMIENTOS DE SOPORTE:
SUGERENCIAS Y RECLAMOS DE CLIENTES
Revisión:
Código:
Fecha:
01 PD-SOP-02 01-07-2012
SUGERENCIAS Y RECLAMOS DE CLIENTES
Objetivo
El presente procedimiento en función de norma establece los lineamientos y acciones a seguir para
asegurar la gestión de servicios al cliente.
Alcance
La presente norma es administrada por el Director Técnico Responsable del laboratorio, y es fuente
de aplicación y consulta en la misma área.
Definición
Para los propósitos de esta norma se aplican las siguientes definiciones:
Sugerencia: Critica positiva para mejorar una o varias actividades.
Reclamo: No conformidad por un producto y/o servicio.
Pagina:
101/124
LABORATORIO
SEÑOR DE SANTIAGO
MANUAL – POES – PROCESO ANÁLISIS
Título: PROCEDIMIENTOS DE SOPORTE:
SUGERENCIAS Y RECLAMOS DE CLIENTES
Revisión:
Código:
Fecha:
01 PD-SOP-02 01-07-2012
Diagrama del Proceso
ENCUESTAS
A
CLIENTES
SERVICIOS
AL
CLIENTE
SISTEMA DE
ASEGURAMIENTO
DE CALIDAD
(SAC)
GRADO DE
SATISFACCIÓN
DEL
CLIENTE
PROCESO
DE
RETROALIMENTACIÓN
(SAC)
RECLAMOS
TRATAMIENTO
DE
NO CONFORMIDAD
APLICAR
ACP
Pagina:
102/124
LABORATORIO
SEÑOR DE SANTIAGO
MANUAL – POES – PROCESO ANÁLISIS
Título: PROCEDIMIENTOS DE SOPORTE:
SUGERENCIAS Y RECLAMOS DE CLIENTES
Revisión:
Código:
Fecha:
01 PD-SOP-02 01-07-2012
Descripción del Procedimiento
Evaluar el Grado de Satisfacción del Cliente
Nro.
ACCIÓN
1
Revisar la lista de clientes, estableciéndose el contacto
correspondiente para informar que se realizara de acuerdo a un
intervalo de tiempo (12 meses), una encuesta referente a la
prestación de servicios por el laboratorio.
RESPONSABLE
Dirección
Técnica
2
Emitir el Formulario CL-01/12 (formato establecido anexo al
presente) a los clientes, indicando el propósito y objetivo del mismo.
“
3
Solicitar la devolución del formulario, en un periodo de tiempo de
72 horas desde la extensión del mismo, informado en el momento de
entrega.
“
4
Proceder a recoger (o entrega por los clientes) los formularios, para
el análisis y evaluación.
5
Aplicar las Acciones Correctivas y Preventivas (ACP), en las no
conformidades evaluadas, y mantener el registro específico de los
mismos.
Clientes
y
Director Técnico
Director Técnico
y
Responsable de
Calidad
Frecuencia
Se aplicara en periodos de 12 meses, o de acuerdo a modificaciones en el sistema de calidad
referente a Servicios al Cliente.
Pagina:
103/124
LABORATORIO
SEÑOR DE SANTIAGO
MANUAL – POES – PROCESO ANÁLISIS
Título: PROCEDIMIENTOS DE SOPORTE:
SUGERENCIAS Y RECLAMOS DE CLIENTES
Revisión:
Código:
Fecha:
01 PD-SOP-02 01-07-2012
Formulario para evaluar el grado de satisfacción del cliente
FORM. CL-01/12
ENCUESTA DE SATISFACCIÓN A CLIENTES
Estimado Señor Dr.(a) con el propósito de mejorar y fortalecer nuestros servicios, le agradecemos
responda el presente formulario con honestidad, se respetara y guardara absoluta reserva en sus
criterios.
El cuestionario es anónimo. No lo firme. La evaluación será de forma conjunta.
Utilizar las siguientes referencias: (encierre en un circulo)
No Satisfactorio
Normal
Satisfactorio
1. REFERENTE A LOS RESULTADOS
1.1 Confiabilidad por los Resultados
1.2 Resultados conforme a lo solicitado
1.3 Informe metódico, preciso y no ambiguo
2. REFERENTE AL SERVICIO
2.1 Recibe el cliente un servicio eficiente
2.2 Cumple las exigencias del cliente
2.3 El servicio es cordial y oportuno
3. GENERAL
3.1 Desarrolla sus actividades en un marco ético
3.2 El desempeño esta orientado a mejorar continuamente
3.3 Competitivo estructural y operativamente.
4. SUGERENCIAS
Fuente: Elaboración propia 2012.
1
1
1
2
2
2
3
3
3
1
1
1
2
2
2
3
3
3
1
1
1
2
2
2
3
3
3
Pagina:
104/124
LABORATORIO
SEÑOR DE SANTIAGO
MANUAL – POES – PROCESO ANÁLISIS
Título: PROCEDIMIENTOS DE SOPORTE:
SUGERENCIAS Y RECLAMOS DE CLIENTES
Revisión:
Código:
Fecha:
01 PD-SOP-02 01-07-2012
Descripción del Procedimiento
Tratamiento de los Reclamos
Nro.
ACCIÓN
1
Formalizar el reclamo en el Formulario RE-02/12 (formato
establecido anexo al presente), cuando sean de forma verbal, o si es
por escrito anexar el formato al mismo.
RESPONSABLE
Cliente
y/o
Director Técnico
2
Analizar, evaluar y/o verificar la no conformidad, aplicar el
tratamiento inmediato.
Director Técnico
3
Aplicar las Acciones Correctivas y Preventivas (ACP), de forma de
eliminar y prevenir situaciones de no conformidad.
Director Técnico
y
Responsable de
Calidad
Frecuencia
Se aplicara a la ocurrencia de un reclamo.
Pagina:
105/124
LABORATORIO
SEÑOR DE SANTIAGO
MANUAL – POES – PROCESO ANÁLISIS
Título: PROCEDIMIENTOS DE SOPORTE:
SUGERENCIAS Y RECLAMOS DE CLIENTES
Revisión:
Código:
Fecha:
01 PD-SOP-02 01-07-2012
Formulario para tratamiento de los reclamos
FORM. RE-02/12
RECLAMO
Nº 00
Fecha: ……………………………………………………………………….
CLIENTE / PROVEEDOR: …………………………………………………………
PRODUCTO NO CONFORME: …………………………………………………...
DESCRIPCIÓN DE LA NO CONFORMIDAD:
FIRMA DEL CLIENTE / PROVEEDOR
Fuente: Elaboración propia 2012.
Pagina:
106/124
LABORATORIO
SEÑOR DE SANTIAGO
MANUAL – POES – PROCESO ANÁLISIS
Título: PROCEDIMIENTOS DE SOPORTE:
REGISTROS DE CALIDAD
Revisión:
Código:
Fecha:
01 PD-SOP-03 01-07-2012
REGISTROS DE CALIDAD
Objetivo
El presente procedimiento en función de norma establece los lineamientos y acciones a seguir para
asegurar el manejo adecuado de toda la documentación.
Alcance
La presente norma es administrada por Dirección Técnica Responsable del laboratorio, y es fuente
de aplicación y consulta en la misma área.
Definición
Para los propósitos de esta norma se aplica la siguiente definición:
Registro: Documento que presenta resultados obtenidos, o proporciona evidencias de las
actividades desempeñadas.
Diagrama del Proceso
SISTEMA DE
ASEGURAMIENTO
DE CALIDAD
(SAC)
AUDITORIAS
DE
CALIDAD
(QA)
REGISTROS
DE
CALIDAD
Pagina:
107/124
LABORATORIO
SEÑOR DE SANTIAGO
MANUAL – POES – PROCESO ANÁLISIS
Título: PROCEDIMIENTOS DE SOPORTE:
REGISTROS DE CALIDAD
Revisión:
Código:
Fecha:
01 PD-SOP-03 01-07-2012
Descripción del Procedimiento
Nro.
ACCIÓN
1
Establecer el control y verificación de registros en actividades en los
cuales es necesario implantarlos.
RESPONSABLE
Dirección
Técnica
2
Archivar la documentación y registros en el libro (Título y Código
específico) correspondiente, de acuerdo al sistema de calidad
implantado (anexo al presente).
“
3
Mantener los registros y la documentación, por un periodo de dos
años, en los medios que se considere.
“
4
Los registros y documentos deben ubicarse en un lugar específico,
excepto aquellos clasificados como restringidos.
Director
Técnico
Frecuencia
Aplicable a toda la documentación concerniente al laboratorio y las veces que generen los mismos.
Pagina:
108/124
LABORATORIO
SEÑOR DE SANTIAGO
MANUAL – POES – PROCESO ANÁLISIS
Título: PROCEDIMIENTOS DE SOPORTE:
REGISTROS DE CALIDAD
Revisión:
Código:
Fecha:
01 PD-SOP-03 01-07-2012
GESTIÓN Y MANEJO DE REGISTROS: REGISTROS TÉCNICOS Y DE CALIDAD
Código
Versión
Descripción del Documento de Calidad
RR-TE-01
RR-TE-02
RR-TE-03
RR-TE-04
RR-TE-05
RR-TE-06
RR-TE-07
RR-TE-08
01
01
01
01
01
01
01
01
Registro de Pacientes y Muestras
Informe de Análisis y Resultados
Calibración de Equipos (Certificado de Calibración)
Calibración y/o Verificación de Método Analítico
Identificación y Registro de Equipos
Aseguramiento de Calidad por el Proveedor - SQA
Ambiente e Instalaciones
Gráficos de Control
RR-RC-01
RR-RC-02
RR-RC-03
RR-RC-04
RR-RC-05
01
01
01
01
01
Formulario de Sugerencias y Reclamos por los Clientes
Informe y Resultados de Auditorias Internas
Subcontratación de Análisis
Formulario de Acciones Correctivas y Preventivas
Entrega de Resultados
Pagina:
109/124
LABORATORIO
SEÑOR DE SANTIAGO
MANUAL – POES – PROCESO ANÁLISIS
Título: PROCEDIMIENTOS DE SOPORTE:
GESTIÓN Y CONTROL DE AUDITORIAS
Revisión:
Código:
Fecha:
01 PD-SOP-04 01-07-2012
GESTIÓN Y CONTROL DE AUDITORIAS
Objetivo
El presente procedimiento en función de norma establece los lineamientos y acciones a seguir para
asegurar la realización de auditorias de calidad.
Alcance
La presente norma es administrada por Dirección Técnica Responsable del laboratorio, y es fuente
de aplicación y consulta en la misma área.
Definición
Para los propósitos de esta norma se aplica la siguiente definición:
Auditoria: Proceso de verificación del cumplimiento de los requisitos técnicos y de gestión en las
actividades de una organización, declarando su conformidad o lo contrario.
Pagina:
110/124
LABORATORIO
SEÑOR DE SANTIAGO
MANUAL – POES – PROCESO ANÁLISIS
Título: PROCEDIMIENTOS DE SOPORTE:
GESTIÓN Y CONTROL DE AUDITORIAS
Revisión:
Código:
Fecha:
01 PD-SOP-04 01-07-2012
Diagrama del Proceso
AUDITORIA
INTERNA
AUDITORIAS
DE
CALIDAD
(QA)
AUDITORIA
EXTERNA
VERIFICAR
EL
CUMPLIMIENTO
CONFORME
SISTEMA
DE
CALIDAD
IMPLANTADO
NO CONFORME
APLICAR
ACP
Pagina:
111/124
LABORATORIO
SEÑOR DE SANTIAGO
MANUAL – POES – PROCESO ANÁLISIS
Título: PROCEDIMIENTOS DE SOPORTE:
GESTIÓN Y CONTROL DE AUDITORIAS
Revisión:
Código:
Fecha:
01 PD-SOP-04 01-07-2012
Descripción del Procedimiento
Nro.
ACCIÓN
1
Programar la fecha de realización del proceso de auditoria interna
para el laboratorio, de acuerdo a directrices MC-QA-13 del Manual
de Calidad.
2
3
Seleccionar o contratar el auditor de calidad, referido a los objetivos
de la auditoria. De igual forma solicitar la intervención como
observador del equipo de auditoria al Responsable Regional de
Laboratorios (CODELAB).
Proceder al desarrollo de la auditoria en las fechas programadas.
4
Evaluación y resultados del proceso de auditoria.
5
Aplicar las Acciones Correctivas y Preventivas (ACP) a No
Conformidades encontrados en proceso de auditoria y conservar el
registro específico de los mismos.
RESPONSABLE
Director Técnico
y
Supervisor de
Calidad
“
Equipo
Auditor
“
Director Técnico
y
Supervisor de
Calidad
Frecuencia
Se aplicara en periodos de 24 meses ordinariamente, auditándose cada elemento del sistema de
calidad.
Pagina:
112/124
LABORATORIO
SEÑOR DE SANTIAGO
MANUAL – POES – PROCESO ANÁLISIS
Título: PROCEDIMIENTOS DE SOPORTE:
EVALUACIÓN Y S.Q.A.
Revisión:
Código:
Fecha:
01 PD-SOP-05 01-07-2012
ASEGURAMIENTO DE CALIDAD DEL PROVEEDOR - SQA
Objetivo
El presente procedimiento en función de norma establece los lineamientos y acciones a seguir para
asegurar la calidad del proveedor.
Alcance
La presente norma es administrada por Dirección Técnica Responsable del laboratorio, y es fuente
de aplicación y consulta en la misma área.
Definición
Para los propósitos de esta norma se aplica la siguiente definición:
Proveedor: Entidad que presta u otorga producto(s) y/o servicio(s).
Diagrama del Proceso
REACTIVOS
DIAGNOSTICOS
CONTROL
DE
CALIDAD
ASEGURAMIENTO
DE CALIDAD
DEL
PROVEEDOR
INSUMOS
MATERIALES
Pagina:
113/124
LABORATORIO
SEÑOR DE SANTIAGO
MANUAL – POES – PROCESO ANÁLISIS
Título: PROCEDIMIENTOS DE SOPORTE:
EVALUACIÓN Y S.Q.A.
Revisión:
Código:
Fecha:
01 PD-SOP-05 01-07-2012
Descripción del Procedimiento
Nro.
ACCIÓN
1
Verificar que todo proveedor emita la garantía de calidad, por los
productos que se entregan al laboratorio, validando los mismos con
certificados de calidad y hojas técnicas.
RESPONSABLE
Director Técnico
del
Laboratorio
2
Realizar el Control de Calidad (inspección, pruebas analíticas) al
producto y verificar su documentación de acuerdo a especificaciones
en MC-PA-18 del Manual de Calidad. Mantener el registro
específico.
“
3
Si se detecta una No Conformidad en el proceso de control, el
producto es separado procediendo al reclamo con el formato RE02/12, para la devolución del producto observado. Conservar el
registro específico de reclamos.
Director Técnico
y
Proveedor
Frecuencia
Se aplicara en cada transacción de entrega de productos al laboratorio.
Pagina:
114/124
LABORATORIO
SEÑOR DE SANTIAGO
MANUAL – POES – PROCESO ANÁLISIS
Título: PROCEDIMIENTOS DE SOPORTE:
ACCIÓN CORRECTIVA Y PREVENTIVA (ACP)
Revisión:
Código:
Fecha:
01 PD-SOP-06 01-07-2012
ACCIÓN CORRECTIVA Y PREVENTIVA - ACP
Objetivo
El presente procedimiento en función de norma establece los lineamientos y acciones a seguir para
asegurar la corrección, eliminación y prevención de no conformidades.
Alcance
La presente norma es administrada por Dirección Técnica Responsable del laboratorio, y es fuente
de aplicación y consulta en la misma área.
Definición
Para los propósitos de esta norma se aplican las siguientes definiciones:
Correctivo: Acción de eliminar una ocurrencia o actividad no conforme.
Preventivo: Acción de anticipar el suceso y eliminar una ocurrencia o actividad no conforme.
Diagrama del Proceso
SISTEMA DE
ASEGURAMIENTO
DE CALIDAD
(SAC)
AUDITORIA
DE
CALIDAD
(QA)
ACCIÓN
CORRECTIVA
Y
PREVENTIVA
REGISTROS
FORMATO ACP
Pagina:
115/124
LABORATORIO
SEÑOR DE SANTIAGO
MANUAL – POES – PROCESO ANÁLISIS
Título: PROCEDIMIENTOS DE SOPORTE:
ACCIÓN CORRECTIVA Y PREVENTIVA (ACP)
Revisión:
Código:
Fecha:
01 PD-SOP-06 01-07-2012
Descripción del Procedimiento
Nro.
ACCIÓN
1
Realizar la apertura del expediente de Acción Correctiva (AC) de
acuerdo al Formato AC (establecido y anexo al presente),
determinando la responsabilidad de ejecución, los plazos de
cumplimiento y verificación de la eficacia de las acciones tomadas.
RESPONSABLE
Director Técnico
y
Responsable de
Calidad
2
Proceder al control, evaluación, revisión y retroalimentación del
proceso, procedimiento, adquisiciones o servicios; de forma de
solucionar y eliminar la no conformidad en los plazos establecidos
(máximo de 48 horas), verificando el cumplimiento y efectividad de
las acciones, por el responsable.
“
3
Establecer la Acción Preventiva (AP) en Formato AP, de acuerdo al
expediente AC tras la verificación de las medidas correctivas
aplicadas, con el propósito de eliminar las causas potenciales de no
conformidad.
“
4
Toda la documentación AC y AP cerrado de conformidad en el
expediente, es conservado en el registro específico RR-RC-04.
Director Técnico
del
Laboratorio
Frecuencia
Aplicable en las ocurrencias no conformes:
o Reclamo de clientes
o Detección de una anomalía de proceso (análisis de datos, análisis de las encuestas a los
clientes, sugerencias del personal de la organización, otros).
Pagina:
116/124
LABORATORIO
SEÑOR DE SANTIAGO
MANUAL – POES – PROCESO ANÁLISIS
Título: PROCEDIMIENTOS DE SOPORTE:
ACCIÓN CORRECTIVA Y PREVENTIVA (ACP)
Revisión:
Código:
Fecha:
01 PD-SOP-06 01-07-2012
Formato AC
EXPEDIENTE AC
LABORATORIO CLÍNICO
“SEÑOR DE SANTIAGO”
FORMATO AC
ACCIÓN CORRECTIVA – APERTURA DE EXPEDIENTE
Motivo:
Fecha de apertura:
Causa de la No Conformidad:
Responsable:
EVALUACIÓN
Fecha:
Asistentes:
Director Técnico:
Acciones correctivas:
Responsable(s):
Plazos:
Cumplimentación de acciones
Plazos de cumplimentación
Eficacia de las medidas
Dir. Téc. Lab.
Responsable
Fuente: Manual y Procedimientos de un Sistema de Calidad ISO 9001-2000
Pagina:
117/124
LABORATORIO
SEÑOR DE SANTIAGO
MANUAL – POES – PROCESO ANÁLISIS
Título: PROCEDIMIENTOS DE SOPORTE:
ACCIÓN CORRECTIVA Y PREVENTIVA (ACP)
Revisión:
Código:
Fecha:
01 PD-SOP-06 01-07-2012
Formato AP
EXPEDIENTE AP
LABORATORIO CLÍNICO
“SEÑOR DE SANTIAGO”
FORMATO AP
ACCIÓN PREVENTIVA – APERTURA DE EXPEDIENTE
Motivo:
Fecha de apertura:
Causa de la No Conformidad:
Responsable:
EVALUACIÓN
Fecha:
Asistentes:
Director Técnico:
Acciones correctivas:
Responsable(s):
Plazos:
Cumplimentación de acciones
Plazos de cumplimentación
Eficacia de las medidas
Dir. Téc. Lab.
Responsable
Fuente: Manual y Procedimientos de un Sistema de Calidad ISO 9001-2000
Pagina:
118/124
LABORATORIO
SEÑOR DE SANTIAGO
MANUAL – POES – PROCESO ANÁLISIS
Revisión:
Código:
Fecha:
01 PD-SOP-07 01-07-2012
Título: PROCEDIMIENTOS DE SOPORTE:
CONTROL DE ACCESO A ÁREAS DE ANÁLISIS
CONTROL DE ACCESO A ÁREAS DE ANÁLISIS
Objetivo
El presente procedimiento en función de norma establece los lineamientos y acciones a seguir para
asegurar el ingreso de personal autorizado a las instalaciones del laboratorio.
Alcance
La presente norma es administrada por Dirección Técnica Responsable del laboratorio, y es fuente
de aplicación y consulta en la misma área y el personal externo de la organización.
Definición
Para los propósitos de esta norma se aplica la siguiente definición:
Acceso: Autorización para ejecutar una actividad.
Diagrama del Proceso
PERSONAL
EXTERNO
AUTORIZADO
CONTROL
PERSONAL
NO
AUTORIZADO
ACCESO
A
ÁREAS DE
ANÁLISIS
LABORATORIO
SEÑOR DE SANTIAGO
Pagina:
119/124
MANUAL – POES – PROCESO ANÁLISIS
Revisión:
Código:
Fecha:
01 PD-SOP-07 01-07-2012
Título: PROCEDIMIENTOS DE SOPORTE:
CONTROL DE ACCESO A ÁREAS DE ANÁLISIS
Descripción del Procedimiento
Nro.
ACCIÓN
1
Señalizar al ingreso del área de análisis, con el rotulo de ENTRADA
PROHIBIDA A PERSONAS NO AUTORIZADAS.
RESPONSABLE
Director
Técnico
2
El personal autorizado deberá anunciar su llegada, previo ingreso a Personal autorizado
instalaciones del laboratorio (si es aplicable el personal cuenta con
y
su identificación organizacional).
Dirección Técnica
3
Registrar el ingreso del personal autorizado.
4
El personal No autorizado que requiera ingresar a las instalaciones
del laboratorio (áreas de análisis) con el propósito de auditorias u
otro relevante, deberá tener la aprobación escrita por el Director
Técnico, o llevar una insignia del laboratorio.
Dirección Técnica
Frecuencia
Se aplicara durante todo turno de trabajo ordinario y extraordinario en el laboratorio.
Director
Técnico
Pagina:
120/124
LABORATORIO
SEÑOR DE SANTIAGO
MANUAL – POES – PROCESO ANÁLISIS
Título: PROCEDIMIENTOS DE SOPORTE:
ENTREGA DE INFORME DE RESULTADOS
Revisión:
Código:
Fecha:
01 PD-SOP-08 01-07-2012
ENTREGA DE INFORME DE RESULTADOS
Objetivo
El presente procedimiento en función de norma establece los lineamientos y acciones a seguir para
el proceso de entrega segura y garantizada de informe de resultados al cliente.
Alcance
La presente norma es administrada por Dirección Técnica Responsable del laboratorio, y es fuente
de aplicación y consulta en la misma área.
Definición
Para los propósitos de esta norma se aplican las siguientes definiciones:
Informe: Descripción sistemática de un proceso, procedimiento o actividad.
Resultado: Producto de un proceso, procedimiento o actividad.
Diagrama del Proceso
SISTEMA DE
ASEGURAMIENTO
DE CALIDAD
(SAC)
INFORME
DE
RESULTADOS
REGISTRO
ENTREGA
AL
CLIENTE
Pagina:
121/124
LABORATORIO
SEÑOR DE SANTIAGO
MANUAL – POES – PROCESO ANÁLISIS
Título: PROCEDIMIENTOS DE SOPORTE:
ENTREGA DE INFORME DE RESULTADOS
Revisión:
Código:
Fecha:
01 PD-SOP-08 01-07-2012
Descripción del Procedimiento
Nro.
ACCIÓN
1
Revisar y aprobar el informe de resultados con la firma del
responsable, previo a la entrega del mismo.
2
Registrar una copia del informe en el libro específico RR-TE-02, y
mantener por un periodo de 12 meses.
3
Al momento de entrega del informe, se deberá registrar con la firma
del usuario la recepción del documento, en el libro específico de
entrega RR-RC-05.
RESPONSABLE
Director Técnico
del
Laboratorio
“
Director Técnico
del
Laboratorio
Frecuencia
Se aplicara la entrega por única vez; si el cliente solicita una copia, este deberá argumentar por
escrito por la vía que considere (mail, manuscrito).
Pagina:
122/124
LABORATORIO
SEÑOR DE SANTIAGO
MANUAL – POES – PROCESO ANÁLISIS
Título:
ANEXO 01 - TERMINOLOGIA
Revisión:
Código:
Fecha:
01 MC-PR-20 01-07-2012
ANEXO 01 – TERMINOLOGIA
El presente anexo tiene por finalidad aclarar los términos usados en la aplicación de conceptos de
determinadas nomenclaturas.
AUDITORIA DE CALIDAD: Examen sistemático e independiente para determinar si las
actividades de calidad y sus resultados están de acuerdo con las disposiciones planeadas, y si estas
están implantadas efectivamente para conseguir los objetivos.
CALIBRACIÓN: Conjunto de operaciones que establece, en condiciones especificas, la
correspondencia entre el estímulo y la respuesta de un instrumento de medición, sistema de
medición o transductor de medición.
CALIDAD: Totalidad de características de una entidad que le confiere la capacidad de satisfacer
necesidades implícitas y explicitas.
ENSAYO o ANÁLISIS: Operación técnica que consiste en la determinación de una o más
características o desempeño de un producto dado, de acuerdo con un procedimiento determinado.
ENTIDAD: Todo elemento que puede ser considerado individualmente.
GESTIÓN DE CALIDAD: Todas las actividades de la función gerencial que determinan la
política de calidad, los objetivos y las responsabilidades, y los implanta por medios tales como la
planeación de la calidad, el control de calidad, la garantía de calidad y el mejoramiento de la
calidad dentro del sistema de calidad.
MANUAL DE ASEGURAMIENTO DE CALIDAD: Documento que declara la política de
calidad y describe el sistema de calidad de una organización. Posee otras denominaciones, tales
como Manual de Calidad (MC) o Manual del Sistema de Aseguramiento de Calidad (MSAC).
NO CONFORMIDAD: Incumplimiento de un requisito especificado. Significa también la
ausencia de una o más características de calidad, en relación con requisitos especificados.
ORGANIZACIÓN: Compañía, corporación, firma, empresa o institución, o parte de estas, pública
o privada, sociedad anónima, limitada o con otra forma estatutaria que tiene funciones y estructura
administrativa propia.
POLÍTICA DE CALIDAD: Intenciones y directrices globales de una organización relativas a la
calidad, expresadas formalmente por la alta administración.
PROCEDIMIENTO: Forma especifica de ejecutar una actividad.
Pagina:
123/124
LABORATORIO
SEÑOR DE SANTIAGO
MANUAL – POES – PROCESO ANÁLISIS
Título:
ANEXO 01 - TERMINOLOGIA
Revisión:
Código:
Fecha:
01 MC-PR-20 01-07-2012
PARTE INTERESADA: Persona o grupo, dentro o fuera del lugar de trabajo que tiene interés o
está afectado por el desempeño de calidad de una organización.
PROCESO: Conjunto de recursos y actividades interrelacionados que transforman insumos en
productos.
PRODUCTO: Resultado de actividades o procesos.
REQUISITOS PARA LA CALIDAD: Expresión de las necesidades o su traducción en un
conjunto de requisitos, hechos explícitos en términos cuantitativos y cualitativos, buscando definir
las características de una entidad a fin de permitir su realización y su examen.
SERVICIO: Resultados generados por actividades en la interfaz proveedor – cliente, y por
actividades internas del proveedor para atender las necesidades del cliente.
SISTEMA DE CALIDAD: Estructura organizacional, responsabilidades, procedimientos,
procesos y recursos para la implementación de la gestión de la calidad.
TRAZABILIDAD: Capacidad de recuperación de la historia, de la aplicación o de la ubicación de
una entidad, por medio de identificaciones registradas.
VERIFICACIÓN: Confirmación por examen y provisión de evidencia objetiva, de cumplimiento
con requisitos especificados.
Pagina:
124/124
LABORATORIO
SEÑOR DE SANTIAGO
MANUAL – POES – PROCESO ANÁLISIS
Título:
ANEXO 02 – DOCUMENTOS DE REFERENCIA
Revisión:
Código:
Fecha:
01 MC-PR-20 01-07-2012
ANEXO 02 – DOCUMENTOS DE REFERENCIA
La documentación utilizada para el Sistema de Calidad a implantarse en la organización, utiliza
como referencia los siguientes:
1. ISO 15189 Laboratorios Clínicos – Requisitos Particulares para la Calidad y Competencia
2. ISO/IEC 17025 Requisitos Generales para la Competencia de Laboratorios de Ensayo y
Calibración.
3. ISO 9001:2000 Manual y Procedimientos de un Sistema de Calidad
4. ISO 9001:2000 Sistemas de Gestión de la Calidad - Requisitos
5. ISO 9001:1994 Sistemas de Calidad – Modelo para el aseguramiento de la calidad en el
diseño, desarrollo, producción, instalación y servicio.
6. Manual de Requisitos para Habilitación de Laboratorios / Ministerio de Salud y Deportes
7. Manual para el Aseguramiento de la Calidad de Resultados en Serologia / INLASA
8. Política Ética para Empleados / CBB.
9. Control Estadístico de Calidad en la Producción (Statistical Process Control – SPC)