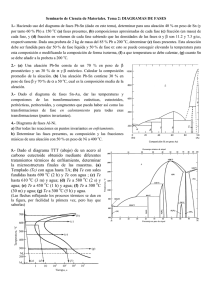
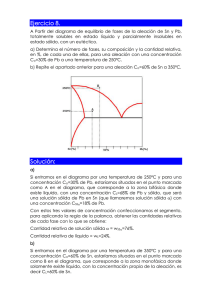
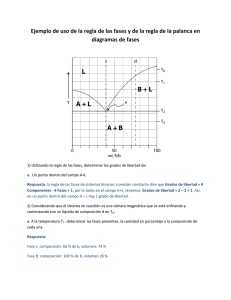
CIENCIAS DE LOS MATERIALES PRÁCTICA DE LABORATORIO N°4 “DIAGRAMA DE FASES” Introducción Los diagramas de fase son la base para el diseño y control de procedimientos que involucran tratamientos térmicos. Aunque representan estados de equilibrio estable o metaestable, son útiles para el entendimiento del desarrollo y la preservación de las estructuras de no equilibrio y sus propiedades. Estas últimas frecuentemente presentan más interés que las estructuras de equilibrio1. Objetivo de la práctica Construir el diagrama binario correspondiente a la aleación Pb-Sn a partir del trazado de las curvas de enfriamiento. Equipos y materiales 1) Mechero y crisoles 2) Termocupla y termómetro 3) Cronómetro 4) 5 aleaciones Pb-Sn: 0, 33, 60, 80 y 100%Sn Procedimiento A cada grupo de trabajo se le asignará una de las 5 composiciones. 1. Colocar la aleación en estado sólido en el crisol y luego éste sobre el mechero. 2. Calentar hasta fundir completamente la aleación. 3. Retirar el aporte de calor. Registrar el tiempo con el cronómetro y la temperatura con el termómetro cada 30 segundos, hasta que la temperatura sea inferior a la del eutéctico. Tener como referencia las temperaturas de transformación de la composición de la aleación analizada según el diagrama de equilibrio Pb-Sn. Diagrama de equilibrio Pb-Sn 1 Callister - Introducción a la Ciencia e Ingeniería de Materiales Análisis de los resultados Las curvas de enfriamiento de aleaciones con un porcentaje de Sn entre 18,3 y 97,8%, presentan un primer cambio de pendiente asociado a la aparición de la fase sólida que corresponda. Dicha pendiente se mantiene hasta que se alcanza la temperatura del eutéctico, cuando toda la masa líquida remanente se transforma en una estructura eutéctica. A medida que el porcentaje de Sn se va aproximando a la concentración del eutéctico, aumenta el intervalo isotérmico, es decir, es mayor el porcentaje de líquido que se transforma en eutéctico (regla de la palanca). Justamente estos dos puntos característicos hallados para cada una de las composiciones estudiadas (temperatura a la que se registra el cambio de pendiente –aparición de la fase sólida– y temperatura a la cual se da la transformación isotérmica –transformación eutéctica–), en conjunto con los puntos de fusión de los componentes puros (tramos isotérmicos también), permiten construir las curvas de liquidus y solidus. INFORME DE LA PRÁCTICA DE LABORATORIO a. Graficar la curva de enfriamiento. b. Obtener el punto de la curva de liquidus y el de la curva de solidus para la composición estudiada. c. Recolectar la información generada en el inciso b para cada una de las composiciones restantes (es decir, deben consultar a 4 grupos). d. Obtener el diagrama Pb-Sn sin las curvas de solvus, sabiendo que la máxima solubilidad de Sn en fase α es de 18,3% en peso, mientras que la máxima solubilidad de Pb en fase β es del 2,2% en peso. e. Representar la micrografía que correspondería a la concentración analizada a temperatura ambiente, indicando microconstituyentes y fases presentes. Indique las propiedades que espera para esta microestructura. f. Explicar por qué considera que se eligió la aleación Sn-Pb y no otra (ej. Fe-C). g. Existen 4 variables que afectan al presente ensayo: presión, temperatura, composición y tiempo. Explique por qué el diagrama de equilibrio se presenta en función de la temperatura y de la composición y no están involucrados la presión y el tiempo. h. A partir del diagrama Pb-Sn provisto a continuación, identificar: 1) Componentes 2) Fases 3) Composición del eutéctico 4) Temperatura del eutéctico 5) Temperatura de fusión del Pb 6) Temperatura de fusión del Sn