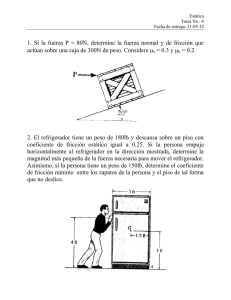
Deposito de energia termica En el desarrollo de la segunda ley de la termodinámica es conveniente tener un cuerpo hipotético grande que pueda suministrar o absorber cantidades finitas de calor sin que sufra ningún cambio de temperatura, al que se le conoce como deposito de energía térmica. Tipos de depósito de energía térmica Los depósitos de energía térmica pueden ser: fuentes de calor o sumideros de calor según la dirección de la transferencia de calor sea donde ellos o hacia ellos. Como un resultado de esa transferencia de calor se produce una disminución o aumento de la energía interna del depósito. Fuente: Deposito o foco que suministra energía en forma de calor, Sumidero: Deposito o foco de energía que absorbe energía en forma de calor. Fluido de trabajo El volumen de control incluye flujos de masa a través de la frontera del volumen de control, por lo que necesita una energía para empujar la masa hacia adentro y hacia afuera del volumen de control, este trabajo se conoce como trabajo de flujo. Eficiencia térmica La eficiencia térmica, e (o simplemente eficiencia), de una máquina térmica se define como la razón entre el trabajo neto realizado y el calor absorbido durante un ciclo, se escribe de la forma: Q= W = Qc - Qf = 1- Qf Qc Qc Qc Se puede pensar en la eficiencia como la razón de lo que se obtiene (trabajo mecánico) a lo que se paga por (energía). Este resultado muestra que una máquina térmica tiene una eficiencia de 100% (e = 1) sólo si QF = 0, es decir, si no se libera calor a la fuente fría. En otras palabras, una máquina térmica con una eficiencia perfecta deberá convertir toda la energía calórica absorbida QC en trabajo mecánico Coeficiente de rendimiento El coeficiente de rendimiento (COP), es una expresión de la eficiencia de una bomba de calor. Cuando se calcula el COP de una bomba de calor, se compara la salida de calor del condensador (Q) con la potencia suministrada al compresor (W). Se puede utilizar esta fórmula para calcular el COP: En otras palabras, el COP se define como la relación entre la potencia (kW) que sale de la bomba de calor como refrigeración o calor, y la potencia (kW) que se suministra al compresor. Refrigerador Un refrigerador es un dispositivo que extrae calor de un foco que está más frío que el ambiente (como el interior de un frigorífico, a 5°C) y lo vierte en el ambiente (a 22°C, por ejemplo). Para funcionar, un refrigerador requiere un trabajo adicional Win, que aumenta el calor de desecho Qout que se entrega al ambiente. Un frigorífico o un aparato de aire acondicionado son ejemplos de refrigeradores. En su uso habitual, lo que hacen los refrigeradores y aparatos de aire acondicionado es principalmente, mantener constante la temperatura del interior de una cámara o habitación, expulsado de forma continua el calor que va entrando por las paredes (aparte, si se introduce un objeto caliente en un frigorífico, éste se encarga de bajar la temperatura del objeto, consumiendo un trabajo adicional). Para ello utiliza de una sustancia de trabajo (vapor de agua, aire u otras sustancias) que realiza una serie de transformaciones termodinámicas de forma cíclica, para que pueda funcionar de forma continua, como sucede con las máquinas térmicas. Bomba de calor Una bomba de calor es un dispositivo mecánico que transporta energía térmica de una región a baja temperatura a una región a temperatura mayor. Se basa en el mismo principio que un refrigerador, salvo que se emplea para pasar calor del ambiente a un foco más caliente. Para esto el, circuito debe estar situado de manera opuesta al caso del refrigerador. El compresor envía el fluido a alta presión al un condensador en el interior de la habitación, donde libera calor por estar a más temperatura que el ambiente. pasa entonces por la válvula hacia el exterior, donde se evapora y cae por debajo de la temperatura exterior, absorbiendo calor en el evaporador. Vuelve entonces al compresor, reiniciando el ciclo. En el uso habitual, lo que hace una bomba de calor es principalmente mantener constante la temperatura del interior de una cámara o habitación, reintroduciendo de forma continua el calor que va escapando por las paredes (aparte, si se introduce un objeto frío en una habitación, la bomba de calor se encarga de elevar la temperatura del objeto, consumiendo un trabajo adicional). Maquinas térmicas Una máquina térmica es un dispositivo cuyo objetivo es convertir calor en trabajo. Para ello utiliza de una sustancia de trabajo (vapor de agua, aire, gasolina) que realiza una serie de transformaciones termodinámicas de forma cíclica, para que la máquina pueda funcionar de forma continua. A través de dichas transformaciones la sustancia absorbe calor (normalmente, de un foco térmico) que transforma en trabajo. Un sistema termodinámico puede describir una serie de transformaciones que lo lleven desde un cierto estado inicial (en el que el sistema se encuentra a una cierta presión, volumen y temperatura) a un estado final en que en general las variables termodinámicas tendrán un valor diferente. Durante ese proceso el sistema intercambiará energía con los alrededores. Los procesos termodinámicos pueden ser de tres tipos: Cuasiestático: es un proceso que tiene lugar de forma infinitamente lenta. Generalmente este hecho implica que el sistema pasa por sucesivos estados de equilibrio, en cuyo caso la transformación es también reversible. Reversible: es un proceso que, una vez que ha tenido lugar, puede ser invertido (recorrido en sentido contrario) sin causar cambios ni en el sistema ni en sus alrededores. Irreversible: es un proceso que no es reversible. Los estados intermedios de la transformación no son de equilibrio. Descripción de la segunda ley de la termodinámica Según la expresión más sencilla del segundo principio de la termodinámica, debida al físico alemán Rudolf Clausius, el calor no puede transmitirse de forma espontánea desde un cuerpo a una determinada temperatura a otro de temperatura mayor. De ello se deduce que no existe la posibilidad de aprovechar toda la energía calórica de un cuerpo, sino solamente aquella porción que pueda cederse al ámbito exterior, dado que para conseguir el enfriamiento de un cuerpo es necesario consumir una cantidad de energía igual a la que se aprovecharía con dicho enfriamiento. El físico francés Nicolás Carnot estableció, con anterioridad a Clausius, un enunciado para este mismo principio según el cual una transformación cíclica de un sistema termodinámico que intercambia calor con una sola fuente térmica no puede generar trabajo positivo. Considérese un sistema en el que tiene lugar un proceso cíclico que da lugar a una cantidad de calor Q y a un trabajo W, con una fuente a temperatura constante. Por tratarse de un ciclo, Q = W, lo que plantea tres posibilidades diferentes: 1.ª, si Q y W son negativos, el sistema recibe trabajo y cede calor, 2.ª, si Q y W son positivos, el sistema absorbe calor y lo convierte en trabajo en su totalidad. El enunciado de Carnot para el segundo principio anula esta posibilidad, lo que implica la inexistencia del móvil perpetuo de segunda especie o motor periódico que transformaría el calor en trabajo a partir de una única fuente. 3.ª, si Q y W presentan valores nulos, cosa que ocurre en los ciclos reversibles que toman calor de una sola fuente, el sistema permanece inalterado. La expresión matemática del segundo principio, según la cual para una transición de calor dQ desde un cuerpo de temperatura T1 a otro de temperatura T2 requiere la introducción de una nueva magnitud denominada entropía (S), tal que en el primer cuerpo se produce una disminución de dicha magnitud equivalente a dS1= dQ T1 y en el segundo un incremento de la misma determinable por dQ dS2 = T2 Forma de Kelvin – Planck de la segunda ley de la termodinámica. “es imposible construir una máquina térmica que, operando en un ciclo, no tenga otro efecto que absorber la energía térmica de una fuente y realizar la misma cantidad de trabajo”. Esto es equivalente a afirmar que “es imposible construir una máquina de movimiento perpetuo (móvil perpetuo) de segunda clase”, es decir, una máquina que pudiera violar la segunda ley de la termodinámica. (Una máquina de movimiento perpetuo de primera clase es aquella que puede violar la primera ley de la termodinámica (conservación de la energía), también es imposible construir una máquina de este tipo) Enunciado de Clausius de la segunda ley de la termodinámica. Resulta deseable construir un refrigerador que pueda realizar su proceso con el mínimo de trabajo. Si se pudiera construir uno donde el proceso de refrigeración se realice sin ningún trabajo, se tendría un refrigerador perfecto. Esto es imposible, porque se violaría la segunda ley de la termodinámica, que es el enunciado de Clausius de la segunda ley (Rudolf Clausius, alemán, 18221888): “es imposible construir una máquina cíclica, que no tenga otro efecto que transferir calor continuamente de un cuerpo hacia otro, que se encuentre a una temperatura más elevada”. Eficientes térmicas y coeficientes de desempeño en una bomba de calor La eficiencia de una bomba de calor se describe en términos de un número llamado coeficiente de desempeño, COP, que se define como la razón del calor transferido hacia la fuente de calor y el trabajo realizado para transferir ese calor. En el caso de una bomba de calor “lo que se saca” es el calor Qout, por lo que el coeficiente de desempeño de una bomba de calor se define como: o, empleando los flujos de calor y trabajo: De esta definición se tiene que el coeficiente de desempeño de una bomba de calor y del refrigerador correspondiente se diferencian en 1. y por tanto el coeficiente de desempeño de una bomba de calor es como mínimo 1. Un valor de 1 quiere decir que no se extrae ningún calor del foco frío, sino que simplemente se transforma trabajo en calor. Esto es lo que hace, por ejemplo, una estufa de resistencia. Para una bomba de calor real el COP puede ser de 4. Esto quiere decir que para aportar 4 J de calor a una habitación solo consume 1 J de energía eléctrica (mientras que una estufa consumiría los 4 J). Las bombas de calor son por tanto más eficientes como sistema de calefacción, pero requieren instalaciones más grandes y poseen problemas de funcionamiento si la temperatura exterior es demasiado baja. Eficientes térmicas y coeficientes de desempeño en un refrigerador: Coeficiente de desempeño Para los refrigeradores se define el coeficiente de desempeño (COPR) según el mismo principio que para las máquinas térmicas siendo “lo que se saca” el calor Qin que se extrae del foco frío y “lo que cuesta” el trabajo Win necesario para ello A diferencia del rendimiento de una máquina térmica, el coeficiente de desempeño puede ser mayor que la unidad (normalmente lo es, de hecho). Dado que refrigeradores y bombas de calor operan en ciclos, el coeficiente de desempeño puede definirse en términos de los flujos de calor y trabajo Donde cada flujo se calcula dividiendo el calor o trabajo intercambiados en un ciclo dividido por el periodo de éste. En el diseño de refrigeradores se suele usar como unidad la frigoría (fg), definida como 1 kcal (= 4186 J) de calor extraído. También, como unidad de potencia, se usa la frigoría/hora (fg/h), llamada erróneamente como frigoría a secas, que nos da el flujo de calor extraído Un refrigerador eficiente es aquel que remueve la mayor cantidad de calor de la fuente fría con la menor cantidad de trabajo. Por lo tanto, un buen refrigerador debe tener un coeficiente de rendimiento alto, normalmente de 5 o 6. Un refrigerador imposible tendría un coeficiente de rendimiento infinito. Eficiencia térmica Un refrigerador se optimizará reduciendo el trabajo consumido para la misma cantidad de calor extraída del foco frío. La eficiencia (ε) de un refrigerador d se define entonces como: Eficientes térmicas y Coeficientes de desempeño de una maquina reversible Una máquina reversible es una que puede operar en ambos sentidos, esto es, tanto como motor como como refrigerador. Esta máquina debe funcionar describiendo una serie de procesos cada uno de los cuales debe ser reversible (esto es, son procesos cuyo sentido de evolución se puede invertir mediante un cambio infinitesimal de las condiciones del entorno). El concepto de máquina reversible, como el de proceso reversible, es una idealización. No existen máquinas reversibles en el mundo real, sino que deben considerarse como el límite al que tienden máquinas irreversibles cada vez más perfeccionadas. El ejemplo más sencillo de máquina reversible es el de la máquina de Carnot, la cual opera según un ciclo de Carnot reversible. Cuando esta máquina se invierte se convierte en un refrigerador (o bomba de calor) de Carnot. El rendimiento de una máquina reversible es: Cuando esta máquina funciona como refrigerador, su coeficiente de desempeño es: mientras que si actúa como bomba de calor será: Características de un depósito de energía térmica 1. Reciben calor de una fuente de alta temperatura 2. Convierten parte de este calor en trabajo 3. Liberan calor en un sumidero de baja temperatura 4. Operan en ciclo Procesos que se cumple con la primera y segunda ley de la termodinámica La primera ley de la termodinámica es la ley de conservación de la energía generalizada para incluir el calor como una forma de transferencia de energía. Esta ley sólo afirma que un aumento en algunas de las formas de energía debe estar acompañado por una disminución en alguna otra forma de la misma. La primera ley no produce ninguna restricción sobre los tipos de conversiones de energía que pueden ocurrir. Además no hace distinción entre el trabajo y el calor. De acuerdo con la primera ley, la energía interna de un sistema se puede incrementar ya sea agregando calor o realizando un trabajo sobre el sistema. Pero existe una diferencia muy importante entre el trabajo y el calor que no se evidencia de la primera ley. Por ejemplo, es posible convertir completamente el trabajo en calor, pero en la practica, es imposible convertir completamente el calor en trabajo sin modificar los alrededores. La segunda ley de la termodinámica establece cuales procesos de la naturaleza pueden ocurrir o no. De todos los procesos permitidos por la primera ley, solo ciertos tipos de conversión de energía pueden ocurrir. Esta ley marca la dirección en la que deben llevarse a cabo los procesos termodinámicos y, por lo tanto, la imposibilidad de que ocurran en el sentido contrario. De todos los procesos permitidos por la primera ley, solo ciertos tipos de conversión de energía pueden ocurrir. Los siguientes son algunos procesos compatibles con la primera ley de la termodinámica, pero que se cumplen en un orden gobernado por la segunda ley. 1) Cuando dos objetos que están a diferente temperatura se ponen en contacto térmico entre sí, el calor fluye del objeto más cálido al más frío, pero nunca del más frío al más cálido. 2) La sal se disuelve espontáneamente en el agua, pero la extracción de la sal del agua requiere alguna influencia externa. 3) Cuando se deja caer una pelota de goma al piso, rebota hasta detenerse, pero el proceso inverso nunca ocurre. Todos estos son ejemplos de procesos irreversibles, es decir procesos que ocurren naturalmente en una sola dirección. Ninguno de estos procesos ocurre en el orden temporal opuesto. Si lo hicieran, violarían la segunda ley de la termodinámica. La naturaleza unidireccional de los procesos termodinámicos establece una dirección del tiempo. Ciclos de potencia Ciclo de carnot El ciclo de Carnot es un ciclo termodinámico que se produce en un equipo o máquina cuando trabaja absorbiendo una cantidad de calor Q1 de una fuente de mayor temperatura y cediendo un calor Q2 a la de menor temperatura produciendo un trabajo sobre el exterior. Para conseguir la máxima eficiencia la máquina térmica que estamos diseñando debe tomar calor de un foco caliente, cuya temperatura es como máximo Tc y verter el calor de desecho en el foco frío, situado como mínimo a una temperatura Tf. Para que el ciclo sea óptimo, todo el calor absorbido debería tomarse a la temperatura máxima, y todo el calor de desecho, cederse a la temperatura mínima. Por ello, el ciclo que estamos buscando debe incluir dos procesos isotermos, uno de absorción de calor a Tc y uno de cesión a Tf. Para conectar esas dos isotermas (esto es, para calentar el sistema antes de la absorción y enfriarlo antes de la cesión), debemos incluir procesos que no supongan un intercambio de calor con el exterior (ya que todo el intercambio se produce en los procesos isotermos). La forma más sencilla de conseguir esto es mediante dos procesos adiabáticos reversibles (no es la única forma, el motor de Stirling utiliza otro método, la recirculación). Por tanto, nuestra máquina térmica debe constar de cuatro pasos: C→D Absorción de calor Qc en un proceso isotermo a temperatura Tc. D→A Enfriamiento adiabático hasta la temperatura del foco frío, Tf. A→B Cesión de calor | Qf | al foco frío a temperatura Tf. B→C Calentamiento adiabático desde la temperatura del foco frío, Tf a la temperatura del foco caliente, Tc. Ciclo rankie ideal simple El ciclo Rankine es un ciclo que opera con vapor, y es el que se utiliza en las centrales termoeléctricas. Consiste en calentar agua en una caldera hasta evaporarla y elevar la presión del vapor. Éste será llevado a una turbina donde produce energía cinética a costa de perder presión. Su camino continúa al seguir hacia un condensador donde lo que queda de vapor pasa a estado líquido para poder entrar a una bomba que le subirá la presión para nuevamente poder introducirlo a la caldera. Los diagramas p-V en los que interviene un líquido que se vaporiza tienen una diferencia respecto a los de gas: aparece la llamada campana de cambio de fase. En el proceso 1-2 se aumenta la presión del líquido sin pérdidas de calor mediante un compresor o bomba, al que se aporta un pequeño trabajo. - El proceso. 2-3 es una transmisión de calor hacia el fluido de trabajo a presión constante en la caldera. Con este calor se evapora todo el líquido y se calienta el vapor hasta la temperatura máxima. - La expansión del proceso 3-4 se realiza de forma adiabática. El vapor realiza un trabajo en la turbina desde la presión de la caldera hasta un valor bajo de presión al cual se transfiere el vapor al condensador. - El proceso 4-1 consiste en refrigerar el vapor de trabajo a presión constante en el condensador hasta el estado de líquido, para iniciar de nuevo el ciclo. Ciclo rankie con recalientamiento Se desarrollo con el fin de sacar ventaja del incremento de la eficiencia con presiones excesivas. En el ciclo con recalentamiento el vapor , no se expande por completo en una sola etapa hasta la presión del condensador. Luego de expandirse parcialmente, el vapor se extrae de la turbina de alta presión y se recalienta a presión constante en el sistema caldera sobrecalentador. A continuación, se le devuelve a la turbina de baja presion para su expansión posterior hasta la presión de salida. Se puede considerar que la turbina esta constituida por dos etapas una de alta y otra de baja presión. CICLO RANKINE CON REGENERACIÓN Consiste, en extraer parte del vapor expandido en la turbina y utilizarlo para suministrar calor al fluido de trabajo (mediante calentadores), aumentado su temperatura antes de pasar por la fuente principal de calor (Caldera) a una presión determinada. Existen dos tipos de calentadores uno denominado calentador abierto o de contacto directo y el calentador cerrado o cambiador de calor de carcasa y tubos. República Bolivariana De Venezuela Ministerio del Poder Popular Para La Educación Superior Instituto Universitario de tecnología de Administración Industrial Extensión Puerto la Cruz Objetivo N°4 2do ley de la termodinámica: Maquinas térmicas Refrigeradores Bombas de calor Prof: Tibisay Tovar alumnos: Josue Arias C.I:29.663.388 Mauricio Casanova C.I: 24.494.565