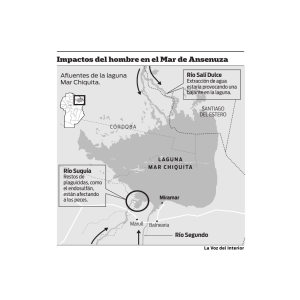
Diagnostico de la estructura y función de la comunidad ictiofaunistica de La Laguna de Sontecomapan, Veracruz
Anuncio

“Diagnóstico de la estructura y función de la comunidad ictiofaunística en la laguna de Sontecomapan, Veracruz” Cecilia Chula Quinto - Alfonso Eliseo Morales Mazariegos - Aarón Alberto Romero Ruíz Alonso Tonalmitzin Yáñez Álvarez RESUMEN Actualmente, en el sistema lagunar de Sontecomapan existe una probable alteración en algunos aspectos estructurales y funcionales de la comunidad ictiofaunística, causada por alteraciones ambientales del sistema ecológico. Por lo que el objetivo del presente estudio fue analizar aspectos estructurales y funcionales de la comunidad ictiofaunística en la Laguna de Sontecomapan, Veracruz y su relación con la dinámica ambiental del sistema lagunar. Se realizaron 10 muestreos de ictiofauna en los días 16 y 17 de octubre del 2018 a lo largo de toda la laguna. El primer día el muestreo se realizó bajo condiciones normales y el segundo día bajo condiciones de norte intenso, por lo que lo obtenido en ambos días de muestreo fue distinto. La composición íctica estuvo integrada por 17 familias, 21 géneros y 29 especies. El segundo día presentó una mayor diversidad (H’=1.9509) en comparación al primer día (H’=1.36). Por otra parte, el primer día presentó una equitatividad menor (J’=0.46) que el segundo día (J’=0.6139). El segundo día también fue superior en biomasa (0.3752 g/m2) y peso promedio (13.42 g/Ind) que el primero. Sin embargo, el primer día presentó una mayor densidad (0.0395 Ind/m2) que el segundo día (0.0280 Ind/m2). Mediante un ACC, se encontró una alta correlación de los parámetros fisicoquímicos con respecto a las especies registradas, cuya distribución varió en ambos días de muestreo por la alteración de los parámetros fisicoquímicos. En conclusión, se registraron aumentos en los parámetros estructurales de la comunidad entre ambos días, debido a la presencia del norte y una alteración en las categorías tróficas. Así mismo, en comparación con otros estudios se observó que existe una tendencia a la degradación de la comunidad ictiofaunística dentro de la laguna. Palabras clave: Ictiofauna, Variables fisicoquímicas, Sontecomapan, Alteración, Parámetros comunitarios. ABSTRACT Currently, in the Sontecomapan Lagoon system there is a probable alteration in some structural and functional aspects of the ichthyofaunal community, caused by environmental alterations of the ecological system. Therefore, the objective of this study was to analyze structural and functional aspects of the ichthyofaunal community in the Sontecomapan Lagoon, Veracruz, and its relationship with the environmental dynamics of the lagoon system. 10 samplings of ichthyofauna were carried out on October 16th and 17th in 2018, throughout the entire lagoon. On the first day, the sampling was carried out under normal conditions and the second day under intense northern conditions, so what was obtained on both days of sampling was different. The fish composition was composed of 17 families, 21 genres and 29 species. The second day presented a greater diversity (H '= 1.9509) compared to the first day (H' = 1.36). On the other hand, the first day showed a lower evenness (J '= 0.46) than the second day (J' = 0.6139). The second day was also higher in biomass (0.3752 g / m2) and average weight (13.42 g / Ind) than the first. However, the first day presented a higher density (0.0395 Ind / m2) than the second (0.0280 Ind / m2). Through an ACC, a high correlation of physicochemical parameters was found related with the registered species, whose distribution varied on both sampling days due to the alteration of the physicochemical parameters. As a conclusion, there were increases in the structural parameters of the community between both days, due to the presence of the north and an alteration in the trophic categories. Likewise, in comparison with other studies, it was observed that there’s a tendency towards the degradation of the ichthyofaunal community within the lagoon. Key words: Ichthyofauna, Physicochemicals Variables, Sontecomapan, Alteration, Community Parameters. INTRODUCCIÓN Una comunidad ecológica se define como una asociación de poblaciones de diferentes especies que viven e interaccionan, directa o indirectamente, en el mismo espacio y tiempo (Solomon et al., 2005; Smith & Smith, 2007; Miller & Spoolman, 2009). Usualmente, sólo se estudian las comunidades a manera de subsistemas de especies, como comunidades de plantas, aves o peces, debido a la similitud de respuestas ante cambios en el ambiente en el que habitan (Smith & Smith, 2007; Morín, 2011). Las comunidades se encuentran estructuradas por la mezcla de las especies que las componen, así como la abundancia relativa de las especies (Smith & Smith, 2007). Una medida conveniente para describir a una comunidad estructuralmente es la riqueza de especies, que es el recuento del número de especies que existen dentro de la comunidad (Solomon et al., 2005; Smith & Smith, 2007; Morín, 2011). El conocimiento del número de especies en una comunidad, sin embargo, no es suficiente para describir su estructura, ya que no todas las especies son igualmente abundantes. Debido a esto, es necesario conocer el número de individuos pertenecientes a cada especie conocida en la comunidad, y relacionarlo con el total de individuos de un muestreo dado, que es conocido como abundancia relativa (Smith & Smith, 2007). Dicha abundancia, además puede variar de lugar a lugar, debido a que las poblaciones que componen a la comunidad no son componentes estáticos, lo que es conocido como la distribución de especies (Begon et al., 2006). Una medición común calculada para las comunidades es la diversidad de especies, que es una medida de la importancia relativa de cada especie en una comunidad, basada en su abundancia relativa (Solomon et al., 2005; Smith & Smith, 2007). Más precisamente, la diversidad local en un determinado tipo de hábitat (como, por ejemplo, una laguna) es conocida como diversidad alfa (Morín, 2011). Dicha medida, sin embargo, no sirve para describir satisfactoriamente la estructura de una comunidad, por lo que, además de la riqueza de especies, se necesita conocer la equitatividad de especies. Ésta es la medida numérica que indica el grado de distribución de individuos que están distribuidos entre las especies de la comunidad (Morín, 2011). Es así que, una comunidad que no presente una equitatividad de especies, seguramente presentará especies dominantes, las cuales afectan en gran medida la dinámica de una comunidad debido a que son muy comunes u ocupan una gran porción de la biomasa total, comúnmente, como resultado de una competencia con el resto de las especies de la comunidad (Solomon et al., 2005; Smith & Smith, 2007; Morín, 2011). Las funciones que se llevan a cabo en y por las comunidades son diversas, desde la producción primaria, redes tróficas, resistencia a alteraciones ambientales o invasiones y degradación del detritus, por mencionar algunas (Morín, 2011). Dichas funciones dependen directamente de la estructura de la comunidad, además de que representan un foco de interés mayor para el estudio de las comunidades ecológicas (Begon et al., 2006; Morín, 2011). Las interacciones interespecíficas, ya sean positivas, negativas o neutras, determinan los flujos de materia y energía que se distribuyen en la comunidad, conocidos como redes tróficas (Smith & Smith, 2007). Por otro lado, los niveles o categorías tróficas, representan los grupos de especies de una comunidad que adquieren energía de manera similar: productores primarios, herbívoros, carnívoros y descomponedores (Morín, 2011). Ambos conceptos son abstracciones utilizadas comúnmente para describir los hábitos alimenticios y relaciones interespecíficas en la comunidad. Sin embargo, las poblaciones de especies de la comunidad tienden a cambiar su dinámica al mismo tiempo que lo hacen importantes gradientes ambientales, en especial si las interacciones entre las especies son fuertes (Smith & Smith, 2007; Morín, 2011). En diversos estudios, por ejemplo, se ha reflejado la influencia de la salinidad, temperatura y transparencia como favorecen o perjudican la estructura de la comunidad de peces (Aguirre-León, et al., 2013; Díaz-Ruíz, et al., 2003). Así mismo, el oxígeno disuelto puede actuar como un parámetro que favorece o limita la presencia de organismos en sistemas costeros (Azevedo, et al., 2007). Como se explicará más adelante, unos de los ecosistemas más dinámicos, productivos y biológicamente ricos, son los costeros, los cuales presentan interacciones complejas entre sus factores biológicos y ambientales, que son de interés científico y económico (Yáñez-Arancibia et al., 2013). En México existen más de 128 ecosistemas costeros, entre los cuales se ubican las lagunas costeras, las cuales son cuerpos de agua semicerrados y situados a lo largo de la línea litoral y por debajo del nivel máximo de las mareas más altas, con el eje mayor paralelo a la línea de costa (Lankford, 1977). La comunicación de dichas lagunas con el mar puede ser permanente o efímera, y son el resultado del encuentro de dos masas de agua: uno o más ríos y el mar (Lankford, 1977). Algunas de las características generales de las lagunas costeras son: I) son altamente productivas, es decir, presentan una alta tasa de productividad primaria y secundaria; II) son ecológicamente complejas, ya que poseen una alta diversidad de especies, así como una diversidad significativa en sus variables ambientales, una trama trófica altamente conectada y conexiones muy marcada con ecosistemas vecinos; lll) son ecológicamente estables, es decir, que tienen una gran capacidad para tolerar diversos tipos de perturbaciones (Yáñez-Arancibia, 1986). Lo mencionado anteriormente, indica que las lagunas costeras son ecosistema de gran importancia, tanto para el beneficio de las sociedades humanas, como para la vida silvestre. En ellas se pescan distintos tipos de organismos, como: ostras, peces óseos y camarones, por lo que son de gran importancia económica. Por otra parte, las aves migratorias utilizan estos ecosistemas de forma extensiva, ya que pasan la mayor parte del año en ellos. También son santuarios para especies en peligro de extinción, como cocodrilos, aves y manatíes (YáñezArancibia, 1986). A pesar de ser de gran importancia económica y ecológica, las lagunas costeras enfrentan distintas amenazas, tales como el azolvamiento, cambios en el patrón hidrológico, la hipersalinidad, la erosión de playas, la eutrofización y contaminación con agroquímicos. Esta última se da por desarrollos urbanos desmedidos, ampliaciones en las fronteras agropecuarias y la tala inmoderada (Sánchez et al., 2007). La comunidad de peces es de gran importancia en los sistemas costeros, ya que funcionan como transformadores de energía a través de complejas interacciones entre ellos y con diferentes hábitats (Karr, 1991). Hay especies muy susceptibles a los cambios, lo que indicaría una alteración en el ecosistema. Por otra parte, hay especies que son más resistentes, por lo que en ambientes muy degradados estas serán las predominantes (Palacio-Núñez, 2007). Lo anteriormente mencionado propicia a la utilización de la ictiofauna como un indicador de la salud de los sistemas lagunares, tanto en ambientes dulceacuícolas como los estuarios (Karr, 1991). Actualmente, en el sistema lagunar de Sontecomapan existe una probable alteración en algunos aspectos estructurales y funcionales de la comunidad ictiofaunística, causada por alteraciones ambientales del sistema ecológico (González-Larraza et al., 2016). Sin embargo, son pocos los estudios que han sido realizados sobre la ictiofauna de la laguna de Sontecomapan, y dichos estudios han abordado aspectos de caracterización y listados de especies de la comunidad (Fuentes-Mata et al., 1989; Hernández-Nava, 2005; Rodríguez-Varela et al., 2010). Además, sólo existen dos estudios que han trabajado con aspectos sobre las funciones de la comunidad y su relación con gradientes ambientales (Alarcón-Sosa, 2007; Guillén-Castrillo, 2016), por lo que el presente trabajo pretende actualizar dichas áreas de conocimiento, así como realizar un diagnóstico de la estructura y función de la comunidad ictiofaunística en la laguna de Sontecomapan, Veracruz. Esto debido a que los aspectos estructurales (diversidad, abundancia, dominancia y riqueza) y funcionales de una comunidad son importantes para el mantenimiento de la integridad de la comunidad (Elton, 1958; McCann, 2000; Tilman et al., 2006), y en un sentido holístico, compromete la estabilidad del ecosistema lagunar de Sontecomapan (Briceño, 2015). Es por lo anterior que, para el presente estudio, se utilizarán los siguientes enfoques para delimitar la comunidad ictiofaunística de la laguna de Sontecomapan: (I) la Definición Física de una Comunidad, que incluye el ensamblaje de las especies encontradas en un hábitat determinado; (II) la Definición Taxonómica de una Comunidad, reconocida por la presencia de una o más especies conspicuas, que dominan ya sea por su biomasa o contribuyen de forma importante a los atributos físicos de la comunidad; (III) la Definición Estadística de una Comunidad, que consiste en grupos de especies cuyas abundancias se encuentran significativamente correlacionadas, positiva o negativamente, a través del tiempo o espacio (Morín, 2011). ANTECEDENTES Alarcón-Sosa (2007) realizó un estudio en la Laguna de Sontecomapan, Veracruz donde determinó los tipos alimentarios y el espectro trófico, así como la estructura trófica de la ictiofauna. En el estudio se identificaron un total de 37 especies, de las cuales 6 pertenecían a las consumidoras primarias, 19 a las consumidoras secundarias y 10 a las terciarias. Además, encontró que la comunidad se encontraba principalmente compuesta por elementos eurihalinos del componente marino, especies más especialistas que generalistas y, una estructura trófica soportada por el zooplancton y detritus. Posteriormente, Guillen-Castrillo (2016) realizó un análisis de la variación espaciotemporal de la comunidad de peces y su relación con los parámetros físico-químicos del sistema lagunar Sontecomapan en Veracruz. Se identificaron un total de 17 familias y 33 especies, 7 de las cuales fueron nuevos registros para la laguna. Los índices de diversidad obtenidos fluctuaron de la siguiente manera: H’= 0.2-1.8, D= 0.7-2.3, J’= 0.1-1.0, disminuyendo de la boca a la cabecera del sistema. En cuanto a la abundancia relativa a densidad, biomasa y el peso promedio, los valores fluctuaron en rangos de 0.001-0.275 ind/m2, 0.020-0.511 g/m2 y 2.0-83.0 g/ind en el sistema lagunar. Además, se identificaron dos especies dominantes, Diapterus rhombeus (IVI=135.8%) en relación al número de capturas y Catharops aguadulce (IVI=84.6%) en relación al peso total. Por otro lado, el Análisis de Correspondencia Canónica realizado demostró que los cambios de pH (r=0.72), oxígeno disuelto (r=0.68), profundidad (r=0.66), salinidad (r=0.54), transparencia (r=0.49) y temperatura (r=-0.23) fueron los factores ambientales que más determinaron la composición y distribución de los peces en la comunidad. El mismo estudio además analizó las categorías tróficas de las especies de peces, las cuales se distribuyeron en 12 especies pertenecientes al primer orden de consumidores, 11 del segundo y 10 del tercer orden, mientras que las categorías ecológicas de las especies se distribuyeron en 26 especies habitantes eurihalinas del componente marino, 4 especies estenohalinas del componente marino y 3 habitantes permanentes del cuerpo estuarino-lagunar. Aguirre-León (2013) realizó un análisis de la variación espacial y temporal de la diversidad, abundancia, y asociaciones de la comunidad de peces y su relación con los parámetros físicoquímicos del sistema lagunar Chica-Grande en Veracruz. La abundancia de los peces no reflejó cambios marcados en el gradiente, no obstante, fue mayor en el hábitat más dulce. Durante los meses de “nortes” (noviembre-febrero) la diversidad (H’=2.05) y riqueza de especies (D=2.99) fue más alta, mientras que la densidad y biomasa fue mayor (0.034 ind /m2, 1.42g/m2) durante los meses de lluvias (Julio-octubre). El Índice de Valor de Importancia (IVI) definió 6 especies dominantes que representan el 77.8% de la abundancia numérica y el 87.9% de la captura total en peso. En este estudio, los gradientes espaciales de las variables ambientales permitieron explicar los cambios en la composición y abundancia de las especies, mientras que los temporales, la estructura comunitaria y su relación con los patrones estacionales de utilización de hábitats por las especies durante sus ciclos de vida. Un estudio similar sobre comunidades de ictiofauna fue el realizado por Yáñez-Arancibia y LaraDomínguez (1982), quienes en un estudio de un ciclo anual determinaron que la Boca de Estero Pargo es un área de crianza, reproducción y alimentación, donde además se registraron un total de 30 familias, y 77 especies a lo largo de 90 colectas con red de arrastre. La salinidad fluctuó en el 95% de las mediciones de 20.61 a 28.41 ppm, mientras que la temperatura tuvo poca fluctuación (27.4 a 29.64°C). Así mismo, se relacionaron las variaciones de la diversidad, biomasa, frecuencia y abundancia numérica con los cambios de salinidad, temperatura y periodos de luz. Del total de las especies más del 36% se identificaron como consumidores de segundo orden, considerándolos como los más importantes para determinar características particulares de la comunidad de peces, el 18% correspondió a consumidores de primer orden y 36% fueron identificados como consumidores de tercer orden. Explica que las categorías ictiotróficas fluctúan a lo largo del año en abundancia numérica. Por otro lado, el 20% del total de especies se identificaron como residentes permanentes, 23% fueron visitantes cíclicos (también referidos como eurihalinos) y 57% fueron identificados como visitantes ocasionales (estenohalinos). Álvarez-Rubio et al. (1984), en un trabajo sobre la ecología y estructura de las comunidades de peces en un sistema lagunar de Nayarit, registró un total de 28 familias y 76 especies de peces capturadas en 124 colectas. En el estudio se encontró que el índice H’n (1.3 a 2.8) fluctúa dependiendo de la selectividad del arte de pesca, la localidad, sus gradientes ambientales y la época del año. Por otro lado, reportó una dominancia en la comunidad por parte de los consumidores del segundo orden. Así mismo, las especies cíclicas o estacionales (también indicadas como eurihalinas) fueron las más abundantes en comparación a las residentes permanentes. Además, indica que la boca y la laguna en sí misma son claramente un puente ecológico con el mar, por lo que dicha heterogeneidad ambiental es el reflejo de las variables físicas, por lo que, en consecuencia, las comunidades de peces están altamente correlacionadas con asociaciones de poblaciones específicas para cada uno de los hábitats. En un estudio realizado por Ramírez-Villarroel, (1994) en una laguna de Venezuela, donde se analizó la estructura de la comunidad de peces, se identificaron 30 familias y 62 especies. La riqueza obtenida a lo largo del estudio, fluctuó de 3.45 a 4.29, la equitatividad de 0.48 a 0.74 y la dominancia de 42.25 a 80.61%, en donde las especies dominantes identificadas fueron Eucinostomus gula, Diapterus rhombeus, Anchoa hepsetus, Archosargus rhomboidalis, Arius herzbergii y Xenomelaniris brasilensis. Las categorías tróficas más frecuentes que se identificaron fueron las de primer (40.32%) y segundo orden (40.32%), seguidas por las del tercer orden (19.36%). Dichos resultados se explican debido al comportamiento de las especies, el lugar de muestreo y el arte de pesca utilizado. Los individuos visitantes ocasionales (o estenohalinos) (41.94%) resultaron ser los más frecuentes, debido a que eran los predominantes en la boca, lugar donde se ejerció más esfuerzo de captura, seguidos por los visitantes cíclicos (o eurihalinos) (30.65%) y en última instancia los residentes permanentes (27.42%). Dicho bajo porcentaje en los residentes permanentes lo explicó debido a la inestabilidad ambiental del área. Arceo-Carranza et al. (2010) evaluó la abundancia y recambio de las especies ícticas que habitan en la laguna de Celestún. Para ello realizaron 6 muestreos bimestrales en una red de 4 estaciones; 2 localizadas en la boca y 2 en la zona interna de la laguna. La tasa de recambio de especies es baja entre hábitats y entre ciclos de luz-oscuridad. Los ensamblajes de peces entre hábitats son más dinámicos que nictimeralmente, debido a que las praderas de vegetación sumergida soportan un mayor número de especies por su función en la alimentación y/o como protección. PREGUNTAS DE INVESTIGACIÓN ● ¿Cómo está estructurada la comunidad ictiofaunística de la laguna de Sontecomapan? ● ¿Cuáles son las categorías tróficas y ecológicas en la comunidad ictiofaunística de la laguna de Sontecomapan? ● ¿Qué variables ambientales determinan las variaciones en la estructura y función de la comunidad de peces en la laguna de Sontecomapan? ● ¿Existen evidencias de posibles alteraciones en la dinámica ecológica de la comunidad ictiofaunística en la zona de estudio? ● ¿Cómo se comporta la comunidad ictiofaunística durante un evento de norte intenso local? HIPÓTESIS Si existe una alteración en la estructura y función de la comunidad de peces, ocasionada por cambios en el comportamiento de las variables ambientales, entonces se verá reflejada en los patrones de distribución, diversidad, abundancia y, en la composición de las categorías tróficas y ecológicas de la ictiofauna. OBJETIVO GENERAL Analizar aspectos estructurales y funcionales de la comunidad ictiofaunística en la laguna de Sontecomapan, Veracruz y su relación con la dinámica ambiental del sistema lagunar. OBJETIVOS ESPECIFICOS 1. Determinar la composición de especies en la comunidad ictiofaunística de la laguna. 2. Determinar la diversidad, riqueza, equitatividad y especies dominantes. 3. Analizar la distribución, biomasa, densidades y pesos promedio de las especies. 4. Identificar las categorías tróficas y ecológicas de la comunidad ictiofaunística. 5. Determinar la relación de las variables ambientales con los atributos estructurales y funcionales de la comunidad. 6. Analizar si el comportamiento de la comunidad ictiológica se encuentra alterado en un sentido histórico y en comparación a ecosistemas similares. 7. Determinar las causas ecológicas que explican la existencia de alteraciones en la estructura y función de la comunidad de peces en el sistema lagunar, así como las consecuencias ecológicas que se producirían en caso de no atender a dichas alteraciones. ÁREA DE ESTUDIO La laguna de Sontecomapan, pertenece a la región de Los Tuxtlas en la Llanura Costera del Golfo de México, dentro del estado de Veracruz, en las coordenadas 18º 30' y 18° 30’ latitud norte, 95º 00' y 95° 04’ longitud oeste (Contreras-Espinosa y Castañeda, 1993), a 20 km al Noreste de la ciudad de Catemaco, Municipio de Catemaco (INEGI, 2001) (Fig. 1). El sistema lagunar es poco profundo con sedimentos que van desde las arenas hasta los limos (Guillén-Castrillo, 2016). Los sedimentos más abundantes en la llanura costera son pliopleistocénicos, constituidos por piroclásticos (materiales fragmentados emitidos por una erupción volcánica en forma sólida o líquida) derivados del área volcánica de Los Tuxtlas (Gómez-Marín, 2003). La laguna mide aproximadamente 12 km de largo y 1.5 km de ancho, y está ubicada en la cuenca que forman el volcán San Martín y Sierra Santa Marta. El sistema lagunar está dividido en varias zonas: La barra y boca de la laguna, que comprende a la playa “Roca Morro” (referida en este trabajo como “estación 1” de muestreo); el canal “El Real” (estación 3), que abarca el arroyo el “Remolino” (estación 2) y la zona del río de las “Palmas” (estación 4) y termina en un canal que se abre y conforma mayoritariamente la laguna (estación 5 “Las cañas” y estación 7 “Punta levisa”), alimentada a su vez por el arroyo los Pollos y el Sumidero, y los ríos Sábalo (estación 6), Yahualtajapan, Coxcoapan, Basura (estación 8) y del Fraile (estación 9) . El sistema lagunar termina a un lado del poblado de Sontecomapan, donde se encuentra el embarcadero y el río Chuniapan (estación 10), que desemboca a un costado del poblado (Fig. 1). Estos ríos conservan algunos bosques de ribera, selva y tulares inundables y algo de selva alta perennifolia (GómezMarín, 2003). Figura 1. Mapa del área de estudio y ubicación de las estaciones de muestreo. Climatología El clima es cálido con una temperatura anual aproximadamente de 22°C, con lluvias de verano e influencia de monzón y un 5-12% de lluvia invernal (enero a marzo). La precipitación está muy influida por vientos húmedos provenientes del Golfo de México y elevada por esta zona orientada al mar. La precipitación anual total se encuentra entre los 3000 a 4000 mm en promedio (LaraDomínguez et al., 2009). Febrero y marzo son los meses más secos y septiembre el más lluvioso con 600 mm (Gómez-Marín, 2003). Los vientos que predominan son los del norte, por la posición de la Sierra respecto a los vientos del Golfo de México. En la zona cruzan tres principales trayectorias de vientos: los provenientes del norte, del este y del sur y en menor medida, del noreste y sureste (Gómez-Marín, 2003). Edafología La edafología encontrada en la zona de Los Tuxtlas está ligada a las condiciones ecogeográficas que se establecen allí y proceden de la alteración de materiales expulsados por los tres volcanes principales (Gómez-Marín, 2003). Aunque existen pocos estudios en el área acerca de los tipos de suelo presentes, se reconocen 9 grandes grupos principales dentro de la Reserva: Andosol, Feozem, Luvisol, Acrisol, Vertisol, Cambisol, Nitosol, Regosol y Litosol que van desde aquellos suelos considerados como jóvenes o de reciente formación, constituidos por una capa delgada, hasta aquellos muy profundos, fértiles, con abundancia de materia orgánica y ácidos (GómezMarín, 2003). Vegetación La vegetación característica de la laguna se destaca por el manglar entremezclado con epifitas, dentro de las especies principales se encuentran: Rhizophora mangle, Avicennia germinans, Acrostichum aureum, Equites umbrellata, Macfadyena uncata y Adenocalymma sausae (GómezMarín, 2003). En zonas inundables de agua salobre al noreste de la laguna de Sontecomapan se encuentra la selva baja perennifolia inundable y presenta un alto grado de modificación, esta comunidad es muy importante para proteger la dinámica de la laguna y mantener el hábitat de alimentación y proteger el ecosistema de desove de las especies marinas (Gómez-Marín, 2003). Fauna Dentro de la fauna que vive, reproduce o refugia en el sistema lagunar se encuentra la lisa (Mugil cephalus, M. trichodon), la lebrancha (Mugil curema), la mojarra (Cichlasoma fenestratum), el róbalo (Centropomus sp), el pargo (Lutjanus sp), la zorra, el roncador, el jurel y chucumite. También se pescan las jaibas azul y prieta (Callinectes sapidus, C. rathbunae), el camarón blanco (Macrobrachium sp) y el langostino (Macrobrachium carcinus). El cangrejo azul (Cardisoma guanhumi) y el ostión son otras especies de importancia comercial con propuestas de vedas para su recuperación (Guillén-Castrillo, 2003; Programa de Conservación y Manejo Los Tuxtlas, 2006). MATERIALES Y MÉTODOS Trabajo de campo Se realizaron muestreos en dos días con marcadas diferencias climatológicas. En el primer día (16 de octubre 2018) se tomaron muestras en condiciones normales, mientras que en el segundo día (17 de octubre 2018), el muestreo se realizó bajo condiciones de norte intenso. Los muestreos consistieron en arrastres de 10 minutos con una red conocida como “Chango” de 5 m de largo, 2.5 m de abertura de trabajo y una luz de malla de 1.8 cm, equipada con tablas de 0.5 x 0.8 m (Aguirre-León, 1998). Se realizaron 10 arrastres en total, uno por cada estación de muestreo. En caso de ser necesario, se realizaron réplicas de 5 minutos de arrastre. Las muestras capturadas recibieron un tratamiento anestésico con una solución de esencia de clavo y, posteriormente, se procesaron in situ, colocando cada colecta por estación en solución de formol diluido con agua contenida en bolsas de plástico marcadas, para así ser trasladadas al laboratorio. Para la relación de la comunidad con las variables ambientales se utilizaron los datos de Reséndiz y Hernández (S/P), quienes realizaron un muestreo en la laguna en los mismos días y condiciones en que el presente estudio fue desarrollado, obteniendo parámetros físico-químicos del cuerpo de agua a 2 niveles, en el fondo y superficie, así como temperatura ambiental y tipo de sedimentos. Identificación y composición de especies Las muestras de ictiofauna conservadas en la solución de formol fueron lavadas y se les dejó remojar durante 24 h. Posterior a dicho lapso de tiempo, se realizó un análisis de cada uno de los individuos para su identificación, conteo de individuos y registro de peso correspondiente. Para la identificación de las especies de ictiofauna se hizo uso de las guías taxonómicas de Campillo-Sainz, et al. (1976), Fischer (1978), Reséndiz-Medina (1981), Castro-Aguirre, et al. (1999) y, Froese y Pauly (2018). Para el caso de los pesos de la ictiofauna, se hizo una sumatoria de los mismos por especie en cada estación, y su resultado se registró. Diversidad de especies El índice Shannon-Wiener (H’), relaciona el número de especies con la proporción de individuos pertenecientes a cada una de ellas presente en la muestra. De igual manera, expresa la uniformidad de los valores de importancia a través de todas las especies de la muestra, donde los valores van de 1.5 a 3.5. A mayor valor de H’ mayor diversidad de especies (Moreno, 2001). 𝑆 ′ 𝐻 = ∑ 𝑃𝑖 𝐿𝑛(𝑃𝑖) 𝑖=1 Riqueza de especie Se calculó mediante el índice de Margalef (DMG), el cual se basa en la relación del número de especies y el número total de individuos o la cantidad de especies por área en una muestra, donde los valores inferiores a 2 son indicativos de baja riqueza de especies y los valores superiores a 5 son indicativos de alta biodiversidad (Moreno, 2001; Campo y Duval, 2014). 𝐷𝑀𝑔 = 𝑆−1 ln(𝑁) Equitatividad La equitatividad de Pielou (J’), se expresa como el grado de uniformidad en la distribución de individuos entre especies. Se mide comparando la diversidad observada en una comunidad contra la diversidad máxima posible de una comunidad hipotética con el mismo número de especies (Moreno, 2001). Valores cercanos a 1 representan condiciones hacia especies igualmente distribuidas y aquellos cercanos a 0 la dominancia de una sola especie (Zarco et al., 2010). 𝐽′ = 𝐻 ′ 𝑜𝑏𝑠 𝐻 ′ 𝑀𝑎𝑥 Dominancia La dominancia de especies se calculó con el índice de valor de importancia (IVI%), como la suma del porcentaje en número, peso y la frecuencia de aparición de las especies en la comunidad, siendo la fórmula: IVI%= N%+P%+F% (De la Cruz-Agüero, 1994) Análisis de distribución de especies Para el análisis de distribución de especies se realizó un mapa del área de estudio por día, en el que se incluyeron las distintas estaciones de muestreo junto con las especies que se presentaron en ellas. Dichos mapas se realizaron con una escala de 1:40,000, ésto con el fin de abarcar cada una de las estaciones de muestreo en un solo mapa. Determinación de abundancias relativas (biomasa, densidades y peso promedio) Para la determinación de biomasa se dividió el peso total entre el área muestreada (g/m 2), esto para cada una de las estaciones de muestreo. Por otra parte, para la obtención de las densidades se realizó igualmente una división del número total de individuos por estación entre el total del área muestreada (Ind/m2) (Krebs, 2009). Así mismo, se realizó una división del peso total entre el número de individuos para determinar el peso promedio en cada estación (Aguirre- León, 1998). Categorías Tróficas y Ecológicas Para la identificación de los niveles tróficos presentes en la comunidad de ictiofauna se emplearon las definiciones y clasificación de Yáñez-Arancibia (1976 y 1986), quien describió las siguientes categorías: Consumidores de primer orden, que incluye a los hervíboros exclusivos, detritívoros y omnívoros; Consumidores de segundo orden, que incluye a los organismos que consumen principalmente animales del primer grupo, así como pequeñas cantidades de detritus y restos vegetales; Consumidores de tercer orden, los cuales son exclusivamente carnívoros y se alimentan de la fauna de los grupos anteriores. Por otro lado, se distinguieron las categorías ecológicas de las especies de peces identificadas de la siguiente manera: Especies habitantes temporales del componente estuarino-lagunar (1A o HTCEL), habitantes permanentes del componente estuarino-lagunar (1B o HPCEL), especies eurihalinas del componente marino (2A o EM), especies estenohalinas del componente marino (2B o ESM), especies catádromas (3A o CAT) y especies anádromas (3B o ANA). Para lo anterior, se utilizó la clasificación de peces marinos que penetran en aguas continentales propuesta por Yañez-Arancibia (1976) y Castro-Aguirre et al. (1999), que está basada en la tolerancia a los cambios de salinidad de las especies. Análisis de Correlación Canónica (ACC) El ACC, es un método que permite analizar simultáneamente un grupo de frecuencias (conteos, respuestas binarias o porcentajes) y un grupo de variables (cuantitativas, cualitativas o ambas) sobre el mismo conjunto de individuos (Vertel, 2010). Para analizar la relación entre la comunidad de peces y las variables ambientales, se realizó un análisis de correlación canónica con el propósito de identificar la dimensionalidad de cada conjunto de variables, utilizando para ésto el paquete estadístico Multivariate Statistical Package (MVSP), versión 3.22. Es así que, se elaboraron 2 matrices de especies distribuídas en cada estación por día, así como 2 matrices de las variables ambientales de cada estación por día. Los datos fueron normalizados para obtener unidades equivalentes en ambas matrices antes de ingresarlos al programa. Árbol de Causas-Efectos Se utilizó la herramienta del árbol de problemas (Martínez y Fernández, 2008) para clasificar las causas de una posible alteración en algunos aspectos estructurales y funcionales de la comunidad ictiofaunística de Sontecomapan, Veracruz y las respectivas consecuencias que pueden llegar a presentarse. RESULTADOS Composición de especies El total de individuos capturados en la laguna fue de 1645, con un peso total de 17451.29 g. En el primer día de muestreo hubo un mayor número de individuos encontrados (1037), así como mayor peso total (9290.06 g), en comparación con el segundo día, donde el número de individuos disminuyó a 608 y el peso total a 8161.23 g. El total de familias fue de 17, dentro de las más representativas, en términos de número de especies, son: Gerreidae, Centropomidae y Lutjanidae (Fig.2). Figura 2. Números de especies por cada familia registrada en la comunidad ictiofaunística de la laguna de Sontecomapan. Se registraron un total de 21 géneros y 29 especies al final del estudio (Cuadro 1). Sin embargo, se encontraron especies diferentes entre el primer (16 de octubre 2018) y segundo día de muestreo (17 de octubre 2018), las cuales fueron: Anchoa hepsetus, Anchoa mitchilli, Hemicaranx amblyrhynchus, Lutjanus synagris y Opsanus beta, las cuales sólo se presentaron en el primer día; Centropomus ensiferus, Dasyatis sabina, Dormitator maculatus, Eucinostomus gula, Eucinostomus melanopterus, Gobiomorus dormitor, Lutjanus analis, Pomadasys ramosus y Strongylura notata, además de un individuo de la familia Pleuronectidae, presente únicamente en el segundo día. Por otro lado, las especies que se encontraron en ambos días fueron: D. rhombeus, C. aguadulce, E. plumieri, Lutjanus griseus, Diapterus auratus, Achirus lineatus, Ariopsis felis, Caranx crysos, Centropomus parallelus, Centropomus undecimalis, Citharichthys spilopterusEucinostomus argenteus, Gobionellus oceanicus, Lutjanus griseus y Polydactylus octonemus. Cuadro 1. Listado de especies identificadas y sus resultados generales del análisis ecológico Especie Abv No. Peso Ind No. H'n Apar Abund Peso Frec Rel (%) Rel (%) (%) IVI (%) CE CT Achirus lineatus Al 16 117.03 5 0.045 0.973 0.671 50 6.745 EM 2 Anchoa hepsetus Ah 1 4.75 1 0.005 0.061 0.027 10 1.108 EM 1 Anchoa mitchilli Am 4 1.86 3 0.015 0.243 0.011 30 3.315 EM 1 Ariopsis felis Af 26 239.60 6 0.066 1.581 1.373 60 9.076 EM 2 Caranx crysos Cc 12 122.60 5 0.036 0.729 0.703 50 6.534 ESM 2 Cathorops Ca 210 5372.32 8 0.263 12.766 30.785 80 51.714 HPCEL 2 Ce 4 70.70 2 0.015 0.243 0.405 20 2.689 EM 3 Cp 2 69.50 2 0.008 0.122 0.398 20 2.561 EM 3 aguadulce Centropomus ensiferus Centropomus parallelus Centropomus Cu 7 508.00 5 0.023 0.426 2.911 50 8.439 EM 3 Cs 19 191.05 5 0.052 1.155 1.095 50 7.352 EM 3 Dasyatis sabina Ds 1 113.00 1 0.005 0.061 0.648 10 1.729 HPCEL 3 Diapterus auratus Da 332 2384.22 7 0.323 20.182 13.662 70 40.987 EM 1 Diapterus Dr 798 4127.40 8 0.351 48.511 23.651 80 80.325 EM 1 Dm 3 19.23 1 0.012 0.182 0.110 10 1.313 HPCEL 1 Ea 23 149.48 4 0.060 1.398 0.857 40 6.336 EM 1 Eucinostomus gula Eg 4 28.90 1 0.015 0.243 0.166 10 1.429 EM 1 Eucinostomus Em 14 85.19 5 0.041 0.851 0.488 50 6.441 EM 1 Eugerres plumieri Ep 139 2349.63 8 0.209 8.450 13.464 80 30.077 EM 1 Gobiomorus Gd 1 20.80 1 0.005 0.061 0.119 10 1.200 EM 3 Go 6 74.32 1 0.020 0.365 0.426 10 1.811 EM 1 Ha 2 16.18 1 0.008 0.122 0.093 10 1.235 ESM 2 Lutjanus analis La 3 56.62 3 0.012 0.182 0.324 30 3.568 EM 3 Lutjanus griseus Lg 11 844.97 8 0.033 0.669 4.842 80 13.674 EM 3 Lutjanus synagris Ls 1 45.80 1 0.005 0.061 0.262 10 1.344 ESM 3 Opsanus beta Ob 1 152.25 1 0.005 0.061 0.872 10 1.954 EM 2 Pleuronectidae P 1 5.20 1 0.005 0.061 0.030 10 1.111 - 2 undecimalis Citharichthys spilopterus rhombeus Dormitator maculatus Eucinostomus argenteus melanopterus dormitor Gobionellus oceanicus Hemicaranx amblyrhynchus Polydactylus Po 2 87.54 2 0.008 0.122 0.502 20 2.664 EM 2 Pr 1 124.70 1 0.005 0.061 0.715 10 1.796 EM 2 Sn 1 68.45 1 0.005 0.061 0.392 10 1.473 EM 2 octonemus Pomadasys ramosus Strongylura notata Abreviatura (Abv), Número de Individuos (No. Ind), Número de Apariciones (No. Apar), Abundancia Relativa (Abund Rel), Peso Relativo (Peso Rel) Frecuencia (Frec), Índice de Valor de Importancia (IVI), Categoría Ecológica (CE) [EM = Eurihalina Marina, ESM = Estenohalina Marina, HPCL = Habitante Permanente del Conjunto Estuarino-Lagunar], Categoría Trófica (CT) [1 = Primer Orden, 2 = Segundo Orden y 3 = Tercer Orden] Diversidad El índice de Diversidad de Shannon-Wiener (H’) (Fig. 3) calculado para el primer día (H’=1.36) fue comparativamente más bajo que el segundo día (H’=1.95). Analizando independientemente cada estación del primer día (16 octubre 2018), en las estaciones 1, 2 y 4 la diversidad calculada fue de H’=0, debido a que sólo se capturó una especie o ninguna (en el caso de la estación 1). Por el contrario, las estaciones con mayor diversidad en el mismo día fueron la 10 y 7, con valores de H’=1.67 y H’=1.27, respectivamente. En el segundo día de muestreo (17 octubre 2018), las estaciones 1 y 2, que en el día anterior tuvieron la una diversidad igual a 0, presentaron valores superiores, aunque aún bajos (H’=0.35 y H’=0.69, respectivamente), resaltando aquel de la estación 4 (H’=1.34). Así mismo las estaciones con valores más altos de diversidad en el segundo día fueron la 3 (H’= 1.83) y la 7 (H’= 2.1). Figura 3. Comportamiento de la diversidad (H’) por estación en los días de muestreo. Riqueza El índice de riqueza de especies de Margalef (DMG) calculado en el presente estudio (Fig. 4) resultó menor el primer día (16 octubre 2018) de muestreo (DMg=2.59) en comparación con el segundo día (17 octubre 2018) de muestreo (DMg= 3.58), de forma similar a lo ocurrido con los valores de diversidad. En el primer día de muestreo los valores más bajos en las estaciones 1, 2 y 4 (DMG= 0 en cada una), y las estaciones con valores más altas fueron la estación 3 (DMG= 1.82) y la 10 (DMG= 2.4). En el segundo día las estaciones 9 y 6 tuvieron los valores más bajos de riqueza de especies (DMG= 1.31 y DMG= 1.32 respectivamente), mientras que la estación 3 (DMG= 2.73) y la estación 7 (DMG= 2.53) presentaron los valores más altos, cuya tendencia es similar a la encontrada en la diversidad, donde ambas estaciones fueron las más altas, pero con la diferencia de que en este caso la estación 3 tuvo mayor valor que la 7. Figura 4. Valores de riqueza de especies obtenida en ambos días por estación. Equitatividad La equitatividad, calculada con el índice de Pielou (J’), al igual que ocurrió con los anteriores parámetros de diversidad, resultó ser menor en el primer día (16 octubre 2018) de muestreo (J’=0.46) que en el segundo día (J’=0.61), como se observa en la Figura 5. Analizando a detalle, la equitatividad obtenida en el primer día demostró ser baja en las estaciones 1,2 y 4 con valores de J’=0 cada una, y se registraron los mayores valores de equitatividad en las estaciones 3 (J’=1) y 10 (J’=0.93), indicando así una distribución uniformemente en dichas estaciones. Por otro lado, en el segundo día (17 octubre 2018) se registró una baja equitatividad en las estaciones 1 y 4 (J’=0.5 y J’=0.55, respectivamente), y se encontró que las estaciones con mayor equitatividad fueron la 2 (J’=1), la estación 3 y la 8 (ambas con valores de J’=0.94). Figura 5. Uniformidad de las especies dentro de la comunidad por estación en ambos días. Dominancia El índice de valor de importancia (IVI) calculado para cada especie en este estudio, se utilizó como indicador de dominancia (Fig. 6). Se determinó una especie dominante en el primer día (16 octubre 2018) de muestreo que fue D. rhombeus (IVI=89.3%) el cual representa el 53.3% en abundancia numérica y el 26% en peso, los cuales fueron los valores más altos a comparación del resto de las especies. Para el segundo dia (17 octubre 2018), las especies dominantes fueron D. rhombeus 71.3% y C. aguadulce 66.5%, representando ambas el 58.7% de abundancia numérica y el 58.6% de la captura en peso, predominando D. rhombeus por sobre las demás mostradas en la Figura 6 que son las especies más representativas por su valor IVI. Figura 6. Valores más altos de IVI de las especies que indican las más representativas dentro de la comunidad ictiofaunística. Los valores totales de índices de diversidad obtenidos en la Laguna de Sontecomapan para el presente estudio (Cuadro 2), mostraron una diversidad de especies de H’= 1.65, lo cual indica que la comunidad ictiofaunística de la laguna de Sontecomapan presenta una diversidad relativamente baja. Con respecto a la riqueza de especies total, el valor de DMG= 3.78, indicó una riqueza media con tendencia a ser alta dentro de la comunidad. Por último, la equitatividad total del estudio (J’=0.49) indica que la distribución de las especies en la comunidad muestreada es medianamente equitativa, conservando una dominancia por algunas especies. La tendencia mencionada también es sugerida por el índice de valor de importancia total de entre las especies identificadas en el estudio, donde el valor más alto pertenece a la especie D. rhombeus (IVI=80%), siendo esta la especie con mayor dominancia dentro de la comunidad representando el 48% de la abundancia total, pero con baja representación en peso (23%). La segunda especie con aparente dominancia en el total del estudio fue C. aguadulce, presentando baja abundancia (12%), pero el 30% del peso de toda la comunidad, seguido por D. auratus y finalmente E. plumieri, lo cual indica que estas especies contribuyen mayormente a la estructura de la comunidad en cuestión de peso, como se puede observar en el Cuadro 2. Cuadro 2. Índices de diversidad en la comunidad ictiofaunística de la laguna. Riqueza de especies Índice de Margalef (DMG) 3.78 Diversidad de especies Índice de Shannon-Weiner (H’) 1.65 Equitatividad de especies Valor de importancia Índice de Pielou (J’) IVI de Diapterus rhombeus 0.49 80.0824% Distribución La distribución de especies varió notoriamente entre ambos días de muestreo (Anexo 1-2), como es el caso de L. griseus, especie que tuvo una amplia distribución el primer día (16 octubre 2018), encontrándose en las estaciones 2, 3, 5, 6 y 8 (representando una frecuencia del 50% mostrada en el Cuadro 1). En contraste, para el segundo día (17 octubre 2018) su distribución disminuyó considerablemente, pues no fue encontrada en ninguna de las estaciones antes mencionadas, en su lugar, fue encontrada únicamente en las estaciones de 1, 4 y 10, sugiriendo posibles micro migraciones dentro del cuerpo lagunar. Al igual que L. griseus, otras especies se desplazaron a través de la laguna hacia la boca, tales como: Ariopsis felis, Diapterus rhombeus, Diapterus auratus, Citharichthys spilopterus y Polydactylus octonemus. Por otra parte, Cathorops aguadulce estuvo presente en las estaciones cercanas a la boca el primer día, migrando hacia el interior de la laguna, al igual que Centropomus undecimalis en el segundo día. Algo que cabe resaltar, es que en el primer día no se encontró ninguna especie en la estación 1, estación en la cual, para el segundo día de muestreo se capturaron 2 especies: L. griseus y Lutjanus analis. Biomasa En el primer día (16 octubre 2018), debido a la ausencia de capturas, no se obtuvo biomasa alguna en la estación 1, mientras que las estaciones 2, 3, 4 y 10 la biomasa estimada fue muy baja, siendo la estación 4 la más baja de ellas (0.0320 g/m2). Por otro lado, en las estaciones restantes, la biomasa estimada fue considerable (en todo superior a 0.50 g/m2), resaltando la estación 8 que tuvo el valor de biomasa más alto para el primer día, siendo éste de 1.1207 g/m2 (Fig. 7). Figura 7. Gráfica comparativa de biomasa por estación de ambos días de muestreo. Para el segundo día (17 octubre 2018), a diferencia del día anterior, si se tuvieron valores de biomasa en la estación en todas las estaciones. En dicho día, las estaciones 2 y 8 fueron las que presentaron los valores más bajos de biomasa (0.02 g/m2 y 0.01 g/m2, respectivamente), resaltando el caso de la estación 8, que en el día anterior presentó el valor más elevado de biomasa. Por otra parte, la estación 10 en el segundo día, fue la estación que presentó la biomasa más alta (1.5568 g/m2), contrastando notoriamente con la biomasa estimada en esa estación el primer día (0.0391 g/m2), y además siendo la estación con más biomasa presente de todo el estudio. Densidad Para el primer día, debido nuevamente a la ausencia de capturas, no se obtuvieron valores de densidad en la estación 1. La densidad presentada en las estaciones 2, 3, 4 y 10 fueron las más bajos en este día de muestreo, siendo todas inferiores a 0.01 Ind/m2. Por otra parte, en las estaciones 5, 6, 7, 9 y 10 las densidades se encontraron por encima de 0.04 Ind/m 2, resaltando la estación 10 (0.1142 Ind/m2) con el valor de densidad más alto del primer día (Fig. 8). En el segundo día, las densidades más bajas obtenidas fueron de las estaciones 1, 2, 3 y 8, siendo la estación 2 la que poseía la densidad más baja (0.0009 Ind/m2). Adicionalmente, hubo una aparente disminución en la densidad en todas las estaciones, excepto en las estaciones 4 y 10, siendo esta última la estación con mayor densidad en el segundo día con valores de 0.1140 Ind/m2. Figura 8. Gráfica comparativa de densidades de ambos días de muestreo. Peso promedio Para el primer día, como en el caso de todos los parámetros anteriores de la primera estación, no se tuvieron valores de peso promedio por no haber capturado nada en esa estación. Por otra parte, se presentaron valores significativamente bajos en las estaciones 4, 5, 6, 7, 8 y 9, siendo la estación 7 la que presentó los valores más bajos en peso promedio, siendo estos de 6.70 g/Ind. Por otro lado, las estaciones 2 y 3, presentaron valores muy elevados en contraste con las demás estaciones, siendo el mayor de 101.33 g/Ind, esto correspondiendo a la estación 3. En el segundo día, ocurrió lo contrario, que el día anterior en la estación 1, ya que esta vez sí se presentaron valores de peso promedio en dicha estación, siendo estos los más altos de todas las demás estaciones (56.33 g/Ind). Se puede observar una disminución significativa en el peso promedio para las estaciones 2 y 3, las cuales anteriormente fueron las más altas en el primer día, bajando de 80.10 a 24.11 g/Ind para la estación 2 y de 101.33 a 31.80 g/Ind en la estación 3. Para el caso de todas las demás estaciones, se presentaron fluctuaciones poco significativas (Fig. 9). Figura 9. Gráfica comparativa de pesos promedio de ambos días de muestreo. En general fue el segundo día el que tuvo mayores niveles de biomasa, aunque esto puede deberse a que el tamaño de esfuerzo fue menor en el segundo día (21,750 m2) que en el primero (26,250 m2). Por otra parte, densidad general presente en el primer día de muestreo, fue superior a la del segundo día de muestreo (0.0395 y 0.0280 Ind/m2), esto debido a que en el primer día de muestreo hubo una mayor captura de individuos. Por su parte, el segundo día de muestreo presentó un peso promedio ligeramente superior al del primer día de muestreo, como se observa en el Cuadro 3 (13.42 y 8.96 g/Ind, respectivamente). Cuadro 3. Abundancias relativas a biomasa, densidad y peso promedio, expresadas por día y en el total del estudio Peso Promedio Área Muestreada (g/Ind) (m2) 0.0395 8.96 26,250 0.3752 0.0280 13.42 21,750 0.3753 0.0354 10.61 46,500 Día de Muestreo Biomasa (g/m2) Densidad (Ind/m2) 16 Octubre 2018 0.3539 17 Octubre 2018 TOTAL Categorías tróficas de la comunidad de ictiofauna Analizando las diferencias, de número de especies, en las proporciones de las categorías tróficas entre el primer (16 octubre 2018) y segundo día (17 octubre 2018), en el primer día se presentaron más especies consumidoras del primer y segundo orden (7 y 7, respectivamente), mientras que sólo presentó 5 especies pertenecientes al tercer orden de los consumidores. Por su parte, en el segundo día se presentaron el mismo número de especies para cada uno de las 3 categorías tróficas (8 en cada una), siendo mayor el número de especies identificadas en cada categoría a las obtenidas en el primer día (Fig. 10). Figura 10. Número de especies de cada categoría trófica para ambos días de muestreo La biomasa (vista como porcentaje del total) perteneciente a los consumidores del primer orden fue la más elevada para el primer día (58.07%), en contraste con la perteneciente a los del tercer orden (13.08%) la cual resultó ser la más baja para el mismo día (Fig. 11). Para el segundo día, la biomasa más baja también fue la obtenida de los consumidores de tercer orden (8.64%), mientras que la biomasa de las categorías tróficas de consumidores del primer y segundo orden fue muy similar (46.93% y 44.43%, respectivamente). Lo anterior, demuestra como la biomasa relativa a los consumidores del primer y tercer orden se vio reducida para el segundo día, a la vez que la biomasa de los consumidores del segundo orden se elevó considerablemente para el mismo día. Figura 11. Biomasa calculada en porcentaje correspondiente a cada categoría trófica En la comunidad ictiofaunística de la laguna de Sontecomapan se identificaron un total de 10 especies para cada una de las categorías tróficas de consumidores del primer y segundo orden, mientras que de los consumidores del tercer orden se identificaron un total de 9 especies, como se observa en el Cuadro 1. Por otro lado, las diferencias entre las tres categorías tróficas son menos marcadas al revisar la biomasa representada por cada categoría trófica en el muestreo total realizado, ya que los consumidores del primer orden representan el 52.34% del total de la biomasa, mientras que los del tercer orden representan el 10.80% (Fig. 11). Categorías ecológicas de la comunidad ictiofaunística Analizando las diferencias, de número de especies, en las proporciones de las categorías ecológicas entre el primer y el segundo día, el primero presentó en su mayoría especies EM (15), mientras que sólo se registraron 3 y 1 especie pertenecientes a las categorías de ESM y HPCEL, respectivamente. Por otro lado, en el segundo día se presentaron aún más especies EM (19), además de que el número de especies ESM disminuyó a 1 y el de especies HPCEL aumentó a 3 (Fig. 12). Figura 12. Número de especies de cada categoría ecológica para ambos días de muestreo La biomasa (expresada como el porcentaje relativo al total) relativa a los individuos EM representó la mayoría para el primer día (74.11%), en contraste con la perteneciente a los de la categoría ESM (1.22%) la cual resultó ser la más baja para el mismo día, como se muestra en la Figura 13. Para el segundo día, la biomasa más baja también fue la obtenida de individuos de la categoría ESM (0.88%), mientras que la biomasa de las categorías ecológicas EM fue menor en relación a primer día (59.74%), y la biomasa de la categoría HPCEL incrementó de 24.68% (en el primer día) a 39.38%. Dichos resultados, muestran un descenso de biomasa relativa a las categorías EM y ESM para el segundo día, y un aumento con relación a la biomasa de la categoría HPCEL. Figura 13. Biomasa calculada en porcentaje correspondiente a cada categoría ecológica En el presente trabajo, se identificaron un total de 22 especies de la categoría ecológica EM, y 3 para cada una de las categorías ESM (C. crysos, H. amblyrhynchus y L. synagris) y HPCEL (C. aguadulce, D. maculatus y D. sabina), como se observa en el Cuadro 1. Sin embargo, las diferencias entre las categorías ecológicas EM y HPCEL son menos marcadas (66.72% y 32.24%, respectivamente), mientras que la biomasa relativa a la categoría ESM fue la más baja de todas (1.04%) (Fig. 13). Variables ambientales Los parámetros físico-químicos registrados en ambos días de muestreo fueron registrados para cada estación de muestreo, como se muestra en el Cuadro 4. Cuadro 4. Registro de parámetros físico-químicos de cada estación de muestreo. Día Est S_S S_F T_S T_F T_A Ox_S Ox_F (ups) (ups) (°C) (°C) (°C) (mg/L) (mg/L) 1 16 23 28.8 29.1 32 6.17 4.78 6.92 2 8.5 32 29.9 30.6 30 6.53 3.08 3 7 29 30.6 30.1 31 5.59 4 10 35 28.4 29 26 5 10 29 29.4 31 6 10 28 29.2 7 6.5 17 8 3 9 7 muestreo pH_S pH_F Pro Tr (m) (m) 7.3 2.1 1.9 7.25 7.56 3.9 1.5 4.35 7.49 7.73 2 1.35 3.88 4.17 7.67 7.83 3.4 1.35 27 6.49 1.6 7.82 7.62 1.7 1.3 30.3 28 5.86 1.42 7.74 7.62 1.5 1.2 28.9 30.4 30 6.74 2.96 6.9 6.99 1.3 1.05 23 28.5 30.7 30 5.86 2.88 6.92 7.05 1.3 0.85 14 30.2 31 31 6.23 3.26 7.24 7.26 1.1 1 16-10-2018 10 X- 1.5 21 27.2 30.6 28 6.49 2.6 6.34 7.1 1.5 0.9 7.95 25.1 29.11 30.2 29.3 5.98 3.11 7.22 7.40 1.98 1.24 8 1 34.65 34.05 27.60 26.8 25.1 5.77 4.53 7.40 7.71 2.00 1.15 2 33.75 33.20 27.90 27.4 25.1 5.61 5.30 7.80 7.94 1.20 0.90 3 15.00 30.95 28.20 27.9 24.3 5.47 4.15 7.89 7.94 1.60 0.56 4 23.70 25.45 27.60 26.9 24.7 6.12 5.36 7.91 7.88 1.20 0.40 5 14.85 16.90 27.00 27.1 24.5 6.31 3.55 7.86 7.77 1.40 0.45 6 0.05 0.05 23.70 23.6 23.9 6.75 5.20 7.97 7.89 1.60 0.25 7 6.10 6.95 25.00 25.2 24.0 7.70 4.82 7.60 7.58 2.30 0.30 8 3.10 14.60 24.70 26.8 24.1 7.62 2.87 7.77 7.24 4.10 0.15 9 0.05 0.05 23.60 23.5 23.9 6.85 6.28 7.69 7.54 2.10 0.15 10 0.00 0.00 23.10 23.2 23.3 7.73 6.40 7.49 7.29 2.25 0.10 13.13 16.22 25.84 25.8 24.2 6.59 4.85 7.74 7.68 1.98 0.44 4 9 17-10-2018 X- Simbología: Salinidad superficial (S_S), Salinidad de fondo (S_F), Temperatura del agua superficial (T_S), Temperatura del agua de fondo (T_F), Temperatura ambiental (T_A), Oxigeno superficial (Ox_S), Oxigeno de fondo (Ox_F), pH superficial(pH_S), pH de fondo(pH_F), Profundidad(Pro), Transparencia (Tr) y X-(Promedio). Análisis peces-hábitat (Análisis de Correlación Canónica) El análisis de correspondencia canónica (ACC) realizado para el primer día (16 octubre 2018) de muestreo, muestra las correlaciones entre las variables ambientales, los sitios de muestreo y la abundancia de las especies, como se observa en la Figura 14. En el eje 1 recae el mayor contenido de la información del análisis con el 40.7% (Eigenvalue= 0.53), mientras que en el eje 2 contiene el 16.4% (Eigenvalue=0.21). Las variables correlacionadas directamente con L. synagris, C. undecimalis y L. griseus fueron: la transparencia, el pH de fondo y en menor medida la temperatura de superficie, el pH de superficie y la salinidad de superficie. La salinidad de superficie tuvo mayor correlación en la estación 2, mientras que el resto de las mencionadas tuvieron una correlación significativa en entre las estaciones 2 y la 3. Las estaciones 5 y 6 tuvieron baja correlación con la transparencia, pH de fondo, pH de superficie y salinidad de la superficie. Así mismo, estas estaciones estuvieron inversamente correlacionadas con la profundidad y la salinidad de fondo. El resto de las especies y las estaciones se encuentran cerca del centroide del gráfico, por lo que no tienen una correlación marcada con los parámetros fisicoquímicos. Sin embargo, cabe resaltar que la temperatura de fondo tuvo una correlación inversa en el eje 2, y positiva en el eje 1 con las especies C. paralellus, A. lineatus y E. plumieri. El oxígeno disuelto en la superficie, por otra parte, tuvo una correlación inversamente proporcional con E. argenteu y P. octonemus en el mismo nivel, A. felis, G. oceánicos y C. spilopterus dentro de las estaciones restantes. Fig. 14. Diagrama de Análisis de Correspondencia Canónica de abundancia de especies, variables ambientales y sitios de muestreo, del primer día de muestreo en la laguna de Sontecomapan. Las abreviaturas de las especies se indican en el Cuadro 1, los triángulos azules representan las estaciones de muestreo. El ACC aplicado al segundo día de muestreo (17 octubre 2018) (Fig. 15), demostró que el eje 1 explicó un 27.186 % (Eigenvalue =0.483) de información del análisis y el eje 2 un 21.768% (Eigenvalue =0.387). Las variables estrechamente relacionadas con P. octonemus y L. griseus, fueron la salinidad de fondo y superficial, la temperatura ambiental, superficial y de fondo. Estas variables se ubicaron dentro de las estaciones 1, 2 y 3, donde la abundancia de las especies ya mencionadas fue mayor. Así mismo, L. analis, estuvo relacionada con la variable de transparencia y de nueva cuenta con la estación 1. Por otra parte, el pH y oxígeno de fondo, junto con el oxígeno superficial, tuvieron una relación inversamente proporcional con el eje 1 con las especies C. crysos, E. argenteus, D. rhombeus, D. maculatus, C. ensiferus, C. aguadulce y E. plumieri, presentes en las estaciones 4, 6, 9 y 10. Sin embargo, al ubicarse en el centro del diagrama, no se encuentran influenciadas íntimamente por los demás parámetros físicoquímicos. De igual manera, la profundidad tuvo una correlación inversamente proporcional con el eje 1 pero directa con las especies A. lineatus, A. felis, P. ramosus, G. dormitor y O. beta, presentes en las estaciones 5, 7 y 8. Fig. 15. Diagrama de Análisis de Correspondencia Canónica de abundancia de especies, variables ambientales y sitios de muestreo, del segundo día de muestreo en la laguna de Sontecomapan. Las abreviaturas de las especies se indican en el cuadro 1. Árbol de Causas-Efectos El problema sobre la alteración en el comportamiento de la comunidad ictiofaunística de la laguna de Sontecomapan fue identificado a partir de 4 principales ejes causales: Procesos climáticos, hidrológicos, costeros y antropogénicos. Dichos ejes causales derivaron en un conjunto de efectos inmediatos, los cuales fueron obtenidos a partir de los resultados de la presente investigación, que sirvieron para el desarrollo de efectos a mediano y largo plazo que incidieron en aspectos ecológicos y económicos (Anexo 3). Dentro de los procesos climáticos, se identificó como causa central el calentamiento global (Salazar-Vallejo, 2002) que, si bien es un fenómeno global, afecta las zonas costeras del Pacífico y del Atlántico (Scavia et al., 2002) que, en conjunto con la alta incidencia de tormentas tropicales, huracanes, y los cambios en la temporalidad climática (Nicholls et al., 2010). Dicho calentamiento global ha condicionado el aumento de la temperatura ambiental en sistemas costeros del Golfo de México, el cual, en conjunto con los cambios en la temporalidad climática han generado la formación de nortes intensos en la reserva de los Tuxtlas, Veracruz, así como corrientes y oleajes fuertes, variando en la duración desde un día hasta una semana (Osorio-Tai, 2015). Eventualmente, los nortes han provocado cambios en los patrones de precipitación de la zona, junto con las alteraciones en la dirección y fuerza de los vientos, causado por la alta incidencia de tormentas tropicales resultado de las altas temperaturas en las costas (Scavia et al., 2002). Dentro de las causas derivadas de procesos hidrológicos, en un nivel macro, se identifican el aumento del caudal de los ríos y el aumento en la escorrentía que acentúa a la primera mencionada, todo esto en una situación de norte causada por un cambio en los patrones de precipitación en Sontecomapan (Tarbuck y Ludgens, 2005; Smith y Smith, 2007; Escobar et al., 2008). Como efecto inmediato de ambos fenómenos se produciría un mayor aporte y resuspensión de los sedimentos arrastrados por el movimiento del agua, así como una disminución en la temperatura del cuerpo de agua (Yáñez-Arancibia et al., 2013). Dicho movimiento de los sedimentos y flujos de agua producirían así un incremento en el aporte de los nutrientes y la materia orgánica del detritus a la laguna (ambos acentuados por lixiviación de residuos de fosas sépticas y agroquímicos), así como alteración en la profundidad en diversos puntos del cuerpo de agua (Tarbuck y Ludgens, 2005; Smith y Smith, 2007; Escobar et al., 2008). Es así como, consecuentemente, se produciría un aumento en la turbidez del agua por la resuspensión de los materiales arrastrados y en movimiento, lo que inmediatamente disminuiría la penetración lumínica en el cuerpo de agua (Tarbuck y Ludgens, 2005; Smith y Smith, 2007). La suma de ésta última, el aumento en el aporte de nutrientes y la alteración en la profundidad de la laguna resultan en una alteración en la producción primaria (Yáñez-Arancibia et al. 2013). En el mismo nivel, una extensión de la cuña de sal hacia el interior de la laguna (causada por un incremento en la entrada de agua salada a zonas costeras) provocaría un aumento en las fluctuaciones de la salinidad a lo largo de la laguna, lo que, en conjunto con la disminución de la temperatura (y la presencia del norte), incrementarían el oxígeno disuelto presente (Smith y Smith, 2007). Analizando esta red de causas y efectos hidrológicos, se distinguen como causantes directos de la alteración en el comportamiento de la ictiofauna: el aumento en las fluctuaciones de la salinidad, el mayor aporte de nutrientes, el mayor aporte de materia orgánica en el detritus, la alteración en la productividad primaria (Downing et al., 1990; Chassot et al., 2010), la disminución en la temperatura del agua y el incremento en el oxígeno disuelto dentro de ésta (Yáñez-Arancibia et al., 2013). Dentro de las causas costeras, se identificó como causas a nivel macro el incremento del efecto mareal, una mayor acción del oleaje y el cambio en la dirección de las corrientes marinas (MARN, 2009). Lo anterior mencionado fue provocado por las condiciones de norte intenso que se suscitaron el día del muestreo. El cambio en las corrientes marinas junto con una mayor acción del oleaje, provocaron el incremento en la erosión del litoral, la cual provocó una alteración de las características del hábitat de la ictiofauna costera y lagunar (Arceo-Carranza et al., 2010). Del cambio en la dirección de corrientes marinas también se derivan los cambios en la distribución de nutrientes, el cual produce una alteración en las cadenas tróficas del área costera (ArceoCarranza et al., 2010; Ibarra et al., 2017) Las corrientes marinas también provocan una alteración en la salinidad a nivel costero, el cual afecta directamente al comportamiento de la comunidad ictiofaunística (Arceo-Carranza et al., 2010). Por otra parte, el incremento mareal provoca, junto con la mayor acción de oleaje, un mayor arrastre de sedimentos marinos del mar a la laguna, seguido de una disminución de la profundidad en la boca de la laguna (MARN, 2009). Sin embargo, el arrastre de sedimentos no es la única causa de la disminución de la profundidad en la boca de la laguna, sino que también lo es la construcción de una escollera en la misma (SEMARNAT, 2012; Vergara, 2007). El incremento del efecto mareal, provocado por las condiciones climáticas, provoca un aumento en el nivel del mar, el cual se ve influenciado por un aumento en las temperaturas por el cambio climático (Salazar-Vallejo, 2002). El aumento del nivel del mar provoca una mayor entrada de agua salada a zonas costeras del sistema lagunar (Arceo-Carranza et al., 2010), lo cual está directamente asociado con la alteración en el comportamiento de la comunidad ictiofaunística de la laguna de Sontecomapan. Dentro de las causas macro de origen antropogénico se encuentra la pesca no regulada (CONAPESCA, 2013), el exceso de crecimiento poblacional (Vega, 2003; Naranjo y Dirzo, 2009) y la falta de conocimiento de la dinámica de la comunidad ictiofaunística local (Carmona et al., 2003). De esta última, se deriva una ausencia de seguimiento de vedas establecidas para la pesca (Carmona-Díaz et al., 2004; CONAPESCA, 2014), así como el uso de técnicas artesanales inadecuadas por parte de la pesca furtiva (CONAPESCA, 2013). Ésto último se ve reflejado en una sobreexplotación de la ictiofauna en la laguna (Vega, 2003; Carmona-Díaz et al., 2004; Naranjo y Dirzo, 2009). Por otro lado, el exceso de crecimiento poblacional, mencionado inicialmente, ha provocado un aumento en la extensión de la frontera agropecuaria, así como un creciente desarrollo de asentamientos irregulares alrededor de la barra del cuerpo lagunar, que ha ocasionado, a lo largo del tiempo, el azolve de sedimentos en la laguna, ya que las mismas actividades antrópicas (producción acuícola, descarga de residuos, turismo y recreación) influyen en la disminución de la profundidad en la boca (SEMARNAT, 2012). Por este motivo se construyó una escollera en la barra, con el fin de contener en gran medida el sedimento acarreado por el transporte litoral. Sin embargo, dicha obra quedó inconclusa (SEMARNAT, 2012) provocando así una modificación en la costa litoral y una pérdida económica por parte de los pobladores que dependen de estos recursos. Los asentamientos irregulares de la población local han provocado un exceso de lixiviación de residuos provenientes de las fosas sépticas utilizadas, ya que viven en condiciones donde carecen de un sistema de drenaje apropiado (Carmona-Díaz et al., 2004; Naranjo y Dirzo, 2009). Por otro lado, el incremento del uso inadecuado e indiscriminado de fertilizantes, herbicidas y plaguicidas provoca que, al lavarse los suelos con las precipitaciones, se lixivien dichos compuestos hacia el cuerpo de agua, lo que, en conjunto con lo mencionado previamente, ha propiciado el envenenamiento de la ictiofauna local (Carmona-Díaz et al., 2004; Naranjo y Dirzo, 2009). Dicho envenenamiento, junto con la sobreexplotación de la ictiofauna inicialmente mencionada, han contribuido a la alteración en el comportamiento de la comunidad ictiofaunística (Navia-López, 2011). De seguir la problemática sobre la alteración en el comportamiento de la comunidad ictiofaunística de la laguna de Sontecomapan, se podría generar una pérdida de integridad del ecosistema. En primera instancia, ésto se vio reflejado en la alteración en los patrones de distribución y migración de las especies de la comunidad ictiofaunística, así como un aumento de 20% en la riqueza y deterioro en la abundancia de 42% de la comunidad, influenciados por la misma alteración de los patrones de migración (Ayala-Pérez et.al., 2003). Como consecuencia del aumento de la riqueza y el deterioro en la abundancia, se produjo un aumento del 25% en la equitatividad (Morín, 2011). Por otro lado, el deterioro en la abundancia ha provocado también repercutió en la reducción en la producción pesquera (Fernández-Carvajal, 2013). Los aumentos en la equitatividad y riqueza, previamente mencionados produjeron así un incremento del 30% en la diversidad ictiofaunística de la laguna de Sontecomapan (Morín, 2011). Cabe señalar que, los cambios porcentuales mencionados previamente, difieren a la tendencia histórica de trabajos como los de Hernández-Nava (2008), Rodríguez-Varela, et al. (2010) y Guillén-Castrillo (2016), donde los niveles de riqueza, equitatividad y abundancia en conjunto, van en decremento con respecto a los primeros estudios realizados en la comunidad ictiofaunística del sistema lagunar de Sontecomapan (Reséndiz-Medina, 1983; Fuentes-Mata et al., 1989). Como efecto de la alteración de los patrones de distribución de las especies se podría producir un aumento en la competencia interespecífica por recursos, así como desplazamiento y pérdida de especies acentuado por la misma competencia interespecífica (Ayala-Pérez et al., 2003). Dicho desplazamiento y pérdida de especies, junto al incremento en la diversidad ictiofaunística local, causarían una alteración en la composición de especies en la laguna (Hernández-Nava, 2008). La reducción en la productividad, antes mencionada, puede generar una pérdida de ingresos por compra-venta de recursos pesqueros, junto con el uso de técnicas no autorizadas para la pesca por parte de los pescadores locales (Jiménez-Badillo, 2006). La competencia interespecífica, el desplazamiento y pérdida de especies generarían un aumento en la tasa de mortalidad de especies menos competitivas (Ayala-Pérez et al., 2012). Por otra parte, la pérdida de ingresos y el uso de técnicas no autorizadas darían lugar a una explotación de los recursos pesqueros vulnerables y juveniles, así como la búsqueda de nuevas áreas de pesca (FernándezCarvajal, 2013; Naranjo y Dirzo, 2009; CONAPESCA, 2013). Dichas técnicas no autorizadas, además, traería consigo una disminución en el uso de peces para el consumo (Lleonart, 2011). Las cadenas tróficas lagunares sufrirían una alteración debido a: la alteración en la composición de especies, el desplazamiento y/o pérdida de especies y un aumento en la tasa de mortalidad de especies menos competitivas (consecuencias previamente mencionadas en párrafos anteriores) (Navia-López, 2011; Naranjo y Dirzo, 2009). Del mismo modo, la disminución de las tallas y pesos de los recursos pesqueros, provocado por la explotación de estos, dará como resultado la alteración en el ciclo de vida de la ictiofauna (Montreuil, 2001). Como consecuencia de esta alteración y la mencionada en las cadenas tróficas, en conjunto con el aumento en la tasa de mortalidad, ocasionará una extinción local de especies (Schindler, 2007). Por otro lado, habría un incremento en la competencia de los pescadores, así como, conflictos de compra-venta entre los diferentes poblados como consecuencia de la disminución de los peces de consumo y la búsqueda de nuevas áreas de pesca (Fernández-Carvajal, 2013; Naranjo y Dirzo, 2009; CONAPESCA, 2013). La extinción de especies, en conjunto con la alteración de las cadenas tróficas y los ciclos de vida, puede dar pie a una alteración o pérdida de la estructura y funciones ecológicas ligadas a la comunidad ictiofaunística (Navia-López, 2011; Naranjo y Dirzo, 2009). Por otra parte, los conflictos de compra-venta y la competencia de los pescadores darán como resultado un aumento en la pobreza por pérdida de los recursos naturales (Fernández-Carvajal, 2013). Esto último, junto con la pérdida de la estructura y funciones ecológicas y la alteración de las cadenas tróficas, podrían llegar a causar en última instancia la pérdida de la integridad del ecosistema (Briceño, 2014). DISCUSIÓN Composición La composición ictiofaunística del presente estudio, fue menor (17 familias, 21 géneros y 29 especies) que lo reportado por el estudio realizado anteriormente por Rodríguez-Varela, et al. (2010), donde identificaron un total de 52 especies pertenecientes a 24 familias y 41 géneros, en temporadas de secas y lluvias utilizando una luz de malla de 0.635 cm. Así mismo, GuillénCastrillo (2016), registró más especies en la Laguna de Sontecomapan, reportando 17 familias, 27 géneros y 33 especies, en los meses de octubre y febrero con una luz de malla similar a la utilizada en este estudio (1.8 cm). Debido a lo anterior, se puede inferir que de manera histórica la composición de especies ha ido en decremento. Sin embargo, el arte de pesca utilizado también pudo haber tenido una influencia al momento de la captura de las especies (ÁlvarezRubio et al., 1984), al igual que el poco tamaño de esfuerzo realizado en los estudios ya mencionados. Diversidad Existen muy pocos estudios sobre la diversidad ictiofaunística en la laguna de Sontecomapan, puesto que la mayoría solo fueron muestreos para actualizar el catálogo íctico de la laguna. En un estudio ecológico, Guillén-Castrillo (2016) encontró para octubre de 2014 una diversidad de H’= 1.8 en la mitad de la laguna, mientras que, en octubre de 2015, la diversidad fue de H’= 1.7 cerca de la boca de la laguna, los cuales fueron los valores más altos obtenidos en dicho trabajo. Los resultados de dicha investigación contrastan con lo obtenido en el presente estudio, realizado también en octubre, donde la diversidad más alta para el primer día fue de H’= 1.67 cerca del embarcadero, mientras que en el segundo fue de H’= 2.1 entre la mitad de la laguna y el embarcadero. En general, la diversidad promedio del presente estudio en el primer día (H’=0.83) y del segundo (H’=1.34), en comparación con la diversidad promedio encontrada por GuillénCastrillo (2016) en el 2014 (H’= 0.94) y 2015 (H’= 1.11), presentó un aumento al presentarse el norte con lluvias. Lo anterior también fue registrado por Zamora (2003) en un estudio realizado en la misma laguna, quien encontró una diversidad con presencia de norte de 1997 de H’= 2.14, tiempo donde se encontró la más alta diversidad. Esto parece sugerir que la diversidad ictiofaunística en la laguna de Sontecomapan sufre una alteración durante la entrada de nortes. Por otro lado, similar al sistema lagunar de Sontecomapan, Toro-Ramírez et al. (2017) registró una diversidad media (H’= 1.7 aproximadamente) en época de nortes, teniendo una mayor diversidad en época de lluvias, resultados similares a los registrados en este estudio. No obstante, en los trabajos realizados en Sontecomapan, la diversidad para la laguna de Sontecomapan ha ido decreciendo gradualmente, (descartando como fenómeno extraordinario el norte de este estudio), sugiriendo una alteración en la estructura y posiblemente en las funciones de la comunidad. Riqueza Para la riqueza de especies, Hernández (2008) considera la laguna de Sontecomapan rica en especies, debido a que registró el 37% (36 especies) de las especies totales (104) reportadas para esta laguna, teniendo 7 especies de diferencia con este estudio donde solo hubo 29 especies. No obstante Guillén-Castrillo (2016) registró una riqueza con el índice de Margalef en octubre de 2014 de DMg =1.9 en la mitad de la laguna y el más bajo (DMg =1.4) cerca del embarcadero, contrastando los resultados obtenidos en el presente estudio, donde en el primer día el mayor valor se obtuvo cerca del embarcadero (DMg =2.4) y el menor (DMg =0) cerca de la boca de la laguna, así mismo en el segundo día el mayor valor se obtuvo cerca de la boca (DMg = 2.7) y el más bajo cerca del embarcadero (DMg =1.31). En el segundo muestreo hecho por Guillén-Castrillo en octubre de 2015, encontró una alta riqueza (DMg =2.27) en la boca de la laguna y la más baja en el embarcadero. En general, la riqueza promedio obtenida en este trabajo en el primer dia (DMg = 1.18) y en el segundo dia (DMg =1.83) muestran una similitud con los datos obtenidos del anterior autor para el muestreo en 2014 (DMg =1.17) y en 2015 (DMg = 1.56), lo que indica un aumento de la riqueza, probablemente a causa de la dinámica de la comunidad en la época de norte. Esto mismo fue registrado en la reserva de Campeche (cuyo sistema lagunar es similar a Sontecomapan) por Toro-Ramírez et al. (2017), quien registró la mayor riqueza de especies en temporada de nortes a diferencia de las otras temporadas de muestreo, los datos del presente estudio concuerdan con lo anterior debido a que la mayor riqueza de especies se obtuvo al segundo día de muestreo que ocurrió dicho fenómeno. Históricamente la riqueza en los diferentes estudios ha sido menor en cada ocasión, en temporalidades similares, y sin tomar en cuenta los componentes comunitarios de las especies, probablemente a la luz de malla utilizada en cada estudio, o que la pesca local haya alcanzado un punto crítico para convertirse en sobrepesca. Equitatividad Con respecto a la Equitatividad, Guillén-Castrillo (2016) encontró para octubre de 2014 una equidad de 1 cerca de la boca de la laguna, debido a que solo había 2 especies con 1 individuo, y la menor Equitatividad cerca del embarcadero con (J’= 0.5). En el segundo muestreo de octubre 2015 obtuvo el mismo patrón de Equitatividad por zona. Comparando el muestreo del 2014 con este trabajo, se encontraron diferencias en los patrones de distribución de las especies, donde en el primer día en la zona cercana a la boca no se obtuvieron valores de este índice, pero el área circundante al embarcadero fue una de las más altas en equidad. Para el segundo día los valores más bajos de equidad se encontraron en la mitad de la laguna, y los más altos en el área cerca del embarcadero. Con respecto al segundo muestreo del autor ya mencionado en octubre en 2015, la parte de la boca de la laguna en esta investigación para el día 16 de octubre no obtuvo valor alguno en uniformidad, y el embarcadero tuvo valores medios de este índice, para el 17 de octubre los valores obtenidos indican una tendencia a la uniformidad en diferentes estaciones y áreas de muestreo, siendo contrastante los datos de ambos días con el trabajo de este autor. En general, la Equitatividad promedio del primer día (J’=0.45) y del segundo día (J’=0.77) tienen similitud con los obtenidos por Guillén-Castrillo (2016) en octubre de 2014 (J’= 0.56) y en 2015 (J’=0.74) debido a que se observó un aumento en la uniformidad, lo que indica que la entrada de nuevas especies al sistema puede generar una distribución uniforme dentro de la comunidad. Para otro sistema lagunar en Campeche, Toro-Ramírez et al. (2017) Encontró una alta Equitatividad en época de secas y en época de lluvias, a comparación de la temporada de norte donde la equidad que obtuvo fue media, con valores homogéneos tanto en el día como en la noche, concordando con este trabajo ya que la uniformidad promedio de ambos días fue media, esto debido a que las abundancias de las especies están distribuidas “equilibradamente” en la comunidad, puesto que se encontró más especies que tuvieron de 1 a 6 individuos únicamente y pocas especies cuyas abundancias superan los 150 individuos, observando un punto “medio” entre las abundancias y el número de especies de la laguna sin llegar a la dominancia por parte de una(s) especie(s), pero tampoco a la uniformidad de la comunidad general. Dominancia Para la dominancia de esta investigación, tanto en el primer día como en el segundo la especie con mayor IVI fue D. rhombeus representando el 93% en abundancia y el 46% en peso, mientras que en el segundo día se encontró que C. aguadulce también tenía un IVI alto después de D. rhombeus representando el 28% en abundancia y el 62% en peso, esto coincide con los resultados obtenidos por Guillén-Castrillo (2016) quien también registró como dominantes a D. rhombeus y C. aguadulce en la laguna de Sontecomapan, representando el 82.3% de abundancia numérica y el 61.1% de la captura total en peso, esto debido a que en el primer día hubo muchas abundancias pero poca captura en peso para ambas especies, a comparación del segundo día donde los individuos de C. aguadulce capturados tuvieron mayor tamaño y peso, mientras que D. rhombeus la mayoría de los individuos colectados eran juveniles o de tamaño pequeño, resultando en los valores ya mencionados del IVI. Aguirre-León et al. (2013) registró para la laguna Chica-Grande en Veracruz una dominancia de 6 especies entre las cuales figura D. rhombeus con un IVI de 117% el cual es mucho mayor al encontrado en este estudio pero que fue la segunda especie con un IVI alto. Así mismo, Toro-Ramírez et al. (2017) encontró en la Reserva de Campeche que la dominancia si bien no fue la especie D. rhombeus, la familia Gerreidae tuvo valores altos de IVI para el total de la comunidad muestreada. El registro de esta especie en los diferentes estudios como dominante en los sistemas lagunares de Veracruz y algunos otros estados de México sugiere que tiene una capacidad de adaptación a diferentes condiciones ambientales, que no requiere de recursos específicos para sobrevivir y que su ciclo reproductivo es constante en todo el año (Díaz-Ruiz et al., 2006). Distribución Arceo-Carranza et al. (2010) menciona que la salinidad es la variable que más afecta a la distribución de los peces, y ésta misma presenta una relación significativa con la densidad y la biomasa. También explica que la temperatura y la profundidad se correlacionan negativamente con la distribución de algunas especies. Por otra parte, Guillén-Castrillo (2016), menciona que las variables ambientales que más influyeron en la composición y distribución de la comunidad ictiofaunística, fueron el pH, el oxígeno disuelto, la profundidad, la salinidad, transparencia y temperatura. En el presente estudio se reportó que las variables antes mencionadas por ArceoCarranza et al. (2010) y Guillén-Castrillo (2016), son las que más influyen en la composición y distribución de las especies ícticas, siendo la salinidad, transparencia y profundidad las que más influyeron en el presente estudio. Se pudo observar un recambio de especies entre estaciones en ambos días de muestreo, ya que en el primer día la mayoría de las especies se encontraron en estaciones intermedias (5, 6, 7 y 8), mientras que, para el segundo día, muchas de estas especies mostraron un aparente desplazamiento hacia estaciones más cercanas a la boca y a la estación 10. Como ya se mencionó, ésto se debe a las alteraciones ambientales que se vivieron el segundo día de muestreo, en el que las variables que más cambiaron fueron la salinidad, la temperatura y la transparencia. Abundancia relativa (Biomasa, Densidad y Peso promedio) En el estudio realizado por Díaz-Ruíz et al. (2006) explica que los valores de biomasa y densidad son mayores en temporadas de lluvias, que es cuando la salinidad y la turbidez son altas y se presenta mayor descarga fluvial y alta productividad primaria. Aguirre-León et al. (2013) menciona que estos valores elevados de densidad y biomasa se deben a que las especies marinas y estuarinas se desplazan del mar a la laguna como preadultos y adultos para alimentarse y/o protegerse. En el presente estudio durante el primer día de muestreo, las variables ambientales de salinidad (r =0.8), temperatura (r =0.8), oxígeno (r =0.8), pH (r =0.9), profundidad (r =0.8), y transparencia (r =0.9) están fuertemente relacionadas con los valores de biomasa y la densidad por estación. En el caso del segundo día, por causa de la entrada del norte, sólo las variables de salinidad (r =0.9), profundidad (r =0.9) y transparencia (r =0.9), fueron las más significativas para la biomasa y la densidad, siendo la profundidad inversamente proporcional a la misma. Lo mencionado anteriormente coincide con los trabajos realizados por Díaz-Ruíz et al. (2006) y Arceo-Carranza et al. (2010), en los que la transparencia, la salinidad, la profundidad y el oxígeno, son las variables más importantes. Aguirre-León et al. (2013) también menciona que en estas épocas de agosto-octubre, las lagunas costeras son ocupadas mayormente por juveniles para alimentarse y crecer, lo que da densidades, biomasas y pesos promedio bajos en esas épocas. Lo anteriormente mencionado coincide con lo reportado en el presente estudio, en el que los pesos promedios fueron bajos con respecto a lo reportado por Guillén-Castrillo (2016), en el que tuvo pesos promedio superiores a los del presente estudio, lo cual sugiere que la mayoría de los individuos capturados no eran adultos. Categorías tróficas En el presente trabajo se identificaron 10 especies de consumidores de primero y segundo orden, cada uno, y 9 especies de consumidores de tercer orden, con una superioridad en abundancia por biomasa por parte de los consumidores de primer orden, seguido por los del segundo orden y dejando a los consumidores de tercer orden la más baja abundancia en biomasa. Dichos resultados son similares a los reportados en un estudio previo realizado en Sontecomapan por Guillén-Castrillo (2016), quien identificó 12, 11 y 10 especies para los consumidores de primero, segundo y tercer orden, respectivamente. Sin embargo, Alarcón-Sosa (2007) obtuvo para los mismos grupos de consumidores 6, 19 y 10 especies, respectivamente, resaltando que, para éste estudio, realizó un análisis de contenido estomacal de las muestras obtenidas, método no empleado para el presente trabajo y el realizado por Guillén-Castrillo (2016). Asimismo, en un trabajo realizado para otro sistema estuarino en Nayarit por Álvarez-Rubio et al. (1984) reportó que del total de las especies registradas el 30.7% correspondía a consumidores de primer orden, 54.7% a consumidores de segundo orden y 28% para los consumidores de tercer orden, explicando la superioridad de los del segundo orden en se debe a su amplio espectro trófico, que les permite tener distintas alternativas de alimentación. Adicionalmente, el mismo autor, al utilizar diferentes artes de pesca para su trabajo, concluye que el uso de red de arrastre tiende a capturar consumidores de primer y tercer orden, la cual fue la técnica empleada para el presente trabajo, por lo que podría ser una razón para el elevado número y biomasa obtenida por parte de los consumidores de primer orden, en comparación con los del segundo orden. Dicha superioridad numérica de especies consumidoras del segundo orden fue reportada en estudios realizados en otros sistemas estuarino-lagunares tropicales (Yáñez-Arancibia y Lara-Domínguez, 1982; Ramírez-Villarroel, 1994), y en comunidades con más de 140 especies, los consumidores de segundo orden ocupan más del 50% de la comunidad de peces en sistemas costeros del Golfo de México (Yáñez-Arancibia et al., 2014). Pasquaud et al. (2008) concluyó, en su trabajo realizado en un sistema estuarino en Francia, que el uso de dos técnicas, como el análisis de contenido estomacal y análisis de isótopo de nitrógeno estable, son eficientes para una descripción detallada de la estructura de una red trófica de peces estuarinos, lo cual podría indicar una deficiente metodología empleada en el presente estudio, tomando en cuenta las diferencias obtenidas con el trabajo realizado por Alarcón-Sosa (2007). Las tres categorías tróficas identificadas en el trabajo (Consumidores de primero, segundo y tercer orden) variaron del primer al segundo día, día que coincidió con la entrada del norte al sistema estuarino. ÁlvarezRubio et al. (1984) y Ramírez-Villarroel (1994) explican que pueden existir fluctuaciones en la estructura trófica de las comunidades estuarinas debido al mismo comportamiento de las especies, el ambiente, estaciones y el arte de pesca utilizado, lo cual explica el aumento de especies en cada categoría trófica que se registró para el segundo día, así como la disminución de la biomasa de los consumidores del primero y tercer orden, y el aumento de biomasa de los consumidores del segundo orden. Este último aumento en la biomasa de los consumidores de segundo orden, que además presentaron el mayor número de especies identificadas (en conjunto con los del primer orden) en el segundo día, se puede explicar a que dicho grupo de consumidores tienen un amplio abanico de opciones tróficas (como confirmaron Álvarez-Rubio et al. (1984)), el cual pudieron aprovechar durante el norte debido a la mezcla y arrastre de materia orgánica en el detritus, el cual es de las principales fuentes de alimento en el ecosistema estuarino (Alarcón-Sosa, 2007; Yáñez-Arancibia et al., 2013). Debido a lo anterior, el presente trabajo puede sugerir dos cosas: una deficiente metodología para la identificación de categorías tróficas, o una posible alteración que ha prevalecido en la estructura ictiotrófica en la laguna, reportada previamente por Guillén-Castrillo (2016) y reportada con los resultados del presente estudio, debido a que los consumidores de segundo orden se encuentran en un aparente bajo porcentaje de abundancia, y éstos son los más importantes al determinar características particulares de comunidades ictiológicas de estuarios tropicales y subtropicales, especialmente durante sus diferentes etapas ontogénicas, debido a su directo impacto a diferentes niveles tróficos en el sistema (Yáñez-Arancibia et al., 2013). Categorías ecológicas Del total de 29 especies registradas en el presente trabajo, 22 pertenecen a la categoría de especies eurihalinas del componente marino (EM), 3 a la categoría de especies estenohalinas del componente marino (ESM) y 3 a la categoría de habitantes permanentes del componente estuarino-lagunar (HPCEL) (representando un 10.34% del total, por cada uno), destacando así la amplia dominancia de la categoría eurihalina (con un aproximado de 75.86% del total). Cabe mencionar que al no poder identificar taxonómicamente a nivel de especie a uno de los ejemplares muestreados (el indicado como Pleuronectidae), no fue tomado en cuenta para la categorización ecológica de este estudio, y por lo tanto sólo 28 especies fueron incluidas en estos resultados. Independientemente de lo anterior, los resultados en la caracterización ecológica del presente estudio fueron notoriamente similares, en cuanto a proporción, a la realizada en el estudio de Guillén-Castrillo (2016), quien reportó para el mismo sistema lagunar un total de 26 especies de la categoría EM, 4 ESM y 3 HPCEL, diferenciándose sólo en cantidad de especies EM y ESM. Dicha diferencia en números puede explicarse debido al poco esfuerzo de muestreo realizado en el presente trabajo, en comparación al realizado por la autora ya mencionada. En otro estudio realizado también en la laguna de Sontecomapan por Alarcón-Sosa (2007), reportó un 75% de especies pertenecientes a la categoría EM, 6% a la ESM y un 19% a la HPCEL, nuevamente asemejándose en gran medida a los resultados de la presente investigación. La misma tendencia de dominancia por parte de la categoría EM ha sido reportada en otros sistemas lagunares tropicales (Álvarez-Rubio et al., 1984; Yáñez-Arancibia, 1985) y, Yáñez-Arancibia et al. (2013) y (Álvarez-Rubio et al., 1984) explican que dicha tendencia se debe a que los estuarios son comúnmente referidos como áreas de guardería para el necton y también son usados como hábitats para peces adultos de especies transitorias, que suelen tener un carácter eurihalino. Así mismo, el número de especies que habitan permanentemente los estuarios es muy bajo (YáñezArancibia, 1985), debido a la alta variación ambiental que existe en dichos ecosistemas costeros y son raras las adaptaciones osmorreguladoras capaces de soportarlas. Las variaciones en las especies y biomasa de las categorías ecológicas presentadas entre el primer y segundo día, en las que fue notable el incremento de especies EM y la disminución de su biomasa, puede explicarse debido a que, como se mencionó previamente, son especies transitorias y cíclicas, que utilizan la laguna para desove, alimentación, reproducción o protección (Álvarez-Rubio et al., 1984), por lo que es de esperarse que las categorías ecológicas fluctúan con el ambiente a lo largo del año (Yáñez-Arancibia y Lara-Domínguez, 1982), como ocurrió al comparar los resultados en ambos días del presente estudio. Análisis de peces-hábitat (ACC) Para el primer dia, los parámetros con mayor correlación fueron la transparencia, la profundidad, el pH, la salinidad y la temperatura, pero solo para algunas especies. En el ACC realizado por Guillén-Castrillo (2016) en la Laguna de Sontecomapan, registró una fuerte correlación con el pH de fondo, primeramente, la profundidad, la salinidad de fondo y la transparencia, y de manera inversa la temperatura de fondo. Las variables encontradas en el presente trabajo coinciden con la mayoría encontrada por dicho autor, agregando la temperatura superficial que tuvo también una correlación directa con algunas especies de la comunidad. De manera semejante, ToroRamírez et al. (2017) realizó un ACC en una laguna de Campeche, encontrando que la variable con mayor influencia en la comunidad es el oxígeno disuelto en época de nortes, seguida por la temperatura, que tuvo más relaciones inversas con la comunidad. Lo anteriormente mencionado, resulta contrastante con este trabajo, debido a que el oxígeno no tuvo una correlación significativa, por lo que no tiene un efecto importante en las especies de la comunidad. Por otro lado, para otros sistemas costeros o lagunares, estudios de campo y laboratorio han comprobado que las variables físicas y químicas de una laguna afectan la comunidad ictiofaunística, tal es el caso de Whitfield (1999) quien encontró que la turbidez o transparencia, ya sea sola o con otras variables ambientales, juega un rol importante en la distribución de peces marinos dentro de los estuarios, así como la tolerancia a distintos rangos de salinidad en sus diferentes estadíos. Whitfield (1999) también encontró una fuerte correlación positiva entre el número de peces en movimiento con la corriente y la media de la profundidad del agua. Aunado a esto, Mendoza et al. (2009) encontró una importante correlación entre la salinidad y el oxígeno disuelto como determinantes en la variabilidad de la composición de la comunidad íctica de la laguna de Chacahua. Si bien, estas variables se registraron en un dia de temporada de lluvias, éstas cambian constantemente, y en el caso del presente estudio, se presentó un fenómeno de norte, donde las variables que tuvieron mayor relación con las especies según el análisis de correspondencia canónica en el segundo día de muestreo, fueron la temperatura, salinidad y oxígeno tanto de fondo como superficial, la transparencia y la profundidad. Diversos estudios mencionan la influencia de la salinidad, la cual condiciona la presencia de las especies. CastilloRivera et al. (2003) reportaron que la temperatura fue la variable que se correlacionó con mayor frecuencia con la diversidad, equidad y dominancia de las especies, en un estudio sobre patrones de la diversidad de peces en la laguna de Pueblo Viejo, Veracruz. De igual manera, PeraltaMeixueiro y Vega-Cendejas (2011) en un estudio sobre la estructura espacial y temporal de los ensamblajes de peces en un sistema costero hiperhalino: Río Lagartos, México, registraron a la salinidad como la variable que mejor explicó la estructura espacial de los ensamblajes de peces. Así mismo, Azevedo et al. (2007) en un estudio sobre peces demersales en una bahía tropical en el sureste de Brasil, reportaron que las variables ambientales como profundidad, salinidad, temperatura, oxígeno disuelto y transparencia, condicionan la distribución y supervivencia de las especies. Entre el primer y segundo día de muestreo, las variables ambientales que más influyeron en la distribución de las especies no fueron las mismas, como anteriormente se mencionó, la dinámica ambiental cambia constantemente, lo cual genera una variación en los parámetros fisicoquímicos de la laguna. No obstante, no todas las especies se ven influenciadas por estas variables, esto se refleja dentro del gráfico como un conglomerado de especies en el centro de ambos ejes y que cambió entre primer y segundo día. Esto podría ser causado por la presencia de algunas especies que no son residentes permanentes dentro de la laguna, sino también, procedentes de otros sistemas acuáticos y que ocupan la laguna en algún momento de su ciclo de vida. CONCLUSIONES ● La composición de especies de la comunidad ictiofaunística en la laguna de Sontecomapan ha disminuido gradualmente en la última década. ● La diversidad, equitatividad y riqueza presentaron un aumento en sus valores en el segundo día, debido a la alteración de los parámetros fisicoquímicos ocasionada por la presencia del norte. Lo cual propició la entrada de especies alóctonas al sistema lagunar. ● Las variables ambientales tuvieron una gran influencia sobre la abundancia relativa (biomasa, densidad y peso promedio) y la distribución de las especies ictiofaunísticas, provocando migraciones a pequeña escala. ● La biomasa y pesos promedios más representativos para la comunidad fueron muy bajos en comparación con otros estudios, lo que sugiere una mayor cantidad de individuos juveniles, indicando una posible alteración en los ciclos de vida de las especies que habitan en la laguna de Sontecomapan. ● Se requiere realizar un análisis trófico más profundo del sistema lagunar, haciendo uso de análisis de contenido estomacal y un análisis de isótopo de nitrógeno estable, preferentemente. ● En la Laguna de Sontecomapan, se identificaron un total de 10 especies de peces consumidores de primer orden, 10 de segundo orden y 9 de tercer orden. ● Existe una alteración de las categorías tróficas en la Laguna de Sontecomapan, en el sentido de la reducción de los consumidores de segundo orden. ● En la Laguna de Sontecomapan existe una dominancia por parte de especies eurihalinas del componente marino (22 especies) y, una baja presencia de especies estenohalinas del componente marino (3 especies) así como de habitantes permanentes del componente estenohalino (3 especies). ● No hay evidencia suficiente para afirmar una alteración en las categorías ecológicas de la comunidad de peces en la Laguna de Sontecomapan. ● Las variables fisicoquímicas tales como la salinidad, temperatura, profundidad, transparencia y oxígeno disuelto, tienen una fuerte relación con la distribución y composición de especies en el sistema lagunar. Sin embargo, no todas las especies se ven influenciadas por las mismas variables fisicoquímicas. ● En el presente estudio se registraron aumentos en los parámetros estructurales de la comunidad entre ambos días, debido a la presencia del norte y una alteración en las categorías tróficas. Así mismo, en comparación con otros estudios se observó que existe una tendencia a la degradación de la comunidad ictiofaunística dentro de la laguna. LITERATURA CITADA ● Aguirre-León, A., S. Díaz-Ruíz y A. Bernal-Becerra. 1998. Ecología de Peces en Sistemas FluvioDeltaicos: Estudio para el Sistema Pom-Atasta en Campeche. Serie Académicos CBS (28). Universidad Autónoma Metropolitana, Unidad Xochimilco. México, D.F. 63 pp. ● Aguirre-León, A., H. E. Pérez-Ponce y S. Díaz-Ruíz. 2013. Heterogeneidad ambiental y su relación con la diversidad y abundancia de la comunidad de peces en un sistema costero del Golfo de México. Universidad Autonoma Metropolitana. México. pp. 145-163. ● Alarcón-Sosa, A. C. 2007. Aspectos tróficos de la ictiofauna de la laguna de Sontecomapan, Veracruz durante la temporada de secas del 2005. Tesis de Licenciatura en Biología. Universidad Nacional Autónoma de México FES Iztacala. Estado de México, México. 81 p. ● Álvarez-Rubio, M., F. Amezcua-Linares y A. Yáñez-Arancibia. 1984. Ecología y estructura de las comunidades de peces en el sistema lagunar Teacapán-Agua Brava, Nayarit, México. Anales del Instituto de Ciencias del Mar y Limnología. UNAM 13(1): 185-242. ● Arceo-Carranza, D., M. E. Vega-Cendejas, J. L. Montero-Muñoz, M. J. Hernández de Santillana. 2010. Influencia del hábitat en las asociaciones nictimerales de peces en una laguna costera tropical. Revista Mexicana de Biodiversidad. 81: 823-824. ● Ayala-Pérez, L., J. Ramos-Miranda y D. Flores-Hernández. 2003. La comunidad de peces de la Laguna de Términos: estructura actual comparada. Revista de Biología Tropical. 51(3): 783-793. ● Ayala-Pérez, L., J. Terán-González, D. Flores-Hernández, J. Ramos-Miranda, A. Sosa-López. 2012. Variabilidad espacial y temporal de la abundancia y diversidad de la comunidad de peces en la costa de Campeche, México. Universidad Autónoma Metropolitana. México, D.F. ● Azevedo, M., F. Araújo, A. Cruz, A. Pessanha, M. Silva & A. Guedes. 2007. Demersal fishes in a tropical bay in southeastern Brazil: partitioning the spatial, temporal and environmental components of ecological variation. Estuaries and Coastal Shelf Science, 75, 468-480. ● Begon, M., C. R. Towsend and J. L. Harper. 2006. Ecology: From Individuals to Ecosystems. 4° Ed. Blackwell Publishing, USA. 738 pp. ● Briceño, V. G. 2015. Evolución de la integridad estructural de ecosistemas lóticos del piedemonte llanero frente a la intervención antrópica. Universidad Nacional de Colombia. Acta Biológica Colombiana 20(2):133-144. ● Campillo-Sainz, J., J. G. Becker-Arreola, H. Hernández-Cervantes, H. Medina-Neri, C. Favre-del Rivero y L. Kasuga-Osaka. 1976. Catálogo de Peces Marinos Mexicanos. Secretaría de Industria y Comercio. Secretaría de Pesca. Instituto de Pesca Nacional. México. 462 pp. ● Carmona-Díaz, G., J. E. Morales-Mávil y E. Rodríguez-Luna. 2004. Plan de manejo para el manglar de Sontecomapan, Catemaco, Veracruz, México: una estrategia para la conservación de sus recursos naturales. Madera y Bosques. 10 (Es 2): 5-23. ● Castillo- Rivera, M., R. Zarate y L. Sanvicente-Añorve.2003. Patrones de la diversidad de peces en la laguna de Pueblo Viejo, Veracruz, México. Hidrobiológica.13 (4): 289-298. ● Castro-Aguirre, J. L., H. Espinosa-Pérez y J. J. Schmitter Soto. 1999. Ictiofauna estuarino-lagunar y vicaria de México. Limusa Noriega Editores. México, D.F. 711 pp. ● Chassot, E., S. Bonhommeau, N. K. Dulvy, F. Melin, R. Watson, D. Gascuel & O. Le Pape. 2010. Global marine primary production constraints fisheries catches. Ecology Letters 13: 495-505 ● CONAPESCA. 2013. La pesca ilegal e irregular en México: una barrera a la competitividad. Disponible en: http://mexico.edf.org/sites/mexico.edf.org/files/pescailegalfinal-07-06-17.pdf ● Contreras-Espinosa, F. y O. Castañeda L. 1993. Ecosistemas costeros mexicanos. Comisión Nacional para el uso de la Biodiversidad. Universidad Autónoma Metropolitana Iztapalapa. México. 415 pp. ● De la Cruz-Agüero, G. 1994. Manual de Usuario ANACOM: Sistema para el Análisis de Comunidades. Ver. 3.0. Departamento de Pesquerías y Biología Marina. CICIMAR - IPN. México, D.F. 99 pp. ● Díaz-Ruíz, S., M. Pérez-Hernández & A. Aguirre-León. 2003. Characterization of fish assemblages in a tropical coastal lagoon in the northwest Gulf of Mexico. Ciencias Marinas 29(4B): 631-644. ● Díaz-Ruíz, S., A. Aguirre-León, E. Cano-Quiroga. 2006. Evaluación ecológica de peces en dos sistemas lagunares estuarinos del sur de Chiapas, México. UAM Iztapalapa. 16 (2): 197-210. ● Downing, J. A., C. Planté & S. Lalonde. 1990. Fish Production Correlated with Primary Productivity, not the Morphoedaphic Index. Canadian Journal of Fisheries and Aquatic Sciences, Vol. 47, 1990: 1929-1936. ● Elton, C. 1958. The Ecology of Invasions by Animal and Plants. London: Methuen, 181 pp. ● Escobar, E. y M. Maass. 2008. Diversidad de procesos funcionales en los ecosistemas, en Capital natural de México, vol. I: Conocimiento actual de la biodiversidad. Conabio, México, pp. 161-189. ● Fernández-Carvajal, D. 2013. Pesca artesanal y pobreza en comunidades aledañas al Golfo de Nicoya. Revista Ciencias Sociales 140: 137-152. ● Fischer, W. (Ed). 1978. FAO Species identification sheets for fisheries purposes. Western Central Atlantic (Fishing Area 31). FAO, Roma, Vol. 1-6. ● Froese, R. and D. Pauly (Ed). 2018. FishBase. World Wide Web electronic publication. www.fishbase.org, version (06/2018). ● Fuentes-Mata, P., H. Espinosa-Pérez & J. Luna-Wiarco. 1989. Nuevos registros de peces en la laguna de Sontecomapan, Veracruz, México. Anales Instituto de Biología. Universidad Nacional Autónoma México. Serie Zoología 60: 257-262. ● Gómez-Marín, F. J. 2003. Ficha informativa de los Humedales Ramsar (FIR). México. pp.1-15. ● González-Larraza, P. G., A. Aguirre-León, G. Almada-Ávila, G. S. Binnqüist-Cervantes. 2016. Diagnóstico sobre la disminución de la calidad del agua en la Laguna de Sontecomapan, Veracruz, México. Seminario ecología de la Laguna de Sontecomapan. UAM, Xochimilco. pp. 56. ● Guillén-Castrillo. 2016. Análisis Ecológico de la Comunidad de Peces en la Laguna de Sontecomapan, Veracruz, México. Informe final de servicio social por investigación. UAM, Xochimilco. 60 pp. ● Ibarra-Marinas, D. y F. Belmonte-Serrato. 2017. Comprendiendo el litoral: Dinámica y procesos. Universidad de Murcia. 66 pp. ● Jiménez-Badillo, M. L. 2006. Caracterización de la pesca en la zona costera Veracruzana. 265296 p. In: Moreno, C.P., Peresbarbosa, R.E. y Travieso, B.A.C. (Eds.). Estrategia para el Manejo costero integral: el enfoque municipal. Volumen I. Instituto de Ecología A.C. y Gobierno del Estado de Veracruz-Llave. México. 1266 p. ● Karr, R. J. 1991. Biological Integrity: A Long-Neglected Aspect of Water Resource Management. Ecological Applications. Ecological Applications Vol I (1): 66-84. ● Krebs, C. 2009. Ecology: The Experimental Analysis of Distribution and Abundance. 6° Ed. Pearson. 695 pp. ● Lara-Domínguez, A. L., J. López-Portillo, R. Martínez-González y A. D. Vázquez-Lule. 2009. Caracterización del sitio de manglar Sontecomapan, en Comisión Nacional para el Conocimiento y Uso de la Biodiversidad (CONABIO). Sitios de manglar con relevancia biológica y con necesidades de rehabilitación ecológica. México. ● Lankford, R. R., 1977. Coastal Lagoons of Mexico, their origin and classification. 182-215 p. In: Wiley, M. (Ed). Estuarine Processes, Circulation, Sediments and Transfer of Material in the Estuary Vol. II. Academic Press. New York. 428 pp. ● Layman, C. A., K. O. Winemiller, D. A. Arrington and D. B. Jepsen. 2005. Body size and trophic position in a diverse tropical food web. Ecology 86 (9): 2530-2535. ● Lleonart, J. 2011. Recursos pesqueros del mediterráneo. Instituto de ciencias del mar. Quaderns de la mediterranea 16: 246-251. ● Martínez, R., y A. Fernández. 2008. Metodologías e Instrumentos para la formulación, evaluación y monitoreo de programas sociales: Árbol de Problema y Áreas de Intervención. COMFAMA/CEPAL. 13 pp. ● McCann, K. 2000. The diversity-stability debate. Nature 405: 228-233. ● Mendoza, E. Castillo-Rivera, M. Zárate-Hernández, R. y Ortiz-Burgos, S. 2009. Seasonal variations in the diversity, abundance, and composition of species an estuarine fish community in the Tropical Eastern Pacific, México. Ichthyological Research, 56:330-339 pp. ● Miller, R. R., W. L. Minckley and S. M. Norris. 2005. Freshwater Fishes of Mexico. The University of Chicago Press. 652 pp. ● Miller, G. T. Jr & S. E. Spoolman. 2009. Essentials of Ecology. 5° Ed. BROOKS/COLE Cengage Learning. Canadá: 279 pp. ● Ministerio de medio ambiente y recursos naturales (MARN). 2009. Introducción a los procesos costeros. Servicio Nacional de Estudios Territoriales. El Salvador ● Montreuil, V., A. García., R. Rodríguez. 2001. Biología reproductiva de Boquichico Prochilodus nigricans, en la amazonía peruana. Folia Amazónica 2 (1-2): 5-13 ● Moreno, C. E. 2001. Métodos para medir la biodiversidad. M&T Manuales y Tesis SEA. Vol. 1. Zaragoza. 84 pp. ● Morin, P. J. 2011. Community Ecology. 2° Ed. Wiley-Blackwell. 407 pp. ● Naranjo, E.J. y R. Dirzo. 2009. Impacto de los factores antropogénicos de afectación directa a las poblaciones silvestres de flora y fauna, en Capital natural de México, vol. II: Estado de conservación y tendencias de cambio. Conabio. 247-276. ● Navia-López, A. F. 2011. Alteraciones de las redes tróficas marinas por efectos de la pesca. Ensayo predoctoral. Instituto Politécnico Nacional. México. ● Nicholls, J. R. & A. Cazenave. 2010. Sea-Level Rise and Its Impact on Coastal Zones. Science 328 (5985): 1517-1520 pp. ● Osorio-Tai, M. E. 2015. Estudio de la intensificación de los vientos en el puerto de Veracruz mediante modelación numérica. Tesis. UNAM. México, D.F. 75 pp. ● Palacio-Nuñez, J. 2007. Designación de zonas prioritarias de conservación en el parque estatal Media Luna, México: Utilización de aves y peces como bioindicadores. Tesis. Universidad de Alicante. México. ● Pasquaud, S., P. Elie, C. Jeantet, I. Billy, P. Martínez and M. Girardin. 2008. A preliminary investigation of the fish food web in the Gironde estuary, France, using dietary and stable isotope analyses. Estuarine, Coastal and Shelf Science (78): 267-279. ● Peralta-Meixueiro M.A. y M.E. Vega-Cendejas. 2011.Spatial and temporal structure of fish assemblages in a hyperhaline coastal system: Ría Lagartos, Mexico. Neotropical Ichthyology. 9(3): 673-682. ● Programa de Conservación y Manejo de la Reserva de la Biosfera Los Tuxtlas, 2006. Comisión Nacional de Áreas Naturales Protegidas y Secretaría del Medio Ambiente y Recursos Naturales. 293 pp. ● Ramírez-Villarroel, P. 1994. Estructura de las comunidades de peces de la Laguna de Raya, Isla de Margarita, Venezuela. Ciencias Marinas 20(1): 1-16. ● Reséndiz-Medina, A. 1981. Estudio de los peces de la Laguna de Términos, Campeche, México. Biotica 6(3): 345–423. ● Reséndiz-Medina, A. 1983. Hidrología e ictiofauna de la Laguna de Zontecomapan, Veracruz, México. Anales del Instituto de Biología. UNAM. Serie Zoología 53(1): 385-417. ● Rodríguez-Varela, A. C., A. Cruz-Gómez y H. Vázquez-López. 2010. List of the Ichthyofauna in the Sontecomapan lagoon, Veracruz, México. UNAM Facultad Iztacala. Tlalnepantla, Estado de México, México. BIOCYT 3(9): 107-121. ● Salazar-Vallejo, S. I. 2002. Huracanes y biodiversidad costera tropical. Biología Tropical 50(2): 415-428. ● Scavia, D., J. C. Field, D. F. Boesch, R. W. Buddemeier, V. Burkett, D. R. Cayan, M. Fogarty, M. A. Harwell, R. W. Howarth, C. Mason, D. J. Reed, T. C. Royer, A. H. Sallenger and J. G. Titus. 2002. Climate Change Impacts on U.S. Coastal and Marine Ecosystems. Estuaries 25(2): 149164. ● Sánchez, O., M. Herzig, E. Peters, R. Márquez, L. Zambrano (Eds.). 2007. Perspectivas sobre conservación de ecosistemas acuáticos en México. SEMARNAT. México. 297 pp. ● Schindler, D. E. 2007. Fish extinctions and ecosystem functioning in tropical ecosystems. Procedings of the National Academy of Sciences of the United States of America (PNAS) 104 (14) 5707-5708. ● Secretaria de Medio Ambiente y Recursos Naturales (SEMARNAT). 2012. MIA. Construccion de obra de protección de la barra de Sontecomapan, Municipio Catemaco, Veracruz. México. 141 pp. ● Smith, T. M. and R. L. Smith. 2007. Ecología. 6° Edición. Pearson Addison Wesley. Madrid, España: 682 pp. ● Solomon, E. P., L. R. Berg and D. W. Martin. 2005. Biology. 7° Ed. Thomson Brooks/Cole. U.S.A. 1108 pp. ● Tarbuck, E. J. y F. K. Ludgens. 2005. Ciencias de la Tierra: Una introducción a la geología física. 8° Ed. Pearson Prentice-Hall. Madrid, España. 686 pp ● Tilman, D., P. Reich and J. Knops. 2006. Biodiversity and ecosystem stability in a decade long grassland experiment. Nature 441: 629-632. ● Toro-Ramírez, A., A. S. López, L. A. A. Pérez, D. Pech, D. H. Garro y R. DR. Rodriguez. 2017. Abundancia y diversidad de la ictiofauna en la Reserva de la Biosfera Los Petenes, Campeche, México: asociaciones con los ciclos nictimerales y las épocas climáticas. Lat. Am. J. Aquat. Res., 45(2): 311-321. ● Vega, M. Y. 2003. Situación de los peces dulceacuícolas en México. Ciencias. 20: 20-30. ● Vergara, M. S. 2007. Desarrollo integral y sustentable de lagunas costeras mexicanas. Trabajo de ingreso como miembro de la academia de ingeniería. 24 pp. ● Vertel, M. L. 2010. Comparación entre el análisis canónico de correspondencias y el análisis factorial múltiple en tablas de frecuencias-variables continuas. Tesis. Universidad Nacional de Colombia. Bogotá, Colombia. 53 pp. ● Whitfield, K. 1999. ichthyofaunal assemblages in estuaries: A South African case study. Fish Biology and Fisheries. 9:151. ● Yáñez-Arancibia, A. y R. S. Nugent. 1976. El papel ecológico de los peces en estuarios y lagunas costeras. Anales del Centro de Ciencias del Mar y Limnología. Universidad Nacional Autónoma de México 4 (1): 107-113 pp. ● Yáñez-Arancibia, A. y A. L. Lara-Domínguez. 1982. Dinámica ambiental de la boca de estero pargo y estructura de sus comunidades de peces en cambios estacionales y cíclicos de 24 horas (Laguna de Términos, Sur del Golfo de México). Anales del Instituto de Ciencias del Mar y Limnología. Universidad Nacional Autónoma de México 10(1): 85-116. ● Yáñez-Arancibia A. 1986. Ecología de la zona costera: Análisis de siete tópicos. AGT Editor. México, D.F. 189 pp. ● Yáñez-Arancibia A., J. W. Day Jr., B. C. Crump, W. M. Kemp. 2013. Estuarine Ecology. 2° Ed. Wiley-Blackwell. 550 pp. ● Zamora, A. L. 2003. Hábitos alimentarios en larvas y juveniles de peces en la laguna de Sontecomapan, Veracruz durante las épocas climáticas de 1996 a 1997. Tesis. Fac. Iztacala. UNAM. ANEXOS 1-2